N-гидрокси-2- (алкил, арил или гетероарилсульфанил, сульфинил или сульфонил) -3-замещенный алкил, арил или гетероариламиды в качестве ингибиторов матричной металлопротеиназы
Номер патента: 3836
Опубликовано: 30.10.2003
Авторы: Ху Байхуа, Дэвис Жами Мари, Венкатесан Мудумбай Аранапакам, Бэйкер Жанни Леа, Гросу Джордж Теодор, О'делл Мэтью Джеймс, Коул Дерек Сесил, Джекобсон Мэрси Памела
Формула / Реферат
1. Соединение формулы
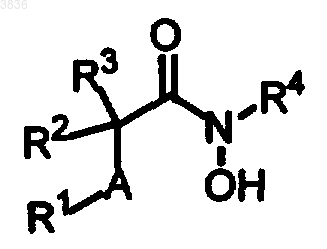
где A представляет собой -S-, -SO- или SO2-;
R1 представляет собой нафтил, фенил, гетероциклил, выбранный из группы: тиенил, триазолил, пиридил, пиразинил, имидазолил, необязательно бензоконденсированные и необязательно замещенные C1-C6алкилом, C1-C6алкокси или фенилом, арилокси, бензилокси и гетероарилокси;
или R1 представляет собой R11-Y-Ph-Z-, где Y представляет собой O, S, NH или простую связь, Z представляет собой простую связь или C1-C4алкилен; R11 представляет собой H, C1-C4алкил, ацил, бензил, пиридилпропил, 5-гидроксипентил, 1-метилпиролидинил, тетрагидропиран-4-ил, хлортиенил, 3-морфолин-4-илпропил, бифенил, пиридил, C3-C7циклоалкил;
R2 представляет собой H, фенил, карбоксифенил, метоксикарбонилфенил, бензил, бифенилметил, C5-C10алк(ди)енил и C5-C10алк(ди)инил, циклогексилметил, гетероарилалкоксибензил, амино(C1-C6)алкоксибензил, хинолинонил, хинолинил, метоксикарбонил(C1-C4)алкил, гидроксиаминокарбонил(C1-C4)алкил, бензилоксиметил, имидазолилметил, гуанидинилбутил;
R3 представляет собой H, C1-C4алкил, C5-C10алк(ди)енил и C5-C10алк(ди)инил, фенил(C1-C4)алкил, феноксибутил, гидроксиаминокарбонил(C1-C4)алкил; или
R2 и R3, взятые вместе с атомом углерода, к которому они присоединены, образуют пиперидиновое кольцо, которое необязательно N-замещено группой, выбранной из фенил-C1-C4алкила, который может быть замещен C1-C6алкокси, бифенил-C1-C6алкилом, C2-C10алкенилом, C1-C8алкилом, C4-C10циклоалкилом или фенокси-C1-C6алкилом;
R4 представляет собой H; при условии, что
a) когда A является S, R2 представляет собой водород и R3 представляет собой водород, тогда R1 не является тиенилом, необязательно моно- или дизамещенным C1-C6алкилом или C1-C6алкокси,
b) когда A является SO2, R2 представляет собой водород и R3 представляет собой 4-фенил-н-бутил, тогда R1 не является 3,4-диметоксифенилом,
и при условии, что исключены соединения, где
a. A является S, R2 и R3 представляют собой водород и R1 представляет собой фенил, содержащий в качестве заместителей кольца три атома водорода и два атома брома;
b. A является S, R2 и R3 представляют собой водород и R1 представляет собой фенил, содержащий в качестве заместителей кольца три атома водорода, один атом хлора и один атом брома;
c. A является S, R2 и R3 представляют собой водород и R1 представляет собой фенил, содержащий в качестве заместителей кольца два атома водорода и три атома брома;
d. A является S, R2 и R3 представляют собой водород и R1 представляет собой фенил, содержащий в качестве заместителей кольца два атома водорода и три атома хлора;
или его фармацевтически приемлемая соль.
2. Соединение по п.1,
где R1 представляет собой фенил, нафтил, гетероциклил, такой как пиридил, тиенил или имидазолил, необязательно замещенные C1-C6алкилом, C1-C6алкокси, C6-C10арилокси или гетероарилокси;
R2 представляет собой C5-C10алк(ди)енил или C5-C10алк(ди)инил;
R3 представляет собой C1-C4алкил, C5-C10алк(ди)енил, C5-C10алк(ди)инил, фенил(C1-C4)алкил или феноксибутил;
или его фармацевтически приемлемая соль.
3. Соединение по п.1, выбранное из группы соединений, включающей
гидроксиамид 2-(4-метоксибензолсульфанил)-2, 5-диметилгекс-4-еновой кислоты,
3-(бифенил-4-ил)-N-гидрокси-2-(4-метоксибензолсульфонил)-2-метилпропионамид,
N-гидрокси-2-(4-метоксибензолсульфонил)-2-метил-3-[4-(2-пиперидин-1-илэтокси)фенил]пропионамид,
N-гидрокси-2-(4-метоксибензолсульфонил)-2-метил-3-пиридин-3-илпропионамид,
N-гидрокси-2-(4-метоксибензолсульфонил)-2-метил-3-хинолин-6-илпропионамид,
N-гидрокси-2-(4-метоксибензолсульфонил)-2-метил-3-[4-(2-морфолин-1-илэтокси)фенил]пропионамид,
гидроксиамид 2-[4-(2-азепан-1-илэтокси)бензил]-2-(4-метоксибензолсульфонил)пропионовой кислоты,
N-гидрокси-2-(4-метоксибензолсульфонил)-2-метил-3-[4-(N,N-диэтиламиноэтокси)фенил]пропионамид,
N-гидрокси-2-(4-метоксибензолсульфонил)-2-метил-3-[3-(2-пиперидин-1-илэтокси)фенил]пропионамид,
N-гидрокси-2-(4-метоксибензолсульфонил)-2-метил-3-[3-(2-морфолин-1-илэтокси)фенил]пропионамид,
N-гидрокси-2-(4-этоксибензолсульфонил)-2-метил-3-[4-(N,N-диэтиламиноэтокси)фенил]пропионамид,
N-гидрокси-2-(4-н-бутоксибензолсульфонил)-2-метил-3-[4-(2-пиперидин-1-илэтокси)фенил]пропионамид,
N-гидрокси-2-(4-метоксибензолсульфонил)-2-метил-3-[3-(N,N-диэтиламиноэтокси)фенил]пропионамид,
гидроксиамид 2-(4-метоксибензолсульфонил)-5-метил-2-(3-метилбут-2-енил)гекс-4-еновой кислоты,
гидроксиамид 2R*-(4-метоксифенил-S*-сульфинил)гептановой кислоты,
N-гидрокси-2-(4-метоксибензолсульфонил)-2-метил-3-[4-(N,N-диизопропиламиноэтокси)фенил]пропионамид
или его фармацевтически приемлемая соль.
4. Соединение по п.1, которое выбрано из группы соединений, включающей
N-гидрокси-2-(4-метоксифенилсульфанил)-2-метил-3-фенилпропионамид,
N-гидрокси-2-(4-метоксифенилсульфанил)-2-фенилацетамид,
гидроксиамид 2-(4-метоксифенилсульфанил)-2,5-диметилгекс-4-еновой кислоты,
N-гидрокси-2-(4-метоксифенилсульфанил)-3-метилбутирамид,
N-гидрокси-2-(4-метоксибензолсульфинил)-2-метил-3-фенилпропионамид,
гидроксиамид 2-(4-метоксибензолсульфинил)-2,5-диметилгекс-4-еновой кислоты,
N-гидрокси-2-(4-метоксибензолсульфинил)-3-метилбутирамид,
N-гидрокси-2-(4-метоксибензолсульфинил)-2-фенилацетамид,
N-гидрокси-2-(4-метоксибензолсульфонил)-3-фенилпропионамид,
гидроксиамид 2-(4-метоксибензолсульфонил)гексановой кислоты,
гидроксиамид 2-(4-метоксибензолсульфонил)тетрадекановой кислоты,
N-гидрокси-2-(4-метоксибензолсульфонил)-2-метил-3-фенилпропионамид,
гидроксиамид 2-(4-метоксибензолсульфонил)-2,5-диметилгекс-4-еновой кислоты,
гидроксиамид 2-(4-метоксибензолсульфонил)-2,5,9-триметилдека-4,8-диеновой кислоты,
3-циклогексил-N-гидрокси-2-(4-метоксибензолсульфонил)-2-метилпропионамид,
гидроксиамид 2-[4-(2-азепан-1-илэтокси)бензил]-2-(4-метоксибензолсульфонил)пентановой кислоты,
3-(4-{3-[4-(3-хлорфенил)пиперазин-1-ил]пропокси}фенил)-N-гидрокси-2-(4-метоксибензолсульфонил)-2-метилпропионамид,
гидроксиамид 2-(4-метоксибензолсульфонил)-5-метил-2-[4-(2-морфолин-4-илэтокси)бензил]гекс-4-еновой кислоты,
гидроксиамид (4Е)-2-(4-метоксибензолсульфонил)-5,9-диметил-2-[4-(2-морфолин-4-илэтокси)бензил]дека-4,8-диеновой кислоты,
гидроксиамид 2-[4-(2-диэтиламиноэтокси)бензил]-2-(4-метоксибензолсульфонил)гексановой кислоты,
N-гидрокси-2-(4-н-бутоксибензолсульфонил)-2-метил-3-[4-(2-пиперидин-1-илэтокси)фенил]пропионамид,
N-гидрокси-2-(4-метоксибензолсульфонил)-2-метил-3-[3-(2-N,N-диэтиламиноэтокси)фенил]пропионамид,
N-гидрокси-2-(4-метоксибензолсульфонил)-2-метил-3-[3-(2-морфолин-1-илэтокси)фенил]пропионамид,
гидроксиамид 6-(1,3-диоксо-1,3-дигидроизоиндол-2-ил)-2-(4-метоксибензолсульфонил)-2-метилгексановой кислоты,
3-[4-(2-диэтиламиноэтокси)фенил]-2-(4-фуран-2-илбензолсульфонил)-N-гидрокси-2-метилпропионамид,
N-гидрокси-2-(4-метоксибензолсульфонил)-2-[4-(2-морфолин-4-илэтокси)бензил]бутирамид,
N-гидрокси-2-(4-метоксибензолсульфонил)-2-[4-(2-пиперидин-1-илэтокси)бензил]бутирамид,
гидроксиамид 2-(4-метоксибензолсульфонил)-2-[4-(2-морфолин-4-илэтокси)бензил]пентановой кислоты,
гидроксиамид 2-[4-(2-азепан-1-илэтокси)бензил]-2-(4-метоксибензолсульфонил)октановой кислоты,
гидроксиамид 2-(4-метоксибензолсульфанил)октановой кислоты,
гидроксиамид 2-(4-фторфенилсульфанил)октановой кислоты,
гидроксиамид 2-(1-метил-1H-имидазол-2-илсульфанил)октановой кислоты,
N-гидрокси-2-(4-метоксибензолсульфонил)-3-нафталин-2-илпропионамид,
гидроксамид N-гидрокси-2-(4-метоксифенилметансульфонил)-2-метил-3-фенилпропионовой кислоты,
гидроксиамид 5-метил-2-(3-метилбут-2-енил)-2-(толуол-4-сульфонил)гекс-4-еновой кислоты,
гидроксамид 2-метил-2-(2-метилфуран-3-сульфонил)-3-фенилпропионовой кислоты,
гидроксамид 2-метил-2-(2-метилфуран-3-сульфонил)-3-[4-(2-пиперидин-1-илэтокси)фенил]пропионовой кислоты,
гидроксамид 2-метил-3-[4-(2-пиперидин-1-илэтокси)фенил-2-(тиофен-2-сульфонил)пропионовой кислоты,
гидроксамид 2-(октан-1-сульфонил)-3-[4-(2-пиперидинилэтокси)фенил]пропионовой кислоты,
гидроксамид 2-метил-3-фенил-2-(тиофен-2-сульфонил)пропионовой кислоты,
гидроксиамид 2-[8-(1-карбоксиэтансульфонил)октан-1-сульфонил]пропионовой кислоты,
гидроксамид 2-(4-бромбензолсульфонил)-2-метил-3-[4-(2-пиперидин-1-илэтокси)фенил]пропионовой кислоты,
3-(4-бромфенил)-N-гидрокси-2-(4-метоксибензолсульфонил)-2-метилпропионамид,
N-гидрокси-2-(4-метоксибензолсульфонил)-2-метил-3-нафталин-2-илпропионамид,
N-гидрокси-2-(4-метоксибензолсульфонил)-3-метилбутирамид,
гидроксиамид 1-(4-метоксибензолсульфонил)циклопентанкарбоновой кислоты,
3-(2-бромфенил)-N-гидрокси-2-(4-метоксибензолсульфонил)-2-метилпропионамид,
гидроксиамид 2-(4-метоксибензолсульфонил)-2-метил-5-фенилпент-4-еновой кислоты,
гидроксиамид 2-(4-метоксибензолсульфонил)-5-фенил-2-(3-фенилпропил)пентановой кислоты,
гидроксиамид 2-аллил-2-(4-метоксибензолсульфонил)пент-4-еновой кислоты,
гидроксиамид 2-(4-метоксибензолсульфонил)-2-пропилпентановой кислоты,
2-бензил-N-гидрокси-2-(4-метоксибензолсульфонил)-3-фенилпропионамид,
N-гидрокси-2-(4-метоксибензолсульфонил)-2-метил-3-пиридин-3-илпропионамид,
N-гидрокси-2-(4-метоксибензолсульфонил)-2-метил-3-нафталин-2-илпропионамид,
N-гидрокси-2-(4-метоксибензолсульфонил)-3-метилбутирамид,
гидроксиамид 1-(4-метоксибензолсульфонил)циклопентанкарбоновой кислоты,
3-(2-бромфенил)-N-гидрокси-2-(4-метоксибензолсульфонил)-2-метилпропионамид,
гидроксиамид 2-(4-метоксибензолсульфонил)-2-метил-5-фенилпент-4-еновой кислоты,
гидроксиамид 2-(4-метоксибензолсульфонил)-5-фенил-2-(3-фенилпропил)пентановой кислоты,
гидроксиамид 2-аллил-2-(4-метоксибензолсульфонил)пент-4-еновой кислоты,
гидроксиамид 2-(4-метоксибензолсульфонил)-2-пропилпентановой кислоты,
2-бензил-N-гидрокси-2-(4-метоксибензолсульфонил)-3-фенилпропионамид,
N-гидрокси-2-(4-метоксибензолсульфонил)-2-метил-3-пиридин-3-илпропионамид,
гидроксиамид 2-(4-метоксибензолсульфонил)-2-пиридин-3-илметилдекановой кислоты,
гидроксиамид 2-(4-метоксибензолсульфонил)-5-метил-2-пиридин-3-илметилгекс-4-еновой кислоты,
2-бензил-4-диизопропиламино-N-гидрокси-2-(4-метоксибензолсульфонил) бутирамид,
3-циклогексил-N-гидрокси-2-(4-метоксибензолсульфонил)-2-пиридин-3-илметилпропионамид,
гидроксиамид 2-(4-метоксибензолсульфонил)-4-метил-2-пиридин-3-илметилпентановой кислоты,
N-гидрокси-2-(4-метоксибензолсульфонил)-2-метил-3-хинолин-6-илпропионамид,
гидроксиамид 2-(4-метоксибензолсульфонил)-6-фенокси-2-пиридин-3-илметилгексановой кислоты,
гидроксиамид 2-(4-метоксибензолсульфонил)-5-метил-2-пиридин-3-илметилгексановой кислоты,
гидроксиамид 2-(4-метоксибензолсульфонил)-2-пиридин-3-илметилгексановой кислоты,
гидроксиамид 2-(4-метоксибензолсульфонил)-2-окт-2-инилдец-4-иновой кислоты,
гидроксиамид 2-(4-метоксибензолсульфонил)-2-бут-2-инилгекс-4-иновой кислоты,
гидроксиамид 2-(4-метоксибензолсульфонил)-2-проп-2-инилпент-4-иновой кислоты,
гидроксиамид 2-(4-метоксибензолсульфонил)-2-пиридин-3-илметилдец-4-иновой кислоты,
гидроксиамид 2-(4-метоксибензолсульфонил)-2-пиридин-3-илметилпент-4-иновой кислоты,
гидроксиамид 2-(4-фторбензолсульфонил)-2-пиридин-3-илметилгекс-4-иновой кислоты,
гидроксиамид 2-(4-фторбензолсульфонил)-2-пиридин-3-илметилдец-4-иновой кислоты,
гидроксиамид 2-(4-фторбензолсульфонил)-2-бут-2-инилгекс-4-иновой кислоты,
гидроксиамид 2-(4-метоксибензолсульфонил)-5-метил-2-(3-метилбут-2-енил)гекс-4-еновой кислоты,
гидроксиамид 2-(4-метоксифенилсульфанил)гептановой кислоты,
гидроксиамид 2R*-(4-метоксифенил-S*-сульфинил)гептановой кислоты,
гидроксиамид 2S*-(4-метоксифенил-R*-сульфинил)гептановой кислоты,
N-гидрокси-2-(4-метоксибензолсульфинил)пропионамид,
N-гидрокси-2-(3-метилбутан-1-сульфанил)пропионамид,
N-гидрокси-2-(3-метилбутан-1-сульфинил)пропионамид,
N-гидрокси-2-(3-метилбутан-1-сульфонил)пропионамид,
N-гидрокси-3-метил-2-(нафталин-2-илсульфанил)бутирамид,
2-(2-нафталинсульфанил)-N-гидроксипропионамид,
N-гидрокси-3-метил-2-(нафталин-2-илсульфинил)бутирамид,
N-гидрокси-3-метил-2-(нафталин-2-илсульфонил)бутирамид,
N-гидрокси-3-метил-2-фенетилсульфинилбутирамид,
N-гидрокси-3-метил-2-фенетилсульфонилбутирамид,
гидроксиамид (1-гидроксикарбамоилпропан-1-сульфонил)уксусной кислоты,
гидроксиамид (1-гидроксикарбамоилпропан-1-сульфинил)уксусной кислоты,
гидроксиамид (1-гидроксикарбамоилпропан-1-сульфанил)пропионовой кислоты,
гидроксиамид (1-гидроксикарбамоилпропан-1-сульфинил)пропионовой кислоты,
гидроксиамид (1-гидроксикарбамоилпропан-1-сульфонил)пропионовой кислоты,
2-(4-гидроксибензолсульфинил)-N-гидрокси-3-фенилпропионамид,
2-(4-гидроксибензолсульфонил)-N-гидрокси-3-фенилпропионамид,
2-(4-ацетиламинобензолсульфанил)-N-гидрокси-3-фенилпропионамид,
2-(4-ацетиламинобензолсульфинил)-N-гидрокси-3-фенилпропионамид,
2-(4-ацетиламинобензолсульфонил)-N-гидрокси-3-фенилпропионамид,
гидроксиамид 4-гидроксикарбамоил-4-(4-метансульфинилфенилсульфинил)бутановой кислоты,
гидроксиамид 4-гидроксикарбамоил-4-(4-метансульфонилфенилсульфонил)бутановой кислоты,
гидроксиамид 4-гидроксикарбамоил-4-(4-бромбензолсульфанил)бутановой кислоты,
гидроксиамид 4-гидроксикарбамоил-4-(4-бромбензолсульфинил)бутановой кислоты,
гидроксиамид 4-гидроксикарбамоил-4-(4-бромбензолсульфонил)бутановой кислоты,
гидроксиамид 4-гидроксикарбамоил-4-(2-трифторметилбензолсульфанил)бутановой кислоты,
гидроксиамид 4-гидроксикарбамоил-4-(2-трифторметилбензолсульфинил)бутановой кислоты,
гидроксиамид 4-гидроксикарбамоил-4-(2-трифторметилбензолсульфонил)бутановой кислоты,
гидроксамид 2-(3-метоксибензолсульфинил)декановой кислоты,
гидроксамид 2-(3-метоксибензолсульфонил)декановой кислоты,
гидроксамид 2-(4-метансульфанилбензолсульфанил)декановой кислоты,
гидроксамид 2-(4-метансульфинилбензолсульфинил)декановой кислоты,
гидроксамид 2-(4-метансульфонилбензолсульфонил)декановой кислоты,
3-бензилокси-N-гидрокси-2-(4-метансульфинилбензолсульфинил)пропионамид,
3-бензилокси-N-гидрокси-2-(4-метансульфонилбензолсульфонил)пропионамид,
3-бензилокси-N-гидрокси-2-(2-хлорбензилсульфанил)пропионамид,
3-бензилокси-N-гидрокси-2-(2-хлорбензилсульфинил)пропионамид,
3-бензилокси-N-гидрокси-2-(2-хлорбензилсульфонил)пропионамид,
2-(4-бромбензолсульфинил)-N-гидрокси-3-(3H-имидазол-4-ил)пропионамид,
2-(4-хлорбензолсульфонил)-N-гидрокси-3-(3H-имидазол-4-ил)пропионамид,
гидроксиамид 2-(3-фторфенилсульфинил)-5-гуанидинопентановой кислоты,
гидроксиаьшф 2-(2-бромсульфанил)-5-гуанидинопентановой кислоты,
гидроксиамид 2-(2-бромсульфинил)-5-гуанидинопентановой кислоты,
гидроксиамид 2-(2-бромсульфонил)-5-гуанидинопентановой кислоты,
гидроксиамид 2-(2,5-дихлорбензолсульфонил)октановой кислоты,
гидроксиамид 2-(3-метоксибензолсульфанил)октановой кислоты,
гидроксиамид 2-(3-метоксибензолсульфинил)октановой кислоты,
гидроксиамид 2-(3-метоксибензолсульфонил)октановой кислоты,
гидроксиамид 2-(3,4-диметоксибензолсульфанил)октановой кислоты,
гидроксиамид 2-(3,4-диметоксибензолсульфинил)октановой кислоты,
гидроксиамид 2-(3,4-диметоксибензолсульфонил)октановой кислоты,
гидроксиамид 2-(2-бензимидазол-2-илсульфанил)октановой кислоты,
гидроксиамид 2-(2-бензоксазол-2-илсульфанил)октановой кислоты,
гидроксиамид 2-(2-бензотиазол-2-илсульфанил)октановой кислоты,
гидроксиамид 2-(2-пиридин-2-сульфанил)октановой кислоты,
гидроксиамид 2-(4-фенилтиазол-2-сульфанил)октановой кислоты,
гидроксиамид 2-(2-пиридин-2-илэтилсульфанил)октановой кислоты,
гидроксиамид 2-(2-фенил-5H-тетразол-5-илсульфанил)октановой кислоты,
гидроксиамид 2-(2-пиразин-2-илэтилсульфанил)октановой кислоты,
гидроксиамид 2-(1-метил-1H-тетразол-5-илсульфанил)октановой кислоты,
гидроксиамид 2-(2-бензимидазол-2-илсульфинил)октановой кислоты,
гидроксиамид 2-(2-пиридин-2-сульфинил)октановой кислоты,
гидроксиамид 2-(4-фенилтиазол-2-сульфинил)октановой кислоты,
гидроксиамид 2-(2-пиразин-2-илэтилсульфинил)октановой кислоты,
гидроксиамид 2-(3-окси-1H-бензимидазол-2-сульфонил)октановой кислоты,
гидроксиамид 2-(4-фенилтиазол-2-сульфонил)октановой кислоты,
гидроксиамид 2-[2-(1-оксипиридин-2-ил)этансульфонил]октановой кислоты,
гидроксиамид 3-(1-гидроксикарбамоилгептилсульфанил)бензойной кислоты,
гидроксиамид 3-[4-(1-гидроксикарбамоилгептилсульфанил)фенил]пропионовой кислоты,
гидроксиамид 2-(тиазол-2-илсульфанил)октановой кислоты,
гидроксиамид 2-(2,5-диоксоимидазолидин-4-илметилсульфанил)октановой кислоты,
3-(1-гидроксикарбамоилгептилсульфинил)бензойную кислоту,
3-[4-(1-гидроксикарбамоилгептилсульфинил)фенил]пропионовую кислоту,
гидроксиамид 2-(хинолин-8-сульфинил)октановой кислоты,
гидроксиамид 2-(нафталин-2-илкарбамоилметансульфинил)октановой кислоты,
гидроксиамид 3-(1-гидроксикарбамоилгептилсульфонил)бензойной кислоты,
3-[4-(1-гидроксикарбамоилгептилсульфонил)фенил]пропионовую кислоту,
гидроксиамид 2-(1H-имидазол-2-сульфонил)октановой кислоты,
гидроксиамид 2-(тиазол-2-илсульфонил)октановой кислоты,
гидроксиамид 2-(хинолин-8-сульфонил)октановой кислоты,
гидроксиамид 2-(нафталин-2-илкарбамоилметансульфонил)октановой кислоты,
гидроксиамид 2-(2,5-диоксоимидазолидин-4-илметилсульфонил)октановой кислоты,
гидроксиамид 2-(4-бутоксибензолсульфанил)октановой кислоты,
гидроксиамид 2-[4-(2-пиперазин-1-илэтокси)бензолсульфанил]октановой кислоты,
гидроксиамид 2-[4-(5-гидроксипентилокси)фенилсульфанил]октановой кислоты,
гидроксиамид 2-[4-(3-пиридин-2-илпропокси)бензолсульфанил]октановой кислоты,
гидроксиамид 2-(4-бензилоксифенилсульфинил)октановой кислоты,
гидроксиамид 2-(4-бутоксибензолсульфинил)октановой кислоты,
гидроксиамид 2-[4-(2-пиперазин-1-илэтокси)бензолсульфинил]октановой кислоты,
гидроксиамид 2-[4-(3-пиридин-2-илпропокси)бензолсульфинил]октановой кислоты,
гидроксиамид 2-(4-бензилоксифенилсульфонил)октановой кислоты,
гидроксиамид 2-(4-бутоксибензолсульфонил)октановой кислоты,
гидроксиамид 2-[4-(2-пиперазин-1-илэтокси)бензолсульфонил]октановой кислоты,
гидроксиамид 2-[4-(3-пиридин-2-илпропокси)бензолсульфонил]октановой кислоты,
гидроксиамид 2-[4-(1-метилпирролидин-3-илокси)бензолсульфанил]октановой кислоты,
гидроксиамид 2-[4-(1-этилпропокси)бензолсульфанил]октановой кислоты,
гидроксиамид 2-[4-(тетрагидропиран-4-илокси)бензолсульфанил]октановой кислоты,
гидроксиамид 2-[4-(1-метилпирролидин-3-илокси)бензолсульфинил]октановой кислоты,
гидроксиамид 2-[4-(1-этилпропокси)бензолсульфинил]октановой кислоты,
гидроксиамид 2-[4-(тетрагидропиран-4-илокси)бензолсульфинил]октановой кислоты,
гидроксиамид 2-[4-(1-метилпирролидин-3-илокси)бензолсульфонил]октановой кислоты,
гидроксиамид 2-[4-(1-этилпропокси)бензолсульфонил]октановой кислоты,
гидроксиамид 2-[4-(тетрагидропиран-4-илокси)бензолсульфонил]октановой кислоты,
гидроксиамид 2-[4-(5-хлортиофен-2-ил)бензолсульфинил]октановой кислоты,
гидроксиамид 2-(4'-хлорбифенил-4-сульфонил)октановой кислоты,
гидроксиамид 2-[4-(5-хлортиофен-2-ил)бензолсульфонил]октановой кислоты,
гидроксиамид 2-[4-(бифенил-4-иламино)фенилсульфанил]октановой кислоты,
гидроксиамид 2-[4-(пиридин-4-иламино)фенилсульфанил]октановой кислоты,
гидроксиамид 2-(4-циклопентиламинофенилсульфанил)октановой кислоты,
гидроксиамид 2-(4-пиперидин-1-илфенилсульфанил)октановой кислоты,
гидроксиамид 2-(4-пиперазин-1-илфенилсульфанил)октановой кислоты,
4-(1-гидроксикарбамоилгептилсульфанил)гидроксиамид 2,5-дихлортиофен-3-сульфоновой кислоты,
4-(1-гидроксикарбамоилгептилсульфанил)гидроксиамид этансульфоновой кислоты,
4-(1-гидроксикарбамоилгептилсульфинил)гидроксиамид 5-хлор-1,3-диметил-1H-пиразол-4-сульфоновой кислоты,
4-(1-гидроксикарбамоилгептилсульфинил)гидроксиамид 2,5-дихлортиофен-3-сульфоновой кислоты,
4-(1-гидроксикарбамоилгептилсульфинил)гидроксиамид 5-пиридин-2-илтиофен-2-сульфоновой кислоты,
4-(1-гидроксикарбамоилгептилсульфонил)гидроксиамид 2-нитробензолсульфоновой кислоты,
4-(1-гидроксикарбамоилгептилсульфонил)гидроксиамид 3-бром-2-хлортиофен-2-сульфоновой кислоты и
4-(1-гидроксикарбамоилгептилсульфонил)гидроксиамид бензо[1,2,5]тиадиазол-4-сульфоновой кислоты;
и их фармацевтически приемлемые соли.
5. Применение соединения по любому из пп.1-4 для получения лекарственного средства для ингибирования патологических изменений, опосредованных матричными металлопротеиназами у млекопитающих.
6. Применение по п.5, где состоянием, подвергаемым лечению, является атеросклероз, образование атеросклеротической бляшки, тромбоэмболия коронарных сосудов из-за отрыва атеросклеротической бляшки, рестеноз, ММП-опосредованое нарушение остеогенеза, воспалительные заболевания центральной нервной системы, старение кожи, ангиогенез, метастазирование опухоли, рост опухоли, остеоартрит, ревматоидный артрит, септический артрит, корнеальная язва, патологическое ранозаживление, костные заболевания, протеинурия, аневризма аорты, дегенерация хряща из-за травматического повреждения сустава, демиелинизирующие заболевания нервной системы, цирроз печени, гломерулонефрит, преждевременное вскрытие плодного пузыря, воспалительные заболевания кишечника или периодонтальные заболевания.
7. Применение по п.5, где состоянием, подвергаемым лечению, является возрастная пятнистая дегенерация, деабетическая ретинопатия, пролиферативная витреоретинопатия, преждевременная ретинопатия, воспаление глаз, кератоконус, синдром Шегрена, миопия, опухоль глаза, глазной ангиогенез/реваскуляризация и роговичное отторжение трансплантата.
8. Применение соединения по любому из пп.1-4 для получения лекарственного средства для ингибирования патологических изменений, опосредованных TNF-a-превращающим ферментом (ТАПФ) у млекопитающих, которое заключается во введении млекопитающему при необходимости такого лечения терапевтически эффективного количества ингибирующего ТАПФ соединения по любому из пп.1-4.
9. Применение по п.8, где состоянием, подвергаемым лечению, является ревматоидный артрит, отторжение трансплантата, кахексия, анорексия, воспаление, лихорадка, инсулиновая невосприимчивость, септический шок, хроническая сердечная недостаточность, воспалительное заболевание центральной нервной системы, воспалительное заболевание кишечника или ВИЧ инфекция.
10. Фармацевтическая композиция, включающая фармацевтичеёъш приемлемый носитель и терапевтически эффективное количество матричной металлопротеиназы или ингибирующего ТАПФ соединения по любому из пп.1-4.
Текст
1 Предпосылки изобретения Матричные металлопротеиназы (ММП) представляют собой группу ферментов, вовлеченных в патологическую деструкцию соединительной ткани и базальных мембран. Эти цинксодержащие эндопептидазы содержат несколько ферментных субъединиц состоящих из коллагеназ, стромелизинов и желатиназ. Из этих классов, было показано, что желатиназы в ММП тесно связаны с ростом и распространением опухолей. Известно, что уровень экспрессии желатиназы повышается при малигнизации и,что желатиназа может разрушать базальную мембрану, что ведет к метастазированию опухоли. Ангиогенез, необходимый для роста твердых опухолей, как было также недавно показано, имеет в своей патологии желатиназный компонент. Более того, очевидно можно предположить, что желатиназа вызывает отрыв атеросклеротической бляшки. Другими условиями выделения ММП являются рестеноз, ММПопосредованное нарушение остеогенеза, воспалительные заболевания центральной нервной системы, старение кожи, рост опухоли, остеоартрит, ревматоидный артрит, септический артрит, корнеальная язва, патологическое ранозаживление, костные заболевания, протеинурия,аневризма аорты, дегенерация хряща в следствие травматического повреждения сустава, демиелинизирующие заболевания нервной системы, цирроз печени, гломерулонефрит, преждевременное вскрытие плодного пузыря, кишечные воспалительные заболевания, периодонтальные заболевания, возрастная пятнистая дегенерация, деабетическая ретинопатия, пролиферативная витреоретинопатия, преждевременная ретинопатия, воспаление глаз, кератоконус,синдром Шегрена, миопия, опухоль глаза, глазной ангиогенез/реваскуляризация и роговичное отторжение трансплантата. Последние обзоры представлены: (1) Recent Advances in MatrixTNF- преобразующий фермент (ТАПФ) катализирует образование TNF- из присоединенного к мембране TNF- белкового предшественника. TNF- является провоспалительным цитокином и в настоящее время, в дополнение к убедительно доказанным противоопухолевым свойствам, предполагается его роль в ревматоидном артрите, септическом шоке, отторжении трансплантата, кахексии, анорексии, воспалении, хронической сердечной недостаточности,воспалительных заболеваниях центральной нервной системы, воспалительных заболеваниях 2 почек, инсулинозависимом диабете и ВИЧ инфекции. Например, исследования с анти-TNFантителами и трансгенными животными показали, что блокируется образование TNF-, препятствуя развитию артрита. Это наблюдение недавно также было проведено на людях. Предполагалось, что низкомолекулярные ингибиторы ММП и ТАПФ, таким образом,имеют возможность для лечения различных состояний заболевания. Несмотря на то, что различные ингибиторы ММР и ТАПФ были идентифицированы и описаны в литературе, громадное большинство этих молекул представляет собой пептиды или пептидоподобные соединения, что предполагает наличие затруднений с биодоступностью и фармакокинетикой, обычных для этих соединений, что может ограничить их клиническую эффективность. Низкая молекулярная масса, сила и длительность действия,оральная биодоступность ингибиторов ММП и/или ТАПФ позволяют, таким образом, достичь высокоэффективного лечения хронических состояний вышеуказанных заболеваний. Недавно в печати появились две ссылки(США 5455258 и Европейская патентная заявка 606046), в которых описаны арилсульфонамидзамещенные гидроксамовые кислоты. Эти статьи касаются соединений, приведенных в примере CGS 27023A. В них приведены данные только для непептидных матричных металлопротеиназных ингибиторов.Salah et al., Liebigs Ann. Chem. 195, (1973) описали несколько производных арилзамещенных тио и арилзамещенных сульфонилацетогидроксамовых кислот общей формулы 1. Эти соединения были получены для изучения реакции Манниха. Позже, они были исследованы на их фунгицидную активность. Некоторые сульфонкарбоновые кислоты описаны в патенте США 4933367. Эти соединения демонстрировали гипогликемическую активность. Сущность изобретения Настоящее изобретение относится к новым низкомолекулярным непептидным ингибиторам матричной металлопротеиназы (ММП) и TNFпреобразующему ферменту (ТАПФ) для лечения артрита, метастазирования опухолей, тканевых изъязвлений, патологического ранозажив 3 ления, периодонтальных заболеваний, костных заболеваний, диабета (инсулинзависимого) и ВИЧ инфекции. В соответствии с данным изобретением,эта группа соединений представлена общей формулой IY представляет собой О, S, NH или простую связь, Z представляет собой простую связь илиR2 и R3, взятые вместе с атомом углерода,к которому они присоединены, образуют пиперидиновое кольцо, которое необязательно Nзамещено группой, выбранной из фенил-C1-C4 алкила, который может быть замещен C1-C6 алкокси, бифенил-C1-C6- алкилом, C2-C10 алкенилом, C1-C8 алкилом, C4-C10 циклоалкилом или фенокси-C1-C6 алкилом;a) когда А является S, R2 представляет собой водород и R3 представляет собой водород,тогда R1 не является тиенилом, необязательно моно или дизамещенным C1-C6 алкилом или C1C6 алкокси,b) когда А является SO2, R2 представляет собой водород и R3 представляет собой 4 фенил-н-бутил, тогда R1 не является 3,4 диметоксифенилом,и при условии, что исключены соединения,гдеa. А является S, R2 и R3 представляют собой водород и R1 представляет собой фенил, 003836 4 содержащий в качестве заместителей кольца три атома водорода и два атома брома;b. А является S, R2 и R3 представляют собой водород и R1 представляет собой фенил,содержащий в качестве заместителей кольца три атома водорода, один атом хлора и один атом брома;c. А является S, R2 и R3 представляют собой водород и R1 представляет собой фенил,содержащий в качестве заместителей кольца два атома водорода и три атома брома;d. А является S, R2 и R3 представляют собой водород и R1 представляет собой фенил,содержащий в качестве заместителей кольца два атома водорода и три атома хлора; или их фармацевтически приемлемыми солями. Более предпочтительным аспектом настоящего изобретения является группа соединений общей формулы (I), гдеR3 представляет собой C1-C4 алкил, C5-C10 алк(ди)енил, C5-C10 алк(ди)инил, фенил (C1-C4) алкил или феноксибутил; или их фармацевтически приемлемые соли. Наиболее предпочтительными соединениями, ингибирующими матричную металлопрротеазу и ТАПФ по настоящему изобретению являются гидроксиамид 2-(4-метоксибензолсульфанил)-2,5-диметилгекс-4-еновой кислоты,3-(бифенил-4-ил)-N-гидрокси-2-(4-метоксибензолсульфонил)-2-метилпропионамид,N-гидрокси-2-(4-метоксибензолсульфонил)-2-метил-3-[4-(2-пиперидин-1-илэтокси)фенил]пропионамид,N-гидрокси-2-(4-метоксибензолсульфонил)-2-метил-3-пиридин-3-илпропионамид,N-гидрокси-2-(4-метоксибензолсульфонил)-2-метил-3-хинолин-6-илпропионамид,N-гидрокси-2-(4-метоксибензолсульфонил)-2-метил-3-[4-(2-морфолин-1-илэтокси) фенил]пропионамид,гидроксиамид 2-[4-(2-азепан-1-илэтокси) бензил]-2-(4-метоксибензолсульфонил)пропионовой кислоты,N-гидрокси-2-(4-метоксибензолсульфонил)-2-метил-3-[4-(N,N-диэтиламиноэтокси) фенил]пропионамид,N-гидрокси-2-(4-метоксибензолсульфонил)-2-метил-3-[3-(2-пиперидин-1-илэтокси) фенил]пропионамид,N-гидрокси-2-(4-метоксибензолсульфонил)-2-метил-3-[3-(2-морфолин-1-илэтокси)фенил]пропионамид, 5 12 гидроксиамид 2-[4-(5-хлортиофен-2-ил) бензолсульфонил]октановой кислоты,гидроксиамид 2-[4-(бифенил-4-иламино) фенилсульфанил]октановой кислоты,гидроксиамид 2-[4-(пиридин-4-иламино) фенилсульфанил]октановой кислоты,гидроксиамид 2-(4-циклопентиламинофенилсульфанил)октановой кислоты,гидроксиамид 2-(4-пиперидин-1-илфенилсульфанил)октановой кислоты,гидроксиамид 2-(4-пиперазин-1-илфенилсульфанил)октановой кислоты,4-(1-гидроксикарбамоилгептилсульфанил) гидроксиамид 2,5-дихлортиофен-3-сульфоновой кислоты,4-(1-гидроксикарбамоилгептилсульфанил) гидроксиамид этансульфоновой кислоты,4-(1-гидроксикарбамоилгептилсульфинил) гидроксиамид 5-хлор-1,3-диметил-1 Н-пиразол 4-сульфоновой кислоты,4-(1-гидроксикарбамоилгептилсульфинил) гидроксиамид 2,5-дихлортиофен-3-сульфоновой кислоты,4-(1-гидроксикарбамоилгептилсульфинил) гидроксиамид 5-пиридин-2-илтиофен-2-сульфоновой кислоты,4-(1-гидроксикарбамоилгептилсульфонил) гидроксиамид 2-нитробензолсульфоновой кислоты,4-(1-гидроксикарбамоилгептилсульфонил) гидроксиамид 3-бром-2-хлортиофен-2-сульфоновой кислоты и 4-(1-гидроксикарбамоилгептилсульфонил) гидроксиамид бензо[1,2,5]тиадиазол-4-сульфоновой кислоты,или их фармацевтически приемлемые соли. Понятно, что соединения, представленные формулой I, где R1, R2, R3 и R4 содержат асимметричные углероды, заключают в себе все возможные стереоизомеры и их смеси, обладающие активностью, что оговаривается ниже. В частности, это рацемические модификации и любые оптические изомеры, которые обладают указанной активностью. Оптические изомеры могут быть исследованы в чистом виде с помощью стандартных методов. Фармацевтически приемлемые соли являются производными фармацевтически приемлемых органических и неорганических кислот, таких как молочная, лимонная,уксусная, винная, янтарная, малеиновая, малоновая, соляная, бромистоводородная, фосфорная, азотная, серная, метансульфоновая и приемлемые известные простейшие кислоты. Настоящее изобретение, таким образом,относится к фармацевтической композиции,которая содержит соединение по данному изобретению в сочетании или ассоциации с фармацевтически приемлемым носителем. В частности, настоящее изобретение относится к фармацевтической композиции, которая содержит эффективное количество соединения по на 13 стоящему изобретению и фармацевтически приемлемый носитель. Композиции предпочтительно предназначены для перорального введения. Однако они могут применяться в других формах введения,например, при парентеральном введении больному. С целью достижения регулярности введения, предпочтительно, чтобы композиция по изобретению была представлена в единичной дозированной форме. Подходящие стандартные лекарственные формы включают таблетки, капсулы и порошки в саше или пузырьках. Такая единичная доза может содержать 0,1-100 мг соединения по изобретению. Соединения по настоящему изобретению могут вводиться перорально в дозе от около от 0,01 до 100 мг на кг. Такая композиция может быть введена от 1 до 6 раз в день, обычно от 1 до 4 раз в день. Композиции по изобретению могут быть получены с обычными эксципиентами, такими как наполнители, разрыхляющий агент, связывающий агент, смазывающий агент, придающий вкус агент и тому подобное. Их получают общепринятым методом. В соответствии с данным изобретением,предложен также способ получения соединений по настоящему изобретению. Способ по изобретению Соединения по настоящему изобретению могут быть получены по одному из общих способов, приведенных ниже. Как показано на схеме 1, соответствующим образом замещенное насыщенное производное меркаптана алкилировали, используя либо замещенное, либо незамещенное (схема 2) производное эфира -бромуксусной кислоты в кипящем ацетоне в колбе с обратным холодильником, используя К 2 СО 3 в качестве основания. Сульфидное производное, полученное таким образом, окисляли с помощью м-хлорпербензойной кислоты в СН 2 Сl2 или используя оксон в метанол/воде. Сульфон, полученный в вышеуказанном процессе, можно в дальнейшем либо алкилировать с помощью различных алкилгалогенидов с получением дизамещенных производных, либо может быть гидролизирован с помощью NaOH/MeOH при комнатной температуре. Однако вместо использования этилового эфира,при наличии третичного бутилового эфира, гидролиз можно проводить с ТФА/СН 2 Сl2 при комнатной температуре. Затем, полученную карбоновую кислоту преобразуют в производное гидроксамовой кислоты путем взаимодействия с оксалилхлоридом/ДМФ (каталитическое количество) и гидроксиламином/триэтиламином.e. (СОСl) 2/CH2Cl2/Et3N/NH2OHHCl. Как показано на схеме 3, сульфидное производное может быть далее алкилировано с помощью литий бис(триметилсилил)амида в ТГФ при 0 С. Алкилированное или моно замещенное соединение гидролизировали и преобразовывали в производное гидроксамовой кислоты. Сульфинильные производные получали окислением сульфидных производных гидроксамовой кислоты с Н 2 О 2 в растворе МеОН. Соответствующие гидроксиамиды 1-замещенной-4-(4-метоксибензолсульфонил) пиперидин-4-карбоновой кислоты получали, исходя из диэтаноламина и соответствующих замещенных алкил- или арилгалогенидов (схема 4). Nзамещенное производное диэтаноламина преобразовывали в дихлорсоединения с помощью тионилхлорида. Соответствующие дихлориды подвергали взаимодействию с замещенными производными этилового эфира сульфонилуксусной кислоты в присутствии К 2 СО 3/18-Краун 6 в кипящем ацетоне. Схема 2. Синтезe. NaOH/MeOH/ТГФ/Комнатная температура; f . (COCl) 2/CH2Cl2/Et3N/NH2OHHCl. Этиловые эфиры 1-замещенной-4-(4-метоксибензолсульфонил)пиперидин-4-карбоновой кислоты, полученные таким образом, преобразовывали в гидроксиамид, как показано на схеме 4. Альтернативно, эти классы соединений и другие гетероциклы могут быть получены, как показано на схемах 5 и 6. Схема 3. Синтезb. (COCl)2/NH2OHHCl/Et3N. Альтернативно, на схемах 7-11 показаны способы получения производных гидроксамовой кислоты с помощью твердого носителя.(гидроксиламиновая смола) может быть соединена с 2-галогенкислотой с получением полимера эфира гидроксамата. Взаимодействие соединения может проходить в присутствии карбодиимида, такого как ДИК, в инертном растворителе, таком как ДМФ, при комнатной температуре. Галогенная группа может быть замещена тиолом в присутствии основания, такого как ДБУ, в инертном растворителе, таком как ТГФ,при комнатной температуре. Сульфид может быть окислен до сульфоксида взаимодействием с окисляющим агентом, таким как третбутилгидропероксид в присутствии кислотного катализатора, такого как бензолсульфоновая кислота, в инертном растворителе, таком как ДХМ, при комнатной температуре. Альтернативно, сульфид может быть окислен до сульфона путем взаимодействия с окисляющим агентом, таким как мета-хлорпероксибензойная кислота, в инертном растворителе, таком как ДХМ, при комнатной температуре. Сульфид,сульфоксид или сульфон могут быть обработаны кислотой, такой как трифторуксусная кисло 17 та, в инертном растворителе, таком как ДХМ, с образованием свободной гидроксамовой кислоты. На схеме 8 показан способ получения гидроксамовых кислот, имеющих алкоксильные группы, присоединенные к ароматическому кольцу.f) ТФА:ДХМ (1:1); 25 С; 1 ч. Гидроксиламиновая смола может быть соединена с 2-галогенкислотой и галогеновая группа может быть замещена фторбензолтиолом, как указано выше. Фтор группа может быть затем заменена на спирт в присутствии основания, такого как гидрид натрия, в инертном растворителе, таком как ДМФ при около 80 С. Алкоксибензолсульфанилгидроксаматный сложный эфир может быть затем окислен либо до соответствующего сульфинил- или сульфонилгидроксаматного сложного эфира, как указано выше. Свободные гидроксамовые кислоты могут быть отделены, как указано выше. На схеме 9 показан способ получения 2 бисарилсульфанил-, сульфинил- и сульфонилгидроксамовых кислот.e) Арилборная кислота (2,0 экв.); тетракис(трифенилфосфин)палладий(0) (0,1 экв.); 10% водного карбоната натрия (10,0 экв.); ДМЭ; 80 С; 8 ч.f) ТФА:ДХМ (1:1); 25 С; 1 ч. Гидроксиламиновая смола может быть связана с 2-галогенкислотой и галогеновая группа может быть заменена на бромбензолтиол, как указано выше. Бромбензолсульфанилгидроксаматный сложный эфир может затем быть окислен либо до соответствующего сульфинила, либо до сульфонилгидроксаматного сложного эфира, как указано выше. Группа брома затем заменяется на арильную группу путем взаимодействия с арилборной кислотой в присутствии катализатора, такого как тетракис(трифенилфосфин)палладий(0), и с основанием, таким как карбонат натрия, в инертном растворителе, таком как ДМЭ, при около 80 С. Свободные гидроксамовые кислоты могут быть отделены, как указано выше. На схеме 10 показан способ получения гидроксамовых кислот, имеющих аминогруппу,присоединенную к ароматическому кольцу.d) ТФА:ДХМ (1:1); 25 С; 1 ч. Гидроксиламиновая смола может быть соединена с 2-галогенкислотой и галогеновая группа может быть заменена бромбензолтиолом, как указано выше. Группа брома может быть затем заменена на амин в присутствии катализатора, такого как, трис(дибензилиденацетон)дипалладий(0), и лиганда, такого как (S)БИНАФ, и основания, такого как трет-бутоксид натрия, в инертном растворителе, таком как диоксан, при около 80 С. Свободные гидроксамовые кислоты могут быть отделены, как указано выше. На схеме 11 показан способ получения гидроксамовых кислот, имеющих сульфонатную группу, присоединенную к ароматическому кольцу. 20 Гидроксиламиновая смола может быть связана с 2-галогенкислотой и галогенная группа может быть заменена на гидроксибензолтиол,как указано выше. Гидроксибензолсульфанилгидроксаматный сложный эфир может быть окислен либо до соответствующего сульфинил, либо до сульфонил гидроксаматного эфира, как указано выше. Гидроксигруппа может быть затем сульфонилирована путем взаимодействия с сульфонилхлоридом в присутствии основания, такого как триэтиламин, в инертном растворителе, таком как ДХМ, при комнатной температуре. Свободные гидроксамовые кислоты могут быть отделены, как указано выше. Следующие примеры по настоящему изобретению иллюстрируют, но никоим образом не ограничивают объем притязаний изобретения. Реагенты и промежуточные соединения, используемые здесь, или коммерчески доступны,или легко могут быть получены специалистами в данной области органического синтеза обычными литературными методами. Соединения по примерам 110-240 получали с помощью методов твердофазного синтеза. Пример 1. N-Гидрокси-2-(4-метоксифенилсульфанил)-2-метил-3-фенилпропионамид. К перемешиваемому в круглодонной колбе раствору 4-метоксибензолтиола (2,8 г, 20 ммоль) и безводного К 2 СO3 (10 г, избыток) в сухом ацетоне (100 мл) добавляли этил 2 бромпропионат (3,6 г, 20 ммоль) и реакционную смесь нагревали с обратным холодильником в течение 8 ч, тщательно перемешивая. В конце реакционной смеси давали охладиться на холоду, отфильтровывали соли калия и реакционную смесь концентрировали. Осадок экстрагировали хлороформом и промывали Н 2O и раствором 0,5 н. NaOH. Органический слой затем тщательно промывали водой, сушили над MgSO4,фильтровали и концентрировали с получением этилового эфира 2-(4-метоксифенилсульфанил) пропионовой кислоты в виде светло-желтого масла. Выход 4,5 г (94%). МС: 241 (М+Н)+. К перемешиваемому раствору этилового эфира 2-(4-метоксифенилсульфанил)пропионовой кислоты (2,44 г, 10 ммоль), в ТГФ (100 мл) при-4 С,медленно добавляли литий бис(триметилсилил)амид (1 М раствор, 15 мл, 15 ммоль). Реакционную смесь оранжевого цвета перемешивали при комнатной температуре в течение 15 мин и затем охлаждали до 0 С при постоянном перемешивании еще в течение часа. Температуру смеси снова доводили до -40 С и по каплям добавляли бензилбромид (1,72 г, 10 ммоль) в ТГФ. Реакцию нагревали до комнатной температуры и перемешивали в течение ночи,затем гасили льдом, экстрагировали хлороформом и промывали водой. Органический слой сушили над MgSO4, фильтровали и концентрировали и хроматографировали на колонке с силикагелем, элюируя 10% этилацетатом:гексаном 21 с получением этилового эфира 2-(4 метоксифенилсульфанил)-2-метил-3-фенилпропионовой кислоты в виде бесцветного масла. Выход: 860 мг, (26%). МС:331 (М+Н)+. Этиловый эфир 2-(4-метоксифенилсульфанил)-2-метил-3-фенилпропионовой кислоты(4,12 г, 12 ммоль) растворяли в метаноле (50 мл) и добавляли 10 н. NaOH (20 мл). Реакционную смесь перемешивали в течение ночи при комнатной температуре. Реакционную смесь концентрировали, разбавляли 1:1 гексан : диэтиловым эфиром и экстрагировали Н 2 О. Водный слой охлаждали льдом и подкисляли до рН 3. Кислоту затем экстрагировали хлороформом, и органический слой сушили над MgSO4, фильтровали и концентрировали с получением 2-(4 метоксифенилсульфанил)-2-метил-3-фенилпропионовой кислоты в виде твердого продукта с низкой температурой плавления. Выход 580 мг,16%. МС: 303,2 (М+Н)+. К перемешиваемому раствору 2-(4-метоксифенилсульфанил)-2-метил-3-фенилпропионовой кислоты (0,5 г, 1,65 ммоль) и ДМФ (2 капли) в СН 2 Сl2 (100 мл) при 0 С, по каплям добавляли оксалилхлорид (1,0 г, 8 ммоль). После добавления реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Одновременно в отдельной колбе перемешивали в ТГФ:воде (5:1, 30 мл) смесь гидроксиламина гидрохлорида (2,0 г, 29 ммоль) и триэтиламина (5 мл, избыток) при 0 С в течение 1 ч. Через час оксалилхлоридную реакционную смесь концентрировали, и бледно-желтый осадок растворяли в 10 мл СН 2 Сl2 и медленно добавляли гидроксиламин при 0 С. Реакционную смесь перемешивали при комнатной температуре в течение 24 ч и концентрировали. Полученный осадок экстрагировали хлороформом и тщательно промывали водой. Полученный продукт очищали хроматографией на колонке с силикагелем и элюировали этилацетатом. N-Гидрокси 2-(4-метоксифенилсульфанил)-2-метил-3-фенилпропионамид выделяли в виде бесцветного твердого продукта. Т.пл. 88 С. Выход: 300 мг, 57%. МС: 318(М+Н)+. 1 Н ЯМР (300 МГц, CDCl3):1,32 (с,3H), 3,07 (д, J=11 Гц, 1 Н) , 3,23 (д, J=11 Гц, 1 Н),3,79 (с, 3H), 6,83-7,36 (м, 9 Н). Пример 2. N-Гидрокси-2-(4-метоксифенилсульфанил)-2-фенилацетамид. Этиловый эфир 2-(4-метоксифенилсульфанил)фенилуксусной кислоты получали в соответствии с общим методом, описанным в примере 1. Исходя из этил -бромфенилацетата(М+Н)+. 2-(4-Метоксифенилсульфанил)-2-фенилуксусную кислоту получали, исходя из этилового эфира 2-(4-метоксифенилсульфанил) фени 003836 22 луксусной кислоты (3,0 г, 10 ммоль), растворенной в метаноле (50 мл) и 10 н. NaOH (20 мл). Результирующую реакционную смесь обрабатывали как в примере 1. Выход 1,9 г, 70%. Твердое вещество с низкой температурой плавления. МС: 273 (М+Н)+. Исходя из 2-(4-метоксифенилсульфанил) фенилуксусной кислоты (1,05 г, 3,83 ммоль) и последующей процедуры, описанной в примере 1, получали 154 мг N-гидрокси-2-(4-метоксифенилсульфанил)-2-фенилацетамида в виде бесцветного твердого продукта. Т.пл. 155 С. Выход 14%. МС: 290 (М+Н)+. 1 Н ЯМР (300 МГц, DMCO-d6):3,72 (с, 3H),4,68 (с, 1 Н), 6,86-7,44 (м, 9 Н). Пример 3. Гидроксиамид 2-(4-метоксифенилсульфанил)-2,5-диметилгекс-4-еновой кислоты. Этиловый эфир 2-(4-метоксифенилсульфанил)-2,5-диметилгекс-4-еновой кислоты получали по методу примера 1, второй абзац. Исходя из этилового эфира (4-метоксифенилсульфанил) пропионовой кислоты (3,5 г, 14,3 ммоль) и 3-метилбут-2-енил (2,25 г, 15 ммоль),получали 2,2 г продукта в виде масла. Выход 50%. МС: 310 (М+Н)+. 2-(4-Метоксифенилсульфанил)-2,5-диметилгекс-4-еноевую кислоту получали, исходя из этилового эфира 2-(4-метоксифенилсульфанил)2,5-диметилгекс-4-еновой кислоты (2,0 г, 6,4 ммоль), растворенного в метаноле (50 мл), и 10 н NaOH (20 мл). Полученную реакционную смесь обрабатывали, как описано в примере 1. Выход составлял 1,9 г, 99% твердого продукта с низкой температурой плавления. МС: 280(M+H)+. Исходя из 2-(4-метоксифенилсульфанил)2,5-диметилгекс-4-еновой кислоты (1,67 г, 5,8 ммоль) и по методу, описанному в примере 1,выделяли 1,5 г гидроксиамида 2-(4-метоксифенилсульфанил)-2,5-диметилгекс-4-еновой кислоты в виде бесцветного твердого продукта. Т.пл. 89 С. Выход 94%. МС: 296 (М+Н)+. 1 Н ЯМР (300 МГц, CDCl3):1,34 (с, 3H), 1,61 (с,3H), 1,74 (с, 3H), 2,41-2,58 (м, 2 Н), 3,80 (с, 3H),5,17 (т, J=7,5 Гц, 1 Н) , 6,86 (д, J=12,4 Гц, 2 Н),7,35 (д, J=12,4 Гц, 2 Н). Пример 4. N-Гидрокси-2-(4-метоксифенилсульфанил)-3-метилбутирамид. Этиловый эфир 2-(4-метоксифенилсульфанил)-3-метилбутановой кислоты получали в соответствии с общим методом, описанным в примере 1. Исходя из этил 2-бром-3-метилбутаноата (20,9 г, 100 ммоль) и 4-метоксибензолтиола (14,0 г, 100 ммоль) выделяли 30 г продукта. Выход 99%. Светло-желтое масло. МС: 271 (М+Н)+. 2-(4-Метоксифенилсульфанил)-3-метилбутановую кислоту получали, исходя из этилового эфира 2-(4-метоксифенилсульфанил)-3-метил 23 бутановой кислоты (5,8 г, 21,6 ммоль), растворенного в метаноле (50 мл) и 10 н. NaOH (30 мл). Полученную реакционную смесь обрабатывали,как описано в примере 1. Выход 5,0 г, 99%. Твердый продукт с низкой температурой плавления. МС: 242 (М+Н)+. Исходя из 2-(4-метоксифенилсульфанил)3-метилбутановой кислоты (4,39 г, 18,3 ммоль) и по методу, описанному в примере 1, выделяли 1,5 г N-гидрокси-2-(4-метоксифенилсульфанил)3-метилбутирамида в виде бесцветного твердого продукта. Т.пл. 119 С. Выход 33%. МС: 256 (М+Н)+. 1 Н ЯМР (300 МГц, DMCO-d6):0,90-1,07 (м,6 Н) , 1,84-1,96 (м, 1 Н), 3,07 (д, J=8,8 Гц, 1 Н),3,75 (с, 3H), 6,88 (д, J=15 Гц, 2 Н), 7,35 (д, J=15 Гц, 2 Н). Пример 5. N-Гидрокси-2-(4-метоксибензолсульфинил)-2-метил-3-фенилпропионамид.N-Гидрокси-2-(4-метоксифенилсульфанил)-2-метил-3-фенилпропионамид (400 мг, 1,26 ммоль) (получен в примере 1) растворяли в метаноле (100 мл) и добавляли 30% H2O2 (10 мл). Реакционную смесь перемешивали в течение 48 ч при комнатной температуре, одновременно охлаждая до 0 С, и гасили насыщенным раствором Na2SO3 (20 мл). Реакционная смесь мутнела. Ее перемешивали 4 ч, концентрировали при комнатной температуре на водяной бане, разбавляли водой, экстрагировали СНСl3 и промывали Н 2O. Органический слой сушили надMgSO4, фильтровали и концентрировали. Соединение, указанное в названии, получали с помощью колоночной хроматографии на силикагеле, элюируя 75% этилацетатом:гексаном. Твердый продукт с низкой температурой плавления. Выход: 220 мг (52%). МС: 334,1 (М+Н)+. 1 Н ЯМР (300 МГц, CDCl3):1,11 (с, 2 Н), 1,22 (с,3H), 3,84 (с, 3H), 7,00-7,61 (м, 9 Н). Пример 6. Гидроксиамид 2-(4-метоксибензолсульфинил)-2,5-диметилгекс-4-еновой кислоты. Исходя из гидроксамида 2-(4-метоксибензолсульфанил)-2,5-диметилгекс-4-еновой кислоты (900 мг, 3,0 ммоль) (получен в примере 3) и по методу, описанному в примере 5, гидроксиамид 2-(4-метоксибензолсульфинил)-2,5 диметилгекс-4-еновой кислоты выделяли в виде бесцветного твердого продукта. Выход: 104 мг (10%). Т.пл. 108 С. МС: 312(д, J=9 Гц, 2 Н). Пример 7. N-Гидрокси-2-(4-метоксибензолсульфинил)-3-метилбутирамид. Исходя из N-гидрокси-2-(4-метоксифенилсульфанил)-3-метилбутирамид (1 г, 3,9 ммоль), полученного как описано в примере 4, и по методу, описанному в примере 5, выделялиN-гидрокси-2-(4-метоксибензолсульфинил)-3 метилбутирамид в виде бесцветного твердого продукта. Выход: 420 мг (40%). Т.пл. 163 С. МС: 272(М+Н)+. 1 Н ЯМР (300 МГц, DMCO-d6):0,891,12 (м, 6 Н), 1,63-1,74 (м, 1 Н), 3,13 (д, J=7 Гц,1 Н), 3,83 (с, 3H), 6,94-7,65 (м, 4 Н). Пример 8. N-Гидрокси-2-(4-метоксибензолсульфинил)-2-фенилацетамид. Исходя из N-гидрокси-2-(4-метоксифенилсульфанил)-2-фенилацетамида (240 мг, 0,83 ммоль), полученного как описано в примере 2, и по методу, описанному в примере 5, выделялиN-гидрокси-2-(4-метоксибензолсульфинил)-2 фенилацетамид в виде бесцветного твердого продукта. Выход: 100 мг (40%). Т.пл. 135 С. МС 304(М+Н)+. 1 Н ЯМР (300 МГц, DMCO-d6):3,75 (с,3H), 4,38 (с, 1 Н), 6,92-7,69 (м, 9 Н). Пример 9. N-Гидрокси-2-(4-метоксибензолсульфонил)-3-фенилпропионамид. К перемешиваемому в круглодонной колбе раствору 4-метоксибензолтиола (2,8 г, 20 ммоль) и безводного К 2 СO3 (10 г, избыток) в сухом ацетоне (100 мл), добавляли бромэтилацетат (3,3 г, 20 ммоль) и реакционную смесь нагревали с обратным холодильником 8 ч,тщательно перемешивая. В конце реакционную смесь охлаждали, соли калия отфильтровывали и реакционную смесь концентрировали. Осадок экстрагировали хлороформом и промывали Н 2 О и раствором 0,5 н. NaOH. Органический слой дополнительно тщательно промывали водой,сушили над MgSO4, фильтровали и концентрировали. Этиловый эфир(4 метоксифенилсульфанил)уксусной кислоты выделяли в виде бледно-желтого масла. Выход: 4,4 г (100%). МС: 227 (М+Н)+. К перемешиваемому раствору 60% 3 хлорпероксибензойной кислоты (14,0 г, 40 ммоль) в метиленхлориде (100 мл) при 0 С,медленно добавляли этиловый эфир (4 метоксифенилсульфанил)уксусной кислоты (4,4 г, 20 ммоль) в СН 2 Сl2 (15 мл). Реакционная смесь мутнела, ее перемешивали при комнатной температуре 6 ч. Реакционную смесь затем разбавляли гексаном (300 мл) и перемешивали 15 мин. Твердые продукты отфильтровывали и добавляли раствор Nа 2SO3 к органическому слою, перемешивали по крайней мере 3 ч, смесь экстрагировали СНСl3 и промывали Н 2O. Органический слой сушили над MgSO4, фильтровали, концентрировали и выделяли бесцветный этиловый эфир (4-метоксифенилсульфонил) уксусной кислоты в виде масла. Выход: 100%. МС: 259,1 (М+Н)+. К перемешиваемому раствору этилового эфира (4-метоксибензолсульфонил) уксусной кислоты (2,5 г, 10 ммоль), бензилбромида (1,8 г,10 ммоль) и 18-Краун-6 (500 мг) в ацетоне (250 мл) добавляли К 2 СО 3 (10 г, избыток) и смесь 25 нагревали с обратным холодильником 24 ч. В конце, реакционную смесь фильтровали, и слой ацетона концентрировали. Полученный осадок экстрагировали хлороформом, промывали тщательно, водой, сушили над безводным MgSO4,фильтровали и концентрировали. Полученный продукт очищали хроматографией на колонке с силикагелем, элюируя 30% этилацетатом : гексаном. Продукт, этиловый эфир 2-(4-метоксибензолсульфонил)-3-фенилпропионовой кислоты, выделяли в виде твердого продукта с низкой температурой плавления. Выход: 3,0 г,86%. Твердый продукт с низкой температурой плавления. МС: 349 (М+Н)+. К перемешиваемому раствору этилового эфира 2-(4-метоксибензолсульфонил)-3-фенилпропионовой кислоты (348 мг, 1 ммоль) в метаноле (25 мл), добавляли 10 н. NaOH (10 мл). Реакционную смесь перемешивали при комнатной температуре 48 ч. В конце, реакционную смесь концентрировали и осторожно нейтрализовали разбавленным HCl. Полученный осадок экстрагировали хлороформом, промывали тщательно водой, сушили и концентрировали. Полученный продукт очищали хроматографией на колонке с силикагелем, элюируя этилацетатом:метанолом(95:5) с получением 2-(4-метоксибензолсульфонил)-3-фенилпропионовой кислоты в видебесцветного масла. Выход: 250 мг, 89%. МС: 321 (М+Н)+. Исходя из 2-(4-метоксибензолсульфонил)3-фенилпропионовой кислоты (200 мг, 0,625 ммоль) и по методу, описанному в примере 1,выделяли 150 мг N-гидрокси-2-(4-метоксибензолсульфонил)-3-фенилпропионамид в виде коричневого твердого продукта. Выход: 71%. Т.пл. 180 С. МС: 336 (М+Н)+. 1 Н ЯМР (300 МГц, CDCl3):3,2 (м, 1 Н) , 3,8 (с,3H), 4,0-4,2 (м, 2 Н), 7,0-8,0 (м, 9 Н). Пример 10. Гидроксиамид 2-(4-метоксибензолсульфонил)гексановой кислоты. Этиловый эфир 2-(4-метоксифенилсульфанил)гексановой кислоты получали в соответствии с общим методом, описанным в примере 1. Исходя из этил 2-бромгексаноата (7 г, 32 ммоль) и 4-метоксибензолтиола (4,2 г, 30 ммоль) выделяли 8,3 г продукта. Выход 98%. Светло-желтое масло. МС: 283 (М+Н)+. Исходя из этилового эфира 2-(4 метоксифенилсульфанил)гексановой кислоты(2,8 г, 10 ммоль) и по методу, описанному в примере 9, выделяли 3 г этилового эфира 2-(4 метоксибензолсульфонил)гексановой кислоты в виде бесцветного твердого продукта. Выход: 95%. Т.пл. 62 С. МС: 314 (М+Н)+. Исходя из этилового эфира 2-(4-метоксибензолсульфонил)гексановой кислоты (2 г,6,3 ммоль) выделяли 1,5 г (83%) 2-(4 метоксибензолсульфонил)гексановой кислоты в виде бесцветного твердого продукта по методу,описанному в примере 9. Т.пл. 116 С. МС: 287 26 Исходя из 2-(4-метоксибензолсульфонил) гексановой кислоты (1,0 г, 3,1 ммоль) и по методу, описанному в примере 1, выделяли 700 мг гидроксиамида 2-(4-метоксибензолсульфонил)гексановой кислоты в виде бесцветного твердого продукта. Выход: 60%. Т.пл. 130 С. МС: 302 (М+Н)+. 1 Н ЯМР (300 МГц, CDCl3):0,786 (т, J=7,2 Гц,3H), 1,1-1,3 (м, 4 Н) , 1,6-1,8 (м, 2 Н), 3,7 (м, 1 Н),3,9 (с, 3H), 7,2 (д, J=11 Гц, 2 Н) , 7,8 (д, J=11 Гц,2 Н), 9,3 (с, 1 Н), 10,9 (с, 1 Н). Пример 11. Гидроксиамид 2-(4-метоксибензолсульфонил)тетрадекановой кислоты. Этиловый эфир 2-(4-метоксифенилсульфанил)тетрадекановой кислоты получали в соответствии с общим методом, описанным в примере 1. Исходя из соответствующего этил-2 броммиристата (5,0 г, 14,9 ммоль) и 4-метокситиофенола (1,9 г, 13,4 ммоль) выделяли 5,0 г продукта. Выход 98%. Светло-желтое масло. МС: 393 (М+Н)+. Исходя из этилового эфира 2-(4-метоксифенилсульфанил)тетрадекановой кислоты (3,9 г,10 ммоль) и по методу, описанному в примере 9,выделяли 3,2 г этилового эфира 2-(4 метоксибензолсульфонил)тетрадекановой кислоты в виде бесцветного твердого продукта. Выход: 76%; масло. МС: 425 (М+Н)+. Исходя из этилового эфира 2-(4-метоксибензолсульфонил)тетрадекановой кислоты (2,5 г, 5,9 ммоль) выделяли 2,0 г (85%) 2-(4 метоксибензолсульфонил)тетрадекановой кислоты в виде бесцветного твердого продукта по методу, описанному в примере 9. Т.пл. 82 С. МС: 397 (М+Н)+. Исходя из 2-(4-метоксибензолсульфонил) тетрадекановой кислоты (1,14 г, 2,9 ммоль) и по методу, описанному в примере 1, выделяли 670 мг гидроксамида 2-(4-метоксибензолсульфонил)тетрадекановой кислоты в виде не совсем белого твердого продукта. Выход: 57%. Т.пл. 114 С. МС: 414 (М+Н)+. 1 Н ЯМР (300 МГц, DMCO-d6) :0,85 (т, J=7 Гц,3H), 1,16-1,27 (м, 20 Н), 1,66 (м, 2 Н), 3,62-3,70(д, J=15 Гц, 2 Н). Пример 12. N-Гидрокси-2-(4-метоксибензолсульфонил)-2-метил-3-фенилпропионамид. К перемешиваемому раствору этилового эфира 2-(4-метоксибензолсульфонил)-3-фенилпропионовой кислоты (1,0 г, 3 ммоль) (пример 9), добавляли метилйодид (1 мл, избыток) и 18 Краун-6 (500 мг) в ацетоне (250 мл), К 2 СО 3 (10 г, избыток) и реакционную смесь нагревали с обратным холодильником 14 ч. В конце реакционную смесь фильтровали и концентрировали слой ацетона. Полученный осадок экстрагировали хлороформом, промывали тщательно водой, сушили над безводным MgSO4, фильтровали и кон 27 центрировали. Полученный продукт очищали хроматографией на колонке с силикагелем,элюируя 30% этилацетатом:гексаном с получением этилового эфира 2-(4-метоксибензолсульфонил)-2-метил-3-фенилпропионовой кислоты в виде бесцветного масла. Выход 1,0 г,98%. МС: 349 (М+Н)+. Исходя из этилового эфира 2-(4-метоксибензолсульфонил)-2-метил-3-фенилпропионовой кислоты (900 мг, 2,7 ммоль) выделяли по методу, описанному в примере 9, 850 мг (количественный выход) 2-(4-метоксибензолсульфонил)-2-метил-3-фенилпропионовой кислоты. Бесцветное масло, МС: 335 (М+Н)+. Исходя из 2-(4-метоксибензолсульфонил)2-метил-3-фенилпропионовой кислоты (900 мг,2,7 ммоль) и по методу, описанному в примере 1, 450 мг N-гидрокси-2-(4-метоксибензолсульфонил)-2-метил-3-фенилпропионамида выделяли в виде коричневого твердого продукта. Выход: 48%. Т.пл. 58 С. МС: 350 (М+Н)+. 1 Н ЯМР (300 МГц, CDCl3):1,4 (с, 3H), 3,1 (д,J=9 Гц, 1 Н), 3,6 (д, J=9 Гц, 1 Н), 3,9 (с, 3H), 6,87,8 (м, 9 Н). Пример 13. Гидроксиамид 2-(4-метоксибензолсульфонил)-2,5-диметилгекс-4-еновой кислоты. Исходя из этилового эфира 2-(4 метоксифенилсульфанил) пропионовой кислоты(пример 1) (12 г, 50 ммоль) и по методу, описанному в примере 9, выделяли 12 г этилового эфира 2-(4-метоксибензолсульфонил)пропионовой кислоты в виде полутвердого продукта. Выход 100%. МС: 256,1 (М+Н)+. По методу, описанному в примере 12, исходя из (1 г, 3,6 ммоль) этилового эфира 2-(4 метоксибензолсульфонил)пропионовой кислоты и изопренилбромида (1,0 г, 6 ммоль) получали этиловый эфир 2-(4-метоксибензолсульфонил)2,5-диметилгекс-4-еновой кислоты. Выход 1,0 г, 81%. Бесцветное масло. МС: 341 (М+Н)+. Исходя из этилового эфира 2-(4-метоксибензолсульфонил)-2,5-диметилгекс-4-еновой кислоты (900 мг, 2,6 ммоль) выделяли 800 мг(96%) 2-(4-метоксибензолсульфонил)-2,5-диметилгекс-4-еновой кислоты в виде полутвердого продукта, по методу, описанному в примере 9. МС: 313 (М+Н)+. Исходя из 2-(4-метоксибензолсульфонил)2, 5-диметилгекс-4-еновой кислоты (1,0 г, 3,2 ммоль) и по методу, описанному в примере 1,700 мг гидроксиамида 2-(4-метоксибензолсульфонил)-2,5-диметилгекс-4-еновой кислоты выделяли в виде твердого продукта с низкой температурой плавления. Выход: 67%. МС: 328 (М+Н)+. 1 Н ЯМР 28 Пример 14. 3-(Бифенил-4-ил)-N-гидрокси 2-(4-метоксибензолсульфонил)-2-метилпропионамид. По методу, описанному в примере 12, получали этиловый эфир 3-(бифенил-4-ил)-2-(4 метоксибензолсульфонил)-2-метилпропионовой кислоты, исходя из (2,7 г, 10 ммоль) этилового эфира 2-(4-метоксибензолсульфонил)пропионовой кислоты и 4-(хлорметил) бифенил (2,5 г,12 ммоль). Выход 4,0 г, 91%. Бесцветное масло. МС: 438 (М+Н)+. Исходя из этилового эфира 3-(бифенил-4 ил)-2-(4-метоксибензолсульфонил)-2-метилпропионовой кислоты (3 г, 6,8 ммоль) выделяли 2,5 г (89%) 3-(бифенил-4-ил)-2-(4-метоксибензолсульфонил)-2-метилпропионовой кислоты в виде бесцветного твердого продукта следуя процедуре, описанной в примере 9. Т.пл. 161 С. МС: 411 (М+Н)+. Исходя из 3-(бифенил-4-ил)-2-(4-метоксибензолсульфонил)-2-метилпропионовой кислоты (2,0 г, 4,8 ммоль) и по методу, описанному в примере 1, выделяли 1,2 г 3-(бифенил-4-ил)-Nгидрокси-2-(4-метоксибензолсульфонил)-2 метилпропионамида в виде прозрачного твердого продукта. Выход: 58%. Т.пл. 177 С. МС: 426 (М+Н)+. 1 Н ЯМР (300 МГц, CDCl3):1,4 (с, 3H), 3,2 (д,J=9 Гц, 1 Н), 3,7 (д, J=9 Гц, 1 Н), 3,9 (с, 3H), 7,07,8 (м, 13 Н), 9,7 (ушир. с, 1 Н). Пример 15. Гидроксамид 2-(4-метоксибензолсульфонил)-2,5,9-триметилдека-4,8-диеновой кислоты. По методу, описанному в примере 12, исходя из (2,7 г, 10 ммоль) этилового эфира 2-(4 метоксибензолсульфонил)пропионовой кислоты и геранилбромида (3,0 г, 13 ммоль), получали этиловый эфир 2-(4-метоксибензолсульфонил)2,5,9-триметилдека-4,8-диеновой кислоты. Выход 4,0 г, 98%. Бесцветное масло. МС: 409(М+Н)+. Исходя из этилового эфира 2-(4 метоксибензолсульфонил)-2,5,9-триметилдека 4,8-диеновой кислоты (3 г, 7,4 ммоль) выделяли 2,8 г (96%) 2-(4-метоксибензолсульфонил)-2,5,9 триметилдека-4,8-диеновой кислоты в виде бесцветного масла следуя процедуре, описанной в примере 9. МС: 379 (М-Н)-. Исходя из 2-(4-метоксибензолсульфонил)2,5,9-триметилдека-4,8-диеновой кислоты (2,0 г,5,2 ммоль) и по методу, описанному в примере 1, 1,8 г гидроксиамида 2-(4-метоксибензолсульфонил)-2,5,9-триметилдека-4,8-диеновой кислоты выделяли в виде бесцветного масла. Выход: 88%. МС: 396 (М+Н)+. 1 Н ЯМР 29 Пример 16. 3-Циклогексил-N-гидрокси-2(4-метоксибензолсульфонил)-2-метилпропионамид. По методу, описанному в примере 12, исходя из (2,7 г, 10 ммоль) этилового эфира 2-(4 метоксибензолсульфонил)пропионовой кислоты и бромметилциклогексана (1,8 г, 10 ммоль) получали этиловый эфир 3-циклогексил-2-(4 метоксибензолсульфонил)-2-метилпропионовой кислоты. Выход 3,5 г, 95%. Желтое масло. МС: 369(M+H)+. Исходя из этилового эфира 3-циклогексил 2-(4-метоксибензолсульфонил)-2-метил пропионовой кислоты (3 г, 8,1 ммоль) выделяли 2,5 г (90%) 3-циклогексил-2-(4-метоксибензолсульфонил)-2-метилпропионовой кислоты в виде бесцветного твердого продукта по методу, описанному в примере 9. Т.пл. 116 С. МС: 341(М+Н)+. Исходя из 3-циклогексил-2-(4-метоксибензолсульфонил)-2-метилпропионовой кислоты (2,0 г, 5,8 ммоль) и по методу, описанному в примере 1, выделяли 1,1 г 3-циклогексил-Nгидрокси-2-(4-метоксибензолсульфонил)-2 метилпропионамида в виде бесцветного твердого продукта. Выход: 55%. Т.пл. 58 С. МС: 356 (М+Н)+. 1 Н ЯМР (300 МГц, CDCl3)1,4 (с, 3H), 2,3 -1,0(2,9 г, 10 ммоль), получали этиловый эфир 2-(4 метоксибензолсульфонил)-2-метил-3-[4-(2-пиперидин-1-илэтокси)фенил]пропионовой кислоты. Выход 4,8 г, 98%. Коричневое масло. МС: 490 (М+Н)+. Исходя из этилового эфира 2-(4-метоксибензолсульфонил)-2-метил-3-[4-(2-пиперидин-1-илэтокси)фенил]пропионовой кислоты(4,0 г, 7,9 ммоль) выделяли 3,5 г (выход: 94 %) 2-(4-метоксибензолсульфонил)-2-метил-3-[4-(2 пиперидин-1-илэтокси)фенил]пропионовой кислоты в виде бесцветных кристаллов по методу,описанному в примере 9. Т.пл. 106 С. МС: 462,5 (М+Н)+. Исходя из 2-(4-метоксибензолсульфонил)2-метил-3-[4-(2-пиперидин-1-ил-этокси)фенилпропионовой кислоты (2,0 г, 4,2 ммоль) и по методу, описанному в примере 1, выделяли 1 гN-гидрокси-2-(4-метоксибензолсульфонил)-2 метил-3-[4-(2-пиперидин-1-илэтокси)фенил] пропионамида в виде бесцветного твердого продукта.(м, 8 Н) , 10,8 (ушир. с, 1 Н). Пример 18. Гидроксиамид 2-[4-(2-азепан 1-илэтокси)бензил]-2-(4-метоксибензолсульфонил)пропионовой кислоты. По методу, описанному в примере 12, этиловый эфир 2-[4-(2-азепан-1-илэтокси)бензил]2-(4-метоксибензолсульфонил)пропионовой кислоты получали, исходя из (2,7 г, 10 ммоль) этилового эфира 2-(4-метоксибензолсульфонил) пропионовой кислоты и 1-[2-(4-хлорметилфенокси)этил]азепан (3,03 г, 10 ммоль). Выход 4,5 г, 90%. Коричневое масло. МС: 504 (М+Н)+. Исходя из этилового эфира 2-[4-(2-азепан 1-илэтокси)бензил]-2-(4-метоксибензолсульфонил)пропионовой кислоты (4,0 г, 7,9 ммоль) выделяли 3,5 г (выход: 94 %) 2-[4-(2-азепан-1 ил-этокси)бензил]-2-(4-метоксибензолсульфонил)пропионовой кислоты в виде полутвердого продукта по методу, описанному в примере 9. МС: 476 (М+Н)+. Исходя из 2-[4-(2-азепан-1-илэтокси)бензил]-2-(4-метоксибензолсульфонил)пропионовой кислоты (2,0 г, 4,2 ммоль) и по методу, описанному в примере 1, выделяли 1 г гидроксиамида 2-[4-(2-азепан-1-илэтокси)бензил]-2-(4 метоксибензолсульфонил)пропионовой кислоты в виде бесцветного твердого продукта. Выход: 1,8 г, 87%. Т.пл. 68 С. МС: 491(М+Н)+. 1 Н ЯМР (300 МГц, CDCl3):1,23 (с,3H), 3,5-1,7 (м, 18 Н), 3,8 (с, 3H), 4,2 (м, 1 Н), 6,47,89 (м, 8 Н), 10,9 (ушир, 1 Н). Пример 19. Гидроксиамид 2-[4-(2-азепан 1-илэтокси)бензил]-2-(4-метоксибензолсульфонил)пентановой кислоты. Этиловый эфир 2-[4-(2-азепан-1-илэтокси) бензил]-2-(4-метоксибензолсульфонил)пентановой кислоты получали в соответствии с общим методом, описанным в пример 12, исходя из этилового эфира 2-(4-метоксибензолсульфонил)пентановой кислоты (3,5 г, 11,7 ммоль) и 1-[2-(4-хлорметилфенокси)этил]азепана (3,9 г,12,8 ммоль). Выход 2,58 г (42%). Коричневое масло. МС: 532,4 (М+Н)+. 2-[4-(2-Азепан-1-ил-этокси)бензил]-2-(4 метоксибензолсульфонил) пентановой кислоты получали, исходя из этилового эфира [4-(2 азепан-1-ил-этокси)бензил]-2-(4-метоксибензолсульфонил) пентановой кислоты (2 г, 3,76 ммоль), растворенного в метаноле (300 мл) и 10N NaOH (15 мл). Полученную смесь обрабатывали, как описано в примере 1. Выход 830 мг (44%). Коричневый твердый продукт с т.пл. 55 С. МС: 504,4 (М+Н)+. Исходя из 2-[4-(2-азепан-1-илэтокси)бензил]-2-(4-метоксибензолсульфонил)пентановой кислоты (690 мг, 1,37 ммоль) и по методу, опи 31 санному в примере 1, 240 мг 2-[4-(2-азепан-1 илэтокси)бензил]-2-(4-метоксибензолсульфонил)пентановой кислоты. Гидроксиамид выделяли в виде желтого твердого продукта. Выход 34%. Т.пл. 85 С. МС: 519,2 (М+Н)+. 1 Н ЯМР (300 МГц, DMCO-d6):0,71 (т, J=7,3 Гц, 3H), 0,78-1,77 (м, 16 Н), 3,04-3,46 (м, 4 Н),3,87 (с, 3H), 4,26 (м, 2 Н) 6,87 (д, J=8,7 Гц, 2 Н),7,14 (м, 4 Н), 7,71 (д, J=9 Гц, 2 Н) , 9,07 (c, 1H), 10(с, 1 Н). Пример 20. N-Гидрокси-2-(4-метоксибензолсульфонил)-2-метил-3-[4-(2-N,N-диизопропиламиноэтокси)фенил]пропионамид. По методу, описанному в примере 12, исходя из (5,4 г, 20 ммоль) этилового эфира 2-(4 метоксибензолсульфонил)пропионовой кислоты и 4-(2-N,N-диизопропиламиноэтокси)бензилхлорида (6,1 г, 20 ммоль), получали этиловый эфир 2-(4-метоксибензолсульфонил)-2-метил-3[4-(2-N,N-диизопропиламиноэтоксифенил]пропионовой кислоты. Выход 8,9 г, 88%. Желтое масло. МС: 506,5 (М+Н)+. Исходя из этилового эфира 2-(4-метоксибензолсульфонил)-2-метил-3-[4-(2-N,N-диизопропиламиноэтокси)фенил]пропионовой кислоты (4,0 г, 7,9 ммоль), выделяли 3,5 г (выход: 92%) 2-(4-метоксибензолсульфонил)-2-метил-3-[4(2-N,N-диизопропиламиноэтокси)фенил]пропионовой кислоты в виде бесцветных кристаллов по методу, описанному в примере 9. Т.пл. 68 С. МС: 478,6 (М+Н)+. Исходя из 2-(4-метоксибензолсульфонил)2-метил-3-[4-(2-N,N-диизопропиламиноэтокси) фенил]пропионовой кислоты (2,0 г, 4,1 ммоль) и по методу, описанному в примере 1, выделяли 1 г 2-(4-метоксибензолсульфонил)-2-метил-3-[4(2-N,N-диизопропиламиноэтокси) фенил] пропионамид в виде бесцветного твердого продукта. Выход: 1 г, 49%. Т.пл. 98 С (соль HCl). МС: 493 (М+Н)+. 1 Н ЯМР (300 МГц, CDCl3) :1,2 (с, 3H), 1,3 (д, 6 Н), 1,4 (д, 6 Н), 3,5-1,5 (м,6 Н), 3,9 (с, 3H), 4,4 (с, 2 Н), 6,5-7,8 (м, 8 Н), 10,8(ушир, 1 Н). Пример 21. N-Гидрокси-2-(4-метоксибензолсульфонил)-2-метил-3-[4-(2-N,N-диэтиламиноэтокси)фенил]пропионамид. По методу, описанному в примере 12, получали этиловый эфир 2-(4-метоксибензолсульфонил)-2-метил-3-[4-(2-N,N-диэтиламиноэтокси)фенил]пропионовой кислоты, исходя из(5,4 г, 20 ммоль) этилового эфира 2-(4-метоксибензолсульфонил)пропионовой кислоты и 4(2-N,N-диэтиламиноэтокси)бензилхлорида (5,5 г, 20 ммоль). Выход 8,5 г, 89%. Коричневое масло. МС: 478,6 (М+Н)+. Исходя из этилового эфира 2-(4 метоксибензолсульфонил)-2-метил-3-[4-(2-N,Nдиэтиламиноэтокси)фенил]пропионовой кисло 003836%) 2-(4-метоксибензолсульфонил)-2-метил-3-[4(2-N,N-диэтиламиноэтокси)фенил]пропионовой кислоты в виде бесцветных кристаллов по методу, описанному в примере 9. Т.пл. 96-98 С. МС: 450,5 (М+Н)+. Исходя из 2-(4-метоксибензолсульфонил)2-метил-3-[4-(2-N,N-диэтиламиноэтокси)фенил] пропионовой кислоты (2,0 г, 4,4 ммоль) и по методу, описанному в примере 1, выделяли 1 г 2-(4-метоксибензолсульфонил)-2-метил-3-[4-(2N,N-диэтиламиноэтокси)фенил]пропионамида в виде бесцветного твердого продукта. Выход: 1 г, 48%. Т.пл. 56-59 С (соль HCl). МС: 465,5 (М+Н) +. 1 Н ЯМР (300 МГц, CDCl3):1,1 (т, 6 Н), 1,3 (с, 3H), 3,2-3,9 (м, 8 Н), 3,9 (с, 3H),4,3 (с, 3H), 6,5-7,8 (м, 8 Н), 10,8 (ушир, 1 Н). Пример 22. N-Гидрокси-2-(4-метоксибензолсульфонил)-2-метил-3-[3-(2-пиперидин-1 илэтокси)фенил]пропионамид. По методу, описанному в примере 12, получали этиловый эфир 2-(4-метоксибензолсульфонил)-2-метил-3-[3-(2-пиперидин-1-илэтокси)фенил]пропионовой кислоты, исходя из (5,2 г, 20 ммоль) этилового эфира 2-(4-метоксибензолсульфонил)пропионовой кислоты и 3-(2 пиперидин-1-илэтокси)бензилхлорида (6,0 г, 20 ммоль). Выход 8,2 г, 83%. Коричневое масло. МС: 490 (М+Н)+. Исходя из этилового эфира 2-(4-метоксибензолсульфонил)-2-метил-3-[3-(2-пиперидин-1 илэтокси)фенил]пропионовой кислоты (6,0 г,12,2 ммоль), выделяли 4,9 г (выход: 79 %) 2-(4 метоксибензолсульфонил)-2-метил-3-[3-(2 пиперидин-1-илэтокси)фенил]пропионовой кислоты в виде бесцветных кристаллов по методу,описанному в примере 9. Т.пл. 112 С. МС: 462,5 (М+Н)+. Исходя из 2-(4-метоксибензолсульфонил)2-метил-3-[3-(2-пиперидин-1-илэтокси)фенил] пропионовой кислоты (3,0 г, 6,5 ммоль) и по методу, описанному в примере 1, выделяли 1,8 г 2-(4-метоксибензолсульфонил)-2-метил-3-[3-(2 пиперидин-1-илэтокси)фенил]пропионамида в виде бесцветного твердого продукта. Выход: 1,8 г, 58%. Т.пл. 74 С. МС: 477(М+Н)+. 1 Н ЯМР (300 МГц, CDCl3):1,25 (с,3H), 1,6-1,8 (м, 6 Н), 2,5-3,7 (м, 8 Н), 3,9 (с, 3H),4,4 (т, 2 Н), 6,7-7,8 (м, 8 Н), 10,8 (ушир, 1 Н). Пример 23. 3-(4-3-[4-(3-Хлорфенил)пиперазин-1-ил]пропоксифенил)-N-гидрокси-2(4-метоксибензолсульфонил)-2-метилпропионамид. По методу, описанному в примере 12, исходя из (2,72 г, 10 ммоль) этилового эфира 2-(4 метоксибензолсульфонил)пропионовой кислоты и 1-[2-(4-хлорметилфенокси)этил]-4-(3-хлорфенил)пиперазин (4,2 г, 11 ммоль)получали этиловый эфир 3-(4-3-[4-(3-хлорфенил)пиперазин-1 33 ил]пропоксифенил)-2-(4-метоксибензолсульфонил)-2-метилпропионовой кислоты. Выход 5,5 г, 89%. Коричневое масло. МС: 616 (М+Н)+. Исходя из этилового эфира 3-(4-3-[4-(3 хлорфенил)пиперазин-1-ил]пропоксифенил)-2(4-метоксибензолсульфонил)-2-метилпропионовой кислоты (4,0 г, 6,5 ммоль) выделяли 3,0 г(выход: 78%) 3-(4-3-[4-(3-хлорфенил)пиперазин-1-ил]пропокси-фенил)-2-(4-метоксибензолсульфонил)-2-метилпропионовой кислоты в виде бесцветных кристаллов по методу, описанному в примере 9. Т.пл. 196 С. МС: 588,1 (М+Н)+. Исходя из 3-(4-3-[4-(3-хлорфенил)пиперазин-1-ил]пропоксифенил)-2-(4-метоксибензолсульфонил)-2-метилпропионовой кислоты (3,0 г,5,1 ммоль) и по методу, описанному в примере 1, выделяли 1,8 г 3-(4-3-[4-(3-хлорфенил)пиперазин-1-ил]пропоксифенил)-N-гидрокси 2-(4-метоксибензолсульфонил)-2-метилпропионамид в виде бледно-желтого твердого продукта. Выход: 1,8 г, 55%. Т.пл. 122 С (соль HCl). МС: 640 (М+Н)+. 1 Н ЯМР (300 МГц, CDCl3):1,2 (с, 3H). 3,4-1,5 (м, 14 Н), 3,9 (с, 3H), 4,5 (м,2 Н) , 6,5-8,2 (м, 12 Н), 10,3 (ушир, 1 Н). Пример 24. Гидроксиамид 2-(4-метоксибензолсульфонил) -5-метил-2-[4-(2-морфолин-4 илэтокси)бензил]гекс-4-еновой кислоты. К перемешиваемому раствору этилового эфира (4-метоксибензолсульфонил) уксусной кислоты (5,16 г, 20 ммоль), изопренилбромида(3,0 г, 20 ммоль) и 18-Краун-6 (500 мг) в ацетоне (250 мл) добавляли К 2 СО 3 (10 г, избыток) и смесь нагревали с обратным холодильником 24 ч. В конце реакционную смесь фильтровали, и слой ацетона концентрировали. Полученный осадок экстрагировали хлороформом, промывали тщательно водой, сушили над безводнымMgSO4, фильтровали и концентрировали. Полученный продукт очищали хроматографией на колонке с силикагелем, элюируя 30% этилацетатом:гексаном. Продукт, этиловый эфир 2-(4 метоксибензолсульфонил)-5-метилгекс-4-еновой кислоты, выделяли в виде бесцветного масла. Выход: 3,0 г, 93%. По методу, описанному в примере 12, этиловый эфир 2-(4-метоксибензолсульфонил)-5 метил-2-[4-(2-морфолин-4-илэтокси)бензил] гекс-4-еновой кислоты получали, исходя из(3,26 г, 10 ммоль) этилового эфира 2-(4-метоксибензолсульфонил)-5-метилгекс-4-еновой кислоты и 4-(2-морфолин-1-илэтокси)бензилхлорида (3,0 г, 11 ммоль). Выход 4,5 г, 82%. Коричневое масло. МС: 546 (М+Н)+. Исходя из этилового эфира 2-(4-метоксибензолсульфонил)-5-метил-2-[4-(2-морфолин-4 илэтокси)бензил]гекс-4-еновой кислоты (3,0 г,5,5 ммоль) выделяли 2,1 г (выход: 75 %) 2-(4 метоксибензолсульфонил)-5-метил-2-[4-(2-морфолин-4-илэтокси)бензил]гекс-4-еновую кисло 003836 34 ту в виде полутвердого продукта по методу,описанному в примере 9. МС: 518,6 (М+Н)+. Исходя из 2-(4-метоксибензолсульфонил)5-метил-2-[4-(2-морфолин-4-илэтокси)бензил] гекс-4-еновой кислоты (1,0 г, 1,9 ммоль) и по методу, описанному в примере 1, выделяли 450 мг гидроксиамида 2-(4-метоксибензолсульфонил)-5-метил-2-[4-(2-морфолин-4-илэтокси) бензил]гекс-4-еновой кислоты в виде бледножелтого твердого продукта. Выход: 450 мг, 45%. Т.пл. 92 С (соль HCl). МС: 570 (М+Н)+. 1 Н ЯМР (300 МГц, CDCl3):1,3 (д, 3H), 1,65 (д, 2 Н), 3,5-1,8 (м, 14 Н), 3,9 (с,3H), 4,5 (м, 2 Н), 5,4 (м, 1 Н), 6,5-7,9 (м, 8 Н), 11,5(ушир, 1 Н). Пример 25. N-Гидрокси-2-(4-этоксибензолсульфонил)-2-метил-3-[4-(2-N,N-диэтиламиноэтокси)фенил]пропионамид. К перемешиваемому раствору 4-гидрокситиофенола (12,6 г, 100 ммоль) и триэтиламина (15,0 г, 150 ммоль) в хлороформе (400 мл) по каплям добавляли 2-бромэтилпропионат (18,2 г,100 ммоль). Реакционную смесь нагревали с обратным холодильником в течение 1 ч и охлаждали до комнатной температуры. Реакционную смесь промывали водой, сушили и концентрировали. Этиловый эфир 2-(4-гидроксифенилсульфанил)пропионовой кислоты выделяли в виде бесцветного масла. Выход: 22,0 г,99%. МС: 227 (М+Н). К перемешиваемому раствору этилового эфира 2-(4-гидроксифенилсульфанил)пропионовой кислоты (11,3 г, 50 ммоль) и К 2 СО 3 (50 г,избыток) в ацетоне (300 мл), добавляли этилйодид (20 мл, избыток) и нагревали с обратным холодильником в течение 8 ч. В конце, реакционную смесь фильтровали и концентрировали. Полученный осадок экстрагировали хлороформом и промывали тщательно водой, сушили и концентрировали. Продукт, этиловый эфир 2-(4 этоксифенилсульфанил)пропионовой кислоты выделяли в виде бесцветного масла. Выход: 12,0 г, 98%. МС: 255 (М+Н). Этиловый эфир 2-(4-этоксифенилсульфанил)пропионовой кислоты превращали в этиловый эфир 2-(4-этоксифенилсульфонил)пропионовой кислоты по методу, описанному в примере 9, абзац 2. По методу, описанному в примере 12, этиловый эфир 2-(4-этоксибензолсульфонил)-2 метил-3-[4-(2-N,N-диэтиламиноэтокси)фенил] пропионовой кислоты получали, исходя из (3,5 г, 12,2 ммоль) этилового эфира 2-(4-этоксибензолсульфонил)пропионовой кислоты и 4-(2N,N-диэтиламиноэтокси)бензилхлорида (3,5 г,12,2 ммоль). Выход 4,8 г, 80%. Коричневое масло. МС: 492,6 (М+Н)+. Исходя из этилового эфира 2-(4-этоксибензолсульфонил)-2-метил-3-[4-(2-N,N-диэтиламиноэтокси)фенил]пропионовой кислоты (4,0 г, 8,1 ммоль) выделяли 3,2 г (выход: 80%) 2-(4 35 этоксибензолсульфонил)-2-метил-3-[4-(2-N,Nдиэтиламиноэтокси) фенил] пропионовой кислоты в виде бесцветного полутвердого продукта по методу, описанному в примере 9. МС: 464,5 (М+Н)+. Исходя из 2-(4-этоксибензолсульфонил)-2 метил-3-[4-(2-N,N-диэтиламиноэтокси)фенил] пропионовой кислоты (2,0 г, 4,3 ммоль) и по методу, описанному в примере 1, выделяли 1,2 г 2-(4-этоксибензолсульфонил)-2-метил-3-[4-(2N,N-диэтиламиноэтокси) фенил] пропионамида в виде бесцветного твердого продукта с низкой температурой плавления. Выход: 1,2 г, 57%; (соль HCl). МС: 478,5(250 мл) добавляли К 2 СО 3 (10 г, избыток) и смесь нагревали с обратным холодильником в течение 24 ч. В конце реакционную смесь фильтровали и слой ацетона концентрировали. Полученный осадок экстрагировали хлороформом, промывали тщательно водой, сушили над безводным MgSO4, фильтровали и концентрировали. Полученный продукт очищали хроматографией на колонке с силикагелем, элюируя 30% этилацетатом : гексаном. Продукт, этиловый эфир 2-(4-метоксибензолсульфонил)-5,9 диметилдека-4,8-диеновой кислоты, выделяли в виде бесцветного масла. Выход: 7,0 г, 89%. По методу, описанному в примере 12, исходя из (1,0 г, 2,5 ммоль) этилового эфира 2-(4 метоксибензолсульфонил)-5,9-диметилдека-4,8 диеновой кислоты и 4-(2-морфолин-1-илэтокси)бензилхлорида (800 мг, 2,5 ммоль), получали этиловый эфир 2-(4-метоксибензолсульфонил)5,9-диметил-2-[4-(2-морфолин-4-илэтокси)бензил]дека-4,8-диеновой кислоты. Выход 1,2 г, 76%. Коричневое масло. МС: 614 (М+Н)+. Исходя из этилового эфира 2-(4-метоксибензолсульфонил)-5,9-диметил-2-[4-(2-морфолин-4-илэтокси)бензил]дека-4,8-диеновой кислоты (2,0 г, 3,2 ммоль) выделяли 1,5 г (выход: 80 %) 2-(4-метоксибензолсульфонил)-5, 9 диметил-2-[4-(2-морфолин-4-илэтокси)бензил] дека-4,8-диеновой кислоты в виде полутвердого продукта по методу, описанному в примере 9. МС: 586,6 (М+Н)+. Исходя из 2-(4-метоксибензолсульфонил)5,9-диметил-2-[4-(2-морфолин-4-илэтокси)бензил]дека-4,8-диеновой кислоты (1,0 г, 1,7 ммоль) и по методу, описанному в примере 1, 003836 36 выделяли 550 мг гидроксиамида (4 Е)-2-(4 метоксибензолсульфонил)-5,9-диметил-2-[4-(2 морфолин-4-илэтокси)бензил]дека-4,8-диеновой кислоты в виде бледно-желтого твердого продукта. Выход: 550 мг, 53%. Т.пл. 61 С (соль HCl). МС: 638 (М+Н)+. Пример 27. Гидроксиамид 2-[4-(2 диэтиламиноэтокси)бензил]-2-(4-метоксибензолсульфонил)гексановой кислоты. Этиловый эфир 2-[4-(2-диэтиламиноэтокси)бензил]-2-(4-метоксибензолсульфонил) гексановой кислоты получали в соответствии с общим методом, описанным в примере 12. Исходя из этилового эфира 2-(4-метоксибензолсульфонил)гексановой кислоты (4 г, 12,7 ммоль) и(М+Н)+. Получали 2-[4-(2-диэтиламиноэтокси)бензил]-2-(4-метоксибензолсульфонил)гексановую кислоту, исходя из этилового эфира 2-[4-(2 диэтиламиноэтокси)бензил]-2-(4-метоксибензолсульфонил)гексановой кислоты (8 г, 15,4 ммоль), растворенного в метаноле (200 мл) и 10 н. NaOH (30 мл). Результирующую смесь обрабатывали, как описано в примере 1. Выход 3,88 г неочищенного продукта (51%) в виде коричневого масла. МС: 492 (М+Н)+. Исходя из 2-[4-(2-диэтиламиноэтокси) бензил]-2-(4-метоксибензолсульфонил)гексановой кислоты (3,88 г, 7,89 ммоль) и по методу,описанному в примере 1, выделяли 800 мг гидроксиамида 2-[4-(2-диэтиламиноэтокси)бензил]2-(4-метоксибензолсульфонил)гексановой кислоты в виде желтого порошка. Выход 20%. Т.пл. 67 С. МС: 507,4 (М+Н)+. 1 Н ЯМР (300 МГц, DMCO-d6):0,75 (т, J=7,l Гц,3H), 1,05 (м, 2 Н), 1,23 (т, J=7,2 Гц, 6 Н) 1,37-1,91(с, 1 Н). Пример 28. N-Гидрокси-2-(4-н-бутоксибензолсульфонил)-2-метил-3-[4-(2-пиперидин-1 илэтокси)фенил]пропионамид. По методу, описанному в примере 12, получали этиловый эфир 2-(4-н-бутоксибензолсульфонил)-2-метил-3-[4-(2-пиперидин-1-илэтокси)фенил]пропионовой кислоты, исходя из (3,1 г, 10 ммоль) этилового эфира 2-(4-н-бутоксибензолсульфонил) пропионовой кислоты (получен из этилового эфира 2-(4-гидроксифенилсульфанил)пропионовой кислоты и н-бутилбромида по методу, описанному в примере 27), 4(2-пиперидин-1-илэтокси)бензилхлорида (3,0 г,10,1 ммоль). Выход 4,5 г, 84%. Коричневое масло. МС: 532,7 (М+Н)+. Исходя из этилового эфира 2-(4-н-бутоксибензолсульфонил)-2-метил-3-[4-(2-пиперидин-1-илэтокси)фенил]пропионовой кислоты(5,0 г, 9,4 ммоль), выделяли 4,2 г (выход: 88%) 2-(4-н-бутоксибензолсульфонил)-2-метил-3-[4(2-пиперидин-1-илэтокси)фенил]пропионовой кислоты в виде бесцветного твердого продукта по методу, описанному в примере 9. МС: 504,6(М+Н)+. Исходя из 2-(4-н-бутоксибензолсульфонил)-2-метил-3-[4-(2-пиперидин-1-илэтокси) фенил]пропионовой кислоты (3,0 г, 5,9 ммоль) и по методу, описанному в примере 1, выделяли 1,3 г 2-(4-н-бутоксибензолсульфонил)-2-метил 3-[4-(2-пиперидин-1-илэтокси)фенил]пропионамида в виде бесцветного твердого продукта. Т.пл. 65 С. Выход: 1,3 г, 42%; (соль HCl). МС: 478,5 (М+Н)+. 1 Н ЯМР (300 МГц, CDC13):0,9(т, 3H), 1,2 (с, 3H), 1,3-1,9 (м, 10 Н), 2,8-4,5 (м,12 Н), 6,8-7,8 (м, 8 Н), 10,8 (ушир.с, 1 Н). Пример 29. N-Гидрокси-2-(4-метоксибензолсульфонил)-2-метил-3-[3-(2-N,N-диэтиламиноэтокси)фенил]пропионамид. По методу, описанному в примере 12, получали этиловый эфир 2-(4-метоксибензолсульфонил)-2-метил-3-[3-(2-N,N-диэтиламиноэтокси)фенил]пропионовой кислоты, исходя из(4,9 г, 18 ммоль). Выход 8,1 г, 93%. Коричневое масло. МС: 478,1 (М+Н)+. Исходя из этилового эфира 2-(4-метоксибензолсульфонил)-2-метил-3-[3-(2-N,N-диэтиламиноэтокси)фенил]пропионовой кислоты (8,1 г, 16,9 ммоль) выделяли 6,7 г (выход: 88 %) 2-(4 метоксибензолсульфонил)-2-метил-3-[3-(2-N,Nдиэтиламиноэтокси)фенил]пропионовой кислоты в виде бесцветного полутвердого продукта по методу, описанному в примере 9. Т.пл. 78-81 С. МС: 450,1 (М+Н)+. Исходя из 2-(4-метоксибензолсульфонил)2-метил-3-[3-(2-N,N-диэтиламиноэтокси)фенил] пропионовой кислоты (6,7 г, 15 ммоль) и по методу, описанному в примере 1, выделяли 1,5 г 2(4-метоксибензолсульфонил)-2-метил-3-[3-(2N,N-диэтиламиноэтокси)фенил]пропионамида в виде бесцветного твердого продукта с низкой температурой плавления. Выход: 1,5 г, 21%; (соль HCl). МС: 450,5 38 ммоль). Выход 9,1 г, 93%. Коричневое масло. МС: 492 (М+Н)+. Исходя из этилового эфира 2-(4-метоксибензолсульфонил)-2-метил-3-[3-(2-морфолин-1 илэтокси)фенил]пропионовой кислоты (10,0 г,20,3 ммоль), выделяли 8,0 г (выход: 86%) 2-(4 метоксибензолсульфонил)-2-метил-3-[3-(2 морфолин-1-илэтокси)фенил]пропионовой кислоты в виде бесцветных кристаллов по методу,описанному в примере 9. МС: 464,5 (М+Н)+. Исходя из 2-(4-метоксибензолсульфонил)2-метил-3-[3-(2-морфолин-1-илэтокси)фенил] пропионовой кислоты (4,55 г, 9,8 ммоль) и по методу, описанному в примере 1, выделяли 440 мг 2-(4-метоксибензолсульфонил)-2-метил-3-[3(2-морфолин-1-илэтокси)фенил]пропионамид в виде бесцветного твердого продукта. Выход: 440 мг, 9%. Т.пл. 63 С. МС: 479,5(М+Н)+. 1 Н ЯМР (300 МГц, DMCO-d6):1,26 (с,3H), 3,18-3,8 (м, 12 Н) , 3,9 (с, 3H), 4,4 (м, 2 Н),6,7-8,8 (м, 8 Н), 10,8 (ушир.с, 1 Н). Пример 31. Гидроксиамид 6-(2,3-диоксо 1,3-дигидроизоиндол-2-ил)-2-(4-метоксибензолсульфонил)-2-метилгексановой кислоты. По методу, описанному в примере 9, этиловый эфир 6-(1,3-диохо-1,3-дигидроизоиндол 2-ил)-2-(4-метоксибензолсульфонил)-2-метилгексановой кислоты получали, исходя из (5,0 г,20 ммоль) этилового эфира 2-(4-метоксибензолсульфонил)уксусной кислоты и 4-фаталимидобромбутана (5,66 г, 20 ммоль). Выход 8,4 г,97%. Бесцветное масло. МС: 474 (М+Н)+. Исходя из этилового эфира 6-(1,3-диоксо 1,3-дигидроизоиндол-2-ил)-2-(4-метоксибензолсульфонил)-2-метилгексановой кислоты (8,4 г,17,7 ммоль), выделяли 6,95 г (88%) 6-(1,3 диоксо-1,3-дигидроизоиндол-2-ил)-2-(4-метоксибензолсульфонил)-2-метилгексановой кислоты в виде бесцветного масла по методу, описанному в примере 9. МС: 446 (М-Н)-. Исходя из 6-(1,3-диоксо-1,3-дигидроизоиндол-2-ил)-2-(4-метоксибензолсульфонил)-2 метилгексановой кислоты (4,9 г, 11 ммоль), и по методу, описанному в примере 1, выделяли 3,1 г гидроксиамида 6-(1,3-диоксо-1,3-дигидроизоиндол-2-ил)-2-(4-метоксибензолсульфонил)-2 метилгексановой кислоты в виде светлокоричневого твердого продукта. Выход: 46%. Т.пл. 146-148 С. МС: 461,2(15,0 г, 150 ммоль) в хлороформе (400 мл) по каплям добавляли 2-бромэтилпропионат (18,2 г,100 ммоль). Реакционную смесь нагревали с обратным холодильником в течение 1 ч и охла 39 ждали до комнатной температуры. Реакционную смесь промывали водой, сушили и концентрировали. Этиловый эфир 2-(4-бромфенилсульфанил)пропионовой кислоты выделяли в виде бесцветного масла. Выход: 28,0 г, 99%. МС: 290(М+Н). Этиловый эфир 2-(4-бромфенилсульфанил)пропионовой кислоты превращают в этиловый эфир 2-(4-бромфенилсульфонил)пропионовой кислоты по методу, описанному в примере 9, абзац 2. Смесь этилового эфира 2-(4-бромфенилсульфонил)пропионовой кислоты (6,4 г, 20 ммоль), 2-(трибутил-станнил) фурана (7,5 г, 21 ммоль) и (Ph3P)4Pd (500 мг) нагревали с обратным холодильником в дегазированном толуоле(250 мл) в течение 8 ч. В конце реакционную смесь фильтровали через целит и концентрировали. Продукт очищали хроматографией на колонке с силикагелем, элюируя 50% этилацетатом:гексаном. Бесцветное масло. Выход: 5,9 г,95%. МС: 309 (М+Н). По методу, описанному в примере 12, исходя из (3,08 г, 10,0 ммоль) этилового эфира 2(4-(2-фуранилбензолсульфонил)пропионовой кислоты и 4-(2-N,N-диэтиламиноэтокси)бензилхлорида (3,5 г, 12,2 ммоль), получали этиловый эфир 2-(4-(2-фуранилбензолсульфонил)-2-метил-3-[4-(2-N,N-диэтиламиноэтокси)фенил] пропионовой кислоты. Выход 5,0 г, 97%. Коричневое масло. МС: 514,6 (М+Н)+. Исходя из этилового эфира 2-(4-(2-фуранилбензолсульфонил)-2-метил-3-[4-(2-N,N-диэтиламиноэтокси)фенил]пропионовой кислоты(5,1 г, 10,0 ммоль), выделяли 3,8 г (выход: 78%) 2-(4-(2-фуранилбензолсульфонил)-2-метил-3-[4(2-N,N-диэтиламиноэтокси)фенил]пропионовой кислоты в виде бесцветного твердого продукта по методу, описанному в примере 9. Т.пл. 58 С. МС: 486,5 (М+Н)+. Исходя из 2-(4-(2-фуранилбензолсульфонил)-2-метил-3-[4-(2-N,N-диэтиламиноэтокси)фенил]пропионовой кислоты (5,0 г, 10,3 ммоль) и по методу, описанному в примере 1,выделяли 1, 2 г 2-(4-этоксибензолсульфонил)-2 метил-3-[4-(2-N,N-диэтиламиноэтокси)фенил] пропионамида в виде бесцветного твердого продукта с низкой температурой плавления. Выход: 3,2 г, 62%; (соль HCl). МС: 502(М+Н)+. 1H ЯМР (300 МГц, CDCl3):1,23 (т,6 Н), 1,4 (с, 2 Н), 2,8 (кв., 4 Н), 3,0(т, 2 Н), 4,1 (т,2 Н), 6,5-8,0 (м, 7 Н). Пример 33. N-Гидрокси-2-(4-метоксибензолсульфонил)-2-[4-(2-морфолин-4-илэтокси) бензил]бутирамид. Получали 5,19 г (40%) этилового эфира 2(4-метоксифенилсульфанил)бутановой кислоты в соответствии с общим методом, описанным в примере 9, исходя из этил 2-бромбутирата(10,71 г, 55 ммоль) и 4-метокситиофенола (7 г,50 ммоль). Чистое масло. МС: 255,2 (М+Н)+. Этиловый эфир 2-(4-метоксибензолсульфонил)бутановой кислоты получали в соответствии с общим методом, описанным в примере 9, исходя из этилового эфира 2-(4-метоксифенилсульфанил)бутановой кислоты (5 г, 20 ммоль). Выход 5,74 г (100%); чистое масло. МС: 287,1 (М+Н)+. По методу, описанному в примере 12, этиловый эфир 2-(4-метоксибензолсульфонил)-2[4-(2-морфолин-4-илэтокси)бензил]бутановой кислоты получали, исходя из (3,5 г, 12,2 ммоль) этилового эфира 2-(4-метоксибензолсульфонил) бутановой кислоты и 4-[2-(хлорметилфенокси) этил]морфолина (2,34 г, 6,7 ммоль). Выход 5,7 г,100%. Коричневое масло. МС: 506,4 (М+Н)+. Исходя из этилового эфира 2-(4-метоксибензолсульфонил)-2-[4-(2-морфолин-4-илэтокси)бензил]бутановой кислоты (5,54 г, 11 ммоль), выделяли 2,9 г (выход: 55%) 2-(4 метоксибензолсульфонил)-2-[4-(2-морфолин-4 илэтокси)бензил]бутановой кислоты в виде бесцветного полутвердого продукта по методу,описанному в примере 9. МС: 478,3 (М+Н)+. Исходя из 2-(4-метоксибензолсульфонил)2-[4-(2-морфолин-4-илэтокси)бензил]бутановой кислоты (2,6 г, 5,4 ммоль) и по методу, описанному в примере 1, выделяли 510 мг N-гидрокси 2-(4-метоксибензолсульфонил)-2-[4-(2-морфолин-4-илэтокси)-бензил]бутирамида в виде коричневого твердого продукта. Выход 2%. Т.пл. 51 С. МС: 493,3 (М+Н)+. 1 Н ЯМР (300 МГц, DMCO-d6):0,90 (т, J=7,2 Гц, 3H), 1,69-1,96 (м, 4 Н), 2,67 (т, 2 Н), 3,34 (м,8 Н), 3,87 (с, 3H), 4,04 (м, 2 Н), 6,8 (д, J=8,7 Гц,2 Н), 7,14 (м, 4 Н), 7,73 (д, J=4,7 Гц, 2 Н), 9,08 (с,1 Н), 10,8 (с, 1 Н). Пример 34. N-Гидрокси-2-(4-метоксибензолсульфонил)-2-[4-(2-пиперидин-1-илэтокси)бензил]бутирамид. По методу, описанному в примере 12, получали этиловый эфир 2-(4-метоксибензолсульфонил)-2-[4-(2-пиперидин-1-илэтокси)бензил]бутановой кислоты, исходя из (1,0 г, 3,33 ммоль) этилового эфира 2-(4-метоксибензолсульфонил)бутановой кислоты и 1-[2-(4-хлорметилфенокси)этил]пиперидина (0,85 г, 3,36 ммоль). Выход 1,07 г, 62%. Коричневое масло. МС: 504,4 (М+Н)+. Исходя из этилового эфира 2-(4 метоксибензолсульфонил)-2-[4-(2-пиперидин-1 ил-этокси)бензил]бутановой кислоты (3,7 г, 7,3 ммоль) 2,2 г (выход: 63%) 2-(4-метоксибензолсульфонил)-2-[4-(2-пиперидин-1-илэтокси)бензил]бутановой кислоты выделяли в виде бесцветного полутвердого продукта по методу,описанному в примере 9. МС: 476 (М+Н)+ . Исходя из 2-(4-метоксибензолсульфонил)2-[4-(2-пиперидин-1-илэтокси)бензил]бутановой кислоты (2,2 г, 4,63 ммоль) и по методу, 41 описанному в примере 1, выделяли 360 мг Nгидрокси-2-(4-метоксибензолсульфонил)-2-[4(2-пиперидин-1-илэтокси)-бензил]бутирамида в виде коричневого твердого продукта. Выход 16%. Т.пл. 75 С. МС: 491,3 (М+Н)+. 1 Н ЯМР (300 МГц, DMCO-d6):0,90 (т, J=7,l Гц,3H), 1,36-1,96 (м, 4 Н), 2,4-2,63 (м, 14 Н), 3,87 (с,3H), 4,01 (т, J=5, 9 Гц, 2 Н) 6,8 (д, J=8,5 Гц, 2 Н),7,11 (м, 4 Н), 7,71 (д, J=8,8 Гц, 2 Н), 9,09 (с, 1 Н),10,8 (с, 1 Н). Пример 35. Гидроксиамид 2-(4-метоксибензолсульфонил)-2-[4-(2-морфолин-4-илэтокси)бензил]пентановой кислоты. Получали 10,46 г (100%) этилового эфира 2-(4-метоксифенилсульфанил)пентановой кислоты в соответствии с общим методом, описанным в примере 9, исходя из этил 2-бромвалерата (8,23 г, 39,3 ммоль) и 4-метокситиофенола(5 г, 35,7 ммоль). Чистое масло. МС: 269 (М+Н)+. Этиловый эфир 2-(4-метоксибензолсульфонил)пентановой кислоты получали в соответствии с общим методом, описанным в примере 9. Исходя из этилового эфира 2-(4-метоксифенилсульфанил)пентановой кислоты (6,9 г,27,4 ммоль). Выход 7,07 г (86%); чистое масло. МС: 300,9 (М+Н)+. По методу, описанному в примере 12, получали этиловый эфир 2-(4-метоксибензолсульфонил)-2-[4-(2-морфолин-4-илэтокси)бензил]пентановой кислоты, исходя из (3,0 г, 10,8 ммоль) этилового эфира 2-(4-метоксибензолсульфонил)пентановой кислоты и 4-[2-(хлорметилфенокси)этил]морфолина (3,45 г, 11,9 ммоль). Выход 3,08 г, 62%. Коричневое масло. МС: 520,4 (М+Н)+. Исходя из этилового эфира 2-(4-метоксибензолсульфонил)-2-[4-(2-морфолин-4-илэтокси)бензил]пентановой кислоты (2,73 г, 5,27 ммоль) выделяли 1,45 г (выход: 56%) 2-(4 метоксибензолсульфонил)-2-[4-(2-морфолин-4 илэтокси)бензил]пентановой кислоты в виде бесцветного полутвердого продукта по методу,описанному в примере 9. МС: 492,3 (М+Н)+. Исходя из 2-(4-метоксибензолсульфонил)2-[4-(2-морфолин-4-илэтокси)бензил]пентановой кислоты (1,01 г, 2,05 ммоль) и по методу,описанному в примере 1, выделяли 190 мг гидроксиамида 2-(4-метоксибензолсульфонил)-2[4-(2-морфолин-4-илэтокси)бензил]пентановой кислоты в виде коричневого твердого продукта. Выход 18%. Т.пл. 101 С. МС: 507,4 42 Этиловый эфир 2-(4-метоксифенилсульфанил)октановой кислоты получали в соответствии с общим методом, описанным в примере 9, исходя из этил 2-бромоктаноата (11,8 г, 47,3 ммоль) и 4-метокситиофенола (6 г, 43 ммоль). Выход: 7,24 г (57%); чистое масло. МС: 311,2 (М+Н)+. Этиловый эфир 2-(4-метоксибензолсульфонил)октановой кислоты получали в соответствии с общим методом, описанным в примере 9, исходя из этилового эфира 2-(4-метоксифенилсульфанил)октановой кислоты (4,0 г, 13,6 ммоль). Выход 3,7 г (83%); чистое масло. МС: 343,3 (М+Н)+. По методу, описанному в примере 12, получали этиловый эфир 2-[4-(2-азепан-1-илэтокси)бензил]-2-(4-метоксибензолсульфонил)октановой кислоты, исходя из (1,69 г, 5,18 ммоль) этилового эфира 2-(4-метоксибензолсульфонил) октановой кислоты и 1-[2-(4-хлорметилфенокси)этил]азепана (1,73 г, 6,0 ммоль). Выход 4,86 г, 99%. Коричневое масло. МС: 574,5 (М+Н)+. Исходя из этилового эфира 2-[4-(2-азепан 1-илэтокси)-бензил]-2-(4-метоксибензолсульфонил)октановой кислоты (4,8 г, 8,37 ммоль),выделяли 1,55 г (выход: 34%) 2-[4-(2-азепан-1 илэтокси)бензил]-2-(4-метоксибензолсульфонил)октановой кислоты в виде бесцветного полутвердого продукта по методу, описанному в примере 9. МС: 551 (М+Н)+. Исходя из 2-[4-(2-азепан-1-илэтокси)бензил]-2-(4-метоксибензолсульфонил)октановой кислоты (1,09 г, 2,0 ммоль) и по методу, описанному в примере 1, выделяли 300 мг гидроксиамида 2-[4-(2-азепан-1-илэтокси)бензил]-2(4-метоксибензолсульфонил)октановой кислоты в виде желтого твердого продукта. Выход 27%. Т.пл. 65 С. МС: 561,6 (М+Н)+. 1 Н ЯМР (300 МГц, DMCO-d6):0,81 (т, J=6,6 Гц, 3H), 1,08-1,82 (м, 14 Н) , 3,13-3,51 (м, 12 Н),3,87 (с, 3H), 4,33 (т, 2 Н), 6,88 (д, J=8,7 Гц, 2 Н),7,14 (м, 4 Н), 7,7 (д, J=9 Гц, 2H), 9,06 (с, 1 Н),10,28 (с, 1 Н). Пример 37. Гидроксиамид 2-(4-метоксибензолсульфанил)октановой кислоты. Этиловый эфир 2-(4-метоксифенилсульфанил)октановой кислоты получали в соответствии с общим методом, описанным в примере 9, исходя из этил 2-бромоктаноата (11,8 г, 47,3 ммоль) и 4-метокситиофенола (6 г, 43 ммоль). Выход: 7,24 г (57%); чистое масло. МС: 311,2(М+Н)+. Исходя из этилового эфира 2-(4 метоксибензолсульфанил)октановой кислоты(3,1 г, 10 ммоль), выделяли 2,55 г (выход: 90%) 2-(4-метоксибензолсульфанил)октановой кислоты в виде бесцветного полутвердого продукта по методу, описанному в примере 9. МС: 283(М+Н)+. Исходя из 2-(4-метоксибензолсульфанил) октановой кислоты (4,25 г, 16 ммоль) и по мето 43 ду, описанному в примере 1, выделяли 3,64 г гидроксиамида 2-(4-метоксибензолсульфанил) октановой кислоты в виде бесцветного твердого продукта. Выход: 76%. Т.пл. 90 С. МС: 298,2(М+Н)+. Пример 38. Гидроксиамид 2-(4-фторфенилсульфанил)октановой кислоты. Этиловый эфир 2-(4-фторфенилсульфанил) октановой кислоты получали в соответствии с общим методом, описанным в примере 9, исходя из этил 2-бромоктаноата (6,47 г, 24,7 ммоль) и 4-фтортиофенола (3 г, 23,4 ммоль). Выход: 6,31 г (90%); чистое масло. МС: 299 (М+Н)+. Исходя из этилового эфира 2-(4-фторбензолсульфанил)октановой кислоты (3,1 г, 10 ммоль) выделяли 2,89 г (выход: 100%) 2-(4 фторбензолсульфанил)октановой кислоты в виде бесцветного полутвердого продукта по методу, описанному в примере 9. МС: 268,9 (М+Н)+. Исходя из 2-(4-фторбензолсульфанил)октановой кислоты (2,49 г, 9,2 ммоль) и по методу,описанному в примере 1, выделяли 2,72 г гидроксиамида 2-(4-фторбензолсульфанил)октановой кислоты в виде бесцветного твердого продукта. Выход: 99%. Т.пл. 58 С. МС: 284(М-Н). Пример 39. Гидроксиамид 2-(1-метил-1 Нимидазол-2-илсульфанил)октановой кислоты. Этиловый эфир 2-(1-метил-1 Н-имидазол-2 илсульфанил)октановой кислоты получали в соответствии с общим методом, описанным в примере 9, исходя из этил 2-бромоктаноата(М+Н)+. Исходя из этилового эфира 2-(1-метил-1 Нимидазол-2-илсульфанил)октановой кислоты(12 г, 42,2 ммоль), выделяли 10,2 г (выход: 95%) 2-(1-метил-1 Н-имидазол-2-илсульфанил)октановой кислоты в виде бесцветного твердого продукта по методу, описанному в примере 9. Т.пл.: 95 С. МС: 257,1 (М+Н)+. Исходя из 2-(1-метил-1 Н-имидазол-2-илсульфанил)октановой кислоты (7,84 г, 30,6 ммоль) и по методу, описанному в примере 1,2,77 г гидроксиамида 2-(1-метил-1 Н-имидазол 2-илсульфанилоктановой кислоты выделяли в виде бесцветного твердого продукта. Выход: 33%. Т.пл.: 125 С. МС: 272,2 44 Исходя из этилового эфира 2-(4-метоксибензолсульфонил)-3-нафталин-2-илпропионовой кислоты (3,7 г, 9 ммоль), выделяли 3,3 г(96%) 2-(4-метоксибензолсульфонил)-3-нафталин-2-илпропионовой кислоты в виде бесцветного масла по методу, описанному в примере 9. МС: 369,1 (М-Н)-. Исходя из 2-(4-метоксибензолсульфонил)3-нафталин-2-ил-пропионовой кислоты (2,2 г,5,9 ммоль) и по методу, описанному в примере 1,выделяли 820 мг(М+Н)+. 1 Н ЯМР (300 МГц, CDC13):3,32 (д,J=7,0 Гц, 1 Н), 3,69 (д, J=7,0 Гц, 1 Н), 3,82 (с, 3H),5,02 (с, 1 Н), 6,92-7,89 (м, 11 Н). Пример 41. Гидроксамид N-гидрокси-2-(4 метоксифенилметансульфонил)-2-метил-3-фенилпропионовая кислота. Смесь 4-метоксибензилмеркаптана (7,0 г,45 ммоль), этил 2-бромпропионата (8,2 г, 46 ммоль) и измельченный высушенный карбонат калия (10 г, 72 ммоль) в 150 мл ацетона нагревали с обратным холодильником в течение 18 ч. Смесь охлаждали, фильтровали и фильтрат концентрировали. Осадок обрабатывали в 150 мл метиленхлорида, промывали водой (150 мл),сушили над безводным сульфатом натрия и выпаривали с выходом 12 г (99%); бесцветная жидкость. МС: 255,1 (М+Н)+. Этот продукт использовали без последующей очистки. К охлажденному во льду (5 С) раствору этилового эфира 2-(4-метоксифенилметансульфанил)пропионовой кислоты (5,7 г, 21 ммоль) в 100 мл СН 2 Сl2 добавляли порциями (7,2 г, 40 ммоль) м-хлорпербензойную кислоту и смесь перемешивали в течение 1 ч. Реакционную смесь растворяли в гексане (500 мл) и перемешивали при 25 С в течение 30 мин при комнатной температуре. Смесь фильтровали, и органический слой обрабатывали насыщенным водным бисульфатом натрия (200 мл). Раствор гексана,содержащий продукт, промывали водой, сушили (Na2SO4) и концентрировали. Выход 5,5 г(91%); бесцветное масло. МС 287,1 (М+Н)+. По методу, описанному в примере 9, этиловый эфир 2-(4-метоксифенилметансульфонил)-2-метил-3-фенилпропионовой кислоты получали, исходя из этилового эфира 2-(4 метоксифенилметансульфонил)пропионовой кислоты (2 г, 7 ммоль) и бензилбромида (1,3 г,7,7 ммоль). Выход 3,0 г, 100%. Твердый продукт с низкой температурой плавления. МС: 377(М+Н)+. 2-(4-Метоксифенилметансульфонил)-2-метил-3-фенилпропионовую кислоту получали,исходя из этилового эфира 2-(4-метоксифенилметансульфонил)-2-метил-3-фенилпропионовой кислоты (3,5 г, 9,0 ммоль), растворенного в метаноле (50 мл) и 10 н. NaOH (30 мл). Получен 45 ную реакционную смесь получали, как описано в примере 9. Выход 930 мг, 31%. Бесцветный твердый продукт. Т.пл.: 106-108 С. МС: 347 (М-Н)+. Исходя из 2-(4-метоксифенилметансульфонил)-2-метил-3-фенилпропионовой кислоты(2,7 г, 7,0 ммоль) и по методу, описанному в примере 1, выделяли 266 мг гидроксамида Nгидрокси-2-(4-метоксифенилметансульфонил)2-метил-3-фенилпропионовой кислоты в виде бесцветного твердого продукта. Выход: 10%. Т.пл. 58-59 С. МС: 364,2(д, 2 Н), 7,19 (м, 2 Н), 7,29-7,33 (д, 4 Н), 9,24 (с,1 Н), 10,88 (с, 1 Н). Пример 42. Гидроксиамид 5-метил-2-(3 метилбут-2-енил)-2-(толуол-4-сульфонил)гекс 4-еновая кислота. Этиловый эфир 5-метил-2-(3-метилбут-2 енил)-2-(толуол-4-сульфонилгекс-4-еновой кислоты получали в соответствии с общим методом, описанным в примере 9, исходя из этил (п-толилсульфонил)ацетата (2,9 г, 10,9 ммоль) и 4-бром-2-метилбутена (3,42 г, 23 ммоль). Выход 4,6 г; желтовато-коричневое масло. МС: 379,2(М+Н)+. 5-метил-2-(3-метилбут-2-енил)-2-(толуол 4-сульфонил)-гекс-4-еновую кислоту получали в соответствии с общим методом, описанным в примере 9, исходя из этилового эфира 5-метил 2-(3-метилбут-2-енил)-2-(толуол-4-сульфонил) гекс-4-еновой кислоты (4,5 г, 11 ммоль), этанола(4,1 г, 11 ммоль) и по методу, описанному в примере 1, выделяли 1,07 г гидроксиамида 5 метил-2-(3-метилбут-2-енил)-2-(толуол-4-сульфонил)гекс-4-еновой кислоты в виде бесцветного твердого продукта. Выход: 30%. Т.пл. 108-110 С. МС: 366,2(получен из 3-меркапто-2-метилфурана) получали в соответствии с общим методом, описанным в примере 9, исходя из этилового эфира 2(2-метилфуран-3-илсульфанил) пропионовой кислоты (2,9 г, 11,9 ммоль), бензилбромида 46 2-Метил-2-(2-метилфуран-3-сульфонил)-3 фенилпропионовой кислоты получали в соответствии с общим методом, описанным в примере 9, исходя из этилового эфира 2-(2-метилфуран-3-илсульфанил)пропионовой кислоты(4,8 г, 14,3 ммоль), растворенного в этаноле (25 мл) и 10 н. гидроксида натрия (10 мл). Выход 3,7 г (84 %), белый твердый продукт. МС: 307,4 (М-Н). Исходя из 2-метил-2-(2-метилфуран-3 сульфонил)-3-фенилпропионовой кислоты (3,58 г, 12 ммоль) и по методу, описанному в примере 1, выделяли 1,078 г гидроксиамида 2-метил-2(2-метилфуран-3-сульфонил)-3-фенилпропионовой кислоты в виде оранжевого твердого продукта. Выход: 29%. Т.пл. 68-70 С. МС: 324(М+Н)+. 1 Н ЯМР (300 МГц, DMCO-d6):1,27 (с,3H), 2,81-2,86 (д, 1 Н), 3,33 (с, 3H), 3,61-3,66 (д,1 Н), 6,66 (с, 1 Н), 7,19-7,25 (м, 5 Н), 7,76 (с, 1 Н),9,09 (с, 1 Н), 10,81 (с, 1 Н). Пример 44. Гидроксамид 2-метил-2-(2 метилфуран-3-сульфонил)-3-[4-(2-пиперидин-1 илэтокси)фенил]пропионовой кислоты. Этиловый эфир 2-метил-2-(2-метилфуран 3-сульфонил)-3-[4-(2-пиперидинилэтокси)фенил] пропионовой кислоты получали в соответствии с общим методом, описанным в примере 9, исходя из этилового эфира 2-(2-метилфуран 3-сульфонил)пропионовой кислоты (2,4 г, 9,8 ммоль) и 1-[2-(4-хлорметилфенокси)этил]пиперидина (2,96 г, 10,7 ммоль). Выход 2,4 г (92%); янтарное масло. МС: 464,2 (М+Н)+. 2-Метил-2-(2-метилфуран-3-сульфонил)-3[4-(2-пиперидин-1-илэтокси)фенил]пропионовую кислоту получали в соответствии с общим методом, описанным в примере 1. Исходя из этилового эфира 2-метил-2-(2-метилфуран-3 сульфонил)-3-[4-(2-пиперидин-1-илэтокси)фенил]пропионовой кислоты (2,01 г, 4,5 ммоль),растворенного в этаноле (20 мл) и 10 н. гидроксида натрия (10 мл). Полученную смесь получали, как описано в примере 9. Выход 2,03 г; кристаллы янтарного цвета. Т.пл. 66-68 С. МС 434 (М-Н). Исходя из 2-метил-2-(2-метилфуран-3 сульфонил)-3-[4-(2-пиперидин-1-илэтокси)фенил]пропионовой кислоты (2,03 г, 6,0 ммоль) и по методу, описанному в примере 1, выделяли 1,36 г гидроксиамида 2-метил-2-(2-метилфуран 3-сульфонил)-3-(4-(2-пиперидин-1-илэтокси) фенил]пропионовой кислоты в виде янтарного твердого продукта. Выход: 32%. Т.пл. 115-117 С. МС: 451,1 47 Пример 45. Гидроксамид 2-метил-3-[4-(2 пиперидин-1-илэтокси)фенил-2-(тиофен-2 сульфонил)пропионовой кислоты. Этиловый эфир 2-метил-3-[4-(2-пиперидин-1-илэтокси)фенил-2-(тиофен-2-сульфонил) пропионовой кислоты получали в соответствии с общим методом, описанным в примере 9, исходя из этилового эфира 2-(тиофен-2 сульфонил)пропионовой кислоты (полученного из 2-меркаптотиофена и этилового эфира 2 бромпропионовой кислоты) (4,4 г, 17,7 ммоль) и 1-[2-(4-хлорметилфенокси)этил]пиперидина (5,3 г, 19,5 ммоль). Выход (96%); полутвердый продукт. МС 466. 2-Метил-3-[4-(2-пиперидин-1-илэтокси)фенил-2-(тиофен-2-сульфонил)пропионовой кислоты получали в соответствии с общим методом, описанным в примере 9, исходя из этилового эфира 2-метил-3-[4-(2-пиперидин-1-илэтокси)фенил-2-сульфонил)пропионовой кислоты (9,8 г, 20 ммоль), растворенного в этаноле(20 мл) и 10 н. гидроксиде натрия (20 мл). Полученную смесь обрабатывали, как описано в примере 1. Выход 4,5 г (49 %). Белый твердый продукт. Т.пл. 170-172 С. МС 436,3 (М-Н). Исходя из 2-метил-3-[4-(2-пиперидин-1 илэтокси)фенил-2-(тиофен-2-сульфонил)пропионовой кислоты (3,6 г, 8,0 ммоль) и по методу,описанному в примере 1, выделяли 345 мг гидроксиамида 2-метил-3-[4-(2-пиперидин-1-илэтокси)фенил-2-(тиофен-2-сульфонил)пропионовой кислоты в виде легкого бесцветного твердого продукта. Выход: 10%. Т.пл. 115-118 С. МС: 451,2(дд, 1 Н), 9,0 (с, 1 Н), 10,0 (с, 1 Н), 10,78 (с, 1 Н). Пример 46. Гидроксамид 2-(октан-1-сульфонил)-3-[4-(2-пиперидин-1-илэтокси)фенил] пропионовой кислоты. Этиловый эфир 2-(октан-1-сульфонил)-3[4-(2-пиперидин-1-илэтокси)фенил]пропионовой кислоты получали в соответствии с общим методом, описанным в примере 9, исходя из этилового эфира 2-(октан-1-сульфонил)пропионовой кислоты (5,0 г, 18 ммоль) и 1-(2-(4 хлорметилфенокси)этил пиперидина (5,6 г, 19,7 ммоль). Выход 8,9 г (96%); янтарное масло, МС: 495. 2-(Октан-1-сульфонил)-3-[4-(2-пиперидинилэтокси)фенил]пропионовой кислоты получали в соответствии с общим методом, описанным в примере 9, исходя из этилового эфира 2(октан-1-сульфонил)-3-[4-(2-пиперидинилэтокси)фенил]пропионовой кислоты (8,9 г, 18 ммоль), этанола (25 мл) и 10 н. гидроксида натрия (25 мл). Выход 6,0 г (72 %).(с, 3H), 3,65-3,69 (д, 1 Н), 6,86-6,89 (д, 2 Н), 7,087,11 (д, 2 Н), 9,16 (с, 1 Н), 10,70 (с, 1 Н). Пример 47. Гидроксиамид 3-бифенил-4-ил 2-метил-2-(1-метил-1 Н-имидазол-2-сульфонил)пропионовой кислоты. Этиловый эфир 3-бифенил-4-ил-2-метил-2(1-метил-1 Н-имидазол-2-сульфонил)пропионовой кислоты получали в соответствии с общим методом, описанным в примере 9, исходя из этилового эфира 2-метил-2-(1-метил-1 Н-имидазолсульфонил)пропионовой кислоты (получали из 1-метил-2-меркаптоимидазола и 2-бромэтилпропионата) (3,0 г, 12,2 ммоль) и 4-хлорметилбифенила (2,97 г, 15 ммоль). Выход 5,0 г (99%); твердый продукт с низкой температурой плавления. МС: 413 (М+Н)+. 3-Бифенил-4-ил-2-метил-2-(1-метил-1 Нимидазол-2-сульфонил)пропионовой кислоты получали в соответствии с общим методом,описанным в примере 9, исходя из этилового эфира 3-бифенил-4-ил-2-метил-2-(1-метил-1 Нимидазол-2-сульфонил)пропионовой кислоты(с, 3H), 3,3 (с, 3H), 3,5 (д, 1 Н), 4,2 (д, 1 Н), 6,8 (д,1 Н), 6,9 (д, 1 Н), 7,18-7,66 (м, 5 Н), 7,30-7,33 (д,2 Н), 7,55-7,58 (д, 2 Н). Пример 48. Гидроксамид 2-метил-3-фенил 2-(тиофен-2-сульфонил)пропионовой кислоты. Этиловый эфир 2-метил-3-фенил-2-(тиофен-2-сульфонил)пропионовой кислоты получали в соответствии с общим методом описанным в примере 9, исходя из этилового эфира 2(тиофен-2-сульфонил)пропионовой кислоты (3,0 г, 12 ммоль) и бензилбромида (2,48 г, 15 ммоль). Выход 5,2 г (%); желтовато-коричневое масло. МС: 339,1 (М+Н)+. 2-Метил-3-фенил-2-(тиофен-2-сульфонил) пропионовую кислоту получали в соответствии с общим методом, описанным в примере 9, ис 49 ходя из этилового эфира 2-метил-3-фенил-2(тиофен-2-сульфонил)пропионовой кислоты (5,0 г, 15 ммоль), этанола (30 мл) и 10 н. гидроксида натрия (10 мл). Выход 5,6 г. МС: 310,0 (М+Н)+. Исходя из 2-метил-3-фенил-2-(тиофен-2 сульфонил)пропионовой кислоты (5,0 г, 16 ммоль) и по методу, описанному в примере 1,выделяли 1,8 г гидроксиамида 2-метил-3-фенил 2-(тиофен-2-сульфонил)пропионовой кислоты в виде бесцветного твердого продукта. Выход: 40%. Т.пл. 116-117 С. МС: 325,9(М+Н)+. 1 Н ЯМР (300 МГц, DMCO-d6): 5 1,29 (с,3H), 3,33 (д, 1 Н), 3,69 (д, 1 Н), 7,18-7,30 (м, 5 Н),7,74 (м, 1 Н), 8,22 (м, 1 Н), 9,13 (с, 1 Н), 10,80 (с,1 Н). Пример 49. Гидроксиамид 2-[8-(1-карбоксиэтансульфонил)октан-1-сульфонил]пропионовой кислоты. Смесь трет-бутилового эфира 2-(4-метоксибензолсульфонил)-2-пиридин-3-илметилдец-4-иновой кислоты (2,60 г, 5,35 ммоль) в метиленхлориде/ТФА (1:1) перемешивали при комнатной температуре в течение 2 ч (ссыл. пример 70). Растворитель упаривали и 2-(4 метоксибензолсульфонил)-2-пиридин-3-илметилдец-4-иновую кислоту очищали хроматографией на колонке с силикагелем (30% метанол/метиленхлорид). Выход: 2,0 г, 87%. Белый твердый продукт. Т.пл. 146 С. МС: 428,1 (М-Н)-. Гидроксиамид 2-(4-метоксибензолсульфонил)-2-пиридин-3-илметилдец-4-иновой кислоты получали в соответствии со способом, описанным в примере 1. Исходя из 2-(4-метоксибензолсульфонил)-2-пиридин-3-илметилдец-4 иновой кислоты (0,71 г, 1,62 ммоль) и гидрохлорида гидроксиламина (1,39 г, 20 ммоль), выделяли 0,48 г продукта. Выход 67%. Не совсем белый твердый продукт. Т.пл. 65 С. МС: 445,0 (М+Н)+. 1 Н ЯМР(300 МГц, ДМСО-d6)0,84 (т, J=6,8 Гц, 3H),1,10-1,40 (м, 6 Н), 1,85-2,00 (м, 2 Н), 2,79 (д,J=17,9 Гц, 1 Н) , 2,90 (д, J=17,9 Гц, 1 Н), 3,50 (д,J=13,7 Гц, 1 Н), 3,74 (д, J=13,7 Гц, 1 Н), 3,89 (с,3H), 7,19 (д, J=9,0 Гц, 2 Н), 7,76 (д, J=9,0 Гц, 2 Н),7,85-7,89 (м, 1 Н), 8,37-8,40 (м, 1 Н), 8,70-8,80 (м,2 Н), 11,0 (ушир. с, 1 Н); ИК (КВr, см-1): 3157 м,3095 м, 2954 с, 2932 с, 2858 м, 1671 м, 1593 с. Анализ для С 23 Н 28N2O5SHCl0,9 Н 2O: Высчитано: С 55,56; Н 6,24; N 5,63. Найдено: С 55,84; Н 6,19; N 5,59. Пример 50. Гидроксиамид 2-(4-метоксибензолсульфонил)-2-пиридин-3-илметилпент-4 иновой кислоты. Трет-бутиловый эфир 2-(4-метоксибензолсульфонил)-2-пиридин-3-илметилпент-4-иновой кислоты получали в соответствии со способом,описанным в примере 38. Исходя из третбутилового эфира 2-(4-метоксибензолсульфонил)-2-пиридин-3-илпропионовой кислоты (3,77 г, 10 ммоль) и пропаргилбромида (1,74 г, 13(М+Н)+. Пример 51. 3-(4-Бромфенил)-N-гидрокси 2-(4-метоксибензолсульфонил)-2-метилпропионамид. По методу, описанному в примере 9, этиловый эфир 3-(4-бромфенил)-2-(4-метоксибензолсульфонил)-2-метилпропионовой кислоты получали, исходя из (3,0 г, 11 ммоль) этилового эфира 2-(4-метоксибензолсульфонил)пропионовой кислоты и 4-бромбензилбромида (3,0 г,12 ммоль). Выход 4,67 г, 96%. Бесцветное масло. МС: 441 (М+Н)+. 3-(4-Бромфенил)-2-(4-метоксибензолсульфонил)-2-метилпропионовой кислоты получали,исходя из этилового эфира 3-(4-бромфенил)-2(4-метоксибензолсульфонил)-2-метилпропионовой кислоты (4,0 г, 9,0 ммоль), растворенного в метаноле (50 мл) и 10 н. NaOH (30 мл). Полученную реакционную смесь обрабатывали, как описано в примере 9. Выход 3,0 г, 78%. Твердый продукт с низкой температурой плавления. МС: 413 (М+Н)+. Исходя из 3-(4-бромфенил)-2-(4-метоксибензолсульфонил)-2-метилпропионовой кислоты (2,7 г, 6,5 ммоль) и по методу, описанному в примере 1, выделяли 2,26 г 3-(4-бромфенил)-Nгидрокси-2-(4-метоксибензолсульфонил)-2 метилпропионамид в виде легкого бесцветного твердого продукта. Выход: 81%. Т.пл. 86-88 С. МС: 429,8(М+Н)+. 1 Н ЯМР (300 МГц, CDCl3):1,42 (с,3H), 1,77 (ушир.с, 1 Н), 3,26 (д, J=7,0 Гц, 1 Н),3,68 (д, J=7,0 Гц, 1 Н), 3,85 (с, 3H), 7,01-7,76 (м,8 Н), 9,71-9,88 (ушир. с, 1 Н). Пример 52. N-Гидрокси-2-(4-метоксибензолсульфонил)-2-метил-3-нафталин-2-илпропионамид. По методу, описанному в примере 9, получали этиловый эфир 2-(4-метоксибензолсульфонил)-2-метил-3-нафталин-2-илпропионовой кислоты, исходя из (5,4 г, 20 ммоль) этилового эфира 2-(4-метоксибензолсульфонил)пропионовой кислоты и 2-бромметилнафталина (4,4 г,20 ммоль). Выход 8,0 г, 97%. Бесцветные кристаллы. Т.пл. 182-184 С. МС: 413 (М+Н)+. 51 Исходя из этилового эфира 2-(4-метоксибензолсульфонил)-2-метил-3-нафталин-2 илпропионовой кислоты (4,6 г, 11 ммоль), выделяли 4,2 г (98%) 2-(4-метоксибензолсульфонил)-2-метил-3-нафталин-2-илпропионовой кислоты в виде бесцветных кристаллов по методу, описанному в примере 9. Т.пл. 144-146 С. МС: 384,9 (М+Н)+. Исходя из 2-(4-метоксибензолсульфонил)2-метил-3-нафталин-2-илпропионовой кислоты(2,4 г, 6,2 ммоль) и следуя методу, описанному в примере 1, выделяли 1,6 г N-гидрокси-2-(4 метоксибензолсульфонил)-2-метил-3-нафталин 2-илпропионамида в виде легкого бесцветного твердого продукта. Выход: 64%. Т.пл. 185-187 С. МС: 400,2(М+Н)+. 1 Н ЯМР (300 МГц, CDCl3):1,56 (с,3H), 3,28 (д, J=8,0 Гц, 1 Н) , 3,81 (д, J=8 Гц, 1 Н),3,93 (с, 3H), 4,88 (ушир. с, 1 Н), 7,02-7,92 (м,11 Н) . Пример 53. N-Гидрокси-2-(4-метоксибензолсульфонил)-3-метилбутирамид. Этиловый эфир 2-(4-метоксифенилсульфанил)-3-метилбутановой кислоты получали в соответствии с общим способом, описанным в примере 1. Исходя из этил 2-бром-3-метилбутаноата (20,9 г, 100 ммоль) и 4-метоксибензолтиола (14,0 г, 100 ммоль), выделяли 30 г этилового эфира 2-(4-метоксифенилсульфанил)-3-метилбутановой кислоты. Выход 99%. Светло-желтое масло. МС: 269 (М+Н)+. Исходя из этилового эфира 2-(4 метоксифенилсульфанил)-3-метилбутановой кислоты (2,68 г 10 ммоль) и следуя методу окисления, описанному в примере 9, выделяли 3 г этилового эфира 2-(4-метоксибензолсульфонил)-3-метилбутановой кислоты в виде бесцветного твердого продукта. Выход: 99%. Т.пл. 53 С. МС: 273 (М+Н)+. Исходя из этилового эфира 2-(4-метоксибензолсульфонил)-3-метилбутановой кислоты (3 г, 10 ммоль), выделяли 2,7 г (96%) 2-(4 метоксибензолсульфонил)-3-метилбутановой кислоты в виде бесцветного твердого продукта следуя методу, описанному в примере 9. Т.пл. 96 С. МС: 273 (М+Н)+. Исходя из 2-(4-метоксибензолсульфонил)3-метилбутановой кислоты (2,0 г, 7,34 ммоль) и следуя методу, описанному в примере 9, выделяли 590 мг N-гидрокси-2-(4-метоксибензолсульфонил)-3-метилбутирамид в виде бесцветного твердого продукта. Т.пл. 220 С. Выход 28%. МС: 288 (М+Н)+. 1H ЯМР (300 МГц, ДМСО-d6):0,88 (д, J=6,7 Гц, 3H), 1,07 (д,J=6,7 Гц, 3H), 2,09-2,20 (ушир. с, 1 Н), 3,53 (д,J=9, 1H), 7,12-7,17 (м, 2 Н), 7,74-7,79 (м, 2 Н). Пример 54. Гидроксиамид 1-(4-метоксибензолсульфонил)циклопентанкарбоновой кислоты. Следуя методу, описанному в примере 9,этиловый эфир 1-(4-метоксибензолсульфонил) 52 циклопентанкарбоновой кислоты получали, исходя из (3,0 г, 11,6 ммоль) этилового эфира 2-(4 метоксибензолсульфонил) уксусной кислоты и 1,4-дибромбутана (2,4 г, 7,6 ммоль). Выход 2,4 г, 78%. Бесцветный твердый продукт. Т.пл. 86-88 С. МС: 313 (М+Н)+. 1-(4-Метоксибензолсульфонил)циклопентанкарбоновой кислоты получали, исходя из этилового эфира 1-(4-метоксибензолсульфонил) циклопентанкарбоновой кислоты (2,2 г, 7,0 ммоль), растворенного в метаноле (50 мл) и 10 н.NaOH (30 мл). Полученную реакционную смесь обрабатывали, как описано в примере 9. Выход 1,66 г, 83%. Бесцветный твердый продукт. Т.пл. 112-115 С. МС: 285 (М+Н)+. Исходя из 1- (4-метоксибензолсульфонил) циклопентанкарбоновой кислоты (442 мг, 1,5 ммоль) и следуя методу, описанному в примере 1, выделяли 410 мг гидроксиамида 1-(4 метоксибензолсульфонил)циклопентанкарбоновой кислоты в виде бесцветного твердого продукта. Т.пл. 89-91 С. Выход 88%. МС: 300 (М+Н)+. 1 Н ЯМР (300 МГц, CDCl3):1,65-1,82 (м, 4 Н), 2,17-2,42 (м,4 Н), 3,87 (с, 3H), 7,0 (д, J=8 Гц, 2H), 7,7 (ушир. с, 1 Н), 7,72 (д, J=8 Гц, 2 Н), 9,73 (ушир. с, 1 Н). Пример 55. 3-(2-Бромфенил)-N-гидрокси 2-(4-метоксибензолсульфонил)-2-метилпропионамид. Следуя методу, описанному в примере 9,этиловый эфир 3-(2-бромфенил)-2-(4-метоксибензолсульфонил)-2-метилпропионовой кислоты получали, исходя из (2,0 г, 7,3 ммоль) этилового эфира 2-(4-метоксибензолсульфонил) пропионовой кислоты и 2-(бром) бензилбромида(2,0 г, 8 ммоль). Выход 3,1 г, 87%. Бесцветное масло. МС: 441 (М+Н)+. 3-(2-Бромфенил)-2-(4-метоксибензолсульфонил)-2-метилпропионовой кислоты получали,исходя из этилового эфира 3-(2-бромфенил)-2(4-метоксибензолсульфонил)-2-метилпропионовой кислоты (3,0 г, 68 ммоль), растворенного в метаноле (50 мл) и 10 н. NaOH (30 мл). Полученную результирующую смесь обрабатывали,как описано в примере 9. Выход 1,7 г, 63%. Твердый продукт в виде воска. МС: 414 (М+Н)+. Исходя из 3-(2-бромфенил)-2-(4-метоксибензолсульфонил)-2-метилпропионовой кислоты (470 мг, 1,1 ммоль) и следуя методу, описанному в примере 9, выделяли 380 мг 3-(2 бромфенил)-N-гидрокси-2-(4-метоксибензолсульфонил)-2-метилпропионамида в виде бесцветного твердого продукта. Т.пл. 93-96 С. Выход 77%. МС: 429 53 Следуя методу, описанному в примере 9,получали этиловый эфир 2-(4-метоксибензолсульфонил)-2-метил-5-фенилпент-4-еновой кислоты, исходя из (3,0 г, 11 ммоль) этилового эфира 2-(4-метоксибензолсульфонил)пропионовой кислоты и циннамилбромида (2,1 г, 11 ммоль). Выход 3,51 г, 82%. Бесцветное масло. МС: 389 (М+Н)+. 2-(4-Метоксибензолсульфонил)-2-метил-5 фенилпент-4-еновой кислоты получали, исходя из этилового эфира 2-(4-метоксибензолсульфонил)-2-метил-5-фенилпент-4-еновой кислоты(3,0 г, 11 ммоль), растворенного в метаноле (50 мл) и 10 н. NaOH (30 мл). Полученную реакционную смесь обрабатывали, как описано в примере 9. Выход 1,9 г, 68%. Желтоватое масло. МС: 361 (М+Н)+. Исходя из 2-(4-метоксибензолсульфонил)2-метил-5-фенилпент-4-еновой кислоты (440 мг,1,2 ммоль) и следуя методу, описанному в примере 1, 420 мг гидроксиамида 2-(4-метоксибензолсульфонил)-2-метил-5-фенилпент-4 еновой кислоты выделяли в виде бесцветного твердого продукта. Т.пл. 162-164 С. Выход 92%. МС: 376 (М+Н)+. 1 Н ЯМР (300 МГц, CDCl3):1,41 (с, 3H), 3,0-3,16 (м, 1 Н),3,30 (д, J=ll Гц, 2 Н), 3,92 (с, 3H), 5,9-6,1 (м, 1 Н),6,53 (д, J=11 Гц, 1 Н), 7,1-7,72 (м, 9 Н), 9,12(ушир. с, 1 Н). Пример 57. Гидроксиамид 2-(4-метоксибензолсульфонил)-5-фенил-2-(3-фенилпропил) пентановой кислоты. Следуя методу, описанному в примере 9,получали этиловый эфир 2-(4-метоксибензолсульфонил)-5-фенил-2-(3-фенилпропил)пентановой кислоты, исходя из (4,0 г, 15,8 ммоль) этилового эфира 2-(4-метоксибензолсульфонил) уксусной кислоты и 3-бромпропилбензола (6,4 г, 32 ммоль). Выход 3,7 г, 47%. Бесцветное масло. МС: 495 (М+Н)+. 2-(4-Метоксибензолсульфонил)-5-фенил-2(3-фенилпропил)пентановой кислоты получали,исходя из этилового эфира 2-(4-метоксибензолсульфонил)-5-фенил-2-(3-фенилпропил)пентановой кислоты (2,0 г, 4 ммоль), растворенного в метаноле (50 мл) и 10 н. NaOH (30 мл). Полученную реакционную смесь обрабатывали, как описано в примере 9. Выход 1,18 г, 63%. Твердый продукт в виде воска. МС: 449,2 (М+Н)+. Исходя из 2-(4-метоксибензолсульфонил)5-фенил-2-(3-фенилпропил)пентановой кислоты(600 мг, 1,2 ммоль) и следуя методу, описанному в примере 1, выделяли 420 мг гидроксиамида 2-(4-метоксибензолсульфонил)-5-фенил-2-(3 фенилпропил)-пентановой кислоты в виде бесцветного твердого продукта. Т.пл. 118-120 С. Выход 68%. МС: 482 (М+Н)+. 1 Н ЯМР (300 МГц, CDCl3):1,52-1,68 (м, 2 Н), 1,74-1,92 (м,2 Н) , 1,98-2,20 (м, 4 Н), 2,58-2,72 (м, 4 Н) , 3,86 (с, 003836(д, J=11 Гц, 2 Н). Пример 58. Гидроксиамид 2-аллил-2-(4 метоксибензолсульфонил)пент-4-еновой кислоты. Следуя методу, описанному в примере 9,этиловый эфир 2-аллил-2-(4-метоксибензолсульфонил)пент-4-еновой кислоты получали,исходя из (3,0 г, 11,6 ммоль) этилового эфира 2(4-метоксибензолсульфонил)уксусной кислоты и аллилбромида (4 мл, избыток). Выход 3,6 г,92%. Желтое масло. МС: 338 (М+Н)+. 2-Аллил-2-(4-метоксибензолсульфонил) пент-4-еновую кислоту получали, исходя из этилового эфира 2-аллил-2-(4-метоксибензолсульфонил)пент-4-еновой кислоты (2,2 г, 6,5 ммоль), растворенного в метаноле (50 мл) и 10 н.NaOH (30 мл). Полученную реакционную смесь обрабатывали, как описано в примере 9. Выход 1,76 г, 87%; желтоватое масло. МС: 311 (М+Н)+. Исходя из 2-аллил-2-(4-метоксибензолсульфонил)пент-4-еновой кислоты (1,5 г, 4,8 ммоль) и следуя методу, описанному в примере 1, выделяли 1,5 г гидроксиамида 2-аллил-2-(4 метоксибензолсульфонил)пент-4-еновой кислоты в виде бесцветного твердого продукта. Т.пл. 114-116 С. Выход 99%. МС: 326 (М+Н)+. 1 Н ЯМР (300 МГц, CDCl3):1,62 (с, 1 Н), 2,70-2,80 (м, 4 Н),3,9 (с, 3H), 5,16-5,27 (м, 4 Н), 5,81-5,94 (м, 2 Н),7,12 (д, J=8 Гц, 2 Н). Пример 59. Гидроксиамид 2-(4-метоксибензолсульфонил)-2-пропилпентановой кислоты. Гидроксиамид 2-аллил-2-(4-метоксибензолсульфонил)пент-4-еновой кислоты (326 мг,1,0 ммоль) (пример 26) растворяли в метаноле(50 мл) и гидрировали над 10% Pd/C (100 мг) при комнатной температуре, под давлением 337,84 Па (49 фунт на квадратный дюйм) в течение 4 ч. В конце реакционную смесь фильтровали и удаляли метанол. Полученный твердый продукт перекристаллизовывали из метанола. Выход: 250 мг, 75%. МС: 330 (М+Н)+. 1 Н ЯМР (300 МГц, CDCl3):0,92 (т, J=4,0 Гц, 6 Н), 1,27-1,59 (м, 4 Н), 1,78-2,02 (м, 4 Н), 3,86(с, 3H), 6,04 (ушир. с, 1 Н), 6,97 (д, J=9 Гц, 2 Н),7,76 (д, J=9 Гц, 2 Н). Пример 60. 2-Бензил-N-гидрокси-2-(4-метоксибензолсульфонил)-3-фенилпропионамид. Следуя методу, описанному в примере 9,исходя из (1,0 г, 3,8 ммоль) этилового эфира 2(4-метоксибензолсульфонил)уксусной кислоты и бензилбромида (4 мл, избыток), получали этиловый эфир 2-бензил-2-(4-метоксибензолсульфонил)-3-фенилпропионовой кислоты. Выход 1,2 г, 72%. Желтое масло. МС: 439 55 из этилового эфира 2-бензил-2-(4-метоксибензолсульфонил)-3-фенилпропионовой кислоты (1,0 г, 2,2 ммоль), растворенного в метаноле(50 мл) и 10 н. NaOH (30 мл). Полученную реакционную смесь обрабатывали, как описано в примере 9. Выход: 580 мг, 62%. Твердый продукт в виде воска. МС: 409 (М-Н)-. Исходя из 2-бензил-2-(4-метоксибензолсульфонил)-3-фенилпропионовой кислоты (410 мг, 1 ммоль) и следуя методу, описанному в примере 1, выделяли 225 мг 2-бензил-Nгидрокси-2-(4-метоксибензолсульфонил)-3-фенилпропионамид в виде воскообразного твердого продукта. Выход 52%. МС: 426 (М+Н)+. lH ЯМР (300 МГц, CDCl3):3,25 (д, J=14 Гц, 2 Н), 3,52 (д,J=14 Гц, 2 Н), 3,9 (с, 3H), 6,93 (д, J=8 Гц, 2 Н),7,02-7,26 (м, 9 Н), 7,61 (д, J=8 Гц, 2 Н), 7,87 (д,J=4 Гц, 1 Н), 9,58 (ушир. с, 1 Н). Пример 61. N-Гидрокси-2-(4-метоксибензолсульфонил)-2-метил-3-пиридин-3-илпропионамид. К раствору этилового эфира 2-(4-метоксибензолсульфонил)пропионовой кислоты (2,7 г, 10 ммоль), гидрохлорида 3-пиколилхлорида(3,2 г, 20 ммоль) и хлорида триэтилбензиламмония (1 г) в метиленхлориде (400 мл), при перемешивании добавляли 10 н. NaOH (30 мл). Реакция продолжалась при комнатной температуре в течение 48 ч. В конце органический слой отделяли и тщательно промывали водой. Органический слой сушили, фильтровали и концентрировали. Полученный сырой продукт очищали хроматографией на колонке с силикагелем. Колонку элюировали 50% этилацетатом:гексаном. Этиловый эфир 2-(4-метоксибензолсульфонил)2-метил-3-пиридин-3-илпропионовой кислоты выделяли в виде коричневого масла. Выход 3,0 г, 82%. Коричневое масло. МС: 364 (М+Н)+. Исходя из этилового эфира 2-(4-метоксибензолсульфонил)-2-метил-3-пиридин-3-илпропионовой кислоты (2,5 г, 6,8 ммоль), выделяли 1,8 г (79%) 2-(4-метоксибензолсульфонил)-2 метил-3-пиридин-3-илпропионовой кислоты в виде бесцветного твердого продукта, следуя методу, описанному в примере 9. Т.пл. 58 С. МС: 336 (М+Н)+. Исходя из 2-(4-метоксибензолсульфонил)2-метил-3-пиридин-3-илпропионовой кислоты(410 мг, 1 ммоль) и следуя методу, описанному в примере 1, выделяли 225 мг N-гидрокси-2-(4 метоксибензолсульфонил)-2-метил-3-пиридин 3-илпропионамида в виде бесцветного твердого продукта. Выход 52%. Т.пл. 98 С. МС: 351 (М+Н)+. 1 Н ЯМР (300 МГц, CDCl3):1,4 (с, 3H), 3,1 (д,J=9,0, 1H), 3,65 (д, J=9,l, 1H), 3,9 (с, 3H), 7-8,5 56 Исходя из этилового эфира 2-(4-метоксибензолсульфонил)уксусной кислоты (7,5 г, 29 ммоль) и 1-бромоктана (6,7 г, 35 ммоль), выделяли 8 г монооктилированного производного этилового эфира 2-(4-метоксибензолсульфонил) декановой кислоты в соответствии с методом,описанным в примере 9. Выход: 8,0 г 74%. МС: 370 (М+Н)+. Следуя методу, описанному в примере 29,этиловый эфир 2-(4-метоксибензолсульфонил)2-пиридин-3-илметилдекановой кислоты получали, исходя из (8,0 г, 21,6 ммоль) этилового эфира 2-(4-метоксибензолсульфонил)декановой кислоты и гидрохлорида 3-пиколилхлорида (4,1 г, 25 ммоль). Выход 6,5 г, 68%. Коричневое масло. МС: 462 (М+Н)+. Исходя из этилового эфира 2-(4-метоксибензолсульфонил)-2-пиридин-3-илметилдекановой кислоты (5,0 г, 11 ммоль), выделяли 4,5 г (91%) 2-(4-метоксибензолсульфонил)-2-пиридин-3-илметилдекановой кислоты в виде бесцветного твердого продукта, следуя методу,описанному в примере 9. Т.пл. 159 С. МС: 434(М+Н)+. Исходя из 2-(4-метоксибензолсульфонил)2-пиридин-3-илметилдекановой кислоты (2,5 г,5,7 ммоль) и следуя методу, описанному в примере 1, выделяли 1,4 г гидроксиамида 2-(4 метоксибензолсульфонил)-2-пиридин-3-илметилдекановой кислоты в виде бесцветного твердого продукта. Выход: 50%. Т.пл. 62 С. МС: 448 (М+Н)+. 1 Н ЯМР (300 МГц, CDCl3):0,86 (т, 6,9 Гц, 3H),1,25-2,17 (м, 14 Н), 3,3 (д, J=14 Гц, 1 Н), 3,5 (д,J=14 Гц, 1 Н), 3,9 (с, 3H), 6,8-8,6 (м, 8 Н). Пример 63. Гидроксиамид 2-(4-метоксибензолсульфонил)-5-метил-2-пиридин-3-илметилгекс-4-еновой кислоты. Следуя методу, описанному в примере 9,получали этиловый эфир 2-(4-метоксибензолсульфонил)-5-метилгекс-4-еновой кислоты, исходя из (6,0 г, 23 ммоль) этилового эфира 2-(4 метоксибензолсульфонил)уксусной кислоты и бромида изопренила (3,0 г, 20 ммоль). Выход 6,52 г, 86%. Бесцветное масло. МС: 327 (М+Н)+. Следуя методу, описанному в примере 29,получали этиловый эфир 2-(4-метоксибензолсульфонил)-5-метил-2-пиридин-3-илметилгекс 4-еновой кислоты, исходя из (4,0 г, 12,2/ммоль) этилового эфира 2-(4-метоксибензолсульфонил)-5-метилгекс-4-еновой кислоты и гидрохлорида 3-пиколилхлорида (2,1 г, 13 ммоль). Выход 4,14 г, 81%. Коричневое масло. МС: 418(М+Н)+. 2-(4-Метоксибензолсульфонил)-5-метил-2 пиридин-3-илметил-гекс-4-еновой кислоты получали, исходя из этилового эфира 2-(4 метоксибензолсульфонил)-5-метил-2-пиридин 3-илметилгекс-4-еновой кислоты (4,0 г, 9,5 ммоль), растворенного в метаноле (50 мл) и 10 н.NaOH (30 мл). Полученную реакционную смесь обрабатывали, как описано в примере 9. Выход 3,2 г, 87%. Твердый продукт цвета слоновой кости. Т.пл. 117-119 С. МС: 390 (М+Н)+. Исходя из 2-(4-метоксибензолсульфонил)5-метил-2-пиридин-3-илметилгекс-4-еновой кислоты (2,1 г, 5,4 ммоль) и следуя методу, описанному в примере 1, выделяли 1,82 г гидроксиамида 2-(4-метоксибензолсульфонил)-5-метил-2-пиридин-3-илметилгекс-4-еновой кислоты в виде бесцветного твердого продукта. Выход: 82%. Т.пл. 89-92 С. МС: 405 (М+Н)+. 1 Н ЯМР (300 МГц, CDCl3):1,63 (с, 3H),1,76 (с, 3H), 2,62-2,78 (м, 2 Н), 3,3 (д, J=4,0 Гц,1 Н), 3,63 (д, J=4,0 Гц, 1 Н), 3,82 (с, 3H), 5,26 (м,1 Н), 7,12-7,88 (м, 6 Н), 8,27-8,33 (м, 2 Н). Пример 64. 2-Бензил-4-диизопропиламино-N-гидрокси-2-(4-метоксибензолсульфонил)бутирамид. Следуя методу, описанному в примере 29,получали этиловый эфир 2-бензил-4-диизопропиламино-2-(4-метоксибензолсульфонил) бутановой кислоты, исходя из (3,0 г, 8,5 ммоль) этилового эфира 2-(4-метоксибензолсульфонил)-3 фенил пропионовой кислоты (пример 9) и гидрохлорида 2-диизопропиламиноэтилхлорида(4,0 г, 20 ммоль). Выход 3,2 г, 79%. Твердый продукт цвета слоновой кости. Т.пл. 89-91 С. МС: 476,4 (М+Н)+. Исходя из этилового эфира 2-бензил-4 диизопропиламино-2-(4-метоксибензолсульфонил)бутановой кислоты (3,53 г, 7,5 ммоль), выделяли 2,8 г (86%) 2-бензил-4-диизопропиламино-2-(4-метоксибензолсульфонил)бутановой кислоты в виде бесцветных кристаллов следуя методу, описанному в примере 9. Т.пл. 136138 С.МС: 448,5 (М+Н)+. Исходя из 2-бензил-4-диизопропиламино 2- (4-метоксибензолсульфонил)бутановой кислоты (1,85 г, 4,1 ммоль) и следуя методу, описанному в примере 1, выделяли 1,3 г 2-бензил-4 диизопропиламино-н-гидрокси-2-(4-метоксибензолсульфонил)бутирамида в виде воскообразного твердого продукта с низкой температурой плавления. Выход: 68%. МС: 463,3 (М+Н)+. 1 Н ЯМР 58 Выход 5,0 г, 94%. Бесцветное масло. МС: 355 (М+Н)+. Следуя методу, описанному в примере 29,получали этиловый эфир 3-циклогексил-2-(4 метоксибензолсульфонил)-2-пиридин-3-илметилпропионовой кислоты, исходя из этилового эфира 3-циклогексил-2-(4-метоксибензолсульфонил)пропионовой кислоты (1,5 г, 4,2 ммоль) и 3-пиколилхлорида (1,0 г, 6 ммоль). Выход 1,0 г, 38%. Бесцветное масло; МС 446 (М+Н)+. Исходя из этилового эфира 3-циклогексил 2-(4-метоксибензолсульфонил)-2-пиридин-3 илметилпропионовой кислоты (1,3 г, 2,9 ммоль),выделяли 1,0 г (83%) 3-циклогексил-2-(4-метоксибензолсульфонил)-2-пиридин-3-илметилпропионовой кислоты в виде бесцветных кристаллов следуя методу, описанному в примере 9. Т.пл. 92 С. МС: 417,5 (М+Н)+. Исходя из 3-циклогексил-2-(4-метоксибензолсульфонил)-2-пиридин-3-илметилпропионовой кислоты (1,0 г, 2,4 ммоль) и следуя методу,описанному в примере 1, выделяли 80 мг 3 циклогексил-N-гидрокси-2-(4-метоксибензолсульфонил)-2-пиридин-3-илметилпропионамида в виде бесцветной соли гидрохлорида. Выход: 71%. Т.пл. 57-60 С. МС: 433(м, 13 Н), 3,3 (д, J=14 Гц, 1 Н), 3,7 (д, J=14 Гц,1 Н), 3,9 (с, 3H), 7,0-8,5 (м, 8 Н). Пример 66. Гидроксиамид 2-(4-метоксибензолсульфонил)-4-метил-2-пиридин-3-илметил)пентановой кислоты. Следуя методу, описанному в примере 9,получали этиловый эфир 2-(4-метоксибензолсульфонил)-4-метилпентановой кислоты, исходя из (5,0 г, 20 ммоль) этилового эфира 2-(4 метоксибензолсульфонил)уксусной кислоты и 1-бром-2-метилпропана (2,6 г, 20 ммоль). Выход 6,0 г, 95%. Бесцветное масло. МС: 315 (М+Н)+. Следуя методу, описанному в примере 29,получали этиловый эфир 2-(4-метоксибензолсульфонил)-4-метил-2-пиридин-3-илметилпентановой кислоты, исходя из (3,1 г, 10 ммоль) этилового эфира 2-(4-метоксибензолсульфонил)-4-метилпентановой кислоты и гидрохлорида 3-пиколилхлорида (1,8 г, 11 ммоль). Выход 3,0 г, 75%. Бесцветное масло. МС: 406 (М+Н)+. Исходя из этилового эфира 2-(4-метоксибензолсульфонил)-4-метил-2-пиридин-3-илметилпентановой кислоты (1,2 г, 2,9 ммоль), выделяли 1,0 г (91%) 2-(4-метоксибензолсульфонил)4-метил-2-пиридин-3-илметилпентановой кислоты в виде бесцветных кристаллов следуя методу, описанному в примере 9. Т.пл. 188-186 С. МС: 378 (М+Н)+. Исходя из 2-(4-метоксибензолсульфонил)4-метил-2-пиридин-3-илметилпентановой кислоты (800 мг, 2,1 ммоль) и следуя методу, описанному в примере 1, выделяли 180 мг гидро 59 ксиамида 2-(4-метоксибензолсульфонил)-4-метил-2-пиридин-3-илметилпентановой кислоты в виде бесцветного твердого продукта. Выход: 21%. Т.пл. 78 С. МС: 393,4(м, 2 Н) , 3,85 (с, 3H), 6,8 -8,5 (м, 10 Н). Пример 67. N-Гидрокси-2-(4-метоксибензолсульфонил)-2-метил-3-хинолин-6-илпропионамид. Следуя методу, описанному в примере 29,получали этиловый эфир 2-(4-метоксибензолсульфонил)-2-метил-3-хинолин-6-илпропионовой кислоты, исходя из (5,2 г, 20 ммоль) этилового эфира 2-(4-метоксибензолсульфонил)пропионовой кислоты и 7-бромметилхинолина (4,4 г, 20 ммоль). Выход 4,5 г, 54%. Бледно-желтый твердый, продукт. Т.пл. 86 С. МС: 414 (М+Н)+. Исходя из этилового эфира 2-(4-метоксибензолсульфонил)-2-метил-3-хинолин-6-илпропионовой кислоты (3,0 г, 7,2 ммоль), выделяли 2,5 г (90%) 2-(4-метоксибензолсульфонил)-2 метил-3-хинолин-6-илпропионовой кислоты в виде бесцветных кристаллов следуя методу,описанному в примере 9. Т.пл. 106-108 С. МС: 386,4 (М+Н)+. Исходя из 2-(4-метоксибензолсульфонил)2-метил-3-хинолин-6-илпропионовой кислоты(2,0 г, 5,2 ммоль) и следуя методу, описанному в примере 1, выделяли 1,2 г N-гидрокси-2- (метоксибензолсульфонил)-2-метил-3-хинолин-6 илпропионамида в виде бесцветного твердого продукта. Выход: 57%. Т.пл. 206 С. МС: 401,4(М+Н)+. Следуя методу, описанному в примере 9,получали этиловый эфир 2-(4-метоксибензолсульфонил)-6-фенокси-2-пиридин-3-илметилгексановой кислоты, исходя из (3,1 г, 10 ммоль) этилового эфира 2-(4-метоксибензолсульфонил)-6-феноксигексановой кислоты и 3-пиколилхлорида (1,8 г, 11 ммоль). Выход 3,5 г, 71%. Бесцветное масло. МС: 498 (М+Н)+. Исходя из этилового эфира 2-(4 метоксибензолсульфонил)-6-фенокси-2-пиридин-3-илметилгексановой кислоты (3,0 г, 6,0 ммоль), выделяли 2,8 г (количественный выход) 60 2-(4-метоксибензолсульфонил)-6-фенокси-2 пиридин-3-илметилгексановой кислоты в виде бесцветных кристаллов следуя методу, описанному в примере 9. Т.пл. 148-151 С. МС: 470,5(М+Н)+. Исходя из 2-(4-метоксибензолсульфонил)6-фенокси-2-пиридин-3-илметилгексановой кислоты (2,0 г, 4,3 ммоль) и следуя методу, описанному в примере 1, получали 1,5 г гидроксиамида 2-(4-метоксибензолсульфонил)-6-фенокси 2-пиридин-3-илметилгексановой кислоты в виде бесцветного твердого продукта. Выход: 72%. Т.пл. 68 С. МС: 485,5(10,0 г, 39 ммоль) этилового эфира 2-(4 метоксибензолсульфонил)уксусной кислоты и 1-бром-3-метилбутана (6,0 г, 40 ммоль). Выход 8,5 г, 62%. Бесцветное масло. МС: 329 (М+Н)+. Следуя методу, описанному в примере 9,получали этиловый эфир 2-(4-метоксибензолсульфонил)-5-метил-2-пиридин-3-илметилгексановой кислоты, исходя из (6,0 г, 18 ммоль) этилового эфира 2-(4-метоксибензолсульфонил)-5-метилгексановой кислоты и гидрохлорида пиколилхлорида (4,1 г, 25 ммоль). Выход 4,5 г, 60%. Коричневое масло. МС: 420 (М+Н)+. Исходя из этилового эфира 2-(4-метоксибензолсульфонил)-5-метил-2-пиридин-3-илметилгексановой кислоты (3,0 г, 7,1 ммоль),выделяли 2,6 г (92%) 2-(4-метоксибензолсульфонил)-5-метил-2-пиридин-3-илметилгексановой кислоты в виде бесцветного твердого продукта, следуя методу, описанному в примере 9. Т.пл.: 173 С. МС: 392 (М+Н)+. Исходя из 2-(4-метоксибензолсульфонил)5-метил-2-пиридин-3-илметилгексановой кислоты (1,0 г, 2,5 ммоль) и следуя методу, описанному в примере 1, выделяли 800 мг гидроксиамида 2-(4-метоксибензолсульфонил)-5-метил-2-пиридин-3-илметилгексановой кислоты в виде бесцветного твердого продукта. Гидрохлорид получали пропусканием газообразного хлористого водорода через раствор в метаноле гидроксиамида. Выход: 72%. Т.пл. 62 С (соль HCl). МС: 408 (М+Н)+. 1 Н ЯМР (300 МГц, CDCl3):0,76
МПК / Метки
МПК: A61K 31/16, C07C 323/60, C07D 295/08
Метки: сульфинил, алкил, матричной, металлопротеиназы, гетероариламиды, сульфонил, арил, n-гидрокси-2, гетероарилсульфанил, 3-замещенный, ингибиторов, качестве
Код ссылки
<a href="https://eas.patents.su/30-3836-n-gidroksi-2-alkil-aril-ili-geteroarilsulfanil-sulfinil-ili-sulfonil-3-zameshhennyjj-alkil-aril-ili-geteroarilamidy-v-kachestve-ingibitorov-matrichnojj-metalloproteinazy.html" rel="bookmark" title="База патентов Евразийского Союза">N-гидрокси-2- (алкил, арил или гетероарилсульфанил, сульфинил или сульфонил) -3-замещенный алкил, арил или гетероариламиды в качестве ингибиторов матричной металлопротеиназы</a>
Следующий патент: Способ получения пантотената кальция
Случайный патент: Устройство для сбора маслянистых загрязнений с поверхности воды (варианты)












