Полизамещенные производные 2-арил-6-фенилимидазо[1,2-a]пиридинов, их получение и их применение в терапии
Формула / Реферат
1. Соединения формулы (I)
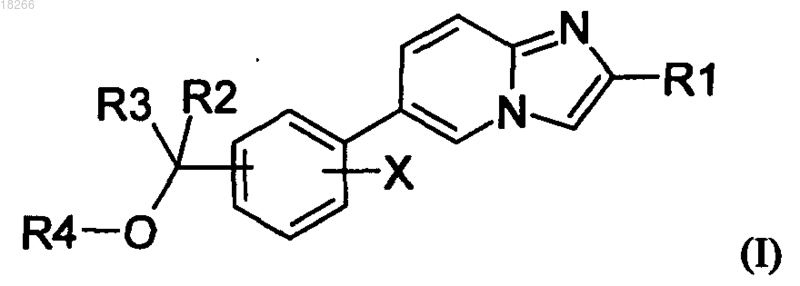
в которой R1 представляет собой фенильную группу или нафтильную группу, причем эти две группы могут быть замещены одним или несколькими атомами или группами, независимо друг от друга выбранными из следующих атомов или групп: галоген, C1-C10-алкил, галоген-C1-C10-алкил, C1-C10-алкокси, C1-C10-тиоалкил, -S(О)2-C1-C10-алкил, циано-, нитро, гидрокси-С1-С10-алкилен, NRaRb-C1-C10-алкилен, CONRaRb, SO2NRaRb, NRcCORd, NRcC(O)ORe, NRcSO2Re или гетероарилов, выбранных из пирролидина и морфолина;
X представляет собой 1-4 одинаковых или различающихся между собой заместителя, выбранных из галогена, C1-C10-алкокси, C1-C10-алкила, в случае необходимости замещенного одной или несколькими гидроксильными группами;
R2 и R3 независимо друг от друга представляют собой атом водорода;
C1-C10-алкильную группу, причем эта группа может быть замещена группой Rf;
R2 и X совместно с атомами углерода, к которым они присоединены, могут образовывать углеродный цикл из 5-7 атомов углерода;
R4 представляет собой атом водорода;
C1-C10-алкильную группу, причем эта группа может быть замещена группой Rf;
Ra и Rb независимо друг от друга представляют собой атом водорода либо C1-C10-алкильную группу либо Ra и Rb совместно со связанным с ними атомом азота образуют пирролидиновую группу или морфолинильную группу;
Rc и Rd независимо друг от друга представляют собой атом водорода либо C1-C10-алкильную группу;
Re представляет собой C1-C10-алкильную группу;
Rf представляет собой C1-C10-алкоксигруппу;
в виде основания или соли присоединения с кислотой.
2. Соединения формулы (I) по п.1, отличающиеся тем, что
X представляет собой один или два одинаковых или различающихся между собой заместителя, выбранных из галогена, C1-C10-алкила, C1-C10-алкокси-, причем C1-C10-алкил может быть замещен гидроксильной группой;
R2 и X совместно с атомами углерода, к которым они присоединены, могут образовывать углеродный цикл из 5 или 6 атомов углерода.
3. Соединения формулы (I) по любому из пп.1 или 2, отличающиеся тем, что замещение фенильного ядра группой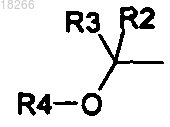 происходит в положения 2, 3 или 4.
происходит в положения 2, 3 или 4.
4. Соединения формулы (I) по любому из пп.1-3, отличающиеся тем, что
R1 представляет собой фенильную группу или нафтильную группу, возможно замещенную одним или несколькими атомами или группами, выбранными независимо друг от друга из атомов галогена или C1-C10-алкильных, C1-C10-алкокси-, нитро-, S(O)2-C1-С10-алкильных, галоген-C1-C10-алкильных, циано-, C1-C10-тиоалкильных, NRcCORd, гидрокси-C1-C10-алкиленовых, NRcSO2Re, CONRaRb, NRcC(O)ORe, SO2NRaRb, NRaRb-C1-C10-алкиленовых групп;
Ra и Rb независимо друг от друга представляют собой атом водорода или C1-C10-алкильную группу,
либо Ra и Rb совместно с атомом азота, к которому они присоединены, образуют пирролидинильную или морфолинильную группу;
Rc и Rd независимо друг от друга представляют собой атом водорода или C1-C10-алкильную группу;
Re представляет собой C1-C10-алкильную группу;
X представляет собой один или два одинаковых или различающихся между собой заместителя, выбранных из галогена, C1-C10-алкилов, C1-C10-алкокси-, причем C1-C10-алкильная группа может быть замещена гидроксильной группой;
R2 и X совместно с атомами углерода, к которым они присоединены, могут образовывать углеродный цикл из 5 или 6 атомов углерода;
R2 и R3 независимо друг от друга представляют собой атом водорода или C1-C10-алкильную группу;
R4 представляет собой атом водорода или C1-C10-алкильную группу, причем эта группа может быть замещена группой Rf;
Rf представляет собой C1-C10-алкоксигруппу;
замещение фенильного ядра группой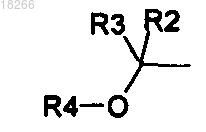 происходит в положения 2, 3 или 4,
происходит в положения 2, 3 или 4,
в виде основания или соли присоединения с кислотой.
5. Соединения формулы (I) по любому из пп.1-4, отличающиеся тем, что
R1 представляет собой фенильную группу, возможно замещенную галогеном, C1-C10-алкильной или C1-C10-алкоксигруппой;
X представляет собой один или несколько галогенов, C1-C10-алкилов, C1-C10-алкокси- или гидрокси-C1-C10-алкилов;
R2 и R3 независимо друг от друга представляют собой атом водорода или C1-C10-алкильную группу;
R2 и X совместно с атомами углерода, к которым они присоединены, могут образовывать углеродный цикл из 6 атомов углерода;
R4 представляет собой атом водорода;
в виде основания или соли присоединения с кислотой.
6. Соединение, выбранное из группы, включающей
{3-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]-2-фторфенил}метанол;
1-{3-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]-2-фторфенил}этанол;
{3-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]-2,6-дифторфенил}метанол;
1-{3-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]-2,6-дифторфенил}этанол;
1-{5-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]-2-фторфенил}этанол;
{3-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]-5-метилфенил}метанол;
{3-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]-5-метоксифенил}метанол;
7-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]-1,2,3,4-тетрагидронафталин-1-ол;
5-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]-1,2,3,4-тетрагидронафталин-1-ол;
{3-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]-4-метилфенил}метанол;
{5-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]-2-фторфенил}метанол;
{5-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]-2-метилфенил}метанол;
{3-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]-2-метилфенил}метанол;
[2-фтор-4-(2-п-толилимидазо[1,2-а]пиридин-6-ил)фенил]метанол;
[2-фтор-6-(2-п-толилимидазо[1,2-а]пиридин-6-ил)фенил]метанол;
{2-фтор-6-[2-(3-метоксифенил)имидазо[1,2-а]пиридин-6-ил]фенил}метанол;
{2-фтор-4-[2-(3-метоксифенил)имидазо[1,2-а]пиридин-6-ил]фенил}метанол и его хлоргидрат;
[2-фтор-4-(2-фенилимидазо[1,2-а]пиридин-6-ил)фенил]метанол и его хлоргидрат;
{2-фтор-3-[2-(3-метоксифенил)имидазо[1,2-а]пиридин-6-ил]фенил}метанол;
[2-фтор-6-(2-фенилимидазо[1,2-а]пиридин-6-ил)фенил]метанол и его хлоргидрат;
[2-фтор-3-(2-п-толилимидазо[1,2-а]пиридин-6-ил)фенил]метанол;
1-{3-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]-4-фторфенил}этанол;
{3-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]-4-фторфенил}метанол;
{3-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]-4-метоксифенил}метанол;
1-{3-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]-4-метоксифенил}этанол;
{3-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]-5-(гидроксиметил)фенил}метанол;
[2-фтор-3-[2-(нафтил-2-ил)имидазо[1,2-а]пиридин-6-ил]фенил]метанол;
[2-фтор-3-(2-фенилимидазо[1,2-а]пиридин-6-ил)фенил]метанол и его хлоргидрат;
(+)-1-{3-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]-4-фторфенил}этанол;
(-)-1-{3-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]-4-фторфенил}этанол;
{2-[2-(2,4-дифторфенил)имидазо[1,2-а]пиридин-6-ил]-6-фторфенил}метанол;
{3-[2-(2,4-дифторфенил)имидазо[1,2-а]пиридин-6-ил]-2,6-дифторфенил}метанол;
2-{4-фтор-3-[2-(3-метоксифенил)имидазо[1,2-а]пиридин-6-ил]фенил}пропан-2 -ол;
1-{4-фтор-3-[2-(3-метоксифенил)имидазо[1,2-а]пиридин-6-ил]фенил}этанол;
2-{3-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]-2,6-дифторфенил}пропан-2-ол;
1-[4-фтор-2-(2-нафтил-2-илимидазо[1,2-а]пиридин-6-ил)фенил]этанол;
6-(2,4-дифтор-3-метоксиметилфенил)-2-п-толилимидазо[1,2-а]пиридин;
{2-фтор-6-[2-(4-нитрофенил)имидазо[1, 2-а]пиридин-6-ил]фенил}метанол;
{2,6-дифтор-3-[2-(4-пирролидин-1-илфенил)имидазо[1,2-а]пиридин-6-ил]фенил}метанол;
{3-[2-(3,4-дифторфенил)имидазо[1,2-а]пиридин-6-ил]-2,6-дифторфенил}метанол;
{2,6-дифтор-3-[2-(2-фторфенил)имидазо[1,2-а]пиридин-6-ил]фенил}метанол;
{3-[2-(3-бромфенил)имидазо[1,2-а]пиридин-6-ил]-2,6-дифторфенил}метанол;
2,6-дифтор-3-[2-(4-метилсульфонилфенил)имидазо[1,2-а]пиридин-6-ил]фенил}метанол;
2-[2-метил-3-(2-фенилимидазо[1,2-а]пиридин-6-ил)фенил]пропан-2-ол;
7-[2-(2,4-дифторфенил)имидазо[1,2-а]пиридин-6-ил]индан-1-ол;
2-(4-хлорфенил)-6-[2,4-дифтор-3-[(2-метоксиэтил)оксиметил]фенил]имидазо[1,2-а]пиридин;
7-[2-(2,4-дифторфенил)имидазо[1,2-а]пиридин-6-ил]-1-метилиндан-1-ол;
2-{3-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]-2-метоксифенил}пропан-2-ол;
1-{3-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]-2-метоксифенил}этанол;
{2-фтор-6-[2-(4-трифторметилфенил)имидазо[1,2-а]пиридин-6-ил]фенил}метанол;
{2-фтор-6-[2-(4-метоксифенил)имидазо[1,2-а]пиридин-6-ил]фенил}метанол;
{2-фтор-6-[2-(4-пирролидин-1-илфенил)имидазо[1,2-а]пиридин-6-ил]фенил}метанол;
{2-фтор-6-[2-(4-фторфенил)имидазо[1,2-а]пиридин-6-ил]фенил}метанол;
{2-[2-(3,4-дифторфенил)имидазо[1,2-а]пиридин-6-ил]-6-фторфенил}метанол;
3-[6-(3-фтор-2-гидроксиметилфенил)имидазо[1,2-а]пиридин-2-ил]бензонитрил;
{2-фтор-6-[2-(2-фторфенил)имидазо[1,2-а]пиридин-6-ил]фенил}метанол;
{2-[2-(3-бромфенил)имидазо[1,2-а]пиридин-6-ил]-6-фторфенил}метанол;
{2-[2-(4-хлор-3-метилфенил)имидазо[1,2-а]пиридин-6-ил]-6-фторфенил}метанол;
{2-[2-(3-хлор-4-метилфенил)имидазо[1,2-а]пиридин-6-ил]-6-фторфенил}метанол;
{2-фтор-6-[2-(4-метилсульфонилфенил)имидазо[1,2-а]пиридин-6-ил]фенил}метанол;
{2,6-дифтор-3-[2-(4-метоксифенил)имидазо[1,2-а]пиридин-6-ил]фенил}метанол;
{2,6-дифтор-3-[2-(4-фторфенил)имидазо[1,2-а]пиридин-6-ил]фенил}метанол;
3-[6-(2,4-дифтор-3-гидроксиметилфенил)имидазо[1,2-а]пиридин-2-ил]бензонитрил;
{2,6-дифтор-3-[2-(4-хлор-3-метилфенил)имидазо[1,2-а]пиридин-6-ил]фенил}метанол;
{2,6-дифтор-3-[2-(3-хлор-4-метилфенил)имидазо[1,2-а]пиридин-6-ил]фенил}метанол;
{2,6-дифтор-3-[2-(4-метилтиофенил)имидазо[1,2-а]пиридин-6-ил]фенил}метанол;
2-[2-хлор-3-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]фенил}пропан-2-ол;
1-[2-хлор-3-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]фенил}этанол;
{2-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]-6-фторфенил}метанол;
2-(4-хлорфенил)-6-[3-фтор-2-[(2-метоксиэтил)оксиметил]фенил]имидазо[1,2-а]пиридин;
N-{3-[6-(3-фтор-2-гидроксиметилфенил)имидазо[1,2-а]пиридин-2-ил]фенил}ацетамид;
{4-[6-(3-фтор-2-гидроксиметилфенил)имидазо[1,2-а]пиридин-2-ил]фенил}метанол;
{3-[6-(3-фтор-2-гидроксиметилфенил)имидазо[1,2-а]пиридин-2-ил]фенил}метанол;
N-{4-[6-(3-фтор-2-гидроксиметилфенил)имидазо[1,2-а]пиридин-2-ил]фенил}метансульфонамид;
4-[6-(3-фтор-2-гидроксиметилфенил)имидазо[1,2-а]пиридин-2-ил]-N,N-диметилбензамид;
метил{4-[6-(3-фтор-2-гидроксиметилфенил)имидазо[1,2-а]пиридин-2-ил]фенил}карбамат;
4-[6-(3-фтор-2-гидроксиметилфенил)имидазо[1,2-а]пиридин-2-ил]-N-метилбензамид;
N-{4-[6-(3-фтор-2-гидроксиметилфенил)имидазо[1,2-а]пиридин-2-ил]фенил}ацетамид;
{2-фтор-6-[2-(4-морфолин-4-илфенил)имидазо[1,2-а]пиридин-6-ил]фенил}метанол;
3-[6-(3-фтор-2-гидроксиметилфенил)имидазо[1,2-а]пиридин-2-ил]-N,N-диметилбензолсульфонамид;
(2-фтор-6-{2-[4-(1-пирролидин-1-илэтил)фенил]имидазо[1,2-а]пиридин-6-ил}фенил)метанол;
2-фтор-4-[6-(3-фтор-2-гидроксиметилфенил)имидазо[1,2-а] пиридин-2-ил]-N,N-диметилбензамид;
N-{3-[6-(2,4-дифтор-3-гидроксиметилфенил)имидазо[1,2-а]пиридин-2-ил]фенил}ацетамид;
{4-[6-(2,4-дифтор-3-гидроксиметилфенил)имидазо[1,2-а]пиридин-2-ил]фенил}метанол;
{3-[6-(2,4-дифтор-3-гидроксиметилфенил)имидазо[1,2-а]пиридин-2-ил]фенил}метанол;
4-[6-(2,4-дифтор-3-гидроксиметилфенил)имидазо[1,2-а]пиридин-2-ил]-N,N-диметилбензамид;
метил{4-[6-(2,4-дифтор-3-гидроксиметилфенил)имидазо[1,2-а]пиридин-2-ил]фенил}карбамат;
4-[6-(2,4-дифтор-3-гидроксиметилфенил)имидазо[1,2-а]пиридин-2-ил]-N-метилбензамид;
N-{4-[6-(2,4-дифтор-3-гидроксиметилфенил)имидазо[1,2-а]пиридин-2-ил]фенил}ацетамид;
{2,6-дифтор-3-[2-(4-морфолин-4-илфенил)имидазо[1,2-а]пиридин-6-ил]фенил}метанол;
N-{3-[6-(2,4-дифтор-3-гидроксиметилфенил)имидазо[1,2-а]пиридин-2-ил]фенил}изобутирамид;
3-[6-(2,4-дифтор-3-гидроксиметилфенил)имидазо[1,2-а]пиридин-2-ил]-N,N-диметилбензолсульфонамид;
(2,6-дифтор-3-{2-[4-(1-пирролидин-1-илэтил)фенил]имидазо[1,2-а]пиридин-6-ил}фенил)метанол;
4-[6-(2,4-дифтор-3-гидроксиметилфенил)имидазо[1,2-а]пиридин-2-ил]-2-фтор-N,N-дициметилбензамид.
7. Лекарственное средство, обладающее модулирующим действием на рецепторы NOT, отличающееся тем, что оно содержит соединение формулы (I) по любому из пп.1-6 либо соль присоединения этого соединения с фармацевтически приемлемой кислотой.
8. Фармацевтическая композиция, обладающая модулирующим действием на рецепторы NOT, отличающаяся тем, что она содержит соединение формулы (I) по любому из пп.1-6 либо фармацевтически приемлемую соль этого соединения, а также по меньшей мере один фармацевтически приемлемый эксципиент.
9. Применение соединения формулы (I) по любому из пп.1-6 для получения лекарственных средств, предназначенных для лечения и профилактики нейродегенеративных заболеваний.
10. Применение соединения формулы (I) по любому из пп.1-6 для получения лекарственных средств, предназначенных для лечения и профилактики заболеваний мозга и эпилепсии.
11. Применение соединения формулы (I) по любому из пп.1-6 для получения лекарственных средств, предназначенных для лечения и профилактики психиатрических заболеваний.
12. Применение соединения формулы (I) по любому из пп.1-6 для получения лекарственных средств, предназначенных для лечения и профилактики воспалительных заболеваний.
13. Применение соединения формулы (I) по любому из пп.1-6 для получения лекарственных средств, предназначенных для лечения и профилактики остеопороза и онкологических заболеваний.
14. Применение соединения формулы (I) по любому из пп.1-6 для получения лекарственных средств, предназначенных для лечения и профилактики болезней Паркинсона и Альцгеймера, таупатий, рассеянного склероза.
15. Применение соединения формулы (I) по любому из пп.1-6 для получения лекарственных средств, предназначенных для лечения и профилактики шизофрении, депрессии, зависимости от веществ, синдрома дефицита внимания и гиперактивности.
16. Способ получения соединений формулы (I) по п.1, в котором соединение формулы (II)
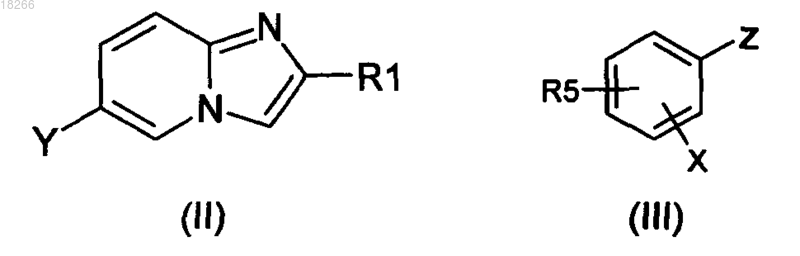 в которой R1 определено по п.1 и Y представляет собой атом галогена или производное бора, вводят в реакцию с производным общей формулы (III), в которой X определено по п.1 и Z представляет собой производное бора или олова, если Y представляет собой атом галогена, или атом галогена, если Y представляет собой производное бора, и R5 представляет собой группу
в которой R1 определено по п.1 и Y представляет собой атом галогена или производное бора, вводят в реакцию с производным общей формулы (III), в которой X определено по п.1 и Z представляет собой производное бора или олова, если Y представляет собой атом галогена, или атом галогена, если Y представляет собой производное бора, и R5 представляет собой группу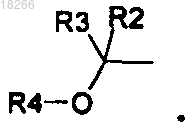
17. Способ получения соединений формулы (I) по п.1, в котором соединение общей формулы (VI)
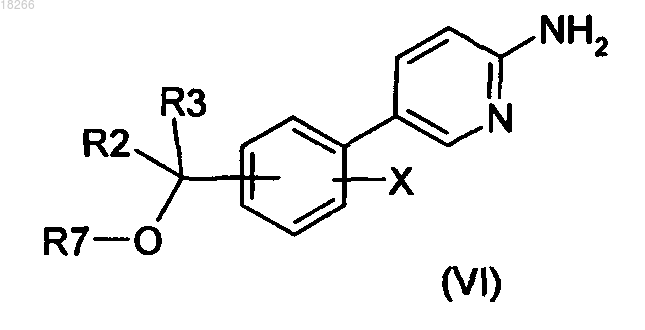
в которой R2, R3 и X определены по п.1 и R7 представляет собой R4 или группу (PG), являющуюся защитной по отношению к гидроксильной группе, вводят в реакцию с бромкетоном общей формулы (VII)
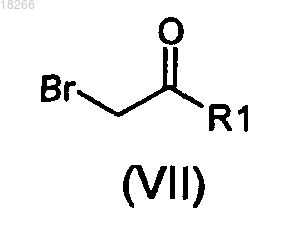
в которой R1 определен по п.1.
18. Способ получения соединений формулы (I) по п.1, в котором соединение формулы (II)
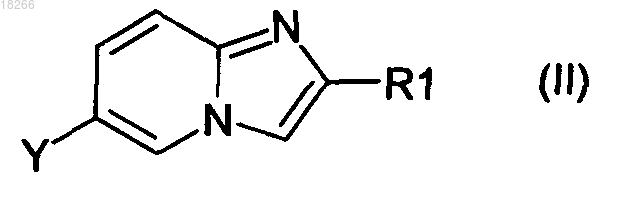
в которой R1 определен по п.1 и Y представляет собой атом галогена или производное бора, вводят в реакцию с производным общей формулы (III')
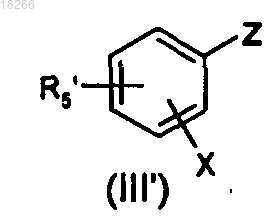
в которой X определен по п.1 и Z представляет собой производное бора или олова, если Y представляет собой атом галогена, или атом галогена, если Y представляет собой производное бора, и R5' представляет собой либо карбонильное производное R2CO, в котором R2 определен по п.1, либо алкилкарбоксилат, с образованием соединения общей формулы (IV), и затем соединение общей формулы (IV) вводят в реакцию с металлоорганическим производным с образованием соединения общей формулы (I).
19. Способ получения соединений формулы (I), в котором соединение общей формулы (VI)
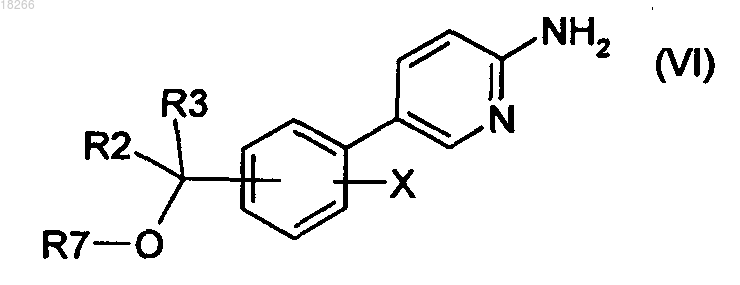
в которой R2, R3 и X определены по п.1 и R7 представляет собой R4 или группу (PG), являющуюся защитной по отношению к гидроксильной группе, вводят в реакцию с бромкетоном общей формулы (VII)
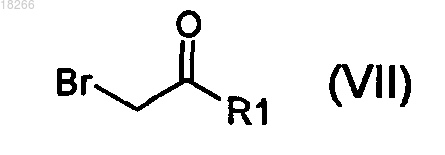
в которой R1 определен по п.1.
20. Способ получения соединений формулы (I) по п.1, в котором соединение общей формулы (VI)
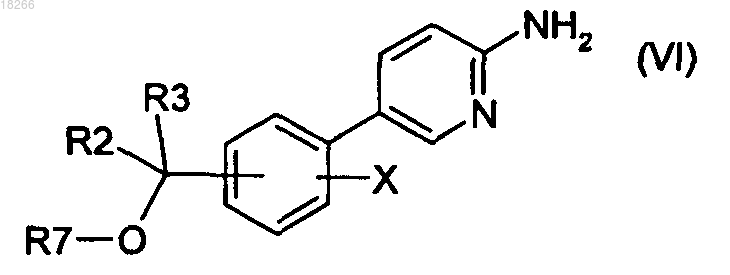
в которой R2, R3 и X определены по п.1 и R7 представляет собой R4 или группу (PG), являющуюся защитной по отношению к гидроксильной группе, вводят в реакцию с бромкетоном общей формулы (VII)
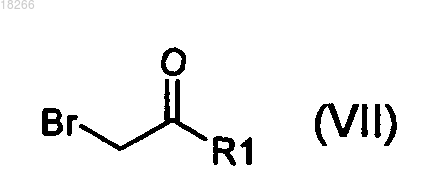
в которой R1 определен по п.1, с образованием соединения общей формулы (VIII)
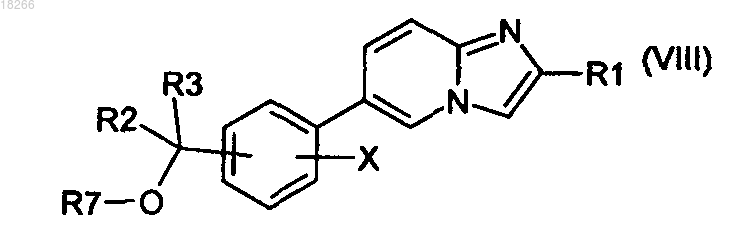
в которой R7 представляет собой группу, являющуюся защитной по отношению к гидроксильной группе, и затем из соединения общей формулы (VIII) удаляют защитные группы с образованием соединения общей формулы (I).
21. Способ получения соединений формулы I по п.1, в котором соединение общей формулы (XI)
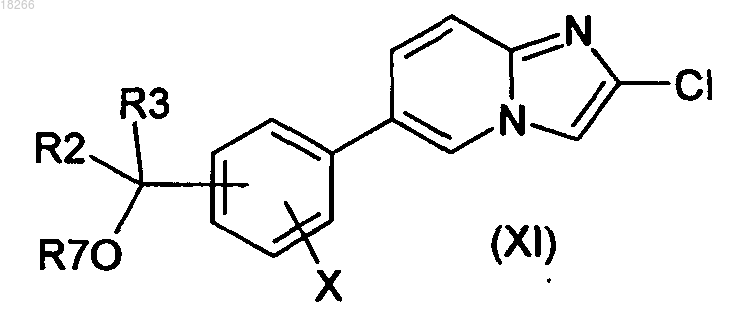
в которой X, R2 и R3 определены по п.1 и R7 представляет собой группу R4, вводят в реакцию с производным общей формулы (XII)
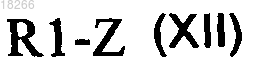
в которой R1 определен по п.1 и Z представляет собой производное бора или олова, с образованием соединений общей формулы (I).
22. Способ получения соединений формулы (I) по п.1, в котором соединение общей формулы (XI)
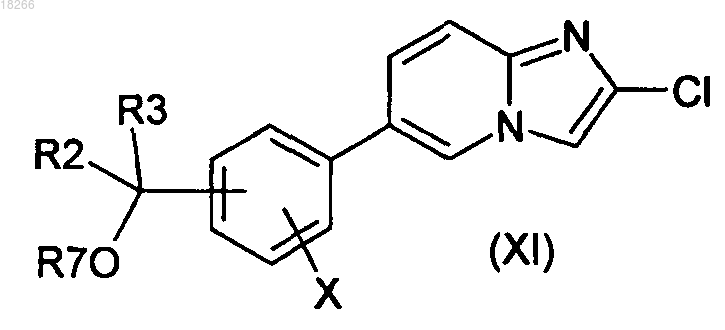
в которой X, R2 и R3 определены по п.1 и R7 представляет собой группу, являющуюся защитной по отношению к гидроксильной группе, вводят в реакцию с производным общей формулы (XII)
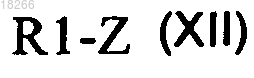
в которой R1 определен по п.1 и Z представляет собой производное бора или олова, с образованием соединений общей формулы (VIII)
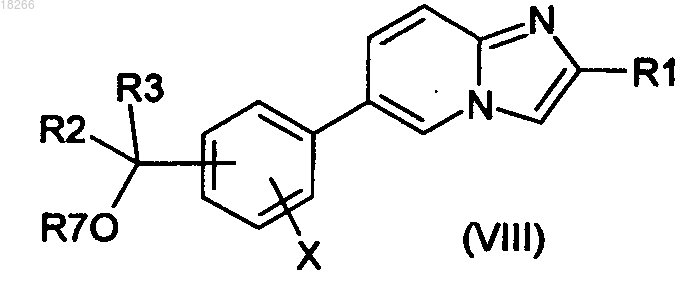
в которой Rl, R2, R3 и X определены по п.1 и R4 представляет собой атом водорода, и затем из соединения общей формулы (VIII) удаляют защитные группы.
23. Промежуточное соединение, выбранное из группы, включающей
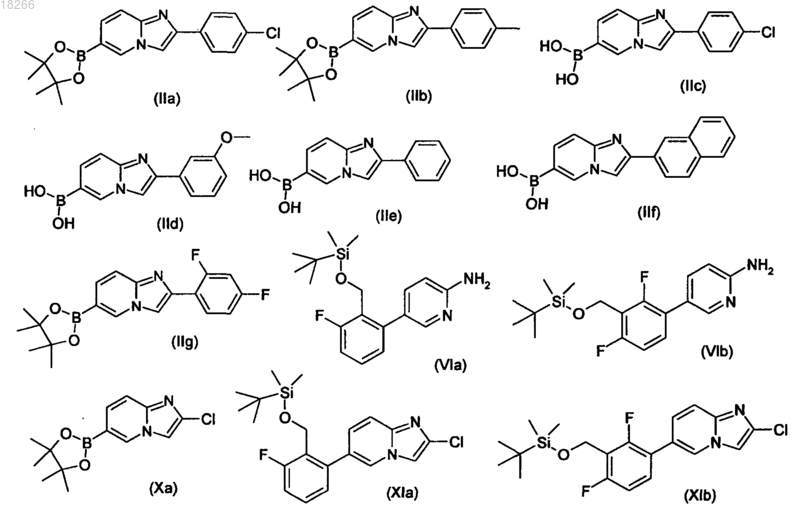
24. Способ получения по любому из пп.16, 17, 18, 19, 20, 21 или 22, в котором соединения общих формул (II), (VI), (X), (XI) представляют собой соединения общих формул (IIa), (IIb), (IIc), (IId), (IIe), (IIf), (IIg), (VIa), (VIb), (Xa), (XIa) и (XIb).
Текст
Описаны соединения формулы I, в которой R1 представляет собой фенильную группу или нафтильную группу, возможно замещенные одним или несколькими атомами или группами, X представляет собой 1-4 одинаковых или различающихся между собой заместителя, выбранных из галогенов, C1-C10-алкилов, C1-C10-алкокси-, причем С 1-С 10-алкил может быть замещен гидроксилом;R2 и R3 независимо друг от друга представляют собой атом водорода или C1-C10-алкильную группу,причем эта группа может быть замещена группой Rf; R2 и X совместно с атомами углерода, к которым они присоединены, могут образовывать углеродный цикл из 5-7 атомов углерода; R4 представляет собой атом водорода, С 1-С 10-алкильную группу, возможно замещенную группой Rf,в виде основания или соли присоединения с кислотой. Также описаны их применение в терапии и способ синтеза. Изобретение относится к полизамещенным производным 2-арил-6-фенилимидазо[1,2-а] пиридина,их получению и их применению в терапии для лечения или профилактики заболеваний, связанных с деятельностью ядерных рецепторов Nurr-1, также называемых NR4A2, NOT, TINUR, RNR-1 и HZF3. Объектом настоящего изобретения являются соединения формулы I в которой R1 представляет собой фенильную группу или нафтильную группу, причем две указанные группы могут быть замещены одним или несколькими атомами или группами, независимо друг от друга выбранными из следующих атомов или групп: галоген, C1-С 10-алкил, галоген-C1-С 10-алкил, C1-С 10 алкокси-, галоген-C1-С 10-алкокси-, C1-С 10-тиоалкил, S(О)-C1-С 10-алкил, -S(О)2-C1-С 10-алкил, гидроксил,циано-, нитро-, гидрокси-C1-С 10-алкилен, NRaRb-C1-С 10-алкилен, C1-С 10-алкокси-C1-С 10-алкиленокси-,NRaRb, CONRaRb, SO2NRaRb, NRcCORd, ОС(O)NRaRb, OCO-C1-С 10-алкил, NRcC(O)ORe, NRcSO2Re,арил-C1-С 10-алкилен, моноциклический арил или гетероарил, причем моноциклический арил или гетероарил может быть замещен одним или несколькими заместителями, выбранными из галогена, C1-С 10 алкильных, галоген-C1-С 10-алкильных, C1-С 10-алкокси-, галоген-C1-С 10-алкокси-, NRaRb, гидроксильной,оксо-, нитро-, циано- или OCO-C1-С 10-алкильных групп;X представляет собой 1-4 одинаковых или различающихся между собой заместителя, выбранных из галогена, C1-С 10-алкилов, C1-С 10-алкокси-, NRaRb, циано-, нитро-, причем C1-С 10-алкил может быть замещен одной или несколькими группами, выбранными из галогена,C1-С 10-алкокси-, галоген-C1-С 10 алкокси-, NRaRb или гидроксила;R2 и R3 независимо друг от друга представляют собой атом водорода;C1-С 10-алкильную группу, причем эта группа может быть замещена группой Rf; арильную группу, возможно замещенную одним или несколькими заместителями, выбранными из галогена, C1-С 10-алкильных, галоген-C1-С 10-алкильных, C1-С 10-алкокси-, галоген-C1-С 10-алкокси-, NRaRb,гидроксильной, нитро- или цианогрупп;R2 и X совместно с атомами углерода, к которым они присоединены, могут образовывать углеродный цикл из 5-7 атомов углерода;R4 представляет собой атом водорода;C1-С 10-алкильную группу, причем эта группа может быть замещена группой Rf; арильную группу, возможно замещенную одним или несколькими заместителями, выбранными из галогена, C1-С 10-алкильных, галоген-C1-С 10-алкильных, C1-С 10-алкокси-, галоген-C1-C10-алкокси-, NRaRb,гидроксильной, нитро-, циано-, C1-C10-алкил(СО)-, CONRaRb, NRcCORd, ОС(О)NRaRb, OCO-C1-C10 алкильных, NRcC(О)ORe или арильных групп, причем арил может быть замещен одним или несколькими заместителями, выбранными из галогена, C1-C10-алкильных, галоген-C1-C10-алкильных, C1-C10 алкокси-, галоген-C1-С 10-алкокси-, NRaRb, гидроксильной, нитро- или цианогрупп;Ra и Rb независимо друг от друга представляют собой атом водорода либо C1-C10-алкильную, арилС 1-С 10-алкиленовую или арильную группу, либо Ra и Rb совместно со связанным с ними атомом азота образуют азетидиновую, пирролидиновую, пиперидиновую, азепиновую, морфолиновую, тиоморфолиновую, пиперазиновую или гомопиперазиновую группу, причем эта группа может быть замещена С 1-С 10 алкильной, арильной или арил-С 1-С 10-алкиленовой группой;Rc и Rd независимо друг от друга представляют собой атом водорода либо C1-C10-алкильную, арилC1-C10-алкиленовую или арильную группу, либо Rc и Rd совместно образуют С 2-С 5-алкиленовую группу;Rf представляет собой атом галогена, C1-C10-алкокси-, галоген-С 1-С 10-алкокси-, гидроксильную,циано-, NRaRb, C(O)NRaRb, NRcCORd, OC(O)NRaRb, OCO-C1-C10-алкильную, NRcCOORe, SO2NRaRb,NRcSO2Re, арил-C1-C10-алкиленовую или арильную группу, причем арил может быть замещен одним или несколькими заместителями, выбранными из галогена, C1-C10-алкильных, галоген-C1-C10-алкильных,C1-C10-алкокси-, галоген-C1-C10-алкокси-, NRaRb, гидроксильной, нитро-, циано- или OCO-C1-C10 алкильных групп,в виде основания или соли присоединения с кислотой. Соединения формулы I могут содержать один или несколько асимметрических атомов углерода. Таким образом, они могут существовать в виде энантиомеров или диастереомеров. Эти энантиомеры,диастереомеры, а также их смеси, в том числе рацемические смеси, являются частью настоящего изобретения. Соединения формулы I могут существовать в виде оснований или солей присоединения с кислотой. Эти соли присоединения являются частью настоящего изобретения. Эти соли могут быть получены с фармацевтически приемлемыми кислотами, однако соли других кислот, используемые, например, при очистке или выделении соединений формулы I, также являются частью настоящего изобретения. Соединения формулы I также могут существовать в виде гидратов или сольватов, а именно в виде ассоциатов или сочетаний с одной или несколькими молекулами воды или с растворителем. Эти гидраты или сольваты также являются частью настоящего изобретения. В рамках настоящего изобретения используются следующие определения:Cx-Ct-группа: группа, содержащая от х до t атомов углерода; атом галогена: фтор, хлор, бром или иод; алкильная группа: линейная, разветвленная или циклическая насыщенная алифатическая группа,возможно замещенная линейной, разветвленной или циклической насыщенной алкильной группой. В качестве примеров можно указать метильную, этильную, пропильную, изопропильную, бутильную, изобутильную, трет-бутильную, циклопропильную, циклобутильную, циклопентильную, циклогексильную,метилциклопропильную, циклопропилметильную группы и др.; алкиленовая группа: двухвалентная алкильная группа; алкоксигруппа: -О-алкильный радикал, в котором алкильная группа подобна определенной выше; галогеналкильная группа: алкильная группа, замещенная одним или несколькими одинаковыми или различными атомами галогена. В качестве примеров можно указать группы CF3, CH2CF3, CHF2, CCl3; галогеналкоксигруппа: -О-алкильный радикал, в котором алкильная группа, подобная определенной выше, является замещенной одним или несколькими одинаковыми или различными атомами галогена. В качестве примеров можно указать группы OCF3, OCHF2, OCCl3; тиоалкильная группа: S-алкильный радикал, в котором алкильная группа подобна определенной выше; арильная группа: моно- или бициклическая ароматическая группа, содержащая от 6 до 10 атомов. В качестве примеров арильных групп можно указать фенильную и нафтильную группы; гетероарильная группа: моно- или бициклическая ароматическая группа, содержащая от 5 до 10 атомов, в том числе от 1 до 4 гетероатомов, выбранных из N, О и S. В качестве примеров моноциклических гетероарильных групп можно указать пиррольную, фурановую, тиофеновую, пиразольную, имидазольную, триазольную, тетразольную, оксазольную, изоксазольную, оксадиазольную, тиазольную, изотиазольную, тиадиазольную, пиридиновую, пиримидиновую, пиразиновую, пиридазиновую, триазиновую; атомы серы и азота могут находиться в окисленном состоянии (N-оксид, сульфоксид, сульфон). Среди соединений формулы I, являющихся объектом настоящего изобретения, первая группа соединений состоит из соединений, в которыхR1 представляет собой фенильную группу или нафтильную группу, возможно замещенную одним или несколькими атомами или группами, выбранными независимо друг от друга из атомов галогена илиRa и Rb независимо друг от друга представляют собой атом водорода или C1-C10-алкильную группу,либо Ra и Rb совместно с атомом азота, к которому они присоединены, образуют азетидинильную, пирролидинильную или морфолинильную группу;Rc и Rd независимо друг от друга представляют собой атом водорода или C1-C10-алкильную группу;Re представляет собой C1-C10-алкильную группу,при этом остальные заместители подобны определенным выше. Среди соединений формулы I, являющихся объектом настоящего изобретения, вторая группа соединений состоит из соединений, в которыхR1 представляет собой фенильную группу или нафтильную группу, возможно замещенную одним или несколькими атомами или группами, выбранными независимо друг от друга из атомов галогенов,метильной, метокси-, нитро, метилсульфонильной, трифторметильной, циано-, метилтио-, пирролидинильной, NHCOCH3, гидроксиметильной, -NHSO2CH3, -CON(CH3)2, -NHC(O)OCH3, -C(O)NHCH3, морфолинильной, -NHC(O)-изопропильной, -SO2N(CH3)2, пирролидинилэтильной групп,при этом остальные заместители подобны определенным выше. Среди соединений формулы I, являющихся объектом настоящего изобретения, третья группа соединений состоит из соединений, в которых:R1 представляет собой фенильную группу или нафтильную группу, причем фенильная группа может быть замещена в положения 2, 3 или 4 одним или несколькими атомами или группами, выбранными независимо друг от друга из атомов галогенов, метильной, метокси-, нитро-, метилсульфонильной, трифторметильной, циано-, метилтио-, пирролидинильной, NHCOCH3, гидроксиметильной, -NHSO2CH3,-CON(CH3)2, -NHC(O)OCH3, -C(O)NHCH3, морфолинильной, -NHC(O)-изопропильной, -SO2N(CH3)2,пирролидинилэтильной групп,при этом остальные заместители подобны определенным выше. Среди соединений формулы I, являющихся объектом настоящего изобретения, четвертая группа соединений состоит из соединений, в которыхX представляет собой один или два одинаковых или различающихся между собой заместителя, выбранных из галогенов, C1-C10-алкилов, C1-C10-алкокси-, причем C1-C10-алкильная группа может быть замещена гидроксильной группой;R2 и X совместно с атомами углерода, к которым они присоединены, могут образовывать углеродный цикл из 5 или 6 атомов углерода; при этом остальные заместители подобны определенным выше. Среди соединений формулы I, являющихся объектом настоящего изобретения, пятая группа соединений состоит из соединений, в которых X представляет собой один или два одинаковых или различающихся между собой заместителя, выбранных из атомов галогенов, метильной, метокси- и гидроксиметильной групп;R2 и X совместно с атомами углерода, к которым они присоединены, могут образовывать углеродный цикл из 5 или 6 атомов углерода; при этом остальные заместители подобны определенным выше. Среди соединений формулы I, являющихся объектом настоящего изобретения, шестая группа соединений состоит из соединений, в которых R2 и R3 независимо друг от друга представляют собой атом водорода или C1-C10-алкильную группу; при этом остальные заместители подобны определенным выше. Среди соединений формулы I, являющихся объектом настоящего изобретения, седьмая группа соединений состоит из соединений, в которых R2 и R3 независимо друг от друга представляют собой атом водорода или метильную группу; при этом остальные заместители подобны определенным выше. Среди соединений формулы I, являющихся объектом настоящего изобретения, восьмая группа соединений состоит из соединений, в которых R4 представляет собой атом водорода или C1-C10-алкильную группу, причем эта группа может быть замещена группой Rf;Rf представляет собой C1-C10-алкоксигруппу; при этом остальные заместители подобны определенным выше. Среди соединений формулы I, являющихся объектом настоящего изобретения, девятая группа соединений состоит из соединений, в которых R4 представляет собой атом водорода, метильную или метоксиэтильную группу; при этом остальные заместители подобны определенным выше. Среди соединений формулы I, являющихся объектом настоящего изобретения, десятая группа соединений состоит из соединений, в которых замещение фенильного ядра группой происходит в положения 2, 3 или 4; при этом заместители соединений формулы I подобны определенным выше. Среди соединений формулы I, являющихся объектом настоящего изобретения, одиннадцатая группа соединений состоит из соединений, в которых R1 представляет собой фенильную группу или нафтильную группу, возможно замещенную одним или несколькими атомами или группами, выбранными независимо друг от друга из атомов галогена или С 1-С 10-алкильной, C1-C10-алкокси-, нитро-, S(O)2-C1 С 10-алкильной, галоген-C1-C10-алкильной, циано-, C1-C10-тиоалкильной, NRaRb, NRcCORd, гидрокси-C1C10-алкиленовой, NRcSO2Re, CONRaRb, NRcC(O)ORe, SO2NRaRb, NRaRb-C1-C10-алкиленовой групп;Ra и Rb независимо друг от друга представляют собой атом водорода или C1-C10-алкильную группу,либо Ra и Rb совместно с атомом азота, к которому они присоединены, образуют пирролидиновую, пиперидинильную или морфолинильную группу;Rc и Rd независимо друг от друга представляют собой атом водорода или C1-C10-алкильную группу;X представляет собой один или два одинаковых или различающихся между собой заместителя, выбранных из галогенов, C1-C10-алкилов, C1-C10-алкокси-, причем C1-C10-алкильная группа может быть замещена гидроксильной группой;R2 и X совместно с атомами углерода, к которым они присоединены, могут образовывать углеродный цикл из 5 или 6 атомов углерода;R2 и R3 независимо друг от друга представляют собой атом водорода или C1-C10-алкильную группу;R4 представляет собой атом водорода или C1-C10-алкильную группу, причем эта группа может быть замещена группой Rf;Rf представляет собой C1-C10-алкоксигруппу; замещение фенильного ядра группой в виде основания или соли присоединения с кислотой. Среди соединений формулы I, являющихся объектом настоящего изобретения, двенадцатая группа соединений состоит из соединений, в которых R1 представляет собой фенильную группу или нафтильную группу, возможно замещенную одним или несколькими атомами или группами, выбранными независимо друг от друга из атомов галогена, метильной, метокси-, нитро-, метилсульфонильной, трифторметильной, циано-, метилтио-, пирролидинильной, NHCOCH3, гидроксиметильной, -NHSO2CH3,-CON(CH3)2, -NHC(O)OCH3, -C(O)NHCH3, морфолинильной, -NHC(О)-изопропильной, -SO2N(CH3)2,пирролидинилэтильной групп,X представляет собой один или два одинаковых или различающихся между собой заместителя, выбранных из атомов водорода или фтора, метильной, метокси- или гидроксиметильной групп;R2 и X совместно с атомами углерода, к которым они присоединены, могут образовывать углеродный цикл из 5 или 6 атомов углерода;R2 и R3 независимо друг от друга представляют собой атом водорода или метильную группу;R4 представляет собой атом водорода, метильную или метоксиэтильную группу; замещение фенильного ядра группой происходит в положения 2, 3 или 4; в виде основания или соли присоединения с кислотой. Среди соединений формулы I, являющихся объектом настоящего изобретения, тринадцатая группа соединений состоит из соединений, в которыхR1 представляет собой фенильную группу, возможно замещенную галогеном, C1-C10-алкильной илиX представляет собой один или несколько галогенов, C1-C10-алкилов, C1-C10-алкокси- или гидроксиС 1-С 10-алкилов;R2 и R3 независимо друг от друга представляют собой атом водорода или C1-C10-алкильную группу;R2 и X совместно с атомами углерода, к которым они присоединены, могут образовывать углеродный цикл из 6 атомов углерода;R4 представляет собой атом водорода; в виде основания или соли присоединения с кислотой. Среди соединений формулы I, являющихся объектом настоящего изобретения, можно назвать, в частности, следующие соединения: 3-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]-2-фторфенилметанол; 1-3-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]-2-фторфенилэтанол; 3-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]-2,6-дифторфенилметанол; 1-3-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]-2,6-дифторфенилэтанол; 1-5-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]-2-фторфенилэтанол; 3-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]-5-метилфенилметанол; 3-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]-5-метоксифенилметанол; 7-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]-1,2,3,4-тетрагидронафталин-1-ол; 5-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]-1,2,3,4-тетрагидронафталин-1-ол; 3-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]-4-метилфенилметанол; 5-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]-2-фторфенилметанол; 5-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]-2-метилфенилметанол; 3-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]-2-метилфенилметанол;(2,6-дифтор-3-2-[4- (1-пирролидин-1-илэтил)фенил]имидазо[1,2-а]пиридин-6-илфенил)метанол; 4-[6-(2,4-дифтор-3-гидроксиметилфенил)имидазо[1,2-а]пиридин-2-ил]-2-фтор-N,N-диметилбензамид. Согласно настоящему изобретению, получение соединений общей формулы I возможно в соответствии со способом, описанным на схеме 1. Схема 1 Получение соединений по изобретению в соответствии со схемой 1 возможно путем катализируемой металлом наподобие палладия реакции сочетания имидазопиридина общей формулы II, в которойR1 определяется аналогично изложенному выше, и Y представляет собой атом галогена или производное бора, с производным общей формулы III, в которой X определяется аналогично изложенному выше, Z представляет собой производное бора или олова, если Y представляет собой атом галогена, или атом гас образованилогена, если Y представляет собой производное бора, R5 представляет собой группу ем соединений общей формулы I, например, согласно способу, описанному в работе А. Gueiffier, Helv.Chim. Acta 2001, 84, 3610-3615. Получение соединений по изобретению в соответствии со схемой 1 также возможно путем катализируемой металлом наподобие палладия реакции сочетания имидазопиридина общей формулы II, в которой R1 определяется аналогично изложенному выше, Y представляет собой атом галогена или производное бора, с производным общей формулы III', в которой X определяется аналогично изложенному выше,Z представляет собой производное бора или олова, если Y представляет собой атом галогена, или атом галогена, если Y представляет собой производное бора, R5' представляет собой карбонильное производное R2CO, в котором R2 определяется аналогично изложенному выше, либо R5' представляет собой алкилкарбоксилат, с образованием соединений общей формулы IV, например, согласно способу, описанному в работе А. Gueiffier, Helv. Chim. Acta 2001, 84, 3610-3615. Затем возможно превращение соединений общей формулы IV в соединения общей формулы I, в которых R4 представляет собой атом водорода, под действием металлоорганического производного наподобие магнийорганического, например R3MgBr, в котором R3 определяется аналогично изложенному выше, либо путем восстановления карбонильной группы под действием гидрида металла, например боргидрида натрия или одного из его производных, либо любым другим способом, известным специалисту в данной области техники. В случае, если методика получения исходных соединений и реагентов, указанных на схеме 1, не описывается они либо являются коммерчески доступными или описанными в литературе, либо могут быть получены в соответствии со способами, описанными в литературе или известными специалисту в данной области техники. В частности, имидазопиридины общей формулы II, в которой Y представляет собой производное бора, могут быть получены, например, согласно способу, описанному в работе Е.DiMauro, J. Org. Chem. 2006, 71, 3959. Согласно настоящему изобретению получение соединений общей формулы I также возможно в соответствии со способом, описанным на схеме 2. Схема 2 Получение соединений по изобретению в соответствии со схемой 2 возможно по реакции конденсации аминопиридина общей формулы VI, в которой R2, R3 и X определяются аналогично изложенному выше, R7 представляет собой R4 или группу (PG), являющуюся защитной по отношению к гидроксильной группе, с бромкетоном общей формулы VII, в которой R1 определяется аналогично изложенному выше, с образованием имидазопиридина общей формулы I, в которой R1, R2, R3, R4 и X определяются аналогично изложенному выше, или с образованием имидазопиридина общей формулы VIII, в которойR7 представляет собой защитную группу (PG), например, способом, описанным в работе М. Fisher, J.Med. Chem. 1972, 15, 982. В качестве групп, являющихся защитными по отношению к гидроксильным,можно указать группы, описанные, например, в работе Т. Greene, Protective Groups in Organic Synthesis(Wiley Interscience), например, трет-бутилдиметилсилильную группу. Наконец, в случае, если R7 представляет собой группу (PG), являющуюся защитной по отношению к гидроксильной, соединения общей формулы VIII вводят в реакцию удаления защитных групп, например, согласно описанному в Т. Greene, Protecting Groups in Organic Synthesis (Wiley Interscience), с образованием соединений общей формулы I, в которой R4 представляет собой атом водорода. Соединения общей формулы VI могут быть получены по катализируемой металлом наподобие палладия реакции сочетания галогенпроизводного общей формулы V, в которой R2, R3, X и Hal определяются аналогично изложенному выше, R7 представляет собой R4 либо группу (PG), являющуюся защитной по отношению к гидроксильной, с 2-аминопиридином IX, замещенным группой Z, представляющей собой производное бора или олова, в том числе, например, 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2 ил)пиридин-2-иламином. Согласно настоящему изобретению получение соединений общей формулы I также возможно в соответствии со способом, описанным на схеме 3. Схема 3 Получение соединений по изобретению в соответствии со схемой 3 возможно по катализируемой металлом наподобие палладия реакции сочетания имидазопиридина общей формулы XI, в которой X, R2 и R3 определяется аналогично вышеизложенному, и R7 представляет собой группу R4, с производным общей формулы XII, в которой R1 определяется аналогично вышеизложенному, и Z представляет собой производное бора или олова, с образованием соединений общей формулы I, например, согласно способу,описанному в работе S. Buchwald, J.A.C.S. 2005, 127, 4685. Получение соединений по изобретению в соответствии со схемой 3 также возможно по катализируемой металлом наподобие палладия реакции сочетания имидазопиридина общей формулы XI, в которой X, R2 и R3 определяется аналогично вышеизложенному, и R7 представляет собой группу (PG), являющуюся защитной по отношению к гидроксильной группе, подобной, например, описанным в работе Т. Greene, Protective Groups in Organic Synthesis (Wiley Interscience), с производным общей формулы XII,в которой R1 определяется аналогично вышеизложенному, и Z представляет собой производное бора или олова, с образованием соединений общей формулы VIII, например, способом, описанным в работе S.Buchwald, J.A.C.S. 2005, 127, 4685. Затем путем осуществления реакции удаления защитных групп, подобной описанным, например, в Т. Greene, Protective Groups in Organic Synthesis (Wiley Interscience), или любым другим способом, известным специалисту в данной области техники, возможно превращение соединений общей формулы VIII в соединения общей формулы I, в которой R4 представляет собой атом водорода. Имидазопиридины общей формулы XI могут быть получены по катализируемой металлом наподобие палладия реакции сочетания имидазопиридина общей формулы X, в которой Y представляет собой производное бора, с производным общей формулы V, в которой R2, R3 и X определяются аналогично вышеизложенному, R7 представляет собой R4 или группу (PG), являющуюся защитной по отношению к гидроксильной, Hal представляет собой атом галогена, кроме хлора, например, способом, описанным в работе A. Gueiffier, Helv. Chim. Acta 2001, 84, 3610-3615. В случае если методика получения исходных соединений и реагентов, указанных на схеме 3, не описывается, они либо являются коммерчески доступными или описанными в литературе, либо могут быть получены в соответствии со способами, описанными в литературе или известными специалисту в данной области техники. В частности, хлорированные имидазопиридины общей формулы X могут быть получены, например, способом, описанным в работе С. Townsend, Syn. Commun. 1997, 27, 1763-1765. При желании и при необходимости продукты формулы I могут быть введены в любом порядке в любые реакции, известные специалисту в данной области техники, с целью превращения в другие продукты формулы I. В качестве примеров реакций можно назвать реакции этерификации или амидирования кислотной группы, реакции карбамоилирования, реакции гидролиза сложноэфирной группы, реакции превращения гидроксильной группы в алкоксигруппу, реакции сочетания, катализируемые переходными металлами,реакции защиты реакционноспособных групп, реакции удаления защитных групп, которые могут быть присоединены к защищенным реакционноспособным группам, реакции солеобразования с неорганическими или органическими кислотами либо с основаниями с целью образования соответствующих солей,реакции расщепления рацемических форм на энантиомеры, причем указанные продукты формулы I, полученные подобным путем, могут находиться в любых возможных рацемических, энантиомерных и диастереомерных формах. В соответствии с другим аспектом настоящего изобретения, его объектами также являются соединения формул IIa, IIb, IIc, IId, IIe, IIf, IIg, VIa, VIb, Xa, XIa и XIb. Подобные соединения являются полезными в качестве промежуточных продуктов при синтезе соединений формулы I. Соединения формул IIa, IIb, IIc, IId, IIe, IIf и IIg могут быть получены в одну стадию (в случае бороновых эфиров) или в две стадии (в случае бороновых кислот), например, способом, описанным в примерах 4 и 6. На первой стадии возможно осуществление конденсации аминопиридина, замещенного производным бора, в том числе, например, 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридин-2 иламина, с альфа-бромкетоном наподобие 2-бром-1-(арил)этанона, например, в среде растворителя наподобие н-пропанола и в присутствии основания, в том числе, например, гидрокарбоната натрия, с целью получения соответствующих сложных эфиров бороновых кислот. Затем на второй стадии проводят гидролиз бороновых эфиров до соответствующих бороновых кислот, например, в смеси ацетона, воды и соляной кислоты. Соединения формул VIa и VIb могут быть получены в одну стадию, например, способом, описанным в примерах 13 и 14. Возможно проведение катализируемой металлом наподобие палладия реакции сочетания производного терт-бутилдиметилоксиметилбромбензола с аминопиридином, замещенным производным бора, в том числе, например, 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридин-2-иламином. Соединение формулы Ха может быть получено, например, способом, описанным в примере 17. На первой стадии возможно осуществление конденсации аминопиридина, замещенного производным бора, в том числе, например, 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридин-2-иламина, с этил 2-бромацетатом. На второй стадии соединение подвергают реакции циклизации и хлорирования в присутствии хлорирующего агента наподобие оксихлорида фосфора, что приводит к соединению Ха. Соединения формул XIa и XIb могут быть получены по катализируемой металлом наподобие палладия реакции сочетания между, например, соединением Ха и производным трет-бутилдиметилоксиметилбромбензола, подобно описанному в примерах 17 и 18. Соединения формул IIa, IIb, IIc, IId, IIe, IIf, IIg, VIa, VIb, Xa, XIa и XIb были получены в состоянии порошков или масел, в виде оснований или солей, присоединения с кислотой. В таблице 1 приведены некоторые физико-химические характеристики данных промежуточных продуктов. В данной таблице в столбце "Соль/основание" "-" прочерк означает соединение в виде свободного основания, "HCl" означает соединение в виде хлоргидрата; соотношение в скобках представляет собой В следующих далее примерах описано получение некоторых соединений, соответствующих настоящему изобретению. Данные примеры не являются ограничительными и служат только для иллюстрации настоящего изобретения. Номера соединений, приводимых в качестве примеров, соответствуют номерам в таблице 2, приведенной далее и иллюстрирующей химические структуры некоторых соединений по изобретению. Используемая номенклатура представляет собой номенклатуру, соответствующую рекомендациямIUPAC (Международного союза по теоретической и прикладной химии, International Union of Pure andApplied Chemistry). Пример 1. 3-[2-(4-Хлорфенил)имидазо[1,2-а]пиридин-6-ил]-2-фторфенилметанол (в таблице соединение 1). 1.1. 6-Бром-2-(4-хлорфенил)имидазо[1,2-а]пиридин. В круглодонную колбу помещали 2,33 г 5-бромпиридин-2-иламина и 3,14 г 2-бром-1-(4-хлорфенил) этанона в 110 мл н-пропанола. Добавляли 1,58 г гидрокарбоната натрия. Раствор нагревали при 80 С в течение 16 ч, давали остыть до комнатной температуры и добавляли 400 мл воды. Осадок собирали фильтрацией, промывали водой и сушили в сушильном шкафу при пониженном давлении. Получили 2,89 г соединения. Спектр ЯМР 1 Н (ДМСО-d6,в м.д.): 7,4 (д, 1 Н); 7,5 (д,2 Н); 7,6 (д, 1 Н); 8,0 (д, 2 Н); 8,4 (с, 1 Н); 8,9 (с,-9 018266 1 Н) . М+Н=308. 1.2. 3-[2-(4-Хлорфенил)имидазо[1,2-а]пиридин-6-ил]-2-фторбензальдегид. В токе аргона в круглодонную колбу, содержащую смесь 5 мл ацетонитрила, 5 мл толуола и 6 мл 2 М раствора карбоната натрия, предварительно дегазированную током аргона, помещали 500 мг 6-бром 2-(4-хлорфенил)имидазо[1,2-а]пиридина, 473 мг 2-фтор-3-формилбензолбороновой кислоты и 93 мг тетракис(трифенилфосфин)палладия. Реакционную смесь нагревали при 70 С в течение 21 ч. После охлаждения реакционную смесь разбавляли этилацетатом и водой, затем органическую фазу отделяли, сушили и концентрировали при пониженном давлении. Остаток подвергали очистке хроматографией на силикагеле при элюировании смесью дихлорметана с этилацетатом в соотношении 98/2. Получили 324 мг соединения. Спектр ЯМР 1H (ДМСО-d6,в м.д.): 7,45-7,55 (м, 4 Н); 7,7 (д, 1 Н); 7,9 (м, 1 Н); 7,95-8,05 (м, 3 Н); 8,5(с, 1 Н); 8,9 (с, 1 Н); 10,35 (с, 1 Н). М+Н=351. 1.3. 3-[2-(4-Хлорфенил)имидазо[1,2-а]пиридин-6-ил]-2-фторфенилметанол. К 150 мг 3-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]-2-фторбензальдегида, растворенным в 20 мл метанола, по частям добавляли 162 мг боргидрида натрия. Затем смесь перемешивали при комнатной температуре в течение 2 ч, затем растворитель отгоняли при пониженном давлении. Остаток повторно растворяли в воде и дихлорметане, органическую фазу отделяли, сушили над сульфатом натрия и концентрировали при пониженном давлении. Остаток подвергали очистке хроматографией на силикагеле при элюировании смесью дихлорметана с метанолом в соотношении 98/2. Получили 87 мг соединения. Т.пл. 200-202 С. Спектр ЯМР 1 Н (ДМСО-d6,в м.д.): 4,65 (д, 2 Н); 5,35 (т, 1 Н); 7,35 (т, 1 Н); 7,4-7,6(м, 5 Н); 7,7 (д, 1 Н); 8,0 (д, 2 Н); 8,5 (с, 1 Н); 8,8 (с, 1 Н). М+Н=353. Пример 2. 1-3-[2-(4-Хлорфенил)имидазо[1,2-а]пиридин-6-ил]2-фторфенилэтанол (в таблице соединение 2). 170 мг 3-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]-2-фторбензальдегида (соединения, полученного по методике, описанной в примере 1.2) в токе аргона помещали в круглодонную колбу и растворяли в 30 мл тетрагидрофурана. Колбу охлаждали до 0 С на ледяной бане и по каплям добавляли 2,60 мл раствора метилмагнийбромида в дибутиловом эфире, предварительно разбавленного до 0,56 М. Раствор оставляли на ледяной бане при перемешивании в течение часа, затем добавляли 5 мл насыщенного водного раствора хлорида аммония. Органическую фазу отделяли, сушили над сульфатом натрия и отгоняли растворитель при пониженном давлении. Остаток подвергали очистке хроматографией на силикагеле при элюировании смесью дихлорметана с метанолом. Получили 64 мг соединения. Т.пл. 193-195 С. Спектр ЯМР 1H (ДМСО-d6,в м.д.): 1,4 (д, 3 Н); 5,1 (м, 1 Н); 5,35 (д, 1 Н); 7,35 (м,1 Н); 7,45-7,65 (м, 5 Н); 7,7 (д, 1 Н); 8,05 (д, 2 Н); 8,5 (с, 1 Н); 8,75 (с, 1 Н). М+Н=367. Пример 3. 3-[4-(2-Хлорфенил)имидазо[1,2-а]пиридин-6-ил]-2,6-дифторфенилметанол (в табл. соединение 3). 3.1. 3-[2-(4-Хлорфенил)имидазо[1,2-а]пиридин-6-ил]-2,6-дифторбензальдегид. В токе аргона в круглодонную колбу, содержащую смесь 5 мл ацетонитрила, 5 мл толуола и 6 мл 2 М раствора карбоната натрия, предварительно дегазированную током аргона, помещали 500 мг 6-бром 2-(4-хлорфенил)имидазо[1,2-а]пиридина (соединения, полученного по методике, описанной в примере 1.1), 364 мг 2,4-дифтор-3-формилбензолбороновой кислоты и 93 мг тетракис(трифенилфосфин)палладия. По истечении 24 ч нагрева при 75 С добавляли 60 мг 2,4-дифтор-3-формилбензолбороновой кислоты, 18 мг катализатора и смесь 2 мл ацетонитрила, 2 мл толуола и 2 мл 2 М раствора карбоната натрия. Нагрев при 75 С продолжали 2 ч. Реакционной смеси давали остыть до комнатной температуры и разбавляли ее этилацетатом и водой. Затем органическую фазу отделяли, сушили и концентрировали растворитель при пониженном давлении. Остаток подвергали очистке хроматографией на силикагеле при элюировании смесью дихлорметана с этилацетатом. Получили 340 мг соединения. Спектр ЯМР 1 Н (ДМСО-d6,в м.д.): 7,4-7,6 (м, 4 Н); 7,7 (д, 1 Н); 8,0-8,1 (м, 3 Н); 8,5 (с, 1 Н); 8,85 (с,1 Н); 10,35 (с, 1 Н). М+Н=369. 3.2. 3-[2-(4-Хлорфенил)имидазо[1,2-а]пиридин-6-ил]-2,6-дифторфенилметанол. К 150 мг 3-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]-2,6-дифторбензальдегида, растворенным в 20 мл метанола, по частям добавляли 154 мг боргидрида натрия. После этого смесь перемешивали при комнатной температуре в течение 3 ч, затем растворитель отгоняли при пониженном давлении. Остаток подвергали разделению в системе вода-дихлорметан, затем органическую фазу отделяли, сушили над сульфатом натрия и концентрировали при пониженном давлении. Остаток растирали с пентаном и собирали фильтрацией, затем сушили в сушильном шкафу при пониженном давлении. Получили 67 мг соединения. Т.пл. 214-216 С. Спектр ЯМР 1 Н (ДМСО-d6,в м.д.): 4,6 (д, 2 Н); 5,3 (м, 1 Н); 7,25 (м, 1 Н); 7,45 (д,1 Н); 7,55 (д, 2 Н); 7,6-7,7 (м, 2 Н); 8,0 (д, 2 Н); 8,5 (с, 1 Н); 8,75 (с, 1 Н). М+Н=371. Пример 4. 7-[2-(4-Хлорфенил)имидазо[1,2-а]пиридин-6-ил]-1,2,3,4-тетрагидронафталин-1-ол (в таблице соединение 8). 4.1. 2-(4-Хлорфенил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)имидазо[1,2-а]пиридин. В круглодонную колбу помещали 5,0 г 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридин-2 иламина и 5,30 г 2-бром-1-(4-хлорфенил)этанона в 150 мл н-пропанола. Добавляли 2,67 г гидрокарбоната натрия. Смесь нагревали при 80 С в течение 16 ч. После охлаждения реакционную смесь концентрировали при пониженном давлении. Получили 10,93 г соединения, использованного на следующих стадиях без дополнительной очистки. Спектр ЯМР 1H (ДМСО-d6,в м.д.): 1,35 (с, 12 Н); 7,35 (д, 1 Н); 7,5-7,6 (м, 3 Н); 7,95 (д, 2 Н); 8,45 (д,1 Н); 7,85 (с, 1 Н). М+Н=355. 4.2. Хлоргидрат (1:1) 2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-бороновой кислоты 7,93 г 2-(4 хлорфенил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)имидазо[1,2-а]пиридина растворяли в 200 мл ацетона и 100 мл воды; к полученному раствору по каплям при перемешивании добавляли 223 мл 1 н. соляной кислоты и перемешивали при комнатной температуре в течение 16 ч. Затем реакционную смесь концентрировали при пониженном давлении. Получили 4,78 г соединения, использованного на следующих стадиях без дополнительной очистки. Спектр ЯМР 1 Н (ДМСО-d6,в м.д.): 7,6-7,75 (м, 2 Н); 7,95 (м, 1 Н); 8,05-8,15 (м, 2 Н); 8,2 (м, 1 Н); 8,9(с, 1 Н); 9,1 (с, 1 Н). М+Н=273. 4.3. 7-[2-(4-Хлорфенил)имидазо[1,2-а]пиридин-6-ил]-3,4-дигидро-2 Н-нафталин-1-он. В круглодонную колбу помещали 5 мл ацетонитрила, 5 мл толуола и 6 мл 2 М раствора карбоната натрия и дегазировали током аргона. Добавляли 400 мг 2-(4-хлорфенил)имидазо[1,2-а]пиридин-6 бороновой кислоты, 320 мг 7-бром-3,4-дигидро-2H-нафталин-1-она и 75 мг тетракис(трифенилфосфин)палладия. Смесь нагревали при 75 С в течение 16 ч, затем давали остыть до комнатной температуры и подвергали разделению в системе этилацетат-вода. Органическую фазу отделяли, сушили и концентрировали растворитель при пониженном давлении. Остаток подвергали очистке хроматографией на силикагеле при элюировании смесью дихлорметана с ацетоном. Получили 238 мг соединения. Спектр ЯМР 1H (ДМСО-d6,в м.д.): 2,05 (м, 2 Н); 2,65 (м, 2 Н); 3,0 (м, 2 Н); 7,55 (м, 3 Н); 7,6-7,75 (м,2 Н); 7,95 (м, 1 Н); 8,05 (д, 2 Н); 8,2 (с, 1 Н); 8,45 (с, 1 Н); 9,0 (с, 1 Н). М+Н=373. 4.4. 7-[2-(4-Хлорфенил)имидазо[1,2-а]пиридин-6-ил]-1,2,3,4-тетрагидронафталин-1-ол. К 238 мг 7-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]-3,4-дигидро-2H-нафталин-1-она, растворенным в 25 мл метанола, по частям добавляли 241 мг боргидрида натрия. Смесь перемешивали при комнатной температуре в течение 2 ч, затем растворитель отгоняли при пониженном давлении. Остаток подвергали разделению в системе вода-этилацетат. Органическую фазу декантировали, сушили над сульфатом натрия и концентрировали при пониженном давлении. Остаток подвергали очистке хроматографией на силикагеле при элюировании смесью дихлорметана с метанолом. Получили 48 мг соединения. Т.пл. 232,3-233,7 С. Спектр ЯМР 1 Н (ДМСО-d6,в м.д.): 1,75 (м, 2 Н); 1,95 (м, 2 Н); 2,75 (м, 2 Н); 4,65 (м, 1 Н); 5,2 (м, 1 Н); 7,2 (м, 1 Н); 7,5 (м, 3 Н); 7,6 (м, 1 Н); 7,7 (м, 1 Н); 7,75 (м, 1 Н); 8,05 (д, 2 Н); 8,45 (с,1 Н); 8,85 (с, 1 Н). М+Н=375. Пример 5. 5-[2-(4-Хлорфенил)имидазо[1,2-а]пиридин-6-ил]-1,2,3,4-тетрагидронафталин-1-ол (в таблице соединение 9). 5.1. 5-Бром-3,4-дигидро-2 Н-нафталин-1-он. В круглодонную колбу помещали 2,21 г AlCl3, к которым в течение 10 мин добавляли 0,91 мл 3,4 дигидро-2H-нафталин-1-она и в течение 5 мин - 0,41 мл Br2; смесь нагревали при 80 С в течение 10 мин. Смеси давали остыть до комнатной температуры и добавляли к ней раствор, содержащий 20 г льда и 2,7 мл концентрированной соляной кислоты. Затем смесь разбавляли водой и диэтиловым эфиром. После этого органическую фазу отделяли, сушили и концентрировали при пониженном давлении. Остаток подвергали очистке с применением препаративной обратно-фазовой хроматографии. Получили 172 мг соединения. Спектр ЯМР 1 Н (ДMCO-d6,в м.д.): 2,1 (м, 2 Н); 2,65 (м, 2 Н); 2,95 (м, 2 Н); 7,35 (т, 1 Н); 7,9 (м, 2 Н). М+Н=226. 5.2. 5-[2-(4-Хлорфенил)имидазо[1,2-а]пиридин-6-ил]-3,4-дигидро-2 Н-нафталин-1-он. По той же методике, что и в примере 4.3, из 210 мг 2-(4-хлорфенил)имидазо[1,2-а]пиридин-6 бороновой кислоты (соединения, полученного по методике, описанной в примере 4.2), 168 мг 5-бром-3,4 дигидро-2H-нафталин-1-она и 39 мг тетракис(трифенилфосфин)палладия получили 300 мг 5-[2-(4 хлорфенил)имидазо[1,2-а]пиридин-6-ил]-3,4-дигидро-2H-нафталин-1-она. Соединение подвергали очистке хроматографией на силикагеле при элюировании смесью дихлорметана с метанолом. Получили 167 мг соединения. Спектр ЯМР 1 Н (ДМСО-d6,в м.д.): 2,0 (м, 2 Н); 2,65 (м, 2 Н); 2,9 (м, 2 Н); 7,35 (д, 1 Н); 7,45-7,55 (м,3 Н); 7,6-7,7 (м, 2 Н); 8,0-8,1 (м, 3 Н); 8,45 (с, 1 Н); 8,6 (с, 1 Н). М+Н=373. 5.3. 5-[2-(4-Хлорфенил)имидазо[1,2-а]пиридин-6-ил]-1,2,3,4-тетрагидронафталин-1-ол. К 167 мг 5-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]-3,4-дигидро-2H-нафталин-1-она, растворенным в 15 мл метанола, по частям добавляли 169 мг боргидрида натрия. Смесь перемешивали при комнатной температуре в течение 2 ч, затем растворитель отгоняли при пониженном давлении. Остаток подвергали разделению в системе вода-этилацетат. Органическую фазу декантировали, сушили над сульфатом натрия и концентрировали при пониженном давлении. Получили 106 мг соединения. Т.пл. 218,1-219, 6 С. Спектр ЯМР 1 Н (ДMCO-d6,в м.д.): 1,6-2,0 (м, 4 Н); 2,55-2,7 (м, 2 Н); 4,65 (м,1 Н); 5,2 (д, 1 Н); 7,2 (д, 1 Н); 7,25-7,35 (м, 2 Н); 7,5 (м, 3 Н); 7,6 (д, 1 Н); 8,05 (д, 2 Н); 8,4 (с, 1 Н); 8,5 (с, 1 Н). М+Н=375. Пример 6. 2-Фтор-3-[2-(3-метоксифенил)имидазо[1,2-а]пиридин-6-ил]фенилметанол (в табл. соединение 19). 6.1. 2-(3-Метоксифенил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)имидазо[1,2-а]пиридин. В круглодонную колбу помещали 5,00 г 2-бром-1-(3-метоксифенил)этанона и 4,80 г 5-(4,4,5,5 тетраметил-1,3,2-диоксаборолан-2-ил)пиридин-2-иламина в 220 мл н-пропанола и добавляли 2,57 г гидрокарбоната натрия. Реакционную смесь нагревали при 80 С в течение 20 ч, давали остыть и концентрировали при пониженном давлении. Остаток подвергали разделению в системе вода-этилацетат, органическую фазу декантировали, сушили над сульфатом магния и затем концентрировали растворитель. Получили 7,47 г соединения. Спектр ЯМР 1 Н (ДМСО-d6,в м.д.): 1,35 (с, 12 Н); 3,85 (с, 3 Н); 6,9 (д, 1 Н); 7,35-7,45 (м, 2 Н); 7,5-7,6(м, 3 Н); 8,45 (с, 1 Н); 8,8 (с, 1 Н). М+Н=351. 6.2. Хлоргидрат (1:1) 2-(3-метоксифенил)имидазо[1,2-а]пиридин-6-бороновой кислоты. 7,47 г 2-(3-метоксифенил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)имидазо[1,2-а]пиридина растворяли в 236 мл ацетона и 118 мл воды; к полученному раствору по каплям при перемешивании добавляли 213 мл 1 н соляной кислоты и перемешивали при комнатной температуре в течение 24 ч. Затем реакционную смесь концентрировали при пониженном давлении. Полученное твердое вещество растирали с диэтиловым эфиром и собирали фильтрацией, затем сушили в сушильном шкафу при 60 С и пониженном давлении. Получили 5,80 г соединения. Спектр ЯМР 1 Н (ДMCO-d6,в м.д.): 3,75 (с, 3 Н); 6,95 (д, 1 Н); 7,3-7,65 (м, 3 Н); 7,8 (д, 1 Н); 8,05 (д,1 Н); 8,75 (с, 1 Н); 8,9 (с, 1 Н). М+Н=325. 6.3. (3-Бром-2-фторфенил)метанол. 2,00 г 3-бром-2-фторбензальдегида растворяли в 98 мл метанола; к полученному раствору по частям добавляли 560 мг боргидрида натрия. Смесь перемешивали при комнатной температуре в течение 2 ч,затем растворитель отгоняли при пониженном давлении. Остаток подвергали разделению в системе вода-этилацетат, органическую фазу отделяли, сушили и концентрировали при пониженном давлении. Остаток подвергали очистке хроматографией на силикагеле при элюировании смесью дихлорметана с метанолом. Получили 1,56 г соединения. Спектр ЯМР 1 Н (ДМСО-d6,в м.д.): 4,60 (д, 2 Н); 5,4 (т, 1 Н); 7,15 (м, 1 Н); 7,5 (м, 1 Н); 7,6 (м, 1 Н). М+Н=206. 6.4. 2-Фтор-3-[2-(3-метоксифенил)имидазо[1,2-а]пиридин-6-ил]фенилметанол. 300 мг (3-бром-2-фторфенил)метанола растворяли в 15 мл толуола и 5 мл этанола и дегазировали током аргона в течение 10 мин. Затем к раствору добавляли 101 мг тетракис(трифенилфосфин)палладия,580 мг 2-(3-метоксифенил)имидазо[1,2-а]пиридин-6-бороновой кислоты и 5 мл 2 М раствора карбоната натрия. Смесь нагревали при 80 С в течение 16 ч, затем, после охлаждения до комнатной температуры,концентрировали при пониженном давлении. Остаток подвергали разделению в системе вода-этилацетат,затем органическую фазу отделяли, сушили и концентрировали при пониженном давлении. Остаток подвергали очистке хроматографией на силикагеле при элюировании смесью дихлорметана с этилацетатом. Получили 254 мг соединения. Т.пл. 143-144 С. Спектр ЯМР 1 Н (ДМСО-d6,в м.д.): 3,85 (с, 3 Н); 4,65 (д, 2 Н); 5,35 (т, 1 Н); 6,95 (д,1 Н); 7,3-7,4 (м, 2 Н); 7,45 (д, 1 Н); 7,5-7,65 (м, 4 Н); 7,7 (д, 1 Н); 8,5 (с, 1 Н); 8,75 (с, 1 Н). М+Н=349. Пример 7. 1-3-[2-(4-Хлорфенил)имидазо[1,2-а]пиридин-6-ил]-4-фторфенилэтанол (в таблице соединение 22). 7.1. 3-[2-(4-Хлорфенил)имидазо[1,2-а]пиридин-6-ил]-4-фторбензальдегид. В токе аргона в круглодонную колбу, содержащую смесь 8 мл ацетонитрила, 8 мл толуола и 10 мл 0,5 М раствора карбоната натрия, предварительно дегазированную током аргона, помещали 800 мг 6 бром-2-(4-хлорфенил)имидазо[1,2-а]пиридина, 437 мг 2-фтор-5-формилбензолбороновой кислоты и 150 мг тетракис(трифенилфосфин)палладия. Смесь нагревали при 75 С в течение 5 ч, затем после охлаждения разбавляли смесью воды и этилацетата. Органическую фазу отделяли, сушили и концентрировали при пониженном давлении. Остаток подвергали очистке хроматографией на силикагеле при элюировании смесью дихлорметана с этилацетатом. Получили 486 мг соединения. Спектр ЯМР 1 Н (ДMCO-d6,в м.д.): 7,65-7,75 (м, 4 Н); 8,05 (д, 1 Н); 8,15-8,25 (м, 4 Н); 8,35 (д, 1 Н); 8,7 (с, 1 Н). М+Н=351. 7.2. 1-3-[2-(4-Хлорфенил)имидазо[1,2-а]пиридин-6-ил]-4-фторфенилэтанол. 470 мг 3-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]-4-фторбензальдегида помещали в круглодонную колбу и растворяли в 90 мл диэтилового эфира и 45 мл тетрагидрофурана. Раствор охлаждали до 0 С на ледяной бане и по каплям добавляли 4 мл 1 М раствора метилмагнийбромида в дибутиловом эфи- 12018266 ре. Смесь перемешивали на ледяной бане в течение 1 ч 30 мин и добавляли 22 мл насыщенного водного раствора хлорида аммония. Органическую фазу отделяли, сушили над сульфатом магния и концентрировали при пониженном давлении. Полученный остаток подвергали очистке хроматографией на силикагеле при элюировании смесью дихлорметана с метанолом. Получили 401 мг соединения. Т.пл. 180-182 С. Спектр ЯМР 1 Н (ДMCO-d6,в м.д.): 1,55 (д, 3 Н); 5,0 (кв, 1 Н); 7,15-7,25 (м, 1 Н); 7,3-7,6 (м, 6 Н); 7,75 (д, 1 Н); 7,85-8,0 (м, 3 Н); 8,4 (с, 1 Н). М+Н=367. Пример 8. (+)-1-3-[2-(4-Хлорфенил)имидазо[1,2-а]пиридин-6-ил]-4-фторфенилэтанол (в табл. соединение 29). 170 мг рацемического 1-3-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]-4-фторфенилэтанола(соединения, полученного на стадии 7.2) пропускали через колонку ChiralPAK AD LOT CFB03 (20 мкм,50350 мм). Элюирование осуществляли смесью метанола, этанола и гептана в соотношении 20/30/50. Получили 60 мг вещества с наименьшим временем удерживания.D: -13,2 (с=0,318, метанол); -13,5 (с=0,308, ДМСО). Т.пл. 184-185 С. Спектр ЯМР 1 Н (ДМСО-d6,в м.д.): 1,4 (с, 3 Н); 4,8 (м, 1 Н); 5,25 (с, 1 Н); 7,3 (т, 1 Н); 7,4-7,55 (м, 4 Н); 7,6 (д, 1 Н); 7,7 (д, 1 Н); 8,0 (д, 2 Н); 8,5 (с, 1 Н); 8,8 (с, 1 Н). Пример 10. 2-[2-(2,4-Дифторфенил)имидазо[1,2-а]пиридин-6-ил]-6-фторфенилметанол (в таблице соединение 31). 10.1. 2-(2,4-Дифторфенил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)имидазо[1,2-а]пиридин. По методике, описанной для стадии 4.1, из 4,76 г 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2 ил)пиридин-2-иламина и 5,09 г 2-бром-1-(2,4-дифторфенил)этанона получили 4,84 г соединения. Спектр ЯМР 1 Н (ДMCO-d6,в м.д.): 1,35 (с, 12 Н); 7,25 (т, 1 Н); 7,35-7,45 (м, 2 Н); 7,6 (д, 1 Н); 8,258,35 (м, 1 Н); 8,45 (с, 1 Н); 8,9 (с, 1 Н) М+=356. 10.2. 2-[2-(2,4-Дифторфенил)имидазо[1,2-а]пиридин-6-ил]-6-фторфенилметанол. В пробирке для работы под давлением в токе аргона дегазировали смесь 9,5 мл ДМЭ и 3,5 мл 2 М раствора карбоната натрия, затем добавляли соединение, полученное на стадии 10.1, 0,29 г 2-бром-6 фторфенилметанола и 81 мг тетракис(трифенилфосфин)палладия; пробирку закрывали и помещали в термостатируемую баню с температурой 100 С на 24 ч при перемешивании. Реакционную смесь охлаждали, отгоняли растворитель при пониженном давлении и разделяли остаток в системе водадихлорметан. Осадок, образовавшийся между двумя фазами, отфильтровывали, сушили и подвергали очистке хроматографией на силикагеле при элюировании смесью дихлорметана с метанолом. Получили 190 мг соединения, которое подвергали перекристаллизации из смеси 2-пропанола с диизопропиловым эфиром. Получили 117 мг соединения. Спектр ЯМР 1 Н (ДМСО-d6,в м.д.): 4,45 (д, 2 Н); 5,25 (т, 1 Н); 7,2-7,35 (м, 3 Н); 7,4-7,55 (м, 3 Н); 7,7(д, 1 Н); 8,35 (м, 2 Н); 8,75 (с, 1 Н). Т.пл. 216,5-217,5 С. Пример 11. 2-3-[2-(4-Хлорфенил)имидазо[1,2-а]пиридин-6-ил]-2,6-дифторфенилпропан-2-ол (в таблице соединение 35). 11.1. 2-(3-Бром-2,6-дифторфенил)пропан-2-ол. В токе аргона в круглодонную колбу помещали 6,3 мл 2 М раствора диизопропиламида лития в тетрагидрофуране (предварительно разбавленного до 0,86 М) и 5 мл тетрагидрофурана. Смесь охлаждали до-78 С и по каплям добавляли 0,59 мл 1-бром-2,4-дифторбензола. Смесь перемешивали при -78 С в течение 30 мин и добавляли четыре порции ацетона по 0,5 мл. После возвращения температуры реакционной смеси к комнатной ее выливали в 20 мл 1 н. соляной кислоты. Затем органическую фазу, экстрагированную диэтиловым эфиром, два раза промывали 20 мл воды, отделяли, сушили над сульфатом магния и концентрировали при пониженном давлении. Полученное масло подвергали очистке хроматографией на силикагеле при элюировании смесью гептана с этилацетатом. Получили 0,50 г соединения. Спектр ЯМР 1H (ДМСО-d6,в м.д.): 1,6 (м, 6 Н); 5,4 (с, 1 Н); 6,95-7,15 (м, 1 Н); 7,6-7,75 (м, 1 Н). 11.2. 2-3-[2-(4-Хлорфенил)имидазо[1,2-а]пиридин-6-ил]-2,6-дифторфенилпропан-2-ол. 500 мг соединения, полученного на стадии 11.1, растворяли в 21 мл толуола и 7 мл этанола и дегазировали в токе аргона в течение 10 мин. К полученному раствору затем добавляли 138 мг тетракис(трифенилфосфин)палладия, 799 мг 2-(4-хлорфенил)имидазо[1.2-а]пиридин-6-бороновой кислоты(соединения, полученного по методике, описанной в примере 4.2) и 5 мл 2 М раствора карбоната натрия. Смесь нагревали при 80 С в течение 1 ч 30 мин, затем после охлаждения до комнатной температуры концентрировали при пониженном давлении. Остаток подвергали разделению в системе вода-этилацетат,затем органическую фазу отделяли, сушили и концентрировали при пониженном давлении. Остаток под- 13018266 вергали очистке хроматографией на силикагеле при элюировании смесью гептана с этилацетатом. Полученное твердое вещество растирали с диизопропиловым эфиром, собирали фильтрацией и затем сушили в сушильном шкафу при пониженном давлении. Получили 383 мг соединения. Т.пл. 191-192 С. Спектр ЯМР 1 Н (ДМСО-d6,в м.д.): 1,65 (с, 6 Н); 5,3 (с, 1 Н); 7,15 (м, 1 Н); 7,4 (м,1 Н); 7,55 (м, 3 Н); 7,7 (м, 1 Н); 8,05 (д, 2 Н); 8,5 (с, 1 Н); 8,75 (с, 1 Н). Пример 12. 2-[2-Хлор-3-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]фенил]пропан-2-ол (в таблице соединение 66). 12.1. 3-Бром-2-хлор-N-метокси-N-метилбензамид. В круглодонную колбу помещали 500 мг 3-бром-2-хлорбензойной кислоты в 12,5 мл тетрагидрофурана. Реакционную смесь охлаждали до 0 С на ледяной бане, затем к ней добавляли 228 мг хлоргидратаN,О-диметилгидроксиламина, 814 мг хлоргидрата 1-(3-диметиламинопропил)-3-этилкарбодиимида и 0,21 мл пиридина. Затем реакционную смесь перемешивали при комнатной температуре в течение 16 ч,после этого растворитель отгоняли при пониженном давлении. Остаток подвергали разделению в системе вода-дихлорметан. Отделенную органическую фазу затем один раз промывали насыщенным раствором хлорида аммония и один раз - насыщенным раствором гидрокарбоната натрия, затем сушили над сульфатом магния и концентрировали при пониженном давлении. Получили 500 мг соединения. Спектр ЯМР 1 Н (ДМСО-d6,в м.д.): 3,3 (с, 3 Н); 3,45 (с, 3 Н); 7,35 (т, 1 Н); 7,5 (д, 1 Н); 7,85 (д, 1 Н). 12.2. 1-(3-Бром-2-хлорфенил)этанон. 0,5 г соединения, полученного на стадии 12.1, помещали в круглодонную колбу и растворяли в 18 мл тетрагидрофурана. Раствор охлаждали до 0 С на ледяной бане и по каплям добавляли 2,7 мл 3 М раствора метилмагнийбромида в этиловом эфире (предварительно разбавленного до 2 М). Раствор оставляли перемешиваться при 0 С в течение 1 ч, затем при комнатной температуре в течение 2 ч. После этого реакционную смесь гидролизовали при 0 С водой и насыщенным раствором хлорида аммония, затем экстрагировали этилацетатом. Органическую фазу отделяли, промывали насыщенным раствором хлорида натрия, сушили над сульфатом магния и концентрировали при пониженном давлении. Получили 0,380 г соединения. ЯМР 1 Н (ДМСО-d6,в м.д.): 2,6 (с, 3 Н); 7,4 (т, 1 Н); 7,65 (д, 1 Н); 7,95 (д, 1 Н). 12.3. 1-[2-Хлор-3-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил)фенил]этанон. 380 мг соединения, полученного на стадии 12.2, растворяли в 16 мл толуола и 8 мл этанола и дегазировали током аргона в течение 10 мин. Затем к раствору добавляли 113 мг тетракис(трифенилфосфин) палладия, 654 мг 2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-бороновой кислоты (соединения, полученного по методике, описанной в примере 4.2) и 4,07 мл 2 М раствора карбоната натрия. Реакционную смесь нагревали при 80 С в течение 2 ч, затем после охлаждения до комнатной температуры концентрировали при пониженном давлении. Остаток подвергали разделению в системе вода-этилацетат. Органическую фазу декантировали, 2 раза промывали водой и 2 раза - насыщенным раствором хлорида натрия, сушили над сульфатом магния и концентрировали при пониженном давлении. Остаток подвергали очистке хроматографией на силикагеле при элюировании смесью дихлорметана с этилацетатом. Полученное твердое вещество растирали с диизопропиловым эфиром, собирали фильтрацией и затем сушили в сушильном шкафу при пониженном давлении. Получили 259 мг соединения. ЯМР 1 Н (ДМСО-d6,в м.д.): 2,65 (с, 3 Н); 7,35 (д, 1 Н); 7,5-7,65 (м, 3 Н); 7,7 (м, 3 Н); 8,05 (д, 2 Н); 8,5(с, 1 Н); 8,7 (с, 1 Н). 12.4. 2-[2-Хлор-3-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил)фенил]пропан-2-ол. 150 мг соединения, полученного на стадии 12.3, в токе азота помещали в круглодонную колбу и растворяли в смеси 26 мл безводного диэтилового эфира и 13 мл безводного тетрагидрофурана. Раствор охлаждали до 0 С на ледяной бане и по каплям добавляли 0,59 мл 3 М раствора метилмагнийбромида в этиловом эфире (предварительно разбавленного до 2 М). Раствор оставляли перемешиваться при 0 С в течение 1 ч, затем при комнатной температуре в течение 2 ч. После этого реакционную смесь гидролизовали при 0 С водой и насыщенным раствором хлорида аммония. После этого органическую фазу отделяли, сушили над сульфатом магния и концентрировали при пониженном давлении. Остаток подвергали очистке хроматографией на силикагеле при элюировании смесью дихлорметана с этилацетатом. Полученное твердое вещество растирали с диизопропиловым эфиром, собирали фильтрацией и затем сушили в сушильном шкафу при пониженном давлении. Получили 25 мг соединения. Т.пл. 230-231 С. ЯМР 1 Н (ДМСО-d6,в м.д.): 1,65 (с, 6 Н); 5,35 (с, 1 Н); 7,3 (д, 1 Н); 7,35-7,45 (м, 2 Н); 7,55 (д, 2 Н); 7,65 (д, 1 Н); 7,95 (д, 1 Н); 8,05 (д, 2 Н); 8,45 (с, 1 Н); 8,6 (с, 1 Н). Пример 13. 1-[2-Хлор-3-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил)фенил]этанол (в таблице соединение 67). К 100 мг соединения, полученного на стадии 12.3, растворенным в 13 мл метанола и охлажденным до 0 С, по частям добавляли 99 мг боргидрида натрия. Смесь перемешивали при комнатной температуре в течение 1 часа, затем растворитель отгоняли при пониженном давлении. Остаток подвергали разделению в системе вода-этилацетат. Органическую фазу декантировали, сушили над сульфатом магния и концентрировали при пониженном давлении. Остаток подвергали очистке хроматографией на силикаге- 14018266 ле при элюировании смесью дихлорметана с этилацетатом. Полученное твердое вещество растирали с диизопропиловым эфиром, собирали фильтрацией и затем сушили в сушильном шкафу при пониженном давлении. Получили 73 мг соединения. Т.пл. 170-172 С. ЯМР 1H (ДМСО-d6,в м.д.): 1,4 (д, 3 Н); 5,15 (м, 1 Н); 5,45 (д, 1 Н); 7,3 (д, 1 Н); 7,4(д, 1 Н); 7,45-7,55 (м, 3 Н); 7,65 (д, 1 Н); 7,75 (д, 1 Н); 8,05 (д, 2 Н); 8,45 (с, 1 Н); 8,6 (с, 1 Н). Пример 14. 2-Фтор-6-[2-(4-фторфенил)имидазо[1,2-а]пиридин-6-ил]фенилметанол (в таблице соединеие 53). 14.1. (2-Бром-6-фторфенил)метанол. 20 г (0,098 моль) 2-бром-6-фторбензальдегида растворяли в 500 мл метанола и охлаждали на ледяной бане; затем к ним по частям добавляли 3,72 г (0,098 моль) боргидрида натрия. Смесь перемешивали на холоде в течение 1 ч, затем растворитель отгоняли при пониженном давлении. Остаток подвергали разделению в системе вода-дихлорметан, органическую фазу отделяли, сушили и концентрировали при пониженном давлении. Остаток кристаллизовали из пентана. Получили 18,1 г соединения. ЯМР 1H (CDCl3,в м.д.): 2,15 (т, 1 Н); 4,95 (д, 2 Н); 7,05-7,3 (м, 2 Н); 7,45 (д, 1 Н). 14.2. (2-Бром-6-фторбензилокси)-трет-бутилдиметилсилан. В круглодонной колбе объемом 500 мл растворяли 15,7 г (0,076 моль) соединения, полученного на предыдущей стадии, в 230 мл ТГФ, добавляли 7,8 г (0,115 моль) имидазола, затем 13,8 г (0,092 моль) трет-бутилдиметилхлорсилана и перемешивали реакционную смесь в течение 16 ч. Затем растворитель отгоняли при пониженном давлении, осадок подвергали разделению в системе вода-диэтиловый эфир,органическую фазу декантировали, промывали водой и сушили ее над сульфатом натрия. После отгонки растворителя получили 25 г масла. ЯМР 1H (CDCl3,в м.д.): 0,0 (с, 6 Н); 0,8 (с, 9 Н); 4,7 (с, 2 Н); 6,8-7,05 (м, 2 Н); 7,25 (д, 1 Н). 14.3. 5-[2-(трет-Бутилдиметилсиланилоксиметил)-3-фторфенил]пиридин-2-иламин. 6,4 г соединения, полученного на стадии 14.2, 4,40 г 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2 ил)пиридин-2-иламина, 30 мг 2 М раствора карбоната натрия и 816 мг [1,1'-бис(дифенилфосфино)ферроцен]дихлоропалладия растворяли в 80 мл N,N-диметилформамида и в токе аргона помещали в круглодонную колбу. Смесь нагревали 2 ч при 80 С. После охлаждения до комнатной температуры растворители отгоняли при пониженном давлении, остаток подвергали разделению в двухфазной системе водаэтилацетат и удаляли нерастворимую фракцию фильтрацией на целите. Органическую фазу декантировали, промывали насыщенным водным раствором хлорида натрия и сушили над сульфатом натрия. Соединение подвергали хроматографической очистке при элюировании смесью дихлорметана с метанолом. Получили 4,58 г масла. ЯМР 1 Н (CDCl3,в м.д.): 0 (с, 6 Н); 0,8 (с, 9 Н); 4,4 (с, 2 Н); 6,05 (с, 2 Н); 6,45 (д, 1 Н); 7,05 (т, 1 Н); 7,35-7,45 (м, 2 Н); 8,0 (с, 1 Н). М+Н=351 не хватает 1 Н. 14.4. 6-[2-(трет-Бутилдиметилсиланилоксиметил)-3-фторфенил]-2-(4-фторфенил)имидазо[1,2-а]пиридин. В пробирке для микроволновой обработки взвешивали 58 мг (0,7 ммоль) бикарбоната натрия. К ним добавляли 83 мг (0,25 ммоль) соединения, полученного на стадии 14.3, растворенные в 2 мл пропан-1 ола, затем 0,375 ммоль 1-(4-фторфенил)-2-бромэтанона, растворенные в 1 мл пропан-1-ола. Пробирку закрывали, затем выдерживали при перемешивании при 80 С в течение 16 ч. Реакционную смесь охлаждали до комнатной температуры и добавляли к ней 200 мг пропантиола на диоксиде кремния (Biotage SiThiol); смесь выдерживали 6 ч при комнатной температуре при перемешивании, затем фильтровали и выпаривали фильтрат при пониженном давлении. Соединение использовали на следующей стадии без дополнительной очистки. 14.5. 2-Фтор-6-[2-(4-фторфенил)имидазо[1,2-а]пиридин-6-ил]фенилметанол. Неочищенное соединение, полученное на стадии 14.4, растворяли в 5 мл ТГФ, содержащем 0,5 ммоль гидрата фторида тетрабутиламмония. Смесь перемешивали 16 ч при комнатной температуре, затем растворитель отгоняли при пониженном давлении. Соединение подвергали хроматографической очистке. Получили 24,9 мг соединения. ЯМР 1 Н (ДМСО-d6,в м.д.): 4,45 (д, 2 Н); 5,3 (т, 1 Н); 7,3 (м, 4 Н); 7,4-7,5 (м, 2 Н); 7,65 (д, 1 Н); 8,05(м, 2 Н); 8,45 (с, 1 Н); 8,65 (с, 1 Н). Пример 15. 3-[2-(3,4-Дифторфенил)имидазо[1,2-а]пиридин-6-ил]-2,6-дифторфенилметанол (в таблице соединение 40). 15.1. (3-Бром-2,6-дифторфенил)метанол. 20 г 3-бром-2,6-дифторбензальдегида растворяли в 450 мл метанола и охлаждали на ледяной бане; затем к ним по частям добавляли 3,42 г боргидрида натрия. Смесь перемешивали при комнатной температуре в течение 1 ч, затем растворитель отгоняли при пониженном давлении. Остаток подвергали разделению в системе вода-дихлорметан, органическую фазу отделяли, сушили и концентрировали при пониженном давлении. Остаток кристаллизовали в н-пентане. Получили 14,6 г соединения. Спектр ЯМР 1 Н (CDCl3,в м.д.): 2,0 (с, 1 Н); 4,9 (с, 2 Н); 6,85-7,0 (м, 1 Н); 7,5-7,65 (м, 1 Н). 15.2. (3-Бром-2,6-дифторбензилокси)трет-бутилдиметилсилан. 11,15 г соединения, полученного на стадии 15.1, растворяли в 150 мл ТГФ, добавляли 5,1 г имидазола, затем 9,04 г хлор-трет-бутилдиметилсилана и перемешивали смесь при комнатной температуре в течение 24 ч. Затем растворитель отгоняли, остаток подвергали разделению в системе вода-диэтиловый эфир, органическую фазу декантировали, промывали водой и сушили над сульфатом натрия. Растворитель отгоняли при пониженном давлении. Получили 17,5 г масла. Спектр ЯМР 1 Н (CDCl3,в м.д.): 0,0 (с, 6 Н); 0,8 (с, 9 Н); 4,65 (с, 2 Н); 6,65-6,7 (м, 1 Н); 7,3-7,4 (м, 1 Н). 15.3. 5-[3-(трет-Бутилдиметилсиланилоксиметил)-2,4-дифторфенил]пиридин-2-иламин. 6,7 г соединения, полученного на стадии 15.2, 4,40 г 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2 ил)пиридин-2-иламина, 30 мл 2 М раствора карбоната натрия и 816 мг [1,1'-бис(дифенилфосфино)ферроцен]дихлоропалладия растворяли в 80 мл N,N-диметилформамида и в токе аргона помещали в круглодонную колбу. Смесь нагревали 2 ч при 80 С. После охлаждения до комнатной температуры растворители отгоняли при пониженном давлении, остаток подвергали разделению в системе вода-этилацетат и удаляли нерастворимую фракцию фильтрацией на целите. Органическую фазу декантировали, промывали насыщенным водным раствором хлорида натрия и сушили над сульфатом натрия. Соединение подвергали хроматографической очистке при элюировании смесью дихлорметана с метанолом. Получили 4,25 г твердого вещества белого цвета. ЯМР 1 Н (ДМСО-d6,в м.д.): 0 (с, 6 Н); 0,8 (с, 9 Н); 4,4 (с, 2 Н); 6,05 (с, 2 Н); 6,45 (д, 1 Н); 7,05 (т, 1 Н); 7,35-7,45 (м, 2 Н); 8,0 (с, 1 Н). М+Н=351. 15.4. 5-[3-(трет-Бутилдиметилсиланилоксиметил)-2,4-дифторфенил]-2-(3,4-дифторфенил)имидазо[1,2-а]пиридин. В пробирке для микроволновой обработки взвешивали 58,8 мг (0,7 ммоль) бикарбоната натрия. К ним добавляли 87,5 мг (0,25 ммоль) соединения, полученного на стадии 15.3, растворенные в 2 мл пропан-1-ола, затем 0,375 ммоль 2-бром-1-(3,4-дифторфенил)этанона, растворенные в 1 мл пропан-1-ола. Пробирку закрывали, затем в течение 16 ч выдерживали при перемешивании при 80 С. После охлаждения реакционной смеси до комнатной температуры к ней добавляли 200 мг пропантиола на диоксиде кремния (Biotage Si-Thiol); смесь выдерживали при комнатной температуре при перемешивании 6 ч, затем фильтровали. Остаток дважды промывали 2 мл пропан-1-ола, затем фильтрат выпаривали. Соединение использовали на следующей стадии без дополнительной очистки. 15.5. 3-[2-(3,4-Дифторфенил)имидазо[1,2-а]пиридин-6-ил]-2,6-дифторфенилметанол. Неочищенное соединение, полученное на стадии 15.4, растворяли в 5 мл ТГФ, содержащем 0,5 ммоль гидрата фторида тетрабутиламмония. Смесь перемешивали 16 ч при комнатной температуре, затем растворитель отгоняли при пониженном давлении. Соединение подвергали хроматографической очистке. Получили 49,6 мг соединения. ЯМР 1 Н (ДМСО-d6,в м.д.): 4,6 (д, 2 Н); 5,35 (т, 1 Н); 7,25 (т, 1 Н); 7,45 (д, 1 Н); 7,5-7,6 (м, 1 Н); 7,67,7 (м, 2 Н); 7,8-7,85 (м, 1 Н); 7,95-8,05 (м, 1 Н); 8,5 (с, 1 Н); 8,75 (с, 1 Н). Пример 16. 2-[2-(4-Хлорфенил)имидазо[1,2-а]пиридин-6-ил]-6-фторфенилметанол (в таблице соединение 68). 16.1. 6-[2-трет-Бутилдиметилсиланилоксиметил)-3-фторфенил]-2-(4-хлорфенил)имидазо[1,2-а]пиридин. В трехгорлую колбу объемом 100 мл, снабженную магнитной мешалкой и поддерживаемую в атмосфере азота, помещали 1,2 г (3,61 ммоль) соединения, полученного на стадии 14.3, 0,94 г (3,97 ммоль) 2 бром-(4-хлорфенил)этанона, 0,42 г (5,05 ммоль) гидрокарбоната натрия и 35 мл абсолютного этанола. После перемешивания при 80 С в течение 18 ч реакционную смесь доводили до комнатной температуры,концентрировали при пониженном давлении и затем разбавляли 50 мл воды и 100 мл CH2Cl2. Органическую фазу декантировали и сушили над сульфатом натрия. Твердое вещество, полученное после отгонки растворителя, подвергали очистке хроматографией на колонке с силикагелем при элюировании смесью дихлорметана с ацетоном. Таким путем получили 1,47 г ожидаемого продукта. ЯМР 1 Н (ДМСО-d6,в м.д.): 0,0 (с, 6 Н); 0,8 (с, 9 Н); 4,5 (д, 2 Н); 7,05 (м, 2 Н); 7,3 (м, 5 Н); 7,55 (д, 1 Н); 7,75 (с, 1 Н); 7,85 (д, 1 Н); 8,35 (с, 1 Н). 16.2. 2-[2-(4-Хлорфенил)имидазо[1,2-а]пиридин-6-ил]-6-фторфенилметанол. К раствору 1,4 г (3 ммоль) соединения, полученного на стадии 16.1, в 50 мл ТГФ, поддерживаемому в инертной атмосфере при комнатной температуре и при перемешивании, добавляли 1,57 г (5,99 ммоль) фторида тетрабутиламмония. После 1 ч реакции при комнатной температуре растворитель отгоняли при пониженном давлении. Остаток разбавляли 20 мл воды и 50 мл дихлорметана. Водную фазу декантировали и экстрагировали 220 мл дихлорметана. Объединенные органические фазы трижды промывали 20 мл воды, сушили над сульфатом натрия и затем концентрировали при пониженном давлении. Выделившееся твердое вещество подвергали очистке хроматографией на колонке с силикагелем при элюировании смесью дихлорметана с метанолом. Полученное твердое вещество перекристаллизовывали из абсолютного этилового спирта. Образовавшиеся кристаллы отфильтровывали и затем сушили при 100 С и пониженном давлении. Получили 0,60 г ожидаемого продукта. ЯМР 1 Н (ДМСО-d6,в м.д.): 4,45 (д, 2 Н); 5,3 (т, 1 Н); 7,3 (м, 2 Н); 7,55-7,4 (м, 4 Н); 7,7 (д, 1 Н); 8,05 (д,- 16018266(в таблице соединение 69). В круглодонную колбу объемом 50 мл помещали 0,4 г (1,13 ммоль) соединения, полученного на стадии 16.2, 0,47 г (3,39 ммоль) 1-бром-2-метоксиэтана и 3,28 г (22,6 ммоль) 40% фторида калия на оксиде алюминия. Смесь разбавляли 10 мл ацетонитрила и 10 мл N,N-диметилформамида и затем перемешивали при 80 С в течение 4 ч. По истечении данного времени охлажденную смесь отфильтровывали. Растворитель отгоняли при пониженном давлении; полученный остаток подвергали очистке хроматографией на колонке с силикагелем при элюировании смесью ацетона с дихлорметаном. Твердое вещество, полученное после отгонки растворителя при пониженном давлении, промывали кипящим изопропиловым эфиром, фильтровали на холоду и затем сушили при 100 С при пониженном давлении. Таким путем было выделено 120 мг ожидаемого продукта. ЯМР 1 Н (ДМСО-d6,в м.д.): 3,45 (с, 3 Н); 3,65 (т, 2 Н); 3,75 (т, 2 Н); 4,5 (с, 2 Н); 7,15 (м, 1 Н); 7,25 (д,1 Н); 7,35 (д, 1 Н); 7,45 (м, 3 Н); 7,7 (д, 1 Н); 7,95 (м, 3 Н); 8,65 (с, 1 Н). Т.пл. 104-105 С. Пример 18. Получение соединений 70-81. 18.1. Бромгидрат этил[2-имино-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-2H-пиридин-1 ил]ацетата. 5,0 г 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридин-2-иламина, растворенных в 7,6 мл этил-2-бромацетата, помещали в круглодонную колбу и перемешивали смесь при комнатной температуре в течение 20 ч. Образовывался осадок, который собирали фильтрацией, промывали диэтиловым эфиром и затем этанолом и сушили в сушильном шкафу при пониженном давлении. Получили 8,78 г соединения. Спектр ЯМР 1 Н (ДМСО-d6,в м.д.): 1,3 (м, 15 Н-недостоверно); 4,1-4,25 (м, 2 Н); 5,2 (с, 2 Н); 7,1 (д,1 Н); 8,0 (д, 1 Н); 8,3 (с, 1 Н); 9,0 (с, 1 Н). М+Н=388. 18.2. 2-Хлор-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)имидазо[1,2-а]пиридин (промежуточное соединение Ха). В круглодонную колбу помещали 8,7 8 г соединения, полученного по методике, описанной в примере 18.1, растворенные в 20 мл POCl3. Реакционную смесь нагревали при 105 С в течение 16 ч, охлаждали до комнатной температуры и концентрировали при пониженном давлении. Остаток подвергали разделению в системе дихлорметан-вода при 0 С и добавляли 30% водный раствор NH4OH до щелочного рН. Органическую фазу отделяли, сушили над сульфатом магния и концентрировали при пониженном давлении. Получили 4,3 г соединения. Т.пл. 115-120 С. Спектр ЯМР 1 Н (ДМСО-d6,в м.д.): 1,35 (м, 12 Н); 7,4 (д, 1 Н); 7,5 (д, 1 Н); 8,1 (с,1 Н); 8,85 (с, 1 Н). М+Н=279. 18.3. 6-[2-трет-Бутилдиметилсиланилоксиметил)-3-фторфенил]-2-хлоримидазо[1,2-а]пиридин. В токе аргона дегазировали 100 мл смеси ТГФ с водой в соотношении 85/15, затем добавляли 5,3 г соединения, полученного в примере 9.2, 6,07 г 2-хлор-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2 ил)имидазо[1,2-а]пиридина, полученного согласно примеру 18.2, 18,6 г карбоната цезия и 466 мг [1,1'бис(дифенилфосфино)ферроцен]дихлоропалладия. Смесь перемешивали в течение 2 ч при 80 С в термостатируемой бане. После охлаждения до комнатной температуры растворители отгоняли при пониженном давлении. Остаток подвергали разделению в системе вода-диэтиловый эфир. Твердую фракцию удаляли фильтрацией. Органическую фазу, дважды промытую насыщенным раствором хлорида натрия, затем сушили над сульфатом натрия и концентрировали при пониженном давлении. Полученный остаток подвергали очистке хроматографией на силикагеле при элюировании смесью дихлорметана с метанолом. Полученное твердое вещество растирали с пентаном, собирали фильтрацией и затем сушили в сушильном шкафу при пониженном давлении. Получили 4,74 г соединения. ЯМР 1 Н (CDCl3,в м.д.): 0 (с, 6 Н); 0,85 (с, 9 Н); 4,5 (с, 2 Н); 7,05-7,1 (м, 2 Н); 7,25-7,3 (м, 2 Н); 7,4 (с,1 Н); 7,45 (с, 1 Н); 8,3 (с, 1 Н). М+Н=391. 18.4. Способ получения соединений 70-81. 18.4.1. В круглодонной колбе объемом 100 мл, очищенной аргоном, взвешивали 0,495 ммоль ацетата палладия и 0,99 ммоль S-Phos. К ним добавляли 55 мл дегазированного толуола и перемешивали смесь в ультразвуковой бане до полного растворения. 18.4.2. В пробирке взвешивали 0,3 ммоль арилбороновой кислоты и затем последовательно добавляли 0,3 6 ммоль тонко размолотого и высушенного фосфата калия, 0,5 мл дегазированного безводного этанола и 0,18 ммоль соединения, полученного в примере 18.3, растворенного в 2 мл толуола, после чего пробирку очищали аргоном. После этого добавляли 1 мл раствора, приготовленного в примере 18.4.1. Пробирку закрывали и поддерживали 16 ч при 75 С и при перемешивании. Вновь добавляли 0,5 мл раствора, полученного в примере 18.4.1, и продолжали нагрев в течение 10 ч. Охлажденный раствор разбавляли 5 мл этилацетата и добавляли 100 мг пропантиола на диоксиде кремния (Biotage Si-Thiol), затем смесь перемешивали при комнатной температуре в течение 4 ч. Твердое вещество отделяли фильтрацией и промывали 22 мл ТГФ. Фильтрат упаривали досуха; остаток использовали на следующей стадии без дополнительной очистки. 18.4.3. В пробирке смешивали соединение, полученное в примере 18.4.2, 0,36 ммоль фторида цезия,растворенные в 3 мл метанола, и 21 мкл уксусной кислоты. Раствор перемешивали 16 часов при комнатной температуре, затем растворители отгоняли. Остаток подвергали очистке с применением ВЭЖХ при элюировании смесью ацетонитрила с водой. Пример 19. Получение соединений 82-93. 19.1. 6-[3-Трет-бутилдиметилсиланилоксиметил)-2,4-дифторфенил]-2-хлоримидазо[1,2-а]пиридин. В токе аргона дегазировали 100 мл смеси ТГФ с водой в соотношении 85/15, затем добавляли 5,3 г соединения, полученного в примере 15.2, 6,07 г 2-хлор-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2 ил)имидазо[1,2-а]пиридина, полученного согласно примеру 18.2, 18,6 г карбоната цезия и 466 мг [1,1'бис(дифенилфосфино)ферроцен]дихлоропалладия. Смесь перемешивали 2 ч при 80 С в термостатируемой бане. После охлаждения до комнатной температуры растворители отгоняли при пониженном давлении. Остаток подвергали разделению в системе вода-диэтиловый эфир. Твердую фракцию удаляли фильтрацией. Органическую фазу, дважды промытую насыщенным раствором хлорида натрия, затем сушили над сульфатом натрия и концентрировали при пониженном давлении. Полученный остаток подвергали очистке хроматографией на силикагеле при элюировании смесью дихлорметана с метанолом. Полученное твердое вещество растирали с пентаном, собирали фильтрацией и сушили в сушильном шкафу при пониженном давлении. Получили 4,74 г соединения. ЯМР 1 Н (ДМСО-d6,в м.д.): 0,0 (с, 6 Н); 0,8 (с, 9 Н); 4,7 (с, 2 Н); 7,15 (т, 1 Н); 7,4 (д, 1 Н); 7,5-7,6 (м,2 Н); 8,0 (с, 1 Н); 8,65 (с, 1 Н). М+Н=409. 19.2. Способ получения соединений 82-93. 19.2.1. В пробирке взвешивали 0,3 ммоль арилбороновой кислоты, затем последовательно добавляли 0,36 ммоль тонко размолотого и высушенного фосфата калия, 0,5 мл дегазированного безводного этанола, 0,18 ммоль соединения, полученного в примере 19.1, растворенные в 2 мл толуола, затем пробирку очищали аргоном. После этого добавляли 1 мл раствора, приготовленного в примере 18.4.1. Пробирку закрывали и поддерживали 16 ч при перемешивании при 75 С. Вновь добавляли 0,5 мл раствора, полученного в примере 18.4.1, и продолжали нагрев в течение 10 ч. Охлажденный раствор разбавляли 5 мл этилацетата и добавляли 100 мг пропантиола на диоксиде кремния (Biotage Si-Thiol), затем смесь перемешивали 4 ч при комнатной температуре. Твердое вещество отделяли фильтрацией и промывали 22 мл ТГФ. Фильтрат упаривали досуха; остаток использовали на следующей стадии без дополнительной очистки. 19.2.2. В пробирке смешивали соединение, полученное в примере 19.2.1, 0,36 ммоль фторида цезия,растворенные в 3 мл метанола, и 21 мкл уксусной кислоты. Раствор перемешивали 16 ч при комнатной температуре, затем растворители отгоняли. Остаток подвергали очистке с применением ВЭЖХ при элюировании смесью ацетонитрила с водой. В табл. 2 приведены химические структуры соединений общей формулы I, являющихся объектом настоящего изобретения. В табл. 3 и 4 приведены физико-химические характеристики некоторых примеров соединений по изобретению. В указанных таблицах: в фенильное ядро (2, 3 или 4); в столбце "R" приведены положения замещения группы в столбце "Т. пл." приведены температуры плавления продуктов в градусах Цельсия (С), либо, если данные продукты были выделены в виде аморфных твердых веществ или масел, они характеризуются массой их [М+Н]; в столбце "Соль/основание" "-" прочерк означает соединение в виде свободного основания, "HCl" означает соединение в виде хлоргидрата; соотношение в скобках представляет собой соотношение (кислота:основание); для соединений 29 и 30 в ячейках столбца "Соль/основание" приведены результаты анализа удельного вращения данных соединений при длине волны 589 нм; растворитель, приведенный в скобках, соответствует растворителю, использованному при выполнении измерений удельного вращения в градусах,буква "с" означает концентрацию растворителя в г/100 мл, DMSO означает диметилсульфоксид;"Ph" означает фенил, "Cl" означает хлор, "F" означает фтор, "Me" означает метил, "МеО" означает метокси-, "(F2CH)O" означает дифторметикси-, IsPr означает изопропил; в столбце R цифра перед заместителем означает положение заместителя R в фенильном ядре; Для соединений 8 и 9 X находится в положениях 4 и 2 соответственно.Для соединений 45 и 47 X находится в положении 3. Соединения 29 и 30 представляют собой энантиомеры рацемического продукта 22.
МПК / Метки
МПК: A61P 25/00, C07D 233/56, A61P 35/00, A61P 19/00, C07D 231/28, C07D 471/04, A61K 31/437
Метки: терапии, 2-арил-6-фенилимидазо[1,2-a]пиридинов, применение, производные, полизамещенные, получение
Код ссылки
<a href="https://eas.patents.su/30-18266-polizameshhennye-proizvodnye-2-aril-6-fenilimidazo12-apiridinov-ih-poluchenie-i-ih-primenenie-v-terapii.html" rel="bookmark" title="База патентов Евразийского Союза">Полизамещенные производные 2-арил-6-фенилимидазо[1,2-a]пиридинов, их получение и их применение в терапии</a>
Предыдущий патент: Способ получения липида путем ферментации исходного сырья, содержащего спирт, мыла и/или жирные кислоты, включающий стадию осаждения мыла щелочно-земельных металлов
Следующий патент: Микроволновый плазменный двигатель
Случайный патент: Пептидомиметики с активностью антагонистов глюкагона и агонистов glp-1












