Производные 2-арил-6-фенилимидазо[1,2-a]пиридинов, их получение и применение в терапии
Номер патента: 17442
Опубликовано: 28.12.2012
Авторы: Ларденуа Патрик, Оливье Анн, Альмарио Гарсия Антонио
Формула / Реферат
1. Соединение, соответствующее формуле (I)

где R1 представляет собой фенил, который при необходимости может иметь в качестве заместителей один или два атома или группы, выбранные независимо друг от друга из галогена, (C1-C6)алкила, галоген(C1-C6)алкила, (C1-C6)алкокси, галоген(C1-C6)алкокси, гидроксила, цианогруппы, нитрогруппы, NRaRb, фенила; или нафтил;
R2 представляет собой атом водорода или (C1-C6)алкил;
R3 представляет собой атом водорода, (C1-C6)алкил, фенил;
R4 представляет собой атом водорода; (C1-C6)алкил, при необходимости замещенный (C1-C6)алкокси; фенил, при необходимости замещенный заместителем, выбранным из галогена, (C1-C6)алкила, галоген(C1-C6)алкила, нитрогруппы, цианогруппы, (C1-C6)алкил(CO)-, CONRaRb;
Ra и Rb представляют собой независимо друг от друга атом водорода или (C1-C6)алкил;
в виде основания или кислотно-аддитивной соли.
2. Соединение формулы (I) по п.1, отличающееся тем, что R1 представляет собой фенил, который при необходимости может иметь в качестве заместителей один или два атома или группы, выбранные независимо друг от друга из галогена, (C1-C6)алкила, (C1-C6)алкокси, гидроксигруппы, цианогруппы, нитрогруппы, NRaRb; или нафтил, в виде основания или кислотно-аддитивной соли.
3. Соединение формулы (I) по п.1 или 2, отличающееся тем, что
R2 и R3 представляют собой независимо друг от друга атом водорода, (C1-C6)алкил;
R4 представляет собой атом водорода; (C1-C6)алкил, при необходимости замещенный (C1-C6)алкокси; фенил, при необходимости замещенный заместителем, выбранным из галогена, (C1-C6)алкила, галоген(C1-C6)алкила, нитрогруппы, цианогруппы, (C1-C6)алкил(CO)-,
в виде основания или кислотно-аддитивной соли.
4. Соединение формулы (I) по любому из пп.1-3, отличающееся тем, что заместитель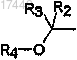
присоединен к фенилу в мета-положении, в виде основания или кислотно-аддитивной соли.
5. Соединение формулы (I) по п.1 или 3, отличающееся тем, что
R4 представляет собой атом водорода;
R2 и R3 представляют собой независимо друг от друга атом водорода, (C1-C6)алкил,
в виде основания или кислотно-аддитивной соли.
6. Соединение формулы (I) по п.1, отличающееся тем, что
R1 представляет собой фенил, который при необходимости может иметь в качестве заместителей один или два атома или группы, выбранные независимо друг от друга из галогена, (C1-C6)алкила, (C1-C6)алкокси, гидроксигруппы, цианогруппы, нитрогруппы, NRaRb, галоген(C1-C6)алкокси или фенила; или нафтил;
R2 представляет собой атом водорода или (C1-C6)алкил;
R3 представляет собой атом водорода, (C1-C6)алкил, фенил;
R4 представляет собой атом водорода; (C1-C6)алкил, при необходимости замещенный (C1-C6)алкокси; фенил, при необходимости замещенный заместителем, выбранным из галогена, (C1-C6)алкила, галоген(C1-C6)алкила, нитрогруппы, цианогруппы, (C1-C6)алкил(CO)-, CONRaRb;
Ra и Rb представляют собой независимо друг от друга атом водорода или (C1-C6)алкил,
в виде основания или кислотно-аддитивной соли.
7. Соединение формулы (I) по п.1, отличающееся тем, что
R1 представляет собой фенил, который при необходимости может иметь в качестве заместителей один или два атома или одну или две группы, выбранные независимо друг от друга из галогена, (C1-C6)алкила, (C1-C6)алкокси, гидроксигруппы, цианогруппы, нитрогруппы, NRaRb, галоген(C1-C6)алкокси; или нафтил;
R2 представляет собой атом водорода или (C1-C6)алкил;
R3 представляет собой атом водорода, (C1-C6)алкил, фенил;
R4 представляет собой атом водорода; (C1-C6)алкил, при необходимости замещенный (C1-C6)алкокси; фенил, при необходимости замещенный заместителем, выбранным из галогена, (C1-C6)алкила, галоген(C1-C6)алкила, нитрогруппы, цианогруппы, (C1-C6)алкил(CO)-, CONRaRb;
в виде основания или кислотно-аддитивной соли.
8. Соединения
[4-(2-фенилимидазо[1,2-а]пиридин-6-ил)фенил]метанол;
[3-(2-фенилимидазо[1,2-а]пиридин-6-ил)фенил]метанол;
{4-[2-(4-пирролидин-1-илфенил)имидазо[1,2-а]пиридин-6-ил]фенил}метанол;
[4-(2-бифенил-4-илимидазо[1,2-а]пиридин-6-ил)фенил]метанол;
3-[6-(4-гидроксиметилфенил)имидазо[1,2-а]пиридин-2-ил]бензонитрил;
3-[6-(3-гидроксиметилфенил)имидазо[1,2-а]пиридин-2-ил]бензонитрил;
3-{6-[3-(2-метоксиэтоксиметил)фенил]имидазо[1,2-а]пиридин-2-ил}бензонитрил;
4-[6-(3-гидроксиметилфенил)имидазо[1,2-а]пиридин-2-ил]бензонитрил;
[3-[2-(нафталин-2-ил)имидазо[1,2-а]пиридин-6-ил]фенил]метанол;
[3-(2-п-толилимидазо[1,2-а]пиридин-6-ил)фенил]метанол;
{3-[2-(4-пирролидин-1-илфенил)имидазо[1,2-а]пиридин-6-ил]фенил}метанол;
{3-[2-(3-трифторметоксифенил)имидазо[1,2-а]пиридин-6-ил]фенил}метанол;
{3-[2-(4-нитрофенил)имидазо[1,2-а]пиридин-6-ил]фенил}метанол;
{4-[2-(4-диэтиламинофенил)имидазо[1,2-а]пиридин-6-ил]фенил}метанол;
3-(2-нафталин-1-илимидазо[1,2-а]пиридин-6-ил)фенил]метанол;
{3-[2-(2,4-диметилфенил)имидазо[1,2-а]пиридин-6-ил]фенил}метанол;
6-[3-(2-метоксиэтоксиметил)фенил]-2-нафталин-2-илимидазо[1,2-а]пиридин;
{3-[2-(4-метоксифенил)имидазо[1,2-а]пиридин-6-ил]фенил}метанол;
{3-[2-(3-метоксифенил)имидазо[1,2-а]пиридин-6-ил]фенил}метанол;
{3-[2-(2-метоксифенил)имидазо[1,2-а]пиридин-6-ил]фенил}метанол;
{3-[2-(2,4-диметоксифенил)имидазо[1,2-а]пиридин-6-ил]фенил}метанол;
{3-[2-(4-фторфенил)имидазо[1,2-а]пиридин-6-ил]фенил}метанол;
{3-[2-(3,5-дифторфенил)имидазо[1,2-а]пиридин-6-ил]фенил}метанол;
{3-[2-(3-фтор-5-трифторметилфенил)имидазо[1,2-а]пиридин-6-ил]фенил}метанол;
{3-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]фенил}метанол;
гидрохлорид (1:1) {3-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]фенил}метанола;
{3-[2-(3-хлорфенил)имидазо[1,2-а]пиридин-6-ил]фенил}метанол;
{3-[2-(4-хлор-3-метилфенил)имидазо[1,2-а]пиридин-6-ил]фенил}метанол;
{3-[2-(3,4-дихлорфенил)имидазо[1,2-а]пиридин-6-ил]фенил}метанол;
{3-[2-(3-фторфенил)имидазо[1,2-а]пиридин-6-ил]фенил}метанол;
6-[3-(4-хлорфеноксиметил)фенил]-2-п-толилимидазо[1,2-а]пиридин;
N-{4-[3-(2-п-толилимидазо[1,2-а]пиридин-6-ил)бензилокси]фенил}ацетамид;
6-[3-(3-нитрофеноксиметил)фенил]-2-п-толилимидазо[1,2-а]пиридин;
6-[3-(4-метилфеноксиметил)фенил]-2-п-толилимидазо[1,2-а]пиридин;
4-[3-(2-п-толилимидазо[1,2-а]пиридин-6-ил)бензилокси]бензонитрил;
1-{4-[3-(2-п-толилимидазо[1,2-а]пиридин-6-ил)бензилокси]фенил}этанон;
6-[3-(4-трифторметилфеноксиметил)фенил]-2-п-толилимидазо[1,2-а]пиридин;
{3-[2-(3-фтор-4-метилфенил)имидазо[1,2-а]пиридин-6-ил]фенил}метанол;
2-{3-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]фенил}пропан-2-ол;
{2-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]фенил}метанол;
гидрохлорид (1:1) {2-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]фенил}метанола;
рацемат 1-{3-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]фенил}этанола;
{3-[2-(2,4-дихлорфенил)имидазо[1,2-а]пиридин-6-ил]фенил}метанол;
{3-[2-(2,4-дифторфенил)имидазо[1,2-а]пиридин-6-ил]фенил}метанол;
{3-[2-(3,4-дифторфенил)имидазо[1,2-а]пиридин-6-ил]фенил}метанол;
гидрохлорид (1:1) {3-[2-(3,4-дифторфенил)имидазо[1,2-а]пиридин-6-ил]фенил}метанола;
{3-[2-(2-хлорфенил)имидазо[1,2-а]пиридин-6-ил]фенил}метанол;
{3-[2-(4-трифторметилфенил)имидазо[1,2-а]пиридин-6-ил]фенил}метанол;
{3-[2-(4-(дифторметил)фенил)имидазо[1,2-а]пиридин-6-ил]фенил}метанол;
рацемат 1-{2-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]фенил}этанола;
2-(4-хлорфенил)-6-(2-метоксиметилфенил)имидазо[1,2-а]пиридин;
гидрохлорид (1:1) 2-(4-хлорфенил)-6-(2-метоксиметилфенил)имидазо[1,2-а]пиридина;
2-(4-хлорфенил)-6-(4-метоксиметилфенил)имидазо[1,2-а]пиридин;
рацемат 1-{3-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]фенил}пропан-1-ола;
рацемат 1-{3-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]фенил}пентан-1-ола;
рацемат 1-{3-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]фенил}гептан-1-ола;
рацемат 1-{3-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]фенил}-3-метилбутан-1-ола;
рацемат {3-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]фенил}циклопентилметанола;
рацемат {3-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]фенил}фенилметанола;
правовращающий энантиомер 1-{3-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]фенил}этанола;
левовращающий энантиомер 1-{3-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]фенил}этанола;
2-(4-хлорфенил)-6-(3-метоксиметилфенил)имидазо[1,2-а]пиридин;
рацемат 1-{4-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]фенил}этанола;
рацемат 1-{3-[2-(2,4-дифторфенил)имидазо[1,2-а]пиридин-6-ил]фенил}этанола;
рацемат 1-{3-[2-(4-фторфенил)имидазо[1,2-а]пиридин-6-ил]фенил}этанола;
рацемат 1-{3-[2-(3,4-дифторфенил)имидазо[1,2-а]пиридин-6-ил]фенил}этанола;
рацемат 1-{3-[2-(2-хлорфенил)имидазо[1,2-а]пиридин-6-ил]фенил}этанола;
рацемат 1-{3-[2-(3-фторфенил)имидазо[1,2-а]пиридин-6-ил]фенил}этанола;
рацемат 1-{3-[2-(3-хлорфенил)имидазо[1,2-а]пиридин-6-ил]фенил}этанола;
4-[6-(3-гидроксиметилфенил)имидазо[1,2-а]пиридин-2-ил]фенол
в виде основания или кислотно-аддитивной соли.
9. Лекарственное средство, отличающееся тем, что оно содержит соединение формулы (I) по любому из пп.1-8 или аддитивную соль такого соединения с фармацевтически приемлемой кислотой.
10. Фармацевтическая композиция, отличающаяся тем, что она содержит соединение формулы (I) по любому из пп.1-8 или фармацевтически приемлемую соль такого соединения, а также по меньшей мере один фармацевтически приемлемый эксципиент.
11. Применение соединения формулы (I) по любому из пп.1-8 для получения лекарственного средства, предназначенного для лечения и профилактики нейродегенеративных заболеваний.
12. Применение соединения формулы (I) по любому из пп.1-8 для получения лекарственного средства, предназначенного для лечения и профилактики травм головного мозга и эпилепсии.
13. Применение соединения формулы (I) по любому из пп.1-8 для получения лекарственного средства, предназначенного для лечения и профилактики психических заболеваний.
14. Применение соединения формулы (I) по любому из пп.1-8 для получения лекарственного средства, предназначенного для лечения и профилактики воспалительных заболеваний.
15. Применение соединения формулы (I) по любому из пп.1-8 для получения лекарственного средства, предназначенного для лечения и профилактики остеопороза и раковых заболеваний.
16. Применение соединения формулы (I) по любому из пп.1-8 для получения лекарственного средства, предназначенного для лечения, связанного с пересадкой и/или трансплантацией клеток-штаммов.
17. Применение соединения формулы (I) по любому из пп.1-8 для получения лекарственного средства, предназначенного для лечения и профилактики болезни Паркинсона, болезни Альцгеймера, таупатий и рассеянного склероза.
18. Применение соединения формулы (I) по любому из пп.1-8 для получения лекарственного средства, предназначенного для лечения и профилактики шизофрении, депрессии, лекарственной зависимости и синдрома дефицита внимания и гиперактивности.
19. Способ получения соединений формулы (I) по п.1, отличающийся тем, что соединения получают реакцией сочетания, катализируемой тетракис-(трифенилфосфин)палладием, между 2-арилимидазопиридином общей формулы (II)
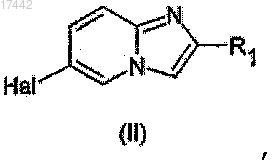
в которой Hal представляет собой атом галогена,
и производным общей формулы (III)
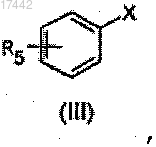
в которой X представляет собой производное бора или олова;
R5 представляет собой группу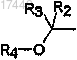
.
Текст
Изобретение относится к производным формулы (I), где R1 представляет собой фенил, который при необходимости может иметь в качестве заместителей один или два атома или группы, выбранные независимо друг от друга из галогена, (C1-C6)алкила, галоген(C1-C6)алкила, (C1-C6)алкокси,галоген(C1-C6)алкокси, гидроксила, цианогруппы, нитрогруппы, NRaRb, фенила, или нафтил; R2 представляет собой атом водорода или (C1-C6)алкил; R3 представляет собой атом водорода,(C1-C6)алкил, фенил; R4 представляет собой атом водорода; (C1-C6)алкил, при необходимости замещенный (C1-C6)алкокси; фенил, при необходимости замещенный заместителем, выбранным из галогена, (C1-C6)алкила, галоген(C1-C6)алкила, нитрогруппы, цианогруппы, (C1-C6)алкил(СО)-,CONRaRb; Ra и Rb представляют собой независимо друг от друга атом водорода или (C1-C6)алкил; находящимся в виде основания или кислотно-аддитивной соли. 017442 Настоящее изобретение относится к производным 2-арил-6-фенилимидазо[1,2-а]пиридина, их получению и применению в терапии при лечении или профилактике заболеваний, в механизме которых участвуют ядерные рецепторы Nurr-1, также называемые NR4A2, NOT, TINUR, RNR-1 и HZF3. Объектами настоящего изобретения являются соединения, соответствующие формуле (I) где R1 представляет собой фенил, который при необходимости может иметь в качестве заместителей один или два атома или группы, выбранные независимо друг от друга из галогена, (C1-C6)алкила,галоген(C1-C6)алкила, (C1-C6)алкокси, галоген(C1-C6)алкокси, гидроксила, цианогруппы, нитрогруппы,NRaRb, фенила; или нафтил;R2 представляет собой атом водорода или (C1-C6)алкил;R3 представляет собой атом водорода, (C1-C6)алкил, фенил;R4 представляет собой атом водорода;(C1-C6)алкил, при необходимости замещенный (C1-C6)алкокси; фенил, при необходимости замещенный заместителем, выбранным из галогена, (C1-C6)алкила, галоген(C1-C6)алкила, нитрогруппы, цианогруппы, (C1-C6)алкил(CO)-, CONRaRb;Ra и Rb представляют собой независимо друг от друга атом водорода или (C1-C6)алкил; в виде основания или кислотно-аддитивной соли. Соединения формулы (I) могут содержать один или несколько асимметрических атомов углерода. Они могут, таким образом, существовать в форме энантиомеров или диастереоизомеров. Такие энантиомеры, диастереоизомеры, а также их смеси, включая рацемические смеси, составляют часть настоящего изобретения. В различных группах, определенных далее, Ra и Rb имеют такие же значения, что и упомянутые ранее. Среди соединений формулы (I), являющихся объектами настоящего изобретения, первую группу соединений в виде оснований или кислотно-аддитивных солей образуют соединения, в которых R1 представляет собой фенил, который при необходимости может иметь в качестве заместителей один или два атома или группы, выбранные независимо друг от друга из галогена, (C1-C6)алкила, (C1-C6)алкокси, гидроксигруппы, цианогруппы, нитрогруппы, NRaRb; или нафтил. Среди соединений формулы (I), являющихся объектами настоящего изобретения, вторую группу соединений в виде оснований или кислотно-аддитивных солей образуют соединения, в которыхR2 и R3 представляют собой независимо друг от друга атом водорода;R4 представляет собой атом водорода;(C1-C6)алкил, при необходимости замещенный (C1-C6)алкокси; фенил, при необходимости замещенный заместителем, выбранным из галогена, (C1-C6)алкила, галоген(C1-C6)алкила, нитрогруппы, цианогруппы, (C1-C6)алкил(CO)-. Среди соединений формулы (I), являющихся объектами настоящего изобретения, третью группу соединений в виде оснований или кислотно-аддитивных солей образуют соединения, в которых заместиприсоединен к фенилу в мета-положении. Среди соединений формулы (I), являющихся объектами настоящего изобретения, четвертую группу соединений в виде оснований или кислотно-аддитивных солей образуют соединения, в которыхR4 представляет собой атом водорода;R2 и R3 представляют собой независимо друг от друга атом водорода, (C1-C6)алкил. Среди соединений формулы (I), являющихся объектами настоящего изобретения, пятую группу соединений в виде оснований или кислотно-аддитивных солей образуют соединения, в которых:R1 представляет собой фенил, который при необходимости может иметь в качестве заместителей один или два атома или группы, выбранные независимо друг от друга из галогена, (C1-C6)алкила,(C1-C6)алкокси, гидроксигруппы, цианогруппы, нитрогруппы, NRaRb, галоген(C1-C6)алкокси или фенила; или нафтил;R2 представляет собой атом водорода или (C1-C6)алкил;R3 представляет собой атом водорода, (C1-C6)алкил, фенил;R4 представляет собой атом водорода;(C1-C6)алкил, при необходимости замещенный (C1-C6)алкокси; фенил, при необходимости замещенный заместителем, выбранным из галогена, (C1-C6)алкила, галоген(C1-C6)алкила, нитрогруппы, цианогруппы, (C1-C6)алкил(CO)-, CONRaRb;Ra и Rb представляют собой независимо друг от друга атом водорода или (C1-C6)алкил. Среди соединений формулы (I), являющихся объектами настоящего изобретения, шестую группу соединений в виде оснований или кислотно-аддитивных солей образуют соединения, в которыхR1 представляет собой фенил, который при необходимости может иметь в качестве заместителей один или два атома или одну или две группы, выбранные независимо друг от друга из галогена, (C1-C6)алкила, (C1-C6)алкокси, гидроксигруппы, цианогруппы, нитрогруппы, NRaRb,галоген(C1-C6)алкокси; или нафтил;R2 представляет собой атом водорода или (C1-C6)алкил;R3 представляет собой атом водорода, (C1-C6)алкил, фенил;R4 представляет собой атом водорода;(C1-C6)алкил, при необходимости замещенный (C1-C6)алкокси; фенил, при необходимости замещенный заместителем, выбранным из галогена, (C1-C6)алкила, галоген(C1-С)алкила, нитрогруппы, цианогруппы, (C1-C6)алкил(CO)-, CONRaRb. Комбинации групп, таких как определенные ранее группы с первой по шестую, также составляют часть настоящего изобретения. Соединения формулы (I) могут существовать в виде оснований или кислотно-аддитивных солей. Такие аддитивные соли составляют часть настоящего изобретения. Как эти соли, которые могут быть получены с фармацевтически приемлемыми кислотами, так и соли других кислот, например, используемых для очистки или выделения соединений формулы (I), также составляют часть настоящего изобретения. Соединения формулы (I) могут существовать также в виде гидратов или сольватов, а именно в виде ассоциатов или комбинаций с одной или несколькими молекулами воды или с растворителем. Такие гидраты и сольваты также составляют часть настоящего изобретения. В описании настоящего изобретения атом галогена означает атом фтора, хлора, брома или йода;(C1-C6)алкил означает линейную или разветвленную насыщенную алифатическую группу, содержащую от 1 до 6 атомов углерода. В качестве примеров можно упомянуть метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, пентил и т.д.;(C3-C7)циклоалкил означает углеродную циклическую группу, содержащую от 3 до 7 атомов углерода. В качестве примеров можно упомянуть циклопропил, циклобутил, циклопентил, циклогексил и т.д.; алкилен означает линейную или разветвленную насыщенную двухвалентную группу, например(C1-C6)алкилен представляет собой линейную или разветвленную двухвалентную углеродную цепочку,содержащую от 1 до 6 атомов углерода, в частности метилен, этилен, 1-метилэтилен, пропилен;(C1-C6)алкоксигруппа означает -О-алкил, в котором алкил является таким, как определено ранее;(C3-C7)циклоалкоксигруппа означает -О-циклоалкил, в котором алкил является таким, как определено ранее; галоген(C1-C6)алкил означает линейную, разветвленную или циклическую алифатическую группу,содержащую от 1 до 6 атомов углерода, имеющих в качестве заместителей один или несколько атомов галогенов, являющихся одинаковыми или различающимися. В качестве примеров можно упомянуть CF3,CH2CF3, CHF2, CCl3; галоген(C1-C6)алкоксигруппа означает -О-алкил, в котором алкил является таким, как определено ранее, и имеет в качестве заместителей один или несколько атомов галогенов, являющихся одинаковыми или различающимися. В качестве примеров можно упомянуть OCF3, OCHF2, OCCl3; тиоалкил означает -S-алкил, в котором алкил является таким, как определено ранее; атомы серы и азота могут находиться в окисленной форме (N-оксид, сульфоксид, сульфон); арил означает ароматический цикл, содержащий от 6 до 10 атомов углерода. В качестве примеров арилов можно упомянуть фенил или нафтил; гетероарил означает ароматический цикл, имеющий от 5 до 10 членов и содержащий от 1 до 4 гетероатомов, выбранных из О, S или N. В качестве неограничительных примеров можно упомянуть имидазолил, тиазолил, оксазолил, фурил, тиофенил, оксадиазолил, тетразолил, пиридинил, пиразинил, пиримидинил, пиридазинил, индолил, бензофуранил, бензотиофенил, бензоксазолил, бензимидазолил, индазолил, бензотиазолил, изобензотиазолил, бензотриазолил, хинолинил, изохинолинил, хиноксалинил.-2 017442 Среди соединений формулы (I), являющихся объектами настоящего изобретения, можно, в частности, назвать следующие соединения:-3 017442 левовращающий энантиомер 1-3-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]фенилэтанола; 2-(4-хлорфенил)-6-(3-метоксиметилфенил)имидазо[1,2-а]пиридин; рацемат 1-4-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]фенилэтанола; рацемат 1-3-[2-(2,4-дифторфенил)имидазо[1,2-а]пиридин-6-ил]фенилэтанола; рацемат 1-3-[2-(4-фторфенил)имидазо[1,2-а]пиридин-6-ил]фенилэтанола; рацемат 1-3-[2-(3,4-дифторфенил)имидазо[1,2-а]пиридин-6-ил]фенилэтанола; рацемат 1-3-[2-(2-хлорфенил)имидазо[1,2-а]пиридин-6-ил]фенилэтанола; рацемат 1-3-[2-(3-фторфенил)имидазо[1,2-а]пиридин-6-ил]фенилэтанола; рацемат 1-3-[2-(3-хлорфенил)имидазо[1,2-а]пиридин-6-ил]фенилэтанола; 4-[6-(3-гидроксиметилфенил)имидазо[1,2-а]пиридин-2-ил]фенол. Согласно настоящему изобретению соединения общей формулы (I) можно получить способом, описанным на схеме 1. Схема 1 Соединения по настоящему изобретению можно получать соответственно схеме 1 реакцией сочетания, катализируемой металлом, таким как палладий, между 2-арилимидазопиридином общей формулы(II), в которой R1 имеет значения, определенные ранее, a Hal представляет собой атом галогена, и производным общей формулы (III), в которой X представляет собой производное бора или олова, a R5 представляет собой группу с получением соединений общей формулы (I). Соединения по настоящему изобретению также можно получать соответственно схеме 1 реакцией сочетания, катализируемой металлом, таким как палладий, между 2-арилимидазопиридином общей формулы (II), в которой R1 имеет значения, определенные ранее, a Hal представляет собой атом галогена, и производным общей формулы (III), в которой X представляет собой производное бора или олова, a R5 представляет собой карбонильное производное R2COR3, где R2 и R3 имеют значения, определенные ранее, с получением соединений общей формулы (IV), например, по методике, описанной A. Gueiffier вHelv. Chim. Acta, 2001, 84, 3610-3615. Затем можно превращать соединения общей формулы (IV) в соединения общей формулы (I) действием металлоорганического производного, такого как магнийорганическое производное, или восстановлением карбонильной группы гидридом металла, например борогидридом натрия или одним из его производных, или любым другим способом, известным специалистам в данной области техники. Соединения формулы (I) при необходимости могут быть использованы в любых реакциях, известных специалистам в данной области техники, и в любом порядке для превращения в другие соединения формулы (I). В качестве примеров таких реакций можно упомянуть реакции этерификации или аминирования кислотной группы, реакции карбамоилирования, реакции гидролиза сложных эфиров, реакции превращения гидроксигрупп в алкоксигруппы, реакции сочетания, катализируемые переходным металлом, реакции защиты реакционноспособных функциональных групп, реакции удаления защитных групп, которые могут быть присоединены к защищаемым реакционноспособным функциональным группам, реакции образования солей неорганическими или органическими кислотами или основаниями с получением соответствующих солей, реакции разделения образовавшихся рацематов на энантиомеры, причем упомянутые соединения формулы (I), получаемые таким образом, при необходимости находятся в виде любых возможных изомерных форм рацематов, энантиомеров и диастереоизомеров. Указанные на схеме 1 исходные вещества и реагенты, способы получения которых не описаны,имеются в продаже или описаны в литературе или могут быть получены способами, описанными или известными специалистам в данной области техники. В следующих далее примерах описано получение некоторых соединений по настоящему изобретению. Эти примеры не являются ограничительными и приведены только для иллюстрации настоящего изобретения. Номера соединений в приведенных примерах соответствуют номерам таблицы, приведенной далее для иллюстрации химической структуры и физических свойств некоторых соединений по настоящему изобретению.-4 017442 Номенклатура соединений была составлена посредством программы Autonom. Пример 1. [4-(2-Фенилимидазо[1,2-а]пиридин-6-ил)фенил]метанол (соединение 1 в таблице). 1.1. 6-Бром-2-фенилимидазо[1,2-а]пиридин. В колбу вносят 1,99 г 2-бром-1-фенилэтанона, 1,73 г 2-амино-5-бромпиридина и 1 г гидрокарбоната натрия в смесь 20 мл этанола и 5 мл воды. Нагревают при 80 С в течение 4 ч, дают охладиться и прибавляют 40 мл воды. Смесь перемешивают в течение 15 мин, далее осадок отделяют фильтрованием, промывают сначала водой, а затем диизопропиловым эфиром и сушат в эксикаторе. Получают 1,8 г требуемого соединения. тпл=192-194 С. 1.2. [4-(2-Фенилимидазо[1,2-а]пиридин-6-ил)фенил]метанол. 150 мг 6-бром-2-фенилимидазо[1,2-а]пиридина, 125 мг 4-(гидроксиметил)фенилбороновой кислоты,19 мг тетракис-(трифенилфосфин)палладия и 2 мл ацетонитрила помещают в пробирку для микроволнового нагревания. В токе азота прибавляют 2 мл толуола, обезгаженного продувкой азотом, затем 2 мл 2 М раствора карбоната натрия. Пробирку помещают в микроволновую печь и нагревают при 150 С в течение 15 мин. Органический слой отделяют, сушат и затем концентрируют при пониженном давлении. Остаток растворяют в диизопропиловом эфире, осадок отделяют фильтрованием, промывают и сушат. Осадок очищают перекристаллизацией из н-бутанола. Получают 52 мг требуемого соединения. тпл=238-240 С. 1 Н ЯМР (ДМСО-d6):, м.д. 4,54 (д, J=5,5 Гц, 2 Н); 5,2 (т, J=5,6 Гц, 1 Н); 7,24-7,73 (м, 9 Н); 7,96 (м,2 Н); 8,36 (с, 1 Н); 8,84 (т, J=1,3 Гц, 1 Н). М+Н=301. Пример 2. [3-[2-(Нафталин-2-ил)имидазо[1,2-a]пиридин-6-ил]фенил]метанол (соединение 9 в таблице). 2.1. 6-Бром-2-(нафталин-2-ил)имидазо[1,2-а]пиридин. Соответственно процедурам примера 1 и исходя из 0,5 г 2-бром-1-(нафталин-2-ил)этанона, 0,72 г 2-амино-5-бромпиридина и 0,29 г гидрокарбоната натрия получают 0,83 г 6-бром-2-(нафталин-2 ил)имидазо[1,2-а]пиридина. тпл=226-228 С. 2.2. [3-[2-(Нафталин-2-ил)имидазо[1,2-а]пиридин-6-ил]фенил]метанол. В токе азота 500 мг 6-бром-2-(нафталин-2-ил)имидазо[1,2-а]пиридина, 235 мг 3-(гидроксиметил)фенилбороновой кислоты и 90 мг тетракис-(трифенилфосфин)палладия помещают в пробирку для микроволнового нагревания, содержащую 5 мл толуола, предварительно обезгаженного продувкой азотом,5 мл ацетонитрила и 6 мл 0,5 М раствора карбоната натрия. Пробирку помещают в микроволновую печь и нагревают при 150 С в течение 15 мин. Органический слой отделяют, сушат, а фильтрат концентрируют при пониженном давлении. Полученный остаток растворяют в 5 мл дихлорметана. Образуется осадок, который отделяют фильтрованием, промывают сначала дихлорметаном, а затем диизопропиловым эфиром и сушат при пониженном давлении. Синтез повторяют несколько раз (6) и полученные твердые продукты объединяют. Получают 2,2 г соединения, которое перекристаллизовывают из смеси н-пропанол/вода, 1/1. Осадок отделяют от жидкости, промывают диизопропиловым эфиром и сушат при пониженном давлении. Получают 1,96 г требуемого соединения. тпл=161-163 С. 1(м, 4 Н); 8,52 (м, 2 Н); 8,84 (м, 1 Н). М+Н=351. Пример 3. [3-(2-п-Толилимидазо[1,2-а]пиридин-6-ил)фенил]метанол (соединение 10 в таблице). 3.1. 6-Бром-2-п-толилимидазо[1,2-а]пиридин. Соответственно процедурам примера 1 и исходя из 150 мг 2-бром-1-п-толилэтанона, 185 мг 2-амино-5-бромпиридина и 87 мг гидрокарбоната натрия получают 200 мг 6-бром-2-п-толилимидазо[1,2 а]пиридина. Соединение очищают хроматографированием на силикагеле, элюируя смесью дихлорметан/метанол, 98/2. Получают 60 мг требуемого соединения. тпл=226-228 С. 3.2. [3-(2-п-Толилимидазо[1,2-а]пиридин-6-ил)фенил]метанол. В токе азота 200 мг 6-бром-2-п-толилимидазо[1,2-а]пиридина, 160 мг 3-(гидроксиметил)фенилбороновой кислоты и 24 мг тетракис-(трифенилфосфин)палладия помещают в пробирку для микроволнового нагревания, содержащую 2 мл толуола, предварительно обезгаженного продувкой азотом,2 мл ацетонитрила и 2 мл 2 М раствора карбоната натрия. Пробирку помещают в микроволновую печь и нагревают при 150 С в течение 15 мин. Органический слой отделяют, сушат, а фильтрат концентрируют при пониженном давлении. Полученный остаток растворяют в 6 мл дихлорметана. Осадок отделяют фильтрованием, промывают дихлорметаном и сушат в эксикаторе при пониженном давлении. Получают 100 мг требуемого соединения. тпл=171-173 С.H ЯМР (ДМСО-d6):, м.д. 2,32 (с, 3 Н); 4,57 (д, J=5,6 Гц, 2H); 5,23 (т, J=5,7 Гц, 1H); 7,19-7,67 (м,8 Н); 7,84 (д, J=8 Гц, 2 Н); 8,32 (с, 1H); 8,82 (м, 1 Н). М+Н=315. Пример 4. 6-[3-(2-Метоксиэтоксиметил)фенил]-2-(нафталин-2-ил)имидазо[1,2-а]пиридин (соединение 17 в таблице)/ В пробирке, выдерживающей давление, растворяют 100 мг [3-(2-(нафталин-2-ил)имидазо[1,2 а]пиридин-6-ил)фенил]метанола (пример 2) и 120 мг простого метилового эфира 2-бромэтанола в 5 мл смеси метанол/диметилформамид, 1/1, и прибавляют 1 г фторида калия на оксиде алюминия. Пробирку закрывают и нагревают в течение 16 ч при 80 С. После охлаждения отделяют фильтрованием твердое вещество, которое промывают дихлорметаном. Фильтрат концентрируют при пониженном давлении и очищают хроматографированием на силикагеле, элюируя смесью дихлорметан/метанол, 99/1. Получают маслоподобное вещество, которое кристаллизуют в 5 мл диизопропилового эфира. Осадок отделяют фильтрованием, промывают диизопропиловым эфиром и сушат при пониженном давлении. Получают 44 мг требуемого соединения. тпл=80-82 С. 1H ЯМР (ДМСО-d6):, м.д. 3,25 (м, 3 Н) 3,55 (м, 4 Н); 4,57 (с, 2 Н); 7,27-7,80 (м, 8 Н); 7,82-8,16 (м, 4 Н); 8,52 (м, 2 Н); 8,89 (м, 1 Н). М+Н=409. Пример 5. 3-[2-(4-Хлорфенил)имидазо[1,2-а]пиридин-6-ил]фенилметанол (соединение 25 в таблице). 5.1. 6-Бром-2-(4-хлорфенил)имидазо[1,2-а]пиридин. Соответственно процедурам примера 1 и исходя из 675 мг 2-бром-1-(4-хлорфенил)этанона, 500 мг 2-амино-5-бромпиридина и 290 мг гидрокарбоната натрия получают 680 мг 6-бром-2-(4 хлорфенил)имидазо[1,2-а]пиридина. Соединение очищают хроматографированием на силикагеле, элюируя смесью дихлорметан/метанол, 98/2. Получают 60 мг требуемого соединения. тпл=210-211 С. 5.2. 3-[2-(4-Хлорфенил)имидазо[1,2-а]пиридин-6-ил]фенилметанол. В токе азота 210 мг 6-бром-2-(4-хлорфенил)имидазо[1,2-а]пиридина, 155 мг 3-(гидроксиметил)фенилбороновой кислоты и 24 мг тетракис-(трифенилфосфин)палладия помещают в пробирку для микроволнового нагревания, содержащую 3 мл толуола, предварительно обезгаженного продувкой азотом,3 мл ацетонитрила и 3 мл 2 М раствора карбоната натрия. Пробирку помещают в микроволновую печь и нагревают при 150 С в течение 15 мин. Органический слой отделяют, сушат, а фильтрат концентрируют при пониженном давлении. Полученный остаток растворяют в дихлорметане. Осадок отделяют фильтрованием, промывают дихлорметаном и сушат в эксикаторе при пониженном давлении. Получают 175 мг требуемого соединения. тпл=181-182 С. 1 Н ЯМР (ДМСО-d6): , м.д. 4,57 (д, J=5,5 Гц, 2H); 5,23 (т, J=5,6 Гц, 1 Н); 7,28-7,71 (м, 8 Н); 7,97 (м,J=8,5 Гц, 2 Н); 8,41 (с, 1 Н); 8,84 (м, 1 Н). М+Н=335. Пример 6. Гидрохлорид (1:1) 3-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]фенилметанола (соединение 26 в таблице). 2,37 г 3-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]фенилметанола суспендируют в 80 мл дихлорметана. При перемешивании прибавляют по каплям 4,26 мл 5 н. раствора соляной кислоты в 2-пропаноле и перемешивают при комнатной температуре в течение 2 ч. Затем реакционную смесь концентрируют при пониженном давлении. Остаточное твердое вещество растворяют в диизопропиловом эфире, осадок отделяют фильтрованием, промывают сначала дихлорметаном, а затем этилацетатом и отделяют от жидкости. Твердое вещество растворяют при комнатной температуре в минимальном количестве метанола, а затем снова осаждают посредством диизопропилового эфира. Осадок отделяют фильтрованием и сушат в сушильном шкафу при пониженном давлении и температуре 60 С. Получают 2,23 г твердого вещества светло-желтого цвета. тпл=244-246 С. 1 Н ЯМР (ДМСО-d6,):, м.д. 4,59 (с, 2H); 7,36-7,55 (м, 2 Н); 7,58-7,74 (м, 4 Н); 7,96 (д, J=9,4 Гц, 1 Н); 8,05 (м, J=8,7 Гц, 2 Н); 8,14 (дд, J=9,3 и 1,7 Гц, 1 Н); 8,70 (с, 1 Н); 9,15 (м, 1 Н). М+Н=335. Пример 7. 6-[3-(4-Хлорфеноксиметил)фенил]-2-п-толилимидазо[1,2-а]пиридин (соединение 31 в таблице). Растворяют 200 мг [3-(2-п-толилимидазо[1,2-а]пиридин-6-ил)фенил]метанола (пример 3) в 20 мл безводного тетрагидрофурана, прибавляют 123 мг п-хлорфенола, 193 мг трибутилфосфина и 210 мг 1,1'-азодикарбонилдипиперидина и затем смесь перемешивают в течение 16 ч при комнатной температуре. Выпаривают растворитель при пониженном давлении. Остаток растворяют в 10 мл этилацетата, осадок отделяют, фильтрат концентрируют и остаток очищают хроматографированием. Полученное твердое-6 017442 вещество растворяют в петролейном эфире, осадок отделяют фильтрованием и сушат при пониженном давлении. Получают 52 мг требуемого соединения. тпл=182-184 С. 1 Н ЯМР (ДМСО-d,):, м.д. 2,32 (с, 3 Н); 5,17 (с, 2 Н); 7,06 (д, J=7 Гц, 2 Н); 7,23 (д, J=7,2 Гц, 2 Н); 7,32(д, J=7,3 Гц, 2H); 7,40-7,80 (м, 6 Н); 7,84 (м, J=7,8 Гц, 2H); 8,32 (с, 1 Н); 8,86 (м, 1 Н). М+Н=425. Пример 8. 2-3-[2-(4-Хлорфенил)имидазо[1,2-а]пиридин-6-ил]фенилпропан- 2-ол (соединение 39 в таблице). 8.1. 1-3-[2-(4-Хлорфенил)имидазо[1,2-а]пиридин-6-ил]фенилэтанон. 300 мг 6-бром-2-(4-хлорфенил)имидазо[1,2-а]пиридина (полученного по методике стадии 5.1),240 мг 3-ацетилбороновой кислоты и 34 мг тетракис-(трифенилфосфин)палладия смешивают в пробирке для микроволнового нагревания, содержащей 4,5 мл ацетонитрила, 4,5 мл толуола и 4,5 мл 2 М раствора гидрокарбоната натрия. Пробирку помещают в микроволновую печь и нагревают при 150 С в течение 15 мин. Органический слой отделяют, сушат и концентрируют при пониженном давлении. Получают твердый остаток, который растирают со смесью 3 мл дихлорметана и 3 мл диизопропилового эфира в течение 30 мин. Осадок отделяют фильтрованием, промывают диизопропиловым эфиром и сушат в эксикаторе при пониженном давлении. Получают 209 мг требуемого соединения. тпл=173-175 С. 8.2. 2-3-[2-(4-Хлорфенил)имидазо[1,2-а]пиридин-6-ил]фенилпропан-2-ол). В токе азота 150 мг соединения, полученного на стадии 8.1, помещают в колбу и растворяют в безводной смеси 20 мл диэтилового эфира и 10 мл тетрагидрофурана. Охлаждают на бане со льдом и прибавляют по каплям 1,3 мл 1 М раствора метилмагнийбромида в дибутиловом эфире. Смесь перемешивают на бане со льдом в течение 1 ч и затем прибавляют 5 мл насыщенного водного раствора хлорида аммония. Органический слой отделяют, сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают хроматографированием на силикагеле, элюируя смесью дихлорметан/метанол, 99/1. Полученное твердое вещество растирают с диизопропиловым эфиром, отделяют фильтрованием и затем сушат в эксикаторе при пониженном давлении. Получают 65 мг требуемого соединения. тпл=166-168 С. 1H ЯМР (ДМСО-d6): , м.д. 1,47 (с, 6 Н); 5,06 (с, 1 Н); 7,33-7,69 (м, 7 Н); 7,78 (м, 1 Н); 7,97 (м, J=8,5 Гц,2 Н); 8,42 (с, 1 Н); 8,83 (м, 1 Н). М+Н=363. Пример 9. 2-[2-(4-Хлорфенил)имидазо[1,2-а]пиридин-6-ил]фенилметанол (соединение 40 в таблице). В токе азота 200 мг 6-бром-2-(4-хлорфенил)имидазо[1,2-а]пиридина (полученного по методике стадии 5.1), 148 мг 2-(гидроксиметил)фенилбороновой кислоты и 22,5 мг тетракис(трифенилфосфин)палладия помещают в пробирку для микроволнового нагревания, содержащую 3 мл ацетонитрила, 3 мл толуола и 3 мл 2 М раствора гидрокарбоната натрия. Пробирку помещают в микроволновую печь и нагревают при 150 С в течение 15 мин. Органический слой отделяют, сушат и концентрируют при пониженном давлении. Остаток очищают хроматографированием на силикагеле, элюируя смесью дихлорметан/метанол, 98/2. Полученное твердое вещество растирают с диизопропиловым эфиром, отделяют фильтрованием и затем сушат в эксикаторе при пониженном давлении. Получают 127 мг требуемого соединения. тпл=164-166 С. 1(соединение 41 в таблице). 40 мг 2-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]фенилметанола суспендируют в 1,5 мл этанола. При перемешивании прибавляют по каплям 1,79 мл 0,1 н. раствора соляной кислоты в 2-пропаноле и перемешивают при комнатной температуре в течение 30 мин. Затем реакционную смесь концентрируют при пониженном давлении. Остаточное твердое вещество растворяют в этаноле, осадок отделяют фильтрованием, промывают сначала этанолом, а затем диэтиловым эфиром и отделяют от жидкости. Полученное вещество сушат в сушильном шкафу при пониженном давлении и температуре 60 С. Получают 17 мг твердого вещества белого цвета. тпл=238-239 С. 1 Н ЯМР (ДМСО-d6): , м.д. 4,50 (с, 2H); 7,36-7,54 (м, 3 Н); 7,60-7,70 (м, 3 Н); 7,77 (м, 1 Н); 7,86 (д,J=7,7 Гц, 1 Н); 8,14 (д, J=9,2 Гц, 2 Н); 8,73 (с, 1 Н); 8,86 (с, 1 Н). М+Н=335.-7 017442 Пример 11. 1-3-[2-(4-Хлорфенил)имидазо[1,2-а]пиридин-6-ил]фенилэтанол (соединение 42 в таблице). К 150 мг 1-3-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]фенилэтанона (соединения, полученного на стадии 8.1), растворенного в 20 мл метанола, прибавляют порциями 164 мг борогидрида натрия. Далее смесь перемешивают при комнатной температуре в течение 1 ч и затем растворитель выпаривают при пониженном давлении. Остаток обрабатывают водой и дихлорметаном, органический слой декантируют, сушат над сульфатом натрия и затем растворитель выпаривают при пониженном давлении. Остаток растирают с диизопропиловым эфиром, отделяют фильтрованием и затем сушат в эксикаторе при пониженном давлении. Получают 124 мг требуемого соединения. тпл=174-176 С. 1H ЯМР (ДМСО-d6,): , м.д. 1,37 (д, J=6,5 Гц, 3 Н); 4,79 (м, 1 Н); 5,19 (д, J=4,2 Гц, 1 Н); 7,31-7,69 (м,8 Н); 7,97 (м, J=8,6 Гц, 2 Н); 8,41 (с, 1 Н); 8,84 (м, 1 Н). М+Н=349. Пример 12. Правовращающий энантиомер 1-3-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6 ил]фенилэтанола (соединение 60 в таблице). 263 мг рацемата 1-3-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]фенилэтанола (соединение 42,пример 11) вносят в колонку ChiralPAK AD DAICEL, 20 мкм, 50250 мм. Элюируют смесью н-гептана и 2-пропанола с соотношением 80/20. После перекристаллизации из диизопропилового эфира получают 115 мг наименее удерживаемого соединения. тпл=168-170 С.H ЯМР (ДМСО-d6): , м.д. 1,36 (д, J=6,2 Гц, 3 Н); 4,79 (м, 1 Н); 5,20 (д, J=4,3 Гц, 1 Н); 7,31-7,69 (м,8 Н); 7,97 (м, J=8,6 Гц, 2 Н); 8,41 (с, 1 Н); 8,84 (м, 1 Н). М+Н=349. Пример 13. Левовращающий энантиомер 1-3-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6 ил]фенилэтанола (соединение 61 в таблице). Соответственно процедурам методики примера 12 и исходя из 263 мг рацемата 1-3-[2-(4 хлорфенил)имидазо[1,2-а]пиридин-6-ил]фенилэтанола получают 112 мг наиболее удерживаемого соединения. тпл=168-170C.H ЯМР (ДМСО-d6): , м.д. 1,37 (д, J=6,6 Гц, 3 Н); 4,79 (м, 1 Н); 5,19 (д, J=4,3 Гц, 1 Н); 7,31-7,69 (м,8 Н); 7,97 (м, J=8,7 Гц, 2 Н); 8,41 (с, 1 Н); 8,84 (м, 1 Н). М+Н=349. Типичные примеры В приведенной далее таблице: в столбце "о/м/п" пояснено положение заместителя в фенильном кольце пометкой "орто/мета/пара"; Ph означает фенил; С 5 Н 9 означает циклопентил; C4H8N означает пирролидин-1-ил; в столбце "тпл" приведены температуры плавления соединений в градусах Цельсия (С) или приведены характеристики соединений по их массе [М+Н] в случае выделения соединений в виде аморфных твердых веществ или маслоподобных веществ; в столбце "Соль/основание" знак "-" означает соединение в виде свободного основания, тогда как формула "HCl" означает соединение в виде гидрохлорида, а соотношение, приведенное в скобках, означает соотношение (кислота:основание). Соединения 60 и 61 представляют собой энантиомеры рацемата соединения 42. С соединениями по настоящему изобретению были проведены фармакологические испытания, позволяющие определить модулирующее действие соединений в отношении рецепторов Nurr-1/NOT. Оценка активности in vitro в клетке N2A.- 10017442 Испытания состояли в измерении активности in vitro соединений по настоящему изобретению в отношении линии клеток (N2A), экспрессирующих эндогенным образом рецептор мыши Nurr-1 и стабильно трансфицированных респонсивным элементом, связывающим NOT (NBRE), присоединенный к генурепортеру люциферазы. Значения ЕС 50 находились в интервале от 0,01 до 1000 нМ. Испытания осуществляли соответственно описанной далее методике. Клеточная линия Neuro-2A происходит из коммерческого стандартного препарата (АТСС). КлонNeuro-2A был получен из спонтанной опухоли, происходящей из штамма мыши A albino, полученногоR.J. Klebe et al. Затем эту линию Neuro-2A стабильно трансфицировали 8NBRE-люциферазой. КлеткиN2A-8NBRE культивировали до конфлюэнтности в культуральных флаконах площадью 75 см 2, содержащих среду DMEM, дополненную 10% эмбриональной телячьей сыворотки, 4,5 г/л глюкозы и 0,4 мг/мл генетицина. После культивирования в течение недели клетки обрабатывали 0,25%-ным трипсином в течение 30 с, затем ресуспендировали в среде DMEM без красного фенолового, содержащей 4,5 г/л глюкозы, 10% делипидированной сыворотки Hyclone, и помещали в планшеты белого цвета на 96 лунок с прозрачным дном. Клетки вносили из расчета 60000 единиц в объеме 75 мкл на лунку за 24 ч до прибавления испытуемых соединений. Испытуемые соединения вносили в объеме 25 мкл и инкубировали дополнительно в течение 24 ч. В день измерения в каждую лунку прибавляли одинаковый объем (100 мкл) тест-системы Steadylite, затем выдерживали в течение 30 мин до достижения полного лизиса клеток и получения максимального сигнала. Затем после запечатывания адгезивной пленкой в планшетах осуществляли измерения с использованием микропланшетного люминометра. Из испытуемых соединений готовили исходные растворы с концентрацией 10-2 М и затем разбавляли 100% ДМСО. Растворы испытуемых соединений с каждой концентрацией предварительно разбавляли культуральной средой перед инкубацией с клетками, что давало, таким образом, конечную концентрацию ДМСО, равную 0,625%. Например, соединения 17, 31, 39 и 40, приведенные в таблице, показали ЕС 50, равную 3,6, 14, 0,7 и 0,7 нМ соответственно. Оценка связи с рецептором NOT человека. Прямую связь между соединениями по настоящему изобретению и рецептором NOT человека оценивали с использованием технологии SPR (surface plasmon resonance (поверхностный плазмонный резонанс. В этом испытании белок ковалентно иммобилизовывали на матрице, а испытуемое соединение вводили в камеру, содержащую чувствительный элемент (биодатчик или химически активную поверхность). Аналитический сигнал прямо пропорционально соответствовал количеству соединения, присоединенного к белку. Испытания связи осуществляли с использованием прибора BIACORE S51 (BiacoreInc., Piscataway N.J.). Цельный белок GST-NOT (NOT-FL) был поставлен компанией Invitrogen (PV3265). Домен связи с лигандом NOT (His-Thr-NOT 329-598) был выделен и очищен соответственно описанному в Nature, 423, 555-560. Оба белка, разбавленные до концентрации 20 мкг/мл ацетатным буферным раствором с рН 5,0, содержащим 5 мМ DTT, были иммобилизованы на поверхности карбоксиметил 5'-декстрана (чувствительный элемент СМ 5, Biacore Inc.) посредством аминной связи соответственно протоколу, рекомендованному компанией Biacore, при элюировании буферным раствором HBS-N(10 мМ HEPES, 0,15 М NaCl, 3 мМ ЭДТА, рН 7,4). Поверхностью чувствительного элемента CM5 улавливались приблизительно 10000-15000 резонансных единиц (RU) белков. Исходные растворы испытуемых соединений в ДМСО с концентрацией 1,5 мМ разбавляли последовательно буферным элюирующим раствором (50 мМ HEPES с рН 8; 150 мМ NaCl; 10 мМ MgCl2; 2% DMSO, 1 мМ DTT) до концентраций в интервале от 3,75 до 0,1 мкМ. Растворы испытуемых соединений с каждой концентрацией вводили при 4 С в течение 1 мин с подачей 30 мкл/мин. Диссоциацию регистрировали в течение 5 мин без осуществления другой процедуры регенерации поверхности. Полученные сигналы корректировали, тестируя растворы испытуемых соединений с каждой концентрацией на поверхности неизмененного декстрана (холостой опыт). Значение сигнала, обусловливаемого выходящим буферным раствором, уменьшали на значение общего сигнала ("double referencing"), a также соответственно эффекту ДМСО. Анализ сигналов осуществляли посредством программы анализа Biacore S51 (версия 1.2.1). Затем соединения оценивали в зависимости от максимального уровня их фиксации и кинетических параметров связи с иммобилизованным белком. Например, соединение 9 имеет сильное сродство, а соединение 10 имеет среднее сродство. Таким образом, из этого следует, что соединения по настоящему изобретению обладают модулирующим действием в отношении рецептора NOT. Следовательно, соединения по настоящему изобретению могут быть использованы для получения лекарственных средств с целью применения их в терапии при лечении или профилактике заболеваний, в механизме которых участвуют рецепторы NOT. Таким образом, объектами настоящего изобретения в одном из других его аспектов являются лекарственные средства, содержащие соединение формулы (I) или аддитивную соль данного соединения с фармацевтически приемлемой кислотой.- 11017442 Такие лекарственные средства находят применение в терапии, в частности при лечении и профилактике нейродегенеративных заболеваний, таких как, например, болезнь Паркинсона, болезнь Альцгеймера, таупатии (например, прогрессирующий супрануклеарный паралич, лобно-височная деменция, кортикобазальная дегенерация, болезнь Пика), рассеянный склероз; травмы головного мозга, такие, как ишемия и черепные травмы, и эпилепсия; психические заболевания, такие как шизофрения, депрессия,лекарственная зависимость, синдром дефицита внимания и гиперактивности; воспалительные заболевания, такие как сосудистые патологии, атеросклероз, воспаление суставов, артроз, ревматоидный артрит,остеоартрит, аллергические воспалительные заболевания, такие как астма, и на завершающей стадии лечения остеопороза и раковых заболеваний. Такие соединения также могут быть использованы при лечении, связанном с пересадкой и/или трансплантацией клеток-штаммов. Настоящее изобретение в одном из других своих аспектов относится к фармацевтическим композициям, содержащим в качестве активного вещества соединение по настоящему изобретению. Такие фармацевтические композиции содержат эффективную дозу по меньшей мере одного соединения по настоящему изобретению или одной фармацевтически приемлемой соли упомянутого соединения, а также по меньшей мере один фармацевтически приемлемый эксципиент. Указанные эксципиенты выбирают из традиционных эксципиентов, известных специалистам в данной области техники, в соответствии с требуемыми фармацевтической формой и способом введения. В фармацевтических композициях по настоящему изобретению, предназначенных для перорального, сублингвального, подкожного, внутримышечного, внутривенного, топического, местного, интратрахеального, интраназального, чрескожного или ректального введения указанное выше активное вещество формулы (I) или его соль может вводиться в стандартной лекарственной форме в смеси с традиционными фармацевтическими эксципиентами животным и человеку для профилактики или лечения указанных выше нарушений или заболеваний. Соответствующие стандартные лекарственные формы для введения включают в себя формы для перорального введения, такие как таблетки, капсулы с мягкой или твердой желатиновой оболочкой, порошки, гранулы и растворы или суспензии для приема внутрь, формы для сублингвального, трансбуккального, интратрахеального, интраокулярного, интраназального введения, путем ингаляции, формы для топического, чрескожного, подкожного, внутримышечного или внутривенного введения, формы для ректального введения и имплантаты. Для топического нанесения соединения по настоящему изобретению можно использовать в виде кремов, гелей, помад или лосьонов. В качестве примера стандартная лекарственная форма соединения по настоящему изобретению в форме таблеток может содержать следующие компоненты: Могут иметь место особые случаи, в которых дозы устанавливают увеличенными или уменьшенными; такие дозы также охватывает настоящее изобретение. По принятой практике соответствующие дозы для каждого пациента определяются врачом в зависимости от способа введения, массы тела и реакции пациента. Настоящее изобретение в одном из других своих аспектов относится также к способу лечения ранее упомянутых патологий, включающему в себя введение пациенту эффективной дозы соединения по настоящему изобретению или одной из его фармацевтически приемлемых солей. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение, соответствующее формуле (I) где R1 представляет собой фенил, который при необходимости может иметь в качестве заместителей один или два атома или группы, выбранные независимо друг от друга из галогена, (C1-C6)алкила,галоген(C1-C6)алкила, (C1-C6)алкокси, галоген(C1-C6)алкокси, гидроксила, цианогруппы, нитрогруппы,NRaRb, фенила; или нафтил;R2 представляет собой атом водорода или (C1-C6)алкил;R3 представляет собой атом водорода, (C1-C6)алкил, фенил;R4 представляет собой атом водорода; (C1-C6)алкил, при необходимости замещенный(C1-C6)алкокси; фенил, при необходимости замещенный заместителем, выбранным из галогена,(C1-C6)алкила, галоген(C1-C6)алкила, нитрогруппы, цианогруппы, (C1-C6)алкил(CO)-, CONRaRb;Ra и Rb представляют собой независимо друг от друга атом водорода или (C1-C6)алкил; в виде основания или кислотно-аддитивной соли. 2. Соединение формулы (I) по п.1, отличающееся тем, что R1 представляет собой фенил, который при необходимости может иметь в качестве заместителей один или два атома или группы, выбранные независимо друг от друга из галогена, (C1-C6)алкила, (C1-C6)алкокси, гидроксигруппы, цианогруппы,нитрогруппы, NRaRb; или нафтил, в виде основания или кислотно-аддитивной соли. 3. Соединение формулы (I) по п.1 или 2, отличающееся тем, чтоR2 и R3 представляют собой независимо друг от друга атом водорода; (C1-C6)алкил;R4 представляет собой атом водорода; (C1-C6)алкил, при необходимости замещенный(C1-C6)алкокси; фенил, при необходимости замещенный заместителем, выбранным из галогена,(C1-C6)алкила, галоген(C1-C6)алкила, нитрогруппы, цианогруппы, (C1-C6)алкил(CO)-,в виде основания или кислотно-аддитивной соли. 4. Соединение формулы (I) по любому из пп.1-3, отличающееся тем, что заместитель присоединен к фенилу в мета-положении, в виде основания или кислотно-аддитивной соли. 5. Соединение формулы (I) по п.1 или 3, отличающееся тем, чтоR4 представляет собой атом водорода;R2 и R3 представляют собой независимо друг от друга атом водорода, (C1-C6)алкил,в виде основания или кислотно-аддитивной соли. 6. Соединение формулы (I) по п.1, отличающееся тем, чтоR1 представляет собой фенил, который при необходимости может иметь в качестве заместителей один или два атома или группы, выбранные независимо друг от друга из галогена, (C1-C6)алкила,(C1-C6)алкокси, гидроксигруппы, цианогруппы, нитрогруппы, NRaRb, галоген(C1-C6)алкокси или фенила; или нафтил;R2 представляет собой атом водорода или (C1-C6)алкил;R3 представляет собой атом водорода, (C1-C6)алкил, фенил;R4 представляет собой атом водорода; (C1-C6)алкил, при необходимости замещенный(C1-C6)алкокси; фенил, при необходимости замещенный заместителем, выбранным из галогена,(C1-C6)алкила, галоген(C1-C6)алкила, нитрогруппы, цианогруппы, (C1-C6)алкил(CO)-, CONRaRb;Ra и Rb представляют собой независимо друг от друга атом водорода или (C1-C6)алкил,в виде основания или кислотно-аддитивной соли. 7. Соединение формулы (I) по п.1, отличающееся тем, чтоR1 представляет собой фенил, который при необходимости может иметь в качестве заместителей один или два атома или одну или две группы, выбранные независимо друг от друга из галогена,(C1-C6)алкила,(C1-C6)алкокси,гидроксигруппы,цианогруппы,нитрогруппы,NRaRb,галоген(C1-C6)алкокси; или нафтил;R2 представляет собой атом водорода или (C1-C6)алкил;R3 представляет собой атом водорода, (C1-C6)алкил, фенил;R4 представляет собой атом водорода; (C1-C6)алкил, при необходимости замещенный(C1-C6)алкокси; фенил, при необходимости замещенный заместителем, выбранным из галогена,(C1-C6)алкила, галоген(C1-C6)алкила, нитрогруппы, цианогруппы, (C1-C6)алкил(CO)-, CONRaRb; в виде основания или кислотно-аддитивной соли. 8. СоединенияN-4-[3-(2-п-толилимидазо[1,2-а]пиридин-6-ил)бензилокси]фенилацетамид; 6-[3-(3-нитрофеноксиметил)фенил]-2-п-толилимидазо[1,2-а]пиридин; 6-[3-(4-метилфеноксиметил)фенил]-2-п-толилимидазо[1,2-а]пиридин; 4-[3-(2-п-толилимидазо[1,2-а]пиридин-6-ил)бензилокси]бензонитрил; 1-4-[3-(2-п-толилимидазо[1,2-а]пиридин-6-ил)бензилокси]фенилэтанон; 6-[3-(4-трифторметилфеноксиметил)фенил]-2-п-толилимидазо[1,2-а]пиридин; 3-[2-(3-фтор-4-метилфенил)имидазо[1,2-а]пиридин-6-ил]фенилметанол; 2-3-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]фенилпропан-2-ол; 2-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]фенилметанол; гидрохлорид (1:1) 2-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]фенилметанола; рацемат 1-3-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]фенилэтанола; 3-[2-(2,4-дихлорфенил)имидазо[1,2-а]пиридин-6-ил]фенилметанол; 3-[2-(2,4-дифторфенил)имидазо[1,2-а]пиридин-6-ил]фенилметанол; 3-[2-(3,4-дифторфенил)имидазо[1,2-а]пиридин-6-ил]фенилметанол; гидрохлорид (1:1) 3-[2-(3,4-дифторфенил)имидазо[1,2-а]пиридин-6-ил]фенилметанола; 3-[2-(2-хлорфенил)имидазо[1,2-а]пиридин-6-ил]фенилметанол; 3-[2-(4-трифторметилфенил)имидазо[1,2-а]пиридин-6-ил]фенилметанол; 3-[2-(4-(дифторметил)фенил)имидазо[1,2-а]пиридин-6-ил]фенилметанол; рацемат 1-2-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]фенилэтанола; 2-(4-хлорфенил)-6-(2-метоксиметилфенил)имидазо[1,2-а]пиридин; гидрохлорид (1:1) 2-(4-хлорфенил)-6-(2-метоксиметилфенил)имидазо[1,2-а]пиридина; 2-(4-хлорфенил)-6-(4-метоксиметилфенил)имидазо[1,2-а]пиридин; рацемат 1-3-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]фенилпропан-1-ола; рацемат 1-3-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]фенилпентан-1-ола; рацемат 1-3-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]фенилгептан-1-ола; рацемат 1-3-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]фенил-3-метилбутан-1-ола; рацемат 3-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]фенилциклопентилметанола; рацемат 3-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]фенилфенилметанола; правовращающий энантиомер 1-3-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]фенилэтанола; левовращающий энантиомер 1-3-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]фенилэтанола; 2-(4-хлорфенил)-6-(3-метоксиметилфенил)имидазо[1,2-а]пиридин; рацемат 1-4-[2-(4-хлорфенил)имидазо[1,2-а]пиридин-6-ил]фенилэтанола; рацемат 1-3-[2-(2,4-дифторфенил)имидазо[1,2-а]пиридин-6-ил]фенилэтанола; рацемат 1-3-[2-(4-фторфенил)имидазо[1,2-а]пиридин-6-ил]фенилэтанола; рацемат 1-3-[2-(3,4-дифторфенил)имидазо[1,2-а]пиридин-6-ил]фенилэтанола; рацемат 1-3-[2-(2-хлорфенил)имидазо[1,2-а]пиридин-6-ил]фенилэтанола; рацемат 1-3-[2-(3-фторфенил)имидазо[1,2-а]пиридин-6-ил]фенилэтанола; рацемат 1-3-[2-(3-хлорфенил)имидазо[1,2-а]пиридин-6-ил]фенилэтанола; 4-[6-(3-гидроксиметилфенил)имидазо[1,2-а]пиридин-2-ил]фенол в виде основания или кислотно-аддитивной соли. 9. Лекарственное средство, отличающееся тем, что оно содержит соединение формулы (I) по любому из пп.1-8 или аддитивную соль такого соединения с фармацевтически приемлемой кислотой. 10. Фармацевтическая композиция, отличающаяся тем, что она содержит соединение формулы (I) по любому из пп.1-8 или фармацевтически приемлемую соль такого соединения, а также по меньшей мере один фармацевтически приемлемый эксципиент. 11. Применение соединения формулы (I) по любому из пп.1-8 для получения лекарственного- 14017442 средства, предназначенного для лечения и профилактики нейродегенеративных заболеваний. 12. Применение соединения формулы (I) по любому из пп.1-8 для получения лекарственного средства, предназначенного для лечения и профилактики травм головного мозга и эпилепсии. 13. Применение соединения формулы (I) по любому из пп.1-8 для получения лекарственного средства, предназначенного для лечения и профилактики психических заболеваний. 14. Применение соединения формулы (I) по любому из пп.1-8 для получения лекарственного средства, предназначенного для лечения и профилактики воспалительных заболеваний. 15. Применение соединения формулы (I) по любому из пп.1-8 для получения лекарственного средства, предназначенного для лечения и профилактики остеопороза и раковых заболеваний. 16. Применение соединения формулы (I) по любому из пп.1-8 для получения лекарственного средства, предназначенного для лечения, связанного с пересадкой и/или трансплантацией клетокштаммов. 17. Применение соединения формулы (I) по любому из пп.1-8 для получения лекарственного средства, предназначенного для лечения и профилактики болезни Паркинсона, болезни Альцгеймера,таупатий и рассеянного склероза. 18. Применение соединения формулы (I) по любому из пп.1-8 для получения лекарственного средства, предназначенного для лечения и профилактики шизофрении, депрессии, лекарственной зависимости и синдрома дефицита внимания и гиперактивности. 19. Способ получения соединений формулы (I) по п.1, отличающийся тем, что соединения получают реакцией сочетания, катализируемой тетракис-(трифенилфосфин)палладием, между 2-арилимидазопиридином общей формулы (II) в которой Hal представляет собой атом галогена,и производным общей формулы (III) в которой X представляет собой производное бора или олова;
МПК / Метки
МПК: A61K 31/437, A61P 25/00, A61P 19/10, A61P 35/00, C07D 471/04
Метки: производные, 2-арил-6-фенилимидазо[1,2-a]пиридинов, терапии, получение, применение
Код ссылки
<a href="https://eas.patents.su/16-17442-proizvodnye-2-aril-6-fenilimidazo12-apiridinov-ih-poluchenie-i-primenenie-v-terapii.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 2-арил-6-фенилимидазо[1,2-a]пиридинов, их получение и применение в терапии</a>
Предыдущий патент: Вакцинация против гриппа по схеме многократного введения с использованием безадъювантной дозы
Следующий патент: Производные тетрагидрохинолина для лечения посттравматических стрессовых расстройств
Случайный патент: Накладка с электростатическими свойствами для выявления аллергенов и её применение












