Способ получения 1-[2-(2-хлор-4-формил-5-метоксифенилкарбамоил)этил]пиперидин-4-илового эфира бифенил-2-илкарбаминовой кислоты
Формула / Реферат
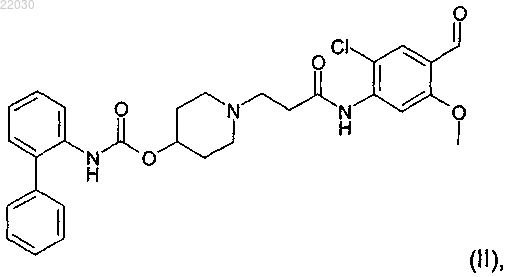
1. Способ получения соединения формулы (II)
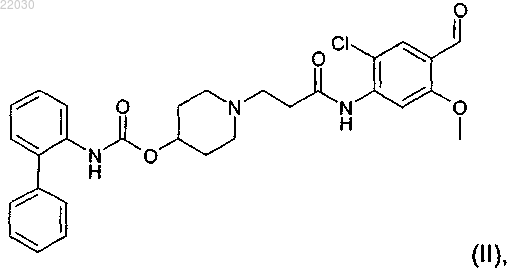
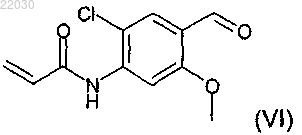
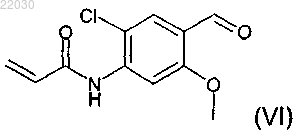
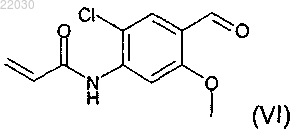
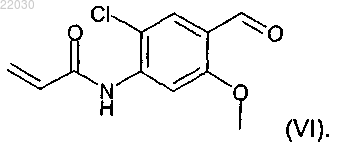
включающий взаимодействие соединения формулы (VI)
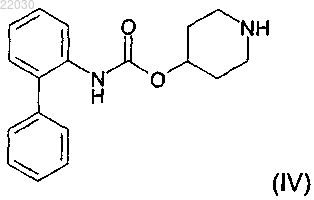
с соединением формулы (IV)
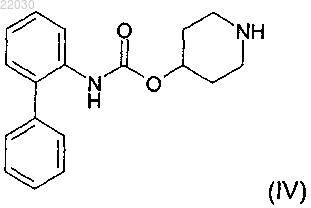
в апротонном или протонном растворителе.
2. Способ по п.1, где взаимодействие проводят в апротонном растворителе.
3. Способ по п.2, где апротонный растворитель представляет собой 2-метилтетрагидрофуран.
4. Способ по любому из пп.1-3, дополнительно включающий добавление органической карбоновой кислоты.
5. Способ по п.4, где органическая карбоновая кислота представляет собой уксусную кислоту.
6. Способ по любому из пп.1-5, где взаимодействие проводят при температуре от температуры окружающей среды до температуры дефлегмации выбранного растворителя.
7. Способ по п.1 получения соединения формулы (II)
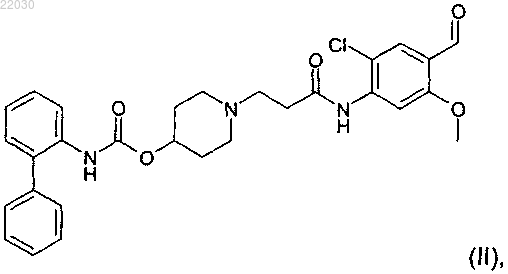
включающий взаимодействие соединения формулы (VI)
с соединением формулы (IV)
в присутствии 2-метилтетрагидрофурана в качестве апротонного растворителя и дополнительно уксусной кислоты, где взаимодействие проводят при температуре 75°C.
8. Способ по п.7, где после взаимодействия реакционную смесь охлаждают до 60°C, добавляют затравку 1-[2-(2-хлор-4-формил-5-метоксифенилкарбамоил)этил]пиперидин-4-илового эфира бифенил-2-илкарбаминовой кислоты, выдерживают при 60°C в течение 30 мин и затем охлаждают до 20°C в течение 4 ч.
9. Способ по п.1 получения соединения формулы (II)
включающий взаимодействие соединения формулы (VI)
с соединением формулы (IV)

в присутствии 2-метилтетрагидрофурана в качестве апротонного растворителя и дополнительно уксусной кислоты, где взаимодействие проводят при температуре 50°C.
10. Способ по п.9, где после взаимодействия реакционную смесь охлаждают до 20°C в течение 90 мин и затем выдерживают при 20°C в течение 4 ч.
11. Соединение формулы (VI), которое представляет собой N-[2-хлор-4-формил-5-(метилокси)фенил]-2-пропенамид
Текст
Раскрыт способ получения соединения формулы (II) Эдни Дин Дейвид, Джон Мэттью Питер (GB) включающий взаимодействие соединения формулы (VI) в апротонном или протонном растворителе.(71)(73) Заявитель и патентовладелец: ГЛАКСО ГРУП ЛИМИТЕД (GB) Настоящее изобретение относится к новой, ключевой стадии способа получения 1-[2-(2-хлор-4[(R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5-ил)этиламино]метил-5 метоксифенилкарбамоил)этил]пиперидин-4-илового эфира бифенил-2-илкарбаминовой кислоты, обладающего как активностью антагониста в отношении мускариновых рецепторов, так и активностью агониста в отношении 2-адренергических рецепторов. В публикации международной заявки WO 2004/074246 (Theravance Inc, South San Francisco, California, US), поданной 13 февраля 2004 г., раскрыты новые бифенильные соединения, которые полезны в лечении легочных расстройств, таких как хроническая обструктивная болезнь легких (ХОБЛ) и астма. В частности, соединение 1-[2-(2-хлор-4-[(R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5 ил)этиламино]метил-5-метоксифенилкарбамоил)этил]пиперидин-4-иловый эфир бифенил-2 илкарбаминовой кислоты раскрыто в качестве обладающего как активностью антагониста в отношении мускариновых рецепторов, так и активностью агониста в отношении 2-адренергических рецепторов. Химическая структура 1-[2-(2-хлор-4-[(R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5 ил)этиламино]метил-5-метоксифенилкарбамоил)этил]пиперидин-4-илового эфира бифенил-2 илкарбаминовой кислоты представлена формулой (I) В WO 2004/074246 раскрыт способ получения соединения формулы (I). Важным промежуточным соединением при получении соединения формулы (I) является 1-[2-(2 хлор-4-формил-5-метоксифенилкарбамоил)этил]пиперидин-4-иловый эфир бифенил-2-илкарбаминовой кислоты (также известный как 1-(3-[2-хлор-4-формил-5-(метилокси)фенил]амино-3-оксопропил)-4 пиперидинил-2-бифенилилкарбамат), представленный формулой (II) Ключевой стадией, раскрытой в WO 2004/074246 (получение 95), при получении соединения формулы (II) является взаимодействие метил-4-(акрилоиламино)-5-хлор-2-(метилокси)бензоата, представленного формулой (III) В этом взаимодействии соединение формулы (III) находится в степени окисления эфира. Поэтому, вWO 2004/074246 приведены две дополнительные стадии взаимодействия, которые необходимы для превращения соединения формулы (V) в соединение формулы (II), обе формулы которых приведены выше. Во-первых, восстановление до степени окисления спирта и, во-вторых, окисление до степени окисления альдегида. Таким образом, начиная с реакции сочетания между соединением формулы (III) и соединением формулы (IV), необходимы три стадии способа для получения ключевого промежуточного соединения 1-[2-(2-хлор-4-формил-5-метоксифенилкарбамоил)этил]пиперидин-4-илового эфира бифенил-2 илкарбаминовой кислоты. В двух более поздних публикациях международных заявок WO 2006/023454 и WO 2007/090859 также раскрыты трехстадийные способы получения 1-[2-(2-хлор-4-формил-5 метоксифенилкарбамоил)этил]пиперидин-4-илового эфира бифенил-2-илкарбаминовой кислоты, где первая стадия представляет собой взаимодействие метил-4-(акрилоиламино)-5-хлор-2(метилокси)бензоата с пиперидин-4-иловым эфиром бифенил-2-илкарбаминовой кислоты. Задача настоящего изобретения состоит в том, чтобы предложить новый альтернативный, более эффективный и более экономичный способ получения соединения формулы (II), ключевого промежуточного соединения при получении 1-[2-(2-хлор-4-[(R)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2 дигидрохинолин-5-ил)этиламино]метил-5-метоксифенилкарбамоил)этил]пиперидин-4-илового эфира бифенил-2-илкарбаминовой кислоты. Таким образом, согласно настоящему изобретению предложен способ получения соединения формулы (II) включающий взаимодействие соединения формулы (VI) в подходящем растворителе. Этот новый альтернативный способ приводит к уменьшению числа стадий, необходимых для получения соединения формулы (II), с трех стадий до одной стадии, предоставляя ряд преимуществ. С экономической точки зрения этот способ приводит к значительному снижению продолжительности производственного цикла, уменьшению отходов растворителя и повышенной производительности по массе. Кроме того, данный улучшенный способ разрешает проблемы, связанные с охраной труда и техникой безопасности, благодаря исключению использования опасных восстановителей, борогидрида лития и алюмогидрида лития, и уменьшает количество отходов металла (марганец, литий) в способе. Борогидрид лития указан в получении 96 (WO 2004/074246) и получении 5 (WO 2006/023454). Алюмогидрид лития указан в получении 15 (WO 2006/023454). Диоксид марганца указан в получении 16 (WO 2006/023454) и примере 1 (WO 2007/090859). Неожиданная стабильность соединения формулы (VI) в сочетании с его непредвиденной избирательностью взаимодействия при обработке соединением формулы (IV) дает возможность успешно провести этот одностадийный процесс. Взаимодействие между соединением формулы (VI) и соединением формулы (IV) проводят в подходящем растворителе. Подходящие растворители могут включать апротонные и протонные растворители. Примеры подходящих апротонных растворителей включают ацетонитрил, 2-метилтетрагидрофуран, тетрагидрофуран, этилацетат, диметилформамид и толуол, но не ограничены ими. Примеры подходящих протонных растворителей включают этанол, метанол, изопропиловый спирт и фенол, но не ограничены ими. В дополнительном аспекте изобретения взаимодействие проводят в 2-метилтетрагидрофуране в качестве растворителя. Способ возможно дополнительно включает добавление источника подходящей органической кислоты. Примеры подходящих органических кислот включают органические карбоновые кислоты, такие как уксусная кислота, муравьиная кислота и бензойная кислота. Добавление подходящей органической карбоновой кислоты в данном способе улучшает профиль распределения примесей при взаимодействии. Таким образом, в дополнительном аспекте изобретения способ дополнительно включает добавление источника органической кислоты. В еще одном дополнительном аспекте изобретения источник органической кислоты представляет собой органическую карбоновую кислоту. В еще одном дополнительном аспекте изобретения органическая карбоновая кислота представляет собой уксусную кислоту. Взаимодействие можно проводить при температуре между температурой окружающей среды и температурой дефлегмации выбранного растворителя и поддерживать при этой температуре до завершения взаимодействия. Продукт реакции можно кристаллизовать из раствора с использованием различных стандартных методик кристаллизации, таких как кристаллизация путем охлаждения или кристаллизация с добавлением антирастворителя. При кристаллизации путем охлаждения реакционную смесь, содержащую растворенное соединение, загрязненное примесями, медленно охлаждают и возможно добавляют затравку, что приводит к образованию кристаллов требуемого соединения, которые нужно отделить от раствора. После кристаллизации кристаллы могут быть отделены посредством фильтрации, промыты с использованием подходящего растворителя и высушены. В дополнительном аспекте изобретения,когда взаимодействие проводят в 2 метилтетрагидрофуране в качестве растворителя и с добавлением уксусной кислоты в качестве источника органической кислоты, реакционную смесь охлаждают до 60C, добавляют затравку 1-[2-(2-хлор-4 формил-5-метоксифенилкарбамоил)этил]пиперидин-4-илового эфира бифенил-2-илкарбаминовой кислоты, выдерживают при 60C в течение 30 мин и затем охлаждают до 20C на протяжении 4 ч. Кристаллизация с добавлением антирастворителя может быть использована в качестве альтернативы кристаллизации путем охлаждения для выделения и очистки интересующего соединения. При кристаллизации с добавлением антирастворителя соединение, загрязненное примесями, растворяют в подходящем растворителе. Добавление антирастворителя уменьшает растворимость интересующего соединения в растворе, способствуя образованию кристаллов требуемого соединения. После кристаллизации кристаллы могут быть выделены посредством фильтрации, промыты с использованием подходящего растворителя и высушены. В дополнительном аспекте изобретения, когда взаимодействие проводят в толуоле в качестве растворителя, реакционную смесь концентрируют при 50C и добавляют денатурированный этанол в качестве антирастворителя для осуществления кристаллизации. Смесь выдерживают при 60C в течение 4 ч и затем охлаждают до 20C на протяжении 4 ч. В дополнительном аспекте изобретения предложено соединение формулы (VI) Экспериментальная часть. Изобретение проиллюстрировано следующим примером. Пример. Стадия А: получение 4-бром-2-хлор-5-метоксианилина 1,3-Дибром-5,5-диметилгидантоин (имеющийся в продаже, например от фирмы Aldrich) (9,1 г; 32 ммоль) добавляли в течение 20 мин к перемешиваемому раствору 6-хлор-3-метоксианилина (имеющийся в продаже, например от фирмы Apollo Scientific) (10,0 г; 63 ммоль) в этилацетате (150 мл) при -5C. Полученный раствор перемешивали при -5C в течение 1 ч, затем промывали раствором карбоната калия (6 г; 43 ммоль) в воде (40 мл) и затем водой (20 мл). Полученный раствор концентрировали при пониженном давлении с получением 4-бром-2-хлор-5-метоксианилина в виде светло-коричневого твердого вещества (14,3 г; 95%). 1 Н ЯМР (400 МГц, CDCl3) H (млн-1) 7.38 (1 Н, s), 6.34 (1 Н, s), 4.02-4.14 (2 Н, уширенный s), 3.83 (3H,s). Хлорид изопропилмагния (2 M в тетрагидрофуране; 23 мл; 46 ммоль) (имеющийся в продаже, например от фирмы Aldrich) добавляли в течение 5 мин к перемешиваемому раствору 4-бром-2-хлор-5 метоксианилина (стадия А) (10 г; 42 ммоль) в тетрагидрофуране (70 мл) при -10C. Полученный раствор оставляли нагреваться до 0C в течение 50 мин с получением густой суспензии, затем охлаждали до-25C и добавляли н-бутиллитий (1,6 М в гексанах; 90 мл; 144 ммоль) в течение 20 мин с последующим добавлением тетрагидрофура на (20 мл). Этот раствор нагревали до -10C в течение 30 мин и затем добавляли N,N-диметилформамид (16 мл; 207 ммоль) в течение 5 мин и полученную густую суспензию нагревали до 0C в течение 20 мин. Осторожно добавляли раствор лимонной кислоты (22 г; 105 ммоль) в воде (50 мл) в течение 15 мин, поддерживая температуру реакции менее 10C. Суспензию выдерживали при 20C в течение 30 мин, затем фильтровали под вакуумом. Осадок на фильтре промывали водой (100 мл) и затем сушили под вакуумом при 40C в течение 16 ч с получением 4-амино-5-хлор-2 метоксибензальдегида (6,1 г; 80% теор.) в виде светло-желтого твердого вещества. 1 Н ЯМР (400 МГц, ДМСО-d6) H (млн-1) 9.95 (1 Н, s), 7.49 (1 Н, s), 6.50-6.57 (2 Н, уширенный s), 6.44 Получение 1. Акриловую кислоту (имеющуюся в продаже, например от фирмы Aldrich) (46 мл; 0,67 моль) медленно добавляли к перемешиваемой суспензии 4-амино-5-хлор-2-метоксибензальдегида (стадия В) (50,0 г; 0,27 моль) и триэтиламина (204 г; 2,02 моль) в этилацетате (0,85 л) при 25C. Ангидрид пропанфосфоновой кислоты (50% в этилацетате; 429 г; 0,67 моль) добавляли в течение 30 мин, поддерживая температуру реакции 30-40C. Эту смесь перемешивали при 30-40C в течение еще 1 ч и затем охлаждали до 25C и разбавляли водой (0,26 л) и подкисляли 32% соляной кислотой (108 г) до рН 2-3. Органический слой отделяли и промывали смесью воды (0,23 л) и 32% гидроксида натрия (14 г) - рН водного слоя составлял приблизительно 7. Органическую фазу промывали водой (0,23 л) и затем концентрировали при пониженном давлении (приблизительно 300 мбар (30 кПа с удалением 0,56 кг дистиллята. Добавляли метилциклогексан (335 г) и затем удаляли еще 286 г дистиллята при пониженном давлении. Добавляли метилциклогексан (111 г) и затем полученную суспензию охлаждали до 20C, фильтровали и промывали метилциклогексаном. Осадок на фильтре сушили при 40C при пониженном давлении в течение 12 ч с получением N-[2-хлор-4-формил-5-(метилокси)фенил]-2-пропенамида (46 г; 71%). Получение 2. 3-Хлорпропионилхлорид (98,4 мл; 1,0 моль) добавляли в течение 30 мин к перемешиваемой суспензии 4-амино-5-хлор-2-метоксибензальдегида (47,4 г; 0,26 моль), не допуская, чтобы температура реакции превышала 20C. По завершении добавления реакционную смесь перемешивали при 20C в течение еще 2 ч и затем фильтровали. Фильтрат концентрировали до 150 мл при пониженном давлении и затем разбавляли этилацетатом (100 мл) и водой (400 мл). Смесь перемешивали при 20C в течение 1 ч и затем фильтровали с получением 3-хлор-N-[2-хлор-4-формил-5-(метилокси)фенил]пропанамида в виде желтоватого твердого вещества, которое не выделяли, а суспендировали в тетрагидрофуране (730 мл) и обрабатывали диизопропилэтиламином (154 мл; 0,88 моль). Полученную смесь перемешивали при 45C в течение 46 ч и затем концентрировали при пониженном давлении с получением остатка, который разбавляли этилацетатом (300 мл), промывали 2 М соляной кислотой (4100 мл) и концентрировали при пониженном давлении с получением N-[2-хлор-4-формил-5-(метилокси)фенил]-2-пропенамида (37,8 г; 62%). 1 Н ЯМР (400 МГц, CDCl3) H (млн-1) 10.31 (1 Н, s), 8.43 (1 Н, s), 8.02 (1 Н, уширенный s), 7.82 (1 Н, s),6.47-6.53 (1 Н, dd), 6.28-6.38 (1 Н, dd), 5.88-5.93 (1 Н, dd), 3.96 (3H, s). Получение 1. Пиперидин-4-иловый эфир бифенил-2-илкарбаминовой кислоты (который может быть получен согласно получению 8, описанному в WO 2004/074246A) (1,03 кг; 3,48 моль) добавляли порциями в течение 5 мин к перемешиваемому раствору N-[2-хлор-4-формил-5-(метилокси)фенил]-2-пропенамида (который может быть получен согласно стадии С (получение 1) или С (получение 2 (0,81 кг; 3,38 моль) и уксусной кислоты (0,39 л; 6,62 моль) в 2-метилтетрагидрофуране (8,1 л) при 60C. Полученный раствор нагревали до 75C и выдерживали при этой температуре в течение 2 ч. Раствор охлаждали до 60C, добавляли затравку 1-[2-(2-хлор-4-формил-5-метоксифенилкарбамоил)этил]пиперидин-4-илового эфира бифенил-2-илкарбаминовой кислоты (4,0 г), выдерживали при 60C в течение 30 мин и затем охлаждали до 20C в течение 4 ч. Полученную суспензию фильтровали под вакуумом и осадок на фильтре промывали IMS (промышленный метилированный спирт) (31,6 л). Твердое вещество сушили в вакуумной печи при 50C в течение 10 ч с получением 1-[2-(2-хлор-4-формил-5 метоксифенилкарбамоил)этил]пиперидин-4-илового эфира бифенил-2-илкарбаминовой кислоты в виде белого твердого вещества (1,50 кг; 82% теор.). 1 Н ЯМР (400 МГц, ДМСО-d6) H (млн-1) 10.70 (1 Н, s), 10.19 (1 Н, s), 8.68 (1 Н, s), 8.25 (1 Н, s), 7.72m/z (ES+) 536 (М+Н). Получение 2. Пиперидин-4-иловый эфир бифенил-2-илкарбаминовой кислоты (который может быть получен согласно получению 8, описанному в WO 2004/074246A) (63,0 кг; 212,57 моль) добавляли к перемешиваемой суспензии N-[2-хлор-4-формил-5-(метилокси)фенил]-2-пропенамида (который может быть получен согласно стадии С (получение 1) или С (получение 2 (50,0 кг; 208,62 моль) и уксусной кислоты (12,6 кг; 209,83 моль) в 2-метилтетрагидрофуране (430 кг) при 25C. Эту смесь затем нагревали до 50C в течение 60 мин и выдерживали при этой температуре в течение 2 ч. Полученную суспензию охлаждали до 20C в течение 90 мин и выдерживали при этой температуре в течение 4 ч. Суспензию фильтровали под вакуумом и осадок на фильтре промывали IMS (378,9 кг). Твердое вещество сушили в вакуумной печи при 50C в течение 10 ч с получением 1-[2-(2-хлор-4-формил-5-метоксифенилкарбамоил)этил]пиперидин-4 илового эфира бифенил-2-илкарбаминовой кислоты в виде белого твердого вещества (90,7 кг; 80,6% теор.). Волновое число максимумов полос поглощения инфракрасного (ИК) спектра (см-1): 3413, 2775,1731, 1698, 1677, 1575, 1515, 1443, 1447, 1401, 1376, 1206, 1043, 1001, 758, 702. Время удерживания в ЖХ (жидкостной хроматографии) составляет 4,58 мин. Оборудование. Спектры 1 Н ЯМР регистрировали на спектрометре Bruker DPX400 с частотой 400 МГц либо вCDCl3, либо ДМСО-d6. Масс-спектры регистрировали на масс-спектрометре Waters LCT с ионизацией электрораспылением в режиме положительных ионов, диапазон массовых чисел 100-1000 (ZQ) или 150-1500 (LCT) а.е.м.(атомных единиц массы). ИК-спектры регистрировали в виде спектров НПВО твердого образца на спектрометре Perkin ElmerSpectrum 100 FTIR при использовании 16-кратного накопления сигнала с разрешением 2,0 см-1. НПВО означает нарушенное полное внутреннее отражение. Хроматограммы ВЭЖХ (высокоэффективной жидкостной хроматографии) регистрировали на ВЭЖХ-хроматографе серии Hewlett Packard Agilent 1100 при следующих условиях: ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения соединения формулы (II) включающий взаимодействие соединения формулы (VI) в апротонном или протонном растворителе. 2. Способ по п.1, где взаимодействие проводят в апротонном растворителе. 3. Способ по п.2, где апротонный растворитель представляет собой 2-метилтетрагидрофуран. 4. Способ по любому из пп.1-3, дополнительно включающий добавление органической карбоновой кислоты. 5. Способ по п.4, где органическая карбоновая кислота представляет собой уксусную кислоту. 6. Способ по любому из пп.1-5, где взаимодействие проводят при температуре от температуры окружающей среды до температуры дефлегмации выбранного растворителя. 7. Способ по п.1 получения соединения формулы (II) включающий взаимодействие соединения формулы (VI) в присутствии 2-метилтетрагидрофурана в качестве апротонного растворителя и дополнительно уксусной кислоты, где взаимодействие проводят при температуре 75C. 8. Способ по п.7, где после взаимодействия реакционную смесь охлаждают до 60C, добавляют затравку 1-[2-(2-хлор-4-формил-5-метоксифенилкарбамоил)этил]пиперидин-4-илового эфира бифенил-2 илкарбаминовой кислоты, выдерживают при 60C в течение 30 мин и затем охлаждают до 20C в течение 4 ч. 9. Способ по п.1 получения соединения формулы (II) включающий взаимодействие соединения формулы (VI) в присутствии 2-метилтетрагидрофурана в качестве апротонного растворителя и дополнительно уксусной кислоты, где взаимодействие проводят при температуре 50C. 10. Способ по п.9, где после взаимодействия реакционную смесь охлаждают до 20C в течение 90 мин и затем выдерживают при 20C в течение 4 ч. 11. Соединение формулы (VI), которое представляет собой N-[2-хлор-4-формил-5(метилокси)фенил]-2-пропенамид
МПК / Метки
МПК: C07D 211/46, C07C 233/33
Метки: кислоты, эфира, 1-[2-(2-хлор-4-формил-5-метоксифенилкарбамоил)этил]пиперидин-4-илового, способ, получения, бифенил-2-илкарбаминовой
Код ссылки
<a href="https://eas.patents.su/8-22030-sposob-polucheniya-1-2-2-hlor-4-formil-5-metoksifenilkarbamoiletilpiperidin-4-ilovogo-efira-bifenil-2-ilkarbaminovojj-kisloty.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения 1-[2-(2-хлор-4-формил-5-метоксифенилкарбамоил)этил]пиперидин-4-илового эфира бифенил-2-илкарбаминовой кислоты</a>
Предыдущий патент: Производные тиенопиримидиндиона в качестве модуляторов trpa1
Следующий патент: Способ и агломерационное устройство ленточного типа для непрерывного спекания гранулированного минерального материала
Случайный патент: Упаковка для замороженных продуктов












