5-амино-4-гидроксипентоиламиды
Номер патента: 20758
Опубликовано: 30.01.2015
Авторы: Тюринг Йоханнес Вильхельмус Й., Самуэльссон Бенгт Бертил, Паркес Кевин, Вегнер Йорг Курт, Кестелейн Барт Рудольф Романи, Калаянов Генадий, Валльберг Ханс Кристиан, Схепенс Вим Берт Грит
Формула / Реферат
1. Соединение формулы I
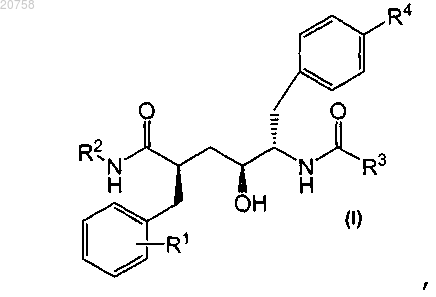
где R1 представляет собой галоген, C1-4алкокси, трифторметокси;
R2 представляет собой группу формулы
R3 представляет собой группу формулы
R4 представляет собой группу формулы
n равно 0 или 1;
каждый А независимо представляет собой CH или N;
R5 и R6 независимо представляют собой водород, C1-4алкил или галоген;
R7 представляет собой C1-4алкил или C1-4алкокси-C1-4алкил;
R8 представляет собой C1-4алкил или C1-4алкокси-C1-4алкил;
каждый R9 независимо представляет собой C1-4алкил, циклопропил, трифторметил, C1-4алкокси или диметиламино;
R10 представляет собой водород, C1-4алкил, циклопропил, трифторметил, C1-4алкокси или диметиламино;
R11 представляет собой водород или C1-4алкил;
его фармацевтически приемлемые аддитивные соли и фармацевтически приемлемые сольваты.
2. Соединение по п.1, где R1 представляет собой галоген или метокси.
3. Соединение по п.1, где R1 представляет собой фтор или хлор, где фтор или хлор расположен в орто-положении, или R1 представляет собой метокси, где метокси расположен в мета-положении.
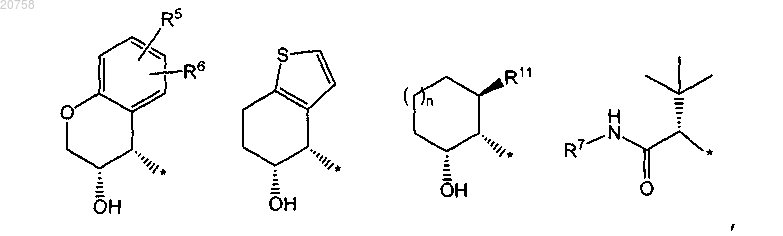
4. Соединение по любому из пп.1-3, где R2 представляет собой группу формулы
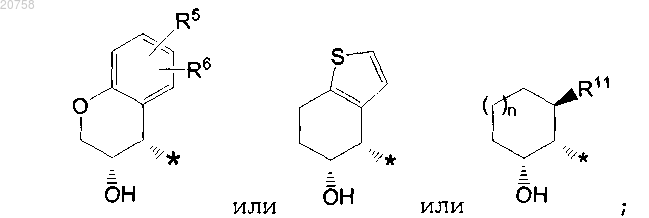
5. Соединение по любому из пп.1-3, где R2 представляет собой группу формулы
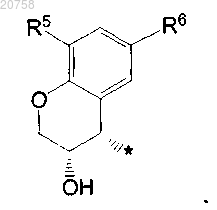
6. Соединение по любому из пп.1-5, где
R5 представляет собой водород и R6 представляет собой галоген или C1-4алкил; R5 представляет собой галоген и R6 представляет собой водород; R5 представляет собой галоген или C1-4алкил и R6 представляет собой водород, или оба R5 и R6 представляют собой водород, или оба представляют собой галоген;
R11 представляет собой C1-4алкил.
7. Соединение по любому из пп.1-5, где
R5 представляет собой водород и R6 представляет собой фтор или хлор; R5 представляет собой фтор или хлор и R6 представляет собой водород; R5 представляет собой водород и R6 представляет собой метил; оба R5 и R6 представляют собой водород или R5 представляет собой хлор и R6 представляет собой фтор; более конкретно R5 представляет собой водород и R6 представляет собой фтор; R5 представляет собой хлор и R6 представляет собой водород; R5 представляет собой водород и R6 представляет собой метил; оба R5 и R6 представляют собой водород или R5 представляет собой хлор и R6 представляет собой фтор;
R11 представляет собой метил.
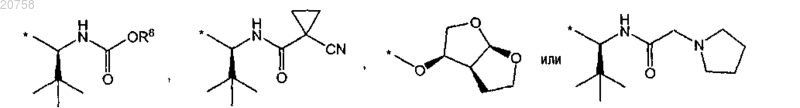
8. Соединение по любому из пп.1-7, где R3 представляет собой группу формулы
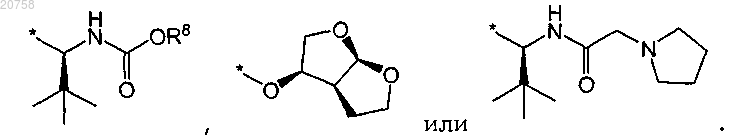
9. Соединение по любому из пп.1-7, где R3 представляет собой группу формулы
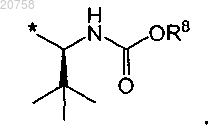
10. Соединение по п.9, где R8 представляет собой метил или 2-метоксиэтил.
11. Соединение по пп.1-10, где R9 представляет собой C1-2алкокси или диметиламино.
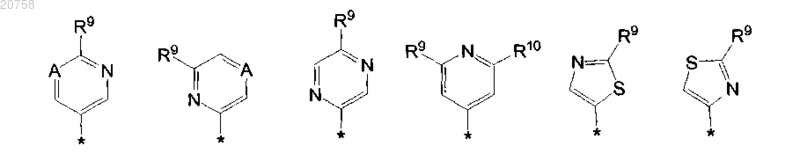
12. Соединение по любому из пп.1-11, где R4 представляет собой группу, имеющую химическую структуру, определенную в п.1, но где в первой группе R9 представляет собой R9a, во второй группе R9 представляет собой R9b, в третьей группе R9 представляет собой R9c, в четвертой группе R9 представляет собой R9d, в пятой и в шестой группе R9 представляет собой R9e, и эти группы могут быть представлены следующим образом:
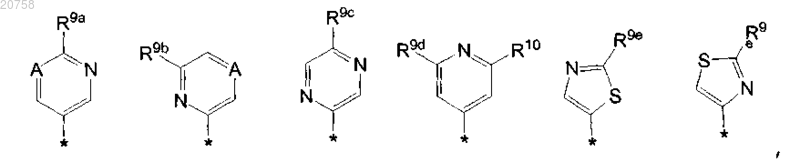
где каждый А независимо представляет собой CH или N;
R9a представляет собой C1-4алкокси или диметиламино;
R9b представляет собой C1-4алкокси или диметиламино;
R9c представляет собой C1-4алкокси или диметиламино;
R9d представляет собой C1-4алкил, циклопропил, трифторметил;
R10 представляет собой водород, C1-4алкил, циклопропил или трифторметил или R10 представляет собой водород, метил, циклопропил или трифторметил;
каждый R9e независимо представляет собой C1-4алкил, циклопропил, C1-4алкокси или диметиламино.
13. Соединение по п.12, где в R9a, R9b, R9c, R9d или R9e C1-4алкокси представляет собой метокси и C1-4алкил представляет собой метил.
14. Соединение по любому из пп.1-7, где R4 представляет собой
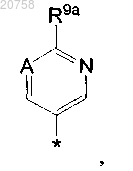
где А представляет собой CH и R9a представляет собой метокси или диметиламино.
15. Соединение по п.1, имеющее формулу
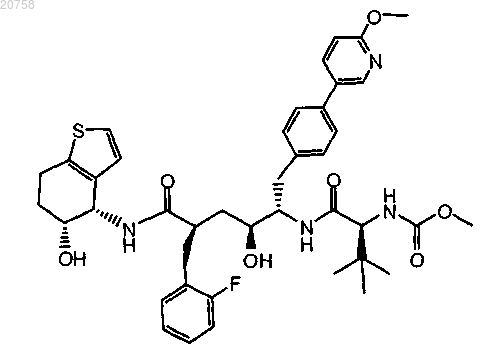
16. Соединение по п.1, имеющее формулу
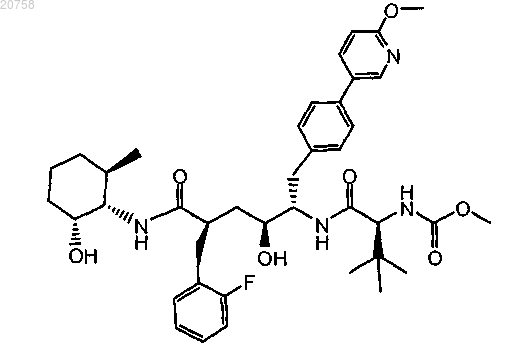
17. Соединение по п.1, имеющее формулу
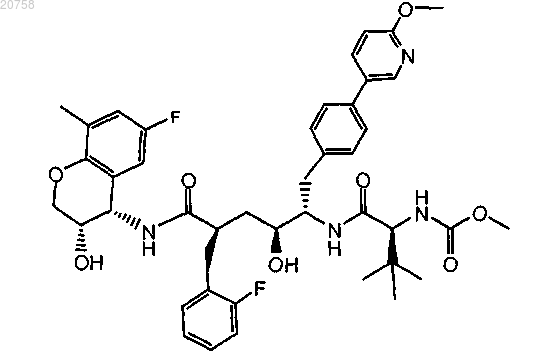
18. Применение соединения по любому из пп.1-17 в качестве лекарственного средства для лечения или профилактики ВИЧ инфекции.
19. Фармацевтическая композиция для лечения ВИЧ инфекции, содержащая эффективное количество соединения формулы I, определенного в любом из пп.1-17, и носитель.
Текст
Ингибиторы ВИЧ формулы (I), где R1 представляет собой галоген, C1-4 алкокси, трифторметокси; R2 представляет собой группу формулы (A); R3 представляет собой группу формулы (B); R4 представляет собой группу формулы (C); n равно 0 или 1; А представляет собой CH или N; R5 и R6 представляют собой водород, C1-4 алкил, галоген; R7 и R8 представляют собой C1-4 алкил или C1-4 алкокси-C1-4 алкил; R9 представляет собой C1-4 алкил, циклопропил, трифторметил, C1-4 алкокси или диметиламино; R10 представляет собой водород, C1-4 алкил, циклопропил, трифторметил, C1-4 алкокси или диметиламино; их фармацевтически приемлемые аддитивные соли и сольваты; фармацевтические композиции, содержащие указанные соединения в качестве активного ингредиента, и способы получения указанных соединений.(71)(73) Заявитель и патентовладелец: ЯНССЕН Ар ЭНД Ди АЙРЛЭНД (IE); МЕДИВИР АБ (SE)(72) Изобретатель: Калаянов Генадий (SE), Кестелейн Барт Рудольф Романи (BE), Паркес Кевин (GB),Самуэльссон Бенгт Бертил (SE), Схепенс Вим Берт Грит, Тюринг Йоханнес Вильхельмус Й. (BE), Валльберг Ханс Кристиан (SE), Вегнер Йорг Курт (BE) Настоящее изобретение относится к 5-амино-4-гидроксипентоиламидам, обладающим свойствами ингибирования репликации ВИЧ (вирус иммунодефицита человека), их получению и фармацевтическим композициям, содержащим указанные соединения. Изначально лечение ВИЧ инфекции заключалось в монотерапии с помощью производных нуклеозидов, но, несмотря на успехи в подавлении вирусной репликации, эти лекарственные средства быстро потеряли свою эффективность ввиду появления устойчивых к лекарству штаммов. Стало понятным, что высокая скорость мутации, объединенная с быстрой репликацией, делали ВИЧ особенно трудной задачей для противовирусной терапии. Введение комбинационной терапии с некоторыми противоВИЧ агентами улучшали терапевтические результаты. В настоящее время стандартом лечения является так называемаяHAART (высокоактивная противоретровирусная терапия), которая обеспечивает сильную и продолжительную вирусную супрессию. HAART обычно включает нуклеозидные или нуклеотидные ингибиторы обратной транскриптазы (NRTI или NtRTI соответственно) с ненуклеозидным ингибитором обратной транскриптазы (NNRTI) или ингибитором протеазы (PI). Современные руководства по противоретровирусной терапии рекомендуют режим такой тройной комбинационной терапии даже для начального лечения. Хотя HAART способна подавлять ВИЧ вплоть до неопределяемых уровней, устойчивость может появиться из-за проблем предрасположенности. Также было показано, что резистентный вирус встречается у недавно инфицированных индивидуумов, что приводит к серьезному ограничению в выборе терапии для этих не принимавших лекарства пациентов. Таким образом, все еще остается потребность в новых и эффективных соединениях, которые могут использоваться в качестве противоВИЧ лекарственных препаратов. В частности, имеется потребность в дополнительных ингибиторах ВИЧ протеазы, которые являются более эффективными с точки зрения активности против вируса дикого типа, а также против мутированных штаммов, в частности по отношению к мутированным штаммам, отобранных с помощью недавно опробированных ингибиторов протеазы. Существует потребность в ингибиторах протеазы, которые являются благоприятными с точки зрения их фармакокинетического профиля, в частности, которые проявляют пониженное связывание с протеином плазмы. Целью настоящего изобретения являются конкретные новые группы 5-амино-4 гидроксипентоиламидов, обладающие ингибирующими репликацию ВИЧ свойствами. Соединения по изобретению отличаются от известных из уровня техники соединений структурой,фармакологической активностью и/или фармакологической эффективностью. Было обнаружено, что они очень активны не только против вируса дикого типа, но также против мутантных штаммов, в частности против штаммов, которые становятся резистентными по отношению к одному или нескольким известным ингибиторам протеазы, и эти штаммы указываются как штаммы ВИЧ, резистентные к лекарственным средствам и мультилекарственным средствам. Таким образом, в одном аспекте настоящее изобретение относится к соединениям формулы I,включая его химические стереоизомерные формы, которые могут быть представлены формулой IR2 представляет собой группу формулыR3 представляет собой группу формулыR4 представляет собой группу формулыn равно 0 или 1; каждый А независимо представляет собой CH или N;R5 и R6 независимо представляют собой водород, C1-4 алкил или галоген;R8 представляет собой C1-4 алкил или C1-4 алкокси-C1-4 алкил; каждый R9 независимо представляет собой C1-4 алкил, циклопропил, трифторметил, C1-4 алкокси или диметиламино;R11 представляет собой водород или C1-4 алкил; их фармацевтически приемлемым аддитивным солям и фармацевтически приемлемым сольватам. Всякий раз, когда используется фрагмент молекулы или группа, связь со звездочкой (- ) является связью, соединяющей этот фрагмент или группу с остатком молекулы. Как здесь используется, C1-4 алкил как группа или часть группы обозначает насыщенные углеводородные радикалы с прямой или разветвленной цепью, имеющие от 1 до 4 атомов углерода, такие как метил, этил, 1-пропил, 2-пропил, 1-бутил, 2-бутил, 2-метилпропил, трет-бутил. Представляющими интересC1-4 алкилами являются C1-3 алкил или C1-2 алкил; C1-3 алкил обозначает насыщенные углеводородные радикалы с прямой или разветвленной цепью, имеющие от 1 до 3 атомов углерода; C1-2 алкил обозначает метил или этил. Термин "галоген" относится к фтору, хлору, брому или йоду, в частности к фтору или хлору. Всякий раз, когда в определении соединений формулы I или какой-либо подгруппы соединений формулы I, указанных здесь, встречается радикал, указанный радикал имеет независимые значения, определенные выше для соединений формулы I или для более ограниченных определений, указанных здесь далее. Следует отметить, что положения радикалов в любом фрагменте молекулы, используемых в определениях, могут быть где угодно в таких фрагментах в той мере, как это соответствует химической стабильности. Например, радикал R1 может быть в любом положении фенила, к которому он присоединен. Когда в каком-либо фрагменте имеются более одного какого-либо радикала (например, галоген,C1-4 алкил), каждое определение является независимым. Какие-либо ограничения в определениях радикалов, указанных здесь, подразумевают их применимость к группе соединений формулы I, а также к любой подгруппе, определенной или указанной здесь. Линии, изображенные от заместителя к кольцевой системе, указывают на то, что связь может быть направлена к любому подходящему атому кольца. Фармацевтически приемлемые формы аддитивных солей, которые способны образовывать соединения по настоящему изобретению, могут быть получены удобным образом, используя подходящие кислоты, такие как, например, неорганические кислоты, такие как галогенводородные кислоты, например хлористо-водородная или бромисто-водородная кислота, серная, полусерная, азотная, фосфорная и т.п. кислоты; или органические кислоты, такие как, например, уксусная, аспарагиновая, додецилсерная, гептановая, гексановая, никотиновая, пропановая, гидроксиуксусная, молочная, пировиноградная, щавелевая, малоновая, янтарная, малеиновая, фумаровая, яблочная, винная, лимонная, метансульфоновая, этансульфоновая,бензолсульфоновая,п-толуолсульфоновая,цикламиновая,салициловая,паминосалициловая, памоевая и т.п. кислоты. С другой стороны, указанные формы солей добавления кислот могут быть преобразованы в формы свободных оснований путем обработки с соответствующим основанием. Соединения формулы I, содержащие кислотные протоны, могут быть преобразованы в их фармацевтически приемлемые аддитивные соли металла или аминов, образующиеся при обработке соответствующими органическими и неорганическими основаниями. Подходящие солевые формы оснований включают, например, соли аммония, соли щелочных и щелочно-земельных металлов, например соли лития, натрия, калия, магния, кальция и т.п., соли с органическими основаниями, например соли с первичными, вторичными и третичными алифатическими и ароматическими аминами, такими как метиламин,этиламин, пропиламин, изопропиламин, четыре изомера бутиламина, диметиламин, диэтиламин, диэтаноламин, дипропиламин, диизопропиламин, ди-н-бутиламин, пирролидин, пиперидин, морфолин, триметиламин, триэтиламин, трипропиламин, хинуклидин, пиридин, хинолин и изохинолин, бензатин, Nметил-D-глюкамин, 2-амино-2-(гидроксиметил)-1,3-пропандиол, гидрабамин, и соли с аминокислотами,такими как, например, аргинин, лизин и т.п. Наоборот, солевая форма может быть преобразована при обработке кислотой в форму свободной кислоты. Термин "фармацевтически приемлемый сольват" подразумевает включение форм добавления гид-2 020758 ратов и сольватов, которые могут образовывать соединения формулы I, включая их стереоизомерные формы. Примерами таких сольватов являются, например, гидраты, алкоголяты, такие как этаноляты,изопропаноляты, н-пропаноляты и т.п. Соединения формулы I могут содержать один или несколько центров хиральности и могут существовать в виде стереохимически изомерных форм. Особый интерес среди указанных соединений представляют соединения формулы I, которые являются стереохимически чистыми. Термин "стереохимически изомерные формы", как здесь используется, обозначает все возможные стереоизомерные формы соединений формулы I, их фармацевтически приемлемые аддитивные соли и фармацевтически приемлемые сольваты. Если не указано или не определено иного, химическое название соединений обозначает смесь всех возможных стереохимически изомерных форм, где указанные смеси содержат все диастереомеры и энантиомеры основной молекулярной структуры, а также каждую отдельную изомерную форму соединений формулы I, их фармацевтически приемлемые аддитивные соли и фармацевтически приемлемые сольваты, по существу, свободные, т.е. в сочетании с менее чем 10%, предпочтительно, менее чем 5%, в частности менее чем 2%, более предпочтительно менее чем 1% других изомеров. Стерические центры могут иметь R- или S-конфигурацию; заместители у бивалентных циклических (частично) насыщенных радикалов могут иметь либо цис-, либо транс-конфигурацию; двойные связи могут иметь либо Е(entgegen), либо Z (zusammen)-стереохимию. Некоторые соединения формулы I могут также существовать в виде таутомерной формы. Такие формы, хотя и не указаны в явном виде в вышеуказанной формуле, также включены в объем настоящего изобретения. По настоящему изобретению также предполагается включение любых изотопов атомов, присутствующих в соединениях по изобретению. Например, изотопы водорода включают тритий и дейтерий, и изотопы углерода включают 13C и 14C. Всякий раз, когда используются здесь выше или здесь далее, термины "соединения формулы I","настоящие соединения", "соединения по настоящему изобретению" или иные эквивалентные термины, и подобным же образом, термины "подгруппы соединений формулы I", "подгруппы настоящих соединений", "подгруппы соединений по настоящему изобретению" или иные эквивалентные термины предназначены для включения соединений общей формулы I или подгрупп соединений общей формулы I, а также их солей, сольватов и стереоизомеров. Всякий раз, когда здесь выше или здесь далее указывается, что каждый из заместителей может быть независимо выбран из перечня определений, таких как, например, для R1 или R2, любые возможные сочетания предназначены для включения, если они являются химически возможными или приводят к молекулам такой химической стабильности, чтобы они могли быть подвергнуты обработке стандартными фармацевтическими методами. Конкретные подгруппы соединений формулы I или любые подгруппы соединений формулы I указаны здесь, где(a) R1 представляет собой галоген или R1 представляет собой фтор или хлор; где галоген (или фтор или хлор), в частности, замещен в орто-положении; или(b) R1 представляет собой метокси; где метокси, в частности, замещен в мета-положении. Конкретные подгруппы соединений формулы I или любые подгруппы соединений формулы I указаны здесь, где(a) R2 представляет собой группу формулы(b) или где R2 представляет собой группу формулы Дальнейшими вариантами осуществления настоящего изобретения являются такие соединения формулы I или любые из подгруппы соединений формулы I, гдеR5 представляет собой водород и R6 представляет собой галоген или C1-4 алкил;R5 представляет собой галоген и R6 представляет собой водород;R5 представляет собой галоген или C1-4 алкил и R6 представляет собой водород; или оба R5 и R6 представляют собой водород, или оба представляют собой галоген. Дальнейшими вариантами осуществления настоящего изобретения являются такие соединения формулы I или любые из подгруппы соединений формулы I, где галоген в определениях R5 и R6 представляет собой фтор или хлор и C1-4 алкил представляет собой метил. Конкретными вариантами осуществления настоящего изобретения являются такие соединения формулы I или любые из подгруппы соединений формулы I, включая соединения, где R2 имеет значения,определенные выше в (а) или (b), где R5 представляет собой водород и R6 представляет собой фтор или хлор; R5 представляет собой фтор или хлор и R6 представляет собой водород; R5 представляет собой водород и R6 представляет собой метил; оба R5 и R6 представляют собой водород, или R5 представляет собой хлор и R6 представляет собой фтор; более конкретно, где R5 представляет собой водород и R6 представляет собой фтор; R5 представляет собой хлор и R6 представляет собой водород; R5 представляет собой водород и R6 представляет собой метил; оба R5 и R6 представляют собой водород, R5 представляет собой хлор и R6 представляет собой фтор, R5 представляет собой метил и R6 представляет собой фтор,или R5 представляет собой фтор и R6 представляет собой метил. Вариантами осуществления настоящего изобретения являются такие соединения формулы I или любые из подгруппы соединений формулы I, где R3 представляет собой группу формулы Дальнейший вариант осуществления настоящего изобретения касается таких соединений по изобретению, где R3 представляет собой группу формулы Вариантами осуществления настоящего изобретения являются такие соединения формулы I или любые из подгруппы соединений формулы I, где R8 представляет собой метил или 2-метоксиэтил или гдеR8 представляет собой метил. Вариантами осуществления настоящего изобретения являются такие соединения формулы I или любые из подгруппы соединений формулы I, где R9 представляет собой C1-2 алкокси или диметиламино,или R9 представляет собой метокси или диметиламино, или R9 представляет собой метокси. Вариантами осуществления настоящего изобретения являются такие соединения формулы I или любые из подгруппы соединений формулы I, где R4 представляет собой группу, имеющую химическую структуру, определенную выше, но где в первой группе R9 представляет собой R9a, во второй группе R9 представляет собой R9b, в третьей группе R9 представляет собой R9c, в четвертой группе R9 представляет собой R9d, в пятой и в шестой группе R9 представляет собой R9e; и группы могут быть представлены следующим образом: где каждый А независимо представляет собой CH или N или где каждый А представляет собой CH;R10 представляет собой водород, C1-4 алкил, циклопропил или трифторметил или R10 представляет собой водород, метил, циклопропил или трифторметил; каждый R9e независимо представляет собой C1-4 алкил, циклопропил, C1-4 алкокси или диметиламино. Особый интерес представляют собой соединения, где в R9a, R9b, R9c, R9d или R9e C1-4 алкокси представляет собой метокси и C1-4 алкил представляет собой метил. В следующем варианте осуществления изобретения R4 представляет собой группу, имеющую следующую химическую структуру: где А представляет собой CH и R9a представляет собой метокси или диметиламино. Вариантами осуществления настоящего изобретения являются такие соединения формулы I или любые из подгруппы соединений формулы I, где R11 представляет собой C1-4 алкил или где R11 представляет собой метил. Один вариант осуществления изобретения касается соединений 1-102, перечисленных в табл. I в конце экспериментальной части, включая их фармацевтически приемлемые соли и сольваты. Конкретный вариант осуществления относится к свободной форме (не фармацевтически приемлемые соли и сольваты) соединений 1-102, перечисленных в табл. I. Особый интерес представляют соединения номер 7, 8, 52, 67, 91, 93, 96, 101 и 102, перечисленные в табл. I в конце примеров, включая их фармацевтически приемлемые соли и сольваты. Соединения формулы I, где R3 представляет собой группу формулы и указанные соединения, представленные формулой I-а, могут быть получены путем конденсации промежуточного соединения формулы II с производным карбоновой кислоты формулы III образующей амид реакцией. Условия проведения взаимодействия для этой реакции образования амида те же, что и для конденсации аминокислот в синтезе пептидов. Используемые конденсирующие агенты могут быть выбраны из N-этоксикарбонил-2-этокси-1,2-дигидрохинолина (EEDQ), N-изобутоксикарбонил-2 изобутокси-1,2-дигидрохинолина (IIDQ), гексафторфосфата N,N,N',N'-тетраметил-O-(7-азабензотриазол 1-ил)урония (HATU), гексафторфосфата бензотриазол-1-илокси-трис-(диметиламино)фосфония (ВОР),гексафторфосфата бензотриазол-1-илокси-трис-пирролидинофосфония (РуВОР), дициклогексилкарбодиимида(EDCI) или 1,3 диизопропилкарбодиимида. Может быть добавлен катализатор, например, 1-гидроксибензотриазол(HOBt) или 4-диметиламинопиридин (DMAP). Реакцию обычно проводят в присутствии основания, в частности основания амина, такого как третичный амин, например триэтиламин, N-метилморфолин,N,N-диизопропилэтиламин (последний упоминается также как основание Ханига, DIPEA или DIEA). Растворители, которые могут использоваться, включают биполярные апротонные растворители, такие как DMA, ДМФ или ацетонитрил, галогенированные углеводороды, такие как CH2Cl2 или CHCl3, эфирные растворители, такие как ТГФ. В одном варианте осуществления реакцию конденсации проводят с представленные здесь формулой I-b, могут быть получены приводящим к образованию уретана взаимодействием промежуточного соединения формулы II с соответствующим электрофильным карбонильным соединением формулы IV, таким как хлорформиат, или активированный 2,5 диоксопирролидин-1-олят, паранитрофенолят или 2-пиридилкарбонат.Lg в вышеприведенной схеме обозначает удаляемую группу, такую как хлор, бром, 2,5 диоксопирролидин-1-олят, паранитрофенолят. Промежуточные соединения формулы II, в свою очередь, могут быть получены, как показано на следующей реакционной схеме: В вышеуказанной схеме М представляет собой группу -B(ORa)2 или группу -Sn(Rb)3, где Ra представляет собой водород или алкильную или алкандиильную группу, например 2,3-диметил-2,3 бутандиил, и Rb представляет собой алкильную группу, такую как метил или бутил. PG представляет собой гидроксизащитную группу, которая может быть избирательно отщеплена в присутствии Восгруппы. Y представляет собой бром, йод или трифторметансульфонильную (трифлат или TfO-) группу. X представляет собой хлор, бром или йод. Трифлатная группа может быть введена путем взаимодействия промежуточного соединения формулы X, содержащего гидроксигруппу в положении брома, с трифторметансульфонимидом в присутствии основания в растворителе, таком как дихлорметан. Промежуточное соединение формулы X, содержащее гидроксигруппу, в свою очередь, может быть получено исходя из промежуточного соединения XI,содержащего защитную гидроксигруппу в положении группы Y, следуя способам, описанным здесь далее для преобразования XI в X, с последующей стадией удаления защитных групп. Защитная группа,которая может быть использована в данном способе, представляет собой бензильную группу, которая может быть удалена с помощью водорода в присутствии катализатора. На первой стадии лактон XI алкилируют с помощью бензилгалогенида до бензилированного лактона X. Эту реакцию проводят в апротонном растворителе, таком как ТГФ, с основанием, например бис(триметилсилил)амидом лития, бис-(триметилсилил)амидом натрия или диизопропиламидом лития, при низкой температуре, например при -78C, затем добавляют бензилгалогенид. Лактон в промежуточном соединении X подвергают раскрытию кольца с помощью гидролиза, используя основание, такое как LiOH, NaOH или KOH, в водном растворителе, таком как смесь ДМФ, DMA, диоксана, ТГФ и воды. Данный гидролиз приводит к промежуточным соединениям IX, где затем спиртовую группу защищают с помощью подходящей защитной группы PG, например, силильной группой, такой как триизопропилсилил, трет-бутилдиметилсилил или т.п., в уловиях, известных из уровня техники, с получением промежуточных соединений формулы VIII. Карбоксильную группу преобразуют в соответствующий амид в VII путем конденсации промежуточного соединения VIII с первичным амином формулы R2-NH2. Условия для этой реакции являются такими, как описано выше. Необязательно, R2-NH2 может быть использован в рацемической форме, и полученная диастереоизомерная смесь промежуточных соединений VII может быть разделена, например, с помощью хроматографии. На следующей стадии О-защитную группу в VII удаляли с получением промежуточных соединенийVI. Например, в случае использования трет-бутилдиметилсилильной группы может быть использован фторид тетрабутил-аммония (TBAF) или HF в ацетонитриле. Промежуточные соединения VI, которые могут представлять собой бром, йод или трифлат (-OTf) производными, подвергают затем реакции поперечного углерод-углерод связывания, такой как реакция Сузуки, Стилла, Хека или Негиши, которая катализируется металлом (обычно Pd, Ni или Cu катализаторам). Одним из примеров такой реакции поперечного связывания является реакция Сузуки, по которой VI подвергают взаимодействию с замещенной гетероарильной бороновой кислотой или сложным эфиром (например, пинаколатоборонатом) в присутствии палладиевого катализатора при повышенной температуре. Реакцию проводят в присутствии основания, такого как бикарбонат натрия, карбонат натрия, гидроксид натрия, карбонат калия, карбонат цезия, фосфат калия и т.д. Когда неорганическое основание трудно растворяется в органическом растворителе, его используют в виде водного раствора. Другой такой реакцией поперечного связывания является реакция Стилла, по которой VI подвергают взаимодействю с замещенным гетероарильным станнатом при повышенной температуре в присутствии палладиевого катализатора. В качестве добавки может быть использована соль металла, такая как хлорид лития, бромид лития или йодид лития. Палладиевые катализаторы, подходящие для реакций Сузуки или Стилла, включают Pd(PPh3)4 (Ph=фенил), Pd2(dba)3(dba=дибензилиденацетон), Pd(OAc)2, Pd(dppf)Cl2 (dppf=1,1'-бис-(дифенилфосфино)ферроцен). В некоторых случаях для облегчения реакции конденсации могут быть добавлены дополнительные лиганды (например, три-трет-бутилфосфин, 1,1'-бис-(дифенилфосфино)ферроцен, три-о-толилфосфин или т.п.). Еще одной такой реакцией является реакция Хека, по которой ненасыщенный галогенид (или трифлат) подвергают взаимодействию с алкеном и основанием и палладиевым катализатором с образованием замещенного алкена. В настоящем случае реакция включает катализируемое палладием поперечное связывание арилгалогенида или трифлата и тиазола. Подходящим катализатором для этой реакции являетсяPd(PPh3)4. Подходящие органические растворители для этого типа реакций включают тетрагидрофуран,1,4-диоксан и 1,2-диметоксиэтан, ароматические растворители, такие как бензол или толуол, спиртовые растворители, такие как метанол или этанол, ацетонитрил, диметилформамид или смесь указанных растворителей. Основанием, которое может быть использовано, является ацетат щелочного металла, такой как ацетат калия. Удаление N-защитной группы Boc в V, например, обработкой кислотой, с использованием трифторуксусной кислоты в галогенированном растворителе, таком как CH2Cl2, или соляной кислоты в изопропаноле, в завершение приводит к промежуточному соединению II. Удаление Вос-защитных групп можно также осуществить путем обработки промежуточного соединения V триметилсилилйодидом или смесью триметилсилилхлорида и NaI в подходящем растворителе, например, ацетонитриле, CHCl3 или CH2Cl2. Реакции удаления Вос-защитных групп предпочтительно проводят при комнатной температуре. Промежуточные соединения формулы XI могут быть получены, как показано на следующей реакционной схеме, где Y определен выше, и PG представляет собой N-защитную группу, такую как ВОСгруппа. На первой стадии спиртовую группу в 2-фенетиловом спирте XVII подвергают окислению до соответствующего ацетальдегида XVI, используя слабый окислитель, такой как гипохлорит натрия в присутствии 2,2,6,6-тетраметилпиперидин-1-оксила (или TEMPO), который является селективным окислителем,приводящим к альдегидам из первичных спиртов. На следующей стадии ацетальдегид XVI подвергают взаимодействию с защищенным амином и бензолсульфинатом. Взаимодействие полученного таким образом сульфона XV с лактоном XIV дает производное лактона XIII, которое разделяют с помощью хиральной хроматографии до энантиомерно чистого XII, где двойную связь восстанавливают, например,водородом в присутствии Ni Ренея. Когда это приемлемо, стадии синтеза при получении соединений, соответствующих формуле II, могут быть осуществлены в другом порядке. Например, реакцию поперечного связывания можно проводить на различных стадиях синтетической последовательности по вышеуказанной схеме, такой как с промежуточными соединениями VI, VII, VIII, IX и XI. Поперечное связывание может быть осуществлено даже на последней стадии синтеза, например, в конце синтеза, как проиллюстрировано на следующей реакционной схеме. На этой схеме М имеет значения, указанные выше, и условия реакции поперечного связывания также являются такими, как описано выше. Промежуточные соединения XVIII могут быть получены следующими способами получения промежуточных соединений II, но исключая реакцию поперечного связывания, с последующей реакцией конденсацией для введения R3-CO-группы. Соединения формулы I, где R3 представляет собой группу формулы где указанные соединения, представленные формулой I-c, могут быть получены образующей амид реакцией между промежуточным соединением формулы XIX и цианоциклопропилкарбоновой кислотойXX, как проиллюстрировано на следующей реакционной схеме. Условия для этой реакции являются такими, как описано выше, например, для преобразования II в I-а. Промежуточные соединения формулы XIX могут быть получены, как показано на следующей схеме: На первой стадии промежуточное соединение II конденсируют с N-защищенным третбутилглицином XXI, таким как Вос-трет-бутилглицин, путем образующей амид реакции, следуя условиям реакции, описанным выше для преобразования II в I-а, что дает промежуточное соединение XXII. Вос-защитную группу в XXII можно удалить в условиях, известных из уровня техники, как описано здесь выше, с получением свободного промежуточного амино соединения XIX. Соединения формулы I, где R3 представляет собой группу формулы где указанные соединения, представленные формулой I-d, могут быть получены реакцией образования уретана в конце синтеза, как проиллюстрировано на следующей реакционной схеме, путем конденсации промежуточного соединения формулы XIX с подходящим электрофильным карбонильным соединением, таким как хлорформиат, или с активированным сукцинимидилом, паранитрофенилом или пиридилкарбонатом. Эта реакция особенно подходит для получения соединений, где R8 представляет собой C1-4 алкокси-C1-4 алкил. Соединения формулы I, где R3 представляет собой группу формулы где указанные соединения, представленные формулой I-е, могут быть получены путем конденсации с пирролидинилуксусной кислотой в образующей амид реакции, в реакционных условиях, описанных выше. Как проиллюстрировано на реакционной схеме ниже, соединения I-е также могут быть получены двухстадийным способом, включающим сначала реакцию промежуточного соединения XIX с хлорацетилхлоридом в присутствии основания, например третичного амина, такого как триэтиламин, в растворителе, таком как дихлорметан, получая промежуточное соединение XXIII. Эту реакцию можно проводить, например, сначала при низкой температуре, такой как при 0C, с последующим перемешиванием при комнатной температуре. Промежуточные соединения XXIII затем подвергают взаимодействию с пирролидином в присутствии нуклеофильного катализатора, такого как йодид тетрабутиламмония или т.п., предпочтительно в биполярном апротонном растворителе (например, DMA, ДМФ, Nметилпирролидинон). Эту реакцию предпочтительно проводят при комнатной температуре. Соединения формулы I, где R2 представляет собой 3-гидроксихроманил, также могут быть получены сначала путем конденсации 3-гидрокси-4-хроманамина XXIV с 3-арилпропионовой кислотой XXV, с получением промежуточного соединения XXVI, используя условия, описанные здесь выше, для образования амидной связи. Затем NH и OH группы защищают с помощью 2-метоксипропена, получая промежуточное соединение XXVII. Это преобразование может быть осуществлено, используя галогенированый растворитель, такой как дихлорметан, в присутствии кислотного катализатора, такого как птолуолсульфонат пиридиния, в интервале температур между 0C и комнатной температурой. Полученный амид XXVII и оксиран XXVIII обрабатывают сильным основанием, таким как н-бутиллитий, при температуре в области между -78 и -25C с получением промежуточного соединения XXIX. Последнее подвергают реакции поперечного связывания с боронатом или производным олова XXX, как описано здесь выше, что дает XXXI, который, в свою очередь, подвергают удалению защиты XXXII в кислотных условиях. Последний соответствует промежуточному соединению формулы II и может быть далее подвергнут взаимодействиям, как описано выше для соединений формулы I. Соединения формулы I также могут быть преобразованы одно в другое путем реакций преобразования реакционных групп. Соединения формулы I, где R2 обозначает где один или оба из R5 и R6 представляют собой хлор, бром или йод, могут быть преобразованы в соответствующие соединения, где один или оба из R5 и R6 представляют собой водород, используя водород в присутствии катализатора, такой как палладий на углероде. И, наоборот, когда один или оба из R5 иR6 представляют собой водород, указанные соединения могут быть галогенированы в 6- или 8 положении, используя галогенирующий агент, такой как N-бромсукцинимид (NBS) или Nхлорсукцинимид (NCS). Указанное преобразование может быть также осуществлено на промежуточных соединениях, содержащих вышеуказанную группу R2. Некоторые промежуточные соединения и исходные продукты являются известными соединениями и могут быть коммерчески доступными или могут быть получены в соответствии с известными в данной области способами. Промежуточные соединения формулы R2-NH2, где R2 представляет собой группу хроманола, могут быть получены из фенола XXXIII 5-ти стадийным синтезом. На первой стадии фенол XXXIII обрабатывают 3-бромпропионовой кислотой в воде в присутствии основания, такого как NaOH, при повышенной температуре, такой как температура кипения с обратным холодильником. На второй стадии полученную 3-феноксипропионовую кислоту XXXIV подвергают ацилированию по Фриделю-Крафтцу, используя оксалилхлорид и AlCl3 в растворителе, таком как дихлорметан, с получением хроманона XXXV, который, в свою очередь, бромируют (бромом или CuBr2) в галогенированном растворителе, таком как дихлорметан, с получением бромхроманона XXXVI. Восстановление с помощью гидрида металла, такого как NaBH4, в протонном растворителе, таком как метанол, в интервале между 0C и комнатной температурой, дает бронированный спирт XXXVII. Бромированный спирт XXXVII подвергают реакции Риттера,используя ацетонитрил и водный раствор сильной кислоты, такой как серная кислота, с получением промежуточного соединения оксазолина XXXVIII, которое гидролизуют в разбавленной кислоте при температуре в интервале между 80 и 120C с получением рацемического 4-аминохроманола формулы XXXIX. Указанный 4-аминохроманол может быть разделен на соответствующие энантиомеры, используя известные в данной области условия, такие как хроматография, используя хиральную стационарную фазу, или путем образования диастереомерной соли, используя оптически чистую органическую кислоту в виде разделяющего агента, такую как миндальная кислота или т.п. 4-Аминохроманол XXXIX может быть галогенирован в 6- или 8-положении, например, с помощьюN-хлорсукинимида, с получением соответствующих 6- или 8-галогензамещенных 4-аминохроманолов. Промежуточные соединения формулы R2-NH2, представленные могут быть получены, исходя из 6,7-дигидро-5 Н-бензо[b]тиофен-4-она, путем введения гидроксильной группы с помощью (+)-(8,8-дихлоркамфорилсульфонил)оксазиридина в присутствии основания, такого как бис-(триметилсилил)амид натрия, в полярном растворителе, таком как ТГФ, при низкой температуре, такой как -78C. Кетогруппу затем преобразуют в соответствующий бензилоксим XLII,используя O-бензилгидроксиламин в пиридине, и оксим восстанавливают до соответствующего аминаXLIII, используя, например, боран в полярном растворителе, таком как ТГФ, в интервале температур между 0 и 70C Циклогексаноламин формулы XLIVIII может быть получен в 4 стадии, исходя из 3-(R)метилциклогексанона. На первой стади ацетат XLVa получают путем обработки в изопропенилацетате при температуре 100C в присутствии кислотного катализатора, такого как п-толуолсульфоновая кислота. Соответствующий нитрокетон XLVI получают путем обработки смесью уксусного ангидрида и концентрированной азотной кислоты при температуре в интервале между комнатной температурой и 50C. Кетогруппу восстанавливают гидридом металла, таким как боргидрид натрия, в спиртовом растворителе,таком как метанол, при комнатной температуре, с получением нитроспирта XLVII. Восстановление до аминоспирта XLVIII достигают путем гидрирования в присутствии никеля Ренея в этилацетате. Соединения формулы I и большинство промежуточных соединений по настоящему изобретению имеют асимметрические атомы углерода. Чистые стереохимически изомерные формы указанных соединений и указанных промежуточных соединений могут быть получены известными в данной области способами. Например, диостереоизомеры могут быть разделены физическими способами, такими как селективная кристаллизация или хроматографические методы, например, распределение обратного потока,- 12020758 жидкостная хроматография и тому подобные способы. Энантиомеры могут быть получены из рацемических смесей сначала преобразованием указанных рацемических смесей с помощью подходящих разделяющих агентов, таких как, например, хиральные кислоты, в смеси диастереомерных солей или соединений; затем физическим разделением указанных смесей диастереомерных солей или соединений, например, селективной кристаллизацией или хроматографическими методами, например, жидкостнойхроматографией и тому подобными способами; и, наконец, преобразованием указанных разделенных диастереомерных солей или соединений в соответствующие энантиомеры. Чистые стереохимически изомерные формы также могут быть получены из чистых стереохимически изомерных форм соответствующих промежуточных соединений и исходных продуктов, при условии, что промежуточные реакции протекают с сохранением стереохимической чистоты. Альтернативный способ разделения энантиомерных форм соединений формулы I и промежуточных соединений включает жидкостную хроматографию, в частности,жидкостную хроматографию с использованием хиральной стационарной фазы, такой как жидкостная хроматография высокого разрешения или хроматография с использованием сверхкритического диоксида углерода. Соединения формулы I проявляют противоВИЧ свойства, в частности они ведут себя как ингибиторы ВИЧ протеазы. ВИЧ является причиной синдрома приобретенного иммуного дефицита (СПИД) у людей и преимущественно инфицируют Т-4 клетки человека и разрушают их или изменяют их нормальную функцию, особенно координацию иммунной системы. В результате, у инфицированного пациента постоянно уменьшается число Т-4 клеток, которые, кроме того, ведут себя аномально. Следовательно, иммунодефицитная система неспособна подавить инфекции и неоплазмы, и инфицированный ВИЧ субъект обычно погибает от условно-патогенных инфекций, таких как пневмония, или рака. Соединения по изобретению демонстрируют также активность против лекарственно- и мультилекарственно-резистентных штаммов ВИЧ, в частности против штаммов ВИЧ, которые обладают приобретенной резистентностью к одному или нескольким принятым ингибиторам протеазы, в частности к атазанавиру, лопинавиру и ритонавиру. Благодаря противоВИЧ свойствам, соединения формулы I, их фармацевтически приемлемые аддитивные соли и сольваты, включая любые их стереоизомерные формы, могут быть использованы для лечения индивидуумов, инфицированных ВИЧ, и для профилактики указанных инфекций. Состояния, которые могут быть предотвращены или подвергнуты лечению с помощью соединений по настоящему изобретению, особенно состояния, связаннные с ВИЧ, включают СПИД, связанный со СПИДом комплекс (ARC), прогрессивную генерализированную лимфаденопатию (PGL), а также хронические заболевания центральной нервной системы, вызванные ретровирусами, такие как, например, опосредованная ВИЧ деменция и рассеянный склероз. Таким образом, соединения по настоящему изобретению могут быть использованы в качестве лекарственного средства против любых из вышеуказанных состояний. В частности, соединения формулы I могут быть использованы при получении лекарственного средства для лечения или предупреждения ВИЧ инфекции. В следующем аспекте настоящее изобретение относится к способу лечения человека, страдающего от вирусных инфекций, или способу профилактики людей от поражения вирусными инфекциями, особенно ВИЧ инфекциями. Указанный способ включает введение людям эффективного количества соединения формулы I, его фармацевтически приемлемой аддитивной соли, фармацевтически приемлемого сольвата или его возможной стереоизомерной формы. Указанное использование в качестве лекарственного средства или способ лечения влючают введение ВИЧ-инфицированным субъектам соединения в количестве, эффективном для противодействия состояниям, связанным с ВИЧ и другими патогенными ретровирусами, особенно ВИЧ-1. Настоящее изобретение относится также к композициям для лечения ВИЧ инфекции, содержащим терапевтически эффективное количество соединения формулы I и фармацевтически приемлемый носитель или разбавитель. Соединения по настоящему изобретению или их любая подгруппа для целей введения могут быть составлены в различные фармацевтические формы. В качестве подходящих композиций можно указать все композиции, обычно используемые для системного ввода лекарственных средств. Для получения фармацевтических композиций по настоящему изобретению, эффективное количество конкретного соединения, необязательно в виде аддитивной соли, в качестве активного ингредиента, объединяют в однородную смесь с фармацевтически приемлемым носителем, где носитель может быть выбран из широкого разнообразия форм, в зависимости от вида желаемого препарата для введения. Указанные фармацевтические композиции желательно представлены в виде единичной дозированной формы, подходящей, например, для перорального, ректального или подкожного введения. Например, при получениия композиции в виде пероральной дозированной формы могут быть использованы любые обычные фармацевтические среды, такие как, например, вода, гликоли, масла, спирты и т.п. для случаев пероральных жидких препаратов, таких как суспензии, сиропы, эликсиры, эмульсии и растворы; или твердые носители, такие как крахмалы, сахара, глина, разбавители, смазывающие вещества, связующие, разрыхлители и т.п. для порошков, пилюль, капсул и таблеток. Ввиду легкости их введения, таблетки и капсулы представляют собой наиболее удобные пероральные единичные дозированные формы, в которых обычно используются твердые фармацевтические носители. Охватываются также твердые формы препаратов, которые могут быть преобразованы непосредственно перед использованием в жидкие формы. В композициях, подходящих для подкожного введения, носитель необязательно содержит средство, усиливающее проницаемость, и/или подходящий смачивающий агент, необязательно объединенные с подходящими добавками любой природы в небольшом количестве, и эти добавки не оказывают заметного нежелательного воздействия на кожу. Указанные добавки могут облегчать введение в кожу и/или могут быть полезными при получении желаемых композиций. Такие композиции могут быть введены различными путями, например, в виде трансдермального пластыря, в виде точечного нанесения, в виде мази. Соединения по настоящему изобретению могут также быть введены посредством ингаляции или инсуффляции с помощью способов и составов, используемых в данной области техники для введения указанным путем. Таким образом, в целом, соединения по настоящему изобретению могут быть введены в легкие в виде раствора,суспензии или сухого порошка. Особенно удобно составлять вышеуказанные фармацевтические композиции в виде единичной дозированной формы для легкого введение и однородного дозирования. Единичная дозированная форма,как здесь используется, относится к физически дискретным единицам, подходящим в качестве одноразовых доз, где каждая единица содержит заранее определенное количество активного ингредиента, рассчитанного для достижения желаемого терапевтического эффекта, в сочетании с требуемым фармацевтическим носителем. Примерами таких единичных дозированных форм являются таблетки (включая таблетки с насечками или таблетки с покрытием), капсулы, пилюли, пакетики с порошком, облатки, суппозитории, инъекционные растворы или суспензии и т.п., и их отдельные множества. Специалист по лечению ВИЧ-инфекции сможет определить эффективное количество на основе результатов исследований, представленных здесь далее. Обычно предусматривается, что эффективное суточное количество могло бы быть от 0,01 до 50 мг/кг массы тела, более предпочтительно, от 0,1 до 10 мг/кг массы тела. Может быть приемлемым введение требуемой дозы в виде двух, трех, четырех или более дробных доз, с соответствующими интервалами в течение суток. Указанные дробные дозы могут быть составлены в виде единичных дозированных форм, например, содержащих от 1 до 1000 мг, и в частности, от 5 до 200 мг активного ингредиента на единичную дозированную форму. Точные дозировки и частота введения зависят от конкретного используемого соединения формулыI, конкретного состояния, подвергаемого лечению, серьезности состояния, подвергаемого лечению, возраста, веса и общего физического состояния конкретного пациента, а также от другого лекарственного средства, которое может принимать индивидуум, что хорошо известно специалисту в данной области. Более того, очевидно, что эффективное количество может быть уменьшено или повышено в зависимости от реакции подвергаемого лечению субъекта и/или в зависимости от оценки лечащего врача, прописывающего соединение по настоящему изобретению. Таким образом, диапазоны эффективного количества,указанные выше, являются только руководством и не предназначены для ограничения объема или использования изобретения каким-либо образом. Кроме того, в качестве лекарственного средства может быть использовано сочетание одного или нескольких дополнительных противоретровирусных соединений и соединения формулы (I). Таким образом, настоящее изобретение относится также к продукту, содержащему (а) соединение формулы (I) и (b) одно или несколько дополнительных противоретровирусных соединений, в виде комбинированного препарата для одновременного, раздельного или последовательного применения для противоВИЧ лечения. Различные лекарственные средства могут быть объединены в раздельные препараты или в единичный препарат, вместе с фармацевтически приемлемыми носителями. Указанные другие противоретровирусные соединения могут являться любыми известными противоретровирусными соединениями, такими как нуклеозидные ингибиторы обратной транскриптазы (NRTI), например, зидовудин (AZT), диданозин(FZT, HDP-990003), фосфазид, KP-1461, рацивир (PSI-5004), MIV-210 и GS-9131; ненуклеозидные ингибиторы обратной транскриптазы (NNRTI), такие как делавирдин (DLV), эфавиренз (EFV), невирапин(NVP), дапивирин (ТМС 120), этравирин (ETR, TMC125), рилпивирин (ТМС 278), IDX899, RDEA-806,UK-453601, RDEA-427 и UC-781; нуклеотидные ингибиторы обратной транскриптазы (NtRTI), например, тенофовир и его пролекарство тенофовир дизопроксил фумарат (TDF); ингибиторы протеазы, например, ритонавир (RTV), сахинавир (SQV), лопинавир (АВТ-378, LPV), индинавир (IDV), ампренавир(GW433908 или VX-175), бреканавир (GW-640385, VX-385), типранавир (PNU-140690), DG-17, SPI256,PPL-100 (МК 8122), и ТМС 310911; ингибиторы проникновения, которые включают ингибиторы слияния(например, энфувиртид (Т-20) сифувиртид, HRG-214, альбувиртид, SUC-HAS и maC46/M87o), ингибиторы прикрепления, модуляторы внутриклеточного биосинтеза холестерина и кортикостероидов (например, SP-01A), и ингибиторы ко-рецепторов, последние включают CCR5 антагонисты (например,CCR5mAb004, маравирок (UK-427,857), PRO-140, TAk-220, TAk-652, PF232798, викривирок (SCH-D,SCH-417, 690), GSK-706769, нифевирок и SCH-532706) и CXR4 антагонисты (например, AMD-070), дру- 14020758 гими примерами ингибиторов проникновения являются TNX-355, INCB 9471, BMS-488043, нонакин иVGV-1; ингибиторы созревания, например, бевиримат (РА-457) и вивекон; и ингибиторы вирусной интегразы, например, ральтегравир (МК-0518), эльвитегравир (JTK-303, GS-9137), BMS-538158, S-349572,JTK-656 S-247303 и GS-265744. Следующие примеры предназначены для иллюстрации настоящего изобретения, и никоим образом не ограничивают его объем. Примеры. Аналитическую тонкослойную хроматографию (ТСХ) осуществляли на пластинках с силикагелем 60 F254 (Merck) с визуализацией с помощью ультрафиолетового света, перманганата калия или фосфомолибденовой кислоты. Хроматографию на колонках с силикагелем осуществляли с помощью силикагелевых картриджей SuperFlash (50 мкм) или GraceResolv (35-45 мкм). Спектр 1H ядерного магнитного резонанса (ЯМР) регистрировали при 400 или 500 МГц. Химические сдвигиприведены в м.д. по отношению к тетраметилсилану (TMS), и значения J приведены в Гц. Мультиплетность указывали, используя следующие аббревиатуры: с для синглета, ушир.с для уширенного синглета, д для дублета, т для триплета, кв для квартета, септ для септета и м для мультиплета. Отическое вращение []20D представлено в град/дм, и концентрация дана в г/100 мл в указанном растворителе. Инфракрасный спектр (ИК) и спектр колебательного кругового дихроизма (VCD) регистрировали в 0,09 мм ячейке с окошками из CaF2, на приборе Bruker Equinox-55 с модулем РМА-37 при 4-см-1 разрешении (образцы растворяли в ДМСОd6). Данные каждого VCD получали три раза с одиночасовым временем сбора. Если не указано иного,энантиомерный избыток (эи) определяли с помощью хроматографии со сверхкритической подвижной фазой (SFC) на колонке Chiralpak Daicel AD-H. Названия соединений образовывали, используя ChemDraw Ultra, версия 9.0 (CambridgeSoft). Пример 1. Синтез трет-бутил (S)-2-(4-бромфенил)-1-S)-5-оксотетрагидрофуран-2-ил)этилкарбамат -)предшественник 1). Способ А. Стадия 1. 2,2,6,6-Тетраметилпиперидин-1-оксил (TEMPO; 1,6 г, 1,0 ммоль, 0,002 экв.) и NaBr (6 г,500 ммоль, 1,0 экв.) последовательно добавляли при энергичном перемешивании к раствору спирта 1-1([CAS No.: 4654-39-1]; 100 г, 500 ммоль, 1,0 экв.) в дихлорметане (2300 мл) при температуре 0C. Добавляли насыщенный водный раствор NaHCO3 и 10%-ный раствор NaOCl (400 мл). Смесь перемешивали в течение приблизительно десяти минут до тех пор, пока данные тонкослойной хроматографии (ТСХ) не показывают, что исходный продукт израсходован. Дихлорметановый слой отделяли. Водный слой быстро экстрагировали с помощью диэтилового эфира. Объединенные органические фазы промывали водным раствором NaHSO3 (10%) и KI (4%), насыщенным солевым раствором и сушили над безводным сульфатом натрия. После удаления большей части летучих продуктов в вакууме (поддерживая температуру ниже 25C), полученный раствор альдегида 1-2 в дихлорметане (50 мл) использовали как таковой непосредственно на следующей стадии. Стадия 2. Смесь дихлорметанового раствора альдегида 1-2 (460 ммоль, 1,0 экв.), трет-бутил карба- 15020758 мата (107,8 г, 920 ммоль, 2,0 экв.), бензолсульфината натрия (151,0 г, 920 ммоль, 2,0 экв.) и муравьиной кислоты (42,3 г, 920 ммоль, 2,0 экв.) в смеси метанола (250 мл) и воды (500 мл) перемешивали при температуре 40C в течение 24 ч (протекание реакции отслеживали с помощью данных ТСХ). Реакционную смесь охлаждали до комнатной температуры. Образовавшийся осадок отфильтровывали, промывали водой и диэтиловым эфиром и сушили при пониженном давлении с получением 150 г (72% в расчете на исходное промежуточное соединение 1-1) промежуточного соединения (rac)-1-3. Стадия 3. К смеси диизопропиламина (26 г, 250 ммоль, 1,1 экв.) в сухом тетрагидрофуране (ТГФ; 100 мл) добавляли по каплям н-бутиллитий (100 мл, 2,5 М раствора, 250 ммоль, 1,1 экв.) при температуре-78C в атмосфере азота. Смеси давали нагреться до комнатной температуры и перемешивали при комнатной температуре в течение 30 мин. Смесь опять охлаждали до температуры -78C и добавляли по каплям раствор 2(5H)-фуранона (21 г, 250 ммоль, 1,1 экв.) в сухом ТГФ (100 мл). После перемешивания в течение дополнительных 20 мин при температуре -78C, реакционную смесь переносили в раствор промежуточного соединения (rac) -1-3 (100 г, 227 ммоль, 1,0 экв.) в сухом ТГФ (800 мл) при температуре-78C. Полученную смесь перемешивали в течение дополнительных 20 мин при температуре -78C. В реакционную смесь добавляли по каплям насыщенный водный раствор NaHCO3 при температуре -40C,экстракцию проводили с помощью этилацетата. Объединенные органические фазы промывали насыщенным водным раствором Na2CO3 и насыщенным солевым раствором, сушили с помощью MgSO4 и концентрировали в вакууме. Полученный остаток промывали смесью диэтиловый эфир/метанол (10:1) и сушили с получением 40 г (rac)-1-4. Маточный раствор выпаривали досуха, полученный остаток очищали с помощью препаративной высокоэффективной жидкостной хроматографии (ВЭЖХ) с получением 10 г(rac) -1-4. В целом, получали 50 г (58%) рацемического продукта. Стадия 4. Рацемическую смесь (rac)-1-4 разделяли посредством препаративной хроматографии со сверхкритической подвижной фазой (SFC) на колонке Chiralpak Daicel AD-20 мкм (50300 мм, подвижная фаза: изократический 30% пропан-2-ол, скорость потока: 130 мл/мин). Желаемый (1S,2S)энантиомер 1-4 выделяли в качестве второй фракции с выходом 42%. Стадия 5. Раствор промежуточного соединения 1-4 (10 г, 26,2 ммоль, 1,0 экв.) в ТГФ (200 мл) гидрировали (1,0 атм водорода) при температуре 25C в течение 3 ч с помощью Ni Ренея (2 г, 20% массовое соотношение) в качестве катализатора. После поглощения водорода (1,0 экв.), катализатор отфильтровывали и фильтрат выпаривали. Остаток очищали путем хроматографии на колонке с силикагелем с получением 7,0 г (70%, эи 95%) (-)-предшественника 1 в виде кристаллов белого цвета. 1(79,8 г, 3282 ммоль, 12,3 экв.), и ТГФ (2,7 л) в атмосфере азота. Реакционную смесь нагревали до температуры 30-35C и выдерживали при этой температуре. Медленно в течение 2 ч добавляли 4-бромбутен(361,4 г, 2677 ммоль, 10,0 экв.), температуру реакционной смеси поддерживали ниже 65C. После завершения добавления реакционную смесь перемешивали в течение минимум 2 ч при температуре 60-65C и затем охлаждали на ледяной бане. В реакционную смесь в течение по меньшей мере 1 ч добавляли по каплям раствор амида 1-5 ([CAS No.: 949885-93-2]; 103,7 г, 267 ммоль, 1,0 экв.) в ТГФ (560 мл), температуру поддерживали ниже 3C. Реакционной смеси давали нагреться до комнатной температуры и перемешивали в течение минимум 4 ч при этой температуре. После охлаждения до температуры -5C реакционную смесь гасили медленным добавлением водного раствора хлорида амония. Органический слой от- 16020758 деляли, промывали насыщенным солевым раствором и частично концентрировали при пониженном давлении. Добавляли гептан, смесь опять частично упаривали при пониженном давлении и охлаждали до температуры 15C. Осадок отфильтровывали и промывали гептаном. После высушивания при температуре 45C в течение 16 ч получали 112,2 г (72 мас.%, 80%-ный выход) сырого промежуточного продукта 1-6. Стадия 2. Раствор RuCl33H2O (2,04 г, 7 ммоль, 0,03 экв.) в воде (77 мл) добавляли к раствору NaIO4(236 г, 1105 ммоль, 5,5 экв.) в воде (1,9 л). Эту ракционную смесь добавляли в течение 30 мин к раствору промежуточного соединения 1-6 (107,7 г (71 мас.%), 201 ммоль, 1,0 экв.) в ацетоне (1,9 л) при комнатной температуре. Реакционную смесь перемешивали при комнатной температуре до завершения преобразования (приблизительно один час). В реакционную смесь в течение 30 мин добавляли водный растворNa2S2O3. Реакционную смесь концентрировали при пониженном давлении до прекращения выделения ацетона. К остатку добавляли воду (1,9 л), суспензию перемешивали в течение 30 мин при комнатной температуре. Осадок отфильтровывали и влажную лепешку на фильтре вновь переводили во взвесь в воде. Влажную лепешку, образованную после фильтрации и промывания водой, сушили при температуре 45C с получением 80,6 г (90 мас.%, 90%-ный выход) сырого промежуточного продукта 1-7. Стадия 3. Смесь промежуточного соединения 1-7 (67,0 г (90 мас.%), 150 ммоль, 1,0 экв.) и KHCO3(75,1 г, 750 ммоль, 5,0 экв.) в диметилформамиде (ДМФ; 1200 мл) перемешивали при комнатной температуре в течение 20 мин. В реакционную смесь в течение периода 20 мин добавляли йодметан (42,6 г,300 ммоль, 2,0 экв.), реакционную смесь перемешивали при комнатной температуре в течение 7 ч. Затем реакционную смесь фильтровали через целит, добавляли водный раствор хлорида аммония с такой скоростью, чтобы температура оставалась ниже 25C. Затем добавляли трет-бутилметиловый эфир, и смесь фильтровали через целит. Органический слой отделяли, промывали насыщенным солевым раствором и концентрировали при пониженном давлении. К остатку добавляли гептан, затем суспензию перемешивали в течение 6 ч при комнатной температуре, осадок отфильтровывали, промывали гептаном и сушили в вакуумной печи при температуре 40C в течение 16 ч. Получали 50,0 г (91 мас.%, 73%-ный выход) промежуточного соединения 1-8. Стадия 4. К раствору сложного эфира 1-8 (45 г, 109 ммоль, 1,0 экв.) в сухом ТГФ (900 мл) при температуре -65C в атмосфере азота добавляли по каплям в течение минимум 1,5 ч N-селектрид (135 мл 1 М раствора в ТГФ, 135 ммоль, 1,24 экв.). Затем реакционную смесь перемешивали еще в течение 1 ч при температуре -65C, температуру поднимали до -35C и перемешивание продолжали в течение 30 мин при этой температуре. Затем при температуре 0-10C добавляли по каплям 10%-ный водный раствор лимонной кислоты, далее добавляли трет-бутилметиловый эфир. Потом смесь перемешивали в течение 30 мин,органический слой отделяли, промывали насыщенным водным раствором NaHCO3 и насыщенным солевым раствором и концентрировали при пониженном давлении. Остаток вновь растворяли в третбутилметиловом эфире и опять концентрировали при пониженном давлении. Сырой продукт очищали с помщью флеш-хроматографии на колонке с силикагелем (элюент: гептан/трет-бутилметиловый эфир 2:1) с получением 37,0 г (94%, эи 95%) (-)-предшественника 1 в виде твердого продукта не совсем белого цвета.[]20D=-20,9 (с 1,0, MeOH). Первичные амины, указанные далее, были использованы в качестве предшественников, представленных примерами формулы R2-NH2, как определено выше. Те соединения, которые не являются коммерчески доступными, могут быть синтезированы способами, описанными в литературе (предшественники 2, 14 а, 15 и 17), или способами, описанными в примерах 2-13 (предшественники 3-14b). Стадия 1. Охлажденный на льду раствор 3-бромпропионовой кислоты (298 г, 1,95 моль, 1,25 экв.) иNaOH (156 г 50%-ного водного раствора, 1,95 моль, 1,25 экв.) в воде (500 мл) добавляли в течение периода 90 мин к смеси 2-хлорфенола ([CAS No.: 95-57-8]; 200 г, 1,56 моль, 1,0 экв.) и NaOH (124 г 50%ного водного раствора, 1,56 моль, 1,0 экв.) в воде (1 л) при температуре кипения с обратным холодильником. Реакционную смесь перемешивали при температуре кипения с обратным холодильником в течение 3 ч. После охлаждения до комнатной температуры, реакционную смесь подкисляли концентрированным водным раствором соляной кислоты. Осадок отфильтровывали и промывали водой с получением первой партии кислоты 2-2. Фильтрат экстрагировали дихлорметаном, объединенные органические фазы последовательно экстрагировали насыщенным NaHCO3. Водный слой подкисляли концентрированным водным раствором соляной кислоты; осадок отфильтровывали и промывали водой с получением второй партии кислоты 2-2. После высушивания в вакуумной печи в течение уикэнда, получали 112 г (36%) промежуточного соединения 2-2 в виде твердого продукта белого цвета. Стадия 2. Раствор кислоты 2-2 (112 г, 558 ммоль, 1,0 экв.) и нескольких капель ДМФ в дихлорметане (1,5 л) охлаждали на ледяной бане. Добавляли по каплям оксалилхлорид (142 г, 1,12 моль, 2,0 экв.),реакционной смеси давали нагреться до комнатной температуры и перемешивали в течение ночи. Растворитель концентрировали при пониженном давлении. Остаток вновь растворяли в дихлорметане (1,5 л). Порциями добавляли трихлорид алюминия (89 г, 670 ммоль, 1,2 экв.) и реакционную смесь перемешивали в течение ночи при комнатной температуре. Реакционную смесь медленно выливали в охлажденный 1 М раствор соляной кислоты. Слои разделяли и водную фазу экстрагировали дихлорметаном. Объединенные органические слои промывали насыщенным водным раствором Na2CO3 и насыщенным солевым раствором, сушили над безводным MgSO4 и концентрировали при пониженном давлении с получением 104 г (102%) сырого промежуточного продукта 2-3. Стадия 3. К раствору сырого промежуточного продукта 2-3 (104 г) в дихлорметане при температуре кипения с обратным холодильником медленно добавляли бром (30,7 мл, 598 ммоль, 1,05 экв.). После завершения добавления полученную смесь перемешивали при температуре кипения с обратным холодильником в течение 30 мин. Реакционную смесь охлаждали до комнатной температуры, промывали насыщенным водным раствором метабисульфита натрия и насыщенным солевым раствором, сушили над безводным MgSO4 и концентрировали в вакууме с получением смеси дибромида 2-4 и монобромида 2-5. Остаток растворяли в уксусной кислоте (750 мл) и добавляли сульфит натрия (93 г, 740 ммоль). Реакционную смесь перемешивали при температуре 70C в течение 3 ч. Реакционную смесь охлаждали до комнатной температуры и частично упаривали, добавляли воду и дихлорметан. Органический слой отделяли и концентрировали при пониженном давлении. Сырой промежуточный продукт 2-5 использовали как таковой на следующей стадии (выход не определяли). Стадия 4. К раствору сырого промежуточного продукта 2-5 в метаноле (1,5 л) при температуре 0C порциями добавляли NaBH4 (21,7 г, 574 ммоль) и смесь перемешивали при комнатной температуре в течение 30 мин. Реакционную смесь частично упаривали при пониженном давлении и остаток разбавляли этилацетатом. Органическую фазу промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Сырой продукт очищали путем хроматографии на колонке с силикагелем (элюент: дихлорметандихлорметан/метанол 96:4) с получением 105,5 г (67% в расчете на промежуточное соединение 2-3) промежуточного соединения 2-6. Стадия 5. Концентрированную серную кислоту (16 мл, 300 ммоль, 2,0 экв.) добавляли по каплям к раствору промежуточного соединения 2-6 (39.5 г, 150 ммоль, 1,0 экв.) в ацетонитриле (800 мл). Реакционную смесь перемешивали при температуре 45-50C до тех пор, пока не переставал присутствовать исходный продукт (около 5 ч) и затем концентрировали при пониженном давлении. Добавляли воду (800 мл) и ацетонитрил (200 мл), реакционную смесь перемешивали при температуре кипения с обратным холодильником в течение двух дней. Реакционную смесь затем охлаждали до комнатной температуры,промывали дихлорметаном и подщелачивали 50%-ным водным раствором NaOH до pH 12-13. Осадок отфильтровывали, промывали водой и сушили в вакуумной печи с получением 25,2 г (84%) рацемического предшественника 3. Рацемическую смесь разделяли посредством препаративной ВЭЖХ на колонке Chiralpak DaicelAD (подвижная фаза:ацетонитрил), желаемый (3S,4S)-энантиомер +)-предшественник 3) выделяли в качестве первой фракции (эи 95%). 1 Н ЯМР (400 МГц, ДМСО-d6)м.д. 1,92 (ушир.с, 2H), 3,84-3,92 (м, 2H), 4,14 (дд, J=10,9, 2,5 Гц, 1H),4,17 (дд, J=11,1, 5,5 Гц, 1H), 5,17 (ушир.с, 1H), 6,85 (т, J=7,8 Гц, 1H), 7,23 (д, J=7,6 Гц, 1H), 7,41 (д, J=7,8 Гц, 1H).[]20D=+59,2 (с 0,37, MeOH). Абсолютную конфигурацию (+)-предшественника 3 определяли путем сравнения оптического вращения ([]20D=+45,8 (с 0,27, MeOH после восстановительного удаления хлора (газообразный водород(1 атм), палладий на углероде в качестве катализатора) с оптическим вращением (+)-предшественника 2. Пример 3. Синтез (rac)-цис-4-амино-7-хлорхроман-3-ола rac)-предшественник 4).(rac)-Предшественник 4 получали исходя из 3-хлорфенола, используя способы, показанные в примере получения (rac)-предшественника 3. 1 Н ЯМР (400 МГц, ДМСО-d6)м.д. 1,83 (ушир.с, 2H), 3,79-3,89 (м, 2H), 4,03-4,12 (м, 2H), 5,12 Стадия 1. Ди-трет-бутилдикарбонат (14,5 г, 66,6 ммоль, 1,1 экв.) растворяли в ТГФ (100 мл), раствор охлаждали до температуры 0C и перемешивали. Одновременно добавляли (3S,4S)-4-аминохроман 3-ол +)-предшественник 2) (10 г, 60,5 ммоль, 1,0 экв.) и NaHCO3 (5,1 г, 60,5 ммоль, 1,0 экв.), при этом хорошо перемешивая. Реакционную смесь перемешивали при комнатной температуре в течение 4 ч. Растворитель частично упаривали, добавляли воду и полученную смесь экстрагировали диэтиловым эфиром. Объединенные органические экстракты промывали 10%-ным раствором лимонной кислоты и насыщенным солевым раствором, сушили с помощью MgSO4, фильтровали и упаривали досуха с получением 21 г сырого карбамата 4-1. Стадия 2. Сырой карбамат 4-1 растворяли в ДМФ (100 мл) и добавляли N-хлорсукинимид (NCS; 8,9 г, 66, 6 ммоль, 1,1 экв.). Реакционную смесь перемешивали при температуре 80C в течение 1 ч. Реакционную смесь охлаждали до комнатной температуры, разбавляли диэтиловым эфиром, промывали насыщенным водным раствором Na2CO3 и насыщенным солевым раствором, сушили над безводным MgSO4 и концентрировали при пониженном давлении с получением 16,3 г (82% за две стадии) сырого промежу- 20020758 точного продукта 4-2. Стадия 3. Раствор 4-2 (16,3 г, 54,2 ммоль, 1,0 экв.) и трифторуксусной кислоты (ТФУ; 124 г, 1084 ммоль, 20,0 экв.) в дихлорметане (100 мл) перемешивали при комнатной температуре в течение 1 ч. Реакционную смесь подщелачивали насыщенным раствором Na2CO3 и экстрагировали дихлорметаном. Объединенные органические фазы промывали водой и насыщенным солевым раствором и сушили с помощью MgSO4. Сырой продукт перекристаллизовывали из этилацетата с получением 6,8 г (61%) (-)предшественника 5 (эи 95%). 1(rac)-цис-4-Амино-8-фторхроман-3-ол получали исходя из коммерчески доступного 8-фторхроман 4-она [CAS No.: 11141-00-5], используя способы, показанные в примере получения (rac)предшественника 3. Рацемическую смесь отделяли посредством препаративной SFC на колонке ChiralpakDaicel AD-H (30250 мм, подвижная фаза: изократический 32% метанол (содержащий 0,2% изопропиламина)/68% CO2, скорость потока: 50 мл/мин), желаемый (3S,4S)-энантиомер +)-предшественник 6) выделяли в качестве первой фракции (эи 95%). 1 Н ЯМР (400 МГц, ДМСО-d6)м.д. 1,90 (ушир.с, 2H), 3,84-3,92 (м, 2H), 4,09 (дд, J=11,1, 2,7 Гц, 1H),4,14 (дд, J=10,9, 5,5 Гц, 1H), 5,15 (ушир.с, 1H), 6,82 (тд, J=7,9, 5,1 Гц, 1H), 7,01 (ддд, J=11,3, 8,2, 1,4 Гц,1H) 7,24 (д, J=7,8 Гц, 1H).[]20D=+24, 6 (с 0,43, MeOH). Абсолютную геометрическую конфигурацию определяли, используя VCD. Пример 6. Синтез (3S,4S)-4-амино-7-фторхроман-3-ола +) -предшественник 7).(rac)-цис-4-Амино-7-фторхроман-3-ол получали, используя способы, показанные в примере получения (rac)-предшественника 3. Смесь (rac)-цис-4-амино-7-фторхроман-3-ола (31,8 г, 174 ммоль, 1,0 экв.) и (+)-(5)-миндальной кислоты (26,4 г, 174 ммоль, 1,0 экв.) кипятили с обратным холодильником в метаноле (600 мл) до получения прозрачного раствора. Соль миндальной кислоты, получаемую после кристаллизации в течение ночи, собирали путем фильтрации и растворяли в 3 М водном растворе NaOH. Водный слой экстрагировали этилацетатом, объединенные органические фазы сушили безводнымMgSO4 и концентрировали при пониженном давлении с получением 6,5 г (21%) энантиомерно обогащенного (+)-предшественника 7 (эи 95%). 1 Н ЯМР (400 МГц, ДМСО-d6)м.д. 2,03 (ушир.с, 2H), 3,81-3,86 (м, 2H), 4,01-4,10 (м, 2H), 5,09[]20D=+36,0 (с 0,42, MeOH). Абсолютную геометрическую конфигурацию определяли, используя VCD. Пример 7. Синтез (3S,4S)-4-амино-6-фторхроман-3-ола +)-предшественник 8).(rac)-цис-4-Амино-6-фторхроман-3-ол получали исходя из коммерчески доступного 6-фторхроман 4-она [CAS No.: 66892-34-0], используя способы, показанные в примере получения (rac)предшественника 3. (rac)-цис-4-Амино-6-фторхроман-3-ол (7,63 г, 41,7 ммоль, 1,0 экв.) растворяли в этаноле (30 мл) при нагревании, добавляли порциями (-)-(R)-миндальную кислоту (6,68 г, 45,8 ммоль, 1,1 экв.) и раствор нагревали до температуры кипения с обратным холодильником. Затем по каплям добавляли гептан (6 мл). Образовавшейся суспензии давали охладиться до комнатной температуры и оставляли стоять в течение 1 ч. Фильтрация давала соль миндальной кислоты в виде твердого продукта белого цвета, который перекристаллизовывали из этанола. Полученную соль растворяли в 2 М водном раствореNaOH. Водную фазу экстрагировали этилацетатом, объединенные органические фазы сушили безводнымMgSO4 и концентрировали при пониженном давлении с получением 2,0 г (26%) энантиомерно обогащенного (+)-предшественника 8 (эи=82%). 1 Н ЯМР (400 МГц, ДМСО-d6)м.д. 1,88 (ушир.с, 2H), 3,79-3,89 (м, 2H), 4,01 (ддд, J=11,1, 2,6, 1,0 Гц, 1H), 4,06 (дд, J=11,1, 5,1 Гц, 1H), 5,08 (д, J=3,5 Гц, 1H), 6,69 (дд, J=9,0, 4,9 Гц, 1H), 6,90 (тд, J=8,6, 3,3 Гц, 1H), 7,24 (дд, J=9,7, 3,2 Гц, 1H).[]20D=+25,8 (с 0,50, MeOH). Абсолютную геометрическую конфигурацию определяли, используя VCD. Пример 8. Синтез (3S,4S)-4-амино-6,8-дифторхроман-3-ола +)-предшественник 9).(rac)-цис-4-Амино-6,8-дифторхроман-3-ол получали исходя из 2,4-дифторфенола [CAS No.: 367-271], используя способы, показанные в примере получения (rac)-предшественника 3. Рацемическую смесь отделяли посредством препаративной SFC на колонке Chiralpak Daicel AD-H (30250 мм, подвижная фаза: изократический 50% метанол (содержащий 0,2% изопропиламин)/50% CO2, скорость потока: 50 мл/мин), желаемый (3S,4S)-энантиомер +)-предшественник 9) выделяли в качестве первой фракции (эи 95%). 1 Н ЯМР (400 МГц, ДМСО-d6)м.д. 1,92 (ушир.с, 2H), 3,84-3,90 (м, 2H), 4,11 (ддд, J=11,2, 2,2, 0,8 Гц, 1H), 4,16 (дд, J=11,1, 4,6 Гц, 1H), 5,19 (ушир.с, 1H), 7,06 (ддд, J=11,3, 8,5, 3,1 Гц, 1H), 7,14 (дм, J=9,7 Гц, 1H).[]20D=+9,7 (c 0,41, MeOH). Абсолютную геометрическую конфигурацию определяли, используя VCD. Пример 9 а. Синтез (3S,4S)-4-амино-8-хлор-6-фторхроман-3-ола +)-предшественник 10 а).(rac)-цис-4-Амино-8-хлор-6-фторхроман-3-ол получали исходя из 2-хлор-4-фторфенола [CAS No.: 1996-41-4], используя способы, показанные в примере получения (rac)-предшественника 3. Желаемый(3S,4S)-энантиомер +)-предшественник 10 а) выделяли посредством препаративной SFC на колонке Chiralpak Daicel AD-H (30250 мм, подвижная фаза: изократический 40% метанол (содержащий 0,6% изопропиламина)/60% СО 2, скорость потока: 50 мл/мин), желаемый (3S,4S)-энантиомер +)предшественник 10 а) выделяли в качестве первой фракции (эи 95%). 1 Н ЯМР (400 МГц, ДМСО-d6)м.д. 2,03 (ушир.с, 2H), 3,84-3,91 (м, 2H), 4,15 (ддд, J=11,3, 2,5, 0,8 Гц, 1H), 4,20 (дд, J=11,3, 4,4 Гц, 1H), 5,21 (ушир.с, 1H), 7,20 (дд, J=8,2, 3,1 Гц, 1H), 7,30 (ддд, J=9,5, 3,1,0,9 Гц, 1H).[]20D=+39,7 (с 1,0, MeOH). Абсолютную геометрическую конфигурацию определяли, используя VCD. Пример 9b. Синтез (3S,4S)-4-амино-6-фтор-8-метилхроман-3-ола +)-предшественник 10b).(rac)-цис-4-Амино-6-фтор-8-метилхроман-3-ол получали исходя из коммерчески доступного 2 метил-4-фторфенола [CAS No.: 452-72-2] (9b-1), используя слегка модифицированный метод синтеза,показанный в примере получения (rac)-предшественника 3. Стадия 1. К раствору NaH (9,1 г 60%-ной дисперсии в масле, 238 ммоль, 1,2 экв.) в ДМФ (300 мл) при температуре 0C по каплям добавляли раствор 2-метил-4-фторфенола [CAS No.: 452-72-2]; 25,0 г,198 ммоль, 1,0 экв.) в ДМФ (40 мл). Суспензию перемешивали при комнатной температуре в течение 30 мин и вновь охлаждали до температуры 0C, по каплям добавляли раствор 1-хлор-3-гидроксипропана(22,5 г, 238 ммоль, 1,2 экв.) в ДМФ (40 мл). Реакционную смесь нагревали в течение 2 ч при температуре 60C (может потребоваться дополнительное количество NaH и 1-хлор-3-гидроксипропана для завершения реакции). Реакционную смесь охлаждали до комнатной температуры и добавляли воду, водный слой экстрагировали с помощью диэтилового эфира, объединенные органические фазы промывали водным раствором NaOH и насыщенным солевым раствором, сушили над безводным MgSO4 и концентрировали при пониженном давлении. Сырой продукт использовали как таковой на следующей стадии. Стадия 2. Промежуточное соединение 9b-2 (12,9 г, 70 ммоль) растворяли в смеси 1:1 CH3CN/H2O(425 мл). Добавляли порциями TEMPO (1094 мг, 7 ммоль, 0,1 экв.) и бис (ацетокси) йодбензол (BAIB; 56,4 г, 175 ммоль, 2,5 экв.) и реакционную смесь перемешивали при комнатной температуре в течение ночи (может потребоваться дополнительное количество TEMPO и BAIB для завершения окисления). Реакционную смесь гасили путем добавления водного раствора Na2S2O3, водную фазу экстрагировали DCM и объединенные органические слои затем экстрагировали водным раствором Na2CO3. После подкисления с помощью 1 М водного раствора соляной кислоты водную фазу экстрагировали с помощью DCM. Объединенные органические слои сушили над безводным MgSO4 и концентрировали при пониженном давлении с получением 13,2 г (96%) промежуточного соединения 9b-3. Последний затем преобразовывали в(3S,4S)-энантиомер +)-предшественник 10b) выделяли в качестве первой фракции посредством препаративной ВЭЖХ на колонке Chiralpak Daicel AD (подвижная фаза: ацетонитрил). 1 Н ЯМР (400 МГц, ДМСО-d6)м.д. 1,89 (ушир.с, 2H), 2,08 (с, 3H), 3,83 (ушир.с, 2H), 4,04 (д, J=10,9 Гц, 1H), 4,09 (дд, J=11,5, 4,9 Гц, 1H), 5,07 (ушир.с, 1H), 6,82 (д, J=9, б Гц, 1H), 7,07 (д, J=9, б Гц, 1H).[]20D=+50,3 (c 0,38, MeOH). Абсолютную геометрическую конфигурацию определяли, используя VCD. Пример 10 а. Синтез (3S,4S)-4-амино-6-хлор-8-фторхроман-3-ола -)-предшественник 11 а). 348-62-9], используя способы, показанные в примере получения (rac)-предшественника 3. Рацемическую смесь отделяли посредством препаративной SFC на колонке Chiralpak Daicel AD-H (20250 мм, подвижная фаза:изократический 40% метанол (содержащий 0,2% изопропиламина)/60% CO2, скорость потока: 50 мл/мин), желаемый (3S,4S)-энантиомер -)-предшественник 11 а) выделяли в качестве первой фракции (эи 95%). 1[]20D=-32,0 (с 0,42, MeOH). Абсолютную геометрическую конфигурацию определяли, используя VCD. Пример 10b. Синтез (3S,4S)-4-амино-8-фтор-6-метилхроман-3-ола +) -предшественник 11b).(rac)-цис-4-Амино-8-фтор-6-метилхроман-3-ол получали исходя из 4-метил-2-фторфенола [CASNo.: 452-81-3], используя способы, показанные в примере получения (rac)-предшественника 10b. Рацемическую смесь отделяли посредством препаративной SFC на колонке Chiralpak Daicel AD-H (30250 мм, подвижная фаза: изократический 20% метанол (с 0, 6% изопропиламина)/20% CO2, скорость потока: 50 мл/мин), желаемый (3S,4S)-энантиомер +)-предшественник 11b) выделяли в качестве первой фракции (эи 95%). 1[]20D=+88,8 (с 0,18, MeOH). Абсолютную геометрическую конфигурацию определяли, используя VCD. Пример 11. Синтез (3S,4S)-4-амино-6-метилхроман-3-ола -)-предшественник 12).(rac)-цис-4-Амино-6-метилхроман-3-ол получали исходя из 6-метил-4-хроманона [CAS No.: 3951375-2], используя способы, показанные в примере получения (rac)-предшественника 3. Рацемическую смесь отделяли посредством препаративной SFC на колонке Chiralpak Daicel AD-H (30250 мм, подвижная фаза: изократический 17% метанол (с 0,5% изопропиламином)/83% CO2, скорость потока: 50 мл/мин), желаемый (3S,4S)-энантиомер -)-предшественник 12) выделяли в качестве второй фракции (эи 95%). 1[]20D=-18,7 (с 0,43, MeOH). Абсолютную геометрическую конфигурацию определяли, используя VCD. Пример 12. Синтез (4S,5S)-4-амино-4,5,6,7-тетрагидробензо[b]тиофен-5-ола +)-предшественник 13). Стадия 1. Раствор 6,7-дигидро-5 Н-бензо[b]тиофен-4-она (исходный продукт 12-1, [CAS No.: 1341495-4]; 39 г, 256 ммоль, 1,0 экв.) в ТГФ (150 мл) добавляли по каплям к смеси бис-(триметилсилил)амида натрия (NHMDS; 307 мл 1 М раствора в ТГФ, 307 ммоль, 1,2 экв.) и ТГФ (200 мл) при температуре -78C в атмосфере аргона, реакционную смесь перемешивали в течение дополнительных 30 мин при температуре -78C. Добавляли по каплям раствор (+)-(8,8-дихлоркамфорилсульфонил)оксазиридина (94 г, 307 ммоль, 1,2 экв.) в ТГФ (300 мл). После перемешивания в течение 2 ч при температуре -78C реакционную смесь гасили путем добавления избытка уксусной кислоты и давали нагреться до комнатной температуры. Добавляли воду и этилацетат, и водную фазу отделяли и экстрагировали этилацетатом. Объединенные органические фазы сушили над безводным MgSO4 и концентрировали при пониженном давлении. Остаток вновь растворяли в дихлорметане (300 мл) и растирали в гептане (500 мл), осадок удаляли путем фильтрации и промывали диизопропиловым эфиром. Фильтрат концентрировали при пониженном давлении, остаток очищали путем хроматографии на колонке с силикагелем (элюент: гептангептан/этилацетат 4:6) с получением 50 г (116%) загрязненного промежуточного соединения 12-2. Сырой продукт использовали как таковой на следующей стадии. Стадия 2. Гидрохлорид O-бензилгидроксиламина (41 г, 256 ммоль, 1,0 экв.) добавляли к раствору сырого промежуточного продукта 12-2 (50 г) в пиридине (500 мл). Реакционную смесь перемешивали при комнатной температуре в течение уикэнда. Смесь упаривали и совместно упаривали два раза с толуолом. Остаток вновь растворяли в этилацетате, органическую фазу промывали 5%-ным водным раствором лимонной кислоты и насыщенным солевым раствором, сушили безводным MgSO4 и концентрировали при пониженном давлении с получением 72 г сырого промежуточного продукта 12-3. Стадия 3. Комплекс боран-диметилсульфид (198 мл 1 М раствора в ТГФ, 395 ммоль, 1,54 экв.) добавляли по каплям к раствору сырого промежуточного продукта 12-3 (72 г) в ТГФ (1 л) при температуре 0C. Реакционную смесь перемешивали при температуре кипения с обратным холодильником в течение ночи. Затем растворитель частично удаляли отгонкой (реакционный сосуд был снабжен нисходящим холодильником), реакционную смесь далее перемешивали при температуре кипения до завершения преобразования. Реакционную смесь охлаждали на ледяной бане и гасили путем осторожного добавления воды. Водную фазу насыщали NaCl и несколько раз экстрагировали метилтетрагидрофураном. Объединенные органические фазы сушили безводным MgSO4 и концентрировали при пониженном давлении с получением цис/трансизомерной смеси 8:2. Желаемый цис-изомер выделяли с помощью хроматографии на силикагеле (элюент:дихлорметандихлорметан/7 М раствор аммиака в метаноле 96:4), получали 17,8 г (40% за 3 стадии, 60% эи (эи был определен с помощью жидкостной хроматографии (ЖХ) после образования амида с (+)-(5)-миндальной кислотой. (+)-Предшественник 13 (17,7 г, 105 ммоль, 1,0 экв.) перекристаллизовывали с (+)-(S)-миндальной кислотой (16 г, 105 ммоль, 1,0 экв.) в метаноле в течение ночи. Твердое вещество белого цвета отфильтровывали. Фильтрат концентрировали и полученный остаток опять перекристаллизовывали. Обе партии объединяли и растворяли в 3 М водном растворе NaOH. Водную фазу экстрагировали дихлорметаном, объединенные органические слои сушили безводным MgSO4 и концентрировали при пониженном давлении с получением 11,5 г (65%) энантиомерно чистого (+)предшественника 13 (эи 95%). 1 Н ЯМР (400 МГц, хлороформ-d)м.д. 1,78-2,03 (м, 2H), 2,20 (ушир.с, 3H), 2,76 (ддд, J=16,6, 9,4,6,2 Гц, 1H), 2,93 (дд, J=16,6, 5,3 Гц, 1H), 3,80-4,00 (м, 2H), 6,94 (д, J=5,0 Гц, 1H), 7,13 (д, J=5,3 Гц, 1H).[]20D=+59,6 (с 0,49, MeOH). Абсолютную геометрическую конфигурацию определяли, используя VCD. Пример 13. Синтез гидрохлорида (1S,2R,6R)-2-гидрокси-6-метилциклогексанамина -)-предшественник 14b). Стадия 1. Кетон 13-1 ([CAS No.: 13368-65-5]; 430 г, 3,83 моль, 1,0 экв.) и моногидрат паратолуолсульфоновой кислоты (pTSA.H2O; 72,9 г, 0,38 моль, 0,1 экв.) в изопропенилацетате (2,5 л) кипятили с обратным холодильником в течение 6 ч при температуре 100C. Затем реакционную смесь охлаждали до комнатной температуры, добавляли воду. Органический слой отделяли и промывали насыщенным водным раствором NaHCO3 и насыщенным солевым раствором, сушили над безводным NaSO4 и концентрировали в вакууме с получением 530 г (90%) смеси 7:10 желаемого изомера 13-2 А и нежелаемого изомера 13-2 В (изомерное соотношение определяли с помощью 1 Н ЯМР). Эту смесь использовали как таковую на следующей стадии. Стадия 2. Изомерную смесь 13-2 А и 13-2 В (10 6,2 г, 0,95 моль, 1,0 экв.) растворяли в ангидриде уксусной кислоты (400 мл). Добавляли по каплям концентрированную азотную кислоту (61 мл, 0,95 моль,1,0 экв.) с такой скоростью, чтобы реакционная температура поддерживалась между 30 и 40C. После завершения добавления реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Данные ТСХ показывали завершение реакции (элюент: петролейный эфир/этилацетат 5:1, Rf=0,4, два пятна близко друг к другу). Реакционную смесь добавляли по каплям в водный насыщенный растворNaHCO3 (79,8 г NaHCO3 в воде, 0,95 моль, 1,0 экв.). Смесь экстрагировали этилацетатом, объединенные органические слои промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали в вакууме. Сырой продукт очищали путем хроматографии на колонке с силикагелем (элюент: петролейный эфир/этилацетат 97:391:9) с получением 12,5 г (11%) промежуточного соединения 13-3 (второе пятно). Стадия 3. К раствору промежуточного соединения 13-3 (125 г, 795 ммоль, 1,0 экв.) в сухом метаноле (3,0 л) при комнатной температуре порциями добавляли NaBH4 (40 г, 1,03 моль, 1,3 экв.). Реакционную смесь перемешивали в течение 30 мин при комнатной температуре. Смесь нейтрализовали 10%-ным водным раствором KHSO4 до pH 7 и концентрировали при пониженном давлении. Добавляли воду и смесь экстрагировали этилацетатом. Объединенные органические фазы промывали насыщенным солевым раствором, сушили над безводным MgSO4 и концентрировали при пониженном давлении с получением смеси 1:1 промежуточного соединения 13-4 и его эпимерного спирта. Оба эпимера разделяли посредством препаративной SFC на колонке Chiralpak Daicel AD-5 мкм (30250 мм, подвижная фаза: изократический 20% изопропанол/80% CO2, скорость потока 60 мл/мин), в качестве первой фракции получали 29 г (22%) желаемого изомера 13-4. 1 Н ЯМР (400 МГц, CDCl3)м.д. 0,99 (д, J=6,8 Гц, 3H), 1,10 (м, 1H), 1,50 (м, 2H), 1,75-1,91 (м, 2H),2,01 (м, 1H), 2,50 (м, 1H), 2,85 (ушир.с, 1H), 4,20 (дд, J=11,6, 2,0 Гц, 1H), 4,51 (с, 1H). Стадия 4. Раствор 13-4 (29 г, 169,6 ммоль, 1,0 экв.) в этилацетате (1,25 л) гидрировали при атмосферном давлении в течение 5 ч при температуре 5C в присутствии Ni Ренея (32 г) в качестве катализатора. После поглощения газообразного водорода (3,0 экв.), катализатор отфильтровывали. К фильтрату при температуре 0C добавляли раствор соляной кислоты в диоксане, полученную смесь перемешивали в течение 30 мин. Растворитель частично удаляли при пониженном давлении, осадок собирали путем фильтрации и промывали петролейным эфиром и диэтиловым эфиром с получением 20,9 г (74%) (-)предшественника 14b (эи 95%, эи определяли с помощью ЖХ после образования амида с (S)-(+)-метокситрифторметилфенилацетилхлоридом). 1[]20D=-0,53 (с 1,01, MeOH). Далее указаны карбокислотные и карбонатные предшественники, необходимые в качестве связующих звеньев, позволяющих ввести R3, как определено выше. Те из них, которые не являются коммерчески доступными, могут быть синтезированы в соответствии со способами, описанными в литературе Амин 14-1 синтезировали в соответствии с литературными способами, исходя из предшественника 19. Стадия 1. К раствору амина 14-1 (1,8 г, 8,13 ммоль, 1,0 экв.), 1-цианоциклопропанкарбоновой кислоты (0,90 г, 8,13 ммоль, 1,0 экв.) и N-этил-N-изопропилпропан-2-амина (DIPEA; 3,15 г, 8,13 ммоль, 1,0 экв.) в ДМФ (80 мл) при температуре -20C добавляли HATU (3,56 г, 9,35 ммоль, 1,15 экв.). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Добавляли этилацетат, органическую фазу промывали насыщенным раствором NaHCO3, сушили безводным MgSO4 и концентрировали при пониженном давлении с получением 1,83 г (72%) сырого промежуточного продукта 14-2. Продукт использовали как таковой на следующей стадии. Стадия 2. Раствор промежуточного соединения 14-2 (1,83 г, 5,81 ммоль, 1,0 экв.) в метаноле гидрировали при атмосферном давлении при температуре 25C в течение 3 ч в присутствии Pd(Pd/C 10%) в качестве катализатора. Реакционную смесь фильтровали через целит и фильтрат концентрировали при пониженном давлении. Остаток очищали путем хроматографии на колонке с силикагелем (элюент: дихлорметан/метанол/уксусная кислота 97:2:1) с получением 0,75 г (58%) предшественника 22. (Наблюдалось, что в процессе проведения вышеуказанной последовательности синтеза имела место сильная рацемизация). 1 Н ЯМР (400 МГц, хлороформ-d)м.д. 1,07 (с, 9H), 1,56 (д, J=3,7 Гц, 2H), 1,63-1,79 (м, 2H), 4,41 (д,J=9,0 Гц, 1H), 6,87 (д, J=8,8 Гц, 1H), 11,12 (ушир.с, 1H). Ниже указаны предшественники, представляющие примеры формулы R4-M, как определено выше,которые были использованы для реакции Сузуки или реакции поперечного связывания Стилла. Те соединения, которые не являются коммерчески доступными, могут быть синтезированы способами, описанными в литературе (предшественник 25 и 26), или способами, описанными в примерах 15 и 16 (предшественники 27, 28, 36 и 37). В течение 2 ч к раствору 2-изопропилтиазола ([CAS No.: 15679-10-4]; 65 г, 511 ммоль, 1,0 экв.) в сухом ТГФ (1,3 л) при температуре -78C добавляли диизопропиламид лития (LDA; 245 мл 2,5 М раствора,613,2 ммоль, 1,2 экв.). После перемешивания в течение 1 ч при этой температуре добавляли по каплям хлорид трибутилолова (111 мл, 408,8 ммоль, 0,8 экв.). Реакционной смеси давали постепенно нагреться до комнатной температуры в течение около 3 ч, после чего смесь гасили насыщенным водным растворомNH4Cl и разбавляли с помощью диэтилового эфира. Органический слой отделяли и водный слой экстрагировали с помощью диэтилового эфира. Объединенные органические слои сушили с помощью MgSO4 и концентрировали при пониженном давлении с получением 51 г (24%) предшественника 27. 1H ЯМР (300 МГц, хлороформ-d)м.д. 0,90 (т, J=7,3 Гц, 9H), 1,06-1,16 (м, 6H), 1,25-1,39 (м, 6H),1,42 (д, J=7,0 Гц, 6H), 1,48-1,61 (м, 6H), 3,38 (септ, J=6,9 Гц, 1H), 7,60 (с, 1H). Предшественник 28 синтезировали аналогично предшественнику 27 исходя из 2 циклопропилтиазола [CAS No.: 1159821-56-3], но используя в качестве основания н-бутиллитий. Смесь 2-циклопропил-6-метилпиридина ([CAS No.: 41765-00-8]; 1,99 г, 14,9 ммоль, 1,0 экв.), бис(пинаколато)диборона (Pin2B2; 3,7 9 г, 14,9 ммоль, 1,0 экв.) и 4,4'-ди-третбутил-2,2'-бипиридина (dtbpy; 0,08 г, 0,30 ммоль, 0,02 экв.) в октане (25 мл) продували азотом. Добавляли димер хлор-1,5 циклооктадиена иридия(I) ([IrCl(COD)]2; 0,10 г, 0,149 ммоль, 0,01 экв.) и реакционную смесь перемешивали при температуре 80C в течение 6 ч. Реакционную смесь охлаждали до комнатной температуры и разбавляли дихлорметаном. Добавляли воду и смесь перемешивали в течение 15 мин. Водную фазу экстрагировали дихлорметаном (6 раз), объединенные органические фазы сушили безводным MgSO4 и концентрировали при пониженном давлении с получением 3,7 г (95%) сырого предшественника 36. Последний использовали без дополнительной очистки. Предшественник 37 синтезировали аналогично предшественнику 36, исходя из 2,6 диметилпиридина [CAS No.: 108-48-5]. Следующие примеры иллюстрируют типичные способы синтеза соединения формулы I. Соответствующие данные ЯМР и/или точки плавления представлены в табл. 2. Пример 17. Синтез соединения 7 Стадия 1. Раствор (-)-предшественника 1 (12,5 г, 32,5 ммоль, 1,0 экв.) в сухом ТГФ (100 мл) охлаждали до температуры -78C в атмосфере азота. Медленно добавляли литий бис (триметилсилил) амид(LHMDS; 68,3 мл 1 М раствора в ТГФ, 68,3 ммоль, 2,1 экв.). Через 30 мин при температуре -78C одной порцией в реакционную смесь добавляли 2-фторбензилбромид (4,19 мл, 34,2 ммоль, 1,05 экв.). Переме- 28020758 шивание продолжали в течение 90 мин при температуре -78C. Добавляли уксусную кислоту (1 мл) и воду, смеси давали нагреться до комнатной температуры. Добавляли этилацетат, органическую фазу отделяли и последовательно промывали 10%-ным раствором лимонной кислоты, насыщенным водным раствором NaHCO3 и насыщенным солевым раствором, сушили над безводным MgSO4 и концентрировали при пониженном давлении. Сырой продукт очищали путем хроматографии на колонке с силикагелем(элюент: гептангептан/этилацетат 7:3) с получением 10,7 г (67%) промежуточного соединения 17-1. Стадия 2. К раствору промежуточного соединения 17-1 (3,3 г, 6,7 ммоль, 1,0 экв.) в метаноле (20 мл) добавляли NaOH (33,5 мл 1 М водного раствора, 33,5 ммоль, 5,0 экв.). Реакционную смесь перемешивали при комнатной температуре в течение 3 ч. Реакционную смесь частично концентрировали при пониженном давлении и затем подкисляли до pH 2-3 с помощью 10%-ного раствора лимонной кислоты. Осадок белого цвета отфильтровывали, промывали водой и сушили в высоком вакууме. Сырой промежуточный продукт 17-2 (3,33 г, 96%) использовали как таковой на следующей стадии. Стадия 3. Имидазол (3,08 г, 45,2 ммоль, 7,0 экв.) и трет-бутилдиметилсилилхлорид (4,87 г, 32,4 ммоль, 5,0 экв.) добавляли к раствору промежуточного соединения 17-2 (3,33 г, 6,47 ммоль, 1,0 экв.) в ДМФ (650 мл). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Добавляли метанол (30 мл) и перемешивание продолжали до тех пор, пока данные жидкостной хроматографиимасс спектрометрии (LCMS) не показывали завершение удаления защиты TBDMS у карбоновой кислоты. В реакционную смесь добавляли этилацетат и 10%-ный раствор лимонной кислоты. Органическую фазу отделяли, промывали насыщенным солевым раствором, сушили безводным MgSO4 и концентрировали при пониженном давлении. Сырой продукт очищали путем хроматографии на колонке с силикагелем (элюент: гептангептан/этилацетат 7:4) с получением 3,7 г (91%) чистого промежуточного соединения 17-3. Стадия 4. Триэтиламин (0,89 г, 8,83 ммоль, 1,2 экв.), HATU (2,94 г, 7,73 ммоль, 1,05 экв.) и (+)предшественник 2 (1,54 г, 7,7 3 ммоль, 1,05 экв.) последовательно добавляли к раствору промежуточного соединения 17-3 (4,60 г, 7,36 ммоль, 1,0 экв.) в ДМФ (70 мл). Реакционную смесь перемешивали в течение 1 ч при комнатной температуре. Добавляли фторид тетрабутиламмония (TBAF, 73,64 мл 1 М раствора в ТГФ, 73,64 ммоль, 10,0 экв.) и реакционную смесь перемешивали при температуре 50C до завершения удаления защиты TBDMS. Промежуточное соединение 17-4 осаждали путем добавления в реакционную смесь насыщенного водного раствора Na2CO3. Осадок отфильтровывали, промывали водой и сушили в высоком вакууме. Сырой продукт использовали как таковой на следующей стадии. Стадия 5. Смесь промежуточного соединения 17-4 (400 мг, 0,61 ммоль, 1,0 зкв.), предшественника 34 (303 мг, 1,83 ммоль, 3,0 экв.), тетракис-(трифенилфосфин)палладия (Pd(PPh3)4; 141 мг, 0,12 ммоль, 0,2 экв.) и Na2CO3 (2,74 мл 2 М водного раствора, 5,47 ммоль, 9,0 экв.) в диоксане (3 мл) перемешивали при температуре 110C в течение 30 мин (для предотвращения образования побочных продуктов время реакции было коротким) в атмосфере аргона. Реакционную смесь затем быстро охлаждали на ледяной бане и добавляли насыщенный водный раствор Na2CO3. Водный слой экстрагировали этилацетатом, объединенные органические фазы сушили безводным MgSO4 и концентрировали при пониженном давлении.
МПК / Метки
МПК: C07D 277/30, C07D 405/12, C07D 401/12, C07D 213/64, A61P 31/18, A61K 31/506, C07D 213/74, C07D 493/04, C07D 417/12
Метки: 5-амино-4-гидроксипентоиламиды
Код ссылки
<a href="https://eas.patents.su/30-20758-5-amino-4-gidroksipentoilamidy.html" rel="bookmark" title="База патентов Евразийского Союза">5-амино-4-гидроксипентоиламиды</a>
Предыдущий патент: Способ увеличения длительности цикла работы пастеризатора
Следующий патент: Способ переработки никельсодержащего сырья
Случайный патент: Триазолопиримидиновые производные в качестве ингибиторов киназы-3 гликогенсинтазы