Производные [[ 2-(амино-3,4-диоксо-1-циклобутен-1-ил)амино ]алкил]кислоты, применяемые для лечения боли
Номер патента: 9993
Опубликовано: 30.06.2008
Авторы: Залеска Маргарет Мария, Брандт Майкл Ричард, Мойер Джон Аллен
Формула / Реферат
1. Способ лечения боли у млекопитающего, включающий введение млекопитающему, нуждающемуся в лечении боли, эффективного для лечения боли количества по меньшей мере одного соединения, имеющего формулу
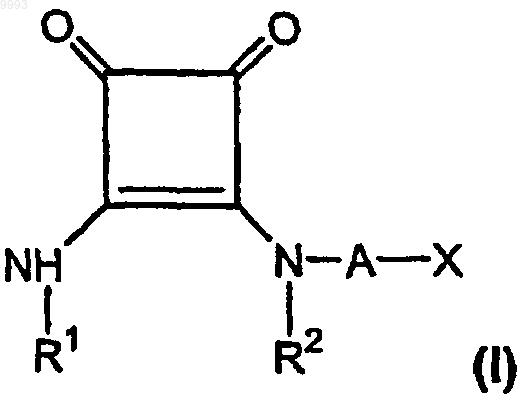
где R1 представляет собой водород, алкил, содержащий 1-6 атомов углерода, или фенилалкил, содержащий 7-12 атомов углерода;
R2 представляет собой водород, алкил, содержащий 1-6 атомов углерода, алкенил, содержащий 2-6 атомов углерода, или фенилалкил, содержащий 7-12 атомов углерода, или
R1 и R2, взятые вместе как Z, являются -CH2CH2-, -CH2C(R6)(R7)CH2- или
-CH2C(R8)(R9)-C(R10)(R11)CH2-, где R6, R8 и R10 представляют собой, независимо, водород, алкил, содержащий 1-6 атомов углерода, или гидроксил и R7, R9 и R11 представляют, независимо, водород или алкил, содержащий 1-6 атомов углерода;
A представляет собой алкилен, содержащий 1-6 атомов углерода, или алкенилен, содержащий 2-6 атомов углерода;
X представляет собой CO2R3, P(O)(OR4)(OR5), 3,5-диоксо-1,2,4-оксадиазолидин-2-ил или
5-тетразолил, где R3, R4 и R5 представляют собой, независимо, водород или алкил, содержащий 1-6 атомов углерода;
или его фармацевтически приемлемой соли.
2. Способ по п.1, в котором
R1 представляет собой водород, метил, этил или бензил;
R2 представляет собой водород, метил, этил, аллил, металлил или бензил
или R1 и R2, взятые вместе как Z, представляют собой -CH2CH2-, -CH2C(R6)(R7)CH2- или
-CH2C(R8)(R9)-C(R10)(R11)CH2-;
A представляет собой алкилен с неразветвленной или разветвленной цепью, выбранный из -CH2-,
-CH2CH2-, -CH(CH3)CH2-, -CH2CH(CH3)-, -(CH2)3- или -(CH2)4-; и
X выбран из карбоксила, фосфонила или 5-тетразолила;
или его фармацевтически приемлемая соль.
3. Способ по п.1, в котором
R1 и R2, взятые вместе как Z, представляют собой -CH2CH2-, -CH2C(R6)(R7)CH2- или
-CH2C(R8)(R9)-C(R10)(R11)CH2-;
A представляет собой алкилен с неразветвленной или разветвленной цепью, выбранный из -CH2-,
-CH2CH2-, -CH(CH3)CH2-, -CH2CH(CH3)-, -(CH2)3- или -(CH2)4-;
X выбран из карбоксила, фосфонила или 5-тетразолила.
4. Способ по любому одному из пп.1-3, в котором соединение формулы (I) включает по меньшей мере одно из следующих соединений:
N-(2-амино-3,4-диоксо-1-циклобутен-1-ил)-бета-аланина;
2-[2-[(2-амино-3,4-диоксо-1-циклобутен-1-ил)амино]этил]-1,2,4-оксадиазолидин-3,5-диона;
N-(2-амино-3,4-диоксо-1-циклобутен-1-ил)-N-(2-пропенил)глицина;
[2-[(2-амино-3,4-диоксо-1-циклобутен-1-ил)амино]этил]фосфоновой кислоты;
[(E)-4-[(2-амино-3,4-диоксо-1-циклобутен-1-ил)амино]-2-бутенил]фосфоновой кислоты или
[2-[(2-амино-3,4-диоксо-1-циклобутен-1-ил)метиламино]этил]фосфоновой кислоты;
или его фармацевтически приемлемую соль.
5. Способ по любому одному из пп.1-3, в котором соединение формулы (I) включает [2-(7,8-диоксо-2,5-диазабицикло[4.2.0]окт-1(6)-ен-2-ил)этил]фосфоновую кислоту или ее фармацевтически приемлемую соль.
6. Способ по любому одному из пп.1-3, в котором соединение формулы (I) включает
[2-(8,9-диоксо-2,6-диазабицикло[5.2.0]нон-1(7)-ен-2-ил)этил]фосфоновую кислоту или ее фармацевтически приемлемую соль.
7. Способ по любому одному из пп.1-3, в котором соединение формулы (I) включает
[2-(4-гидрокси-8,9-диоксо-2,6-диазабицикло[5.2.0]нон-1(7)-ен-2-ил)этил]фосфоновую кислоту или ее фармацевтически приемлемую соль.
8. Способ по любому одному из пп.1-3, в котором соединение формулы (I) включает
8,9-диоксо-2,6-диазабицикло[5.2.0]нон-1(7)-ен-2-уксусную кислоту или ее фармацевтически приемлемую соль.
9. Способ по любому одному из пп.1-3, в котором соединение формулы (I) включает
2-[(1Н-тетразол-5-ил)метил]-2,6-диазабицикло[5.2.0]нон-1(7)-ен-8,9-дион или его фармацевтически приемлемую соль.
10. Способ по любому одному из пп.1-3, в котором соединение формулы (I) включает
[2-(9,10-диоксо-2,7-диазабицикло[6.2.0]дец-1(8)-ен-2-ил)этил]фосфоновую кислоту или ее фармацевтически приемлемую соль.
11. Способ по любому одному из пп.1-10, в котором боль является острой болью или хронической болью.
12. Способ по п.11, где боль является воспалительной болью, скелетно-мышечной болью, костной болью, пояснично-крестцовой болью, шейной болью и болью верхней части спины, висцеральной болью, соматической болью, невропатической болью, раковой болью, болью, вызванной повреждением или хирургической операцией, или головной болью или их комбинациями.
13. Способ по п.11, в котором боль является хронической болью.
14. Способ по п.13, в котором хроническая боль связана с аллодинией, гиперглазией или обеими.
15. Способ по п.13, где хронической болью является невропатическая боль; раковая боль; висцеральная боль; скелетно-мышечная боль; костная боль; головная боль или боль, связанная с инфекциями, серповидно-клеточной анемией, аутоиммунными нарушениями, рассеянным склерозом или воспалением или их комбинации.
16. Способ по п.13, в котором боль включает невропатическую боль.
17. Способ по п.16, в котором невропатическая боль связана с диабетической невропатией, периферической невропатией, послегерпетической невралгией, тройничной невралгией, поясничными или цервикальными радикулопатиями, фибромиалгией, языкоглоточной невралгией, рефлекторной симпатической дистрофией, казуалгией, таламическим синдромом, авульсией нервных корешков, фантомной болью, болью после торакотомии, раком, химическим повреждением, токсинами, недостаточностью питания или вирусными или бактериальными инфекциями или их комбинациями.
18. Способ по любому одному из пп.1-17, дополнительно включающий введение фармацевтически эффективного количества по меньшей мере одного ослабляющего боль агента.
19. Способ по п.18, в котором ослабляющий боль агент включает один или более аналгетиков; противовоспалительных агентов; препаратов против мигрени; трициклических антидепрессантов; антиэпилептиков; a2-агонистов или селективных ингибиторов повторного поглощения серотонина/селективных ингибиторов повторного поглощения норэпинефрина или их комбинации.
20. Способ по п.19, в котором ослабляющий боль агент включает опиоидный аналгетик.
21. Фармацевтическая композиция для лечения боли, включающая:
а) эффективное для лечения боли количество, по меньшей мере приблизительно 150 мг/день для пероральной дозы, по меньшей мере одного соединения формулы
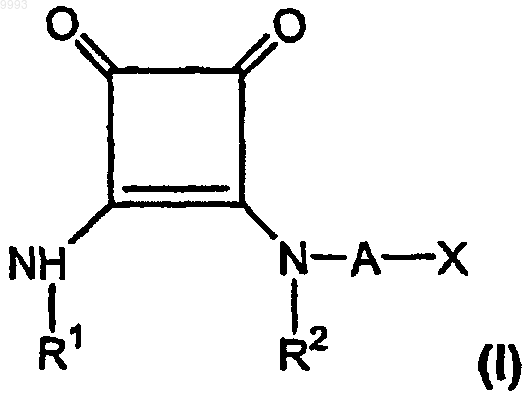
где R1 представляет собой водород, алкил, содержащий 1-6 атомов углерода, или фенилалкил, содержащий 7-12 атомов углерода;
R2 представляет собой водород, алкил, содержащий 1-6 атомов углерода, алкенил, содержащий 2-6 атомов углерода, или фенилалкил, содержащий 7-12 атомов углерода, или
R1 и R2, взятые вместе как Z, представляют собой -CH2CH2-, -CH2C(R6)(R7)CH2- или
-CH2C(R8)(R9)-C(R10)(R11)CH2-, где R6, R8 и R10 представляют собой, независимо, водород, алкил, содержащий 1-6 атомов углерода, или гидроксил и R7, R9 и R11 представляют собой, независимо, водород или алкил, содержащий 1-6 атомов углерода;
A представляет собой алкилен, содержащий 1-6 атомов углерода, или алкенилен, содержащий 2-6 атомов углерода;
X представляет собой CO2R3, P(O)(OR4)(OR5), 3,5-диоксо-1,2,4-оксадиазолидин-2-ил или
5-тетразолил, где R3, R4 и R5 представляют собой, независимо, водород или алкил, содержащий 1-6 атомов углерода;
или его фармацевтически приемлемую соль;
b) фармацевтически эффективное количество по меньшей мере одного ослабляющего боль агента.
22. Фармацевтическая композиция для лечения боли, включающая:
а) эффективное для лечения боли количество, по меньшей мере приблизительно 3 мг/день для внутривенной дозы, по меньшей мере одного соединения формулы
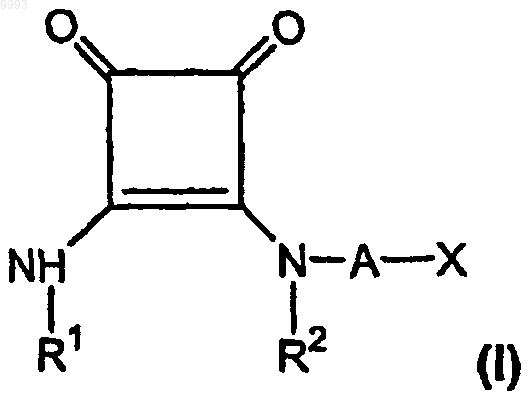
где R1 представляет собой водород, алкил, содержащий 1-6 атомов углерода, или фенилалкил, содержащий 7-12 атомов углерода;
R2 представляет собой водород, алкил, содержащий 1-6 атомов углерода, алкенил, содержащий 2-6 атомов углерода, или фенилалкил, содержащий 7-12 атомов углерода, или
R1 и R2, взятые вместе как Z, представляют собой -CH2CH2-, -CH2C(R6)(R7)CH2- или
-CH2C(R8)(R9)-C(R10)(R11)CH2-, где R6, R8 и R10 представляют собой, независимо, водород, алкил, содержащий 1-6 атомов углерода, или гидроксил и R7, R9 и R11 представляют собой, независимо, водород или алкил, содержащий 1-6 атомов углерода;
A представляет собой алкилен, содержащий 1-6 атомов углерода, или алкенилен, содержащий 2-6 атомов углерода;
X представляет собой CO2R3, P(O)(OR4)(OR5), 3,5-диоксо-1,2,4-оксадиазолидин-2-ил или
5-тетразолил, где R3, R4 и R5 представляют собой, независимо, водород или алкил, содержащий 1-6 атомов углерода;
или его фармацевтически приемлемую соль;
b) фармацевтически эффективное количество по меньшей мере одного ослабляющего боль агента.
23. Композиция по п.21, в которой эффективное для лечения боли количество по меньшей мере одного соединения формулы (I) составляет приблизительно от 150 до 900 мг/день для пероральной дозы.
24. Композиция по п.22, в которой эффективное для лечения боли количество по меньшей мере одного соединения формулы (I) составляет приблизительно от 3 до 50 мг/день для внутривенной дозы.
25. Композиция по п.21 или 22, где соединение формулы (I) имеет формулу
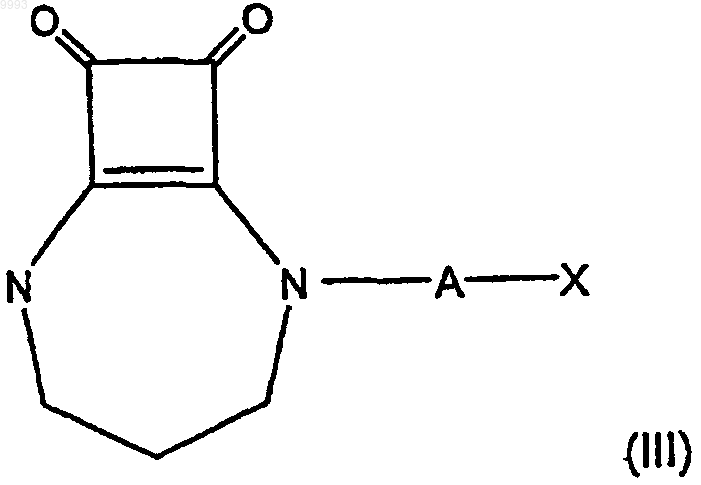
где A и X имеют значения, указанные в п.21 или 22.
26. Композиция по п.21 или 22, где соединением формулы (I) является по меньшей мере одно из следующих соединений:
[2-(7,8-диоксо-2,5-диазабицикло[4.2.0]окт-1(6)-ен-2-ил)этил]фосфоновой кислоты;
[2-(8,9-диоксо-2,6-диазабицикло[5.2.0]нон-1(7)-ен-2-ил)этил]фосфоновой кислоты;
[2-(4-гидрокси-8,9-диоксо-2,6-диазабицикло[5.2.0]нон-1(7)-ен-2-ил)этил]фосфоновой кислоты;
8,9-диоксо-2,6-диазабицикло[5.2.0]нон-1(7)-ен-2-уксусной кислоты;
2-[(1Н-тетразол-5-ил)метил]-2,6-диазабицикло[5.2.0]нон-1(7)-ен-8,9-диона;
[2-(9,10-диоксо-2,7-диазабицикло[6.2.0]дец-1(8)-ен-2-ил)этил]фосфоновой кислоты
или его фармацевтически приемлемая соль.
27. Композиция по п.21 или 22, где снижающий боль агент включает по меньшей мере один опиоидный аналгетик.
28. Фармацевтическая композиция для лечения боли, включающая:
а) эффективное для лечения боли количество, по меньшей мере приблизительно 150 мг/день для пероральной дозы, по меньшей мере одного соединения формулы
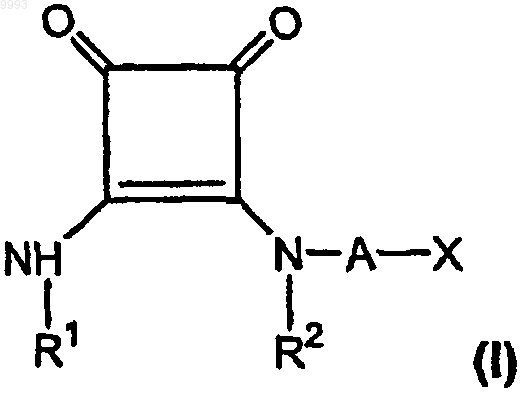
где R1 и R2, взятые вместе как Z, представляют собой -CH2CH2-, -CH2C(R6)(R7)CH2- или
-CH2C(R8)(R9)-C(R10)(R11)CH2-, где R6, R8 и R10 представляют собой, независимо, водород, алкил, содержащий 1-6 атомов углерода, или гидроксил и R7, R9 и R11 представляют собой, независимо, водород или алкил, содержащий 1-6 атомов углерода;
A представляет собой алкилен, содержащий 1-6 атомов углерода, или алкенилен, содержащий 2-6 атомов углерода;
X представляет собой CO2R3, P(O)(OR4)(OR5), 3,5-диоксо-1,2,4-оксадиазолидин-2-ил или
5-тетразолил, где R3, R4 и R5 представляют собой, независимо, водород или алкил, содержащий 1-6 атомов углерода;
или его фармацевтически приемлемую соль;
b) по меньшей мере один фармацевтический носитель.
29. Фармацевтическая композиция для лечения боли, включающая:
а) эффективное для лечения боли количество, по меньшей мере приблизительно 3 мг/день для внутривенной дозы, по меньшей мере одного соединения формулы
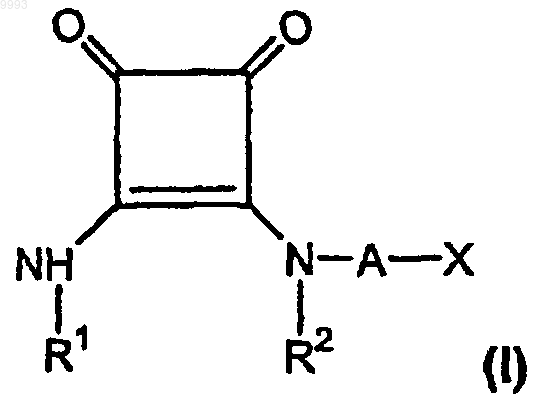
где R1 и R2, взятые вместе как Z, представляют собой -CH2CH2-, -CH2C(R6)(R7)CH2- или
-CH2C(R8)(R9)-C(R10)(R11)CH2-, где R6, R8 и R10 представляют собой, независимо, водород, алкил, содержащий 1-6 атомов углерода, или гидроксил и R7, R9 и R11 представляют собой, независимо, водород или алкил, содержащий 1-6 атомов углерода;
A представляет собой алкилен, содержащий 1-6 атомов углерода, или алкенилен, содержащий 2-6 атомов углерода;
X представляет собой CO2R3, P(O)(OR4)(OR5), 3,5-диоксо-1,2,4-оксадиазолидин-2-ил или
5-тетразолил, где R3, R4 и R5 представляют собой, независимо, водород или алкил, содержащий 1-6 атомов углерода;
или его фармацевтически приемлемую соль;
b) по меньшей мере один фармацевтический носитель.
30. Композиция по п.28, в которой эффективное для лечения боли количество по меньшей мере одного соединения формулы (I) составляет приблизительно от 150 до 900 мг/день для пероральной дозы.
31. Композиция по п.29, в которой эффективное для лечения боли количество по меньшей мере одного соединения формулы (I) составляет приблизительно от 3 до 50 мг/день для внутривенной дозы.
32. Композиция по п.28 или 29, в которой соединение формулы (I) имеет формулу
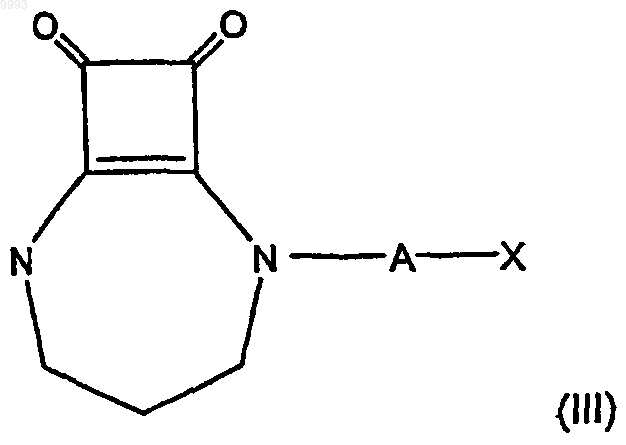
где A и X имеют значения, указанные в п. 28 или 29.
33. Композиция по п.32, дополнительно включающая по меньшей мере один ослабляющий боль агент.
34. Композиция по п.33, где ослабляющий боль агент включает опиоидный аналгетик.
35. Композиция по п.28 или 29, где соединением формулы (I) является по меньшей мере одно из следующих соединений:
[2-(7,8-диоксо-2,5-диазабицикло[4.2.0]окт-1(6)-ен-2-ил)этил]фосфоновой кислоты;
[2-(8,9-диоксо-2,6-диазабицикло[5.2.0]нон-1(7)-ен-2-ил)этил]фосфоновой кислоты;
[2-(4-гидрокси-8,9-диоксо-2,6-диазабицикло[5.2.0]нон-1(7)-ен-2-ил)этил]фосфоновой кислоты;
8,9-диоксо-2,6-диазабицикло[5.2.0]нон-1(7)-ен-2-уксусной кислоты;
2-[(1Н-тетразол-5-ил)метил]-2,6-диазабицикло[5.2.0]нон-1(7)-ен-8,9-диона;
[2-(9,10-диоксо-2,7-диазабицикло[6.2.0]дец-1(8)-ен-2-ил)этил]фосфоновой кислоты
или его фармацевтически приемлемая соль.
36. Фармацевтичесъря композиция для лечения боли в стандартной лекарственной форме, включающая эффективное для лечения боли количество, по меньшей мере приблизительно 150 мг/день для пероральной дозы, по меньшей мере одного соединения формулы
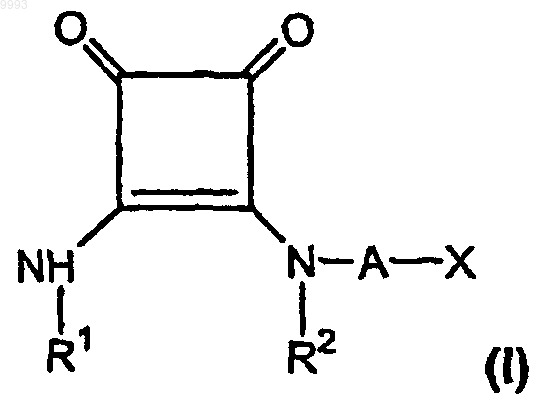
где R1 и R2, взятые вместе как Z, представляют собой -CH2CH2-, -CH2C(R6)(R7)CH2- или
-CH2C(R8)(R9)-C(R10)(R11)CH2-, где R6, R8 и R10 представляют собой, независимо, водород, алкил, содержащий 1-6 атомов углерода, или гидроксил и R7, R9 и R11 представляют собой, независимо, водород или алкил, содержащий 1-6 атомов углерода;
A представляет собой алкилен, содержащий 1-6 атомов углерода, или алкенилен, содержащий 2-6 атомов углерода;
X представляет собой CO2R3, P(O)(OR4)(OR5), 3,5-диоксо-1,2,4-оксадиазолидин-2-ил или
5-тетразолил, где R3, R4 и R5 представляют собой, независимо, водород или алкил, содержащий 1-6 атомов углерода; или его фармацевтически приемлемой соли.
37. Фармацевтическая композиция для лечения боли в стандартной лекарственной форме, включающая эффективное для лечения боли количество, по меньшей мере приблизительно 3 мг/день для внутривенной дозы, по меньшей мере одного соединения формулы
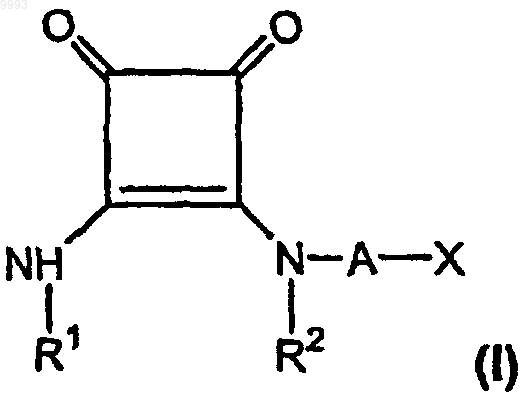
где R1 и R2, взятые вместе как Z, представляют собой -CH2CH2-, -CH2C(R6)(R7)CH2- или
-CH2C(R8)(R9)-C(R10)(R11)CH2-, где R6, R8 и R10 представляют собой, независимо, водород, алкил, содержащий 1-6 атомов углерода, или гидроксил и R7, R9 и R11 представляют собой, независимо, водород или алкил, содержащий 1-6 атомов углерода;
A представляет собой алкилен, содержащий 1-6 атомов углерода, или алкенилен, содержащий 2-6 атомов углерода;
X представляет собой CO2R3, P(O)(OR4)(OR5), 3,5-диоксо-1,2,4-оксадиазолидин-2-ил или
5-тетразолил, где R3, R4 и R5 представляют собой, независимо, водород или алкил, содержащий 1-6 атомов углерода;
или его фармацевтически приемлемую соль.
38. Композиция по п.36, в которой эффективное для лечения боли количество одного соединения формулы (I) составляет приблизительно от 150 до 900 мг/день для пероральной дозы.
39. Композиция по п.37, в которой эффективное для лечения боли количество одного соединения формулы (I) составляет приблизительно от 3 до 50 мг/день для внутривенной дозы.
40. Композиция по п.36 или 37, в которой соединение формулы (I) имеет формулу
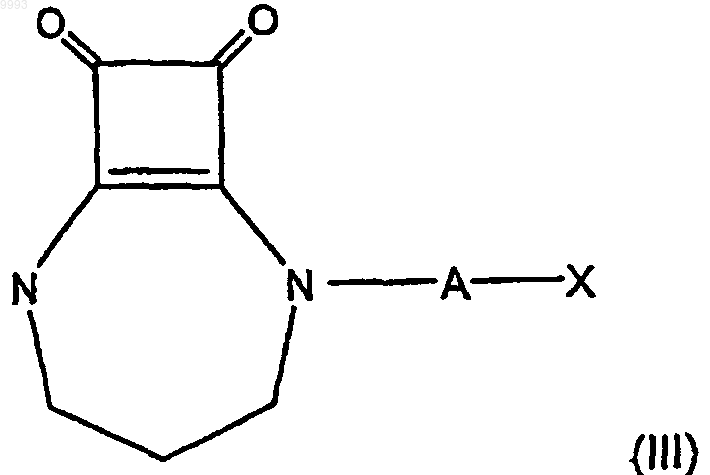
где A и X имеют значения, определенные в п.36 или 37.
41. Композиция по п.36 или 37, в которой соединением формулы (I) является по меньшей мере одно из следующих соединений:
[2-(7,8-диоксо-2,5-диазабицикло[4.2.0]окт-1(6)-ен-2-ил)этил]фосфоновой кислоты;
[2-(8,9-диоксо-2,6-диазабицикло[5.2.0]нон-1(7)-ен-2-ил)этил]фосфоновой кислоты;
[2-(4-гидрокси-8,9-диоксо-2,6-диазабицикло[5.2.0]нон-1(7)-ен-2-ил)этил]фосфоновой кислоты;
8,9-диоксо-2,6-диазабицикло[5.2.0]нон-1(7)-ен-2-уксусной кислоты;
2-[(1Н-тетразол-5-ил)метил]-2,6-диазабицикло[5.2.0]нон-1(7)-ен-8,9-диона или
[2-(9,10-диоксо-2,7-диазабицикло[6.2.0]дец-1(8)-ен-2-ил)этил]фосфоновой кислоты
или его фармацевтически приемлемая соль.
42. Композиция по п.36 или 37, которая находится в форме таблетки или капсулы.
43. Терапевтическая упаковка для дозирования млекопитающему, которое нужно лечить от боли, включающая:
а) одну или более стандартных доз по меньшей мере одного соединения формулы (I), содержащих эффективное для лечения боли количество, по меньшей мере приблизительно 150 мг/день для пероральной дозы, одного соединения формулы
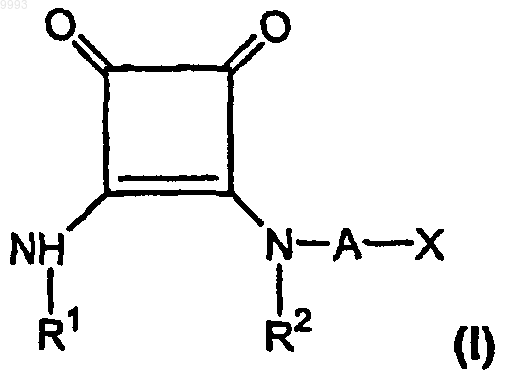
где R1 и R2, взятые вместе как Z, представляют собой -CH2CH2-, -CH2C(R6)(R7)CH2- или
-CH2C(R8)(R9)-C(R10)(R11)CH2-, где R6, R8 и R10 представляют собой, независимо, водород, алкил, содержащий 1-6 атомов углерода, или гидроксил и R7, R9 и R11 представляют собой, независимо, водород или алкил, содержащий 1-6 атомов углерода;
A представляет собой алкилен, содержащий 1-6 атомов углерода, или алкенилен, содержащий 2-6 атомов углерода;
X представляет собой CO2R3, P(O)(OR4)(OR5), 3,5-диоксо-1,2,4-оксадиазолидин-2-ил или
5-тетразолил, где R3, R4 и R5 представляют собой, независимо, водород или алкил, содержащий 1-6 атомов углерода;
или его фармацевтически приемлемую соль;
b) контейнер, включающий одну или более стандартных доз и этикетку, указывающую на использование упаковки для лечения боли у млекопитающего.
44. Терапевтическая упаковка для дозирования млекопитающему, которое нужно лечить от боли, включающая:
а) одну или более стандартных доз по меньшей мере одного соединения формулы (I), содержащих эффективное для лечения боли количество по меньшей мере приблизительно 3 мг/день для внутривенной дозы, по меньшей мере одного соединения формулы
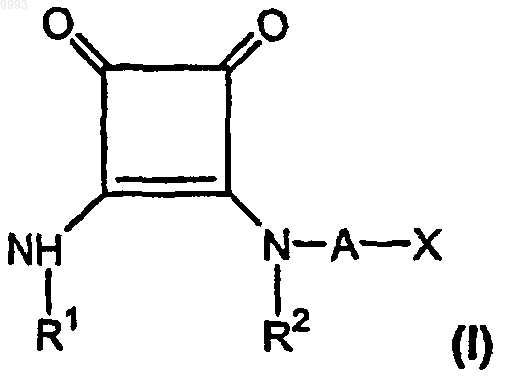
где R1 и R2, взятые вместе как Z, представляют собой -CH2CH2-, -CH2C(R6)(R7)CH2- или
-CH2C(R8)(R9)-C(R10)(R11)CH2-, где R6, R8 и R10 представляют собой, независимо, водород, алкил, содержащий 1-6 атомов углерода, или гидроксил и R7, R9 и R11 представляют собой, независимо, водород или алкил, содержащий 1-6 атомов углерода;
A представляет собой алкилен, содержащий 1-6 атомов углерода, или алкенилен, содержащий 2-6 атомов углерода;
X представляет собой CO2R3, P(O)(OR4)(OR5), 3,5-диоксо-1,2,4-оксадиазолидин-2-ил или
5-тетразолил, где R3, R4 и R5 представляют собой, независимо, водород или алкил, содержащий 1-6 атомов углерода;
или его фармацевтически приемлемую соль;
b) контейнер, включающий одну или более стандартных доз и этикетку, указывающую на использование упаковки для лечения боли у млекопитающего.
45. Упаковка по п.43, в которой эффективное для лечения боли количество по меньшей мере одного соединения формулы (I) составляет приблизительно от 150 до 900 мг/день для пероральной дозы.
46. Упаковка по п.44, в которой эффективное для лечения боли количество по меньшей мере одного соединения формулы (I) составляет приблизительно от 3 до 50 мг/день для внутривенной дозы.
47. Упаковка по п.43 или 44, где соединение формулы (I) имеет формулу
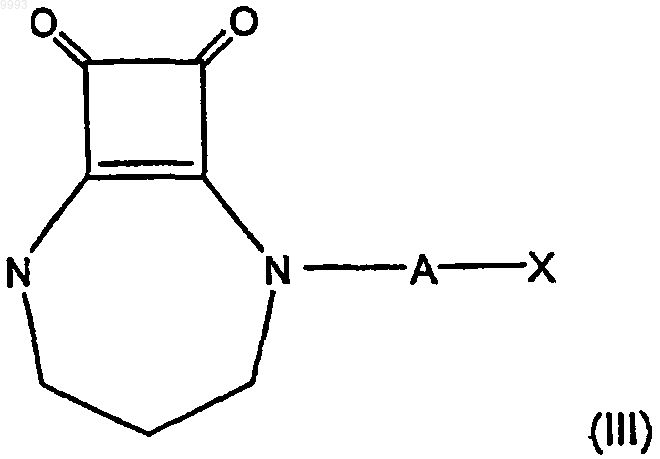
где A и X имеют значения, указанные в п.43 или 44.
48. Упаковка по п.43 или 44, где соединением формулы (I) является по меньшей мере одно из следующих соединений:
[2-(7,8-диоксо-2,5-диазабицикло[4.2.0]окт-1(6)-ен-2-ил)этил]фосфоновой кислоты;
[2-(8,9-диоксо-2,6-диазабицикло[5.2.0]нон-1(7)-ен-2-ил)этил]фосфоновой кислоты;
[2-(4-гидрокси-8,9-диоксо-2,6-диазабицикло[5.2.0]нон-1(7)-ен-2-ил)этил]фосфоновой кислоты;
8,9-диоксо-2,6-диазабицикло[5.2.0]нон-1(7)-ен-2-уксусной кислоты;
2-[(1Н-тетразол-5-ил)метил]-2,6-диазабицикло[5.2.0]нон-1(7)-ен-8,9-диона или
[2-(9,10-диоксо-2,7-диазабицикло[6.2.0]дец-1(8)-ен-2-ил)этил]фосфоновой кислоты
или его фармацевтически приемлемая соль.
49. Применение соединения, имеющего формулу
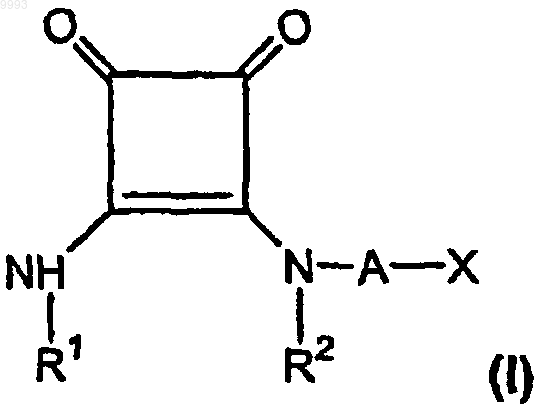
где R1 представляет собой водород, алкил, содержащий 1-6 атомов углерода, или фенилалкил, содержащий 7-12 атомов углерода;
R2 представляет собой водород, алкил, содержащий 1-6 атомов углерода, алкенил, содержащий 2-6 атомов углерода, или фенилалкил, содержащий 7-12 атомов углерода, или
R1 и R2, взятые вместе как Z, представляют собой -CH2CH2-, -CH2C(R6)(R7)CH2- или
-CH2C(R8)(R9)-C(R10)(R11)CH2-, где R6, R8 и R10 представляют собой, независимо, водород, алкил, содержащий 1-6 атомов углерода, или гидроксил и R7, R9 и R11 представляют собой, независимо, водород или алкил, содержащий 1-6 атомов углерода;
A представляет собой алкилен, содержащий 1-6 атомов углерода, или алкенилен, содержащий 2-6 атомов углерода;
X представляет собой CO2R3, P(O)(OR4)(OR5), 3,5-диоксо-1,2,4-оксадиазолидин-2-ил или
5-тетразолил, где R3, R4 и R5 представляют собой, независимо, водород или алкил, содержащий 1-6 атомов углерода;
или его фармацевтически приемлемой соли для изготовления лекарственного средства для лечения боли у млекопитающего.
50. Применение по п.49, где
R1 представляет собой водород, метил, этил или бензил;
R2 представляет собой водород, метил, этил, аллил, металлил или бензил
или R1 и R2, взятые вместе как Z, представляют собой -CH2CH2-, -CH2C(R6)(R7)CH2- или
-CH2C(R8)(R9)-C(R10)(R11)CH2-;
A представляет собой алкилен с неразветвленной или разветвленной цепью, выбранный из -CH2-,
-CH2CH2-, -CH(CH3)CH2-, -CH2CH(CH3)-, -(CH2)3- или -(CH2)4-;
X выбран из карбоксила, фосфонила или 5-тетразолила.
51. Применение по п.49 или 50, где
R1 и R2, взятые вместе как Z, представляют собой -CH2CH2-, -CH2C(R6)(R7)CH2- или
-CH2C(R8)(R9)-C(R10)(R11)CH2-;
A представляет собой алкилен с неразветвленной или разветвленной цепью, выбранный из -CH2-,
-CH2CH2-, -CH(CH3)CH2-, -CH2CH(CH3)-, -(CH2)3- или -(CH2)4-;
X выбран из карбоксила, фосфонила или 5-тетразолила.
52. Применение по любому одному из пп.49-51, где соединением формулы (I) является по меньшей мере одно из следующих соединений:
N-(2-амино-3,4-диоксо-1-циклобутен-1-ил)-бета-аланина;
2-[2-[(2-амино-3,4-диоксо-1-циклобутен-1-ил)амино]этил]-1,2,4-оксадиазолидин-3,5-диона;
N-(2-амино-3,4-диоксо-1-циклобутен-1-ил)-N-(2-пропенил)глицина;
[2-[(2-амино-3,4-диоксо-1-циклобутен-1-ил)амино]этил]фосфоновой кислоты;
[(E)-4-[(2-амино-3,4-диоксо-1-циклобутен-1-ил)амино]-2-бутенил]фосфоновой кислоты;
[2-[(2-амино-3,4-диоксо-1-циклобутен-1-ил)метиламино]этил]фосфоновой кислоты;
[2-(7,8-диоксо-2,5-диазабицикло[4.2.0]окт-1(6)-ен-2-ил)этил]фосфоновой кислоты;
[2-(8,9-диоксо-2,6-диазабицикло[5.2.0]нон-1(7)-ен-2-ил)этил]фосфоновой кислоты;
[2-(4-гидрокси-8,9-диоксо-2,6-диазабицикло[5.2.0]нон-1(7)-ен-2-ил)этил]фосфоновой кислоты;
8,9-диоксо-2,6-диазабицикло[5.2.0]нон-1(7)-ен-2-уксусной кислоты;
2-[(1Н-тетразол-5-ил)метил]-2,6-диазабицикло[5.2.0]нон-1(7)-ен-8,9-диона,
[2-(9,10-диоксо-2,7-диазабицикло[6.2.0]дец-1(8)-ен-2-ил)этил]фосфоновой кислоты
или его фармацевтически приемлемая соль.
Текст
009993 Боль охарактеризована и описана в литературе с различных сторон. Например, боль может быть интенсивной, локализованной, острой, или жгучей и/или ноющей, тупой, диффузной или ожоговой по природе. Боль может быть также централизованной, имеющей место в дорсальном отростке спинного мозга,стволе мозга и головном мозге, или периферической, проявляющейся у места повреждения и окружающей ткани. Боль, которая имеет место в течение продолжительных периодов времени (т.е. устойчивая боль), обычно называют хронической. Примеры хронической боли включают невропатическую, воспалительную и раковую боли. Эти боли могут быть отнесены к гипералгезии и/или аллодинии, где гипералгезия относится к повышению чувствительности к обычно повреждающему стимулу и аллодиния относится к повышению чувствительности к обычно неповреждающему стимулу. Тип хронической боли, который в настоящее время нуждается в адекватном фармакологическом лечении, является невропатической болью. Невропатическую боль обычно считают хронической болью,вызванной повреждением или патологическими изменениями в периферической или центральной нервной системе. Примеры патологических изменений, относящихся к невропатической боли, включают пролонгированную периферическую или центральную неврональную сенсибилизацию, центральную сенсибилизацию, связанную с повреждением ингибирующих и/или возбуждающих функций нервной системы и аномальными взаимосвязями между парасимпатической и симпатической нервными системами. Широкий диапазон клинических состояний может быть связан с невропатической болью или может служить основой для невропатической боли, включающий, например, диабет, посттравматическую боль после ампутации, боль нижней части спины, рак, химическое повреждение или токсины, другие основные хирургические операции, периферическое нервное повреждение вследствие сдавливания при травматическом повреждении, недостаточность питания или инфекции, такие как опоясывающий герпес или ВИЧ. Имеются различные типы агентов, используемых в настоящее время для лечения боли, такие как,например ненаркотические аналгетики, такие как аспирин, ацетаминофен или ибупрофен; нестероидные противовоспалительные лекарственные средства (NSAID), наркотические аналгетики, такие как морфин, гидроморфон, фентанил, кодеин или меперидин; стероиды, такие как преднизон или дексаметазон; трициклические антидепрессанты, такие как амитриптилин, дезипрамин или имипрамин; противоэпилептические средства, такие как габапентин, карбамазепин, топирамат, натрий валпроат или фенитоин,или комбинации этих различных агентов. Однако указанные агенты обычно являются неудовлетворительными для лечения боли хронической природы и могут иметь вредные побочные действия, такие как сонливость, головокружение, сухость во рту, увеличение массы тела, снижение памяти и/или ортостатическая гипотензия. Совсем недавно интересным было использование ингибиторов рецепторов N-метил-D-аспартата(NMDA) для лечения боли (в дальнейшем называемые антагонистами NMDA-рецепторов). Было показано, что рецепторы NMDA принимают участие в широком диапазоне процессов, включающих гибель нейронов после ишемии, синаптическую пластичность, связанную с формированием памяти, и центральную сенсибилизацию во время персистентной боли. Считается, что глутамат, который регулирует рецепторы NMDA, играет ключевую роль при боли, и особенно хронической боли. Рецепторы NMDA локализованы на всем протяжении центральной нервной системы. РецепторыNMDA являются лиганд-открываемыми катионными каналами, которые модулируют проток ионов натрия, калия и кальция, когда их активируют глутаматом в сочетании с глицином. Считается, что структурно рецептор NMDA состоит из гетеромультимерных каналов, содержащих две основные субъединицы, названные NR1 и NR2. Эти две субъединицы содержат связывающий глицин сайт, связывающий глутамат сайт и связывающий полиамин сайт. Для субъединицы NR1 были идентифицированы множественные сплайсинговые варианты, тогда как для субъединицы NR2 были идентифицированы четыре типа отдельных субъединиц (NR2A, NR2B, NR2C и NR2D). NMDA-рецептор содержит также сайт связыванияMg, локализованный внутри поры ионофора комплекса рецептор NMDA/канал, который блокирует поток ионов. Оказывается, что фенциклидин (PCP), а также другие соединения связываются с этим сайтом Mg. Для того чтобы был открыт проход PCP к рецептору PCP, сначала должен открыться канал глутаматом и глицином (т.е. зависимость использования). Для взаимодействия с указанными сайтами NMDA-рецептора были разработаны различные антагонисты NMDA. Например, антагонисты глутаматного сайта NMDA-рецептора относятся к тем антагонистам, которые взаимодействуют с сайтом связывания глутамата NR2-субъединицы. Примеры антагонистов глутаматного сайта NMDA-рецептора, которые были показаны на преклинических моделях для подавления боли, включаютAP5 (D-2-амино-5-фосфонопентановую кислоту). См., например, Karlsten and Gordh, Drugs and Aging 11: 398-412, 1997. Были идентифицированы другие антагонисты NMDA-рецептора, которые взаимодействуют у глицинового сайта, нечувствитель-1 009993 ного к стрихнину (глицин), такие как L701324 (7-хлор-4-гидрокси-3-(3-фенокси)фенил-2(1H)хинолин), и у полиаминового сайта, такие как ифенпродил. Неконкурентные антагонисты, блокирующиеBennett, J. Pain Symptom Management 19: S2, 2000; Sang, J. Pain Symp. Manag. 19 (1): S21, 2000. Антагонисты NMDA-рецептора использовали в клинических условиях для лечения боли. Например, кетамин использовали для лечения послегерпетической невралгии, фантомной боли, боли после нервного повреждения, послеоперационной боли и ожоговой боли. Кроме того, например, декстрометорфан использовали для лечения боли при диабетической невропатии и послеоперационной боли и амантадин использовали для лечения боли у раковых пациентов. Клиническая пригодность указанных антагонистов NMDA-рецепторов была ограничена вредными побочными эффектами, такими как головная боль, нарушение моторной функции, такой как атаксия,седативный эффект и/или психотомиметические эффекты, такие как головокружение, галлюцинации,дисфория или нарушение познавательной способности при аналгезирующих дозах. См., например,Нао et al., Pain 66: 279-285, 1996; Chaplan et al., J. Pharmacol. Exper. Ther. 280: 829-838, 1997; Suzuki et al.,Pain 91: 101-109, 2000; Bennett, J. Pain Symptom Management 19: S2, 2000; Sang, J. Pain Symp. Manag. 19(1): S21, 2000. Сообщалось, например, что высокоаффинный блокатор NMDA-рецепторного канала кетамин, который иногда используют для лечения боли, относящейся к ожоговой, обладает описанными вредными, побочными действиями, которые ограничивают его использование для лечения пациентов(Pal et al. Burns, 23: 404-412, 1997). Кроме того, разработка дизоцилпина (MK-801) как антагониста, блокирующего NMDA-рецепторный канал, была прекращена вследствие психотомиметических эффектов,подобных эффектам, вызываемым фенциклидином (т.е. PCP). Предполагалось, что блокаторы каналов с более низкой аффинностью, такие как декстрометорфан, амантадин и мемантин, могут иметь более низкие вредные, побочные действия, чем блокаторы с высокой аффинностью (Rogawski, Trennds Pharmacol.Sci. 14: 325, 1998). В поддержку этой точки зрения говорит тот факт, что декстрометорфан оказывал аналгезирующее действие на пациентов, страдающих диабетической невропатией, с меньшими вредными, побочными действиями, чем кетамин (Sang, J. Pain Symp. Manag. 19 (1): S21, 2000). Аналогично этому амантадин ослаблял хирургическую невропатическую боль у раковых больных с меньшими побочными действиями (Hewitt, Clin. J. Pain 16: 573, 2000). Однако даже в случае имеющих более низкую аффинность неконкурентных антагонистов, блокирующих NMDA-рецепторный канал, подобно неконкурентным антагонистам с более высокой аффинностью, имелись нежелательные психотомиметические эффекты, которые препятствовали разработке. Например, на преклинических моделях блокаторы NMDA-рецепторного канала различных аффинностей стойко вызывают эффекты PCP-подобного дискриминативного стимула у крыс, обучаемых различению(дискриминации) между физиологическим раствором и PCP. Мемантин, кетамин и дизоцилпин - все заменяют эффекты PCP-подобного дискриминативного стимула у крыс (Nicholson et al., Behav. Pharmacol. 9(3): 231-243, 1998; Mori et al., Behav. Brain Res. 119: 33-40, 2001). Кроме того, подобно PCP мемантин поддерживает самовведение у обезьян, что позволяет предположить, что он может иметь потенциал злоупотребления у людей (Nicholson et al., Behav. Pharmacol. 9(3): 231-243, 1998). Использование зависимых блокаторов NMDA-рецепторных каналов может также повысить частоту сердечных сокращений и кровяное давление, которые могут дополнительно ограничить их клиническое использование. Хотя глутаматные антагонисты NMDA-рецептора не имеют степени психотомиметических побочных действий у человека или PCP-подобных эффектов дискриминативного стимула у животных (не у человека) (см., например, Baron and Woods, Psychopharmacol. 118(1): 42-51, 1995; Mori et al., Behav. BrainPharmacol. 159(2): 133-139, 1989), было показано, что они имеют многочисленные побочные действия. Например, было показано, что глутаматный антагонист NMDA, CGS-19755, вызывает временное, обратимое индуцирование вакуолей в некоторых слоях поясных и ретросплениальных корковых веществ мышей и крыс при поведенчески эффективных дозах (т.е. отношение эффективность/вакуолизация равно 1). См., например, Herring et al., Excitatory Amino Acids Clinical Results with Antagonists, publishedby Academic Press, Ch. 1, 1997. Хотя функциональные значения вакуолизации являются неясными, предшествующие исследования позволяют предположить, что образование вакуолей коррелирует с психотомиметическими эффектами, вызываемыми антагонистами NMDA-рецепторов (см., например, Olney et al.,Science, 244: 1630-1632, 1989; Olney et al., Science, 245: 1515-1518, 1991), и может привести к ограниченной гибели нервных клеток, как в случае дизоцилпина (Fix et al., Exp. Neurol. 123: 204-215, 1993). Таким образом, было бы желательно найти альтернативные соединения, эффективные при лечении боли. Эти соединения, предпочтительно, должны иметь пониженные неблагоприятные побочные действия и/или быть более эффективными при лечении боли. В патенте США 5168103 на имя Kinney et al. (в дальнейшем обозначаемый Kinney) описаны некоторые производные 2-(амино-3,4-диоксо-1-циклобутен-1-ил)амино]алкил]кислоты,полезные в качестве нейрозащитных и противосудорожных агентов. Указанные производные-2 009993 2-(амино-3,4-диоксо-1-циклобутен-1-ил)амино]алкил]кислоты описаны как конкурентные антагонистыNMDA, полезные для лечения некоторых нарушений центральной нервной системы, таких как судороги,повреждение клеток головного мозга и связанные с ними нейродегенеративные заболевания. Побочные действия одного из соединений, описанных в патенте Kinney, [2-(8,9-диоксо-2,6 диазабицикло[5.2.0]нон-1(7)-ен-2-ил)этил]фосфоновой кислоты, были предварительно определены на здоровых волонтерах в исследовании фазы I, проведенном в Европе. Данное исследование было проведено в связи с разработкой применения данного соединения для лечения у пациентов ишемии, связанной с ударом (Bradford et al., Stroke and Cerebral Circulation abstract, 1998). Авторы настоящего изобретения обнаружили, что производные циклобутена в патенте Kinney являются эффективными при лечении боли на различных доклинических моделях боли. Например, авторы настоящего изобретения обнаружили, что указанные производные циклобутена могут ослаблять боль при состояниях, когда испытанные здесь антагонисты NMDA-рецепторов не могут сделать это. Кроме того, указанные производные циклобутена не имеют степени вредных, побочных эффектов, проявляемой известными антагонистами NMDA-рецептора в дозах, необходимых для ослабления боли. Например, авторы настоящего изобретения, как описано более подробно в дальнейшем, обнаружили, что соединения, описанные Kinney, такие как [2-(8,9-диоксо-2,6-диазабицикло[5.2.0]нон-1(7)-ен-2 ил)этил]фосфоновая кислота, не вызывают атаксию или седативный эффект по сравнению с другими описанными конкурентными глутаматными антагонистами (CGS-19755), конкурентными полиаминовыми антагонистами (ифенпродил) и вызывающими зависимость блокаторами каналов (MK-801, мемантин,дизоцилипин, кетамин) в дозах, необходимых для ослабления боли в преклинических моделях. Кроме того, как указано ранее, обнаружено, что некоторые антагонисты NMDA-рецепторов, такие какCGS-19755, обнаруживали временное, обратимое индуцирование вакуолей в некоторых слоях поясных и ретросплениальных корковых веществ мышей и крыс. В противоположность CGS-19755,который вызывает вакуолизацию в поведенчески эффективных дозах, производные циклобутена,такие как[2-(8,9-диоксо-2,6-диазабицикло[5.2.0]нон-1(7)-ен-2-ил)этил]фосфоновая кислота,имеют отношение эффективность/вакуолизация вплоть до 16. Кроме того, в отличие от ранее указанных антагонистов, блокирующих NMDA-рецепторный канал, производные циклобутена, такие как[2-(8,9-диоксо-2,6-диазабицикло[5.2.0]нон-1(7)-ен-2-ил)этил]фосфоновая кислота, не заменяют PCP у крыс, что позволяет предположить, что это соединение не связано с PCP-подобными психотомиметическими эффектами или не создает PCP-подобное предрасположение к злоупотреблению. Кроме того,[2-(8,9-диоксо-2,6-диазабицикло[5.2.0]нон-1(7)-ен-2-ил)этил]фосфоновая кислота лишена многихPCP-подобных эффектов вплоть до доз, которые в 4-10 раз выше, чем дозы, эффективные для ишемической модели. Краткое изложение сущности изобретения Настоящее изобретение относится к способу лечения боли у млекопитающего, который включает введение млекопитающему, нуждающемуся в таком лечении, эффективного для лечения количества по меньшей мере одного соединения, имеющего формулуX представляет собой CO2R3, P(O)(OR4)(OR5), 3,5-диоксо-1,2,4-оксадиазолидин-2-ил или 5-тетразолил, где R3, R4 и R5 представляют собой, независимо, водород или алкил, содержащий 1-6 атомов углерода; или его фармацевтически приемлемой соли. Настоящее изобретение относится также к фармацевтической композиции, которая содержит эффективное для лечения боли количество, по меньшей мере приблизительно 150 мг/день для пероральной дозы или 3 мг/день для внутривенной дозы, соединения формулы (I) или его фармацевтически приемлемой соли, где R1 и R2, взятые вместе, представляют собой Z и остальные символы имеют значения, указанные выше; и по меньшей мере один фармацевтически приемлемый носитель. В предпочтительном-3 009993 варианте осуществления такая композиция содержит также фармацевтически эффективное количество по меньшей мере одного ослабляющего боль агента. Предложена также фармацевтическая композиция,которая содержит эффективное для лечения боли количество соединения формулы (I), по меньшей мере приблизительно 150 мг/день для пероральной дозы или по меньшей мере приблизительно 3 мг/день для внутривенной дозы, или его фармацевтически приемлемой соли и фармацевтически эффективного количества по меньшей мере одного ослабляющего боль агента. Настоящее изобретение относится также к фармацевтической композиции в стандартной лекарственной форме и терапевтической упаковке, содержащей эффективное для лечения боли количество, по меньшей мере приблизительно 150 мг/день для пероральной дозы или по меньшей мере приблизительно 3 мг/день для внутривенной дозы, соединения формулы (I) в стандартной лекарственной форме для лечения боли у млекопитающего. Подробное описание изобретения Соединения, полезные в настоящем изобретении для лечения боли, включают производные циклобутена формулы где R1 представляет собой водород, алкил, содержащий 1-6 атомов углерода или фенилалкил, содержащий 7-12 атомов углерода,R2 представляет собой водород, алкил, содержащий 1-6 атомов углерода, алкенил, содержащий 2-6 атомов углерода, или фенилалкил, содержащий 7-12 атомов углерода, илиX представляет собой CO2R3, P(O)(OR4)(OR5), 3,5-диоксо-1,2,4-оксадиазолидин-2-ил или 5-тетразолил, где R3, R4 и R5 представляют собой, независимо, водород или алкил, содержащий 1-6 атомов углерода; или его фармацевтически приемлемую соль. Примерами алкила для R1-11 и алкилена для A являются неразветвленные или разветвленные группы, такие как метил, этил, пропил (например, н-пропил, изопропил), бутил (например, н-бутил, изобутил), пентил (например, н-пентил, изопентил) или гексил. Предпочтительные алкильные группы настоящего изобретения имеют 1-4 атома углерода. Примерами алкенила для R2 и алкенилена для A являются неразветвленные или разветвленные моно-, ди- или полиненасыщенные группы, такие как винил,проп-1-енил, аллил, металлил, бут-1-енил, бут-2-енил или бут-3-енил. Примерами фенилалкильных групп для R1 и R2 являются такие группы, у которых алкильная часть является неразветвленной или разветвленной углеродной цепью, имеющей 1-6 атомов углерода, такие как бензил, фенилэтил, 3-фенилпропил или 4-фенилбутил. Предпочтительными значениями для R1 являются водород, метил, этил или бензил. Предпочтительными значениями для R2 являются водород, метил, этил, аллил, металлил или бензил. Другими предпочтительными значениями являются, когда R1 и R2, взятые вместе, образуют радикал где Z представляет собой -CH2CH2-, -CH2C(R6)(R7)CH2- или -CH2C(R8)(R9)-C(R10)(R11)CH2-, предпочтительно, -CH2C(R6)(R7)CH2-, где R6, R8 и R10 представляют собой, независимо, водород, алкил, содержащий 1-6 атомов углерода, или гидроксил и R7, R9 и R11 представляют собой, независимо, водород или алкил, содержащий 1-6 атомов углерода. Предпочтительно, R6-R11 представляют собой водород. Что касается A, предпочтительными примерами алкиленовых групп являются группы с неразветвленной или разветвленной цепью, имеющие 1-4 атома углерода, такие как -CH2-, -CH2CH2-,-CH(CH3)CH2-, -CH2CH(CH3)-, -(CH2)3- или -(CH2)4-. Предпочтительными примерами алкениленовых групп для A являются цис- и транс-группы, предпочтительно, имеющие 2-4 атома углерода, такие как -CH2-CH=CH-, -CH=C(CH3)-, C(CH3)=CH-,-4 009993-CH=CH-CH2-, -CH2-CH=CH-CH2- или -CH2-CH=C(CH3)-. Предпочтительно, A представляет собой алкилен, содержащий 1-4 атома углерода или транс-2-бутилен. Предпочтительные заместители для X представляют собой карбоксил, фосфонил или 5-тетразолил. В наиболее предпочтительном варианте осуществления настоящего изобретения соединения, полезные в настоящем изобретении, имеют формулу где A и X имеют значения, указанные выше. Соединения, полезные в настоящем изобретении, включают также фармацевтически приемлемые соли соединений формулы (I). Термин фармацевтически приемлемая соль означает любое соединение, образованное реакцией присоединения фармацевтически приемлемого основания или кислоты и соединения формулы (I) с образованием соответствующей соли. Термин фармацевтически приемлемый означает вещество, которое является приемлемым для фармацевтического применения без токсикологической перспективы и не взаимодействует неблагоприятным образом с активным ингредиентом. Фармацевтически приемлемыми солями являются предпочтительно соли щелочных металлов(натрия, калия, лития) или щелочно-земельных металлов (кальция, магния) соединений формулы (I) или соли соединений формулы (I) с фармацевтически приемлемыми катионами, образованными из аммиака или основного амина. Примеры последнего катиона включают, но не ограничиваются перечисленным, аммоний, моно-, ди- или триметиламмоний, моно-, ди- или триэтиламмоний, моно-, ди- или трипропиламмоний(изои нормальный),этилдиметиламмоний,бензилдиметиламмоний,циклогексиламмоний, бензиламмоний, дибензиламмоний, пиперидиний, морфолиний, пирролидиний,пиперазиний,1-метилпиперидиний,1-изопропилпирролидиний,1,4-диметилпиперазиний,1-н-бутилпиперидиний,2-метилпиперидиний,1-этил-2-метилпиперидиний,моно-,диили триэтаноламмоний, трис-(гидроксиметил)метиламмоний или фенилмоноэтаноламмоний. Соединения, описанные здесь, могут быть получены способами, описанными в патенте США 5168103 (Kinney et al.), выданном 1 декабря 1992 г., полное содержание которого включено в описание в качестве ссылки. Соединения данного изобретения могут также быть получены способами, описанными в патентах США 5240946 (Kinney et al.), 5990307 (Asselin et al.) или 6011168 (Asselin et al.), содержание этих патентов также полностью включено в качестве ссылки. Предпочтительные соединения, полезные в настоящем изобретении, включают следующие соединения или их фармацевтически приемлемые соли:[2-(9,10-диоксо-2,7-диазабицикло[6.2.0]дец-1(8)-ен-2-ил)этил]фосфоновую кислоту. В более предпочтительном варианте осуществления настоящего изобретения соединением,используемым для лечения боли, является [2-(8,9-диоксо-2,6-диазабицикло[5.2.0]нон-1(7)-ен-2 ил)этил]фосфоновая кислота, имеющая формулу или ее фармацевтически приемлемая соль.-5 009993 Не претендуя никоим образом на связь с теорией, считают, что производные циклобутена настоящего изобретения имеют уникальную аффинность и селективность для некоторых сайтов связывания наNMDA-рецепторе. Считается, что уникальная аффинность и селективность обеспечивают эффективное лечение боли при более низких дозах и/или вызывают меньше побочных действий в дозах, необходимых для ослабления боли. Производные циклобутена, описанные здесь, являются полезными для лечения боли у млекопитающих в соответствии со способами настоящего изобретения. Термин лечение, используемый здесь,означает частичное или полное облегчение, подавление, уменьшение интенсивности и/или ослабление боли. Например, термин лечение, используемый здесь, включает частичное или полное облегчение,подавление или ослабление боли в течение некоторого периода времени. Лечение включает также полностью уменьшение интенсивности боли. Соединения, полезные в настоящем изобретении, являются пригодными для лечения целого ряда различных типов болей, испытываемых млекопитающими, такими как человек. Соединения настоящего изобретения являются эффективными, например, при лечении острой боли (кратковременной) или хронической боли (регулярно появляющейся или стойкой). Эта боль может быть централизованной или периферической. Примеры боли, которая может быть острой или хронической и которую можно лечить в соответствии со способами настоящего изобретения, включают воспалительную боль, скелетно-мышечную боль,костную боль, пояснично-спинную боль, боль шеи или верхней части спины, висцеральную боль, соматическую боль, невропатическую боль, раковую боль, боль, вызванную повреждением или хирургической операцией, такую как ожоговая боль, или головные боли, такие как мигрени или головные боли вследствие большого напряжения или комбинации этих болей. Специалисту в данной области должно быть понятно, что указанные боли могут перекрывать друг друга. Например, боль, вызванная воспалением, может быть также висцелярной или скелетно-мышечной по природе. В предпочтительном варианте осуществления настоящего изобретения соединения, полезные в настоящем изобретении, вводят млекопитающим для лечения хронической боли, такой как невропатическая боль, связанная, например, с повреждением или патологическими изменениями в периферической или центральной нервной системе; раковая боль; висцелярная боль, связанная, например, с брюшинной,тазовой и/или перинеальной областями или панкреатитом; скелетно-мышечная боль, связанная, например, с нижней или верхней частью спины, позвоночником, фибромиалгией, височно-верхнечелюстным суставом или синдромом миофасциальной боли; костная боль, связанная, например, с дегенеративными заболеваниями костей и суставов, таких как остеоартрит, ревматоидный артрит или спинальный стеноз; головные боли, такие как мигрень или головные боли, связанные с большим напряжением, или боль, связанная с инфекциями, такими как ВИЧ, серповидноклеточной анемией, аутоиммунными нарушениями,рассеянным склерозом или воспалением, таким как остеоартрит или ревматоидный артрит. В предпочтительном варианте осуществления соединения, полезные в данном изобретении, используют для лечения хронической боли, которая является невропатической, висцеральной, скелетномышечной, костной, головной, раковой или воспалительной болью или их комбинацией, в соответствии с описанными здесь способами. Воспалительная боль может быть связана с целым рядом медицинских состояний, таких как остеоартрит, ревматоидный артрит, хирургическая операция или повреждение. Невропатическая боль может быть связана, например, с диабетической невропатией, периферической невропатией, послегерпетической невралгией, невралгией тройничного нерва, поясничными или цервикальными радикулопатиями,фибромиалгией, языкоглоточной невралгией, рефлекторной симпатической дистрофией, казуалгией, таламическим синдромом, авульсией нервных корешков или нервным нарушением, вызванным повреждением, приводящим к периферической и/или центральной сенсибилизации, такой как фантомная боль,рефлекторная симпатическая дистрофия или боль после торактомии, раком, химическим повреждением,токсинами, недостаточностью питания или вирусными или бактериальными инфекциями, такими как опоясывающий лишай или ВИЧ, или их комбинациями. Способы использования соединений данного изобретения также включают способы лечения, в которых невропатическая боль является состоянием,вторичным к метастатической инфильтрации, болезненному ожирению, ожогам или центральным болезненным состояниям, относящимся к таламическим состояниям. Как указано ранее, способы настоящего изобретения могут быть использованы для лечения боли,которая является соматической и/или висцелярной по природе. Например, соматическая боль, которую можно лечить в соответствии со способами настоящего изобретения, включает боли, связанные с повреждением структурной или мягкой ткани, образованным во время хирургической операции, зубными процедурами, ожогами или травматическими повреждениями тела. Примеры висцелярной боли, которую можно лечить в соответствии со способами настоящего изобретения, включают такие типы боли, связанные с заболеванием внутренних органов или являющиеся результатом заболеваний внутренних органов,таких как неспецифический язвенный колит, синдром раздраженной толстой кишки, раздраженный мочевой пузырь, болезнь Крона, ревматологическая (артралгия), опухоли, гастрит, панкреатит, инфекционные заболевания органов или нарушения желчных путей или их комбинации. Специалист в данной об-6 009993 ласти должен также знать, что боль, которую лечат в соответствии со способами настоящего изобретения, может также относиться к состояниям гипералгезии, аллодинии или обоим. Кроме того, хроническая боль может быть с периферической или центральной сенсибилизацией или без нее. Соединения, полезные в данном изобретении, можно также использовать для лечения острых и/или хронических болей, связанных с состоянием женщин, которые могут также называться болью специфической для женщин. Такие группы боли включают боли, которые встречаются только у женщин или преимущественно у женщин, включая боль, связанную с менструацией, овуляцией, беременностью или родами, выкидышем, внематочной беременностью, ретроградной менструацией, разрывом фолликулярной кисты или кисты corpus luteum, раздражением тазовых внутренних органов, фибромами матки, аденомиозом, эндометриозом, инфекцией и воспалением, ишемией тазовых органов, обструкцией, внутрибрюшинными спайками, анатомической деформацией тазовых внутренних органов, абсцессом яичников,потерей тазового упора, опухолями, тазовой гиперемией, или упоминаемыми болями, вызванными негинекологическими причинами. Производные циклобутена, полезные в настоящем изобретении, могут быть введены различными путями, в том числе, например, пероральным, внутримышечным, внутрибрюшинным, эпидуральным,подоболочечным, внутривенным, подкожным, введением внутрь слизистой оболочки, таким как сублингвальный или интраназальный путь или трансдермальным путем. В предпочтительном варианте осуществления настоящего изобретения соединения, полезные в настоящем изобретении, вводят перорально, внутримышечно или внутрь слизистой оболочки. Соединения, полезные в настоящем изобретении, вводят в эффективном для лечения боли количестве млекопитающему, нуждающемуся в лечении боли. Используемый термин "эффективное для лечения боли количество" означает, по меньшей мере, минимальное количество производного циклобутена или его формы фармацевтически приемлемой соли, которое лечит рассматриваемую боль. Для определения требуемого для лечения эффективного количества соединения, которое нужно ввести при лечении боли, врач может, например, оценить действия данного производного циклобутена на пациенте инкрементальным приращением дозы, такой как пероральная доза, предпочтительно приблизительно от 3 до приблизительно 1000 мг/кг до достижения нужного уровня симптоматического ослабления боли. Для достижения нужного результата схема непрерывного приема лекарственного средства затем может быть модифицирована, причем диапазон для пероральной дозы составляет предпочтительно приблизительно от 150 до приблизительно 900 мг/день. Аналогичные способы могут быть приняты для определения эффективного диапазона доз для других путей введения, таких как внутривенные и внутримышечные пути, на основании данных биологической доступности. Например, установлено, что внутривенные дозы должны предпочтительно составлять от приблизительно 3 до приблизительно 50 мг/день. Хотя производные циклопентена могут быть введены в соответствии со способами настоящего изобретения в качестве единственного активного ингредиента для лечения боли, авторами настоящего изобретения установлено, что производные циклобутена могут быть также введены с одним или несколькими другими агентами, ослабляющими боль. Термин "ослабляющие боль агенты" означает любой агент,который непосредственным или косвенным образом лечит болевые симптомы. Примеры агентов, ослабляющих боль непрямым образом, включают, например, противовоспалительные агенты, такие как антиревматоидные агенты. Один или несколько других, ослабляющих боль агентов, могут быть введены одновременно (например, индивидуально в одно и то же время или вместе в фармацевтической композиции) и/или последовательно с одним или несколькими производными циклобутена, полезными в настоящем изобретении. Предпочтительно производные циклобутена и один или несколько ослабляющих боль агентов предпочтительно вводят таким образом, чтобы оба присутствовали в организме млекопитающего в течение определенного периода времени для лечения боли. Способ введения другого ослабляющего боль агента может быть таким же или отличается от пути введения, используемого для производного циклобутена. Например, другой ослабляющий боль агент может быть введен пероральным, внутримышечным, внутрибрюшинным, эпидуральным, подоболочечным, внутривенным, через слизистую оболочку, например интраназальным или сублингвальным способом, подкожным или чрескожным способом. Предпочтительный путь введения будет зависеть от конкретного выбранного агента для ослабления боли, и рекомендованный путь(и) его введения известен(ы) специалисту в данной области. Например, опиоиды предпочтительно вводят пероральными, внутривенными или внутримышечными путями. Специалист в данной области должен знать, что доза другого, ослабляющего боль агента, вводимого млекопитающему, будет зависеть от конкретного ослабляющего боль агента и требуемого пути введения. В соответствии с этим другой ослабляющий боль агент может быть дозирован и введен в соответствии с практикой, известной специалисту в данной области, такой как практика, описанная в ссылках,таких как Physicians' Desk Reference, 55 Edition, 2001, published by Medical Economics Co., Inc., Montvale, NJ. Примеры ослабляющих боль агентов, которые могут быть введены с производными циклобутена,полезными в настоящем изобретении, включают аналгетики, такие как ненаркотические или наркотические аналгетики;-7 009993 противовоспалительные агенты, такие как нестероидные противовоспалительные агенты (NSAID),стероиды или антиревматические агенты; препараты против мигрени, такие как бета-адренергические блокирующие агенты, производные спорыньи или изометептен; трициклические антидепрессанты, такие как амитриптилин, дезипрамин или имипрамин; антиэпилептические агенты, такие как габапентин, карбамазепин, топирамат, натрий вальпроат или фенитоин; 2-агонисты или селективные ингибиторы повторного поглощения серотонина/селективные ингибиторы повторного поглощения норэпинефрина или их комбинации. Специалист в данной области должен знать, что описанные ниже некоторые агенты действуют, ослабляя множественные состояния, такие как боль и воспаление, тогда как другие агенты могут ослабить только один симптом, такой как боль. Специфическим примером агента, имеющего множественные свойства, является аспирин, который представляет собой противовоспалительное средство, когда его дают в высоких дозах, но при более низких дозах он является только аналгетиком. Ослабляющий боль агент может включать любую комбинацию вышеуказанных агентов, например ослабляющим боль агентом может быть ненаркотический аналгетик в комбинации с наркотическим аналгетиком. Ненаркотические аналгетики, полезные в настоящем изобретении, включают, например,салицилаты, такие как аспирин, ибупрофен (MOTRIN, ADVIL), кетопрофен (ORUDIS), напроксен(NAPROSYN), ацетаминофен, индометацин или их комбинации. Примеры наркотических агалгезирующих агентов, которые могут быть использованы в сочетании с производными циклобутена,включают опиоидные аналгетики, такие как фентенил, суфентанил, морфин, гидроморфон, кодеин,оксикодон, бупренорфин или их фармацевтически приемлемые соли или их комбинации. Примеры противовоспалительных агентов, которые могут быть использованы в комбинации с производными циклобутена, включают, но не ограничиваются перечисленным, аспирин; ибупрофен; кетопрофен; напроксен; этодолак (LODINE), ингибиторы COX-2, такие как целекоксиб (CELEBREX), рофекоксиб(MK-663),деракоксиб,2-(4-этоксифенил)-3-(4-метансульфонилфенил)пиразоло[1,5-b]пиридазин,4-(2-оксо-3-фенил-2,3 дигидрооксазол-4-ил)бензолсульфонамид,дарбуфелон,флозулид,4-(4-циклогексил-2-метил-5 оксазолил)-2-фторбензолсульфонамид, мелоксикам, нимезулид, 1-метилсульфонил-4-(1,1-диметил-4-(4 фторфенил)циклопента-2,4-диен-3-ил)бензол,4-(1,5-дигидро-6-фтор-7-метокси-3-(трифторметил)-(2)бензотиопирано(4,3-c)пиразол-1-ил)бензолсульфонамид, 4,4-(диметил-2-фенил-3-(4-метилсульфонил)фенил)циклобутенон, 4-амино-N-(4-(2-фтор-5-трифторметил)тиазол-2-ил)бензолсульфонамид, 1-(7-третбутил-2,3-дигидро-3,3-диметил-5-бензофуранил)-4-циклопропилбутан-1-он или их фармацевтически приемлемые соли, сложные эфиры или сольваты; сулиндак (CLINORIL); диклофенак (VOLTAREN); пироксикам (FELDENE); дифлунизал (DOLOBID), набуметон (RELAFEN), оксапрозин(DAYPRO), индометацин (INDOCIN ); или стероиды, такие как PEDIAPED , пероральный раствор натрийфосфата преднизолона, SOLU-MEDROL, натрийсукцинат метилпреднизолона для инъекции,сироп преднизолона марки PRELONE. Следующие примеры противовоспалительных агентов, предпочтительно используемых для лечения ревматоидного артрита, включают напроксен, который является коммерчески доступным в форме таблеток с отсроченным высвобождением EC-NAPROSYN, таблеток NAPROSYN, ANAPROX и ANAPROX DS и суспензии NAPROSYN от Roche Labs, таблетки целекоксиба CELEBREX,рофекоксиб VIOXX, бетаметазон CELESTONE, капсулы пеницилламина CUPRAMINE, титруемые таблетки пеницилламина DEPEN, инъецируемая суспензия ацетата метилпреднизолонаDEPO-MEDROL, таблетки лефлуномида ARAVA, таблетки с отсроченным высвобождением сулфазалазина AZULFIDINE EN-tabs, капсулы пироксикама FELDENE, таблетки диклофенака калияCATAFLAM, таблетки с отсроченным высвобождением диклофенака натрия VOLTAREN, таблетки длительного высвобождения диклофенака натрия VOLTAREN-XR или этанрецептные продуктыENBREL. Примеры других агентов, используемых для лечения воспалений, особенно, ревматоидного артрита,включают иммуносупрессанты, такие как капсулы циклоспорина GENGRAF, капсулы или пероральные растворы циклоспорина NEORAL или таблетки или внутривенные инъекции азатиоприна IMURAN, капсулы, пероральные суспензии или суппозитории индометацина INDOCIN, сульфат гидроксихлорохина PLAQUENIL или рекомбинант инфликсимаба для внутривенной инъекцииREMICADE, или соединения золота, такие как ауранофин или тиомалат золота и натрия для инъекцииMYOCHRISYINE. Производные циклобутена, полезные в настоящем изобретении, могут быть также введены с одним или несколькими другими фармацевтически активными агентами, такими как агенты, используемые для лечения любого другого медицинского состояния млекопитающего, которое связано или не связано с болью, испытываемой млекопитающим. Примеры таких фармацевтических активных агентов включают-8 009993 противоангиогенные, противоопухолевые, антидиабетические, противоинфекционные или желудочнокишечные агенты или их комбинации. Более полный список фармацевтически активных агентов, в том числе ослабляющих боль, можно найти в Physician's Desk Reference, 55 Edition, 2001, published by Medical Economics Co., Inc., Montvale,NJ. Каждый из этих агентов может быть введен в соответствии с фармацевтически эффективными дозами и режимами введения, известными в данной области, такими как дозы и режимы, описанные для продуктов в Physician's Desk Reference, 55 Edition, 2001, published by Medical Economics Co., Inc., Montvale, NJ. В предпочтительном варианте осуществления настоящего изобретения по меньшей мере одно производное циклобутена вводят по меньшей мере с одним опиоидным аналгетиком в соответствии с ранее описанными способами. Неожиданно было обнаружено, что производные циклобутена, полезные в настоящем изобретении, при введении по меньшей мере с одним опиоидным аналгетиком, таким как морфин, имеют такие полезные действия, как синергически пониженное восприятие боли, повышенную продолжительность ослабления боли и/или пониженные отрицательные побочные действия до более высокой степени, чем другие сравнимые антагонисты NMDA. Производные циклобутена, полезные в настоящем изобретении, могут быть также введены неразбавленными (т.е. такими, как они есть) или в составе фармацевтической композиции. Фармацевтические композиции, полезные в настоящем изобретении, могут быть в любой форме,известной специалисту в данной области, например в жидкой или твердой. Фармацевтические композиции, в дополнение к содержащим эффективное для лечения боли количество одного или более производных циклобутена настоящего изобретения, могут включать один или более ингредиентов, известных специалисту в данной области и применяемых для изготовления фармацевтических композиций. Такие ингредиенты включают, например, носители (например, в твердой или жидкой форме), корригенты, смазывающие вещества, солюбилизаторы, суспендирующие агенты, наполнители, агенты, придающие композиции скольжение, вспомогательные средства для прессования, связующие, агенты, дезинтегрирующие таблетки, инкапсулирующие материалы, эмульгаторы, буферы, консерванты, подслащивающие вещества, загущающие агенты, красящие агенты, регуляторы вязкости, стабилизаторы или осморегуляторы или их комбинации. Твердые фармацевтические композиции предпочтительно содержат один или более твердых носителей и, необязательно, одну или более других добавок, таких как корригенты, смазывающие вещества,солюбилизаторы, суспендирующие агенты, наполнители, агенты, придающие композиции скольжение,вспомогательные средства для прессования, связующие или дезинтегрирующие таблетки агенты или инкапсулирующий материал. Подходящие твердые носители включают, например, фосфат кальция, стеарат магния, тальк, сахара, лактозу, декстрин, крахмал, желатин, целлюлозу, метилцеллюлозу, натриевую соль карбоксиметилцеллюлозы, поливинилпирролидин, низкоплавкие воски или ионообменные смолы или их комбинации. В порошкообразных фармацевтических композициях носитель представляет собой предпочтительно тонкоизмельченное твердое вещество, которое находится в смеси с тонкоизмельченным активным ингредиентом. В таблетках активный ингредиент смешивают с носителем, имеющим необходимые свойства прессования, в подходящих пропорциях и, необязательно, другими добавками и прессуют для получения требуемой формы и размера. Твердые фармацевтические композиции, такие как порошки и таблетки, предпочтительно содержат вплоть до 99% активного ингредиента. Жидкие фармацевтические композиции предпочтительно содержат одно или несколько производных циклобутена и один или несколько жидких носителей для образования растворов, суспензий, эмульсий, сиропов, эликсиров или композиций, находящихся под давлением. Фармацевтически приемлемые жидкие носители включают, например, воду, органический растворитель, фармацевтически приемлемые масла или жир или их комбинации. Жидкий носитель может содержать другие подходящие фармацевтические добавки, такие как солюбилизаторы, эмульгаторы, буферы, консерванты, подслащивающие вещества, корригенты, суспендирующие агенты, загущающие агенты, красители, регуляторы вязкости, стабилизаторы или осморегуляторы или их комбинации. Примеры жидких носителей, подходящих для перорального или парентерального введения, включают воду (предпочтительно, содержащую добавки, такие как производные целлюлозы, например, натриевая соль карбоксиметилцеллюлозы),спирты или их производные (включая одноатомные спирты или многоатомные спирты, такие как гликоли) или масла (например, фракционированное кокосовое масло или арахисовое масло). Для парентерального введения носителем может быть также масляный сложный эфир, такой как этилолеат и изопропилмиристат. Жидким носителем для находящихся под давлением композиций могут быть галогенированные углеводороды или другой фармацевтически приемлемый пропеллент. Жидкие фармацевтические композиции, которые являются стерильными растворами или суспензиями, могут быть введены парентерально, например, внутримышечной, внутрибрюшинной, эпидуральной, подоболочечной, внутривенной или подкожной инъекцией. Фармацевтические композиции для перорального введения или введения через слизистую оболочку могут быть в форме жидкой либо твердой композиции.-9 009993 В предпочтительном варианте осуществления настоящего изобретения фармацевтическая композиция помимо содержания производного циклобутена может содержать также фармацевтически эффективное количество одного или более ослабляющих боль агентов, как ранее описано, и/или фармацевтически эффективное количество одного или более фармацевтически активных агентов, как описано выше. Таким образом, настоящее изобретение предлагает также фармацевтическую композицию для лечения боли, содержащую эффективное для лечения боли количество по меньшей мере одного производного циклобутена, полезного в настоящем изобретении, и фармацевтически эффективное количество по меньшей мере одного ослабляющего боль агента, как ранее описано. В более предпочтительном варианте осуществления ослабляющий боль агент включает опиодный аналгетик. Предпочтительная фармацевтическая композиция находится в виде стандартной лекарственной формы, такой как таблетки или капсулы. В такой форме композицию разделяют на поддозы в стандартной дозе, содержащей подходящие количества активного ингредиента. Стандартные лекарственные формы могут быть упакованными композициями, например упакованными порошками, флаконами, ампулами, предварительно наполненными шприцами или саше, содержащими жидкости. Стандартная лекарственная форма может быть, например, капсулой или таблеткой или может быть подходящим числом любых таких композиций в упакованной форме. Таким образом, настоящее изобретение предлагает также фармацевтическую композицию в виде стандартной лекарственной формы для лечения боли у млекопитающего, которая содержит эффективную для лечения боли стандартную дозу по меньшей мере одного производного циклобутена настоящего изобретения. Как известно специалисту в данной области, предпочтительная эффективная стандартная доза для лечения боли будет зависеть, например, от способа введения. Например, стандартная доза для перорального введения предпочтительно составляет приблизительно от 75 до приблизительно 300 мг и более предпочтительно приблизительно от 100 до приблизительно 300 мг производного циклобутена,полезного в настоящем изобретении. Настоящее изобретение предлагает также терапевтическую упаковку для дозированного введения производного циклобутена млекопитающему, которого лечат по поводу боли. Терапевтическая упаковка,предпочтительно, содержит одну или несколько стандартных доз производного циклобутена и контейнер, содержащий одну или несколько стандартных доз и этикетку, направленную на использование упаковки для лечения боли у млекопитающего. В предпочтительном варианте осуществления стандартная доза имеет форму таблетки или капсулы. В предпочтительном варианте осуществления каждая стандартная доза является эффективным для лечения боли количеством. Примеры Производные циклобутена, полезные в настоящем изобретении, оценивали на их эффективность для лечения боли. Для сравнения испытывали также антагонисты рецепторов NMDA, известные как ослабляющие боль. Используемые способы испытания были использованы другими специалистами в данной области для оценки эффективности соединений для ослабления боли. См., например, Bennett G.J. and Xie T.K.,A peripheral mononeuropathy in rat produces disorders of pain sensation like those seen in man, Pain 33: 87-107, 1988; Chaplan S.R., Bach R.W., Pogrel J.W., Chung J.M. and Yaksh T.L., Quantitative assessment oftactile allodynia in the rat paw, J. Neurosci. Methods 53: 55-63, 1994 and Mosconi T. and Kruger L., Fixeddiameter polyethylene cuffs applied to the rat sciatic nerve induce a painful neuropathy: ultrastructural morphometric analysis of axonal alterations Pain 64: 37-57, 1996. Субъекты. Помещенные в индивидуальные камеры крысы Spraque-Dawley имели свободный доступ к корму и воде. Фактически поддерживали дневной цикл 12 ч света/12 ч темноты (световая часть с 6:00 утра до 6:00 вечера). Условия выдерживания животных и исследования проводили в соответствии с инструкциями, предложенными National Institutes of Health Committee on Laboratory Animal Resources. Этих субъектов использовали в приведенных ниже испытаниях. Испытываемые соединения. Производные циклобутена, испытанные в примерах:B. 2-[(1 Н-тетразол-5-ил)метил]-2,6-диазабицикло[5.2.0]нон-1(7)-ен-8,9-дион (соединение B). Соединения A и B получены в соответствии со способом синтеза, описанным в патенте США 5990307 Asselin и патенте США 5168103 Kinney et al. соответственно. Производные циклобутена настоящего изобретения сравнивали с одним или несколькими антагонистами NMDA известными средствами для лечения боли мемантином, полученным от RBI (Natick, MA); дизоцилипином, полученным от RBI (Natick, MA); кетамином, полученным от Fort Dodge (Fort Dodge, IO); ифепродилом, полученным от Sigma (St. Louis, MO);NMDA-рецепторных каналов, тогда как мемантин является умеренноаффинным, вызывающим зависимость блокатором NMDA-рецепторных каналов. CGS-19755 является конкурентным антагонистомNMDA, и ифенпродил является конкурентным антагонистом полиамина. Способ испытания 1. Индуцированная простагландином E2 термическая гиперчувствительность. Концевую часть хвоста 10 см помещали в сосуд-термос, содержащий воду, нагретую до 38, 42, 46,50, 54 или 58C. Латентный период (в секундах) для животного до удаления хвоста из воды использовали в качестве меры ноцицепции. Если животное не удаляло хвост на протяжении 20 с, экспериментатор удалял хвост и регистрировал максимальный латентный период 20 с. После измерения термической чувствительности базовой линии термическую гиперчувствительность вызывали инъекцией 50 мкл 0,1 мг простагландина E2 (PGE2) в концевую 1 см часть хвоста. Кривые зависимости температура-эффект создавали до (базовая линия) и после (15, 30, 60, 90 и 120 мин) инъекции PGE2. Предыдущие исследования на других видах животных (например, обезьянах; Brandt etal., J. Pharmacol. Exper. Ther. 296:939, 2001) и результаты настоящего исследования показывают, чтоPGE2 вызывает доза- и времязависимую термическую гиперчувствительность, которая является максимальной через 15 мин после инъекции и проходит через 2 ч. Исследование с использованием одного соединения. Способность лекарственных средств реверсировать PGE2-индуцированную термическую гиперчувствительность оценивали с использованием процедуры введения одной дозы на время курса. Во время процедуры одну дозу испытываемого соединения вводили внутрибрюшинно (IP), перорально (PO) или интраназально (IN) за 30 мин до инъекции PGE2. Тактильную чувствительность оценивали через 30 мин после инъекции PGE2. Исследование с применением комбинации соединений. Проводили комбинационные исследования с антагонистами NMDA-рецепторов вместе с мю-опиоидным агонистом морфином. Минимально эффективную дозу морфина (5,6 мг/кг) вводили отдельно или в комбинации с неэффективными дозами антагонистов NMDA-рецепторов в анализе отдергивания хвоста в нагретой воде. Соединения вводили IP в то же время за 30 мин до испытания. Комбинационное исследование с антагонистами NMDA-рецепторов вместе с -опиоидным агонистом морфином проводили также в анализе PGE2-индуцированной термической гиперчувствительности. Дозу морфина (5,6 мг/кг), которая полностью реверсировала термическую гиперчувствительность (т.е. происходило возвращение к базовой линии), вводили отдельно и в комбинации с дозами антагонистовNMDA-рецепторов в термическом анализе PGE2-индуцированного отдергивания хвоста в нагретой воде. Соединения вводили IP в то же самое время, что и PGE2, за 30 мин до проведения испытания. Анализ данных испытания по способу 1. Температуру, которая вызывала полумаксимальное повышение латентного периода отдергивания хвоста (т.е. Т 10), вычисляли из каждой кривой зависимости температура-эффект. T10 определяли интерполяцией из линии, проходящей между точкой выше и точкой ниже 10 с на кривой зависимости температура-эффект. Для этих исследований термическую гиперчувствительность определяли как смещение в левую часть на кривой зависимости температура-эффект и снижение в величине Т 10. Возвращение термической гиперчувствительности определяли как возвращение к базовой линии кривой зависимости температура-эффект и величине Т 10 и вычисляли по следующему уравнению: в котором T10 лекарственное средство+PGE2 представляет собой T10 после введения лекарственного средства в комбинации с PGE2;T10PGE2 представляет собой T10 после введения только PGE2;T10 базовая линия представляет собой Т 10 в контрольных условиях. Величина MPE 100% указывает на полное возвращение к базовой термической чувствительности,наблюдаемой без инъекции PGE2. Величина выше 100% указывает на то, что испытуемое соединение снижало термическую чувствительность более чем к базовой термической чувствительности без инъекции PGE2. Способ испытания 2. Хроническое повреждение сдавливанием. Крыс анестезировали 3,5% галотана в O2 при подаче 1 л/мин и выдерживали при 1,5% галотана в O2 во время хирургической операции. Модифицированное хроническое сдавливающее повреждение седалищного нерва (Mosconi and Kruger, 1996; Bennet and Xie, 1988) достигали рассечением кожи и отслаиванием через бедренную двуглавую мышцу для обнажения седалищного нерва. Трубчатую манжетку (длина 2 мм) из полиэтилена PE 90 (Intramedic, Clay Adams; Becton Dickinson Co.) помещали вокруг седалищного нерва на уровне середины бедра. Рану закрывали по слоям с использованием шелкового шовного материала 4-0 и зажимов для ран. Испытание проводили через 6-10 дней после хирургической операции. Животных помещали в приподнятые клетки из проволоки и позволяли им акклиматизироваться к условиям комнаты для испытания в течение 45-60 мин. Базовую тактильную чувствительность оценива- 11009993 ли с использованием ряда калиброванных монофиламентов von Frey (Stoelting; Wood Dale, IL) за 0-3 дня перед операцией. Монофиламенты von Frey наносили на середину подошвы задней лапы в последовательном восходящем или нисходящем порядке, как это требовалось, чтобы быть как можно ближе к порогу реакции. О пороге судили по наименьшему усилию, когда индуцировали резкую реакцию отдергивания на стимулы. Таким образом, реакция отдергивания приводила к предоставлению следующего, более легкого стимула, и отсутствие реакции отдергивания приводило к предоставлению следующего, более сильного стимула. Крыс с базовыми порогами силы 10 г исключали из этого исследования. Спустя приблизительно одну неделю после CCI-хирургии тактильную чувствительность повторно оценивали и животных, которые обнаруживали двигательную недостаточность (т.е. волочение лапы) или неспособность проявлять последующую тактильную гиперчувствительность (порог 10 г), исключали из последующего испытания. В условиях предоставления кумулятивных доз соединение вводили IP каждые 30 мин с кумулятивной дозой, увеличивающейся в приращенияхlog единиц. Тактильную гиперчувствительность оценивали спустя 20-30 мин после каждого введения лекарственного средства. Анализ данных способа испытания 2. Рассчитывали 50% пороговые величины (в граммах силы), оцениваемые с использованием непараметрического критерия Диксона (Chaplan et al., 1994) и в качестве максимальной силы использовали силу 15 г. Кривые доза-эффект строили для каждого экспериментального условия для каждой крысы. Индивидуальные величины пороговой тактильной гиперчувствительности усредняли для получения среднего значения (1 SEM (CKO. Обращение тактильной гиперчувствительности определяли как возврат к базовой тактильной чувствительности и рассчитывали по следующему уравнению: где 50%лекарственное средство+CCI представляет собой 50% величину после введения соединения в животных спустя приблизительно одну неделю после CCI-хирургии; 50%CCI представляет собой 50% величину перед CCI-хирургией. Максимальный эффект 100% обращения представляет возврат к средней предоперационной величине порога для субъектов в данном экспериментальном условии. Способ испытания 3. Реакция, регулируемая схемой предоставления стимула (раздражителя). Крыс обучали с использованием процедуры с множественными циклами во время экспериментальных сеансов, проводимых 5 дней каждую неделю. Каждый цикл обучения состоял из 10-минутного периода предобработки с последующим 10-минутным периодом ответной реакции. Во время периода предобработки световые стимулы не обеспечивались, и ответная реакция не имела последствий, вызываемых схемой предоставления стимула. Во время периода ответной реакции включали левый или правый световые раздражители (уравновешенным образом среди субъектов), удлиняли рычаг управления реакции, и субъекты могли реагировать при фиксированной схеме с предоставлением корма с коэффициентом 30. Сеансы обучения состояли из 3 последовательных циклов. Сеансы испытания были идентичными сеансам обучения, за исключением того, что в начале первого цикла вводили единственную дозу лекарственного средства. Анализ данных. Оперативные скорости реакции индивидуальных животных усредняли для трех циклов во время сеансов испытания и преобразовывали в % от контрольных скоростей реакции с использованием средней скорости из предыдущего дня обучения в качестве контрольного значения (т.е. среднего значения трех циклов). Результаты представляли в виде средней (1 SEM) скорости реакции как % от контроля. Таким образом, например, тест-величина 100% указывала бы на то, что скорость реакции после введения испытуемого соединения была такой же, как и скорость контрольной реакции, и не было вредного, побочного действия испытуемого соединения. Результаты. Способ испытания 1. Базовая термическая ноцицепция и PGE2-индуцированная термическая гиперчувствительность. В условиях базовой линии максимальные латентные периоды отдергивания хвоста (т.е. 20 с) обычно получали при температурах 38, 42 и 46C. Когда температуру воды повышали до 50C, латентные периоды отдергивания хвоста для индивидуальных крыс были обычно между 5 и 15 с. Самая высокая температура 54C давала латентный период отдергивания хвоста меньше 10 с у всех крыс. Средние величины T10 базовой линии (отдергивание через 10 с) были между 49 и 51C. Доза 0,1 мг PGE2 вызывала доза- и времязависимую термическую гиперчувствительность, проявляющуюся как сдвиг в левую сторону кривой температура-эффект и снижение в величине Т 10. Максимальные снижения в латентных периодах отдергивания хвоста имело место через 15 мин после введения и латентные периоды возвращались к базовой линии через 120 мин после инъекции. Нижеприведенная табл. 1 показывает влияния PGE2 в сочетании со сравнительными соединениямиантагонистами NMDA вплоть до доз, которые вызывают наблюдаемые сигналы седативного состояния и атаксии (т.е. соединение примера 1 - 10 мг/кг, соединение примера 2 - 100 мг/кг, соединение- 12009993 примера 3 - 0,3 мг/кг, соединение примеров 4-6 - 30 мг/кг), ни одно из сравнительных соединений,включая мемантин (соединения примеров 1 и 2), дизоцилпин (соединение примера 3), кетамин (соединение примера 4), ифенфродил (соединение примера 5) или CGS-19755 (соединение примера 6), не вызывало более чем 25% обращение PGE2-индуцированной термической гиперчувствительности. По сравнению с ними [2-(8,9-диоксо-2,6-диазабицикло[5.2.0]нон-1(7)-ен-2-ил)этил]фосфоновая кислота, производное циклобутена, полезное в настоящем изобретении (соединение A), вызывает 79% обратимость послеIP введения в дозе 10 мг/кг и 87% обратимость при PO введении в дозе 100 мг/кг. Эти дозы (вплоть до 178 мг/кг) не были связаны с седативным состоянием или атаксией, как в случае сравнительных примеров. Кроме того, 1 или 3 мг соединения A, введенного интраназально (IN), вызывает 37 или 79% обратимость соответственно. Средняя доза, вычисленная от массы субъекта, представляет дозы 2,6 и 7,5 мг/кг соответственно. Аналогично этому другое производное циклобутена, полезное в настоящем изобретении, 2-[(1 Н-тетразол-5-ил)метил]-2,6-диазабицикло[5.2.0]нон-1(7)-ен-8,9-дион (соединение B), вызывало полное обращение PGE2-индуцированной термической гиперчувствительности. Эффективность производных циклобутена, полезных в настоящем изобретении, таких как соединения A и B, в ослаблении боли, такой как термическая гиперчувствительность, является удивительной и неожиданной. Например, все соединения, испытанные по способу 1 испытания, были антагонистамиNMDA-рецепторов, однако соединения A и B проявляли себя по существу и значительно лучше, чем сравнительные соединения. Особенно важно отметить, что как соединение A, так и соединение B, подобные сравнительному соединению CGS-19755, являются конкурентными глутаматными антагонистами NMDA-рецептора, но соединения A и B проявляют себя по существу и значительно лучше. Таблица 1 Результаты PGE2-индуцированной термической гиперчувствительности Представлено в столбике для аппроксимации; действительная средняя доза составляет 2,6 мг/кг; Представлено в столбике для аппроксимации; действительная средняя доза составляет 7,5 мг/кг. Производные циклобутена, полезные в настоящем изобретении, испытывали также с опиоидным аналгетиком для определения способности производного циклобутена снижать термическую чувствительность в комбинации с опиоидным аналгетиком, морфином. Минимально эффективную дозу морфина вводили отдельно или в комбинации с неэффективными дозами испытуемых соединений. В табл. 2 показаны примеры испытания на отдергивание хвоста из нагретой воды. Доза 5,6 мг/кг морфина, введеннаяIP (соединение примера 11), вызвала небольшое, однако все же значительное повышение Т 10 (51,20,7) по сравнению с Т 10 наполнителя (48,90,1). При введении IP в комбинации с 5,6 мг/кг морфина неэффективная доза 18 мг/кг кетамина (соединение примера 12) вызывала незначительное повышение Т 10 (52,80,5) по сравнению с одним морфином (соединение примера 13). В противоположность этому неэффективная доза соединения A 10 мг/кг при введении IP (пример 14) в комбинации с морфином значительно и неожиданно повышала Т 10 (55,81,3) по сравнению с одним морфином (пример 15).- 13009993 Таблица 2 Комбинационные исследования отдергивания хвоста из нагретой воды Производные циклобутена, полезные в настоящем изобретении, испытывали также с опиоидным аналгетиком для определения способности производного циклобутена снижать PGE2-индуцированную термическую гиперчувствительность в комбинации с опиоидным аналгетиком, морфином. В табл. 3 показаны примеры анализа PGE2-индуцированной термической гиперчувствительности. PGE2, инъецированный в хвост, значительно снижал Т 10 (44,80,1) по сравнению с T10 наполнителя (50,30,4; соединение примера 16). Доза 5,6 мг/кг морфина (соединение примера 17) значительно обращала Т 10 до величины,одинаковой с величиной носителя (50,60,5). При введении IP в комбинации с 5,6 мг/кг морфина неэффективная доза 18 мг/кг примера 3 (соединение примера 18) вызывала незначительное повышение Т 10 (51,70,2) по сравнению с одним морфином (соединение примера 19) . В противоположность этому эффективная доза соединения примера 6, 10 мг/кг (Т 10=48,80,2; пример 20) при введении IP в комбинации с морфином значительно и неожиданно повышает T10 (55,30,2) по сравнению с одним морфином Способ испытания 2. Хроническое сдавливающее повреждение. В табл. 4 показаны влияния производных циклобутена, полезных в настоящем изобретении,на обращение CCI-индуцированной тактильной гиперчувствительности у животных, у которых была хирургическая операция за неделю до испытания. Для сравнения испытывали также антагонистыNMDA-рецепторов, мемантин (соединение примера 22) и CGS-19755 (соединение примера 23). Вплоть до доз, которые индуцировали наблюдаемые симптомы седативного эффекта и атаксии (т.е. соединение примера 22 - 10 мг/кг, соединение примера 23 - 30 мг/кг), ни одно из сравнительных соединений не вызывало никакого обращения CCI-индуцированной тактильной гиперчувствительности. По сравнению с этим соединение A (пример 24) продуцировало 97% обращение после IP введения и соединение B(пример 25) продуцировало 40% обращение после IP введения. Дозы для соединений A и B не были связаны с седативным эффектом или атаксией, как было видно со сравнительными соединениями.- 14009993 Таблица 4 Тактильная гиперчувствительность, индуцированная хроническим сдавливающим повреждением Эффективность производных циклобутена, полезных в настоящем изобретении, таких как A и B, в ослаблении боли, такой как CCI-индуцированная тактильная гиперчувствительность, является удивительной и неожиданной. Например, соединения A и B выполняли действие в ослаблении боли значительно и по существу лучше, чем известные антагонисты NMDA-рецепторов, мемантин и CGS-19755. Результаты испытания по способу 3. Для оценки потенциальных вредных, побочных действий производных циклобутена, полезных в настоящем изобретении, соединение A вводили животным соответственно режиму предоставления кормов. Для сравнения испытывали также антагонисты NMDA-рецептора, мемантин и дизоцилпин. В табл. 5 показано, что мемантин (соединение примера 26) и дизоцилпин дозазависимым способом повышали скорость реагирования. Они были дозами, которые не обращают PGE2-индуцированную термическую гиперчувствительность или CCI-индуцированную тактильную гиперчувствительность. В противоположность этому соединение A, введенное IP (пример 28) или PO (пример 29), неожиданно не модифицировало значительно скорости реагирования в дозах, которые обращали PGE2-индуцированную термическую гиперчувствительность или CCI-индуцированную тактильную гиперчувствительность. Таблица 5 Опытное реагирование ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ лечения боли у млекопитающего, включающий введение млекопитающему, нуждающемуся в лечении боли, эффективного для лечения боли количества по меньшей мере одного соединения,имеющего формулуR1 и R2, взятые вместе как Z, являются -CH2CH2-, -CH2C(R6)(R7)CH2- илиX представляет собой CO2R3, P(O)(OR4)(OR5), 3,5-диоксо-1,2,4-оксадиазолидин-2-ил или 5-тетразолил, где R3, R4 и R5 представляют собой, независимо, водород или алкил, содержащий 1-6 атомов углерода; или его фармацевтически приемлемой соли. 2. Способ по п.1, в которомR2 представляет собой водород, метил, этил, аллил, металлил или бензил или R1 и R2, взятые вместе как Z, представляют собой -CH2CH2-, -CH2C(R6)(R7)CH2- илиA представляет собой алкилен с неразветвленной или разветвленной цепью, выбранный из -CH2-,-CH2CH2-, -CH(CH3)CH2-, -CH2CH(CH3)-, -(CH2)3- или -(CH2)4-; иX выбран из карбоксила, фосфонила или 5-тетразолила; или его фармацевтически приемлемая соль. 3. Способ по п.1, в которомR1 и R2, взятые вместе как Z, представляют собой -CH2CH2-, -CH2C(R6)(R7)CH2- илиA представляет собой алкилен с неразветвленной или разветвленной цепью, выбранный из -CH2-,-CH2CH2-, -CH(CH3)CH2-, -CH2CH(CH3)-, -(CH2)3- или -(CH2)4-;X выбран из карбоксила, фосфонила или 5-тетразолила. 4. Способ по любому одному из пп.1-3, в котором соединение формулы (I) включает по меньшей мере одно из следующих соединений:[2-[(2-амино-3,4-диоксо-1-циклобутен-1-ил)метиламино]этил]фосфоновой кислоты; или его фармацевтически приемлемую соль. 5. Способ по любому одному из пп.1-3, в котором соединение формулы (I) включает [2-(7,8-диоксо 2,5-диазабицикло[4.2.0]окт-1(6)-ен-2-ил)этил]фосфоновую кислоту или ее фармацевтически приемлемую соль. 6. Способ по любому одному из пп.1-3, в котором соединение формулы (I) включает[2-(8,9-диоксо-2,6-диазабицикло[5.2.0]нон-1(7)-ен-2-ил)этил]фосфоновую кислоту или ее фармацевтически приемлемую соль. 7. Способ по любому одному из пп.1-3, в котором соединение формулы (I) включает[2-(4-гидрокси-8,9-диоксо-2,6-диазабицикло[5.2.0]нон-1(7)-ен-2-ил)этил]фосфоновую кислоту или ее фармацевтически приемлемую соль. 8. Способ по любому одному из пп.1-3, в котором соединение формулы (I) включает 8,9-диоксо-2,6-диазабицикло[5.2.0]нон-1(7)-ен-2-уксусную кислоту или ее фармацевтически приемлемую соль. 9. Способ по любому одному из пп.1-3, в котором соединение формулы (I) включает 2-[(1 Н-тетразол-5-ил)метил]-2,6-диазабицикло[5.2.0]нон-1(7)-ен-8,9-дион или его фармацевтически приемлемую соль. 10. Способ по любому одному из пп.1-3, в котором соединение формулы (I) включает[2-(9,10-диоксо-2,7-диазабицикло[6.2.0]дец-1(8)-ен-2-ил)этил]фосфоновую кислоту или ее фармацевтически приемлемую соль. 11. Способ по любому одному из пп.1-10, в котором боль является острой болью или хронической болью. 12. Способ по п.11, где боль является воспалительной болью, скелетно-мышечной болью, костной болью, пояснично-крестцовой болью, шейной болью и болью верхней части спины, висцеральной болью,соматической болью, невропатической болью, раковой болью, болью, вызванной повреждением или хирургической операцией, или головной болью или их комбинациями. 13. Способ по п.11, в котором боль является хронической болью.- 16009993 14. Способ по п.13, в котором хроническая боль связана с аллодинией, гиперглазией или обеими. 15. Способ по п.13, где хронической болью является невропатическая боль; раковая боль; висцеральная боль; скелетно-мышечная боль; костная боль; головная боль или боль, связанная с инфекциями,серповидно-клеточной анемией, аутоиммунными нарушениями, рассеянным склерозом или воспалением или их комбинации. 16. Способ по п.13, в котором боль включает невропатическую боль. 17. Способ по п.16, в котором невропатическая боль связана с диабетической невропатией, периферической невропатией, послегерпетической невралгией, тройничной невралгией, поясничными или цервикальными радикулопатиями, фибромиалгией, языкоглоточной невралгией, рефлекторной симпатической дистрофией, казуалгией, таламическим синдромом, авульсией нервных корешков, фантомной болью, болью после торакотомии, раком, химическим повреждением, токсинами, недостаточностью питания или вирусными или бактериальными инфекциями или их комбинациями. 18. Способ по любому одному из пп.1-17, дополнительно включающий введение фармацевтически эффективного количества по меньшей мере одного ослабляющего боль агента. 19. Способ по п.18, в котором ослабляющий боль агент включает один или более аналгетиков; противовоспалительных агентов; препаратов против мигрени; трициклических антидепрессантов; антиэпилептиков; 2-агонистов или селективных ингибиторов повторного поглощения серотонина/селективных ингибиторов повторного поглощения норэпинефрина или их комбинации. 20. Способ по п.19, в котором ослабляющий боль агент включает опиоидный аналгетик. 21. Фармацевтическая композиция для лечения боли, включающая: а) эффективное для лечения боли количество, по меньшей мере приблизительно 150 мг/день для пероральной дозы, по меньшей мере одного соединения формулыR1 и R2, взятые вместе как Z, представляют собой -CH2CH2-, -CH2C(R6)(R7)CH2- илиX представляет собой CO2R3, P(O)(OR4)(OR5), 3,5-диоксо-1,2,4-оксадиазолидин-2-ил или 5-тетразолил, где R3, R4 и R5 представляют собой, независимо, водород или алкил, содержащий 1-6 атомов углерода; или его фармацевтически приемлемую соль;b) фармацевтически эффективное количество по меньшей мере одного ослабляющего боль агента. 22. Фармацевтическая композиция для лечения боли, включающая: а) эффективное для лечения боли количество, по меньшей мере приблизительно 3 мг/день для внутривенной дозы, по меньшей мере одного соединения формулыR1 и R2, взятые вместе как Z, представляют собой -CH2CH2-, -CH2C(R6)(R7)CH2- илиX представляет собой CO2R3, P(O)(OR4)(OR5), 3,5-диоксо-1,2,4-оксадиазолидин-2-ил или 5-тетразолил, где R3, R4 и R5 представляют собой, независимо, водород или алкил, содержащий 1-6 атомов углерода; или его фармацевтически приемлемую соль;b) фармацевтически эффективное количество по меньшей мере одного ослабляющего боль агента. 23. Композиция по п.21, в которой эффективное для лечения боли количество по меньшей мере одного соединения формулы (I) составляет приблизительно от 150 до 900 мг/день для пероральной дозы. 24. Композиция по п.22, в которой эффективное для лечения боли количество по меньшей мере одного соединения формулы (I) составляет приблизительно от 3 до 50 мг/день для внутривенной дозы. 25. Композиция по п.21 или 22, где соединение формулы (I) имеет формулу где A и X имеют значения, указанные в п.21 или 22. 26. Композиция по п.21 или 22, где соединением формулы (I) является по меньшей мере одно из следующих соединений:[2-(9,10-диоксо-2,7-диазабицикло[6.2.0]дец-1(8)-ен-2-ил)этил]фосфоновой кислоты или его фармацевтически приемлемая соль. 27. Композиция по п.21 или 22, где снижающий боль агент включает по меньшей мере один опиоидный аналгетик. 28. Фармацевтическая композиция для лечения боли, включающая: а) эффективное для лечения боли количество, по меньшей мере приблизительно 150 мг/день для пероральной дозы, по меньшей мере одного соединения формулы где R1 и R2, взятые вместе как Z, представляют собой -CH2CH2-, -CH2C(R6)(R7)CH2- илиX представляет собой CO2R3, P(O)(OR4)(OR5), 3,5-диоксо-1,2,4-оксадиазолидин-2-ил или 5-тетразолил, где R3, R4 и R5 представляют собой, независимо, водород или алкил, содержащий 1-6 атомов углерода; или его фармацевтически приемлемую соль;b) по меньшей мере один фармацевтический носитель. 29. Фармацевтическая композиция для лечения боли, включающая: а) эффективное для лечения боли количество, по меньшей мере приблизительно 3 мг/день для внутривенной дозы, по меньшей мере одного соединения формулы где R1 и R2, взятые вместе как Z, представляют собой -CH2CH2-, -CH2C(R6)(R7)CH2- илиX представляет собой CO2R3, P(O)(OR4)(OR5), 3,5-диоксо-1,2,4-оксадиазолидин-2-ил или 5-тетразолил, где R3, R4 и R5 представляют собой, независимо, водород или алкил, содержащий 1-6 атомов углерода; или его фармацевтически приемлемую соль;b) по меньшей мере один фармацевтический носитель. 30. Композиция по п.28, в которой эффективное для лечения боли количество по меньшей мере одного соединения формулы (I) составляет приблизительно от 150 до 900 мг/день для пероральной дозы. 31. Композиция по п.29, в которой эффективное для лечения боли количество по меньшей мере одного соединения формулы (I) составляет приблизительно от 3 до 50 мг/день для внутривенной дозы. 32. Композиция по п.28 или 29, в которой соединение формулы (I) имеет формулу где A и X имеют значения, указанные в п. 28 или 29. 33. Композиция по п.32, дополнительно включающая по меньшей мере один ослабляющий боль агент. 34. Композиция по п.33, где ослабляющий боль агент включает опиоидный аналгетик. 35. Композиция по п.28 или 29, где соединением формулы (I) является по меньшей мере одно из следующих соединений:[2-(9,10-диоксо-2,7-диазабицикло[6.2.0]дец-1(8)-ен-2-ил)этил]фосфоновой кислоты или его фармацевтически приемлемая соль. 36. Фармацевтическая композиция для лечения боли в стандартной лекарственной форме, включающая эффективное для лечения боли количество, по меньшей мере приблизительно 150 мг/день для пероральной дозы, по меньшей мере одного соединения формулы где R1 и R2, взятые вместе как Z, представляют собой -CH2CH2-, -CH2C(R6)(R7)CH2- илиX представляет собой CO2R3, P(O)(OR4)(OR5), 3,5-диоксо-1,2,4-оксадиазолидин-2-ил или 5-тетразолил, где R3, R4 и R5 представляют собой, независимо, водород или алкил, содержащий 1-6 атомов углерода; или его фармацевтически приемлемой соли. 37. Фармацевтическая композиция для лечения боли в стандартной лекарственной форме, включающая эффективное для лечения боли количество, по меньшей мере приблизительно 3 мг/день для внутривенной дозы, по меньшей мере одного соединения формулы где R1 и R2, взятые вместе как Z, представляют собой -CH2CH2-, -CH2C(R6)(R7)CH2- илиX представляет собой CO2R3, P(O)(OR4)(OR5), 3,5-диоксо-1,2,4-оксадиазолидин-2-ил или 5-тетразолил, где R3, R4 и R5 представляют собой, независимо, водород или алкил, содержащий 1-6 атомов углерода; или его фармацевтически приемлемую соль. 38. Композиция по п.36, в которой эффективное для лечения боли количество одного соединения формулы (I) составляет приблизительно от 150 до 900 мг/день для пероральной дозы. 39. Композиция по п.37, в которой эффективное для лечения боли количество одного соединения формулы (I) составляет приблизительно от 3 до 50 мг/день для внутривенной дозы. 40. Композиция по п.36 или 37, в которой соединение формулы (I) имеет формулу где A и X имеют значения, определенные в п.36 или 37. 41. Композиция по п.36 или 37, в которой соединением формулы (I) является по меньшей мере одно из следующих соединений:[2-(9,10-диоксо-2,7-диазабицикло[6.2.0]дец-1(8)-ен-2-ил)этил]фосфоновой кислоты или его фармацевтически приемлемая соль. 42. Композиция по п.36 или 37, которая находится в форме таблетки или капсулы. 43. Терапевтическая упаковка для дозирования млекопитающему, которое нужно лечить от боли,включающая: а) одну или более стандартных доз по меньшей мере одного соединения формулы (I), содержащих эффективное для лечения боли количество, по меньшей мере приблизительно 150 мг/день для пероральной дозы, одного соединения формулы где R1 и R2, взятые вместе как Z, представляют собой -CH2CH2-, -CH2C(R6)(R7)CH2- илиX представляет собой CO2R3, P(O)(OR4)(OR5), 3,5-диоксо-1,2,4-оксадиазолидин-2-ил или 5-тетразолил, где R3, R4 и R5 представляют собой, независимо, водород или алкил, содержащий 1-6 атомов углерода; или его фармацевтически приемлемую соль;b) контейнер, включающий одну или более стандартных доз и этикетку, указывающую на использование упаковки для лечения боли у млекопитающего. 44. Терапевтическая упаковка для дозирования млекопитающему, которое нужно лечить от боли,включающая: а) одну или более стандартных доз по меньшей мере одного соединения формулы (I), содержащих эффективное для лечения боли количество по меньшей мере приблизительно 3 мг/день для внутривенной дозы, по меньшей мере одного соединения формулы где R1 и R2, взятые вместе как Z, представляют собой -CH2CH2-, -CH2C(R6)(R7)CH2- илиX представляет собой CO2R3, P(O)(OR4)(OR5), 3,5-диоксо-1,2,4-оксадиазолидин-2-ил или 5-тетразолил, где R3, R4 и R5 представляют собой, независимо, водород или алкил, содержащий 1-6 атомов углерода; или его фармацевтически приемлемую соль;b) контейнер, включающий одну или более стандартных доз и этикетку, указывающую на использование упаковки для лечения боли у млекопитающего. 45. Упаковка по п.43, в которой эффективное для лечения боли количество по меньшей мере одного соединения формулы (I) составляет приблизительно от 150 до 900 мг/день для пероральной дозы. 46. Упаковка по п.44, в которой эффективное для лечения боли количество по меньшей мере одного соединения формулы (I) составляет приблизительно от 3 до 50 мг/день для внутривенной дозы. 47. Упаковка по п.43 или 44, где соединение формулы (I) имеет формулу где A и X имеют значения, указанные в п.43 или 44. 48. Упаковка по п.43 или 44, где соединением формулы (I) является по меньшей мере одно из следующих соединений:[2-(9,10-диоксо-2,7-диазабицикло[6.2.0]дец-1(8)-ен-2-ил)этил]фосфоновой кислоты или его фармацевтически приемлемая соль. 49. Применение соединения, имеющего формулуR1 и R2, взятые вместе как Z, представляют собой -CH2CH2-, -CH2C(R6)(R7)CH2- илиX представляет собой CO2R3, P(O)(OR4)(OR5), 3,5-диоксо-1,2,4-оксадиазолидин-2-ил или 5-тетразолил, где R3, R4 и R5 представляют собой, независимо, водород или алкил, содержащий 1-6 атомов углерода; или его фармацевтически приемлемой соли для изготовления лекарственного средства для лечения боли у млекопитающего.R2 представляет собой водород, метил, этил, аллил, металлил или бензил или R1 и R2, взятые вместе как Z, представляют собой -CH2CH2-, -CH2C(R6)(R7)CH2- илиA представляет собой алкилен с неразветвленной или разветвленной цепью, выбранный из -CH2-,-CH2CH2-, -CH(CH3)CH2-, -CH2CH(CH3)-, -(CH2)3- или -(CH2)4-;R1 и R2, взятые вместе как Z, представляют собой -CH2CH2-, -CH2C(R6)(R7)CH2- илиA представляет собой алкилен с неразветвленной или разветвленной цепью, выбранный из -CH2-,-CH2CH2-, -CH(CH3)CH2-, -CH2CH(CH3)-, -(CH2)3- или -(CH2)4-;X выбран из карбоксила, фосфонила или 5-тетразолила. 52. Применение по любому одному из пп.49-51, где соединением формулы (I) является по меньшей мере одно из следующих соединений:[2-(4-гидрокси-8,9-диоксо-2,6-диазабицикло[5.2.0]нон-1(7)-ен-2-ил)этил]фосфоновой кислоты; 8,9-диоксо-2,6-диазабицикло[5.2.0]нон-1(7)-ен-2-уксусной кислоты; 2-[(1 Н-тетразол-5-ил)метил]-2,6-диазабицикло[5.2.0]нон-1(7)-ен-8,9-диона,[2-(9,10-диоксо-2,7-диазабицикло[6.2.0]дец-1(8)-ен-2-ил)этил]фосфоновой кислоты или его фармацевтически приемлемая соль.
МПК / Метки
МПК: A61P 25/04, A61K 31/551, A61K 31/197, A61K 31/198, A61K 31/662, A61K 31/4245
Метки: алкил]кислоты, боли, лечения, применяемые, производные, 2-(амино-3,4-диоксо-1-циклобутен-1-ил)амино
Код ссылки
<a href="https://eas.patents.su/23-9993-proizvodnye-2-amino-34-diokso-1-ciklobuten-1-ilamino-alkilkisloty-primenyaemye-dlya-lecheniya-boli.html" rel="bookmark" title="База патентов Евразийского Союза">Производные [[ 2-(амино-3,4-диоксо-1-циклобутен-1-ил)амино ]алкил]кислоты, применяемые для лечения боли</a>
Предыдущий патент: Способ возведения подземных сооружений и устройство для его осуществления
Следующий патент: Новые хинолиновые производные
Случайный патент: Дозатор жидкости автоматический












