Бензимидазолы и родственные аналоги в качестве модуляторов сиртуина
Номер патента: 20578
Опубликовано: 30.12.2014
Авторы: Ву Чи Б., Перни Роберт Б., Нг Пуи Йи, Диш Джереми С., Блум Чарльз А.
Формула / Реферат
1. Соединение формулы (II)
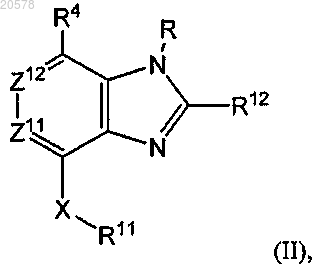
или его соль, где
один из Z11 и Z12 представляет собой CR13, а другой из Z11 и Z12 выбран из N и CR13, где
R13 выбран из водорода, галогена, -ОН, -CºN, фторзамещенного C1-C2 алкила, -О-(C1-C2 фторзамещенный алкил), -S-(С1-С2 фторзамещенный алкил), C1-C4 алкила, -(C1-C2 алкил)-N(R14)(R14), -О-СН2СН(ОН)СН2ОН,
-O-(C1-C4) алкила, -О-(С1-С3) алкил-N(R14)(R14), -N(R14)(R14), -S-(C1-C4) алкила и С3-С7 циклоалкила;
R выбран из водорода, -(С2-С4) алкила, -(C1-C4) фторзамещенного алкила, -(C1-C4)алкил-N(R7)(R7), -(С1-С4) алкил-С(O)-N(R7)(R7), -(С2-С4) алкил-O-R7 и -(С2-С4) алкил-N(R7)-С(О)-R7, где
каждый R7 независимо выбран из водорода и -C1-C4 алкила; или
два R7, связанные с одним и тем же атомом азота, взятые вместе с атомом азота, образуют 4-7-членный насыщенный гетероцикл, необязательно включающий один дополнительный гетероатом, выбранный из N, S, S(=O), S(=O)2 и О, где насыщенный гетероцикл необязательно замещен по одному атому углерода -ОН,
-C1-C4 алкилом, фтором, -NH2, -NH(C1-C4 алкил), -N(C1-C4 алкил)2, -NH(CH2CH2OCH3) или
-N(СН2СН2ОСН3)2;
R4 выбран из водорода, галогена, -CºN, фторзамещенного C1-С2 алкила, -S-(C1-C2) фторзамещенного алкила, C1-C4 алкила, -S-(C1-C4) алкила и С3-С7 циклоалкила;
X выбран из
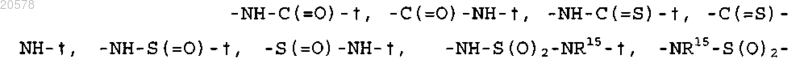
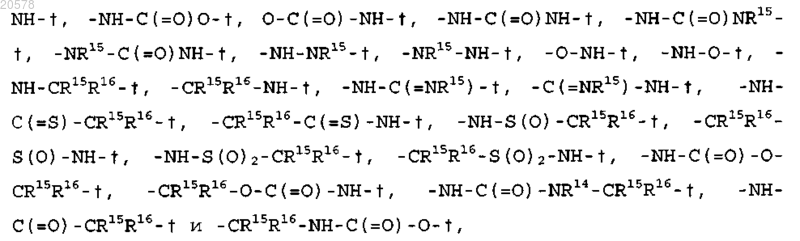 где
гдеR15 и R16 независимо выбраны из водорода, C1-C4 алкила, CF3 и -(С1-С4 алкил)-CF3;
R11 представляет собой гетероцикл, который представляет собой 4-7-членное моноциклическое кольцо или 8-12-членное бициклическое кольцо, а также спироконденсированную и связанную мостиковой связью полициклическую кольцевую систему, включающие один или несколько гетероатомов, выбранных из N, О и S атомов, причем моноциклическое кольцо и каждое из бициклических колец независимо выбраны из насыщенного, ненасыщенного или ароматического кольца,
где R11 необязательно замещен одним-двумя заместителями, независимо выбранными из галогена, -CºN, C1-C3 алкила, С3-С7 циклоалкила, C1-C2 фторзамещенного алкила, =O, -O-C1-C4 алкила, -S-R14, -(C1-C4 алкил)-N(R14)(R14), -N(R14)(R14), -О-(С2-С4 алкил)-N(R14)(R14), -C(O)-N(R14)(R14), -C(O)-O-R14 и -(С1-С4 алкил)-С(O)-N(R14)(R14), где
каждый R14 независимо выбран из водорода и -C1-C4 алкила; или
два R14, взятые вместе с атомом азота, с которым они связаны, образуют 4-8-членный насыщенный гетероцикл, необязательно включающий один дополнительный гетероатом, выбранный из N, S, S(=O), S(O)2 и О, где
когда R14 представляет собой алкил, такой алкил необязательно замещен одной или несколькими группами
-ОН, -O-(C1-C4 алкил), фтор, -NH2, -NH(C1-C4 алкил), -N(C1-C4 алкил)2, -NH(CH2CH2OCH3) или
-N(CH2CH2OCH3)2, и
когда два R14, взятые вместе с атомом азота, с которым они связаны, образуют 4-8-членный насыщенный гетероцикл, такой насыщенный гетероцикл необязательно замещен по атому углерода группой -ОН, -C1-C4 алкил, фтор, -NH2, -NH(C1-C4 алкил), -N(C1-C4 алкил)2, -NH(CH2CH2OCH3) или -N(СН2СН2ОСН3)2; и необязательно замещен по любому замещаемому атому азота группой -C1-C4 алкил, фторзамещенный C1-C4 алкил или -(СН2)2-О-СН3;
R12 выбран из карбоцикла, который представляет собой 5-7-членную моноциклическую кольцевую систему, независимо выбранную из насыщенной, ненасыщенной и ароматической кольцевой системы, где все кольцевые атомы представляют собой углерод, и гетероцикла, определенного для R11, отличного от пиперазина, индазола, триазола или пиразолопиридина, где R12 необязательно замещен одним-двумя заместителями, независимо выбранными из галогена, -CºN, C1-C4 алкила, С3-С7 циклоалкила, C1-C2 фторзамещенного алкила, -O-R14, -S-R14, -S(O)-R14, -S(O)2-R14, -(С1-С4 алкил)-N(R14)(R14), -N(R14)(R14), -О-(С2-С4 алкил)-N(R14)(R14), -С(O)-N(R14)(R14), -(С1-С4 алкил)-С(O)-N(R14)(R14), -О-фенила, фенила и второго гетероцикла, определенного для R11, и когда R12 представляет собой фенил, R12 также необязательно замещен 3,4-метилендиокси, фторзамещенным 3,4-метилендиокси, 3,4-этилендиокси, фторзамещенным 3,4-этилендиокси или -O-(насыщенный гетероцикл), где любой фенильный или второй гетероциклический заместитель радикала R12 необязательно замещен галогеном; -CºN; С1-С4 алкилом, C1-C2 фторзамещенным алкилом, группой -О-(C1-C2 фторзамещенный алкил), -О-(C1-C4 алкил), -S-(C1-C4 алкил), -S-(C1-C2 фторзамещенный алкил), -NH-(C1-C4 алкил) и -N-(C1-C4 алкил)2.
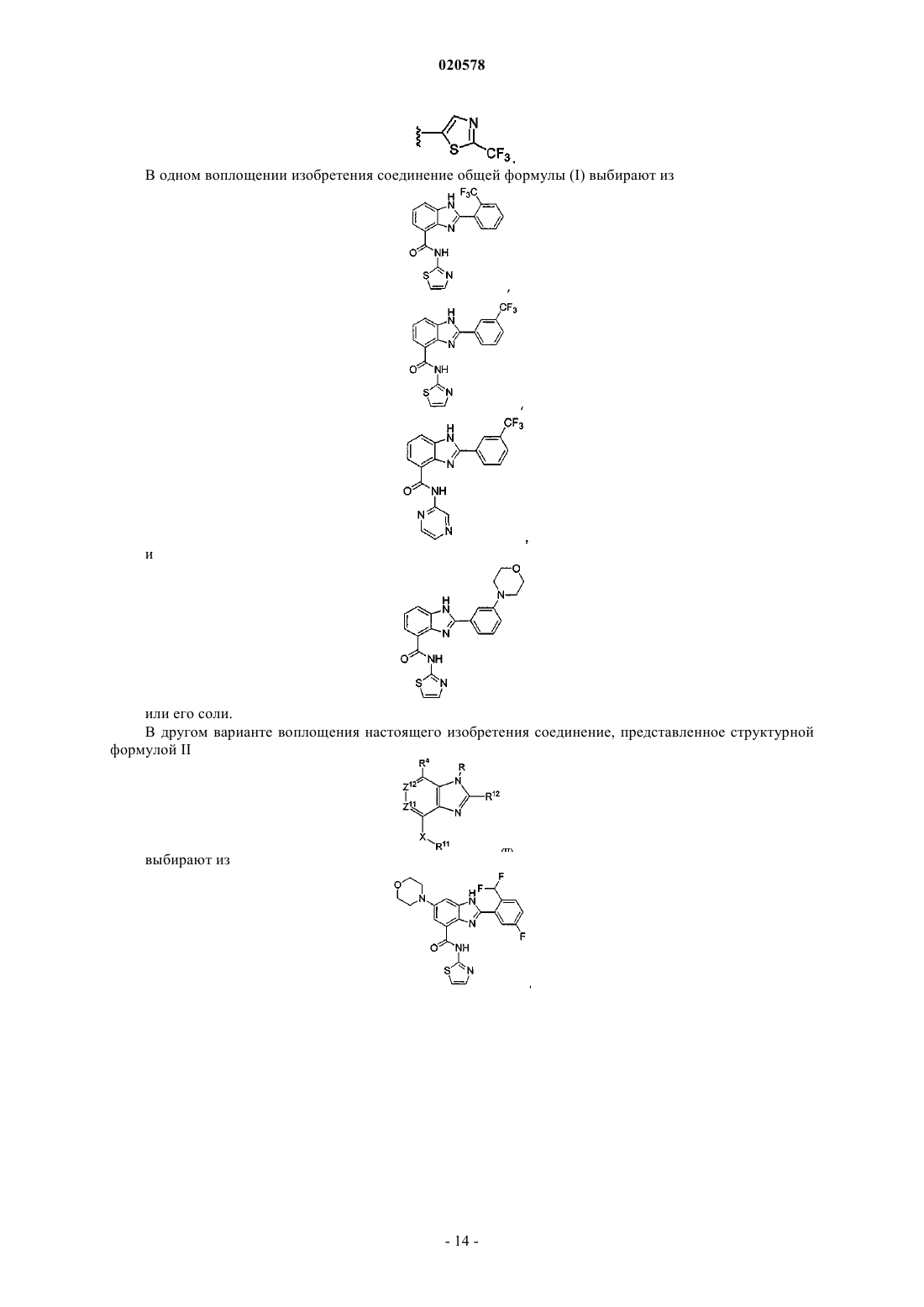
2. Соединение по п.1, имеющее формулу
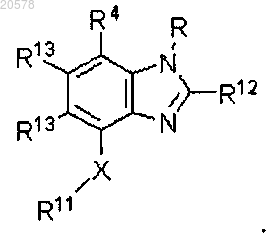
3. Соединение формулы (I)
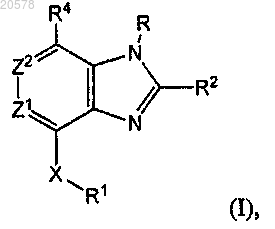
или его соль, где
один из Z1 и Z2 представляет собой CR3, а другой из Z1 и Z2 выбран из N и CR3, где
R3 выбран в каждом случае из водорода, гидрокси, галогена, -CºN, фторзамещенного C1-C2 алкила, -О-(C1-C2) фторзамещенного алкила, -S-(C1-С2) фторзамещенного алкила, C1-C4 алкила, -О-(С1-С4) алкила, -S-(C1-C4) алкила, С3-С7 циклоалкила;
R выбран из водорода, -(С2-С4) алкила, -(C1-C4)фторзамещенного алкила, -(С1-С4) алкил-N(R7)(R7), -(C1-C4) алкил-С(O)-N(R7)(R7), -(С2-С4)алкил-O-R7 и -(С2-С4) алкил-N(R7)-С(О)-R7, где
каждый R7 независимо выбран из водорода и -С1-С4 алкила; или
два R7, связанные с одним и тем же атомом азота, взятые вместе с атомом азота, образуют 4-7-членный насыщенный гетероцикл, необязательно включающий один дополнительный гетероатом, выбранный из N, S, S(=O), S(=O)2 и О, где насыщенный гетероцикл необязательно замещен по одному атому углерода группой -ОН, -C1-C4 алкил, фтор, -NH2, -NH(C1-C4 алкил), -N(C1-C4 алкил)2, -NH(CH2CH2OCH3) или
-N(СН2СН2ОСН3)2;
R1 выбран из карбоцикла, который представляет собой 5-7-членную моноциклическую или 8-12-членную бициклическую кольцую систему, а также спироконденсированную и связанную мостиковой связью полициклическую кольцевую систему, где все кольцевые атомы представляют собой углерод, причем моноциклическое или каждое из бициклических колец независимо выбрано из насыщенного, ненасыщенного и ароматического кольца, и гетероцикла, который представляет собой 4-7-членную моноциклическую или 8-12-членную бициклическую кольцевую систему, а также спироконденсированную и связанную мостиковой связью полициклическую кольцевую систему, включающую один или несколько гетероатомов, выбранных из N, О и S атомов, причем моноциклическое кольцо и каждое из бициклических колец независимо выбраны из насыщенного, ненасыщенного или ароматического кольца,
где R1 необязательно замещен одним-двумя заместителями, независимо выбранными из галогена, -CºN, C1-C3 алкила, =O, С3-С7 циклоалкила, фторзамещенного C1-C2 алкила, -O-R8, -S-R8, -(C1-C2 алкил)-N(R8)(R8),
-N(R8)(R8), -О-(C1-C2 алкил)-N(R8)(R8), -(C1-C2 алкил)-О-(С1-С2 алкил)-N(R8)(R8) и -(C1-C2 алкил)-С(О)-N(R8)(R8), и когда R1 представляет собой фенил, R1 также необязательно замещен 3,4-метилендиокси, фторзамещенным 3,4-метилендиокси, 3,4-этилендиокси и фторзамещенным 3,4-этилендиокси;
каждый R8 независимо выбран из водорода и -C1-C4 алкила; или
два R8, взятые вместе с атомом азота, с которым они связаны, образуют 4-8-членный насыщенный гетероцикл, необязательно включающий один дополнительный гетероатом, выбранный из N, S, S(=O), S(=O)2 и О, где алкил необязательно замещен одной или несколькими группами -ОН, фтор, -NH2, -NH(C1-С4 алкил), -N(C1-C4 алкил)2, -NH(СН2СН2ОСН3) или -N(СН2СН2ОСН3)2, и насыщенный гетероцикл необязательно замещен по атому углерода группой -ОН, -C1-C4 алкил, фтор, -NH2, -NH(C1-C4 алкил), -N(C1-C4 алкил)2, -NH(CH2CH2OCH3) или -N(СН2СН2ОСН3)2,
R2 выбран из карбоцикла, определенного для R1, содержащего по меньшей мере пять кольцевых атомов, и 4-7-членного моноциклического гетероцикла, определенного для R1, отличного от пиперазина, где R2 необязательно замещен одним-двумя заместителями, независимо выбранными из галогена, -CºN, C1-C3 алкила, С3-С7 циклоалкила, C1-C2 фторзамещенного алкила, -O-R8, -S-R8, -(С1-С2 алкил)-N(R8)(R8),
-N(R8)(R8), -О-(С1-С2 алкил)-N(R8)(R8), -(C1-C2 алкил)-О-(C1-C2 алкил)-N(R8)(R8), -С(O)-N(R8)(R8), -(C1-C2 алкил)-С(O)-N(R8)(R8), -О-фенила, фенила и второго гетероцикла, определенного для R1, и когда R2 представляет собой фенил, R2 также необязательно замещен 3,4-метилендиокси, фторзамещенным 3,4-метилендиокси, 3,4-этилендиокси или фторзамещенным 3,4-этилендиокси, где любой фенильный или второй гетероциклический заместитель R2 необязательно замещен галогеном; -CºN; C1-C3 алкилом, C1-C2 фторзамещенным алкилом, -О-(C1-C2) фторзамещенным алкилом, -O-(C1-С3) алкилом, -S-(C1-C3) алкилом,
-S-(C1-C2) фторзамещенным алкилом, -NH-(C1-C3) алкилом и -N-(C1-C3)2 алкилом; и
R4 выбран из водорода, галогена, -CºN, фторзамещенного C1-С2 алкила, -S-(C1-C2) фторзамещенного алкила, C1-C4 алкила, -S-(C1-C4) алкила и С3-С7 циклоалкила;
X выбран из
каждый R5 и R6 независимо выбран из водорода, С1-С4 алкила, -CF3 и (C1-C2 алкил)-CF3, где
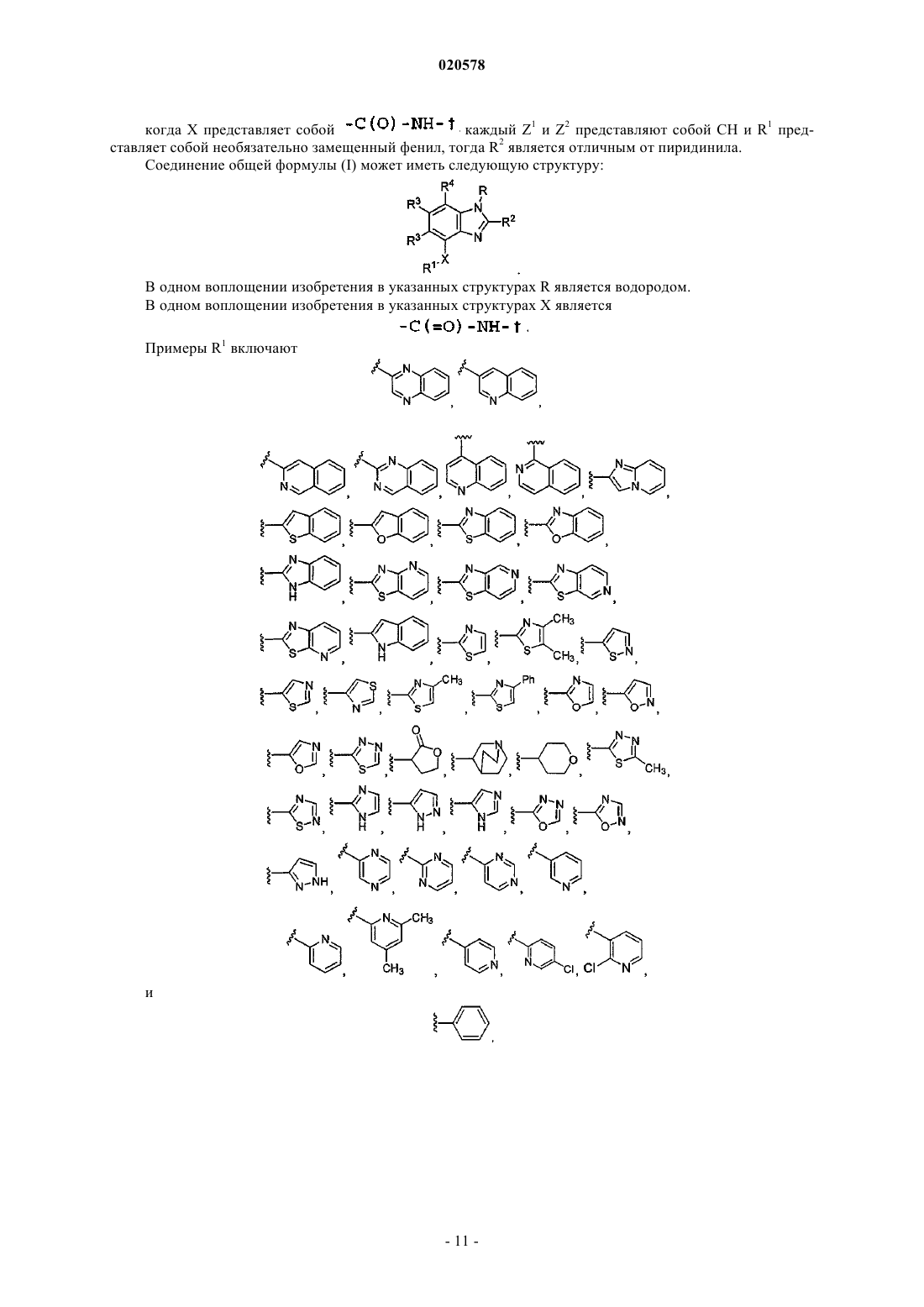
когда X представляет собой
каждый Z1 и Z2 представляют собой СН и R1 представляет собой необязательно замещенный фенил, тогда R2 является отличным от пиридинила.
4. Соединение по п.3, имеющее формулу
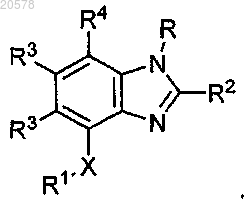
5. Соединение по любому из пп.1-4, где R является водородом.
6. Соединение по любому из пп.1-5, где X является
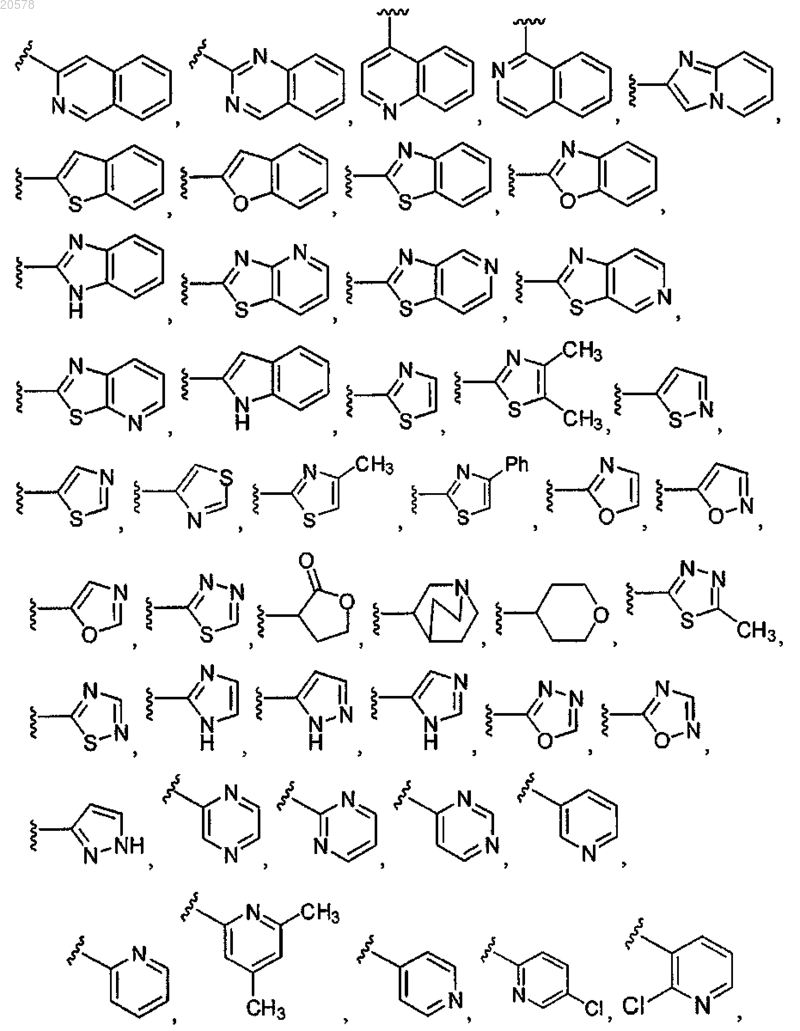
7. Соединение по п.1 или 2, где R11 выбирают из
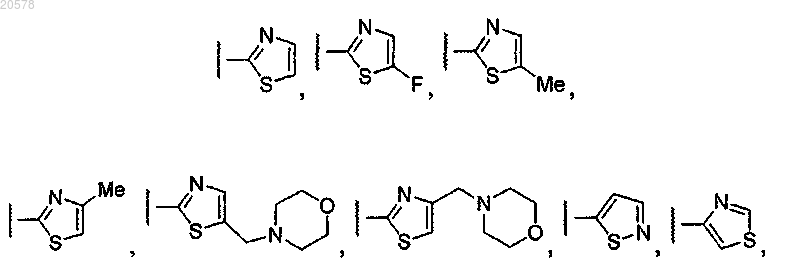
и
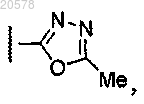
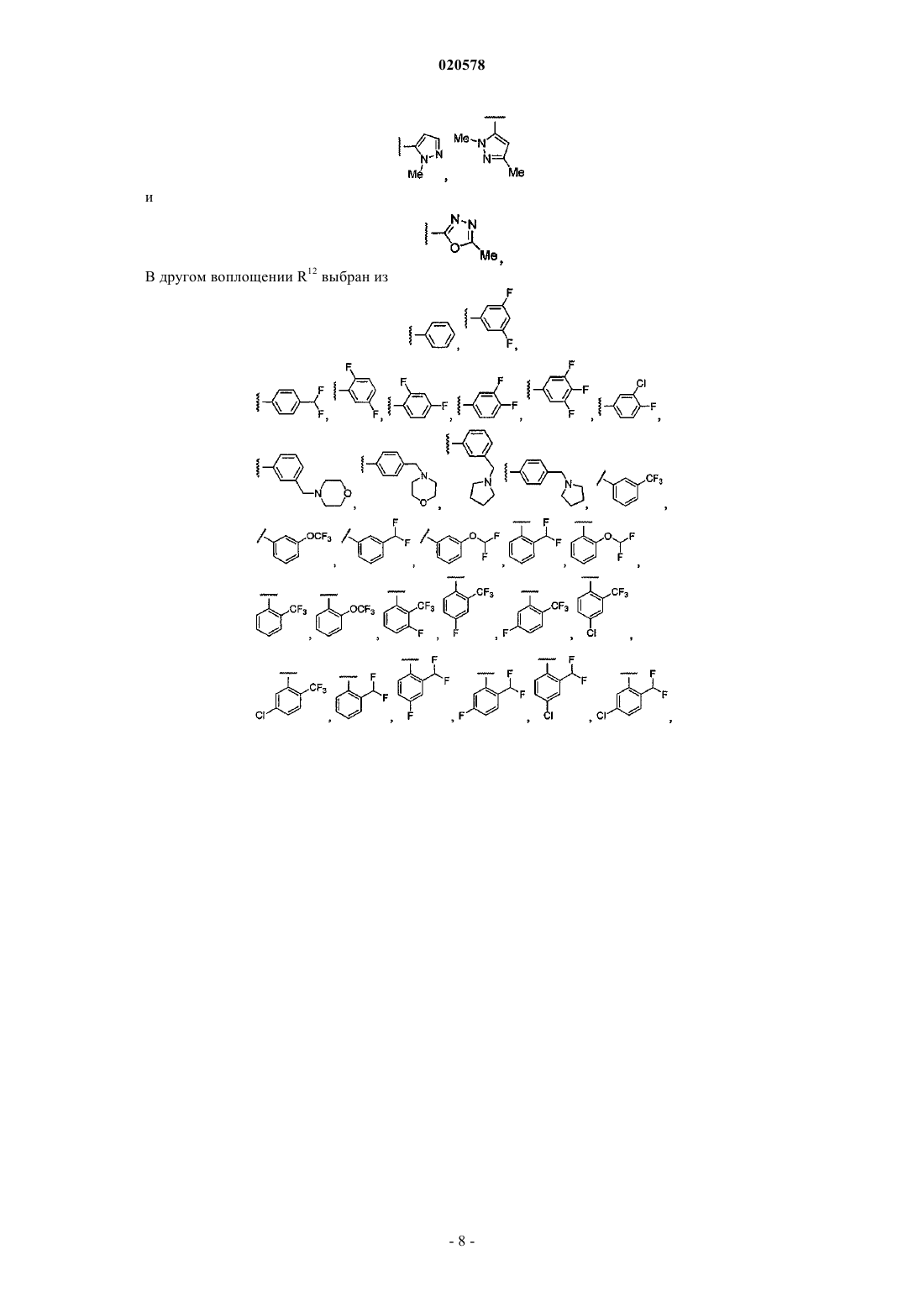
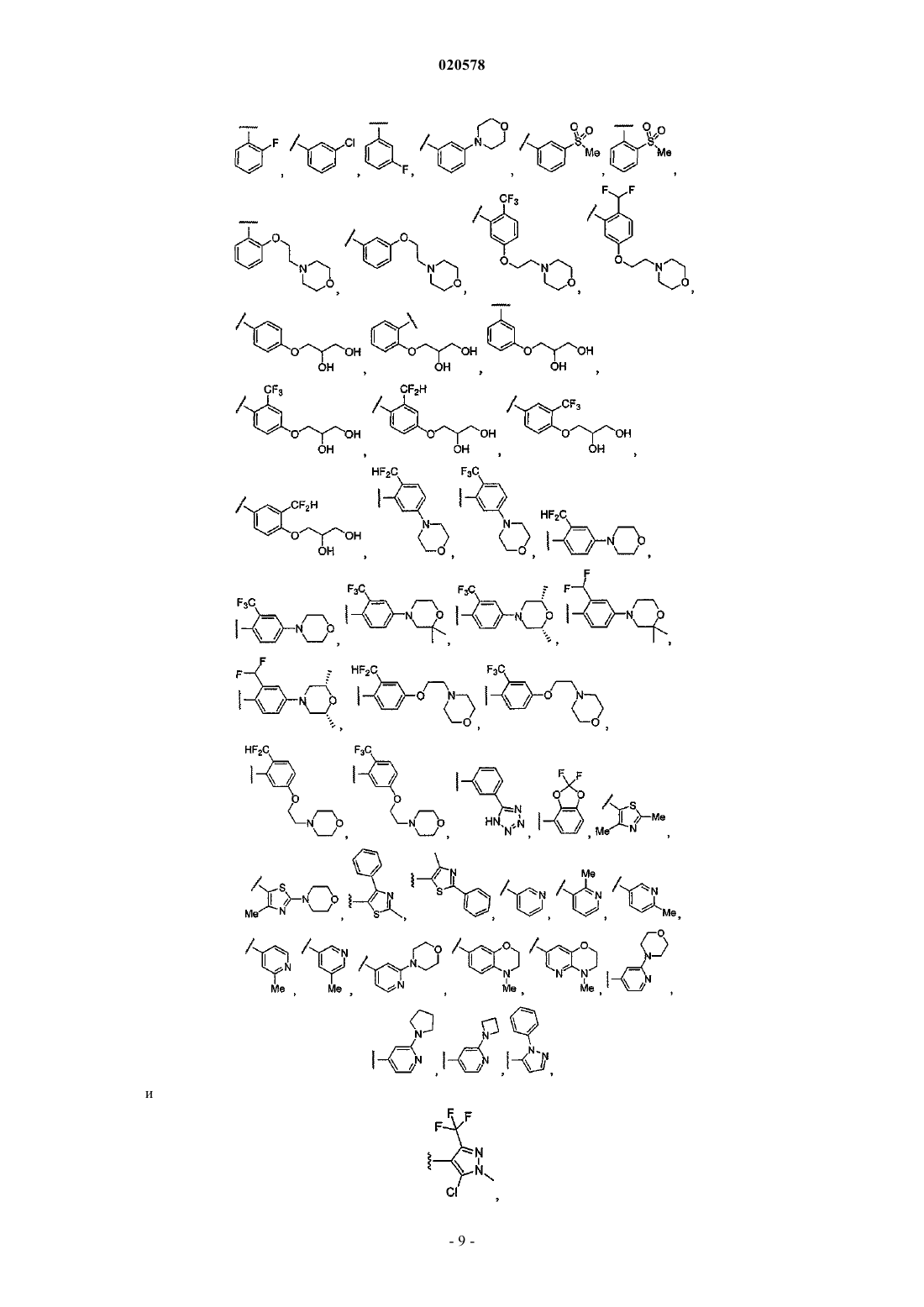
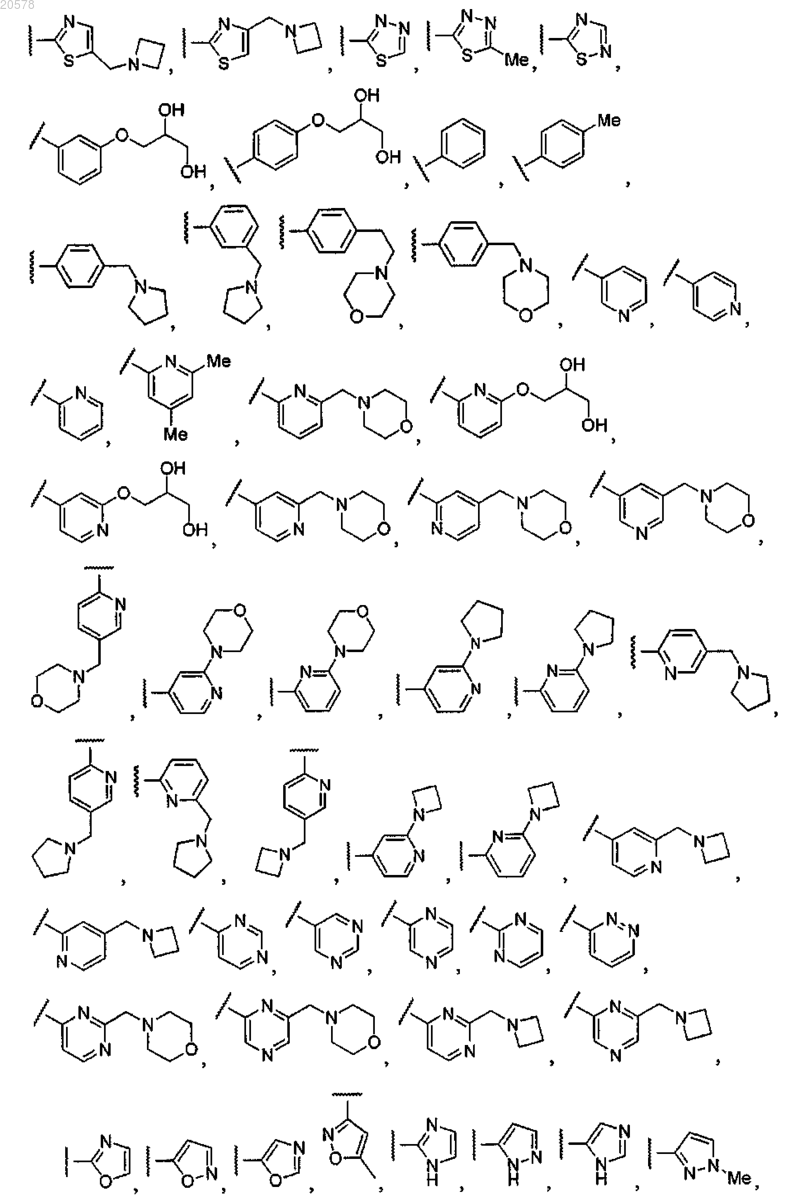
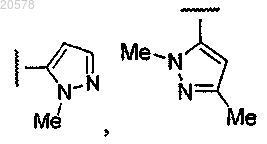
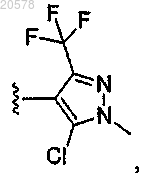
8. Соединение по любому из пп.1, 2 или 7, где R12 выбран из
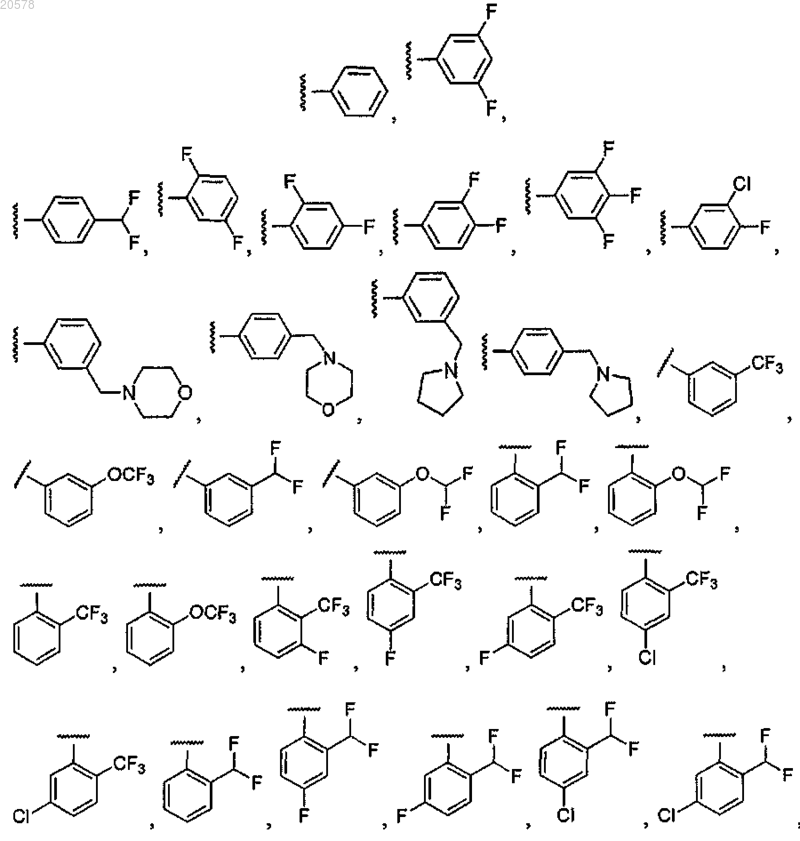
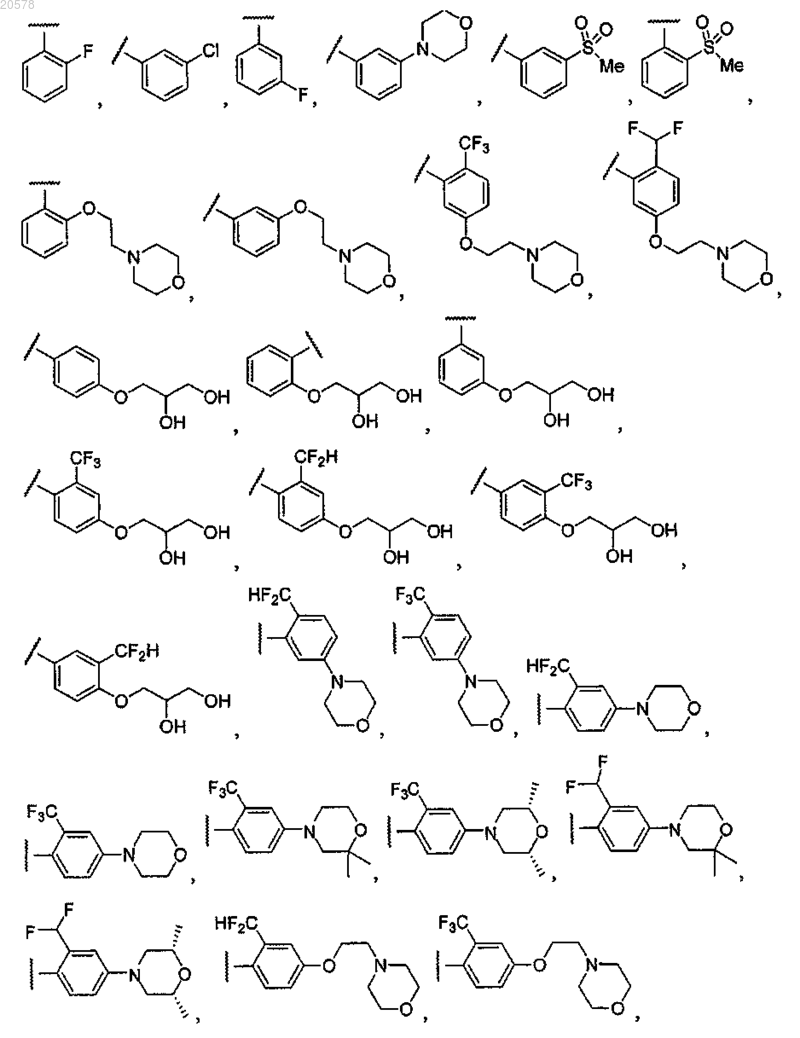
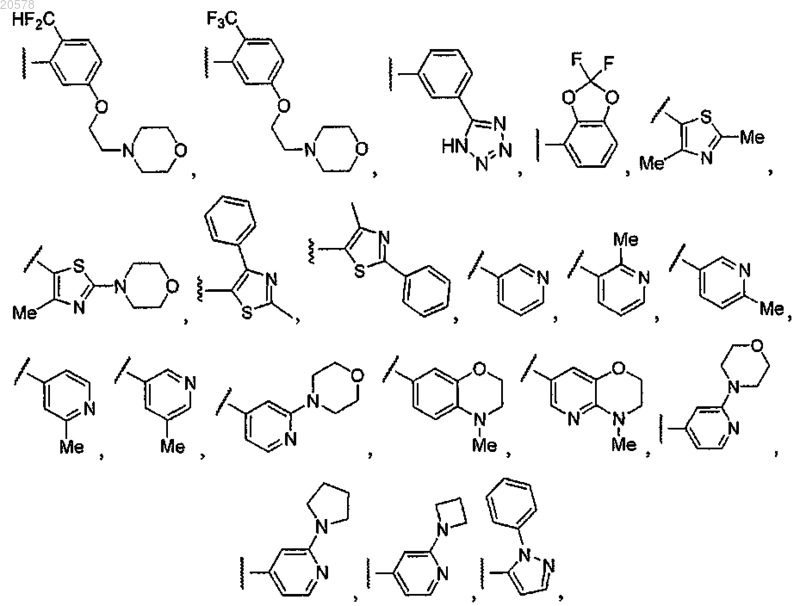
и
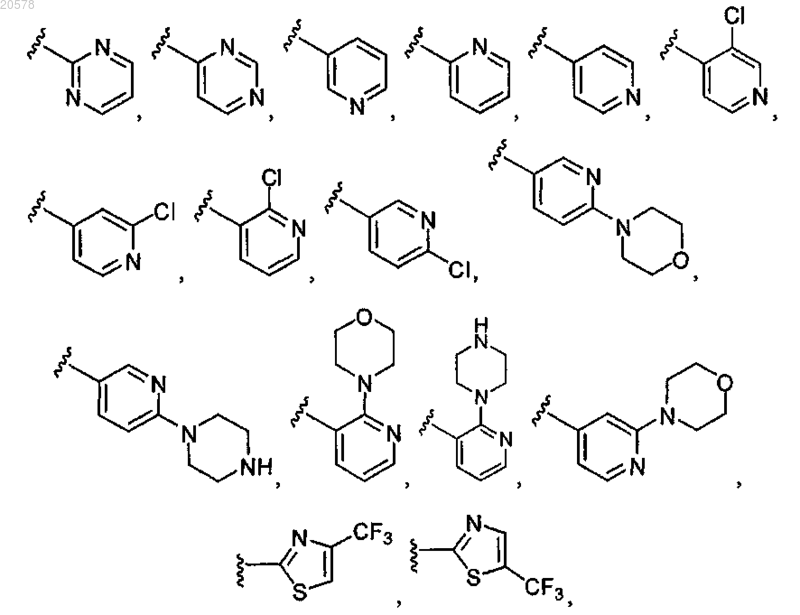
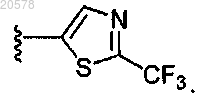
9. Соединение по п.3 или 4, где R1 выбран из
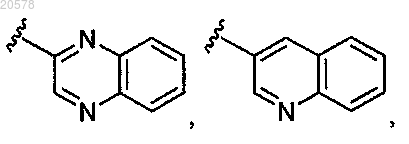
и
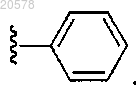
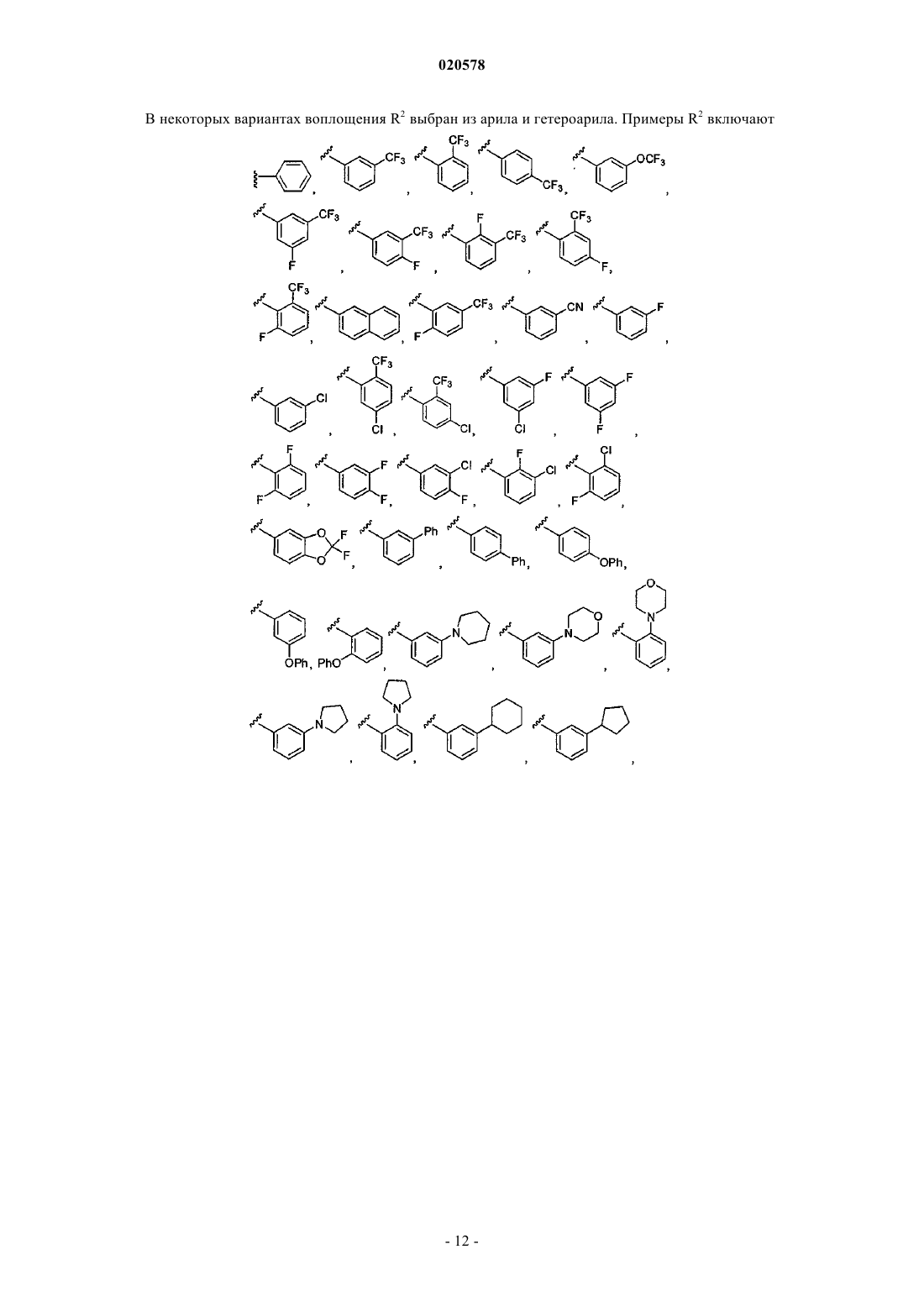
10. Соединение по любому из пп.3, 4 или 9, где R2 выбран из
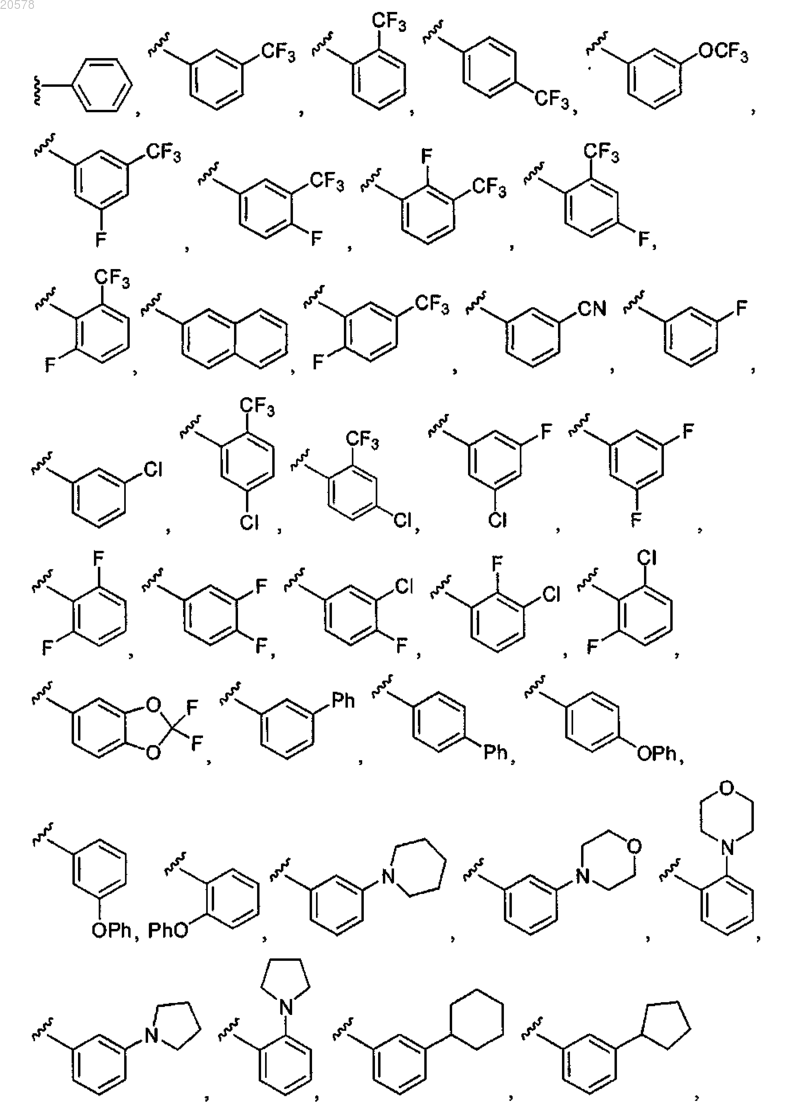
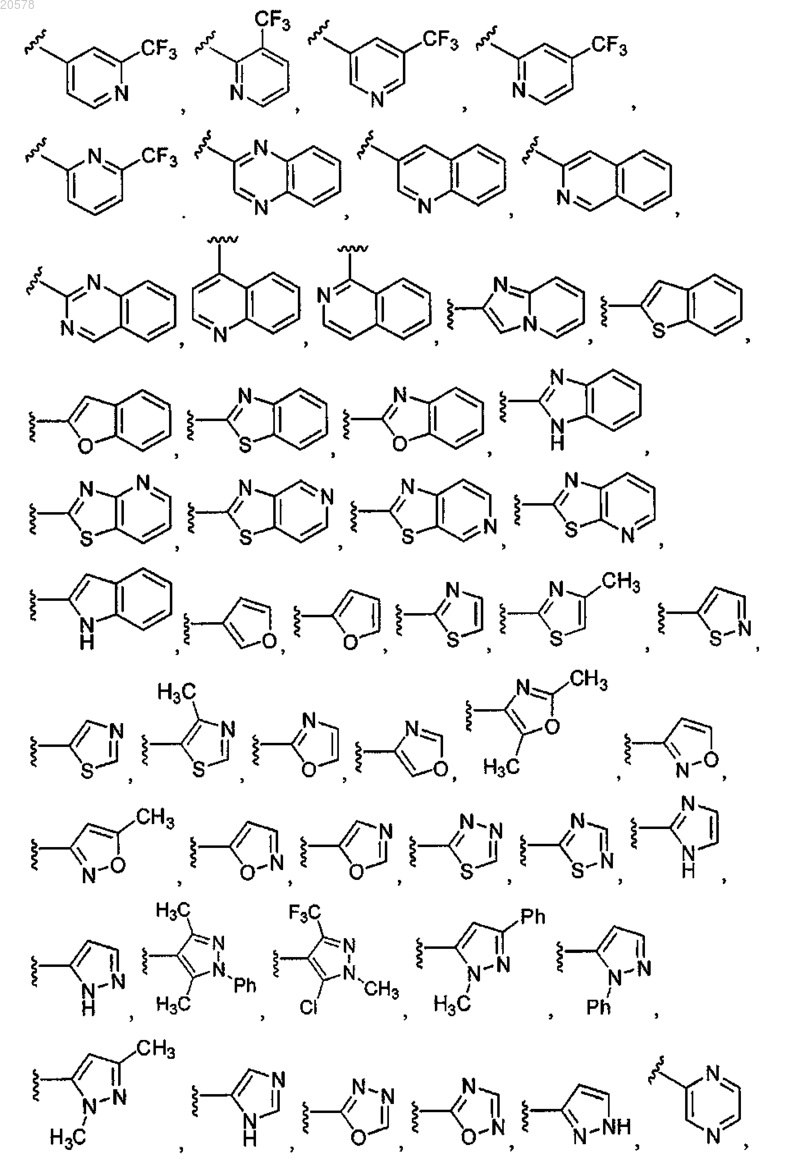
и
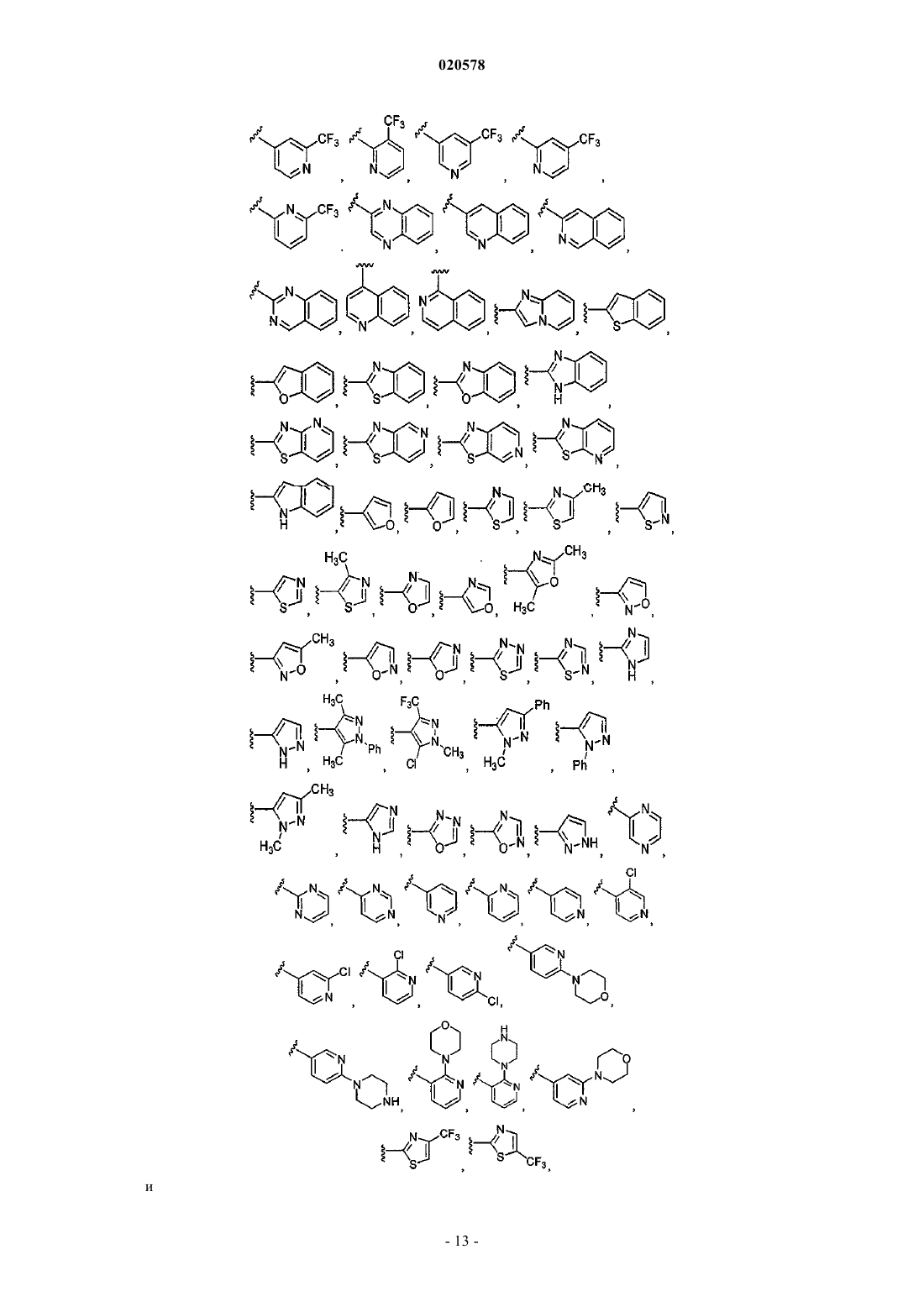
11. Соединение по п.1, выбранное из
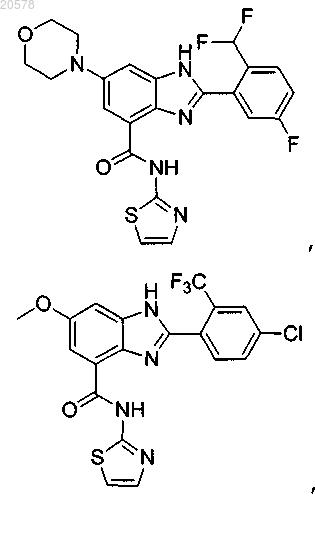
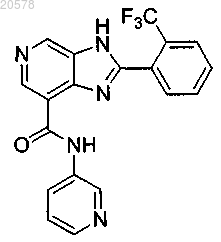
и
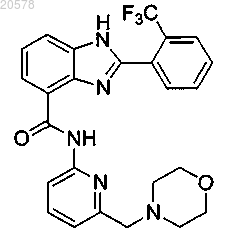
или его соль.
12. Соединение по п.3, выбранное из
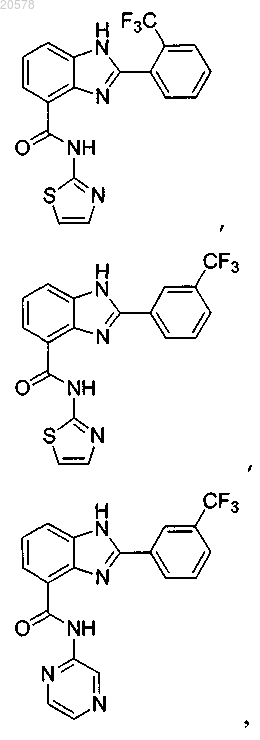
и
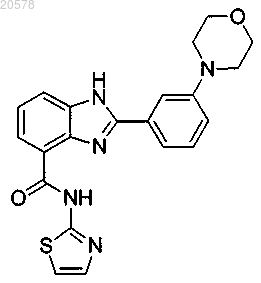
или его соль.
13. Фармацевтическая композиция, включающая соединение по любому из пп.1-12 или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель.
14. Фармацевтическая композиция по п.13, дополнительно включающая другое активное средство, выбранное из противовоспалительных средств, анальгетиков, противомикробных средств, противогрибковых средств, антибиотиков, витаминов, антиоксидантов и блокирующих солнечные лучи средств, включая антранилаты, бензофеноны (в частности, бензофенон-3), производные камфоры, циннаматы (например, октилметоксициннамат), дибензоилметаны (например, бутилметоксидибензоилметан), п-аминобензойную кислоту (РАВА) и ее производные и салицилаты (например, октилсалицилат).
15. Способ лечения субъекта, страдающего от или чувствительного к резистентности к инсулину, метаболического синдрома, диабета или его осложнений, или повышения чувствительности к инсулину у субъекта, включающий введение субъекту, нуждающемуся в этом, композиции по п.13.
Текст
В настоящей заявке представлены сиртуин-модулирующие соединения формулы (II). Сиртуинмодулирующие соединения можно использовать для увеличения продолжительности жизни клетки и для лечения и/или профилактики множества различных заболеваний и расстройств, включая,например, заболевания или расстройства, связанные со старением или стрессом, диабет, ожирение,нейродегенеративные заболевания, сердечно-сосудистое заболевание, нарушения свертываемости крови, воспаление, рак и/или приливы, а также заболевания или расстройства, для которых будет полезным повышение митохондриальной активности. Также представлены композиции,включающие сиртуин-модулирующее соединение в сочетании с другим терапевтическим средством. Родственные заявки Настоящая заявка заявляет преимущество предварительной заявки США 61/133938, поданной 3 июля 2008 г., содержание которой включено посредством ссылки во всей полноте. Предпосылки изобретения Семейство "молчащих" информационных регуляторных (Silent Information Regulator "SIR") генов представляет собой высококонсервативную группу генов, присутствующих в геномах организмов от archaebacteria до высших эукариот. Кодируемые SIR белки вовлечены в различные процессы от регуляции сайленсинга гена до репарации ДНК. Белки, кодируемые членами генного семейства SIR, демонстрируют высокую консервативность последовательности в 250-аминокислотном центральном представляющем собой ядро домене. Хорошо охарактеризованным геном в этом семействе является S. cerevisiaeSIR2, который вовлечен в сайленсинг НМ локусов, которые содержат информацию, определяющую тип спаривания дрожжей, эффекты положения теломера и клеточное старение. Белок Sir2 дрожжей относится к семейству гистондеацетилаз. Гомолог Sir2, CobB, в Salmonella typhimurium действует как NAD (никотинамидадениндинуклеотид)-зависимая ADP-рибозилтрансфераза.Sir2 белок представляет собой деацетилазу класса III, которая использует NAD в качестве сосубстрата. В отличие от других деацетилаз, многие из которых вовлечены в сайленсинг генов, Sir2 не чувствительна к ингибиторам гистондеацетилаз класса I и II, подобных трихостатину A (TSA). Деацетилирование ацетил-лизина посредством Sir2 тесно связано с NAD гидролизом, с образованием никотинамида и нового ацетил-ADP рибозного соединения. NAD-зависимая деацетилазная активность Sir2 является существенной для его функций, что может связывать его биологическую роль с клеточным метаболизмом в дрожжах. Гомологи Sir2 млекопитающих имеют NAD-зависимую гистондеацетилазную активность. Биохимические исследования показали, что Sir2 может легко деацетилировать амино-концевые отростки гистонов Н 3 и Н 4, приводя к образованию 1-O-ацетил-ADP-рибозы и никотинамида. Штаммы с дополнительными копиями SIR2 демонстрируют повышенный rДНК сайленсинг и на 30% большую продолжительность жизни. Недавно было показано, что дополнительные копии гомолога SIR2 С. elegans,sir-2.1, и dSir2 ген D. melanogaster сильно увеличивают продолжительность жизни в этих организмах. Это говорит о том, что SIR2-зависимый регуляторный путь для старения возник рано в результате эволюции и хорошо сохранился. В настоящее время считается, что развитие Sir2 генов произошло для усиления здоровья организма и резистентности к стрессу для повышения возможности его выживания в неблагоприятных условиях. У человека существует семь Sir2-подобных генов (SIRT1-SIRT5), у которых есть общий для них консервативный каталитический домен Sir2. SIRT1 представляет собой ядерный белок с наивысшей степенью сходства последовательности с Sir2. SIRT1 регулирует несколько клеточных мишеней путем деацетилирования, включая супрессор опухоли р 53, клеточный сигнальный фактор NF-В и FOXO транскрипционный фактор.SIRT3 представляет собой гомолог SIRT1, который является консервативным в прокариотах и эукариотах. SIRT3 белок нацелен на кристы митохондрий посредством уникального домена, расположенного на N-конце. SIRT3 обладает NAD+-зависимой протеиндеацетилазной активностью и широко экспрессируется, в частности, в метаболически активных тканях. Считается, что SIRT3 при переносе в митохондрии должен расщепляться до более мелкой активной формы под действием митохондриальной матриксной процессинговой пептидазы (МРР). Ограничение калорий известно более 70 лет как способствующее улучшению здоровья и продлению жизни млекопитающих. Продолжительность жизни дрожжей, также как у многоклеточных животных, также продлевается в результате вмешательств, которые напоминают ограничение калорий, таких как низкий уровень глюкозы. То открытие, что дрожжи и мухи, у которых отсутствует SIR2 ген, долго не живут при ограничении калорий, является свидетельством того, что SIR2 гены опосредуют благоприятные в отношении здоровья эффекты диеты с ограничением калорий. Более того, мутации, которые снижают активность глюкоза-чувствительного сАМР (аденозин 3',5'-монофосфат)-зависимого (PKA) пути у дрожжей, увеличивают продолжительность жизни в клетках дикого типа, но не в мутантных sir2 штаммах, указывая на то, что SIR2 вероятно является ключевым компонентом, действующим по направлению пути ограничения калорий. Краткое описание изобретения В настоящей заявке представлены новые сиртуин-модулирующие соединения и способы их применения. В одном аспекте настоящее изобретение обеспечивает сиртуин-модулирующие соединения структурных формул (I) и (II), как описано подробно ниже. В другом аспекте настоящее изобретение обеспечивает способы применения сиртуин-модулирующих соединений или композиций, включающих сиртуин-модулирующие соединения. В некоторых вариантах воплощения сиртуин-модулирующие соединения, которые повышают уровень и/или активность белка сиртуина, можно использовать для различных терапевтических применений, включая, лечение и/или профилактику множества различных заболеваний и расстройств, включая, например, лечение субъекта, страдающего от или чувствительный к резистентности к инсулину, метаболического синдрома,диабета или его осложнений, или повышения чувствительности к инсулину у субъекта. Сиртуин-модулирующие соединения можно вводить отдельно или в сочетании с другими соединениями, включая другие сиртуин-модулирующие соединения или другие терапевтические средства. Подробное описание изобретения 1. Определения Как это используется в настоящей заявке, следующие термины и фразы должны иметь значения,указанные ниже. Если не указано иное, все технические и научные термины, используемые в настоящей заявке, имеют общепринятые значения, известные специалистам в данной области со средней квалификацией. Термин "средство" используется в настоящей заявке для обозначения химического соединения,смеси химических соединений, биологической макромолекулы (такой как нуклеиновая кислота, антитело, белок или его часть, например, пептид) или экстракта, полученного из биологических веществ, таких как клетки или ткани бактерий, растений, грибов или животных (в частности, млекопитающих). Активность таких средств может сделать их подходящими в качестве "терапевтического средства", которое представляет собой биологически, физиологически или фармакологически активное вещество (или вещества), которое действует локально или системно в организме субъекта. Термин "биодоступный", когда он относится к соединению, является общепринятым в данной области и относится к форме соединения, которая, для этого соединения или части вводимого количества этого соединения, обеспечивает возможность абсорбции, включения или делает его иным образом физиологически доступным для субъекта или пациента, которому его вводят."Биологически активная часть сиртуина" относится к части белка сиртуина, обладающей биологической активностью, такой как способность к осуществлению деацетилирования. Биологически активные части сиртуина могут включать домен, представляющий собой ядро сиртуинов. Биологически активные части SIRT1 с номером доступа GenBankNP036370, которые охватывают NAD+связывающий домен и субстрат-связывающий домен, например, могут включать без ограничения, аминокислоты 62-293 с номером доступа GenBankNP036370, которые кодируются нуклеотидами 237932 с номером доступа GenBankNM012238. Поэтому эта область иногда указывается как представляющий ядро домен. Другие биологически активные части SIRT1, также иногда указываемые как являющиеся ядром домены, включают область аминокислот 261-447 с номером доступа GenBankNP036370, которые кодируются нуклеотидами 834-1394 с номером доступа GenBankNMJ12238; область аминокислот 242-493 с номером доступа GenBank NP036370, которые кодируются нуклеотидами 777-1532 с номером доступа GenBankNM012238; или область аминокислот 254-495 с номером доступа GenBankNP036370, которые кодируются нуклеотидами 813-1538 с номером доступа GenBankNM012238. Термин "домашние животные" относится к кошкам и собакам. Как он используется в настоящей заявке, термин "собака (собаки)" относится к любому члену вида Canis familiaris, который включает большое количество различных пород. Термин "кошка (кошки)" относится к кошачьему животному, включая домашних кошек и других членов семейства Felidae, рода Felis."Диабет" относится к высокому уровню сахара в крови или кетоацидозу, а также к хроническим общим метаболическим расстройствам, возникающим в результате продолжительного состояния, характеризующегося высоким уровнем сахара в крови, или в результате пониженной толерантности к глюкозе."Диабет" охватывает обе формы этого заболевания, тип I и тип II (инсулин-независимый сахарный диабет или NIDDM). Что касается диабета, факторы риска включают следующие: объем талии больше чем 40 дюймов (101,6 см) для мужчин или 35 дюймов (88,9 см) для женщин, кровяное давление 130/85 мм рт.ст. или выше, уровень триглицеридов выше 150 мг/дл, уровень глюкозы в крови натощак больше чем 100 мг/дл или уровень липопротеинов высокой плотности меньше чем 40 мг/дл у мужчин или 50 мг/дл у женщин. Термин "ED50" является общепринятым в данной области. В некоторых вариантах воплощения,ED50 означает дозу лекарственного средства, которая обеспечивает 50% от максимального ответа или эффекта, или, альтернативно, дозу, которая обеспечивает предваретельно определенный ответ для 50% испытываемых субъектов или препаратов. Термин "LD50" является общепринятым в данной области. В некоторых вариантах воплощения, LD50 означает дозу лекарственного средства, которая является летальной для 50% испытываемых субъектов. Термин "терапевтический индекс" является общепринятым в данной области термином, который относится к терапевтическому индексу лекарственного средства,определяемому как LD50/ED50. Термин "гиперинсулинемия" относится к состоянию индивидуума, при котором уровень инсулина в крови выше нормального. Термин "резистентность к инсулину" относится к состоянию, при котором нормальное количество инсулина вызывает недостаточный биологический ответ по сравнению с биологическим ответом у субъекта, который не имеет резистентности к инсулину. бому заболеванию или состоянию, которое вызвано резистентностью к инсулину или которому способствует резистентность к инсулину. Примеры включают диабет, ожирение, метаболический синдром,синдромы инсулин-резистентности, синдром X, резистентность к инсулину, высокое кровяное давление,гипертензия, высокий уровень холестерина в крови, дислипидемия, гиперлипидемия, дислипидемия, атеросклеротическое заболевание, включая удар, заболевание коронарных артерий или инфаркт миокарда,гипергликемия, гиперинсулинемия и/или гиперпроинсулинемия, нарушенная толерантность к глюкозе,замедленное выделение инсулина, диабетические осложнения, включая коронарное сердечное заболевание, стенокардия, застойная сердечная недостаточность, удар, когнитивные функции при деменции, ретинопатия, периферическая невропатия, нефропатия, гломерулонефрит, гломерулосклероз, нефротический синдром, гипертензивный нефросклероз, некоторые типы рака (такие как эндометриальный, молочной железы, предстательной железы и толстой кишки), осложнения беременности, плохое женское репродуктивное здоровье (такое как нарушение ментруального цикла, бесплодие, нерегулярная овуляция,синдром поликистоза яичников (PCOS, липодистрофия, расстройства, связанные с холестерином, такие как желчные конкременты, холецистит и желчекаменная болезнь, подагра, обструктивные приступы апноэ во сне и респираторные проблемы, остеоартрит и профилактика и лечение потери костной массы,например, остеопороза. Термин "скот" относится к одомашненным четвероногим животным, которые включают животных,которых выращивают на мясо и различные побочные продукты, таким как коровы, включая крупный рогатый скот и других членов рода Bos, свиньи, включая домашнюю свинью и других членов рода Sus,овцы, включая овцу и других членов рода Ovis, домашние козы и другие члены рода Capra; к одомашненным четвероногим животным, которых выращивают для специальных целей, например, для использования в качестве вьючных животных, таким как лошади, включая домашних лошадей и других членов семейства Equidae, рода Equus. Термин "млекопитающее" известен из уровня техники, и примеры млекопитающих включают человека, приматов, домашний скот (включая коров, свиней и т.д.), домашних животных (например, собак,кошек и т.д.) и грызунов (например, мышей и крыс)."Тучные" индивидуумы или индивидуумы, страдающие ожирением, это, в основном, индивидуумы,имеющие индекс массы тела (BMI) по меньшей мере 25 или больше. Ожирение может быть или не быть связано с резистентностью к инсулину. Термины "парентеральное введение" и "вводимый парентерально" являются общепринятыми в данной области и относятся к способам введения, отличным от энтерального и местного введения, обычно путем инъекции, и включают, без ограничения, внутривенную, внутримышечную, внутриартериальную,интратекальную, интракапсулярную, интраорбитальную, внутрисердечную, внутрикожную, интраперитонеальную, транстрахеальную, подкожную, субкутикулярную, внутрисуставную, субкапсулярную, субарахноидальную, интраспинальную и интрастернальную инъекцию и инфузию."Пациент", "субъект", "индивидуум" или "хозяин" относится либо к человеку или животному, отличному от человека. Термин "фармацевтически приемлемый носитель" является общепринятым в данной области и относится к фармацевтически приемлемому веществу, композиции или носителю, такому как жидкий или твердый наполнитель, разбавитель, эксципиент, растворитель или инкапсулирующее вещество, вовлеченному в перенос или транспортирование какой-либо представляющей интерес композиции или ее компонента. Каждый носитель должен быть "приемлемым" в том смысле, что он должен быть совместим с представляющей интерес композицией и ее компонентами и не быть вредным для пациента. Некоторые примеры веществ, которые могут служить в качестве фармацевтически приемлемых носителей, включают (1) сахара, такие как лактоза, глюкоза и сахароза; (2) крахмалы, такие как кукурузный крахмал и картофельный крахмал; (3) целлюлозу и ее производные, такие как натриевая соль карбоксиметилцеллюлозы, этилцеллюлоза и ацетат целлюлозы; (4) порошкообразный трагакант; (5) солод; (6) желатин; (7) тальк; (8) эксципиенты, такие как масло какао и воски для суппозиториев; (9) масла, такие как арахисовое масло, масло семян хлопчатника, саффлоровое масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло, (10) гликоли, такие как пропиленгликоль; (11) полиолы, такие как глицерин,сорбит, маннит и полиэтиленгликоль; (12) сложные эфиры, такие как этилолеат и этиллаурат; (13) агар;(14) буферные вещества, такие как гидроксид магния и гидроксид алюминия; (15) альгиновую кислоту;(16) апирогенную воду; (17) изотонический физиологический раствор; (18) раствор Рингера; (19) этиловый спирт; (20) фосфатно-буферные растворы и (21) другие нетоксичные совместимые вещества, используемые в фармацевтических композициях. Термин "профилактическое" или "терапевтическое" лечение является общепринятым в данной области и относится к введению лекарственного средства хозяину. Если его вводят до клинического проявления нежелательного состояния (например, заболевания или другого нежелательного состояния животного-хозяина), тогда лечение является профилактическим, т.е. защищает хозяина против развития нежелательного состояния, тогда как, если его вводят после проявления нежелательного состояния, лечение является терапевтическим (т.е. оно предназначено для уменьшения, облегчения или поддержания существующего нежелательного состояния или вызываемых им побочных эффектов). Термин "апирогенный", при ссылке на композицию, относится к композиции, которая не содержит пирогена в количестве, которое могло бы привести к неблагоприятному эффекту (например, раздражение, лихорадка, воспаление, диарея, респираторный дистресс-синдром, эндотоксический шок и т.д.) у субъекта, которому была введена такая композиция. Например, предполагается, что термин охватывает композиции, которые не содержат или, по существу, не содержат эндотоксина, такого как, например,липополисахарида (LPS)."Репликативная продолжительность жизни" клетки относится к количеству дочерних клеток, продуцируемых отдельной "материнской клеткой". "Хронологическое старение" или "хронологическая продолжительность жизни", с другой стороны, относится к промежутку времени, в течение которого популяция не-делящихся клеток остается жизнеспособной, будучи лишенной питательных веществ. "Увеличение продолжительности жизни клетки" или "продление продолжительности жизни клетки", при применении к клеткам или организмам, относится к увеличению количества дочерних клеток, продуцируемых одной клеткой; повышению способности клеток или организмов справляться со стрессами и бороться с повреждением, например, ДНК, белков; и/или повышение способности клеток или организмов выживать и существовать в живом состоянии более длительное время в конкретных условиях, например,стресса (например, тепловой шок, осмотический стресс, высокоэнергетическое излучение, химическииндуцированный стресс, повреждение ДНК, недостаточный уровень соли, недостаточный уровень азота или недостаточный уровень питательных веществ). Продолжительность жизни можно увеличить по меньшей мере на около 20, 30, 40, 50, 60% или в пределах от 20 до 70%, от 30 до 60%; от 40 до 60% или более с использованием способов, описанных в настоящей заявке."Сиртуин-активирующее соединение" относится к соединению, которое повышает уровень белка сиртуина и/или повышает по меньшей мере одну активность белка сиртуина. В иллюстративном варианте воплощения, сиртуин-активирующее соединение может повышать по меньшей мере одну биологическую активность белка сиртуина на по меньшей мере около 10, 25, 50, 75, 100% или более. Примеры биологических активностей сиртуиновых белков включают деацетилирование, например, гистонов и р 53; продление продолжительности жизни; повышение геномной стабильности; сайленсинг транскрипцию и контроль сегрегации окисленных белков между материнскими и дочерними клетками."Белок сиртуин" относится к члену семейства белков сиртуиндеацетилазы или, предпочтительно, к Sir2 семейству, которое включают Sir2 дрожжей (номер доступа GenBank P53685), Sir-2.1 С. elegans (номер доступа GenBank NP501912) и человеческий SIRT1 (номер доступа GenBank NM012238 и NP036370 (илиAF083106 и SIRT2 (номер доступа GenBank NM012237, NM030593, NP036369, NP085096 и AF083107) белки. Другие члены семейства включают четыре дополнительных Sir2-подобных гена дрожжей, называемых"HST генами" (гомологи Sir два) HST1, HST2, HST3 и HST4 и пять других человеческих гомологов hSIRT3,hSIRT4, hSIRT5, hSIRT6 и hSIRT7 (Brachmann et al. (1995) Genes Dev. 9:2888 and Frye et al. (1999) BBRC 260:273). Предпочтительными сиртуинами являются те, которые имеют больше сходства с SIRT1, т.е. hSIRT1 и/или Sir2, чем с SIRT2, такие как члены, имеющие по меньшей мере часть N-концевой последовательности,которая присутствует в SIRT1 и отсутствует в SIRT2, например, как это имеет SIRT3.AF083106) ) белки и их эквиваленты и фрагменты. В другом варианте воплощения, SIRT1 белок включает полипептид, включающий последовательность, состоящую из или, по существу, состоящую из аминокислотной последовательности, представленной в GenBank, номера доступа NP036370, NP501912,NP085096, NP036369 или Р 53685. SIRT1 белки включают полипептиды, включающие всю или часть аминокислотной последовательности, представленной в GenBank, номера доступа NP036370, NP501912,NP085096, NP036369 или Р 53685; аминокислотной последовательности, представленной в GenBank,номера доступа NP036370, NP501912, NP085096, NP036369 или Р 53685, с от 1 до около 2, 3, 5, 7, 10,15, 20, 30, 50, 75 или более консервативных аминокислотных замен; аминокислотной последовательности,которая, по меньшей мере, является на 60, 70, 80, 90, 95, 96, 97, 98 или 99% идентичной последовательности, представленной в GenBank, номера доступа NP036370, NP501912, NP085096, NP036369 или Р 53685, и их функциональные фрагменты. Полипептиды по настоящему изобретению также включают гомологи (например, ортологи и паралоги), варианты или фрагменты представленных в GenBank с номерами доступа NP036370, NP501912, NP085096, NPJB6369 или Р 53685."SIRT3 белок" относится к члену белкового семейства сиртуиндеацетилазы и/или к гомологу SIRT1 белка. В одном варианте воплощения, SIRT3 белок включает человеческий SIRT3 (номер доступа GenBankAAH01042, NP036371 или NP001017524) и мышиный SIRT3 (номер доступа GenBank NP071878) белки и их эквивалетны и фрагменты. В другом варианте воплощения, SIRT3 белок включает полипептид, включающий последовательность, состоящую из или, по существу, состоящую из аминокислотной последовательности, представленной в GenBank, номера доступа ААН 01042, NP036371, NP001017524 илиNP071878. SIRT3 белки включают полипептиды, включающие всю или часть аминокислотной последовательности, представленной в GenBank, номера доступа ААН 01042, NP036371, NP001017524 или ААН 01042, NP036371, NP001017524 или NP071878, с от 1 до около 2, 3, 5, 7, 10, 15, 20, 30, 50, 75 или более консервативных аминокислотных замен; аминокислотной последовательности, которая, по меньшей мере, является на 60, 70, 80, 90, 95, 96, 97, 98 или 99% идентичной последовательности, представленной в GenBank, номера доступа ААН 01042, NP036371, NP001017524 или NP071878, и их функциональные фрагменты. Полипептиды по настоящему изобретению также включают гомологи (например, ортологи и паралоги), варианты или фрагменты представленных в GenBank с номерами доступа ААН 01042, NP036371,NP001017524 или NP071878. В одном варианте воплощения, SIRT3 белок включает фрагмент SIRT3 белка, который образуется путем расщепления митохондриальной матриксной процессинговой пептидазой (МРР) и/или митохондриальной промежуточной пептидазой (MIP). Термины "системное введение", "вводимый системно", "периферическое введение" и "вводимый периферийно" являются общепринятыми в данной области и относятся к введению представляющей интерес композиции, терапевтического или другого средства, отличному от введения непосредственно в центральную нервную систему, так, чтобы оно поступало в систему пациента, подвергалось, таким образом, метаболизму и другим подобным процессам. Термин "терапевтическое средство" является общепринятым в данной области и относится к любой химической частице, которая является биологически, физиологически или фармакологически активным веществом, которое действует локально или системно у субъекта. Термин также означает любое вещество, предназначенное для использования в диагностике, лечении, облегчению, лечению или профилактики заболевания или для усиления желаемого физического или умственного развития и/или состояний у животного или человека. Термин "терапевтический эффект" является общепринятым в данной области и относится к местному или системному эффекту у животных, в частности, млекопитающих и, более конкретно, у людей,вызванному фармакологически активным веществом. Фраза "терапевтически эффективное количество" означает такое количество этого вещества, которое обеспечивает некоторый желаемый местный или системный эффект при разумном соотношении польза/риск, применимом к любому лечению. Терапевтически эффективное количество такого вещества варьирует в зависимости от субъекта и состояния заболевания, подлежащего лечению, массы тела и возраста субъекта, тяжести состояния заболевания, способа введения и подобных факторов, и его легко может определить специалист в данной области со средней квалификацией. Например, некоторые композиции, описанные в настоящей заявке, можно вводить в достаточном количестве для получения желаемого эффекта при разумном соотношении польза/риск, применимом к такому лечению."Лечение" состояния или заболевания относится к лечению, а также облегчению по меньшей мере одного симптома состояния или заболевания. Термин "ухудшение зрения" относится к снижению зрения, которое часто является только частично обратимым или необратимым после лечения (например, хирургической операции). В частности, сильное ухудшение зрения называется "слепотой" или "потерей зрения", что относится к полной потере зрения,зрению хуже чем 20/200, что нельзя исправить при помощи корректирующих линз, или к полю зрения с диаметром меньше чем 20 (радиус 10). 2. Модуляторы сиртуина В одном аспекте настоящее изобретение обеспечивает новые сиртуин-модулирующие соединения для лечения и/или профилактики множества различных заболеваний и расстройств, включая, например,лечение субъекта, страдающего от или чувствительный к резистентности к инсулину, метаболического синдрома, диабета или его осложнений, или повышения чувствительности к инсулину у субъекта. Соединения, раскрытые в настоящей заявке, могут быть подходящими для использования в фармацевтической композиции и/или одном или нескольких способах, раскрытых в настоящей заявке. В одном варианте воплощения сиртуин-модулирующие соединения по настоящему изобретению представлены структурной формулой (II) или его соль, где один из Z11 и Z12 представляет собой CR13, а другой из Z11 и Z12 выбран из N и CR13, гдеR выбран из водорода, -(С 2-С 4) алкила, -(C1-C4) фторзамещенного алкила, -(C1-C4) алкил-N(R7)(R7), (С 1-С 4) алкил-С(О)-N(R7)(R7), -(C2-C4) алкил -O-R7 и -(С 2-С 4) алкил-N(R7)-С(О)-R7, где каждый R7 независимо выбран из водорода и -C1-C4 алкила; или два R7, связанные с одним и тем же атомом азота, взятые вместе с атомом азота, образуют 4-7 членный насыщенный гетероцикл, необязательно включающий один дополнительный гетероатом, выбранный из N, S, S(=O), S(=O)2 и О, где насыщенный гетероцикл необязательно замещен по одному атому углерода -ОН, -C1-C4 алкилом, фтором, -NH2, -NH(C1-C4 алкил), - N(C1-C4 алкил)2, -NH(CH2CH2OCH3) или -N(CH2CH2OCH3)2;R и R16 независимо выбраны из водорода, C1-C4 алкила, CF3 и -(C1-C4 алкил)-CF3;R11 представляет собой гетероцикл, который представляет собой 4-7-членное моноциклическое кольцо или 8-12-членное бициклическое кольцо, а также спиро-конденсированную и связанную мостиковой связью полициклическую кольцевую систему, включающие один или несколько гетероатомов,выбранных из N, О и S атомов, причем моноциклическое кольцо и каждое из бициклических колец независимо выбраны из насыщенного, ненасыщенного или ароматического кольца,где R11 необязательно замещен одним-двумя заместителями, независимо выбранными из галогена, CN, C1-C3 алкила, С 3-С 7 циклоалкила, C1-C2 фторзамещенного алкила, =O, -O-C1-C4 алкила, -S-R14, -(C1C4 алкил)-N(R14)(R14), -N(R14)(R14), -О-(С 2-С 4 алкил)-N(R14)(R14), -C(O)-N(R14)(R14), -C(O)-O-R14 и -(C1-C4 алкил)-С(О)-N(R14)(R14), где каждый R14 независимо выбран из водорода и -C1-C4 алкила; или два R14, взятые вместе с атомом азота, с которым они связаны, образуют 4-8-членный насыщенный гетероцикл, необязательно включающий один дополнительный гетероатом, выбранный из N, S, S(=O),S(О)2 и О, где когда R14 представляет собой алкил, такой алкил необязательно замещен одной или несколькими группами -ОН, -О-(C1-С 4 алкил), фтор, -NH2, -NH(C1-C4 алкил), -N(C1-C4 алкил)2, NH(CH2CH2OCH3) или N(CH2CH2OCH3)2, и когда два R14, взятые вместе с атомом азота, с которым они связаны, образуют 4-8-членный насыщенный гетероцикл, такой насыщенный гетероцикл необязательно замещен по атому углерода группой ОН, -C1-C4 алкил, фтор, -NH2, -NH(C1-C4 алкил), -N(С 1-С 4 алкил)2, -NH(СН 2 СН 2 ОСН 3) или N(CH2CH2OCH3)2; и необязательно замещен по любому замещаемому атому азота группой -C1-C4 алкил,фторзамещенный C1-C4 алкил или - (СН 2)2-О-СН 3; иR12 выбран из карбоцикла, который представляет собой 5-7-членную моноциклическую кольцевую систему, независимо выбранную из насыщенной, ненасыщенной и ароматической кольцевой системы,где все кольцевые атомы представляют собой углерод, и гетероцикла, определенного для R11, отличного от пиперазина, индазола, триазола или пиразолопиридина, где R12 необязательно замещен одним-двумя заместителями, независимо выбранными из галогена, -CN, С 1-С 4 алкила, С 3-С 7 циклоалкила, C1-C2 фторзамещенного алкила, -O-R14, -S-R14, -S(O)R14, -S(O)2-R14, -(C1-C4 алкил)-N(R14)(R14), -N(R14)(R14), -О(С 2-С 4 алкил)-N(R14)(R14), -C(O)-N(R14)(R14), -(C1-C4 алкил)-C(O)-N(R14)(R14), -O-фенила, фенила и второго гетероцикла, определенного для R11, и когда R12 представляет собой фенил, R12 также необязательно замещен 3,4-метилендиокси, фторзамещенным 3,4-метилендиокси, 3,4-этилендиокси, фторзамещенным 3,4-этилендиокси или -O-(насыщенный гетероцикл), где любой фенильный или второй гетероциклический заместитель радикала R12 необязательно замещен галогеном; -CN; C1-C4 алкилом, C1-C2 фторзамещенным алкилом, группой -О-(C1-C2 фторзамещенный алкил), -О-(С 1-С 4 алкил), -S-(С 1-С 4 алкил), -S(C1-C2 фторзамещенный алкил), -NH-(C1-C4 алкил) и -N-(C1-C4 алкил)2. 15 В некоторых вариантах воплощения соединение имеет формулу В одном воплощении изобретения в указанных структурах R является водородом, а X является В некоторых воплощениях в соединениях формулы (II) R11 выбирают из Настоящее изобретение также относится к соединению общей формулы (I) или его соли, где один из Z1 и Z2 представляет собой CR3, а другой из Z1 и Z2 выбран из N и CR3, гдеR3 выбран в каждом случае из водорода, гидрокси, галогена, -CN, фторзамещенного C1-C2 алкила,-О-(C1-C2) фторзамещенного алкила, -S-(C1-C2) фторзамещенного алкила, C1-C4 алкила, -О-(C1-С 4) алкила, -S-(C1-C4) алкила, С 3-С 7 циклоалкила;R выбран из водорода, -(С 2-С 4) алкила, -(C1-C4) фторзамещенного алкила, -(C1-C4) алкил-N(R7)(R7), (С 1-С 4) алкил-С(О)-N(R7)(R7), -(C2-C4) алкил-O-R7 и -(С 2-С 4) алкил-N(R7)-С(О)-R7, где каждый R7 независимо выбран из водорода и -C1-C4 алкила; или два R7, связанные с одним и тем же атомом азота, взятые вместе с атомом азота, образуют 4-7 членный насыщенный гетероцикл, необязательно включающий один дополнительный гетероатом, выбранный из N, S, S(=O), S(=O)2 и О, где насыщенный гетероцикл необязательно замещен по одному атому углерода группой -ОН, -C1-C4 алкил, фтор, -NH2, -NH(C1-C4 алкил), -N(C1-C4 алкил)2, NH(CH2CH2OCH3) или -N(CH2CH2OCH3)2;R1 выбран из карбоцикла, который представляет собой 5-7-членную моноциклическую или 8-12 членную бициклическую кольцую систему, а также спиро-конденсированную и связанную мостиковой связью полициклическую кольцевую систему, где все кольцевые атомы представляют собой углерод,причем моноциклическое или каждое из бициклических колец независимо выбрано из насыщенного,ненасыщенного и ароматического кольца, и гетероцикла, который представляет собой 4-7-членную моноциклическую или 8-12-членную бициклическую кольцевую систему, а также спиро-конденсированную и связанную мостиковой связью полициклическую кольцевую систему, включающую один или несколько гетероатомов, выбранных из N, О и S атомов, причем моноциклическое кольцо и каждое из бициклических колец независимо выбраны из насыщенного, ненасыщенного или ароматического кольца,где R1 необязательно замещен одним-двумя заместителями, независимо выбранными из галогена, CN, С 1-С 3 алкила, =O, С 3-C7 циклоалкила, фторзамещенного C1-C2 алкила, -O-R8, -S-R8, -(C1-C2 алкил)N(R8)(R8), -N(R8)(R8), -О-(C1-C2 алкил)-N(R8)(R8), -(С 1-С 2 алкил)-О-(С 1-С 2 алкил)-N(R8)(R8) и -(С 1-С 2 алкил)-С(О)-N(R8)(R8), и когда R1 представляет собой фенил, R1 также необязательно замещен 3,4 метилендиокси, фторзамещенным 3,4-метилендиокси, 3,4-этилендиокси и фторзамещенным 3,4 этилендиокси; каждый R8 независимо выбран из водорода и -С 1-С 4 алкила; или два R8, взятые вместе с атомом азота, с которым они связаны, образуют 4-8-членный насыщенный гетероцикл, необязательно включающий один дополнительный гетероатом, выбранный из N, S, S(=O),S(=O)2 и О, где алкил необязательно замещен одной или несколькими группами -ОН, фтор, -NH2, NH(C1-C4 алкил), -N(C1-C4 алкил)2, -NH(CH2CH2OCH3) или -N(СН 2 СН 2 ОСН 3)2, и насыщенный гетероцикл необязательно замещен по атому углерода группой -ОН, -C1-C4 алкил, фтор, -NH2,-NH(C1-C4 алкил), N(C1-C4 алкил)2, NH(CH2CH2OCH3) или -N(CH2CH2OCH3)2,R2 выбран из карбоцикла, определенного для R1, содержащего по меньшей мере пять кольцевых атомов, и 4-7-членного моноциклического гетероцикла, определенного для R1, отличного от пиперазина,где R2 необязательно замещен одним-двумя заместителями, независимо выбранными из галогена, -C N,C1-C3 алкила, С 3-С 7 циклоалкила, C1-C2 фторзамещенного алкила, -O-R8, -S-R8, -(C1-C2 алкил)-N(R8)(R8), N(R8)(R8), -О-(C1-C2 алкил)-N(R8)(R8), -(С 1-С 2 алкил)-О-(C1-C2 алкил)-N(R8)(R8), -С(О)-N(R8)(R8), -(С 1-С 2 алкил)-С(O)-N(R8)(R8), -О-фенила, фенила и второго гетероцикла, определенного для R1, и когда R2 представляет собой фенил, R2 также необязательно замещен 3,4-метилендиокси, фторзамещенным 3,4 метилендиокси, 3,4-этилендиокси или фторзамещенным 3,4-этилендиокси, где любой фенильный или второй гетероциклический заместитель R2 необязательно замещен галогеном; -CN; C1-C3 алкилом, C1-C2 фторзамещенным алкилом, -О-(C1-C2) фторзамещенным алкилом, -О-(C1-C3) алкилом, -S-(C1-C3) алкилом, -S-(C1-C2) фторзамещенным алкилом, -NH-(C1-C3) алкилом и -N-(C1-C3)2 алкилом; иX выбран из где указывает, где X связан с R1; и каждый R5 и R6 независимо выбран из водорода, С 1-С 4 алкила, -CF3 и (C1-C2 алкил)-CF3, где когда X представляет собой каждый Z1 и Z2 представляют собой СН и R1 представляет собой необязательно замещенный фенил, тогда R2 является отличным от пиридинила. Соединение общей формулы (I) может иметь следующую структуру: В одном воплощении изобретения в указанных структурах R является водородом. В одном воплощении изобретения в указанных структурах X является Примеры R1 включают- 11020578 В некоторых вариантах воплощения R2 выбран из арила и гетероарила. Примеры R2 включают В одном воплощении изобретения соединение общей формулы (I) выбирают из или его соли. В другом варианте воплощения настоящего изобретения соединение, представленное структурной формулой II или его соли. Соединения по настоящему изобретению, включающие новые соединения по настоящему изобретению, также можно использовать в способах, описанных в настоящей заявке. Соединения и их соли, описанные в настоящей заявке, также могут образовывать их соответствующие гидраты (например, полугидрат, моногидрат, дигидрат, тригидрат, тетрагидрат) и сольваты. Подходящие растворители для получения сольватов и гидратов, как правило, может выбрать специалист в данной области. Соединения и их соли могут присутствовать в аморфной или кристаллической (включая кокристаллическую и полиморфную) формы. Сиртуин-модулирующие соединения по настоящему изобретению успешно модулируют уровень и/или активность белка сиртуина, в частности, деацетилазную активность белка сиртуина. Отдельно или в дополнение к указанным выше свойствам, некоторые сиртуин-модулирующие соединения по настоящему изобретению, по существу, не обладают одной или несколькими из следующих активностей: ингибирование Р 13-киназы, ингибирование альдоредуктазы, ингибирование тирозиновой киназы, трансактивация EGFR тирозиновой киназы, коронарная дилатация или спазмолитическая активность, при концентрациях соединения, которые являются эффективными для модулирования деацетилирующей активности белка сиртуина (например, такого как SIRT1 и/или SIRT3 белок). Термин "гетероцикл" или "гетероциклический" означает кольцевые системы, включающие один или несколько гетероатомов, выбранных из, например, N, О и S атомов, и включает 4-7 членные моноциклические и 8-12-членные бициклические кольца, а также спиро-конденсированные и связанные мостиковой связью полициклические кольцевые системы, где моноциклическое кольцо и каждое из бициклических колец независимо выбраны из насыщенного, ненасыщенного или ароматического колец. Когда гетероцикл является полициклическим, должно быть понятно, что необходимо, чтобы только одно кольцо содержало гетероатом. Если не указано иное, гетероцикл необязательно замещен одной или несколькими группами заместителей, выбранными из галогена, -CN, C1-C3 алкила, С 1-С 2 фторзамещенного алкила, -О-(C1-C2) фторзамещенного алкила, -О-(С 1-С 3) алкила, -S-(C1-C3) алкила, -S-(C1-C2) фторзамещенного алкила, гидроксила, амино, -NH-(C1-C3) алкила и -N-(C1-C3)2 алкила. Моноциклические кольца включают 5-7-членный арил или гетероарил, 3-7-членный циклоалкил и 5-7-членный неароматический гетероциклил. Моноциклические кольца необязательно замещены одной или несколькими группами заместителей, выбранных из галогена, циано, низшего алкокси, низшего алкила, гидроксила, амино, низшего алкиламино и низшего диалкиламино. Примеры моноциклических групп включают замещенные и незамещенные гетероциклы и карбоциклы. Конкретные моноциклические группы включают тиазолил, оксазолил, оксазинил, тиазинил, дитианил, диоксанил, изоксазолил,изотиазолил, триазолил, фуранил, тетрагидрофуранил, дигидрофуранил, пиранил, тетразолил, пиразолил,пиразинил, пиридазинил, имидазолил, пиридинил, пирролил, дигидропирролил, пирролидинил, пиперидинил, пиперазинил, пиримидинил, морфолинил, тетрагидротиофенил, тиофенил, циклогексил, циклопентил, циклопропил, циклобутил, циклогептанил, азетидинил, оксетанил, тииранил, оксиранил, азиридинил и тиоморфолинил. Ароматические (арильные) группы включают карбоциклические ароматические группы, такие как фенил, нафтил и антрацил, и гетероарильные группы, такие как имидазолил, тиенил, фурил, пиридил,пиримидил, пиранил, пиразолил, пирролил, пиразинил, тиазолил, оксазолил и тетразолил. Ароматические группы также включают конденсированные полициклические ароматические коль- 15020578 цевые системы, в которых карбоциклическое ароматическое кольцо или гетероарильное кольцо является конденсированным с одним или несколькими другими гетероарильными кольцами. Примеры включают бензотиенил, бензофурил, индолил, хинолинил, бензотиазол, бензоксазол, бензимидазол, хинолинил, изохинолинил и изоиндолил. Фторзамещенный включает от одного фтор-заместителя до перфторзамещения. Примеры фторзамещенного С 1-С 2 алкила включают -CFH2, CF2H, -CF3, -CH2CH2F, -CH2CHF2, -CHFCH3, -CF2CHF2. Перфторзамещенный C1-C2 алкил, например, включает -CF3 и -CF2CF3. Подходящие заместители в группах, указанных как являющиеся замещенными или незамещенными, представляют собой такие, которые, по существу, не оказывают вмешательства в способность раскрываемого соединения обладать одним или несколькими свойствами, раскрытыми в настоящей заявке. Заместитель, по существу, мешает таким свойствам соединения, когда цифровой показатель этого свойства снижается больше чем на около 50% в соединении с заместителем по сравнению с соединением без заместителя. Комбинации заместителей и переменных, предусматриваемые настоящим изобретением, представляют собой только такие комбинации, которые приводят к образованию стабильных соединений. Как он используется в настоящей заявке, термин "стабильный" относится к соединениям, которые обладают стабильностью, достаточной для возможности их промышленного получения и которая поддерживает целостность соединения в течение периода времени, достаточного для того, чтобы соединение было полезным для целей, подробно описанных в настоящей заявке. Также в настоящее изобретение включены соли, в частности, фармацевтически приемлемые соли,сиртуин-модулирующих соединений, описанных в настоящей заявке. Соединения по настоящему изобретению, которые содержат достаточно кислотные, достаточно основные или и те и другие функциональные группы, могут взаимодействовать с любым из широкого ряда неорганических оснований и неорганических и органических кислот с образованием соли. Альтернативно, соединения, которые имеют присущий им заряд, такие как соединения с четвертичным азотом, могут образовывать соль с подходящим противоионом (например, галогенид, такой как бромид, хлорид или фторид, в частности, бромид). Кислоты, обычно используемые для образования кислотно-аддитивных солей, представляют собой неорганические кислоты, такие как хлористоводородная кислота, бромистоводородная кислота, иодистоводородная кислота, серная кислота, фосфорная кислота и подобные, и органические кислоты, такие как п-толуолсульфоновая кислота, метансульфоновая кислота, щавелевая кислота, п-бромфенилсульфоновая кислота, угольная кислота, янтарная кислота, лимонная кислота, бензойная кислота, уксусная кислота и подобные. Примеры таких солей включают сульфат, пиросульфат, бисульфат, сульфит, бисульфит, фосфат, вторичный кислый фосфат, первичный кислый фосфат, метафосфат, пирофосфат, хлорид, бромид,иодид, ацетат, пропионат, деканоат, каприлат, акрилат, формиат, изобутират, капроат, гептаноат, пропиолат, оксалат, малонат, сукцинат, суберат, себацат, фумарат, малеат, бутин-1,4-диоат, гексин-1,6 диоат, бензоат, хлорбензоат, метилбензоат, динитробензоат, гидроксибензоат, метоксибензоат, фталат,сульфонат, ксилолсульфонат, фенилацетат, фенилпропионат, фенилбутират, цитрат, лактат, гаммагидроксибутират, гликолят, тартрат, метансульфонат, пропансульфонат, нафталин-1-сульфонат, нафталин-2-сульфонат, манделат и подобные. Основно-аддитивные соли включают соли, образованные из неорганических оснований, таких как гидроксиды, карбонаты, бикарбонаты аммония или щелочных или щелочно-земельных металлов и подобные. Такие основания, полезные для получения солей по настоящему изобретению, таким образом,включают гидроксид натрия, гидроксид калия, гидроксид аммония, карбонат калия и подобные. В соответствии с другим вариантом воплощения, настоящее изобретение обеспечивает способы получения определенных выше сиртуин-модулирующих соединений. Соединения могут быть синтезированы с использованием традиционных способов. Выгодным образом, эти соединения удобным образом синтезируют из легко доступных исходных веществ. Синтетические химические преобразования и процедуры, полезные для синтеза сиртуинмодулирующих соединений, описанных в настоящей заявке, известны из уровня техники и включают,например, такие, которые описаны в R. Larock, Comprehensive Organic Transformations (1989); Т. W.Organic Synthesis (1995). В иллюстративном варианте воплощения сиртуин-модулирующее соединение может пересекать цитоплазматические мембраны клеток. Например, соединение может обладать способностью проникновения в клетку по меньшей мере около 20, 50, 75, 80, 90 или 95%. Сиртуин-модулирующие соединения, описанные в настоящей заявке, также могут иметь одну или несколько из следующих характеристик: соединение может быть, по существу, нетоксичным для клетки или субъекта; сиртуин-модулирующее соединение может представлять собой органическую молекулу или малую молекулу 2000 amu (атомных единиц массы) или меньше, 1000 amu или меньше; соединение может иметь период полужизни в нормальных атмосферных условиях по меньшей мере около 30 дней,60 дней, 120 дней, 6 месяцев или 1 год; соединение может иметь период полужизни в растворе по мень- 16020578 шей мере около 30 дней, 60 дней, 120 дней, 6 месяцев или 1 год; сиртуин-модулирующее соединение может быть более стабильным в растворе, чем ресвератрол, по меньшей мере на около 50%, в 2 раза, 5 раз, 10 раз, 30 раз, 50 раз или 100 раз; сиртуин-модулирующее соединение может способствовать деацетилированию фактора ДНК-репарации Ku70; сиртуин-модулирующее соединение может способствовать деацетилированию RelA/p65; соединение может повышать общие скорости обмена и усиливать чувствительность клеток к TNF-индуцированному апоптозу. В некоторых вариантах воплощения сиртуин-модулирующее соединение не обладает какой-либо существенной способностью ингибирования гистондеацетилазы (HDACs) класса I, HDAC класса II илиHDAC I и II при концентрациях (например, in vivo), эффективных для модулирования деацетилазной активности сиртуина. Например, в предпочтительных вариантах воплощения сиртуин-модулирующее соединение представляет собой сиртуин-активирующее соединение, и оно выбрано таким образом, чтобы его значение ЕС 50 для активирования деацетилазной активности сиртуина было по меньшей мере в 5 раз меньше, чем значение ЕС 50 для ингибирования HDAC I и/или HDAC II, и еще более предпочтительно по меньшей мере в 10 раз, в 100 раз или даже в 1000 раз меньше. Способы анализа HDAC I и/или HDACII активности хорошо известны из уровня техники, и наборы для осуществления таких анализов могут быть коммерчески доступными (см., например, BioVision, Inc. (Mountain View, CA; world wide web atbiovision.com) и Thomas Scientific (Swedesboro, NJ; world wide web at tomassci.com). В некоторых вариантах воплощения сиртуин-модулирующее соединение не обладает какой-либо существенной способностью модулирования гомологов сиртуина. В одном варианте воплощения активатор человеческого белка сиртуина может не обладать какой-либо существенной способностью активировать сиртуиновый белок низших эукариот, в частности, дрожжей или человеческих патогенов, при концентрациях (например, in vivo), эффективных для активирования деацетилазной активности человеческого сиртуина. Например, сиртуин-активирующее соединение может быть выбрано таким образом, чтобы его значение ЕС 50 для активирования деацетилазной активности человеческого сиртуина, такого какSIRT1 и/или SIRT3, было по меньшей мере в 5 раз меньше, чем значение ЕС 50 для активирования сиртуин дрожжей, такого как Sir2 (такого как Candida, S. cerevisiae и т.д.), и еще более предпочтительно по меньшей мере в 10 раз, в 100 раз или даже в 1000 раз меньше. В другом варианте воплощения ингибитор белка сиртуина низших эукариот, в частности дрожжей или человеческих патогенов, не обладает какойлибо существенной способностью ингибирования сиртуинового белка человека при концентрациях (например, in vivo), эффективных для ингибирования деацетилазной активности белка сиртуина низших эукариот. Например, сиртуин-ингибирующее соединение может быть выбрано таким образом, чтобы его значение ИК 50 для ингибирования деацетилазной активности человеческого сиртуина, такого как SIRT1 и/или SIRT3, было по меньшей мере в 5 раз меньше, чем значение ИК 50 для ингибирования сиртуина дрожжей, такого как Sir2 (такого как Candida, S. cerevisiae и т.д.), и еще более предпочтительно по меньшей мере в 10 раз, в 100 раз или даже в 1000 раз меньше. В некоторых вариантах воплощения сиртуин-модулирующее соединение может обладать способностью модулирования одного или нескольких гомологов белка сиртуина, например, одного или нескольких человеческих SIRT1, SIRT2, SIRT3, SIRT4, SIRT5, SIRT6 или SIRT7. В одном варианте воплощения сиртуин-модулирующее соединение обладает способностью модулирования как SIRT1, так и SIRT3 белка. В других вариантах воплощения модулятор SIRT1 не обладает какой-либо существенной способностью модулирования других гомологов белка сиртуина, например, одного или нескольких человеческихSIRT2, SIRT3, SIRT4, SIRT5, SIRT6 или SIRT7, при концентрациях (например, in vivo), эффективных для модулирования деацетилазной активности человеческого SIRT1. Например, сиртуин-модулирующее соединение может быть выбрано таким образом, чтобы его значение ED50 для модулирования деацетилазной активности человеческого SIRT1 было по меньшей мере в 5 раз меньше, чем значение ED50 для модулирования одного или нескольких человеческих SIRT2, SIRT3, SIRT4, SIRT5, SIRT6 или SIRT7, и еще более предпочтительно по меньшей мере в 10 раз, в 100 раз или даже в 1000 раз меньше. В одном варианте воплощения модулятор SIRT1 не обладает какой-либо существенной способностью модулированияSIRT3 белка. В других вариантах воплощения модулятор SIRT3 не обладает какой-либо существенной способностью модулирования других гомологов белка сиртуина, например, одного или несколько человеческихSIRT1, SIRT2, SIRT4, SIRT5, SIRT6 или SIRT7, при концентрациях (например, in vivo), эффективных для модулирования деацетилазной активности человеческого SIRT3. Например, сиртуин-модулирующее соединение может быть выбрано таким образом, чтобы его значение ED50 для модулирования деацетилазной активности человеческого SIRT3 было по меньшей мере в 5 раз меньше, чем значение ED50 для модулирования одного или нескольких человеческих SIRT1, SIRT2, SIRT4, SIRT5, SIRT6 или SIRT7, и еще более предпочтительно по меньшей мере в 10 раз, в 100 раз или даже в 1000 раз меньше. В одном варианте воплощения модулятор SIRT3 не обладает какой-либо существенной способностью модулированияSIRT1 белка. В некоторых вариантах воплощения сиртуин-модулирующее соединение может иметь сродство связывания в отношении белка сиртуина около 10-9 М, 10-10 М, 10-11M, 10-12M или меньше. Сиртуин- 17020578 модулирующее соединение может снижать (активатор) или повышать (ингибитор) кажущийся Km белка сиртуина в отношении его субстрата или NAD+ (или другого ко-фактора) по меньшей мере примерно в 2, 3, 4, 5, 10, 20, 30, 50 или 100 раз. В некоторых вариантах воплощения Km значения определяют с использованием масс-спектрометрического анализа, описанного в настоящей заявке. Предпочтительные активирующие соединения снижают Km сиртуина в отношении его субстрата или ко-фактора в большей степени, чем ресвератрол при такой же концентрации, или снижают Km сиртуина в отношении его субстрата или ко-фактора аналогичнго тому, как это достигается с использованием ресвератрола, при более низкой концентрации. Сиртуин-модулирующее соединение может повышатьVmax белка по меньшей мере примерно в 2, 3, 4, 5, 10, 20, 30, 50 или 100 раз. Сиртуин-модулирующее соединение может иметь значение ED50 для модулирования деацетилазной активности SIRT1 и/илиSIRT3 белка меньше чем около 1 нМ, меньше чем около 10 нМ, меньше чем около 100 нМ, меньше чем около 1 мкМ, меньше чем около 10 мкМ, меньше чем около 100 мкМ, или от около 1-10 нМ, от около 10100 нМ, от около 0,1-1 мкМ, от около 1-10 мкМ или от около 10-100 мкМ. Сиртуин-модулирующее соединение может модулировать деацетилазную активность SIRT1 и/или SIRT3 белка по меньшей мере примерно в 5, 10, 20, 30, 50 или 100 раз, как определено в клеточном анализе или в анализе на основе клетки. Сиртуин-активирующее соединение может вызывать по меньшей мере примерно на 10%, 30%,50%, 80%, в 2 раза, 5 раз, 10 раз, 50 раз или 100 раз большую индукцию деацетилазной активности белка сиртуина по сравнению с такой же концентрацией ресвератрола. Сиртуин-модулирующее соединение может иметь значение ED50 для модулирования SIRT5 больше по меньшей мере примерно в 10 раз, 20 раз, 30 раз, 50 раз или более, чем для модулирования SIRT1 и/или SIRT3. 3. Примеры применения В некоторых аспектах настоящее изобретение обеспечивает способы для модулирования уровня и/или активности белка сиртуина и способы их применения. В некоторых вариантах воплощения настоящее изобретение обеспечивает способы применения сиртуин-модулирующих соединений, где сиртуин-модулирующие соединения активируют белок сиртуина, например, повышают уровень и/или активность белка сиртуина. Сиртуин-модулирующие соединения, которые повышают уровень и/или активность белка сиртуина, могут быть полезными для различных терапевтических применений, включая, например, в лечении страдающего от или чувствительный к резистентности к инсулину, метаболического синдрома, диабета или его осложнений, или повышения чувствительности к инсулину у субъекта. Способы включают введение субъекту, нуждающемуся в этом,фармацевтически эффективного количества сиртуин-модулирующего соединения, например, сиртуинактивирующего соединения. Хотя авторы настоящего изобретения не желают быть связанными теорией, считается, что активаторы по настоящему изобретению могут взаимодействовать с сиртуином в одном и том же местоположении в белке сиртуина (например, активный сайт или сайт, влияющий на Km или Vmax активного сайта). Считается, что это является причиной, почему некоторые классы активаторов и ингибиторов сиртуина могут иметь существенное структурное сходство. Сиртуин-модулирующие соединения, описанные в настоящей заявке, могут быть взяты отдельно или в сочетании с другими соединениями. Смесь двух или более сиртуин-модулирующих соединений можно вводить субъекту, нуждающемуся в этом. Сиртуин-модулирующее соединение, которое повышает уровень и/или активность белка сиртуина, можно вводить с одним или несколькими из следующих соединений: ресвератрол, бутеин, фисетин, пицеатаннол или кверцетин. Сиртуин-модулирующее соединение, которое повышает уровень и/или активность белка сиртуина, можно вводить в сочетании с никотиновой кислотой. Также сиртуин-модулирующее соединение, которое снижает уровень и/или активность белка сиртуина, можно вводить с одним или несколькими из следующих соединений: никотинамид (NAM), сурамин; NF023 (антагонист Gбелка); NF279 (антагонист пуринергического рецептора); тролокс (6-гидрокси-2,5,7,8,тетраметилхроман-2 карбоновая кислота); (-)-эпигаллокатехин (гидрокси на участках 3,5,7,3',4',5'); (-)-эпигаллокатехин галлат(гидрокси на участках 5,7,3',4',5' и галлатный сложный эфир на участке 3); цианидин хлорид (3,5,7,3',4'пентагидроксифлавилий хлорид); делфинидин хлорид (3,5,7,3',4',5'-гексагидроксифлавилий хлорид); мирицетин (каннабисцетин; 3,5,7,3',4',5'-гексагидроксифлавон); 3,7,3',4',5'-пентагидроксифлавон; госсипетин(3,5,7,8,3',4'-гексагидроксифлавон), сиртинол и сплитомицин. В различных вариантах воплощения комбинированные терапии, включающие сиртуин-модулирующее соединение, могут относиться к (1) фармацевтическим композициям, которые включают одно или несколько сиртуин-модулирующих соединений в сочетании с одним или несколькими терапевтическими средствами (например, одним или несколькими терапевтическими средствами, описанными в настоящей заявке); и (2) совместное введение одного или нескольких сиртуинмодулирующих соединений с одним или несколькими терапевтическими средствами, где сиртуинмодулирующее соединение и терапевтическое средство не были сформулированы в одну и ту же композицию(но могут присутствовать в одном и том же наборе или упаковке, такой как блистерная упаковка или другая многокамерная упаковка; соединенные, отдельно запаянные контейнеры (например, мешочки из фольги),которые может отделять сам потребитель; или набор, где сиртуин модулирующее соединение(соединения) и другое терапевтическое средство(средства) находятся в отдельных емкостях). Когда используют отдельные композиции, сиртуин-модулирующее соединение можно вводить одновременно с введением другого терапевтического средства, с перерывами, ступенчато, до, после, или используя сочетания таких способов. В некоторых вариантах воплощения способы снижения тяжести, профилактики или лечения заболеваний или расстройств с использованием сиртуин-модулирующего соединения также могут включать повышение уровня белка сиртуина, такого как человеческий SIRT1, SIRT2 и/или SIRT3 или их гомологи. Повышение уровней белка достигается путем введения в клетку одной или нескольких копий нуклеиновой кислоты, которая кодирует сиртуин. Например, уровень сиртуина можно увеличить в клетке млекопитающего путем введения в клетку млекопитающего нуклеиновой кислоты, кодирующей сиртуин, например, повышение уровня SIRT1 путем введения нуклеиновой кислоты, кодирующей аминокислотную последовательность, представленную под номером доступа GenBankNP036370, и/или повышение уровня SIRT3 путем введения нуклеиновой кислоты, кодирующей аминокислотную последовательность,представленную под номером доступа GenBankААН 01042. Нуклеиновая кислота, которую вводят в клетку для повышения уровня белка сиртуина, может кодировать белок, который является по меньшей мере на около 80, 85, 90, 95, 98 или 99% идентичным последовательности сиртуина, например, SIRT1 и/или SIRT3 белок. Например, нуклеиновая кислота, кодирующая белок, может быть по меньшей мере на около 80, 85, 90, 95, 98 или 99% идентичной нуклеиновой кислоте, кодирующей SIRT1 (например, номер доступа GenBankNM12238) и/или SIRT3 (например, номер доступа GenBankВС 001042) белок. Нуклеиновая кислота также может представлять собой нуклеиновую кислоту, которая гибридизуется, предпочтительно в жестких условиях гибридизации, с нуклеиновой кислотой, кодирующей сиртуин дикого типа, например, SIRT1 и/или SIRT3 белок. Жесткие условия гибридизации могут включать гибридизацию и промывку в 0,2SSC при 65 С. Когда используют нуклеиновую кислоту, которая кодирует белок, который является отличным от белка сиртуина дикого типа, такой как белок, который представляет собой фрагмент сиртуина дикого типа, этот белок, предпочтительно, является биологически активным, например, является способным к деацетилированию. Необходимо только экспрессировать в клетке часть сиртуина, который является биологически активным. Например, белок, который отличается от SIRT1 дикого типа, имеющего номер доступа GenBankNP036370, предпочтительно содержит структуру его ядра. Структура ядра иногда относится к аминокислотам 62-293 с номером доступа GenBankNP036370, которые кодируются нуклеотидами 237-932 с номером доступа GenBankнМ 012238, который охватывает NAD-связывающий, а также субстратсвязывающий домены. Домен ядра SIRT1 также может относиться к области аминокислот от 261 до 447 с номером доступа GenBankNP036370, которые кодируются нуклеотидами 834-1394 с номером доступа GenBankнМ 012238; к области аминокислот от 242 до 493 с номером доступа GenBankNP036370, которые кодируются нуклеотидами 777-1532 с номером доступа GenBankнМ 012238; или к области аминокислот от 254 до 495 с номером доступа GenBankNP036370, которые кодируются нуклеотидами 813-1538 с номером доступа GenBankNM012238. Сохраняет ли белок биологическую функцию, например, способность к деацетилированию, можно определить в соответствии со способами, известными из уровня техники. В некоторых вариантах воплощения, способы снижения тяжести, профилактики или лечения заболеваний или расстройств с использованием сиртуин-модулирующего соединения также могут включать снижение уровня белка сиртуина, такого как человеческий SIRT1, SIRT2 и/или SIRT3 или его гомологи. Снижение уровня белка сиртуина достигается в соответствии с способами, известными из уровня техники. Например, siRNA, антисмысловая нуклеиновая кислота или рибозим, мишенью которых является сиртуин, могут экспрессироваться в клетке. Доминантный отрицательный сиртуиновый мутант, например, мутант, который не способен к деацетилированию, также можно использовать. Например, можно использовать мутант H363Y белка SIRT1, описанный, например, в Luo et al. (2001) Cell 107:137. Альтернативно, можно использовать средства, которые ингибируют транскрипцию. Способы модулирования уровней белка сиртуина также включают способы модулирования транскрипции генов, кодирующих сиртуины, способы стабилизации/дестабилизации соответствующих mPHK и другие способы, известные из уровня техники. Метаболические расстройства/диабет В другом аспекте сиртуин-модулирующие соединения, которые повышают уровень и/или активность белка сиртуина, можно использовать для лечения или профилактики метаболического расстройства, такого как резистентность к инсулину, преддиабетическое состояние, диабет типа II и/или их осложнения. Введение сиртуин-модулирующего соединения, которое повышает уровень и/или активность белка сиртуина, может повысить чувствительность к инсулину и/или понизить уровни инсулина у субъекта. Субъект, нуждающийся в таком лечении, может быть субъектом, у которого имеется резистентность к инсулину или другой предшествующий симптом диабета типа II, который страдает диабетом типа II или у которого имеется предрасположенность к развитию любого из этих состояний. Например,субъект может быть субъектом, у которого имеется резистентность к инсулину, например, высокие уровни циркуляции инсулина и/или связанные с этим состояния, такие как гиперлипидемия, дислипогенез, гиперхолестеринемия, нарушенная толерантность к глюкозе, высокий уровень глюкозного сахара в крови, другие проявления синдрома X, гипертензия, атеросклероз и липодистрофия. В иллюстративном варианте воплощения сиртуин-модулирующие соединения, которые повышают уровень и/или активность белка сиртуина, можно вводить в виде комбинированной терапии для лечения или профилактики метаболического расстройства. Например, одно или несколько сиртуинмодулирующих соединений, которые повышают уровень и/или активность белка сиртуина, можно вводить в сочетании с одним или несколькими анти-диабетическими средствами. Глазные расстройства Один аспект настоящего изобретения представляет собой способ ингибирования, уменьшения или иным образом лечения ухудшения зрения путем введения пациенту терапевтической дозы модулятора сиртуина, выбранного из соединения, раскрытого в настоящей заявке, или его фармацевтически приемлемой соли, пролекарства или метаболического производного. В некоторых аспектах настоящего изобретения ухудшение зрения вызвано повреждением сетчатки. В конкретных вариантах воплощения повреждение сетчатки вызвано нарушением притока крови к глазу(например, артериосклероз, васкулит). Примеры заболеваний сетчатки включают диабетический макулярный отек, ретинопатию на фоне диабета, пролиферативную диабетическую ретинопатию. Соединения настоящего изобретения могут быть полезны в ингибировании, принимающего лечение химиотерапевтическим лекарственным средством (например, нейротоксичным лекарственным средством, лекарственным средством, которое повышает внутриглазное давление, таким как стероид), путем введения субъекту, нажудающемуся в таком лечении, терапевтической дозы модулятора сиртуина, раскрытого в настоящей заявке. Модулятор сиртуина можно вводить в сочетании с терапией для лечения и/или профилактики CMV ретинопатии. 4. Анализы Соединения настоящей заявки могут использовать для скрининга для идентификации соединений или веществ, которые модулируют сиртуины. Вещество может представлять собой нуклеиновую кислоту, такую как аптамер. Анализы можно осуществлять в клеточном или не-клеточном формате. Например,анализ может включать инкубирование (или контактирование) сиртуина с испытываемым веществом в условиях, в которых сиртуин может модулироваться средством, известным как модулирующее сиртуин,и контроль или определение уровня модуляции сиртуина в присутствии испытываемого вещества по сравнению с отсутствием испытываемого вещества. Уровень модуляции сиртуина можно определить путем определения его способности к деацетилированию субстрата. Примеры субстратов включают ацетилированные пептиды, которые могут быть получены от BIOMOL (Plymouth Meeting, PA). Предпочтительные субстраты включают пептиды р 53, такие как включающие ацетилированный К 382. Особенно предпочтительным субстратом является Fluor de Lys-SIRT1 (BIOMOL), т.е. ацетилированный пептидArg-His-Lys-Lys. Другими субстратами являются пептиды из человеческих гистонов Н 3 и Н 4 или ацетилированная аминокислота. Субстраты могут быть флуорогенными. Сиртуин может представлять собойSIRT1, SIR2, SIRT3 или его часть. Например, рекомбинантный SIRT1 может быть получен от BIOMOL. Реакцию можно осуществлять в течение около 30 мин и останавливать, например, при помощи никотинамида. Анализ флуоресцентной активности HDAC/набор для определения лекарственного средства(АК-500, BIOMOL Research Laboratories) можно использовать для определения уровня ацетилирования. Подобные анализы описаны в Bitterman et al. (2002) J. Biol. Chem. 277:45099. Уровень модуляции сиртуина в анализе можно сравнить с уровнем модуляции сиртуина в присутствии одного или нескольких (отдельно или одновременно) соединений, описанных в настоящей заявке, которые могут служить в качестве положительного или отрицательного контролей. Сиртуины для использования в этих анализах могут представлять собой непроцессированные сиртуиновые белки или их части. Поскольку в настоящей заявке было показано, что активирующие соединения, как оказалось, взаимодействуют с N-концомSIRT1, белки для использования в анализах включают N-концевые части сиртуинов, например, область аминокислот 1-176 или 1-255 SIRT1; область аминокислот 1-174 или 1-252 Sir2. Скрининговый анализ включает (i) контактирование сиртуина с испытываемым веществом и ацетилированным субстратом в условиях, подходящих для деацетилирования субстрата сиртуином в отсутствие испытываемого вещества; и (ii) определение уровня ацетилирования субстрата, где более низкий уровень ацетилирования субстрата в присутствии испытываемого вещества по сравнению с отсутствием испытываемого вещества показывает, что испытываемое вещество стимулирует деацетилирование сиртуином, тогда как более высокий уровень ацетилирования субстрата в присутствии испытываемого вещества по сравнению с отсутствием испытываемого вещества показывает, что испытываемое вещество ингибирует деацетилирование сиртуином. Способы идентификации средства, которое модулирует, например, стимулирует, сиртуины in vivo,могут включать (i) контактирование клетки с испытываемым веществом и субстратом, который способен проникать в клетку в присутствии ингибитора класса I и класса II HDACs в условиях, подходящих для деацетилирования субстрата сиртуином в отсутствие испытываемого вещества; и (ii) определение уровня ацетилирования субстрата, где более низкий уровень ацетилирования субстрата в присутствии испытываемого вещества по сравнению с отсутствием испытываемого вещества показывает, что испытываемое вещество стимулирует деацетилирование сиртуином, тогда как более высокий уровень ацетилирования субстрата в присутствии испытываемого вещества по сравнению с отсутствием испытываемого вещества показывает, что испытываемое вещество ингибирует деацетилирование сиртуином. Предпочтительным субстратом является ацетилированный пептид, который также предпочтительно является флуорогенными, как описано далее в настоящей заявке. Способ, кроме того, может включать лизис клетки для определения уровня ацетилирования субстрата. Субстраты могут быть добавлены к клеткам в концентрации в пределах от около 1 мкМ до около 10 мМ, предпочтительно от около 10 мкМ до 1 мМ, еще более предпочтительно от около 100 мкМ до 1 мМ, такой как около 200 мкМ. Предпочтительный субстрат представляет собой ацетилированный лизин, например, -ацетиллизин (Fluor de Lys, FdL) или Fluor de LysSIRTl. Предпочтительный ингибитор класса I и класса II HDACs представляет собой трихостатин A(TSA), который можно использовать при концентрациях в пределах от около 0,01 до 100 мкМ, предпочтительно от около 0,1 до 10 мкМ, такой как 1 мкМ. Инкубацию клеток с испытываемым соединением и субстратом можно осуществлять в течение времени от около 10 мин до 5 ч, предпочтительно около 1-3 ч. Поскольку TSA ингибирует все HDACs класса I и класса II и поскольку некоторые субстраты, например,Fluor de Lys, являются плохим субстратом для SIRT2 и еще худшим субстратом для SIRT3-7, такой анализ можно использовать для идентификации модуляторов SIRT1 in vivo. 5. Фармацевтические композиции Сиртуин-модулирующие соединения, описанные в настоящей заявке, можно формулировать в композицию традиционным способом с использованием одного или нескольких физиологически или фармацевтически приемлемых носителей или эксципиентов. Например, сиртуин-модулирующие соединения и их фармацевтически приемлемые соли и сольваты могут быть сформулированы для введения, например,путем инъекции (например, подкожной (п/к), внутримышечной (в/м), интраперитонеальной (и/п, ингаляции или инсуффляции (либо через рот, либо через нос) или перорального, буккального, сублингвального, чрескожного, назального, парентерального или ректального введения. В одном варианте воплощения, сиртуин-модулирующее соединение можно вводить местно, на участок, где присутствуют целевые клетки, т.е. в конкретную ткань, орган или жидкость организма (например, кровь, цереброспинальную жидкость и т.д.). Сиртуин-модулирующие соединения могут быть сформулированы для различных способов введения, включая системное и местное или локализованное введение. Способы и композиции можно найти вRemington's Pharmaceutical Sciences, Meade Publishing Co., Easton, PA. Для парентерального введения предпочтительными являются инъекции, включая внутримышечную, внутривенную, интраперитонеальную и подкожную. Для введения путем инъекции, соединения могут быть сформулированы в форме жидких растворов, предпочтительно в физиологически совместимых буферах, таких как раствор Хэнка или раствор Рингера. Кроме того, соединения могут быть сформулированы в твердую форму и снова растворены или суспендированы непосредственно перед использованием. Также включены лиофилизированные формы. Для перорального введения фармацевтические композиции могут быть в форме, например, таблеток, лепешек или капсул, полученных традиционными способами с использованием фармацевтически приемлемых эксципиентов, таких как связующие (например, предварительно желатинизированный кукурузный крахмал, поливинилпирролидон или гидроксипропилметилцеллюлоза) ; наполнителей (например, лактоза, микрокристаллическая целлюлоза или вторичный кислый фосфат кальция) ; смазывающих веществ (например, стеарат магния, тальк или диоксид кремния); разрыхлителей (например, картофельный крахмал или натрийкрахмалгликолят); или смачивающих веществ (например, лаурилсульфат натрия). Таблетки могут иметь покрытие, нанесенное способами, хорошо известными из уровня техники. Жидкие препараты для перорального введения могут быть в форме, например, растворов, сиропов или суспензий, или они могут быть представлены в виде сухого продукта для реструктурирования водой или другим подходящим носителем перед применением. Такие жидкие препараты могут быть получены традиционными способами с использованием фармацевтически приемлемых добавок, таких как суспендирующие вещества (например, сироп сорбита, производные целлюлозы или гидрогенизированные пищевые жиры); эмульгаторов (например, лецитин или аравийская камедь); неводных носителей (например,миндальное масло, масляные сложные эфиры, этиловый спирт или фракционированные растительные масла); и консервантов (например, метил- или пропил-п-гидроксибензоаты или сорбиновая кислота). Препараты также могут содержать буферные соли, отдушки, красители и подсластители, если это является подходящим. Препараты для перорального введения могут быть соответствующим образом сформулированы для получения контролируемого высвобождения активного соединения. Для введения путем ингаляции (например, для доставки в легкие) доставку сиртуин-модулирующих соединений удобным образом можно осуществить при помощи аэрозольного спрея из находящихся под давлением упаковок или распылителя, с использованием подходящего пропеллента, например, дихлордифторметана, трихлорфторметана, дихлортетрафторэтана, диоксида углерода или другого подходящего газа. В случае находящегося под давлением аэрозольного препарата, единицу дозирования можно определять путем обеспечения клапана для доставки отмеренного количества. Капсулы и картриджи, например, из желатина для использования в ингаляторе или инсуффляторе могут быть сформулированы таким образом, чтобы они содержали порошкообразную смесь соединения и подходящей основы для порошка,такой как лактоза или крахмал. Сиртуин-модулирующие соединения могут быть сформулированы для парентерального введения путем инъекции, например, болюсной инъекции или непрерывной инфузии. Композиции для инъекций могут быть представлены в стандартной лекарственной форме, например, в ампулах или многодозовых контейнерах, с добавлением консерванта. Композиции могут быть в такой форме как суспензии, растворы или эмульсии в масляных или водных носителях и могут содержать агенты для формулирования, такие как суспендирующие, стабилизирующие и/или диспергирующие вещества. Альтернативно, активный ингредиент может быть в порошкообразной форме для соединения с подходящим носителем, например,стерильной апирогенной водой, перед применением. Сиртуин-модулирующие соединения также могут быть сформулированы в ректальные композиции,такие как суппозитории или удерживаемые клизьмы, например, содержащие традиционные основы для суппозиторий, такие как масло какао или другие глицериды. Помимо композиций, описанных выше, сиртуин-модулирующие соединения также могут быть сформулированы в виде депо препарата. Такие долгодействующие композиции можно вводить путем имплантации (например, подкожно или внутримышечно) или путем внутримышечной инъекции. Таким образом, например, сиртуин-модулирующие соединения могут быть сформулированы с подходящими полимерными или гидрофобными веществами (например, в виде эмульсии в приемлемом масле), или ионообменными смолами, или в виде плохо растворимых производных, например, в виде плохо растворимой соли. Формула контролируемого высвобождения также включает пластыри. Липосомы представляют собой еще одну систему доставки лекарственного средства, которое легко вводится путем инъекции. Соответственно, в способе по настоящему изобретению активные соединения также можно вводить в форме липосомной системы доставки. Липосомы хорошо известны специалистам в данной области. Липосомы могут быть образованы из различных фосфолипидов, таких как холестерин,стеариламин фосфатидилхолинов. Липосомы, которые можно использовать в способе по настоящему изобретению охватывают все типы липосом, включая, но не ограничиваясь этим, малые однослойные везикулы, большие однослойные везикулы и многослойные везикулы. Другой путь получения композиции, в частности, раствора, модулятора сиртуина, такого как ресвератрол или его производное, включает использование циклодекстрина. Под циклодекстрином подразумевается -, - или -циклодекстрин. Циклодекстрины подробно описаны в Pitha et al., патент США 4727064, который включен в настоящую заявку посредством ссылки. Циклодекстрины представляют собой циклические олигомеры глюкозы; эти соединения образуют комплексы включения с любым лекарственным средством, молекула которого может подходить в липофильно-ищущие полости молекулы циклодекстрина. Быстро разлагаемые или растворимые лекарственные формы являются полезными для быстрой абсорбции, в частности, буккальной и сублигвальной абсорбции фармацевтически активных средств. Быстро плавящиеся лекарственные формы являются удобными для пациентов, таких как пациенты пожилого и детского возраста, для которых затруднительно проглатывание типичной твердой лекарственной формы, такой как лепешки и таблетки. Кроме того, у быстро плавящихся лекарственных форм отсутствуют недостатки, связанные, например, с лекарственными формами для жевания, где продолжительность времени, в течение которого активное вещество остается у пациента во рту, играет важную роль в определении количества маскирующего вкус вещества и степени, до которой пациент может отвергать по причине неприятного ощущения в горле активное вещество. Фармацевтические композиции (включая косметические препараты) могут включать от около 0,00001 до 100%, например, от 0,001 до 10% или от 0,1 до 5 мас.%, одного или нескольких сиртуин-модулирующих соединений, описанных в настоящей заявке. В другом варианте воплощения, фармацевтическая композиция включает: (i) от 0,05 до 1000 мг соединения по настоящему изобретению или его фармацевтически приемлемой соли и (ii) от 0,1 до 2 г одного или нескольких фармацевтически приемлемых эксципиентов. В одном варианте воплощения, сиртуин-модулирующее соединение, описанное в настоящей заявке,включено в композицию для местного применения, содержащую носитель местного применения, который, как правило, подходит для местного введения лекарственного средства, и включающий любое такое вещество, известное из уровня техники. Носитель местного применения можно выбрать таким образом,чтобы обеспечить композицию в желаемой форме, например, в форме мази, лосьона, крема, микроэмульсии, геля, масла, раствора или т.п., и может состоять из вещества либо природного, либо синтетического происхождения. Предпочтительно, чтобы выбранный носитель не оказывал вредного действия на активное вещество или другие компоненты композиции для местного применения. Примеры подходящих для местного применения носителей для использования в настоящей заявке включают воду, спирты и другие нетоксичные органические растворители, глицерин, минеральное масло, силикон, вазелин, ланолин, жирные кислоты, растительные масла, парабены, воски и подобные вещества. Композиции могут представлять собой бесцветные, не имеющие запаха мази, лосьоны, кремы, микроэмульсии, гели. Сиртуин-модулирующие соединения могут быть включены в мази, которые, как правило, представляют собой полутвердые препараты, в основе которых обычно вазелин или другие нефтепродукты. Специальная основа для мази, которую можно использовать, как должно быть понятно специалистам, представляет собой такую, которая может обеспечить оптимальную доставку лекарственного средства и,предпочтительно, может обеспечить также и дополнительные желаемые характеристики, например,смягчающие свойства или подобные. Что касается других носителей или наполнителей, основа для мази должна быть инертной, стабильной, нераздражающей и неощущаемой. Сиртуин-модулирующие соединения могут быть включены в лосьоны, которые, как правило, представляют собой препараты для нанесения на поверхность кожи без трения, и типично являются жидкими или полужидкими препаратами, в которых твердые частицы, включая активное вещество, присутствуют в водной или спиртовой основе. Лосьоны обычно представляют собой суспензии твердых частиц и могут включать жидкую масляную эмульсию типа масло-в-воде. Сиртуин-модулирующие соединения могут быть включены в кремы, которые, как правило, представляют собой вязкие жидкие или полутвердые эмульсии, либо масло-в-воде, либо вода-в-масле. Основы для крема являются водосмываемыми и содержат масляную фазу, эмульгатор и водную фазу. Масляная фаза, в основном, состоит из вазелина и жирного спирта, такого как цетиловый или стеариловый спирт; водная фаза обычно, хотя необязательно, превышает по объему масляную фазу и, как правило,содержит увлажнитель. Эмульгатор в композиции крема, как объясняется в указанном выше ссылочном документе Remington, как правило, представляет собой нетоксичное анионное, катионное или амфотерное поверхностно-активное вещество. Сиртуин-модулирующие соединения могут быть включены в микроэмульсии, которые, как правило, представляют собой термодинамически стабильные изотропно чистые дисперсии, состоящие из двух несмешивающихся жидкостей, таких как масло и вода, стабилизированных межфазной пленкой молекул поверхностно-активного вещества (Encyclopedia of Pharmaceutical Technology (New York: Marcel Dekker,1992), vol. 9). Сиртуин-модулирующие соединения могут быть включены в композиции гелей, которые, как правило, представляют собой полутвердые системы, состоящие либо из суспензий, образованных из небольших неорганических частиц (двухфазные системы), либо крупных органических молекул, распределенных, по существу, однородно в жидком носителе (однофазные гели). Хотя для гелей обычно используют водный жидкий носитель, спирты и масла также можно использовать в качестве жидкого носителя. Другие активные вещества также могут быть включены в композиции, например, другие противовоспалительные средства, анальгетики, противомикробные средства, противогрибковые средства, антибиотики, витамины, антиоксиданты и блокирующие солнечные лучи средства, обычно используемые в солцезащитных композициях, включая, но не ограничиваясь этим, антранилаты, бензофеноны (в частности, бензофенон-3), производные камфоры, циннаматы (например, октилметоксициннамат), дибензоилметаны (например, бутилметоксидибензоилметан), п-аминобензойную кислоту (РАВА) и ее производные и салицилаты (например, октилсалицилат). В некоторых композициях для местного применения активное вещество присутствует в количестве,которое находится в пределах приблизительно от 0,25 до 75 мас.%, в расчете на массу композиции,предпочтительно в пределах приблизительно от 0,25 до 30 мас.% в расчете на массу композиции, более предпочтительно в пределах приблизительно от 0,5 до 15 мас.% в расчете на массу композиции и наиболее предпочтительно в пределах приблизительно от 1,0 до 10 мас.% в расчете на массу композиции. Состояния глаза можно лечить или осуществлять профилактику, например, системно, местно, путем внутриглазной инъекции сиртуин-модулирующего соединения или путем введения устройства замедленного высвобождения, которое высвобождает сиртуин-модулирующее соединение. Сиртуинмодулирующее соединение, которое повышает уровень и/или активность белка сиртуина, может доставляться в фармацевтически приемлемом офтальмологическом носителе так, чтобы поддерживать контакт соединения с поверхностью глаза в течение достаточного периода времени, обеспечивая возможность пенетрации соединения в роговичную и внутреннюю области глаза, например, в переднюю камеру, заднюю камеру, стекловидное тело, водянистую влагу, эндолимфу, роговицу, радужную оболочку/ресничную область, хрусталик, сосудистую оболочку/сетчатку и склеру. Фармацевтически приемлемый офтальмологический носитель может, например, представлять собой мазь, растительное масло или инкапсулирующее вещество. Альтернативно, соединения по настоящему изобретению можно вводить при помощи инъекции непосредственно в эндолимфу или водянистую влагу глаза. Еще в одном альтернативном случае, соединения можно вводить системно, например, путем внутривенной инфузии или путем инъекции, для лечения глаза. Сиртуин-модулирующие соединения, описанные в настоящей заявке, можно хранить в среде без доступа кислорода. Например, ресвератрол или его аналог могут обеспечиваться в герметичной капсуле для перорального введения, такой как Capsugel от компании Pfizer, Inc. Клетки, например, которые были обработаны ex vivo сиртуин-модулирующим соединением, можно вводить в соответствии со способами, предусмотренными для введения трансплантата субъекту, которые могут сопровождаться, например, введением иммуносупрессанта, например, циклоспорина А. Общие принципы формулирования лекарственных средств можно найти в Cell Therapy: Stem CellUniversity Press, 1996; и Hematopoietic Stem Cell Therapy, E. D. Ball, J. ListerP. Law, Churchill Livingstone, 2000. Токсичность и терапевтическую эффективность сиртуин-модулирующих соединений можно определить с использованием стандартных фармацевтических процедур в клеточных культурах или с использованием экспериментальных животных. LD50 представляет собой дозу, летальную для 50% популяции.ED50 представляет собой дозу, терапевтически эффективную для 50% популяции. Отношение доз, вызывающих токсический и терапевтический эффекты (LD50/ED50) представляет собой терапевтический индекс. Сиртуин-модулирующие соединения, которые демонстрируют большие терапевтические индексы,являются предпочтительными. Хотя можно использовать сиртуин-модулирующие соединения, которые демонстрируют токсические побочные эффекты, необходимо принять меры предосторожности и разработать систему доставки, которая нацеливает такие соединения на участок пораженной ткани, чтобы свести к минимуму потенциальное повреждение непораженных клеток и, таким образом, уменьшить побочные эффекты. Данные, полученные в анализах клеточных культур и исследованиях на животных, можно использовать для формулирования ряда доз, предназначенных для человека. Доза таких соединений может находиться в пределах циркулирующих концентраций, которые включают ED50 с незначительной или полностью отсутствующей токсичностью. Доза может варьировать в этих пределах в зависимости от используемой лекарственной формы и используемого пути введения. Для любого соединения, терапевтически эффективную дозу изначально можно определить при помощи анализов клеточных культур. Доза может быть сформулирована в животных моделях для достижения пределов концентрации в плазме, которые включают значение ИК 50 (т.е. концентрация испытываемого соединения, при которой достигается полумаксимальное ингибирование симптомов), определенное в клеточной культуре. Такую информацию можно использовать для более точного определения полезных доз для человека. Уровни в плазме можно измерить, например, при помощи высокоэффективной жидкостной хроматографии. Также соединения настоящей заявки могут включаться в наборы, например, наборы для терапевтических целей. Набор может включать одно или несколько сиртуин-модулирующих соединений, например, в предварительно отмеренных дозах. Набор, необязательно, может включать устройства для контактирования клеток с соединениями и инструкции по применению. Устройства включают шприцы, стенты и другие устройства для введения сиртуин-модулирующего соединения субъекту (например, в кровеносный сосуд субъекта) или наложения его на кожу субъекта. В другом варианте воплощения, настоящее изобретение обеспечивает композицию вещества, включающую модулятор сиртуина по настоящему изобретению и другое терапевтическое средство (тех самых, которые используют в комбинированной терапии и комбинированных композициях) в отдельных лекарственных формах, но связанных друг с другом. Термин "связанные друг с другом", как он используется в настоящей заявке, означает, что отдельные лекарственные формы упакованы вместе или иным образом связаны друг с другом так, чтобы было понятно, что эти отдельные лекарственные формы продаются и предназначены для введения как часть одной схемы лечения. Такое средство и модулятор сиртуина предпочтительно упакованы вместе в блистерной упаковке или другой многокамерной упаковке,или в связанных между собой отдельно запаянных контейнерах (таких как мешочки из фольги или подобные), которые разделяются пользователем (например, отрываются по линии раздела между двумя контейнерами). Набор может представлять собой отдельные сосуды, включающие а) модулятор сиртуина по настоящему изобретению; и b) другое терапевтическое средство, такое как средства, указанные в настоящем описании. Для практического осуществления описанных способов используют, если не указано иное, традиционные процедуры клеточной биологии, клеточного культивирования, молекулярной биологии, трансгенной биологии, микробиологии, рекомбинантной ДНК и иммунологии, которые известны специалистам в данной области. Такие процедуры подробно объясняются в литературе (см., например, Molecular Примеры Настоящее изобретение, общее описание которого представлено выше, будет более понятно при ссылке на представленные ниже примеры, которые включены исключительно в целях иллюстрации некоторых аспектов и вариантов воплощения настоящего изобретения, и не предназначены для какоголибо ограничения настоящего изобретения. Пример 1. Общая процедура получения 2-(2-(трифторметил)фенил)-1 Н-бензо[d]имидазол-4-карбоновой кислоты (3) 2,3-Диаминобензойная кислота (1; 50 мг, 0,33 ммоль), 2-(трифторметил)бензальдегид (2; 57 мг, 0,33 ммоль) и метабисульфит натрия (Na2S2O5, 82 мг, 0,43 ммоль) поглощались в DMF (5 мл) и смесь перемешивали при 100 С в течение 17 ч. Реакционную смесь охлаждали до комнатной температуры и разбавляли при помощи H2O. Полученную смесь перемешивали при комнатной температуре в течение 1 ч и фильтровали. Собранные твердые вещества промывали водой и сушили с получением 2-(2-(трифторметил)фенил)-1 Н-бензо[d] имидазол-4-карбоновой кислоты 3 в виде бледно-коричневого твердого вещества (75 мг, выход: 74%). MS (ESI) рассчитано для C15H9F3N2O2: 306,06; найдено: 307 [М+Н]. Эту общую процедуру используют для получения любых 4-карбоксипроизводных 1 Н-бензо[d]имидазола с использованием подходящего альдегидного компонента в качестве замены для 2(трифторметил)бензальдегида 2 в описанной выше схеме. Пример 2. Получение N-(тиазол-2-ил)-2-(2-(трифторметил)фенил)-1 Н-бензо[d]имидазол-4-карбоксамида (соединение 208) 2-(2-(Трифторметил)фенил)-1 Н-бензо[d]имидазол-4-карбоновая кислота (3; 75 мг, 0,24 ммоль) поглащалась в DMF (2 мл) вместе с тиазол-2-амином (4; 24 мг, 0,24 ммоль) и HATU (186 мг, 0,49 ммоль). Добавляли DIEA (81 мкл, 0,49 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 18 ч. Реакционную смесь разбавляли водой и фильтровали. Собранные твердые вещества подвергали дальнейшей очистке при помощи хроматографии на силикагеле с получением желаемого продукта, а именно N-(тиазол-2-ил)-2-(2-(трифторметил)фенил)-1 Н-бензо[d]имидазол-4-карбоксамида (соединение 208), в виде белого твердого вещества (35 мг, выход: 38%). MS (ESI) рассчитано дляC18H11F3N4OS: 388,06; найдено: 389 [М+Н]. Эту общую процедуру используют для любых амидных производных, представленных в Таблице 1,путем замещения подходящей карбоновой кислотой и аминовыми компонентами соединений 3 и 4, соответственно. Пример 3. Синтез гидрохлорида 2-(6-пиперазин-1-ил)пиридин-3-ил)-N-(тиазол-2-ил)-1 Н-бензо[d] имидазол-4-карбоксамида (соединение 251). Стадия 1. Получение 2-(6-хлорпиридин-3-ил)-1 Н-бензо[d]имидазол-4-карбоновой кислоты (6) 2,3-Диаминобензойная кислота (1; 200 мг, 1,31 ммоль), 6-хлорникотинальдегид (5; 186 мг, 1,31 ммоль) и Na2S2O5 (324 мг, 1,7 ммоль) поглащалась в DMF (10 мл) и перемешивали при 100 С в течение 18 ч. Реакционную смесь охлаждали до комнатной температуры и разбавляли при помощи Н 2 О. Полученную смесь перемешивали в течение 1 ч при комнатной температуре и фильтровали. Собранные твердые вещества промывали водой, МеОН и сушили с получением 2-(6-хлорпиридин-3-ил)-1 Нбензо[d]имидазол-4-карбоновой кислоты 6 в виде бледно-твердого вещества (340 мг, выход: 95%). 2-(6-Хлорпиридин-3-ил)-1 Н-бензо[d]имидазол-4-карбоновая кислота (6; 340 мг, 1,24 ммоль) поглащалась в DMF (5 мл) вместе с тиазол-2-амином (4; 125 мг, 1,24 ммоль) и HATU (943 мг, 2,48 ммоль). Добавляли DIEA (0,41 мл, 2,48 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь разбавляли водой и полученные твердые вещества собирали фильтрованием. Очистка при помощи хроматографии на силикагеле (пентан/EtOAc) давала 2-(6-хлорпиридин-3 ил)-N-(тиазол-2-ил)-1 Н-бензо[d]имидазол-4-карбоксамид 7 в виде бледно-желтого твердого вещества(7; 30 мг, 0,084 ммоль) и трет-бутил пиперазин-1-карбоксилат (170; 156,5 мг, 0,84 ммоль) в DMSO (1,2 мл), перемешивали при 140 С в микроволновом реакторе в течение 25 мин. Реакционную смесь охлаждали до комнатной температуры и разбавляли водой. Полученные твердые вещества собирали фильтрованием, промывали водой и сушили в вакууме с получением трет-бутил 4-(5-(4-(тиазол-2-илкарбамоил)1 Н-бензо[d]имидазол-2-ил)пиридин-2-ил)пиперазин-1-карбоксилата 8 в виде бледно-желтого твердого вещества (20 мг, 71%) . MS (ESI) рассчитано для C25H27N7O3S: 505,19; найдено: 506 [М+Н]. Стадия 4. Получение гидрохлорида 2-(6-(пиперазин-1-ил)пиридин-3-ил)-N-(тиазол-2-ил)-1 Н-бензо Смесь,содержащую трет-бутил 4-(5-(4-(тиазол-2-илкарбамоил)-1 Н-бензо[d]имидазол-2 ил)пиридин-2-ил)пиперазин-1-карбоксилат (8; 20 мг, 0,039 ммоль) в метанольном растворе HCl (3 н., 2 мл), перемешивали при комнатной температуре в течение 18 ч. Осажденные твердые вещества собирали фильтрованием, промывали при помощи МеОН и сушили с получением гидрохлорида 2-(6-(пиперазин-1 ил)пиридин-3-ил)-N-(тиазол-2-ил)-1 Н-бензо[d]имидазол-4-карбоксамида (соединение 251) в виде бледножелтого твердого вещества (21 мг). MS (ESI) рассчитано для C20H19N7OS (m/z) : 405,14; найдено: 406 Смесь, содержащую 2-(6-хлорпиридин-3-ил)-N-(тиазол-2-ил)-1 Н-бензо[d]имидазол-4-карбоксамид (7; 20 мг, 0,056 ммоль) и морфолин (48; 49 мг, 0,56 ммоль) в DMSO (1,5 мл), перемешивали при 140 С в микроволновом реакторе в течение 25 мин. Реакционную смесь охлаждали до комнатной температуры и разбавляли водой. Осажденные твердые вещества собирали фильтрованием и сушили. Твердые вещества снова растворяли в EtOAc и добавляли достаточное количество петролейного эфира для осаждения из него продукта снова. Твердые вещества собирали фильтрованием, промывали при помощи МеОН и сушили с получением 2-(6 морфолинопиридин-3-ил)-N-(тиазол-2-ил)-1 Н-бензо[d]имидазол-4-карбоксамида (соединение 247) в виде бледно-желтого твердого вещества (13 мг, 57%). MS (ESI) рассчитано для C20H18N6O2S: 406,12; найдено: 407 2-(2-Хлорпиридин-3-ил)-N-(тиазол-2-ил)-1 Н-бензо[d]имидазол-4-карбоксамид 9 получали в соответствии с общей процедурой, описанной выше, с использованием подходящего альдегидного компонента. Смесь, содержащую это вещество, а именно 2-(2-хлорпиридин-3-ил)-N-(тиазол-2-ил)-1 Н-бензо[d] имидазол-4-карбоксамид (9; 19 мг, 0,053 ммоль) и морфолин (48; 46 мг, 0,53 ммоль) в DMSO (1,2 мл),перемешивали при 140 С в микроволновом реакторе в течение 25 мин. Реакционную смесь охлаждали до комнатной температуры и разбавляли водой. Осажденные твердые вещества собирали фильтрованием и сушили. Твердые вещества снова растворяли в EtOAc и добавляли достаточное количество петролейного эфира для осаждения продукта снова. Твердые вещества собирали фильтрованием, промывали при помощи МеОН и сушили с получением 2-(2-морфолинопиридин-3-ил)-N-(тиазол-2-ил)-1 Н-бензо[d] имидазол-4-карбоксамида (соединение 250) в виде белого твердого вещества (13 мг, 60%). MS (ESI) рассчитано для C20H18N6O2S (m/z): 406,12; найдено: 407 [М+Н]. Пример 6. Получение 2-(2-(2-(трифторметил)фенил)-1 Н-бензо[d]имидазол-4-карбоксамидо) пиридин 1-оксида (соединение 329)(10; 100 мг, 0,26 ммоль) в CH2Cl2 (10 мл) добавляли mCPBA (140 мг, 0,81 ммоль) в атмосфере азота. Смесь перемешивали при комнатной температуре в течение 12 ч. Добавляли насыщенный водный раствор K2CO3 (10 мл) и смесь экстрагировали при помощи CH2Cl2 (310 мл). Объединенные органические слои сушили (Na2SO4), концентрировали при пониженном давлении. Полученный остаток очищали при помощи хроматографии (CH2Cl2:метанол=20:1) с получением 2-(2-(2-(трифторметил)фенил)-1 Н-бензо[d] имидазол-4-карбоксамидо)пиридин 1-оксида (Соединение 329) (60,0 мг, 58%) в виде бесцветного твердого вещества. MS (ESI) рассчитано для C20H13F3N4O2: 398,10; найдено: 399 [М+Н]. Пример 7. Синтез N-(2-(3-(трифторметил)фенил)-1 Н-бензо[d]имидазол-4-ил)тиазол-4-карбоксамида Раствор 2-(3-(трифторметил)фенил)-1 Н-бензо[d]имидазол-4-карбоновой кислоты (11; 1,53 г, 5,0 ммоль), дифенилфосфорилазида (DPPA, 1,39 г, 5,0 ммоль) и Et3N (0,75 г, 7,4 ммоль) в толуоле (15 мл) перемешивали при комнатной температуре в течение 2 ч и затем перемешивали при температуре кипения с обратным холодильником в течение 2 ч. Добавляли бензиловый спирт (0,54 г, 5,0 ммоль) и полученную реакционную смесь перемешивали при температуре кипения с обратным холодильником еще в течение 12 ч. После охлаждения до комнатной температуры смесь промывали последовательно водным раствором лимонной кислоты (10% мас./мас.), насыщенным раствором NaHCO3 и насыщенным солевым раствором. Органический слой сушили (Na2SO4) и концентрировали при пониженном давлении. Полученный остаток очищали при помощи хроматографии (петролейный эфир:этилацетат=10:1) с получением бензил 2-(3-(трифторметил)фенил)-1 Н-бензо[d]имидазол-4-илкарбамата 12 (1,45 г, 70%) в виде твердого вещества. MS (ESI) рассчитано для C22H16F3N3O2: 411,12; найдено: 412 [М+Н]. К перемешиваемому раствору бензил 2-(3-(трифторметил)фенил)-1 Н-бензо[d]имидазол-4 илкарбамата (12; 1,45 г, 3,5 ммоль) в метаноле (20 мл) добавляли 5% Pd/C (0,20 г). Реакционную смесь тщательно продували азотом и затем перемешивали в атмосфере водорода, 1 атм, при комнатной температуре в течение 18 ч. Смесь фильтровали через слой целита и фильтрат концентрировали при пониженном давлении с получением 2-(3-(трифторметил)фенил)-1 Н-бензо[d]имидазол-4-амина 13 (0,90 г, 3,25 ммоль, 93%) в виде твердого вещества. MS (ESI) рассчитано для C14H10F3N3: 277,08; найдено: 278 [М+Н]. Стадия 3. Получение N-(2-(3-(трифторметил)фенил)-1 Н-бензо[d]имидазол-4-ил)тиазол-4-карбоксамида (соединение 332)DMF (10 мл) перемешивали при комнатной температуре в течение 12 ч. Добавляли насыщенный водный раствор NaHCO3 (5 мл) и смесь фильтровали. Остаток промывали этилацетатом (315 мл) и водный слой экстрагировали этилацетатом (315 мл). Объединенные органические слои сушили (MgSO4) и концентрировали при пониженном давлении. Полученный остаток очищали при помощи хроматографии (петролейный эфир:этилацетат=10:1) с получением N-(2-(3-(трифторметил)фенил)-1 Н-бензо[d]имидазол-4 ил)тиазол-4-карбоксамида (соединение 332) (0,30 г, 0,77 ммоль, 77%) в виде бесцветного твердого вещества. MS (ESI) рассчитано для C18H11F3N4OS: 388,06; найдено: 389 [М+Н]. Пример 8. Получение N-(пиридин-2-ил)-2-(3-(трифторметил)фенил)-1 Н-бензо[d]имидазол-4-амина Смесь, содержащую 2-(3-(трифторметил)фенил)-1 Н-бензо[d]имидазол-4-амин (13; 332 мг, 1,20 ммоль), 2-хлорпиридин (15; 138 мг 1,22 ммоль), Pd(OAc)2 (120 мг, 0,53 ммоль), BINAP (336 мг, 0,53 ммоль) и t-BuOK (150 мг, 1,34 ммоль) в толуоле (10 мл), перемешивали при температуре кипения с обратным холодильником в течение 12 ч в инертной атмосфере N2. Реакционную смесь концентрировали при пониженном давлении и полученный остаток экстрагировали этилацетатом (315 мл). Объединенные органические слои сушили (Na2SO4) и концентрировали при пониженном давлении. Полученный остаток очищали при помощи хроматографии (петролейный эфир:этилацетат=1:1) с получением N(пиридин-2-ил)-2-(3-(трифторметил)фенил)-1 Н-бензо[d]имидазол-4-амина (соединение 581) (30 мг, 0,085 ммоль, 7,1%) в виде бесцветного твердого вещества. MS (ESI) рассчитано для C19H13F3N4: 354,11; найдено: 355 [М+Н] Пример 9. Получение N-(пиридин-3-илметил)-2-(3-(трифторметил)фенил)-1 Н-бензо[d]имидазол-4 амина (соединение )(10 мл), перемешивали при комнатной температуре в течение 12 ч в инертной атмосфере N2. Добавляли насыщенный водный раствор NaHCO3 (10 мл) и смесь экстрагировали этилацетатом (315 мл). Объединенные органические слои сушили (Na2SO4) и концентрировали при пониженном давлении. Полученный остаток очищали при помощи хроматографии (градиентное элюирование, петролейный эфир:этилацетат=1:1 до 1:3) с получением N-(пиридин-3-илметил)-2-(3-(трифторметил)фенил)-1 Н-бензо К перемешиваемому раствору 4-хлор-2-(трифторметил)бензальдегида (17; 4,20 г, 20,0 ммоль) в метаноле (25 мл) добавляли триэтоксиметан (3,60 г, 24,0 ммоль) при 0 С. Полученную реакционную смесь нагревали до комнатной температуры и перемешивали в течение 12 ч. Добавляли раствор MeONa в метаноле для доведения рН 10. Растворитель удаляли при пониженном давлении и полученный остаток разбавляли водой. Смесь экстрагировали этилацетатом (350 мл) и объединенные органические слои сушили (Na2SO4) и концентрировали при пониженном давлении с получением 4-хлор-1(диметоксиметил)-2-(трифторметил)бензола 18 (3,20 г, 12,6 ммоль, 63%). Стадия 2. Получение 4-(4-(диметоксиметил)-3-(трифторметил)фенил)морфолина (19) Смесь 4-хлор-1-(диметоксиметил)-2-(трифторметил)бензола (18; 3,20 г, 12,6 ммоль), Pd2(dba)3(0,30 г, 0,33 ммоль), t-BuOK (3,50 г, 31,2 ммоль) и морфолина (48; 1,09 г, 12,6 ммоль) в безводном толуоле (50 мл) перемешивали при температуре кипения с обратным холодильником в течение 12 ч в инертной атмосфере азота. После охлаждения до комнатной температуры смесь фильтровали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали при помощи хроматографии (петролейный эфир:этилацетат=10:1) с получением 4-(4-(диметоксиметил)-3-(трифторметил)фенил)морфолина 19 Смесь 4-(4-(диметоксиметил)-3-(трифторметил)фенил)морфолина (19; 0,40 г, 1,31 ммоль), 2,3 диаминобензойной кислоты (1; 0,20 г, 1,31 ммоль), Na2S2O5 (0,33 г, 1,74 ммоль) в DMF (10 мл) перемешивали при 110 С (масляная баня) в течение 18 ч. После охлаждения до комнатной температуры смесь разбавляли водой (20 мл) и перемешивали в течение 30 мин. Смесь фильтровали; фильтровальную лепешку промывали водой (310 мл) и сушили с получением 2-(4-морфолино-2-(трифторметил)фенил)-1 Нбензо[d]имидазол-4-карбоновой кислоты 20 (0,37 г, 72%) в виде серого твердого вещества. Стадия 4. Получение 2-(4-морфолино-2-(трифторметил)фенил)-N-(пиридин-3-ил)-1 Н-бензо[d] имидазол-4-карбоксамида (соединение 430) Смесь 2-(4-морфолино-2-(трифторметил)фенил)-1 Н-бензо[d]имидазол-4-карбоновой кислоты (20; 157 мг, 0,40 ммоль), HATU (304 мг, 0,80 ммоль), DIEA (207 мг, 1,60 ммоль) и 3-аминопиридина (173; 37 мг, 0,40 ммоль) в DMF (2 мл) перемешивали при комнатной температуре в течение 12 ч. Добавляли воду (20 мл) и перемешивали в течение 30 мин. Смесь экстрагировали этилацетатом(310 мл). Объединенные органические слои сушили (Na2SO4) и концентрировали при пониженном давлении. Полученный остаток очищали при помощи хроматографии с получением 2-(4-морфолино-2(трифторметил)фенил)-N-(пиридин-3-ил)-1 Н-бензо[d]имидазол-4-карбоксамида (соединение 430) (64 мг,34%) в виде бледно-желтого твердого вещества. MS (ESI) рассчитано для C24H20F3N5O2: 467,16; найдено: 468 [М+Н].
МПК / Метки
МПК: C07D 403/12, C07D 403/14, C07D 413/14, A61K 31/437, C07D 513/04, C07D 413/12, C07D 417/14, C07D 471/04, C07D 417/12, C07D 405/12, C07D 401/12, C07D 405/14, C07D 401/14, C07D 471/08, A61K 31/4184
Метки: сиртуина, родственные, аналоги, качестве, модуляторов, бензимидазолы
Код ссылки
<a href="https://eas.patents.su/30-20578-benzimidazoly-i-rodstvennye-analogi-v-kachestve-modulyatorov-sirtuina.html" rel="bookmark" title="База патентов Евразийского Союза">Бензимидазолы и родственные аналоги в качестве модуляторов сиртуина</a>
Предыдущий патент: Способ получения олефинов из оксигенатов
Следующий патент: Способ лечения реперфузионных повреждений тканей
Случайный патент: Управляющий программный продукт и система обработки данных