Новые 2-замещенные бензимидазолы в качестве селективных модуляторов рецептора андрогена (sarms)
Номер патента: 15542
Опубликовано: 31.08.2011
Авторы: Нг Реймонд А., Мл.Алфорд К., Лантер Джеймс К., Суй Чжихуа
Формула / Реферат
1. Соединение формулы (I)
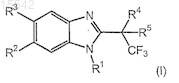
где R1выбирают из группы, состоящей из водорода или низшего алкила;
R2 и R3представляют собой галоген;
R4 представляет собой алкенил или алкинил;
где алкенил или алкинил является необязательно замещенным одним или более заместителями, независимо выбираемыми из группы, состоящей из галогена, гидроксила, карбоксила, циано-, нитрогруппы, NRERF, NRE-C(О)-низшего алкила и фенила;
где RE и RF, каждый независимо, выбирают из водорода или низшего алкила и где фенил необязательно замещен одним-четырьмя заместителями, независимо выбираемыми из группы, состоящей из галогена, низшего алкила, низшего алкоксила, гидроксила, карбоксила, циано-, нитро-, аминогруппы, (низший алкил)аминогруппы и ди(низший алкил)аминогруппы;
R5 означает ОН;
альтернативно, R4 и R5вместе с атомом, с которым они связаны, образуют циклическую структуру, выбираемую из группы, состоящей из 2-пирролидинила, 2-тетрагидрофуранила, 2-(2,5-дигидро-1Н-пирролила), 2-(2,5-дигидрофуранила), 2-имидазолидинила, 2-оксазолидинила, 2-[1,3]диоксоланила, 2-пиперидинила, 6-(1,2,3,6-тетрагидропиридинила), 2-(1,2,3,6-тетрагидропиридинила), 2-тетрагидропиранила, 6-(3,6-дигидро-2Н-пиранила), 2-(3,6-дигидро-2Н-пиранила), 2-(гексагидропиримидинила), 2-[1,3]оксазинанила и 2-[1,3]диоксанила;
где циклическая структура необязательно замещена одним или более заместителями, независимо выбираемыми из группы, состоящей из низшего алкила, -(низший алкил)-ОН и -(низший алкил)-(галогена);
и его фармацевтически приемлемые соли.
2. Соединение по п.1, где
R1 выбирают из группы, состоящей из водорода, низшего алкила, -(низший алкил)-CN, -(СН2)-гетероарила,
-(СН2)-(С2-4-алкенила), -(СН2)-(С2-4-алкинила), -(низший алкил)-С(О)-O-(низшего алкила) и -(низший алкил)-O-Si(CH3)2-(трет-бутила);
R2 и R3, каждый независимо, выбирают из группы, состоящей из галогена, цианогруппы и замещенного галогеном низшего алкила;
R4 выбирают из группы, состоящей из алкенила и алкинила, где алкенил необязательно замещен заместителем, выбираемым из группы, состоящей из гидроксила, карбоксила и фенила;
R5 означает ОН;
альтернативно, R4 и R5вместе с атомом, с которым они связаны, образуют циклическую структуру, выбираемую из группы, состоящей из 2-(2,5-дигидрофуранила), 2-тетрагидрофуранила, 2-[1,3]диоксоланила, 2-[1,3]диоксанила, 2-имидазолила и 2-оксазолидинила;
где циклическая структура необязательно замещена одним-двумя заместителями, независимо выбираемыми из группы, состоящей из метила, этила, гидроксиметила, гидроксиэтила и -(C1-2-алкил)галогена;
или его фармацевтически приемлемая соль.
3. Соединение по п.2, где
R1 выбирают из группы, состоящей из водорода, метила и этила;
R2 представляет собой хлор;
R3 представляет собой хлор;
R4 выбирают из группы, состоящей из винила, (+)-винила, (-)-винила, аллила, (+)-аллила, (-)-аллила, 2-метилаллила, 2-пропен-3-ила, Z-2-пропен-3-ила, Е-2-пропен-3-ила, 3-метил-1-пропен-3-ила, 2-карбокси-1-пропен-3-ила, 3-фенил-1-пропен-3-ила, 3,3-диметил-1-пропен-3-ила, 2,3-диметил-2-пропен-3-ила, 2-метил-2-пропен-3-ила, изопропенила, пропа-1,2-диен-3-ила, 3-метилпропа-1,2-диен-3-ила, 3-этилпропа-1,2-диен-3-ила, 1-бутен-4-ила, 1-пропин-3-ила, (+)-1-пропин-3-ила, (-)-1-пропин-3-ила, 2-пропин-3-ила, 1-гидрокси-2-пропин-3-ила, 1-фенил-1-пропин-3-ила и 2-бутин-4-ила;
R5 означает ОН;
альтернативно, R4 и R5 вместе с атомом, с которым они связаны, образуют циклическую структуру, выбираемую из группы, состоящей из 2-(2,5-дигидрофуранила), 2-тетрагидрофуранила, 2-[1,3]диоксоланила, 2-(4-гидроксиметил[1,3]диоксаланила), 2-(4-хлорметил[1,3]диоксаланила), 2-[1,3]диоксанила, 2-имидазолила и 2-оксазолидинила;
или его фармацевтически приемлемая соль.
4. Соединение по п.3, где
R1 выбирают из группы, состоящей из водорода и этила;
R4 выбирают из группы, состоящей из винила, аллила, (+)-аллила, (-)-аллила, 2-метилаллила, 2-пропен-3-ила, Z-2-пропен-3-ила, Е-2-пропен-3-ила, 3-метил-1-пропен-3-ила, 3-фенил-1-пропен-3-ила, 3,3-диметил-1-пропен-3-ила, 2,3-диметил-2-пропен-3-ила, 2-метил-2-пропен-3-ила, изопропенила, пропа-1,2-диен-3-ила, 3-метилпропа-1,2-диен-3-ила, 3-этилпропа-1,2-диен-3-ила, 1-бутен-4-ила, 1-пропин-3-ила, (+)-1-пропин-3-ила, (-)-1-пропин-3-ила и 2-пропин-3-ила;
R5 означает ОН;
альтернативно, R4 и R5 вместе с атомом, с которым они связаны, образуют циклическую структуру, выбираемую из группы, состоящей из 2-тетрагидрофуранила, 2-[1,3]диоксоланила, 2-(4-гидроксиметил[1,3]диоксаланила), 2-(4-хлорметил[1,3]диоксаланила), 2-[1,3]диоксанила, 2-имидазолила и 2-оксазолидинила;
или его фармацевтически приемлемая соль.
5. Соединение по п.3, где
R1 выбирают из группы, состоящей из водорода и метила;
R4 выбирают из группы, состоящей из винила, (+)-винила, аллила, Z-2-пропен-3-ила, пропа-1,2-диен-3-ила, 1-пропин-3-ила, (+)-1-пропин-3-ила и (-)-1-пропин-3-ила;
R5 означает ОН;
альтернативно, R4 и R5вместе с атомом, с которым они связаны, образуют циклическую структуру, выбираемую из группы, состоящей из 2-(2,5-дигидрофуранила) и 2-тетрагидрофуранила;
или его фармацевтически приемлемая соль.
6. Соединение по п.3, где
R1 означает водород;
R4 выбирают из группы, состоящей из изопропенила, Z-2-пропен-3-ила и (+)-винила;
R5 означает ОН;
альтернативно, R4 и R5вместе с атомом, с которым они связаны, образуют 2-[1,3]диоксаланил;
или его фармацевтически приемлемая соль.
7. Соединение по п.2, где
R1 выбирают из группы, состоящей из водорода и низшего алкила;
R2 и R3, каждый независимо, выбирают из группы, состоящей из галогена, замещенного галогеном низшего алкила и цианогруппы;
R4 представляет собой алкенил или алкинил; где алкенил необязательно замещен заместителем, выбираемым из группы, состоящей из гидроксила, карбоксила и фенила;
R5 означает ОН;
или его фармацевтически приемлемая соль.
8. Соединение по п.7, где
R1 выбирают из группы, состоящей из водорода и метила;
R4 выбирают из группы, состоящей из винила, (+)-винила, (-)-винила, аллила, (+)-аллила, (-)-аллила, 2-метилаллила, 2-пропен-3-ила, Z-2-пропен-3-ила, Е-2-пропен-3-ила, 3-метил-1-пропен-3-ила, 2-карбокси-1-пропен-3-ила, 3-фенил-1-пропен-3-ила, 3,3-диметил-1-пропен-3-ила, 2,3-диметил-2-пропен-3-ила, 2-метил-2-пропен-3-ила, изопропенила, пропа-1,2-диен-3-ила, 3-метилпропа-1,2-диен-3-ила, 3-этилпропа-1,2-диен-3-ила, 1-бутен-4-ила, 1-пропин-3-ила, 2-пропин-3-ила, (+)-1-пропин-3-ила, (-)-1-пропин-3-ила, 1-гидрокси-2-пропин-3-ила, 1-фенил-1-пропин-3-ила и 2-бутин-4-ила;
R5 означает ОН;
или его фармацевтически приемлемая соль.
9. Соединение по п.6, где R1 означает водород;
R2 и R3, каждый, означает хлор;
R4 выбирают из группы, состоящей из изопропенила, Z-2-пропен-3-ила и (+)-винила;
R5 означает ОН;
или его фармацевтически приемлемая соль.
10. Соединение по п.2, где
R1 выбирают из группы, состоящей из водорода, низшего алкила, -(низший алкил)-CN, -(СН2)-гетероарила,
-(СН2)-(С2-4-алкенила), -(СН2)-(С2-4-алкинила), -(низший алкил)-С(О)-O-(низшего алкила) и -(низший алкил)-O-Si(CH3)2-(трет-бутила);
R2 и R3, каждый независимо, выбирают из группы, состоящей из галогена и замещенного галогеном низшего алкила;
R4 и R5вместе с атомом, с которым они связаны, образуют циклическую структуру, выбираемую из группы, состоящей из 2-(2,5-дигидрофуранила), 2-тетрагидрофуранила, 2-[1,3]диоксоланила, 2-[1,3]диоксанила, 2-имидазолила и 2-оксазолидинила;
где циклическая структура необязательно замещена одним-двумя заместителями, независимо выбираемыми из группы, состоящей из гидроксиметила, гидроксиэтила и -(C1-2-алкил)галогена;
или его фармацевтически приемлемая соль.
11. Соединение по п.10, где
R1 выбирают из группы, состоящей из водорода, метила, этила, цианометила, 2-пиридилметила, аллила, 1-пропин-3-ила, метоксикарбонилметила и трет-бутилдиметилсилилоксиэтила;
R2 выбирают из группы, состоящей из хлора и трифторметила;
R3 означает хлор;
R4 и R5вместе с атомом, с которым они связаны, образуют циклическую структуру, выбираемую из группы, состоящей из 2-(2,5-дигидрофуранила), 2-тетрагидрофуранила, 2-[1,3]диоксоланила, 2-(4-гидроксиметил[1,3]диоксаланила), 2-(4-хлорметил[1,3]диоксаланила), 2-[1,3]диоксанила, 2-имидазолила и 2-оксазолидинила;
или его фармацевтически приемлемая соль.
12. Соединение по п.11, где R1 означает водород;
R2 и R3, каждый, означает хлор;
R4 и R5вместе с атомом, с которым они связаны, образуют 2-[1,3]диоксаланил;
или его фармацевтически приемлемая соль.
13. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и соединение по п.1.
14. Способ получения фармацевтической композиции, включающий смешение соединения по п.1 и фармацевтически приемлемого носителя.
Текст
Дата публикации и выдачи патента Номер заявки НОВЫЕ 2-ЗАМЕЩННЫЕ БЕНЗИМИДАЗОЛЫ В КАЧЕСТВЕ СЕЛЕКТИВНЫХ МОДУЛЯТОРОВ РЕЦЕПТОРА АНДРОГЕНА (SARMS) Настоящее изобретение относится к новым 2-замещенным производным бензимидазола,содержащим их фармацевтическим композициям и их применению для лечения нарушений и состояний, модулируемых рецептором андрогена. 015542 Область техники, к которой относится изобретение Настоящее изобретение относится к новым 2-замещенным производным бензимидазола, содержащим их фармацевтическим композициям и их применению для лечения нарушений и состояний, модулируемых рецептором андрогена. Более конкретно, соединения согласно настоящему изобретению пригодны для лечения, например, рака предстательной железы, доброкачественной гиперплазии предстательной железы (ВРН), гирсутизма, алопеции, нервно-психической анорексии, рака молочной железы,акне, СПИДа, кахексии, андропаузы, остеопении, остеопороза, женской половой дисфункции, мужской половой дисфункции, в качестве усилителя либидо, в качестве контрацептива для мужчин, в качестве усилителя активности у мужчин и/или для восстановления мышц при ожогах. Предпосылки создания изобретения Андрогены представляют собой анаболические стероидные гормоны животных, регулирующие мышечную и скелетную массу, созревание репродуктивной системы, развитие вторичных половых признаков и поддерживание фертильности у мужчин. У женщин тестостерон превращается в эстроген в большинстве тканей-мишеней, но сами по себе андрогены могут играть роль в случае нормальной женской физиологии, например в головном мозге. Основной андроген, находящийся в сыворотке крови, является тестостероном и представляет собой эффективное соединение в тканях, таких как семенники и гипофиз. В предстательной железе и коже тестостерон превращается в 5-дигидротестостерон (DHT) за счет воздействия 5-редуктазы. DHT является более сильным андрогеном, чем тестостерон, так как он более прочно связывается с рецептором андрогена. Подобно всем стероидным гормонам андрогены связываются со специфической к рецептору внутренней стороной клеток тканей-мишеней, в случае рецептора андрогена. Он представляет собой член семейства ядерного фактора транскрипции рецептора. Связывание андрогена с рецептором активирует его и вызывает его связывание с ДНКсвязывающими сайтами, смежными с генами-мишенями. Оттуда он вступает во взаимодействие с белками-соактиваторами и основными факторами транскрипции для регуляции экспрессии гена. Таким образом, через свой рецептор андрогены вызывают изменения в экспрессии генов в клетках. Эти изменения, в конечном счете, оказывают влияние на метаболический выход, дифференцировку или пролиферацию клетки, которые проявляются в физиологии ткани-мишени. Несмотря на то что модуляторы функции рецептора андрогена клинически использовали в течение некоторого периода времени, как стероидные (Basaria S., Wahlstrom J.Т., Dobs A.S., J. Clin Endocrinol Metab (2001), 86, cc. 5108-5117; Shahidi N.T., Clin Therapeutics (2001), 23, cc. 1355-1390), так и нестероидные(Newling D.W., Br. J. Urol., 1996, 77(6), cc. 776-784) соединения обладают значительными лабильностями,связанными с их фармакологическими параметрами, включая гинекофилию, болезненность молочной железы и гепатотоксичность. Кроме того, взаимодействия лекарственное средство - лекарственное средство наблюдали у пациентов, подвергаемых антикоагуляционной терапии с использованием кумаринов. Наконец, пациенты с чувствительностями к анилину могут подвергаться опасности за счет метаболитов нестероидных антиандрогенов. Нестероидные агонисты и антагонисты рецептора андрогена пригодны для лечения множества нарушений и заболеваний. Более конкретно, антагонисты рецептора андрогена можно применять при лечении рака предстательной железы, доброкачественной гиперплазии предстательной железы, гирсутизма у женщин, алопеции, нервно-психической анорексии, рака молочной железы и акне. Агонисты рецептора андрогена можно применять в случае мужской контрацепции, усиления мужской активности, а также при лечении рака, СПИДа, кахексии и других нарушений. Дополнительно, агонисты рецептора андрогена пригодны при стимулировании восстановления при ожогах (Murphy K.D., Suchmore Т., Micak R.P., Chinkes D.L., Klein G.L., Herndon D.N., Effects of long-termoxandrolone administration in severely burned children, Surgery, (2004), 136(2), cc. 219-224). Однако существует необходимость в имеющих небольшую молекулу нестероидных антагонистах рецептора андрогена. Авторы настоящего изобретения в данном описании описывают новый ряд 2 замещенных производных бензимидазола, пригодных в качестве модуляторов рецептора андрогена. Краткое изложение сущности изобретения Настоящее изобретение относится к соединению формулы (I)R2 и R3, каждый независимо, выбирают из группы, состоящей из галогена, гидроксила, карбоксила,низшего алкила, замещенного галогеном низшего алкила, низшего алкоксила, замещенного галогеном низшего алкоксила, циано-, нитро-, аминогруппы, низшей алкиламиногруппы, ди(низший алкил)аминогруппы, -С(О)-(низшего алкила), -С(О)-(низшего алкоксила), -C(O)-NRARB, -S(О)0-2-(низшего алкила),-S(О)2-NRARB, -N(RA)-С(О)-(низшего алкила) и -N(RA)-С(О)-(замещенного галогеном низшего алкила); где RA и RB, каждый независимо, выбирают из водорода или низшего алкила;-(С 2-4-алкил)гетероарила; где алкенил или алкинил является необязательно замещенным одним или более заместителями, независимо выбираемыми из группы, состоящей из галогена, гидроксила, карбоксила, циано-, нитрогруппы, NRERF, NRE-C(О)-низшего алкила и фенила; где RE и RF, каждый независимо, выбирают из водорода или низшего алкила; и где фенил (заместитель у алкенила или алкинила) необязательно замещен одним-четырьмя заместителями, независимо выбираемыми из группы, состоящей из галогена, низшего алкила, низшего алкоксила, гидроксила, карбоксила, циано-, нитро-, аминогруппы, (низший алкил)аминогруппы и ди(низший алкил)аминогруппы; где арил или гетероарил, один или как часть замещающей группы, необязательно замещен одним или более заместителями, независимо выбираемыми из группы, состоящей из галогена, гидроксила, карбоксила, низшего алкила, низшего алкоксила, фторированного низшего алкила, фторированного низшего алкоксила, фенокси-, циано-, нитрогруппы, NRCRD и -(низший алкил)-NRBRC, -С(О)-(низшего алкила),-С(О)-(низшего алкоксила), -C(O)-NRCRD, -N(RC)-C(O)-(низшего алкила), -N(RC)-C(O)-(замещенного галогеном низшего алкила), -S(О)0-2-(низшего алкила) и -S(О)2-NRCRD; где RC и RD, каждый независимо,выбирают из водорода и низшего алкила;R5 означает OR6; где R6 выбирают из группы, состоящей из водорода, низшего алкила и -С(О)(низшего алкила); альтернативно, R4 и R5 вместе с атомом, с которым они связаны, образуют циклическую структуру,выбираемую из группы, состоящей из 2-пирролидинила, 2-тетрагидрофуранила, 2-(2,5-дигидро-1 Нпирролила), 2-(2,5-дигидрофуранила), 2-имидазолидинила, 2-оксазолидинила, 2-[1,3]диоксоланила, 2 пиперидинила, 6-(1,2,3,6-тетрагидропиридинила), 2-(1,2,3,6-тетрагидропиридинила), 2-тетрагидропиранила, 6-(3,6-дигидро-2 Н-пиранила), 2-(3,6-дигидро-2 Н-пиранила), 2-(гексагидропиримидинила), 2[1,3]оксазинанила и 2-[1,3]диоксанила; где циклическая структура необязательно замещена одним или более заместителями, независимо выбираемыми из группы, состоящей из низшего алкила, -(низший алкил)-ОН и -(низший алкил)(галогена); и его фармацевтически приемлемым солям. Иллюстрацией настоящего изобретения является фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и любое из описанных здесь соединений. Иллюстрацией настоящего изобретения является фармацевтическая композиция, получаемая смешением любого из описанных здесь соединений и фармацевтически приемлемого носителя. Иллюстрацией настоящего изобретения является способ получения фармацевтической композиции,включающий смешение любого из описанных здесь соединений и фармацевтически приемлемого носителя. Иллюстрацией настоящего изобретения являются способы лечения нарушений и состояний, модулируемых рецептором андрогена, включающие введение субъекту, нуждающемуся в этом, терапевтически эффективного количества любого из описанных здесь соединений или фармацевтических композиций. Одним примером настоящего изобретения является способ лечения модулируемого рецептором андрогена нарушения, выбираемого из группы, состоящей из рака предстательной железы, доброкачественной гиперплазии предстательной железы (ВРН), гирсутизма, алопеции, нервно-психической анорексии, рака молочной железы, акне, СПИДа (синдром приобретенного иммунодефицита), кахексии, андропаузы, остеопении, остеопороза, женской половой дисфункции, мужской половой дисфункции, ослабленного либидо, для мужской контрацепции или для усиления активности у мужчин или для восстановления мышц при ожогах, включающий введение субъекту, нуждающемуся в этом, терапевтически эффективного количества любого (любой) из описанных здесь соединений или фармацевтических композиций. Другим примером настоящего изобретения является способ лечения модулируемого рецептором андрогена нарушения, выбираемого из группы, состоящей из рака предстательной железы, ВРН, гирсутизма, алопеции, рака молочной железы, акне и мужской контрацепции, включающий введение субъекту, нуждающемуся в этом, терапевтически эффективного количества любого (любой) из описанных здесь соединений или фармацевтических композиций. Другим примером настоящего изобретения является способ лечения модулируемого рецептором андрогена нарушения, выбираемого из группы, состоящей из анорексии, СПИДа, кахексии, андропаузы,остеопении, остеопороза, женской половой дисфункции, мужской половой дисфункции, ослабленного-2 015542 либидо, в случае усиления мужской активности или восстановления мышц при ожогах, включающий введение субъекту, нуждающемуся в этом, терапевтически эффективного количества любого (любой) из описанных здесь соединений или фармацевтических композиций. Другим примером настоящего изобретения является применение любого из описанных здесь соединений для получения лекарственного средства в целях лечения (а) рака предстательной железы, (b) доброкачественной гиперплазии предстательной железы (ВРН), (с) гирсутизма, (d) алопеции, (е) нервнопсихической анорексии, (f) рака молочной железы, (g) акне, (h) СПИДа, (i) кахексии, (j) андропаузы, (k) остеопении, (l) остеопороза, (m) женской половой дисфункции, (n) мужской половой дисфункции, (о) ослабленного либидо, в случае (р) мужской контрацепции, в случае (q) усиливаемой мужской активности или в случае (r) восстановления мышц при ожогах, у субъекта, нуждающегося в этом. Подробное описание настоящего изобретения Настоящее изобретение относится к способу получения соединения формулы (I) где R1, R2, R3, R4 и R5 имеют значения, как описано здесь. Соединения согласно настоящему изобретению пригодны в качестве селективных модуляторов рецептора андрогена для лечения опосредуемых по меньшей мере одним рецептором андрогена нарушений, выбираемых из группы, состоящей из рака предстательной железы, доброкачественной гиперплазии предстательной железы (ВРН), гирсутизма, алопеции, нервно-психической анорексии, рака молочной железы, акне, СПИДа, кахексии, андропаузы, остеопении, остеопороза, женской половой дисфункции,мужской половой дисфункции и ослабленного либидо, или в случае мужской контрацепции, усиливаемой мужской активности или в случае восстановления мышц при ожогах. Предпочтительно модулируемое по меньшей мере одним рецептором андрогена нарушение выбирают из группы, состоящей из кахексии, андропаузы, остеопороза, остеопении, и в случае восстановления мышц при ожогах, более предпочтительно опосредуемое по меньшей мере одним рецептором андрогена нарушение выбирают из группы, состоящей из кахексии, андропаузы, остеопороза и остеопении. В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I),которые являются антагонистами рецептора андрогена. В другом варианте осуществления настоящее изобретение относится к соединениям формулы (I), которые являются агонистами рецептора андрогена. В следующем варианте осуществления настоящее изобретение относится к соединениям формулы (I),которые проявляют тканевый селективный агонизм и антагонизм к рецептору андрогена. В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I),которые пригодны для лечения рака предстательной железы, доброкачественной гиперплазии предстательной железы, гирсутизма у женщин, алопеции, нервно-психической анорексии, рака молочной железы и акне. В другом варианте осуществления настоящее изобретение относится к соединениям формулы (I),которые пригодны в случае мужской контрацепции, в случае усиления мужской активности и/или для лечения рака, СПИДа, кахексии, и/или в случае восстановления мышц при ожогах. В одном варианте осуществления настоящего изобретения R1 выбирают из группы, состоящей из водорода, низшего алкила, -(низший алкил)-CN, -(СН 2)-(С 2-4-алкенила), -(СН 2)-(С 2-4-алкинила), фторированного низшего алкила, -(СН 2)-гетероарила, -(СН 2)-арила, -(СН 2)-(фторированного низшего алкила),-(низший алкил)-С(О)-О-(низшего алкила), -(низший алкил)-О-(низшего алкила) и -(низший алкил)-OSi(CH3)2-(трет-бутила). В другом варианте осуществления настоящего изобретения R1 выбирают из группы, состоящей из водорода, низшего алкила, -(низший алкил)-CN, -(СН 2)-гетероарила, -(СН 2)-(С 2-4-алкенила), -(СН 2)-(С 2-4 алкинила), -(низший алкил)-С(О)-О-(низшего алкила) и -(низший алкил)-O-Si(СН 3)2-(трет-бутила). В другом варианте осуществления настоящего изобретения R1 выбирают из группы, состоящей из водорода, метила, этила, цианометила, 2-пиридилметила, аллила, 1-пропин-3-ила, метоксикарбонилметила и трет-бутилдиметилсилилоксиэтила. В другом варианте осуществления настоящего изобретения R1 выбирают из группы, состоящей из водорода, метила, этила, цианометила, 2-пиридилметила, аллила, 1-пропин-3-ила, метоксикарбонилметила и трет-бутилдиметилсилилоксиэтила. В другом варианте осуществления настоящего изобретения R1 выбирают из группы, состоящей из водорода, этила, цианометила, аллила и 1-пропин-3-ила. В другом варианте осуществления настоящего изобретения R1 выбирают из группы, состоящей из водорода и низшего алкила. В другом варианте осуществления настоящего изобретения R1 выбирают из группы, состоящей из водорода и метила. В другом варианте осуществления настоящего изобретения R1 означает водород. В одном варианте осуществления настоящего изобретения R2 и R3, каждый независимо, выбирают из группы, состоящей из галогена, гидроксила, карбоксила, низшего алкила, замещенного галогеном-3 015542 низшего алкила, циано-, нитро-, аминогруппы, низшей алкиламиногруппы, ди(низший алкил)аминогруппы, -С(О)-(низшего алкила), -С(О)-(низшего алкокси), -C(O)-NRARB, -N(RA)-C(O)(низшего алкила) и -N(RA)-С(О)-(замещенного галогеном низшего алкила); где RA и RB, каждый независимо, выбирают из водорода, метила или этила. В другом варианте осуществления настоящего изобретения R2 и R3, каждый независимо, выбирают из группы, состоящей из галогена, цианогруппы и замещенного галогеном низшего алкила. В другом варианте осуществления настоящего изобретения R2 и R3, каждый независимо, выбирают из группы, состоящей из хлора, трифторметила и цианогруппы. В другом варианте осуществления настоящего изобретения R2 и R3, каждый, означает хлор. В другом варианте осуществления настоящего изобретения R2 и R3, каждый независимо, выбирают из группы, состоящей из галогена и замещенного галогеном низшего алкила. В другом варианте осуществления настоящего изобретения R2 и R3, каждый независимо, выбирают из группы, состоящей из хлора и трифторметила. В одном варианте осуществления настоящего изобретения R2 выбирают из группы, состоящей из хлора и трифторметила. В одном варианте осуществления настоящего изобретения R3 выбирают из группы, состоящей из хлора и цианогруппы. В другом варианте осуществления настоящего изобретенияR3 означает хлор. В одном варианте осуществления настоящего изобретения R4 выбирают из группы, состоящей из алкенила, алкинила, арила, -(С 2-4-алкил)арила, гетероарила и -(С 2-4-алкил)гетероарила; где алкенил или алкинил являются необязательно замещенными одним-двумя (предпочтительно одним) заместителями,независимо выбираемыми из группы, состоящей из галогена, гидроксила, карбоксила, цианогруппы,нитрогруппы, NRERF, NRE-C(О)-низшего алкила и фенила; где RE и RF, каждый независимо, выбирают из водорода или низшего алкила; и где фенил необязательно замещен одним-двумя (предпочтительно одним) заместителями, независимо выбираемыми из группы, состоящей из галогена, низшего алкила, низшего алкоксила, гидроксила, карбоксила, циано-, нитро-, аминогруппы, (низший алкил)аминогруппы и ди(низший алкил)аминогруппы; и где арил или гетероарил, один или как часть замещающей группы,необязательно замещен одним-двумя (предпочтительно одним) заместителями, независимо выбираемыми из группы, состоящей из галогена, гидроксила, карбоксила, низшего алкила, низшего алкоксила, фторированного низшего алкила, фторированного низшего алкоксила, фенокси-, циано-, нитрогруппы,NRCRD, -(низший алкил)-NRBRC, -С(О)-(низшего алкила) и -С(О)-(низшего алкоксила); и где RC и RD,каждый независимо, выбирают из водорода или низшего алкила. В другом варианте осуществления настоящего изобретения R4 выбирают из группы, состоящей из алкенила, алкинила и арила; где арил необязательно замещен, как описано здесь. В другом варианте осуществления настоящего изобретения R4 выбирают из группы, состоящей из алкенила и алкинила. В другом варианте осуществления настоящего изобретения R4 выбирают из группы, состоящей из винила, (+)-винила, (-)-винила, аллила, (+)-аллила, (-)-аллила, 2-метилаллила, 2-пропен-3-ила, Z-2 пропен-3-ила, Е-2-пропен-3-ила, 3-метил-1-пропен-3-ила, 2-карбокси-1-пропен-3-ила, 3-фенил-1-пропен 3-ила, 3,3-диметил-1-пропен-3-ила, 2,3-диметил-2-пропен-3-ила, 2-метил-2-пропен-3-ила, изопропенила,пропа-1,2-диен-3-ила, 3-метилпропа-1,2-диен-3-ила, 3-этилпропа-1,2-диен-3-ила, 1-бутен-4-ила, 1 пропин-3-ила, (+)-1-пропин-3-ила, (-)-1-пропин-3-ила, 2-пропин-3-ила, 1-гидрокси-2-пропин-3-ила, 1 фенил-1-пропин-3-ила, 2-бутин-4-ила и фенила. В другом варианте осуществления настоящего изобретения R4 выбирают из группы, состоящей из винила, аллила, (+)-аллила, (-)-аллила, 2-метилаллила, 2-пропен-3-ила, Z-2-пропен-3-ила, Е-2-пропен-3 ила, 3-метил-1-пропен-3-ила, 3-фенил-1-пропен-3-ила, 3,3-диметил-1-пропен-3-ила, 2,3-диметил-2 пропен-3-ила, 2-метил-2-пропен-3-ила, изопропенила, пропа-1,2-диен-3-ила, 3-метилпропа-1,2-диен-3 ила, 3-этилпропа-1,2-диен-3-ила, 1-бутен-4-ила, 1-пропин-3-ила, (+)-1-пропин-3-ила, (-)-1-пропин-3-ила,2-пропин-3-ила и фенила. В другом варианте осуществления настоящего изобретения R4 выбирают из группы, состоящей из винила, (+)-винила, аллила, Z-2-пропен-3-ила, пропа-1,2-диен-3-ила, 1-пропин-3 ила, (+)-1-пропин-3-ила и (-)-1-пропин-3-ила. В другом варианте осуществления настоящего изобретенияR4 выбирают из группы, состоящей из изопропенила, Z-2-пропен-3-ила и (+)-винила. В одном варианте осуществления настоящего изобретения R4 выбирают из группы, состоящей из алкенила, алкинила и арила; где алкенил является необязательно замещенным заместителем, выбираемым из группы, состоящей из гидроксила, карбоксила и фенила. В другом варианте осуществления настоящего изобретения R4 выбирают из группы, состоящей из винила, (+)-винила, (-)-винила, аллила, (+)-аллила, (-)-аллила, 2-метилаллила, 2-пропен-3-ила, Z-2 пропен-3-ила, Е-2-пропен-3-ила, 3-метил-1-пропен-3-ила, 2-карбокси-1-пропен-3-ила, 3-фенил-1-пропен 3-ила, 3,3-диметил-1-пропен-3-ила, 2,3-диметил-2-пропен-3-ила, 2-метил-2-пропен-3-ила, изопропенила,пропа-1,2-диен-3-ила, 3-метилпропа-1,2-диен-3-ила, 3-этилпропа-1,2-диен-3-ила, 1-бутен-4-ила, 1 пропин-3-ила, 2-пропин-3-ила, (+)-1-пропин-3-ила, (-)-1-пропин-3-ила, 1-гидрокси-2-пропин-3-ила, 1 фенил-1-пропин-3-ила, 2-бутин-4-ила и фенила. В другом варианте осуществления настоящего изобретения R4 выбирают из группы, состоящей из изопропенила, Z-2-пропен-3-ила и (+)-винила.-4 015542 В одном варианте осуществления настоящего изобретения R5 означает OR6; где R6 выбирают из группы, состоящей из водорода, метила, этила, -С(О)-метила и -С(О)-этила. В другом варианте осуществления настоящего изобретения R5 означает ОН. В одном варианте осуществления настоящего изобретения R4 и R5 вместе с атомом, с которым они связаны, образуют циклическую структуру, выбираемую из группы, состоящей из 2-пирролидинила, 2 тетрагидрофуранила, 2-(2,5-дигидро-1 Н-пирролила), 2-(2,5-дигидрофуранила), 2-имидазолидинила, 2 оксазолидинила, 2-[1,3]диоксоланила, 2-пиперидинила, 6-(1,2,3,6-тетрагидропиридинила), 2-(1,2,3,6 тетрагидропиридинила), 2-тетрагидропиранила, 6-(3,6-дигидро-2 Н-пиранила), 2-(3,6-дигидро-2 Н-пиранила), 2-(гексагидропиримидинила), 2-[1,3]оксазинанила и 2-[1,3]диоксанила; где циклическая структура необязательно замещена одним или более заместителями (предпочтительно одним-двумя, более предпочтительно одним заместителем), независимо выбираемыми из группы, состоящей из C1-2-алкила, -(C1-2 алкил)-ОН и -(C1-2-алкил галогена. В другом варианте осуществления настоящего изобретения R4 и R5 вместе с атомом, с которым они связаны, образуют циклическую структуру, выбираемую из группы, состоящей из 2,5-дигидрофуранила,2-тетрагидрофуранила, 2-[1,3]диоксоланила, 2-[1,3]диоксанила, 2-имидазолила и 2-оксазолидинила; где циклическая структура необязательно замещена одним или более заместителями (предпочтительно одним-двумя, более предпочтительно одним заместителем), независимо выбираемыми из группы, состоящей из метила, этила, гидроксиметила, гидроксиэтила и -(C1-2-алкил)галогена. В другом варианте осуществления настоящего изобретения R4 и R5 вместе с атомом, с которым они связаны, образуют циклическую структуру, выбираемую из группы, состоящей из 2,5-дигидрофуранила,2-тетрагидрофуранила, 2-[1,3]диоксоланила, 2-(4-гидроксиметил[1,3]диоксаланила), 2-(4-хлорметил[1,3]диоксаланила), 2-[1,3]диоксанила, 2-имидазолила и 2-оксазолидинила. В другом варианте осуществления настоящего изобретения R4 и R5 вместе с атомом, с которым они связаны, образуют циклическую структуру, выбираемую из группы, состоящей из 2 тетрагидрофуранила, 2-[1,3]диоксоланила, 2-(4-гидроксиметил[1,3]диоксаланила), 2-(4-хлорметил[1,3]диоксаланила), 2-[1,3]диоксанила, 2-имидазолила и 2-оксазолидинила. В другом варианте осуществления настоящего изобретения R4 и R5 вместе с атомом, с которым они связаны, образуют циклическую структуру, выбираемую из группы, состоящей из 2,5-дигидрофуранила и 2-тетрагидрофуранила. В другом варианте осуществления настоящего изобретения R4 и R5 вместе с атомом, с которым они связаны, образуют 2-[1,3]диоксаланил. Дополнительные варианты осуществления настоящего изобретения включают таковые, где заместители, выбираемые в случае одного или более переменных, указанных здесь (т.е. R1, R2, R3, R4, R5, R6),независимо выбирают из любого отдельного заместителя или любой подгруппы заместителей, выбираемых из полного перечня, как приведенный здесь. Дополнительные варианты осуществления настоящего изобретения включают любое отдельное соединение или подгруппу соединений, выбираемых из типичных соединений, перечисленных в нижеприводимых табл. 1-2. Типичные соединения согласно настоящему изобретению перечислены в нижеприводимых табл. 12. За исключением иначе указанного, когда во внесенном в список соединении имеется стереогенный центр, соединение получают в виде смеси стереоконфигураций. Подразумевают, что в том случае, где присутствует стереогенный центр, (+)- и (-)-обозначения указывают на то, что точная стереоконфигурация центра не определена, но определено направление оптического вращения.-5 015542 Таблица 1 Типичные соединения формулы (I)-6 015542 Таблица 2 Типичные соединения формулы (I) Используемый в настоящем описании термин галоген означает хлор, бром, фтор и иод. Используемый в настоящем описании термин алкил, используемый ли отдельно или как часть замещающей группы, включает линейные и разветвленные цепи. Например, алкильные радикалы включают метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил и т.п. За исключением иначе указанного, термин низший, когда используется вместе с алкилом, означает состав угле-7 015542 родной цепи из 1-4 атомов углерода. Используемый в настоящем описании термин алкенил, используемый ли отдельно или как часть замещающей группы, включает линейные и разветвленные углеродные цепи, где углеродная цепь содержит по меньшей мере одну, предпочтительно одну-две, более предпочтительно одну двойную связь. Например, алкенильные радикалы включают, но не ограничиваясь этим, аллил, 1-пропен-3-ил, 1-бутен-4 ил, пропа-1,2-диен-3-ил и т.п. За исключением иначе указанного, термин низший, когда используется вместе с алкенилом, означает состав углеродной цепи из 2-4 атомов углерода. Используемый в настоящем описании термин алкинил, используемый ли отдельно или как часть замещающей группы, включает линейные и разветвленные углеродные цепи, где углеродная цепь содержит по меньшей мере одну, предпочтительно одну-две, более предпочтительно одну тройную связь. Например, алкинильные радикалы включают, но не ограничиваясь этим, винил, 1-пропин-3-ил, 2-бутин 4-ил и т.п. За исключением иначе указанного, термин низший, когда используется вместе с алкинилом,означает состав углеродной цепи из 2-4 атомов углерода. Используемый в настоящем описании, за исключением иначе указанного, термин замещенный галогеном алкил или термин замещенный галогеном низший алкил означает любой алкил или низшую алкильную группу, как описано выше, замещенную по меньшей мере одним атомом галогена, выбираемым из группы, состоящей из фтора, хлора, брома или иода, предпочтительно фтора, хлора или брома,более предпочтительно фтора или хлора, наиболее предпочтительно фтора. Подобным образом, за исключением иначе указанного, термин фторированный алкил или термин фторированный низший алкил означает любую алкильную или низшую алкильную группу, как описано выше, замещенную по меньшей мере одним атомом фтора. Подходящие примеры включают, но не ограничиваясь этим, -CF3,-CH2-CF3, -CF2-CF2-CF2-CF3 и т.п. Предпочтительно фторированный алкил или фторированный низший алкил означает -CF3. Используемый в настоящем описании, за исключением иначе указанного, термин алкоксил означает содержащий кислород простого эфира радикал описанных выше алкильных групп с линейной или разветвленной цепью. Например, метокси-, этокси-, н-пропокси-, втор-бутокси-, трет-бутокси-, нгексилоксигруппа и т.п. Используемый в настоящем описании, за исключением иначе указанного, термин замещенный галогеном алкоксил или термин замещенный галогеном низший алкоксил означает любую алкоксильную или низшую алкоксильную группу, как описано выше, замещенную по меньшей мере одним атомом галогена, выбираемым из группы, состоящей из фтора, хлора, брома или иода, предпочтительно фтора,хлора или брома, более предпочтительно фтора или хлора, наиболее предпочтительно фтора. Подобным образом, используемый в настоящем описании, за исключением иначе указанного, термин фторированный алкоксил или термин фторированный низший алкоксил означает любую алкоксильную или низшую алкоксильную группу, как описано выше, замещенную по меньшей мере одним атомом фтора. Подходящие примеры включают, но не ограничиваясь этим, -OCF3, -OCH2-CF3, -OCF2-CF2-CF2-CF3 и т.п. Предпочтительно фторированный алкоксил или фторированный низший алкоксил означает -OCF3. Используемый в настоящем описании, за исключением иначе указанного, термин арил относится к незамещенным карбоциклическим ароматическим группам, таким как фенил, нафтил и т.п. Используемый в настоящем описании, за исключением иначе указанного, термин гетероарил означает любую пяти- или шестичленную ароматическую моноциклическую структуру, содержащую по меньшей мере один гетероатом, выбираемый из группы, состоящей из О, N и S, необязательно включающую один-три дополнительных гетероатома, независимо выбираемых из группы, состоящей из О, N и S; или девяти- или десятичленную ароматическую бициклическую структуру, содержащую по меньшей мере один гетероатом, выбираемый из группы, состоящей из О, N и S, необязательно включающую один-четыре дополнительных гетероатома, независимо выбираемых из группы, состоящей из О, N и S. Гетероарил может быть присоединен к любому гетероатому или атому углерода цикла, так что в результате образуется стабильная структура. Примеры подходящих гетероарильных групп включают, но не ограничиваясь этим, пирролил, фурил, тиенил, оксазолил, имидазолил, пиразолил, изоксазолил, изотиазолил, триазолил, тиадиазолил, пиридил, пиридазинил, пиримидинил, пиразинил, пиранил, фуразанил, индолизинил, индолил, изоиндолинил, индазолил, бензофурил, бензотиенил, бензимидазолил, бензтиазолил, пуринил, хинолизинил, хинолинил, изохинолинил, изотиазолил, циннолинил, фталазинил, хиназолинил, хиноксалинил, нафтиридинил, птеридинил и т.п. Используемое в настоящем описании обозначениеозначает присутствие стереогенного центра. Когда отдельная группа является замещенной (например, алкенил, арил, гетероарил и т.д.), такая группа может иметь один или более заместителей, предпочтительно один-пять заместителей, более предпочтительно один-три заместителя, наиболее предпочтительно один-два заместителя, независимо выбираемых из перечня заместителей. При ссылке на заместители термин независимо означает, что, когда возможны более чем один из-8 015542 таких заместителей, такие заместители могут быть одинаковыми или отличными друг от друга. Для более краткого описания, некоторые из количественных выражений, употребляемых здесь, не ограничены термином примерно. Понятно, что используют ли термин примерно явно или нет, подразумевают, что каждое количество, указанное здесь, относится к фактически определенному значению, и подразумевают, что оно также относится к приближению к такому определенному значению, которое должно быть приемлемо подразумеваемым для квалифицированного специалиста в данной области,включая приближение, обусловленное экспериментальными условиями и/или условиями измерения в случае такого определяемого значения. Используемый в настоящем описании, за исключением иначе указанного, термин защитная группа азота означает группу, которая может быть присоединена к атому азота для защиты вышеуказанного атома азота от участия в реакции и может быть без труда удалена после реакции. Подходящие защитные группы азота включают, но не ограничиваясь этим, карбаматы - группы формулы -C(O)O-R, где R означает, например, метил, этил, трет-бутил, бензил, фенилэтил, СН 2=СН-СН 2- и т.п.; амиды - группы формулы -C(O)-R', где R' означает, например, метил, фенил, трифторметил и т.п.; N-сульфонильные производные - группы формулы -SO2-R", где R" означает, например, толил, фенил, трифторметил, 2,2,5,7,8 пентаметилхроман-6-ил, 2,3,6-триметил-4-метоксибензол и т.п. Другие подходящие защитные группы азота можно найти в руководствах, таких как T.W. GreeneP.G.M. Wuts, Protective Groups in OrganicSynthesis, John WileySons, 1991. Согласно стандартной номенклатуре, используемой в настоящем описании, концевая часть указываемой боковой цепи описывается сначала с последующей соседней функциональной группой по отношению к точке присоединения. Так, например, заместитель фенил(C1-6-алкил)аминокарбонил(C1-6 алкил) относится к группе формулы Используемый в настоящем описании, за исключением иначе указанного, термин модулятор андрогена означает любое соединение, которое проявляет тканевую селективную агонистическую и/или антагонистическую активность. Например, модулятором андрогена может быть соединение, которое проявляет агонистическую активность в мышечной ткани и антагонистическую активность в ткани предстательной железы (например, в случае лечения кахексии). Далее, модулятором андрогена может быть соединение, которое проявляет различные степени агонистической или антагонистической активности в-9 015542 зависимости от типа ткани. Термин субъект, используемый в настоящем описании, относится к животному, предпочтительно к млекопитающему, более предпочтительно к человеку, который является объектом лечения, наблюдения или эксперимента. Термин терапевтически эффективное количество, используемый в настоящем описании, означает такое количество активного соединения или фармацевтического агента, которое вызывает биологический или медицинский ответ в тканевой системе животного или человека, к которому стремится исследователь, ветеринар, врач или другой клиницист, включающий ослабление симптомов подвергаемого лечению заболевания или нарушения. Как используется здесь, подразумевают, что термин композиция включает продукт, содержащий конкретные ингредиенты в конкретных количествах, а также любой продукт, который получают в результате, прямо или не прямо, комбинации конкретных ингредиентов в конкретных количествах. Когда соединения согласно настоящему изобретению имеют по меньшей мере один хиральный центр, они могут, соответственно, существовать в виде энантиомеров. Когда соединения имеют два или более хиральных центра, они могут дополнительно существовать в виде диастереомеров. Должно быть понятно, что все такие изомеры и их смеси входят в рамки настоящего изобретения. Кроме того, некоторые из кристаллических форм соединений могут существовать в виде полиморфов и подразумевают, что как таковые они входят в рамки настоящего изобретения. В дополнение, некоторые из соединений могут образовывать сольваты с водой (т.е. гидраты) или с обычными органическими растворителями, и подразумевают, что такие сольваты также входят в рамки настоящего изобретения. Соединения формулы (I), где R1 означает водород и R5 означает ОН, можно получать в соответствии со способом, показанным на схеме 1. Схема 1 Соответственно, подходящим образом замещенное соединение формулы (X), известное соединение или соединение, полученное с помощью известных способов, вводят во взаимодействие с подходящим образом замещенным соединением формулы (XI), где А 1 означает низший алкил, известным соединением или соединением, полученным с помощью известных способов, в присутствии кислоты Льюиса, такой как AlCl (CH2CH3)2, Al(CH3)3, TiCl4 и т.п., в органическом растворителе, таком как толуол, ксилолы и т.п., при температуре выше, чем примерно комнатная температура, предпочтительно при температуре примерно 80 С, более предпочтительно почти при температуре кипения с обратным холодильником, с получением соответствующего соединения формулы (Ia). Соединения формулы (I), где R1 означает водород и R5 означает ОН, альтернативно можно получать в соответствии со способом, представленным на нижеприводимой схеме 2. Схема 2 Соответственно, подходящим образом замещенное соединение формулы (X), известное соединение или соединение, полученное с помощью известных способов, вводят во взаимодействие с подходящим образом замещенным соединением формулы (XII), в присутствии кислоты, такой как HCl, H2SO4, HBr и т.п., в воде; или в присутствии неразбавленной (т.е. в отсутствие дополнительного растворителя) полифосфорной кислоты (РРА); при температуре выше, чем примерно комнатная температура, предпочтительно почти при температуре кипения с обратным холодильником, с получением соответствующего соединения формулы (XIII). Соединение формулы (XIII) вводят во взаимодействие с подходящим образом выбранным окислителем, получая соответствующее соединение формулы (XIV). Например, соединение формулы (XIII) может быть введено во взаимодействие с обесцвечивающей смесью и TEMPO, в присутствии межфазно- 10015542 го катализатора, такого как TBAHS, в присутствии соли, такой как KBr, в двухфазной смеси воды и органического растворителя (такого как этилацетат, ДХМ и т.п.), с получением соответствующего соединения формулы (XIV). Альтернативно, соединение формулы (XIII) может быть введено во взаимодействие со смесью CrO3 и H2SO4, в растворителе, таком как вода, ДХМ и т.п., с получением соответствующего соединения формулы (XIV). Еще альтернативно, соединение формулы (XIII) может быть введено во взаимодействие с периодинаном Десс-Мартина, в органическом растворителе, таком как ДХМ, бензол и т.п., с получением соответствующего соединения формулы (XIV). Предпочтительно соединение формулы (XIV) высушивают для удаления любой гидратной воды или любого гидратного компонента. Соединение формулы (XIV) вводят во взаимодействие с подходящим образом замещенным соединением формулы (XV), где М означает MgCl, MgBr, MgI или Li, известным соединением или соединением, полученным с помощью известных способов, с получением соответствующего соединения формулы(Ia). Например, когда в соединении формулы (XV) М означает MgCl, MgBr, MgI или Li, соединение формулы (XIV) вводят во взаимодействие с соединением формулы (XV) в безводном органическом растворителе, таком как ТГФ, диэтиловый эфир и т.п., предпочтительно при температуре ниже, чем примерно комнатная температура, более предпочтительно при температуре почти 0 С, с получением соответствующего соединения формулы (Ia). Альтернативно, когда в соединении формулы (XV) М означает Br, соединение формулы (XIV) вводят во взаимодействие с соединением формулы (XV), в присутствии металла, в смеси из водного раствора с рН, равным от примерно 7 до примерно 4, предпочтительно с рН от примерно 3 до примерно 4, и органического растворителя, такого как этилацетат, ДХМ и т.п., предпочтительно при примерно комнатной температуре, с получением соответствующего соединения формулы (Ia). Квалифицированному специалисту в данной области должно быть понятно, что, когда соединение формулы (XIV) вводят во взаимодействие с соединением формулы (XV), где М означает MgCl, MgBr,MgI или Li, соединение формулы (XIV) предпочтительно высушивают перед введением во взаимодействие. Предпочтительно соединение формулы (XIV) вводят во взаимодействие с соединением формулы(XV), где М означает MgCl, MgBr, MgI или Li, для получения соединений формулы (I), где R4 означает алкил, алкенил, арил, (С 2-4-алкил)арил, гетероарил или -(низший алкил)гетероарил. Предпочтительно соединение формулы (XIV) вводят во взаимодействие с соединением формулы(XV), где М означает Br, для получения соединения формулы (I), где R4 означает алкенил, -(СН)-алкенил или -(СН 2)-алкинил. Соединения формулы (I), где R4 и R5 вместе с атомом, с которым они связаны, образуют циклическую структуру, содержащую один гетероатом, могут быть получены в соответствии со способом, представленным на нижеприводимой схеме 3. Схема 3 Соответственно, подходящим образом замещенное соединение формулы (X), известное соединение или соединение, полученное с помощью известных способов, вводят во взаимодействие с подходящим образом замещенным соединением формулы (XVI), где А 1 означает низший алкил, известным соединением или соединением, полученным с помощью известных способов, в присутствии кислоты Льюиса,такой как AlCl(CH2CH3)2, Al(CH3)3, TiCl4 и т.п., в органическом растворителе, таком как толуол, ксилолы и т.п., при температуре выше, чем примерно комнатная температура, предпочтительно при температуре примерно 80 С, более предпочтительно почти при температуре кипения с обратным холодильником, с получением соответствующего соединения формулы (Ib). Соединения формулы (I), где R4 и R5 вместе с атомом, с которым они связаны, образуют циклическую структуру, содержащую два гетероатома кислорода, можно альтернативно получать в соответствии со способом, представленным на нижеприводимой схеме 4. Соответственно, подходящим образом замещенное соединение формулы (XVII), известное соединение или соединение, полученное в соответствии с известными способами, вводят во взаимодействие с подходящим образом замещенным соединением формулы (XVIII), где R0 выбирают из группы, состоящей из водорода, низшего алкила, -(низший алкил)-ОН и -(низший алкил)(галогена), известным соединением или соединением, полученным с помощью известных способов, в присутствии неорганического основания, такого как K2CO3, Na2CO3, CS2CO3 и т.п., в органическом растворителе, таком как ДМФА,ДМСО и т.п., с получением соответствующих соединений формулы (Ic). Соединения формулы (I), где R4 и R5 вместе с атомом, с которым они связаны, образуют циклическую структуру, содержащую два гетероатома азота, можно получать в соответствии со способом, представленным на нижеприводимой схеме 5. Схема 5 Соответственно, подходящим образом замещенное соединение формулы (XVII), известное соединение или соединение, полученное с помощью известных способов, вводят во взаимодействие с подходящим образом замещенным соединением формулы (XIX), где R0 выбирают из группы, состоящей из водорода, низшего алкила, -(низший алкил)-ОН и -(низший алкил)(галогена), известным соединением или соединением, полученным с помощью известных способов, в присутствии катализатора, такого какpTsOH, PPTS и т.п., в органическом растворителе, таком как толуол, ксилолы и т.п., при температуре выше, чем примерно комнатная температура, предпочтительно почти при температуре кипения с обратным холодильником, с получением соответствующего соединения формулы (Id). Соединения формулы (I), где R4 и R5 вместе с атомом, с которым они связаны, образуют циклическую структуру, содержащую гетероатомы кислорода и азота, можно альтернативно получать в соответствии со способом, представленным на нижеприводимой схеме 6. Схема 6 Соответственно, подходящим образом замещенное соединение формулы (XVII) вводят во взаимодействие с подходящим образом замещенным соединением формулы (XX), где R0 выбирают из группы,состоящей из водорода, низшего алкила, -(низший алкил)-ОН и -(низший алкил)(галогена), в присутствии неорганического основания, такого как K2CO3, Na2CO3, Cs2CO3 и т.п., в органическом растворителе,таком как ДМФА, ДМСО и т.п., с получением соответствующего соединения формулы (Ie). Квалифицированному специалисту в данной области должно быть понятно, что соединения формулы (I), где R4 и R5 вместе с атомом, с которым они связаны, образуют циклическую структуру, можно альтернативно получать в соответствии со способами, представленными на вышеприведенных схемах 4,5 и 6, путем замены соединения формулы (XVII) подходящим образом замещенным соединением формулы (XXI) известным соединением или соединением, полученным с помощью известных способов (например, как описано в примере 2, который приводится здесь далее). Квалифицированному специалисту в данной области должно быть понятно, что соединение формулы (XXI) уравновешивается с соответствующим соединением формулы (XVII) в присутствии воды. Соединения формулы (I), где R5 означает -OR6, и R6 является другим, чем водород, можно получать из соответствующего соединения формулы (Ia), в соответствии с известными способами, например, путем алкилирования, ацилирования, введения во взаимодействие с подходящим образом замещенным соединением формулы R1-Br в присутствии NaH и т.п. Соединения формулы (I), где R1 является другим, чем водород, можно получать из соответствующего соединения формулы (Ia) в соответствии с известными способами, например путем алкилирования,ацилирования, сульфонилирования и т.п. Квалифицированному специалисту в данной области должно быть понятно, что, когда стадия реакции согласно настоящему изобретению может быть осуществлена во множестве растворителей или растворяющих систем, вышеуказанную стадию реакции также можно осуществлять в смеси подходящих растворителей или растворяющих систем. Когда способы получения соединений согласно настоящему изобретению приводят к образованию смеси стереоизомеров, эти изомеры можно разделять обычными методами, такими как препаративная хроматография. Соединения могут быть получены в рацемической форме, или индивидуальные энантиомеры могут быть получены либо путем энантиоспецифического синтеза, либо путем разделения. Соединения, например, могут быть разделены на составляющие их энантиомеры стандартными методами,такими как получение диастереомерных пар путем образования соли с оптически активной кислотой,такой как (-)-ди-п-толуоил-D-винная кислота и/или (+)-ди-п-толуоил-L-винная кислота, с последующей фракционной кристаллизацией и регенерацией свободного основания. Соединения также могут быть разделены путем получения диастереомерных сложных эфиров или амидов, с последующим хроматографическим разделением и удалением хирального вспомогательного агента. Альтернативно, соединения могут быть разделены с использованием хиральной колоночной ВЭЖХ. Во время любого из способов получения соединений согласно настоящему изобретению может быть необходимо и/или желательно защищать чувствительные или реакционноспособные группы в случае любой из имеющих к этому отношение молекул. Этого можно достигать посредством обычных защитных групп, таких как таковые, описанные в руководствах Protective Groups in Organic Chemistry,ред. J.F.W. McOmie, Plenum Press, 1973; и T.W. GreeneP.G.M. Wuts, Protective Groups in Organic Synthesis, John WileySons, 1991. Защитные группы можно удалять на подходящей последующей стадии,используя методы, известные в уровне техники. Настоящее изобретение включает в свои рамки пролекарства соединений согласно настоящему изобретению. Вообще, такие пролекарства должны быть функциональными производными соединений,которые без труда превращаются in vivo в необходимые соединения. Таким образом, в случае способов лечения согласно настоящему изобретению, термин введение включает лечение различных описанных нарушений с помощью конкретно указанного соединения или соединения, которое может быть конкретно не указано, но которое превращается в конкретное соединение in vivo после введения пациенту. Обычные способы в отношении выбора и получения подходящих пролекарственных производных описаны, например, в "Design of Prodrugs", ред. Н. Bundgaard, Elsevier, 1985. Для применения в медицине соли соединений согласно настоящему изобретению относятся к нетоксичным фармацевтически приемлемым солям. Другие соли, однако, могут быть пригодны для получения соединений согласно настоящему изобретению или их фармацевтически приемлемых солей. Подходящие фармацевтически приемлемые соли соединений включают кислотно-аддитивные соли, которые, например, могут быть образованы путем смешения раствора соединения с раствором фармацевтически приемлемой кислоты, такой как соляная кислота, серная кислота, фумаровая кислота, малеиновая кислота, янтарная кислота, уксусная кислота, бензойная кислота, лимонная кислота, винная кислота,угольная кислота или фосфорная кислота. Кроме того, когда соединения согласно настоящему изобретению содержат кислотный остаток, их подходящие фармацевтически приемлемые соли могут включать соли щелочных металлов, например соли натрия или калия; соли щелочно-земельных металлов, например соли кальция или магния; и соли, образованные с подходящими органическими лигандами, например четвертичные аммониевые соли. Таким образом, типичные фармацевтически приемлемые соли включают следующие: ацетат, бензолсульфонат, бензоат, бикарбонат, бисульфат, битартрат, борат, бромид, эдетат каль- 13015542 ция, камзилат, карбонат, хлорид, клавуланат, цитрат, дигидрохлорид, эдетат, эдизилат, эстолат, эзилат,фумарат, глюцептат, глюконат, глутамат, гликоллиларсанилат, гексилрезорцинат, гидрабамин, гидробромид, гидрохлорид, гидроксинафтоат, иодид, изотионат, лактат, лактобионат, лаурат, малат, малеат,манделат, мезилат, метилбромид, метилнитрат, метилсульфат, мукат, напзилат, нитрат, Nметилглюкаминаммониевая соль, олеат, памоат (эмбонат), пальмитат, пантотенат, фосфат/дифосфат, полигалактуронат, салицилат, стеарат, сульфат, субацетат, сукцинат, таннат, тартрат, теоклат, тозилат, триэтиодид и валерат. Типичные кислоты и основания, которые могут быть использованы для получения фармацевтически приемлемых солей, включают следующие: кислоты, включая уксусную кислоту, 2,2-дихлоруксусную кислоту, ацилированные аминокислоты,адипиновую кислоту, альгиновую кислоту, аскорбиновую кислоту, L-аспарагиновую кислоту, бензолсульфоновую кислоту, бензойную кислоту, 4-ацетамидобензойную кислоту, (+)-камфорную кислоту,камфорсульфоновую кислоту, (+)-(1S)-камфора-10-сульфоновую кислоту, каприновую кислоту, капроновую кислоту, каприловую кислоту, коричную кислоту, лимонную кислоту, цикламиновую кислоту,додецилсерную кислоту, этан-1,2-дисульфоновую кислоту, этансульфоновую кислоту, 2 гидроксиэтансульфоновую кислоту, муравьиную кислоту, фумаровую кислоту, галактаровую кислоту,гентизиновую кислоту, глюкогептоновую кислоту, D-глюконовую кислоту, D-глюкороновую кислоту, Lглутаминовую кислоту, -оксоглутаровую кислоту, гликолевую кислоту, гипуровую кислоту, бромоводородную кислоту, соляную кислоту, (+)-L-молочную кислоту, -DL-молочную кислоту, лактобионовую кислоту, малеиновую кислоту, (-)-L-яблочную кислоту, малоновую кислоту, -DL-миндальную кислоту, метансульфоновую кислоту, нафталин-2-сульфоновую кислоту, нафталин-1,5-дисульфоновую кислоту, 1-гидрокси-2-нафтойную кислоту, никотиновую кислоту, азотную кислоту, олеиновую кислоту,оротовую кислоту, щавелевую кислоту, пальмитиновую кислоту, памоевую кислоту, фосфорную кислоту, L-пироглутаминовую кислоту, салициловую кислоту, 4-аминосалициловую кислоту, себаевую кислоту, стеариновую кислоту, янтарную кислоту, серную кислоту, дубильную кислоту, (+)-L-винную кислоту, тиоциановую кислоту, п-толуолсульфоновую кислоту и ундециленовую кислоту; и основания, включая аммиак, L-аргинин, бенетамин, бензатин, гидроксид кальция, холин, деанол,диэтаноламин, диэтиламин, 2-(диэтиламино)этанол, этаноламин, этилендиамин, N-метилглюкамин, гидрабамин, 1 Н-имидазол, L-лизин, гидроксид магния, 4-(2-гидроксиэтил)морфолин, пиперазин, гидроксид калия, 1-(2-гидроксиэтил)пирролидин, вторичный амин, гидроксид натрия, триэтаноламин, трометамин и гидроксид цинка. Настоящее изобретение, далее, включает фармацевтические композиции, содержащие одно или более соединений формулы (I) с фармацевтически приемлемым носителем. Фармацевтические композиции,содержащие одно или более соединений согласно настоящему изобретению, описанных здесь, в качестве активного ингредиента, могут быть получены путем тщательного смешения соединения или соединений с фармацевтическим носителем в соответствии с обычными фармацевтическими способами смешения. Носитель может иметь большое разнообразие форм в зависимости от желательного пути введения (например, пероральный, парентеральный). Так, в случае жидких пероральных готовых лекарственных форм, таких как суспензии, эликсиры и растворы, подходящие носители и добавки включают воду, гликоли, масла, спирты, ароматизирующие агенты, консерванты, стабилизаторы, красители и т.п.; в случае твердых пероральных готовых лекарственных форм, таких как порошки, капсулы и таблетки, подходящие носители и добавки включают крахмалы, сахара, разбавители, гранулирующие агенты, смазочные вещества, связующие агенты, дезинтегрирующие агенты и т.п. На твердые пероральные готовые лекарственные формы также могут быть нанесены покрытия с помощью веществ, таких как сахара, или они могут быть покрыты энтеросолюбильной оболочкой с тем, чтобы модулировать большой участок абсорбции. Для парентерального введения носитель обычно состоит из стерильной воды, и могут быть добавлены другие ингредиенты для улучшения растворимости или сохранения. Инъецируемые суспензии или растворы также могут быть получены при использовании водных носителей вместе с соответствующими добавками. Для получения фармацевтических композиций согласно настоящему изобретению одно или более соединений согласно настоящему изобретению в качестве активного ингредиента тщательно смешивают с фармацевтическим носителем в соответствии со стандартными фармацевтическими способами смешения, причем носитель может принимать большое разнообразие форм в зависимости от формы лекарственного препарата, желательной для введения, например пероральная или парентеральная, такая как внутримышечная. При получении композиций в пероральной лекарственной форме можно использовать любую из обычных фармацевтических сред. Так, в случае жидких пероральных готовых лекарственных форм, таких как, например, суспензии, эликсиры и растворы, подходящие носители и добавки включают воду, гликоли, масла, спирты, ароматизирующие агенты, консерванты, красители и т.п.; в случае твердых пероральных готовых лекарственных форм, таких как, например, порошки, капсулы, каплеты, гелькапсы и таблетки, подходящие носители и добавки включают крахмалы, сахара, разбавители, гранулирующие агенты, смазочные вещества, связующие агенты, дезинтегрирующие агенты и т.п. Вследствие легкости их введения таблетки и капсулы представляют собой наиболее преимущественную пероральную разовую- 14015542 лекарственную форму, в случае которой, очевидно, используют твердые фармацевтические носители. Если желательно, на таблетки может быть нанесено покрытие из сахара, или они могут быть покрыты энтеросолюбильной оболочкой при использовании стандартных способов. В случае парентеральных форм носитель обычно включает стерильную воду, однако могут быть включены другие ингредиенты,например, для целей, таких как способствование растворимости или для сохранения. Также можно получать инъецируемые суспензии, в случае которых можно использовать подходящие жидкие носители,суспендирующие агенты и т.п. Фармацевтические композиции согласно настоящему описанию содержат на разовую лекарственную форму, например таблетку, капсулу, порошок, инъекцию, объем чайной ложки и т.п., количество активного ингредиента, необходимое для доставки эффективной дозы, как описано выше. Фармацевтические композиции согласно настоящему описанию содержат на разовую лекарственную форму, например таблетку, капсулу, порошок, инъекцию, суппозиторий, объем чайной ложки и т.п.,примерно 0,01-500 мг активного ингредиента и могут быть получены в дозировке примерно 0,05-500 мг/кг/сутки, предпочтительно примерно 0,05-10 мг/кг/сутки, более предпочтительно примерно 0,1-5,0 мг/кг/сутки или в любом в этом отношении диапазоне. Дозы, однако, можно варьировать в зависимости от потребности пациентов, тяжести состояния, которое подвергают лечению, и используемого соединения. Можно осуществлять или введение в течение суток, или постпериодическое дозирование. Предпочтительно эти композиции находятся в виде разовых лекарственных форм, таких как таблетки, пилюли, капсулы, порошки, гранулы, стерильные парентеральные растворы или суспензии, дозированный аэрозоль или жидкие спреи, капли, ампулы, автоинжекторные устройства или суппозитории; для перорального, парентерального, интраназального, сублингвального или ректального введения или для введения в виде ингаляции или инсуффляции. Альтернативно, композиция может находиться в форме, пригодной для введения один раз в неделю или для введения один раз в месяц; например нерастворимая соль активного соединения, такая как деканоат, может быть использована для получения депопрепарата для внутримышечной инъекции. Для получения твердых композиций, таких как таблетки, основной активный ингредиент смешивают с фармацевтическим носителем, например со стандартными ингредиентами для таблетирования, такими как кукурузный крахмал, лактоза, сахароза, сорбит, тальк,стеариновая кислота, стеарат магния, дикальцийфосфат или камеди и другими фармацевтическими разбавителями, например водой, для получения твердой, предварительно подготовленной композиции, содержащей гомогенную смесь соединения согласно настоящему изобретению, или его фармацевтически приемлемой соли. Когда ссылаются на эти предварительно подготовленные композиции как на гомогенные, подразумевают, что активный ингредиент равномерно диспергирован во всей композиции, так что композицию можно, без труда, подразделять на в равной степени эффективные лекарственные формы,такие как таблетки, пилюли и капсулы. Эту твердую предварительно подготовленную композицию затем подразделяют на разовые лекарственные формы описанного выше типа, содержащие от 0,1 до примерно 500 мг активного ингредиента согласно настоящему изобретению. На таблетки или пилюли новой композиции может быть нанесено покрытие, или они могут быть иным образом компаундированы для получения лекарственной формы, обладающей преимуществом пролонгированного действия. Например, таблетка или пилюля может содержать внутренний лекарственный компонент и внешний лекарственный компонент, причем последний находится в форме покрытия для первого. Два компонента могут быть разделены энтеросолюбильным слоем, который служит для противодействия дезинтеграции в желудке и позволяет внутреннему компоненту проходить нетронутым в двенадцатиперстную кишку или пролонгированно высвобождаться. Можно использовать множество веществ для таких энтеросолюбильных слоев или покрытий, причем такие вещества включают некоторое количество полимерных кислот с такими веществами, как шеллак, цетиловый спирт и ацетат целлюлозы. Жидкие формы, в которых новые композиции согласно настоящему изобретению могут быть включены для введения перорально или путем инъекции, включают водные растворы, подходящим образом ароматизированные сиропы, водные или масляные суспензии и ароматизированные эмульсии с пищевыми маслами, такими как хлопковое масло, кунжутное масло, кокосовое масло или арахисовое масло, а также эликсиры и подобные фармацевтические эксципиенты. Подходящие диспергирующие или суспендирующие агенты для водных суспензий включают синтетические и природные камеди, такие как трагакант, гуммиарабик, альгинат, декстран, натрийкарбоксиметилцелюлоза, метилцеллюлоза, поливинилпирролидон или желатин. Способ лечения нарушений или состояний, модулируемых рецептором андрогена, как описанный в настоящем изобретении, также можно осуществлять, используя фармацевтическую композицию, содержащую любое из соединений, как описанные здесь, и фармацевтически приемлемый носитель. Фармацевтическая композиция может содержать от примерно 0,01 до примерно 500 мг, предпочтительно примерно 1-100 мг соединения и может находиться в любой форме, пригодной для выбранного способа введения. Носители включают необходимые и инертные фармацевтические эксципиенты, включая, но не ограничиваясь этим, связующие вещества, суспендирующие агенты, смазочные вещества, ароматизирующие агенты, подсластители, консерванты, красители и средства для покрытий. Композиции, пригодные для перорального введения, включают твердые формы, такие как пилюли, таблетки, каплеты, капсулы (причем каждая включает готовые лекарственные формы с немедленным высвобождением, высвобо- 15015542 ждением во времени и пролонгированным высвобождением), гранулы и порошки, и жидкие формы, такие как растворы, сиропы, эликсиры, эмульсии и суспензии. Формы, пригодные для парентерального введения, включают стерильные растворы, эмульсии и суспензии. Преимущественно соединения согласно настоящему изобретению можно вводить в виде одной дозы в сутки, или общая суточная доза может быть введена в виде разделенных доз два, три или четыре раза в сутки. Кроме того, соединения согласно настоящему изобретению можно вводить в интраназальной форме посредством местного применения пригодных интраназальных сред или посредством трансдермальных кожных пластырей, как хорошо известно квалифицированному специалисту в данной области. Для введения в форме трансдермальной системы доставки введение дозы, конечно, должно быть предпочтительнее непрерывным, чем нерегулярным, на всем протяжении схемы приема лекарственного средства. Например, для перорального введения в форме таблетки или капсулы активный компонент лекарственного средства можно комбинировать с пероральным нетоксическим фармацевтически приемлемым инертным носителем, таким как этанол, глицерин, вода и т.п. Кроме того, если желательно или необходимо, также можно вводить в смесь пригодные связующие вещества, смазочные вещества, дезинтегрирующие агенты и красители. Пригодные связующие вещества включают, без ограничения этим перечнем, крахмал, желатин, природные сахара, такие как глюкоза или -лактоза, кукурузные подсластители,природные и синтетические камеди, такие как гуммиарабик, трагакант или олеат натрия, стеарат натрия,стеарат магния, бензоат натрия, ацетат натрия, хлорид натрия и т.п. Дезинтегрирующие агенты включают, без ограничения этим перечнем, крахмал, метилцеллюлозу, агар, бентонит, ксантановую камедь и т.п. Жидкие формы включают подходящим образом ароматизированные суспендирующие или диспергирующие агенты, такие как синтетические и природные камеди, например трагакант, гуммиарабик, метилцеллюлоза и т.п. Для парентерального введения желательны стерильные суспензии и растворы. Изотонические готовые лекарственные формы, обычно содержащие пригодные консерванты, используют,когда желательно внутривенное введение. Соединение согласно настоящему изобретению также можно вводить в форме липосомных систем доставки, таких как небольшие униламеллярные везикулы, большие униламеллярные везикулы и мультиламеллярные везикулы. Липосомы могут быть получены из ряда фосфолипидов, таких как холестерин,стеариламин или фосфатидилхолины. Соединения согласно настоящему изобретению также могут быть доставлены путем использования моноклональных антител в качестве индивидуальных носителей, с которыми связаны молекулы соединения. Соединения согласно настоящему изобретению также могут быть связаны с растворимыми полимерами в качестве нацеливаемых носителей лекарственных средств. Такие полимеры могут включать поливинилпирролидон, пирановый сополимер, полигидроксипропилметакриламидфенол, полигидроксиэтиласпартамидфенол или полиэтиленоксидполилизин, замещенный пальмитоильным остатком. Кроме того, соединения согласно настоящему изобретению могут быть связаны с классом биоразлагаемых полимеров, пригодных для достижения контролируемого высвобождения лекарственного средства, как,например, полимолочная кислота, полиэпсилонкапролактон, полигидроксимасляная кислота, сложные полиортоэфиры, полиацетали, полидигидропираны, полицианоакрилаты и поперечно-сшитые или амфипатические блок-сополимеры гидрогелей. Соединения согласно настоящему изобретению могут быть введены в любую из вышеупомянутых композиций и в соответствии со схемами приема, установленными в данной области, когда необходимо лечение нарушений или состояний, модулируемых рецептором андрогена. Суточная доза продуктов может варьироваться в широком диапазоне, от 0,01 до 500 мг на взрослого человека в сутки. Для перорального введения композиции предпочтительно получают в форме таблеток, содержащих 0,01, 0,05, 0,1, 0,5, 1,0, 2,5, 5,0, 10,0, 15,0, 25,0, 50,0, 100, 150, 200, 250 и 500 мг активного ингредиента для симптоматического регулирования дозировки в случае пациента, подвергаемого лечению. Эффективное количество лекарственного средства обычно удовлетворяет уровню дозировки от примерно 0,01 до примерно 500 мг/кг массы тела в сутки. Предпочтительно диапазон составляет от примерно 0,5 до примерно 10,0 мг/кг массы тела в сутки, более предпочтительно от примерно 0,1 до примерно 5,0 мг/кг массы тела в сутки. Соединения можно вводить при режиме 1-4 раза в сутки. Оптимально вводимые дозировки могут быть без труда определены квалифицированным специалистом в данной области, и они могут варьироваться в зависимости от конкретно используемого соединения, способа введения, эффективности готового лекарственного средства, пути доставки и прогрессирования состояния заболевания. В дополнение, факторы, ассоциируемые с конкретным пациентом, которого подвергают лечению, включающие возраст пациента, массу тела, диету и время введения, приводят к необходимости регулирования дозировок. Следующие примеры приводятся для способствования пониманию настоящего изобретения и не подразумевают и не должны быть истолкованы как ограничение каким-либо путем настоящего изобретения, излагаемого в формуле изобретения, которая следует далее. В примерах, которые следуют ниже, некоторые синтетические продукты перечислены как выделен- 16015542 ные в виде остатка. Квалифицированному специалисту в данной области должно быть понятно, что термин остаток не ограничивает физическое состояние, в котором выделяют продукт, и может включать,например, твердое вещество, масло, пену, смолу, сироп и т.п. Пример 1. 1-(5,6-Дихлор-1 Н-бензимидазол-2-ил)-2,2,2-трифторэтанол. В 4-горлую колбу емкостью 1 л, оснащенную регулятором температуры с термопарой, верхней механической мешалкой, конденсатором и адаптером для ввода/вывода азота, вводят 4,5-дихлор-1,2 фенилендиамин (71,3 г, 0,403 моль), трифтормолочную кислоту (87,0 г, 0,604 моль) и 4 н. раствор HCl(340 мл). Реакционную смесь кипятят с обратным холодильником в течение 18 ч (температура составляет 100 С). Полученный раствор охлаждают до комнатной температуры и затем разбавляют с помощьюEtOAc (1 л) и воды (1 л). Этот раствор медленно обрабатывают с помощью NaHCO3 (500 г) до тех пор,пока рН не достигнет значения 8-9. После прекращения вспенивания фазы разделяют и водный слой экстрагируют с помощью EtOAc (3 раза по 1 л). Объединенную органическую фазу промывают водой (1 л) и насыщенным солевым раствором (1 л), сушат над MgSO4, отфильтровывают и выпаривают досуха, получая сырой остаток. Этот сырой остаток очищают с помощью флэш-хроматографии, используя SiO2 (2 кг) и смесь 10% EtOAc/CH2Cl2 (2 л) и 20% EtOAc/CH2Cl2 (32 л), и продукт высушивают в вакууме в течение 18 ч при температуре 60 С, получая указанное в заголовке соединение в виде твердого вещества коричневатого цвета. Пример 2. 1-(5,6-Дихлор-1 Н-бензимидазол-2-ил)-2,2,2-трифторэтанон. В 4-горлую колбу емкостью 3 л, оснащенную регулятором температуры с термопарой, верхней механической мешалкой, капельной воронкой и адаптером для ввода/вывода азота, вводят 1-(5,6-дихлор 1 Н-бензимидазол-2-ил)-2,2,2-трифторэтанол (91,0 г, 0,32 моль), 4-метокси-ТЕМРО (14,3 г, 0,077 моль) иKBr (4 г, 0,0336 моль) в ТГФ (900 мл). Гомогенный раствор коричневого цвета перемешивают в течение 15 мин при охлаждении до температуры -10 С. После охлаждения по каплям добавляют NaOCl (670 мл) в течение 1/2 ч. Реакционную смесь разбавляют с помощью EtOAc (1,5 л) и воды (1,5 л). После прекращения вспенивания фазы разделяют и водный слой экстрагируют с помощью EtOAc (2 л). Объединенный органический слой промывают насыщенным солевым раствором (2 л), сушат над Na2SO4, отфильтровывают и выпаривают досуха, получая сырой остаток. Этот сырой остаток очищают с помощью флэшхроматографии, используя SiO2 (1 кг) и смесь 40% EtOAc/гексаны (24 л), и продукт высушивают в вакууме в течение 18 ч при температуре 50 С, получая 1-(5,6-дихлор-1 Н-бензимидазол-2-ил)-2,2,2 трифторэтанон в виде твердого вещества желтого цвета. Пример 3. 2-(5,6-Дихлор-1 Н-бензимидазол-2-ил)-1,1,1-трифторпент-4-ен-2-ол ( 1). 1-(5,6-Дихлор-1 Н-бензимидазол-2-ил)-2,2,2-трифторэтанон (1,41 г, 4,99 ммоль), аллилбромид (0,85 мл, 10,05 ммоль) и индий (1,15 г, 10,05 ммоль) суспендируют в ТГФ (50 мл) и 0,01 М растворе HCl (150 мл) и энергично перемешивают в течение 18 ч. Слои разделяют и водный слой экстрагируют этилацетатом (3 раза по 30 мл). Объединенные экстракты промывают насыщенным солевым раствором (50 мл) и сушат над Na2SO4. Полученное сырое масло коричневого цвета очищают с помощью колоночной хроматографии (SiO2, смесь 20% этилацетат/гексаны), получая указанное в заголовке соединение в виде твердого вещества желто-коричневого цвета. 1 Н ЯМР (400 МГц, CD3CN):7,79 (с, 2 Н),5,59 (м, 1 Н),5,17 (д, J=17,1 Гц, 1 Н),5,07 (д, J=11 Гц,1 Н),3,13 (дд, J=6,8, 14,3 Гц, 1 Н),2,88 (дд, J=7,2, 14,3 Гц, 1 Н).(+)-Энантиомер 2-(5,6-дихлор-1 Н-бензимидазол-2-ил)-1,1,1-трифторпент-4-ен-2-ола ( 23) и (-)энантиомер 2-(5,6-дихлор-1 Н-бензимидазол-2-ил)-1,1,1-трифторпент-4-ен-2-ола ( 24). Порцию продукта, полученного в соответствии с методикой, описанной выше, растворяют в смеси 20% изопропанол/гексан и хроматографируют, используя колонку ChiralPak AD размером 550 см (объ- 17015542 емная скорость потока 70 мл/мин, подвижная фаза: смесь 10% изопропанол/гексан), элюируя сначала (+)энантиомер ( 23), затем (-)-энантиомер ( 24). Данные 1 Н-ЯМР и масс-спектрометрии для двух выделенных соединений идентичны таковым соединения 1, выделенного выше. Пример 4. 2-(5,6-Дихлор-1 Н-бензимидазол-2-ил)-1,1,1-трифторпента-3,4-диен-2-ол ( 3) и 2-(5,6 дихлор-1 Н-бензимидазол-2-ил)-1,1,1-трифторпент-4-ин-2-ол ( 2).(80%-ный раствор в толуоле, 1,10 мл, 15,4 ммоль) и индий (1,56 г, 13,6 ммоль) суспендируют в ТГФ (50 мл) и 0,01 М растворе HCl (150 мл) и энергично перемешивают в течение 18 ч. Слои разделяют и водный слой экстрагируют этилацетатом (3 раза по 30 мл). Объединенные экстракты промывают насыщенным солевым раствором (50 мл) и сушат над Na2SO4. Полученное сырое масло коричневого цвета представляет собой смесь 2-(5,6-дихлор-1 Н-бензимидазол-2-ил)-1,1,1-трифторпента-3,4-диен-2-ола и 2-(5,6-дихлор 1 Н-бензимидазол-2-ил)-1,1,1-трифторпент-4-ин-2-ола, которую очищают с помощью колоночной хроматографии (SiO2, смесь 20% этилацетат/гексаны). 2-(5,6-Дихлор-1 Н-бензимидазол-2-ил)-1,1,1-трифторпента-3,4-диен-2-ол выделяют в виде твердого вещества светло-желтого цвета. 1 Н ЯМР (300 МГц, CD3CN):7,82 (с, 2 Н),5,93 (т, J=6,7 Гц, 1 Н),5,16 (д, J=6,6 Гц, 1 Н).MS измерено: 323, 325 (М+Н); 321, 323 (М-1). 2-(5,6-Дихлор-1 Н-бензимидазол-2-ил)-1,1,1-трифторпент-4-ин-2-ол выделяют в виде твердого вещества оранжево-желтого цвета. 1 Н ЯМР (400 МГц, CD3CN):7,82 (с, 2 Н),3,35 (дд, J=2,6, 16,8 Гц, 1 Н),3,11 (дд, J=2,6, 17,0 Гц,1 Н) ,5,59 (м, 1 Н),2,18 (с, 1 Н).(-)-энантиомер 2-(5,6-дихлор-1 Н-бензимидазол-2-ил)-1,1,1-трифторпента-3,4-диен-2-ола ( 32). Порцию продукта выделенного соединения 2, полученного в соответствии с методикой, описанной выше, растворяют в смеси 20% этанол/гептан и хроматографируют, используя колонку ChiralPak AD размером 550 см (объемная скорость потока 70 мл/мин, подвижная фаза: смесь 20% этанол/гептан),элюируя сначала (+)-энантиомер ( 31), затем (-)-энантиомер ( 32). Данные 1 Н-ЯМР и массспектрометрии для двух выделенных соединений идентичны таковым соединения 2, выделенного выше. Пример 5. 2-(5,6-Дихлор-1 Н-бензимидазол-2-ил)-1,1,1-трифторбут-3-ен-2-ол ( 4). К 1-(5,6-дихлор-1 Н-бензимидазол-2-ил)-2,2,2-трифторэтанону (326 мг) в ТГФ (10 мл) при температуре -78 С по каплям добавляют винилмагнийбромид (2,42 мл 1,0 М раствора в ТГФ). Полученную смесь затем перемешивают при температуре 0 С в течение 2 ч. Полученную смесь гасят водой и 1 н. растворомHCl, экстрагируют с помощью EtOAc, сушат над Na2SO4, отфильтровывают и концентрируют с получением остатка. Этот остаток очищают с помощью флэш-хроматографии на колонке Biotage 40s+ и элюируют смесью 10-40% EtOAc/гексаны, получая смолообразное вещество желтого цвета. Это смолообразное вещество желтого цвета растворяют в минимальном количестве CH2Cl2 и растирают в гексанах, получая указанное в заголовке соединение в виде твердого вещества светло-желтого цвета. 1 Н ЯМР (300 МГц, d6-DMSO):13,03 (уш.с, 1 Н), 7,99 (с, 1 Н), 7,76 (с, 1 Н), 7,69 (с, 1 Н), 6,54 (дд, 1 Н,J=10,8, 17,2 Гц), 5,71 (д, 1 Н, J=17,2 Гц), 5,59 (д, 1 Н, J=10,8 Гц).- 18015542 1-(5,6-Дихлор-1 Н-бензимидазол-2-ил)-2,2,2-трифторэтанон (0,61 г, 2,2 ммоль), 1-бром-2-бутин (1,7 мл, 18,8 ммоль) и индий (2,49 г, 21,7 ммоль) суспендируют в ТГФ (10 мл) и 0,045 М растворе HCl (20 мл) и энергично перемешивают в течение ночи. Реакционную смесь разбавляют водой (60 мл) и этилацетатом (40 мл), слои разделяют и водный слой экстрагируют этилацетатом (3 раза по 20 мл). Объединенные экстракты промывают насыщенным солевым раствором (50 мл) и сушат над Na2SO4. Полученный сырой продукт очищают с помощью колоночной хроматографии (SiO2, смесь 20% этилацетат/гексаны), получая указанное в заголовке соединение в виде твердого вещества не совсем белого цвета. 1 Н ЯМР (400 МГц, CDCl3):7,76 (с, 2 Н),5,08 (м, 2 Н),1, 88 (с, 3 Н).MS измерено: 337, 339 (М+Н); 335, 337 (М-1). Соединение 33 (также известное как 2-(5,6-дихлор-1 Н-бензимидазол-2-ил)-1,1,1-трифторгекс-4 ин-2-ол) получают в виде второстепенного побочного продукта вышеописанной реакции и выделяют в виде остатка. Пример 7. 3-(5,6-Дихлор-1 Н-бензимидазол-2-ил)-4,4,4-трифтор-3-гидроксибутиронитрил ( 7). К раствору безводного ацетонитрила (0,4 мл) в ТГФ (10 мл) при температуре -78 С добавляют nBuLi (2,9 мл 2,5 М раствора в гексанах). Полученную смесь перемешивают в течение 45 мин при температуре -78 С. К этому раствору затем добавляют раствор 1-(5,6-дихлор-1 Н-бензимидазол-2-ил)-2,2,2 трифторэтанона (930 мг) в ТГФ (5 мл). Полученную смесь перемешивают при температуре -78 С в течение 1 ч. Реакционную смесь гасят с помощью NH4Cl (водный) и полученную смесь экстрагируют с помощью EtOAc. Объединенные экстракты промывают насыщенным солевым раствором и сушат надNa2SO4. Полученный сырой продукт очищают с помощью колоночной хроматографии (SiO2, смесь 015% этилацетат/гексаны), получая указанное в заголовке соединение в виде твердого вещества желтого цвета. 1 Н ЯМР (300 МГц, d6-DMSO):13,31 (1, 1 Н), 8,48 (с, 1 Н), 8,04 (с, 1 Н), 7,73 (с, 1 Н), 3,59 (ABq, 2H,JAB=16,9 Гц, vAB=59 Гц). Пример 8. 2-(5,6-Дихлор-1 Н-бензимидазол-2-ил)-1,1,1-трифторпент-3-ин-2-ол ( 8). К 1-(5,6-дихлор-1 Н-бензимидазол-2-ил)-2,2,2-трифторэтанону (535 мг) в ТГФ (10 мл) при температуре -78 С по каплям добавляют 1-пропинилмагнийбромид (8 мл 0,5 М раствора в ТГФ). Полученную смесь затем перемешивают при температуре 0 С в течение 3 ч. Реакционную смесь гасят водой и 1 н. раствором HCl, экстрагируют с помощью EtOAc, сушат над Na2SO4, отфильтровывают и концентрируют с получением остатка. Остаток очищают с помощью флэш-хроматографии на колонке Biotage 40s+ и элюируют смесью 10-40% EtOAc/гексаны, получая твердое вещество желтого цвета. Твердое вещество желтого цвета растворяют в минимальном количестве CH2Cl2 и растирают в гексанах, получая указанное в заголовке соединение в виде твердого вещества белого цвета. 1 Н ЯМР (300 МГц, d6-DMSO):13,10 (уш.с, 1 Н), 8,48 (с, 1 Н), 8,01 (с, 1 Н), 7,69 (с, 1 Н), 1-97 (с, 3 Н). К 1-(5,6-дихлор-1 Н-бензимидазол-2-ил)-2,2,2-трифторэтанону (793 мг) в ТГФ (5 мл) при температуре -78 С по каплям добавляют изопропенилмагнийбромид (12,3 мл 0,5 М раствора в ТГФ). Полученную смесь затем перемешивают при температуре 0 С в течение 5 ч. Реакционную смесь гасят водой и 1 н. раствором HCl, экстрагируют с помощью EtOAc, сушат над Na2SO4, отфильтровывают и концентрируют с получением остатка. Остаток очищают с помощью флэш-хроматографии на колонке Biotage 40s+ и элюируют смесью 10-40% EtOAc/гексаны, получая смолообразное вещество оранжевого цвета. Смолообразное вещество оранжевого цвета растворяют в минимальном количестве CH2Cl2 и растирают в гексанах, получая указанное в заголовке соединение в виде твердого вещества персикового цвета. К 1-(5,6-дихлор-1 Н-бензимидазол-2-ил)-2,2,2-трифторэтанону (595 мг) в ТГФ (5 мл) при температуре -78 С по каплям добавляют фенилмагнийбромид (4,6 мл 1 М раствора в ТГФ). Полученную смесь перемешивают при температуре 0 С в течение 4 ч. Реакционную смесь гасят водой и 1 н. раствором HCl,экстрагируют с помощью EtOAc, сушат над Na2SO4, отфильтровывают и концентрируют с получением остатка. Остаток очищают с помощью флэш-хроматографии на колонке Biotage 40s+ и элюируют смесью 10-40% EtOAc/гексаны, получая твердое вещество желтого цвета. Твердое вещество желтого цвета растворяют в минимальном количестве CH2Cl2 и растирают в гексанах, получая указанное в заголовке соединение в виде твердого вещества желто-коричневого цвета. К 1-(5,6-дихлор-1 Н-бензимидазол-2-ил)-2,2,2-трифторэтанону (609 мг) в ТГФ (4 мл) и воде (12 мл) при комнатной температуре добавляют 3-бром-2-метилпропен (0,31 мл), затем порошкообразный индий(279 мг, -100 меш.). Полученную смесь затем перемешивают при комнатной температуре в течение 18 ч. Полученную смесь отфильтровывают через слой Celite, промывают с помощью EtOAc, слои разделяют,водный слой экстрагируют с помощью EtOAc, сушат над Na2SO4, отфильтровывают и концентрируют с получением остатка. Остаток очищают с помощью флэш-хроматографии на колонке Biotage 40s+ и элюируют смесью 10-40% EtOAc/гексаны, получая смолообразное вещество оранжевого цвета. Смолообразное вещество оранжевого цвета растворяют в минимальном количестве CH2Cl2 и растирают в гексанах, получая указанное в заголовке соединение в виде твердого вещества оранжевого цвета. 1 Н ЯМР (400 МГц, d4-MeOD):7,78 (уш., 1 Н), 7,69 (уш., 1 Н), 4,73 (с, 1 Н), 4,69 (с, 1 Н), 2,98 (ABq,2H, JAB=14,3 Гц, vAB=120,4 Гц), 1,54 (с, 3 Н). Протоны NH и ОН не обнаружены. Пример 12. 2-(5,6-Дихлор-1 Н-бензимидазол-2-ил)-1,1,1-трифтор-4-метилпент-3-ен-2-ол ( 14). К 1-(5,6-дихлор-1 Н-бензимидазол-2-ил)-2,2,2-трифторэтанону (565 мг) в ТГФ (5 мл) при температуре 0 С добавляют реактив Гриньяра, свежеприготовленный из 1-бром-2-метилпропена (0,51 мл), маленькой хлопьевидной частицы иода и порошка магния (146 мг) в ТГФ (5 мл). Полученную смесь затем перемешивают при комнатной температуре в течение 3 ч. Реакционную смесь гасят с помощью NH4Cl (насыщенный водный раствор), отфильтровывают через слой Celite, промывают с помощью EtOAc, слои разделяют, водный слой экстрагируют с помощью EtOAc, сушат над Na2SO4, отфильтровывают и концентрируют с получением остатка. Остаток очищают с помощью флэш-хроматографии на колонке Biotage 40s+ и элюируют смесью 10-40% EtOAc/гексаны, получая твердое вещество желтого цвета. Твердое вещество желтого цвета растворяют в минимальном количестве CH2Cl2 и растирают в гексанах, получая указанное в заголовке соединение в виде твердого вещества желтого цвета. 1 Н ЯМР (400 МГц, d4-MeOD):7,73 (уш., 2 Н), 5,91 (с, 1 Н), 1,84 (с, 3 Н), 1,46 (с, 3 Н). Протоны NH и ОН не обнаружены. К 1-(5,6-дихлор-1 Н-бензимидазол-2-ил)-2,2,2-трифторэтанону (510 мг) в ТГФ (5 мл) при температуре 0 С добавляют реактив Гриньяра, свежеприготовленный из цис-1-бром-1-пропена (1,07 мл), маленькой хлопьевидной частицы иода и порошка магния (306 мг) в ТГФ (5 мл). Полученную смесь затем перемешивают при комнатной температуре в течение 3 ч. Реакционную смесь гасят с помощью NH4Cl (насыщенный водный раствор), отфильтровывают через слой Celite, промывают с помощью EtOAc, слои разделяют, водный слой экстрагируют с помощью EtOAc, сушат над Na2SO4, отфильтровывают и концентрируют с получением остатка. Остаток очищают с помощью флэш-хроматографии на колонке Biotage 40s+ и элюируют смесью 10-40% EtOAc/гексаны, получая твердое вещество желтого цвета. Твердое вещество желтого цвета растворяют в минимальном количестве CH2Cl2 и растирают в гексанах, получая указанное в заголовке соединение в виде твердого вещества желтого цвета. 1 Н ЯМР (400 МГц, d4-MeOD):7,77 (уш., 1 Н), 7,72 (уш., 1 Н), 6,07-6,12 (м, 1 Н), 6,01-6,05 (м, 1 Н),1,52 (дд, 3 Н, J=1,2, 6,9 Гц). Протоны NH и ОН не обнаружены. К 1-(5,6-дихлор-1 Н-бензимидазол-2-ил)-2,2,2-трифторэтанону (636 мг) в ТГФ (5 мл) при температуре 0 С добавляют реактив Гриньяра, свежеприготовленный из транс-1-бром-1-пропена (1,35 мл), маленькой хлопьевидной частицы иода и порошка магния (382 мг) в ТГФ (5 мл). Полученную смесь затем перемешивают при комнатной температуре в течение 3 ч. Реакционную смесь гасят с помощью NH4Cl (насыщенный водный раствор), отфильтровывают через слой Celite, промывают с помощью EtOAc, слои разделяют, водный слой экстрагируют с помощью EtOAc, сушат над Na2SO4, отфильтровывают и концентрируют с получением остатка. Остаток очищают с помощью флэш-хроматографии на колонке Biotage 40s+ и элюируют смесью 10-40% EtOAc/гексаны, получая твердое вещество желтого цвета. Твердое вещество желтого цвета растворяют в минимальном количестве CH2Cl2 и растирают в гексанах, получая указанное в заголовке соединение в виде твердого вещества желтого цвета. 1 Н ЯМР (400 МГц, d4-MeOD):7,79 (уш., 1 Н), 7,71 (уш., 1 Н), 6,13 (s, 1 Н), 6,11-6,13 (м, 1 Н), 1,82 К 1-(5,6-дихлор-1 Н-бензимидазол-2-ил)-2,2,2-трифторэтанону (3,2 г) в ТГФ (40 мл) при температуре 0 С добавляют литиевый реагент, свежеприготовленный из тетрагидропиран-2-пропинилокси (1,6 мл) и n-BuLi (4,5 мл 2,5 М раствора в гексанах) в ТГФ (20 мл) (перемешиваемый при температуре -78 С в течение 2 ч). Полученную смесь затем перемешивают при комнатной температуре в течение 3 ч. Реакционную смесь гасят с помощью NH4Cl (насыщенный водный раствор), отфильтровывают через слойCelite, промывают с помощью EtOAc, слои разделяют, водный слой экстрагируют с помощью EtOAc,сушат над Na2SO4, отфильтровывают и концентрируют с получением остатка. Остаток очищают с помощью флэш-хроматографии на колонке Biotage 40s+ и элюируют смесью 5-30% EtOAc/гексаны, получая твердое вещество оранжевого цвета. К раствору простого ТНР-эфира (2,28 г, см. приведенную выше методику) в метаноле (25 мл) добавляют моногидрат п-толуолсульфоновой кислоты (2,05 г) и полученную смесь перемешивают при комнатной температуре в течение 2 ч. Реакционную смесь затем гасят с помощью Na2CO3 (водный раствор), экстрагируют с помощью EtOAc и сушат над Na2SO4 с получением остатка. Остаток очищают с- 21015542 помощью флэш-хроматографии на колонке Biotage 40s+ и элюируют смесью 5-35% EtOAc/гексаны, получая указанное в заголовке соединение в виде твердого вещества оранжевого цвета. 1 Н ЯМР (300 МГц, d6-DMSO):13,16 (уш., 1 Н), 8,66 (уш., 1 Н), 8,01 (с, 1 Н), 7,69 (с, 1 Н), 5,46 (т, 1 Н,J=6,1 Гц), 4,23 (д, 2 Н, J=6,0 Гц). 1-(5,6-Дихлор-1 Н-бензимидазол-2-ил)-2,2,2-трифторэтанон (0,31 г, 1,09 ммоль), 3,3-диметилаллилбромид (90%-ный; 1,40 мл, 10,8 ммоль) и индий (1,26 г, 11,0 ммоль) суспендируют в ТГФ (10 мл) и 0,02 М растворе HCl (15 мл) и энергично перемешивают в течение 18 ч. Реакционную смесь затем разбавляют водой (60 мл) и этилацетатом (40 мл), слои разделяют и водный слой экстрагируют этилацетатом (3 раза по 20 мл). Объединенные экстракты промывают насыщенным солевым раствором (50 мл) и сушат над Na2SO4, получая сырое масло. Сырое масло очищают с помощью колоночной хроматографии (SiO2; смесь 20% этилацетат/гексаны), получая указанное в заголовке соединение в виде твердого вещества не совсем белого цвета. 1 Н ЯМР (400 МГц, CD3CN):7,88 (с, 2 Н), 6,18 (дд, 1 Н, J=1,3, 10,9 Гц), 5,14 (м, 2 Н), 1,19 (с, 3 Н),1,17 (с, 3 Н). 1-(5,6-Дихлор-1 Н-бензимидазол-2-ил)-2,2,2-трифторэтанон (0,31 г, 1,09 ммоль), кротилбромид (1,2 мл, 11,8 ммоль) и индий (1,26 г, 11,0 ммоль) суспендируют в ТГФ (10 мл) и 0,02 М растворе HCl (15 мл) и энергично перемешивают в течение 18 ч. Реакционную смесь затем разбавляют водой (60 мл) и этилацетатом (40 мл), слои разделяют и водный слой экстрагируют этилацетатом (3 раза по 20 мл). Объединенные экстракты промывают насыщенным солевым раствором (50 мл) и сушат над Na2SO4, получая сырое масло. Сырое масло очищают с помощью колоночной хроматографии (SiO2, смесь 20% этилацетат/гексаны), получая указанное в заголовке соединение в виде смеси диастереомеров (2:1) в виде твердого вещества не совсем белого цвета. 1 Н ЯМР (400 МГц, CD3CN):7,88 (с, 2 Н), (смесь диастереомеров)5,92 и 5,78 (м, 1 Н), (смесь диастереомеров)5,26 и 4,99 (д, J=17,1 Гц, 1 Н), (смесь диастереомеров)5,17 и 4,92 (д, J=10,3 Гц,1 Н), (смесь диастереомеров)3,26 и 3,18 (м, 1 Н), (смесь диастереомеров)1,16 и 0,86 (д, J=6,9 Гц,3 Н). 1-(5,6-Дихлор-1 Н-бензимидазол-2-ил)-2,2,2-трифторэтанон (0,30 г, 1,05 ммоль), 2-(бромметил)акриловая кислота (1,80 г, 10,9 ммоль) и индий (1,23 г, 10,7 ммоль) суспендируют в ТГФ (10 мл) и 0,02 М растворе HCl (15 мл) и энергично перемешивают в течение 18 ч. Реакционную смесь затем разбавляют водой (60 мл) и этилацетатом (40 мл), слои разделяют и водный слой экстрагируют этилацетатом (3 раза по 20 мл). Объединенные экстракты промывают насыщенным солевым раствором (50 мл) и сушат надNa2SO4 с получением сырого вещества. Сырое вещество очищают с помощью колоночной хроматографии (SiO2; смесь 50% этилацетат/гексаны), получая указанное в заголовке соединение в виде твердого вещества не совсем белого цвета.(1,6 мл, 10,5 ммоль) и индий (1,22 г, 10,7 ммоль) суспендируют в ТГФ (10 мл) и 0,02 М растворе HCl (15 мл) и энергично перемешивают в течение 18 ч. Реакционную смесь затем разбавляют водой (60 мл) и этилацетатом (40 мл), слои разделяют и водный слой экстрагируют этилацетатом (3 раза по 20 мл). Объединенные экстракты промывают насыщенным солевым раствором (50 мл) и сушат над Na2SO4 с получением сырого масла. Сырое масло очищают с помощью колоночной хроматографии (SiO2; смесь 20% этилацетат/гексаны), получая указанное в заголовке соединение в виде твердого вещества не совсем белого цвета. 1 Н ЯМР (400 МГц, CD3CN):10,63 (уш. с, 1 Н), 7,77 (с, 1 Н), 7,55 (с, 1 Н), 7,14 (м, 2 Н), 7,06 (м, 3 Н),6,47 (дд, J=10,0, 18,7 Гц, 1 Н), 5,32 (м, 2 Н), 5,24 (дд, J=1,5, 10,2 Гц, 1 Н), 4,35 (д, J=9,9 Гц, 1 Н).(0,14 мл, 1,3 ммоль), дихлорбис(трифенилфосфин)палладий (31,7 мг, 0,045 ммоль), иодид меди (17,8 мг,0,093 ммоль) и триэтиламин (0,25 мл, 1,8 ммоль) суспендируют в ТГФ (5 мл) и полученную смесь энергично перемешивают в течение ночи. Реакционную смесь затем концентрируют в вакууме и полученное сырое масло коричневого цвета очищают с помощью колоночной хроматографии (SiO2; смесь 50% диэтиловый эфир/CH2Cl2), получая указанное в заголовке соединение в виде твердого вещества оранжевожелтого цвета. 1 Н ЯМР (400 МГц, CD3CN):7,90 (с, 1 Н), 7,75 (с, 1 Н), 7,29 (м, 3 Н), 7,21 (м, 2 Н), 3,54 (д, J=17,1 Гц,1 Н), 3,33 (д, J=17,1 Гц, 1 Н). 2-(2,2,2-Трифторацетил)-6-трифторметил-1 Н-бензимидазол-5-карбонитрил (0,31 г, 0,95 ммоль), аллилбромид (0,82 мл, 9,5 ммоль) и индий (1,09 г, 9,5 ммоль) суспендируют в ТГФ (12 мл) и 0,03 М растворе HCl (10 мл) и энергично перемешивают в течение ночи. Реакционную смесь затем разбавляют водой(60 мл) и этилацетатом (40 мл), слои разделяют и водный слой экстрагируют этилацетатом (3 раза по 20 мл). Объединенные экстракты промывают насыщенным солевым раствором (50 мл) и сушат над Na2SO4 с получением сырого вещества. Сырое вещество очищают с помощью колоночной хроматографии (SiO2; смесь 20% этилацетат/гексаны), получая указанное в заголовке соединение в виде твердого вещества не совсем белого цвета. 1 2-(2,2,2-Трифторацетил)-6-трифторметил-1 Н-бензимидазол-5-карбонитрил (0,31 г, 0,94 ммоль),пропаргилбромид (80%-ный раствор в толуоле, 1,1 мл, 12,3 ммоль) и индий (1,08 г, 9,5 ммоль) суспендируют в ТГФ (12 мл) и 0,03 М растворе HCl (10 мл) и энергично перемешивают в течение ночи. Реакционную смесь затем разбавляют водой (60 мл) и этилацетатом (40 мл), слои разделяют и водный слой экстрагируют этилацетатом (3 раза по 20 мл). Объединенные экстракты промывают насыщенным солевым раствором (50 мл) и сушат над Na2SO4 с получением сырого вещества. Сырое вещество очищают с помощью колоночной хроматографии (SiO2; смесь 20% этилацетат/гексаны), получая указанное в заголовке соединение в виде твердого вещества не совсем белого цвета. 1 Н ЯМР (400 МГц, CD3CN):8,29 (с, 1 Н),8,15 (с, 1 Н), 3,39 (дд, J=2,6, 17,1 Гц, 1 Н), 3,15 (дд, J=2,7,17,1 Гц, 1 Н), 2,20 (т, J=2,7 Гц, 1 Н). К 1-(5,6-дихлор-1 Н-бензимидазол-2-ил)-2,2,2-трифторэтанону (595 мг) в ТГФ (3 мл) при температуре -78 С по каплям добавляют 3-бутенилмагнийбромид (7,8 мл 0,5 М раствора в ТГФ). Полученную смесь затем перемешивают при температуре 0 С в течение 4 ч. Реакционную смесь гасят водой и 1 н. раствором HCl, экстрагируют с помощью EtOAc, сушат над Na2SO4, отфильтровывают и концентрируют с получением остатка. Остаток очищают с помощью флэш-хроматографии на колонке Biotage 40s+ и элюируют смесью 10-40% EtOAc/гексаны, получая твердое вещество желтого цвета. Твердое вещество желтого цвета растворяют в минимальном количестве Et2O и растирают в гексанах, получая указанное в заголовке соединение в виде твердого вещества желто-коричневого цвета. 1 2-(2,2,2-Трифторацетил)-6-трифторметил-1 Н-бензимидазол-5-карбонитрил (0,31 г, 0,94 ммоль), 1 бром-2-бутин (0,85 мл, 9,4 ммоль) и индий (1,09 г, 9,5 ммоль) суспендируют в ТГФ (12 мл) и 0,03 М растворе HCl (10 мл) и энергично перемешивают в течение ночи. Реакционную смесь затем разбавляют водой (60 мл) и этилацетатом (40 мл), слои разделяют и водный слой экстрагируют этилацетатом (3 раза по 20 мл). Объединенные экстракты промывают насыщенным солевым раствором (50 мл) и сушат надNa2SO4 с получением сырого вещества. Сырое вещество очищают с помощью колоночной хроматографии (SiO2; смесь 20% этилацетат/гексаны), получая указанное в заголовке соединение в виде твердого вещества белого цвета. 1 Н ЯМР (400 МГц, CD3CN):8,27 (с, 1 Н), 8,13 (с, 1 Н), 5,00 (дд, J=3,1, 6,2 Гц, 1 Н), 1,71 (с, 3 Н). К 1-(5,6-дихлор-1 Н-бензимидазол-2-ил)-2,2,2-трифторэтанону (577 мг) в ТГФ (5 мл) при температуре 0 С добавляют реактив Гриньяра, свежеприготовленный из 2-бром-3-метил-2-бутена (1,73 мл), маленькой хлопьевидной частицы иода и порошка магния (347 мг) в ТГФ (5 мл). Полученную смесь перемешивают при комнатной температуре в течение 3 ч. Реакционную смесь гасят с помощью NH4Cl (насыщенный водный раствор), отфильтровывают через слой Celite, промывают с помощью EtOAc, слои разделяют, водный слой экстрагируют с помощью EtOAc, сушат над Na2SO4, отфильтровывают и концентрируют с получением остатка. Остаток очищают с помощью флэш-хроматографии на колонке Biotage 40s+ и элюируют смесью 10-40% EtOAc/гексаны, получая твердое вещество желтого цвета. Твердое вещество желтого цвета растворяют в минимальном количестве CH2Cl2 и растирают в гексанах, получая указанное в заголовке соединение в виде твердого вещества не совсем белого цвета. 1 Продукт 2-(5,6-дихлор-1 Н-бензимидазол-2-ил)-1,1,1-трифторбут-3-ен-2-ол (285 мг) затем разделяют на (+)- и (-)-энантиомеры посредством ВЭЖХ на колонке Chiralpak AD (размером 550 см), используя в качестве элюента смесь 7% изопропанола в гептане (70 мл/мин). 1 Н ЯМР (300 МГц, d6-DMS0):13,03 (уш.с, 1 Н), 7,99 (с, 1 Н), 7,76 (с, 1 Н), 7,69 (с, 1 Н), 6,54 (дд, 1 Н,J=10,8, 17,2 Гц), 5,71 (д, 1 Н, J=17,2 Гц), 5,59 (д, 1 Н, J=10,8 Гц). К раствору этил-3,3,3-трифторпирувата (14,2 г) в ТГФ (200 мл) при температуре -78 С по каплям добавляют винилмагнийбромид (84 мл 1 М раствора в ТГФ) посредством капельной воронки. Полученную смесь затем нагревают до температуры окружающей среды в течение 2 ч. Реакционную смесь гасят путем выливания в смесь льда. К полученной смеси затем добавляют 2 н. раствор HCl, смесь экстрагируют с помощью EtOAc и сушат над Na2SO4. После концентрирования полученный сырой продукт отфильтровывают через слой силикагеля и промывают смесью 50% Et2O/гексаны. Полученную смесь концентрируют, получая указанное в заголовке соединение в виде масла золотистого цвета. Пример 28. Этиловый эфир 2-аллилокси-2-трифторметилбут-3-еновой кислоты. К раствору этилового эфира 2-гидрокси-2-трифторметилбут-3-еновой кислоты (3,6 г) в ТГФ (100 мл) при температуре 0 С добавляют гидрид натрия (1,1 г 60%-ной дисперсии в масле), аллилбромид (2,3 мл) и тетрабутиламмонийиодид (1,35 г). Полученную смесь затем кипятят с обратным холодильником в- 25015542 течение 5 ч. Реакционную смесь осторожно гасят с помощью NH4Cl (водный раствор), экстрагируют с помощью EtOAc и сушат над Na2SO4. После концентрирования полученный сырой продукт отфильтровывают через слой силикагеля и промывают смесью 20% CH2Cl2/гексаны, затем концентрируют, получая указанное в заголовке соединение в виде масла желтого цвета. Пример 29. Этиловый эфир 2-трифторметил-2,5-дигидрофуран-2-карбоновой кислоты. К раствору этилового эфира 2-аллилокси-2-трифторметилбут-3-еновой кислоты (2,15 г, см. выше) вCH2Cl2 (100 мл) при комнатной температуре добавляют катализатор Grubbs 2-го поколения (Aldrich) (67 мг). Полученную смесь перемешивают в течение 18 ч при комнатной температуре. Реакционную смесь затем отфильтровывают через слой Celite и силикагеля, промывают с помощью EtOAc и затем концентрируют, получая указанное в заголовке соединение в виде масла желтого цвета. Пример 30. 5,6-Дихлор-2-(2-трифторметил-2,5-дигидрофуран-2-ил)-1 Н-бензимидазол ( 45). К 4,5-дихлор-1,2-диамину (1,56 г) в толуоле (10 мл) при температуре 0 С осторожно добавляют диэтилалюминийхлорид (0,55 мл) и реакционную смесь оставляют нагреваться до комнатной температуры,затем перемешивают в течение 1 ч. К полученной суспензии пурпурного цвета при температуре 0 С добавляют этиловый эфир 2-трифторметил-2,5-дигидрофуран-2-карбоновой кислоты (464 мг). Полученную смесь перемешивают при комнатной температуре в течение 1 ч, затем нагревают при температуре 110 С в течение 20 ч. Реакционную смесь гасят с помощью 6 н. раствора HCl, разбавляют с помощью EtOAc и промывают 6 н. раствором HCl. Органические экстракты сушат над Na2SO4, отфильтровывают и концентрируют с получением остатка. Остаток очищают с помощью флэш-хроматографии на колонке Biotage 40s+ и элюируют смесью 10-40% EtOAc/гексаны, получая смолообразное вещество оранжевого цвета. Смолообразное вещество оранжевого цвета растворяют в минимальном количестве CH2Cl2 и растирают в гексанах, получая указанное в заголовке соединение в виде порошка белого цвета. 1 Н ЯМР (300 МГц, d6-DMSO):13,14 (с, 1 Н), 7,98 (уш., 1 Н), 7,72 (уш., 1 Н), 6,62 (д, 1 Н, J=6,2 Гц),6,26 (д, 1 Н, J=6,1 Гц), 4,98 (с, 2 Н). К 5,6-дихлор-2-(2-трифторметил-2,5-дигидрофуран-2-ил)-1 Н-бензимидазолу (95 мг) в метаноле (5 мл) добавляют родий-на-оксиде алюминия (32 мг). Полученную смесь перемешивают при комнатной температуре в атмосфере водорода из баллона в течение 5 ч. Реакционную смесь затем отфильтровывают через слой Celite, промывают с помощью Et2O и концентрируют, получая указанное в заголовке соединение в виде твердого вещества желто-коричневого цвета. 1 Н ЯМР (300 МГц, d6-DMSO):13,12 (уш., 1 Н), 7,92 (уш., 1 Н), 7,74 (уш., 1 Н), 4,09-4,14 (м, 2 Н),2,75-2,84 (м, 1 Н), 2,54-2,61 (м, 1 Н), 2,07-2,13 (м, 1 Н), 1,89-1,99 (м, 1 Н). Пример 32. 2-(5,6-Дихлор-1 Н-бензимидазол-2-ил)-3-этил-1,1,1-трифторпента-3,4-диен-2-ол ( 62).(983 мг) суспендируют в ТГФ (15 мл) и воде (45 мл) и энергично перемешивают в течение ночи. Реакционную смесь затем разбавляют водой и этилацетатом, слои разделяют и водный слой экстрагируют этилацетатом. Объединенные экстракты промывают насыщенным солевым раствором и сушат над Na2SO4,получая сырой продукт. Этот сырой продукт очищают с помощью колоночной хроматографии (SiO2; смесь 5-30% этилацетат/гексаны), получая указанное в заголовке соединение в виде твердого вещества персикового цвета. 1-(5,6-Дихлор-1 Н-бензимидазол-2-ил)-2,2,2-трифторэтанон (1,14 г, 4,02 ммоль), 2-хлорэтанол (0,83 мл, 12,4 ммоль) и карбонат калия (1,68 г, 12,2 ммоль) растворяют в ДМФА (18 мл). Реакционную смесь перемешивают в течение 18 ч при температуре окружающей среды, затем разбавляют этилацетатом (80 мл), промывают водой (50 мл) и насыщенным солевым раствором (2 раза по 50 мл). Экстракты сушат надNa2SO4, отфильтровывают, концентрируют с получением твердого вещества светло-коричневого цвета и твердое вещество светло-коричневого цвета очищают с помощью колоночной хроматографии (SiO2; смесь 30% этилацетат/гексаны), получая указанное в заголовке соединение в виде твердого вещества желто-коричневого цвета. 1 Н ЯМР (400 МГц, CD3CN):7,83 (с, 2 Н),4,29 (м, 4 Н). 1-(5,6-Дихлор-1 Н-бензимидазол-2-ил)-2,2,2-трифторэтанон (2,13 г, 7,51 ммоль), 2-хлорэтанол (1,90 мл, 22,7 ммоль) и карбонат калия (3,13 г, 22,6 ммоль) растворяют в ДМФА (14 мл). Реакционную смесь перемешивают в течение 18 ч при температуре окружающей среды, затем разбавляют этилацетатом (100 мл), промывают водой (80 мл) и насыщенным солевым раствором (2 раза по 80 мл). Экстракты сушат надNa2SO4, отфильтровывают, концентрируют с получением твердого вещества светло-коричневого цвета и твердое вещество светло-коричневого цвета очищают с помощью колоночной хроматографии (SiO2; смесь 20% этилацетат/гексаны), получая указанное в заголовке соединение в виде твердого вещества светло-желтого цвета. 1 Н ЯМР (400 МГц, CD3CN):7,84 (с, 2 Н),4,14 (м, 2 Н),3,95 (м, 2 Н),2,16 (м, 2 Н). 1-(5,6-Дихлор-1 Н-бензимидазол-2-ил)-2,2,2-трифторэтанон (1,02 г, 3,61 ммоль), этилендиамин (0,74 мл, 11,04 ммоль) и моногидрат паратолуолсульфоновой кислоты (0,12 г, 0,603 ммоль) суспендируют в толуоле (80 мл), затем кипятят с обратным холодильником при использовании ловушки Дина-Старка в течение 3 ч. Спустя 3 ч к реакционной смеси добавляют этилендиамин (0,74 мл, 11,04 ммоль) и реакционную смесь продолжают кипятить с обратным холодильником при использовании ловушки ДинаСтарка в течение 18 ч. Реакционную смесь охлаждают до комнатной температуры и концентрируют в вакууме с получением сырого остатка коричневого цвета. Сырой остаток коричневого цвета растворяют в этилацетате (60 мл), промывают водой (3 раза по 50 мл) и насыщенным солевым раствором (50 мл),затем сушат над Na2SO4. Осушитель удаляют путем фильтрации и фильтрат концентрируют в вакууме,получая сырое масло коричневого цвета, которое очищают с помощью колоночной хроматографии (SiO2; смесь 50% этилацетат/гексаны), получая указанное в заголовке соединение в виде твердого вещества светло-оранжевого цвета. 1 Н ЯМР (400 МГц, CD3CN):7,80 (с, 2 Н),3,32 (уш. с, 2 Н),3,06 (м, 2 Н). 5,6-Дихлор-2-(2-трифторметил[1,3]диоксолан-2-ил)-1 Н-бензимидазол (0,37 г, 1,1 ммоль) растворяют в ДМФА (6 мл), обрабатывают с помощью 60%-ной дисперсии NaH в минеральном масле (9,14 г, 3,5 ммоль) и перемешивают в атмосфере азота в течение 20 мин. Затем к реакционной смеси добавляют 2(бромметил)пиридингидробромид (0,44 г, 1,7 ммоль) и перемешивают при комнатной температуре в течение ночи. Реакционную смесь разбавляют этилацетатом (25 мл) и диэтиловым эфиром (25 мл), промывают водой (30 мл) и насыщенным солевым раствором (3 раза по 30 мл), затем сушат над Na2SO4. Концентрированный сырой продукт очищают с помощью колоночной хроматографии (SiO2; смесь 50% этилацетат/гексаны), получая указанное в заголовке соединение в виде твердого вещества не совсем белого цвета. 1 Н ЯМР (400 МГц, CD3CN):8,42 (д, J=4,5 Гц, 1 Н),7,96 (с, 1 Н),7,70 (д, J=1,6 Гц, 1 Н),7,67 (с,1 Н),7,24 (м, 1 Н),7,05 (д, J=7,9 Гц, 1 Н),5,67 (с, 2 Н),4,19 (т, J=7,0 Гц, 2 Н),3,95 (м, 2 Н).(0,73 г, 5,3 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Реакционную смесь затем разбавляют этилацетатом (40 мл) и диэтиловым эфиром (40 мл), промывают водой(50 мл) и насыщенным солевым раствором (3 раза по 30 мл), после чего сушат над Na2SO4. Реакционную смесь отфильтровывают, концентрируют с получением твердого вещества светло-коричневого цвета,которое очищают с помощью колоночной хроматографии (SiO2; 100% этилацетат), получая указанное в заголовке соединение в виде твердого вещества светло-желтого цвета. 1 Н ЯМР (400 МГц, CD3CN):8,31 (с, 1 Н),8,17 (с, 1 Н),4,36 (м, 2 Н),4,30 (м, 1 Н).MS измерено: 352 (М+1), 350 (М-Н). Пример 38. Общая методика алкилирования 5,6-дихлор-2-(2-трифторметил[1,3]диоксолан-2-ил)-1 Нбензимидазола. К суспензии NaH (1,25 ммоль) в безводном ДМФА (5 мл) добавляют раствор 5,6-дихлор-2-(2 трифторметил[1,3]диоксолан-2-ил)-1 Н-бензимидазола (1,0 ммоль) в безводном ДМФА (5 мл). После перемешивания реакционной смеси при комнатной температуре в течение 30 мин по каплям добавляют подходящим образом замещенный электрофил (1-10 экв.) посредством шприца. Реакционную смесь перемешивают в течение ночи при комнатной температуре и затем выливают в воду (125 мл) при быстром перемешивании. Полученный осадок собирают путем фильтрации и очищают с помощью флэшхроматографии (SiO2; дихлорметан), получая продукт. В соответствии с общей методикой, описанной выше, получают следующие соединения согласно настоящему изобретению. После названия и структуры каждого соединения указан подходящим образом замещенный электрофил, используемый в реакции. Пример 39. 5,6-Дихлор-1-метил-2-(2-трифторметил[1,3]диоксолан-2-ил)-1 Н-бензимидазол ( 52).
МПК / Метки
МПК: A61K 31/422, A61K 31/4184, C07D 403/04, A61P 5/00, C07D 405/04, C07D 235/12, C07D 413/04
Метки: модуляторов, sarms, рецептора, новые, 2-замещенные, качестве, бензимидазолы, селективных, андрогена
Код ссылки
<a href="https://eas.patents.su/30-15542-novye-2-zameshhennye-benzimidazoly-v-kachestve-selektivnyh-modulyatorov-receptora-androgena-sarms.html" rel="bookmark" title="База патентов Евразийского Союза">Новые 2-замещенные бензимидазолы в качестве селективных модуляторов рецептора андрогена (sarms)</a>
Предыдущий патент: Профиль из листового металла для сухого способа строительства
Случайный патент: Процесс получения водорода термическим разложением воды












