Соединения для уменьшения продукции β-амилоида
Номер патента: 20322
Опубликовано: 30.10.2014
Авторы: Ксю Ли, Ши Цзэлян, Бой Кеннес М., Томпсон III Лорин А., Олсон Ричард Е., Мэйкор Джон Е., Джанг Юнхюи, Ву Ёнг-Йин, Гернон Джейсон М., Зуев Дмитрий С.
Формула / Реферат
1. Соединение формулы (I)
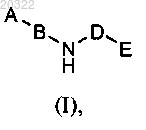
где А представляет собой пяти- или шестичленное гетероароматическое кольцо, выбранное из пиридина, триазола, имидазола и пиразола, и указанное гетероароматическое кольцо необязательно имеет в качестве заместителей одну или две группы, выбранные из атома галогена и C1-6алкила;
В выбран из фенила и пиридинила, где фенил и пиридинил необязательно имеют один или два заместителя, независимо выбранных из C1-6алкокси, C1-6алкила, C1-3алкиламино-С1-6алкокси, циано, С1-3диалкиламино-С1-6алкокси, атома галогена, галоген-С1-6алкокси, галоген-С1-6алкила, гидрокси, метиламино и амино;
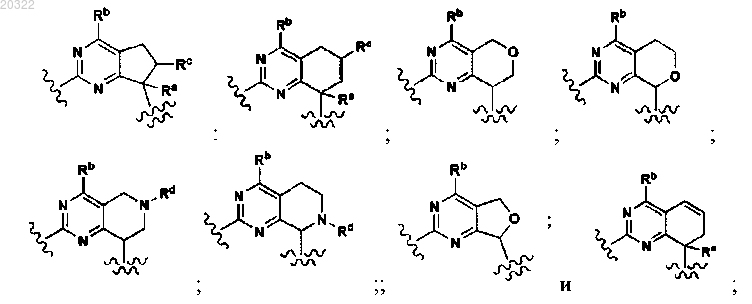
D выбран из
 означает место присоединения к атому азота исходной молекулы;
означает место присоединения к атому азота исходной молекулы;
 означает место присоединения к группировке Е;
означает место присоединения к группировке Е;
Ra выбран из атома водорода, С1-6алкила, С2-6алкенила и гидрокси;
Rb представляет собой -NRxRy, где Rx и Ry независимо выбраны из атома водорода, С1-4алкокси, С1-4алкокси-С1-4алкила, С1-4алкоксикарбонила, С1-6алкила, С3-7циклоалкила, (С3-7циклоалкил)С1-4алкила, гидрокси-С1-4алкила и тридейтерометила, где алкильная часть (С3-7циклоалкил)С1-4алкила может быть необязательно замещенной и иметь в качестве заместителей группу С1-4алкокси, или
Rx и Ry вместе с атомом азота, к которому они присоединены, образуют четырех-семичленное моноциклическое или бициклическое кольцо, необязательно содержащее одну двойную связь и необязательно содержащее один дополнительный гетероатом, выбранный из О, NRz и S, где Rz выбран из атома водорода, С1-6алкила и С1-4алкоксикарбонила и где указанное кольцо необязательно имеет один или два заместителя, независимо выбранных из С1-6алкокси, C1-6алкила, атома галогена, галоген-С1-4алкила, гидрокси, -NRfRg, оксо, спироциклического диоксоланила, где Rf и Rg независимо выбраны из атома водорода, С1-4алкоксикарбонила и C1-6алкила;
Rc выбран из атома водорода, С1-4алкилсульфонила, С1-4алкилсульфониламидо, амино, C1-6алкиламино, С1-6диалкиламино, С3-7циклоалкиламино, гидрокси и С1-4алкокси;
Rd выбран из атома водорода, С1-6алкила, С1-4алкокси-С1-4алкилкарбонила, C1-6алкоксикарбонила, С1-6алкилкарбонила, С1-6алкилсульфонила, С3-7циклоалкилсульфонила, С3-7циклоалкилкарбонила, С1-6диалкиламино-С1-4алкилкарбонила и галоген-С1-4алкила, где алкильная часть указанного алкоксикарбонила, алкилкарбонила и алкилсульфонила необязательно имеет один заместитель, выбранный из С1-4диалкиламино и С1-4алкокси; и
Е представляет собой фенил, необязательно замещенный одним, двумя или тремя заместителями, независимо выбранными из C1-6алкила, C1-6алкокси, циано, атома галогена, галоген-С1-6алкокси и галоген-С1-6алкила,
или фармацевтически приемлемая соль указанного соединения.
2. Соединение по п.1, у которого А имеет в качестве заместителя одну группу, выбранную из атома галогена и C1-6алкила, или фармацевтически приемлемая соль указанного соединения.
3. Соединение по п.2, у которого В выбран из фенила и пиридинила, где фенил и пиридинил необязательно имеют один или два заместителя, независимо выбранных из C1-6алкокси и атома галогена, или фармацевтически приемлемая соль указанного соединения.
4. Соединение по п.3, у которого D выбран из
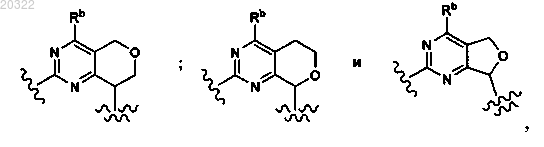
или фармацевтически приемлемая соль указанного соединения.
5. Соединение по п.4, у которого Rb представляет собой -NRxRy, где Rx и Ry независимо выбраны из атома водорода, С1-4алкокси-С1-4алкила, C1-6алкила, С3-7циклоалкила, гидрокси-С1-4алкила и тридейтерометила, где алкильная часть (С3-7циклоалкил)С1-4алкила может быть необязательно замещенной и иметь в качестве заместителей группу С1-4алкокси, или фармацевтически приемлемая соль указанного соединения.
6. Соединение по п.4, у которого Rb представляет собой -NRxRy, где Rx и Ry вместе с атомом азота, к которому они присоединены, образуют четырех-семичленное моноциклическое или бициклическое кольцо, необязательно содержащее один дополнительный гетероатом, выбранный из О и NRz, где Rz выбран из C1-6алкила и С1-4алкоксикарбонила, и где указанное кольцо необязательно имеет один или два заместителя, независимо выбранные из С1-6алкокси, C1-6алкила, атома галогена, галоген-С1-4алкила, гидрокси, -NRfRg, оксо и спироциклического диоксоланила, где Rf и Rg независимо выбраны из атома водорода, С1-4алкоксикарбонила и C1-6алкила, или фармацевтически приемлемая соль указанного соединения.
7. Соединение по п.3, у которого D выбран из
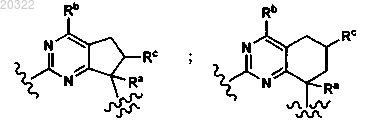 и
и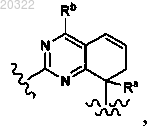
или фармацевтически приемлемая соль указанного соединения.
8. Соединение по п.7, у которого Rb представляет собой -NRxRy, где Rx и Ry независимо выбраны из атома водорода, С1-4алкокси-С1-4алкила, С1-6алкила, С3-7циклоалкила, гидрокси-С1-4алкила и тридейтерометила, где алкильная часть (С3-7циклоалкил)С1-4алкила может быть необязательно замещенной и иметь в качестве заместителей группу С1-4алкокси, или фармацевтически приемлемая соль указанного соединения.
9. Соединение по п.7, у которого Rb представляет собой -NRxRy, где Rx и Ry вместе с атомом азота, к которому они присоединены, образуют четырех-семичленное моноциклическое или бициклическое кольцо, необязательно содержащее один дополнительный гетероатом, выбранный из О и NRz, где Rz выбран из C1-6алкила и С1-4алкоксикарбонила, и где указанное кольцо необязательно имеет один или два заместителя, независимо выбранных из C1-6алкокси, C1-6алкила, атома галогена, галогенС1-4алкила, гидрокси, -NRfRg, оксо и спироциклического диоксоланила, где Rf и Rg независимо выбраны из атома водорода, С1-4алкоксикарбонила и С1-6алкила, или фармацевтически приемлемая соль указанного соединения.
10. Соединение по п.3, у которого D выбран из
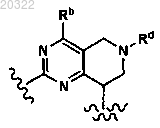 и
и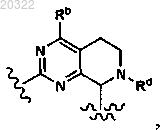
или фармацевтически приемлемая соль указанного соединения.
11. Соединение по п.10, у которого Rb представляет собой -NRxRy, где Rx и Ry независимо выбраны из атома водорода, С1-4алкокси-С1-4алкила, С1-6алкила, С3-7циклоалкила, гидрокси-С1-4алкила и тридейтерометила, где алкильная часть (С3-7циклоалкил)С1-4алкила может быть необязательно замещенной и иметь в качестве заместителей группу С1-4алкокси, или фармацевтически приемлемая соль указанного соединения.
12. Соединение по п.10, у которого Rb представляет собой -NRxRy, где Rx и Ry вместе с атомом азота, к которому они присоединены, образуют четырех-семичленное моноциклическое или бициклическое кольцо, необязательно содержащее один дополнительный гетероатом, выбранный из О и NRz, где Rz выбран из C1-6алкила и С1-4алкоксикарбонила, и где указанное кольцо необязательно имеет один или два заместителя, независимо выбранные из С1-6алкокси, С1-6алкила, атома галогена, галоген-С1-4алкила, гидрокси, -NRfRg, оксо и спироциклического диоксоланила, где Rf и Rg независимо выбраны из атома водорода, С1-4алкоксикарбонила и C1-6алкила, или фармацевтически приемлемая соль указанного соединения.
13. Соединение, выбранное из
N2-(3-метокси-4-(3-метил-1H-1,2,4-триазол-1-ил)фенил)-N4-метил-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
N2-(3-фтор-4-(3-метил-1H-1,2,4-триазол-1-ил)фенил)-N4-метил-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
N2-(3-фтор-4-(5-метил-1H-1,2,4-триазол-1-ил)фенил)-N4-метил-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-N4,N4-диметил-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
(S)-N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-N4,N4-диметил-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
(R)-N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-N4,N4-диметил-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-N4-этил-N4-метил-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
(S)-N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-N4-этил-N4-метил-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
(R)-N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-N4-этил-N4-метил-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
4-(азетидин-1-ил)-N-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-2-амина;
(S)-4-(азетидин-1-ил)-N-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-2-амина;
(R)-4-(азетидин-1-ил)-N-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-2-амина;
N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-N4-метил-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
(S)-N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-N4-метил-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
(R)-N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-N4-метил-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-N4-циклопропил-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-N4-циклобутил-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-N4-изопропил-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-7-(4-фторфенил)-N4-метил-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
(S)-N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-7-(4-фторфенил)-N4-метил-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
(R)-N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-7-(4-фторфенил)-N4-метил-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
N2-(3-фтор-4-(5-метил-1Н-1,2,4-триазол-1-ил)фенил)-7-(4-фторфенил)-N4-метил-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
N2-(2-фтор-5-метокси-4-(3-метил-1H-1,2,4-триазол-1-ил)фенил)-7-(4-фторфенил)-N4-метил-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
N2-(6-(4-хлор-1H-имидазол-1-ил)-5-метоксипиридин-3-ил)-7-(4-фторфенил)-N4-метил-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
N-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-4-(3,3-дифторазетидин-1-ил)-7-(4-фторфенил)-6,7-дигидро-5H-циклопента[d]пиримидин-2-амина;
4-(3,3-дифторазетидин-1-ил)-N-(3-фтор-4-(5-метил-1H-1,2,4-триазол-1-ил)фенил)-7-(4-фторфенил)-6,7-дигидро-5H-циклопента[d]пиримидин-2-амина;
N-(4-(3-хлор-1H-1,2,4-триазол-1-ил)-3-метоксифенил)-4-(3,3-дифторазетидин-1-ил)-7-(4-фторфенил)-6,7-дигидро-5H-циклопента[d]пиримидин-2-амина;
4-((1S,4S)-2-окса-5-азабицикло[2.2.1]гептан-5-ил)-N-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-7-(4-фторфенил)-6,7-дигидро-5H-циклопента[d]пиримидин-2-амина;
N-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-7-(4-фторфенил)-4-(2-метилпирролидин-1-ил)-6,7-дигидро-5H-циклопента[d]пиримидин-2-амина;
N-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-4-((2S,6R)-2,6-диметилморфолино)-7-(4-фторфенил)-6,7-дигидро-5H-циклопента[d]пиримидин-2-амина;
1-(2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифениламино)-7-(4-фторфенил)-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)-4-метилпиперидин-4-ола;
N-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-4-(2-этилпирролидин-1-ил)-7-(4-фторфенил)-6,7-дигидро-5H-циклопента[d]пиримидин-2-амина;
4-(4-амино-4-метилпиперидин-1-ил)-N-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-7-(4-фторфенил)-6,7-дигидро-5H-циклопента[d]пиримидин-2-амина;
N2-(3-фтор-4-(5-метил-1H-1,2,4-триазол-1-ил)фенил)-7-(4-фторфенил)-N4-метил-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
1-(2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифениламино)-7-(4-фторфенил)-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)-3-(трифторметил)пирролидин-3-ола;
N-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-4-(3-(диметиламино)пирролидин-1-ил)-7-(4-фторфенил)-6,7-дигидро-5H-циклопента[d]пиримидин-2-амина;
N-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-7-(4-фторфенил)-4-(4-метилпиперазин-1-ил)-6,7-дигидро-5H-циклопента[d]пиримидин-2-амина;
N-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-7-(4-фторфенил)-4-(пиперазин-1-ил)-6,7-дигидро-5H-циклопента[d]пиримидин-2-амина;
N-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-7-(4-фторфенил)-4-(3-(метиламино)пирролидин-1-ил)-6,7-дигидро-5H-циклопента[d]пиримидин-2-амина;
N-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-7-(4-фторфенил)-4-(3-(метиламино)азетидин-1-ил)-6,7-дигидро-5H-циклопента[d]пиримидин-2-амина;
N-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-4-(3-(диметиламино)азетидин-1-ил)-7-(4-фторфенил)-6,7-дигидро-5H-циклопента[d]пиримидин-2-амина;
N2-(3-фтор-4-(3-метил-1H-1,2,4-триазол-1-ил)фенил)-7-(4-фторфенил)-N4-метил-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
N-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-7-(4-фторфенил)-4-((S)-3-фторпирролидин-1-ил)-6,7-дигидро-5H-циклопента[d]пиримидин-2-амина;
N-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-7-(4-фторфенил)-4-((R)-3-фторпирролидин-1-ил)-6,7-дигидро-5H-циклопента[d]пиримидин-2-амина;
N-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-4-(4,4-дифторпиперидин-1-ил)-7-(4-фторфенил)-6,7-дигидро-5H-циклопента[d]пиримидин-2-амина;
N-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-4-(4-фтор-5,6-дигидропиридин-1(2H)-ил)-7-(4-фторфенил)-6,7-дигидро-5H-циклопента[d]пиримидин-2-амина;
N-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-7-(4-фторфенил)-4-(3-(трифторметил)пирролидин-1-ил)-6,7-дигидро-5H-циклопента[d]пиримидин-2-амина;
N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-N4-(3-этоксипропил)-7-(4-фторфенил)-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
3-(2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифениламино)-7-(4-фторфенил)-6,7-дигидро-5H-циклопента[d]пиримидин-4-иламино)пропан-1-ола;
7-(4-фторфенил)-N2-(3-метокси-4-(3-метил-1H-1,2,4-триазол-1-ил)фенил)-N4-метил-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-N4-(1-циклопропил-2-метоксиэтил)-7-(4-фторфенил)-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-7-(4-фторфенил)-N4,N4-диметил-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
(S)-N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-7-(4-фторфенил)-N4,N4-диметил-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
(R)-N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-7-(4-фторфенил)-N4,N4-диметил-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-7-(4-фторфенил)-N4-тридейтерометил-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-7-(4-фторфенил)-N4-((R)-1-метоксибутан-2-ил)-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-N4-((R)-1-циклопропилэтил)-7-(4-фторфенил)-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-N4-((S)-1-циклопропилэтил)-7-(4-фторфенил)-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-N4-метил-8-фенил-7,8-дигидро-5H-пирано[4,3-d]пиримидин-2,4-диамина;
N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-N4-этил-N4-метил-8-фенил-7,8-дигидро-5H-пирано[4,3-d]пиримидин-2,4-диамина;
(S)-N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-N4-этил-N4-метил-8-фенил-7,8-дигидро-5H-пирано[4,3-d]пиримидин-2,4-диамина;
(R)-N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-N4-этил-N4-метил-8-фенил-7,8-дигидро-5H-пирано[4,3-d]пиримидин-2,4-диамина;
N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-N4,N4-диметил-8-фенил-7,8-дигидро-5H-пирано[4,3-d]пиримидин-2,4-диамина;
(S)-N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-N4,N4-диметил-8-фенил-7,8-дигидро-5H-пирано[4,3-d]пиримидин-2,4-диамина;
(R)-N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-N4,N4-диметил-8-фенил-7,8-дигидро-5H-пирано[4,3-d]пиримидин-2,4-диамина;
8-(4-фторфенил)-N2-(3-метокси-4-(3-метил-1H-1,2,4-триазол-1-ил)фенил)-N4-метил-7,8-дигидро-5H-пирано[4,3-d]пиримидин-2,4-диамина;
N4-этил-8-(4-фторфенил)-N2-(3-метокси-4-(3-метил-1Н-1,2,4-триазол-1-ил)фенил)-7,8-дигидро-5H-пирано[4,3-d]пиримидин-2,4-диамина;
N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-N4-этил-8-(4-фторфенил)-7,8-дигидро-5H-пирано[4,3-d]пиримидин-2,4-диамина;
N-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-8-(4-фторфенил)-4-((R)-3-фторпирролидин-1-ил)-7,8-дигидро-5H-пирано[4,3-d]пиримидин-2-амина;
N-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-8-(4-фторфенил)-4-((S)-3-фторпирролидин-1-ил)-7,8-дигидро-5H-пирано[4,3-d]пиримидин-2-амина;
N4-этил-N2-(3-фтор-4-(5-метил-1H-1,2,4-триазол-1-ил)фенил)-8-(4-фторфенил)-7,8-дигидро-5H-пирано[4,3-d]пиримидин-2,4-диамина;
N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-8-(4-фторфенил)-N4-метил-7,8-дигидро-5H-пирано[4,3-d]пиримидин-2,4-диамина;
N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-8-(4-фторфенил)-N4,N4-диметил-7,8-дигидро-5H-пирано[4,3-d]пиримидин-2,4-диамина;
N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-N4-этил-8-(4-фторфенил)-N4-метил-7,8-дигидро-5H-пирано[4,3-d]пиримидин-2,4-диамина;
N-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-4-(3,3-дифторазетидин-1-ил)-8-(4-фторфенил)-7,8-дигидро-5H-пирано[4,3-d]пиримидин-2-амина;
N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-8-(4-хлорфенил)-N4-метил-7,8-дигидро-5H-пирано[4,3-d]пиримидин-2,4-диамина;
N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-8-(4-хлорфенил)-N4,N4-диметил-7,8-дигидро-5H-пирано[4,3-d]пиримидин-2,4-диамина;
N-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-8-(4-хлорфенил)-4-(3,3-дифторазетидин-1-ил)-7,8-дигидро-5H-пирано[4,3-d]пиримидин-2-амина;
8-(4-хлорфенил)-N2-(3-фтор-4-(5-метил-1H-1,2,4-триазол-1-ил)фенил)-N4,N4-диметил-7,8-дигидро-5H-пирано[4,3-d]пиримидин-2,4-диамина;
8-(4-хлорфенил)-4-(3,3-дифторазетидин-1-ил)-N-(3-фтор-4-(5-метил-1H-1,2,4-триазол-1-ил)фенил)-7,8-дигидро-5H-пирано[4,3-d]пиримидин-2-амина;
8-(4-хлорфенил)-N2-(3-фтор-4-(5-метил-1H-1,2,4-триазол-1-ил)фенил)-N4-метил-7,8-дигидро-5H-пирано[4,3-d]пиримидин-2,4-диамина;
8-(4-хлорфенил)-N2-(3-метокси-4-(4-метил-1H-имидазол-1-ил)фенил)-N4-метил-7,8-дигидро-5H-пирано[4,3-d]пиримидин-2,4-диамина;
8-(4-хлорфенил)-N2-(3-метокси-4-(3-метил-1H-1,2,4-триазол-1-ил)фенил)-N4-метил-7,8-дигидро-5H-пирано[4,3-d]пиримидин-2,4-диамина;
8-(4-бромфенил)-N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-N4-метил-7,8-дигидро-5H-пирано[4,3-d]пиримидин-2,4-диамина;
8-(4-бромфенил)-N2-(3-фтор-4-(5-метил-1H-1,2,4-триазол-1-ил)фенил)-N4-метил-7,8-дигидро-5H-пирано[4,3-d]пиримидин-2,4-диамина;
N-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-7-(4-фторфенил)-4-((S)-2-метилпирролидин-1-ил)-5,7-дигидрофуро[3,4-d]пиримидин-2-амина;
N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-N4-этил-7-(4-фторфенил)-5,7-дигидрофуро[3,4-d]пиримидин-2,4-диамина;
N-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-7-(4-фторфенил)-4-((S)-3-фторпирролидин-1-ил)-5,7-дигидрофуро[3,4-d]пиримидин-2-амина;
N4-этил-N2-(3-фтор-4-(5-метил-1H-1,2,4-триазол-1-ил)фенил)-7-(4-фторфенил)-5,7-дигидрофуро[3,4-d]пиримидин-2,4-диамина;
N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-7-(4-фторфенил)-N4-метил-5,7-дигидрофуро[3,4-d]пиримидин-2,4-диамина;
N-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-4-(3,3-дифторазетидин-1-ил)-7-(4-фторфенил)-5,7-дигидрофуро[3,4-d]пиримидин-2-амина;
N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-N4-((R)-1-циклопропилэтил)-7-(4-фторфенил)-5,7-дигидрофуро[3,4-d]пиримидин-2,4-диамина;
N2-(3-фтор-4-(5-метил-1H-1,2,4-триазол-1-ил)фенил)-7-(4-фторфенил)-N4-метил-5,7-дигидрофуро[3,4-d]пиримидин-2,4-диамина;
N-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-7-(4-фторфенил)-4-((R)-3-фторпирролидин-1-ил)-5,7-дигидрофуро[3,4-d]пиримидин-2-амина;
N-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-4-((2S,6R)-2,6-диметилморфолино)-7-(4-фторфенил)-5,7-дигидрофуро[3,4-d[пиримидин-2-амина;
N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-N4-метил-8-фенил-6,8-дигидро-5H-пирано[3,4-d]пиримидин-2,4-диамина;
N2-(3-фтор-4-(3-метил-1H-1,2,4-триазол-1-ил)фенил)-N4-метил-8-фенил-6,8-дигидро-5H-пирано[3,4-d]пиримидин-2,4-диамина;
N2-(3-фтор-4-(5-метил-1H-1,2,4-триазол-1-ил)фенил)-N4-метил-8-фенил-6,8-дигидро-5H-пирано[3,4-d]пиримидин-2,4-диамина;
N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-N4-этил-8-(4-фторфенил)-6,8-дигидро-5H-пирано[3,4-d]пиримидин-2,4-диамина;
N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-N4-этил-8-(4-фторфенил)-N4-метил-6,8-дигидро-5H-пирано[3,4-d]пиримидин-2,4-диамина;
N-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-8-(4-фторфенил)-4-((R)-3-фторпирролидин-1-ил)-6,8-дигидро-5H-пирано[3,4-d]пиримидин-2-амина;
N-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-8-(4-фторфенил)-4-((S)-3-фторпирролидин-1-ил)-6,8-дигидро-5H-пирано[3,4-d]пиримидин-2-амина;
N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-7-(4-хлорфенил)-N4,N4-диметил-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
N-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-7-(4-хлорфенил)-4-(3,3-дифторазетидин-1-ил)-6,7-дигидро-5H-циклопента[d]пиримидин-2-амина;
N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-7-(4-хлорфенил)-N4-метил-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
(S)-N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-7-(4-хлорфенил)-N4-метил-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
(R)-N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-7-(4-хлорфенил)-N4-метил-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-7-(3,4-дифторфенил)-N4,N4-диметил-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
(S)-N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-7-(3,4-дифторфенил)-N4,N4-диметил-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
(R)-N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-7-(3,4-дифторфенил)-N4,N4-диметил-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-7-(3,4-дифторфенил)-N4-метил-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
(S)-N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-7-(3,4-дифторфенил)-N4-метил-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
(R)-N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-7-(3,4-дифторфенил)-N4-метил-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-N4-метил-7-(4-(трифторметокси)фенил)-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
(S)-N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-N4-метил-7-(4-(трифторметокси)фенил)-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
(R)-N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-N4-метил-7-(4-(трифторметокси)фенил)-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-N4-этил-7-(4-(трифторметокси)фенил)-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
(S)-N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-N4-этил-7-(4-(трифторметокси)фенил)-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
(R)-N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-N4-этил-7-(4-(трифторметокси)фенил)-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
N-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-4-(3,3-дифторазетидин-1-ил)-7-(4-(трифторметокси)фенил)-6,7-дигидро-5H-циклопента[d]пиримидин-2-амина;
(S)-N-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-4-(3,3-дифторазетидин-1-ил)-7-(4-(трифторметокси)фенил)-6,7-дигидро-5H-циклопента[d]пиримидин-2-амина;
(R)-N-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-4-(3,3-дифторазетидин-1-ил)-7-(4-(трифторметокси)фенил)-6,7-дигидро-5H-циклопента[d]пиримидин-2-амина;
N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-N4,N4-диметил-7-(4-(трифторметокси)фенил)-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
(S)-N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-N4,N4-диметил-7-(4-(трифторметокси)фенил)-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
(R)-N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-N4,N4-диметил-7-(4-(трифторметокси)фенил)-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
4-(азетидин-1-ил)-N-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-7-(4-(трифторметокси)фенил)-6,7-дигидро-5H-циклопента[d]пиримидин-2-амина;
(S)-4-(азетидин-1-ил)-N-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-7-(4-(трифторметокси)фенил)-6,7-дигидро-5H-циклопента[d]пиримидин-2-амина;
(R)-4-(азетидин-1-ил)-N-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-7-(4-(трифторметокси)фенил)-6,7-дигидро-5H-циклопента[d]пиримидин-2-амина;
N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-7-(3,5-дифторфенил)-N4-метил-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-N4-метил-7-(3,4,5-трифторфенил)-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
(S)-N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-N4-метил-7-(3,4,5-трифторфенил)-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
(R)-N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-N4-метил-7-(3,4,5-трифторфенил)-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
N2-(3-фтор-4-(5-метил-1H-1,2,4-триазол-1-ил)фенил)-N4-метил-7-(3,4,5-трифторфенил)-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
N2-(6-(4-хлор-1H-имидазол-1-ил)-5-метоксипиридин-3-ил)-N4-метил-7-(3,4,5-трифторфенил)-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
N2-(4-(3-хлор-1H-1,2,4-триазол-1-ил)-3-метоксифенил)-N4-метил-7-(3,4,5-трифторфенил)-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
N-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-4-(3,3-дифторпирролидин-1-ил)-7-(3,4,5-трифторфенил)-6,7-дигидро-5H-циклопента[d]пиримидин-2-амина;
(S)-N-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-4-(3,3-дифторпирролидин-1-ил)-7-(3,4,5-трифторфенил)-6,7-дигидро-5H-циклопента[d]пиримидин-2-амина;
(R)-N-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-4-(3,3-дифторпирролидин-1-ил)-7-(3,4,5-трифторфенил)-6,7-дигидро-5H-циклопента[d]пиримидин-2-амина;
N-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-4-(3,3-дифторазетидин-1-ил)-7-(3,4,5-трифторфенил)-6,7-дигидро-5H-циклопента[d]пиримидин-2-амина;
N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-7-(2,4-дифторфенил)-N4-метил-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
(S)-N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-7-(2,4-дифторфенил)-N4-метил-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
(R)-N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-7-(2,4-дифторфенил)-N4-метил-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-N4-этил-7-метил-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-N4-этил-7-аллил-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-8-(3,5-дифторфенил)-N4-этил-7,8-дигидро-5H-пирано[4,3-d]пиримидин-2,4-диамина;
N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-8-(3,4-дифторфенил)-N4-этил-7,8-дигидро-5H-пирано[4,3-d]пиримидин-2,4-диамина;
N-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-4-(3,3-дифторазетидин-1-ил)-8-(3,4-дифторфенил)-7,8-дигидро-5H-пирано[4,3-d]пиримидин-2-амина;
N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-8-(3,4-дифторфенил)-N4-метил-7,8-дигидро-5H-пирано[4,3-d]пиримидин-2,4-диамина;
8-(3,4-дифторфенил)-N4-этил-N2-(3-фтор-4-(5-метил-1H-1,2,4-триазол-1-ил)фенил)-7,8-дигидро-5H-пирано[4,3-d]пиримидин-2,4-диамина;
N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-N4-((R)-1-циклопропилэтил)-8-(4-(трифторметил)фенил)-7,8-дигидро-5H-пирано[4,3-d]пиримидин-2,4-диамина;
N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-N4-этил-8-(4-(трифторметил)фенил)-7,8-дигидро-5H-пирано[4,3-d]пиримидин-2,4-диамина;
N4-этил-N2-(3-фтор-4-(5-метил-1H-1,2,4-триазол-1-ил)фенил)-8-(4-(трифторметил)фенил)-7,8-дигидро-5H-пирано[4,3-d]пиримидин-2,4-диамина;
N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-N4-метил-8-(4-(трифторметил)фенил)-7,8-дигидро-5H-пирано[4,3-d]пиримидин-2,4-диамина;
4-(2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифениламино)-4-(этиламино)-7,8-дигидро-5H-пирано[4,3-d]пиримидин-8-ил)бензонитрила;
N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-N4-метил-8-(4-(трифторметокси)фенил)-7,8-дигидро-5H-пирано[4,3-d]пиримидин-2,4-диамина;
N-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-4-((R)-3-фторпирролидин-1-ил)-8-(4-(трифторметокси)фенил)-7,8-дигидро-5H-пирано[4,3-d]пиримидин-2-амина;
N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-N4-этил-N4-метил-8-фенил-5,6,7,8-тетрагидрохиназолин-2,4-диамина;
(S)-N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-N4-этил-N4-метил-8-фенил-5,6,7,8-тетрагидрохиназолин-2,4-диамина;
(R)-N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-N4-этил-N4-метил-8-фенил-5,6,7,8-тетрагидрохиназолин-2,4-диамина;
N-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-8-фенил-5,6,7,8-тетрагидрохиназолин-2-амина;
N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-N4-этил-8-(4-фторфенил)-N4-метил-5,6,7,8-тетрагидрохиназолин-2,4-диамина;
N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-8-(4-фторфенил)-N4,N4-диметил-5,6,7,8-тетрагидрохиназолин-2,4-диамина;
(S)-N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-8-(4-фторфенил)-N4,N4-диметил-5,6,7,8-тетрагидрохиназолин-2,4-диамина;
(R)-N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-8-(4-фторфенил)-N4,N4-диметил-5,6,7,8-тетрагидрохиназолин-2,4-диамина;
N-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-8-(4-фторфенил)-5,6,7,8-тетрагидрохиназолин-2-амина;
N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-N4-метил-6-(метилсульфонил)-8-фенил-5,6,7,8-тетрагидропиридо[4,3-d]пиримидин-2,4-диамина;
N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-6-(циклопропилсульфонил)-N4-метил-8-фенил-5,6,7,8-тетрагидропиридо[4,3-d]пиримидин-2,4-диамина;
метил 2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифениламино)-4-(этиламино)-8-фенил-7,8-дигидропиридо[4,3-d]пиримидин-6(5H)-карбоксилата;
(2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифениламино)-4-(этиламино)-8-фенил-7,8-дигидропиридо[4,3-d]пиримидин-6(5H)-ил)(циклопропил)метанона;
1-(2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифениламино)-4-(этиламино)-8-фенил-7,8-дигидропиридо[4,3-d]пиримидин-6(5H)-ил)-2-метоксиэтанона;
N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-N4-этил-6-(метилсульфонил)-8-фенил-5,6,7,8-тетрагидропиридо[4,3-d]пиримидин-2,4-диамина;
1-(2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифениламино)-4-(этиламино)-8-фенил-7,8-дигидропиридо[4,3-d]пиримидин-6(5H)-ил)-2-(диметиламино)этанона;
N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-6-(циклопропилсульфонил)-N4-этил-8-фенил-5,6,7,8-тетрагидропиридо[4,3-d]пиримидин-2,4-диамина;
1-(2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифениламино)-4-(этиламино)-8-фенил-7,8-дигидропиридо[4,3-d]пиримидин-6(5H)-ил)этанона;
N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-N4-этил-6-(этилсульфонил)-8-фенил-5,6,7,8-тетрагидропиридо[4,3-d]пиримидин-2,4-диамина;
N4-этил-N2-(3-фтор-4-(3-метил-1H-1,2,4-триазол-1-ил)фенил)-6-(метилсульфонил)-8-фенил-5,6,7,8-тетрагидропиридо[4,3-d]пиримидин-2,4-диамина;
N4-этил-N2-(3-фтор-4-(5-метил-1H-1,2,4-триазол-1-ил)фенил)-6-(метилсульфонил)-8-фенил-5,6,7,8-тетрагидропиридо[4,3-d]пиримидин-2,4-диамина;
6-(циклопропилсульфонил)-N2-(3-фтор-4-(3-метил-1H-1,2,4-триазол-1-ил)фенил)-N4-метил-8-фенил-5,6,7,8-тетрагидропиридо[4,3-d]пиримидин-2,4-диамина;
6-(циклопропилсульфонил)-N2-(3-фтор-4-(5-метил-1Н-1,2,4-триазол-1-ил)фенил)-N4-метил-8-фенил-5,6,7,8-тетрагидропиридо[4,3-d]пиримидин-2,4-диамина;
циклопропил(4-(этиламино)-2-(3-фтор-4-(3-метил-1Н-1,2,4-триазол-1-ил)фениламино)-8-фенил-7,8-дигидропиридо[4,3-d]пиримидин-6(5H)-ил)метанона;
циклопропил(4-(этиламино)-2-(3-фтор-4-(5-метил-1H-1,2,4-триазол-1-ил)фениламино)-8-фенил-7,8-дигидропиридо[4,3-d]пиримидин-6(5H)-ил)метанона;
N4-этил-N2-(3-фтор-4-(3-метил-1H-1,2,4-триазол-1-ил)фенил)-8-фенил-6-(2,2,2-трифторэтил)-5,6,7,8-тетрагидропиридо[4,3-d]пиримидин-2,4-диамина;
N4-этил-N2-(3-фтор-4-(5-метил-1H-1,2,4-триазол-1-ил)фенил)-8-фенил-6-(2,2,2-трифторэтил)-5,6,7,8-тетрагидропиридо[4,3-d]пиримидин-2,4-диамина;
N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-N4,N4-диметил-6-(метилсульфонил)-8-фенил-5,6,7,8-теграгидропиридо[4,3-d]пиримидин-2,4-диамина;
N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-N4,6-диметил-8-фенил-5,6,7,8-тетрагидропиридо[4,3-d]пиримидин-2,4-диамина;
N2-(3-фтор-4-(3-метил-1H-1,2,4-триазол-1-ил)фенил)-N4,6-диметил-8-фенил-5,6,7,8-тетрагидропиридо[4,3-d]пиримидин-2,4-диамина;
N2-(3-фтор-4-(5-метил-1H-1,2,4-триазол-1-ил)фенил)-N4,6-диметил-8-фенил-5,6,7,8-тетрагидропиридо[4,3-d]пиримидин-2,4-диамина;
N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-N4-этил-6-метил-8-фенил-5,6,7,8-тетрагидропиридо[4,3-d]пиримидин-2,4-диамина;
N4-этил-N2-(3-фтор-4-(3-метил-1H-1,2,4-триазол-1-ил)фенил)-6-метил-8-фенил-5,6,7,8-тетрагидропиридо[4,3-d]пиримидин-2,4-диамина;
N4-этил-N2-(3-фтор-4-(5-метил-1H-1,2,4-триазол-1-ил)фенил)-6-метил-8-фенил-5,6,7,8-тетрагидропиридо[4,3-d]пиримидин-2,4-диамина;
N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-8-(4-фторфенил)-N4-метил-6-(метилсульфонил)-5,6,7,8-тетрагидропиридо[4,3-d]пиримидин-2,4-диамина;
N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-N4-этил-8-(4-фторфенил)-6-(метилсульфонил)-5,6,7,8-тетрагидропиридо[4,3-d]пиримидин-2,4-диамина;
N4-этил-N2-(3-фтор-4-(3-метил-1H-1,2,4-триазол-1-ил)фенил)-8-(4-фторфенил)-6-(метилсульфонил)-5,6,7,8-тетрагидропиридо[4,3-d]пиримидин-2,4-диамина;
N4-этил-N2-(3-фтор-4-(5-метил-1H-1,2,4-триазол-1-ил)фенил)-6-(метилсульфонил)-8-(4-фторфенил)-5,6,7,8-тетрагидропиридо[4,3-d]пиримидин-2,4-диамина;
N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-N4,6-диэтил-8-(4-фторфенил)-N4-метил-5,6,7,8-тетрагидропиридо[4,3-d]пиримидин-2,4-диамина;
N-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-4-(3,3-дифторазетидин-1-ил)-8-(4-фторфенил)-6-метил-5,6,7,8-тетрагидропиридо[4,3-d]пиримидин-2-амина;
N-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-4-(3,3-дифторазетидин-1-ил)-8-(4-фторфенил)-6-(метилсульфонил)-5,6,7,8-тетрагидропиридо[4,3-d]пиримидин-2-амина;
N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-N4-этил-8-(4-фторфенил)-N4-метил-5,6,7,8-тетрагидропиридо[4,3-d]пиримидин-2,4-диамина;
N-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-4-(3,3-дифторазетидин-1-ил)-8-(4-фторфенил)-5,6,7,8-тетрагидропиридо[4,3-d]пиримидин-2-амина;
N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-8-(4-фторфенил)-N4,6-диметил-5,6,7,8-тетрагидропиридо[4,3-d]пиримидин-2,4-диамина;
N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-N4-этил-8-(4-фторфенил)-6-метил-5,6,7,8-тетрагидропиридо[4,3-d]пиримидин-2,4-диамина;
N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-N4-этил-8-(4-фторфенил)-N4,6-диметил-5,6,7,8-тетрагидропиридо[4,3-d]пиримидин-2,4-диамина;
N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-N4-этил-8-(4-фторфенил)-N4-метил-5,6,7,8-тетрагидропиридо[3,4-d]пиримидин-2,4-диамина;
N-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-8-(4-фторфенил)-4-((S)-3-фторпирролидин-1-ил)-7-(4-метоксибензил)-5,6,7,8-тетрагидропиридо[3,4-d]пиримидин-2-амина;
N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-N4-этил-8-(4-фторфенил)-7-(метилсульфонил)-5,6,7,8-тетрагидропиридо[3,4-d]пиримидин-2,4-диамина;
N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-N4,7-диэтил-8-(4-фторфенил)-5,6,7,8-тетрагидропиридо[3,4-d]пиримидин-2,4-диамина;
метил 2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифениламино)-4-(этиламино)-8-(4-фторфенил)-5,6-дигидропиридо[3,4-d]пиримидин-7(8H)-карбоксилата;
1-(2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифениламино)-4-(этиламино)-8-(4-фторфенил)-5,6-дигидропиридо[3,4-d]пиримидин-7(8H)-ил)этанона;
N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-N4-этил-8-(4-фторфенил)-N4-метил-7-(метилсульфонил)-5,6,7,8-тетрагидропиридо[3,4-d]пиримидин-2,4-диамина;
N-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-8-(4-фторфенил)-4-((R)-3-фторпирролидин-1-ил)-7-(метилсульфонил)-5,6,7,8-тетрагидропиридо[3,4-d]пиримидин-2-амина;
N-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-8-(4-фторфенил)-4-((R)-3-фторпирролидин-1-ил)-7-(метилсульфонил)-5,6,7,8-тетрагидропиридо[3,4-d]пиримидин-2-амина;
N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-N4-этил-8-(4-фторфенил)-7-метил-5,6,7,8-тетрагидропиридо[3,4-d]пиримидин-2,4-диамина;
N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-N4-тридейтерометил-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
(S)-N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-N4-тридейтерометил-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
(R)-N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-N4-тридейтерометил-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифениламино)-4-(метиламино)-8-фенил-7,8-дигидрохиназолин-8-ола;
2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифениламино)-4-(метиламино)-8-фенил-5,6,7,8-тетрагидрохиназолин-8-ола;
2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифениламино)-4-(диметиламино)-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-7-ола;
(6S,7S)-2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифениламино)-4-(диметиламино)-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-6-ола;
N-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-4-(3-хлоразетидин-1-ил)-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-2-амина;
N-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-4-(3-фторазетидин-1-ил)-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-2-амина;
N-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-4-(3-метоксиазетидин-1-ил)-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-2-амина;
N-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-7-фенил-4-(5,8-диокса-2-азаспиро[3.4]октан-2-ил)-6,7-дигидро-5H-циклопента[d]пиримидин-2-амина;
1-(2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифениламино)-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)азетидин-3-она;
1-(2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифениламино)-7-(4-фторфенил)-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)-3-метилазетидин-3-карбонитрила;
N-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-4-(3-этоксиазетидин-1-ил)-7-(4-фторфенил)-6,7-дигидро-5H-циклопента[d]пиримидин-2-амина;
N-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-7-фенил-4-(5-окса-2-азаспиро[3.4]октан-2-ил)-6,7-дигидро-5H-циклопента[d]пиримидин-2-амина;
1-(2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифениламино)-7-(4-фторфенил)-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)-3-метилазетидин-3-ола;
N-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-4-(3-фтор-3-метилазетидин-1-ил)-7-(4-фторфенил)-6,7-дигидро-5H-циклопента[d]пиримидин-2-амина;
N-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-7-(4-фторфенил)-4-(3-метокси-3-метилазетидин-1-ил)-6,7-дигидро-5H-циклопента[d]пиримидин-2-амина;
7-(4-фторфенил)-4-(3-метокси-3-метилазетидин-1-ил)-N-(3-метокси-4-(3-метил-1H-1,2,4-триазол-1-ил)фенил)-6,7-дигидро-5H-циклопента[d]пиримидин-2-амина;
7-(2,4-дифторфенил)-N2-(3-метокси-4-(3-метил-1H-1,2,4-триазол-1-ил)фенил)-N4-метил-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
(S)-7-(2,4-дифторфенил)-N2-(3-метокси-4-(3-метил-1H-1,2,4-триазол-1-ил)фенил)-N4-метил-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
(R)-7-(2,4-дифторфенил)-N2-(3-метокси-4-(3-метил-1Н-1,2,4-триазол-1-ил)фенил)-N4-метил-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
6-(2,2-дифторэтил)-N4-этил-N2-(3-фтор-4-(5-метил-1H-1,2,4-триазол-1-ил)фенил)-8-фенил-5,6,7,8-тетрагидропиридо[4,3-d]пиримидин-2,4-диамина;
6-(2,2-дифторэтил)-N4-этил-N2-(3-фтор-4-(3-метил-1H-1,2,4-триазол-1-ил)фенил)-8-фенил-5,6,7,8-тетрагидропиридо[4,3-d]пиримидин-2,4-диамина;
N4-этил-N2-(3-метокси-4-(4-хлор-1H-13-имидазол-1-ил)фенил)-8-фенил-6-(2,2,2-трифторэтил)-5,6,7,8-тетрагидропиридо[4,3-d]пиримидин-2,4-диамина;
N4-этил-N2-(3-метокси-4-(4-хлор-1H-13-имидазол-1-ил)фенил)-8-фенил-6-(2,2-дифторэтил)-5,6,7,8-тетрагидропиридо[4,3-d]пиримидин-2,4-диамина;
8-(4-фторфенил)-N2-(3-метокси-4-(3-метил-1H-1,2,4-триазол-1-ил)фенил)-N4,6-диметил-5,6,7,8-тетрагидропиридо[4,3-d]пиримидин-2,4-диамина;
8-(4-фторфенил)-N2-(3-метокси-4-(5-метил-1H-1,2,4-триазол-1-ил)фенил)-N4,6-диметил-5,6,7,8-тетрагидропиридо[4,3-d]пиримидин-2,4-диамина;
(±)-2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифениламино)-4-(метиламино)-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-5-она;
(E)-2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифениламино)-4-(метиламино)-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-5-она О-метил оксима;
2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифениламино)-4-(метиламино)-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-5-ола;
N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-N4-метил-8-фенил-5,6,7,8-тетрагидрохиназолин-2,4-диамина;
1-(2-метокси-4-(4-(метиламино)-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-2-иламино)фенил)-1H-имидазол-4-карбонитрила;
N-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-7-фенил-4-(1,4-диокса-7-азаспиро[4.4]нонан-7-ил)-6,7-дигидро-5H-циклопента[d]пиримидин-2-амина;
1-(2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифениламино)-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)пирролидин-3-она;
4-(8-(4-фторфенил)-4-(метиламино)-6-(метилсульфонил)-5,6,7,8-тетрагидропиридо[4,3-d]пиримидин-2-иламино)бензонитрила;
N2-(4-(4-(дифторметил)-1H-имидазол-1-ил)-3-метоксифенил)-7-(4-фторфенил)-N4-метил-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
N2-(3-метокси-4-(1-метил-1H-пиразол-4-ил)фенил)-N4-метил-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
N-(2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифениламино)-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)-N-метилметансульфонамида;
N-(2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифениламино)-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)-N-метансульфонамида;
N-(2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифениламино)-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)-N-метилацетамида;
N-(2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифениламино)-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)-N-ацетамида;
N2-(4-(4-хлор-1H-имидазол-1-ил)-3-метоксифенил)-N4-(5-изопропил-2-метилфенил)-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
4-(4-(5-изопропил-2-метилфениламино)-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-2-иламино)бензонитрила;
N4-метил-N2-(2-метилпиридин-4-ил)-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
N2-(3-метоксифенил)-N4-метил-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
N2-(4-фторфенил)-N4-метил-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
N2-(3,5-дифторфенил)-N4-метил-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
N2-(4-хлор-3-метоксифенил)-N4-метил-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
N2-(4-бром-2-метоксифенил)-N4-метил-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
N2-(4-фтор-3-метоксифенил)-N4-метил-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
N4-метил-7-фенил-N2-(пиримидин-5-ил)-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
N4-метил-7-фенил-N2-(пиридин-4-ил)-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
4-(4-(метиламино)-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-2-иламино)бензонитрила;
2-(4-(метиламино)-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-2-иламино)бензонитрила;
4-(4-(метиламино)-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-2-иламино)-1-нафтонитрила;
5-(4-(метиламино)-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-2-иламино)пиколинонитрила;
2-(4-(4-(метиламино)-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-2-иламино)фенил)ацетонитрила;
2-(4-(метиламино)-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-2-иламино)-1H-бензо[d]имидазол-5-карбонитрила;
3-(4-(метиламино)-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-2-иламино)бензонитрила;
N2-(4-трет-бутилфенил)-N4-метил-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
N4-метил-N2-(4-(метилсульфонил)фенил)-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
N4-метил-7-фенил-N2-(4-(трифторметокси)фенил)-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
4-(4-(метиламино)-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-2-иламино)фталонитрила;
4-(4-(метиламино)-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-2-иламино)-2-(трифторметил)бензонитрила;
N4-метил-7-фенил-N2-(4-(трифторметил)фенил)-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
5-(4-(метиламино)-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-2-иламино)-2,3-дигидро-1H-инден-1-она;
2-(4-(метиламино)-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-2-иламино)-1H-имидазол-4,5-дикарбонитрила;
2-бром-5-(4-(метиламино)-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-2-иламино)бензонитрила;
N,N-диметил-4-(4-(метиламино)-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-2-иламино)бензамида;
1-(4-(4-(метиламино)-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-2-иламино)фенил)циклопентанкарбонитрила;
N4-метил-7-фенил-N2-(1,2,3,4-тетрагидроизохинолин-6-ил)-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
4-(4-(метиламино)-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-2-иламино)-2-(трифторметокси)бензонитрила;
1-(4-(4-(метиламино)-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-2-иламино)фенил)циклопропанкарбонитрила;
1-(2-метокси-4-(4-(метиламино)-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-2-иламино)фениламино)циклопропанкарбонитрила;
N4-метил-N2-(2-метил-1H-индол-5-ил)-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
N2-(бензофуран-5-ил)-N4-метил-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
N2-(1Н-индол-5-ил)-N4-метил-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
N4-метил-N2-(2-метилбензо[d]оксазол-6-ил)-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
N2-(1Н-бензо[d]имидазол-6-ил)-N4-метил-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
N4-метил-N2-(1-метил-1H-индол-5-ил)-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
N4-метил-N2-(2-метилбензо[d]тиазол-6-ил)-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
N2-(4-бром-3-метоксифенил)-N4-метил-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
1-(4-(4-(метиламино)-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-2-иламино)фенил)этанона;
N2-(4-циклопропилфенил)-7-(4-фторфенил)-N4-метил-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
N2-(4-этинилфенил)-7-(4-фторфенил)-N4-метил-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
7-(4-фторфенил)-N4-метил-N2-(4-(проп-1-инил)фенил)-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
N2-(3-метокси-4-(2-метилпиридин-4-ил)фенил)-N4-метил-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
N2-(3-метокси-4-(пиридин-4-ил)фенил)-N4-метил-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина и
N2-(3-метокси-4-(пиридин-3-ил)фенил)-N4-метил-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диамина;
или фармацевтически приемлемая соль указанного соединения.
14. Фармацевтическая композиция для лечения расстройств, чувствительных к уменьшению продукции β-амилоидного пептида, содержащая терапевтически эффективное количество соединения по п.1 или его фармацевтически приемлемой соли в сочетании с фармацевтически приемлемым носителем или разбавителем.
15. Способ лечения расстройств, чувствительных к уменьшению продукции β-амилоидного пептида, у млекопитающего, нуждающегося в таком лечении, который включает введение указанному млекопитающему терапевтически эффективного количества соединения по п.13 или его фармацевтически приемлемой соли.
16. Способ по п.15, отличающийся тем, что указанное расстройство выбрано из болезни Альцгеймера (БА), болезни Дауна, легкого когнитивного нарушения (ЛКН), церебральной амилоидной ангиопатии (ЦАА), деменции с тельцами Леви (ДТЛ), бокового амиотрофического склероза (ALS-D), миозита с включенными тельцами (IBM) и возрастной дегенерации желтого пятна.
17. Способ по п.16, отличающийся тем, что указанное расстройство выбрано из болезни Альцгеймера и болезни Дауна.
18. Способ по п.17, отличающийся тем, что указанное расстройство представляет собой болезнь Альцгеймера.
Текст
СОЕДИНЕНИЯ ДЛЯ УМЕНЬШЕНИЯ ПРОДУКЦИИ -АМИЛОИДА В изобретении предложены соединения формулы (I) модулирующие продукцию -амилоидного пептида (-АР), которые можно применять в лечении болезни Альцгеймера и других состояний, вызываемых продукцией -амилоидного пептида (-АР). Область техники изобретения Изобретение относится к способу лечения болезни Альцгеймера (БА) и других состояний, связанных с продукцией -амилоида, с использованием соединений, которые являются ингибиторами продукции -амилоидного пептида (А). Кроме того, изобретение относится к фармацевтическим композициям,содержащим указанные соединения. Уровень техники изобретения Болезнь Альцгеймера (БА) представляет собой прогрессирующее нейродегенеративное заболевание, начало которого характеризуется потерей памяти и дальнейшее развитие которого приводит к таким последствиям, как тяжелое нарушение познавательных способностей, изменение поведения и нарушение моторной функции (Grundman, M. et ah, Arch Neurol. (2004) 61: 59-66; Walsh, D.M. et ah, Neuron (2004) 44: 181-193). БА представляет собой самую распространенную форму деменции и является третьей основной причиной смерти после сердечно-сосудистых расстройств и рака. Негативные последствия БА значительны, к ним относятся страдание пациентов и членов их семей, а также выключение пациентов и лиц, осуществляющих за ними уход, из производственной деятельности. В настоящее время отсутствуют методики лечения, которые эффективно предупреждают БА или устраняют клинические симптомы и лежащую в их основе патофизиологию. Для подтверждения диагноза БА у пациента, страдавшего деменцией, необходимо провести гистологическое исследование на вскрытии, чтобы оценить количество и локализацию нейритических бляшек и нейрофибриллярных клубков (Consensus recommendations for the postmortem diagnosis of Alzheimer'sdisease. Neurobiol. Aging (1997) 18: S1-2). Аналогичные изменения наблюдаются у пациентов, страдающих трисомией 21 (болезнью Дауна). Бляшки преимущественно состоят из -амилоидных (А) пептидов,которые образуются в результате последовательного протеолитического расщепления предшественника бета-амилоида (АРР) -секретазой (ВАСЕ, от англ. P-site APP-cleaving enzyme) с образованием Nконцевого фрагмента АРР и -секретазой с образованием С-концевого фрагмента АРР (Selkoe, D.J., Physiol. Rev. (2001) 81: 741-766). -Секретаза представляет собой трансмембранный белковый комплекс, который включает никастрин, Aph-1, PEN-2 и либо пресенилин-1 (PS-1), либо пресенилин-2 (PS-2) (Wolfe,M.S. et ah, Science (2004) 305: 1119-1123). Считается, что PS-1 и PS-2 содержат каталитические сайты секретазы. А 40 представляет собой наиболее распространенную форму синтезируемых А (80-90%), тогда как А 42 наиболее тесно связан с патогенезом БА. В частности, мутации в генах АРР, PS-1 и PS-2, приводящие к редким наследственным формам БА, вызывают образование А 42-агрегатов, являющихся первичными токсическими продуктами (Selkoe, D.J., Physiol Rev. (2001) 81: 741-766). Имеющиеся данные дают возможность предположить, что олигомерные протофибриллярные и внутриклеточные А 42 играют значительную роль в патологическом процессе (Cleary, J.P. et al., Nat Neurosci. (2005) 8: 79-84). Ингибиторы ферментов, участвующих в образовании А 42, таких как -секретаза, представляют собой потенциальные базисные лекарства для лечения БД. Есть основания считать, что уменьшение уровня А в головном мозге путем ингибирования секретазы может препятствовать появлению и прогрессированию БА (Selkoe, D., Physiol Rev. (2001) 81: 741-766; Wolfe, M., J Med Chem. (2001) 44: 2039-2060). Появляются данные о роли А в других заболеваниях, включающих легкое когнитивное нарушение (ЛКН), болезнь Дауна, церебральную амилоидную ангиопатию (САА), деменцию с тельцами Леви (DLB), боковой амиотрофический склероз (ALS-D), миозит с включенными тельцами (IBM) и возрастную дегенерацию желтого пятна. Соответственно, соединения, которые ингибируют -секретазу и уменьшают продукцию А, можно было с успехом использовать в лечении этих или других А-обусловленных заболеваний. Избыточная продукция и/или замедленный клиренс А приводят к развитию САА (Thal, D. et al., JNeuropath Exp Neuro. (2002) 61: 282-293). У пациентов, страдающих данным заболеванием, сосудистые амилоидные депозиты вызывают дегенерацию стенок сосудов и аневризмы, что может являться причиной 10-15% геморрагических инсультов у пожилых пациентов. Как и в случае БА, мутации в гене, кодирующем А, приводят к развитию ранней формы САА, называемой церебральная геморрагия с амилоидозом голландского типа, а у мышей, экспрессирующих данный мутантный белок, развивается САА,похожая на соответствующее заболевание у человека. Соединения, которые снижают уровень А, могли бы замедлить или предотвратить развитие САА. Проявлениями DLB являются зрительные галлюцинации, бред и паркинсонизм. Интересно, что мутации, обнаруженные у пациентов, страдающих наследственными формами БА, и вызывающие накопление А в виде депозитов, также могут вызывать образование телец Леви и симптомы DLB (Yokota, О. etal., Acta Neuropathol (Berl) (2002) 104: 637-648). Кроме того, у некоторых пациентов, страдающих DLB,имеются депозиты А , схожие с депозитами А , характерными для БА (Deramecourt, V. et al., J Neuropathol Exp Neurol. (2006) 65: 278-288). На основе этих данных можно предположить, что А , по-видимому,является причиной патологии, обусловленной тельцами Леви, которая характерна для DLB, и поэтому соединения, которые снижают уровень А, могли бы замедлить или предотвратить развитие DLB.-1 020322 Приблизительно у 25% пациентов, страдающих ALS, имеет место значительная по своей выраженности деменция или афазия (Hamilton, R.L. et al., Acta Neuropathol. (Berl.) (2004) 107: 515-522). У большей части (60%) этих пациентов (называемых ALS-D-пациентами) обнаружены убиквитин-позитивные включения, содержащие в основном белок TDP-43 (Neumann, M. et al, Science (2006) 314: 130-133). Приблизительно 30% ALS-D-пациентов имеют амилоидные бляшки, похожие на А-бляшки, вызывающие деменцию (Hamilton, R.L. et al., Acta Neuropathol. (Berl.) (2004) 107: 515-522). Для выявления данных пациентов следует использовать визуализирующие агенты для определения амилоидных бляшек, данные пациенты потенциально излечимы с помощью соединений, которые снижают уровень А.IBM представляет собой редкое возрастное дегенеративное заболевание скелетных мышц. Появление депозитов А в мышцах пациентов, страдающих IBM, и рекапитуляция некоторых аспектов данного заболевания путем моделирования повышенной экспрессии АРР в мышцах трансгенных мышей поддерживает другие данные о роли А в развитии IBM (смотри обзор Murphy, M.P. et al., Neurology (2006) 66:S65-68). Соединения, которые снижают уровень А, могли бы замедлить или предотвратить развитиеIBM. Установлено, что при возрастной дегенерации желтого пятна А является одним из компонентов старческих бляшек, внеклеточных депозитов, расположенных под пигментным эпителием сетчатки(RPE) (Anderson, D.H. et al., Exp. Eye Res. (2004) 78: 243-256). Недавние исследования на мышах показали возможную связь А и дегенерации желтого пятна (Yoshida, Т. et al, J. Clin. Invest. (2005) 115: 27932800). Обнаружено, что у пациентов, страдающих БА, увеличено депонирование А и имеют место супрануклеарные катаракты (supranuclear cataracts) (Goldstein, L.E. et al, Lancet (2003) 361: 1258-1265). Соединения, которые снижают уровень А, могли бы замедлить или предотвратить развитие возрастной дегенерации желтого пятна. Соединения, которые ингибируют -секретазу, также могут быть использованы в лечении состояний, ассоциированных с потерей миелинизации, например рассеянного склероза (Watkins, T.A. et al, Neuron (2008) 60: 555-569). Недавние исследования, выполненные учеными Медицинского Центра при Джорджтаунском университете, дают возможность предположить, что ингибиторы -секретазы могут предотвращать продолжительные нарушения, вызванные травматическим повреждением головного мозга (Loane, D.J. et al, Nature Medicine (2009): 1-3). Логично предположить, что блокирование активности указанных секретаз приводит к снижению уровня А. Дополнительный подход состоит в избирательном уменьшении продукции А 1-42 путем воздействия определенными соединениями, которые направляют расщепление АРР -секретазой в сторону формирования альтернативных более коротких форм А, которые, по-видимому, обладают меньшей способностью агрегировать, и вследствие этого растворы коротких форм А являются менее нейротоксичными, чем растворы A1-42 (см. Barten, Donna M; Meredith, Jere Е., Jr.; Zaczek, Robert; Houston,John G.; Albright, Charles F. Drugs in RD (2006), 7(2), 87-97). Соответственно, соединения, которые избирательно уменьшают продукцию А 1-42, и фармацевтические композиции данных соединений являются лечебными агентами, которые предотвращают повреждение, вызываемое сверхпродукцией А, и могут быть использованы в лечении болезни Альцгеймера, болезни Дауна, САА и миозита с включенными тельцами, DLB и других расстройств, связанных со сверхпродукцией А. Сущность изобретения Согласно первому аспекту настоящего изобретения предложено соединение формулы (I) или его фармацевтически приемлемая соль, где А представляет собой пяти- или шестичленное гетероароматическое кольцо, содержащее от одного до трех гетероатомов, независимо выбранных из атома азота, кислорода и серы, и указанное гетероароматическое кольцо необязательно имеет в качестве заместителей одну или две группы, выбранные из атома галогена, галогенС 1-6 алкила, гидрокси, амино, С 1-6 алкокси и С 1-6 алкила; В выбран из фенила и пиридинила, где фенил и пиридинил необязательно имеют один или два заместителя, независимо выбранные из С 1-6 алкокси, С 1-6 алкила, С 1-3 алкиламино-С 1-6 алкокси, циано, С 13 диалкиламино-С 1-6 алкокси, атома галогена, галогенС 1-6 алкокси, галогенС 1-6 алкила, гидрокси, метиламино и амино; означает место присоединения к атому азота исходной молекулы; означает место присоединения к группировке 'Е';Ra выбран из атома водорода, С 1-6 алкила, С 2-6 алкенила и гидрокси;Rb представляет собой -NRxRy, где Rx и Ry независимо выбраны из атома водорода, С 1-4 алкокси, С 1-4 алкоксиС 1-4 алкила, С 1-4 алкоксикарбонила, С 1-6 алкила, С 3-7 циклоалкила, (С 3-7 циклоалкил)С 1-4 алкила, гидроксиС 1-4 алкила и тридейтерометила, где алкильная часть (С 3-7 циклоалкил)С 1-4 алкила может быть необязательно замещенной и иметь в качестве заместителей группу С 1-4 алкокси, или Rx и Ry вместе с атомом азота, к которому они присоединены, образуют четырех-семичленное моноциклическое или бициклическое кольцо, необязательно содержащее одну двойную связь и необязательно содержащее один дополнительный гетероатом, выбранный из О, NRZ и S, где Rz выбран из атома водорода, С 1-6 алкила и С 1-4 алкоксикарбонила, и где указанное кольцо необязательно имеет один или два заместителя, независимо выбранные из С 1-6 алкокси, С 1-6 алкила, атома галогена, галогенС 1-4 алкила, гидрокси, -NRfR9, оксо, спироциклического диоксоланила, где Rf и Rg независимо выбраны из атома водорода, С 1-4 алкоксикарбонила и С 1-6 алкила;Rc выбран из атома водорода, С 1-4 алкилсульфонила, С 1-4 алкилсульфониламидо, амино, С 1-6 алкиламино, С 1-6 диалкиламино, С 3-7 циклоалкиламино, гидрокси и С 1-4 алкокси;Rd выбран из атома водорода, C1-6 алкила, С 1-4 алкоксиС 1-4 алкилкарбонила, С 1-6 алкоксикарбонила,С 1-6 алкилкарбонила, С 1-6 алкилсульфонила, С 3-7 циклоалкилсульфонила, С 3-7 циклоалкилкарбонила, С 1-6 диалкиламиноС 1-4 алкилкарбонила и галогенС 1-4 алкила, где алкильная часть указанного алкоксикарбонила, алкилкарбонила и алкилсульфонила необязательно имеет один заместитель, выбранный из С 1-4 диалкиламино и С 1-4 алкокси; и Е выбран из C1-6 алкила, С 4-6 циклоалкила, (С 4-7 циклоалкил)С 1-4 алкила, бензила, фенила и пятишестичленного гетероароматического кольца, содержащего один или два атома азота, где фенил, фенильная часть бензила и гетероароматическое кольцо необязательно имеют один, два или три заместителя, независимо выбранные из C1-6 алкила, С 1-6 алкокси, циано, атома галогена, галогенС 1-6 алкокси и галогенС 1-6 алкина. Настоящее изобретение относится к указанным соединениям, другие важные цели изобретения описаны в данной заявке ниже. Подробное оисание изобретения Согласно первому варианту осуществления первого аспекта настоящего изобретения предложено соединение формулы (I), описанное выше, или его фармацевтически приемлемая соль, где А представляет собой пятичленное гетероароматическое кольцо, содержащее от одного до трех атомов азота, и указанное гетероароматическое кольцо необязательно имеет в качестве заместителя одну группу, выбранную из атома галогена и C1-6 алкила. Согласно второму варианту осуществления изобретения В выбран из фенила и пиридинила, где фенил и пиридинил необязательно имеют один или два заместителя, независимо выбранные из С 1-6 алкокси и атома галогена. Согласно третьему варианту осуществления изобретения Е представляет собой фенил, необязательно имеющий один, два или три заместителя, независимо выбранные из C1-6 алкила, С 1-6 алкокси, циано, атома галогена, галогенС 1-6 алкокси и галогенС 1-6 алкила. Согласно четвертому варианту осуществления изобретения D выбран из-3 020322 Согласно пятому варианту осуществления изобретения Rb представляет собой -NRxRy, где Rx и Ry независимо выбраны из атома водорода, С 1-4 алкоксиС 1-4 алкила, C1-6 алкила, С 3-7 циклоалкила, гидроксиС 1-4 алкила и тридейтерометила, где алкильная часть (С 3-7 циклоалкил)С 1-4 алкила может быть необязательно замещенной и иметь в качестве заместителей группу С 1-4 алкокси. Согласно шестому варианту осуществления первого аспекта настоящего изобретения предложено соединение формулы (I), или его фармацевтически приемлемая соль, где А представляет собой пятичленное гетероароматическое кольцо, содержащее от одного до трех атомов азота, и указанное гетероароматическое кольцо необязательно имеет в качестве заместителя одну группу, выбранную из атома галогена и С 1-6 алкила; В выбран из фенила и пиридинила, где фенил и пиридинил необязательно имеют один или два заместителя, независимо выбранные из С 1-6 алкокси и атома галогена; Е представляет собой фенил, необязательно имеющий один, два или три заместителя, независимо выбранные из С 1-6 алкила, С 1-6 алкокси, циано, атома галогена, галогенС 1-6 алкокси и галогенС 1-6 алкила; и Rb представляет собой -NRxRy, где Rx и Ry вместе с атомом азота, к которому они присоединены,образуют четырех-семичленное моноциклическое или бициклическое кольцо, необязательно содержащее один дополнительный гетероатом, выбранный из О и NRz, где Rz выбран из С 1-6 алкила и С 1-4 алкоксикарбонила, и где указанное кольцо необязательно имеет один или два заместителя, независимо выбранные из С 1-6 алкокси, C1-6 алкила, атома галогена, галогенС 1-4 алкила, гидрокси, -NRfRg, оксо и спироциклического диоксоланила, где Rf и Rg независимо выбраны из атома водорода, С 1-4 алкоксикарбонила и С 1-6 алкила. Согласно седьмому варианту осуществления первого аспекта настоящего изобретения предложено соединение формулы (I), или его фармацевтически приемлемая соль, где А представляет собой пятичленное гетероароматическое кольцо, содержащее от одного до трех атомов азота, и указанное гетероароматическое кольцо необязательно имеет в качестве заместителя одну группу, выбранную из атома галогена и С 1-6 алкила; В выбран из фенила и пиридинила, где фенил и пиридинил необязательно имеют один или два заместителя, независимо выбранные из С 1-6 алкокси и атома галогена; Е представляет собой фенил, необязательно имеющий один, два или три заместителя, независимо выбранные из C1-6 алкила, С 1-6 алкокси, циано, атома галогена, галогенС 1-6 алкокси и галогенС 1-6 алкила; и Согласно восьмому варианту осуществления первого аспекта настоящего изобретения предложено соединение формулы (I), или его фармацевтически приемлемая соль, где А представляет собой пятичленное гетероароматическое кольцо, содержащее от одного до трех атомов азота, и указанное гетероароматическое кольцо необязательно имеет в качестве заместителя одну группу, выбранную из атома галогена и C1-6 алкила; В выбран из фенила и пиридинила, где фенил и пиридинил необязательно имеют один или два заместителя, независимо выбранные из С 1-6 алкокси и атома галогена; Е представляет собой фенил, необязательно имеющий один, два или три заместителя, независимо выбранные из С 1-4 алкила, С 1-6 алкокси, циано, атома галогена, галогенС 1-6 алкокси и галогенС 1-4 алкила; и Rb представляет собой- NRxRy, где Rx и Ry независимо выбраны из атома водорода, С 1-4 алкокси С 1-4 алкила, С 1-6 алкила, С 3-7 циклоалкила, гидроксиС 1-4 алкила и тридейтерометила, где алкильная часть(С 3-7 циклоалкил)С 1-4 алкила может быть необязательно замещенной и иметь в качестве заместителей группу С 1-6 алкокси. Согласно девятому варианту осуществления первого аспекта настоящего изобретения предложено соединение формулы (I), или его фармацевтически приемлемая соль, где А представляет собой пятичленное гетероароматическое кольцо, содержащее от одного до трех атомов азота, и указанное гетероароматическое кольцо необязательно имеет в качестве заместителя одну группу, выбранную из атома галогена и С 1-6 алкила; В выбран из фенила и пиридинила, где фенил и пиридинил необязательно имеют один или два за-4 020322 местителя, независимо выбранные из С 1-6 алкокси и атома галогена; Е представляет собой фенил, необязательно имеющий один, два или три заместителя, независимо выбранные из С 1-6 алкила, С 1-6 алкокси, циано, атома галогена, галогенС 1-6 алкокси и галогенС 1-6 алкила;Rb представляет собой -NRxRy, где Rx и Ry вместе с атомом азота, к которому они присоединены,образуют четырех-семичленное моноциклическое или бициклическое кольцо, необязательно содержащее один дополнительный гетероатом, выбранный из О и NRz, где Rz выбран из С 1-6 алкила и С 1-4 алкоксикарбонила, и где указанное кольцо необязательно имеет один или два заместителя, независимо выбранные из С 1-6 алкокси, С 1-6 алкила, атома галогена, галогенС 1-4 алкила, гидрокси, -NRfRg, оксо и спироциклического диоксоланила, где Rf и Rg независимо выбраны из атома водорода, С 1-4 алкоксикарбонила и С 1-6 алкила. Согласно десятому варианту осуществления первого аспекта настоящего изобретения предложено соединение формулы (I), или его фармацевтически приемлемая соль, где А представляет собой пятичленное гетероароматическое кольцо, содержащее от одного до трех атомов азота, и указанное гетероароматическое кольцо необязательно имеет в качестве заместителя одну группу, выбранную из атома галогена и С 1-6 алкила; В выбран из фенила и пиридинила, где фенил и пиридинил необязательно имеют один или два заместителя, независимо выбранные из С 1-6 алкокси и атома галогена; Е представляет собой фенил, необязательно имеющий один, два или три заместителя, независимо выбранные из С 1-6 алкила, С 1-6 алкокси, циано, атома галогена, галогенС 1-6 алкокси и галогенС 1-6 алкила; и Согласно одиннадцатому варианту осуществления первого аспекта настоящего изобретения предложено соединение формулы (I), или его фармацевтически приемлемая соль, где А представляет собой пятичленное гетероароматическое кольцо, содержащее от одного до трех атомов азота, и указанное гетероароматическое кольцо необязательно имеет в качестве заместителя одну группу, выбранную из атома галогена и С 1-6 алкила; В выбран из фенила и пиридинила, где фенил и пиридинил необязательно имеют один или два заместителя, независимо выбранные из С 1-6 алкокси и атома галогена; Е представляет собой фенил, необязательно имеющий один, два или три заместителя, независимо выбранные из С 1-6 алкила, С 1-6 алкокси, циано, атома галогена, галогенС 1-6 алкокси и галогенС 1-6 алкила;Rb представляет собой -NRxRy, где Rx и Ry независимо выбраны из атома водорода, С 1-4 алкоксиС 1-4 алкила, С 1-6 алкила, С 3-7 циклоалкила, гидроксиС 1-4 алкила и тридейтерометила, где алкильная часть (С 3-7 циклоалкил)С 1-4 алкила может быть необязательно замещенной и иметь в качестве заместителей группу С 1-4 алкокси. Согласно двенадцатому варианту осуществления первого аспекта настоящего изобретения предложено соединение формулы (I), или его фармацевтически приемлемая соль, где А представляет собой пятичленное гетероароматическое кольцо, содержащее от одного до трех атомов азота, и указанное гетероароматическое кольцо необязательно имеет в качестве заместителя одну группу, выбранную из атома галогена и С 1-6 алкила; В выбран из фенила и пиридинила, где фенил и пиридинил необязательно имеют один или два за-5 020322 местителя, независимо выбранные из С 1-6 алкокси и атома галогена; Е представляет собой фенил, необязательно имеющий один, два или три заместителя, независимо выбранные из С 1-6 алкила, С 1-6 алкокси, циано, атома галогена, галогенС 1-6 алкокси и галогенС 1-6 алкила;Rb представляет собой -NRxRy, где Rx и Ry, вместе с атомом азота, к которому они присоединены,образуют четырех-семичленное моноциклическое или бициклическое кольцо, необязательно содержащее один дополнительный гетероатом, выбранный из О и NRz, где Rz выбран из С 1-6 алкила и С 1-4 алкоксикарбонила, и где указанное кольцо необязательно имеет один или два заместителя, независимо выбранные из С 1-6 алкокси, C1-6 алкила, атома галогена, галогенС 1-4 алкила, гидрокси, -NRfRg, оксо и спироциклического диоксоланила, где Rf и Rg независимо выбраны из атома водорода, С 1-4 алкоксикарбонила и С 1-6 алкила. Согласно тринадцатому варианту осуществления первого аспекта изобретения определение А расширено и дополнительно включает ацил, ацетил, нитрил, CF3, бром и CH2CN и гетероароматическое кольцо дополнительно может иметь в качестве заместителей CHCF2 и/или CN. Согласно четырнадцатому варианту осуществления первого аспекта изобретения В также может включать пиримидинил. Согласно пятнадцатому варианту осуществления первого аспекта изобретения Rb как часть D также может включать SO2C1-6 алкил, ацетил и фенил, необязательно имеющий в качестве заместителей 1-3 С 1-6 алкина; и, кроме того, кольцо как часть Rz также может включать спироциклический тетрагидрофуранил. Кроме того, D также может включать где Rh, Ri =Н, ОН или Rh и Ri вместе образуют С=О, C=N-OH или С=N-ОС 1-6 алкил. Согласно второму аспекту в настоящем изобретении предложена фармацевтическая композиция для лечения расстройств, чувствительных к уменьшению продукции -амилоидного пептида, содержащая терапевтически эффективное количество соединения формулы (I), или его фармацевтически приемлемой соли, в сочетании с фармацевтически приемлемым носителем или разбавителем. Согласно третьему аспекту в настоящем изобретении предложен способ лечения расстройств, чувствительных к уменьшению продукции -амилоидного пептида, у млекопитающего, нуждающегося в таком лечении, который включает введение указанному млекопитающему терапевтически эффективного количества соединения Формулы (I) или его фармацевтически приемлемой соли. Согласно первому варианту осуществления первого аспекта изобретения указанное расстройство выбрано из болезни Альцгеймера (БА), болезни Дауна, легкого когнитивного нарушения (ЛКН), церебральной амилоидной ангиопатии (ЦАА), деменции с тельцами Леви (ДТЛ), бокового амиотрофического склероза (ALS-D), миозита с включенными тельцами (IBM), возрастной дегенерации желтого пятна и рака. Согласно второму варианту осуществления третьего аспекта изобретения указанное расстройство выбрано из болезни Альцгеймера и болезни Дауна. Согласно третьему варианту осуществления третьего аспекта изобретения указанное расстройство представляет собой болезнь Альцгеймера. Другие аспекты настоящего изобретения могут включать подходящие комбинации вариантов осуществления изобретения, раскрытых в данном описании. Другие аспекты и варианты осуществления изобретения могут быть найдены в данном описании. Описание настоящего изобретения должно быть истолковано в соответствии с законами и принципами образования химических связей. В некоторых случаях для того, чтобы поместить заместитель в определенное положение, необходимо удалить атом водорода. Необходимо понимать, что соединения, включенные в объем настоящего изобретения, соответствуют требованиям, предъявляемым к стабильности соединений, которые используются в качестве фармацевтических агентов. Подразумевается, что определение любого заместителя или переменной в конкретном положении молекулы не зависит от определений данного заместителя или переменной, когда они расположены в других местах этой же молекулы.-6 020322 Все патенты, заявки на патенты и ссылка на литературу, упомянутые в описании изобретения,включены в данное описание посредством ссылки во всей своей полноте. В случае расхождения с указанными источниками, настоящее описание, включая определения, будет иметь преимущественную силу. В некоторых случаях количество атомов углерода в конкретной группе указано перед названием группы. Например, термин "галогенС 1-6 алкокси" означает галогеналкоксигруппу, содержащую от одного до шести атомов углерода, а термин "С 1-4 алкоксиС 1-2 алкил" означает алкоксигруппу, содержащую от одного до четырех алкоксигрупп, соединенных с основной молекулярной группировкой через алкильную группу, содержащую один или два атома углерода. Во всех случаях, когда использованы такие названия,они заменяют собой все другие определения, содержащиеся в данном описании. В контексте данного описания формы единственного числа существительных включают формы множественного числа, если из контекста ясно не следует иное. Термин "алкокси" в контексте данного описания относится к алкильной группе, соединенной с основной молекулярной группировкой через атом кислорода. Термин "алкоксиалкил" в контексте данного описания относится к алкильной группе, имеющей в качестве заместителей одну, две или три алкоксигруппы. Термин "алкоксиалкилкарбонил" в контексте данного описания относится к алкоксиалкильной группе, соединенной с основной молекулярной группировкой через карбонильную группу. Термин "алкоксикарбонил" в контексте данного описания относится к алкоксигруппе, соединенной с основной молекулярной группировкой через карбонильную группу. Термин "алкил" в контексте данного описания относится к группе, происходящей от нормальной или разветвленной насыщенной углеводородной цепи, содержащей от одного до десяти атомов углерода. Термин "алкиламино" в контексте данного описания относится к -NHRx, где Rx представляет собой алкильную группу. Термин "алкиламиноалкокси" в контексте данного описания относится к алкиламиногруппе, соединенной с основной молекулярной группировкой через алкоксигруппу. Термин "алкилкарбонил" в контексте данного описания относится к алкильной группе, соединенной с основной молекулярной группировкой через карбонильную группу. Термин "алкилсульфонил" в контексте данного описания относится к алкильной группе, соединенной с основной молекулярной группировкой через сульфонильную группу. Термин "алкилсульфониламидо" в контексте данного описания относится к -C(O)NHS(O)2Rx, где Rx представляет собой алкильную группу. Термин "амино" в контексте данного описания относится к -NH2. Термин "карбонил" в контексте данного описания относится к -С(О)-. Термин "циано" в контексте данного описания относится к -CN. Термин "циклоалкил" в контексте данного описания относится к насыщенной моноциклической углеводородной кольцевой системе, содержащей от трех до четырнадцати атомов углерода и не содержащей гетероатомов. Термин "(циклоалкил)алкил" в контексте данного описания относится к алкильной группе, имеющей в качестве заместителей одну, две или три циклоалкильных группы. Термин "циклоалкиламино" в контексте данного описания относится к -NHRx, где Rx представляет собой циклоалкильную группу. Термин "циклоалкилкарбонил" в контексте данного описания относится к циклоалкильной группе,соединенной с основной молекулярной группировкой через карбонильную группу. Термин "циклоалкилсульфонил" в контексте данного описания относится к циклоалкильной группе,соединенной с основной молекулярной группировкой через сульфонильную группу. Термин "диалкиламино" в контексте данного описания относится к -NRxRy, где каждый из Rx и Ry представляет собой алкильную группу. Термин "диалкиламиноалкокси" в контексте данного описания относится к диалкиламиногруппе,соединенной с основной молекулярной группировкой через алкоксигруппу. Термин "диалкиламиноалкил" в контексте данного описания относится к алкильной группе, имеющей в качестве заместителей одну, две или три диалкиламиногруппы. Термин "диалкиламиноалкилкарбонил" в контексте данного описания относится к диалкиламиноалкильной группе, соединенной с основной молекулярной группировкой через карбонильную группу. Термины "галоген" и "атом галогена" в контексте данного описания относятся к F, Cl, Br и I. Термин "галогеналкокси" в контексте данного описания относится к галогеналкильной группе, соединенной с основной молекулярной группировкой через атом кислорода. Термин "галогеналкил" в контексте данного описания относится к алкильной группе, имеющей в качестве заместителей один, два, три или четыре атома галогена. Термин "гидрокси" в контексте данного описания относится к -ОН. Термин "гидроксиалкил" в контексте данного описания относится к алкильной группе, имеющей в качестве заместителей одну, две или три гидроксигруппы.-7 020322 Термин "метиламино" в контексте данного описания относится к -NHCH3. Термин "оксо" в контексте данного описания относится к =O. Термин "сульфонил" в контексте данного описания относится к -SO2-. Следует понимать, что изобретение включает все стереохимические формы, или их смеси, которые способны уменьшать продукцию -амилоидного пептида. Некоторые соединения согласно настоящему изобретению могут существовать в различных стабильных конформационных формах, которые могут быть разделены. Торсионная асимметрия, обусловленная ограниченным вращением вокруг асимметричной простой связи, например, вследствие стерического препятствия или напряжения кольца, может быть использована для разделения разных конформеров. Настоящее изобретение включает каждый конформационный изомер указанных соединений и их смеси. Подразумевается, что настоящее изобретение включает все изотопы атомов, которые присутствуют в соединениях согласно настоящему изобретению. Изотопы представляют собой атомы, имеющие одно и то же атомное число, но разные массовые числа. В качестве неограничивающего примера часто встречающихся изотопов можно привести изотопы водорода, включающие дейтерий и тритий. Изотопы углерода включают 13 С и 14 С. Соединения согласно изобретению, меченные изотопами, обычно могут быть получены с помощью стандартных методик, известных специалистам в данной области техники, или с помощью методик, аналогичных методикам, приведенным в данном описании, с использованием подходящих реагентов, меченных изотопами, вместо немеченых реагентов, используемых в других случаях. Такие соединения могут иметь целый ряд возможных применений, например, могут быть использованы в качестве стандартов и реагентов при определении биологической активности. Стабильные изотопы обладают потенциальной способностью благоприятно модифицировать биологические, фармакологические или фармакокинетические свойства содержащих их соединений. Некоторые соединения согласно настоящему изобретению могут существовать в цвиттер-ионной форме, и настоящее изобретение включает каждую цвиттер-ионную форму указанных соединений и их смеси. Соединения согласно настоящему изобретению могут существовать в виде фармацевтически приемлемых солей. Термин "фармацевтически приемлемая соль" в контексте данного описания означает соли или цвиттер-ионные формы соединений согласно настоящему изобретению, которые являются растворимыми или диспергируемыми в воде или масле, являются, по результатам медицинской оценки,пригодными для использования в контакте с тканями пациентов, не обладают чрезмерной токсичностью,не вызывают чрезмерного раздражения, аллергической реакции или других проблем или осложнений,соизмеримых с разумным соотношением пользы и риска, и являются эффективными, если используются по назначению. Данные соли могут быть получены в результате взаимодействия подходящего атома азота с подходящей кислотой на заключительных стадиях выделения и очистки соединения или отдельно,после синтеза соединения. Типичные соли присоединения кислот включают ацетат, адипат, альгинат,цитрат, аспартат, бензоат, бензолсульфонат, бисульфат, бутират, камфорат, камфорсульфонат; диглюконат, глицерофосфат, полусульфат, гептаноат, гексаноат, формиат, фумарат, гидрохлорид, гидробромид,гидроиодид, 2-гидроксиэтансульфонат, лактат, малеат, мезитиленсульфонат, метансульфонат, нафтиленсульфонат, никотинат, 2-нафталинсульфонат, оксалат, пальмоат, пектинат, персульфат, 3 фенилпроприонат, пикрат, пивалат, пропионат, сукцинат, тартрат, трихлорацетат, трифторацетат, фосфат, глутамат, бикарбонат, пара-толуолсульфонат и ундеканоат. Примеры кислот, которые могут быть использованы для получения фармацевтически приемлемых солей присоединения, включают неорганические кислоты, такие как соляная, бромисто-водородная, серная и фосфорная, и органические кислоты,такие как щавелевая, малеиновая, янтарная и лимонная. Соли присоединения оснований могут быть получены на заключительных стадиях выделения и очистки соединений в результате взаимодействия карбоксильной группы с подходящим основанием,таким как гидроксид, карбонат или бикарбонат катиона металла, или с аммиаком или органическим первичным, вторичным или третичным амином. Катионы фармацевтически приемлемых солей включают катионы лития, натрия, калия, кальция, магния и алюминия, а также катионы нетоксичных четвертичных аминов, такие как аммоний, тетраметиламмоний, тетраэтиламмоний, метиламин, диметиламин, триметиламин, триэтиламин, диэтиламин, этиламин, трибутиламин, пиридин, N,N-диметиланилин, N-метилпиперидин, N-метилморфолин, дициклогексиламин, прокаин, дибензиламин, N,N-дибензилфенетиламин иN,N'-дибензилэтилендиамин. Другие типичные органические амины, которые могут быть использованы для получения солей присоединения оснований, включают этилендиамин, этаноламин, диэтаноламин,пиперидин и пиперазин. Если в терапевтических целях терапевтически эффективное количество соединения формулы (I), а также его фармацевтически приемлемых солей, может быть введено в виде необработанного химического соединения, активный ингредиент может быть представлен в виде фармацевтической композиции. Соответственно, в изобретении дополнительно предложены фармацевтические композиции, которые включают терапевтически эффективное количество соединений формулы (I), или их фармацевтически приемлемых солей, и один или более чем один фармацевтически приемлемый носитель, разбавитель или-8 020322 эксципиент. Соединения формулы (I) и их фармацевтически приемлемые соли являются такими, как описано выше. Носитель(и), разбавитель(и) или эксципиент(ы) должен (должны) быть приемлемым(и) в смысле его (их) совместимости с другими ингредиентами препарата и не наносить вреда реципиенту. В соответствии с другим аспектом изобретения также предложен способ получения фармацевтического препарата, включающий смешивание соединения формулы (I), или его фармацевтически приемлемой соли, с одним или более чем одним фармацевтически приемлемым носителем, разбавителем или эксципиентом. Доза соединений формулы I, необходимая для достижения терапевтического эффекта, зависит не только от таких факторов, как возраст, масса тела и пол пациента, способа введения, но также от желаемой степени уменьшения продукции -AP и эффективности конкретного используемого соединение в отношении конкретного нарушения, вызываемого данным заболеванием. Следует принимать во внимание, что лечебная доза конкретного соединения может быть введена в виде стандартной лекарственной формы и что данная стандартная лекарственная форма, подобранная специалистом, отражает относительный уровень активности соединения. Решение о назначении конкретной дозы и частоты введения(сколько раз в сутки следует проводить введение) принимается по усмотрению врача. С целью получения желаемого терапевтического эффекта дозы могут быть подобраны в соответствии с конкретными обстоятельствами, указанными в настоящем изобретении. Для млекопитающего, включая человека, имеющего или возможно имеющего любое заболевание,связанное с продукцией -AP, подходящая доза соединения формулы I или фармацевтической композиции, содержащей указанное соединение, как правило, суточная доза, находится в диапазоне от приблизительно 0,05 мг/кг до приблизительно 10 мг/кг, предпочтительно от приблизительно 0,1 до 2 мг/кг, при парентеральном введении. При пероральном введении данная доза может находиться в диапазоне от приблизительно 0,1 до приблизительно 75 мг/кг, предпочтительно от 0,1 до 10 мг/кг массы тела. Предпочтительно, когда активный ингредиент вводят равными дозами от одного до четырех раз в сутки. Однако обычно сначала вводят маленькую дозу, и затем дозу постепенно увеличивают до тех пор, пока не будет определена доза, оптимальная для конкретного реципиента, находящегося на лечении. В соответствии с правилами клинической практики указанное соединение предпочтительно вводить до получения в организме концентрационного уровня, который обеспечивает эффективное противоамилоидное действие и не вызывает никаких вредных или нежелательных побочных эффектов. Однако следует понимать,что количество соединения, которое вводят в действительности, определяет врач с учетом всех существенных обстоятельств, включающих состояние, которое лечат, выбранное соединение, которое планируют вводить, выбранный путь введения, возраст, массу тела, реакцию конкретного пациента и тяжесть симптомов пациента. Фармацевтические препараты могут быть адаптированы для введения любым подходящим путем,например пероральным (включая трансбуккальный или сублингвальный), ректальным, назальным, местным (включая трансбуккальный, сублингвальный или трансдермальный), вагинальным или парентеральным (включая подкожные, внутрикожные, внутримышечные, внутрисуставные, интрасиновиальные, интрастернальные, интратекальные, внутривенные или интрадермальные инъекции или инфузии, а также инъекции или инфузии внутрь пораженных тканей) путем. Такие препараты могут быть получены с помощью методик, известных в области фармации, например путем объединения активного ингредиента с носителем (носителями) или эксципиентом (эксципиентами). Фармацевтические препараты, адаптированные для перорального введения, могут быть представлены в виде дискретных единиц, например, капсул или таблеток, порошков или гранул, растворов или суспензий в водных или неводных жидкостях, пен или кремов для приема внутрь или жидких эмульсий типа масло в воде или эмульсий типа вода в масле. Например, в препарате, адаптированном для перорального введения, в форме таблетки или капсулы активный лекарственный компонент может быть комбинирован с подходящим для перорального введения нетоксичным фармацевтически приемлемым инертным носителем, таким как этанол, глицерин, вода и тому подобное. Порошки изготавливают путем измельчения соединения с получением подходящего тонкого помола и смешивания с измельченным подобным образом фармацевтическим носителем, таким как пригодный для приема внутрь углевод, например крахмал или маннит. Препарат также может содержать ароматизаторы, консерванты, диспергирующие и окрашивающие агенты. Капсулы изготавливают из описанной выше порошковой смеси, которой заполняют желатиновую оболочку. Перед заполнением капсульной оболочки в порошковую смесь могут быть добавлены скользящие и смазывающие вещества, такие как коллоидный кремнезем, тальк, стеарат магния, стеарат кальция или твердый полиэтиленгликоль. Когда капсулы предназначены для приема внутрь, для улучшения доступности лекарства также могут быть добавлены разрыхлители или солюбилизирующие агенты, такие как агар-агар, карбонат кальция или карбонат натрия. Кроме того, если это желательно или необходимо, в смесь также могут быть включены подходящие связующие вещества, смазывающие вещества, разрыхлители и окрашивающие агенты. Подходящие связующие вещества включают крахмал, желатин, природные сахара, такие как глюкоза или бета-лактоза,-9 020322 кукурузные подсластители, природные и синтетические камеди, такие как гуммиарабик, трагакант или альгинат натрия, карбоксиметилцеллюлозу, полиэтиленгликоль и тому подобное. Смазывающие вещества, используемые в данных лекарственных формах, включают олеат натрия, хлорид натрия и тому подобное. Разрыхлители включают, без ограничения, крахмал, метилцеллюлозу, агар, бетонит (betonite),ксантановую камедь и тому подобное. Таблетки изготавливают в виде препарата, например, путем получения порошковой смеси, гранулирования или комкования, добавления смазывающего вещества и разрыхлителя и прессования в форме таблетки. Порошковую смесь получают путем смешивания соединения, измельченного подходящим образом, с разбавителем или основой, описанными выше, и, необязательно, со связующим веществом, таким как карбоксиметилцеллюлоза, алигинат, желирующее вещество или поливинилпирролидон, замедлителем растворения, таким как парафин, ускорителем ресорбции, таким как четвертичная соль, и/или поглощающим агентом, таким как бетонит, каолин или гидрофосфат кальция. Порошковая смесь может быть гранулирована путем увлажнения связующим веществом, таким как сироп, крахмальная паста, раствор гуммиарабика или растворы целлюлозных или полимерных веществ, и последующего продавливания через сито. Как альтернатива гранулированию, порошковая смесь может быть пропущена через таблеточную машину, которая дробит разнородные куски смеси, превращая их в гранулы. Для предотвращения прилипания гранул к формообразующему штампу при производстве таблеток, гранулы могут быть покрыты смазывающим веществом путем добавления стеариновой кислоты, соли стеариновой кислоты, талька или минерального масла. После добавления смазывающего вещества из смеси прессуют таблетки. Соединения согласно настоящему изобретению также могут быть комбинированы с подвижным инертным носителем, затем из полученной смеси сразу прессуют таблетки, минуя стадии гранулирования или комкования. На таблетки могут быть нанесены прозрачные или матовые защитные покрытия, состоящие из изолирующего покрытия шеллаком, покрытия сахаром или полимерным веществом и полирующего покрытие воском. Чтобы отличать разные стандартные дозы, в эти покрытия могут быть добавлены красящие вещества. Жидкие препараты, подходящие для перорального введения, такие как растворы, сиропы и эликсиры, могут быть изготовлены в стандартной лекарственной форме, чтобы принимаемое количество жидкости содержало заданное количество соединения. Сиропы могут быть получены путем растворения соединения в подходящих ароматизированных водных растворах, а эликсиры получают с использованием нетоксичного носителя. Также могут быть добавлены солюбилизаторы и эмульгаторы, такие как этоксилированные изостеариловые спирты и полиоксиэтиленовые эфиры сорбита, консерванты, вкусовые добавки, такие как мятное масло или натуральные подсластители, или сахарин или другие искусственные подсластители, и тому подобное. При необходимости препараты в стандартных лекарственных формах, предназначенные для перорального введения, могут быть получены путем микрокапсулирования. Данные препараты также могут быть изготовлены в форме препаратов пролонгированного или замедленного высвобождения, например,путем покрытия или внедрения частиц вещества в полимеры, воск и тому подобное. Соединения формулы (I) и их фармацевтически приемлемые соли также могут быть введены в форме липосомальных систем доставки, таких как малые моноламеллярные везикулы, большие моноламеллярные везикулы и многослойные везикулы. Липосомы могут быть получены из различных фосфолипидов, таких как холестерин, стеариламин или фосфатидилхолин. Соединения формулы (I) и их фармацевтически приемлемые соли также могут быть доставлены с помощью моноклональных антител в качестве индивидуальных носителей, к которым присоединены молекулы соединения. Соединения также могут быть присоединены к растворимым полимерам в качестве носителей для направленной доставки лекарства. Такие полимеры могут включать поливинилпирролидон, сополимер пирана, полигидроксипропилметакриламидфенол, полигидроксиэтиласпартамидфенол или полиэтиленоксидполилизин, содержащий в качестве заместителей пальмитоильные остатки. Кроме того, соединения могут быть присоединены к биодеградируемым полимерам, которые можно использовать для достижения контролируемого высвобождения лекарства, например, к полимолочной кислоте,поли-эпсилон-капролактону, полигидроксимасляной кислоте, полиортоэфирам, полиацеталям, полидигидропиранам, полицианоакрилатам и поперечно-сшитым или амфипатичным блоксополимерам гидрогелей. Фармацевтические препараты, адаптированные для трансдермального введения, могут быть изготовлены в форме отдельных пластин пластыря, которые остаются в непосредственном контакте с эпидермисом реципиента в течение продолжительного периода времени. В этом случае активный ингредиент может быть доставлен из пластыря, например, путем ионтофореза, описание которого можно найти вPharmaceutical Research, 3(6), 318 (1986). Фармацевтические препараты, адаптированные для местного введения, могут быть изготовлены в форме мазей, кремов, суспензий, лосьонов, порошков, растворов, паст, гелей, спреев, аэрозолей или масел. Для лечения глаз или других внешних тканей, например тканей ротовой полости и кожи, предпочтительно использовать препараты в форме мази или крема для местного введения. При изготовлении препарата в форме мази активный ингредиент может быть смешан либо с парафиновой мазевой основой,- 10020322 либо мазевой основой, смешивающейся с водой. Альтернативно активный ингредиент может быть представлен в виде препарата в форме крема, где в качестве кремовой основы используется эмульсии масло в воде или вода в масле. Фармацевтические препараты, адаптированные для местного введения в глаза, включают глазные капли, где активный ингредиент растворен или суспендирован в подходящем носителе, главным образом в водном растворителе. Фармацевтические препараты, адаптированные для местного введения в ротовую полость, включают лепешки, пастилки и жидкости для промывания рта. Фармацевтические препараты, адаптированные для ректального введения, могут быть изготовлены в форме суппозиториев или клизмы. Фармацевтические препараты, адаптированные для назального введения, где в качестве носителя используется твердое вещество, включают крупный порошок, который можно втягивать носом, как нюхательный табак, то есть путем быстрой ингаляции через носовой ход из контейнера с порошком, который держат близко к носу. Подходящие препараты в форме назального спрея или назальных капель, где в качестве носителя используется жидкость, включают водные или масленые растворы активного ингредиента. Фармацевтические препараты, адаптированные для введения путем ингаляции, включают мелкие частицы пыли или тумана, которые могут быть сформированы с помощью различных типов аэрозольных дозирующих устройств, небулайзеров или инсуффляторов. Фармацевтические препараты, адаптированные для вагинального введения, могут быть изготовлены в форме пессариев, тампонов, кремов, гелей, паст, пен или спреев. Фармацевтические препараты, адаптированные для парентерального введения, включают водные и неводные стерильные растворы для инъекций, которые могут содержать антиоксиданты, буферные агенты, бактериостатические вещества и соли, которые делают препарат изотоничным крови реципиента, для которого он предназначен, а также водные и неводные стерильные суспензии, которые могут содержать суспендирующие агенты и загустители. Данные препараты могут находиться в упаковках для одноразового приема или в упаковках для многократного приема, например в запаянных ампулах и пробирках, а также могут храниться в лиофилизированном состоянии (после сублимационной сушки); в лиофилизированные препараты непосредственно перед использованием требуется добавить только стерильный жидкий носитель, например воду для инъекций. Экстемпоральные инъекционные растворы и суспензии могут быть приготовлены из стерильных порошков, гранул и таблеток. Следует понимать, что кроме конкретных ингредиентов, описанных выше, препараты могут содержать другие агенты, используемые в данной области техники, имеющие отношение к данному препарату,например, препараты, подходящие для перорального введения, могут содержать корригенты. Далее настоящее изобретение будет описано со ссылкой на некоторые варианты осуществления изобретения, не ограничивающие его объем. Напротив, настоящее изобретение включает все альтернативы, модификации и эквиваленты, как если бы они были включены в объем прилагаемой формулы изобретения. Соответственно, каждый из приведенных примеров, которые включают конкретные варианты осуществления изобретения, иллюстрирует только одно практическое использование изобретения, при этом следует понимать, что данные примеры иллюстрируют только некоторые варианты осуществления изобретения и приведены для того, чтобы показать, что именно является наиболее полезным, и облегчить понимание описанных методик и концептуальных аспектов изобретения. Соединения согласно настоящему изобретению могут быть синтезированы с использованием методик, описанных ниже, в сочетании с методиками синтеза, известными в химии органического синтеза,или их вариаций, понятных специалистам в данной области техники. Предпочтительные методики включают методики, описанные ниже, но не ограничены ими. Все ссылки на литературу, упомянутые в описании изобретения, включены в данное описание посредством ссылки во всей своей полноте. Соединения согласно настоящему изобретению могут быть получены с использованием реакций и методик, описанных в данном разделе. Указанные реакции проводят в растворителях, подходящих для используемых реагентов и веществ, а также подходящих для осуществления желаемых превращений. Также необходимо понимать, что в описаниях методик синтеза, приведенных ниже, все выбранные условия реакций, включая выбор растворителя, реакционной атмосферы, температуры реакционной смеси,продолжительности реакции, и методики очистки соответствуют стандартным условиям проведения данной реакции, которые может легко определить специалист в данной области техники. Специалисту в области органического синтеза понятно, что функциональные группы, находящиеся в различных положениях молекулы, должны быть совместимы с предполагаемыми реагентами и реакциями. Ограничения,которые накладываются на заместители, которые совместимы с условиями реакции, совершенно очевидны специалисту в данной области техники, при наличии таких ограничений должны быть использованы альтернативные методики. Исходные вещества, которые могут быть использованы для синтеза соединений согласно настоящему изобретению, известны специалистам в данной области техники. Данные вещества либо имеются в продаже, либо могут быть легко синтезированы.- 11020322 Описанные ниже методики являются исключительно иллюстративными и не ограничивают объем формулы изобретения каким-либо образом. Следует понимать, что в некоторых случаях необходимо получить соединение, в котором функциональная группа защищена с использованием стандартных защитных групп. Такие защитные группы затем удаляют с получением соединения согласно настоящему изобретению. Детали, касающиеся использования защитных групп применительно к настоящему изобретению, известны специалистам в данной области техники. Аббревиатуры, использованные в настоящей заявке, включая, в частности, аббревиатуры, использованные в иллюстративных схемах и примерах, приведенных ниже, хорошо известны специалистам в данной области техники. Некоторые из использованных аббревиатур перечислены ниже. Химические аббревиатуры, использованные в описании изобретения и примерах, определены следующим образом: "dba" означает дибензилиденацетон; "трет-Bu" означает трет-бутил "ДХМ" означает дихлорметан; "LDA" означает диизопропиламид лития; "Ph" означает фенил; "ТФУ" означает трифторуксусную кислоту; "Et" означает этил; "ДМФА" означает N,N-диметилформамид; "ОАс" означает ацетат; "ч" означает часы, "мин" означает минуты, и "ТГФ" означает тетрагидрофуран. Примеры методик, которые могут быть использованы для получения соединений согласно настоящему изобретению, приведены на схемах 1-24. На схемах 1-3 приведены различные пути синтеза замещенных анилиновых фрагментов, использованных при получении указанных соединений. Как показано на схеме 1, ряд замещенных гетероциклов 1, включая (без ограничения) 1H-имидазол, 4-метил-1Hимидазол, 4-хлор-1H-имидазол, 4-(дифторметил)-1H-имидазол, может быть присоединен к замещенным хлор- или фторнитроаренам 2, включая (без ограничения) 2-хлор-4-нитроанизол, в присутствии основания с получением гетероарилзамещенных нитроаренов 3. Восстановление соединений 3 с использованием реагентов, включая железо в кислой среде, или каталитической гидрогенизации в присутствии таких катализаторов, как палладий на углероде, или других катализаторов, известных специалисту в данной области техники, приводит к получению замещенных анилинов 4. Несмотря на то, что схема 1 иллюстрирует получение 4-(1H-имидазол-1-ил)анилинов 4, специалисту в данной области техники понятно, что данная методика может быть широко использована для синтеза других 4-гетероариланилинов, включая(без ограничения) разнозамещенные 4-(1H-1,2,4-триазол-1-ил)анилины и 4-(1H-1,2,3-триазол-1 ил)анилины. Кроме того, вместо нитроаренов формулы 2 могут быть использованы замещенные нитропиридины, что в итоге приводит к получению аминозамещенных пиридинов. Схема 1 Дополнительные методики получения замещенных анилинов основаны на палладийкатализируемом сочетании арилгалогенидов или гетероарилгалогенидов с бороновыми кислотами (реакция сочетания Сузуки). Как показано на схеме 2, биариланилины 10 и 11 и их нитропредшественники 8 и 9, могут быть получены путем сочетания эфиров арил- или гетероарилбороновых кислот 5 и 7, соответственно, с замещенными арилгалогенидами 6, включая 1-бром-2-метокси-4-нитробензол. Альтернативно партнеры в реакции сочетания могут быть изменены таким образом, как показано на Схеме 3, в этом случае замещенные нитроарены 8 и 9 получают в результате сочетания арилгалогенида 12 или гетероарилгалогенида 14, соответственно, с бороновым эфиром нитроарена 13. Подразумевается, что описанные выше общие реакционные схемы приведены в качестве иллюстрации общих методик синтеза, которые являются высоко толерантными в отношении различных функциональных групп, и что данные методики не ограничены конкретными структурами, показанными на схемах 2 и 3. Специалисты в данной области техники должны понимать, что аналогичные методики, включая сочетание Стилле, а именно сочетание арил- или гетероарилгалогенидов и арил- или гетероарилстаннанов, также являются отличными методиками для получения необходимых анилинов или их нитропредшественников. На следующих схемах приведены различные пути синтеза 2,4-дихлор-7-арил-6,7-дигидро-5Hциклопента[d]пиримидинов, использованных при получении соединений согласно настоящему изобретению. Как показано на схеме 4, циклопентанон 15 может быть подвергнут взаимодействию с различными галогенидами арилмагния с получением третичных спиртов 16. В присутствии дегидратирующих агентов, таких как неорганические кислоты или тионилхлорид, данные третичные спирты могут быть подвергнуты элиминированию воды с получением олефинов 17. При обработке агентами, окисляющими до перекисного соединения, такими как пермуравьиная кислота, олефины 17 могут быть превращены в 2 арилциклопентаноны 18. Abu Thaher, В.; Koch, P.; Del Amo, V.; Knochel, P.; Laufer, S. Synthesis 2008, 2,225-228. Схема 4 Альтернативно (смотри схему 5), 2-арилциклопентаноны 18 могут быть получены путем обработки циклопентеноксида 19 различными галогенидами арилмагния в присутствии соли меди, такой как иодид меди, и последующего окисления полученных спиртов 20. Указанное окисление может быть выполнено с использованием ряда окисляющих агентов, известных специалистам в данной области техники, при этом лучшие результаты получаются при использовании периодинана Десса-Мартина. Dess, D. В.; Martin, J.C. J. Org. Chem. 1983, 48, 4155-4156. Схема 5 Дополнительные кетоны, которые могут использоваться для получения соединений согласно п.1 формулы изобретения, могут быть получены с использованием методики, описанной в О. Dirat et al., Tetrahedron Letters, 2006, 47, 1295. Данная методика (приведена на схеме 6) основана на альфаарилировании (Fox et al., Journal of the American Chemical Society, 2000, 122, 1360) подходящих кетонов- 13020322 21, которые включают ацетали или кетали в положении 4. Соответствующие исходные кетоны 21 имеются в продаже или могут быть легко получены специалистами в данной области, могут быть использованы различные ацетали, включая показанный на схеме этиленгликолькеталь или кетали других спиртов,включая 1,3-пропандиол, метанол, этанол и другие. Данная методика также хорошо подходит для получения незамещенных альфа-арилкетонов 24. Схема 6 Дополнительные альфа-арилкетоны могут быть получены с использованием методики, приведенной на схеме 7. Тетрагидро-4H-пиран-4-он обычно бромируют с использованием в качестве бромирующего агента брома в дихлорметане или пирролидина гидротрибромида. Затем полученный альфабромкетон может быть подвергнут взаимодействию с реактивом Гриньяра с получением (после переноса арильной группы) желаемого альфа-арилкетон 27. Схема 7 Как показано на схеме 8, 2-арилциклопентаноны 18 могут быть депротонированы сильным основанием, таким как LDA, и обработаны алкилцианоформиатом с получением кетоэфиров 28, которые подвергают взаимодействию с 2-метил-2-тиопсевдомочевиной с получением 2-амино-7-арил-6,7 дигидроциклопента[е][1,3]оксазин-4(5H)-онов 29. Соединения 29 подвергают гидролизу в присутствии кислотного катализатора с получением 7-арил-6,7-дигидроциклопента[е][1,3]оксазин-2,4(3H,5H)-дионов 30. Larsen, J. S.; Christensen, L.; Ludvig, G.; Jorgensen, P. Т.; Pedersen, E. В.; Nielsen, С. J. Chem. Soc., Perkin Trans. I2000, 3035-3038. Схема 8 Альтернативно 7-арил-6,7-дигидроциклопента[е][1,3]оксазин-2,4(3H,5H)-дионы 31 получают в результате взаимодействия 2-арилциклопентанонов 18 с N-(хлоркарбонил)изоцианатом (cхема 9). Последующая обработка 7-арил-6,7-дигидроциклопента[е][1,3]оксазин-2,4(3H,5H)-дионов 31 раствором аммиака в воде и хлорирование оксихлоридом фосфора приводят к получению 2,4-дихлор-7-арил-6,7 дигидро-5H-циклопента[d]пиримидинов 33. Схема 9 По аналогии с синтезом, представленным на схеме 9, дополнительные кетоны могут быть подвергнуты взаимодействию с N-(хлоркарбонил)изоцианатом с получением дополнительных оксазиндионов 35,которые могут быть подвергнуты взаимодействию с аммиаком с получением желаемых пиримидиндионов 36 (cхема 10). Последующее хлорирование приводит к получению промежуточных дихлоридов 37. Аналогично данная методика может быть использована для получения конденсированных дихлорпиримидинов (cхема 11) с использованием соответствующих кетальзащищенных кетонов, которые могут быть получены в соответствии со cхемой 6. 2,4-Дихлор-7-арил-6,7-дигидро-5H-циклопента[d]пиримидины 33 также могут быть синтезированы в соответствии с методикой, описанной на схеме 12. 4-Хлор-2,6-диметоксипиримидин 40 может быть депротонирован сильным основанием, таким как н-бутиллитий или 2,2,6,6-тетраметилпиперидин, депротонирование останавливают путем добавления аллилбромида с получением 5-аллил-4-хлор-2,6 диметоксипиримидина 41. Nencka, R.; Votruba, I.; Hebabeck, H.; Jansa, P.; Tlout'ov, E.; Horsk, K.;Masojidkov, M.; Hol, A. J. Med. Chem. 2007, 50, 6016-6023. Данное соединение может быть подвергнуто взаимодействию с -стирилбороновыми кислотами в присутствии палладиевого катализатора, такого как тетракис-(трифенилфосфин)палладий, с получением соединений Формулы 42, которые могут быть подвергнуты метатезису олефинов с замыканием цикла в присутствии катализатора Граббса с получением 2,4-диметокси-7-арил-5H-циклопента[d]пиримидинов 43. Grubbs, R. H. Handbook of Metathesis, 2003, FirstEdition, Wiley-VCH. Двойная связь в соединении 43 может быть восстановлена с получением 2,4 диметокси-7-арил-6,7-дигидро-5H-циклопента[d]пиримидинов 44, которые подвергают гидролизу в присутствии кислотного катализатора и последующему хлорированию оксихлоридом фосфора с получением промежуточных соединений 33. Схема 12 Дополнительные представители класса соединений, описанных в п.1 формулы изобретения, могут быть получены в соответствии со схемой 13. Карбоксилирование бензонитрилов и последующее простое восстановление с использованием катализа на металле (палладий на углероде или аналогичные методики) приводят к получению замещенного сложного бета-аминоэфира 48. Конденсация с эфиром акриловой кислоты приводит к получению промежуточного соединения 49, которое либо сразу может быть алкилировано по атому азота, чтобы обеспечить присутствие заместителей Rd, либо может быть защищено пара-метоксибензильной группой согласно схеме 13, а снятие защитной группы и введение Rd может быть выполнено позднее. Затем промежуточное соединение 50 подвергают циклизации в присутствии основания (обычно KOt-Bu) с получением сложного бета-кетоэфира 51. Конденсация сложного бетакетоэфира 51 с мочевиной в присутствии основания приводит к получению пиримидиндионового промежуточного соединения 52, которое затем может быть хлорировано в стандартных условиях с получением дихлорида 53. Данный дихлорид может быть превращен в соединения, описанные в п.1 формулы изобретения, с использованием стандартных методик (смотри ниже). Схема 13- 15020322 Дополнительные представители класса соединений, описанных в п.1 формулы изобретения, могут быть получены в соответствии со схемой 14. Этерификация аминокислоты и последующее алкилирование с использованием 4-бромбутановой кислоты этилового эфира приводят к получению промежуточного соединения 56, которое либо сразу может быть алкилировано по атому азота, чтобы обеспечить присутствие заместителей Rd, либо может быть защищено пара-метоксибензильной группой согласно схеме 14, а снятие защитной группы и введение Rd может быть выполнено позднее. Затем промежуточное соединение 57 подвергают циклизации в присутствии основания (обычно KOt-Bu) с получением сложного бета-кетоэфира 58. Конденсация сложного бета-кетоэфира 58 с мочевиной в присутствии основания приводит к получению пиримидиндионового промежуточного соединения 59, которое затем может быть хлорировано в стандартных условиях с получением дихлорида 60. Данный дихлорид может быть превращен в соединения, описанные в п.1 формулы изобретения, с использованием стандартных методик Как показано на схеме 15, диметоксибензильная группа, используемая для защиты атома азота у соединения, имеющего структуру, представленную формулой 61, может быть удалена, например, под действием сильной кислоты (ТФУ в присутствии анизола в качестве катионного очистителя) с получением свободного амина, который затем может быть дополнительно модифицирован, например, путем ацилирования, сульфонилирования или алкилирования с использованием стандартных методик с получением дополнительных соединений, описанных в п.1 формулы изобретения. Аналогично амин 64, позиционный изомер, может быть подвергнут идентичным превращениям, как показано на схеме 16, с получением дополнительного класса соединений, описанных в п.1 формулы изобретения. Схема 15 Дополнительные аналоги могут быть получены с использованием методики, приведенной на схеме 17. Этерификация по Фишеру гидроксикислот 67 (имеются в продаже) приводит к получению сложного эфира, который затем подвергают алкилированию по спиртовой группировке в присутствии оксида серебра (I) в качестве катализатора. Восстановление полученного олефина и циклизация приводят к получению сложного бета-кетоэфира 71. Превращение сложного бета-кетоэфира 71 в пиримидиндион с использованием KOt-Bu и мочевины и последующее хлорирование с помощью POCl3 приводят к получению дихлорида 73, который может быть использован в синтезе соединений, описанных в п.1 формулы изобретения, в соответствии со схемой 22. Дополнительные аналоги могут быть получены с использованием методики, приведенной на схеме 18. Взаимодействие пиримидин-2,4,6-триола с POCl3 в ДМФА приводит к получению хлорзамещенного альдегида 75. Защита альдегида и последующее взаимодействие с реактивом Гриньяра приводят к получению дихлоридного реагента 77. Гидролитическое деблокирование и восстановление полученного альдегида до спирта и последующая циклизация по действием тетраацетата свинца с замыканием тетрагидрофуранового кольца приводят к получению замещенного дихлорида 80, который затем может быть использован для синтеза дополнительных соединений, описанных в п.1 формулы изобретения, с использованием описанных ниже методик. Схема 18 2,4-Дихлор-7-арил-6,7-дигидро-5H-циклопента[d]пиримидины 81 подвергают селективному взаимодействию с первичными и вторичными аминами с получением 2-амино-производных 82, которые при нагревании могут быть подвергнуты взаимодействию с анилинами 4 с получением соединений согласно настоящему изобретению 83 (Схема 19). Указанное взаимодействие может быть выполнено либо в присутствии кислоты (например с использованием уксусной кислоты), либо в присутствии основания (например с использованием гидрида натрия). Альтернативно данное взаимодействие может быть осуществлено путем катализа на металле в условиях, описанных в литературе, например с использованием в качестве катализатора комплекса палладия и Xantphos (9,9-диметил-4,5-бис(дифенилфосфино)ксантена), в присутствии сильного основания (NaOt-Bu) или Na2CO3, в смеси воды и сорастворителя (обычно ТГФ/вода или диоксан/вода). Схема 19 Дополнительные соединения, описанные в п.1 формулы изобретения, могут быть получены путем конденсации подходящих кетальсодержащих дихлоридов с аминами и анилинами (с использованием приведенной выше методики), с получением промежуточных соединений 86 (cхема 20). Деблокирование кеталя, например, с использованием водной кислоты приводит к получению кетона 88, который представляет собой очень полезное промежуточное соединение для синтеза других соединений. Данный кетон может быть сразу конденсирован с аминами с использованием восстановительных условий (восстановительное алкилирование) с получением замещенных аминов 89. Альтернативно указанный кетон может быть восстановлен с помощью гидридных реагентов, таких как NaBH4 или LiAlH4, с получением спирта. Спирт 90 может быть активирован, например как метансульфонат, и затем подвергнут замещению нуклеофильными реагентами, включая тиолы, азиды или другие нуклеофилы. Окисление полученного тиола приводит к получению сульфоксида и сульфона. Восстановление полученного азида представляет собой легкий путь получения амина, который затем может быть алкилирован с получением дополнительных соединений, описанных в п.1 формулы изобретения. На схеме 21 приведена дополнительная методика получения аналогов, описанных в п.1 формулы изобретения, с использованием альдегида 76 в качестве исходного соединения. Присоединение литированного фенилдитиана к альдегиду 76 приводит к получению промежуточного соединения 92. Снятие защитных групп приводит к получению кетоальдегида 93, который может быть циклизирован до замещенного пирролидина 94 с последующим восстановительным алкилированием. На данной стадии может быть использован либо амин, который сразу вводит желаемый заместитель Rd, либо амин, который вводит защитную группу (включая 4-метоксибензил), как показано на схеме. Полученный таким образом дихлорид может быть превращен в соединения, описанные в п.1 формулы изобретения, с использованием методик, изложенных в данной заявке. Дополнительные аналоги могут быть получены путем удаления защитной 4-метоксибензильной группы с использованием методик, известных специалистам в данной области, например действием ТФУ в присутствии анизола в качестве катионного очистителя, и последующего дополнительного алкилирования, ацилирования или сульфонилирования с использованием известных методик. Схема 21 В общем случае дополнительные пиримидин дихлориды, полученные с использованием описанных выше методик или других методик, известных в данной области техники, могут быть превращены в дополнительные аналоги, описанные в п.1 формулы изобретения, в соответствии с методикой, приведенной на схеме 22. Пиримидин дихлориды подвергают взаимодействию с аминами с получением хлоридов 99,которые соответствуют структурам D-E, описанным в п.1 формулы изобретения, где связь, которая соединяет структуру D-E с фрагментом ABNH, активирована как замещаемая хлоридная группа. Соединения, описанные в п.1 формулы изобретения, получают путем конденсации хлоридов 99 с анилинамиABNH2 с использованием методик, приведенных выше на схеме 19. Схема 22- 18020322 Рацемические соединения согласно настоящему изобретению могут быть разделены с использованием методик хирального разделения, известных среднему специалисту в данной области техники, с получением индивидуальных энантиомеров (cхема 23). Это продемонстрировано ниже на примере серии циклопента[d]пиримидинов, но одинаково применимо к другим рацемическим соединениям, описанным в данной заявке. Схема 23 На схемe 23 а приведена дополнительная методика получения соединений, описанных в п.1 формулы изобретения. 4-Хлор-2,6-диметоксипиримидин 101 (имеется в продаже) может быть подвергнут депротонированию с использованием бутиллития или тетраметилпиперидида лития с последующим аллированием с получением защищенного пиримидина 102. Реакции сочетания Сузуки между пиримидином 102 и фенилвинилбороновой кислотой в присутствии палладиевого катализатора приводит к получению диена 103, который может быть эффективно циклизирован путем метатезиса с замыканием цикла в стандартных условиях с использованием катализатора Граббса II. Полученный олефин может быть восстановлен с получением промежуточного соединения 105. Снятие защитной группы и хлорирование в стандартных условиях открывают дополнительный путь получения дихлоридов 106, которые могут быть превращены в соединения, описанные в п.1 формулы изобретения, с использованием методики, приведенной на схеме 22. Схема 23 а Рацемические соединения согласно настоящему изобретению могут быть разделены с использованием методик хирального разделения, известных среднему специалисту в данной области техники, с получением индивидуальных энантиомеров (cхема 24). Это продемонстрировано ниже на примере серии циклопента[d]пиримидинов, но одинаково применимо к другим рацемическим соединениям, описанным в данной заявке. Схема 24"ЖХВД" представляет собой использованную в данном описании аббревиатуру жидкостной хроматографии высокого давления. "ЖХ-МС" относится к жидкостной хроматографии высокого давления,которую выполняют в соответствии с определением ЖХВД и с использованием массспектрометрического детектора. Растворители для ЖХВД: когда указано, что хроматографию выполняли с использованием "стандартных условий", это означает, что образец растворяли в метаноле (1 мг/мл) и элюировали с использованием градиента, задаваемого программой, со скоростью потока растворителя 1,0 мл/мин. Препаративная обратнофазовая ЖХВД: когда указано, что хроматографию выполняли с использованием "стандартных условий", это означает, что образец (приблизительно 20 мг) растворяли в метаноле (10 мг/мл) и очищали на колонке Waters-Atlantis S5 30 мм х 100 мм с использованием для элюирования градиента концентрации (0%-100%) буфера В в буфере А (буфер А = 10% СН 3 ОН/90% вода/0,1% ТФУ и буфер В = 90% МеОН/10% вода/0,1% ТФУ) в течение 10 мин при 40 мл/мин. Спектры протонного ЯМР получали на спектрометре Bruker 400 или 500. Данные относятся к фиксированному растворителю. Подразумевается, что приведенные примеры дополнительно помогают понять раскрытие сущности настоящего изобретения. Подразумевается, что конкретные использованные вещества, а также продукты и условия дополнительно иллюстрируют конкретные варианты осуществления изобретения и не ограничивают обоснованный объем изобретения. Синтез промежуточных соединений Смесь 4-хлор-1H-имидазола (5,0 г, 48,8 ммоль), 1-хлор-2-метокси-4-нитробензола (9,15 г, 48,8 ммоль) и гидроксид калия (хлопья, 2,74 г, 48,8 ммоль) в безводном ДМСО (диметилсульфоксиде) (50 мл) нагревали в течение 20 ч при 80 С. Реакционную смесь оставляли охлаждаться до комнатной температуры и вливали в 800 мл воды при интенсивном перемешивании. Полученный желто-оранжевый осадок собирали путем вакуумной фильтрации с использованием воронки с грубым фильтром из пористого стекла. Неочищенное влажное твердое вещество переносили в колбу Эрленмейера объемом 1 л. В колбу добавляли абсолютный этанол (250 мл), и полученную суспензию нагревали, пока не растворялось все твердое вещество. Полученный прозрачный раствор охлаждали до комнатной температуры, что приводило к медленной кристаллизации желаемого продукта. Через 2 ч кристаллическое твердое вещество собирали путем вакуумной фильтрации и промывали свежей порцией этанола (100 мл). Твердое вещество сушили в условиях глубокого вакуума с получением 4-хлор-1-(2-метокси-4-нитрофенил)-1Hимидазола (5,2 г, выход: 42%) в виде желтоватого кристаллического твердого вещества. ЖХ-МС (М+Н)+ В круглодонную колбу объемом 500 мл, содержащую смесь 4-хлор-1-(2-метокси-4-нитрофенил)1H-имидазола (5,2 г, 20,5 ммоль), абсолютного этанола (100 мл) и ледяной уксусной кислоты (50 мл),добавляли железный порошок - 325 меш (4,6 г, 82 ммоль). К колбе присоединяли обратный холодильник,охлаждаемый водой, и данную гетерогенную смесь нагревали до 100 С при интенсивном перемешивании в течение 30 мин. Реакционную смесь оставляли охлаждаться до комнатной температуры и добавляли к охлаждаемому и перемешиваемому раствору 3 М NaOH (291 мл). Полученную смесь выливали в делительную воронку и экстрагировали EtOAc (3250 мл). Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали под вакуумом с получением 4-(4-хлор-1H-имидазол 1-ил)-3-метоксианилина (4,57 г, выход: 97%) в виде твердого вещества. ЖХ-МС (М+Н)+ 224,0. 1 Н ЯМР(552 мг, 3,22 ммоль) в ДМФА (объем: 6446 мкл) добавляли K2CO3 (891 мг, 6,45 ммоль). Температуру полученной смеси доводили до 120 С, и смесь перемешивали в течение ночи. Реакционную смесь разбавляли EtOAc (20 мл), промывали водой (2 х 10 мл), солевым раствором (10 мл), сушили над MgSO4, фильтровали и концентрировали под вакуумом с получением 1-(2-метокси-4-нитрофенил)-1H-имидазол-4 карбонитрила (698 мг, 2,86 ммоль, выход: 89%). ЖХ-МС (М+Н)+ = 245,0. 1 Н ЯМР (500 МГц, MeOD)м.д.: 8.30-8.34 (1 Н), 8.19-8.23 (1 Н), 8.09-8.12 (1 Н), 8.00-8.05 (1 Н), 7.71-7.79 (1 Н), 4.02-4.10 (3 Н). Препарат АА. 4-(4-Циано-1H-имидазол-1-ил)-3-метоксианилин(соотношение: 2; объем: 15 мл) добавляли уксусную кислоту (соотношение: 1,000; объем: 7,50 мл) и же- 20020322 лезо (630 мг, 11,29 ммоль). Температуру полученной смеси доводили до 100 С, и смесь перемешивали в течение 2 ч. Затем реакционную смесь разбавляли водой и подводили до рН 8 путем добавления 1 н. водного раствора гидроксида натрия. Данную смесь экстрагировали EtOAc (35 мл). Объединенные экстракты промывали водой (5 мл), солевым раствором (5 мл), сушили над MgSO4, фильтровали и концентрировали под вакуумом. ЖХ-МС (М+Н)+ = 215,0. Препарат В. 3-Фтор-4-(3-метил-1H-1,2,4-триазол-1-ил)анилин Смесь 3-метил-1H-1,2,4-триазола (15,0 г, 181 ммоль), 1,2-дифтор-4-нитробензола (28,7 г, 181 ммоль) и бикарбоната натрия (15,2 г, 181 ммоль) в ДМСО (100 мл) нагревали в течение 48 ч при 80 С. Затем реакционную смесь оставляли охлаждаться до комнатной температуры и вливали в воду (800 мл). Полученную водную смесь экстрагировали EtOAc (3200 мл). Объединенные органические экстракты промывали последовательно водой (500 мл) и солевым раствором (100 мл). Органический слой сушили над сульфатом натрия, фильтровали и концентрировали под вакуумом. Неочищенную реакционную смесь очищали путем хроматографии на силикагеле (30-80% EtOAc/гексан, линейный градиент) с получением двух региоизомерных продуктов. Чистые фракции, содержащие менее полярный региоизомер, объединяли и концентрировали с получением 1-(2-фтор-4-нитрофенил)-3-метил-1H-1,2,4-триазола (7,2 г, 30,8 ммоль, выход: 17%) в виде желтоватого твердого вещества. Чистые фракции, содержащие более полярный региоизомер, объединяли и концентрировали с получением 1-(2-фтор-4-нитрофенил)-5-метил-1H1,2,4-триазола (6,23 г, 28,0 ммоль, выход: 15%) в виде желтоватого твердого вещества. Спектры 1-(2 фтор-4-нитрофенил)-3-метил-1H-1,2,4-триазола: ЖХ-МС (М+Н)+ = 223,1. 1 Н ЯМР (500 МГц, CDCl3)м.д.: 8.73 (d, J=2.7 Гц,1 Н), 8.15-8.26 (m, 3 Н), 2.53 (s, 3 Н). Препарат В. 3-Фтор-4-(3-метил-1 Н-1,2,4-триазол-1-ил)анилин К охлаждаемому в бане с ледяной водой раствору 1-(2-фтор-4-нитрофенил)-5-метил-1H-1,2,4 триазола (15,0 г, 67,5 ммоль, препарат А, стадия 1) в метаноле (400 мл) добавляли в атмосфере азота 10% палладий на углероде (2,50 г, 23,5 ммоль). Колбу несколько раз обезгаживали и продували газообразным водородом (из двухслойного баллона). Полученную смесь оставляли нагреваться до комнатной температуры и затем оставляли перемешиваться в течение 72 ч в атмосфере водорода. Затем сосуд продували газообразным азотом. Реакционный сосуд и его содержимое охлаждали в бане с ледяной водой, и добавляли еще одну порцию 10% палладия на углероде (2,50 г, 23,5 ммоль). Колбу несколько раз обезгаживали и продували газообразным водородом (из двухслойного баллона). Полученную смесь оставляли нагреваться до комнатной температуры и затем оставляли перемешиваться в течение 6 ч в атмосфере водорода. Затем сосуд продували газообразным азотом. Неочищенную реакционную смесь фильтровали через короткую пробку диатомовой земли (Celite). Реакционный сосуд и диатомовую землю (Celite ) промывали новой порцией метанола. Объединенные фильтраты концентрировали под вакуумом. Остаток сушили в условиях глубокого вакуума в течение ночи с получением 3-фтор-4-(3-метил-1H-1,2,4-триазол 1-ил)анилина (12,1 г, 63,0 ммоль, выход: 93%) в виде черно-серого твердого вещества. ЖХ-МС (М+Н)+ 193,2. 1 Н ЯМР (500 МГц, CDCl3)м.д.: 8.31 (d, J=2.4 Гц, 1 Н), 7.47 (t, J=8.7 Гц, 1 Н), 6.47-6.58 (m, 2 Н),3.97 (br. s., 2 Н), 2.48 (s, 3 Н). Препарат С. 3-Фтор-4-(5-метил-1H-1,2,4-триазол-1-ил)анилин Смесь 3-метил-1H-1,2,4-триазола (15,0 г, 181 ммоль), 1,2-дифтор-4-нитробензола (28,7 г, 181 ммоль) и бикарбоната натрия (15,2 г, 181 ммоль) в ДМСО (100 мл) нагревали в течение 48 ч при 80 С. Затем реакционную смесь оставляли охлаждаться до комнатной температуры и вливали в воду (800 мл). Полученную водную смесь экстрагировали EtOAc (3200 мл). Объединенные органические экстракты промы- 21020322 вали последовательно водой (500 мл) и солевым раствором (100 мл). Органический слой сушили над сульфатом натрия, фильтровали и концентрировали под вакуумом. Неочищенную реакционную смесь очищали путем хроматографии на силикагеле (30-80% EtOAc/гексан, линейный градиент) с получением двух региоизомерных продуктов. Чистые фракции, содержащие менее полярный региоизомер, объединяли и концентрировали с получением 1-(2-фтор-4-нитрофенил)-3-метил-1H-1,2,4-триазола (7,2 г, 30,8 ммоль, выход: 17%) в виде желтоватого твердого вещества. Чистые фракции, содержащие более полярный региоизомер, объединяли и концентрировали с получением 1-(2-фтор-4-нитрофенил)-5-метил-1H1,2,4-триазола (6,23 г, 28,0 ммоль, выход: 15%) в виде желтоватого твердого вещества. Спектры 1-(2 фтор-4-нитрофенил)-5-метил-1H-1,2,4-триазола: ЖХ-МС (М+Н)+ = 223,1. 1 Н ЯМР (500 МГц, CDCl3)м.д.: 8.18-8.24 (m, 2 Н) 8.04 (s, 1 Н) 7.69-7.78 (m, 1 Н) 2.47-2.53 (m, 3 Н). Препарат С. 3-Фтор-4-(5-метил-1H-1,2,4-триазол-1-ил)анилин К охлажденному в бане с ледяной водой раствору 1-(2-фтор-4-нитрофенил)-5-метил-1H-1,2,4 триазола (3,7 г, 17 ммоль) в метаноле (200 мл) в атмосфере азота добавляли 10% палладий на углероде(1,5 г, 14,1 ммоль). Колбу несколько раз обезгаживали и продували газообразным водородом (из двухслойного баллона). Полученную смесь оставляли нагреваться до комнатной температуры и затем оставляли перемешиваться в течение 18 ч в атмосфере водорода. Затем сосуд продували газообразным азотом. Неочищенную реакционную смесь фильтровали через короткую пробку диатомовой земли (Celite). Реакционный сосуд и диатомовую землю (Celite) промывали новой порцией метанола. Объединенные фильтраты концентрировали под вакуумом. Остаток сушили в условиях глубокого вакуума с получением 3-фтор-4-(5-метил-1H-1,2,4-триазол-1-ил)анилина (3,14 г, выход: 91%) в виде черно-серого твердого вещества. ЖХ-МС (М+Н)+ 193,1. 1 Н ЯМР (500 МГц, CDCl3)м.д.: 7.91 (s, 1H) 7.14 (t, J=8.55 Гц, 1 Н) 6.436.53 (m, 2 Н) 4.04 (br. s., 2 Н) 2.36 (s, 3 Н). Препарат D. 3-Метокси-4-(3-метил-1 Н-1,2,4-триазол-1-ил)анилин Смесь 3-метил-1H-1,2,4-триазола (5,0 г, 60,2 ммоль), 1-хлор-2-метокси-4-нитробензола (11,3 г, 60,2 ммоль) и KOH (хлопья, 3,4 г, 48,1 ммоль) в безводном ДМСО (50 мл) нагревали в течение 6 ч при 80 С. Затем реакционную смесь оставляли охлаждаться до комнатной температуры и вливали в 800 мл воды при интенсивном перемешивании. Полученную водную смесь экстрагировали EtOAc (3200 мл). Объединенные органические экстракты промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали под вакуумом. Неочищенный остаток очищали путем хроматографии на силикагеле (02% МеОН/хлороформ, линейный градиент) с получением 1-(2-метокси-4-нитрофенил)-3-метил-1H-1,2,4 триазола (3,7 г, выход: 26%). ЖХ-МС (М+Н)+ = 235,2. Препарат D. 3-Метокси-4-(3-метил-1 Н-1,2,4-триазол-1-ил)анилин К охлаждаемому в бане с ледяной водой раствору 1-(2-метокси-4-нитрофенил)-3-метил-1H-1,2,4 триазола (3,7 г, 12,7 ммоль) в метаноле (250 мл) добавляли в атмосфере азота 10% палладий на углероде(1,2 г). Колбу несколько раз обезгаживали и продували газообразным водородом (из двухслойного баллона). Полученную смесь оставляли нагреваться до комнатной температуры и затем оставляли перемешиваться в течение 18 ч в атмосфере водорода. Затем колбу продували газообразным азотом. Неочищенную реакционную смесь фильтровали через короткую пробку диатомовой земли (Celite). Реакционный сосуд и пробку промывали метанолом. Фильтрат концентрировали под вакуумом. Осадок сушили в условиях глубокого вакуума в течение ночи с получением 3-метокси-4-(3-метил-1H-1,2,4-триазол-1 ил)анилина (2,44 г, выход: 94%) в виде красноватого твердого вещества. ЖХ-МС (М+Н)+ 205,2. 1 Н ЯМР- 22020322 Указанное в заголовке соединение получали в результате взаимодействия промежуточного соединения С(1) и NaOMe в ДМФА и последующего восстановления полученного 1-(2-метокси-4 нитрофенил)-5-метил-1H-1,2,4-триазола с использованием Fe и хлорида аммония. ЖХ-МС (М+Н)+ 205,1. 1 Н ЯМР (500 МГц, ХЛОРОФОРМ-d)м.д.: 7.90 (1 Н, s), 7.05 (1 Н, d, J=7.93 Гц), 6.27-6.34 (2 Н, m), 3.91 Смесь 4-метил-1H-имидазола (18,0 г, 53,5 ммоль), 1-хлор-2-метокси-4-нитробензола (10,0 г, 53,5 ммоль) и гидроксида калия (4,5 г, 80,3 ммоль) в ДМСО (50 мл) нагревали в течение 24 ч при 110 С. Затем реакционную смесь оставляли охлаждаться до комнатной температуры и вливали в 1000 мл воды. Полученную водную смесь экстрагировали дихлорметаном (3250 мл). Объединенные органические экстракты промывали солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали под вакуумом. Неочищенную реакционную смесь очищали путем хроматографии на силикагеле (картридж, содержащий 330 г силикагеля, 0-2% МеОН/хлороформ, линейный градиент в течение 72 мин,скорость потока: 25 мл/мин) с получением 1-(2-метокси-4-нитрофенил)-4-метил-1H-имидазола (2,56 г,выход: 20%) в виде желто-оранжевого твердого вещества. ЖХ-МС (М+Н)+ = 234,1. 1 Н ЯМР (500 МГц,CDCl3)м.д.: 7.97-8.00 (m, 1H) 7.93-7.97 (m, 2 Н) 7.45 (d, J=8.85 Гц, 1 Н) 7.02 (s, 1H) 4.02 (s, 3 Н) 2.35 (s,3 Н). Препарат Е. 3-Метокси-4-(4-метил-1H-имидазол-1-ил)анилин К охлаждаемому в бане с ледяной водой раствору 1-(2-метокси-4-нитрофенил)-4-метил-1Hимидазола (2,56 г, 11,0 ммоль) в метаноле (150 мл) добавляли в атмосфере азота 10% палладий на углероде (250 мг). Колбу несколько раз обезгаживали и продували газообразным водородом (из двухслойного баллона). Полученную смесь оставляли нагреваться до комнатной температуры и затем оставляли перемешиваться в течение 18 ч в атмосфере водорода. Затем колбу продували газообразным азотом. Неочищенную реакционную смесь фильтровали через короткую пробку диатомовой земли (Celite). Реакционный сосуд и пробку промывали метанолом. Фильтрат концентрировали под вакуумом. Осадок сушили в условиях глубокого вакуума в течение ночи с получением 3-метокси-4-(4-метил-1H-имидазол-1 ил)анилина (2,25 г, выход: 100%) в виде черно-серого воскообразного твердого вещества. ЖХ-МС К раствору 1-тритил-1H-имидазол-4-карбальдегида в дихлорметане при 0 С добавляли дезоксифтор и данную смесь перемешивали в течение 3 суток. Затем продукт обрабатывали в течение ночи смесьюAcOH/HCl (1:5) при температуре окружающей среды с получением 4-(дифторметил)-1H-имидазола. Препарат ЕЕ. 3-Метокси-4-(4-дифторметил-1H-имидазол-1-ил)анилин Промежуточное соединение ЕЕ(1) обрабатывали в соответствии с описанной выше методикой синтеза препарата Е с получением желаемого препарата ЕЕ. ЖХ-МС (М+Н)+ 240,2. 1 Н ЯМР (400 МГц,ДМСО-d6)м.д.: 8.42 (s, 1 Н) 7.93 (s, 1 Н), 7.48 (d, J=8.4 Гц, 1 Н) 7.19-6.88 (m, 3 Н) 3.81 (s, 3 Н). Препарат F. 4-(3-Хлор-1 Н-1,2,4-триазол-1-ил)-3-метоксианилин Смесь 3-хлор-1H-1,2,4-триазола (2,76 г, 26,7 ммоль), 1-хлор-2-метокси-4-нитробензола (5,0 г, 26,7 ммоль), гидроксида калия (хлопья, 1,496 г, 26,7 ммоль) и ДМСО (25 мл) нагревали в герметично закрытом реакционном сосуде при 100 С в течение 24 ч. Реакционную смесь оставляли охлаждаться до комнатной температуры, и добавляли еще одну порцию 3-хлор-1H-1,2,4-триазола (1,38 г, 0,5 экв.) и гидроксида калия (0,75 г, 0,5 экв.). Реакционный сосуд снова герметично закрывали и нагревали до 110 С дополнительно в течение 24 ч. Смесь оставляли охлаждаться до комнатной температуры и вливали в 500 мл воды. Полученную водную смесь экстрагировали EtOAc (3100 мл). Объединенные органические экстракты промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали под вакуумом. Неочищенный остаток очищали путем хроматографии на силикагеле (0-5% МеОН/хлороформ,линейный градиент в течение 144 мин, скорость потока: 25 мл/мин) с получением 2-(3-хлор-1H-1,2,4 триазол-1-ил)-5-нитрофенола (0,924 г, 3,84 ммоль, выход: 14,4%). ЖХ-МС (М+Н)+ = 241,0. 1 Н ЯМР (500 МГц, CDCl3)м.д.: 11.97 (br. s., 1H) 9.24 (s, 1H) 7.90-7.95 (m, 1H) 7.89 (d, J=2.44 Гц, 1 Н) 7.84 (dd, J=8.85,2.44 Гц, 1 Н). Промежуточное соединение F(2). 3-Хлор-1-(2-метокси-4-нитрофенил)-1H-1,2,4-триазол(0,388 г, 6,91 ммоль) и ДМСО (25 мл) добавляли иодметан (0,860 мл, 13,82 ммоль). Смесь оставляли перемешиваться в течение 24 ч при комнатной температуре. Затем реакционную смесь вливали в воду (250 мл) и экстрагировали EtOAc (3100 мл). Объединенные экстракты промывали водой, промывали солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали под вакуумом. Неочищенный остаток очищали путем колоночной хроматографии на силикагеле (0-1% МеОН/хлороформ, линейный градиент в течение 72 мин, скорость потока: 25 мл/мин). Фракции, содержащие чистый продукт,объединяли и концентрировали с получением 3-хлор-1-(2-метокси-4-нитрофенил)-1H-1,2,4-триазола(8 мл). Пробирку закрывали и нагревали в течение 24 ч при 70-80 С. Смесь охлаждали до комнатной температуры, вливали в воду (300 мл) и экстрагировали EtOAc (2150 мл). Объединенные органические слои промывали солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали под вакуумом с получением 4-(3-хлор-1H-1,2,4-триазол-1-ил)-3-метоксианилина (577 мг, 73%) в виде коричневого твердого вещества. ЖХ-МС (М+Н)+ 225,1. Препарат FF. 6-(4-Хлор-1H-имидазол-1-ил)-5-метоксипиридин-3-амин Смесь 4-хлор-1H-имидазола (2,72 г, 26,5 ммоль), 2-хлор-3-метокси-5-нитропиридина (5,0 г, 26,5 ммоль) и KOH (хлопья, 1,488 г, 26,5 ммоль) в безводном ДМСО (25 мл) нагревали в течение 5 ч при 80 С. Реакционную смесь оставляли охлаждаться до комнатной температуры и вливали в 1,0 л воды при интенсивном перемешивании. Смесь перемешивали в течение 16 ч при комнатной температуре. Образо- 24020322 вавшийся осадок собирали путем вакуумной фильтрации с использованием воронки с грубым фильтром из пористого стекла. Твердое вещество сушили в условиях глубокого вакуума в течение 24 ч с получением 2-(4-хлор-1H-имидазол-1-ил)-3-метокси-5-нитропиридина (5,22 г, 20,50 ммоль, выход: 77%) в виде светло-коричневого твердого вещества. ЖХ-МС (М+Н)+ = 255,0. 1 Н ЯМР (500 МГц, ДМСО-d6)м.д.: 8.94 (d, J=2.44 Гц, 1 Н) 8.51 (d, J=1.83 Гц, 1 Н) 8.42 (d, J=2.44 Гц, 1 Н) 8.02 (d, J=1.83 Гц, 1 Н) 4.12 (s, 3 Н). Препарат FF. 6-(4-Хлор-1H-имидазол-1-ил)-5-метоксипиридин-3-амин В колбу, содержащую смесь 2-(4-хлор-1H-имидазол-1-ил)-3-метокси-5-нитропиридина (5,0 г, 19,64 ммоль), абсолютный этанол (50 мл) и ледяную уксусную кислоту (20 мл), добавляли железный порошок 325 меш (2,19 г, 39,3 ммоль). К колбе присоединяли обратный холодильник, охлаждаемый водой, и данную гетерогенную смесь нагревали до 100 С при интенсивном перемешивании в течение 30 мин. Реакционную смесь оставляли охлаждаться до комнатной температуры и нейтрализовали путем добавления к охлаждаемому и интенсивно перемешиваемому раствору 5 М NaOH. Полученную смесь выливали в делительную воронку и экстрагировали EtOAc. Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали под вакуумом с получением 6-(4-хлор-1H-имидазол-1-ил)-5 метоксипиридин-3-амина (3,12 г, выход: 71%). ЖХ-МС (М+Н)+ 225,1. 1 Н ЯМР (500 МГц, CDCl3)м.д.: 8.06 (d, J=1.83 Гц, 1 Н) 7.53 (dd, J=13.28, 1.98 Гц, 2 Н) 6.70 (d, J=2.44 Гц, 1 Н) 3.90 (s, 3 Н) 3.86 (br. s., 2 Н). Препарат FFF. 2-Фтор-5-метокси-4-(3-метил-1 Н-1,2,4-триазол-1-ил)анилин Смесь 3-метил-1H-1,2,4-триазола (2,20 г, 26,4 ммоль), 1,5-дифтор-2-метокси-4-нитробензола (5,00 г,26,4 ммоль) и карбоната калия (3,65 г, 26,4 ммоль) в безводном ДМСО (50 мл) нагревали в течение 24 ч при 80 С. Реакционную смесь оставляли охлаждаться до комнатной температуры и вливали в смесь воды (500 мл) и солевого раствора (10 мл). Полученную водную смесь экстрагировали EtOAc (2250 мл). Объединенные органические экстракты промывали водой (500 мл), сушили над сульфатом натрия, фильтровали и концентрировали под вакуумом. Неочищенную реакционную смесь очищали путем колоночной хроматографии на силикагеле (50% EtOAc/гексан) с получением 1-(5-фтор-2-метокси-4 нитрофенил)-3-метил-1H-1,2,4-триазола (1,24 г, выход: 18%). ЖХ-МС (М+Н)+ = 253,2. 1 Н ЯМР (500 МГц,CDCl3)м.д.: 8.95 (s, 1 Н) 8.00 (d, J=11.60 Гц, 1 Н) 7.80 (d, J=6.10 Гц, 1 Н) 4.09 (s, 3 Н) 2.50 (s, 3 Н). Препарат FFF. 2-Фтор-5-метокси-4-(3-метил-1H-1,2,4-триазол-1-ил)анилин К охлаждаемому в бане с ледяной водой раствору 1 -(5-фтор-2-метокси-4-нитрофенил)-3-метил-1H1,2,4-триазола (1,24 г, 4,92 ммоль) в метаноле (100 мл) добавляли в атмосфере азота 10% палладий на углероде (0,523 г, 4,92 ммоль). Колбу несколько раз обезгаживали и продували газообразным водородом(из двухслойного баллона). Полученную смесь оставляли нагреваться до комнатной температуры и затем оставляли перемешиваться в течение 18 ч в атмосфере водорода. Затем сосуд продували газообразным азотом. Неочищенную реакционную смесь фильтровали через короткую пробку диатомовой земли(Celite ). Реакционный сосуд и пробку промывали новой порцией метанола. Объединенные фильтраты концентрировали под вакуумом. Остаток сушили в условиях глубокого вакуума в течение ночи с получением 2-фтор-5-метокси-4-(3-метил-1H-1,2,4-триазол-1-ил)анилина (1,05 г, выход: 96%) в виде серого твердого вещества. ЖХ-МС (М+Н)+ 223,1. 1 Н ЯМР (500 МГц, CDCl3)м.д.: 8.46 (s, 1H) 7.39 (d, J=11.29 Гц, 1 Н) 6.44 (d, J=7.63 Гц, 1 Н) 3.89 (br. s., 2 Н) 3.83 (s, 3 Н) 2.47 (s, 3 Н). Препарат G. 2,4-Дихлор-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин К раствору 3,0 М раствора бромида фенилмагния в диэтиловом эфире (49,7 мл, 149 ммоль) добавляли ТГФ (300 мл). Раствор охлаждали до 0 С, и затем добавляли циклопентанон (13,23 мл, 149 ммоль). Данную реакционную смесь перемешивали в течение 30 мин, при комнатной температуре, затем - в течение 2 ч при температуре дефлегмации. Добавляли лед (20 г) и затем 6 н. HCl, пока не растворялся осадок. Продукт экстрагировали диэтиловым эфиром. Объединенные эфирные слои промывали насыщенным раствором бикарбоната натрия, сушили над безводным сульфатом магния и фильтровали. Растворитель удаляли под вакуумом, и остаток очищали путем колоночной хроматографии на силикагеле с получением циклопентенилбензола (21,49 г, 149 ммоль, выход: 100%) в виде бесцветного масла. ЖХ-МС Смесь 30% перекиси водорода (23 мл, 149 ммоль) и 85% муравьиной кислоты (100 мл, 2619 ммоль) нагревали при 40 С в течение 15 мин. Смесь осторожно добавляли к циклопентенилбензолу (21,49 г, 149 ммоль), и полученную двухфазную систему интенсивно перемешивали в течение 4 ч при комнатной температуре. В начале перемешивания реакция сопровождалась выделением тепла. В конце перемешивания раствор становился гомогенным. Реакционную смесь осторожно гасили путем добавления насыщенного водного раствора бикарбоната натрия. Продукт экстрагировали диэтиловым эфиром. Объединенные эфирные слои сушили над безводным сульфатом магния и фильтровали. Растворитель удаляли под вакуумом, и полученный продукт очищали путем колоночной хроматографии на силикагеле с выходом 2 фенилциклопентанона (19,995 г, 125 ммоль, выход: 84%) в виде коричневого масла. ЖХ-МС (М+Н)+ = 161,0. 1 Н ЯМР (500 МГц, CDCl3)м.д.: 7.38 (1H, t, J=7.3 Гц), 7.30-7.35 (2 Н, m), 7.19 (2 Н, d, J=7.3 Гц),3.28-3.37 (1H, m), 2.71 (1 Н, td, J=4.6, 2.7 Гц), 2.58-2.63 (1 Н, m), 2.43-2.55 (1H, m), 2.29 (1 Н, ddd, J=19.0,10.5, 9.0 Гц), 2.07-2.21 (1H, m), 1.88 -1.99 (1 Н,m). Промежуточное соединение G(3). Этил 2-оксо-3-фенилциклопентанкарбоксилат К раствору диизопропиламина (6,62 мл, 46,8 ммоль) в ТГФ (200 мл) при -78 С добавляли 1,6 М раствор н-бутиллития в гексанах (29,3 мл, 46,8 ммоль). Данный раствор перемешивали в течение 30 мин при-78 С и обрабатывали раствором 2-фенилциклопентанона (5 г, 31,2 ммоль) в сухом ТГФ (50 мл). После перемешивания в течение 30 мин при -78 С к реакционной смеси добавляли цианмуравьиной кислоты этиловый эфир (3,36 мл, 34,3 ммоль). Полученный раствор нагревали до 25 С с перемешиванием в течение 3 ч. Реакционную смесь гасили путем добавления 10 мл воды, промывали солевым раствором, сушили над безводным сульфатом натрия, концентрировали под вакуумом и очищали путем колоночной хроматографии на силикагеле с получением этил 2-оксо-3-фенилциклопентанкарбоксилата (5,3 г, 22,82 ммоль, выход: 73%) в виде бесцветного масла. ЖХ-МС (М+K)+ = 273,2. 1 Н ЯМР (500 МГц, CDCl3)м.д.: 7.32-7.39 (2 Н, m), 7.25-7.31 (1H, m), 7.19-7.25 (2 Н, m), 4.18-4.32 (2 Н, m), 3.29-3.55 (2 Н, m), 1.87-2.62 (4 Н,m), 1.28-1.39 (3 Н, m). Промежуточное соединение G(4). 2-Амино-7-фенил-6,7-дигидроциклопента[е][1,3]оксазин-4(5H)он 2-Метил-2-тиопсевдомочевины сульфат (1,336 г, 9,61 ммоль) растворяли в воде, (10 мл) и добавляли KOH (1,128 г, 20,10 ммоль). Добавляли при перемешивании этил 2-оксо-3-фенилциклопентанкарбоксилат (2,03 г, 8,74 ммоль), и данную реакционную смесь перемешивали в течение ночи при комнатной температуре. Реакционную смесь фильтровали, промывали водой и диэтиловым эфиром и сушили над безводным сульфатом натрия с получением 2-амино-7-фенил-6,7-дигидроциклопента[е][1,3]оксазин-4(5H)-она (1,22 г, 5,35 ммоль, выход: 61,2%) в виде белого твердого вещества. ЖХ-МС 2-Амино-7-фенил-6,7-дигидроциклопента[е][1,3]оксазин-4(5H)-он (900 мг, 3,94 ммоль) растворяли при перемешивании в 3 М водном растворе хлористого водорода (32 мл, 96 ммоль). Данную смесь нагревали в течение 1 ч при температуре дефлегмации. Затем реакционную смесь охлаждали и экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором бикарбоната натрия и солевым раствором, сушили над безводным сульфатом натрия, концентрировали под вакуумом и очищали путем колоночной хроматографии на силикагеле с получением 7-фенил-6,7-дигидроциклопента(1 Н, t, J=7.6 Гц), 2.82-2.91 (1 Н, m), 2.61-2.79 (2 Н, m), 2.11-2.21 (1H, m), или раствор 2 фенилциклопентанона (19,995 г, 125 ммоль) и N-(хлоркарбонил)изоцианата (23,70 г, 225 ммоль) перемешивали в течение 1 ч при 58 С и в течение 45 мин при 130 С. Полученную смолистую реакционную смесь растворяли в этилацетате и нейтрализовали насыщенным водным раствором бикарбоната натрия. Органический слой сушили над безводным сульфатом магния и фильтровали. Продукт очищали путем колоночной хроматографии на силикагеле с получением 7-фенил-6,7-дигидроциклопента [е][1,3]оксазин 2,4(3H,5H)-диона (3,751 г, 16,36 ммоль, выход: 13%) в виде коричневатого твердого вещества. ЖХ-МС Раствор 7-фенил-6,7-дигидроциклопента[е][1,3]оксазин-2,4(3H,5H)-диона (3,751 г, 16,36 ммоль) в концентрированном водном растворе аммиака (80 мл, 16,36 ммоль) нагревали в сосуде высокого давления объемом 350 мл в течение 5 ч. Растворитель удаляли под вакуумом с получением 7-фенил-6,7 дигидро-1H-циклопента[d]пиримидин-2,4(3H,5H)-диона (3,73 г, 16,34 ммоль, выход: 100%) в виде коричневого твердого вещества. ЖХ-МС (М+Н)+ = 229,1. 1 Н ЯМР (500 МГц, диметилсульфоксид-d6)м.д.: 7.34 (2 Н, t,J=7.5 Гц), 7.26 (1H, t,J=7.3 Гц), 7.18 (2 Н, d, J=7.3 Гц), 5.39 (1 Н, br s), 4.14 (1H, d,J=7.3 Гц), 2.432.68 (2 Н, m), 1.80-1.88 (2 Н, m). Препарат G. 2,4-Дихлор-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин Раствор 7-фенил-6,7-дигидро-1H-циклопента[d]пиримидин-2,4(3H,5H)-диона (1,241 г, 5,44 ммоль) в оксихлориде фосфора (14,93 мл, 163 ммоль) нагревали в микроволновой печи при 110 С в течение 1 ч. Когда лед растаял, продукт экстрагировали дихлорметаном. Объединенные органические экстракты сушили над безводным сульфатом магния и фильтровали. Растворитель удаляли под вакуумом, и остаток очищали путем колоночной хроматографии на силикагеле с получением 2,4-дихлор-7-фенил-6,7 дигидро-5H-циклопента[d]пиримидина (3,132 г, 72%) в виде светло-коричневого твердого вещества. ЖХМС (М+Н)+ = 265,0. 1 Н ЯМР (500 МГц, CDCl3)м.д.: 7.31-7.37 (2 Н, m), 7.27 (1H, d, J=7.0 Гц), 7.15 (2 Н, d,J=7.9 Гц), 4.44 (1H, t, J=8.2 Гц), 3.09-3.18 (1H, m), 2.97-3.06 (1 Н, m), 2.73 (1 Н, ddd, J=9.0, 4.7, 4.6 Гц), 2.26 К раствору 2,4-дихлор-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидина (препарат G) (395 мг,1,49 ммоль) в ТГФ (3700 мкл), добавляли 2 М MeNH2 в ТГФ (3700 мкл, 7,45 ммоль). Данную реакционную смесь оставляли перемешиваться при комнатной температуре. Когда реакция завершалась, удаляли растворитель и остаток наносили на силикагель. Элюировали смесью EtOAc/Hex с получением желаемо- 27020322 го 2-хлор-N-метил-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-4-амина (80,8 мг, 0,220 ммоль,выход: 69,1%). ЖХ-МС (М+Н)+ = 260,1. 1 Н ЯМР (500 МГц, CDCl3)м.д.: 7.07 (3 Н, dd, J=8.5, 5.5 Гц), 6.96 Раствор 2,4-дихлор-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидина (200 мг, 0,754 ммоль) и избыточного количества диметиламина (3,77 мл, 7,54 ммоль) в МеОН (2 мл) перемешивали в течение 1 ч при комнатной температуре. Растворитель удаляли под вакуумом с получением 2-хлор-N,N-диметил-7 фенил-6,7-дигидро-5H-циклопента[d]пиримидин-4-амина (207 мг, 0,756 ммоль, выход: 100%). ЖХ-МС Раствор 2,4-дихлор-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидина (150 мг, 0,566 ммоль) и избыточного количества N-метилэтанамина (0,486 мл, 5,66 ммоль) в МеОН (2 мл) перемешивали в течение 1 ч при комнатной температуре. Растворитель удаляли под вакуумом с получением 2-хлор-N-этил-Nметил-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-4-амина (163 мг, 0,566 ммоль, выход: 100%). ЖХ-МС (М+Н)+ = 288,2. Препарат Gd. 4-(Азетидин-1-ил)-2-хлор-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин Раствор 2,4-дихлор-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидина (150 мг, 0,566 ммоль) и избыточного количества азетидина (162 мг, 2,83 ммоль) в метаноле (1 мл) перемешивали в течение 30 мин при комнатной температуре. Растворитель удаляли под вакуумом с получением 4-(азетидин-1-ил)-2 хлор-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидина (162 мг, 0,567 ммоль, выход: 100%). ЖХ-МС(N,N-диизопропилэтиламин) (0,432 мл, 2,472 ммоль). Данную реакционную смесь перемешивали в течение ночи при комнатной температуре. Растворитель удаляли под вакуумом, и остаток очищали путем колоночной хроматографии на силикагеле с получением 2-хлор-N-тридейтерометил-7-фенил-6,7 дигидро-5H-циклопента[d]пиримидин-4-амина в виде коричневого масла. ЖХ-МС (М+Н)+ = 281,2. Препарат Gf. 2-Хлор-N-циклопропил-7-фенил-6,7-дигидро-5H-циклопента[dпиримидин-4-аминNMP (N-метилпирролидиноне) (2 мл) добавляли по каплям циклопропанамин (110 мг, 1,924 ммоль). Данную смесь перемешивали в течение 3 ч при комнатной температуре. Полученный продукт осаждали путем добавления 8 мл воды. Твердое вещество отфильтровывали и сушили на воздухе с получением- 28020322 неочищенного 2-хлор-N-циклопропил-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-4-амина (175 мг, 0,612 ммоль, выход: 96%), который использовали на следующей стадии без какой-либо очистки. ЖХМС (М+Н)+ = 286,1 Препарат Gg. 2-Хлор-N-циклобутил-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-4-аминNMP (2 мл) добавляли по каплям циклобутанамин (129 мг, 1,81 ммоль). Данную смесь перемешивали в течение 3 ч при комнатной температуре. Полученный продукт осаждали путем добавления 8 мл воды. Твердое вещество отфильтровывали и сушили на воздухе с получением неочищенного 2-хлор-Nциклобутил-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-4-амина (177 мг, 0,57 ммоль, выход: 94%), который использовали на следующей стадии без какой-либо очистки. ЖХ-МС (М+Н)+ = 300,1. Препарат Gh. 2-Хлор-7-фенил-N-изопропил-6,7-дигидро-5H-циклопента[d]пиримидин-4-аминNMP (2 мл) добавляли по каплям пропан-2-амин (115 мг, 1,95 ммоль). Данную смесь перемешивали в течение 3 ч при комнатной температуре. Полученный продукт осаждали путем добавления 8 мл воды. Твердое вещество отфильтровывали, сушили на воздухе и очищали с помощью Biotage (12 г, гексаны 70% EtOAc) с получением 2-хлор-N-изопропил-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин-4 амина (154 мг, 0,535 ммоль, выход: 82%). 1 Н ЯМР (500 МГц, CDCl3)м.д.: 7.30 (2 Н, t, J=7.5 Гц), 7.207.25 (1 Н, m), 7.15 (1 Н, d, J=1.5 Гц), 7.13 (1 Н, s), 4.53 (1 Н, d, J=7.3 Гц), 4.37-4.45 (1 Н, m), 4.23-4.28 (1 Н,m), 2.58-2.78 (3 Н, m), 2.10-2.17 (1 Н, m), 1.27-1.29 (6 Н, m). Препарат Gi. 2-Хлор-4-(3-хлоразетидин-1-ил)-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин Смесь 3-хлоразетидина, HCl (217 мг, 1,697 ммоль), 2,4-дихлор-7-фенил-6,7-дигидро-5Hциклопента[d]пиримидина (150 мг, 0,566 ммоль) и DIEA (N,N-диизопропилэтиламин) (0,395 мл, 2,263 ммоль) в N-метил-2-пирролидиноне (2,0 мл) перемешивали в течение 3 ч при комнатной температуре. К данной реакционной смеси добавляли воду (8 мл). Выпавший в осадок продукт отфильтровали, промывали водой и сушили на воздухе. ЖХ-МС (М+Н)+ = 320,0. 1 Н ЯМР (500 МГц, ХЛОРОФОРМ-d)м.д.: 7.21-7.39 (m, 3 Н) 7.14 (d, J=7.02 Гц, 2 Н) 4.65-4.84 (m, 3 Н) 4.34-4.48 (m, 2 Н) 4.23 (dd, J=9.16, 6.41 Гц, 1 Н) 3.00 (dd, J=8.85, 5.80 Гц, 1 Н) 2.83-2.93 (m, 1 Н) 2.54-2.72 (m, 1 Н) 2.02-2.20 (m, 1 Н). Препарат Gj. 2-Хлор-4-(3-фторазетидин-1-ил)-7-фенил-6,7-дигидро-5H-циклопента[d]пиримидин Указанное в заголовке соединение получали в результате взаимодействия 3-фторазетидина и препарата G, в соответствии с методикой, использованной для синтеза препарата Gi. ЖХ-МС (М+Н)+ = 304,1. 1 Н ЯМР (500 МГц, ХЛОРОФОРМ-d)м.д.: 7.19-7.37 (m, 3 Н) 7.15 (d, J=7.32 Гц, 2 Н) 5.39-5.52 (m,1 Н) 4.59 (dddd, J=14.88, 10.15, 5.19, 4.88 Гц, 2 Н) 4.30-4.50 (m, 2 Н) 4.23 (dd, J=9.00, 6.26 Гц, 1 Н) 2.963.07 (m, 1 Н) 2.84-2.96 (m, 1 Н) 2.56-2.70 (m, 1 Н) 2.05-2.21 (m, 1 Н). Препарат Gk. 2-Хлор-4-(3-метоксиазетидин-1-ил)-7-фенил-6,7-дигидро-5H-циклопента[d] пиримидин
МПК / Метки
МПК: C07D 239/70, C07D 413/14, C07D 417/12, C07D 401/12, C07D 471/04, A61K 31/517, C07D 407/12, A61K 31/5377, A61K 31/519, C07D 401/14, C07D 403/12, C07D 491/113, C07D 403/14, C07D 491/052, C07D 491/08
Метки: продукции, уменьшения, соединения, бета-амилоида
Код ссылки
<a href="https://eas.patents.su/30-20322-soedineniya-dlya-umensheniya-produkcii-beta-amiloida.html" rel="bookmark" title="База патентов Евразийского Союза">Соединения для уменьшения продукции β-амилоида</a>
Предыдущий патент: Чувствительный элемент датчика
Следующий патент: Способ получения углеродного энтеросорбента
Случайный патент: Упаковка с дозированной формой тестостеронового геля для лечения гипогонадизма и способ её получения












