Новые гетероциклические соединения в качестве антагонистов метаботропных глутаматных рецепторов 5-го подтипа (мглу5)
Номер патента: 18328
Опубликовано: 30.07.2013
Авторы: Леонарди Амедео, Рива Карло, Грацьяни Давид, Мотта Гьянни, Поггеси Елена, Лонги Маттео Марко
Формула / Реферат
1. Соединение, имеющее общую формулу I
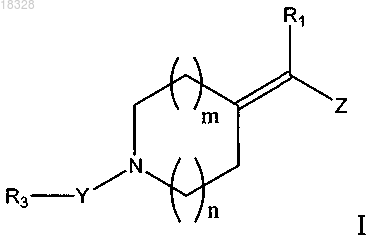
в которой Z обозначает группу формулы -CºC-R2 или -CH=CH-R2;
R1 обозначает атом водорода или галогена или C1-С6алкильную группу;
R2 обозначает выборочно замещенную моно- или бициклическую С2-С9гетероциклическую группу, содержащую от 1 до 3 гетероатомов, выбранных из азота, кислорода и серы,
выборочно замещенную фенильную группу,
выборочно замещенную С1-С6алкильную группу,
выборочно замещенную С2-С6алкенильную группу либо
выборочно замещенную С3-С6циклоалкильную группу, или
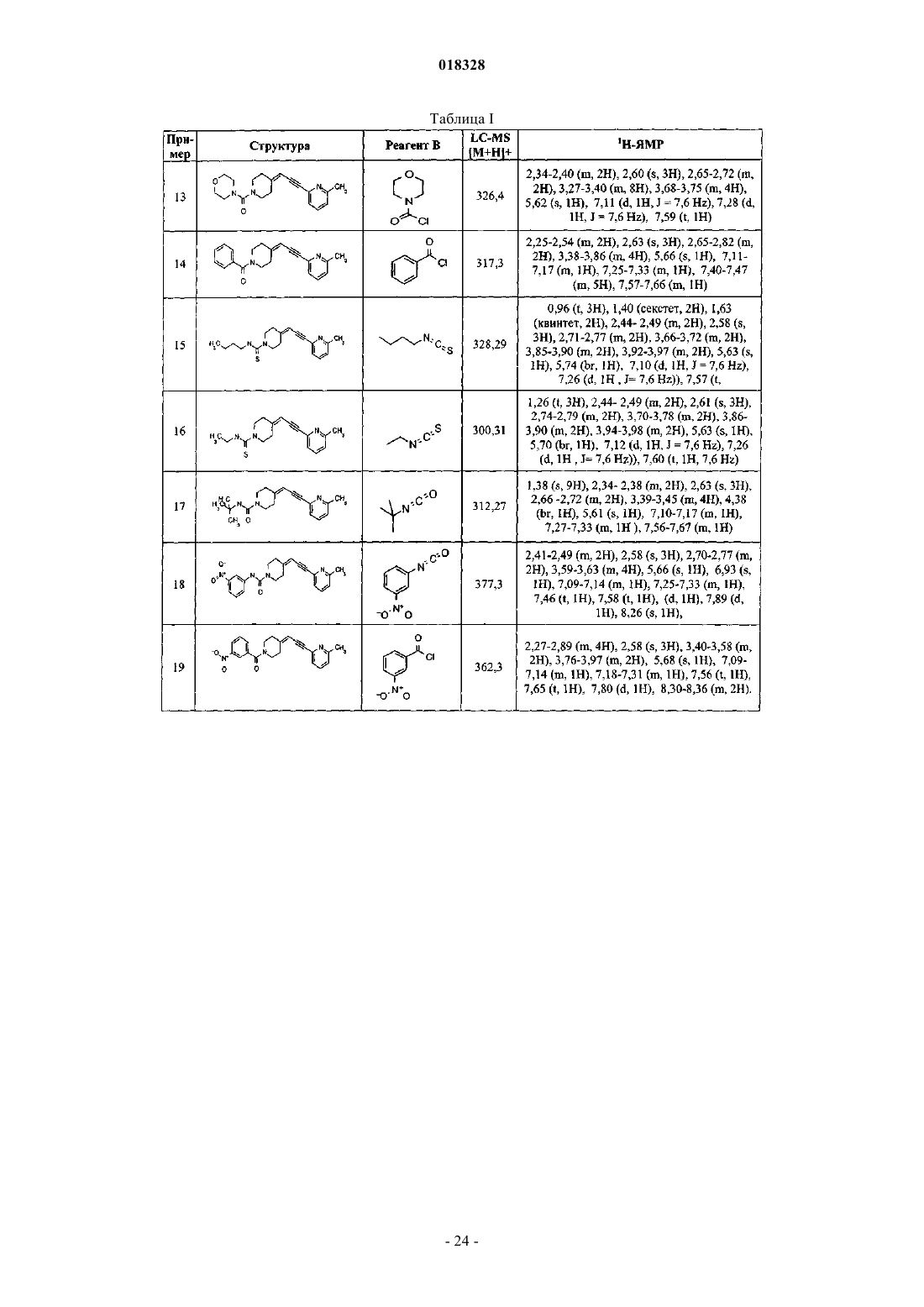
R2 обозначает группу -C(O)-R2A, в которой R2A определен как R2 выше;
R3 обозначает атом водорода,
выборочно замещенную C1-С6алкильную группу,
выборочно замещенную моно-, би- или трициклическую С2-С14гетероциклическую группу, содержащую от 1 до 3 гетероатомов, выбранных из азота, кислорода и серы,
выборочно замещенную моноциклическую С6 арильную группу,
выборочно замещенную С3-С6циклоалкильную группу, либо
выборочно замещенную C3-С6циклоалкенильную группу,
заместители для каждой выборочно замещенной группы представляют собой
атом галогена или оксо, нитро, циано, карбомоильную, C1-С6алкилкарбонильную или C1-С6алкилкарбонил-(C1-С6)алкильную группу, либо группу формулы -NR*R*, в которой каждый R* независимо обозначает атом водорода или C1-С6алкильную группу, либо
C1-С6алкильную или C1-С6алкоксигруппу, каждая из которых может выборочно иметь от 1 до 8 независимо выбранных гало, циано, гидрокси или фенильных заместителей,
С3-C9 моно- или бициклоалкильную группу, выборочно содержащую от 1 до 3 независимо выбранных C1-С6алкильных, оксо, гало, циано, нитро, амино, гидрокси или фенильных заместителей, или
группу формулы -А, -О-А, -(CH2)q-A, или -C(O)NR**-A,
в которой А обозначает фенильную группу или С2-С8гетероциклическую группу, содержащую от 1 до 3 гетероатомов, выбранных из азота, кислорода и серы, при этом каждая из групп А может выборочно содержать от 1 до 3 независимо выбранных гало, нитро и C1-С6алкильных и C1-С6алкокси заместителей,
каждый R** независимо обозначает атом водорода или C1-С6алкильную группу, и
q обозначает 0 или является целым числом от 1 до 6;
при условии, что если Z обозначает группу формулы -СН=СН-R2, то R1 обозначает атом водорода и "оксо" и "гидрокси" исключаются из выборочных заместителей,
или энантиомер, диастереомер, N-оксид или их фармацевтически приемлемая соль.
2. Соединение по п.1, в котором Z обозначает группу формулы -CºC-R2, в которой R2 определен в п.1.
3. Соединение по п.2, в котором R1 обозначает атом водорода или фтора или метильную группу.
4. Соединение по любому из предшествующих пунктов, в котором m составляет 1 и n составляет 1.
5. Соединение по одному из предшествующих пунктов, в котором R2 обозначает выборочно замещенную пирролидинильную, тиазолильную, пиридильную, хинолильную, хиноксалинильную или фенильную группу, при этом заместителями для каждой выборочно замещенной группы являются атом фтора, хлора или брома, либо оксо, нитро, циано, цианометильная, ацетильная, метильная, метокси, этокси, изопропокси, трифторметильная, трифторметокси, ацетоамино, 2,2-диметилпропаноиламино, 3,3-диметил-2-оксо-1-азетидинильная, 1-пирролидинилметильная, 1Н-пиразол-1-ил, 3-метил-1,2,4-оксадиазол-5-ил или морфолиногруппа.
6. Соединение по п.5, в котором R2 обозначает пиридильную или фенильную группу, замещенную атомом фтора и(или) метильную группу, при этом дополнительные заместители являются произвольными.
7. Соединение по п.5, в котором R2 обозначает 6-метил-2-пиридильную, 5-циано-2-пиридильную, 3-фторфенильную, 2,5-дифторфенильную группу или 3,5-дифторфенильную группу.
8. Соединение по любому из предшествующих пунктов, в котором R3 обозначает
C1-С6алкильную группу, замещенную выборочно замещенной группой А,
выборочно замещенную моно- или бициклическую C2-С9гетероциклическую группу, содержащую от 1 до 3 гетероатомов, выбранных из азота, кислорода и серы,
выборочно замещенную фенильную группу,
выборочно замещенную С3-С6циклоалкильную группу или
выборочно замещенную C3-С6циклоалкенильную группу.
9. Соединение по п.8, в котором R3 обозначает моно- или бициклическую C2-С9гетероциклическую группу, содержащую от 1 до 3 гетероатомов, выбранных из азота, кислорода и серы, и, как минимум, 2 смежных атома углерода, первый из которых связан с атомом азота проиллюстрированного содержащего азот кольца (при этом Y отсутствует) и второй из которых несет циано или нитрозаместитель, при этом дополнительные заместители являются произвольными.
10. Соединение по п.8, в котором R3 обозначает выборочно замещенную пирролидинильную, пиразолильную, имидазолильную, 1,2,4-триазолильную, изоксазолильную, фурильную, тиэнильную, пиридильную, пиперидильную, пиразинильную, пиримидинильную, морфолинильную, имидазо[2,1-b]тиазолильную, индолильную, изоиндолильную, имидазо[1,2-а]пиридильную, 1,2,3-бензатриазолильную, хинолильную, изохинолильную, хиноксалинильную, пиридо[2,3-b]пиразинильную, 1,4-бензоксазинильную или фенильную группу, при этом заместителями для каждой выборочной замещенной группы являются атом фтора, хлора, брома или йода, либо метильная, изопропильная, метокси, этокси, пропокси, циано, нитро, трифторметильная, трифторметокси, ацетильная, ацетамино, фенильная, бензилокси, фенилкарбамоильная, 4-фторфенильная, 3-фтор-4-метилфенильная, 2-фурильная, 2-тиэнильная, 4-пиридильная, пиперидино, 2-пиримидинильная, 2-пиримидинилокси, 1,3-тиазол-2-ил, 2-метил-1,3-тиазол-4-ил, 2-оксо-пирролидин-1-ил, 5-метил-1,2,4-оксадиазол-3-ил, 2,5-диметил-1Н-пиррол-1-ил группа.
11. Соединение по п.8, в котором R3 обозначает 6-метил-3-нитро-2-пиридильную, 6-метил-3-циано-2-пиридильную, 4-метокси-3-циано-2-пиридильную, 3-циано-2-тиэнильную или 3-циано-2-пиразинильную группу.
12. Любое из следующих соединений по п.1 или энантиомер, диастереомер, N-оксид или их фармацевтически приемлемую соль, а именно:
1-(3-нитро-2-пиридил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(t-бутоксикарбонил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(2-нитрофенил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(6-метил-3-нитро-2-пиридил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(6-метокси-3-нитро-2-пиридил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(5-метил-2-нитрофенил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(5-метокси-2-нитрофенил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(3-нитро-2-пиридил)-4-[3-(2-пиридил)проп-2-инилиден]пиперидин,
1-(3-нитро-2-пиридил)-4-(3-фенилпроп-2-инилиден)пиперидин,
1-(3-нитро-2-пиридил)-4-[3-(3-пиридил)проп-2-инилиден]пиперидин,
1-фенилкарбамоил-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-морфолинокарбонил-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-бензоил-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(бутиламинотиокарбонил-3-нитро-2-пиридил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(этиламинотиокарбонил-3-нитро-2-пиридил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(1-бутилкарбамоил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(3-нитрофенилкарбамоил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(3-нитробензоил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-этоксикарбонил-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(циклогексиламинотиокарбонил-3-нитро-2-пиридил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(фениламинотиокарбонил-3-нитро-2-пиридил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(1-фенилэтилкарбамоил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-бутирил-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-бутилкарбамоил-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-этилкарбамоил-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-бензил-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-бутил-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(3-нитро-2-пиридил)-4-[3-(4-пиридил)проп-2-инилиден]пиперидин,
1-(3-нитро-2-пиридил)-4-[3-(3-хинолил)проп-2-инилиден]пиперидин,
1-(3-нитро-2-пиридил)-4-[3-(6-морфолино-3-пиридил)проп-2-инилиден]пиперидин,
1-(3-нитро-2-пиридил)-4-[3-(6-фтор-3-пиридил)проп-2-инилиден]пиперидин,
1-(3-нитро-2-пиридил)-4-[3-(6-ацетил-2-пиридил)проп-2-инилиден]пиперидин,
1-(3-нитро-2-пиридил)-4-[3-(6-изопропокси-3-пиридил)проп-2-инилиден]пиперидин,
1-(3-нитро-2-пиридил)-4-[3-(3-метокси-2-пиридил)проп-2-инилиден]пиперидин,
1-фенил-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(2-цианофенил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(4-метокси-2-нитрофенил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(t-бутоксикарбонил)-4-[3-(5-циано-3-пиридил)проп-2-инилиден]пиперидин,
1-(t-бутоксикарбонил)-4-[3-(6-циано-3-пиридил)проп-2-инилиден]пиперидин,
1-(3-нитро-2-пиридил)-4-[3-(5-циано-3-пиридил)проп-2-инилиден]пиперидин,
1-(3-нитро-2-пиридил)-4-[3-(6-циано-3-пиридил)проп-2-инилиден]пиперидин,
1-(1-бутоксикарбонил)-4-[3-(2-метил-1,3-тиазол-4-ил)проп-2-инилиден]пиперидин,
4-[3-(2-метил-1,3-тиазол-4-ил)проп-2-инилиден]пиперидин,
1-(3-нитро-2-пиридил)-4-[3-(2-метил-1,3-тиазол-4-ил)проп-2-инилиден]пиперидин,
1-(4-циано-3,5-дифторфенил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(5-циано-2-метоксифенил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(5-бром-2-циано-3-фторфенил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(4-фтор-2-нитрофенил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(4-циано-2-нитрофенил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-[2-(2,5-диметил-1Н-пиррол-1-ил)-5-пиримидинил]-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(6-хиноксалинил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(2-пиридил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(6-циано-2-пиридил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(4-гидроксиметил-2-нитрофенил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(3-трифторметил-2-пиридил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(6-трифторметил-2-пиридил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(5-трифторметил-2-пиридил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(3-циано-2-пиридил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(t-бутоксикарбонил)-4-[1-фтор-3-фенил-проп-2-инилиден]пиперидин,
1-(3-нитро-2-пиридил)-4-[1-фтор-3-фенил-проп-2-инилиден]пиперидин,
1-(2-метоксиэтоксикарбонил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(2-цианоэтоксикарбонил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-бензилоксикарбонил-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(2-фтор-4-нитрофеноксикарбонил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(2-тиэнилметоксикарбонил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(2-пиридилоксикарбонил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(1-метил-4-пиперидинилоксикарбонил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-[2-(1Н-индол-3-ил)этоксикарбонил]-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(2,2,2-трифтор-1-трифторметил-этоксикарбонил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(2,3,4-трифторфеноксикарбонил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(циклогексилоксикарбонил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(циклобутилметоксикарбонил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(5-бром-2-пиридилоксикарбонил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(3-феноксипропоксикарбонил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(4,6-диметилпиримидинилоксикарбонил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(N-метил-N-фенилкарбамоил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(N,N-диэтилкарбамоил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(N,N-диметилкарбамоил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(N-метил-N-3-нитрофенилкарбамоил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(N-метил-N-бутилкарбамоил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-[N-метил-N-(t-бутил)карбамоил]-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(N-метил-N-этилкарбамоил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-[N-метил-N-(1-фенилэтил)карбамоил]-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(N-этил-N-изопропилкарбамоил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(р-толилсульфонил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(2-нитрофенилсульфонил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-фенилсульфонил-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-[5-(2-оксо-1-пирролидинил)-2-метилфенилсульфонил]-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(4-метоксифенилсульфонил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(4-бром-2,5-дифторфенилсульфонил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-бензилсульфонил-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-этилсульфонил-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(2-хлор-4-цианофенилсульфонил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(3-фторбензилсульфонил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-циклогексилметилсульфонил-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(4-метил-3-нитрофенилсульфонил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(2,2,2-трифторэтилсульфонил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(4-изопропилфенилсульфонил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(4-цианофенилсульфонил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(5-хлор-2-метокси-4-метилфенилсульфонил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(7,7-диметил-2-оксобицикло[2.2.1]гепт-1-илметилсульфонил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-[3-(4-метоксифенокси)пропилсульфонил]-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(3-бромфенилсульфонил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(4-бром-2-фторфенилсульфонил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(6-хлор-имидазо[2,1-b]тиазол-5-илсульфонил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(1,2-диметил-1Н-имидазол-4-илсульфонил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-[4-(1,2,3-тиадиазол-4-ил)фенилсульфонил]-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-[5-(t-бутил)-2-метоксифенилсульфонил]-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(2-нитробензоил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(2-пиразинилкарбонил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(3-бромбензоил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(4-фенил-4-оксобутирил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(3,4,5-триметоксибензоил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(4-нитробензоил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(3-метил-2-нитробензоил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-гептаноил-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(2-тиэнилкарбонил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(4,4,4-трифторбутирил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-[3-(2-пиримидинилокси)бензоил]-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(5-бром-3-пиридилацетил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(5-хинолилкарбонил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-[5-амино-5-оксо-3-(4-хлорфенил)пентаноил]-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(3-фталимидопропионил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(3-хлор-4,5-диметоксибензоил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(2-метокси-3-пиридилкарбонил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-[5-метил-1-(4-фторфенил)-1Н-1,2,4-триазол-3-илкарбонил]-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(3-бромфеноксиацетил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-[3-(5-метил-1,2,4-оксадиазол-3-ил)бензоил]-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-фталимидоацетил-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(5-фтор-1Н-индол-3-илацетил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(2-хлор-6-метокси-4-пиридилкарбонил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(1-метил-1Н-1,2,3-бензотриазол-5-илкарбонил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(2-нитрофеноксиацетил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(2,5-диметил-3-фурилкарбонил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(5-хлор-2-тиэнилкарбонил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(3-йодбензоил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(3,5-дифторфенилацетил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(2,6-диметокси-3-пиридилкарбонил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(2-хлор-6-метил-4-пиридилкарбонил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(5-метокси-1Н-индол-3-илкарбонил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(3,3-диметилбутирил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-метоксиацетил-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(4-метоксибензоил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(3-метоксибензоил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(2-метоксибензоил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(2-метокси-3-пиридилкарбонил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-[1-(4-пиридил)-4-пиперидинилкарбонил]-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-[3(4Н)-оксо-2Н-1,4-бензоксазин-6-илкарбонил]-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-[3-(3-фторфенокси)пропионил]-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(2-пиперидино-5-пиримидинилкарбонил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-[1-(3-фтор-4-метилфенил)-2-оксопирролидин-4-илкарбонил]-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(4-ацетамидо-2-метилбензоил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(3-хлорбензоил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(3-фенилбензоил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(2-фуроил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-фенилацетил-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(4-фенилбутирил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(3-фторбензоил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(3-метилбензоил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(3-цианобензоил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(3-трифторметоксибензоил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(3-трифторметилбензоил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(5-бром-2-фуроил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(5-нитро-2-фуроил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(5-фенил-2-фуроил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(3-хлор-2-тиэнилкарбонил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(4-метил-2-тиэнилкарбонил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(5-метил-2-тиэнилкарбонил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(2,5-дихлор-3-тиэнилкарбонил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(3-фуроил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(5-фенил-3-изоксазолилкарбонил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-[5-(2-тиэнил)-1Н-пиразол-3-ил-карбонил]-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-[5-(2-фурил)-1Н-пиразол-3-ил-карбонил]-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(5-нитро-2-тиэнилкарбонил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-бензилоксибензоил-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(3-метил-2-фуроил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(3-этокси-2-тиэнилкарбонил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(5-ацетил-2-тиэнилкарбонил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(5-фенил-2-тиэнилкарбонил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-[3-(2-метил-1,3-тиазол-4-ил)бензоил]-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(5-хлор-4-метокси-3-тиэнилкарбонил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(5-метилтио-2-тиэнилкарбонил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(3-хлор-4-метил-2-тиэнилкарбонил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-[3-(1,3-тиазол-2-ил)бензоил]-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-[3-(2-пиримидинил)бензоил]-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(3-нитро-2-пиридил)-4-(4-оксо-пент-2-инилиден)пиперидин,
1-(3-нитро-2-пиридил)-4-[4-(4-фторфенил)-4-оксо-бут-2-инилиден]пиперидин,
1-(3-нитро-2-пиридил)-4-(5,5-диметил-4-оксо-гекс-2-инилиден)пиперидин,
1-(3-нитро-2-пиридил)-4-[4-(2-тиэнил)-4-оксо-бут-2-инилиден]пиперидин,
1-(3-нитро-2-пиридил)-4-(4-циклогексил-4-оксо-бут-2-инилиден)пиперидин,
1-(3-нитро-2-пиридил)-4-(5-метил-4-оксо-гекс-5-эн-2-инилиден)пиперидин,
1-(3-нитро-2-пиридил)-4-[3-(3,5-дифтор-4-метоксифенил)проп-2-инилиден]пиперидин,
1-(3-нитро-2-пиридил)-4-[3-(4-циано-3-фторфенил)проп-2-инилиден]пиперидин,
1-(3-нитро-2-пиридил)-4-[3-(5-фтор-2-метоксифенил)проп-2-инилиден]пиперидин,
1-(3-нитро-2-пиридил)-4-[3-(3,5-дифторфенил)проп-2-инилиден]пиперидин,
1-(3-нитро-2-пиридил)-4-[3-(4-цианофенил)проп-2-инилиден]пиперидин,
1-(3-нитро-2-пиридил)-4-{3-[4-(3,3-диметил-2-оксо-1-азетидинил)фенил]проп-2-инилиден}пиперидин,
1-(3-нитро-2-пиридил)-4-{3-[4-(1-пирролидинилметил)фенил]проп-2-инилиден}пиперидин,
1-(3-нитро-2-пиридил)-4-[3-(2,3-диметоксифенил)проп-2-инилиден]пиперидин,
1-(3-нитро-2-пиридил)-4-[3-(3-трифторметилфенил)проп-2-инилиден]пиперидин,
1-(3-нитро-2-пиридил)-4-[3-(3-бромфенил)проп-2-инилиден]пиперидин,
1-(3-нитро-2-пиридил)-4-[3-(3-метилфенил)проп-2-инилиден]пиперидин,
1-(3-нитро-2-пиридил)-4-[3-(3-метоксифенил)проп-2-инилиден]пиперидин,
1-(3-нитро-2-пиридил)-4-[3-(6-хиноксалинил)проп-2-инилиден]пиперидин,
1-(3-нитро-2-пиридил)-4-[3-(3-цианометилфенил)проп-2-инилиден]пиперидин,
1-(3-нитро-2-пиридил)-4-[3-(3-нитрофенил)проп-2-инилиден]пиперидин,
1-(3-нитро-2-пиридил)-4-[3-(3-цианофенил)проп-2-инилиден]пиперидин,
1-(3-нитро-2-пиридил)-4-[3-(3-хлорфенил)проп-2-инилиден]пиперидин,
1-(t-бутоксикарбонил)-4-(гепт-2-инилиден)пиперидин,
1-(3-нитро-2-пиридил)-4-[3-(6-трифторметил-3-пиридил)проп-2-инилиден]пиперидин,
1-(3-нитро-2-пиридил)-4-[3-(2-фтор-6-метил-3-пиридил)проп-2-инилиден]пиперидин,
1-(3-нитро-2-пиридил)-4-[3-(3-бром-2-хлор-4-пиридил)проп-2-инилиден]пиперидин,
1-(3-нитро-2-пиридил)-4-[3-(3-бром-2-фтор-4-пиридил)проп-2-инилиден]пиперидин,
1-(3-нитро-2-пиридил)-4-[3-(3-фтор-4-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(3-нитро-2-пиридил)-4-[3-(5-фтор-3-пиридил)проп-2-инилиден]пиперидин,
1-(3-нитро-2-пиридил)-4-[3-(6-фтор-2-пиридил)проп-2-инилиден]пиперидин,
1-(3-нитро-2-пиридил)-4-[3-(6-изопропокси-3-пиридил)проп-2-инилиден]пиперидин,
1-(3-нитро-2-пиридил)-4-[3-(2-этокси-3-пиридил)проп-2-инилиден]пиперидин,
1-(5-нитро-2-пиридил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(6-метокси-3-нитро-2-пиридил)-4-[3-(3,5-дифторфенил)проп-2-инилиден]пиперидин,
1-(5-бром-2-пиримидинил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(3-метил-5-нитро-2-пиридил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(5-циано-3-метил-2-пиридил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(6-циано-3-пиридил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(4-метил-3-пиридил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(4-изохинолил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(4-метил-5-оксоциклопентенил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(3-нитро-2-тиэнил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(5-нитро-2-фурил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(5-фенилкарбамоил-2-фурил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(2-метил-4-нитро-1Н-5-имидазолил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(t-бутоксикарбонил)-(3Е)-3-[3-(6-метил-2-пиридил)проп-2-инилиден]пирролидин,
1-(3-нитро-2-пиридил)-4-(4-фенил-бут-3-ин-2-илиден)пиперидин,
1-(3-нитро-2-пиридил)-4-[(2Е)-3-фенил-проп-2-энилиден]пиперидин,
1-(3-нитроимидазо[1,2-а]пиридин-2-ил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(3-нитро-2-пиридил)-4-[3-(3-трифторметоксифенил)проп-2-инилиден]пиперидин,
1-(3-нитро-2-пиридил)-4-[3-(2-оксо-1-пирролидинил)проп-2-инилиден]пиперидин,
1-(5-трифторметил-3-пиридил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(3-циано-5-фенил-2-пиридил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(2-пропокси-3-пиридил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(пиридо[2,3-b]пиразин-7-ил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(3-циано-2-тиэнил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(6-этокси-3-пиридил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(3-нитро-2-пиридил)-4-[3-(2,6-дифторфенил)проп-2-инилиден]пиперидин,
1-(3-нитро-2-пиридил)-4-{3-[3-(1H-пиразол-1-илметил)фенил]проп-2-инилиден}пиперидин,
1-(3-нитро-2-пиридил)-4-{3-[2-(2,2-диметилпропиониламино)-3-пиридил]проп-2-инилиден}пиперидин,
1-(3-нитро-2-пиридил)-4-{3-[3-(4-метилпиперазин-1-илметил)фенил]проп-2-инилиден}пиперидин,
1-(3-нитро-2-пиридил)-4-[3-(3-ацетилфенил)проп-2-инилиден]пиперидин,
1-(6-метил-3-нитро-2-пиридил)-4-[3-(4-фтор-2-пиридил)проп-2-инилиден]пиперидин,
1-(6-метил-3-нитро-2-пиридил)-4-[3-(3,5-дифторфенил)проп-2-инилиден]пиперидин,
1-(6-метил-3-нитро-2-пиридил)-4-[3-(3-фторфенил)проп-2-инилиден]пиперидин,
1-(6-метил-3-нитро-2-пиридил)-4-[3-(2-пиридил)проп-2-инилиден]пиперидин,
1-(6-метил-3-нитро-2-пиридил)-4-[3-(6-фтор-2-пиридил)проп-2-инилиден]пиперидин,
1-(6-метил-3-нитро-2-пиридил)-4-[3-(6-фтор-3-пиридил)проп-2-инилиден]пиперидин,
1-(6-метил-3-нитро-2-пиридил)-4-[3-(2-фтор-4-пиридил)проп-2-инилиден]пиперидин,
1-(6-метил-3-нитро-2-пиридил)-4-[3-(5-фтор-3-пиридил)проп-2-инилиден]пиперидин,
1-(6-метил-3-нитро-2-пиридил)-4-[3-(5-циано-3-пиридил)проп-2-инилиден]пиперидин,
1-(6-метил-3-нитро-2-пиридил)-4-[3-(2,5-дифторфенил)проп-2-инилиден]пиперидин,
1-(3-циано-6-метил-2-пиридил)-4-[3-(3,5-дифторфенил)проп-2-инилиден]пиперидин,
1-(3-циано-6-метил-2-пиридил)-4-[3-(3-фторфенил)проп-2-инилиден]пиперидин,
1-(3-циано-6-метил-2-пиридил)-4-[3-(4-пиридил)проп-2-инилиден]пиперидин,
1-(3-циано-6-метил-2-пиридил)-4-[3-(6-фтор-2-пиридил)проп-2-инилиден]пиперидин,
1-(3-циано-6-метил-2-пиридил)-4-[3-(5-циано-3-пиридил)проп-2-инилиден]пиперидин,
1-(3-циано-6-метил-2-пиридил)-4-[3-(2-фтор-4-пиридил)проп-2-инилиден]пиперидин,
1-(3-циано-6-метил-2-пиридил)-4-[3-(2-пиридил)проп-2-инилиден]пиперидин,
1-(3-циано-6-метил-2-пиридил)-4-[3-(2,5-дифторфенил)проп-2-инилиден]пиперидин,
1-(3-циано-6-метил-2-пиридил)-4-[3-(5-циано-2-пиридил)проп-2-инилиден]пиперидин,
1-(3-циано-6-метил-2-пиридил)-4-[3-(6-фтор-3-пиридил)проп-2-инилиден]пиперидин,
1-(3-циано-6-метил-2-пиридил)-4-[3-(5-фтор-3-пиридил)проп-2-инилиден]пиперидин,
1-(3-циано-4-метокси-2-пиридил)-4-[3-(3-фторфенил)проп-2-инилиден]пиперидин,
1-(3-циано-4-метокси-2-пиридил)-4-[3-(3,5-дифторфенил)проп-2-инилиден]пиперидин,
1-(3-циано-4-метокси-2-пиридил)-4-[3-(2,5-дифторфенил)проп-2-инилиден]пиперидин,
1-(3-циано-4-метокси-2-пиридил)-4-[3-(2-пиридил)проп-2-инилиден]пиперидин,
1-(3-циано-4-метокси-2-пиридил)-4-[3-(6-фтор-2-пиридил)проп-2-инилиден]пиперидин,
1-(3-циано-4-метокси-2-пиридил)-4-[3-(6-фтор-3-пиридил)проп-2-инилиден]пиперидин,
1-(3-циано-4-метокси-2-пиридил)-4-[3-(2-фтор-4-пиридил)проп-2-инилиден]пиперидин,
1-(3-циано-4-метокси-2-пиридил)-4-[3-(5-фтор-3-пиридил)проп-2-инилиден]пиперидин,
1-(3-циано-4-метокси-2-пиридил)-4-[3-(5-циано-3-пиридил)проп-2-инилиден]пиперидин,
1-(3-циано-4-метокси-2-пиридил)-4-[3-(5-циано-2-пиридил)проп-2-инилиден]пиперидин,
1-(3-циано-6-метил-2-пиридил)-4-(4-фенил-бут-3-ин-2-илиден)пиперидин,
1-(6-метил-3-нитро-2-пиридил)-4-[3-(6-бром-2-пиридил)проп-2-инилиден]пиперидин,
1-(6-метил-3-нитро-2-пиридил)-4-[3-(3-этоксифенил)проп-2-инилиден]пиперидин,
1-(6-метил-3-нитро-2-пиридил)-4-[3-(3-ацетилфенил)проп-2-инилиден]пиперидин,
1-(6-метил-3-нитро-2-пиридил)-4-[3-(3-ацетамидофенил)проп-2-инилиден]пиперидин,
1-(6-метил-3-нитро-2-пиридил)-4-[3-(3-ацетонилфенил)проп-2-инилиден]пиперидин,
1-(6-метил-3-нитро-2-пиридил)-3-(3Z)-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(6-метил-3-нитро-2-пиридил)-3-(3Е)-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(6-метил-3-нитро-2-пиридил)-4-(4-фенил-бут-3-ин-2-илиден)пиперидин,
1-(1-метил-4-нитро-1Н-имидазол-5-ил)-4-(4-фенил-бут-3-ин-2-илиден)пиперидин,
1-(1-метил-4-нитро-1Н-имидазол-5-ил)-4-[3-(3,5-дифторфенил)проп-2-инилиден]пиперидин,
1-(1-метил-4-нитро-1Н-имидазол-5-ил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(4-нитро-1Н-имидазол-5-ил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин,
1-(3-циано-2-тиэнил)-4-[3-(2,5-дифторфенил)проп-2-инилиден]пиперидин,
1-(6-метил-3-нитро-2-пиридил)-4-{3-[3-(3-метил-1,2,4-оксадиазол-5-ил)фенил]проп-2-инилиден}пиперидин, или
1-(2-циано-3-пиразинил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин.
Текст
НОВЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ АНТАГОНИСТОВ МЕТАБОТРОПНЫХ ГЛУТАМАТНЫХ РЕЦЕПТОРОВ 5-ГО ПОДТИПА (МГЛУ 5)Z обозначает группу формулы -CC-R2 или -CH=CH-R2; m и n равны 0, 1 или 2; Y обозначает связующую группу либо отсутствует; R1 обозначает атом водорода или галогена или C1-С 6 алкильную группу;обозначает произвольную двойную связь; и R1, R2 и R3 выбраны из широкого диапазона выборочно замещенных алкильных, циклоалкильных,арильных и гетероциклических групп. Соединения являются мГлу 5 антагонистами, используемыми при лечении нейромышечной дисфункции нижнего отдела мочевыводящих путей, мигрени и гастроэзофагеальной рефлюксной болезни у животных. Предпочтительными соединениями I являются соединения, имеющие ниже приведенную формулу(71)(73) Заявитель и патентовладелец: РЕКОРДАТИ АЙЕРЛЕНД ЛИМИТЕД (IE) Область техники, к которой относится изобретение Настоящее изобретение относится к новым гетероциклическим соединениям, имеющим избирательное сродство к метаботропным глутаматным рецепторам 5-го подтипа (мГлу 5), и к фармацевтическим композициям, включающим такие соединения. Предпосылки к созданию изобретения Заболевания нижних мочевыводящих путей включают целый ряд синдромов, оказывающих негативное воздействие на нормальное мочеиспускание. Заболевания нижних мочевыводящих путей могут развиться в результате сочетания патологических и (или) возрастных изменений мочеполовой системы или в результате иной этиологии, например неврологических расстройств. Лица, страдающие от заболеваний нижних мочевыводящих путей, сталкиваются с ухудшением качества жизни, включая чувство неловкости, низкую самооценку и общее снижение эмоционального благосостояния, социальной функции и общего состояния здоровья. Более того, заболевания нижних мочевыводящих путей могут быть связаны с иными физическими заболеваниями, в том числе с целлюлитом, пролежневыми язвами, инфекциями мочевыводящих путей, падениями с переломами, депривацией сна, социальной самоизоляцией, депрессией и половой дисфункцией. Лицам старшего возраста, страдающим от заболеваний нижних мочевыводящих путей, может потребоваться больший уход со стороны лиц, обеспечивающих медицинское обслуживание, как членов семьи, так и врачей-специалистов, что может явиться основополагающим фактором для принятия решения относительно помещения пациентов в медицинские учреждения. По оценкам Национального института здравоохранения США до 35 млн американских граждан страдают от заболеваний нижних мочевыводящих путей. В возрасте до 80 лет женщины в большей степени подвержены заболеваниям нижних мочевыводящих путей по сравнению с мужчинами (2:1), а после указанного возраста мужчины и женщины в равной степени подвержены указанным заболеваниям. Частотность заболеваний нижних мочевыводящих путей увеличивается с возрастом. К 65 годам заболевания нижних мочевыводящих путей поражают от 15 до 30% всех лиц и приблизительно 50% лиц, проходящих длительный курс лечения. Для лечения заболеваний нижних мочевыводящих путей использовали лекарственные средства с различными механизмами действия. Указанные лекарственные средства включают препараты, непосредственно воздействующие на нижние мочевыводящие пути, например антимускариновые средства и альфа 1-антагонисты, а также препараты, действующие через центральную нервную систему, например ингибитор обратного захвата серотонина и(или) норадреналина. Тем не менее, по информации Института здравоохранения США, несмотря на достигнутый некоторый прогресс в области диагностирования, купирования и лечения заболеваний нижних мочевыводящих путей, указанные заболевания нередко остаются трудноустранимыми. Таким образом, существует необходимость в усовершенствовании лекарственных средств, рецептур и методов лечения для лечения заболеваний нижних мочевыводящих путей. Глутаминовая кислота - возбуждающая аминокислота - присутствует в синапсах по всей центральной нервной системе и, как известно, воздействует, как минимум, на два типа рецепторов: ионотропные и метаботропные глутаматные рецепторы. Основная функция ионотропных глутаматных рецепторов заключается в том, что их активация образует лиганд-управляемые ионные каналы и, тем самым, прямо опосредует передачу электрических сигналов нервных клеток, приводя к быстрым и относительно большим изменениям проводимости в пост-синаптических мембранах. Метаботропные глутаматные рецепторы (мГлуРц) косвенно регулируют передачу электрических сигналов путем оказания влияния на внутриклеточные метаболические процессы с помощью G-белков. Изменения в пост-синаптической клетке, опосредуемые через мГлуРц в последующем относительно замедляются со временем и не связаны с быстрыми и значительными изменениями невральной мембранной проводимости. Было приведено описание трех подтипов ионотропных глутаматных рецепторов, т.е. NMDA (Nметил-D-аспартат), АМРА (альфа-амино-3-гидрокси-5-метил-4-изоксазол-пропионовая кислота) и каинатные подтипы. Было клонировано восемь подтипов метаботропных глутаматных рецепторов. Подтипы классифицируются на три группы на основе сходств последовательности и фармакологических и биохимических свойств (Spooren et al., Trends Pharmacol. Sci. 22: 331-337, 2001): мГлу рецепторы группы I (мГлу 1 и мГлу 5), мГлу рецепторы группы II (мГлу 2 и мГлу 3) и мГлу рецепторы группы III (мГлу 4, мГлу 6, мГлу 7 и мГлу 8). Как известно, мГлу 5 рецептор группы I (либо человека, либо крысы) включает, как минимум, два подтипа "а" и "b". Подтип "b" длиннее, чем подтип "а" ввиду альтернативного сплайсинга удлинения 32 аминокислотных остатков в С-концевом (внутриклеточном) домене, 50 остатков от начала домена. Длина мГлу 5b человека составляет 1212 аминокислотных остатков, в то время как в форме "а" отсутствуют аминокислотные остатки с 877 по 908 (номер 828 является первым внутриклеточного домена). Длина мГлу 5b крысы составляет 1203 аминокислотных остатков, в то время как в форме "а" отсутствуют аминокислотные остатки с 876 по 907 (номер 827 является первым внутриклеточного домена). (Hermans и двумя четкими топологическими доменами: большим внутриклеточным N-концевым доменом "венерина мухоловка", ответственным за связывание агониста, и 7-ТМ доменом в сочетании с внутриклеточным Сконцевым доменом, участвующим в активации рецептора и связывании G-белка. Как было показано, 7-ТМ домен мГлу 1 рецепторов образует связывающий "карман" для положительных и отрицательных аллостерических модуляторов; отрицательные аллостерические модуляторы были определены благодаря высокопроизводительным технологиям скрининга, и они действуют в качестве неконкурентных антагонистов, не оказывающих воздействия на связывание агонистов. Наиболее интересным свойством указанных молекул дополнительно к их высокой потенции является их примечательная селективность подтипа. 7-ТМ связывающая область расположена в кармане, покрытом ТМ-III, TM-V, TM-VI и TM-VII; указанный сайт соответствует ретинальному связывающему "карману" в родопсине. Аллостерические модуляторы мГлу 5 представляют собой поразительный прогресс, демонстрирующий возможности развития новых исследовательских инструментов и терапевтических лекарственных средств, обеспечивающих регулирование активности специфических подтипов мГлуР. Во всех случаях соединения настоящего изобретения указываются как мГлу 5 антагонисты, но фактически они представляют собой отрицательные аллостерические модуляторы, действующие в 7-ТМ связывающей области. В заявке WO 00/63166 приведено описание трициклических производных карбаминовой кислоты,используемых для лечения различных заболеваний, в том числе недержания мочи. В соответствии с описанием производные представляют собой агонисты или антагонисты мГлу рецепторов группы I со специфичностью к мГлу 1 рецептору. В заявке WO 01/32632 приведено описание производных пиримидина, используемых для лечения различных заболеваний, в том числе недержания мочи. В соответствии с описанием производные представляют собой селективные антагонисты мГлу 1 рецептора, обладающего, как минимум, 10-кратной селективностью к мГлу 1 рецептору по сравнению с мГлу 5 рецептором. В заявке WO 01/27070 приведено описание бисарилацетамидов, используемых для лечения недержания мочи помимо иных состояний. Описываемые молекулы представляют собой агонисты или антагонисты, обладающие селективностью по отношению к мГлу 1 рецептору. В патенте США 6369222 приведено описание производных гетероциклоазепинил пиримидина,используемых для лечения недержания мочи помимо иных состояний. Описываемые производные представляют собой антагонисты мГлу 1 рецептора. Таким образом, в вышеприведенных заявках и патенте раскрываются антагонисты мГлу 1 рецептора в качестве приемлемых средств для лечения недержания мочи. Тем не менее, ни в одном из документов,на которые дается ссылка, не приведено экспериментальное подтверждение лечения недержания мочи либо у человеческих пациентов, либо в животной модели болезни нижних отделов мочевыводящих путей. Нами были приведены испытания интенсивности действия селективных мГлу 1 и селективных мГлу 5 антагонистов в крысиной модели, используемой для обнаружения действия на нижние мочевыводящие пути. Неожиданно была обнаружена хорошая активность в отношении антагонистов селективных к мГлу 5 рецептору, в то время как два промышленно выпускаемых антагониста, селективных к мГлу 1 рецептору, не вызвали какого-либо эффекта. Антагонист, селективный к мГлуР рецепторам группы II,также не проявил способности вызвать эффект в крысиной модели. Учитывая указанные результаты,селективные мГлу 5 антагонисты могут являться эффективным средством для лечения заболеваний нижних отделов мочевыводящих путей. Таким образом, настоящие изобретатели неожиданно обнаружили, что введение отрицательных аллостерических модуляторов глутаматного мГлу 5 рецептора, называемого в настоящем документе мГлу 5 антагонистами, обеспечивает мощное ингибирование рефлекса мочеиспускания. Следовательно, указанные модуляторы являются полезными для лечения заболеваний нижних отделов мочевыводящих путей и их симптомов (Международная заявка на патент WO 04/067002 (Recordati. Описание изобретения Настоящее изобретение предусматривает создание соединений, имеющих общую формулу IZ обозначает группу формулы -CC-R2 или -CH=CH-R2;R1 обозначает атом водорода или галогена или C1-C6 алкильную группу;R2 обозначает выборочно замещенную моно- или бициклическую С 2-С 9 гетероциклическую группу, содержащую от 1 до 3 гетероатомов, выбранных из азота, кислорода и серы,выборочно замещенную фенильную группу,выборочно замещенную C1-C6 алкильную группу,выборочно замещенную C2-C6 алкенильную группу, либо выборочно замещенную C3-C6 циклоалкильную группу,или R2 обозначает группу -C(O)-R2A, в которой R2A определен как R2 выше;R3 обозначает атом водорода,выборочно замещенную C1-C6 алкильную группу,выборочно замещенную моно-, би- или трициклическую С 2-С 14 гетероциклическую группу, содержащую от 1 до 3 гетероатомов, выбранных из азота, кислорода и серы,выборочно замещенную моноциклическую С 6 арильную группу,выборочно замещенную С 3-С 6 циклоалкильную группу, либо выборочно замещенную С 3-С 6 циклоалкенильную группу,Y обозначает группу формулы -С(О)-, -NH-C(O)-, -N(C1-C6 алкил)-С(О)-, -О-С(О)-, -NH-C(S)- илиm и n равны 0, 1 или 2; заместители для каждой выборочно замещенной группы представляют собой атом галогена или оксо, нитро, циано, карбомоильную, C1-C6 алкилкарбонильную или С 1-С 6 алкилкарбонил-(С 1-С 6)алкильную группу, либо группу формулы -NRR, в которой каждый R независимо обозначает атом водорода илиC1-C6 алкильную или C1-C6 алкоксигруппу, каждая из которых может выборочно иметь от 1 до 8 независимо выбранных гало, циано, гидрокси или фенильных заместителей,С 3-С 9 моно- или бициклоалкильную группу, выборочно содержащую от 1 до 3 независимо выбранных C1-C6 алкильных, оксо, гало, циано, нитро, амино, гидрокси или фенильных заместителей, или группу формулы -А, -О-А, -(CH2)q-A, или -C(O)NR-A,в которой А обозначает фенильную группу или C2-C8 гетероциклическую группу, содержащую от 1 до 3 гетероатомов, выбранных из азота, кислорода и серы, при этом каждая из групп А может выборочно содержать от 1 до 3 независимо выбранных гало, нитро и C1C6 алкильных и C1-C6 алкоксизаместителей,каждый R независимо обозначает атом водорода или C1-C6 алкильную группу, иq обозначает 0 или является целым числом от 1 до 6; при условии, что если Z обозначает группу формулы -СН=СН-R2, то R1 не обозначает атом водорода, при условии, что если Z обозначает группу формулы -СН=СН-R2, то R1 обозначает атом водорода, и"оксо" и "гидрокси" исключаются из выборочных заместителей. В объем настоящего изобретения включены энантиомеры, диастереомеры, N-оксиды и фармацевтически приемлемые соли соединений I. Предпочтительные соединения в соответствии с настоящим изобретением представляют собой соединения, в которых Z обозначает группу формулы -СС-R2 Также предпочтительными являются соединения, в которых m составляет 1 и n составляет 1. Путем сочетания указанных предпочтений с предпочтительной группой Z получаем следующие соединения II как наиболее предпочтительные. В соединениях I заместители для каждой выборочно замещенной группы представляют собой атом галогена или оксо, нитро, циано, гидрокси, карбомоильную, C1-C6 алкилкарбонильную группу либо группу формулы -NRR, в которой каждый R независимо обозначает атом водорода или C1-C6 алкильную, C1-C6 алкилкарбонильную, фенильную или бензильную группу, либоC1-C6 алкильную, C2-C6 алкенильную, C2-C6 алкинильную или C1-C6 алкоксигруппу, каждая из которых может выборочно иметь от 1 до 8 независимо выбранных оксо, гало, циано, нитро, амино, гидрокси или фенильных заместителей,С 3-С 9 моно- или бициклоалкильную группу, выборочно содержащую от 1 до 3 независимо выбранных C1-C6 алкильных, оксо, гало, циано, нитро, амино, гидрокси или фенильных заместителей, или группу формулы -А, -О-А, -С(О)-А, -(CH2)q-A, -NR-A, -C(O)NR-A, -NRC(O)-A или -ОС(О)-А,в которой А обозначает фенильную группу или С 2-С 8 гетероциклическую группу,содержащую от 1 до 3 гетероатомов, выбранных из азота, кислорода и серы, при этом каждая из групп А может выборочно содержать от 1 до 3 независимо выбранных гало, гидрокси, циано, нитро и C1C6 алкильных заместителей,каждый R независимо обозначает атом водорода или C1-C6 алкильную группу, иq обозначает 0 или является целым числом от 1 до 6. Соединения настоящего изобретения являются мГлу 5 антагонистами, используемыми при лечении нейромышечной дисфункции нижнего отдела мочевыводящих путей, мигрени и гастроэзофагеальной рефлюксной болезни (GERD) у животных. В юрисдикциях, в которых способы лечения людей и животных рассматриваются как патентуемые, настоящее изобретение охватывает способы для лечения нейромышечной дисфункции нижнего отдела мочевыводящих путей, для лечения мигрени и для лечения гастроэзофагеальной рефлюксной болезни (GERD) у животных.Y предпочтительно обозначает группу формулы -С(О)-, -NH-C(O)-, -N(C1-C6 алкил)-С(О)- ,-О-С(О), -NH-C(S)- или -SO2- либо отсутствует.R1 предпочтительно обозначает атом водорода или фтора, либо метильную, фенильную, гидрокси,метокси, метоксикарбонилокси, диметиламино или пиперидино группу. В том случае, когда Z обозначает группу формулы (i-a), R1 предпочтительно обозначает атом водорода или фтора, либо метильную или фенильную группу. R2 предпочтительно обозначает выборочно замещенную моно или бициклическую С 1-С 9 гетероциклическую группу, содержащую от 1 до 3 гетероатомов, выбранных из азота, кислорода и серы,выборочно замещенную фенильную группу,выборочно замещенную C1-C6 алкильную группу,выборочно замещенную C2-C6 алкенильную группу,выборочно замещенную С 3-С 6 циклоалкильную группу, или группу -C(O)-R2A, в которой R2A определен как R2 выше. Более предпочтительно R2 обозначает выборочно замещенную пирролидинильную, тиазолильную,пиридильную, хинолильную или фенильную группу, при этом заместителями для каждой выборочно замещенной группы являются атом фтора, хлора или брома, либо оксо, нитро, циано, цианометильная,ацетильная, метильная, метокси, этокси, изопропокси, трифторметильная, трифторметокси, ацетоамино,2,2-диметилпропаноиламино, 3,3-диметил-2-оксо-1-азетидинильная, 1-пирролидинилметильная, 1 Нпиразол-1-ил, 3-метил-1,2,4-оксадиазол-5-ил или морфолино группа. Исключительно предпочтительными соединениями в указанной группе являются соединения, в которых R2 обозначает пиридильную или фенильную группу, замещенную атомом фтора и(или) метильную группу, при этом дополнительные заместители являются произвольными. Наиболее предпочтительно R2 обозначает 6-метил-2-пиридильную, 5-циано-2-пиридильную, 3 фторфенильную, 2,5-дифторфенильную группу или 3,5-дифторфенильную группу.R3 предпочтительно обозначает C1-C6 алкильную группу, замещенную выборочно замещенной группой А,выборочно замещенную моно- или бициклическую С 1-С 9 гетероциклическую группу, содержащую от 1 до 3 гетероатомов, выбранных из азота, кислорода и серы,выборочно замещенную фенильную группу,выборочно замещенную C3-C6 циклоалкильную группу или выборочно замещенную C3-C6 циклоалкенильную группу. Более предпочтительно R3 обозначает моно- или бициклическую C1-C9 гетероциклическую группу,содержащую от 1 до 3 гетероатомов, выбранных из азота, кислорода и серы, и, как минимум, 2 смежных атома углерода, первый из которых связан с атомом азота проиллюстрированного, содержащего азот,кольца (при этом Y отсутствует), и второй из которых несет циано или нитро заместитель, при этом дополнительные заместители являются произвольными. В соответствии с другим вариантом R3 может обозначать выборочно замещенную пирролидинильную, пиразолильную, имидазолильную, 1,2,4-триазолильную, изоксазолильную, фурильную, тиэнильную, пиридильную, пиперидильную, пиразинильную, пиримидинильную, морфолинильную, имидазо[2,1-b]тиазолильную,индолильную,изоиндолильную,имидазо[1,2-а]пиридильную,1,2,3 бензатриазолильную, хинолильную, изохинолильную, хиноксалинильную, пиридо[2,3-b]пиразинильную,1,4-бензоксазинильную или фенильную группу, при этом заместителями для каждой выборочной замещенной группы являются атом фтора, хлора, брома или йода, либо метильная, изопропильная, метокси,этокси, пропокси, циано, нитро, трифторметильная, трифторметокси, ацетильная, ацетамино, фенильная,бензилокси, фенилкарбамоильная, 4-фторфенильная, 3-фтор-4-метилфенильная, 2-фурильная, 2 тиэнильная, 4-пиридильная, пиперидино, 2-пиримидинильная, 2-пиримидинилокси, 1,3-тиазол-2-ил, 2 метил-1,3-тиазол-4-ил, 2-оксопирролидин-1-ил, 5-метил-1,2,4-оксадиазол-3-ил, 2,5-диметил-1 Н-пиррол 1-ил группа. Наиболее предпочтительно R3 обозначает 6-метил-3-нитро-2-пиридильную, 6-метил-3-циано-2 пиридильную, 4-метокси-3-циано-2-пиридильную, 3-циано-2-тиэнильную или 3-циано-2-пиразинильную группу. Настоящее изобретение также предусматривает использование соединения, имеющего общую фор-4 018328 в которой R1, R2, R3, m и n согласно вышеприведенному определению для лечения заболеваний нижнего отдела мочевыводящих путей. Наиболее предпочтительными соединениями в соответствии с настоящим изобретением являются соединения, полученные в нижеприведенных примерах. Селективность соединений настоящего изобретения может быть определена путем:(a) проведения отдельного измерения связующего сродства испытуемого соединения к мГлу 5 рецептору, мГлу 1 рецептору и мГлу рецепторам группы II;(b) определения указанных испытуемых соединений, которые:(2) связываются с мГлу 5 рецептором со сродством, как минимум, 10-кратно превышающим сродство к мГлу 1 рецептору и мГлу рецепторам группы II;(c) проведения отдельного измерения способности каждого из соединений, определенных на этапе(b), действовать в качестве антагониста, либо обратного агониста в мГлу 5 рецепторе. Предпочтительно, чтобы активность соединений, определенных на этапах (а), (b) и (с) выше, была подтверждена путем оценки активности соединения при лечении заболевания нижнего отдела мочевыводящих путей у человека, либо в системе животной модели. Наиболее предпочтительно, чтобы определенные соединения проявляли активность в увеличении объемной емкости мочевого пузыря у бодрствующих крыс. Термин "соли" может включать соли присоединения кислоты, либо соли присоединения свободных оснований. Соли предпочтительно являются фармацевтически приемлемыми. Примеры кислот, которые могут быть использованы для получения фармацевтически приемлемых солей присоединения кислоты,включают без ограничения соли, полученные из нетоксичных неорганических кислот, таких как азотная,фосфорная, серная кислоты или бромисто-водородная, йодисто-водородная, фтористо-водородная и фосфористая кислоты, а также соли, полученные из нетоксичных органических кислот, таких как, алифатическая моно- и дикарбоновая кислоты, фенил-замещенные алканойные (карбоновые) кислоты, гидроксил алканойные кислоты, алканедиойные (дикарбоновые) кислоты, ароматические кислоты, алифатические и ароматические сульфоновые кислоты и уксусная, малеиновая, янтарная и лимонная кислоты. Неограничивающие примеры таких солей включают нападизилат, безилат, сульфат, пиросульфат, бисульфат,сульфит, бисульфит, нитрат, фосфат, монокислый фосфат, дикислый фосфат, метафосфат, пирофосфат,хлорид, бромид, йодид, ацетат, трифторацетат, пропионат, каприлат, изобутират, оксалат, малонат, сукцинат, суберат, себакат, фумарат, малеат, манделат, бензоат, хлорбензоат, метилбензоат, динитробензоат,фталат, бензолсульфонат, тулуолсульфонат, фенилацетат, цитрат, лактат, малеат, тартрат, метансульфонат и т.д. Также предусматриваются соли аминокислот, такие как оргинат и т.д., глюконат, галактуронат(см., например, Berge, et al. "Pharmaceutical Salts," J. Pharm. Sci. 1977; 66:1). Обычно фармацевтически приемлемая соль соединения I может быть легко получена путем использования требуемой кислоты или основания в зависимости от обстоятельств. Соль может выпасть из раствора и может быть собрана путем фильтрования, либо может быть извлечена путем выпаривания растворителя. Например, водный раствор кислоты, такой как соляная кислота, может быть добавлен к водной суспензии соединения I, и полученную смесь можно подвергнуть выпариванию до сухого состояния(лиофилизация) с целью получения соли присоединения кислоты в виде твердого вещества. В соответствии с другим вариантом соединение I может быть растворено в приемлемом растворителе, например в спирте, таком как изопропанол, и кислоту можно добавить в тот же самый растворитель или иной приемлемый растворитель. Полученная соль присоединения кислоты далее может быть непосредственно осаждена, либо выделена фильтрованием путем добавления менее полярного растворителя, такого как диизопропиловый эфир или гексан. Соли присоединения кислоты соединений I могут быть получены путем смешивания формы свободного основания с достаточным количеством требуемой кислоты для получения соли известным способом. Форма свободного основания может быть регенирована путем смешивания солевой формы с основанием и выделения свободного основания известным способом. Формы свободного основания в некоторой степени отличаются от своих соответствующих солевых форм в плане некоторых физических свойств, таких как растворимость в полярных растворителях, но в иных случаях соли эквиваленты своему соответствующему свободному основанию в целях настоящего изобретения. Фармацевтически приемлемые соли присоединения основания получают с металлами или аминами,-5 018328 такими как щелочные или щелочно-земельные металлы или органические амины. Примеры металлов,используемых в качестве катионов, включают натрий, калий, магний, кальций и т.д. Примеры приемлемых аминов включают N,N'-дибензилэтилендиамин, хлорпрокаин, холин, диэтаноламин, дициклогексиламин, этилендиамин, N-метилглукамин и прокаин. Соли присоединения основания указанных кислых соединений получают путем смешивания формы свободной кислоты с достаточным количеством требуемого основания для получения соли известным способом. Форма свободной кислоты может быть регенерирована путем смешивания солевой формы соли с кислотой и путем выделения свободной кислоты. Соединения в соответствии с настоящим изобретением могут иметь как основной, так и кислотный центр и, таким образом, могут быть в форме цвиттер-ионов. Специалистам в области органической химии должно быть очевидно, что многие органические соединения способны формировать комплексы с растворителями, в которых они реагируют, либо из которых они осаждаются или кристаллизуются. Указанные комплексы известны как "сольваты". Например,комплекс с водой известен как "гидрат". Сольваты соединения настоящего изобретения не выходят за объемы изобретения. Соли соединений I могут образовывать сольваты (например, гидраты), и настоящее изобретение также включает все такие сольваты. Значение слова "сольваты" хорошо известно специалистам в данной области техники как соединение, образованное путем взаимодействия растворителя с растворенным веществом (т.е., сольвация). Способы получения сольватов широко известны в данной области техники (см., например, Brittain. Polymorphism в Pharmaceutical solids. Marcel Decker, New York, 1999). Соединения I могут существовать в рацемических смесях, либо в любом ином сочетании. В отношении рацемических смесей могут быть использованы способы для энантиомерного обогащения с целью получения композиций, обогащенных конкретным энантиомером, либо могут быть превращены в композицию, содержащую единичный энантиомер. Для очистки сложных смесей диастереомеров с целью их преобразования в энантиомеры обычно требуется два этапа. На первом этапе смесь диастереомеров разбивают на пары энантиомеров. На втором этапе пары энантиомеров дополнительно очищают для формирования композиций, обогащенных тем или иным энантиомером или, более предпочтительно, разлагают на композиции, содержащие чистые энантиомеры. Для разделения энантиомеров обычно требуется реакция или молекулярное взаимодействие с хиральным веществом, например, растворителем или матрицей колонки. Разделение может быть достигнуто, например, путем преобразования смеси энантиомеров, например рацемической смеси в смесь диастереомеров путем проведения реакции с чистым энантиомером второго вещества, т.е., разделяющего агента. Далее два полученных диастереомерных продукта могут быть разделены. Затем разделенные диастереомеры снова преобразуют в чистые энантиомеры путем реверсирования начального химического превращения. Разделение энантиомеров может быть достигнуто за счет различий их нековалентного связывания с хиральным веществом, например, путем хроматографии на гомохиральных адсорбантах. Нековалентное связывание между энантиомерами и хроматографическим адсорбантом позволяет создать диастереомерные комплексы, ведущие к дифференциальному разделению в мобильном и связанном состояниях в хроматографической системе. Таким образом, два энантиомера перемещаются по хроматографической системе, например по колонке с различными скоростями, в результате чего обеспечивается их разделение. Хиральные разделительные колонки хорошо известны в данной области техники, и обеспечен их серийный выпуск (например, MetaChem Technologies Inc., филиал ANSYS Technologies, Inc., Lake Forest,CA). Анализ и очистка энантиомеров могут быть проведены с использованием, например, хиральных стационарных фаз (CSPs) для ВЭЖХ. Хиральные ВЭЖХ колонки обычно содержат одну форму энантиомерного соединения и иммобилизованного на поверхности материала силикагелевой набивки.D-фенилглицин и L-лейцин являются примерами хиральных стационарных фаз I типа и в них используются сочетания-взаимодействий, водородных связей, диполь-дипольных взаимодействий и стерических взаимодействий с целью достижения хирального распознавания. С целью разделения на колонки I типа энантиомеры анализируемого вещества должны содержать функциональность, дополняющую функциональность хиральных стационарных фаз таким образом, чтобы имело место существенное взаимодействие аналита с хиральной стационарной фазой. Образец должен предпочтительно содержать одну из нижеприведенных функциональных групп: -кислоту или -основание, донор и (или) акцептор водородной связи, либо амидный диполь. В некоторых случаях используют дериватизацию для добавления интерактивных сайтов к именно тем соединениям, у которых они отсутствуют. Наиболее широко используемые производные включают формирование амидов из аминов и карбоновых кислот.MetaChiral ODM является примером хиральных стационарных фаз II типа. Первичные механизмы формирования комплексов растворенное вещество-хиральная стационарная фаза обусловлены аттрактивными взаимодействиями, однако комплексы включения также играют важную роль. Образование водородной связи,-взаимодействия и дипольная укладка являются важными факторами для хирального разделения на MetaChiral ODM. Дериватизация может явиться необходимой в тех случаях, когда молекула растворенного вещества не содержит группы, необходимые для взаимодействий растворенное вещество-колонка. Дериватизация - обычно до бензиламидов - может быть необходима в отношении сильнополярных молекул, таких как содержащихся в аминах и карбоновых кислотах, которые в противном случае эффективно взаимодействовали бы со стационарной фазой за счет неспецифических стереовзаимодействий. Соединения формулы I могут быть разделены на диастереомерные пары, например, путем разделения с помощью колончатой хроматографии или тонкослойной хроматографии на силикагеле. В данном тексте диастереомерные пары называют диастереомером с высоким коэффициентом удержания тонкослойной хроматографии; и диастереомер с низким коэффициентом удержания тонкослойной хроматографии. Диастереомеры могут быть дополнительно обогащены для конкретного энантиомера или разделены на единичный энантиомер с помощью способов, хорошо известных в данной области техники, например способов, описание которых приведено в настоящем патенте. Относительная конфигурация диастереомерных пар может быть выведена путем применения теоретических моделей или правил (например, правило Крама, модель Фелкин-Ана), либо путем использования более надежных трехмерных моделей, сформированных с помощью программ вычислительной химии. Во многих случаях указанные способы позволяют прогнозировать, какой диастереомер является энергетически предпочтительным продуктом химического превращения. В качестве альтернативы относительная конфигурация диастереомерных пар может быть косвенно определена путем выявления абсолютных конфигураций единичного энантиомера в одной из диастереомерных пар (или в обеих диастереомерных парах). Абсолютная конфигурация стереоцентров может быть определена с помощью способа, исключительно хорошо известного специалистам в данной области техники (например, рентгеновской дифракции, циркулярного дихроизма). Определение абсолютной конфигурации также может оказаться эффективным для подтверждения предсказуемости теоретических моделей и могут оказаться полезными для более широкого использования указанных моделей по отношению к аналогичным молекулам, полученным путем проведения реакции с использованием аналогичных механизмов (например, восстановление кетонов и восстановительное аминирование кетонов гидридами). Настоящее изобретение также охватывает стереоизомеры син-анти типа и их встречающиеся смеси,когда обозначает двойную связь, R2 обозначает алкильную группу и (или) m не является 1. Группу наивысшего Кан-Инголд-Прелог приоритета, присоединенную к одному из концевых соединенных двойной связью атомов оксима, сравнивают с гидроксильной группой оксима. Стереомер обозначают как Z(zusammen = вместе), или Syn, если гидроксил оксима находится на той же стороне исходной плоскости,проходящей через двойную связь C=N как и группа наивысшего приоритета; другой стереомер обозначают как Е (entgegen - противоположный), или Anti. Настоящее изобретение также включает пролекарства соединений I, .т.е, соединений, выделяющих активное исходное лекарственное вещество в соответствии с формулой I в vivo при введении в организм млекопитающего. Пролекарство является фармакологически активным или, в большинстве случаев, неактивным соединением, которое преобразуется в фармакологически активное вещество за счет метаболического превращения. Пролекарство соединений I получают путем модифицирования функциональных групп, присутствующих в соединениях I таким образом, чтобы обеспечивалось расщепление iмодифицированных веществ в vivo и выделение исходного соединения. В физиологических условиях[например, при воздействии естественно образующегося(ихся) фермента (ов)] в пролекарстве быстро происходят химические изменения в vivo, в результате чего обеспечивается высвобождение фармакологически активного вещества. Пролекарства включают соединения I, в которых гидрокси, амино или карбокси группа связана с любой группой, которая может быть расщеплена в vivo для регенерации свободной гидрокси, амино или карбокси группы соответственно. Примеры пролекарств включают без ограничения сложные эфиры (например, ацетатные, форматные и бензоатные производные) соединений I или любое иное производное, которое под воздействием физиологического рН либо фермента преобразуется в активное исходное лекарственное вещество. Известные процедуры выбора и получения приемлемых производных пролекарств описаны в литературе (см., например, Bundgaard. Design of Pro-drugs. Elsevier,1985). Пролекарства могут быть введены аналогично способу введения активного ингредиента, в который они преобразуются, или они могут быть доставлены в резервуарной форме, например, в виде трансдермального пластыря или иного резервуара, предназначенного для обеспечения (путем выделения фермента или иного соответствующего реагента) медленного преобразования во времени пролекарства в активный ингредиент и доставки активного ингредиента в организм пациента. Настоящее изобретение также включает метаболиты. "Метаболит" соединение, описание которого приведено в настоящем патенте, является производным соединения, образованного при метаболизации соединения. Термин "активный метаболит" относится к биологически активному производному, образующемуся при метаболизации соединения. Термин "метаболизированный" относится к сумме процессов, с помощью которых происходит изменение конкретного вещества в живом организме. Короче говоря, все присутствующие в организме соединения подвергаются воздействию ферментов, вырабатывае-7 018328 мых организмом, с целью получения энергии и(или) их удаления из организма. Специфические ферменты вызывают специфические структурные изменения соединения. Например, цитохром Р 450 катализирует разнообразные окислительные и восстановительные реакции, в то время как уридиндифосфат глюкоронилтранфераза катализирует перенос активированной молекулы глукороновой кислоты в ароматические спирты, алифатические спирты, карбоновые кислоты, амины и свободные сульфидрильные группы. Дополнительная информация по метаболизму может быть получена из источника The Pharmacological Basis of Therapeutics , 9th Edition, McGraw-Hill (1996), pages 11-17. Метаболиты соединений, раскрытых в настоящем патенте, могут быть идентифицированы либо путем введения соединений в организм-хозяин и анализа образцов ткани, взятых из организма-хозяина,либо путем инкубирования соединений с помощью гепатических клеток in vitro и анализа полученных соединений. Оба способа хорошо известны в данной области техники. Краткое описание чертежей Фиг. 1 - график, иллюстрирующий воздействие соединения примера 1 на объемную емкость мочевого пузыря крыс в зависимости от времени, введенного перорально при дозировке 1 и 3 мг/кг по сравнению с контрольным лечением плацебо. Фиг. 2 - график, иллюстрирующий воздействие соединения примера 10 на объемную емкость мочевого пузыря крыс в зависимости от времени, введенного перорально при дозировке 0,3 и 1 мг/кг по сравнению с контрольным лечением плацебо. Фиг. 3 - график, иллюстрирующий воздействие эталонного соединения 3-2-метил-4 триазолил)этинил)пиридин (МТЕР) на объемную емкость мочевого пузыря крыс в зависимости от времени, введенного перорально при дозировке 1 и 3 мг/кг по сравнению с контрольным лечением плацебо. Заболевания нижнего отдела мочевыводящих путей Номенклатура симптомов и патологий нижних отделов мочевыводящих путей, используемая в настоящем документе, приведена в Abrams et al., Neurol u Urodyn. 21:167-178 (2002) и Andersson et al.,Pharmacol. Rev. 56:581-631 (2004). Дисфункции мочеиспускания могут быть грубо классифицированы как нарушения функций накопления мочи и опорожнения мочевого пузыря. Симптомы накопления мочи в мочевом пузыре проявляются во время фазы накопления мочи в мочевом пузыре и включают повышенную частоту мочеиспускания в дневное время, ночное мочеиспускание (пробуждение ночью для мочеиспускания один или несколько раз), императивные позывы на мочеиспускание (внезапное непреодолимое желание мочеиспускания,которому трудно противостоять) и недержание мочи (любая непроизвольная утечка мочи). Недержание мочи может дополнительно характеризоваться в соответствии с нижеприведенными симптомами.Недержание мочи при напряжении является непроизвольной утечкой мочи при усилии или напряжении,либо при чихании или кашле. Императивное недержание мочи является непроизвольной утечкой мочи,сопровождаемой императивным позывом на мочеиспускание или непосредственно предшествующей императивному позыву на мочеиспускание. Смешанное недержание мочи является непроизвольной утечкой мочи, связанной с императивным позывом на мочеиспускание, а также с напряжением, усилием,чиханием или кашлем. Недержание мочи вследствие переполнения мочевого пузыря является непроизвольной утечкой мочи, имеющей место после переполнения емкости мочевого пузыря, т.е. при невозможности его опорожнения. Энурез также относится к любой непроизвольной утечке мочи. Ночной энурез заключается в утечке мочи, происходящей во время сна. Симптомы мочеиспускания включают медленную струю мочи, разделение или распыление струи мочи, прерывистую струю мочи (прерывистость, т.е. приостановление и возобновление потока мочи во время мочеиспускания), задержку мочи (затруднение при начале мочеиспускания, приводящее к задержке наступления мочеиспускания после того, как человек готов помочиться), натуживание и терминальное мочеиспускание по каплям (длительная окончательная часть мочеиспускания, когда поток мочи замедлился до струйки или капель). Заболевания нижних мочевыводящих путей дополнительно могут быть категоризированы по группам симптомов (т.е. синдром) или по этиологии. Лица, страдающие от синдрома гиперактивности мочевого пузыря, например, обычно страдают от симптомов императивного позыва к мочеиспусканию, неотложного недержания мочи, повышенной частоты мочеиспускания в дневное время или ноктурии. Гиперактивность мочевого пузыря обычно возникает в результате гиперактивности мышц детрузора, которая называется нестабильностью мышц детрузора. Нестабильность мышц детрузора может возникнуть в результате расстройств не неврологического характера, таких как камни мочевого пузыря, заболевание мышц, инфекция мочевыводящих путей либо побочные эффекты лекарственных средств, либо нестабильность может носить идиопатический характер. Нейрогенный гиперактивный мочевой пузырь (либо нейрогенный мочевой пузырь) является типом гиперактивного мочевого пузыря, возникающим в результате гиперактивности детрузорной мышцы, называемой гиперрефлексией детрузора, являющейся вторичной по отношению к известным неврологическим нарушениям. Пациенты с такими неврологическими расстройствами, как инсульт, болезнь Паркинсона, диабет, рассеянный склероз, периферическая нейропатия или повреждение позвоночника, нередко страдают от нейрогенного гиперактивного мочевого пузыря. Цистит (включая интерстициальный цистит) является заболеванием нижних мочевыводящих путей известной этиологии, которое в основном поражает женщин молодого и среднего возраста, хотя этому заболеванию также могут быть подвержены мужчины и дети. Симптомы интерстициального цистита могут включать симптомы мочеиспускания, повышенную частоту мочеиспускания в дневное время, императивный позыв к мочеиспусканию, ноктурию или надлобковую либо тазовую боль, относящуюся к мочеиспусканию и исчезающую при мочеиспускании. Многие пациенты, страдающие от интерстициального цистита, также испытывают головные боли, а также сталкиваются с проблемами желудочнокишечного и кожного характера. В ряде случаев интерстициальный цистит также может быть связан с язвами мочевого пузыря или рубцами на мочевом пузыре. Простатит и простатодиния являются заболеваниями нижних отделов мочевыводящих путей, которые, предположительно, поражают приблизительно 2-9% взрослого мужского населения. Простатит является воспалением простаты и включает бактериальный простатит (острый и хронический) и небактериальный простатит. Острый и хронический бактериальный простатит характеризуется воспалением простаты и бактериальной инфекцией предстательной железы и обычно связан с симптомами боли, повышенной частотой мочеиспускания в дневное время и (или) императивным позывом к мочеиспусканию. Хронический бактериальный простатит отличается от острого бактериального простатита рецидивирующим характером заболевания. Хронический небактериальный простатит характеризуется воспалением простаты неизвестной этиологии, сопровождаемый наличием чрезмерного количества клеток воспаления в секрециях предстательной железы, не связанный с бактериальной инфекцией предстательной железы и обычно сопровождаемый такими симптомами, как боль, повышенная частота мочеиспускания в дневное время и (или) императивный позыв к мочеиспусканию. Простатодиния представляет собой заболевание, схожее по своим симптомам с простатитом, за исключением отсутствия воспаления простаты, бактериальной инфекции простаты и повышенного уровня клеток воспаления в секрециях предстательной железы. Простатодиния может быть связана с симптомами боли, повышенной частотой мочеиспускания в дневное время и (или) императивным позывом к мочеиспусканию. Доброкачественная гиперплазия простаты является незлокачественным увеличением простаты и наиболее часто встречается у мужчин старше 40 лет. Доброкачественная гиперплазия простаты предположительно обусловлена чрезмерным ростом клеток как гландулярных, так и стромальных элементов простаты. Симптомы доброкачественной гиперплазии простаты могут включать повышенную частоту мочеиспускания, императивный позыв к мочеиспусканию, неотложное недержание мочи, ноктурию и симптомы мочеиспускания, включающие медленную струю мочи, разделение или распыление струи мочи, прерывистую струю мочи, задержку мочи, натуживание и терминальное мочеиспускание по каплям. Эффективное количество соединения I может быть использовано для лечения заболеваний нижних отделов мочевыводящих путей у пациентов, нуждающихся в таком лечении. Лечение заболеваний нижних отделов мочевыводящих путей включает лечение симптомов накопления мочи в мочевом пузыре и симптомов опорожнения мочевого пузыря. Лечение заболеваний нижних мочевыводящих путей также включает лечение повышенной частоты мочеиспускания в дневное время, ноктурию, императивный позыв к мочеиспусканию, недержание мочи, включая неотложное недержание мочи, недержание мочи при напряжении, смешанное недержание мочи и недержание мочи вследствие переполнения мочевого пузыря, энурез, включая ночной энурез, медленную струю мочи, разделение или распыление струи мочи,прерывистую струю мочи, задержку мочи, натуживание и терминальное мочеиспускание по каплям. Лечение заболеваний нижних отделов мочевыводящих путей также включает лечение синдрома гиперактивного мочевого пузыря, в том числе лечение одного или нескольких симптомов императивного позыва к мочеиспусканию, неотложное недержание сочи, повышенной частоты мочеиспускания в дневное время или ноктурии. Лечение заболеваний нижних мочевыводящих путей дополнительно включает лечение любого из вышеуказанных состояний, симптомов и (или) синдромов, вызванных или связанных с циститом, в том числе с интерстициальным циститом, простатитом, доброкачественной гиперплазией простаты, неврологическими расстройствами, уменьшением резервуарной способности мочевого пузыря (т.е. снижением способности накопления мочи в мочевом пузыре). Соединение I может быть использовано для лечения непроизвольного мочеиспускания, например,неотложного недержания мочи, недержания мочи при напряжении, смешанного недержания мочи или недержания мочи вследствие переполнения мочевого пузыря. Такое недержание мочи может быть вызвано и(или) связано с гиперактивностью мочевого пузыря или доброкачественной гиперплазией простаты. Фармацевтические композиции Несмотря на то, что существует возможность введения соединения I в виде основного вещества,предпочтительным является ввести активный ингредиент в фармацевтическую рецептуру, например, в которой вещество находится в смеси с фармацевтически приемлемым носителем, выбранным с учетом предполагаемого пути введения и стандартной фармацевтической практики. Таким образом, в соответствии с одной особенностью настоящее изобретение также предусматривает создание фармацевтической композиции, содержащей соединение I или энантиомер, диастереомер,-9 018328N-оксид или их фармацевтически приемлемые соли в смеси с фармацевтически приемлемым носителем. Соединения I могут быть использованы в сочетании с другими видами терапии и(или) активными веществами. Таким образом, в соответствии с дополнительной особенностью настоящее изобретение предусматривает создание фармацевтической композиции, содержащей, как минимум, одно соединение I или его фармацевтически приемлемое производное, второе активное вещество и выборочно фармацевтически приемлемый носитель. Очевидно, что при комбинировании в одном и том же составе два соединения должны быть стабильными и совместимыми друг с другом и с другими компонентами состава. При составлении отдельной рецептуры они могут быть представлены в любой удобной рецептуре, предпочтительно в таком виде, который известен в данной области техники для таких соединений. Термин "носитель" относится к разбавителю, вспомогательному веществу и(или) носителю, с которыми производится введение активного соединения. Фармацевтические композиции настоящего изобретения могут содержать комбинации нескольких носителей. Такие фармацевтические носители могут представлять собой стерильные жидкости, такие как вода, физиологические солевые растворы, водные растворы декстрозы, водные растворы глицерина и масла, в том числе масла из нефти, животного, растительного или синтетического происхождения, такие как арахисовое масло, соевой масло, минеральное масло, кунжутное масло и т.д. Воду или водные растворы, физиологические солевые растворы и водные растворы декстрозы и глицерина предпочтительно используют в качестве носителей, в частности, для инъецируемых растворов. Описание приемлемых фармацевтических носителей приведено в "Remington'sPharmaceutical Sciences" by E.W. Martin, 18th Edition. Рецептура соединений настоящего изобретения может быть составлена для введения любым удобным способом для применения в человеческой или ветеринарной медицине, и, таким образом, изобретение включает в своем объеме фармацевтические композиции, содержащие соединение настоящего изобретения, предназначенное для использования в человеческой или ветеринарной медицине. Такие композиции могут быть представлены для применения обычным способом с помощью одного или нескольких приемлемых носителей. Приемлемые носители для терапевтического применения хорошо известны в фармацевтической области и описаны, например, в Remington's Pharmaceutical Sciences, Mack PublishingCo. (A. R. Gennaro edit. 1985). Фармацевтический носитель может быть выбран в зависимости от предполагаемого пути введения или стандартной фармацевтической практики. Фармацевтические композиции могут содержать дополнительно к носителю любое(ые) приемлемое(ые) связующее(ие) вещество(а), смазывающее (ие) вещество(а), суспендирующее(ие) вещество(а), покровное(-е) вещество(а) и(или) солюбилизирующее(ие) вещество(а). В фармацевтическую композицию могут быть включены консерванты, стабилизаторы, красители и даже ароматизирующие вещества. Примеры консервантов включают бензоат натрия, аскорбиновую кислоту и сложные эфиры п-гидроксибензойной кислоты. Также могут быть использованы антиокисданты и суспендирующие вещества. Соединения настоящего изобретения могут быть измельчены с использованием известных способов измельчения, таких как мокрый помол с целью получения частиц, размер которых является подходящим для формирования таблеток и иных типов рецептур. Тонкоизмельченные (в форме наночастиц) препараты соединений настоящего изобретения могут быть получены с помощью технологических процессов,известных в данной области техники, например, см. WO 02/00196 (SmithKline Beecham). Пути введения и стандартные лекарственные формы Пути введения (доставки) включают без ограничения один или несколько способов: пероральный(например, в виде таблеток, капсул или принимаемого внутрь раствора), топический, мукозальный (например, в виде назального спрея или аэрозоля для ингаляцции), назальный, парентеральный (например, в виде инъецируемой формы), гастроинтенстинальный, интраспинальный, интраперитонеальный, внутримышечный, внутривенный, внутриматочный, внутриглазной, интрадермальный, интракраниальный, интратрахеальный, интравагинальный, интрацеребровентрикулярный, интрацеребральный, подкожный,офтальмический (в том числе, введение в стекловидное тело или интракамеральный), трансдермальный,ректальный, буккальный, эпидуральный и сублингвальный. Таким образом, композиции настоящего изобретения включают композиции в форме, специально составленной для, например, парентерального, перорального, буккального, ректального, топического,имплантного, офтальмического, назального или мочеполового применения. В предпочтительных примерах осуществления фармацевтические композиции настоящего изобретения составляют в рецептуру в форме, приемлемой для пероральной доставки. К композиции/составу могут предъявляться различные требования в зависимости от различных систем доставки. Следует понимать, что не все из соединений необходимо вводить одним и тем же путем. Аналогичным образом, если композиция содержит более одного активного компонента, то в этом случае указанные компоненты могут быть введены различньми путями. Например, фармацевтическая композиция настоящего изобретения может быть составлена для доставки с помощью мини насоса или мукозальным путем, например, в виде назального спрея или аэрозоля для ингаляции или в виде принимаемого внутрь раствора, либо парентерально, и в этом случае композицию составляют в виде инъеци- 10018328 руемой формы для доставки, например, внутривенным, внутримышечным или подкожньм путем. В другом варианте состав может быть предназначен для доставки различными путями. В том случае, когда вещество необходимо доставить мукозально через слизистую оболочку желудочно-кишечного тракта, вещество должно сохранять стабильность при прохождении через желудочнокишечный тракт, например, оно должно быть стойким к протеолитической деградации, стабильным при кислотном рН и стойким к детергентному воздействию желчи. Например, на соединение I может быть нанесен слой энтеросолюбильного покрытия. Материал слоя энтеросолюбильного покрытия может быть диспергирован или растворен либо в воде, либо в приемлемом органическом растворителе. Могут быть использованы нижеприведенные полимеры слоя энтеросолюбильного покрытия (один или несколько,отдельно или в сочетании); например, растворы или дисперсии сополимеров метакриловой кислоты, ацетатфталат целлюлозы, ацетат бутират целлюлозы, фталат гидроксипропилметилцеллюлозы, ацетат сукцинат гидроксипропилметилцеллюлозы, фталат поливинилацетата, тримеллитат ацетата целлюлозы,карбоксиметилэтилцеллюлоза, шеллак или иной(ые) приемлемый(е) полимер(ы) слоя энтеросолюбильного покрытия. По экологическим причинам процесс нанесения водных покрытий может быть предпочтительным. При использовании таких технологических процессов нанесения водных покрытий наиболее предпочтительными являются сополимеры метакриловой кислоты. В тех случаях, когда это приемлемо, фармацевтические композиции могут быть введены путем ингаляции, в форме суппозитория или пессария, топически в форме лосьона, раствора, крема, мази или пудры, с помощью трансдермального пластыря, перорально в форме таблеток, содержащих такие вспомогательные вещества как крахмал или лактоза, или в форме капсул или овулей, либо отдельно, либо в смеси со вспомогательными веществами или в форме эликсиров, растворов или суспензий, содержащих ароматизаторы или пигменты, либо они могут быть инъецированы парентерально, например, внутривенно, внутримышечно или подкожно. Для буккального или сублингвального введения композиции могут быть введены в форме таблеток или пастилок, рецепт которых может быть составлен известным способом. Фармацевтические композиции настоящего изобретения могут быть введены парентерально, например путем инфузии или инъекции. В тех случаях, когда предусматривается парентеральное введение композиции настоящего изобретения, такое введение включает один или несколько нижеприведенных способов: внутривенное, внутриартериальное, интраперитонеальное, интратрахеальное, интравентрикулярное, интрауретральное, интрастернальное, интракранеальное, внутримышечное или подкожное введение вещества; и(или) путем использования инфузионных методов. Фармацевтические композиции,приемлемые для инъецирования или инфузии, могут быть в форме стерильного водного раствора, дисперсии или стерильного порошка, содержащего активный ингредиент, отрегулированный при необходимости для приготовления такого стерильного раствора или дисперсии, приемлемых для инфузии или инъецирования. Указанный препарат может быть выборочно инкапсулирован в липосомы. Во всех случаях окончательный препарат должен быть стерильным, жидким и стабильным в условиях производства и хранения. С целью повышения стабильности при хранении такие препараты также могут содержать консерванты с целью предотвращения роста микроорганизмов. Действие микроорганизмов может быть предотвращено путем добавления различных антибактериальных и противогрибковых веществ, например, парабена, хлорбутанола или аскорбиновой кислоты. Во многих случаях рекомендуются изотонические вещества, например сахара, буферы растворы и хлорид натрия с целью обеспечения осмотического давления аналогичного осмотическому давлению жидкостей организма, в частности, крови. Длительная абсорбция таких инъецируемых смесей может быть достигнута путем введения веществ, замедляющих абсорбцию, таких как моностеарат алюминия или желатин. Дисперсии могут быть приготовлены в жидком носителе или промежуточном веществе, таком как глицерин, жидкие полиэтиленгликоли, триацетилглицериновые масла и их смеси. Жидкий носитель или промежуточное вещество может представлять собой растворитель или жидкую диспергирующую среду,содержащую, например, воду, этанол, полиол (например, глицерин, проииленгликоль и т.д.), растительные масла, нетоксичные сложные глицериновые эфиры или их приемлемые смеси. Приемлемая текучесть может поддерживаться за счет образования липосом, введения частиц приемлемого размера в случае дисперсий или путем добавления поверхностно-активных веществ. Для парентерального введения наиболее оптимальной формой используемого соединения является форма стерильного водного раствора, который может содержать другие вещества, например достаточное количество солей или глюкозы для создания изотонического раствора, приближающегося по своему составу к крови. При необходимости водные растворы должны быть приемлемым образом буферированы(предпочтительно значения рН от 3 до 9). Приготовление приемлемых парентеральных составов в стерильных условиях легко осуществимо с помощью стандартных фармацевтических способов, хорошо известных специалистам в данной области техники. Стерильные инъецируемые растворы могут быть приготовлены путем смешивания соединения формул I, II или III с соответствующим растворителем и с одним или несколькими из вышеуказанных носителей с последующим проведением стерильного фильтрования. В случае стерильных порошков,приемлемых для использования при приготовлении стерильных инъецируемых растворов, предпочти- 11018328 тельные способы приготовления включают сушку в вакууме и лиофилизацию, которые обеспечивают получение порошкообразных смесей антагонистов альдостероновых рецепторов и требуемых вспомогательных веществ для последующего приготовления стерильных растворов. Рецептура соединений в соответствии с настоящим изобретением может быть составлена для использования в человеческой или ветеринарной медицине путем инъецирования (например, путем внутривенного инъецирования или инфузии болюсов, либо путем внутримышечного, подкожного или интратекального введения), и соединения могут быть представлены в виде однократной дозы, в ампулах или в иных упаковках лекарственных средств для однократного приема или многократного приема, к которым при необходимости добавлен консервант. Композиции для инъекций могут быть в форме суспензий, растворов или эмульсий в масляном или водном растворителе и могут содержать образующую рецептуру вещества, такие как суспендирующие, стабилизирующие, солюбилизирующие и (или) диспергирующие вещества. В других вариантах активный ингредиент может быть в форме стерильного порошка для растворения перед использованием в приемлемом растворителе, например, в стерильной, не содержащей пирогена воде. Соединения настоящего изобретения могут быть введены (например, перорально или топически) в форме таблеток, капсул, овулей, эликсиров, растворов или суспензий, которые могут содержать ароматизаторы или пигменты для немедленного, отсроченного, модифицированного, замедленного, прерывистого или контролируемого высвобождения. Соединения в соответствии с настоящим изобретением также могут быть предназначены для использования в человеческой или ветеринарной медицине в форме, приемлемой для перорального или буккального введения, например, в форме растворов, гелей, сиропов, жидкостей для полоскания рта или суспензий, либо в виде сухого порошка для восстановления водой или иным приемлемым растворителем до применения, выборочно с ароматизаторами и пигментами. Также могут быть использованы твердые композиции, такие как таблетки, капсулы, лепешки, пастилки, пилюли, болюсы, порошки, пасты, гранулы, драже и предварительно приготовленные препараты, твердые и жидкие композиции для перорального применения могут быть приготовлены с использованием способов, хорошо известных в данной области техники. Такие композиции также могут содержать один или несколько фармацевтически приемлемых носителей и вспомогательных веществ, которые могут иметь твердую или жидкую форму. Таблетки могут содержать такие вспомогательные вещества, как микрокристаллическую целлюлозу, лактозу, цитрат натрия, карбонат кальция, двухосновной фосфат кальция и глицин, разрыхлители,такие как крахмал (предпочтительно кукурузный, картофельный и маниоковый крахмал), натрия гликолят крахмала, кроскармеллоза натрия и некоторые сложные силикаты, а также гранулирующие связующие вещества, такие как поливинлпирролидон, гидроксипропилметилцеллюлоза (НРМС), гидроксипропилцеллюлоза (НРС), сахароза, желатин и камедь. Кроме того, в состав могут быть включены смазывающие вещества, стеарат магния, стеариновая кислота, глицерил бегенат и тальк. Композиции могут быть введены перорально в форме таблеток, микрочастиц, минитаблеток, капсул, мешочков и пероральных растворов или суспензий или порошков для их приготовления с быстрым или контролируемым высвобождением. Дополнительно к новым твердым формам пантопразол в соответствии с настоящим изобретением в качестве активного вещества пероральные препараты могут выборочно включать различные стандартные фармацевтические носители и вспомогательные вещества, такие как связующие вещества, наполнители, буферы, смазывающие вещества, глиданты, красители, разрыхлители, одоранты, подсластители, поверхностно-активные вещества, смазки для форм, антиадгезивные вещества и покрытия. Некоторые вспомогательные вещества могут выполнять несколько функций в композициях, например действовать в качестве как связующих веществ, так и разрыхлителей. Примеры фармацевтически приемлемых разрыхлителей для пероральных композиций, используемых в настоящем изобретении, включают без ограничения крахмал, прежелатинизированный крахмал,натрия гликолят крахмала, карбоксиметилцеллюлоза натрия, кроскармеллоза натрия, микрокристаллическая целлюлоза, алгинаты, смолы, поверхностно-активные вещества, шипучие композиции, водные силикаты алюминия и сшитый поливинилпирролидон. Примеры фармацевтически приемлемых связующих веществ для пероральных композиций, используемых в настоящем изобретении, включают без ограничения камедь; производные целлюлозы, такие как метилцеллюлоза, карбоксиметилцеллюлоза, гидроксипропилметилцеллюлоза, гидроксипропилцеллюлоза или гидроксиэтилцеллюлоза; желатин, глюкозу, декстрозу, ксилитол, полиметакрилаты, поливинилпирролидон, сорбитол, крахмал, прежелатинизированный крахмал, трагант, ксантановую смолу, алгинаты, алюмосиликат магния, полиэтиленгликоль и бентонит. Примеры фармацевтически приемлемых наполнителей для пероральных композиций, используемых в настоящем изобретении, включают без ограничения лактозу, ангидротактозу, моногидрат лактозы,сахарозу, декстрозу, маннитол, сорбитол, крахмал, целлюлозу (в частности, микрокристаллическую целлюлозу), дигидро- или ангидрофосфат кальция, карбонат кальция и сульфат кальция. Примеры фармацевтически приемлемых смазывающих веществ, используемых в композициях настоящего изобретения, включают без ограничения стеарат магния, тальки, полиэтиленгликоль, полимеры этиленоксида, лаурилсульфат натрия, лаурилсульфат магния, олеат натрия, стеарилфумарат натрия и коллоидальную двуокись кремния. Примеры фармацевтически приемлемых одорантов для пероральных композиций включают без ограничения синтетические ароматические вещества и естественные ароматические масла, такие как экстракты масел, цветов, фруктов например, бананов, яблок, вишен и персиков) или их сочетания, и аналогичные ароматические вещества. Их использование зависит от многих факторов, при этом наиболее важный фактор заключается в органолептической приемлемости для людей, которые будут принимать фармацевтические композиции. Примеры фармацевтически приемлемых красителей для пероральных композиций включают без ограничения синтетические и естественные красители, такие как двуокись титана, бета-каратин и экстракты кожуры грейпфрута. Примеры фармацевтически приемлемых покровных веществ для пероральных композиций, топически используемых для облегчения проглатывания, модификации свойств высвобождения, улучшения внешнего вида и (или) маскирования вкуса композиций включают без ограничения гидроксипропилметилцеллюлозу, гидроксипропилцеллюлозу и сополимеров акрилата-метакрилата. Примеры фармацевтически приемлемых подсластителей для пероральных композиций включают без ограничения аспартам, натрий сахарин, цикламат натрия, ксилитол, маннитол, сорбитол, лактозу и сахарозу. Примеры фармацевтически приемлемых буферов включают без ограничения лимонную кислоту,цитрат натрия, бикарбонат натрия, двуосновной фосфат натрия, оксид магния, карбонат кальция и гидроксид магния. Примеры фармацевтически приемлемых поверхностно-активных веществ включают без ограничения лаурилсульфат натрия и полисорбаты. Твердые композиции аналогичного типа могут быть использованы в качестве наполнителей в желатиновых капсулах. Предпочтительные вспомогательные вещества в этом отношении включают лактозу,крахмал, целлюлозу, молочный сахар или высокомолекулярные полиэтиленгликоли. Для водных суспензий и (или) эликсиров препарат может быть смешан с различными подсластителями или ароматизаторами, пигментами или красителями, с эмульгирующими и (или) суспендирующими веществами, с растворителями, такими как вода, этанол, полиэтиленгликоль и глицерин или с их сочетаниями. Рецептура соединения в соответствии с настоящим изобретением также может быть составлена, например, в виде суппозиториев, например, содержащих известные суппозиторные основы для использования в человеческой или ветеринарной медицине, либо в виде пессариев, например, содержащих известные пессарийные основы. Рецептура соединений в соответствии с настоящим изобретением может быть составлена для топического введения при использовании в человеческой и ветеринарной медицине в форме мазей, кремов,желе, гелей, гидрогелей, лосьонов, растворов, шампуней, порошков (включая распыляемые или опудривающие порошки), пессариев, тампонов, спреев, растворов для нанесения методом окунания, аэрозолей,капель (например, глазных, ушных или назальных капель) или растворов для нанесения методом полива. В целях топического нанесения на кожу рецепт препарата в соответствии с настоящим изобретением может быть составлен в виде приемлемой мази, содержащей активное соединение, суспендированное или растворенное, например, в смеси с одним или несколькими из следующих веществ: минеральное масло, жидкий петролатум, белый петролатум, пропиленкликоль, соединение полиоксиэтилена и полиоксипропилена, эмульгирующий воск, сорбитан моностеарат, полиэтиленгликоль, жидкий парафин, полисорбат 60, воск на основе цетиловых эфиров, цетеариловый спирт, 2-октилдодеканол, бензиловый спирт и вода. Такие композиции также могут содержать иные фармацевтически приемлемые вспомогательные вещества, такие как полимеры, масла, жидкие носители, поверхностно-активные вещества, буферы, консерванты, стабилизаторы, антиоксиданты, увлажнители, смягчители, красящие вещества и одоранты. Примеры фармацевтически приемлемых полимеров, пригодных для таких топических композиций,включают без ограничения акриловые полимеры; производные целлюлозы, такие как натрийкарбоксиметилцеллюлозу, метилцеллюлозу или гидроксипропилцеллюлозу; и природные полимеры, такие как алгинаты, трагант, пектин, ксантан и цитозан. Примеры фармацевтически приемлемых масел, которые также являются приемлемыми для композиций, включают без ограничения минеральные масла, силиконовые масла, жирные кислоты, спирты и гликоли. Примеры фармацевтически приемлемых жидких носителей включают без ограничения воду, спирты или гликоли, такие как этанол, изопропанол, пропиленгликоль, гексиленгликоль, глицерин и полиэтиленгликоль либо их смеси, в которых псевдополиморф растворен или диспергирован выборочно с добавлением нетоксичных анионных, катионных или неионных поверхностно-активных веществ и неорганических или органических буферов. Примеры фармацевтически приемлемых консервантов включают без ограничения различные антибактериальные и противогрибковые вещества, такие как растворители, например этанол, пропиленгли- 13018328 коль, бензиловый спирт, хлорбутанол, четвертичные аммониевые соли и парабены (такие как метилпарабен, этилпарабен, пропилпарабен и т.д.). Примеры фармацевтически приемлемых стабилизаторов и антиоксидантов включают без ограничения этилендиаминтетрауксусную кислоту (EDTA), тиомочевину, токоферол и бутилгидроксианизол. Примеры фармацевтически приемлемых увлажнителей включают без ограничения глицерин, сорбитол, мочевину и полиэтиленгликоль. Примеры фармацевтически приемлемых смягчителей включают без ограничения минеральные масла, изопропилмиристат и изопропилпалмитат. Соединения также можно вводить дермально или трансдермально, например, путем использования трансдермального пластыря. Для офтальмического применения рецептура соединений может быть составлена в виде микронизированной суспензии в изотонической, рН-регулируемом стерильном солевом растворе либо предпочтительно в виде растворов в изотоническом, рН-регулируемом стерильном солевом растворе, предпочтительно в сочетании с таким консервантом как бензилалкония хлорид. Как указывалось, соединения в соответствии с настоящим изобретением могут быть введены интраназально либо путем ингаляции, и их доставка приемлемым образом осуществляется в форме сухого порошка с помощью ингалятора либо в форме аэрозольного спрея, подаваемого из баллончика, насоса,пульверизатора или распылителя спрея с помощью приемлемого газа-вытеснителя, например дихлордифторметана, трихлорфторметана, дихлортатрафторэтана, гидрофторалкана, такого как 1,1,1,2 тетрафторэтан (HFA 134AT) или 1,1,1,2,3,3,3-гептафторпропан (HFA 227EA), двуокиси углерода или иного приемлемого газа. В случае аэрозолей в упаковке под давлением единица дозирования может быть определена путем установки клапана для подачи дозированного количества. Баллончик, насос, пульверизатор или распылитель может содержать раствор или суспензию активного соединения, например, при использовании смеси этанола и газа-вытеснителя в качестве растворителя, которая может дополнительно содержать смазывающее вещество, например сорбитан триолеат. Капсулы и патроны (выполненные, например, из желатина) для применения в ингаляторе или инсуффляторе могут иметь рецептуру, содержащую порошкообразную смесь соединения и приемлемую порошкообразную основу, такую как лактоза или крахмал. Для топического введения путем ингаляции соединения в соответствии с настоящим изобретением могут подаваться с помощью распылителя для использования в человеческой или ветеринарной медицине. Фармацевтические композиции в соответствии с настоящим изобретением могут содержать от 0,01 до 99 вес./об.% активного материала. Например, для топического введения композиция в целом может содержать 0,01-10%, более предпочтительно 0,01-1% активного материала. Активные вещества также могут быть введены в форме липосомных систем доставки, таких как моноламеллярные везикулы, крупные моноламеллярные везикулы и мультиламеллярные везикулы. Липосомы могут быть сформированы из широкого диапазона фосфолипидов, таких как холестерин, стеариламин или фосфатидилхолинов. Фармацевтическая композиция или стандартные лекарственные формы, включающие эффективное количество соединения в соответствии с настоящим изобретением, могут быть введены животному,предпочтительно человеку, нуждающемуся в лечении нейромышечной дисфункции нижнего отдела мочевыводящих путей, описанной Е. J. McGuire в "Campbell's UROLOGY", 5th Ed., 616-638, 1986, W.B.Saunders Company. В соответствии со значением, используемым в настоящем контексте, термин "эффективное количество" относится к количеству, приводящему к поддающемуся измерению уменьшению интенсивности как минимум одного симптома или параметра конкретного заболевания. В предпочтительном примере осуществления настоящего изобретения соединение обеспечивает лечение заболеваний мочевыводящих путей, таких как императивный позыв к мочеиспусканию, гиперактивный мочевой пузырь, повышение частоты мочеиспускания, снижение эластичности мочевого пузыря (снижение объемной емкости мочевого пузыря), цистит (включая интерстициальный цистит), недержание мочи, утечку мочи, энурез, расстройство мочеиспускания, затрудннное начало мочеиспускания и затруднение с опорожнением мочевого пузыря. В другом предпочтительном примере осуществления настоящего изобретения соединение обеспечивает лечение мигрени. В дополнительном примере осуществления настоящего изобретения соединение используют для лечения гастроэзофагеальной рефлюксной болезни. Фармацевтическая композиция или стандартная лекарственная доза в соответствии с настоящим изобретением может быть введена в соответствии с дозой и режимом введения, определяемыми путем стандартных испытаний в свете данных выше рекомендаций с целью достижения оптимальной активности при минимальной токсичности или минимальных побочных эффектах для конкретного пациента. Однако такая тонкая настройка схемы лечения является стандартной в свете данных в настоящем тексте рекомендаций. Дозировка активных веществ в соответствии с настоящим изобретением может изменяться в зависимости от широкого спектра факторов, таких как основное заболевание, состояние пациента, вес, пол и возраст и способ введения лекарственного препарата. Эффективное количество для лечения заболевания может быть легко определено путем эмпирических методов, известных специалистам в данной области техники, например, путем создания матрицы доз и частоты введения и путем сравнения групп экспериментальных единиц или субъектов в каждой точке в матрице. Точное количество препарата, вводимое пациенту, изменяется в зависимости от состояния и тяжести заболевания и от физического состояния пациента. Поддающееся измерению уменьшение интенсивности любого симптома или параметра может быть определено специалистом в данной области техники, либо пациент может сообщить информацию об этом лечащему врачу. Очевидно, что любое клинически или статистически значимое снижение или уменьшение интенсивности любого симптома или параметра заболеваний мочевых путей не выходит за объем настоящего изобретения. Клинически значимое снижение или уменьшение является ощущаемым пациентом или врачом. Например, один пациент может одновременно страдать от нескольких симптомов расстройства мочеиспускания, таких как, например, императивный позыв к мочеиспусканию и исключительно высокая частота мочеиспускания или от обоих симптомов, и интенсивность указанных симптомов может быть уменьшена путем использования способов настоящего изобретения. В случае недержания мочи любое сокращение частоты или объема нежелательного мочеиспускания рассматривается как благоприятный эффект, достигаемый за счет настоящего метода лечения. Количество вводимого препарата может находиться в интервале от приблизительно 0,01 до приблизительно 25 мг/кг/сутки, предпочтительно от приблизительно 0,1 до приблизительно 10 мг/кг/сутки и наиболее предпочтительно от приблизительно 0,2 до приблизительно 5 мг/кг/день. Очевидно, что фармацевтические рецептуры настоящего изобретения не обязательно должны содержать полное количество препарата, являющееся эффективным при лечении заболевания, так как такое эффективное количество может быть достигнуто путем введения нескольких доз таких фармацевтических рецептур. В предпочтительном примере осуществления настоящего изобретения соединения I изготовлены в виде капсул или таблеток, содержащих от 10 до 200 мг соединений настоящего изобретения, которые предпочтительно вводят пациенту в виде общей суточной дозы от 10 до 300 мг, предпочтительно от 20 до 150 мг и наиболее предпочтительно приблизительно 50 мг для купирования симптомов недержания мочи или иных дисфункций. Фармацевтическая композиция для парентерального введения содержит от приблизительно 0,01 до приблизительно 100 вес.% активных веществ настоящего изобретения от 100 вес.% общей фармацевтической композиции. В целом, трансдермальные лекарственные формы содержат от приблизительно 0,01 до приблизительно 100 вес.% активных веществ от 100% общего веса лекарственной формы. Для лечения заболеваний нижнего отдела мочевыводящих путей соединение I может быть введено в сочетании, как минимум, с одним соединением дополнительного класса терапевтических веществ. Такой дополнительный класс может представлять собой класс антимускариновых средств, включающих без ограничения оксибутинин, толдеродин, дарифенацин, солифенацин, троспиум, фезотеродин и темиверин. Комбинированная терапия с использованием, как минимум, одного соединения I может дополнительно включать лечение с помощью селективного или неселективного ЦОГ ингибитора. Примеры СОГ ингибиторов включают без ограничения ибупрофен, напроксен, беноксапрофен, флурбипрофен, фенопрофен, фенбуфен, кетопрофен, индопрофен, пирпрофен, карпрофен, тиоксапрофен, супрофен, тиапрофеновую кислоту, флупрофен, индометацин, сулиндак, толметин, зомепирак, диклофенак, фенклофенак,ибуфенак, ацетилсалициловую кислоту, пироксикам, теноксикам, набуметон, кеторолак, азапропазон,мефенамовую кислоту, толфенамовую кислоту, дифлунизал, ацеметацин, фентиазак, клиданак, меклофенамовую кислоту, флуфенамовую кислоту, нифлумовую кислоту, флуфенизал, судоксикам, этодолак,салициловую кислоту, бенорилат, изоксикам и 2-фтор-а-метил[1,1'-бифенил]-4-уксусную кислоту, 4(нитроокси)бутилэфир (См. Wenk, et al., Europ. J. Pharmacol. 453:319-324 (2002, мелоксикам, парекоксиб и нимесулид. Комбинированная терапия с помощью, как минимум, одного соединения I может дополнительно включать лечение с использованием альфа-1-адренергического антагониста. Предпочтительные альфа-1-адренергические антагонисты, приемлемые для введения в сочетании с мГлу 5 антагонистами, включают, например, без ограничения празосин, доксазосин, теразосин, альфузосин, силодосин и тамсулосин. Описание дополнительных альфа-1-адренергических антагонистов, приемлемых для введения в сочетании с мГлу 5 антагонистами, приведено в патентах US 5990114, US 6306861, US 6365591, US 6387909 и US 6403594. Комбинированная терапия с использованием, как минимум, одного соединения I может дополнительно включать лечение ингибитором поглощения серотонина и (или) норадреналина. Примеры ингибиторов поглощения серотонина и (или) норадреналина включают без ограничения дулоксетин, милнаципран, амоксапин, венлафаксин, дес-венлафаксин, сибутрамин, тезофенсин, и дес-метилсибутрамин. В конкретных примерах осуществления настоящего изобретения ингибитор поглощения серотонина и (или) норадреналина, приемлемый для введения в сочетании с мГлу 5 антагонистами, является се- 15018328 лективным ингибитором поглощения серотонина (т.е., селективным ингибитором обратного захвата серотонина). В конкретных примерах осуществления настоящего изобретения ингибиторы поглощения серотонина и (или) норадреналина, приемлемые для введения в сочетании с мГлу 5 антагонистами, являются селективными ингибиторами поглощения норадреналина (т.е., NARI). Фармацевтическая композиция или стандартная лекарственная форма может быть введена в виде однократной суточной дозы либо общая суточная доза может быть введена в виде раздельных доз. Кроме того, желательным может являться совместное введение или последовательное введение другого соединения для лечения заболевания. С этой целью составляют рецептуры комбинированных активных лекарственных средств в виде единицы дозирования лекарственного средства. Для проведения комбинированной терапии, при которой соединения находятся в составах раздельного дозирования, соединения могут быть введены одновременно, либо могут быть введены поочередно. Например, соединение в соответствии с настоящим изобретением может быть введено утром, а антимускариновое соединение может быть введено вечером или наоборот. Дополнительные соединения также могут быть введены в конкретные периоды времени. Порядок введения зависит от широкого диапазона факторов, включающих возраст, вес, пол и заболевания пациента; тяжесть и этиологию заболеваний,подлежащих лечению, путь введения препарата, ренальную и гепатическую функцию, анамнез и чувствительность пациента к препарату. Определение порядка введения может быть точно отрегулировано, и такая точная регулировка является обычной процедурой в свете рекомендаций, данных в настоящем тексте. Синтез соединений в соответствии с настоящим изобретением Специалистам в данной области техники должно быть очевидно, что желательным является использование защищенных производных промежуточных продуктов, используемых для получения соединенияI. Защита и снятие защиты функциональных групп может осуществляться с использованием традиционных методов (см., например, Green и Wuts Protective Groups в Organic Synthesis. John Wiley и Sons, NewYork, 1999.). Гидрокси или аминогруппы могут быть защищены любой гидрокси или амино-защитной группой. Амино-защитные группы могут быть удалены с помощью известных способов. Например,ацильные группы, такие как алканоильные, алкоксикарбонильные и ароильные группы могут быть удалены путем сольволиза, например путем гидролиза в кислой или щелочной среде. Арилметоксикарбонильные группы (например, бензилоксикарбонильная группа) могут быть расщеплены путем гидрогенолиза в присутствии такого катализатора, как палладий на угле. Синтез целевых соединений завершается путем удаления любых защитных групп, которые могут присутствовать в предпоследних промежуточных соединениях, с использованием стандартных способов,хорошо известных специалистам в данной области техники. Далее окончательные продукты, с которых снята защита, подвергают при необходимости очистке с помощью стандартных методов, таких как силикагелевая хроматография, ВЭЖХ на силикагеле и т.д. или путем рекристаллизации. Соединения изобретения, в которых R1 обозначает Н, обычно получают в соответствии с нижеприведенными схемами: Схема 1 В схеме 1 Ak обозначает алкильную группу, L обозначает уходящую группу и остальные переменные являются переменными в соответствии с определением для общей формулы I. 3-бром-1-триметилсилил-1-пропин (1) добавляют при температуре от -10 до 25 С к раствору предварительно сформированного фосфаниона, полученного in situ из соответствующего диалкилфосфита(например, диэтилфосфита), обрабатывая его основанием, предпочтительно бис-триметилсилиламидом натрия или лития в апротонном растворителе, предпочтительно в ТГФ или диметилэтаноамине (ДМЭ) при температуре от -50 до 0 С. По завершению указанного процесса получают соединение 2 (см. такжеGibson, A. W.; Humphrey, G. R.; Kennedy, D. J.; Wright, S. H. В.; Synthesis 1991 (5), 414). Далее соединение 2 преобразуют в соответствующий стабилизированный илид путем проведения реакции с основанием, предпочтительно bis-триметилсилиламидом натрия или лития (LiHMDS) в апротонном растворителе, предпочтительно ТГФ или ДМЭ при температуре от -78 до 0 С. Далее указанный илид реагирует с пиперидоном 3 в том же самом химическом реакторе при температуре -60 - 0 С, в результате чего получают соединения 4 (Gibson, A. W.; Humphrey, G. R.; Kennedy, D. J.; Wright, S. H. В.;Synthesis 1991 (5), 414 or Boehmer, J.; Schobert, R.; J Chem Res, Synop, 1998, (7), 372-373). В соответствии с другим вариантом ацетиленовые соединения 4 могли бы быть получены путем проведения реакции пиперидонов 3 с илидом, полученным из (3-триметилсилил-2-пропинил)трифенилфосфоний бромида и, например, BuLi в ТГФ (Hann, М. М.; Sammes, P. G.; Kennewell, P. D.; Таилог, J. В.; J Chem Soc, Perkin Trans 1, 1982, 307 or Nicolaou, K. C; Webber, S. E.; J Am Chem Soc 1984,106, 5734), и путем проведения его реакции по аналогичному вышеприведенному методу. Другой приемлемый процесс заключается в использовании (3-2-пропинил)трифениларсоний бромида (Shen, Yanchang;Liao, Quimu; J. Organomet. Chem.; 346; 1988; 181-184) и получении илида мышьяка с помощью BuLi или иного приемлемого основания и путем проведения его реакции с пиперидонами 3. Далее силильную защитную группу соединений 4 удаляют путем обработки тетрабутиламмоний фторидом в ТГФ при температуре в диапазоне от комнатной температуры до точки дефлегмирования,либо путем гидролиза с основанием (K2CO3 или KOH в Метанол) или с помощью иного приемлемого способа, выбранного из способов, приведенных в Greene-Wuts (Greene's Protective Groups в Organic Synthesis, 3rd Edition, Peter G. M. Wuts, Theodora W. Greene 1999, Wiley Interscience page 654-659) и хорошо известных специалистам в данной области техники. Полученные таким образом ацетиленовые соединения 5 далее преобразуют в соединения I путем проведения их реакции с R2-L с помощью хорошо известного метода Соногаширы (Science of Synthesis, H. Heaney и S. Christie, October 2003, Vol. 3, Page 402 иfollowing), в которой используют йодид меди и палладий комплекс, выбранный из (Ph3P)2PdCl2,(Ph3P)2Pd(OAc)2, (Ph3P)4Pd (который также может быть получен в situ, например, из трифенилфосфина иPd(OAc)2), и все иные палладий комплексы, указанные в литературе и используемые для такого вида реакции, в присутствии такого основания, как триэтиламин (TEA), диэтиламин (DEA), диизопропилэтиламин (ДИРЕА), триметиламин (ТМА), бутиламин, пиперидин. Растворители выбраны из ТГФ, ДМЭ,ДМФ, ДМА, этилацетата, диметилсульфоксида, толуола и иных растворителей, приемлемых для проведения реакции; либо аналогичное основание в избыточном количестве может быть использовано в качестве реакционного растворителя. При проведении реакции в ДМФ или ДМЭ выделение соединений 5 можно избежать путем добавления тетрабутиламмоний фторида или тетрабутиламмоний хлорида непосредственно в реакционную среду, содержащую соединения 4 до соединения (Sorensen, U.S., PomboVillar, Е. Tetrahedron 2005, 61, 2697-2703). Заместители R2 вводят с использованием арильных или гетероарильных гелогенидов (предпочтительно в порядке убывания - йод, бромид, хлорид), арильных или гетероарильных трифталатов, алкильных галогенидов или ацильных хлоридов, ароильных хлоридов, гетероароильных хлоридов. Трифталаты синтезируют с использованием способов, хорошо известных в данной области техники, например, из фенолов или гидроксиарилов (гетероарилов) с помощью трифторметансульфонового ангидрида в хлорированном растворителе или с помощью N-фенилтрифлимида в толуоле или хлорированном растворителе в присутствии основания или при его отсутствии (например,триэтиламина). Оба процесса могут быть ускорены под воздействием микроволн путем проведения реакции в микроволновой печи. Иные приемлемые уходящие группы L для R2-L включают нонафлаты,тозилаты и трифторбораты калия. Пиперидоны 3 коммерчески доступны и могут быть легко получены из пиперидонов, при этом кето-группа может быть свободной или защищенной как кеталь, с использованием простых процессов ацитилирования, (тио)карбамоилирования, восстановительного аминирования, алкилирования, арилирования у азотистого основания, хорошо известных специалистам в данной области техники и полно задокументированных в литературе. В схеме 2 представлена вероятная и возможная альтернатива схеме 1 для получения соединения I с помощью R1 = Н. В схеме 2, Ak обозначает алкильную группу, PG обозначает защитную группу, и остальные переменные являются переменными, определенными в соответствии для общей формулы I. При указанном синтетическом пути используют N-защищенные пиперидоны (коммерчески доступные и легко получаемые с использованием стандартных процессов), где PG обозначает соответствующим образом выбранную защитную группу, такую как t-бутоксикарбонильную (Boc), флуоренилметоксикарбонильную (Fmoc), бензильную (Bn), бензилоксикарбонильную (Z), тритильную (Tr), арилсульфонильную или иные группы. Реакцию защищенных пиперидонов 6 проводят с использованием аналогичных способов, описанных для получения соединений 3, с целью получения соединений 7 - хорошо сконструированных производных, снабженных ортогональной защитой. Таким образом, соединения 7 могут быть последовательно преобразованы в соответствии с процессом, описанным выше для схемы 1, в соединения 8 и 9, и с них может быть снята защита для преобразования в соединение 10 с использованием стандартных процессов снятия защиты, выбранных из процессов, приведенных в Greene-Wuts (Greene'sProtective Groups в Organic Synthesis, 3rd Edition, Peter G. M. Wuts, Theodora W. Greene 1999, Wiley Interscience page 654-659). Соединения 10 являются синтонами, используемыми для синтезирования путем простых процессов реакции соединения I с ранее определенным и фиксированным заместителем R2. В соответствии с другим вариантом соединения 8 могут быть дополнительно N- не защищены путем традиционных способов с целью получения соединений 11, которые, в свою очередь, последовательно N-дериватизируют и подвергают ацетиленовой СН дериватизации в соответствии с процессами, приведенными выше для соединений 5 в схеме 1. В соответствии с другим вариантом селективное снятие защиты N-PG групп соединений 7 позволяет получить соединения 12, которые могут вступать в реакцию, как описано выше, для получения соединений 4, дереватизируемых далее по схеме 1 с целью получения соединений I. Соединения I настоящего изобретения, в которых R1 имеет значение в соответствии с описанием в общей формуле I (H также включен), могут быть в целом получены по нижеприведенной схеме 3: В схеме 3 Q обозначает защитную группу или R3-Y- группу, Hal обозначает атом галогена, и остальные переменные величины имеют значения в соответствии с вышеприведенной общей формулой I. Соединения 14 могут быть получены из соединений 13 с использованием стандартных условий олефинирования, таких как Wittig, Horner-Hemmons, Petersen, либо методов на основе мышьяка. Общий обзор указанных методов и направлений приведен в следующих ссылочных материалах:'The Wittig reaction и related methods, N. J. Lawrence в Preparation of Alkenes, J. M. J. Williams, Ed., OxfordUniversityPress, Oxford (1996); pp 19-58; Phosphorus Ylides, O. I. Kolodiazhnyi, Wiley, N.Y. (1999); A. W. Johnson,Ylides и Imines of Phosphorus, Wiley, N.Y. (1993); Ager, D. J. Org. React. 1990,38,1-223. При проведении реакции с использованием соли трифенилфосфония могут быть использованы бутиллитий либо диизопропиламид лития (LDA), либо гексаметилдисилиламид лития (LHMDS) для получения илида фосфора в ТГФ или в ином апротонном растворителе (например, ДМЭ), и илид вступает в реакцию с собственно пиперидоном с целью получения требуемого продукта. Реагенты на основе фосфината, фосфин оксида или фосфоната могут быть использованы с аналогичными основаниями, либо с метоксидом или этоксидом натрия или калия в спиртовых растворителях или с гидридом натрия в апротонных растворителях. Соединения 14 могут быть легко преобразованы в соединения 16, обычно без выделения промежуточных дигалопроизводных 15 путем проведения сначала дегалогенирования олефинной связи (Br2, NCS,NBS или иных реагентов в приемлемом растворителе, например, в АсОН или хлорированном растворителе), а затем путем проведения дегидрогалогенирования соединений 15 с использованием основания(K2CO3, DBU, DMAP и т.д.). При проведении реакций олефинирования соединений 13, как указывалось выше, с использованиемCHBr3 или CBr4 либо CHFBr2 или CFBr3 и трифенилфосфина (или иного триарилфосфина, связанного с полимерной смолой, либо не связанного с ней), в присутствии такого катализатора, как ZnBr2 или диэтилцинк, либо при их отсутствии, обеспечивается простое получении соединений 17. ИспользованиеCBr4 приводит к получению 1,1-дибромвинил производного соединений 17, которое может последовательно вступать в реакцию с металлоорганическими соединениями, например, метилмагнийбромидом для получения производного 16 (R1 = алкил, фенил), либо может вступать в реакцию с сильным органическим основанием (например, BuLi или NaHMDS и т.д.) с целью получения карбаниона, который, в свою очередь, вступал в реакцию с электрофилом (например, CH3I) для получения производного 16 (R1 = алкил, фенил). При использовании аналогичных методов, описанных выше, для реакции Хорнера использование галометилфосфорного реагента (например, хлорметилтрифенилфосфоний хлорида или дифенилхлорметилфенилфосфоната) приводит непосредственно к образованию соединений 16, начиная с соединений 13. Альтернативная методология, используемая для преобразования соединений 13 в соединения 17 включает использование CH2Br2 или CH2I2 либо CH2Cl2 или CHI3 в присутствии TiCl4 и магния, либо в присутствии титан комплекса или CrCl2. Соединения 16 (или соединения 17, где (Hal, Hal обозначает фтор плюс йод или фтор плюс бромид) далее реагируют по методу Соногаширы (см. выше) для получения соединений 18 (I) с R1 = F. Соединения 18, где Q равно PG (защитная группа), должны быть подвергнуты дополнительному этапу снятия защиты, приводящему к образованию соединений 19 в соответствии с приведенным выше описанием в схеме 2. Соединения 19 могут быть надлежащим образом преобразованы в соединения I с помощью вышеописанных стандартных процессов. Схема 4 В схеме 4 L обозначает соответствующую уходящую группу (галогенную, мезилатную, тозилатную или иную группу), PR обозначает содержащий фосфор остаток, (например, диалкоксифосфорил либо дифеноксифосфорил, либо трифенилфосфонил, либо трифениларсинил), Q обозначает защитную группу либо R3-Y-группу, R1 обозначает алкильную или фенильную группу и остальные переменные имеют значения в соответствии с определением для общей формулы I. В схеме 4 приведено описание варианта процесса получения соединений 14 с R1 = алкил или фенил. В указанном способе соединения 20 (являющиеся коммерчески доступными или легко получаемыми с использованием стандартных процессов, хорошо известных специалистам в данной области техники) вступают в реакцию по методу Арбузова или по иному приемлемого методу для получения солей фосфония или фосфонатов или иных промежуточных соединений фосфора, которые последовательно могут быть соединены с алкилальдегидом или бензальдегидом по методу Виттинга-Хорнера для получения соединений 14 (R1 = алкил или фенил). Схема 5 Схема 5, в которой PG обозначает защитную группу, Q обозначает защитную группу или R3-Yгруппу, и оставшиеся переменные имеют значения в соответствии с определением для общей формулы I,представляет собой еще один способ синтеза соединений 18 (I). Легко получаемые амиды 22 Вайнреба(L. De Luca, G. Giacomelli, M. Taddei, J. Org. Chem., 2001, 66, 2535-2537) могут вступать в реакцию с использованием хорошо известных способов с реагентами Григнарда или литиевыми реагентами для получения кетонов 24. В том случае, когда R1=H, соединения 24 являются коммерчески доступными, либо исключительно легко синтезируемыми из коммерчески доступных исходных материалов. Простое преобразование в енолтрифлаты или енолсульфонаты 25 (R = CF3SO2, p-MePhSCO2) гарантирует получение качественного исходного материала для последующего преобразования в соединения 18 (I) путем соединения по методу Соногаширы, описанному выше. В соответствии с другим вариантом соединения 23 (Corley, E. G. et al., J Org Chem, 69, (15), 2004,5120-5123) могут вступать в реакцию при образовании палладий-катализируемого соединения с ацилхлоридами для получения соединений 24. Соединения 24 также могут быть конденсированы ацетиленовыми соединениями R2CCH с использованием методологий на основе льюисовской кислоты или реакций альдольного типа при использовании оснований с целью получения соединений 26 (I), которые могут быть, в свою очередь, дегидрированы для получения соединения 18 (I). Соединения 18 и 26, в которых Q равно PG (защитная группа), должны быть пройти дополнительный этап снятия защиты, ведущей к образованию N-незащищенных соединений в соответствии с описанием выше в схеме 2. Полученные в соответствии с таким методом соединения могут быть надлежащим образом N-дериватизированы до соединений I с помощью приведенных выше стандартных методов. Процессы синтеза других соединений настоящего изобретения, включенных в примеры, описание которых не приведено в настоящем общем описании синтеза соединений настоящего изобретения, хорошо задокументированы в экспериментальной части настоящего изобретения. Свободные основания формулы I, их диастереомеры и энантиомеры могут быть преобразованы в соответствующие фармацевтически приемлемые соли при стандартных условиях, хорошо известных в данной области техники. Например, свободное основание растворяют в приемлемом органическом растворителе, таком как метанол, обрабатывают, например, одним эквивалентом малеиновой или щавелевой кислоты, одним или двумя эквивалентами соляной кислоты или метасульфоновой кислоты и затем концентрируют под вакуумом с целью получения соответствующей фармацевтически приемлемой соли. Остаток далее может быть подвергнут очистке путем рекристаллизации из соответствующего органического растворителя или смеси органических растворителей, таких как метанол/диэтилэфир.N-оксиды соединений формулы I могут быть синтезированы путем проведения простых реакций окисления, хорошо известных специалистам в данной области техники. Примеры настоящего изобретения Настоящее изобретение проиллюстрировано с помощью следующих примеров. Пример 1. 1-(3-Нитро-2-пиридил)-4-[3-(6-метил-2-пиридил)-проп-2-инилиден]пиперидин Диэтил (3-триметилсислпроп-2-инил)фосфонат (соединение 1 а) В раствор LiHMDS (1M в ТГФ, 63,8 мл, 63,8 ммоль) в безводном ТГФ (162 мл) по каплям добавляли при постоянном перемешивании при -10 С в атмосфере азота диэтилфосфита (7,4 мл, 63,8 ммоль). Полученный раствор перемешивали при той же температуре в течение 20 мин. Далее к смеси добавляли 3-бром-1-триметилсилилсилил-1-пропин (10 мл, 63,8 ммоль) и реакционную смесь перемешивали при-10 С в течение 2 ч, затем быстро охлаждали водой и экстрагировали этилацетатом. Комбинированные органические слои промывали рассолом, высушивали над Na2SO4, выпаривали до сухого состояния под вакуумом и получали 14,86 г одноименного продукта. 1 Н-ЯМР (CDCl3, ): соответствует Feringa, Ben L. et al., Org. Biomol. Chem., Volume 3 (14), 2005,2524-2533-60 С в потоке N2, по каплям добавляли раствор LiHMDS (1M В ТГФ, 2,74 мл, 2,74 ммоль) и смесь перемешивали при -60 С в течение 15 мин. К полученному раствору по каплям добавляли раствор 1-(3 нитро-2-пиридил)-4-оксопиперидин (0,55 г, 2,49 ммоль) в безводном ТГФ (12 мл). Реакционную смесь перемешивали при -60 в течение 15 мин, затем смесь нагревалась до комнатной температуры в течение 2 ч. Затем смесь быстро охлаждали водой и экстрагировали этилацетатом. Комбинированные органические слои промывали рассолом, высушивали над Na2SO4, выпаривали до сухого состояния под вакуумом и получали 0,79 г одноименного продукта. Сырой продукт характеризовался достаточной степенью чистоты для использования на следующем этапе без какой-либо дополнительной очистки.MS: [М+Н]+ = 316,16 1-(3-Нитро-2-пиридил)-4-(проп-2-инилиден)пиперидин (соединение 1 с) Раствор соединения 1b (0,57 г, 1,81 ммоль) и гидрат фторида тетра-n-бутиламмония (0,57 г, 2,03 ммоль) в 38 мл ТГФ перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь вливали в воду и экстрагировали этилацетатом. Комбинированные органические слои промывали рассолом,высушивали над Na2SO4, выпаривали до сухого состояния под вакуумом и получали остаток, который очищали методом флэш-хроматографии (этилацетат - петролейный эфир в отношении 1 : 9), обеспечивающим получение одноименного продукта (0,21 г). MS: [М+Н]+ = 244,13 1-(3-Нитро-2-пиридил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин Смесь соединения 1 с (0,21 г, 0,86 ммоль), 2-бром-6-метилпиридина (0,11 мл, 0,95 ммоль), тетракис(трифенилфосфин)палладия(0) (70 мг, 0,06 ммоль), CuI (16 мг, 0,09 ммоль) в безводном и дегазированном триэтиламине (10 мл) нагревали при 80 С в атмосфере азота в течение 2 ч в герметичном сосуде. Реакционную смесь охлаждали, вливали в воду и экстрагировали этилацетатом. Комбинированные органические слои промывали рассолом, высушивали над Na2SO4, выпаривали до сухого состояния под вакуумом и получали остаток, который очищали методом флэш-хроматографии (этилацетат - петролейный эфир в отношении 3,5 : 6,5), обеспечивая получение одноименного соединения (0,20 г). 1 Н-ЯМР (CDCl3): 2,48-2,55 (m, 2H), 2,61 (s, 3 Н), 2,80-2,85 (m, 2H), 3,50-3,58 (m, 4H), 5,66 (s, 1H),6,75-6,80 (m, 1H), 7,09 (d, 1H, J = 7,46 Hz), 7,24-7,29 (m, 1H), 7,55 (t, 1H, J = 7,46 Hz), 8,14-8,19 (m, 1H),8,35-8,38 (m, 1H) MS: [M+H]+ = 335,12 Пример 2. 1-(t-бутоксикарбонил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин 1-(1-бутоксикарбонил)-4-(3-триметисилил-проп-2-инилиден)пиперидин (соединение 2 а) Одноименное соединение получали в соответствии с процедурой, описанной для получения соединения 1b, но при использовании 1-(t-бутоксикарбонил)-4-оксопиперидина вместо 1-(3-нитро-2-пиридил)4-оксопиперидина. После стандартной процедуры выделения продукта реакции путем выпаривания комбинированных экстрактов EtOAc получали сырой продукт, обладающий достаточной степенью чистоты для использования на следующем этапе без дополнительной очистки. 1 Н-ЯМР (CDCl3): 0,21 (s, 9H), 1,50 (s, 9H), 2,21-2,27 (m, 2H), 2,48-2,53 (m, 2H), 3,40-3,51 (m,4H),5,40 (s, 1H)MS: [M+H]+= 294,29 1-(t-бутоксикарбонил)-4-(проп-2-инилиден)пиперидин (cоединение 2b) Одноименное соединение получали в соответствии с процедурой, описанной для получения соединения 1 с, но при использовании соединения 2 а вместо соединения 1b. После стандартной процедуры выделения продукта реакции путем выпаривания комбинированных экстрактов EtOAc получали сырой продукт, обладающий достаточной степенью чистоты для использования на следующем этапе без дополнительной очистки. 1MS: [M+H]+= 222,23 1-(t-бутоксикарбонил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин Одноименное соединение получали в соответствии с процедурой, описанной для получения соединения примера 1, но начиная с соединения 2b вместо соединения 1 с. После стандартной процедуры выделения продукта реакции путем выпаривания комбинированных экстрактов EtOAc получали сырой продукт, который очищали методом флэш-хроматографии (этилацетат - петролейный эфир в отношении 3,5 : 6,5), обеспечивающим получение одноименного соединения. 1MS: [M+H]+= 313,27 Пример 3. 4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин К раствору соединения примера 2 (17 г, 54,4 ммоль) в CHCl3 (840 мл) добавляли трифторуксусную кислоту (60 мл, 779 ммоль) и затем реакционную смесь перемешивали при 70 С в течение 15 мин до тех пор, пока с помощью жидкого хроматографа не обнаруживалось полное преобразование реагента. После охлаждения до комнатной температуры добавляли воду, а затем водный раствор NaOH (2N) до достижения щелочного рН. Отделение органического слоя и экстрагирование водного слоя CH2Cl2, промывка рассолом и высушивание над Na2SO4 обеспечивало получение одноименного соединения (11,6 г). 1MS: [M+H]+ = 213,25 Пример 4. 1-(2-Нитрофенил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин Хорошо гомогенезированную смесь соединения примера 3 (20 мг, 0,09 ммоль) и 1-бром-2 нитробензол (22,8 мг, 0,11 ммоль) перемешивали при 90 С в течение 0,5 ч, затем при 110 С в течение 1 ч. Неочищенный продукт реакции очищали методом флэш-хроматографии (градиент этилацетата - петролейного эфира от 3 : 7 до 4 : 6), обеспечивая получение одноименного соединения (8,3 мг). 1 Н-ЯМР (CDCl3): 2,50-2,55 (m, 2H), 2,61 (s, 3 Н), 2,82-2,87 (m, 2H), 3,11-3,16 (m, 2H), 3,16-3,21 (m,2 Н), 5,62 (s, 1H), 7,03-7,16 (m, 2 Н), 7,19 (d, 1 Н, J = 7,51 Hz), 7,26-7,30 (m, 1H), 7,48 (t, 1H, J = 7,51 Hz),7,52-7,64 (m, 1H), 7,81 (d, 1H) MS: [M+H]+= 334,30 Пример 5. 1-(6-Метил-3-нитро-2-пиридил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин Хорошо гомогенезированную смесь соединения примера 3 (23 мг, 0,11 ммоль) и 2-хлор-6-метил-3 нитропиридина (26,2 мг, 0,15 ммоль) перемешивали при 120 С в течение 0,5 ч. Неочищенный продукт реакции очищали методом флэш-хроматографии (градиент этилацетата - петролейного эфира от 3 : 7 до 4 : 6), обеспечивая получение одноименного соединения (21 мг). 1 Н-ЯМР (CDCl3): 2,48 (s, 3 Н), 2,49-2,53 (m, 2H), 2,67 (s, 3 Н), 2,81-2,86 (m, 2H), 3,49-3,55 (m, 2 Н),3,56-3,60 (m, 2 Н), 5,66 (s, 1H), 6,61 (d, 1H, J=8,2 Hz), 7,13-7,18 (m, 1H), 7,29-7,35 (m, 1H), 7,60-7,70 (m,1H), 8,09 (d ,1H, J = 8,2 Hz) MS: [M+H]+ = 349,41 Пример 6. 1-(6-Метокси-3-нитро-2-пиридил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]-пиперидин Хорошо гомогенезированную смесь соединения примера 3 (23 мг, 0,11 ммоль) и 2-хлор-5-метокси 3-нитропиридина (24,4 мг, 0,13 ммоль) перемешивали при 120 С в течение 0,5 ч. Неочищенный продукт реакции очищали методом флэш-хроматографии (градиент этилацетата - петролейного эфира от 2 : 8 до 3 : 7), обеспечивая получение одноименного соединения (24 мг). 1 Н-ЯМР (CDCl3): 2,50-2,55 (m, 2H), 2,66 (s, 3 Н), 2,85-2,90 (m, 2H), 3,50-3,55 (m, 2H), 3,60-3,65 (m,2H), 3,97 (s, 3 Н), 5,68 (s, 1H), 6,17 (d, 1H, J=8,76 Hz), 7,13-7,18 (m, 1H), 7,29-7,35 (m, 1 Н), 7,60-7,70 (m,1H), 8,25 (d, 1H, J=8,76 Hz) MS: [M+H]+ = 365,36 Пример 7. 1-(5-метил-2-нитрофенил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин Хорошо гомогенезированную смесь соединения примера 3 (19 мг, 0,89 ммоль) и 3-фтор-4-нитротолуол(20,2 мг, 0,13 ммоль) перемешивали при 120 С в течение 0,5 ч. Неочищенный продукт реакции очищали методом флэш-хроматографии (градиент этилацетата - петролейного эфира от 2 : 8 до 3 : 7), обеспечивая получение одноименного соединения (18 мг). 1 Н-ЯМР (CDCl3): 2,40 (s, 3 Н), 2,52-2,57 (m, 2H), 2,68 (s, 3 Н), 2,85-2,92 (m, 2H), 3,10-3,15 (m, 2 Н),3,17-3,22 (m, 2 Н), 5,64 (s, 1H), 6,85 (d, 1H, J=8,19 Hz), 6,93 (s, 1H), 7,13-7,20 (m, 1H), 7,30-7,37 (m, 1H),7,60-7,72 (m, 1H), 7,78 (d ,1H, J=8,19 Hz)MS: [M+H]+ = 348,36 Пример 8. 1-(5-Метокси-2-нитрофенил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин Хорошо гомогенезированную смесь соединения примера 3 (20 мг, 0,93 ммоль) и 2-фтор-4 метоксинитробензол (21,3 мг, 0,12 ммоль) перемешивали при 120 С в течение 0,5 ч. Неочищенный продукт реакции очищали методом флэш-хроматографии (этилацетат - петролейный эфир в отношении 1:1),обеспечивая получение одноименного соединения (21 мг). 1 Н-ЯМР (CDCl3): 2,55-2,62 (m, 2H), 2,80 (s, 3 Н), 2,93-3,02 (m, 2H), 3,10-3,18 (m, 2H), 3,22-3,28 (m,2 Н), 3,88 (s, 3 Н), 5,66 (s, 1H), 6,51-6,59 (m, 2H), 7,19-7,31 (m, 1H), 7,36-7,46 (m, 1H), 7,73-7,87 (m, 1H),8,05 (d ,1H) MS: [M+H]+ = 364,31 Пример 9. 1-(3-Нитро-2-пиридил)-4-[3-(2-пиридил)проп-2-инилиден]пиперидин Одноименное соединение получали в соответствии с процедурой, описанной для получения соединения в примере 1 путем проведения реакции соединения 1 с с 2-йодпиридином вместо 2-бром-6 метилпиридина. Сырой продукт очищали методом флэш-хроматографии (этилацетат - петролейный эфир в отношении 1:1), обеспечивая получение одноименного соединения. 1 Н-ЯМР (CDCl3): 2,50-2,55 (m, 2H), 2,80-2,85 (m, 2H), 3,50-3,60 (m, 4H), 5,68 (s, 1H), 6,78 (dd, 1H,J=4,6 и 7,8 Hz), 7,27-7,32 (m, 1H), 7,48 (d, 1H, J=7,84 Hz), 7,81 (t, 1H, J = 4,2 Hz), 8,16 (dd, 1H, J= 7,8 Hz и 1,7Hz), 8,36 (dd, 1H, J=1,7 Hz и 4,2 Hz), 8,60-8,65 (m, 1H)MS: [M+H]+ = 321,10 Пример 10. 1-(3-Нитро-2-пиридил)-4-(3-фенил-проп-2-инилиден)пиперидин Одноименное соединение получали в соответствии с процедурой, описанной для получения соединения в примере 1 путем проведения реакции соединения 1 с с йодбензолом вместо 2-бром-6 метилпиридина. Очистку проводили методом флэш-хроматографии при отношении петролейного эфираMS: [M+H]+ = 320,24 Пример 11. 1-(3-Нитро-2-пиридил)-4-[3-(3-пиридил)проп-2-инилиден]пиперидин Одноименное соединение получали в соответствии с процедурой, описанной для получения соединения в примере 1 путем проведения реакции соединения 1c с 3-йодпиридином вместо 2-бром-6 метилпиридина. Очистку проводили методом флэш-хроматографии при отношении петролейного эфира- этилацетата 6 : 4 и получали соединение примера 11. 1 Н-ЯМР (CDCl3): 2,52-2,57 (m, 2H), 2,74-2,79(m, 2H), 3,50-3,60 (m, 4H), 5,67 (s, 1H), 6,82 (dd, 1H,J=4,4 и 7,8 Hz), 7,66-7,74 (m, 1H), 8,13-8,21 (m, 2H), 8,38 (dd, 1H), 8,58-8,63 (m, 1H), 8,72-8,77 (m, 1H)MS: [M+H]+=321,30 Пример 12. 1-Фенилкарбамоил-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин К раствору соединения примера 3 (0,11 г, 0,52 ммоль) в CH2Cl2 (10 мл) добавляли фенилизоцианат (0,06 мл, 0,54 ммоль) и реакционную смесь перемешивали в течение ночи при комнатной температуре. Выпаривание и очистка сырого продукта методом автоматизированной флэш-жидкостной хроматографии (Horizon Biotage) при элюировании градиентом петролейного эфира - этилацетата от 87 : 13 до 0 : 100 обеспечивали получение одноименного продукта (154 мг). 1H-ЯМР (CDCl3): 2,41-2,46 (m, 2H), 2,64 (m, 3 Н), 2,74-2,79 (m, 2H), 3,57-3,62 (m, 4H), 5,65 (s, 1H),6,58 (s, 1H), 7,05 (t, 1H, J = 7,52 Hz), 7,14 (d, 1H, J = 7,88 Hz), 7,28-7,34 (m, 3H), 7,38-7,42 (m, 2H), 7,63 (t,1H, J = 7,88 Hz) MS: [M+H]+ = 332,4 Примеры 13-26 (таблица I) Указанные соединения синтезировали в соответствии с процедурой, описанной в примере 12, замещая фенилизоцианат реагентом В (см. табл. I ниже). Очистку проводили методом автоматизированной флэш-жидкостной хроматографии (Horizon - Biotage) при элюировании градиентом петролейного эфира - этилацетата от 100:0 до 20:80. Соединения примеров 17 и 18 далее подвергали очистке методом препаративной обращено-фазной жидкостной хроматографии и масс-спектороскопии (LC-MS) с использованием MS-C18 XTerra колонки 3050 мм при элюировании градиентом буфер бикарбоната аммония (20 мМ рН 8) - ацетонитрил. Пример 27. 1-Бензил-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин Смесь соединения примера 3 (0,22 г, 1,04 ммоль), бензальдегида (0,13 мл, 1,25 ммоль), триацетоксиборгидрида натрия (0,33 г, 1,56 ммоль) и 15 мл of CH2Cl2 перемешивали в течение ночи при комнатной температуре. Далее смесь разбавляли водой, органический слой отделяли, промывали рассолом (2 х 15 мл), высушивали (Na2SO4), выпаривали до сухого состояния под вакуумом и получали сырой продукт,который очищали методом автоматизированной флэш-жидкостной хроматографии (Horizon - Biotage),элюируя градиентом петролейного эфира - этилацетата от 85:15 до 0:100 до получения одноименного соединения, которое дополнительно очищали методом препаративной обращенно-фазной жидкостной хроматографии и масс-спектороскопии (LC-MS) с использованием MS-C18 XTerra колонки 3050 мм при элюировании градиентом буфер бикарбонат аммония (20 мМ рН 8) - ацетонитрил (0,12 г). 1 Н-ЯМР (CDCl3): 2,34-2,80 (m, 11 Н), 3,57-3,74 (m, 2 Н), 5,54 (s, 1H), 7,07 (d, 1H, J = 7,65 Hz), 7,23 (d,1H, J = 7,65 Hz), 7,29-7,43 (m, 5H), 7,52 (t, 1H, J = 7,65 Hz), MS: [M+H]+ = 303,3 Пример 28. 1-Бутил-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин Было получено одноименное соединение в соответствии с процедурой, описанной для получения соединения примера 27, но при этом бензальдегид замещали бутиральдегидом. После стандартной процедуры выделения продукта реакции сырой продукт очищали методом автоматизированной флэшжидкостной хроматографии (Horizon - Biotage) при элюировании градиентом петролейного эфира(этилацетат + 1,4 N метанольный аммиак 1 : 0,1) от 90 : 10 до 30 : 70 до получения одноименного соединения. 1 Н-ЯМР (CDCl3): 0,96 (t, 3 Н), 1,35 (sextet, 2H), 1,62 (br, 2H), 2,4-2,9 (m, 13H), 5,56 (s, 1H), 7,07 (d,1H, J = 7,65 Hz), 7,25 (d, 1H, J = 7,65 Hz), 7,54 (t, 1H, J = 7,65 Hz). MS: [M+H]+ = 269,3 Пример 29. 1-(t-бутоксикарбонил)-4-[3-(6-метил-2-пиридил)-1-фенил-проп-2-инилиден]пиперидин К раствору 1-(t-бутоксикарбонил)-4-(1-фенил-3-триметилсилилпроп-2-инилиден)пиперидина (0,08 г, 0,216 ммоль), приготовленного с соответствии с описанием в патенте US 2004/0063744 в дегазированном ДМФ (2 мл) добавляли по каплям раствор тетра-н-бутиламмоний фторида (TBAF) (0,056 г, 0,21 ммоль) в ДМФ (1 мл). После перемешивания при комнатной температуре в течение 15 мин, добавляли триэтиламин (0,06 мл, 0,43 ммоль), CuI (0,002 г, 0,01 ммоль), тетракис(трифенилфосфин)палладий(0)(0,012 г, 0,01 ммоль) и 2-бром-6-метилпиридин (0,026 мл, 0,23 ммоль). Реакционную смесь нагревали при 80 С в течение 2 ч, затем ее охлаждали, вливали в воду и экстрагировали этилацетатом. Комбинированные органические слои промывали рассолом, высушивали над Na2SO4, выпаривали до сухого состояния под вакуумом и получали остаток, который очищали методом флэш-хроматографии (этилацетат - петролейный эфир в отношении 2:8), обеспечивая получение одноименного соединения (0,03 г). 1 Н-ЯМР (CDCl3): 1,50 (s, 9H), 2,36-2,43(m, 2H), 2,56 (s, 3 Н), 2,81-2,89 (m, 2H), 3,37-3,46 (m, 2H),3,58-3,63 (m, 2H), 7,07 (d, 1H, J = 7,65 Hz), 7,23 (d, 1H, J = 7,65 Hz), 7,29-7,43 (m, 5H), 7,52 (t, 1H, J = 7,65MS: [M+H]+ = 389,45 Пример 30. 1-(3-Нитро-2-пиридил)-4-[3-(4-пиридил)проп-2-инилиден]-1-пиперидин Одноименное соединение получали в соответствии с процедурой, описанной для получения соединения в примере 1, но при этом проводили реакцию между соединением 1 с и 4-йодпиридином вместо 2 бром-6-метилпиридина. Очистку проводили методом флэш-хроматографии петролейным эфиром - этилацетатом в отношении 6,5 : 3,5 и получали соединение примера 30. 1 Н-ЯМР (CDCl3): 2,52-2,57 (m, 2H), 2,75-2,80 (m, 2H), 3,50-3,60 (m, 4H), 5,68 (s, 1H), 6,79-6,84 (m,1H), 7,44-7,48 (m, 2H), 8,18 (d, 1H), 8,36-8,39 (m, 1H), 8,48-8,82 (m, 2H). MS: [M+H]+ = 321,29 Пример 31. 1-(3-Нитро-2-пиридил)-4-[3-(3-хинолил)-проп-2-инилиден]пиперидин Хорошо гомогенезированную смесь соединения 1 с (50 мг, 0,21 ммоль), 3-бромхинолина (0,039 мл,0,21 ммоль), дихлорида бис-(трифенилфосфин)палладия (5 мг, 0,007 ммоль) и фторида тетрабутиламмония (215 мг, 0,82 ммоль) перемешивали при 80 С в течение 1 ч в герметичном сосуде. Реакционную смесь охлаждали, вливали в воду и экстрагировали этилацетатом. Комбинированные органические слои промывали рассолом, высушивали над Na2SO4, выпаривали до сухого состояния под вакуумом и получали остаток, который очищали методом флэш-хроматографии (градиент этилацетата - петролейного эфира от 2 : 8 до 4 : 6), обеспечивая получение одноименного соединения (0,51 г). 1 Н-ЯМР (CDCl3): 2,52-2,58 (m, 2H), 2,79-2,80 (m, 2H), 3,52-3,62 (m, 4H), 5,71 (s, 1H), 6,78-6,84 (m,1H), 7,68-7,74 (m, 1H), 7,82-7,92 (m, 2H), 8,16-8,21 (m, 1H), 8,36-8,49 (m, 3H), 8,98 (s, 1H).MS: [M+H]+ = 371,38 Пример 32. 1-(3-Нитро-2-пиридил)-4-[3-(6-морфолино-3-пиридил)проп-2-инилиден]пиперидин Одноименное соединение получали в соответствии с процедурой, описанной для получения соединения в примере 31, но при этом проводили реакцию соединения 1 с с 5-йод-2-морфолино-пиридином вместо 3-бромхинолина. Очистку проводили методом флэш-хроматографии петролейным эфиром - этилацетатом в отношении 6 : 4 и получали соединение примера 32. 1 Н-ЯМР (CDCl3): 2,48-2,52 (m, 2H), 2,71-2,76 (m, 2H), 3,50-3,58 (m, 4H), 3,66-3,78 (m, 4 Н), 3,81-3,92MS: [M+H]+ = 406,28 Пример 33. 1-(3-Нитро-2-пиридил)-4-[3-(6-фтор-3-пиридил)проп-2-инилиден]пиперидин Одноименное соединение получали в соответствии с процедурой, описанной для получения соединения в примере 31, но при этом использовали 5-бром-2-фторпиридин вместо 3-бромхинолина при присоединении к соединению 1 с. Очистку проводили методом флэш-хроматографии петролейным эфиром этилацетатом в отношении 6 : 4 и получали соединение примера 33. 1 Н-ЯМР (CDCl3): 2,50-2,54 (m, 2H), 2,74-2,78 (m, 2H), 3,52-3,59 (m, 4H), 5,64 (s, 1H), 6,80-6,84 (m,1H), 6,90-6,95 (m, 1H), 7,80-7,85 (m, 1H), 8,19 (d, 1H), 8,31 (s, 1H), 8,39-8,41 (m, 1H).MS: [M+H]+ = 339,14 Пример 34. 1-(3-Нитро-2-пиридил)-4-[3-(6-ацетил-2-пиридил)проп-2-инилиден]пиперидин Одноименное соединение получали в соответствии с процедурой, описанной для получения соединения в примере 31, но при этом использовали 2-ацетил-6-бромпиридин вместо 3-бромхинолина при присоединении к соединению 1 с. Очистку проводили методом флэш-хроматографии петролейным эфиром - этилацетатом в отношении 6 : 4 и получали одноименное соединение. 1 Н-ЯМР (CDCl3): 2,53-2,58 (m, 2H), 2,77 (s, 3 Н), 2,81-2,86 (m, 2H), 3,55-3,61 (m, 4H), 5,70 (s, 1H),6,80-6,84 (m, 1H), 7,58-7,62 (m, 1H), 7,78-7,84 (m, 1H), 7,95-7,99 (m, 1H), 8,18-8,22 (m, 1H), 8,38-8,41 (m,1H). MS: [M+H]+ = 363,28 Пример 35. 1-(3-Нитро-2-пиридил)-4-[3-(6-изопропокси-3-пиридил)проп-2-инилиден]пиперидин Одноименное соединение получали в соответствии с процедурой, описанной для получения соединения в примере 31, но при этом использовали 5-йод-2-изопропоксипиридин вместо 3-бромхинолина при присоединении к соединению 1 с. Очистку проводили методом флэш-хроматографии петролейным эфиром - этилацетатом в отношении 3,5 : 6,5 и получали одноименное соединение. 1 Пример 36. 1-(3-Нитро-2-пиридил)-4-[3-(3-метокси-2-пиридил)проп-2-инилиден]пиперидин Одноименное соединение получали в соответствии с процедурой, описанной для получения соединения в примере 31, но при этом использовали 2-йод-3-метоксипиридин вместо 3-бромхинолина. Очистку проводили методом флэш-хроматографии петролейным эфиром - этилацетатом в отношении 1 : 1 и получали соединение примера 36. 1 Н-ЯМР (CDCl3): 2,50-2,56 (m, 2H), 2,86-2,92 (m, 2H), 3,52-3,60 (m, 4H), 3,98 (s, 3 Н), 5,75 (m, 1 Н),6,76-6,81 (m, 1H), 7,35-7,38 (m, 2H), 8,16-8,19 (m, 1H), 8,23-8,31 (m, 1H), 8,35-8,41 (m, 1H).MS: [M+H]+ = 351,24 Пример 37. 1-Фенил-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин Смесь соединения примера 3 (0,22 г, 1,04 ммоль), бромбензола (0,17 г, 1,04 ммоль), карбоната цезия(0,68 г, 2,1 ммоль), 2,2-бис(дифенилфосфино)-1,1-бинафтила (BINAP) (0,031 г, 0,05 ммоль), ацетата палладий (II) (0,01 мг, 0,05 ммоль) в безводном дегазированном толуоле (10 мл) нагревали при 110 С в атмосфере азота в течение 12 ч в герметичном сосуде. Реакционную смесь охлаждали, вливали в воду и экстрагировали этилацетатом. Комбинированные органические слои промывали рассолом, высушивали над Na2SO4, выпаривали до сухого состояния под вакуумом и получали остаток, который очищали методом флэш-хроматографии (этилацетат - петролейный эфир в отношении 2:8), обеспечивая получение одноименного соединения (0,30 г). 1 Н-ЯМР (CDCl3): 2,40-2,65 (m, 5 Н), 2,86 (brd, 2 Н), 3,38 (brd, 4 Н), 5,63 (s, 1H), 6,8-7,20 (m, 6H),7,32(d, 1H, J = 7,65 Hz), 7,58 (t, 1H, J = 7,65 Hz).MS: [M+H]+ = 289,3 Пример 38. 1-(2-Цианофенил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин Было получено одноименное соединение в соответствии с процедурой, описанной для получения соединения примера 37, но при этом заменяя бромбензол на 2-бромбензонитрил. Очистку проводили методом флэш-хроматографии (этилацетат - петролейный эфир в отношении 3 : 7) и получали одноименное соединение. 1MS: [M+H]+ = 314,3 Пример 39. 1-(4-Метокси-2-нитрофенил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин Было получено одноименное соединение в соответствии с процедурой, описанной для получения соединения примера 37, но при этом бромбензол заменили 4-бром-3-нитроанизолом. Очистку проводили методом флэш-хроматографии (этилацетат-петролейный эфир в отношении 3 : 7) и получали одноименное соединение. 1 Н-ЯМР (CDCl3): 2,45-2,55 (m, 2 Н), 2,61 (s, 3 Н), 2,75-2,85 (m, 2 Н), 3,00-3,15 (m, 4 Н), 3,84 (s, 3 Н),5,60 (s, 1H), 7,05-7,20 (m, 3 Н), 7,24-7,35 (m, 2 Н) 7,59 (t, 1H, J = 7,65 Hz).MS: [M+H]+ = 364,3 Пример 40. 1-(t-бутоксикарбонил)-4-[3-(5-циано-3-пиридил)проп-2-инилиден]пиперидин Смесь соединения 2b (0,5 г, 2,26 ммоль), 5-бромникотиннитрила (0,511 г, 2,26 ммоль),бис(трифенилфосфин)палладий(II)дихлорида (80 мг, 0,05 ммоль) и CuI (43,1 мг, 0,1 ммоль) в безводном и дегазированном триэтиламине (12,6 мл) нагревали при 80 С в атмосфере азота в течение 2 ч в герметизированном сосуде. Реакционную смесь охлаждали, фильтровали на целите, вливали в воду и экстрагировали этилацетатом. Комбинированные органические слои промывали рассолом, высушивали надNa2SO4, выпаривали до сухого состояния под вакуумом и получали остаток, который очищали методом флэш-хроматографии (градиент этилацетата - петролейного эфира от 4 : 96 до 30:70), обеспечивая получение одноименного соединения (0,731 г).MS: [M+H]+ = 324,2 Пример 41. 1-(t-бутоксикарбонил)-4-[3-(6-циано-3-пиридил)проп-2-инилиден]пиперидин Было получено одноименное соединение в соответствии с процедурой, описанной для получения соединения примера 40, но при этом 5-бромникотиннитрил заменили 5-бром-2-цианопиридином. Очистку проводили методом флэш-хроматографии (градиент этилацетата-петролейного эфира от 5 : 95 до 40 : 60) и получали одноименный продукт.MS: [M+H]+ = 324,2 Примеры 42 и 43. 1-(3-нитро-2-пиридил)-4-[3-(5-циано-3-пиридил)проп-2-инилиден]пиперидин 1-(3-нитро-2-пиридил)-4-[3-(6-циано-3-пиридил)проп-2-инилиден]пиперидин 4-[3-(5-циано-3-пиридил)-проп-2-инилиден]пиперидин (соединение 42 а) 4-[3-(6-ииано-3-пиридил)-проп-2-инилиден]пиперидин (соединение 43 а) Одноименные соединения получали в соответствии с процедурой, описанной для получения соединения примера 3, но при этом начинали с соединений примеров 40 и 41 соответственно вместо соединения примера 2. Сырые продукты использовали на следующем этапе без дополнительной очистки.MS: [M+H]+ = 224,3 1-(3-нитро-2-пиридил)-4-[3-(5-ииано-3-пиридил)проп-2-инилиден]пиперидин (соединение 42) 1-(3-нитро-2-пиридил)-4-[3-(6-циано-3-пиридил)проп-2-инилиден]пиперидин (соединение 43) При использовании 2-бром-3-нитропиридина вместо 1-бром-2-нитробензола и при проведении реакции в соответствии с описанием в примере 4, но при перемешивании в течение ночи при комнатной температуре в N,N-диметилацетамиде в присутствии молярного эквивалента триэтиламина легко синтезировали одноименные продукты.MS: [M+H]+ = 346,2 Пример 44. 1-(t-бутоксикарбонил)-4-[3-(2-метил-1,3-тиазол-4-ил)проп-2-инилиден]пиперидин 1-(t-бутоксикарбонил)-4-бромметилен-пиперидин (Соединение 44 а) Бис-триметилсилиламид лития (1 M в ТГФ, 7,38 мл, 7,38 ммоль) добавляли по каплям в суспензию бромметилтрифенилфосфиний бромида (3,22 г, 7,38 ммоль) при -15 С в атмосфере азота. Спустя 15 мин при перемешивании при этой же температуре добавляли N-Boc пиперидон (1,4 г, 7,03 ммоль), растворенный в ТГФ (10 мл). Перемешивание продолжали и спустя 2 ч при комнатной температуре реакционную смесь быстро охлаждали водой и этилацетатом. Комбинированные экстракты промывали, высушивали над Na2SO4, выпаривали до сухого состояния. Сырой остаток очищали методом автоматизированной флэш-хроматографии (этилацетат - петролейный эфир в отношении 98 : 2), обеспечивая получение одноименного соединения (1,27 г).MS: [M+H]+ = 276,2 1-(t-бутоксикарбонил)-4-[3-(2-метил-1,3-тиазол-4-ил)проп-2-инилиден]пиперидин Раствор гидрата фторида тетрабутиламмония (818 мг, 2,93 ммоль) в ДМФ (8 мл) по каплям добавляли в раствор 2-метил-4-триметилсиланилэтинилтиазола (Yasuyoshi et al., J. Med. Chem., 49, 3, 2006,1080 - 1100, 0,52 г, 2,66 ммоль) в ДМФ (7 мл). Спустя 2 ч при перемешивании добавляли бис(трифенилфосфин)палладий(II)дихлорид (93 мг, 0,13 ммоль), CuI (51 мг, 0,27 ммоль), и безводный и дегазированный триэтиламин (1 мл) нагревали при 80 С в атмосфере азота в течение 2 ч в герметичном сосуде. Реакционную смесь охлаждали, вливали в воду и экстрагировали этилацетатом. Комбинированные органические слои промывали рассолом, высушивали над Na2SO4, выпаривали до сухого состояния под вакуумом и получали остаток, который очищали методом флэш-хроматографии (градиент этилацетата - петролейного эфира от 4 : 96 до 30:70), обеспечивая получение одноименного соединения (0,847 г).MS: [М+Н]+ = 319,2 Пример 45. 4-[3-(2-Метил-1,3-тиазол-4-ил)проп-2-инилиден]пиперидин Одноименный продукт синтезировали в соответствии с процедурой, описанной в примере 3, но при этом начинали с соединения примера 44 вместо соединения примера 2.MS: [М+Н]+ = 219,2 Пример 46. 1-(3-Нитро-2-пиридил)-4-[3-(2-метил-1,3-тиазол-4-ил)проп-2-инилиден]пиперидин Одноименный продукт синтезировали в соответствии с процедурой, описанной в примере 42, но при этом начинали с соединения примера 45 вместо соединений 42 а. После стандартной процедуры выделения продукта реакции сырой продукт очищали методом флэш-хроматографии (градиент этилацетата- петролейного эфира от 8 : 92 до 40 : 60), обеспечивая получение одноименного соединения.MS: [М+Н]+ = 341,1 Примеры 47-53 (табл. II) Указанные соединения синтезировали в соответствии с процедурой, описанной в примере 37, но при этом бромбензол заменяли реагентом В (таблица II). Очистку проводили методом автоматизированной флэш-жидкостной хроматографии (Horizon - Biotage), элюируя градиентом петролейного эфира этилацетата от 95 : 5 до 30 : 70. Таблица II Пример 54. 1-(2-Пиридил)-4-[3-(6-метил-2-пиридил)проп-2-инилиден]пиперидин Раствор соединения примера 3 (100 мг, 0,47 ммоль), 2-фторпиридина (45,5 мкл, 0,52 ммоль), триэтиламина (102 мкл) в N-метилпирролидоне нагревали в микроволновой печи при 160 С в течение 20 мин. Далее реакционную смесь охлаждали, вливали в воду и экстрагировали этилацетатом. Комбинированные органические слои промывали рассолом, высушивали над Na2SO4, выпаривали до сухого состояния под вакуумом и получали остаток, который очищали методом флэш-хроматографии (градиент этилацетата - петролейного эфира от 7:93 до 40:0), обеспечивая получение одноименного соединения (0,02 г).MS: [M+H]+ = 290,34 Примеры 55-60 (таблица III) Указанные соединения синтезировали в соответствии с процедурой, описанной в примере 54, заменяя 2-фторпиридин реагентом В. Очистку проводили методом автоматизированной флэш-жидкостной хроматографии (Horizon - Biotage), элюируя градиентом петролейного эфира - этилацетата от 95:5 до 30:70.
МПК / Метки
МПК: C07D 513/04, A61P 13/02, C07D 401/06, A61K 31/4545, C07D 401/04, C07D 407/14, C07D 409/14, C07D 417/14, C07D 471/04, C07D 401/14, C07D 413/14, C07D 417/06, C07D 211/70
Метки: 5-го, глутаматных, mglu5, соединения, антагонистов, качестве, гетероциклические, рецепторов, подтипа, метаботропных, новые
Код ссылки
<a href="https://eas.patents.su/30-18328-novye-geterociklicheskie-soedineniya-v-kachestve-antagonistov-metabotropnyh-glutamatnyh-receptorov-5-go-podtipa-mglu5.html" rel="bookmark" title="База патентов Евразийского Союза">Новые гетероциклические соединения в качестве антагонистов метаботропных глутаматных рецепторов 5-го подтипа (мглу5)</a>
Предыдущий патент: Способ химической обработки поверхностей полупроводников и устройство для его выполнения
Следующий патент: Трубопровод для транспортировки криогенной текучей среды
Случайный патент: Способ защиты радиолокационных станций от противорадиолокационных ракет с использованием передающих устройств малой мощности и устройство для его осуществления