Производные пиррола в качестве положительных аллостерических модуляторов метаботропных глутаматных рецепторов
Номер патента: 14081
Опубликовано: 30.08.2010
Авторы: Рошер Джен-Филиппе, Лингард Йан, Поли Соня Мария, Паломби Джиованни, Ле Поул Эммануэль, Гаглиарди Стефания
Формула / Реферат
1. Соединение, которое имеет формулу I-B
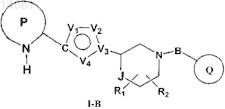
где R1и R2 независимо друг от друга представляют собой водород, -(C1-С6)алкил или галоген;
Р представляет собой возможно конденсированный с бензольным кольцом 5-членный гетероарил, содержащий от 1 до 2 атомов азота в кольце, который может содержать заместитель, выбранный из группы, включающей галоген, (C1-С6)алкил, (C1-С6)галогеналкил, CN и NO2, при этом Р присоединен к остальной части молекулы через атом углерода, соседний с группой -NH- в составе Р;
Q выбран из группы, включающей фенил, 6-членный гетероарил, содержащий 1 атом азота в кольце, и 5-членный гетероарил, содержащий 2 соседних гетероатома, где один из указанных соседних гетероатомов представляет собой N, а второй представляет собой О, при этом каждый из указанных фенила и гетероарилов может содержать от 1 до 2 заместителей, выбранных из группы, включающей галоген и (C1-С6)алкил;
V1 и V2независимо друг от друга представляют собой -О- или -N=;
V3 представляет собой С или N;
V4 представляет собой N;
В представляет собой -С(=O)-;
J представляет собой одинарную связь или -С-;
или фармацевтически приемлемые соли, гидраты или сольваты указанного соединения.
2. Соединение по п.1, которое имеет формулу I-C

в которой R1 и R2независимо друг от друга представляют собой водород, -(C1-С6)алкил или галоген;
Р представляет собой возможно конденсированный с бензольным кольцом 5-членный гетероарил, содержащий от 1 до 2 атомов азота в кольце, который может содержать заместитель, выбранный из группы, включающей галоген, (C1-С6)алкил, (C1-С6)галогеналкил, CN и NO2, при этом Р присоединен к остальной части молекулы через атом углерода, соседний с группой -NH- в составе Р;
Q выбран из группы, включающей фенил, 6-членный гетероарил, содержащий 1 атом азота в кольце, и 5-членный гетероарил, содержащий 2 соседних гетероатома, где один из указанных соседних гетероатомов представляет собой N, а второй представляет собой О,
при этом каждый из указанных фенила и гетероарилов может содержать от 1 до 2 заместителей, выбранных из группы, включающей галоген и (C1-С6)алкил;
В представляет собой -С(=O)-;
J представляет собой -С- или одинарную связь;
или фармацевтически приемлемые соли, гидраты или сольваты указанного соединения.
3. Соединение по п.1, которое имеет формулу II-А
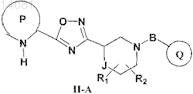
где R1и R2 независимо друг от друга представляют собой водород, -(C1-С6)алкил или галоген;
Р представляет собой возможно конденсированный с бензольным кольцом 5-членный гетероарил, содержащий от 1 до 2 атомов азота в кольце, который может содержать заместитель, выбранный из группы, включающей галоген, (C1-С6)алкил, (C1-С6)галогеналкил, CN и NO2, при этом Р присоединен к остальной части молекулы через атом углерода, соседний с группой-NH- в составе Р;
Q выбран из группы, включающей фенил, 6-членный гетероарил, содержащий 1 атом азота в кольце, и 5-членный гетероарил, содержащий 2 соседних гетероатома, где один из указанных соседних гетероатомов представляет собой N, а второй представляет собой О, при этом каждый из указанных фенила и гетероарилов может содержать от 1 до 2 заместителей, выбранных из группы, включающей галоген и (C1-С6)алкил;
В представляет собой -С(=O)-;
J представляет собой одинарную связь или -С-;
или фармацевтически приемлемые соли, гидраты или сольваты указанного соединения.
4. Соединение по п.1, которое имеет формулу II-С
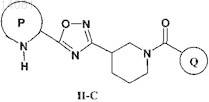
где Р представляет собой возможно конденсированный с бензольным кольцом 5-членный гетероарил, содержащий от 1 до 2 атомов азота в кольце, который может содержать заместитель, выбранный из группы, включающей галоген, (C1-С6)алкил, (C1-С6)галогеналкил, CN и NO2, при этом Р присоединен к остальной части молекулы через атом углерода, соседний с группой -NH- в составе Р;
Q выбран из группы, включающей фенил, 6-членный гетероарил, содержащий 1 атом азота в кольце, и 5-членный гетероарил, содержащий 2 соседних гетероатома, где один из указанных соседних гетероатомов представляет собой N, а второй представляет собой О, при этом каждый из указанных фенила и гетероарилов может содержать от 1 до 2 заместителей, выбранных из группы, включающей галоген и (C1-С6)алкил;
или фармацевтически приемлемые соли, гидраты или сольваты указанного соединения.
5. Соединение по п.1, которое имеет формулу I-D
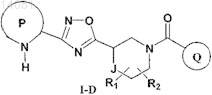
где R1и R2 независимо друг от друга представляют собой водород, -(C1-С6)алкил или галоген;
Р представляет собой возможно конденсированный с бензольным кольцом 5-членный гетероарил, содержащий от 1 до 2 атомов азота в кольце, который может содержать заместитель, выбранный из группы, включающей галоген, (C1-С6)алкил, (C1-С6)галогеналкил, CN и NO2, при этом Р присоединен к остальной части молекулы через атом углерода, соседний с группой -NH- в составе Р;
Q выбран из группы, включающей фенил, 6-членный гетероарил, содержащий 1 атом азота в кольце, и 5-членный гетероарил, содержащий 2 соседних гетероатома, где один из указанных соседних гетероатомов представляет собой N, а второй представляет собой О, при этом каждый из указанных фенила и гетероарилов может содержать от 1 до 2 заместителей, выбранных из группы, включающей галоген и (C1-С6)алкил;
J представляет собой одинарную связь или -С-;
или фармацевтически приемлемые соли, гидраты или сольваты указанного соединения.
6. Соединение по п.1, которое имеет формулу I-Е

где Р представляет собой возможно конденсированный с бензольным кольцом 5-членный гетероарил, содержащий от 1 до 2 атомов азота в кольце, который может содержать заместитель, выбранный из группы, включающей галоген, (C1-C6)алкил, (C1-С6)галогеналкил, CN и NO2,
при этом Р присоединен к остальной части молекулы через атом углерода, соседний с группой -NH- в составе Р;
Q выбран из группы, включающей фенил, 6-членный гетероарил, содержащий 1 атом азота в кольце, и 5-членный гетероарил, содержащий 2 соседних гетероатома, где один из указанных соседних гетероатомов представляет собой N, а второй представляет собой О,
при этом каждый из указанных фенила и гетероарилов может содержать от 1 до 2 заместителей, выбранных из группы, включающей галоген и (C1-С6)алкил;
или фармацевтически приемлемые соли, гидраты или сольваты указанного соединения.
7. Соединение по любому из пп.1-6, которое может существовать в виде оптических изомеров, отличающееся тем, что указанное соединение представляет собой или рацемическую смесь или индивидуальный оптический изомер.
8. Соединение по любому из пп.1-6, отличающееся тем, что указанное соединение выбирают из
(4-фторфенил)-{(S)-3-[3-(1Н-пиррол-2-ил)-[1,2,4]оксадиазол-5-ил]пиперидин-1-ил}метанона;
(2,4-дифторфенил)-{(S)-3-[3-(1Н-пиррол-2-ил)-[1,2,4]оксадиазол-5-ил]пиперидин-1-ил}метанона;
(3,4-дифторфенил)-{(S)-3-[3-(1Н-пиррол-2-ил)-[1,2,4]оксадиазол-5-ил]пиперидин-1-ил}метанона;
(6-фторпиридин-3-ил)-{(S)-3-[3-(1H-пиррол-2-ил)-[1,2,4]оксадиазол-5-ил]пиперидин-1-ил}метанона;
(3,4-дифторфенил)-{3-[5-(1H-пиррол-2-ил)-[1,2,4]оксадиазол-3-ил]пиперидин-1-ил}метанона;
(2,4-дифторфенил)-{3-[5-(1H-пиррол-2-ил)-[1,2,4]оксадиазол-3-ил]пиперидин-1-ил}метанона;
(4-фторфенил)-{3-[5-(1Н-пиррол-2-ил)-[1,2,4]оксадиазол-3-ил]пиперидин-1-ил}метанона;
(6-фторпиридин-3-ил)-{3-[5-(1H-пиррол-2-ил)-[1,2,4]оксадиазол-3-ил]пиперидин-1-ил}метанона;
(4-фтор-2-метилфенил)-{3-[5-(1H-пиррол-2-ил)-[1,2,4]оксадиазол-3-ил]пиперидин-1-ил}метанона;
(3,4-дифторфенил)-{(S)-3-[5-(1H-пиррол-2-ил)-[1,2,4]оксадиазол-3-ил]пиперидин-1-ил}метанона;
(4-фторфенил)-{3-[5-(1H-индол-2-ил)-[1,2,4]оксадиазол-3-ил]пиперидин-1-ил}метанона;
(2,4-дифторфенил)-{(S)-3-[3-(1H-индол-2-ил)-[1,2,4](оксадиазол-5-ил]пиперидин-1-ил}метанона;
(4-фторфенил)-{3-[5-(2Н-пиразол-3-ил)-[1,2,4]оксадиазол-3-ил]пиперидин-1-ил}метанона;
(3,4-дифторфенил)-{3-[5-(2Н-пиразол-3-ил)-[1,2,4]оксадиазол-3-ил]пиперидин-1-ил}метанона;
(4-фторфенил)-{3-[5-(1Н-имидазол-2-ил)-[1,2,4]оксадиазол-3-ил]пиперидин-1-ил}метанона;
(3,4-дифторфенил)-{(S)-3-[3-(1H-индол-2-ил)-[1,2,4]оксадиазол-5-ил]пиперидин-1-ил}метанона;
(4-фторфенил)-{(S)-3-[3-(1Н-индол-2-ил)-[1,2,4]оксадиазол-5-ил]пиперидин-1-ил}метанона;
(3,4-дифторфенил)-{3-[5-(1Н-имидазол-2-ил)-[1,2,4]оксадиазол-3-ил]пиперидин-1-ил}метанона;
{(S)-3-[3-(1H-индол-2-ил)-[1,2,4]оксадиазол-5-ил]пиперидин-1-ил}-(5-метилизоксазол-4-ил)метанона;
(5-метилизоксазол-4-ил)-{(S)-3-[3-(1H-пиррол-2-ил)-[1,2,4]оксадиазол-5-ил]пиперидин-1-ил}метанона;
(6-фторпиридин-3-ил)-{(S)-3-[5-(1H-пиррол-2-ил)-[1,2,4]оксадиазол-3-ил]пиперидин-1-ил}метанона;
(4-фторфенил)-{(S)-3-[5-(1H-пиррол-2-ил)-[1,2,4]оксадиазол-3-ил]пиперидин-1-ил}метанона;
(6-фторпиридин-3-ил)-{3-[5-(1Н-индол-2-ил)-[1,2,4]оксадиазол-3-ил]пиперидин-1-ил}метанона;
(4-фторфенил)-{(S)-3-[3-(1H-имидазол-2-ил)-[1,2,4]оксадиазол-5-ил]пиперидин-1-ил}метанона;
(3,4-дифторфенил)-{(S)-3-[3-(1H-имидазол-2-ил)-[1,2,4]оксадиазол-5-ил]пиперидин-1-ил}метанона;
{3-[5-(1H-индол-2-ил)-[1,2,4]оксадиазол-3-ил]пиперидин-1-ил}-(5-метилизоксазол-4-ил)метанона;
(4-фторфенил)-{(S)-3-[5-(4-метил-1H-пиррол-2-ил)-[1,2,4]оксадиазол-3-ил]пиперидин-1-ил}метанона;
(6-фторпиридин-3-ил)-{(S)-3-[5-(4-метил-1Н-пиррол-2-ил)-[1,2,4]оксадиазол-3-ил]пиперидин-1-ил}метанона;
(5-метилизоксазол-4-ил)-{(S)-3-[5-(4-метил-1Н-пиррол-2-ил)-[1,2,4]оксадиазол-3-ил]пиперидин-1-ил}метанона;
(2-фторпиридин-4-ил)-{(S)-3-[5-(4-метил-1Н-пиррол-2-ил)-[1,2,4]оксадиазол-3-ил]пиперидин-1-ил}метанона;
(4-фторфенил)-{(S)-3-[3-(4-метил-1Н-пиррол-2-ил)][1,2,4]оксадиазол-5-илпиперидин-1-ил}метанона;
(3,4-дифторфенил)-{(S)-3-[3-(4-метил-1Н-пиррол-2-ил)-[1,2,4]оксадиазол-5-ил]пиперидин-1-ил}метанона;
(6-фторпиридин-3-ил)-{(S)-3-[3-(4-метил-1Н-пиррол-2-ил)-[1,2,4]оксадиазол-5-ил]пиперидин-1-ил}метанона;
(2-фторпиридин-4-ил)-{(S)-3-[3-(4-метил-1Н-пиррол-2-ил)-[1,2,4]оксадиазол-5-ил]пиперидин-1-ил}метанона;
(5-метилизоксазол-4-ил)-{(S)-3-[3-(4-метил-1Н-пиррол-2-ил)-[1,2,4]оксадиазол-5-ил]пиперидин-1-ил}метанона;
(4-фторфенил)-{(S)-3-[5-(4-нитро-1H-пиррол-2-ил)-[1,2,4]оксадиазол-3-илпиперидин-1-ил}метанона;
(4-фторфенил)-{(R)-3-[3-(1H-пиррол-2-ил)-[1,2,4]оксадиазол-5-илпиперидин-1-ил}метанона;
(4-фторфенил)-{(S)-3-[5-(5-метил-1Н-пиррол-2-ил)-[1,2,4]оксадиазол-3-илпиперидин-1-ил}метанона;
{(S)-3-[5-(4-хлор-1Н-пиррол-2-ил)-[1,2,4]оксадиазол-3-илпиперидин-1-ил}-(4-фторфенил)метанона;
{(S)-3-[5-(4-хлор-1H-пиррол-2-ил)-[1,2,4]оксадиазол-3-илпиперидин-1-ил}-(6-фторпиридин-3-ил)метанона;
{(S)-3-[5-(4-хлор-1H-пиррол-2-ил)-[1,2,4]оксадиазол-3-илпиперидин-1-ил}-(2-фторпиридин-4-ил)метанона;
{(S)-3-[5-(4-хлор-1H-пиррол-2-ил)-[1,2,4]оксадиазол-3-илпиперидин-1-ил}-(5-метилизоксазол-4-ил)метанона;
{(S)-3-[3-(4-хлор-1H-пиррол-2-ил)-[1,2,4]оксадиазол-5-илпиперидин-1-ил}-(4-фторфенил)метанона;
{(S)-3-[5-(4-бром-1H-пиррол-2-ил)-[1,2,4]оксадиазол-3-илпиперидин-1-ил}-(6-фторпиридин-3-ил)метанона;
{(S)-3-[3-(4-бром-1H-пиррол-2-ил)-[1,2,4]оксадиазол-5-илпиперидин-1-ил}-(4-фторфенил)метанона;
{(S)-3-[3-(4-бром-1H-пиррол-2-ил)-[1,2,4]оксадиазол-5-илпиперидин-1-ил}-(6-фторпиридин-3-ил)метанона;
(4-фторфенил)-{3-фтор-3-[3-(1H-пиррол-2-ил)-[1,2,4]оксадиазол-5-илпиперидин-1-ил}метанона;
{3,3-дифтор-5-[3-(1Н-пиррол-2-ил)-[1,2,4]оксадиазол-5-илпиперидин-1-ил}-(4-фторфенил)метанона;
{3,3-диметил-5-[3-(1H-пиррол-2-ил)-[1,2,4]оксадиазол-5-илпиперидин-1-ил}-(4-фторфенил)метанона;
(4-фторфенил)-{(S)-3-[3-(4-фтор-1H-пиррол-2-ил)-[1,2,4]оксадиазол-5-илпиперидин-1-ил}метанона;
(3,4-дифторфенил)-{(S)-3-[3-(4-фтор-1Н-пиррол-2-ил)-[1,2,4]оксадиазол-5-илпиперидин-1-ил}метанона;
(6-фторпиридин-3-ил)-{(S)-3-[3-(4-фтор-1Н-пиррол-2-ил)-[1,2,4]оксадиазол-5-ил]пиперидин-1-ил}метанона;
(2-фторпиридин-4-ил)-{(S)-3-[3-(4-фтор-1Н-пиррол-2-ил)-[1,2,4]оксадиазол-5-ил]пиперидин-1-ил}метанона;
(4-фторфенил)-{(S)-3-[5-(1Н-пиррол-2-ил)тетразол-2-илпиперидин-1-ил}метанона;
(4-фторфенил)-{(S)-3-[5-(4-трифторметил-1Н-имидазол-2-ил)-[1,2,4]оксадиазол-3-ил]пиперидин-1-ил}метанона;
(6-фторпиридин-3-ил)-{(S)-3-[5-(4-изопропил-1Н-пиррол-2-ил)-[1,2,4]оксадиазол-3-ил]пиперидин-1-ил}метанона;
(4-фторфенил)-{3-[3-(1H-пиррол-2-ил)-[1,2,4]оксадиазол-5-ил]пирролидин-1-ил}метанона;
(3-фторпиридин-4-ил)-{(S)-3-[5-(4-метил-1Н-пиррол-2-ил)-[1,2,4]оксадиазол-3-ил]пиперидин-1-ил}метанона;
{(S)-3-[5-(4-хлор-1Н-пиррол-2-ил)-[1,2,4]оксадиазол-3-илпиперидин-1-ил}-(3-фторпиридин-4-ил)метанона;
(2-фторпиридин-4-ил)-{(S)-3-[5-(4-фтор-1Н-пиррол-2-ил)-[1,2,4]оксадиазол-3-ил]пиперидин-1-ил}метанона;
{(S)-3-[5-(4-бром-1Н-пиррол-2-ил)-[1,2,4]оксадиазол-3-илпиперидин-1-ил}-(3-фторпиридин-4-ил)метанона;
(3-фторпиридин-4-ил)-{(S)-3-[5-(4-фтор-1Н-пиррол-2-ил)-[1,2,4]оксадиазол-3-ил]пиперидин-1-ил}метанона;
(4-фторфенил)-{(S)-3-[5-(4-фтор-1Н-пиррол-2-ил)-[1,2,4]оксадиазол-3-илпиперидин-1-ил}метанона;
(6-фторпиридин-3-ил)-{(S)-3-[5-(4-фтор-1Н-пиррол-2-ил)-[1,2,4]оксадиазол-3-ил]пиперидин-1-ил}метанона;
{(S)-3-[3-(4-хлор-1H-пиррол-2-ил)-[1,2,4]оксадиазол-5-илпиперидин-1-ил}-(6-фторпиридин-3-ил)метанона;
{(S)-3-[3-(4-хлор-1H-пиррол-2-ил)-[1,2,4]оксадиазол-5-илпиперидин-1-ил}-(2-фторпиридин-4-ил)метанона;
{(S)-3-[3-(4-хлор-1H-пиррол-2-ил)-[1,2,4]оксадиазол-5-илпиперидин-1-ил}-(3-фторпиридин-4-ил)метанона;
{(S)-3-[3-(4-хлор-1H-пиррол-2-ил)-[1,2,4]оксадиазол-5-илпиперидин-1-ил}-(5-метилизоксазол-4-ил)метанона;
{(S)-3-[3-(4-бром-1H-пиррол-2-ил)-[1,2,4]оксадиазол-5-илпиперидин-1-ил}-(3-фторпиридин-4-ил)метанона;
(3-фторпиридин-4-ил)-{(S)-3-[3-(4-фтор-1Н-пиррол-2-ил)-[1,2,4]оксадиазол-5-ил]пиперидин-1-ил}метанона;
(3-фторпиридин-4-ил)-{(S)-3-[3-(4-метил-1Н-пиррол-2-ил)-[1,2,4]оксадиазол-5-ил]пиперидин-1-ил}метанона;
(4-фторфенил)-{(S)-3-[5-(4-циано-1Н-пиррол-2-ил)-[1,2,4]оксадиазол-3-илпиперидин-1-ил}метанона;
5-{3-[(S)-1-(6-фторпиридин-3-карбонил)пиперидин-3-ил]-[1,2,4]оксадиазол-5-ил}-1H-пиррол-3-карбонитрил;
5-{3-[(S)-1-(2-фторпиридин-4-карбонил)пиперидин-3-ил]-[1,2,4]оксадиазол-5-ил}-1H-пиррол-3-карбонитрила;
5-{3-[(S)-1-(3-фторпиридин-4-карбонил)пиперидин-3-ил]-[1,2,4]оксадиазол-5-ил}-1H-пиррол-3-карбонитрила;
(4-фторфенил)-{(S)-3-[5-(4-трифторметил-1Н-пиррол-2-ил)-[1,2,4]оксадиазол-3-ил]пиперидин-1-ил}метанона;
(3-фторпиридин-4-ил)-{(S)-3-[5-(4-трифторметил-1Н-пиррол-2-ил)-[1,2,4]оксадиазол-3-илпиперидин-1-ил}метанона;
(6-фторпиридин-3-ил)-{(S)-3-[5-(4-трифторметил-1Н-пиррол-2-ил)-[1,2,4]оксадиазол-3-илпиперидин-1-ил}метанона;
(3,4-дифторфенил)-{(S)-3-[3-(4-метил-1Н-имидазол-2-ил)-[1,2,4]оксадиазол-5-ил]пиперидин-1-ил}метанона;
{(S)-3-[5-(4-хлор-1H-пиррол-2-ил)-[1,2,4]оксадиазол-3-илпиперидин-1-ил}пиридин-4-илметанона;
(6-фторпиридин-3-ил)-{(S)-3-[3-(4-трифторметил-1Н-пиррол-2-ил)-[1,2,4]оксадиазол-5-илпиперидин-1-ил}метанона.
9. Фармацевтическая композиция, которая содержит терапевтически эффективное количество соединения по любому из пп.1-8 и фармацевтически приемлемый носитель и/или наполнитель.
10. Способ лечения или предотвращения у млекопитающего, включая человека, состояния, на лечение или предотвращение которого оказывает действие или лечению или предотвращению которого способствует нейромодуляторное действие аллостерических модуляторов mGluR5, включающий введение млекопитающему, которое нуждается в указанном лечении или предотвращении, эффективного количества соединения или композиции по любому из пп.1-9.
11. Способ лечения или предотвращения у млекопитающего, включая человека, состояния, на лечение или предотвращение которого оказывает действие или лечению или предотвращению которого способствует нейромодуляторное действие положительного аллостерического модулятора mGluR5 (энхансера), включающий введение указанному млекопитающему, которое нуждается в указанном лечении или предотвращении, эффективного количества соединения или композиции по любому из пп.1-9.
12. Способ лечения или предотвращения расстройства центральной нервной системы, выбранного из группы, включающей тревожные расстройства: агорафобию, генерализованное тревожное расстройство (ГТР), обсессивно-компульсивное расстройство (ОКР), паническое расстройство, посттравматическое стрессовое расстройство (ПТСР), социофобию, другие фобии, тревожное расстройство, связанное с употреблением психоактивных веществ, который включает введение эффективного количества соединения или композиции по любому из пп.1-9.
13. Способ лечения или предотвращения расстройства центральной нервной системы, выбранного из группы, включающей расстройства у детей - синдром дефицита внимания с гиперактивностью, который включает введение эффективного количества соединения или композиции по любому из пп.1-9.
14. Способ лечения или предотвращения расстройства центральной нервной системы, выбранного из группы, включающей расстройства пищевого поведения: нервную анорексию, нервную булимию, включающий введение эффективного количества соединения или композиции по любому из пп.1-9.
15. Способ лечения или предотвращения расстройства центральной нервной системы, выбранного из группы, включающей расстройства настроения: биполярные расстройства (I & II), циклотимическое расстройство, депрессию, дистимическое расстройство, большое депрессивное расстройство, расстройство настроения, связанное с употреблением психоактивных препаратов, который включает введение эффективного количества соединения или композиции по любому из пп.1-9.
16. Способ лечения или предотвращения расстройства центральной нервной системы, выбранного из группы, включающей психотические расстройства: шизофрению, бредовое расстройство, шизоаффективное расстройство, шизофреноформное расстройство, психотическое расстройство, связанное с употреблением психоактивных веществ, который включает введение эффективного количества соединения или композиции по любому из пп.1-9.
17. Способ лечения или предотвращения расстройства центральной нервной системы, выбранного из группы, включающей когнитивные расстройства: делирий, персистирующий делирий, связанный с употреблением психоактивных веществ, деменцию, деменцию, вызванную ВИЧ, деменцию, вызванную хореей Гентингтона, деменцию, вызванную болезнью Паркинсона, деменцию типа Альцгеймера, персистирующую деменцию, связанную с употреблением психоактивных веществ, умеренные когнитивные нарушения, который включает введение эффективного количества соединения или композиции по любому из пп.1-9.
18. Способ лечения или предотвращения расстройства центральной нервной системы, выбранного из группы, включающей расстройства личности: обсессивно-компульсивное расстройство личности, шизоидное расстройство личности, шизотипальное расстройство личности, который включает введение эффективного количества соединения или композиции по любому из пп.1-9.
19. Способ лечения или предотвращения расстройства центральной нервной системы, выбранного из группы, включающей расстройства, связанные с употреблением психоактивных веществ: злоупотребление алкоголем, алкогольную зависимость, алкогольную абстиненцию, синдром отмены алкоголя с делирием, алкогольное психотическое расстройство, амфетаминовую зависимость, амфетаминовую абстиненцию, кокаиновую зависимость, кокаиновую абстиненцию, никотиновую зависимость, никотиновую абстиненцию, опиоидную зависимость, опиоидную абстиненцию, который включает введение эффективного количества соединения или композиции по любому из пп.1-9.
20. Способ лечения или предотвращения воспалительного заболевания центральной нервной системы, выбранного из форм рассеянного склероза, таких как доброкачественный рассеянный склероз, ремитирующий рассеянный склероз, вторично-прогрессирующий рассеянный склероз, первично-прогрессирующий рассеянный склероз, рецидивирующий рассеянный склероз, который включает введение эффективного количества соединения или композиции по любому из пп.1-9.
21. Применение соединения по любому из пп.1-8 для получения медикамента для лечения или предотвращения заболеваний или состояний согласно любому из пп.12-20.
22. Применение композиции по п.9 для получения медикамента для лечения или предотвращения заболеваний или состояний согласно любому из пп.12-20.
23. Применение соединения по любому из пп.1-8 для приготовления метки для получения изображений метаботропных глутаматных рецепторов.
Текст
ПРОИЗВОДНЫЕ ПИРРОЛА В КАЧЕСТВЕ ПОЛОЖИТЕЛЬНЫХ АЛЛОСТЕРИЧЕСКИХ МОДУЛЯТОРОВ МЕТАБОТРОПНЫХ ГЛУТАМАТНЫХ РЕЦЕПТОРОВ Настоящее изобретение относится к новым соединениям, которые представляют собой производные пиррола и родственные соединения формулы I-В, в которой V1, V2, V3, V4, J, В, Р,Q, R1 и R2 определены в описании. Соединения согласно настоящему изобретению подходят для предотвращения или лечения расстройств центральной или периферической нервной системы, а также других расстройств, модулируемых рецепторами mGluR5. Гаглиарди Стефания (IT), Ле Поул Эммануэль (CH), Лингард Йан, Паломби Джиованни (IT), Поли Сонья Мария, Рошер Джен-Филиппе (CH)(71)(73) Заявитель и патентовладелец: АДДЕКС ФАРМА СА (CH) 014081 Область техники Настоящее изобретение относится к новым соединениям формулы I которые представляют собой положительные аллостерические модуляторы метаботропных рецепторов подтипа 5 (mGluR5), которые пригодны для лечения или предотвращения расстройств центральной нервной системы, таких как, например, снижение когнитивных функций, как позитивные, так и негативные симптомы шизофрении, а также различные другие расстройства центральной или периферической нервной системы, в которые вовлечены глутаматные метаботропные рецепторы подтипа mGluR5. Настоящее изобретение также относится к фармацевтическим соединениям и композициям для предотвращения или лечения указанных заболеваний, в которые вовлечены mGluR5. Предпосылки изобретения Глутамат, основной аминокислотный трансмиттер в центральной нервной системе (ЦНС) млекопитающих, опосредует возбуждающую синаптическую нейротрансмиссию посредством активации рецепторных каналов ионотропных глутаматных рецепторов (iGluRs, а именно NMDA, АМРА и каинатных) и метаботропных глутаматных рецепторов (mGluRs). iGluRs отвечают за быструю возбуждающую трансмиссию (Nakanishi S. et al., (1998) Brain Res. Rev., 26:230-235), тогда как mGluRs играют в большей степени модулирующую роль, что способствует тонкой настройке синаптической эффективности. Глутамат участвует в многочисленных физиологических функциях, таких как долговременное потенцирование(LTP), процесс, который, как полагают, лежит в основе обучения и памяти, а также сердечно-сосудистой регуляции, чувственного восприятия и развития синаптической пластичности. Кроме того, глутамат играет важную роль в патофизиологии различных неврологических и психиатрических заболеваний, особенно в тех случаях, когда наблюдают дисбаланс в глутаматэргической нейротрансмиссии.mGluRs представляют собой связанные с G-белками рецепторы, которые содержат семь трансмембранных доменов. Восемь членов семейства разделены на три группы (группы I, II и III) в соответствии с гомологией их аминокислотных последовательностей и их фармакологическими свойствами (SchoeppD.D. et al. (1999) Neuropharmacology, 38:1431-1476). Активация mGluRs приводит к большому разнообразию внутриклеточных ответов и активации различных трансдукционных каскадов. Среди членов семейства mGluR подтип mGluR5 представляет наибольший интерес для восстановления равновесия при недостатке или избытке нейропередачи при нейропсихиатрических заболеваниях. mGluR5 является членом группы I и его активация инициирует клеточные ответы при помощи опосредованных G-белком механизмов. mGluR5 связывается с фосфолипазой С и стимулирует фосфоинозитидный гидролиз и внутриклеточную мобилизацию кальция. Было показано, что белки mGluR5 локализованы в постсинаптических элементах, граничащих с постсинаптическим уплотнением (Lujan R. et al. (1996) Eur. J. Neurosci., 8:1488-500; Lujan R. et al. (1997)J. Chem. Neuroanat., 13:219-41), и их редко наблюдают в пресинаптических элементах (Romano С. et al.(1995) J. Comp. Neurol., 355:455-69). Рецепторы mGluR5 могут вследствие этого изменять постсинаптические ответы на нейротрансмиттер или регулировать высвобождение нейротрансмиттера. В ЦНС рецепторы mGluR5 широко распространены в основном в коре, гиппокампе, каудатопутамене (хвостатом ядре и скорлупе, вместе составляющих полосатое тело) и прилежащем ядре. Поскольку было показано, что указанные области головного мозга вовлечены в проявления эмоций, мотивационные процессы и многочисленные аспекты когнитивной функции, прогнозируют, что модуляторыmGluR5 могут представлять большой терапевтический интерес. Предполагают, что создание модуляторов mGluR, селективных к подтипам рецептора, может оказаться полезным для множества потенциальных клинических состояний. Указанные состояния включают эпилепсию, нейропатическую и воспалительную боль, многочисленные психиатрические расстройства(см. Brauner-Osborne H. et al. (2000) J. Med. Chem., 43:2609-45; Bordi F. and Ugolini A. (1999) Prog. Neurobiol., 59:55-79; Spooren W. et al. (2003) Behav. Pharmacol., 14:257-77). Гипотеза о том, что гипофункция глутаматэргической системы, которая выражается в гипофункции рецептора NMDA, может быть одной из причин развития шизофрении, получила в последние несколько лет возрастающую поддержку (Goff D.C. and Coyle J.T. (2001) Am. J. Psychiatry, 158:1367-1377; CarlssonA. et al. (2001) Annu. Rev. Pharmacol. Toxicol., 41:237-260 в качестве обзора). Указание на роль дисфункции глутаматэргической нейротрансмиссии также подтверждается тем фактом, что антагонисты глутаматных рецепторов подтипа NMDA могут вызывать полный спектр симптомов, а также психологических проявлений шизофрении, таких как гипофронтальность, нарушенное преимпульсное ингибирование и повышенное освобождение дофамина в подкорке. Кроме того, клинические исследования позволяют предположить, что частота аллелей mGluR5 связана с шизофренией в некоторых группах населения(Devon R.S. et al. (2001) Mol. Psychiatry., 6:311-4) и что увеличение передачи сигналов через mGluR5 об-1 014081 наружено в слоях пирамидальных клеток коры головного мозга больных шизофренией (Ohnuma T. et al.(1998) Brain Res. Mol. Brain Res., 56:207-17). Вовлечение mGluR5 в неврологические и психиатрические заболевания подтверждают данные, показывающие, что активация mGluRs группы I in vivo вызывает потенцирование функции рецепторовNMDA во многих областях головного мозга, главным образом, за счет активации рецепторов mGluR5et al. (2001) Neuroscience, 106:579-87; Benquet P. et al. (2002) J. Neurosci., 22:9679-86). Роль глутамата в процессах памяти также твердо установлена в течение последнего десятилетияMem., 76:284-297). Эксперименты на мышах с нуль-мутацией по mGluR5 подтвердили роль mGluR5 в обучении и памяти. Указанные мыши демонстируют избирательную неспособность справиться с двумя типами заданий, на пространственное обучение и память, и пониженное LTP в зоне СА 1 гиппокампа (LuPhysiol. Behav., 73:793-802; Rodrigues et al. (2002) J. Neurosci., 22:5219-5229). Обнаружение того, что mGluR5 отвечает за потенцирование опосредованных рецепторами NMDA токов, может указывать на потенциальную возможность применения агонистов указанных рецепторов в качестве средств, улучшающих когнитивную функцию, а также в качестве новых антипсихотических средств, действующих за счет селективного усиления функции рецепторов NMDA. Активация NMDARs может потенцировать гипофункциональные NMDARs в нейронных цепях, задействованных в шизофрении. Последние данные in vivo указывают на то, что активация mGluR5 может представлять собой новый и эффективный подход к лечению снижения когнитивной функции и как позитивных, так и негативных симптомов шизофрении (Kinney G.G. et al. (2003) J. Pharmacol. Exp. Ther.,306(1):116-123). Поэтому рецептор mGluR5 рассматривают как потенциальную мишень для лекарственных средств при лечении психиатрических и неврологических расстройств, включая излечимые заболевания, которыми в данном контексте являются тревожные расстройства, нарушения внимания, пищевые нарушения,расстройства настроения, психотические расстройства, когнитивные расстройства, расстройства личности и расстройства смысловой сферы. Большинство существующих в настоящее время модуляторов функции mGluR5 были разработаны как структурные аналоги глутамата, квисквалата или фенилглицина (Schoepp D.D. et al. (1999) Neuropharmacology, 38:1431-1476) и крайне перспективно разработать in vivo активные и селективные модуляторы mGluR5, действующие на центр связывания глутамата. Новый путь разработки селективных модуляторов заключается в идентификации молекул, действующих по аллостерическим механизмам, модулируя рецептор посредством связывания с центром, отличным от высококонсервативного ортостерического центра связывания. Положительные аллостерические модуляторы mGluRs недавно были предложены в качестве новых лекарственных форм, проявляющих указанную привлекательную возможность. Указанный тип молекул был обнаружен для mGluR1, mGluR2, mGluR4 и mGluR5 (Knoflach F. et al. (2001) Proc. Natl. Acad. Sci.Trans., 32:881-7). DFB и родственные молекулы описаны в качестве положительных аллостерических модуляторов mGluR5 in vitro, однако они имеют низкую активность (O'Brien J.A. et al. (2003) Mol. Pharmacol. 64:731-40). Были запатентованы производные бензамида (WO 2004/087048; O'Brien J.A. (2004) J.Pharmacol. Exp. Ther. 309:568-77), а недавно в качестве положительных аллостерических модуляторовmGluR5 были описаны производные аминопиразола (Lindsley et al. (2004) J. Med. Chem. 47:5825-8; WO 2005/087048). Среди производных аминопиразола, CDPPB (3-циано-N-(1,3-дифенил-1 Н-пиразол-5 ил)бензамид) проявил при действии in vivo эффект, подобный антипсихотическому в моделях поведения крыс (Kinney G.G. et al. (2005) J. Pharmacol. Exp. Ther. 313:199-206). Этот отчет согласуется с гипотезой,что аллостерическое потенцирование mGluR5 может обеспечить новый подход к разработке антипсихотических средств. Недавно была описана новая серия положительных аллостерических модуляторов рецепторов mGluR5 (WO 2005/044797). В международной публикации WO 99/45006, Pfizer Inc., раскрыты производные оксадиазолилпиперидина в качестве ингибиторов фермента ротамазы. Описаны также некоторые классы арильных и гетероарилоксадиазольных соединений: US 04/106607, WO 03/056823, WO 02/72570, GB 1164572, FR 6671. Никакие конкретные ранее описанные соединения структурно не связаны с соединениями согласно настоящему изобретению. Настоящее изобретение относится к способу лечения или предотвращения состояния у млекопитающего, включая человека, на лечение или предотвращение которого воздействуют или облегчают его посредством нейромодуляторного действия положительных аллостерических модуляторов mGluR5.-2 014081 Чертеж Чертеж иллюстрирует действие 10 мкМ вещества из примера 1 настоящего изобретения на культуру первичных кортикальных клеток, экспрессирующих mGluR5, в отсутствии или в присутствии 300 нМ глутамата. Подробное описание изобретения Согласно настоящему изобретению предложены новые соединения общей формулы I или фармацевтически приемлемые соли, гидраты или сольваты указанных соединений,где W представляет собой (С 4-С 7)циклоалкильное, (C3-С 7)гетероциклоалкильное, (C3-С 7)гетероциклоалкил(C1-С 3)алкильное или (C3-С 7)гетероциклоалкенильное кольца;R1 и R2 независимо друг от друга представляют собой водород, -(C1-C6)алкил, -(C2-C6)алкенил, -(С 2C6)алкинил, арилалкил, гетероарилалкил, гидроксил, аминогруппу, аминоалкил, гидроксиалкил, -(C1C6)алкоксил, или R1 и R2 вместе могут образовывать (С 3-C7)циклоалкильное кольцо, карбонильную связьC=O или углерод-углеродную двойную связь; Р представляет собой (С 5-С 7)гетероциклоалкильное, (C5-С 7)гетероциклоалкенильное кольца или гетероарильную группу формулR3, R4, R5, R6 и R7 независимо друг от друга представляют собой водород, галоген, -NO2, -(C1C6)алкил, -(C3-C6)циклоалкил, -(C3-C7)циклоалкилалкил, -(С 2-C6)алкенил, -(С 2-C6)алкинил, галоген(С 1C6)алкил, гетероарил, гетероарилалкил, арилалкил, арил, -OR8, -NR8R9, -C(=NR10)NR8R9, -NR8COR9,-NR8CO2R9, -NR8SO2R9, -NR10CONR8R9, -SR8, -S(=O)R8, -S(=O)2R8, -S(=O)2NR8R9, -C(=O)R8, -C(O)-O-R8,-C(=O)NR8R9, -C(=NR8)R9 или -C(=NOR8)R9; при этом, возможно, два заместителя совместно с находящимися между ними атомами образуют бициклическое гетероциклоалкильное, арильное или гетероарильное кольца; причем каждое кольцо возможно дополнительно имеет замещение 1-5 группами, каждая из которых независимо представляет собой галоген, -CN, -(C1-C6)алкил, -O-(C0-C6)алкил, -O-(C3 С 7)циклоалкилалкил, -О(арил), -О(гетероарил), -O-(-C1-C3)алкиларил, -O-(С 1-C3)алкилгетероарил,-N-С 0-C6)алкил)С 0-C3)алкиларил) или -NC0-С 6)алкил)C0-С 3-)алкилгетероарил);R8, R9, R10 независимо друг от друга представляют собой водород, (С 1-С 6)алкил, (C3-C6)циклоалкил,(С 3-С 7)циклоалкилалкил, (С 2-С 6)алкенил, (С 2-С 6)алкинил, галоген(C1-С 6)алкил, гетероциклоалкил, гетероарил, гетероарилалкил, арилалкил или арил; любой из которых возможно имеет замещение 1-5 группами, каждая из которых независимо представляет собой галоген, -CN, -(С 1-С 6)алкил,-О-(С 0-С 6)алкил, -O-(С 3-С 7)циклоалкилалкил, -О(арил), -О(гетероарил), -NC0-C6)алкил)2, -NC0 С 6)алкил)C3-С 7)циклоалкил) или -NС 0-С 6)алкил)(арил);D, E, F, G, K и L в Р независимо друг от друга представляют собой -C(R3)=, -C(R3)=C(R4)-, -C(=O)-,-C(=S)-, -O-, -N=, -N(R3)- или -S-;Q обозначает циклоалкильную, арильную или гетероарильную группу формулR3, R4, R5, R6 и R7 независимо друг от друга представляют собой группы, определенные выше;D, E, F, G и Н в Q независимо друг от друга представляют собой -C(R3)=, -C(R3)=C(R4)-, -C(=O)-,-C(=S)-, -О-, -N=, -N(R3)- или -S-; А представляет собой -N=N- в азогруппе, этил, этенил, этинил, -NR8C(=O)-, -NR8C(=O)-O-,-NR8C(=O)-NR9-, -NR8S(=O)2-, -C(=O)NR8-, -O-C(=O)NR8-, -S-, -S(=O)-, -S(=O)2-, -S(=O)2NR8-, -C(=O)-O-,-O-C(=O)-, -C(=NR8)NR9-, -C(=NOR8)NR9-, -NR8C(=NOR9)-, =N-O-, -O-N=CH- или арильную или гетероарильную группу формулR3, R4, R5 и R6 независимо друг от друга представляют собой группы, определенные выше;D, E, F, G и Н в А независимо друг от друга представляют собой -C(R3)=, -C(R3)=C(R4)-, -C(=O)-,-C(=S)-, -О-, -N=, -N(R3)- или -S-;R3, R4, R5 и R6 независимо друг от друга представляют собой группы, определенные выше; В представляет собой одинарную связь, -С(=O)-(C0-С 2)алкил-, -С(=O)-(С 2-С 6)алкенил-, -С(=O)-(С 2 С 6)алкинил-, -С(=O)-O-, -С(=О)NR8-(С 0-С 2)алкил-, -C(=NR8)NR9-, -S(=О)-(С 0-С 2)алкил-, -S(=О)2-(С 0 С 2)алкил-,-S(=O)2NR8-(C0-C2)алкил-,-C(=NR8)-(CO-С 2)алкил-,-С(=NOR8)-(С 0-С 2)алкилилиR8 и R9 независимо друг от друга представляют собой группы, определенные выше; любой N может представлять собой N-оксид. Настоящее изобретение охватывает оба возможных стереоизомера, также как рацемические соединения и индивидуальные энантиомеры указанных соединений. В целях однозначности следует понимать, что в настоящем описании "(C1-C6)" обозначает углеродную группу, содержащую 1, 2, 3, 4, 5 или 6 атомов углерода. "(C0-C6)" обозначает углеродную группу,которая содержит 0, 1, 2, 3, 4, 5 или 6 атомов углерода. В настоящем описании "С" обозначает атом углерода. В приведенном выше определении термин "(C1-C6)алкил" охватывает такие группы, как метил,этил, пропил, азопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, изопентил, неопентил, третпентил, гексил или подобные им. Термин "(С 2-C6)алкенил" охватывает такие группы, как этенил, 1-пропенил, аллил, изопропенил, 1 бутенил, 3-бутенил, 4-пентенил или подобные им. Термин "(С 2-С 6)алкинил" охватывает такие группы, как этинил, пропинил, бутинил, пентинил или подобные им. Термин "галоген" охватывает такие атомы, как фтор, хлор, бром и йод. Термин "циклоалкил" относится к возможно замещенному карбоциклу, не содержащему гетероатомов, включая моно-, би- и трициклические насыщенные карбоциклы, а также системы с конденсированными кольцами. Указанные системы с конденсированными кольцами могут включать одно полностью или частично ненасыщенное кольцо, такое как бензольное кольцо, с образованием систем с конденсированными кольцами, таких как карбоциклы, конденсированные с бензольным кольцом. Термин "циклоалкил" охватывает такие системы с конденсированными кольцами, как спироконденсированные кольцевые системы. Примеры циклоалкилов включают циклопропил, циклобутил, циклопентил, циклогексил, декагидронафталин, адамантан, индан, флуорен, 1,2,3,4-тетрагидронафталин или подобные им. Термин "гетероциклоалкил" относится к возможно замещенному карбоциклу, содержащему по меньшей мере один гетероатом, выбранный независимо среди О, N, S. Этот термин включает моно-, бии трициклические насыщенные карбоциклы, а также системы с конденсированными кольцами. Указанные системы с конденсированными кольцами могут содержать одно полностью или частично ненасыщенное кольцо, такое как бензольное кольцо, и образовывать систему с конденсированными кольцами,такую как карбоцикл, конденсированный с бензольным кольцом. Примеры гетероциклоалкилов включают пиперидин, пиперазин, морфолин, тетрагидротиофен, индолин, изохинолин или подобные им. Термин "арил" охватывает (С 6-C10)арильную группу, такую как фенил, 1-нафтил, 2-нафтил или подобные им. Термин "арилалкил" охватывает (C6-C10)арил(С 1-C3)алкильную группу, такую как бензильная группа, 1-фенилэтильная группа, 2-фенилэтильная группа, 1-фенилпропильная группа, 2-фенилпропильная группа, 3-фенилпропильная группа, 1-нафтилметильная группа, 2-нафтилметильная группа или тому подобное. Термин "гетероарил" охватывает 5-10-членную гетероциклическую группу, содержащую от 1 до 4 гетероатомов, выбранных среди кислорода, азота или серы, с образованием такого кольца, как фурил(индольное кольцо), изоиндолил (изоиндольное кольцо), бензоимидазолил (бензоимидазольное кольцо),пуринил (пуриновое кольцо), хинолил (хинолиновое кольцо), фталазинил (фталазиновое кольцо), нафтиридинил (нафтиридиновое кольцо), хиноксалинил (хиноксалиновое кольцо), циннолил (циннолиновое кольцо), птеридинил (птеридиновое кольцо), оксазолил (оксазольное кольцо), изоксазолил (изоксазольное кольцо), бензоксазолил (бензоксазольное кольцо), бензотиазолил (бензотиазольное кольцо), фуразанил (фуразановое кольцо) или подобные им. Термин "гетероарилалкил" охватывает гетероарил(C1-C3)алкильную группу, причем примеры гетероарила аналогичны приведенным в определении выше, представляют собой такие группы, как 2 фурилметильная группа, 3-фурилметильная группа, 2-тиенилметильная группа, 3-тиенилметильная группа, 1-имидазолилметильная группа, 2-имидазолилметильная группа, 2-тиазолилметильная группа, 2 пиридилметильная группа, 3-пиридилметильная группа, 1-хинолилметильная группа или аналогичные им. Термин "сольват" относится к комплексу непостоянной стехиометрии, образованному растворенным веществом (например, соединением формулы I) и растворителем. Растворитель представляет собой фармацевтически приемлемый растворитель, предпочтительно такой как вода; указанный растворитель не должен влиять на биологическую активность растворенного вещества."Возможно" означает, что описанное после событие(я) могут происходить или не происходить, и включает оба случая, когда событие(я) происходит и когда событие(я) не происходит. Термин "замещенный" относится к замещению указанным заместителем или заместителями, множественные степени замещения допустимы, если не определено иначе. Предпочтительные соединения согласно настоящему изобретению представляют собой соединения формулы I-А или фармацевтически приемлемые соли, гидраты или сольваты указанных соединений,где R1 и R2 независимо друг от друга представляют собой водород, -(C1-C6)алкил, -(С 2-С 6)алкенил,-(С 2-С 6)алкинил, арилалкил, гетероарилалкил, гидроксил, аминогруппу, аминоалкил, гидроксиалкил,-(C1-C6)алкоксил, или R1 и R2 вместе могут образовывать (C3-С 7)циклоалкильное кольцо, карбонильную связь C=O или углерод-углеродную двойную связь; Р представляет собой (С 5-C7)гетероциклоалкильное, (C5-С 7)гетероциклоалкенильное кольцо или гетероарильную группу формулR3, R4, R5, R6 и R7 независимо друг от друга представляют собой водород, галоген, -NO2, -(C1C6)алкил, -(С 3-C6)циклоалкил, -(C3-С 7)циклоалкилалкил, -(С 2-C6)алкенил, -(С 2-C6)алкинил, галоген(C1C6)алкил, гетероарил, гетероарилалкил, арилалкил, арил, -OR8, -NR8R9, -C(=NR10)NR8R9, -NR8COR9,-NR8CO2R9, -NR8SO2R9, -NR10CONR8R9, -SR8, -S(=O)R8, -S(=O)2R8, -S(=O)2NR8R9, -C(=O)R8, -C(O)-O-R8,-C(=O)NR8R9, -C(=NR8)R9 или -C(=NOR8)R9; при этом, возможно, два заместителя совместно с находящимися между ними атомами образуют бициклическое гетероциклоалкильное, арильное или гетероарильное кольца; причем каждое кольцо возможно дополнительно имеет замещение 1-5 группами, каждая из которых независимо представляет собой галоген, -CN, -(C1-С 6)алкил, -О-(С 0-C6)алкил, -O-(C3 С 7)циклоалкилалкил, -О(арил), -О(гетероарил), -O-(-C1-C3)алкиларил, -O-(C1-С 3)алкилгетероарил,-N-C0-С 6)алкил)C0-С 3)алкиларил) или -NC0-С 6)алкил)C0-С 3)алкилгетероарил);R8, R9, R10 каждый независимо друг от друга представляют собой водород, (C1-C6)алкил, (C3C6)циклоалкил, (C3-С 7)циклоалкилалкил, (С 2-C6)алкенил, (С 2-C6)алкинил, галоген(C1-C6)алкил, гетероциклоалкил, гетероарил, гетероарилалкил, арилалкил или арил; любой из которых возможно имеет замещение 1-5 группами, каждая из которых независимо представляет собой галоген, -CN, -(C1-C6)алкил,-O-(C0-С 6)алкил, -O-(C3-С 7)циклоалкилалкил, -О(арил), -О(гетероарил), -NC0-С 6)алкил)2, -NC0C6)алкил)С 3-С 7)циклоалкил) или -NC0-C6)алкил)(арил);D, E, F, G, K и L в Р независимо друг от друга представляют собой -C(R3)=, -C(R3)=C(R4)-, -C(=O)-,-5 014081Q обозначает циклоалкильную, арильную или гетероарильную группу формулR3, R4, R5, R6 и R7 независимо друг от друга представляют собой группы, определенные выше;D, E, F, G и Н в Q независимо друг от друга представляют собой -C(R3)=, -C(R3)=C(R4)-, -C(=O)-,-C(=S)-, -O-, -N=, -N(R3)- или -S-; А представляет собой -N=N- в азогруппе, этил, этенил, этинил, -NR8C(=O)-, -NR8C(=O)-O-,-NR8C(=O)-NR9-, -NR8S(=O)2-, -C(=O)NR8-, -O-C(=O)NR8-, -S-, -S(=O)-, -S(=O)2-, -S(=O)2NR8-, -C(=O)-O-,-O-C(=O)-, -C(=NR8)NR9-, -C(=NOR8)NR9-, -NR8C(=NOR9)-, =N-O-, -O-N=CH- или арильную или гетероарильную группу формулR3, R4, R5 и R6 независимо друг от друга представляют собой группы, определенные выше;D, E, F, G и Н в А независимо друг от друга представляют собой -C(R3)=, -C(R3)=C(R4)-, -C(=O)-,-C(=S)-, -O-, -N= -N(R3)- или -S-; R3, R4, R5 и R6 независимо друг от друга представляют собой группы,определенные выше; В представляет собой одинарную связь, -С(=O)-(C0-С 2)алкил-, -С(=O)-(С 2-C6)алкенил-, -С(=O)-(С 2 С 6)алкинил-, -С(=O)-O-, -С(=О)NR8-(С 0-С 2)алкил-, -C(=NR8)NR9-, -S(=О)-(С 0-С 2)алкил-, -S(=О)2-(С 0 С 2)алкил-,-S(=O)2NR8-(C0-С 2)алкил-,-C(=NR8)-(C0-С 2)алкил-,-C(=NOR8)-(C0-C2)алкилилиR8 и R9 независимо друг от друга представляют собой группы, определенные выше;J представляет собой одинарную связь, -C(R10, R11)-, -О-, -N(R10)- или -S-;R10, R11 независимо друг от друга представляют собой водород, -(C1-C6)алкил, -(C3-C6)циклоалкил,-(C3-С 7)циклоалкилалкил, -(С 2-C6)алкенил, -(С 2-C6)алкинил, галоген(С 1-С 6)алкил, гетероарил, гетероарилалкил, арилалкил или арил; любой из которых возможно имеет замещение 1-5 группами, каждая из которых независимо представляет собой галоген, -CN, -(С 1-C6)алкил, -O(C0-С 6)алкил, -O(C3 С 7)циклоалкилалкил, -О(арил), -О(гетероарил), -NC0-C6)алкил)C0-C6)алкил), -NC0-C6)алкил)C3 С 7)циклоалкил) или -NС 0-C6)алкил)(арил); любой N может представлять собой N-оксид. Настоящее изобретение охватывает оба возможных стереоизомера, также как рацемические соединения и индивидуальные энантиомеры указанных соединений. Особенно предпочтительные соединения согласно настоящему изобретению представляют собой соединения формулы I-B где R1 и R2 независимо друг от друга представляют собой водород, -(C1-C6)алкил, -(С 2-C6)алкенил,-(С 2-C6)алкинил, арилалкил, гетероарилалкил, гидроксил, аминогруппу, аминоалкил, гидроксиалкил,-(C1-C6)алкоксил, или R1 и R2 вместе могут образовывать (C3-С 7)циклоалкильное кольцо, карбонильную связь C=O или углерод-углеродную двойную связь; Р представляет собой (С 5-С 7)гетероциклоалкильное, (С 5-C7)гетероциклоалкенильное кольца или гетероарильную группу формулR3, R4, R5, R6 и R7 независимо друг от друга представляют собой водород, галоген, -NO2, -(C1C6)алкил, -(C3-C6)циклоалкил, -(C3-С 7)циклоалкилалкил, -(С 2-C6)алкенил, -(С 2-C6)алкинил, галоген(C1 С 6)алкил, гетероарил, гетероарилалкил, арилалкил, арил, -OR8, -NR8R9, -C(=NR10)NR8R9, -NR8COR9,-NR8CO2R9, -NR8SO2R9, -NR10CONR8R9, -SR8, -S(=O)R8, -S(=O)2R8, -S(=O)2NR8R9, -C(=O)R8, -C(O)-O-R8,-C(=O)NR8R9, -C(=NR8)R9 или -C(=NOR8)R9; при этом, возможно, два заместителя совместно с находящимися между ними атомами образуют бициклическое гетероциклоалкильное, арильное или гетероарильное кольца; причем каждое кольцо возможно дополнительно имеет замещение 1-5 группами, каждая из которых независимо представляет собой галоген, -CN, -(C1-C6)алкил, -O-(C0-C6)алкил, -O-(C3 С 7)циклоалкилалкил, -О(арил), -О(гетероарил), -O-(С 1-С 3)алкиларил, -O-(С 1-С 3)алкилгетероарил, -N-С 0C6)алкил)C0-С 3)алкиларил) или -NC0-С 6)алкил)С 0-C3)алкилгетероарил);R8, R9, R10 независимо друг от друга представляют собой водород, (С 1-C6)алкил, (C3-C6)циклоалкил,(C3-С 7)циклоалкилалкил, (С 2-C6)алкенил, (С 2-C6)алкинил, галоген(C1-C6)алкил, гетероциклоалкил, гетероарил, гетероарилалкил, арилалкил или арил; любой из которых возможно имеет замещение 1-5 группами, каждая из которых независимо представляет собой галоген, -CN, -(C1-C6)алкил, -O-(C0-C6)алкил,-O-(C3-С 7)циклоалкилалкил, -О(арил), -О(гетероарил), -NC0-C6)алкил)2, -NC0-С 6)алкил)C3 С 7)циклоалкил) или -NC0-С 6)алкил)(арил);D, E, F, G, K и L в Р независимо друг от друга представляют собой -C(R3)=, -C(R3)=C(R4)-, -C(=O)-,-C(=S)-, -O-, -N=, -N(R3)- или -S-;Q обозначает циклоалкильную, арильную или гетероарильную группу формулR3, R4, R5, R6 и R7 независимо друг от друга представляют собой группы, определенные выше;D, E, F, G и Н в Q независимо друг от друга представляют собой -C(R3)=, -C(R3)=C(R4)-, -C(=O)-,-C(=S)-, -O-, -N=, -N(R3)- или -S-;V1, V2, V3, V4 и V5 независимо друг от друга представляют собой -C(R3)=, -C(R3)=C(R4)-, -C(=O)-,-C(=S)-, -O-, -N=, -N(R3)- или -S-; В представляет собой одинарную связь, -С(=О)-(С 0-С 2)алкил-, -С(=O)-(С 2-С 6)алкенил-, -С(=O)-(С 2 С 6)алкинил-, -С(=O)-O-, -C(=O)NR8-(C0-C2)алкил-, -C(=NR8)NR9- -S(=О)-(С 0-С 2)алкил-, -S(=О)2-(С 0 С 2)алкил-,-S(=O)2NR8-(CO-C2)алкил,-C(=NR8)-(CO-С 2)алкил-,-С(=NOR8)-(С 0-С 2)алкилилиR8 и R9 независимо друг от друга представляют собой группы, определенные выше;J представляет собой одинарную связь, -C(R10, R11)-, -О-, -N(R10)- или -S-;R10, R11 независимо друг от друга представляют собой водород, -(С 1-C6)алкил, -(C3-C6)циклоалкил,-(C3-С 7)циклоалкилалкил, -(С 2-С 6)алкенил, -(С 2-С 6)алкинил, галоген(C1-C6)алкил, гетероарил, гетероарилалкил, арилалкил или арил; любой из которых возможно имеет замещение 1-5 группами, каждая из которых независимо представляет собой галоген, -CN, -(C1-C6)алкил, -O(C0-С 6)алкил, -O(C3 С 7)циклоалкилалкил, -О(арил), -О(гетероарил), -NC0-С 6)алкил)C0-С 6)алкил), -NC0-C6)алкил)C3 С 7)циклоалкил) или -NC0-C6)алкил)(арил); любой N может представлять собой N-оксид. Настоящее изобретение охватывает оба возможных стереоизомера, также как рацемические соединения и индивидуальные энантиомеры указанных соединений. Более предпочтительные соединения согласно настоящему изобретению представляют собой соединения формулы I-C или фармацевтически приемлемые соли, гидраты или сольваты указанных соединений,-7 014081 где R1 и R2 независимо друг от друга представляют собой водород, -(C1-C6)алкил, -(C1-C6)алкенил,-(С 2-C6)алкинил, арилалкил, гетероарилалкил, гидроксил, аминогруппу, аминоалкил, гидроксиалкил,-(С 1-C6)алкоксил, или R1 и R2 вместе могут образовывать (C3-C7)циклоалкильное кольцо, карбонильную связь C=O или углерод-углеродную двойную связь; Р представляет собой (С 5-С 7)гетероциклоалкильное, (C5-С 7)гетероциклоалкенильное кольца или гетероарильную группу формулR3, R4, R5, R6 и R7 независимо друг от друга представляют собой водород, галоген, -NO2, -(С 1 С 6)алкил, -(С 3-С 6)циклоалкил, -(С 3-С 7)циклоалкилалкил, -(C1-C6)алкенил, -(C1-C6)алкинил, галоген(C1 С 6)алкил, гетероарил, гетероарилалкил, арилалкил, арил, -OR8, -NR8R9, -C(=NR10)NR8R9, -NR8COR9,-NR8CO2R9, -NR8SO2R9, -NR10CONR8R9, -SR8, -S(=O)R8, -S(=O)2R8, -S(=O)2NR8R9, -C(=O)R8, -C(O)-O-R8,-C(=O)NR8R9, -C(=NR8)R9 или -C(=NOR8)R9; при этом, возможно, два заместителя совместно с находящимися между ними атомами образуют бициклическое гетероциклоалкильное, арильное или гетероарильное кольца; причем каждое кольцо возможно дополнительно имеет замещение 1-5 группами, каждая из которых независимо представляет собой галоген, -CN, -(C1-C6)алкил, -O-(C0-C6)алкил, -O-(C3 С 7)циклоалкилалкил, О(арил), -О(гетероарил), -O-(-C1-C3)алкиларил, -O-(C1-С 3)алкилгетероарил, -N-C0 С 6)алкил)С 0-C3)алкиларил) или -NC0-C6)алкил)C0-C3-)алкилгетероарил);R8, R9, R10 независимо друг от друга представляют собой водород, (С 1-C6)алкил, (C3-C6)циклоалкил,(C3-С 7)циклоалкилалкил, (С 2-С 6)алкенил, (С 2-С 6)алкинил, галоген(С 1-C6)алкил, гетероциклоалкил, гетероарил, гетероарилалкил, арилалкил или арил; любой из которых возможно имеет замещение 1-5 группами, каждая из которых независимо представляет собой галоген, -CN, -(C1-C6)алкил, -О-(С 0-C6)алкил,-O-(C3-С 7)циклоалкилалкил, -О(арил), -О(гетероарил), -NC0-C6)алкил)2, -NC0-C6)алкил)C3 С 7)циклоалкил) или -NС 0-C6)алкил)(арил);D, E, F, G, K и L в Р независимо друг от друга представляют собой -C(R3)=, -C(R3)=C(R4)-, -C(=O)-,-C(=S)-, -O-, -N=, -N(R3)- или -S-;Q обозначает циклоалкильную, арильную или гетероарильную группу формулR3, R4, R5, R6 и R7 независимо друг от друга представляют собой группы, определенные выше;D, E, F, G и Н в Q независимо друг от друга представляют собой -C(R3)=, -C(R3)=C(R4)-C(=O)-,-C(=S)-, -O-, -N=, -N(R3)- или -S-; В представляет собой одинарную связь, -С(=O)-(C0-С 2)алкил-, -С(=O)-(С 2-C6)алкенил-, -С(=O)-(С 2 С 6)алкинил-, -С(=O)-O-, -С(=О)NR8-(С 0-С 2)алкил-, -C(=NR8)NR9- -S(=О)-(С 0-С 2)алкил-, -S(=O)2-(C0 С 2)алкил-,-S(=O)2NR8-(C0-C2)алкил-,-C(=NR8)-(C0-С 2)алкил-,-С(=NOR8)-(С 0-С 2)алкилилиR8 и R9 независимо друг от друга представляют собой группы, определенные выше;J представляет собой одинарную связь, -C(R10, R11)-, -О-, -N(R10)- или -S-;R10, R11 независимо друг от друга представляют собой водород, -(C1-C6)алкил, -(С 3-С 6)циклоалкил,-(С 3-C7)циклоалкилалкил, -(С 2-C6)алкенил, -(С 2-С 6)алкинил, галоген(C1-C6)алкил, гетероарил, гетероарилалкил, арилалкил или арил; любой из которых возможно имеет замещение 1-5 группами, каждая из которых независимо представляет собой галоген, -CN, -(C1-C6)алкил, -O(C0-C6)алкил, -O(С 3 С 7)циклоалкилалкил, -О(арил), -О(гетероарил), -NC0-C6)алкил)C0-C6)алкил), -NC0-C6)алкил)C3 С 7)циклоалкил) или -NС 0-С 6)алкил)(арил); любой N может представлять собой N-оксид. Настоящее изобретение охватывает оба возможных стереоизомера, также как рацемические соединения и индивидуальные энантиомеры указанных соединений. В другом своем аспекте соединение согласно настоящему изобретению может представлять собой соединение формулы (I-D) или его фармацевтически приемлемую соль или фармацевтически приемлемые соли, гидраты или сольваты указанного соединения,где R1 и R2 независимо друг от друга представляют собой водород, -(C1-C6)алкил, -(С 2-C6)алкенил,-(С 2-C6)алкинил, арилалкил, гетероарилалкил, гидроксил, аминогруппу, аминоалкил, гидроксиалкил,-(С 1-C6)алкоксил, или R1 и R2 вместе могут образовывать (C3-C7)циклоалкильное кольцо, карбонильную связь C=O или углерод-углеродную двойную связь; Р представляет собой (С 5-С 7)гетероциклоалкильное, (С 5-С 7)гетероциклоалкенильное кольца или гетероарильную группу формулR3, R4, R5, R6 и R7 независимо друг от друга представляют собой водород, галоген, -NO2, -(С 1 С 6)алкил, -(C3-С 6)циклоалкил, -(С 3-С 7)циклоалкилалкил, -(С 2-C6)алкенил, -(С 2-C6)алкинил, галоген(C1C6)алкил, гетероарил, гетероарилалкил, арилалкил, арил, -OR8, -NR8R9, -C(=NR10)NR8R9, -NR8COR9,-NR8CO2R9, -NR8SO2R9, -NR10CONR8R9, -SR8, -S(=O)R8, -S(=O)2R8, -S(=O)2NR8R9, -C(=O)R8, -C(O)-O-R8,-C(=O)NR8R9, -C(=NR8)R9 или -C(=NOR8)R9; при этом, возможно, два заместителя совместно с находящимися между ними атомами образуют бициклическое гетероциклоалкильное, арильное или гетероарильное кольца; причем каждое кольцо возможно дополнительно имеет замещение 1-5 группами, каждая из которых независимо представляет собой галоген, -CN, -(С 1-C6)алкил, -O-(C0-C6)алкил, -O-(C3 С 7)циклоалкилалкил, О(арил), -О(гетероарил), -O-(-C1-C3)алкиларил, -O-(C1-С 3)алкилгетероарил, -N-C0C6)алкил)C0-C3)алкиларил) или -NС 0-С 6)алкил)C0-C3-)алкилгетероарил);R8, R9, R10 независимо друг от друга представляют собой водород, (C1-C6)алкил, (C3-C6)циклоалкил,(C3-С 7)циклоалкилалкил, (С 2-C6)алкенил, (С 2-C6)алкинил, галоген(C1-C6)алкил, гетероциклоалкил, гетероарил, гетероарилалкил, арилалкил или арил; любой из которых возможно имеет замещение 1-5 группами, каждая из которых независимо представляет собой галоген, -CN, -(С 1-С 6)алкил, -О-(С 0-С 6)алкил,-O-(C3-С 7)циклоалкилалкил, -О(арил), -О(гетероарил), -NС 0-C6)алкил)2, -NC0-С 6)алкил)C3 С 7)циклоалкил) или -NC0-С 6)алкил)(арил);D, E, F, G, K и L в Р независимо друг от друга представляют собой -C(R3)=, -C(R3)=C(R4)-, -C(=O)-,-C(=S)-, -О-, -N=, -N(R3)- или -S-;Q обозначает циклоалкильную, арильную или гетероарильную группу формулR3, R4, R5, R6 и R7 независимо друг от друга представляют собой группы, определенные выше;D, E, F, G и Н в Q независимо друг от друга представляют собой -C(R3)=, -C(R3)=C(R4)-, -C(=O)-,-C(=S)-, -О-, -N=, -N(R3)- или -S-;J представляет собой одинарную связь, -C(R10, R11)-, -О-, -N(R10)- или -S-;R10, R11 независимо друг от друга представляют собой водород, -(С 1-С 6)алкил, -(С 3-С 6)циклоалкил,-(С 3-С 7)циклоалкилалкил, -(С 2-C6)алкенил, -(С 2-C6)алкинил, галоген(С 1-C6)алкил, гетероарил, гетероарилалкил, арилалкил или арил; любой из которых возможно имеет замещение 1-5 группами, каждая из которых независимо представляет собой галоген, -CN, -(C1-C6)алкил, -O(C0-С 6)алкил, -O(С 3 С 7)циклоалкилалкил, -О(арил), -О(гетероарил), -NC0-C6)алкил)C0-С 6)алкил), -NC0-С 6)алкил)С 3 С 7)циклоалкил) или -NС 0-C6)алкил)(арил); любой N может представлять собой N-оксид. Настоящее изобретение охватывает оба возможных стереоизомера, также как рацемические соединения и индивидуальные энантиомеры указанных соединений. В другом своем аспекте настоящее изобретение относится к соединениям формулы II-А или фармацевтически приемлемым солям, гидратам или сольватам указанных соединений,где R1 и R2 независимо друг от друга представляют собой водород, -(C1-C6)алкил, -(С 2-C6)алкенил,-(С 2-C6)алкинил, арилалкил, гетероарилалкил, гидроксил, аминогруппу, аминоалкил, гидроксиалкил,-(C1-C6)алкоксил, или R1 и R2 вместе могут образовывать (С 3-С 7)циклоалкильное кольцо, карбонильную связь C=O или углерод-углеродную двойную связь; Р представляет собой (С 5-С 7)гетероциклоалкильное, (C5-C7)гетероциклоалкенильное кольца или гетероарильную группу формулR3, R4, R5, R6 и R7 независимо друг от друга представляют собой водород, галоген, -NO2, -(C1C6)алкил, -(С 3-С 6)циклоалкил, -(С 3-С 7)циклоалкилалкил, -(С 2-С 6)алкенил, -(С 2-С 6)алкинил, галоген(C1 С 6)алкил, гетероарил, гетероарилалкил, арилалкил, арил, -OR8, -NR8R9, -C(=NR10)NR8R9, -NR8COR9,-NR8CO2R9, -NR8SO2R9, -NR10CONR8R9, -SR8, -S(=O)R8, -S(=O)2R8, -S(=O)2NR8R9, -C(=O)R8, -C(O)-O-R8,-C(=O)NR8R9, -C(=NR8)R9 или -C(=NOR8)R9; при этом, возможно, два заместителя совместно с находящимися между ними атомами образуют бициклическое гетероциклоалкильное, арильное или гетероарильное кольца; причем каждое кольцо, возможно, дополнительно имеет замещение 1-5 группами, каждая из которых независимо представляет собой галоген, -CN, -(C1-C6)алкил, -O-(C0-C6)алкил, -O-(C3 С 7)циклоалкилалкил, О(арил), -О(гетероарил), -O-(-C1-C3)алкиларил, -O-(C1-C3)алкилгетероарил, -N-C0C6)алкил)C0-C3)алкиларил) или -NC0-C6)алкил)C0-C3-)алкилгетероарил);R8, R9, R10 независимо друг от друга представляют собой водород, (C1-C6)алкил, (C3-С 6)циклоалкил,(C3-С 7)циклоалкилалкил, (С 2-C6)алкенил, (С 2-С 6)алкинил, галоген(C1-C6)алкил, гетероциклоалкил, гетероарил, гетероарилалкил, арилалкил или арил; любой из которых возможно имеет замещение 1-5 группами, каждая из которых независимо представляет собой галоген, -CN, -(С 1-С 6)алкил, -О-(С 0-С 6)алкил,-O-(С 3-C7)циклоалкилалкил, -О(арил), -О(гетероарил), -NС 0-C6)алкил)2, -NС 0-C6)алкил)C3 С 7)циклоалкил) или -NС 0-С 6)алкил)(арил);D, E, F, G, K и L в Р независимо друг от друга представляют собой -C(R3)=, -C(R3)=C(R4)-, -C(=O)-,-C(=S)-, -O-, -N=, -N(R3)- или -S-;Q обозначает циклоалкильную, арильную или гетероарильную группу формулR3, R4, R5, R6 и R7 независимо друг от друга представляют собой группы, определенные выше;D, E, F, G и Н в Q независимо друг от друга представляют собой -C(R3)=, -C(R3)=C(R4)-, -C(=O)-,-C(=S)-, -О-, -N=, -N(R3)- или -S-; В представляет собой одинарную связь, -С(=O)-(C0-С 2)алкил-, -С(=O)-(С 2-С 6)алкенил-, -С(=O)-(С 2 С 6)алкинил-, -С(=O)-O-, -С(=O)NR8-(C0-С 2)алкил-, -C(=NR8)NR9-, -S(=О)-(С 0-С 2)алкил-, -S(=О)2-(С 0 С 2)алкил-,-S(=O)2NR8-(C0-C2)алкил-,-C(=NR8)-(C0-С 2)алкил-,-C(=NOR8)-(C0-C2)алкилилиR8 и R9 независимо друг от друга представляют собой группы, определенные выше;J представляет собой одинарную связь, -C(R10, R11)-, -O-, -N(R10)- или -S-;R10, R11 независимо друг от друга представляют собой водород, -(C1-C6)алкил, -(C3-C6)циклоалкил,-(С 3-С 7)циклоалкилалкил, -(С 2-С 6)алкенил, -(С 2-C6)алкинил, галоген(C1-C6)алкил, гетероарил, гетероарилалкил, арилалкил или арил; любой из которых возможно имеет замещение 1-5 группами, каждая из которых независимо представляет собой галоген, -CN, -(С 1-C6)алкил, -О(С 0-С 6)алкил, -O(C3-С 7)циклоалкилалкил, -О(арил), -О(гетероарил), -NC0-С 6)алкил)C0-C6)алкил), -NC0-C6)алкил)С 3-С 7)циклоалкил) или -NС 0-С 6)алкил)(арил); любой N может представлять собой N-оксид.- 10014081 Настоящее изобретение охватывает оба возможных стереоизомера, также как рацемические соединения и индивидуальные энантиомеры указанных соединений. В одном из вариантов реализации настоящего изобретения оно относится к соединениям формулы или фармацевтически приемлемым солям, гидратам или сольватам указанных соединений,где R1 и R2 независимо друг от друга представляют собой водород, -(C1-C6)алкил, -(С 2-C6)алкенил,-(С 2-C6)алкинил, арилалкил, гетероарилалкил, гидроксил, аминогруппу, аминоалкил, гидроксиалкил,-(C1-C6)алкоксил, или R1 и R2 вместе могут образовывать (С 3-С 7)циклоалкильное кольцо, карбонильную связь C=O или углерод-углеродную двойную связь; Р представляет собой (С 5-С 7)гетероциклоалкильное, (С 5-С 7)гетероциклоалкенильное кольца или гетероарильную группу формулR3, R4, R5, R6 и R7 независимо друг от друга представляют собой водород, галоген, -NO2, -(C1C6)алкил, -(С 3-C6)циклоалкил, -(C3-С 7)циклоалкилалкил, -(С 2-C6)алкенил, -(С 2-C6)алкинил, галоген(C1C6)алкил, гетероарил, гетероарилалкил, арилалкил, арил, -OR8, -NR8R9, -C(=NR10)NR8R9, -NR8COR9,-NR8CO2R9, -NR8SO2R9, -NR10CONR8R9, -SR8, -S(=O)R8, -S(=O)2R8, -S(=O)2NR8R9, -C(=O)R8, -C(O)-O-R8,-C(=O)NR8R9, -C(=NR8)R9 или -C(=NOR8)R9; при этом, возможно, два заместителя совместно с находящимися между ними атомами образуют бициклическое гетероциклоалкильное, арильное или гетероарильное кольца; причем каждое кольцо возможно дополнительно имеет замещение 1-5 группами, каждая из которых независимо представляет собой галоген, -CN, -(С 1-C6)алкил, -O-(C0-C6)алкил, -O-(C3 С 7)циклоалкилалкил, О(арил), -О(гетероарил), -O-(-С 1-C3)алкиларил, -O-(C1-C3)алкилгетероарил, -N-C0C6)алкил)C0-C3)алкиларил) или -NC0-C6)алкил)С 0-C3-)алкилгетероарил);R8, R9, R10 независимо друг от друга представляют собой водород, (C1-C6)алкил, (С 3-C6)циклоалкил,(C3-С 7)циклоалкилалкил, (C1-С 6)алкенил, (С 2-C6)алкинил, галоген(C1-C6)алкил, гетероциклоалкил, гетероарил, гетероарилалкил, арилалкил или арил; любой из которых возможно имеет замещение 1-5 группами, каждая из которых независимо представляет собой галоген, -CN, -(C1-С 6)алкил, -О-(С 0-C6)алкил,-O-(С 3-С 7)циклоалкилалкил, -О(арил), -О(гетероарил), -NC0-C6)алкил)2, -NC0-C6)алкил)C3 С 7)циклоалкил) или -NС 0-C6)алкил)(арил);D, E, F, G, K и L в Р независимо друг от друга представляют собой -C(R3)=, -C(R3)=C(R4)-, -C(=O)-,-C(=S)-, -O-, -N=, -N(R3)- или -S-;Q обозначает циклоалкильную, арильную или гетероарильную группу формулR3, R4, R5, R6 и R7 независимо друг от друга представляют собой группы, определенные выше;D, E, F, G и Н в Q независимо друг от друга представляют собой -C(R3)=, -C(R3)=C(R4)-, -C(=O)-,-C(=S)-, -O-, -N=, -N(R3)- или -S-;J представляет собой одинарную связь, -C(R10, R11)-, -О-, -N(R10)- или -S-;R10, R11 независимо друг от друга представляют собой водород, -(C1-C6)алкил, -(C3-C6)циклоалкил,-(С 3-С 7)циклоалкилалкил, -(С 2-C6)алкенил, -(C1-C6)алкинил, галоген(C1-С 6)алкил, гетероарил, гетероарилалкил, арилалкил или арил; любой из которых, возможно, замещен 1-5 независимыми заместителями: галоген, -CN, -(C1-C6)алкил, -O(C0-C6)алкил, -O(C3-C7)циклоалкилалкил, -О(арил), -О(гетероарил),-NC0-С 6)алкил)C0-С 6)алкил), -NC0-C6)алкил)C3-С 7)циклоалкил) или -NC0-С 6)алкил)(арил); любой N может представлять собой N-оксид.- 11014081 Настоящее изобретение охватывает оба возможных стереоизомера, также как рацемические соединения и индивидуальные энантиомеры указанных соединений. Особенно предпочтительными соединениями являются(6-фторпиридин-3-ил)-(S)-3-[3-(4-трифторметил-1 Н-пиррол-2-ил)-[1,2,4]оксадиазол-5 ил]пиперидин-1-илметанон. Настоящее изобретение относится к фармацевтически приемлемым солям, образованным присоединением кислот к соединениям формулы I или к фармацевтически приемлемым носителям или разбавителям. Настоящее изобретение относится к способу лечения или предотвращения состояния у млекопитающего, включая человека, лечение или предотвращение которого осуществляют или облегчают посредством нейромодуляторного действие аллостерических модуляторов mGluR5 и, в частности, положительных аллостерических модуляторов mGluR5. Настоящее изобретение относится к способу лечения или предотвращения различных расстройств периферической и центральной нервной системы, таких как толерантность или зависимость, тревога,депрессия, психиатрическое заболевание, такое как психоз, воспалительная или нейропатическая боль,ухудшение памяти, болезнь Альцгеймера, ишемия, злоупотребление и склонность к наркотикам. Настоящее изобретение относится к фармацевтическим композициям, которые обеспечивают от примерно 0,01 до 1000 мг активного компонента на отдельную дозу. Указанные композиции можно вводить любым подходящим способом. Например, орально в форме капсул, парентерально в форме растворов для инъекций, поверхностно в форме мазей или лосьонов, через глаза в форме глазной примочки,ректально в форме суппозиториев. Фармацевтические композиции согласно настоящему изобретению можно изготовить общепринятыми в данной области способами; тип применяемых фармацевтических композиций может зависеть от выбранного способа введения. Общая суточная доза обычно варьирует (находится) в пределах от примерно 0,05 до 2000 мг. Способы синтеза Соединения общей формулы I можно получить способами, известными в области органического синтеза, как это частично описано в нижеследующих схемах синтеза. Во всех описанных ниже схемах следует понимать, что для чувствительных или реакционноспособных групп в случае необходимости применяют защитные группы в соответствии с общими принципами химии. На защитные группы воздействуют в соответствии со стандартными способами органического синтеза (Green T.W. and WutsP.G.M. (1991) Protecting Groups in Organic Synthesis, John Wiley et Sons). Указанные группы удаляют на подходящей стадии синтеза соединения с применением способов, очевидных для специалистов в данной области. Выбор процесса, как и условий реакции и порядка их выполнения, должен соответствовать приготовлению соединений формулы I. Соединения формулы I могут быть представлены в виде смеси энантиомеров, которую можно разделить на индивидуальные чистые R- или S-энантиомеры. Если, например, желательно получить конкретный энантиомер соединения формулы I, его можно получить путем асимметрического синтеза, или способом получения с применением хирального вспомогательного вещества, при этом разделяют полученную смесь диастереомеров и удаляют вспомогательную группу, чтобы получить требуемые энантиомеры в очищенном виде. В качестве варианта, если молекула содержит основную функциональную группу, такую как аминогруппа, или кислотную функциональную группу, такую как карбоксил, указанное разделение легко можно осуществить путем фракционной кристаллизации из различных растворителей солей соединений формулы I с оптически активными кислотами или другими известными в литературе способами, например, хиральной колоночной хроматографией. Разделение конечного продукта и промежуточного или исходного вещества можно осуществлять любым подходящим способом, известным в данной области техники, как описано Eliel E.L., Wilen S.H.and Mander L.N. (1984) Stereochemistry of Organic Compounds, Wiley-Interscience. Множество гетероциклических соединений формулы I можно получить, используя широко известные в данной области синтетические подходы (Katrizky A.R. and. Rees C.W. (1984) Comprehensive Heterocyclic Chemistry, Pergamon Press). Продукт реакции можно выделить и очистить, применяя стандартные методики, такие как экстракция, хроматография, кристаллизация, перегонка или подобные им. Соединения формулы I, в которых W представляет собой 3-замещенное пиперидиновое кольцо,можно получить в соответствии с последовательностью синтеза, показанной на схемах 1-4. При этом Р представляет собой гетероциклическое кольцо с функциональной группой N-H, как определено выше; Q представляет собой арил или гетероарил, как описано выше; В представляет собой-С(=O)-(C0-С 2)алкил-. Исходное вещество амидоксим можно получить способами, известными в области органического синтеза, как это частично описывает следующая схема синтеза схема 1. В свою очередь, проводят реакцию нитрильного производного (например, 4-фторбензонитрила) в нейтральной или щелочной среде с гидроксиламином, таким как триэтиламин, диизопропилэтиламин,карбонат натрия, гидроксид натрия или аналогичным им, в подходящем растворителе (например, метиловый спирт, этиловый спирт). Реакцию, как правило, проводят при медленном повышении температуры реакционной смеси от комнатной температуры до температуры в диапазоне от 70 до 80 С включительно за время в диапазоне от примерно 1 до 48 ч включительно (см. например, Lucca, George V. De; Kim, Ui Т.; Liang, Jing; Cordova, Beverly; Klabe, Ronald M.; et al.; J. Med. Chem.; EN; 41; 13; 1998; 2411-2423, Lila,Christine; Gloanec, Philippe; Cadet, Laurence; Herve, Yolande; Fournier, Jean; et al.; Synth.Commun.; EN; 28; 23; 1998; 4419-4430 и см.: Sendzik, Martin; Hui, Hon C.; Tetrahedron Lett.; EN; 44; 2003; 8697-8700 и приведенные здесь ссылки на реакцию в нейтральной среде). Схема 2 Замещенное производное амидоксима (описанное на схеме 1) можно превратить в производное ациламидоксима с применением способа, приведенного на схеме 2. На схеме 2 PG1 представляет собой аминозащитную группу, такую как трет-бутилоксикарбонил, бензилоксикарбонил, этоксикарбонил, бензил или подобные им. Реакцию сочетания можно ускорить при помощи агентов сочетания, известных в области органического синтеза, таких как КДИ (1-(3-диметиламинопропил)-3-этилкарбодиимид), ДЦК(N,N'-дициклогексилкарбодиимид), в присутствии подходящего основания, такого как триэтиламин, диизопропилэтиламин, в подходящем растворителе (например, тетрагидрофуран, дихлорметан, N,Nдиметилформамид, диоксан). Обычно в реакционной смеси может также присутствовать кокатализатор,такой как НОВТ (гидроксибензотриазол), НОАТ (1-гидрокси-7-азабензотриазол). Реакцию обычно проводят в диапазоне температур от комнатной температуры до 60 С включительно на протяжении промежутка времени от примерно 2 до 12 ч, чтобы получить промежуточное соединение ациламидоксим. Реакцию циклизации можно вызвать термически в диапазоне температур от примерно 80 до примерно 150 С на протяжении интервала времени от примерно 2 до 18 ч (см., например, Suzuki, Takeshi; Iwaoka,Kiyoshi; Imanishi, Naoki; Nagakura, Yukinori; Miyata, Keiji; et al.; Chem. Pharm. Bull.; EN; 47; 1; 1999; 120122). Продукт реакции можно выделить и очистить с применением стандартных методик, таких как экстракция, хроматография, кристаллизация, перегонка или аналогичных. Конечную стадию можно осуществлять либо способом, описанным на схеме 3, либо способом, описанным на схеме 4. Схема 3 Как показано на схеме 3, защитные группы PG1 удаляют с применением стандартных способов. На схеме 3, где В определено выше, X представляет собой галоген, например, проводят реакцию производного пиперидина с арил- или гетероарилацилхлоридом с применением способа, легко понятного специалисту. Реакцию можно ускорить при помощи основания, такого как триэтиламин, диизопропиламин, пиридин, в подходящем растворителе (например, тетрагидрофуран, дихлорметан). Реакцию обычно проводят при медленном повышении температуры реакционной смеси от 0 С до комнатной температуры в течение интервала времени от примерно 4 до 12 ч. Как показано на схеме 4, защитные группы PG1 удаляют с применением стандартных способов. Реакцию сочетания можно ускорить при помощи агентов сочетания, известных в области органического синтеза,таких как КДИ(N,N'дициклогексилкарбодиимид), или при помощи агентов сочетания на полимерном носителе, таких как карбодиимид на полимерном носителе (PS-DCC, ex Argonaut Technologies), в присутствии подходящего основания, такого как триэтиламин, диизопропилэтиламин, в подходящем растворителе (например, тетрагидрофуран, дихлорметан, N,N-диметилформамид, диоксан). Обычно в реакционной смеси может также присутствовать кокатализатор, такой как НОВТ (гидроксибензотриазол), НОАТ (1-гидрокси-7-азабензотриазол). Реакцию обычно проводят при комнатной температуре на протяжении интервала времени от примерно 2 до 12 ч. Соединения формулы II-В, в которых J представляет собой СН 2, a R1, R2 представляют собой Н,можно получить в соответствии с последовательностью реакций синтеза, приведенной на схеме 5. При этом Р представляет собой гетероциклическое кольцо с функциональной группой N-H, как определено выше; Q представляет собой арил или гетероарил, как описано выше; В представляет собой Проводят реакцию исходного нитрильного производного с гидроксиламином, такой как триэтиламин, диизопропилэтиламин, карбонат натрия, гидроксид натрия в нейтральной или щелочной среде или подобным им, в подходящем растворителе (например, метиловый спирт, этиловый спирт). Как правило,в процессе реакции реакционную смесь медленно нагревают от комнатной температуры до температуры в диапазоне от 70 до 80 С включительно, в течение примерно 1-48 ч включительно (см., например,Lucca, George V. De; Kim, Ui Т.; Liang, Jing; Cordova, Beverly; Klabe, Ronald M.; et al.; J. Med. Chem.; EN; 41; 13; 1998; 2411-2423, Lila, Christine; Gloanec, Philippe; Cadet, Laurence; Herve, Yolande; Fournier, Jean; etal.; Synth.Commun.; EN; 28; 23; 1998; 4419-4430 и см.: Sendzik, Martin; Hui, Hon C.; Tetrahedron Lett.; EN; 44; 2003; 8697-8700 и ссылки здесь на реакцию в нейтральной среде). Замещенное производное амидоксима (описанное на схеме 5) можно превратить в производное ациламидоксима при помощи подхода, показанного на схеме 1. На схеме 1, PG1 представляет собой аминозащитную группу, такую как трет-бутилоксикарбонил, бензилоксикарбонил, этоксикарбонил, бензил или подобные им. Реакцию сочетания можно ускорить при помощи агентов сочетания, известных в органическом синтезе, таких как КДИ (1-(3-диметиламинопропил)-3-этилкарбодиимид), ДЦК (N,N'дициклогексилкарбодиимид), в присутствии подходящего основания, такого как триэтиламин, диизопропилэтиламин, в подходящем растворителе (например, тетрагидрофуран, дихлорметан, N,Nдиметилформамид, диоксан). Обычно в реакционной смеси может также присутствовать кокатализатор,такой как НОВТ (гидроксибензотриазол), НОАТ (1-гидрокси-7-азабензотриазол). Реакцию, как правило,проводят в диапазоне значений температуры от комнатной до 60 С, включительно, в течение примерно 2-12 ч, чтобы получить промежуточное соединение ациламидоксим. Реакцию циклизации можно вызвать термически в диапазоне температур от примерно 80 до примерно 150 С в течение промежутка времени- 16014081 примерно от 2 до примерно 18 ч (см., например, Suzuki, Takeshi; Iwaoka, Kiyoshi; Imanishi, Naoki; Nagakura, Yukinori; Miyata, Keiji; et al.; Chem. Pharm. Bull.; EN; 47; 1; 1999; 120-122). Или наоборот, ациламидоксим можно выделить и очистить с применением стандартных методик, а затем подвергнуть циклизации. Реакцию циклизации обычно проводят в щелочной среде, такой как триэтиламин, диизопропилэтиламин, карбонат натрия, гидроксид натрия, и тому подобное, в подходящем растворителе (например,ацетонитрил, диоксан). Реакция, как правило, протекает в диапазоне температур от примерно 80 до примерно 150 С в течение промежутка времени от примерно 2 до примерно 18 ч. Продукт реакции можно выделить и очистить с применением стандартных методик, таких как экстракция, хроматография, кристаллизация, перегонка или аналогичных. Затем защитные группы PG1 удаляют с применением стандартных способов. На схеме 5 В определено выше, X представляет собой галоген или гидроксил; например, проводят реакцию производного пиперидина с арил- или гетероарилацилхлоридом, при помощи способов, легко понятных специалистам. Реакцию можно ускорить при помощи основания, такого как триэтиламин, диизопропиламин, пиридин, в подходящем растворителе (например, тетрагидрофуран, дихлорметан). Как правило, в процессе реакции реакционной смеси позволяют медленно нагреваться от 0 С до комнатной температуры на протяжении промежутка времени от примерно 4 до 12 ч. Если X представляет собой ОН, реакцию сочетания можно ускорить при помощи известных в органическом синтезе агентов сочетания, таких как КДИ (1-(3 диметиламинопропил)-3-этилкарбодиимид), ДЦК (N,N'-дициклогексилкарбодиимид), или агентов сочетания на полимерном носителе, таких как карбодиимид на полимерном носителе (PS-DCC, ex ArgonautTechnologies), в присутствии подходящего основания, такого как триэтиламин, диизопропилэтиламин, в подходящем растворителе (например, тетрагидрофуран, дихлорметан, N,N-диметилформамид, диоксан). Обычно в реакционной смеси может также присутствовать кокатализатор, такой как НОВТ (гидроксибензотриазол), НОАТ (1-гидрокси-7-азабензотриазол) или подобные им. Реакция, как правило, протекает при комнатной температуре в течение промежутка времени в диапазоне от примерно 2 до 12 ч. Соединения формулы I, имеющие основную природу, могут образовывать широкий спектр различных фармацевтически приемлемых солей с различными органическими и неорганическими кислотами. Указанные соли легко получить обработкой основных соединений, по существу, эквивалентным количеством предпочтительной минеральной или органической кислоты в подходящем органическом растворителе, таком как метанол, этанол или изопропанол (см. Stahl P.H., Wermuth C.G., Handbook of Pharmaceuticals Salts, Properties, Selection and Use, Wiley, 2002). Следующие не ограничивающие примеры предназначены проиллюстрировать настоящее изобретение. Физические данные, приведенные для служащих примерами соединений, согласуются с установленной структурой указанных соединений. Примеры Если не оговорено иное, все исходные вещества получены от промышленных поставщиков и использованы без дальнейшей очистки. В частности, следующие сокращения могут быть использованы в примерах и на протяжении описания. Все ссылки на раствор соли относятся к насыщенному водному раствору NaCl. Если не указано иначе, все температуры выражены в С (градусы Цельсия). Все реакции проводят в инертной атмосфере при комнатной температуре, если не отмечено иное. 1 Н ЯМР спектры записывают на приборе Brucker 500 МГц или на Brucker 300 МГц. Химические сдвиги выражены в миллионных долях (м.д., единицы мк). Константы взаимодействия выражены в герцах (Гц). Структуры расщепления описывают видимые мультиплетности и обозначены как с (синглет), д(Waters); детектор PDA: 2996 (Waters). Колонка: Ascentis 1002,1 мм 3 мкм; расход 0,3 мл/мин; подвижная фаза: фаза А=вода/ацетонитрил 95/5+0,1% ТФУК, фаза В=вода/ацетонитрил 5/95+0,1% ТФУК. 0-0,5 мин (А: 98%, В: 2%), 2,0 мин (А: 20%, В: 80%), 6,0 мин (А: 0%, В: 100%), 6,0 -9,5 мин (А: 0%, В: 100%),9,6 мин (А: 98%, В: 2%), 9,6-11,0 мин (А: 98%, В: 2%); УФ-детектирование: длина волны 254 нм. Все масс-спектры сняты способами электрораспылительной ионизации (ESI). За ходом большинства реакций наблюдали при помощи тонкослойной хроматографии на 0,25 мм пластинах силикагеля Macherey-Nagel (60F-2254), визуализация при помощи УФ-освещения. Высокоскоростную колоночную хроматографию (flash chromatography) выполняли на силикагеле (220-440 меш,Fluka). Определение температуры плавления выполняли на приборе Buchi B-540. Используемая микроволновая печь представляет собой устройство фирмы Biotage (Optimizer),снабженное внутренним датчиком, который следит за температурой и давлением в ходе реакции и поддерживает выбранную температуру при помощи компьютерного управления.(S)-3-[3-(1H-пиррол-2-ил)-[1,2,4]оксадиазол-5-ил]пиперидин-1 карбоновой кислоты. К раствору 1H-пиррол-2-карбонитрила (0,110 мл, 1,3 ммоль) в EtOH (2 мл) добавляют при комнатной температуре гидроксиламин (50 вес.% водный раствор, 0,318 мл, 5,2 ммоль) и кипятят раствор с обратным холодильником при перемешивании в течение 2 ч. Удаляют растворитель при пониженном давлении, чтобы получить N-гидрокси-1 Н-пиррол-2-карбоксамидин, который немедленно используют на следующей стадии. Смесь N-гидрокси-1 Н-пиррол-2-карбоксамидина (1,3 ммоль), S-1-Boc-пиперидин-3-карбоновой кислоты (0,3 г, 1,3 ммоль), КДИ.HCl (0,374 г, 1,95 ммоль) и НОВТ (0,2 г, 1,3 ммоль) в диоксане (6 мл) перемешивают в течение 2 ч при комнатной температуре, в атмосфере азота, а затем кипятят реакционную смесь с обратным холодильником в течение 7 ч. Растворитель выпаривают при пониженном давлении. Полученный остаток разбавляют водой (20 мл) и ДХМ (20 мл), разделяют фазы и промывают органический слой последовательно водой (20 мл 2 раза) и NaOH 1N (20 мл 2 раза). Органический слой высушивают над Na2SO4 и концентрируют при пониженном давлении. Очистка при помощи высокоскоростной хроматографии (силикагель, элюент: ДХМ/МеОН 99/1) дает 0,11 г трет-бутилового эфира (S)-3-[3-(1Hпиррол-2-ил)-[1,2,4]оксадиазол-5-ил]пиперидин-1-карбоновой кислоты. Выход: 26%; (коричневое масло); ЖХ-МС (RT): 5,45 мин (способ А); МС (ES+) дает m/z: 318,2(МН+). 1(В) (S)-3-[3-(1H-Пиррол-2-ил)-[1,2,4]оксадиазол-5-ил]пиперидина гидрохлорид. трет-Бутиловый эфир (S)-3-[3-(1H-пиррол-2-ил)-[1,2,4]оксадиазол-5-ил]пиперидин-1-карбоновой кислоты (0,11 г, 0,35 ммоль) растворяют в диоксане (2 мл) и добавляют по каплям 2 мл HCl 4 N (диоксановый раствор) при 0 С. Полученную смесь перемешивают при комнатной температуре в течение 1 ч. Выпаривают растворитель при пониженном давлении, чтобы получить 76 мг (выход: количественный)(S)-3-[3-(1H-пиррол-2-ил)-[1,2,4]оксадиазол-5-ил]пиперидина гидрохлорида в виде белого твердого вещества. Выход: количественный; (коричневое твердое вещество); ЖХ-МС (RT): 0,65 мин (способ А); МС(ES+) дает m/z: 218,2 (МН+). 1(С) (4-Фторфенил)-(S)-3-[3-(1H-пиррол-2-ил)-[1,2,4]оксадиазол-5-ил]пиперидин-1-илметанон. К суспензии (S)-3-[3-(1H-пиррол-2-ил)-[1,2,4]оксадиазол-5-ил]пиперидина гидрохлорида (76 мг,0,35 ммоль) в сухом дихлорметане (15 мл) добавляют по каплям при 0 С триэтиламин (0,12 мл, 0,87 ммоль) и 4-фторбензоилхлорид (0,045 мл, 0,38 ммоль). Оставляют реакционную смесь нагреться до комнатной температуры и перемешивают в атмосфере азота на протяжении ночи. Полученный раствор обрабатывают NaOH 1N (10 мл) и разделяют фазы. Органический слой промывают водой (5 мл) и раствором соли (5 мл), а затем высушивают над Na2SO4 и выпаривают при пониженном давлении. Полученный неочищенный продукт очищают при помощи высокоскоростной хроматографии (силикагель, элюент: ДХМ/МеОН/NH4OH 98:2:0,2), чтобы получить 80 мг целевого соединения. Выход: 58% (белый порошок); т.пл.=130-135 С; []D20=+118,13 (с=1,02, МеОН); ЖХ-МС (RT): 6,63 мин (способ О); МС (ES+) дает m/z: 341,2 (МН+). 1 Н-ЯМР (ДМСО-d6),(м. д.): 11,52 (с уш, 1 Н); 7,47 (дд, 2 Н); 7,23 (дд, 2 Н); 6,97 (м, 1 Н); 6,74 (м, 1 Н); 6,21 (м, 1 Н); 4,22 (м, 1 Н); 3,77 (м, 1 Н); 3,50 (дд, 1 Н); 3,35 (ддд, 1 Н); 3,27 (ддд, 1 Н); 2,24 (м, 1 Н); 1,96 (м,1 Н); 1,82 (м, 1 Н); 1,63 (м, 1 Н). Пример 2. Указанное соединение получают в соответствии с процедурой, описанной в примере 1(C), начиная с(S)-3-[3-(1 Н-пиррол-2-ил)-[1,2,4]оксадиазол-5-ил]пиперидина гидрохлорида (полученного, как описано в примере 1(B. Очистку конечного соединения осуществляют при помощи препаративной ВЭЖХ. Выход: 20% (коричневое масло); ЖХ-МС (RT): 6,59 мин (способ Q); MC (ES+) дает m/z: 359,1 Указанное соединение получают в соответствии с процедурой, описанной в примере 1(C), начиная с(S)-3-[3-(1 Н-пиррол-2-ил)-[1,2,4]оксадиазол-5-ил]пиперидина гидрохлорида (полученного, как описано в примере 1(B. Очистку конечного соединения осуществляют при помощи препаративной ВЭЖХ. Выход: 25% (коричневое масло); ЖХ-МС (RT): 6,65 мин (способ Q); MC (ES+) дает m/z: 359,1 Смесь (S)-3-[3-(1H-пиррол-2-ил)-[1,2,4]оксадиазол-5-ил]пиперидина гидрохлорида (0,1 г, 0,39 ммоль, полученного, как описано в примере 1(B, 6-фторникотиновой кислоты (66 мг, 0,47 ммоль), НОАТ (80 мг, 0,59 ммоль), PS-DCC (ex Argonaut Technologies, 0,66 г, 0,79 ммоль, нагрузка: 1,2 ммоль/г) и ТЭА (0,14 мл, 1 ммоль) в сухом дихлорметане (10 мл) выдерживают в течение ночи при орбитальном перемешивании (IKA Vibrax VXR). Смолу отфильтровывают и многократно промывают дихлорметаном; фильтрат промывают HCl 1N (10 мл 2 раза), NaOH 1N (водн.) (10 мл 2 раза) и раствором соли, а затем высушивают над сульфатом натрия и выпаривают при пониженном давлении. Полученный неочищенный продукт очищают при помощи высокоскоростной хроматографии (силикагель, элюент: AcOEt/гексан 7/3), чтобы получить 28 мг (6-фторпиридин-3-ил)-(S)-3-[3-(1H-пиррол 2-ил)-[1,2,4]оксадиазол-5-ил]пиперидин-1-илметанона. Выход: 23% (белое твердое вещество); т.пл.=131-132 С; []D20=+45,54 (с=0,67, МеОН); ЖХ-МС 5(A) трет-Бутиловый эфир 3-карбамоилпиперидин-1-карбоновой кислоты. К раствору 1-Вос-пиперидин-3-карбоновой кислоты (1,58 г, 6,89 ммоль) в хлороформе (10 мл) добавляют по каплям при 0 С триэтиламин (0,96 мл, 6,89 ммоль), а затем этилхлорформиат (0,69 мл, 7,23 ммоль), в атмосфере азота. После перемешивания в течение 10 мин при 0 С через раствор пропускаютNH3 (газ) в течение 1 ч. Затем реакционную смесь перемешивают при комнатной температуре в течение 3 ч, добавляют 5% NaHCO3 (водн.) и разделяют фазы. Органический слой высушивают над сульфатом натрия и выпаривают при пониженном давлении, чтобы получить целевое соединение, которое используют на следующей стадии без дальнейшей очистки. Выход: количественный; ЖХ-МС (RT): 3,31 мин (способ А); МС (ES+) дает m/z: 229,0 (МН+). 5(B) трет-Бутиловый эфир 3-цианопиперидин-1-карбоновой кислоты. Оксихлорид фосфора (0,64 мл, 6,89 ммоль) добавляют по каплям при 0 С к раствору третбутилового эфира 3-карбамоилпиперидин-1-карбоновой кислоты (1,58 г, 6,89 ммоль) в пиридине (15 мл),в атмосфере азота. После перемешивания на протяжении ночи при комнатной температуре, добавляют этилацетат и промывают полученный раствор 10% HCl (2 раза). Разделяют фазы, высушивают органический слой над сульфатом натрия и выпаривают досуха при пониженном давлении. Полученное целевое соединение используют на следующей стадии без дальнейшей очистки. Выход: количественный; ЖХ-МС (RT): 4,48 мин (способ А); МС (ES+) дает m/z: 211,1 (МН+). 5(C) трет-Бутиловый эфир 3-(N-гидроксикарбамимидоил)пиперидин-1-карбоновой кислоты.- 21014081 Раствор трет-бутилового эфира 3-цианопиперидин-1-карбоновой кислоты (1,4 г, 6,89 ммоль) и водного гидроксиламина (50% в воде, 1,7 мл, 27,5 ммоль) в этаноле (15 мл) кипятят с обратным холодильником в течение 2 ч. Растворитель выпаривают при пониженном давлении, чтобы получить целевое соединение, которое используют на следующей стадии без дальнейшей очистки. Выход: количественный; ЖХ-МС (RT): 2,71 мин (способ А); МС (ES+) дает m/z: 244,0 (МН+). 5(D) трет-Бутиловый эфир 3-[5-(1 Н-пиррол-2-ил)-[1,2,4]оксадиазол-3-ил]пиперидин-1-карбоновой кислоты. Смесь трет-бутилового эфира 3-(N-гидроксикарбамимидоил)пиперидин-1-карбоновой кислоты(0,4 г, 1,6 ммоль), 1H-пиррол-2-карбоновой кислоты (182 мг, 1,6 ммоль), НОВТ (248 мг, 1,6 ммоль),КДИ.HCl (0,47 г, 2,5 ммоль) и сухого триэтиламина (0,461 мл, 3,29 ммоль) в сухом диоксане (4 мл) выдерживают при перемешивании при комнатной температуре в течение 20 ч, в атмосфере азота. Затем реакционную смесь кипятят с обратным холодильником в течение 5 ч и выпаривают растворитель при пониженном давлении. Полученный остаток разбавляют водой (15 мл) и этилацетатом (15 мл), разделяют фазы и промывают органический слой последовательно водой (10 мл, дважды), Na2CO3 1N (10 мл,дважды) и раствором соли. Органический слой высушивают над сульфатом натрия и удаляют растворитель в вакууме, чтобы получить остаток, который очищают при помощи высокоскоростной хроматографии (силикагель, элюент: петролейный эфир/этилацетат 4:1), чтобы получить чистое целевое соединение(110 мг). Выход: 38%; ЖХ-МС (RT): 5,54 мин (способ А); МС (ES+) дает m/z: 319,1 (МН+). 5(E) 3-[5-(1H-Пиррол-2-ил)-[1,2,4]оксадиазол-3-ил]пиперидина гидрохлорид. К раствору трет-бутилового эфира 3-[5-(1H-пиррол-2-ил)-[1,2,4]оксадиазол-3-ил]пиперидин-1 карбоновой кислоты (0,110 г, 0,35 ммоль) в дихлорметане (5 мл) добавляют при 0 С 1,5 мл HCl 4N (диоксановый раствор), оставляют реакционную смесь нагреться до комнатной температуры и перемешивают в течение 20 ч. Выпаривают растворитель при пониженном давлении, чтобы получить целевое соединение в виде белого твердого вещества, которое используют на следующей стадии без дальнейшей очистки. Выход: количественный; ЖХ-МС (RT): 2,25 мин (способ А); МС (ES+) дает m/z: 219,1 (МН+). 5(F) (3,4-Дифторфенил)-3-[5-(1H-пиррол-2-ил)-[1,2,4]оксадиазол-3-ил]пиперидин-1-илметанон. К суспензии 3-[5-(1H-пиррол-2-ил)-[1,2,4]оксадиазол-3-ил]пиперидина гидрохлорида (88 мг, 0,35 ммоль) в сухом дихлорметане (5 мл) добавляют по каплям при 0 С триэтиламин (145 мкл, 1 ммоль) и 3,4 дифторбензоилхлорид (52 мкл, 0,4 ммоль). Оставляют реакционную смесь нагреться до комнатной температуры и перемешивают в течение 30 мин, в атмосфере азота. Затем полученный раствор обрабатывают водой (5 мл) и разделяют фазы. Органический слой промывают последовательно HCl 0,5 N (10 мл, 2 раза), 5% NaHCO3 (10 мл, дважды), а затем высушивают над Na2SO4 и выпаривают при пониженном давлении. Полученный неочищенный продукт очищают при помощи высокоскоростной хроматографии (силикагель, элюент: петролейный эфир:AcOEt 1:1), чтобы получить 49 мг целевого соединения. Выход: 70% (белое твердое вещество); т.пл.=177 С; ЖХ-МС (RT): 6,88 мин (способ Q); МС (ES+) дает m/z: 359,1 (МН+). 1 Н-ЯМР (ДМСО-d6),(м. д.): 12,02 (с уш, 1 Н); 7,44 (м, 2 Н); 7,26 (м, 1 Н); 7,12 (дд, 1 Н); 6,96 (дд, 1 Н); 6,30 (дд, 1 Н); 4,22 (м, 1 Н); 3,80 (м, 1 Н); 3,34 (дд, 1 Н); 3,22 (ддд, 1 Н); 3,10 (м, 1 Н); 2,19 (м, 1 Н); 1,96-1,76 Указанное соединение получают в соответствии с процедурой, описанной в примере 5(F), начиная с 3-[5-(1 Н-пиррол-2-ил)-[1,2,4]оксадиазол-3-ил]пиперидина гидрохлорида (полученного, как описано в примере 5(E. Очистку конечного соединения осуществляют при помощи высокоскоростной хроматографии на силикагеле (элюент: гексан:AcOEt 1:1). Выход: 61% (белое твердое вещество); т.пл.=151 С; ЖХ-МС (RT): 7,11 мин (способ Q); MC (ES+) дает m/z. 359,1. 1 Н-ЯМР (ДМСО-d6),(м. д.): 12,02 (суш, 1 Н); 7,45 (м, 1 Н); 7,22 (м, 1 Н); 7,12 (м, 2 Н); 6,96 (д, 1 Н); 6,30 (дд, 1 Н); 4,57 (м уш, 1 Н); 3,95 (м уш, 1 Н); 3,44-3,13 (м, 2 Н); 3,05 (м,1 Н); 2,19 (м, 1 Н); 1,96-1,74 (м,2 Н); 1,59 (м, 1 Н). Пример 7. Указанное соединение получают в соответствии с процедурой, описанной в примере 5(F), начиная с 3-[5-(1 Н-пиррол-2-ил)-[1,2,4]оксадиазол-3-ил]пиперидина гидрохлорида (полученного, как описано в примере 5(E. Очистку конечного соединения осуществляют при помощи высокоскоростной хроматографии на силикагеле (элюент: гексан:AcOEt 1:1). Выход: 52% (белое твердое вещество); т.пл.=158 С; ЖХ-МС (RT): 6,88 мин (способ Q); MC (ES+) дает m/z: 341,2 (МН+). 1 Н-ЯМР (ДМСО-d6),(м. д.): 12,03 (с уш, 1 Н); 7,47 (дд, 2 Н); 7,22 (дд, 2 Н); 7,12 (дд, 1 Н); 6,96 (дд,1 Н); 6,30 (дд, 1 Н); 4,26 (м, 1 Н); 3,83 (м, 1 Н); 3,32 (дд, 1 Н); 3,19 (ддд, 1 Н); 3,08 (м, 1 Н); 2,19 (м, 1 Н); 1,961,76 (м, 2 Н); 1,63 (м, 1 Н). Пример 8.(56 мг, 0,3 ммоль), НОВТ (44 мг, 0,3 ммоль) и ТЭА (0,083 мл, 0,59 ммоль) в ДХМ (3 мл) перемешивают на протяжении ночи при комнатной температуре, в атмосфере азота. Выпаривают растворитель при пониженном давлении. Полученный остаток разбавляют водой (5 мл) и этилацетатом (10 мл), разделяют фазы, промывают органический слой Na2CO3 2 N (5 мл 2 раза) и высушивают над Na2SO4. Выпаривание растворителя при пониженном давлении дает неочищенный продукт в виде твердого вещества, которое очищают при помощи высокоскоростной хроматографии на силикагеле (элюент: петролейный эфир:этилацетат 1:1). Выход: 56% (белое твердое вещество); т.пл.=143 С; ЖХ-МС (RT): 6,44 мин (способ Q); MC (ES+) дает m/z: 342,1 (МН+). 1 Н-ЯМР (ДМСО-d6),(м. д.): 12,03 (с уш, 1 Н); 8,31 (м, 1 Н); 8,02 (ддд, 1 Н); 7,21 (ддд, 1 Н); 7,13 (дд,1 Н); 6,96 (дд, 1 Н); 6,30 (дд, 1 Н); 4,24 (м, 1 Н); 3,81 (м, 1 Н); 3,46-3,21 (м, 2 Н); 3,13 (м, 1 Н); 2,19(м, 1 Н); 1,97-1,76 (м, 2 Н); 1,65 (м, 1 Н). Пример 9. Указанное соединение получают в соответствии с процедурой, описанной в примере 8, с применением 4-фтор-2-метилбензойной кислоты в качестве предпочтительной кислоты и начиная с 3-[5-(1 Нпиррол-2-ил)-[1,2,4]оксадиазол-3-ил]пиперидина гидрохлорида (полученного, как описано в примере 5(E. Очистку конечного соединения осуществляют при помощи высокоскоростной хроматографии на силикагеле (элюент: петролейный эфир/этилацетат 1:1) Выход: 43% (белое твердое вещество); т.пл.=203 С; ЖХ-МС (RT): 6,68 мин (способ Q); MC (ES+) дает m/z: 355,2 (МН+). 1 Н-ЯМР (ДМСО-d6),(м. д.): 12,02 (с уш, 1 Н); 7,22 (м, 1 Н); 7,15-6,92 (м, 4 Н); 6,30 (дд, 1 Н); 4,56 (м уш, 1 Н); 3,79 (м уш, 1 Н); 3,32 (дд, 1 Н); 3,21-2,99 (м, 2 Н); 2,24 (с, 3H); 2,19 (м, 1 Н); 1,96-1,72 (м, 2 Н); 1,58 10(A) трет-Бутиловый эфир (S)-3-карбамоилпиперидин-1-карбоновой кислоты. К раствору (S)-1-Вос-пиперидин-3-карбоновой кислоты (2 г, 8,72 ммоль) в хлороформе (40 мл) добавляют по каплям при 0 С триэтиламин (1,21 мл, 8,72 ммоль), а затем этилхлорформиат (0,8 мл, 8,30 ммоль), в атмосфере азота. После перемешивания в течение 10 мин при 0 С, через раствор пропускаютNH3 (газ) в течение 1 ч. Затем реакционную смесь перемешивают при комнатной температуре в течение 3 ч, добавляют 5% NaHCO3 (водн.) и разделяют фазы. Органический слой высушивают над сульфатом натрия и выпаривают при пониженном давлении, чтобы получить целевое соединение, которое исполь- 23014081 зуют на следующей стадии без дальнейшей очистки. Выход: количественный; ЖХ-МС (RT): 3,31 мин (способ A); MC (ES+) дает m/z: 229,0 (МН+). 10(B) трет-Бутиловый эфир (S)-3-цианопиперидин-1-карбоновой кислоты. Оксихлорид фосфора (812 мл, 8,72 ммоль) добавляют по каплям при 0 С к раствору третбутилового эфира (S)-3-карбамоилпиперидин-1-карбоновой кислоты (2 г, 8,72 ммоль) в пиридине (20 мл), в атмосфере азота. После перемешивания на протяжении ночи при комнатной температуре, добавляют этилацетат и промывают полученный раствор 10% HCl (2 раза). Разделяют фазы, высушивают органический слой над сульфатом натрия и выпаривают досуха при пониженном давлении. Полученное целевое соединение используют на следующей стадии без дальнейшей очистки. Выход: количественный; ЖХ-МС (RT): 4,48 мин (способ А); МС (ES+) дает m/z: 211,1 (МН+). 10(C) трет-Бутиловый эфир (S)-3-(N-гидроксикарбамимидоил)пиперидин-1-карбоновой кислоты. Раствор трет-бутилового эфира (S)-3-цианопиперидин-1-карбоновой кислоты (1,8 г, 8,72 ммоль) и водного гидроксиламина (50% в воде, 2,1 мл, 34,88 ммоль) в этаноле (20 мл) кипятят с обратным холодильником в течение 2 ч. Выпаривают растворитель при пониженном давлении, чтобы получить целевое соединение, которое используют на следующей стадии без дальнейшей очистки. Выход: количественный; ЖХ-МС (RT): 2,71 мин (способ А); МС (ES+) дает m/z: 244,0 (МН+). 10(D) трет-Бутиловый эфир(0,4 г, 1,6 ммоль), полученного, как описано в примере 10(C), 1 Н-пиррол-2-карбоновой кислоты (182 мг,1,6 ммоль), НОВТ (248 мг, 1,6 ммоль), КДИ.HCl (0,47 г, 2,5 ммоль) и сухого триэтиламина (0,461 мл, 3,29 ммоль) в сухом диоксане (4 мл) выдерживают при перемешивании при комнатной температуре в течение 20 ч, в атмосфере азота. Затем реакционную смесь кипятят с обратным холодильником в течение 5 ч и выпаривают растворитель при пониженном давлении. Полученный остаток разбавляют водой (15 мл) и этилацетатом (15 мл), разделяют фазы и промывают органический слой последовательно водой (10 мл,дважды), 1N Na2CO3 (10 мл, дважды) и раствором соли. Высушивают органический слой над сульфатом натрия и удаляют растворитель в вакууме, чтобы получить остаток, который очищают при помощи высокоскоростной хроматографии (силикагель, элюент: петролейный эфир/этилацетат 4:1), чтобы получить чистое целевое соединение (110 мг). Выход: 35%; ЖХ-МС (RT): 5,55 мин (способ А); МС (ES+) дает m/z: 319,1 (МН+). 10(E) (S)-3-[5-(1H-Пиррол-2-ил)-[1,2,4]оксадиазол-3-ил]пиперидина гидрохлорид. К раствору трет-бутилового эфира (S)-3-[5-(1H-пиррол-2-ил)-[1,2,4]оксадиазол-3-ил]пиперидин-1 карбоновой кислоты (0,110 г, 0,35 ммоль) в дихлорметане (5 мл) добавляют при 0 С 1,5 мл 4N HCl (диоксановый раствор), оставляют реакционную смесь нагреться до комнатной температуры и перемешивают в течение 20 ч. Выпаривают растворитель при пониженном давлении, чтобы получить целевое соединение в виде белого твердого вещества, которое используют на следующей стадии без дальнейшей очистки. Выход: количественный; ЖХ-МС (RT): 2,25 мин (способ А); МС (ES+) дает m/z: 219,1 (МН+). 10(F)(3,4-Дифторфенил)-(S)-3-[5-(1H-пиррол-2-ил)-[1,2,4]оксадиазол-3-ил]пиперидин-1 илметанон. К суспензии (S)-3-[5-(1H-пиррол-2-ил)-[1,2,4]оксадиазол-3-ил]пиперидина гидрохлорида (88 мг,0,35 ммоль) в сухом дихлорметане (5 мл) добавляют по каплям при 0 С триэтиламин (145 мкл, 1 ммоль) и 3,4-дифторбензоилхлорид (52 мкл, 0,4 ммоль). Оставляют реакционную смесь нагреться до комнатной температуры и перемешивают в течение 30 мин в атмосфере азота. Полученный раствор обрабатывают водой (5 мл) и разделяют фазы. Органический слой промывают последовательно 0,5 N HCl (10 мл, 2 раза), 5% NaHCO3 (10 мл, дважды), затем высушивают над Na2SO4 и выпаривают при пониженном давлении. Полученный неочищенный продукт очищают при помощи высокоскоростной хроматографии (силикагель, элюент: петролейный эфир:AcOEt 1:1), чтобы получить 49 мг целевого соединения. Выход: 48% (белое твердое вещество); т.пл.=168 С; ЖХ-МС (RT): 6,42 мин (способ Q); МС (ES+) дает m/z: 359,2 (МН+). 1 Н-ЯМР (ДМСО-d6),(м. д.): 12,02 (с уш, 1 Н); 7,50-7,38 (м, 2 Н); 7,27 (м, 1 Н); 7,12 (дд, 1 Н); 6,96 (дд,1 Н); 6,30 (дд, 1 Н); 4,22 (м, 1 Н); 3,80 (м, 1 Н); 3,34 (дд, 1 Н); 3,22 (ддд, 1 Н); 3,10 (ддд, 1 Н); 2,19 (м, 1 Н); 1,97-1,76 (м, 2 Н); 1,63 (м, 1 Н). Пример 11.(0,3 г, 1,2 ммоль, полученного, как описано в примере 5(C, 1 Н-индол-2-карбоновой кислоты (0,2 г, 1,2 ммоль), НОВТ (0,17 г, 1,2 ммоль), КДИ.HCl (0,71 г, 3,7 ммоль) и сухого DIEA (0,631 мл, 3,7 ммоль) в сухом ацетонитриле (10 мл) нагревают при 130 С в течение 30 мин в микроволновой печи. Выпаривают растворитель при пониженном давлении, разбавляют полученный остаток водой (15 мл) и этилацетатом(15 мл), разделяют фазы и промывают органический слой последовательно водой (10 мл, дважды), 1NNa2CO3 (10 мл, дважды) и раствором соли. Органический слой высушивают над сульфатом натрия и удаляют растворитель в вакууме, чтобы получить остаток, который очищают при помощи высокоскоростной хроматографии (силикагель, элюент: петролейный эфир/этилацетат 4:1), чтобы получить чистое целевое соединение (120 мг). Выход: 27%; ЖХ-МС (RT): 6,47 мин (способ А); МС (ES+) дает m/z: 369,1 (МН+). 11(В) 2-(3-Пиперидин-3-ил-[1,2,4]оксадиазол-5-ил)-1H-индола гидрохлорид. Указанное соединение получают в соответствии с процедурой, описанной в примере 10(E), начиная с трет-бутилового эфира 3-[5-(1H-индол-2-ил)-[1,2,4]оксадиазол-3-ил]пиперидин-1-карбоновой кислоты(полученного, как описано в примере 11(A. Выход: количественный (белый порошок); ЖХ-МС (RT): 3,06 мин (способ А); МС (ES+) дает m/z: 269,1 (МН+). 11(С) (4-Фторфенил)-3-[5-(1H-индол-2-ил)-[1,2,4]оксадиазол-3-ил]пиперидин-1-илметанон. Указанное соединение получают в соответствии с процедурой, описанной в примере 10(F), с применением 2-(3-пиперидин-3-ил-[1,2,4]оксадиазол-5-ил)-1 Н-индола гидрохлорида (полученного, как описано в примере 11(B. Очистку конечного соединения осуществляют при помощи высокоскоростной хроматографии на силикагеле (элюент: гексан:AcOEt 6:4) Выход: 64% (белое твердое вещество); т.пл.=199-201 С; ЖХ-МС (RT): 7,28 мин (способ Q); МС(S)-3-[3-(1H-индол-2-ил)-[1,2,4]оксадиазол-5-ил]пиперидин-1 карбоновой кислоты. Указанное соединение получают в соответствии с процедурой, описанной в примере 1(А), начиная с 1H-индол-2-карбонитрила. трет-Бутиловый эфир (S)-3-[3-(1H-индол-2-ил)-[1,2,4]оксадиазол-5-ил]пиперидин-1-карбоновой кислоты используют без дальнейшей очистки. Выход: количественный (коричневое масло); ЖХ-МС (RT): 6,41 мин (способ А); МС (ES+) даетm/z: 369,1 (МН+). 12(В) 2-S)-5-Пиперидин-3-ил-[1,2,4]оксадиазол-3-ил)-1H-индола гидрохлорид. Указанное соединение получают в соответствии с процедурой, описанной в примере 1(В), начиная с трет-бутилового эфира (S)-3-[3-(1 Н-индол-2-ил)-[1,2,4]оксадиазол-5-ил]пиперидин-1-карбоновой кислоты. Выход: количественный (коричневое твердое вещество); ЖХ-МС (RT): 2,63 мин (способ В); МС(2,4-Дифторфенил)-(S)-3-[3-(1H-индол-2-ил)-[1,2,4]оксадиазол-5-ил]пиперидин-1 илметанон. Указанное соединение получают в соответствии с процедурой, описанной в примере 1(С), начиная с 2-S)-5-пиперидин-3-ил-[1,2,4]оксадиазол-3-ил)-1 Н-индола гидрохлорида.(2,4-Дифторфенил)-(S)-3-[3-(1 Н-индол-2-ил)-[1,2,4]оксадиазол-5-ил]пиперидин-1-илметанон получают в чистом виде после высокоскоростной колоночной хроматографии (силикагель, элюент: 13(A) трет-Бутиловый эфир 3-[5-(2 Н-пиразол-3-ил)-[1,2,4]оксадиазол-3-ил]пиперидин-1-карбоновой кислоты. Смесь трет-бутилового эфира 3-(N-гидроксикарбамимидоил)пиперидин-1-карбоновой кислоты (0,5 г, 2,05 ммоль, полученного, как описано в примере 5(С, 2 Н-пиразол-3-карбоновой кислоты (0,23 г, 2,05 ммоль), НОВТ (0,31 г, 2,05 ммоль), КДИ.HCl (0,59 г, 3,08 ммоль) и сухого триэтиламина (1,1 мл, 4 ммоль) в сухом диоксане (8 мл) выдерживают при перемешивании при комнатной температуре в течение 5 ч, в атмосфере азота. Затем реакционную смесь разбавляют ДХМ и промывают 5% NaHCO3 и раствором соли. Органический слой высушивают над Na2SO4 и концентрируют. Полученный неочищенный продукт очищают на силикагеле (элюент: ДХМ:МеОН 20:1,5), чтобы получить 520 мг трет-бутилового эфира 3[(гидроксиимино]-[(2 Н-пиразол-3-карбонил)амино]метилпиперидин-1-карбоновой кислоты (выход: 75%; ЖХ-МС (RT): 3,18 мин (способ А); МС (ES+) дает m/z: 338,06). Раствор трет-бутилового эфира 3[(гидроксиимино]-[(2 Н-пиразол-3-карбонил)амино]метилпиперидин-1-карбоновой кислоты (0,52 г,1,54 ммоль) и триэтиламина (0,43 мл, 3,086 ммоль) в диоксане (4 мл) кипятят с обратным холодильником в течение 14 ч, а затем частично удаляют растворитель в вакууме. Выпавшее в осадок твердое вещество отфильтровывают, чтобы получить 360 мг целевого соединения. Выход: 73% (белое твердое вещество); ЖХ-МС (RT): 3,5 мин (способ А); МС (ES+) дает m/z: 320,1(МН+). 13(B) 3-[5-(2 Н-Пиразол-3-ил)-[1,2,4]оксадиазол-3-ил]пиперидина гидрохлорид. Указанное соединение получают в соответствии с процедурой, описанной в примере 5(E), начиная с трет-бутилового эфира 3-[5-(2 Н-пиразол-3-ил)-[1,2,4]оксадиазол-3-ил]пиперидин-1-карбоновой кислоты(полученного, как описано в примере 13(A. Выход: количественный (белый порошок); ЖХ-МС (RT): 1,1 мин (способ С); МС (ES+) дает m/z: 220,1 (МН+). 13(C) (4-Фторфенил)-3-[5-(2 Н-пиразол-3-ил)-[1,2,4]оксадиазол-3-ил]пиперидин-1-илметанон. Указанное соединение получают в соответствии с процедурой, описанной в примере 5(F), с применением 3-[5-(2 Н-пиразол-3-ил)-[1,2,4]оксадиазол-3-ил]пиперидина гидрохлорида (полученного, как описано в примере 13(B. Очистку конечного соединения осуществляют при помощи высокоскоростной хроматографии на силикагеле (элюент: АсОЕ:гексан 3:1) Выход: 62% (аморфное белое твердое вещество); ЖХ-МС (RT): 6,90 мин (способ Q); MC (ES+) дает Указанное соединение получают в соответствии с процедурой, описанной в примере 5(F), с применением 3-[5-(2 Н-пиразол-3-ил)-[1,2,4]оксадиазол-3-ил]пиперидина гидрохлорида (полученного, как описано в примере 13(B. Очистку конечного соединения осуществляют при помощи высокоскоростной хроматографии на силикагеле (элюент: АсОЕ:петролейный эфир 3:1). Выход: 54% (аморфное белое твердое вещество); ЖХ-МС (RT): 7,07 мин (способ Q); MC (ES+) дает Указанное соединение получают в соответствии с процедурой, описанной в примере 1 (С), начиная с 2-S)-5-пиперидин-3-ил-[1,2,4]оксадиазол-3-ил)-1H-индола гидрохлорида (полученного, как описано в примере 12(В.(3,4-дифторфенил)-(S)-3-[3-(1 Н-индол-2-ил)-[1,2,4]оксадиазол-5-ил]пиперидин-1 илметанон получают в чистом виде после высокоскоростной колоночной хроматографии (силикагель,элюент: AcOEt :петролейный эфир 3:7). Указанное соединение получают в соответствии с процедурой, описанной в примере 1(С), начиная с 2-S)-5-пиперидин-3-ил-[1,2,4]оксадиазол-3-ил)-1 Н-индола гидрохлорида (полученного, как описано в примере 12(В.(4-Фторфенил)-(S)-3-[3-(1H-индол-2-ил)-[1,2,4]оксадиазол-5-ил]пиперидин-1 илметанон получают в чистом виде после высокоскоростной колоночной хроматографии (силикагель,элюент: AcOEt:петролейный эфир 3:7). Выход: 18% (белое твердое вещество); ЖХ-МС (RT): 6,99 мин (способ Q); МС (ES+) дает m/z: 391,2(0,25 г, 1,03 ммоль, полученного, как описано в примере 5 (С, 1 Н-имидазол-2-карбоновой кислоты (116 мг, 1,03 ммоль), НОВТ (161 мг, 1,05 ммоль), КДИ.HCl (0,3 г, 1,55 ммоль) и сухого триэтиламина (0,29 мл,2,05 ммоль) в сухом ДХМ (10 мл) перемешивают в течение 4 ч при комнатной температуре, в атмосфере азота. Затем полученный раствор концентрируют в вакууме и очищают полученный неочищенный продукт на силикагеле (элюент: ДХМ:МеОН 20:1), чтобы получить 100 мг трет-бутилового эфира 3[(гидроксиимино]-[(1 Н-имидазол-2-карбонил)амино]метилпиперидин-1-карбоновой кислоты (выход: 29%; ЖХ-МС (RT): 2,54 мин (способ В); МС (ES+) дает m/z: 357,95 (МН+. Раствор трет-бутилового эфира 3-[(гидроксиимино]-[(1H-имидазол-2-карбонил)амино]метилпиперидин-1-карбоновой кислоты (0,1 г, 0,3 ммоль) и DIEA (0,043 мл, 0,3 ммоль) в MeCN (4 мл) нагревают в течение 30 мин при 150 С в запаянной трубке при помощи микроволнового излучения. После охлаждения в осадок выпадает белое твердое вещество, которое собирают при помощи фильтрования,чтобы получить 43 мг целевого соединения. Выход: 45% (белое твердое вещество); ЖХ-МС (RT): 2,97 мин (способ В); МС (ES+) дает m/z: 320,1(МН+). 17(B) 3-[5-(1H-Имидазол-2-ил)-[1,2,4]оксадиазол-3-ил]пиперидина трифторацетат. трет-Бутиловый эфир 3-[5-(1H-имидазол-2-ил)-[1,2,4]оксадиазол-3-ил]пиперидин-1-карбоновой кислоты (40 мг, 0,125 ммоль), полученный, как описано в примере 17(А), растворяют в ДХМ (1 мл) и добавляют ТФУК (1 мл). Полученный раствор перемешивают в течение 30 мин, а затем удаляют растворитель в вакууме, чтобы получить целевое соединение в виде бесцветного смолистого вещества, которое используют без дальнейшей очистки. Выход: количественный (бесцветное смолистое вещество); ЖХ-МС (RT): 0,65 мин (способ В); МС(ES+) дает m/z: 220,1(MH+). 17(C) (4-Фторфенил)-3-[1H-имидазол-2-ил)-[1,2,4]оксадиазол-3-ил]пиперидин-1-илметанон. К раствору 3-[5-(1H-имидазол-2-ил)-[1,2,4]оксадиазол-3-ил]пиперидина трифторацетата (полученного, как описано в примере 19(В и триэтиламина (35 мкл, 0,25 ммоль) в сухом ДХМ (2 мл) добавляют при перемешивании 4-фторбензоилхлорид (16 мкл, 0,13 ммоль). Полученный раствор перемешивают в атмосфере азота в течение 2 ч, а затем концентрируют в вакууме. Очистку полученного чернового продукта осуществляют при помощи высокоскоростной хроматографии на силикагеле (элюент: ДХМ:МеОН 20:1). Получают целевое соединение в виде белого твердого вещества (35 мг) Выход: 81% (аморфное белое твердое вещество); ЖХ-МС (RT): 5,58 мин (способ Q); МС (ES+) дает Целевое соединение получают в соответствии с процедурой эксперимента, описанной в примере 17(C), начиная с 3-[5-(1 Н-имидазол-2-ил)-[1,2,4]оксадиазол-3-ил]пиперидина трифторацетата (полученного, как описано в примере 17(B и 3,4-дифторбензоилхлорида. Очистку осуществляют при помощи растирания с диэтиловым эфиром, чтобы получить (3,4-дифторфенил)-3-[5-(1H-имидазол-2-ил)[1,2,4]оксадиазол-3-ил]пиперидин-1-илметанон в виде белого твердого вещества. Выход: 60% (белое твердое вещество); т.пл.=148,5-148,9 С; ЖХ-МС (RT): 6,73 мин (способ Q); MC Указанное соединение получают в соответствии с процедурой, описанной в примере 4, начиная с 2S)-5-пиперидин-3-ил-[1,2,4]оксадиазол-3-ил)-1H-индола гидрохлорида (полученного, как описано в примере 12(В, с применением 5-метилизоксазол-4-карбоновой кислоты в качестве предпочтительной кислоты.(S)-3-[3-(1 Н-индол-2-ил)-[1,2,4]оксадиазол-5-ил]пиперидин-1-ил-(5-метилизоксазол-4-ил)метанон получают в чистом виде после высокоскоростной колоночной хроматографии (силикагель, элюент: ДХМ). Выход: 5% (белый порошок); т.пл.=163-164 С; ЖХ-МС (RT): 6,63 мин (способ Q); MC (ES+) дает Указанное соединение получают в соответствии с процедурой, описанной в примере 4, начиная с(5-Метилизоксазол-4-ил)-(S)-3-[3-(1 Н-пиррол-2-ил)-[1,2,4]оксадиазол-5-ил]пиперидин-1 илметанон получают в чистом виде после высокоскоростной колоночной хроматографии (силикагель,элюент: гексан/этилацетат 3:7). Выход: 60% (белый порошок); т.пл.=125-127 С; []D20=+47,8 (с=0,68, МеОН); ЖХ-МС (RT): 6,01 мин (способ Q); MC (ES+) дает m/z: 328,1 (МН+). 1 Н-ЯМР (ДМСО-d6, 373 K),(м. д.): 11,32 (с уш, 1 Н); 8,52 (с, 1 Н); 6,97 (м, 1 Н); 6,74 (м, 1 Н); 6,22 (м,1 Н); 4,22 (дд, 1 Н); 3,78 (ддд, 1 Н); 3,58 (дд, 1 Н); 3,36 (м, 2 Н); 2,46 (с, 3H); 2,24 (м, 1 Н); 2,06-1,79 (м, 2 Н); 1,66 (м, 1 Н). Пример 21. Указанное соединение получают в соответствии с процедурой, описанной в примере 8, начиная с(6-Фторпиридин-3-ил)-(S)-3-[5-(1 Н-пиррол-2-ил)-[1,2,4]оксадиазол-3-ил]пиперидин-1-илметанон получают в чистом виде после высокоскоростной колоночной хроматографии (силикагель, элюент: петролейный эфир/этилацетат 1:1). Выход: 49% (белое твердое вещество); т.пл.=147 С; []D20=+118,45 (с=1,005, МеОН); ЖХ-МС (RT): 6,03 мин (способ Q); MC (ES+) дает m/z: 342,1 (МН+). 1 Н-ЯМР (ДМСО-d6, 343 K),(м. д.): 12,05 (с уш, 1 Н); 8,32 (м, 1 Н); 8,03 (ддд, 1 Н); 7,21 (ддд, 1 Н); 7,13 (дд, 1 Н); 6,96 (дд, 1 Н); 6,30 (дд, 1 Н); 4,23 (м, 1 Н); 3,81 (м, 1 Н); 3,37 (дд, 1 Н); 3,26 (ддд, 1 Н); 3,13 (м,1 Н); 2,19 (м, 1 Н); 1,97-1,76 (м, 2 Н); 1,66 (м, 1 Н). Пример 22. Указанное соединение получают в соответствии с процедурой, описанной в примере 1(C), начиная с(4-Фторфенил)-(S)-3-[5-(1H-пиррол-2-ил)-[1,2,4]оксадиазол-3-ил]пиперидин-1-илметанон получают в чистом виде после высокоскоростной колоночной хроматографии (силикагель, элюент: петролейный эфир/этилацетат 1:1). Выход: 54% (белое твердое вещество); т.пл.=181 С; []D20=+108,05 (с=0,975, МеОН); ЖХ-МС (RT): 6,41 мин (способ Q); MC (ES+) дает m/z: 341,2 (МН+). 1 Н-ЯМР (ДМСО-d6, 343 K),(м. д.): 12,04 (с уш, 1 Н); 7,47 (дд, 2 Н); 7,22 (дд, 2 Н); 7,12 (м, 1 Н); 6,96 Указанное соединение получают в соответствии с процедурой, описанной в примере 8, начиная с 2(3-пиперидин-3-ил-[1,2,4]оксадиазол-5-ил)-1 Н-индола гидрохлорида (полученного, как описано в примере 11(В, с применением 6-фторпиридин-3-карбоновой кислоты в качестве предпочтительной кислоты. Выход: 51% (белое твердое вещество); т.пл.=163,1-164,3 С; ЖХ-МС (RT): 7,52 мин (способ Q); MC 24(A) Амид 1 Н-имидазол-2-карбоновой кислоты. Раствор 1H-имидазол-2-карбоновой кислоты (200 мг, 1,78 ммоль) и тионилхлорида (3 мл) кипятят с обратным холодильником в течение 2 ч. Реакционную смесь охлаждают до комнатной температуры и выливают в толуол (5 мл), полученный осадок собирают путем фильтрации, а затем промывают диэтиловым эфиром. Полученное твердое вещество растворяют в конц. NH4OH (водн.) (3 мл) и перемешивают при 10 С в течение 1 ч, затем оставляют реакционную смесь нагреться до КТ. Выпавшее в осадок твер- 29
МПК / Метки
МПК: A61K 31/4245, A61P 25/22, A61P 25/32, A61K 31/415, A61P 25/18, A61P 25/34, A61P 25/36, C07D 413/14, C07D 401/14
Метки: аллостерических, метаботропных, рецепторов, положительных, глутаматных, модуляторов, качестве, производные, пиррола
Код ссылки
<a href="https://eas.patents.su/30-14081-proizvodnye-pirrola-v-kachestve-polozhitelnyh-allostericheskih-modulyatorov-metabotropnyh-glutamatnyh-receptorov.html" rel="bookmark" title="База патентов Евразийского Союза">Производные пиррола в качестве положительных аллостерических модуляторов метаботропных глутаматных рецепторов</a>
Предыдущий патент: Иммуномодулирующие гетероциклические соединения
Следующий патент: Полиморфы этилового эфира 3-[(2-{[4-(гексилоксикарбониламиноиминометил)фениламино]метил}-1-метил-1н-бензимидазол-5-карбонил)пиридин-2-иламино]пропионовой кислоты
Случайный патент: Сульфонамиды в качестве ингибиторов белков семейства bcl-2, предназначенные для лечения рака












