Производные 2-бифениламино-4-аминопиримидина в качестве ингибиторов киназ
Номер патента: 17252
Опубликовано: 30.11.2012
Авторы: Грей Натанаэл С., Бурсалая Бадри, Ли Кристиан Чо-Хуа, Хе Сяосюй, Лю Вэньшу, Марсилдже Томас Х., Чэнь Бэй
Формула / Реферат
1. Соединение формулы (1)
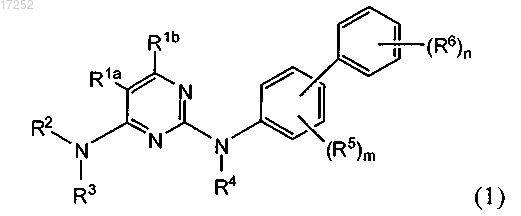
или его фармацевтически приемлемая соль, где R1a обозначает галоген, С1-С6алкил или галогензамещенный С1-С6алкил;
R1b обозначает Н;
R2 обозначает С6-С10карбоциклическое или 5-10-членное гетероарильное или 5-7-членное гетероциклическое кольцо, каждое из которых содержит от 1 до 3 гетероатомов, выбранных из N, О и S, каждый из которых необязательно замещен 1-2 С1-С6алкилом, -L-Y, -L-C(O)O0-1-(CR2)q-R8 или -L-C(O)-NRR8;
R3 обозначает Н или CO(R7), где R7 обозначает С1-С6алкил;
R4 обозначает Н;
R5 и R6 независимо обозначают С1-С6алкил, С1-С6алкоксигруппу, С2-С6алкенил или С2-С6алкинил, каждый из которых необязательно замещен атомом галогена, аминогруппой или гидроксигруппой, или R5 и R6 независимо обозначают галоген, нитрогруппу, цианогруппу, OR8, O(CR2)p-OR8, -L-NR(R8), -L-NR(CR2)pOR8, -L-NR-(CR2)q-C(O)R9, -L-Y, -L-C(O)O0-1-(CR2)q-R8, -L-C(O)-NRR8, -L-C(O)-NR-(CR2)p-NRR8, -L-C(O)NR(CR2)pOR8, -L-C(O)-(CR2)q-NR-C(O)-R9, -L-C(O)NR(CR2)pSR8, -L-C(O)NR(CR2)pS(O)1-2R9, -L-S(O)2R9, -L-S(O)2NRR8, -L-S(O)2NR(CR2)pNR(R8),-L-S(O)2NR(CR2)pOR8,
в другом варианте, 2 соседние группы R5 вместе с атомами углерода, к которым они присоединены, образуют 9-14-членное кольцо;
R8 и R9 независимо обозначают (CR2)qY или С1-С6алкил, С1-С6алкоксигруппу, С2-С6алкенил или C2-С6алкинил, каждый из которых необязательно замещен атомом галогена, аминогруппой или гидроксигруппой, или R8 обозначает Н,
каждый R обозначает Н или С1-С6алкил;
Y обозначает С3-С12карбоциклическое кольцо, С6-С10арил или 5-10-членное гетероарильное или гетероциклическое кольцо, каждое из которых содержит от 1 до 4 гетероатомов, выбранных из N, О и S, где Y необязательно замещен 1-3 С1-С6алкилом;
L обозначает (CR2)1-4 или связь;
m равно 2-4;
р равно 1-4, и
n и q независимо равны 0-4.
2. Соединение по п.1 формулы (2А) или (2В)
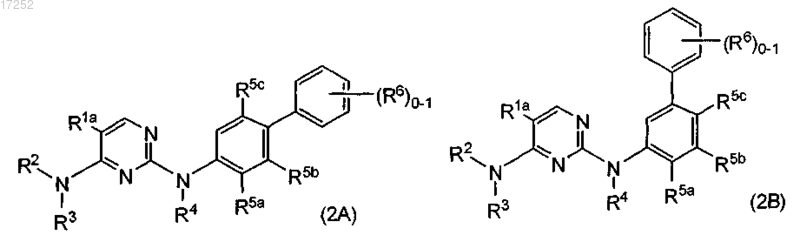
где один из R5a, R5b и R5c обозначает Н, а другие из указанных радикалов и R6 независимо обозначают С1-С6алкил, С1-С6алкоксигруппу, С2-С6алкенил или С2-С6алкинил, каждый из которых необязательно замещен атомом галогена, аминогруппой или гидроксигруппой, или R5a, R5b, R5c и R6 независимо обозначают галоген, нитрогруппу, цианогруппу, OR8, O(CR2)p-OR8, -L-NR(R8), -L-NR(CR2)pOR8, -L-NR-L-C(O)R9, -L-Y,
-L-C(O)O0-1-(CR2)q-R8, -L-C(O)-NRR8, -L-C(O)-NR-(CR2)p-NRR8, -L-C(O)NR(CR2)pOR8, -L-C(O)-(CR2)q-NR-C(O)-R9, -L-C(O)NR(CR2)pSR8, -L-C(O)NR(CR2)pS(O)1-2R9, -L-S(O)2R9, -L-S(O)2NRR8,
-L-S(O)2NR(CR2)pNR(R8), -L-S(O)2NR(CR2)pOR8, где L обозначает (CR2)1-4 или связь;
R8 и R9 независимо обозначают (CR2)qY или С1-С6алкил, С1-С6алкоксигруппу, С2-С6алкенил или C2-С6алкинил, каждый из которых необязательно замещен атомом галогена, аминогруппой или гидроксигруппой, или R8 обозначает Н;
каждый R обозначает Н или С1-С6алкил;
Y обозначает С3-С12карбоциклическое кольцо, С6-С10арил или 5-10-членное гетероарильное или гетероциклическое кольцо, каждое из которых содержит от 1 до 4 гетероатомов, выбранных из N, О и S, где Y необязательно замещен 1-3 С1-С6алкилом,
р равно 1-4 и
q равно 0-4.
3. Соединение по п.2, где R5b обозначает Н,
R5a и R5c независимо обозначают галоген, гидроксигруппу, С1-С6алкил, С1-С6алкоксигруппу, галогензамещенный С1-С6алкил или галогензамещенную С1-С6алкоксигруппу и
R6 обозначает С1-С6алкил, -L-NR-L-C(O)R9, -L-C(O)O0-1-(CR2)q-R8, -L-C(O)-NRR8, -L-S(O)2R9 или -L-S(O)2NRR8.
4. Соединение по п.2, где R5c обозначает Н и R5a и R5b независимо обозначают галоген, гидроксигруппу, С1-С6алкил, С1-С6алкоксигруппу, галогензамещенный С1-С6алкил или галогензамещенную C1-С6алкоксигруппу.
5. Соединение по п.1 формулы (3A) или (3B)
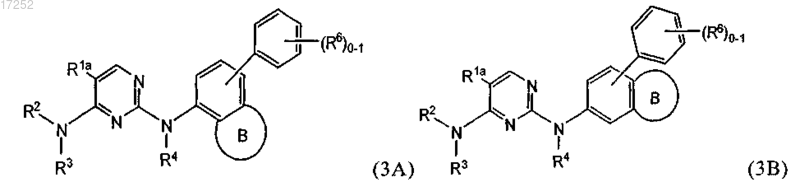
где кольцо В обозначает С5-С7карбоциклическое кольцо, С6-С10арил или 5-10-членное гетероарильное или 5-7-членное гетероциклическое кольцо.
6. Соединение по п.5, где кольцо В вместе с фенильным кольцом, которое к нему присоединено, образует нафталинил или тетрагидронафталинил.
7. Соединение по любому из предшествующих пунктов, где R2 обозначает пиразолил, пирролил, тиофенил, пиримидинил, изоксазолил, пиридил, азепан-2-онил, тиазолил, имидазолил, изоксазолил, индазолил, хинолинил или бицикло[2.2.1]гепт-5-енил, каждый из которых необязательно замещен 1-2 C1-С6алкилом,
-L-Y, -L-C(O)O0-1-(CR2)q-R8 или -L-C(O)-NRR8.
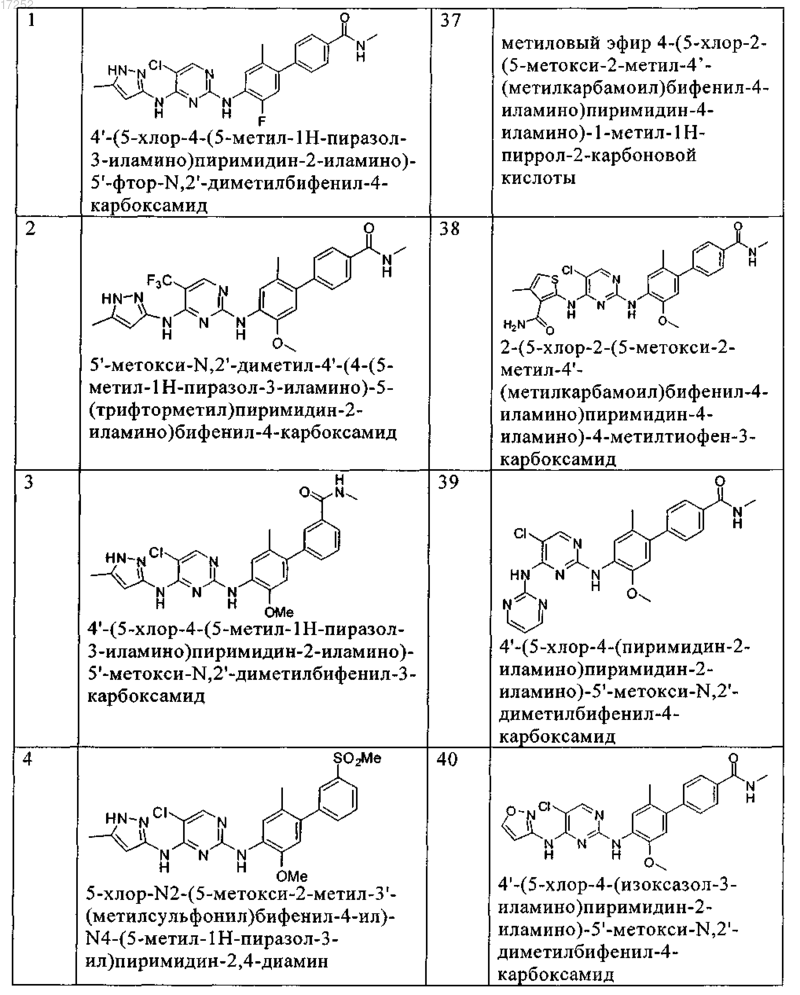
8. Соединение по любому из предыдущих пунктов, где указанное соединение выбирают из группы, включающей
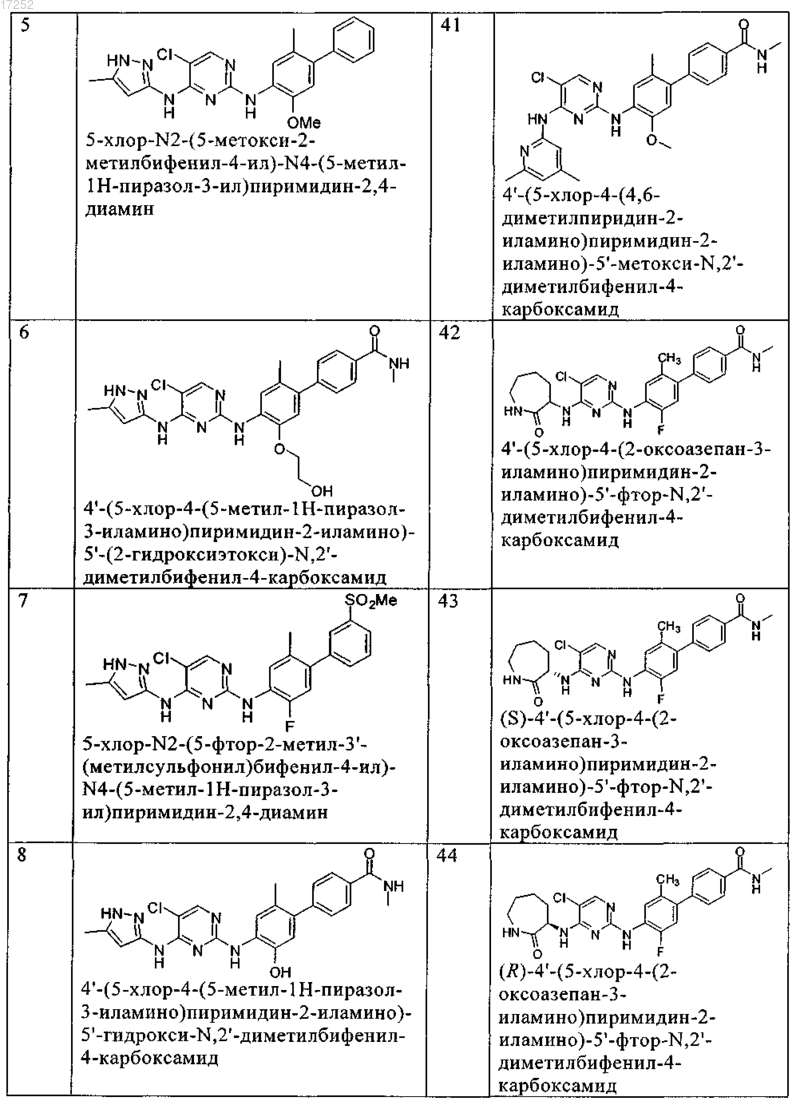
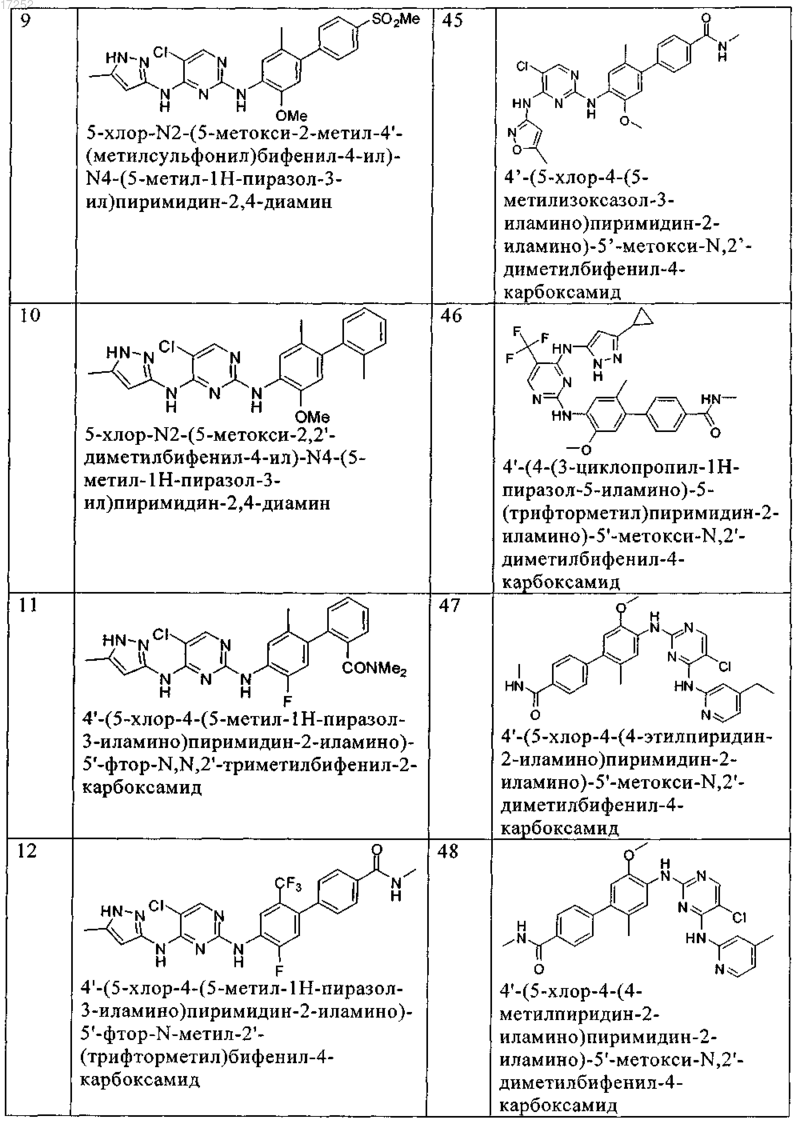
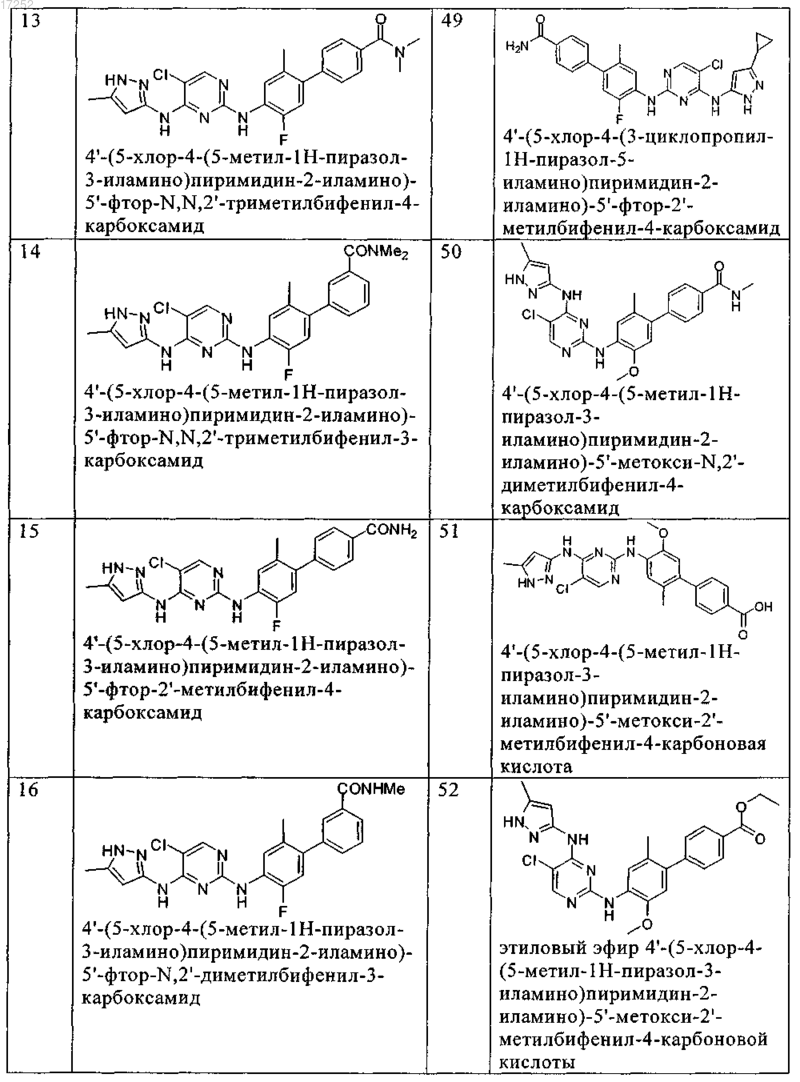
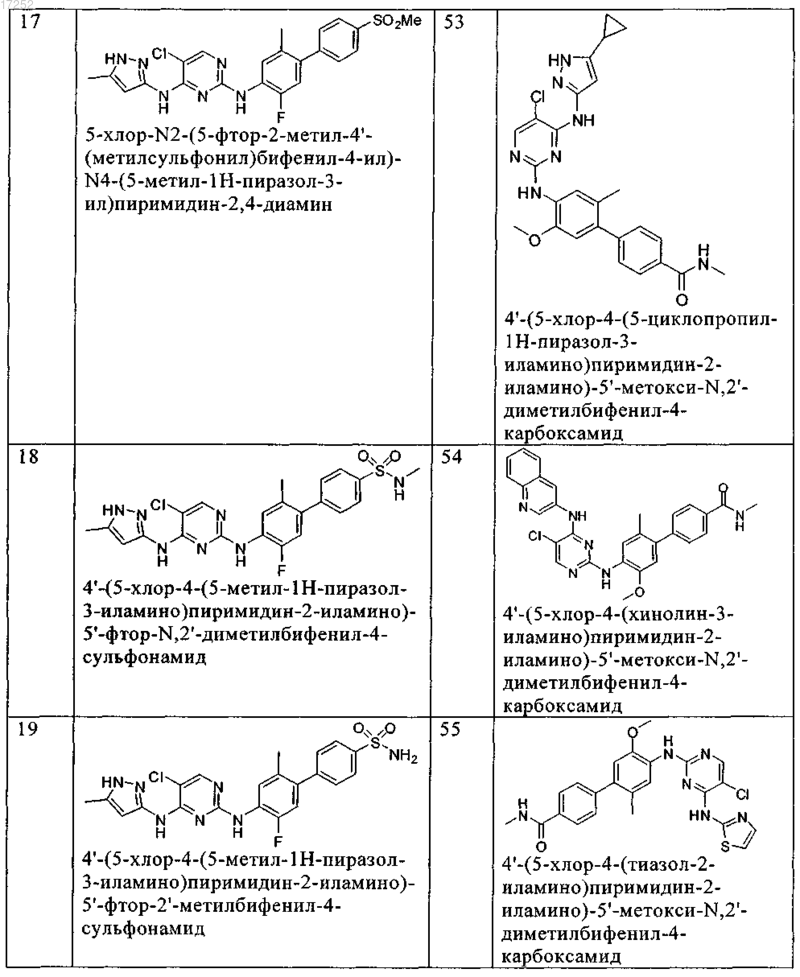
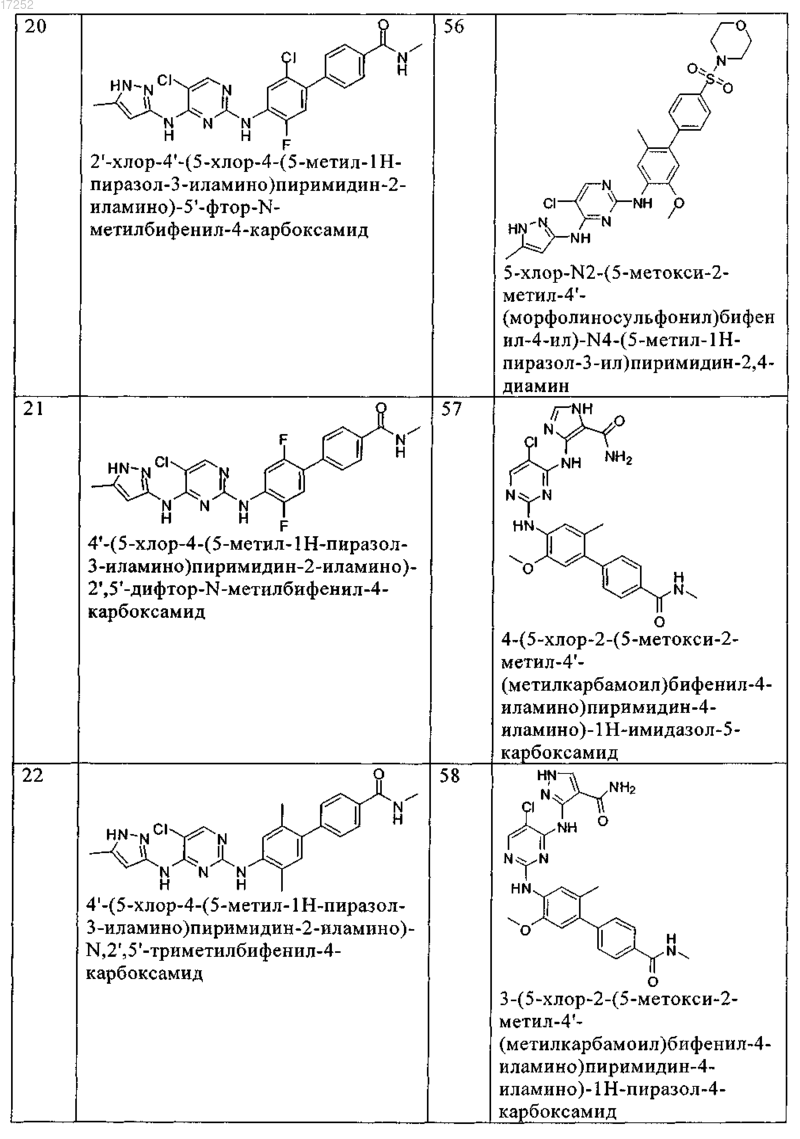
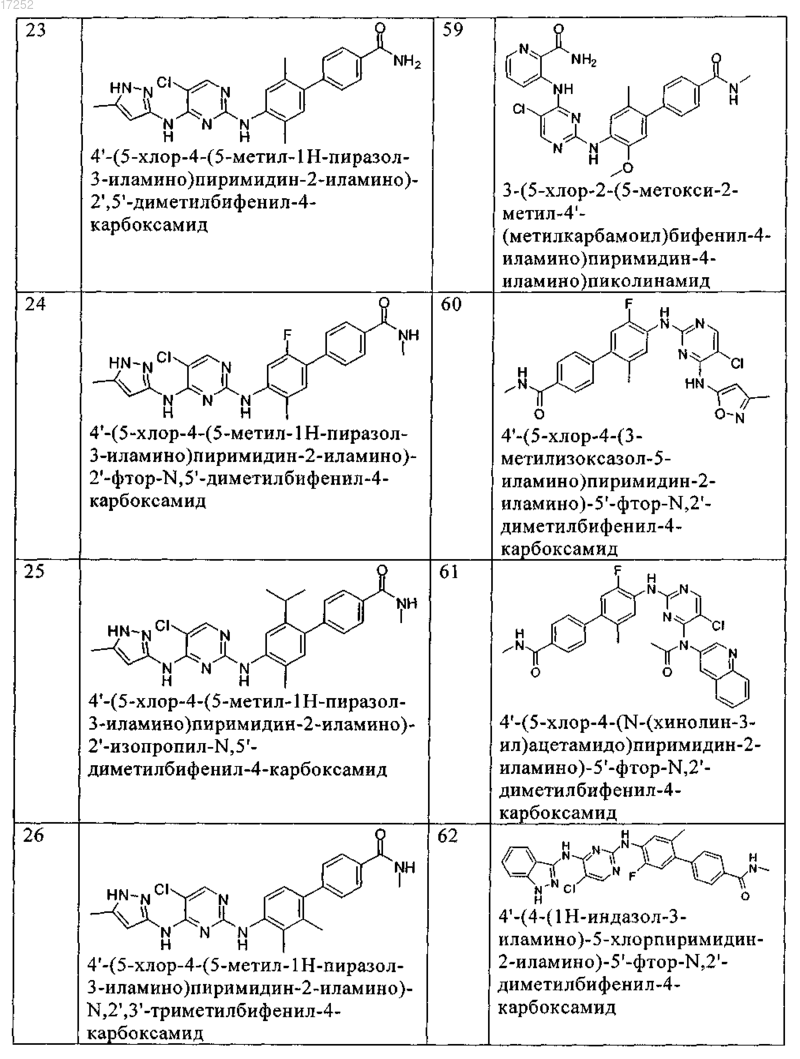
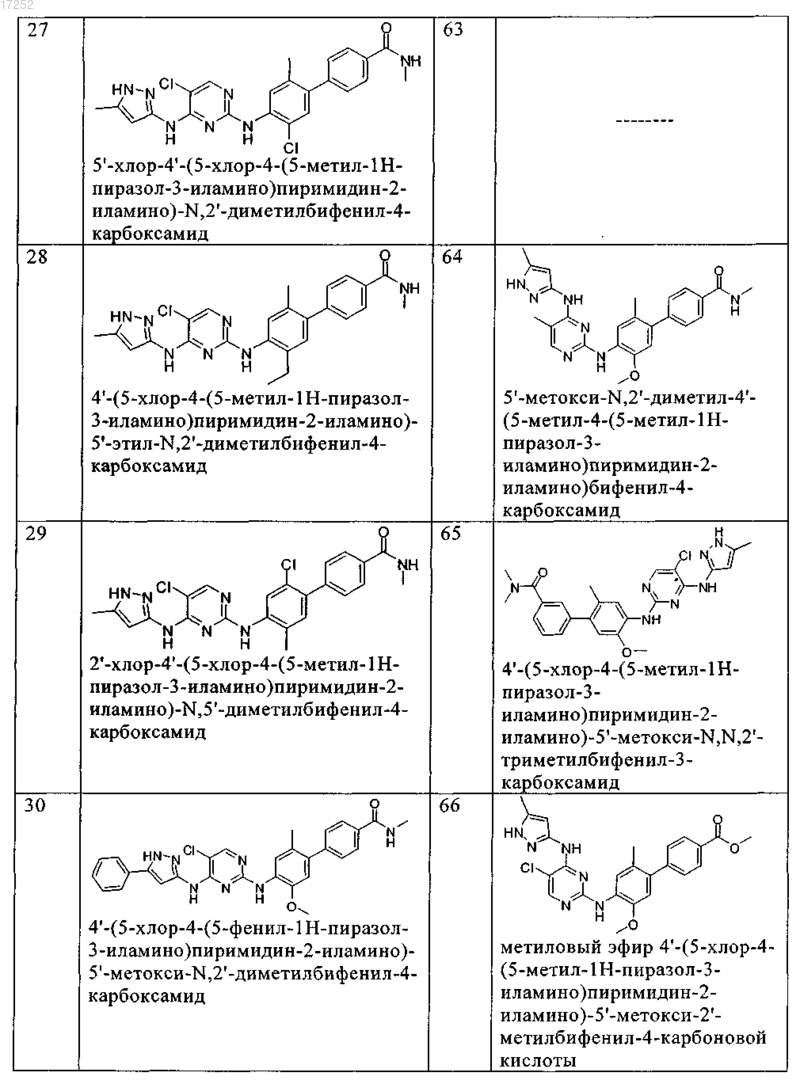
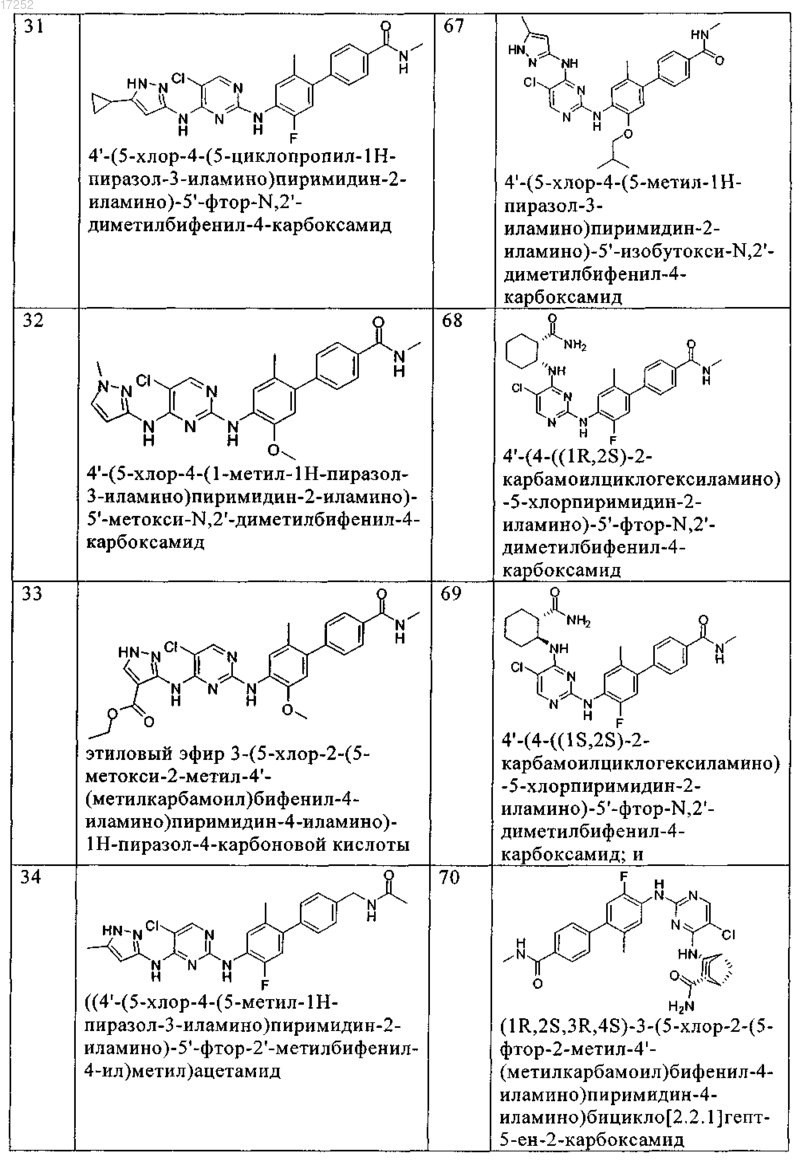
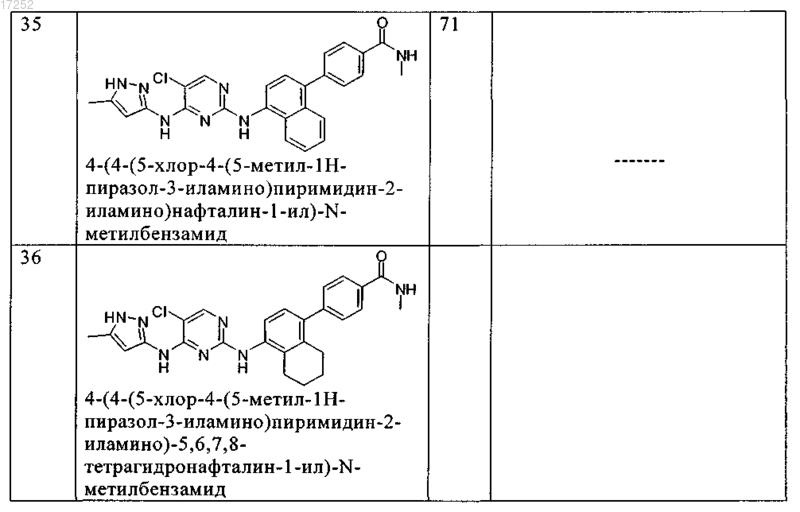
9. Соединение формулы (4)

или его фармацевтически приемлемые соли;
где R1 обозначает галоген, С1-С6алкил или галогензамещенный С1-С6алкил;
R3 обозначает Н или CO(R7), где R7 обозначает С1-С6алкил;
R4 обозначает Н;
R5, R12 и R13 независимо обозначают С1-С6алкил, С1-С6алкоксигруппу, С2-С6алкенил или C2-С6алкинил, каждый из которых необязательно замещен атомом галогена, аминогруппой или гидроксигруппой, или R5, R12 и R13 независимо обозначают галоген, нитрогруппу, цианогруппу, OR8, O(CR2)p-OR8, -L-NR(R8), -L-NR(CR2)pOR8, -L-NR-L-C(O)R9, -L-Y, -L-C(O)O0-1-(CR2)q-R8, -L-C(O)-NRR8, -L-C(O)-NR-(CR2)p-NRR8, -L-C(O)NR(CR2)pOR8, -L-C(O)-(CR2)q-NR-C(O)-R9, -L-C(O)NR(CR2)pSR8, -L-C(O)NR(CR2)pS(O)1-2R9, -L-S(O)2R9, -L-S(O)2NRR8, -L-S(O)2NR(CR2)pNR(R8), -L-S(O)2NR(CR2)pOR8, где L обозначает (CR2)1-4 или связь;
R8, R9 и R11 независимо обозначают (CR2)qY или С1-С6алкил, С1-С6алкоксигруппу, С2-С6алкенил или С2-С6алкинил, каждый из которых необязательно замещен атомом галогена, аминогруппой или гидроксигруппой,
или R8 и R11 независимо обозначают Н;
R10 обозначает NR(R8), NR(CR2)pNR(R8), NR(CR2)pOR8, NR(CR2)qC(O)R8 или R9, каждый R обозначает Н или С1-С6алкил;
Y обозначает С3-С12карбоциклическое кольцо, С6-С10арил или 5-10-членное гетероарильное или гетероциклическое кольцо, каждое из которых содержит от 1 до 4 гетероатомов, выбранных из N, О и S, где Y необязательно замещен 1-3 С1-С6алкилом;
Z обозначает СО или S(O)1-2;
m равно 2-4;
р равно 1-4 и
q равно 0-4.
10. Соединение по п.1, где указанное соединение представлено формулой (4А)
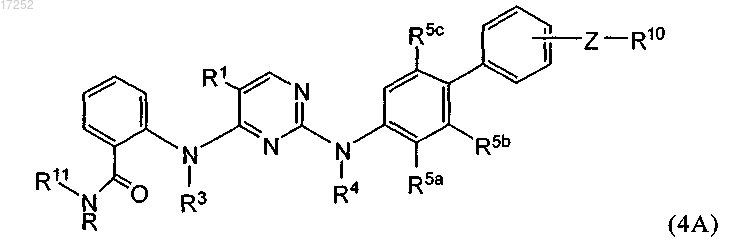
где один из R5a, R5b и R5c обозначает Н, а другие из указанных радикалов независимо обозначают С1-С6алкил, С1-С6алкоксигруппу, С2-С6алкенил или С2-С6алкинил, каждый из которых необязательно замещен атомом галогена, аминогруппой или гидроксигруппой, или R5a, R5b и R5c независимо обозначают галоген, нитрогруппу, цианогруппу, OR8, O(CR2)p-OR8, -L-NR(R8), -L-NR(CR2)pOR8, -L-NR-L-C(O)R9, -L-Y, -L-C(O)O0-1-(CR2)q-R8, -L-C(O)-NRR8, -L-C(O)-NR-(CR2)p-NRR8, -L-C(O)NR(CR2)pOR8, -L-C(O)-(CR2)q-NR-C(O)-R9, -L-C(O)NR(CR2)pSR8, -L-C(O)NR(CR2)pS(O)1-2R9, -L-S(O)2R9, -L-S(O)2NRR8, -L-S(O)2NR(CR2)pNR(R8), -L-S(O)2NR(CR2)pOR8, где L обозначает (CR2)1-4 или связь;
R8, R9 и Rn независимо обозначают (CR2)qY или С1-С6алкил, С1-С6алкоксигруппу, С2-С6алкенил или С2-С6алкинил, каждый из которых необязательно замещен атомом галогена, аминогруппой или гидроксигруппой,
или R8 и R11 независимо обозначают Н;
каждый R обозначает Н или С1-С6алкил;
Y обозначает С3-С12карбоциклическое кольцо, С6-С10арил или 5-10-членное гетероарильное или гетероциклическое кольцо, каждое из которых содержит от 1 до 4 гетероатомов, выбранных из N, О и S, где Y необязательно замещен 1-3 С1-С6алкилом;
р равно 1-4 и
q равно 0-4.
11. Соединение по п.9 или 10, где R5b обозначает Н и R5a и R5c независимо обозначают галоген, гидроксигруппу, С1-С6алкил, С1-С6алкоксигруппу, галогензамещенный С1-С6алкил, галогензамещенную С1-С6алкоксигруппу, -L-C(O)-NRR8 или -L-C(O)O0-1-(CR2)q-R8;
где L обозначает связь;
R8 обозначает (CR2)qY;
каждое q равно 0 и
Y обозначает 5-7-членное гетероциклическое кольцо.
12. Соединение по любому из пп.9-11, где указанное соединение выбирают из группы, включающей
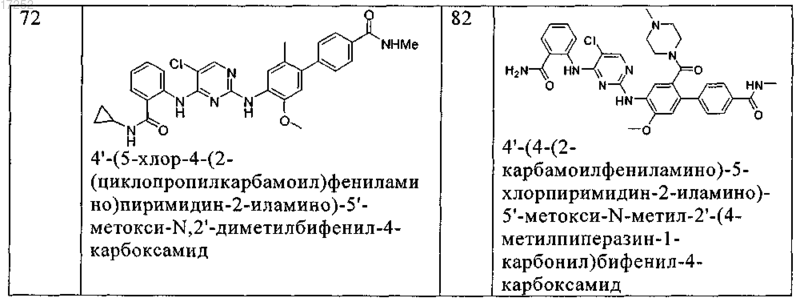
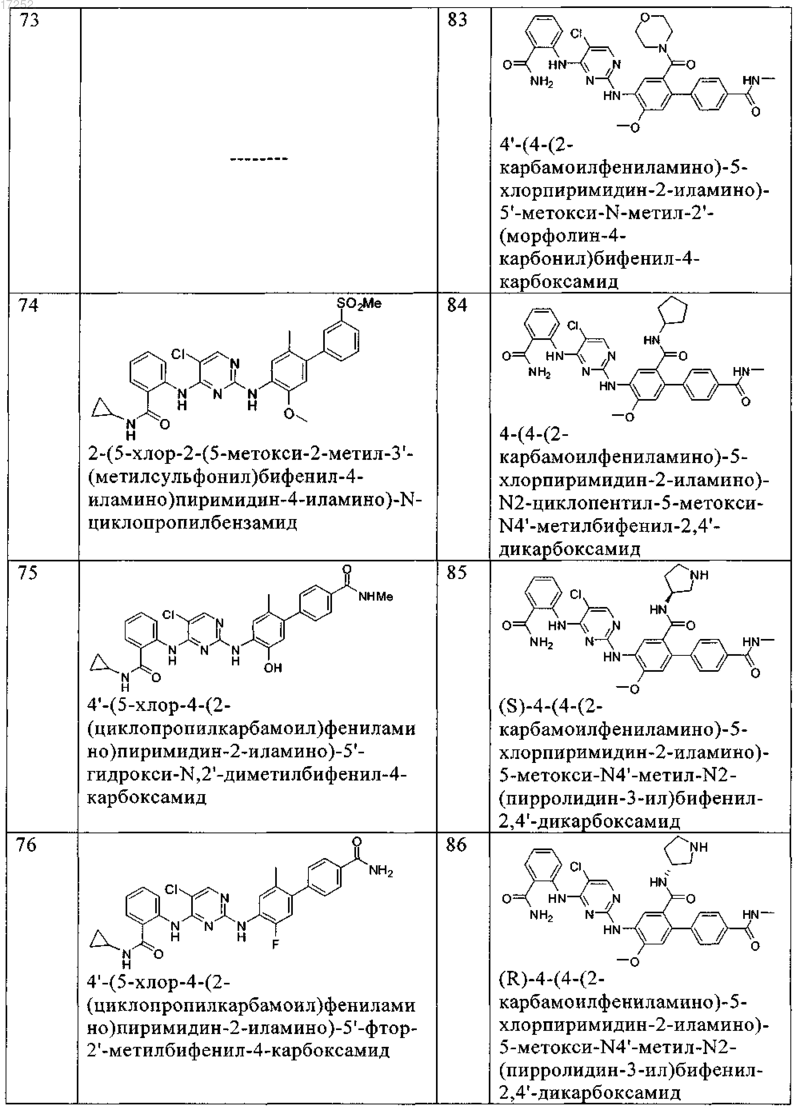
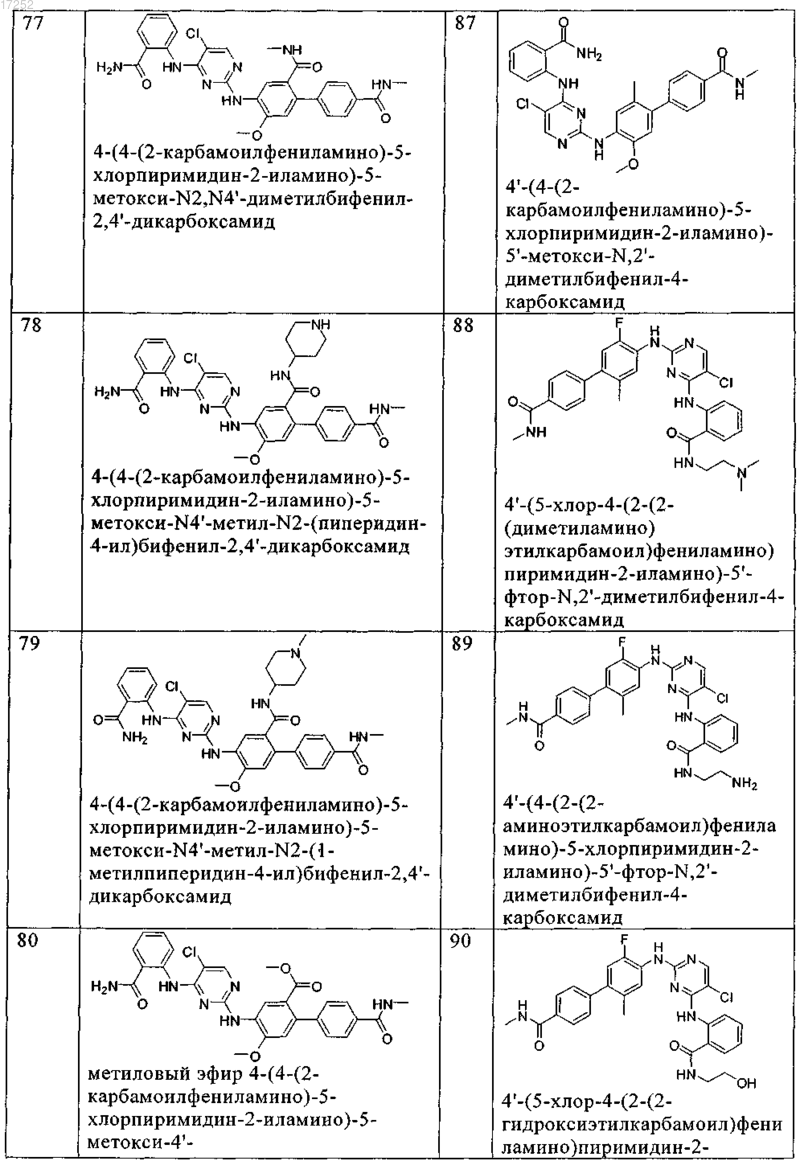
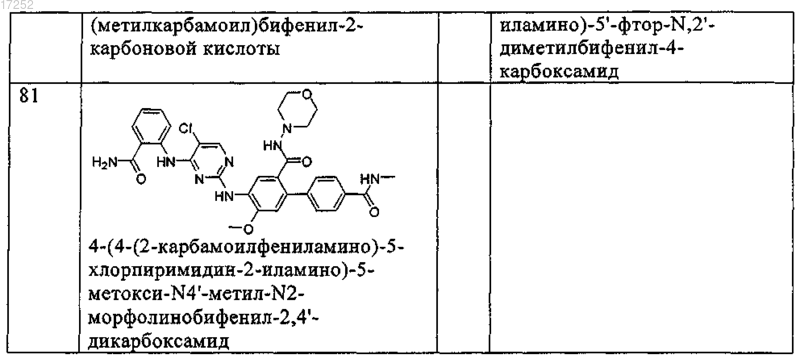
13. Способ ингибирования рецептора инсулиноподобного фактора роста (IGF-1R) или киназы анапластической лимфомы in vitro, который заключается во введении в систему клеток или ткани или в организм субъекта-млекопитающего терапевтически эффективного количества соединения по любому из пп.1-12 или его фармацевтически приемлемых солей.
14. Применение соединения по любому из пп.1-12 для получения лекарственного средства, предназначенного для лечения нейробластомы, солидной опухоли легких, саркомы, остеосаркомы, синовиальной саркомы или саркомы Юинга.
Текст
В изобретении предлагаются новые производные пиримидина формулы (1) и их фармацевтические композиции, а также способы применения указанных соединений. Например, производные пиримидина по настоящему изобретению можно использовать для лечения, снижения интенсивности симптомов или профилактики состояния, чувствительного к ингибированию инсулиноподобного фактора роста (IGF-1R) или киназы анапластической лимфомы (ALK). 017252 Перекрестные ссылки на родственные заявки В настоящей заявке испрашивается приоритет в отношении заявок на выдачу патентов США 60/966449, поданной 28 августа 2007 г., и 61/075556, поданной 25 июня 2008 г., каждая из которых полностью включена в настоящее описание в качестве ссылки. Область техники В настоящем изобретении предлагаются ингибиторы протеинкиназы, более подробно новые производные пиримидина и фармацевтические композиции на их основе, а также их применение в качестве фармацевтических средств. Предпосылки создания настоящего изобретения Сигналы инсулиноподобного фактора роста (IGF-1) в значительной степени принимают участие в развитии рака, при этом основным фактором является рецептор IGF-1(IGF-1R). Рецептор IGR-1R играет важную роль при трансформации опухолей и выживании злокачественных клеток, но только частично участвует в процессе роста нормальных клеток. Использование рецетора IGF-1R в качестве мишени является перспективным при лечении рака (см. статью Larsson и др., Br. J. Cancer, т. 92, стр. 2097-2101(2005. Киназа анапластической лимфомы (ALK), которая является членом подсемейства инсулиновых рецепторов семейства рецепторных тирозинкиназ, принимает участие в онкогенезе опухолей кроветворных и некроветворных тканей. Установлена аномальная экспрессия полноразмерных рецепторов ALK в нейробластомах и глиобластомах, а гибридные белки ALK выявлены в анапластической крупноклеточной лимфоме. Исследование гибридных белков ALK может способствовать разработке новых способов лечения пациентов с ALK-положительными злокачественными заболеваниями (см. статью Pulford и др., Cell.Mol. Life Sci., т. 61, стр. 2939-2953 (2004. В связи с накоплением данных о взаимосвязи заболеваний с IGF-1R и ALK существует необходимость в разработке соединений, пригодных для лечения и профилактики заболевания, чуствительного к ингибированию IGF-1R и ALK. Описание вариантов осуществления настоящего изобретения В настоящем изобретении предлагаются новые производные пиримидина и фармацевтические композиции на их основе, а также их применение в качестве фармацевтических средств. В одном объекте настоящего изобретения предлагаются соединения формулы (1) или их фармацевтически приемлемые соли, где R1a обозначает галоген, С 1-С 6 алкил, или галогензамещенный С 1-С 6 алкил; R1b обозначает Н;R2 обозначает С 6-С 10 карбоциклическое или 5-10-членное гетероарильное или 5-7-членное гетероциклическое кольцо, каждое из которых содержит от 1 до 3 гетероатомов, выбранных из N, О и S, каждый из которых необязательно замещен 1-2 С 1-С 6 алкилом, -L-Y, -L-C(O)O0-1-(CR2)q-R8 или -L-C(O)NRR8;R5 и R6 независимо обозначают С 1-С 6 алкил, С 1-С 6 алкоксигруппу, С 2-С 6 алкенил или С 2-С 6 алкинил,каждый из которых необязательно замещен атомом галогена, аминогруппой или гидроксигруппой, илиR8 и R9 независимо обозначают (CR2)qY или С 1-С 6 алкил, С 1-С 6 алкоксигруппу, С 2-С 6 алкенил или C2 С 6 алкинил, каждый из которых необязательно замещен атомом галогена, аминогруппой или гидроксигруппой, или R8 обозначает Н, каждый R обозначает Н или С 1-С 6 алкил;Y обозначает С 3-С 12 карбоциклическое кольцо, С 6-С 10 арил или 5-10-членное гетероарильное или гетероциклическое кольцо, каждое из которых содержит от 1 до 4 гетероатомов, выбранных из N, О и S,где Y необязательно замещен 1-3 С 1-С 6 алкилом;-1 017252 В одном варианте осуществления настоящего изобретения предлагаются соединения формулы (2A) или (2B) где один из R5a, R5b и R5c обозначает Н, а другие из указанных радикалов и R6 независимо обозначают С 1-С 6 алкил, С 1-С 6 алкоксигруппу, С 2-С 6 алкенил или С 2-С 6 алкинил, каждый из которых необязательно замещен атомом галогена, аминогруппой или гидроксигруппой, или R5a, R5b, R5c и R6 независимо обозначают галоген, нитрогруппу, цианогруппу, OR8, O(CR2)p-OR8, -L-NR(R8), -L-NR(CR2)pOR8, -L-NR-LC(O)R9, -L-Y, -L-C(O)O0-1-(CR2)q-R8, -L-C(O)-NRR8, -L-C(O)-NR-(CR2)p-NRR8, -L-C(O)NR(CR2)pOR8, -LC(O)-(CR2)q-NR-C(O)-R9, -L-C(O)NR(CR2)pSR8, -L-C(O)NR(CR2)pS(O)1-2R9, -L-S(O)2R9, -L-S(O)2NRR8, -LS(O)2NR(CR2)pNR(R8), -L-S(O)2NR(CR2)pOR8, где L обозначает (CR2)1-4 или связь;R8 и R9 независимо обозначают (CR2)qY или С 1-С 6 алкил, С 1-С 6 алкоксигруппу, С 2-С 6 алкенил или C2 С 6 алкинил, каждый из которых необязательно замещен атомом галогена, аминогруппой или гидроксигруппой, или R8 обозначает Н; каждый R обозначает Н или С 1-С 6 алкил;Y обозначает C3-С 12 карбоциклическое кольцо, С 6-С 10 арил или 5-10-членное гетероарильное или гетероциклическое кольцо, каждое из которых содержит от 1 до 4 гетероатомов, выбранных из N, О и S,где Y необязательно замещен 1-3 С 1-С 6 алкилом,p равно 1-4, иq равно 0-4. В некоторых примерах R5b в приведенной выше формуле (2 А) или (2 В) обозначает Н, a R5a и R5c независимо обозначают галоген, гидроксигруппу, С 1-С 6 алкил, С 1-С 6 алкоксигруппу, галогензамещенный C1 С 6 алкил или галогензамещенную С 1-С 6 алкоксигруппу, и R6 обозначает С 1-С 6 алкил, -L-NR-L-C(O)R9, -LC(O)O0-1-(CR2)q-R8, -L-C(O)-NRR8, -L-S(O)2R9 или -L-S(O)2NRR8. В предпочтительных примерах R5c обозначает Н, и R5a и R5b независимо обозначают галоген, гидроксигруппу, С 1-С 6 алкил, С 1-С 6 алкоксигруппу, галогензамещенный С 1-С 6 алкил или галогензамещенную С 1-С 6 алкоксигруппу. В другом варианте осуществления настоящего изобретения предлагаются соединения формулы (3A) или (3B) где кольцо В обозначает С 3-С 7 карбоциклическое кольцо, С 6-С 10 арил, или 5-10-членное гетероарильное или 5-7-членное гетероциклическое кольцо. В приведенных выше формулах (1), (2 А), (2 В), (3A) и (3B) R2 обозначает пиразолил, пирролил, тиофенил, пиримидинил, изоксазолил, пиридил, азепан-2 онил, тиазолил, имидазолил, изоксазолил, индазолил, хинолинил или бицикло[2.2.1]гепт-5-енил, каждый из которых необязательно замещен 1-2 C1-С 6 алкилом, -L-Y, -L-C(O)O0-1-(CR2)q-R8 или -L-C(O)-NRR8. В еще одном объекте настоящего изобретения предлагаются соединения формулы (4) или их фармацевтически приемлемые соли, или его фармацевтически приемлемые соли; где R1 обозначает галоген, С 1-С 6 алкил или галогензамещенный С 1-С 6 алкил;R5, R12 и R13 независимо обозначают С 1-С 6 алкил, С 1-С 6 алкоксигруппу, С 2-С 6 алкенил или С 2 С 6 алкинил, каждый из которых необязательно замещен атомом галогена, аминогруппой или гидроксигруппой, или R5, R12 и R13 независимо обозначают галоген, нитрогруппу, цианогруппу, OR8, O(CR2)p-OR8,-L-NR(R8), -L-NR(CR2)pOR8, -L-NR-L-C(O)R9, -L-Y, -L-C(O)O0-1-(CR2)q-R8, -L-C(O)-NRR8, -L-C(O)-NR-2 017252R8, R9,R11 независимо обозначают (CR2)qY или С 1-С 6 алкил, С 1-С 6 алкоксигруппу, С 2-С 6 алкенил или С 2-С 6 алкинил, каждый из которых необязательно замещен атомом галогена, аминогруппой или гидроксигруппой, или R8 и R11 независимо обозначают Н;Y обозначает С 3-С 12 карбоциклическое кольцо, С 6-С 10 арил или 5-10-членное гетероарильное или гетероциклическое кольцо, каждое из которых содержит от 1 до 4 гетероатомов, выбранных из N, О и S,где Y необязательно замещен 1-3 С 1-С 6 алкилом;Z обозначает СО или S(O)1-2;q равен 0-4. В одном варианте осуществления настоящего изобретения предлагаются соединения формулы (4 А) где один из R5a, R5b и R5c обозначает Н, а другие из указанных радикалов независимо обозначают С 1-С 6 алкил, С 1-С 6 алкоксигруппу, С 2-С 6 алкенил или С 2-С 6 алкинил, каждый из которых необязательно замещен атомом галогена, аминогруппой или гидроксигруппой, или R5a, R5b и R5c независимо обозначают галоген, нитрогруппу, цианогруппу, OR8, O(CR2)p-OR8, -L-NR(R8), -L-NR(CR2)pOR8, -L-NR-L-C(O)R9, -LY, -L-C(O)O0-1-(CR2)q-R8, -L-C(O)-NRR8, -L-C(O)-NR-(CR2)p-NRR8, -L-C(O)NR(CR2)pOR8, -L-C(O)-(CR2)qNR-C(O)-R9, -L-C(O)NR(CR2)pSR8, -L-C(O)NR(CR2)pS(O)1-2R9, -L-S(O)2R9, -L-S(O)2NRR8, -LS(O)2NR(CR2)pNR(R8), -L-S(O)2NR(CR2)pOR8, где L обозначает (CR2)1-4 или связь;R8, R9 и Ru независимо обозначают (CR2)qY или С 1-С 6 алкил, С 1-С 6 алкоксигруппу, С 2-С 6 алкенил или С 2-С 6 алкинил, каждый из которых необязательно замещен атомом галогена, аминогруппой или гидроксигруппой, или R8 и R11 независимо обозначают Н; каждый R обозначает Н или С 1-С 6 алкил;Y обозначает С 3-С 12 карбоциклическое кольцо, С 6-С 10 арил или 5-10-членное гетероарильное или гетероциклическое кольцо, каждое из которых содержит от 1 до 4 гетероатомов, выбранных из N, О и S,где Y необязательно замещен 1-3 С 1-С 6 алкилом; р равно 1-4, и q равен 0-4. В некоторых примерах R5b обозначает Н, и R5a и R5c независимо обозначают галоген, гидроксигруппу, С 1-С 6 алкил, С 1-С 6 алкоксигруппу, галогензамещенный С 1-С 6 алкил, галогензамещенную C1-С 6 алкоксигруппу, -L-C(O)-NRR8 или -L-C(O)O0-1-(CR2)q-R8; где L обозначает связь;Y обозначает 5-7-членное гетероциклическое кольцо. Кроме того, в настоящем изобретении предлагаются способы ингибирования IGF1R или ALK, которые заключаются во введении в клетку, ткань или в организм млекопитающего терапевтически эффективного количества соединения формул (1), (2 А), (2 В), (3A), (3B), (4) или (4 А) или их фармацевтически приемлемых солей, при этом обеспечивается ингибирование указанной киназы или лечение указанного состояния, опосредованного IGF1R или ALK. В другом варианте осуществления настоящего изобретения предлагается применение соединений формул (1), (2 А), (2 В), (3A), (3B), (4) или (4 А) для получения лекарственного средства, предназначенного для лечения состояния, опосредованного IGF-1R или ALK, причем указанное состояние обозначает аутоиммунное заболевание, реакцию трансплантат против хозяина, инфекционное заболевание или клеточное пролиферативное нарушение. В другом варианте осуществления настоящего изобретения предлагается применение соединений формул (1), (2 А), (2 В), (3A), (3B), (4) или (4 А) для получения лекарственного средства, предназначенного для лечения клеточного пролиферативного нарушения, включая, но не ограничиваясь только ими,множественную миелому, нейробластому, синовиальную гепатоцеллюлярную саркому, саркому Юинга или солидную опухоль, выбранную из остеосаркомы, меланомы и опухоли молочной железы, почки,предстательной железы, колоректальной опухоли, опухоли щитовидной железы, яичников, поджелудочной железы, легких, матки или желудочно-кишечного тракта. В описанных выше способах применения соединений по настоящему изобретению соединения формул (1), (2 А), (2 В), (3A), (3B), (4) или (4 А) вводят в систему, включающую клетки или ткани, или субъекту-млекопитающему, такому как человек или животное.-3 017252 Определения Термин алкил обозначает остаток или структурный элемент в составе других групп, например,галогензамещенный алкил или алкоксигруппу, с прямой или разветвленной цепью. Необязательно замещенные алкил, алкенил или алкинил, использованные в данном контексте, необязательно замещены галогенами (например, CF3), или один или более атомов углерода в их составе замещены или заменены гетероатомом, таким как NR, О или S (например, -ОСН 2 СН 2 О-, алкилтиолы, тиоалкоксигруппа, алкиламины и т.п.). Термин арил обозначает моноциклическое или конденсированное бициклическое ароматическое кольцо, содержащее атомы углерода. Термин арилен обозначает двухвалентный радикал, образующийся из арильной группы. Например, арильные группы включают фенил, инденил, инданил, нафтил или 1,2,3,4-тетрагидронафталенил, который необязательно замещен в орто-, мета- или пара-положении. Значение термина гетероарил, использованного в данном контексте, аналогично значению термина арил, как описано выше, в котором один или более атомов в цикле обозначают гетероатом. Например, гетероарильные заместители, пригодные для применения в соединениях по настоящему изобретению, включают моноциклические или бициклические 5-10-членные гетероарилы, содержащие от 1 до 4 гетероатомов, выбранных из N, О и S. Примеры гетероарилов включают, не ограничиваясь только ими,пиридил, пиразинил, индолил, индазолил, хиноксалинил, хинолинил, бензофуранил, бензопиранил, бензотиопиранил, бензо[1,3]диоксол, имидазолил, бензимидазолил, пиримидинил, фуранил, оксазолил, изоксазолил, триазолил, бензотриазолил, тетразолил, пиразолил, тиенил, пирролил, изохинолинил, пуринил,тиазолил, тетразинил, бензотиазолил, оксадиазолил, бензоксадиазолил и т.п. Термин карбоциклическое кольцо, использованный в данном контексте, обозначает насыщенное или частично ненасыщенное, моноциклическое, конденсированное бициклическое или мостиковое полициклическое кольцо, содержащее атомы углерода, которое необязательно замещено, например, группами=O. Примеры карбоциклических колец включают, не ограничиваясь только ими, циклопропил, циклобутил, циклопентил, циклогексил, циклопропилен, циклогексанон и т.п. Значение термина гетероциклическое кольцо, использованного в данном контексте, аналогично значению термина карбоциклическое кольцо, как описано выше, один или более атомов углерода в составе которого являются гетероатомами. Например, гетероциклическим кольцом, пригодным для применения в соединениях по настоящему изобретению, является 4-7-членное гетероциклическое кольцо,содержащее от 1 до 3 гетероатомов, выбранных из N, О и S, или из их комбинаций, таких как -S(O) или S(O)2-. Примеры гетероциклических колец включают, не ограничиваясь только ими, азетидинил, морфолиногруппу, пирролидинил, пирролидинил-2-он, пиперазинил, пиперидинил, пиперидинилон, 1,4 диокса-8-азаспиро[4.5]дец-8-ил, 1,2,3,4-тетрагидрохинолинил и т.п. Гетероциклические кольца, используемые в данном контексте, могут включать бициклические амины и бициклические диамины. Термин атом Н, использованный в данном контексте, в составе любых групп-заместителей (например, CH2) включает все его пригодные изотопы, например H, 2H и 3H. Термины совместное введение или комбинированное введение или аналогичные термины, использованные в данном контексте, обозначают введение выбранных терапевтических агентов одному пациенту, а также обозначают курсы лечения, при которых агенты необязательно вводят одинаковым способом или одновременно. Термин фармацевтическая комбинация, использованный в данном контексте, обозначает продукт,полученный после смешивания активных ингредиентов, и включает фиксированные и нефиксированные комбинации активных ингредиентов. Термин фиксированная комбинация обозначает, что активные ингредиенты, например, соединение формулы (1) и совместно вводимый агент, вводят пациенту одновременно в виде единой формы или единой дозы. Термин нефиксированная комбинация обозначает,что активные ингредиенты, например, соединение формулы (1) и совместно вводимый агент, вводят пациенту в отдельности одновременно, поочередно или последовательно без ограничений времени введения, при этом указанный способ введения обеспечивает терапевтически эффективные уровни активных ингредиентов в организме пациента. Последнее также относится к комбинированному лечению, например, к введению трех или более активных ингредиентов. Термин терапевтически эффективное количество обозначает количество соединения, которое вызывает биологическую или медицинскую ответную реакцию в клетке, ткани, органе, организме животного или человека, определяемую исследователем, ветеринаром, врачом или другим медицинским персоналом. Термин введение субъекту соединения обозначает доставку соединения по настоящему изобретению и его пролекарства субъекту, нуждающемуся в указанном лечении. Способы осуществления настоящего изобретения В настоящем изобретении предлагаются новые производные пиримидина и фармацевтические композиции на их основе, а также способы применения указанных соединений. В одном объекте настоящего изобретения предлагаются соединения формулы (1) или их фармацевтически приемлемые соли, где R1a обозначает галоген, С 1-С 6 алкил, или галогензамещенный С 1-С 6 алкил; R1b обозначает Н;R2 обозначает С 6-С 10 карбоциклическое или 5-10-членное гетероарильное или 5-7-членное гетероциклическое кольцо, каждое из которых содержит от 1 до 3 гетероатомов, выбранных из N, О и S, каждый из которых необязательно замещен 1-2 С 1-С 6 алкилом, -L-Y, -L-C(O)O0-1-(CR2)q-R8 или -L-C(O)NRR8; R3 обозначает Н или CO(R7), где R7 обозначает С 1-С 6 алкил; R4 обозначает Н;R5 и R6 независимо обозначают С 1-С 6 алкил, С 1-С 6 алкоксигруппу, С 2-С 6 алкенил или С 2-С 6 алкинил,каждый из которых необязательно замещен атомом галогена, аминогруппой или гидроксигруппой, илиR8 и R9 независимо обозначают (CR2)qY или С 1-С 6 алкил, С 1-С 6 алкоксигруппу, С 2-С 6 алкенил или С 2 С 6 алкинил, каждый из которых необязательно замещен атомом галогена, аминогруппой или гидроксигруппой, или R8 обозначает Н, каждый R обозначает Н или С 1-С 6 алкил;Y обозначает С 3-С 12 карбоциклическое кольцо, С 6-С 10 арил или 5-10-членное гетероарильное или гетероциклическое кольцо, каждое из которых содержит от 1 до 4 гетероатомов, выбранных из N, О и S,где Y необязательно замещен 1-3 С 1-С 6 алкилом;n и q независимо равны 0-4. В одном варианте осуществления настоящего изобретения предлагаются соединения формулы (2 А) или (2 В) где один из R5a, R5b и R5c обозначает Н, а другие из указанных радикалов и R6 независимо обозначают С 1-С 6 алкил, С 1-С 6 алкоксигруппу, С 2-С 6 алкенил или С 2-С 6 алкинил, каждый из которых необязательно замещен атомом галогена, аминогруппой или гидроксигруппой, или R5a, R5b, R5c и R6 независимо обозначают галоген, нитрогруппу, цианогруппу, OR8, O(CR2)p-OR8, -L-NR(R8), -L-NR(CR2)pOR8, -L-NR-LC(O)R9, -L-Y, -L-C(O)O0-1-(CR2)q-R8, -L-C(O)-NRR8, -L-C(O)-NR-(CR2)p-NRR8, -L-C(O)NR(CR2)pOR8, -LC(O)-(CR2)q-NR-C(O)-R9, -L-C(O)NR(CR2)pSR8, -L-C(O)NR(CR2)pS(O)1-2R9, -L-S(O)2R9, -L-S(O)2NRR8, -LS(O)2NR(CR2)pNR(R8), -L-S(O)2NR(CR2)pOR8, где L обозначает (CR2)1-4 или связь;R8 и R9 независимо обозначают (CR2)qY или С 1-С 6 алкил, С 1-С 6 алкоксигруппу, С 2-С 6 алкенил или C2 С 6 алкинил, каждый из которых необязательно замещен атомом галогена, аминогруппой или гидроксигруппой, или R обозначает Н; каждый R обозначает Н или С 1-С 6 алкил;Y обозначает С 3-С 12 карбоциклическое кольцо, С 6-С 10 арил или 5-10-членное гетероарильное или гетероциклическое кольцо, каждое из которых содержит от 1 до 4 гетероатомов, выбранных из N, О и S,где Y необязательно замещен 1 -3 С 1-С 6 алкилом,р равно 1-4, иq равно 0-4. В другом варианте осуществления настоящего изобретения предлагаются соединения формулы где кольцо В обозначает С 5-С 7 карбоциклическое кольцо, С 6-С 10 арил, или 5-10-членное гетероарильное или 5-7-членное гетероциклическое кольцо. В еще одном объекте настоящего изобретения предлагаются соединения формулы (4) или их фармацевтически приемлемые соли, где R1 обозначает галоген, С 1-С 6 алкил или галогензамещенный С 1-С 6 алкил; R3 обозначает Н или CO(R7), где R7 обозначает С 1-С 6 алкил; R4 обозначает Н;R5, R12 и R13 независимо обозначают С 1-С 6 алкил, С 1-С 6 алкоксигруппу, С 2-С 6 алкенил или C2 С 6 алкинил, каждый из которых необязательно замещен атомом галогена, аминогруппой или гидроксигруппой, или R5, R12 и R13 независимо обозначают галоген, нитрогруппу, цианогруппу, OR8, O(CR2)p-OR8,-L-NR(R8), -L-NR(CR2)pOR8, -L-NR-L-C(O)R9, -L-Y, -L-C(O)O0-1-(CR2)q-R8, -L-C(O)-NRR8, -L-C(O)-NR(CR2)p-NRR8, -L-C(O)NR(CR2)pOR8, -L-C(O)-(CR2)q-NR-C(O)-R9, -L-C(O)NR(CR2)pSR8, -L-C(O)NRR8, R9 и R11 независимо обозначают (CR2)qY или С 1-С 6 алкил, С 1-С 6 алкоксигруппу, С 2-С 6 алкенил или С 2-С 6 алкинил, каждый из которых необязательно замещен атомом галогена, аминогруппой или гидроксигруппой, или R8 и R11 независимо обозначают Н;Y обозначает С 3-С 12 карбоциклическое кольцо, С 6-С 10 арил или 5-10-членное гетероарильное или гетероциклическое кольцо, каждое из которых содержит от 1 до 4 гетероатомов, выбранных из N, О и S,где Y необязательно замещен 1-3 С 1-С 6 алкилом;Z обозначает СО или S(O)1-2;q равен 0-4. В одном варианте осуществления настоящего изобретения предлагаются соединения формулы (4 А), где один из R5a, R5b и R5c обозначает Н, а другие из указанных радикалов независимо обозначают С 1-С 6 алкил, С 1-С 6 алкоксигруппу, С 2-С 6 алкенил или С 2-С 6 алкинил, каждый из которых необязательно замещен атомом галогена, аминогруппой или гидроксигруппой, или R5a, R5b и R5c независимо обозначают галоген, нитрогруппу, цианогруппу, OR8, O(CR2)p-OR8, -L-NR(R8), -L-NR(CR2)pOR8, -L-NR-L-C(O)R9, -LY, -L-C(O)O0-1-(CR2)q-R8, -L-C(O)-NRR8, -L-C(O)-NR-(CR2)p-NRR8, -L-C(O)NR(CR2)pOR8, -L-C(O)-(CR2)qNR-C(O)-R9, -L-C(O)NR(CR2)pSR8, -L-C(O)NR(CR2)pS(O)1-2R9, -L-S(O)2R9, -L-S(O)2NRR8, -LS(O)2NR(CR2)pNR(R8), -L-S(O)2NR(CR2)pOR8, где L обозначает (CR2)1-4 или связь;R8, R9 и R11 независимо обозначают (CR2)qY или С 1-С 6 алкил, С 1-С 6 алкоксигруппу, С 2-С 6 алкенил или С 2-С 6 алкинил, каждый из которых необязательно замещен атомом галогена, аминогруппой или гидроксигруппой, или R8 и R11 независимо обозначают Н; каждый R обозначает Н или С 1-С 6 алкил;Y обозначает С 3-С 12 карбоциклическое кольцо, С 6-С 10 арил или 5-10-членное гетероарильное или гетероциклическое кольцо, каждое из которых содержит от 1 до 4 гетероатомов, выбранных из N, О и S,-6 017252 где Y необязательно замещен 1-3 С 1-С 6 алкилом; р равно 1-4, иq равен 0-4. В приведенных выше формулах (1), (2 А), (2 В), (3A) или (3B) примеры 5-10-членных гетероарильных или 5-7-членных гетероциклических групп R2 включают, не ограничиваясь только ими, пиразолил,пирролил, тиофенил, пиримидинил, изоксазолил, пиридил, азепан-2-онил, 2 Н-тиопиран, 3H-тиопиран,4 Н-тиопиран, тетрагидротиопиран, 2 Н-пиран, 4 Н-пиран, тетрагидропиран, пиперидин, 1,2-дитиин, 1,2 дитиан, 1,3-дитиин, 1,3-дитиан, 1,4-дитиин, 1,4-дитиан, 1,2-диоксин, 1,2-диоксан, 1,3-диоксин, 1,3 диоксан, 1,4-диоксин, 1,4-диоксан, пиперазин, 1,2-оксатиин, 1,2-оксатиан, 4 Н-1,3-оксатиин, 1,3-оксатиан,1,4-оксатиин, 1,4-оксатиан, 2 Н-1,2-тиазин, тетрагидро-1,2-тиазин, 2 Н-1,3-тиазин, 4 Н-1,3-тиазин, 5,6 дигидро-4 Н-тиазин, 4 Н-1,4-тиазин, тетрагидро-1,4-тиазин, 2 Н-1,2-оксазин, 4 Н-1,2-оксазин, 6 Н-1,2 оксазин, 2 Н-1,3-оксазин, 4 Н-1,3-оксазин, 4 Н-1,4-оксазин, морфолин, триоксан, 4 Н-1,2,3-тритиин, 1,2,3 тритиан, 1,3,5-тритиан, гексагидро-1,3,5-триазин, тетрагидротиофен, тетрагидрофуран, пирролин, пирролидин, пирролидон, пирролидион, пиразолин, пиразолидин, имидазолин, имидазолидин, 1,2-диоксол,1,2-диоксолан, 1,3-диоксол, 1,3-диоксолан, 3H-1,2-дитиол, 1,2-дитиолан, 1,3-дитиол, 1,3-дитиолан, изоксазолин, изоксазолидин, оксазолин, оксазолидин, тиазолин, тиозолидин, 3H-1,2-оксатиол, 1,2 оксатиолан, 5 Н-1,2-оксатиол, 1,3-оксатиол, 1,3-оксатиолан, 1,2,3-тритиол, 1,2,3-тритиолан, 1,2,4 тритиолан, 1,2,3-триоксол, 1,2,3-триоксолан, 1,2,4-триоксолан, 1,2,3-триазолин и 1,2,3-триазолидин. В каждой описанной выше формуле любые асимметрические атомы углерода могут присутствовать в (R)-, (S)- или (R,S)-конфигурации. Соединения могут представлять собой смеси изомеров или индивидуальные изомеры, например индивидуальные энантиомеры или диастереомеры. Настоящее изобретение включает также возможные таутомеры соединений по настоящему изобретению. Настоящее изобретение включает также все пригодные изотопные формы соединений по настоящему изобретению или их фармацевтически приемлемые соли. Термин изотопная форма соединения по настоящему изобретению или его фармацевтически приемлемой соли обозначает соединение, в котором по крайней мере один атом заменен на атом одного и того же атомного номера, но различной атомной массы в отличие от атомной массы наиболее распространенного в природе атома. Примеры изотопов,которые могут быть включены в соединения по настоящему изобретению и их фармацевтически приемлемые соли, включают, не ограничиваясь только ими, изотопы водорода, углерода, азота и кислорода,такие как 2 Н, 3 Н, 11 С, 13 С, 14 С, 15N, 17 О, 18 О, 35S, 18F, 36Cl и 123I. Некоторые изотопные формы соединений по настоящему изобретению и их фармацевтически пригодных солей, например, в состав которых включены радиоактивные изотопы, такие как 3H или 14 С, можно использовать в исследованиях по распределению лекарственных средств и/или субстратов в тканях. В некоторых примерах изотопы 3H и 14 С можно использовать в связи с простотой их получения и детектирования. В других примерах замещение изотопами, такими как 2 Н, может обеспечить определенные терапевтические преимущества вследствие большей метаболической стабильности, например, повышенного периода полураспада in vivo или необходимости снижения дозы. Изотопные формы соединений по настоящему изобретению или их фармацевтически приемлемых солей в большинстве случаев получают по стандартным методикам с использованием соответствующих изотопных пригодных реагентов. Изотопные формы соединений по настоящему изобретению можно использовать для изменения метаболического превращения соединения и/или незначительного изменения физических свойств, таких как гидрофобность и т.п. Изотопные формы можно использовать для повышения эффективности и безопасности, повышения биодоступности и периода полураспада, изменения связывания с белками, изменения биораспределения, повышения доли активных метаболитов и/или снижения образования реакционноспособных или токсичных метаболитов. В каждой приведенной выше формуле каждый необязательно замещенный остаток замещен C1 С 6 алкилом, С 2-С 6 алкенилом или С 3-С 6 алкинилом, каждый из которых необязательно замещен галогеном или необязательно содержит атом углерода, замененный или замещенный N, S, О или их комбинацией(например, гидрокси(С 1-С 8)алкил, C1-С 8 алкокси(C1-С 8)алкил), галогеном, аминогруппой, амидиногруппой, С 1-С 6 алкоксигруппой, гидроксигруппой, метилендиоксигруппой, карбоксигруппой, C1-С 8 алкилкарбонилом, C1-С 8 алкоксикарбонилом, карбамоилом, C1-С 8 алкилкарбамоилом, сульфамоилом, цианогруппой, оксогруппой, нитрогруппой или необязательно замещенным карбоциклическим кольцом, гетероциклическим кольцом, арилом или гетероарилом, как описано выше. Фармацевтические свойства и применение Соединения по настоящему изобретению и их фармацевтически приемлемые соли характеризуются ценными фармакологическими свойствами по данным анализа in vitro в бесклеточных системах и в присутствии клеток, и, таким образом, их можно использовать в качестве фармацевтических средств. В одном объекте настоящего изобретения соединения ингибируют активность тирозинкиназы анапластической лимфомы (ALK) и гибридного белка NPM-ALK. Такая протеинтирозинкиназа образуется при слиянии генов нуклеофосмина (NPM) и ALK, что приводит к независимости активности протеинтирозинкиназы от лигандов ALK. NPM-ALK играет основную роль в передаче сигнала в ряде кроветвор-7 017252 ных клеток и других клетках человека, что приводит к развитию заболеваний крови и опухолей, например, анапластической крупноклеточной лимфомы (АККЛ) и лимфом не-Ходжкина (ЛНХ), прежде всегоALK + ЛНХ, воспалительных миофибробластных опухолей (ВМО) и нейробластом (см. статью Duyster и др., Oncogene, т. 20, сс. 5623-5637 (2001. Кроме NPM-ALK, при развитии заболеваний крови и опухолей человека наблюдается слияние других генов, например, TPM3-ALK (слияние немышечного тропомиозина с ALK). Ингибирование активности тирозинкиназы ALK можно оценивать стандартными методами, например, с использованием рекомбинантного домена киназы ALK аналогично тому, как описано для киназыVEGF-R (см. статью J. Wood и др., Cancer Res., т. 60, сс. 2178-2189 (2000. В большинстве случаев, методы определения ферментативной активности in vitro проводят с использованием протеинтирозинкиназы GST-ALK в 96-луночных планшетах в 20 мМ буферном растворе Трис-HCl, рН 7,5, содержащем 3 мМMgCl2, 10 мМ MnCl2, 1 мМ DTT, 0,1 мкКи/в лунку (=30 мкл) [-33 Р]-АТФ, 2 мкМ АТФ, 3 мкг/мл поли(Glu, Tyr4:1)поли-EY (фирмы Sigma, Р-0275), 1% ДМСО, 25 нг фермента ALK. Реакционные смеси инкубируют в течение 10 мин при температуре окружающей среды. Реакцию останавливают добавлением 50 мкл 125 мМ ЭДТУ и реакционную смесь переносят в планшет MAIP Multiscreen (фирмы Millipore,Bedford, MA, США), предварительно смоченный метанолом, и повторно пропитанный в течение 5 минH2O. После промывки (0,5% Н 3 РО 4) радиоактивность в планшетах определяют на жидкостном сцинтиляционном счетчике. Величины IC50 рассчтывают методом линейной регрессии по графикам зависимости ингибирования (%). Соединения по настоящему изобретению эффективно подавляют рост клеток BaF3 мыши, избыточно экспрессирующих NPM-ALK человека (фирмы DSMZ Deutsche Sammiung von Mikroorganismen undZelikulturen GmbH, Германия). Экспрессию NPM-ALK получают после трансфекции клеток BaF3 вектором экспрессии pClneo (фирмы Promega Corp., Madison WI, США), кодирующим NPM-ALK, и после последующего отбора клеток, устойчивых к G418. Выживаемость нетрансфектированных клеток BaF3 зависит от ИЛ-3. И наоборот, клетки BaF3, экспрессирующие NPM-ALK (далее клетки BaF3-NPM-ALK) пролиферируют в отсутствие ИЛ-3, т.к. они получают сигнал к пролиферации от киназы NPM-ALK. Предполагаемые ингибиторы киназы NPM-ALK, таким образом, отменяют сигнал роста, т.е. проявляется антипролиферативная активность. Антипролиферативную активность предполагаемых ингибиторов киназы NPM-ALK можно подавлять при добавлении ИЛ-3, который передает сигналы роста по механизму,независимому от NPM-ALK. Описаны также аналогичные клеточные системы с использованием киназыFLT3 (см. статью Е Weisberg и др., Cancer Cell, т. 1, сс. 433-443 (2002. Ингибирующую активность соединений по настоящему изобретению оценивают следующим образом. В большинстве случаев клетки BaF3- NPM-ALK (15000/в лунке микротитрационного планшета) переносят в 96-луночные микротитрационные планшеты. Серийные разведения исследуемых соединений, растворенных в диметилсульфоксиде (ДМСО), добавляют в лунки, причем конечная концентрация ДМСО в лунке не должна превышать 1% (об./об.). После добавления соединений планшеты инкубируют в течение 2 сут, в течение указанного периода контрольные культуры, несодержащие исследуемое соединение, проходят 2 цикла деления клеток. Рост клеток BaF3- NPM-ALK оценивают при окрашивании клеток реагентом YOPRO (см. статью Т. Idziorek и др., J. Immunol. Methods, т. 185, сс. 249-258 (1995. В каждую лунку добавляют 25 мкл буферного раствора для лизиса, содержащего 20 мМ цитрата натрия,pH 4,0, 26,8 мМ хлорида натрия, 0,4 % NP40, 20 мМ ЭДТУ, 20 мМ реагента YOPRO. После завершения лизиса клеток в течение 60 мин при КТ определяют общее количество реагента YOPRO, связанного с ДНК, в ридере для 96-луночных планшетов Cytofluor II (фирма PerSeptive Biosystems) с использованием следующих параметров: длина волны возбуждения (нм) 485/20 и испускания (нм) 530/25. В другом объекте соединения по нстоящему изобретению ингибируют рецептор инсулиноподобного фактора роста (IGF-1R). Эффективность соединений по настоящему изобретению в качестве ингибиторов киназной активности IGF-1R оценивают по связыванию с клетками методом ИФА. Данный метод анализа основан на определении активности соединений по настоящему изобретению в отношении аутофосфорилирования IGF-1R, индуцированного IGF-1. Соединения по настоящему изобретению можно использовать для лечения заболеваний, опосредованных IGF-1R и/или ALK. Примеры заболеваний, опосредованных IGF-1R и/или ALK, включают, не ограничиваясь только ими, пролиферативные заболевания, такие как опухоли, например опухоли молочной железы, почки, предстательной железы, колоректальная опухоль, опухоли щитовидной железы, яичников, поджелудочной железы, нервной системы, легких, матки и желудочно-кишечного тракта, а также остеосаркомы и меланомы. Соединения по настоящему изобретению можно также применять для лечения и/или профилактики острых или хронических воспалительных заболеваний или нарушений или аутоиммунных заболеваний,например, таких как ревматоидный артрит, остеоартрит, системная красная волчанка, болезнь Хашимото, рассеянный склероз, тяжелая псевдопаралитическая миастения, диабет (типа I и II), и нарушений,связанных с ними, респираторных заболеваний, таких как астма или воспалительное повреждение печени, воспалительного повреждения почечных клубочков, кожных проявлений иммунологически опосре-8 017252 дованных нарушений или заболеваний, воспалительных и гиперпролиферативных кожных заболеваний(таких как псориаз, атопический дерматит, аллергический контактный дерматит, раздражающий контактный дерматит и другие экзематозные дерматиты, себорейные дерматиты), воспалительных заболеваний глаз, например, таких как синдром Шегрена, кератоконъюктивит или увеит, воспалительного заболевания кишечника, болезни Крона или язвенного колита. В соответствии с упомянутым выше в настоящем изобретении предлагаются: 1) соединение по настоящему изобретению для применения в качестве фармацевтического средства,2) соединение по настоящему изобретению для применения в качестве ингибитора IGF-1R, например, для применения любым способом, как описано в данном контексте,3) фармацевтическая композиция, например, для применения любым способом, как описано в данном контексте, включающая соединение по настоящему изобретению в качестве активного ингредиента в комбинации с одним или более фармацевтически приемлемыми разбавителями или носителями,4) способ лечения любого заболевания или нарушения, как описано в данном контексте, у субъекта,нуждающегося в указанном лечении, который заключается во введении эффективного количества соединения по настоящему изобретению или фармацевтической композиции, включающей указанное соединение,5) применение соединения по настоящему изобретению для получения лекарственного средства,предназначенного для лечения или профилактики заболевания или состояния, в развитии которого активация IGF-1R играет основную роль или принимает участие,6) способ по п.4, который заключается в совместном введении, например, одновременно или последовательно, терапевтически эффективного количества соединения по настоящему изобретению и одного или более других лекарственных средств, при этом указанное другое лекарственное средство является пригодным для лечения любого заболевания, описанного в данном контексте,7) комбинация, включающая терапевтически эффекивное количество соединения по настоящему изобретению и одно или более других лекарственных средств, при этом указанное другое лекарственное средство является пригодным для лечения любого заболевания, описанного в данном контексте,8) применение соединения по настоящему изобретению для получения лекарственного средства,предназначенного для лечения или профилактики заболевания, чувствительного к ингибированию киназы анапластической лимфомы (ALK),9) применение по п.8, где заболевание, подлежащее лечению, выбирают из анапластической крупноклеточной лимфомы, лимфом не Ходжкина, воспалительных миофибробластных опухолей, нейробластом и неопластических заболеваний,10) применение по п.8 или 9, где соединением по настоящему изобретению является фармацевтически приемлемая соль соединения, описанного в любом из примеров,11) способ лечения заболевания, чувствительного к ингибированию киназы анапластической лимфомы, прежде всего заболевания, выбранного из анапластической крупноклеточной лимфомы, лимфом не-Ходжкина, воспалительных миофибробластных опухолей, нейробластом и новообразований, при этом указанный способ заключается во введении эффективного количества соединения по настоящему изобретению или его фармацевтически приемлемой соли. Способы введения и фармацевтические композиции. В большинстве случаев соединения по настоящему изобретению можно вводить в терапевтически эффективных количествах любым стандартным пригодным способом в отдельности или в комбинации с одним или более терапевтическими агентами. Величина терапевтически эффективного количества может значительно изменяться в зависимости от тяжести заболевания, возраста и относительного состояния здоровья субъекта, эффективности используемого соединения и других факторов, известных специалистам в данной области техники. Например, для лечения новообразований и нарушений иммунной системы необходимые дозы также изменяются в зависимости от способа введения, конкретного состояния,подлежащего лечению, и требуемого эффекта. В большинстве случаев удовлетворительные результаты достигаются при системном введении суточной дозы приблизительно от 0,01 до приблизительно 100 мг/кг массы тела, или предпочтительно приблизительно от 0,03 до 2,5 мг/кг массы тела. Указанная суточная доза для крупных млекопитающих, например, для человека, может составлять приблизительно от 0,5 мг до приблизительно 2000 мг, или более предпочтительно приблизительно от 0,5 мг до приблизительно 100 мг, которую вводят пригодным способом, например, в виде разделенных доз до 4 раз в сут или в форме пролонгированного действия. Пригодные стандартные лекарственные формы для перорального введения включают приблизительно от 1 до 50 мг активного ингредиента. Соединения по настоящему изобретению можно вводить в виде фармацевтических композиций любым стандартным способом, например энтеральным, например, пероральным, например, в форме таблеток или капсул, парентеральным, например, в форме растворов или суспензий для инъекций, или местным способом, например, в форме лосьонов, гелей, мазей или кремов, или в назальной форме или в форме суппозиториев.-9 017252 Фармацевтические композиции, включающие соединение по настоящему изобретению в форме свободного основания или в форме фармацевтически приемлемой соли, в комбинации по крайней мере с одним фармацевтически приемлемым носителем или разбавителем получают по стандартным методикам смешивания, грануляции, нанесения покрытий, растворения или лиофилизации. Например, фармацевтические композиции, включающие соединение по настоящему изобретению в комбинации по крайней мере с одним фармацевтически приемлемым носителем или разбавителем, можно получать стандартным способом смешивания с фармацевтически приемлемым носителем или разбавителем. Стандартные лекарственные формы для перорального введения содержат, например, приблизительно от 0,1 мг до приблизительно 500 мг активного вещества. В одном варианте осуществления настоящего изобретения фармацевтическими композициями являются растворы активного ингредиента, включающие суспензии или дисперсии, такие как изотонические водные растворы. В случае лиофилизированных композиций, включающих активный ингредиент в отдельности или в комбинации с носителем, таким как маннит, дисперсии или суспензии можно получать непосредственно перед использованием. Фармацевтические композиции можно стерилизовать и/или они могут содержать адъюванты, такие как консерванты, стабилизаторы, смачивающие или эмульгирующие агенты, агенты, ускоряющие растворение, соли для регулировки осмотического давления и/или буферные вещества. Пригодные консерванты включают, не ограничиваясь только ими, антиоксиданты,такие как аскорбиновая кислота или бактерицидные агенты, такие как сорбиновая кислота или бензойная кислота. Растворы или суспензии также могут включать загустители, включающие, не ограничиваясь только ими, натриевую соль карбоксиметилцеллюлозы, карбоксиметилцеллюлозу, декстран, поливинилпирролидон, желатины или солюбилизирующие агенты, например твин 80 (моноэфир полиоксиэтилен(20)сорбита и олеиновой кислоты). Суспензии в масле могут включать в качестве масляного компонента растительные, синтетические или полусинтетические масла, пригодные для инъекций. Примеры включают жидкие сложные эфиры жирных кислот, которые содержат в качестве кислотного компонента длинноцепную жирную кислоту,содержащую от 8 до 22 атомов углерода, или, в некоторых вариантах, от 12 до 22 атомов углерода. Пригодные жидкие сложные эфиры жирных кислот включают, не ограничиваясь только ими, сложные эфиры лауриновой кислоты, тридециловой кислоты, миристиновой кислоты, пентадециловой кислоты,пальмитиновой кислоты, маргаринововй кислоты, стеариновой кислоты, арахидиновой кислоты, бегеновой кислоты или соответствующих ненасыщенных кислот, например олеиновой кислоты, элаидиновой кислоты, эруковой кислоты, брассидиновой кислоты и линолевой кислоты, и, при необходимости, могут содержать антиоксиданты, например, витамин Е, 3-каротен или 3,5-ди-трет-бутилгидрокситолуол. Спиртовая кромпонента указанных эфиров жирных кислот может содержать 6 атомов углерода и может являться одновалентной или многовалентной, например, моно-, ди- или трехвалентным спиртом. Пригодные спиртовые компоненты включают, без ограничения перечисленным, метанол, этанол, пропанол, бутанол или пентанол, или их изомеры, гликоль и глицерин. Другие пригодные эфиры жирных кислот включают, не ограничиваясь только ими, этиловый эфир олеиновой кислоты, изопропиловый эфир миристиновой кислоты, изопропиловый эфир пальмитиновой кислоты, продукт LABRAFIL М 2375 (полиоксиэтилен глицерин), продукт LABRAFIL М 1944 CS(ненасыщенные полигликолизированные глицериды, полученные алкоголизом персикового масла и включающие глицериды и сложный эфир полиэтиленгликоля), продукт LABRASOL (насыщенные полигликолизированные глицериды, полученные алкоголизом ТСМ и включающие глицериды и сложный эфир полиэтиленгликоля, фирмы GaKefosse, Франция), и/или продукт MIGLYOL 812 (триглицерид насыщенных жирных кислот с длиной цепи от C8 до C12 фирмы Hls AG, Германия), и растительные масла, такие как хлопковое масло, миндальное масло, оливковое масло, касторовое масло, кунжутное масло,соевое масло или арахисовое масло. Фармацевтические композиции для перорального введения получают, например, при смешивании активного ингредиента с одним или более твердых носителей и при необходимости грануляции полученной смеси, переработки смеси или гранул при добавлении дополнительных эксципиентов, при этом получают таблетки или ядра таблеток. Пригодные носители включают, не ограничиваясь только ими, наполнители, такие как сахара, например, лактоза, сахароза, маннит или сорбит, составы на основе целлюлозы и/или фосфатов кальция,например, трикальций фосфата или гидрофосфата кальция, и также связующие агенты, такие как крахмалы, например, кукурузный, пшеничный, рисовый или картофельный крахмал, метилцеллюлоза, гидроксипропилметилцеллюлоза, натриевая соль карбоксиметилцеллюлозы и/или поливинилпирролидон,и/или при необходимости дезинтегрирующие агенты, такие как упомянутые выше крахмалы, карбоксиметилированный крахмал, сшитый поливинилпирролидон, альгиновая кислота или ее соли, такие как альгинат натрия. Другие эксципиенты включают кондиционеры текучести и замасливатели, например,кремниевую кислоту, тальк, стеариновую кислоту или ее соли, такие как стеарат магния или кальция,и/или полиэтиленгликоль или его производные. На ядра таблеток можно наносить пригодные, необязательно энтеральные покрытия с использова- 10017252 нием, кроме прочего, концентрированных растворов сахаров, которые могут содержать аравийскую камедь, тальк, поливинилпирролидон, полиэтиленгликоль и/или диоксид титана, или растворы покрытий в пригодных органических растворителях или смесях растворителей, или, для получения энтеральных покрытий, растворы пригодных составов на основе целлюлозы, такие как фталат ацетилцеллюлозы или фталат гидроксипропилметилцеллюлозы. В таблетки или покрытия для таблеток можно добавлять красители или пигменты, например, для идентификации таблеток или различных доз активного ингредиента. Фармацевтические композиции для перорального введения включают также твердые или мягкие желатиновые капсулы, включающие желатин и пластификатор, такой как глицерин или сорбит. Твердые капсулы могут содержать активный ингредиент в форме гранул, например, в смеси с наполнителями,такими как кукурузный крахмал, связующими агентами и/или смазвающими агентами, такими как тальк или старат магния, и необязательно стабилизаторами. В мягких капсулах активный игредиент растворен или суспендирован в пригодных жидких эксципиентах, таких как жирные масла, вазелин или жидкие полиэтиленгликоли или сложные эфиры жирных кислот и этилен- или пропиленгликоля, в которые можно добавлять стабилизаторы и ПАВ, например, сложный эфир полиоксиэтилена и сорбитовой кислоты. Фармацевтическими композициями, пригодными для введения ректальным способом, являются,например, суппозитории, включающие комбинацию активного ингредиента и основу суппозитория. Пригодными основами суппозиториев являются, например, природные или синтетические триглицериды, парафиновые углеводороды, полиэтиленгликоли или высшие спирты. Фармацевтические композиции, пригодные для парентерального введения, включают водные растворы активного ингредиента в водорастворимой форме, например, в форме водорастворимой соли, или водные суспензии для инъекций, содержащие загустители, например натриевую соль карбоксиметилцеллюлозы, сорбит и/или декстран, и при необходимости стабилизаторы. Активный ингредиент, необязательно в комбинации с эксципиентами, может также присутствовать в форме лиофилизата и его можно растворить непосредственно перед введением парентеральным способом при добавлении пригодных растворителей. Растворы, предназначенные, например, для введения парентеральным способом, можно использовать и в качестве растворов для вливаний. Получение составов для инъекций обычно проводят в стерильных условиях, например, заполнение ампул или флаконов с последующей их укупоркой. Соединения по настоящему изобретению можно вводить в качестве единственного активного ингредиента или в комбинации с другими лекарственными средствами, предназначенными для лечения новообразований или в качестве иммуномодуляторов. Например, соединения по настоящему изобретению можно использовать согласно настоящему изобретению в комбинации с фармацевтическими композициями, эффективными при лечении различных заболеваний, как описано выше, например, в комбинации с циклофосфамидом, 5-фторурацилом, флударабином, гемцитабином, цисплатином, карбоплатином,винкристином, винбластином, этопозидом, иринотеканом, паклитакселем, доцетакселем, ритуксаном,доксорубицином, гефитинибом или иматинибом, а также в комбинации с циклоспоринами, рапамицинами, аскомицинами или их иммунодепрессантными аналогами, например, циклоспорином А, циклоспорином G, FK-506, сиролимусом или эверолимусом, кортикостероидами, например преднизоном, циклофосфамидом, азатиопреном, метотрексатом, солями золота, сульфасалазином, противомалярийными агентами, брекинаром, лефлуномидом, мизорибином, микофеноловой кислотой, микофенолятом, мофетилом, 15-дезоксиспергуалином, иммунодепрессантными моноклональными антителами, например, моноклональными антителами к рецепторам лейкоцитов, например МНС, CD2, CD3, CD4, CD7, CD25,CD28, CD40, CD45, CD58, CD80, CD86, CD152, CD137, CD154, ICOS, LFA-1, VLA-4 или их лигандами,или другими иммуномодулирующими соединениями, например CTLA41g. В настоящем изобретении предлагаются также фармацевтические комбинации, например набор,включающий а) первый агент, который является соединением по настоящему изобретению, как описано в данном контексте, в свободной форме или в форме фармацевтически приемлемой соли, и б) по крайней мере один другой агент. Набор может содержать инструкции по их введению. Способы получения соединений по настоящему изобретению. Основные способы получения соединений по настоящему изобретению описаны в разделе Примеры, приведенном ниже. В описанных реакциях реакционноспособные функциональные группы, например, гидроксигруппы, аминогруппы, иминогруппы, тиогруппы или карбоксигруппы, если они присутствуют в конечном продукте, можно защищать для предотвращения их нежелательного участия в реакциях. Стандартные защитные группы можно использовать согласно стандартным методикам (см., например, книгу T.W. Greene и P. G. M. Wuts, "Protective Groups in Organic Chemistry", John Wiley and Sons,1991). Соединения по настоящему изобретению, включая их соли, можно также получать в форме гидратов, или их кристаллогидраты могут содержать, например, растворитель, использованный для кристаллизации (который присутствует в форме сольватов). Соли можно превращать в соединения в форме свободного основания, например, при обработке основными агентами, например карбонатами щелочных металлов, гидрокарбонатами щелочных металлов или гидроксидами щелочных металлов, такими как карбонат калия или гидроксид натрия. Соединение в форме основно-аддитивной соли можно превратить- 11017252 в соответствующую свободную кислоту при обработке пригодной кислотой (например, хлористоводородной кислотой и т.п.). Поскольку новые соединения в свободной форме и в форме их солей, включая соли, которые можно использовать в качестве промежуточных соединений, например для очистки или идентификации новых соединений, являются чрезвычайно близкими в структурном отношении, любое упоминание соединений в свободной форме подразумевает и упоминание соответствующих солей. Соли соединений по настоящему изобретению, содержащих солеобразующую группу, получают по стандартным методикам. Таким образом, кислотно-аддитивные соли соединений формул (1), (2 А), (2 В),(3A), (3B), (4) и (4 А) можно получить при обработке кислотой или пригодным анионообменным реагентом. Фармацевтически приемлемые соли соединений по настоящему изобретению можно получить, например, в виде кислотно-аддитивных солей органических или неорганических кислот из соединений формул (1), (2 А), (2 В), (3A), (3B), (4) и (4 А), содержащих основный атом азота. Пригодные неорганические кислоты включают, не ограничиваясь только ими, галогенсодержащие кислоты, такие как хлористоводородная кислота, серная кислота или фосфорная кислота. Пригодные органические кислоты включают, не ограничиваясь только ими, карбоновые, фосфоновые, сульфоновые или сульфамовые кислоты, например, уксусную кислоту, пропионовую кислоту, октановую кислоту,декановую кислоту, додекановую кислоту, гликолевую кислоту, молочную кислоту, фумаровую кислоту,янтарную кислоту, адипиновую кислоту, пимелиновую кислоту, субериновую кислоту, азелаиновую кислоту, яблочную кислоту, винную кислоту, лимонную кислоту, аминокислоты, такие как глутаминовая кислота и аспарагиновая кислота, малеиновую кислоту, гидроксималеиновую кислоту, метилмалеиновую кислоту, циклогексанкарбоновую кислоту, адамантанкарбоновую кислоту, бензойную кислоту, салициловую кислоту, 4-аминосалициловую кислоту, фталевую кислоту, фенилуксусную кислоту, миндальную кислоту, коричную кислоту, метан- или этансульфоновую кислоту, 2-гидроксиэтансульфоновую кислоту,этан-1,2-дисульфоновую кислоту, бензолсульфоновую кислоту, 2-нафталинсульфоновую кислоту, 1,5 нафталиндисульфоновую кислоту, 2-, 3- или 4-метилбензолсульфоновую кислоту, метилсерную кислоту,этилсерную кислоту, додецилсерную кислоту, N-циклогексилсульфамовую кислоту, N-метил-, N-этил или N-пропилсульфамовую кислоту или другие органические протонные кислоты, такие как аскорбиновая кислота. Для выделения или очистки можно также использовать фармацевтически неприемлемые соли, например, пикраты и перхлораты. Для терапевтических целей можно использовать только фармацевтически приемлемые соли или соединения в свободной форме (если возможно, в форме фармацевтических препаратов). Соединения по настоящему изобретению в неокисленной форме можно получать из N-оксидов соединений по настоящему изобретению при обработке восстановителем (например, серой, диоксидом серы, трифенилфосфином, боргидридом лития, боргидридом натрия, трихлоридом фосфора, трибромидом фосфора и т.п.) в пригодном инертном органическом растворителе (например, ацетонитриле, этаноле,водном диоксане и т.п.) при температуре от 0 до 80C. Производные пролекарств соединений по настоящему изобретению получают по стандартным методикам (подробное описание приведено, например, в статье Saulnier и др., Bioorganic and MedicinalChemistry Letters, т. 4, с. 1985 (1994. Например, соответствующие пролекарства можно получать при взаимодействии немодифицированных соединений по настоящему изобретению с пригодным карбамилирующим агентом (например, 1,1-ацилоксиалкилкарбанохлоридатом, пара-нитрофенилкарбонатом или т.п.). Защищенные производные соединений по настоящему изобретению получают по стандартным методикам. Подробное описание методик ведения защитных групп и их удаления приведено в книге Т. W.Greene, "Protecting Groups in Organic Chemistry", 3-е изд., John Wiley and Sons, Inc., 1999. Соединения по настоящему изобретению можно получать в форме их индивидуальных стереоизомеров при взаимодействии рацемической смеси соединений с оптически активным разделяющим агентом, при этом получают пару диастереоизомеров соединений, при разделении диастереомеров и получении оптически чистых энантиомеров. Разделение энантиомеров можно проводить с использованием ковалентных диастереомерных производных соединений по настоящему изобретению или с использованием диссоциирующих комплексов (например, кристаллических диастереомерных солей). Диастереомеры характеризуются различными физическими свойствами (например, температурами плавления, температурами кипения, растворимостями, реакционными способностями и т.п.) и их можно разделить простым методом с использованием указанных различий. Диастереомеры можно разделять фракционной кристаллизацией, хроматографией или при разделении, основанном на различии в растворимости. Таким образом, получают оптически чистые энантиомеры в комбинации с агентом для их разделения любым способом, не приводящим к их рацемизации. Более подробное описание методик, пригодных для разделения стереоизомеров соединений из их рацемической смеси описано в книге Jean Jacques, Andre Collet, SamuelH. Wilen, "Enantiomers, Racemates and Resolutions", John Wiley And Sons, Inc., 1981. Таким образом, соединения по настоящему изобретению получают по методикам, описанным в разделе примеры, и указанные методики включают(а) необязательно превращение соединения по настоящему изобретению в фармацевтически приемлемую соль,- 12017252(б) необязательно превращение солевой формы соединения по настоящему изобретению в несолевую форму,(в) необязательно превращение неокисленной формы соединения по настоящему изобретению в фармацевтически приемлемый N-оксид,(г) необязательно превращение N-оксида соединения по настоящему изобретению в его неокисленную форму,(д) необязательно выделение индивидуального изомера соединения по настоящему изобретению из смеси изомеров,(е) необязательно превращение немодифицированного соединения по настоящему изобретению в фармацевтически приемлемое производное пролекарства и(ж) необязательно превращение производного пролекарства по настоящему изобретению в его немодифицированную форму. Получение исходных материалов не описано подробно, так как такие соединения известны и их можно получить по стандартным методикам или по методикам, описанным в разделе Примеры. Специалистам в данной области техники представляется очевидным, что описанные выше превращения представлены только в качестве примеров способов получения соединений по настоящему изобретению и что можно использовать другие стандартные способы. Ниже приведены примеры для иллюстрации настоящего изобретения, но не ограничивающие его объем. Промежуточное соединение 1. 2,5-Дихлор-N-(5-метил-1H-пиразол-3-ил)пиримидин-4-амин. Смесь 5-метил-1H-пиразол-3-амина (3,00 г, 30,9 моль), 2,4,5-трихлорпиримидина (5,67 г, 30,9 моль,1 экв.) и Na2CO3 (3,60 г, 34,0 моль, 1,1 экв.) в EtOH (100 мл) нагревали при 40C в течение 24 ч. Растворитель удаляли в вакууме, полученный остаток распределяли между EtOAc (350 мл) и водой (100 мл). Слой EtOAc промывали водой (3 раза), насыщенным водным раствором NaCl (1 раз) и сушили надNa2SO4. Полученный раствор EtOA сконцентрировали в вакууме, при этом получали 2,5-дихлор-N-(5 метил-1H-пиразол-3-ил)пиримидин-4-амин. МС (ES): m/z 244,0 (М+Н+). Промежуточное соединение 2. 2-Хлор-5-метил-N-(5-метил-1H-пиразол-3-ил)пиримидин-4-амин. Смесь 5-метил-1H-пиразол-3-амина (3,00 г, 30,9 моль), 2,4-дихлор-5-метилпиримидина (5,03 г, 30,9 моль, 1 экв.) и Na2CO3 (3,60 г, 34,0 моль, 1,1 экв.) в EtOH (100 мл) нагревали при 40C в течение 24 ч. Растворитель удаляли в вакууме, полученный остаток распределяли между EtOAc (350 мл) и водой (100 мл). Слой EtOAc промывали водой (3 раза), насыщенным водным раствором NaCl (1 раз), сушили надNa2SO4 и концентрировали в вакууме. Полученный неочищенный продукт обрабатывали ультразвуком вEt2O (200 мл), полученный порошкообразный осадок отделяли фильтрованием и промывали Et2O, при этом получали 2-хлор-5-метил-N-(5-метил-1H-пиразол-3-ил)пиримидин-4-амин. МС (ES): m/z 224,1 Смесь 2-аминобензамида (681 мг, 5,0 моль), 2,4,5-трихлорпиримидина (2,75 г, 15 ммоль, 3 экв.) и конц. HCl (водный раствор, 1,72 мл, 20 ммоль, 4 экв.) в 2-пропаноле (100 мл) нагревали при 60C в течение 12 ч. Растворитель 2-пропанол удаляли в вакууме, полученный остаток нейтрализовали до приблизительно рН 7 при добавлении 1 н. водного раствора NaOH, а затем распределяли между EtOAc и водой. При распределении между EtOAc и водой получали значительное количество осадка. Полученный осадок отделяли фильтрованием в вакууме и промывали небольшими количествами EtOAc и воды, при этом получали 2-(2,5-дихлорпиримидин-4-иламино)бензамид. МС (ES): m/z 283,0 (М+Н+). Промежуточное соединение 4. 3-(2,5-Дихлорпиримидин-4-иламино)пиридин-2(1H)-он. Смесь 3-аминопиридин-2(1H)-она (99 мг, 0,90 моль), 2,4,5-трихлорпиримидина (165 мг, 0,90 моль, 1 экв.) и NaHCO3 (76 мг, 0,90 моль, 1 экв.) в смеси МеОН (6 мл) и H2O (3 мл) перемешивали при KT в течение 24 ч. Полученный осадок отделяли фильтрованием в вакууме и промывали небольшими количест- 13017252 вами МеОН и воды, при этом получали 3-(2,5-дихлорпиримидин-4-иламино)пиридин-2(1H)-он. МС (ES): Смесь -цис-2-аминоциклогексанкарбоксамида (28 мг, 0,20 моль), 2,4,5-трихлорпиримидина (37 мг, 0,20 моль, 1 экв.) и NaHCO3 (17 мг, 0,20 моль, 1 экв.) в смеси МеОН (1,0 мл) и H2O (0,5 мл) перемешивали при КТ в течение 12 ч. Реакционную смесь разбавляли EtOAc и промывали водой (2 раза), сушили над Na2SO4 и концентрировали в вакууме, при этом получали -цис-2-(2,5-дихлорпиримидин-4 иламино)циклогексанкарбоксамид. МС (ES): m/z 289,1 (М+Н+). Промежуточное соединение 6. 2,5-Дихлор-N-(5-фенил-1H-пиразол-3-ил)пиримидин-4-амин. Смесь 3-амино-5-фенилпиразола (103 мг, 0,65 моль), 2,4,5-трихлорпиримидина (74,5 мкл, 0,65 моль) и карбоната натрия (68,9 мг, 0,65 моль) в EtOH (3 мл) нагревали при 40C в течение ночи. Полученный осадок отделяли фильтрованием и промывали холодным EtOH, сушили в вакууме, при этом получали 2,5-дихлор-N-(5-фенил-1H-пиразол-3-ил)пиримидин-4-амин. МС (ES): m/z 306,0 (М+Н+). Промежуточное соединение 7. Метиловый эфир 4-(2,5-дихлорпиримидин-4-иламино)-1-метил-1Hпиррол-2-карбоновой кислоты. Смесь гидрохлорида метилового эфира 4-амино-1-метилпиррол-2-карбоновой кислоты (95 мг, 0,5 моль), 2,4,5-трихлорпиримидина (57 мкл, 0,5 моль) и карбоната натрия (106 мг, 1,0 моль) в EtOH (3 мл) нагревали при 40C в течение ночи. Полученный осадок отделяли фильтрованием и промывали холодным EtOH, сушили в вакууме, при этом получали метиловый эфир 4-(2,5-дихлорпиримидин-4-иламино)1-метил-1H-пиррол-2-карбоновой кислоты. МС (ES): m/z 301,0 (М+Н+). Промежуточное соединение 8. 2-(2,5-Дихлорпиримидин-4-иламино)-4-метилтиофен-3-карбоксамид. Смесь 2-амино-4-метилтиофен-3-карбоксамида (78 мг, 0,5 моль), 2,4,5-трихлорпиримидина (57 мкл,0,5 моль) и карбоната натрия (53 мг, 0,5 моль) в EtOH (3 мл) нагревали при 40C в течение ночи. Полученный осадок отделяли фильтрованием и промывали холодным EtOH, сушили в вакууме, при этом получали 2-(2,5-дихлорпиримидин-4-иламино)-4-метилтиофен-3-карбоксамид. МС (ES): m/z 303,0 (М+Н+). Промежуточное соединение 9. N-(2,5-Дихлорпиримидин-4-ил)пиримидин-2-амин. Смесь пиримидин-2-амина (48 мг, 0,5 моль), 2,4,5-трихлорпиримидина (57 мкл, 0,5 моль) и карбоната калия (69 мг, 0,5 моль) в 1,4-диоксане (3 мл) нагревали при 110C в течение ночи. Полученный осадок отделяли фильтрованием и промывали холодным EtOH, сушили в вакууме, при этом получали N(2,5-дихлорпиримидин-4-ил)пиримидин-2-амин. МС (ES): m/z 242,0 (М+Н+). Промежуточное соединение 10. 2,5-Дихлор-N-(1-метил-1H-пиразол-3-ил)пиримидин-4-амин. Смесь 1-метил-1H-пиразол-3-амина (48 мг, 0,5 моль), 2,4,5-трихлорпиримидина (57 мкл, 0,5 моль) и карбоната натрия (53 мг, 0,5 моль) в EtOH (3 мл) нагревали при 40C в течение ночи. Полученный осадок отделяли фильтрованием и промывали холодным EtOH, сушили в вакууме, при этом получали 2,5 дихлор-N-(1-метил-1H-пиразол-3-ил)пиримидин-4-амин. МС (ES): m/z 244,0 (М+Н+). Промежуточное соединение 11. Этиловый эфир 3-(2,5-дихлорпиримидин-4-иламино)-1H-пиразол-4 карбоновой кислоты. Смесь этилового эфира 3-амино-1H-пиразол-4-карбоновой кислоты (80 мг, 0,5 моль), 2,4,5 трихлорпиримидина (57 мкл, 0,5 моль) и карбоната натрия (53 мг, 0,5 моль) в EtOH (3 мл) нагревали при 40C в течение ночи. Полученный осадок отделяли фильтрованием и промывали холодным EtOH, сушили в вакууме, при этом получали этиловый эфир 3-(2,5-дихлорпиримидин-4-иламино)-1H-пиразол-4 карбоновой кислоты. МС (ES): m/z 302,0 (М+Н+). Промежуточное соединение 12. N-(2,5-Дихлорпиримидин-4-ил)изоксазол-3-амин. Смесь изоксазол-3-амина (36 мкл, 0,5 моль), 2,4,5-трихлорпиримидина (57 мкл, 0,5 моль) и карбоната натрия (53 мг, 0,5 моль) в EtOH (3 мл) нагревали при 60C в течение 48 ч. Полученный осадок отделяли фильтрованием и промывали холодным EtOH, сушили в вакууме, при этом получали N-(2,5 дихлорпиримидин-4-ил)изоксазол-3-амин. МС (ES): m/z 231,0 (М+Н+). Промежуточное соединение 13. 2,5-Дихлор-N-(4,6-диметилпиридин-2-ил)пиримидин-4-амин. Смесь 4,6-диметилпиридин-2-амина (61 мг, 0,50 моль), 2,4,5-трихлорпиримидина (57 мкл, 0,5 моль) и иодида калия (166 мг, 1,0 моль) в DMA (3 мл) нагревали при 90C в течение ночи. Смесь концентрировали в вакууме и полученный неочищенный продукт распределяли между EtOAc и солевым раствором. Объединенные органические экстракты сушили (Na2SO4) и концентрировали в вакууме, при этом получали 2,5-дихлор-N-(4,6-диметилпиридин-2-ил)пиримидин-4-амин. МС (ES): m/z 269,0 (М+Н+). Промежуточное соединение 14. N-(2,5-Дихлорпиримидин-4-ил)-5-метилизоксазол-3-амин. Смесь 5-метилизоксазол-3-амина (98 мг, 1,0 моль), 2,4,5-трихлорпиримидина (344 мкл, 3,0 моль) и карбоната натрия (106 мг, 1,0 моль) в EtOH (3 мл) нагревали при 60C в течение ночи. Смесь концентрировали и полученный неочищенный продукт распределяли между EtOAc и солевым раствором. Объединенные органические экстракты сушили (Na2SO4) и концентрировали в вакууме, затем очищали хроматографией на силикагеле (элюент: МеОН/ДХМ, 1:9), при этом получали N-(2,5-дихлорпиримидин-4-ил)-5 метилизоксазол-3-амин. МС (ES): m/z 245,0 (М+Н+). Промежуточное соединение 15. 2,5-Дихлор-N-(5-циклопропил-1H-пиразол-3-ил)пиримидин-4 амин. Смесь 5-циклопропил-1H-пиразол-3-амина (246 мг, 2,00 моль), 2,4,5-трихлорпиримидина (367 мг,2,00 моль, 1 экв.) и Na2CO3 (233 мг, 2,20 моль, 1,1 экв.) в EtOH (10 мл) нагревали при 40C в течение 16 ч. Неочищенную реакционную смесь разбавляли EtOAc и последовательно промывали водой (3 раза) и насыщенным водным раствором NaCl (1 раз). Полученный слой EtOAc сушили над Na2SO4 и затем концентрировали в вакууме, при этом получали 2,5-дихлор-N-(5-циклопропил-1H-пиразол-3-ил)пиримидин-4 амин. МС (ES): m/z 270,0 (М+Н+). Промежуточное соединение 16. 3-(2,5-Дихлорпиримидин-4-иламино)азепан-2-он.- 15017252 экв.) и NaHCO3 (168 мг, 2 моль, 1 экв.) в смеси МеОН (12 мл) и H2O (6 мл) перемешивали при КТ в течение 15 ч. Полученный осадок отделяли фильтрованием в вакууме и промывали небольшими количествами МеОН и воды, при этом получали 3-(2,5-дихлорпиримидин-4-иламино)азепан-2-он. МС (ES): m/z 275,0 (М+Н+). Промежуточное соединение 17. 4'-Амино-5'-фтор-N,2'-диметилбифенил-4-карбоксамид.(91 мг, 0,1 моль) и K3PO4 (424 мг, 2,0 моль) в н-бутаноле (5,0 мл) дегазировали и нагревали при 130C в течение 1 ч. Реакционную смесь концентрировали в вакууме. Неочищенную смесь распределяли междуEtOAc и солевым раствором, органические экстракты собирали и сушили (Na2SO4), концентрировали и очищали хроматографией на силикагеле (элюент: EtOAc/гексан, 1:4), при этом получали 4'-амино-5'фтор-N,2'-диметилбифенил-4-карбоксамид. МС (ES): m/z 259,1 (М+Н+). Промежуточное соединение 18. 4'-Амино-2'-изопропил-N,5'-диметилбифенил-4-карбоксамид.(50 мл) при перемешивании добавляли N-фенил-бис-трифторметансульфонамид (2,62 г, 7,3 моль). Полученную смесь перемешивали в течение 12 ч и концентрировали. Остаток очищали хроматографией на силикагеле (элюент: 5% этилацетат в гексане), при этом получали 2-изопропил-5-метилфенил трифторметансульфонат в виде бесцветного масла. Стадия 2. 2-Изопропил-5-метил-4-нитрофенилтрифторметансульфонат. В раствор 2-изопропил-5-метилфенилтрифторметансульфоната (стадия 1, 1,3 г, 4,6 моль) в уксусной кислоте (10 мл) при 0C медленно добавляли раствор предварительно смешанных конц. серной кислоты и конц. азотной кислоты (2 мл/0,5 мл). Полученную смесь перемешивали при КТ в течение 2 ч, затем выливали в ледяную воду. Смесь экстрагировали этилацетатом (320 мл). Объединенные органические фазы промывали водным раствором карбоната натрия и солевым раствором, сушили над сульфатом натрия. После концентрирования неочищенный 2-изопропил-5-метил-4-нитрофенилтрифторметансульфонат использовали на следующей стадии без дополнительной очистки. Стадия 3. 2'-Изопропил-N,5'-диметил-4'-нитробифенил-4-карбоксамид. Смесь неочищенного 2-изопропил-5-метил-4-нитрофенилтрифторметансульфоната (стадия 2, 200 мг, 0,61 моль), 4-(метилкарбамоил)фенилбороновой кислоты (142 мг, 0,79 моль) и фторида цезия (185 мг,1,22 моль) в диоксане (15 мл) загружали в пробирку для микроволнового реактора и добавляли бис(тритрет-бутилфосфин)палладия (15 мг, 10 мол.%). Пробирку закрывали, смесь продували N2 в течение 3 мин, затем нагревали при 120C в течение 10 мин в микроволновом реакторе. Полученную смесь охлаждали, фильтровали и концентрировали. Остаток очищали хроматографией на силикагеле (элюент: 60% этилацетат в гексане), при этом получали 2'-изопропил-N,5'-диметил-4'-нитробифенил-4-карбоксамид в виде твердого вещества белого цвета. МС (ES): m/z 313,2 (М+Н+). Стадия 4. 4'-Амино-2'-изопропил-N,5'-диметилбифенил-4-карбоксамид. 2'-Изопропил-N,5'-диметил-4'-нитробифенил-4-карбоксамид растворяли в метаноле (20 мл). В полученный раствор добавляли Pd/C (10%). Реакционную смесь дегазировали и несколько раз продували H2,затем перемешивали в атмосфере H2 (1 атм) в течение ночи. Смесь фильтровали и концентрировали, при этом получали указанный в заголовке 4'-амино-2'-изопропил-N,5'-диметилбифенил-4-карбоксамид в виде твердого вещества белого цвета. МС (ES): m/z 283,2 (М+Н+). 1 Н ЯМР (400 МГц, MeOD-d4):7,87 (d, 2 Н, J 8,4 Гц), 7,35 (d, 2H, J 8,4 Гц), 7,31 (s, 1H), 7,14 (s, 1H),3,00 (m, 1H), 2,95 (d, 3H), 2,36 (s, 3H), 1,15 (d, 6 Н, J 6,8 Гц). Промежуточное соединение 19. 4'-Амино-5'-этил-N,2'-диметилбифенил-4-карбоксамид.- 16017252 Стадия 1. 1-Бром-5-хлор-2-метил-4-нитробензол. 1-Бром-5-хлор-2-метил-4-нитробензол в виде твердого вещества желтого цвета получали по описанной ранее методике (промежуточное соединение 18, стадия 2), но при использовании 2-бром-4-хлор 1-метилбензола. Полученный материал использовали на следующей стадии без дополнительной очистки. Стадия 2. 5'-Хлор-N,2'-диметил-4'-нитробифенил-4-карбоксамид. В смесь неочищенного продукта, полученного на стадии 1 (400 мг, 1,6 моль), 4(метилкарбамоил)фенилбороновой кислоты (286 мг, 1,6 моль) и карбоната натрия (340 мг, 3,2 моль) в диметоксиэтане/воде (12:4 мл) добавляли тетракис(трифенилфосфин)палладия (93 мг, 5 мол.%). Смесь продували N2 в течение 3 мин, затем закрывали и нагревали при 90C в течение 3 ч. Полученную смесь охлаждали, фильтровали и концентрировали. Остаток очищали хроматографией на силикагеле (элюент: 30% этилацетат в ДХМ), при этом получали 5'-хлор-N,2'-диметил-4'-нитробифенил-4-карбоксамид в виде твердого вещества желтого цвета. МС (ES): m/z 305,1 (М+Н+). Стадии 3 и 4. 4'-Амино-5'-этил-N,2'-диметилбифенил-4-карбоксамид. В смесь 5'-хлор-N,2'-диметил-4'-нитробифенил-4-карбоксамида (стадия 2, 100 мг, 0,33 моль), дибутилового эфира винилбороновой кислоты (90 мг, 0,5 моль) и карбоната натрия (245 мг, 2,31 моль) в ТГФ/H2O (8:2 мл) добавляли дихлор-бис-(трифенилфосфин)палладия (II) (12 мг, 5 мол.%). Реакционную пробирку закрывали, смесь продували N2 в течение 3 мин, затем нагревали при 90C в атмосфере N2 в течение ночи. Реакционную смесь охлаждали до КТ и выливали в насыщенный водный раствор хлорида аммония. Неочищенную реакционную смесь экстрагировали этилацетатом (315 мл). Органические экстракты объединяли, промывали солевым раствором и концентрировали. Неочищенный продукт очищали колоночной хроматографией на силикагеле (элюент: 30% этилацетат в ДХМ), при этом получали N,2'диметил-4'-нитро-5'-винилбифенил-4-карбоксамид в виде твердого вещества желтого цвета. Полученное твердое вещество растворяли в метаноле (20 мл), в раствор добавляли Pd/C (10%). Реакционную смесь дегазировали, несколько раз продували H2 и перемешивали в атмосфере водорода в течение ночи. Смесь фильтровали и концентрировали, при этом получали 4'-амино-5'-этил-N,2'-диметилбифенил-4 карбоксамид в виде твердого вещества желтого цвета. МС (ES): m/z 269,2 (М+Н+). Промежуточное соединение 20. 4-(4-Амино-5,6,7,8-тетрагидронафталин-1-ил)-N-метилбензами. 4-Бром-5,6,7,8-тетрагидронафталин-1-амин. В раствор 5,6,7,8-тетрагидронафталин-1-амина (1 г, 6,8 моль), триэтиламина (1,9 мл, 13,6 моль) в ДХМ (50 мл) по каплям добавляли ацетилхлорид (587 мг, 7,5 моль). Полученную смесь перемешивали при КТ в течение 2 ч. Затем смесь концентрировали, распределяли между этилацетатом и насыщенным водным раствором хлорида аммония. Органический слой отделяли, промывали солевым раствором и сушили над сульфатом натрия. Полученный после концентрирования N-(5,6,7,8-тетрагидронафталин-1 ил)ацетамид (200 мг) растворяли в уксусной кислоте (30 мл). В полученный раствор по каплям добавляли бром (170 мг, 1,06 моль). Смесь нагревали при 50C в течение ночи. Реакцию останавливали добавлением водного раствора сульфита натрия. Смесь экстрагировали этилацетатом (320 мл). Органические экстракты объединяли и промывали водным раствором бикарбоната натрия, солевым раствором и сушили над сульфатом натрия. После концентрирования получали неочищенный N-(4-бром-5,6,7,8 тетрагидронафталин-1-ил)ацетамид в виде твердого вещества коричневого цвета. Полученное твердое вещество растворяли в метаноле (5 мл) и конц. HCl (15 мл). Смесь кипятили с обратным холодильником при 95C в течение ночи. После охлаждения до КТ смесь выливали в ледяную воду и подщелачивали до рН 12 конц. водным раствором NaOH. Смесь экстрагировали этилацетатом (320 мл). Объединенные органические слои сушили над Na2SO4 и концентрировали. Неочищенный продукт очищали хроматографией на силикагеле (элюент: 15% этилацетат в гексане), при этом получали 4-бром-5,6,7,8 тетрагидронафталин-1-амин в виде твердого вещества бежевого цвета. МС (ES): m/z 226 (М+Н+). 4-(4-Амино-5,6,7,8-тетрагидронафталин-1-ил)-N-метилбензамид в виде твердого вещества белого цвета получали по описанной ранее методике (промежуточное соединение 17), но при использовании соединения, полученного на стадии 3. МС (ES): m/z 281,2 (М+Н+). Промежуточное соединение 21. Метиловый эфир 4-амино-5-метокси-4'-(метилкарбамоил)бифенил 2-карбоновой кислоты. Стадия 1. Метиловый эфир 5-метокси-4'-(метилкарбамоил)-4-нитробифенил-2-карбоновой кислоты. Смесь метилового эфира 2-хлор-4-метокси-5-нитробензойной кислоты (292 мг, 1,19 моль), 4- 17017252(II) (41 мг, 0,06 моль) и карбоната натрия (378 мг, 3,57 моль) в ТГФ (8 мл) и воде (2 мл) в атмосфере азота нагревали при 40C в течение ночи. Реакционную смесь охлаждали до КТ и затем распределяли междуEtOAc и солевым раствором. Органические экстракты сушили (Na2SO4), концентрировали в вакууме и очищали хроматографией на силикагеле (элюент: ЕЮАс/гексан, 1:3), при этом получали метиловый эфир 5-метокси-4'-(метилкарбамоил)-4-нитробифенил-2-карбоновой кислоты. МС (ES): m/z 345,1(М+Н+). Стадия 2. Метиловый эфир 4-амино-5-метокси-4'-(метилкарбамоил)бифенил-2-карбоновой кислоты. Смесь метилового эфира 5-метокси-4'-(метилкарбамоил)-4-нитробифенил-2-карбоновой кислоты(стадия 1, 275 мг, 0,75 моль), Pd (10 мас.% на активированном угле, 27 мг) и МеОН (20 мл) вакуумировали для удаления воздуха, затем реакционную смесь перемешивали в атмосфере водорода (баллон) до полного потребления исходного материала. Pd/C отделяли фильтрованием, фильтрат концентрировали в вакууме и при этом получали метиловый эфир 4-амино-5-метокси-4'-(метилкарбамоил)бифенил-2 карбоновой кислоты. МС (ES): m/z 315,1 (М+Н+). Промежуточное соединение 22. 4'-Амино-5'-метокси-N,2'-диметилбифенил-4-карбоксамид(1,1 г, 1,2 моль) и K3PO4 (7,4 г, 34,9 моль) в н-бутаноле (80 мл) дегазировали и нагревали при 130C в течение ночи. Реакционную смесь фильтровали через слой целлита и концентрировали в вакууме. Неочищенную смесь распределяли между EtOAc и солевым раствором. Органические экстракты сушили(Na2SO4), концентрировали и очищали хроматографией на силикагеле (элюент: EtOAc/гексан, 1:4), при этом получали 4'-амино-5'-метокси-N,2'-диметилбифенил-4-карбоксамид. МС (ES): m/z 271,1 (М+Н+). Пример 1. 4'-(5-Хлор-4-(5-метил-1H-пиразол-3-иламино)пиримидин-2-иламино)-5'-фтор-N,2'диметилбифенил-4-карбоксамид (1). Смесь 2,5-дихлор-N-(5-метил-1H-пиразол-3-ил)пиримидин-4-амина (промежуточное соединение 1,142 мг, 0,5 моль) и 4'-амино-5'-фтор-N,2'-диметилбифенил-4-карбоксамида (промежуточное соединение 17, 150 мг, 0,58 моль) в 2-пропаноле обрабатывали конц. HCl (водный раствор, 6 капель). Смесь закрывали и нагревали в микроволновом реакторе при 140C в течение 20 мин, затем концентрировали и остаток очищали препаративной обращенно-фазовой ЖХВР, при этом получали указанный в заголовке 4'-(5 хлор-4-(5-метил-1H-пиразол-3-иламино)пиримидин-2-иламино)-5'-фтор-N,2'-диметилбифенил-4 карбоксамид в виде твердого вещества белого цвета. МС (ES): m/z 466,1 (М+Н+). 1 Н ЯМР (400 МГц, ДМСО-d6):9,31 (ушир., 1H), 9,23 (ушир., 2 Н), 8,50 (m, 1H), 8,16 (s, 1H), 7,90 (d,2 Н), 7,77 (m, 1 Н), 7,46 (d, 2 Н), 7,14 (d, 1H), 6,19 (s, 1 Н), 2,82 (d, 3H), 2,19 (s, 3H), 2,15 (s, 3H). Пример 2. 5'-Метокси-N,2'-диметил-4'-(4-(5-метил-1H-пиразол-3-иламино)-5-(трифторметил)пиримидин-2-иламино)бифенил-4-карбоксамид (2).(0,5 мл) добавляли хлорид цинка (1,0 М в эфире, 0,46 мл, 0,46 моль) и полученную смесь перемешивали в течение 30 мин. Затем последовательно добавляли 4'-амино-5'-метокси-N,2'-диметилбифенил-4-карбоксамид (111 мг, 0,414 моль) и триэтиламин (46 мг, 0,46 моль), реакционную смесь перемешивали при КТ в течение ночи. Осадок отделяли фильтрованием, промывали МеОН и сушили в вакууме, при этом получали 4'-(4-хлор-5-(трифторметил)пиримидин-2-иламино)-5'-метокси-N,2'-диметилбифенил-4 карбоксамид в виде твердого вещества белого цвета. МС (ES): m/z 451,1 (М+Н+). Стадия 2. 5'-Метокси-N,2'-диметил-4'-(4-(5-метил-1H-пиразол-3-иламино)-5-(трифторметил)пиримидин-2-иламино)бифенил-4-карбоксамид.- 18017252 Смесь 4'-(4-хлор-5-(трифторметил)пиримидин-2-иламино)-5'-метокси-N,2'-диметилбифенил-4-карбоксамида (стадия 1, 20 мг, 0,044 моль), 5-метил-1H-пиразол-3-амина (4,3 мг, 0,044 моль), реагента Xantophos (5,0 мг, 0,009 моль), ацетата палладия (II) (1,0 мг, 0,004 моль) и карбоната цезия (28,6 мг, 0,088 моль) в ТГФ (2,0 мл) нагревали в микроволновом реакторе при 150C в течение 25 мин. Реакционную смесь фильтровали, фильтрат концентрировали в вакууме и очищали препаративной обращенно-фазовой ЖХВР,при этом получали 5'-метокси-N,2'-диметил-4'-(4-(5-метил-1H-пиразол-3-иламино)-5(трифторметил)пиримидин-2-иламино)бифенил-4-карбоксамид. МС (ES): m/z 512,2 (М+Н+). Пример 3. -4'-(5-Хлор-4-(2-оксоазепан-3-иламино)пиримидин-2-иламино)-5'-фтор-N,2'-диметилбифенил-4-карбоксамид (42-44). Смесь 3-(2,5-дихлорпиримидин-4-иламино)азепан-2-она (промежуточное соединение 16, 28 мг, 0,10 моль), 4'-амино-5'-фтор-N,2'-диметилбифенил-4-карбоксамида (промежуточное соединение 17, 31 мг, 0,12 моль, 1,2 экв.) и ТФУ (37 мкл, 57 мг, 0,50 моль, 5 экв.) в 2-пропаноле (3 мл) перемешивали в закрытой пробирке при 100C в течение 48 ч. Полученный раствор концентрировали и затем очищали препаративной обращенно-фазовой ЖХВР, при этом получали -4'-(5-хлор-4-(2-оксоазепан-3-иламино)пиримидин-2 иламино)-5'-фтор-N,2'-диметилбифенил-4-карбоксамид. МС (ES): m/z 497,2 (М+Н+). Индивидуальные энантиомеры -4'-(5-хлор-4-(2-оксоазепан-3-иламино)пиримидин-2-иламино)-5'фтор-N,2'-диметилбифенил-4-карбоксамида разделяли друг от друга методом хиральной ЖХВР, которую проводили в следующих условиях: колонка ChiralPak AD 20x250 мм, элюент: гексан/EtOH/MeOH, 80:10:10,КТ, скорость потока 20 мл/мин, детектор 310 нМ, время цикла 30 мин. Абсолютную конфигурацию энантиомера с большим временем удерживания определяли по сравнению с энантиомером с меньшим временем удерживания следующим способом: повторяли стадии синтеза, описанные для промежуточного соединения 16 и в примере 3, с использованием оптически чистого -аминокапролактама в качестве исходного материала, и на хиральную колонку для ЖХВР совместно наносили конечный оптически чистый продукт и рацемический продукт, полученный в примере 3. В этих условиях (S)-энантиомер характеризуется большим временем удерживания, которое составляет 19,2 мин, а (R)-энантиомер характеризуется меньшим временем удерживания, которое составляет 12,71 мин. После концентрирования пиков с большим и меньшим временем удерживания получали (R) и (S) энантиомеры соответственно. Соединения, приведенные в табл. 1, получали по методикам, описанным в приведенных выше примерах, но с использованием соответствующих исходных материалов. Таблица 1(10:5 мл) добавляли раствор триметилсилилдиазометана в этиловом эфире (2,0 М, 2 мл). Полученную смесь перемешивали в течение 30 мин и концентрировали, при этом получали метиловый эфир 2-(2,5 дихлорпиримидин-4-иламино)бензойной кислоты в виде твердого вещества желтого цвета. Стадия 2. 4'-(5-Хлор-4-(2-(циклопропилкарбамоил)фениламино)пиримидин-2-иламино)-5'-метоксиN,2'-Диметилбифенил-4-карбоксамид. Смесь метилового эфира 2-(2,5-дихлорпиримидин-4-иламино)бензойной кислоты (стадия 1, 50 мг,0,16 моль) и 4'-амино-5'-метокси-N,2'-диметилбифенил-4-карбоксамида (промежуточное соединение 31,46 мг, 0,16 моль) в 2-пропаноле обрабатывали конц. HCl (водный раствор, 4 капли). Смесь закрывали и нагревали в микроволновом реакторе при 120C в течение 20 мин. Полученную смесь концентрировали и остаток распределяли между этилацетатом и водным раствором карбоната натрия. Органический слой концентрировали, при этом получали неочищенный метиловый эфир 2-(5-хлор-2-(5-метокси-2-метил-4'(метилкарбамоил)бифенил-4-иламино)пиримидин-4-иламино)бензойной кислоты в виде твердого вещества коричневого цвета. Полученный неочищенный продукт обрабатывали конц. циклопропиламином(0,5 мл). Смесь нагревали в закрытой пробирке при 110C в течение ночи. Полученную смесь концентрировали и остаток очищали обращенно-фазовой ЖХВР, при этом получали 4'-(5-хлор-4-(2(циклопропилкарбамоил)фениламино)пиримидин-2-иламино)-5'-метокси-N,2'-диметилбифенил-4 карбоксамид в виде твердого вещества белого цвета. МС (ES): m/z 557,2 (М + Н+). 1(s, 3H), 0,86-0,83 (m, 2H), 0,67-0,65 (m, 2H). Соединения, приведенные в табл. 2, получали по методикам, описанным выше в примерах, но с использованием соответствующих исходных материалов. Таблица 2
МПК / Метки
МПК: A61P 35/00, C07D 413/12, A61P 37/00, A61K 31/506, C07D 401/12, C07D 239/48, A61P 31/00, C07D 403/12, C07D 417/12, C07D 409/12
Метки: 2-бифениламино-4-аминопиримидина, качестве, производные, ингибиторов, киназ
Код ссылки
<a href="https://eas.patents.su/30-17252-proizvodnye-2-bifenilamino-4-aminopirimidina-v-kachestve-ingibitorov-kinaz.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 2-бифениламино-4-аминопиримидина в качестве ингибиторов киназ</a>
Предыдущий патент: Крекинг олефинов на модифицированных фосфором молекулярных ситах
Следующий патент: Способ выбора рабочих условий реактора
Случайный патент: Применение дексмедетомидина для седативного воздействия в отделении интенсивной терапии












