Производные пиразолохиназолина: способ получения и применение в качестве ингибиторов киназ
Номер патента: 10904
Опубликовано: 30.12.2008
Авторы: Певарелло Паоло, Тракванди Габриелла, Панцери Акилле, Браска Мария Габриелла, Фанчелли Даниеле, Ролетто Фульвия, Д`алессио Роберто, Вианелло Паола, Вульпетти Анна, Квартьери Франческа, Получчи Паоло, Фергюсон Рон
Формула / Реферат
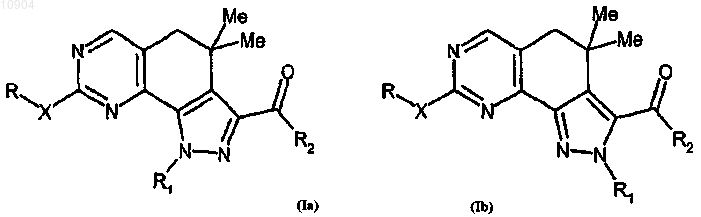
1. Производное пиразолохиназолина, представленное формулой (Ia) или (Ib)
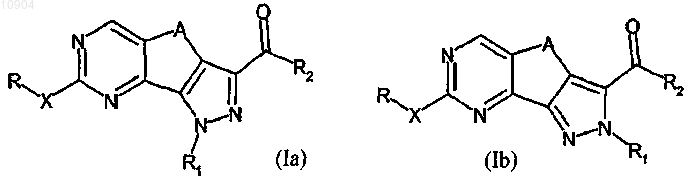
или его фармацевтически приемлемая соль, где R обозначает водород или группу, выбранную из амино, линейного или разветвленного C1-C6алкила, C3-C10циклоалкила, арила, арилC1-C6алкила, гетероциклила или гетероциклилC1-C6алкила; X обозначает простую связь или двухвалентный радикал, выбранный из -NR'-, -CONR'-, -NH-CO-NH-, -О- или -S-, где R' обозначает водород или группу, выбранную из линейного или разветвленного C1-C6алкила, C3-C6циклоалкила, арила, арилC1-C6алкила, гетероциклила или гетероциклилC1-C6алкила или R и R' вместе с атомом азота, с которым они связаны, могут образовывать 5-6-членную гетероарильную или гетероциклильную группу, необязательно содержащую один дополнительный гетероатом, выбранный из N, О или S;
R1, связанный с любым атомом азота пиразольного цикла согласно формулам (Ia) или (Ib), представляет собой атом водорода или группу, выбранную из линейного или разветвленного C1-C6алкила, C3-C6 циклоалкила, арила, арилC1-C6алкила, гетероциклила или гетероциклилC1-C6алкила, или в формуле (Ib) R1 обозначает двухвалентную группу -(CH2)n-NH- группу, связанную с R2, в которой n обозначает 2 или 3;
R2 обозначает группу, выбранную из -NR"R'", -N(OH)R", -OR" или -R", где каждый из R" и R'" независимо обозначает водород или группу, выбранную из линейного или разветвленного C1-C6алкила, C3-C6 циклоалкила или C3-C6циклоалкил C1-C6алкила, арила, арилС1-С6алкила, гетероциклила или гетероциклилC1-C6алкила, или R" и R'" вместе с атомом азота, с которым они связаны, могут образовывать 5-6-членную гетероарильную или гетероциклильную группу, необязательно содержащую один дополнительный гетероатом, выбранный из N, О или S;
А обозначает двухвалентную группу, выбранную из -СН2-, -(СН2)2-, -СН2-С(СН3)2-, -С(СН3)2-СН2- или -СН=СН-;
причем арил имеет следующие значения:
фенил, бифенил, a- или b-нафтил, дигидронафтил, тиенил, бензотиенил, фурил, бензофуранил, пирролил, имидазолил, пиразолил, тиазолил, изотиазолил, оксазолил, изоксазолил, пиридил, пиразинил, пиримидинил, пиридазинил, индолил, изоиндолил, пуринил, хинолил, изохинолил, дигидрохинолинил, хиноксалинил, бензодиоксолил, инданил, инденил, триазолил; и
гетероциклил имеет следующие значения:
пиран, пирролидин, пирролин, имидазолин, имидазолидин, пиразолидин, пиразолин, тиазолин, тиазолидин, дигидрофуран, тетрагидрофуран, 1,3-диокосолан, пиперидин, пиперазин, морфолин;
C1-C6алкил означает метил, этил н-пропил, изопропил, н-бутил, изобутил, трет-бутил, втор-бутил, н-пентил или н-гексил; и
C3-C6циклоалкил означает циклопропил, циклобутил, циклопентил или циклогексил; и
любая из вышеупомянутых групп R1, R', R" и R'" необязательно замещена в любом из свободных положений одной или несколькими группами, независимо выбранными из галогена, нитро, оксо (=O), циано, азидо, алкила, полифторсодержащего алкила, гидроксиалкила, арила, арилалкила, гетероциклила, гетероциклилалкила, циклоалкила, алкиларила, алкилгетероциклила, гидрокси, алкокси, полифторсодержащего алкокси, арилокси, арилалкилокси, гетероциклилокси, гетероциклилалкилокси, метилендиокси, алкилкарбонилокси, алкилкарбонилоксиалкила, арилкарбонилокси, карбокси, алкоксикарбонила, алкоксикарбонилалкила, арилоксикарбонила, циклоалкилоксикарбонила, амино, аминоалкила, алкиламиноалкила, алкиламиноалкилокси, уреидо, алкиламино, диалкиламино, ариламино, диариламино, формиламино, алкилкарбониламино, арилкарбониламино, гетероциклилкарбониламино, алкоксикарбониламино, алкоксиимино, алкилсульфониламино, арилсульфониламино, формила, алкилкарбонила, арилкарбонила, гетероциклилкарбонила, циклоалкилкарбонила, аминокарбонила, алкиламинокарбонила, диалкиламинокарбонила, ариламинокарбонила, алкилсульфонила, арилсульфонила, гетероциклилсульфонила, аминосульфонила, алкиламиносульфонила, диалкиламиносульфонила, арилтио и алкилтио.
2. Соединение формулы (Ia) или (Ib) по п.1, в котором X обозначает группу -NH- и R2 обозначает группу, выбранную из -NHR", -N(OH)R", -OR" или -R", в которой R" представляет собой необязательно замещенную группу, выбранную из C3-C6циклоалкила или циклоалкилалкила, арила, арилалкила, гетероциклила или гетероциклилалкила; и R, R1 и А имеют вышеуказанные значения.
3. Соединение формулы (Ia) или (Ib) по п.1, в котором X обозначает группу -О- и R2 обозначает группу, выбранную из -NHR", -N(OH)R", -OR" или -R", в которой R" представляет собой необязательно замещенную группу, выбранную из C3-C6циклоалкила или циклоалкилалкила, арила, арилалкила, гетероциклила или гетероциклилалкила; и R, R1 и А имеют вышеуказанные значения.
4. Соединение формулы (Ia) или (Ib) по п.1, в котором X обозначает группу -S- и R2 обозначает группу, выбранную из -NHR", -N(OH)R", -OR" или -R", в которой R" представляет собой необязательно замещенную группу, выбранную из C3-C6 циклоалкила или циклоалкилалкила, арила, арилалкила, гетероциклила или гетероциклилалкила; и R, R1 и А имеют вышеуказанные значения.
5. Соединение формулы (Ia) или (Ib) по п.1, где X обозначает группу -NH- и R2 обозначает группу, выбранную из -NHR" или -N(OH)R", в которой R" обозначает атом водорода или линейную или разветвленную C1-C4 алкильную группу; и где A, R и R1 имеют вышеуказанные значения.
6. Соединение формулы (Ia) или (Ib) по п.1, где X обозначает группу -О- и R2 обозначает группу, выбранную из -NHR" или -N(OH)R", в которой R" обозначает атом водорода или линейную или разветвленную C1-C4 алкильную группу; и где A, R и R1 имеют вышеуказанные значения.
7. Соединение формулы (Ia) или (Ib) по п.1, где X обозначает группу -S- и R2 обозначает группу, выбранную из -NHR" или -N(OH)R", в которой R" обозначает атом водорода или линейную или разветвленную C1-C4 алкильную группу; и где A, R и R1 имеют вышеуказанные значения.
8. Соединение формулы (Ib) по п.1, где R, X и А имеют вышеуказанные значения и R1 и R2 соединены через двухвалентную группу -(CH2)n-NH-, в которой n имеет вышеуказанные значения.
9. Соединение формулы (Ia) или (Ib) по п.1, где А обозначает группу, выбранную из -(СН2)2-, -СН2-С(СН3)2- или -С(CH3)2-СН2-.
10. Соединение формулы (Ia) или (Ib) по п.1, выбранное из группы, включающей нижеследующие соединения, возможно, в виде фармацевтически приемлемой соли:







11. Способ лечения пролиферативных заболеваний клеток, вызванных и/или связанных с измененной активностью протеинкиназы, путем введения млекопитающеьу, нуждающемуся в лечении, эффективного количества производного пиразолохиназолина, представленного формулой (Ia) или (Ib), как указано в п.1.
12. Способ по п.11, в котором активность протеинкиназы представляет собой активность Aurora 2.
13. Способ по п.11, в котором активность протеинкиназы представляет собой активность киназы, зависимой от клеточного цикла.
14. Способ по п.11, в котором пролиферативное заболевание клеток выбрано из группы, состоящей из рака, болезни Альцгеймера, вирусных инфекций, аутоиммунных заболеваний и нейродегенеративных расстройств.
15. Способ по п.14, в котором рак выбран из группы, состоящей из карциномы, плоскоклеточной карциномы, опухолей кроветворной ткани миелоидного или лимфоидного происхождения, опухолей мезенхимального происхождения, опухолей центральной и периферической нервной системы, меланомы, семиномы, тератокарциномы, остеосаркомы, пигментной ксеродермы, кератоксантомы, фолликулярного рака щитовидной железы и саркомы Капоши.
16. Способ по п.11, в котором пролиферативное заболевание клеток выбрано из группы, состоящей из доброкачественной гиперплазии простаты, наследственного аденоматозного полипоза, нейрофиброматоза, псориаза, пролиферации гладких клеток стенок сосудов, связанной с атеросклерозом, пневмофиброза, артрита, гломерулонефрита и послеоперационного стеноза и рестеноза.
17. Способ по п.11, который обеспечивает ингибирование ангиогенеза и метастаза опухолей, а также лечение отторжения трансплантата органов и реакции "трансплантат против хозяина".
18. Способ по п.11, который обеспечивает лечение или профилактику алопеции, вызванной радиотерапией или химиотерапией.
19. Способ по п.11, включающий дополнительно воздействие на млекопитающего, нуждающегося в лечении, радиотерапии или химиотерапии в сочетании по меньшей мере с одним цитостатическим или цитотоксическим средством.
20. Способ по п.11, в котором млекопитающим, нуждающимся в лечении, является человек.
21. Способ ингибирования активности киназы Aurora 2, включающий контактирование указанной киназы с эффективным количеством соединения, определенного в п.1.
22. Способ ингибирования активности циклинзависимых киназ, включающий контактирование указанных киназ с эффективным количеством соединения, определенного в п.1.
23. Способ получения соединений формулы (Ia) или (Ib), определенных в п.1, где А представляет собой группу -(СН2)2-, или их фармацевтически приемлемых солей, который включает:
ст.1) взаимодействие 2-этокси-2-циклогексен-1-она с диэтилоксалатом в присутствии (бис-триметилсилил)амида лития [LiN(TMS)2] с получением соединения формулы (II)
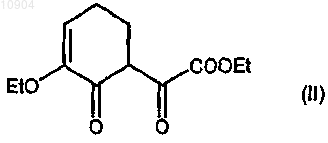
и его обработку производным гидразина формулы (III)
![]()
где R1 имеет вышеуказанные значения, согласно рабочим условиям любой из стадий 2а, 2b или 2с;
ст.2а) в присутствии низшего спирта с получением смеси соединений формулы (IVa) и (IVb)
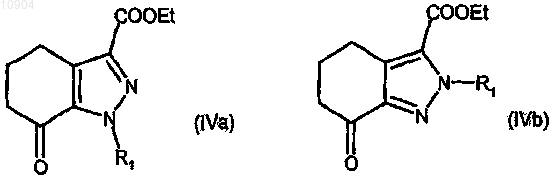
где R1 определен выше, и разделение смеси на отдельные соединения (IVa) и (IVb);
ст.2b) в присутствии уксусной кислоты с получением соединения формулы (IVa);
ст.2с) алкилированием соединения формулы (IVa), полученного на стадии 2а или 2b, в котором R1 обозначает водород, соединениями формулы (IVc)
![]()
где Y обозначает подходящую уходящую группу, выбранную из мезила, тозила или галогена с получением смеси соединений формулы (IVa) и (IVb), в которых R1 определен выше, и разделением указанной смеси на соединения (IVa) и (IVb);
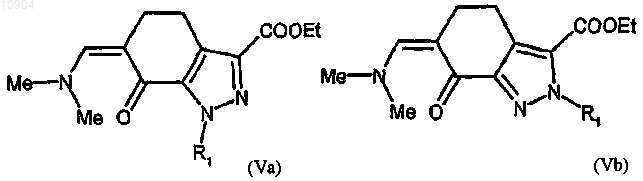
ст.3) взаимодействие соединения формулы (IVa), полученного на любой из стадий 2а, 2b или 2с, или соединения формулы (IVb), полученного на стадиях 2а или 2с, с ди-трет-бутилацеталем диметилформамида с получением соединения формулы (Va) или (Vb)
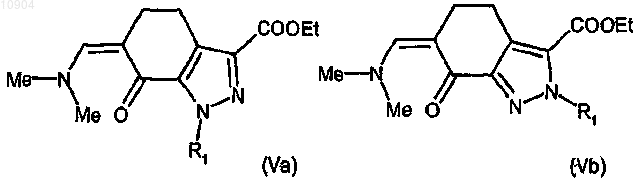
где R1 определен выше; и взаимодействие соединения формулы (Va) или (Vb) согласно любой из альтернативных стадий 4а, 4b или 4с ст.4а) с гуанидином с получением соединения формулы (Ia) или (Ib)
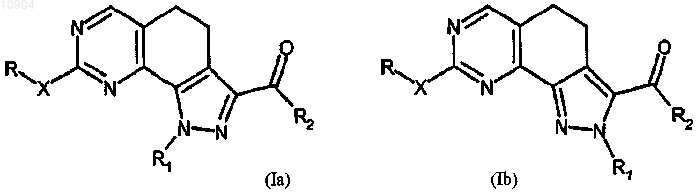
в которых R-X- обозначает амино, R2 обозначает этоксигруппу и R1 определен выше; и последующее их превращение в случае необходимости в другие производные формулы (I);
ст.4b) с производным гуанидина формулы (VI)
![]()
где R определен выше, с получением соединения формулы (Ia) или (Ib), в которых R и R1 имеют вышеуказанные значения, X обозначает -NH- и R2 обозначает этокси; и
последующее их превращение в случае необходимости в другие производные формулы (I);
ст.4с) с алкилизотиомочевиной формулы (VII)
![]()
где R определен выше, с получением соединения формулы (Ia) или (Ib), где R и R1 имеют вышеуказанные значения, X обозначает -S- и R2 обозначает этокси; и последующее их превращение в случае необходимости в другие производные формулы (I);
ст.4d) с метилизомочевиной с получением соединения формулы (Ia) или (Ib), где R1 определен выше, R обозначает метил, X обозначает -О- и R2 обозначает этокси; и последующее их превращение в случае необходимости в другие производные формулы (I).
24. Способ получения соединений формулы (Ia) или (Ib), определенных в п.1, где А представляет собой группу -С(СН3)2-(CH2)2-, или их фармацевтически приемлемых солей, который включает:
ст.5) взаимодействие 2-метокси-4,4-диметил-2-циклогексен-1-она с диэтилоксалатом в присутствии [LiN(TMS)2] с получением соединения формулы (VIII)
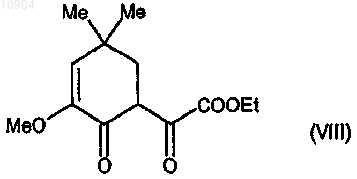
ст.6) взаимодействие соединения формулы (VIII) с производным гидразина формулы (III) согласно любой из предшествующих стадий 2а или 2b способа по п. 23, с получением соединения формулы (IXa) или (IXb),
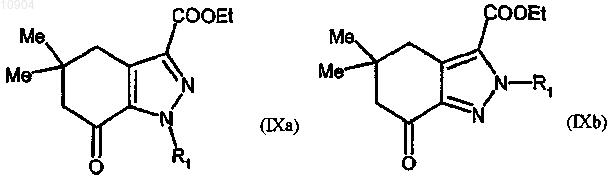
где R1 указан выше;
ст.7) взаимодействие соединения формулы (IXa) или (IXb) с этилформиатом в основных условиях с получением соединения формулы (Ха) или (Xb)
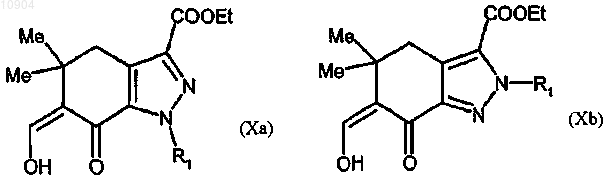
ст.8) взаимодействие соединения формулы (Ха) или (Xb) с производным гуанидина формулы (VI) с получением соединения формулы (Ia) или (Ib)
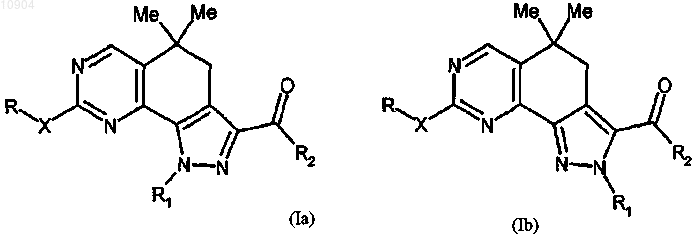
где R и R1 имеют вышеуказанные значения, X обозначает -NH- и R2 обозначает этокси; и последующее их превращение в случае необходимости в другие производные формулы (I).
25. Способ получения соединений формулы (Ia) или (Ib), определенных в п.1, где А представляет собой группу-CH2-С (CH3)2-, или их фармацевтически приемлемых солей, который включает:
ст.9) взаимодействие 2-метокси-5,5-диметил-2-циклогексен-1-она с диэтилоксалатом в присутствии гидрида натрия с получением соединения формулы (XI)
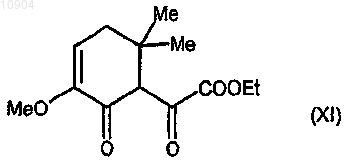
ст.10) взаимодействие соединения формулы (XI) с производным гидразина формулы (III) согласно любой из предшествующих стадий 2а или 2b способа по п. 23, с получением соединения формулы (XIIa) или (XIIb)
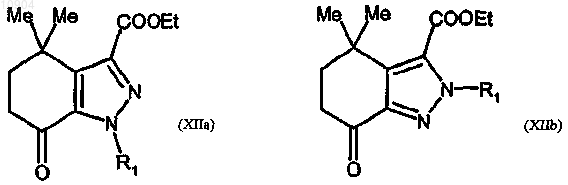
где R1 указан выше;
ст. 11) взаимодействие соединения формулы (XIIa) или (XIIb) с ди-трет-бутилацеталем диметилформамида с получением соединения формулы (XIIIa) или (XIIIb)
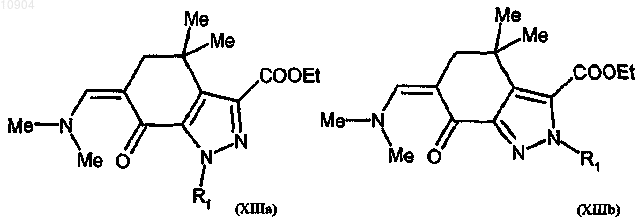
ст. 12) взаимодействие соединения формулы (XIIIa) или (XIIIb) с производным гуанидина формулы (VI) с получением соединения формулы (Ia) или (Ib)
где R и R1 имеют вышеуказанные значения, X обозначает -NH- и R2 обозначает этокси; и последующее их превращение в случае необходимости в другие производные формулы (I).
26. Способ получения соединений формулы (Ib), определенных в п.1, где R1 непосредственно связан с R2 таким образом, что образуется тетрациклическая структура, или их фармацевтически приемлемых солей, который включает:
ст.13) взаимодействие соединения формулы (IVa) или (IVb), где R1 обозначает водород, полученного на стадии 2а способа по п.23 с трифенилметилхлоридом с получением соединения формулы (XIV)
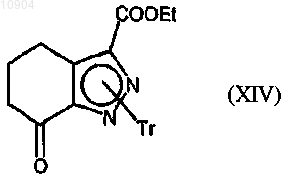
где Tr обозначает тритил (трифенилметил);
ст.14) взаимодействие соединения формулы (XIV) с ди-трет-бутилацеталем диметилформамида согласно стадии 3 способа по п.23 с получением соединения формулы (XV)
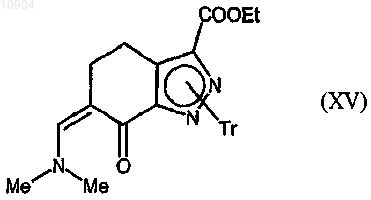
ст.15) взаимодействие соединения формулы (XV) с подходящим производным гуанидина формулы (VI) согласно стадии 4b способа по п.23 с получением соединения формулы (Ia) или (Ib),
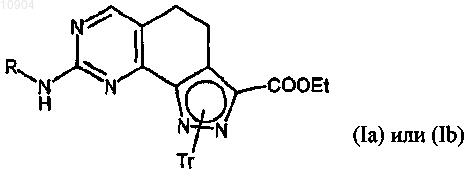
где R указан выше; X обозначает NH, R1 обозначает тритил и R2 обозначает этокси;
ст.16) взаимодействие вышеупомянутого соединения формулы (Ia) или (Ib) в кислых условиях с получением соответствующего соединения формулы (Ia) или (Ib), где R1 представляет собой водород;
ст.17) взаимодействие вышеупомянутого соединения формулы (Ia) или (Ib) с подходящим алкилирующим агентом формулы (XVI) в присутствии трет-бутилата лития
Br-(CH2)n-NH-BOC (XVI),
где n обозначает 2 или 3,
с получением соединения формулы (Ib)
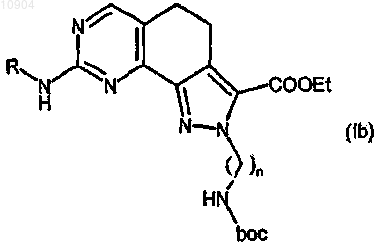
где n и R имеют вышеуказанные значения;
ст.18) взаимодействие вышеупомянутого соединения формулы (Ib) в кислых условиях для превращения трет-бутоксикарбониламиногруппы в аминогруппу (снятие защиты) и взаимодействие с карбонатом цезия (Cs2CO3) с получением любого из двух соединений формулы (Ib)
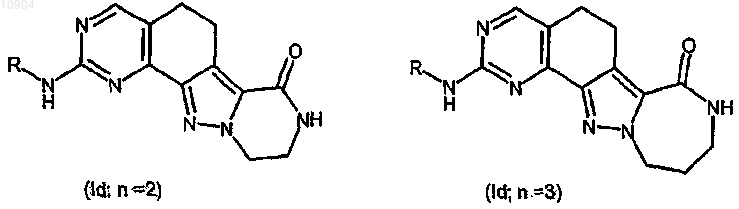
где R указан выше, и последующее их превращение в случае необходимости в другие производные формулы (I).
27. Способ получения соединений формулы (Ia) или (Ib), определенных в п.1, где R2 представляет собой объемную группу, или их фармацевтически приемлемых солей, который включает:
ст.19) взаимодействие 2-этокси-2-циклогексенона с ди-трет-бутилацеталем диметилформамида согласно стадии 3 способа по п.23 с получением соединения формулы (XVII)
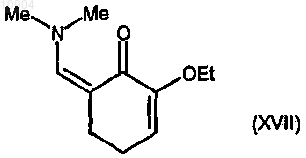
ст.20) взаимодействие соединения формулы (XVII) с производным формулы (VII) согласно стадии 4с способа по п.23 с получением соединения формулы (XVIII)
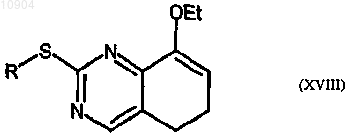
где R определен выше; и
последующую обработку в кислых условиях с получением соединения формулы (XIX)
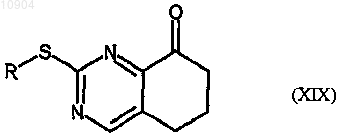
ст.21) взаимодействие соединения формулы (XIX) с соединением формулы (XX)
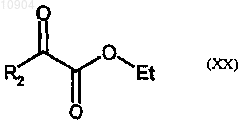
где R2 представляет собой объемную группу, с получением соединения формулы (XXI)
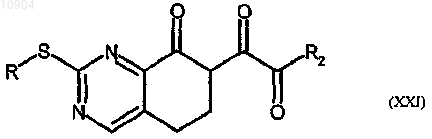
ст.22) взаимодействие соединения формулы (XXI) с производным гидразина формулы (III) согласно стадии 1 способа по п.23 с получением соединения формулы (I), где R и R1 имеют вышеуказанные значения, X обозначает -S- и R2 обозначает объемную группу; и последующее их превращение в случае необходимости в другие производные формулы (I).
28. Способ по пп.23-27, в котором соединения формулы (I), получаемые на любой из стадий 4а, 4b, 4с, 8, 12, 15, 18 и 22, превращают в другие соединения формулы (I), при этом способ включает превращение соединений формулы (I):
ст.23) где R2 обозначает этокси, в соединения формулы (Ia) или (Ib), где R2 обозначает аминогруппу, обработкой гидроксидом аммония
ст.24) где R2 обозначает этокси, в соединения формулы (I), где R2 обозначает группу NHR", R" определен выше, обработкой амином формулы R"-NH2 (XXII)
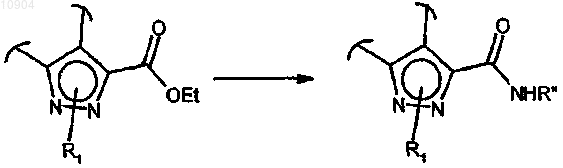
ст.25) где R2 обозначает этокси, в соединения формулы (I), где R2 обозначает группу -ОН, путем кислотного или основного гидролиза
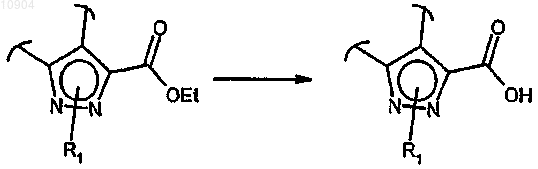
ст.26) где R2 обозначает -ОН, в соединения формулы (I), где R2 обозначает группу -NR"R'" или -N(OH)R", a R" и R'" определены выше путем реакции с производным формулы (XXIII) или (XXIV)
![]()
в основных условиях и в присутствии подходящего конденсирующего агента
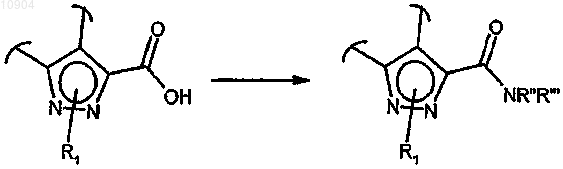
ст.27) где R обозначает водород и X обозначает -NH-, в соединения формулы (I), где R обозначает отличный от водорода заместитель, как определено выше, и X обозначает -CONH-, реакцией с соединением формулы R-COCl (XXV)
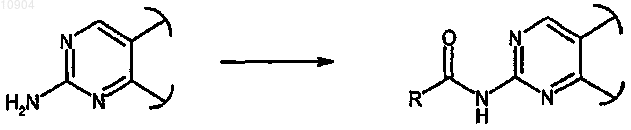
ст.28) где R обозначает водород и X обозначает -NH-, в соединения формулы (I), где R обозначает заместитель, отличный от водорода, как определено выше, и X обозначает -NH-CO-NH-, реакцией с изоцианатом формулы R-NCO (XXVI)
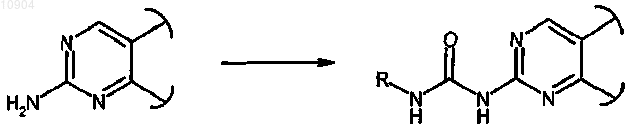
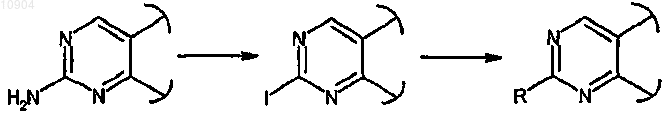
ст.29) где R обозначает водород и X обозначает -NH-, в соединения формулы (I), где R обозначает арил и X обозначает -NH-, сначала превращением аминогруппы в йод действием изоамилнитрита и дийодметана или йодида цезия в присутствии йода и CuI и затем взаимодействием полученного йодпроизводного с ариламином формулы R-NH2 (XXVII) в присутствии ацетата палладия и (2,2'-бис(дифенилфосфино))-1,1'-бинафталина (BINAP)
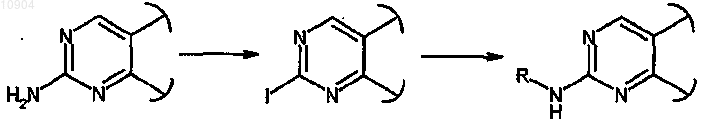
ст.29а), где R обозначает водород и X обозначает -NH-, в соединения формулы (I), где R обозначает алкил, циклоалкил, циклоалкилалкил, арилалкил, гетероциклил, гетероциклилалкил и X обозначает -NH-, сначала превращением аминогруппы в йод, как описано на предыдущей стадии 29, и затем взаимодействием полученного йодпроизводного с алкилом, циклоалкилом, циклоалкилалкилом, арилалкилом, гетероциклилом или гетероциклилалкиламином формулы RNH2 (XXVII), где R определен выше;
ст.30), где R обозначает водород и X обозначает -NH-, в соединения формулы (I), где R обозначает арил и X обозначает простую связь, сначала превращением аминогруппы в йод, как описано на предыдущей стадии 29, и затем взаимодействием полученного йодпроизводного с арилбороновой кислотой формулы R-B(OH)2 (XXVIII) в присутствии производного палладия
ст.31), где R обозначает водород и X обозначает -NH-, в соединения формулы (I), где R обозначает арилметил и X обозначает простую связь, взаимодействием с арилальдегидом формулы R-CHO (XXIX) в присутствии цианоборгидрида натрия (NaBH3CN)

ст.32), где R обозначает метил и X обозначает -S-, в соединения формулы (I), где R обозначрхт необязательно замещенную алкильную, циклоалкильную, гетероциклильную, циклоалкилалкильную, арилалкильную или гетероциклилалкильную группу, сначала превращением RS-группы в RSO2- в окислительных условиях и затем взаимодействием полученного сульфонильного производного с амином формулы R-NH2 (XXVII), где R обозначает необязательно замещенную алкильную, циклоалкильную, гетероциклильную, циклоалкилалкильную, арилалкильную или гетероциклилалкильную группу
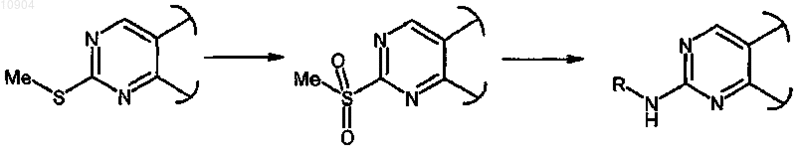
ст.33), где R обозначает метил и X обозначает -S-, в соединения формулы (I), где R обозначает группу, отличную от метильной и X обозначает -O-, сначала превращением RS-группы в RSO2-, как на стадии 32, и затем взаимодействием полученного сульфонильного производного с соединением формулы R-OH (XXX)
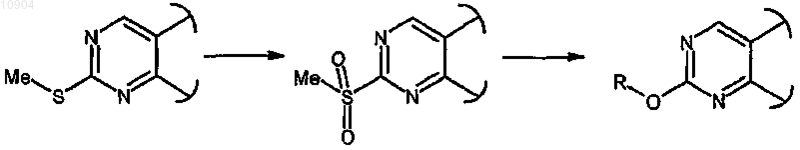
ст.33а), где R обозначает метил и X обозначает -O-, в соединения формулы (I), где R обозначает другую, не метильную группу и X обозначает -O-, сначала превращением МеО-группы в НО- затем взаимодействием полученного соединения с трифторметансульфорилирующим агентом для синтеза соответствующего трифторметансульфоната и последующей реакцией последнего с соединением формулы R-OH (XXX)
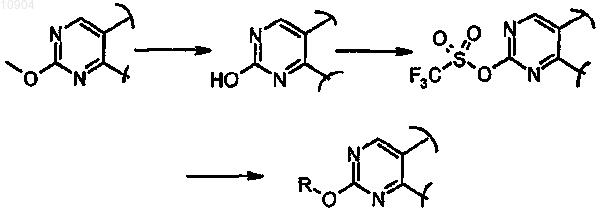
ст.33b), где R обозначает метил и X обозначает -O-, в соединения формулы (I), где R обозначает необязательно замещенную алкильную, циклоалкильную, гетероциклильную, циклоалкилалкильную, гетероциклилалкильную группу и X обозначает -NH-, сначала превращением МеО-группы в НО-, и затем взаимодействием полученного соединения с трифторметансульфорилирующим агентом для синтеза соответствующего трифторметансульфоната и последующей его реакцией с амином формулы R-NH2 (XXVII), где R обозначает необязательно замещенную алкильную, циклоалкильную, гетероциклильную, циклоалкилалкильную, арилалкильную или гетероциклилалкильную группу
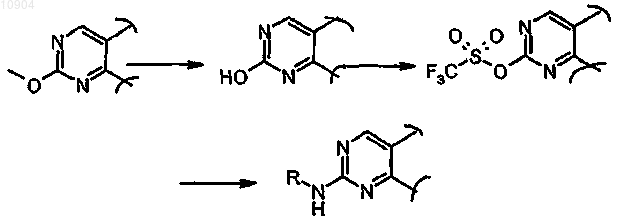
ст.33с), где R обозначает метил и X обозначает -O-, в соединения формулы (I), где R обозначает арил и X обозначает -NH-, сначала превращением МеО-группы в -ОН, затем взаимодействием полученного соединения с трифторметансульфорилирующим агентом для синтеза соответствующего трифторметансульфоната и последующей его реакцией с амином формулы R-NH2 (XXVII), где R обозначает необязательно замещенный арил, в присутствии ацетата палладия и BINAP;
ст.34), где А обозначает группу -(СН2)2-, в соединения формулы (I), где А обозначает группу -СН=СН-, дегидрированием в присутствии Pd или Pt катализатора.
29. Соединение формулы (Va) или (Vb), как определено на ст.3 п.24
где R1 обозначает атом водорода или группу, выбранную из линейного или разветвленного C1-C6 алкила, С3-С6циклоалкила, арила, арилC1-C6алкила, гетероциклила или гетероциклилC1-C6алкила, причем арил имеет следующие значения:
фенил, бифенил, a- или b-нафтил, дигидронафтил, тиенил, бензотиенил, фурил, бензофуранил, пирролил, имидазолил, пиразолил, тиазолил, изотиазолил, оксазолил, изоксазолил, пиридил, пиразинил, пиримидинил, пиридазинил, индолил, изоиндолил, пуринил, хинолил, изохинолил, дигидрохинолинил, хиноксалинил, бензодиоксолил, инданил, инденил, триазолил; и гетероциклил имеет следующие значения: пиран, пирролидин, пирролин, имидазолин, имидазолидин, пиразолидин, пиразолин, тиазолин, тиазолидин, дигидрофуран, тетрагидрофуран, 1,3-диокосолан, пиперидин, пиперазин, морфолин; и C1-C6алкил означает метил, этил н-пропил, изопропил, н-бутил, изобутил, трет-бутил, втор-бутил, н-пентил или н-гексил; и C3-C6циклоалкил означает циклопропил, циклобутил, циклопентил или циклогексил.
30. Библиотека двух или более соединений формулы (Ia) или (Ib)
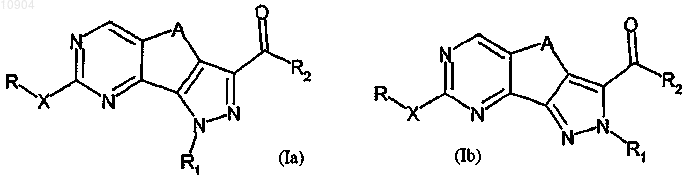
или их фармацевтически приемлемых солей,
в которых R обозначает водород или группу, выбранную из амино, линейного или разветвленного C1-C6 алкила, C3-C10циклоалкила, арила, арилC1-C6алкила, гетероциклила или гетероциклилC1-C6алкила;
X обозначает простую связь или двухвалентный радикал, выбранный из -NR'-, -CONR'-, -NH-CO-NH-, -О- или -S-, где R' обозначает водород или группу,выбранную из линейного или разветвленного C1-С6 алкила, C3-C6 циклоалкила, арила, арилC1-C6алкила, гетероциклила или гетероциклилC1-C6алкила, или R и R' вместе с атомом азота, с которым они связаны, могут образовывать 5-6-членную гетероарильную или гетероциклильную группу необязательно содержащую один дополнительный гетероатом, выбранный из N, О или S;
R1, связанный с любым атомом азота пиразольного цикла в соответствии с формулами (Ia) или (Ib), представляет собой атом водорода или группу, выбранную из линейного или разветвленного C1-C6алкила, С3-C6циклоалкила, арила, арилC1-C6алкила, гетероциклила или гетероциклилC1-C6алкила, или в формуле (Ib) R1 обозначает двухвалентную группу -(CH2)n-NH, связанную с R2, где n обозначает 2 или 3;
R2 обозначает группу, выбранную из -NR"R'", -N(OH)R", -OR" или -R", где R" и R'" обозначают независимо водород или группу, выбранную из линейного или разветвленного C1-C6алкила, C3-C6циклоалкила или C3-C6циклоалкилC1-C6алкила, арила, арилС1-C6алкила, гетероциклила или гетероциклилC1-C6алкила, или R" и R'" вместе с атомом азота, с которым они связаны, могут образовывать 5-6-членную гетероарильную или гетероциклильную группу, необязательно содержащую один дополнительный гетероатом, выбранный из N, О или S;
А обозначает двухвалентную группу, выбранную из -СН2-, -(СН2)2-, -СН2-С(СН3)2-, -С(СН3)2-СН2- или -СН=СН-; причем арил имеет следующие значения:
фенил, бифенил, a- или b-нафтил, дигидронафтил, тиенил, бензотиенил, фурил, бензофуранил, пирролил, имидазолил, пиразолил, тиазолил, изотиазолил, оксазолил, изоксазолил, пиридил, пиразинил, пиримидинил, пиридазинил, индолил, изоиндолил, пуринил, хинолил, изохинолил, дигидрохинолинил, хиноксалинил, бензодиоксолил, инданил, инденил, триазолил; и гетероциклил имеет следующие значения: пиран, пирролидин, пирролин, имидазолин, имидазолидин, пиразолидин, пиразолин, тиазолин, тиазолидин, дигидрофуран, тетрагидрофуран, 1,3-диокосолан, пиперидин, пиперазин, морфолин;
C1-C6алкил означает метил, этил н-пропил, изопропил, н-бутил, изобутил, трет-бутил, втор-бутил, н-пентил или н-гексил; и C3-C6циклоалкил означает циклопропил, циклобутил, циклопентил или циклогексил; и
любая из вышеупомянутых групп R1, R', R" и R'" необязательно замещена в любом из свободных положений одной или несколькими группами, независимо выбранными из галогена, нитро, оксо (=O), циано, азидо, алкила, полифторсодержащего алкила, гидроксиалкила, арила, арилалкила, гетероциклила, гетероциклилалкила, циклоалкила, алкиларила, алкилгетероциклила, гидрокси, алкокси, полифторсодержащего алкокси, арилокси, арилалкилокси, гетероциклилокси, гетероциклилалкилокси, метилендиокси, алкилкарбонилокси, алкилкарбонилоксиалкила, арилкарбонилокси, карбокси, алкоксикарбонила, алкоксикарбонилалкиыр, арилоксикарбонила, циклоалкилоксикарбонила, амино, аминоалкила, алкиламиноалкила, алкиламиноалкилокси, уреидо, алкиламино, диалкиламино, ариламино, диариламино, формиламино, алкилкарбониламино, арилкарбониламино, гетероциклилкарбониламино, алкоксикарбониламино, алкоксиимино, алкилсульфониламино, арилсульфониламино, формила, алкилкарбонила, арилкарбонила, гетероциклилкарбонила, циклоалкилкарбонила, аминокарбонила, алкиламинокарбонила, диалкиламинокарбонила, ариламинокарбонила, алкилсульфонила, арилсульфонила, гетероциклилсульфонила, аминосульфонила, алкиламиносульфонила, диалкиламиносульфонила, арилтио и алкилтио.
31. Фармацевтическая композиция, содержащая терапевтически эффективное количество производного пиразолохиназолина формулы (Ia) или (Ib) по п.1 и по меньшей мере один фармацевтически приемлемый наполнитель, носитель и/или разбавитель.
32. Фармацевтическая композиция по п.31 дополнительно включающая один или несколько химиотерапевтических агентов.
33. Комбинированный препарат, содержащий соединение формулы (Ia) или (Ib) по п.1, или их фармацевтические композиции, как определено в п.27, и один или несколько химиотерапевтических агентов, предназначенный для одновременного раздельного или последовательного применения при противораковой терапии.
34. Применение соединения формулы (Ia) или (Ib) по п.1 в качестве лекарственного средства.
35. Применение соединения формулы (Ia) или (Ib) по п.1 для изготовления лекарственного средства с противоопухолевой активностью.
Текст
010904 Настоящее изобретение относится к производным пиразолохиназолина, к способу их получения,содержащим их фармацевтическим композициям и их применению в качестве терапевтических агентов,особенно для лечения рака и заболеваний, связанных с пролиферацией клеток. Отдельные цитотоксические лекарственные средства, такие, например, как фторурацил (5-FU), доксорубицин и камптотецины, повреждают ДНК или воздействуют на клеточные пути метаболизма, и поэтому во многих случаях вызывают побочное блокирование клеточного цикла. Следовательно, вызывая необратимое повреждение как нормальных, так и опухолевых клеток, указанные агенты приводят к значительной токсичности и побочным эффектам. В этой связи требуются соединения, способные действовать как высокоспецифичные противоопухолевые агенты за счет селективного подавления опухолевых клеток и апоптоза, эффективность которых сравнима с эффективностью имеющихся в настоящее время лекарственных средств, а токсичность ниже. Хорошо известно, что прогрессия клеточного цикла управляется рядом регуляторов контрольных точек, иначе называемых точками рестрикции, которые регулируются семейством ферментов, известных как циклинзависимые киназы (cdk). В свою очередь, сами cdk регулируются на многих уровнях, таких,например, как связывание с циклинами. Согласованные активация и инактивация различных комплексов циклин/cdk необходимы для нормальной прогрессии клеточного цикла. Как критические G1-S, так и G2-M трансляции регулируются стимуляцией активностей различных циклин/cdk. Полагают, что в G1, как циклинD/cdk4, так циклинE/cdk2 медиируют начало S-фазы. Прогрессия через S-фазу требует активности комплекса циклин A/cdk2, хотя для начала митоза требуется активация комплексов циклин A/cdc2 (cdk1) и циклин B/cdc2. Для справки общего характера по циклинам и циклинзависимым киназам см., например, [Kevin R. Webster et al, in Exp. Opin. Invest. Drugs,1998, Vol. 7 (6), 865-887]. В опухолевых клетках регуляторы контрольных точек дефектны, что частично обусловлено прекращением регулирования активности cdk. Например, в опухолевых клетках наблюдается измененная экспрессия циклина Е и циклинзависимых киназ и показано, что делеция р 27 KIP гена ингибитора cdk у мышей приводит в результате к повышению числа случаев рака. Рост доказательств подкрепляет представление о том, что циклинзависимые киназы являются ферментами, лимитирующими скорость прогрессии клеточного цикла и как таковые представляют собой молекулярные мишени для терапевтического вмешательства. Конкретно, прямое ингибирование киназной активности комплексов cdk/циклин должно быть полезно для рестрикции нерегулируемой пролиферации опухолевых клеток. Дополнительными протеинкиназами, про которые известно в данной области техники, что они вовлечены в рост опухолевых клеток, являются Aurora киназы, конкретно Aurora-2. Обнаружено, что Aurora-2 сверхпродуцируется в ряде опухолей различного типа. Ее карта генного локуса при 20ql3, хромосомная область часто экстракопирована при многих видах рака, включающих рак молочной железы [Cancer Res. 1999,59 (9) 2041-4] и толстой кишки. Амплификация 20q13 соответствует плохому прогнозу у больных раком молочной железы без поражения лимфатических узлов, а повышенная экспрессия Aurora-2 свидетельствует о плохом прогнозе и уменьшенной продолжительности жизни больных раком мочевого пузыря [J. Natl. Cancer Inst., 2002,94(17) 1320-9]. Для справки общего характера о роли Aurora-2 в аномальной функции центросом при раковых заболеваниях см. также [Molecular Cancer Therapeutics, 2003,2, 589-595]. Задачей изобретения являются соединения, которые применимы в лечении заболеваний, связанных с пролиферацией клеток, вызванных и/или связанных с измененной активностью протеинкиназы, например, ингибирующей активностью Aurora 2, и активностью киназы, зависимой от клеточного цикла. Еще одной задачей изобретения являются соединения, обладающие ингибирующей активностью в отношении протеинкиназ. Авторы настоящего изобретения обнаружили, что некоторые пиразолохиназолины обладают ингибирующей активностью в отношении протенкиназ, и, следовательно, применимы в терапии в качестве противоопухолевых средств и не обладают токсичностью и побочным действием, вышеупомянутыми недостатками, ассоциируемыми с имеющимися противоопухолевыми средствами. Более конкретно, пиразолохиназолины по изобретению применимы в лечении множества видов рака, включая (но не ограничиваясь ими) карциномы, такие как карцинома мочевого пузыря, молочной железы, толстой кишки, почек, печени, в том числе мелкоклеточный рак легкого, рак пищевода, желчного пузыря, яичников, поджелудочной железы, желудка, шеи, щитовидной железы, простаты и кожи, включая плоскоклеточную карциному, опухоли кроветворной ткани миелодного или лимфоидного происхождения, включая лейкемию, острую лимфоцитную лейкемию, острую лимфобластную лейкемию, В-клеточную лимфому, Тклеточную лимфому, лимфому Ноджкина, неходжкинскую лимфому, волосатоклеточную лимфому и лимфому Буркета; опухоли кроветворных органов миелоидного происхождения, включая острую и хроническую миелогенную лейкемии, миелодиспластический синдром и промиелоцитарную лейкемию,опухоли мезенхимального происхождения, включая фибросаркому и рабдомиосаркома; опухоли центральной и периферической нервной системы, включая астроцитому, нейробластому, глиому и шванно-1 010904 му; другие опухоли, включая меланому, семиному, тератокарциному, остеосаркому, ксеродерму пигментную, кератоксантому, фолликулярный рак щитовидной железы и саркому Капоши. Благодаря ключевой роли киназ клеточного цикла, таких как Aurora или cdks, в регуляции пролиферации клеток, указанные производные пиразолохинолинов также применимы в лечении множества пролиферативных заболеваний клеток, таких, как, например, доброкачественная гиперплазия простаты,наследственный аденоматоз, полипоз, нейрофиброматоз, псориаз, пролиферация гладких клеток стенок сосудов, связанная с атеросклерозом, пневмофиброз, артрит, гломерулонефрит и послеоперационный стеноз и рестеноз. Соединения по изобретению могут быть применимы в лечении болезни Альцгеймера, об этом свидетельствует тот факт, что cdk5 участвует в фосфорилировании tau-протеина [J. Biochem.117, 741-749,1995]. Соединения по настоящему изобретению в качестве модуляторов апоптоза могут также быть применимы в лечении раковых заболеваний, вирусных инфекций, в профилактике развития СПИД у ВИЧинфицированных лиц, аутоиммунных заболеваний, нейродегенеративных расстройств. Соединения по изобретению могут быть применимы для ингибирования развития кровеносных сосудов и метастазирования опухоли, а также в лечении отторжения трансплантатов органов и вторичной иммунной болезни. Соединения по изобретению могут также действовать как ингибиторы других протеинкиназ, например, протеинкиназы С в различных изоформах: Met, PAK-4, PAK-5, ZC-1, STLK-2, DDR-2, Bub-1,PLK, Chkl, Chk2, HER2, rafl, MEK1, MAPK, EGF-R, PDGF-R, FGF-R, IGF-R, PI3K, weel киназы, Src, Abl,Akt, MAPK, ILK, MK-2, IKK-2, Cdc7, Nek- и, следовательно, быть эффективными в лечении заболеваний,связанных с другими протеинкиназами. Соединения по изобретению пригодны для лечения и профилактики алопеции, вызванной радиотерапией или химиотерапией. Таким образом, первый вариант осуществления изобретения относится к способу лечения пролиферативных заболеваний клеток, вызванных и/или связанных с измененной протеинкиназной активностью,например активностью Aurora 2 и активностью киназы, зависимой от клеточного цикла, путем введения млекопитающим, нуждающимся в лечении, эффективного количества производного пиразолохиназолина, представленного формулой (Ia) или (Ib)R обозначает водород или необязательно замещенную группу, выбранную из амино, линейного или разветвленного C1-C6 алкила, C3-C10 циклоалкила, циклоалкилалкила, арила, арилалкила, гетероциклила или гетероциклилалкила;X обозначает простую связь или двухвалентный радикал, выбранный из -NR'-, -CONR'-, -NH-CONH-, -O-, -S- или -SO2-, где R' обозначает водород или необязательно замещенную группу, выбранную из линейного или разветвленного C1-C6 алкила, C3-С 6 циклоалкила, циклоалкилалкила, арила, арилалкила,гетероциклила или гетероциклилалкила или R и R' вместе с атомом азота, с которым они связаны, могут образовывать 5-6-членную гетероарильную или гетероциклильную группу, необязательно содержащую один дополнительный гетероатом, выбранный из N, О или S;R1, связанный с любым атомом азота пиразольного цикла согласно формулам (Ia) или (Ib), представляет собой атом водорода или необязательно замещенную группу, выбранную из линейного или разветвленного C1-C6 алкила, С 3-С 6 циклоалкила, арила, арилалкила, гетероциклила или гетероциклилалкила или в формуле (Ib) R1 обозначает двухвалентную группу -(СН 2)n-NH-, связанную с R2, где n обозначает 2 или 3;R2 обозначает группу, выбранную из -NR"R'", -N(OH)R", -OR" или -R", где каждый из R" и R'" независимо обозначает водород или необязательно замещенную группу, выбранную из линейного или разветвленного C1-C6 алкила, C3-C6 циклоалкила или циклоалкилалкила, арила, арилалкила, гетероциклила или гетероциклилалкила или R" и R'" вместе с атомом азота, с которым они связаны, могут образовывать 5-6-членную гетероарильную или гетероциклильную группу, необязательно содержащую один дополнительный гетероатом, выбранный из N, О или S; А обозначает двухвалентную группу, выбранную из -СН 2-, (СН 2)2-, -СН 2-С(СН 3)2-, -С(СН 3)2-СН 2 или -СН=СН-; или его фармацевтически приемлемой соли. Еще один вариант осуществления изобретения относится к способу лечения пролиферативных заболеваний клеток, вызванных и/или связанных с измененной активностью протеинкиназ, подобно актив-2 010904 ности киназы, зависимой от клеточного цикла, путем введения млекопитающим, нуждающимся в лечении, эффективного количества производного пиразолохиназолина, представленного формулой (Ia) или В предпочтительном варианте осуществления вышеописанных способов пролиферативное заболевание клеток выбрано из группы, состоящей из раковых заболеваний, болезни Альцгеймера, вирусных инфекций, аутоиммунных и нейродегенеративных заболеваний. Конкретные виды рака, которые можно лечить, включают карциному, плоскоклеточную карциному, опухоли кроветворной ткани миелодного или лимфоидного происхождения, опухоли мезенхимального происхождения, опухоли центральной и периферической нервной системы, меланому, семиному,тератокарциному, остеосаркому, ксеродерму пигментную, кератоксантому, фолликулярный рак щитовидной железы и саркому Капоши. В еще одном предпочтительном варианте вышеописанного способа пролиферативное заболевание клеток выбирают из группы, состоящей из доброкачественной гиперплазии простаты, наследственного аденоматоза, полипоза, нейрофиброматоза, псориаза, пролиферации гладких клеток стенок сосудов, связанной с атеросклерозом, пневмофиброза, артрита, гломерулонефрита и послеоперационного стеноза и рестеноза. Кроме того, способ по изобретению относится к ингибированию развития кровеносных сосудов и метастазирования опухоли, а также к лечению отторжения трансплантата органов и вторичной иммунной болезни. Способы по изобретению могут также относиться к ингибированию клеточного цикла или ингибированию активности комплексов cdk/циклин. Кроме вышеуказанного, способы по изобретению относятся к лечению и профилактике алопеции,вызванной радиотерапией или химиотерапией. Настоящее изобретение также относится к производным пиразолохиназолинов, представленным формулой (Ia) или (Ib).R обозначает водород или необязательно замещенную группу, выбранную из амино, линейного или разветвленного C1-C6 алкила, С 3-С 10 циклоалкила, циклоалкилалкила, арила, арилалкила, гетероциклила или гетероциклилалкила;X обозначает простую связь или двухвалентный радикал, выбранный из -NR'-, -CONR'-, -NH-CONH-, -O-, -S- или -SO2-, где R' обозначает водород или необязательно замещенную группу, выбранную из линейного или разветвленного C1-C6 алкила, C3-С 6 циклоалкила, циклоалкилалкила, арила, арилалкила,гетероциклила или гетероциклилалкила, или R и R' вместе с атомом азота, с которым они связаны, могут образовывать 5-6-членную гетероарильную или гетероциклильную группу, необязательно содержащую один дополнительный гетероатом, выбранный из N, О или S;R1, связанный с любым атомом азота пиразольного цикла согласно формулам (Ia) или (Ib), представляет собой атом водорода или необязательно замещенную группу, выбранную из линейного или разветвленного C1-C6 алкила, C3-C6 циклоалкила, арила, арилалкила, гетероциклила или гетероциклилалкила,или в формуле (Ib) R1 обозначает двухвалентную группу -(CH2)n-NH-,связанную с R2, где n обозначает 2 или 3;R2 обозначает группу, выбранную из -NR"R'", -N(OH)R", -OR" или -R", где каждый из R" и R'" независимо обозначает водород или необязательно замещенную группу, выбранную из линейного или разветвленного C1-C6 алкила, C3-C6 циклоалкила или циклоалкилалкила, арила, арилалкила, гетероциклила или гетероциклилалкила, или R" и R'" вместе с атомом азота, с которым они связаны, могут образовывать 5-6 членную гетероарильную или гетероциклильную группу, необязательно содержащую один дополнительный гетероатом, выбранный из N, О или S; А обозначает двухвалентную группу, выбранную из -СН 2-, "(СН 2)2-, -СН 2-С(СН 3)2-, -С(СН 3)2-СН 2 или -СН=СН-; или их фармацевтически приемлемым солям. Настоящее изобретение также включает способы синтеза производных пиразолохиназолина, представленных формулами (Ia) или (Ib), которые, если не указано иное, можно для удобства объединить в-3 010904 группы и обозначить как соединения формулы (I). Фармацевтические композиции, содержащие производные пиразолохиназолина формулы (I), также включены в настоящее изобретение. Более полная оценка изобретения и многие его преимущества будут более понятными из следующего ниже подробного описания. Подробное описание изобретения Некоторые гетероциклические соединения известны из уровня техники в качестве ингибиторов протеинкиназ. Например, о 2-карбоксамидопиразолах и 2-уреидопиразолах и их производных сообщают как об ингибиторах протеинкиназ в международных заявках WO 01/12189, WO 01/12188, WO 02/48114 иWO 02/70515. Конденсированные бициклические соединения, включающие пиразольные остатки и обладающие ингибирующей активностью в отношении киназ, также описаны в WO 00/69846, WO 02/12242, а также вWO 03/028720 и в еще неопубликованной заявке на патент США 60/381092 (подана 17 мая 2002 г.), все от имени заявителя. Конденсированные трициклические производные, обладающие ингибирующей активностью в отношении киназ, также описаны в двух рассматриваемых заявках РСТ/ЕР 03/01594 и PCT/US03/04844 (обе с приоритетом от 19 февраля 2002, согласно заявкам, поданным в США 60/357918 и 60/357960, соответственно) и включенных в настоящую заявку в качестве ссылки; ни одна из указанных заявок конкретно не описывает производные, относящиеся к настоящему изобретению. Кроме того, конденсированные полициклические производные пиримидина в качестве ингибиторов протеинкиназ описаны в международных заявках WO 98/58926 и WO 98/28281, поданных от имени Celltech Therapeutics Ltd; но никакие конкретные пиразолохиназолины по настоящему изобретению не приводятся в них в качестве примеров, хотя они включены в общие формулы обеих заявок. В заключение, в WO 96/40142 (поданной от имени Pfizer Inc.) сообщается о пиримидиновых производных с конденсированными гетероциклическими кольцами для лечения гиперпролиферативных заболеваний. Соединения формулы (I) по изобретению могут иметь асимметрические атомы углерода и, следовательно, могут существовать в виде индивидуальных оптических изомеров, в виде рацемических смесей или в виде любых других смесей, в которых содержится преобладающее количество одного из двух оптических изомеров, подразумевается, что все они охватываются объемом настоящего изобретения. Более того, применение в качестве противоопухолевого агента всех возможных изомеров и их смесей как метаболитов, так и фармацевтически приемлемых биопредшественников (которые иначе называются пролекарствами) соединений формулы (I) также охватываются настоящим изобретением. Пролекарства представляют собой любые ковалентно связанные соединения, которые высвобождают активное исходное лекарственное вещество формулы (I) in vivo. В случаях, если соединения могут находиться в таутомерных формах, например, в виде кетоенольных таутомеров, каждая таутомерная форма рассматривается как включенная в изобретение, независимо от того, существует ли она в равновесии с другим таутомером или преимущественно в одной форме. В настоящем описании, если не оговорено иное, под термином линейный или разветвленный C1-C6 алкил подразумевается любая из групп, таких как, например, метил, этил, н-пропил, изопропил, нбутил, изобутил, трет-бутил, втор-бутил, н-пентил, н-гексил и им подобные. Если иное не оговорено, под термином C3-C10 циклоалкил авторы подразумевают циклоалифатическую группу, такую как циклопропил, циклобутил, циклопентил и циклогексил, а также любую мостиковую циклоалкильную группу, содержащую до 10 атомов углерода. Термин арил включает карбоциклические или гетероциклические углеводороды с 1-2 циклическими остатками, или конденсированными, или связанными друг с другом простыми связями, в которых по меньшей мере один из циклов является ароматическим; при наличии любой ароматический гетероциклический углеводород именуется также гетероарильной группой, содержит 5-6-членный цикл с 1-3 гетероатомами, выбранными из N, О или S. Арильными группами по изобретению являются, например, фенил, бифенил, - или -нафтил, дигидронафтил, тиенил, бензотиенил, фурил, бензофуранил, пирролил, имидазолил, пиразолил, тиазолил,изотиазолил, оксазолил, изоксазолил, пиридил, пиразинил, пиримидинил, пиридазинил, индолил, изоиндолил, пуринил, хинолил, изохинолил, дигидрохинолинил, хиноксалинил, бензодиоксолил, инданил, инденил, триазолил и им подобные. Если иное не оговорено, термин гетероциклил включает 5-6-членные насыщенные, частично ненасыщенные или полностью ненасыщенные гетероциклы с 1-3 гетероатомами, выбранными из N, О илиS. Кроме полностью ненасыщенных гетероциклов, ранее отнесенных к ароматическим гетероциклам и охватываемых термином арил, примерами насыщенных или частично ненасыщенных гетероциклов по изобретению являются пиран, пирролидин, пирролин, имидазолин, имидазолидин, пиразолидин, пиразолин, тиазолин, тиазолидин, дигидрофуран, тетрагидрофуран, 1,3-диокосолан, пиперидин, пиперазин,морфолин и им подобные. Из всего вышесказанного специалисту в данной области техники ясно, что любое соединение по-4 010904 изобретению, в котором X представляет собой простую связь, должно рассматриваться, как содержащее группу R, непосредственно связанную с пиримидиновым остатком. Согласно указанным выше значениям заместителей и, если не указано иное, любая из вышеуказанных групп R, R', R1, R" и R'" необязательно может быть замещена в любом из ее свободных положений одной или несколькими группами, например, 1-6 группами, независимо выбранными из галогена, нитро,оксо (=O), циано, азидо, алкила, полифторсодержащего алкила, гидроксиалкила, арила, арилалкила, гетероциклила, гетероциклилалкила, циклоалкила, алкиларила, алкилгетероциклила, гидрокси, алкокси, полифторзамещенной алкокси, арилокси, арилалкилокси, гетероциклилокси, гетероциклилалкилокси, метилендиокси, алкилкарбонилокси, алкилкарбонилоксиалкила, арилкарбонилокси, карбокси, алкоксикарбонила, алкоксикарбонилалкила, арилоксикарбонила, циклоалкилоксикарбонила, амино, аминоалкила,алкиламиноалкила, алкиламиноалкилокси, уреидо, алкиламино, диалкиламино, ариламино, диариламино,формиламино, алкилкарбониламино, арилкарбониламино, гетероциклилкарбониламино, алкоксикарбониламино, алкоксиимино, алкилсульфониламино, арилсульфониламино, формила, алкилкарбонила, арилкарбонила, гетероциклилкарбонила, циклоалкилкарбонила, гетероциклилкарбонила, аминокарбонила,алкиламинокарбонила, диалкиламинокарбонила, ариламинокарбонила, алкилсульфонила, арилсульфонила, гетероциклилсульфонила, аминосульфонила, алкиламиносульфонила, диалкиламиносульфонила,арилтио и алкилтио. В этом отношении под термином атом галогена авторы подразумевают атом фтора, хлора, брома или йода. Используя термин перфторсодержащий алкил, авторы имеют в виду любую из вышеупомянутых линейных или разветвленных C1-C6 алкильных групп, которые замещены более чем одним атомом фтора,например трифторметил, трифторэтил, 1,1,1,3,3,3-гексафторпропил и им подобные. Используя термины алкокси, арилокси, гетероциклилокси и производные от них, например, перфторсодержащая алкоксигруппа авторы имеют в виду любую из вышеупомянутых алкильных, арильных или гетероциклильных групп, связанных с остальной частью молекулы через атом кислорода (-O-). Из всего вышесказанного специалисту в данной области техники ясно, что любую группу, название которой является составным, такую, например, как арилалкил или гетероциклилалкил, следует рассматривать по частям, из которых она образована, например, как алкильную группу, которая дополнительно замещена арилом или гетероциклилом, где алкил, арил или гетероциклил такие, как определено выше. Аналогично, любые из терминов, такие как, например, алкилтио, алкиламино, диалкиламино, алкоксикарбонил, алкоксикарбониламино, гетероциклилкарбонил, гетероциклилкарбониламино, циклоалкилоксикарбонил и им подобные, включают группы, в которых алкильные, алкоксильные, арильные,циклоалкильные и гетероциклильные остатки такие, как определено выше. Фармацевтически приемлемые соли соединений формулы (I) включают аддитивные соли с неорганическими или органическими кислотами, например, с азотной, соляной, бромисто-водородной, серной,перхлорной, фосфорной, уксусной, трифторуксусной, пропионовой, гликолевой, молочной, щавелевой,малоновой, яблочной, малеиновой, винной, лимонной, бензойной, коричной, миндальной, метансульфоновой, изетиновой и салициловой кислотами, а также соли с неорганическими и органическими основаниями, например с гидроксидами, карбонатами или гидрокарбонатами щелочных и щелочно-земельных металлов, особенно натрия, калия, кальция или магния, ациклическими или циклическими аминами,предпочтительно метиламином, этиламином, диэтиламином, триэтиламином, пиперидином и им подобными. Согласно первому варианту осуществления изобретения, относящемуся к соединениям формулы(Ia) или (Ib), предпочтительными производными являются такие, в которых X обозначает группу -NH- иR2 обозначает группу, выбранную из -NHR", -N(OH)R", -OR" или -R", где R" обозначает необязательно замещенную группу, выбранную из С 3-С 6 циклоалкила или циклоалкилалкила, арила, арилалкила, гетероциклила или гетероциклилалкила; и R, R1 и А такие, как определено выше. Предпочтительными также являются соединения формулы (Ia) или (Ib), в которых X обозначает группу -О- и R2 обозначает группу, выбранную из -NHR", -N(OH)R", -OR" или -R", где R" обозначает необязательно замещенную группу, выбранную из C3-С 6 циклоалкила или циклоалкилалкила, арила, арилалкила, гетероциклила или гетероциклилалкила; и R, R1 и А такие, как определено выше. Предпочтительными также являются соединения формулы (Ia) или (Ib), в которых X обозначает группу -S- и R2 обозначает группу, выбранную из NHR", -N(OH)R", -OR" или -R", где R" обозначает необязательно замещенную группу, выбранную из C3-C6 циклоалкила или циклоалкилалкила, арила, арилалкила, гетероциклила или гетероциклилалкила; и R, R1 и А такие, как определено выше. Еще более предпочтительными из вышеуказанного класса соединений (Ia) или (Ib) являются те же производные, в которых А обозначает группу -(СН 2)2-. Согласно еще одному варианту осуществления изобретения, который относится к соединениям формулы (Ia) или (Ib), класс предпочтительных соединений представлен такими производными, в которых X обозначает группу -NH- и R2 обозначает группу -NHR" или -N(OH)R", где R" обозначает атом водорода или линейную или разветвленную C1-C4 алкильную группу; и где A, R и R1 такие, как определено выше.-5 010904 Еще один класс предпочтительных соединений формулы (Ia) или (Ib) по изобретению представлен производными, в которых X обозначает группу -О- и R2 обозначает группу -NHR" или -N(OH)R", где R" обозначает атом водорода или линейную или разветвленную C1-C4 алкильную группу; и где A, R и R1 такие, как определено выше. Еще один класс предпочтительных соединений формулы (Ia) или (Ib) по изобретению представлен производными, в которых X обозначает группу -S- и R2 обозначает группу -NHR" или -N(OH)R", где R" обозначает атом водорода или линейную или разветвленную C1-C4 алкильную группу; и где A, R и R1 такие, как определено выше. Еще один класс предпочтительных соединений формулы (Ib) по изобретению представлен производными, в которых R, X и А такие, как определено выше, и R1 и R2 соединены вместе двухвалентной группой -(CH2)n-NH- таким образом, что в результате образуются Предпочтительными из вышеуказанного класса соединений формулы (Ia) и (Ib) также являются соединения, в которых А обозначает группу, выбранную из -СН 2-С(СН 3)2- или -С(СН 3)2-СН 2-. Согласно изобретению любое конкретное соединение формулы (Ia) или (Ib) может находиться в виде фармацевтически приемлемой соли, см. экспериментальную часть и формулу изобретения. Как было указано ранее, дополнительный объект настоящего изобретения представлен способом получения соединений формулы (I), причем формула которых, если конкретно не указано иное, должна рассматриваться, как включающая производные формулы (Ia) и (Ib). Таким образом, соединения формулы (I) или их фармацевтически приемлемые соли могут быть получены способом, включающим:(1) если А обозначает -(СН 2)2- группу: ст.1) взаимодействие 2-этокси-2-циклогексен-1-она с диэтилоксалатом в присутствии бис(триметилсилил)амида лития [LiN(TMS)2] с получением соединения формулы (II) и его обработку производным гидразина формулы (III) в котором R1 имеет указанные выше значения, в соответствии с рабочими условиями, описанными любой из стадий 2 а, 2b или 2 с. ст.2 а) в присутствии низшего спирта, чтобы получить смесь соединений формулы (IVa) и (IVb) где R1 описан выше, и разделение их смеси на отдельные соединения (IVa) и (IVb); ст.2b) в присутствии уксусной кислоты, чтобы получить соединение формулы (IVa); ст.2 с) алкилирование соединения формулы (IVa), полученного на стадии 2 а или 2b, где R1 обозначает водород, соединением формулы (IVc); где Y обозначает подходящую уходящую группу, такую как мезил, тозил, галоген, чтобы получить смесь соединений формулы (IVa) и (IVb), где R1 такой, как указано выше, и разделение смеси на отдельные соединения (IVa) и (IVb); ст.3) взаимодействие соединения формулы (IVa), полученного на любой из стадий 2 а, 2b или 2 с,или формулы (IVb), полученного на стадии 2 а или 2 с, с ди-трет-бутилацеталем диметилформамида с получением соединения формулы (Va) или (Vb) где R1 описан выше; и взаимодействие соединения формулы (Va) или (Vb) по любой из альтерна-6 010904 тивных стадий 4 а, 4b или 4 с; ст. 4 а) с гуанидином с получением соединения формулы (Ia) или (Ib) где R-X- обозначает амино, R2 обозначает этокси и R1 описан выше; и необязательно их превращение в другие производные формулы (I); ст.4b) с производным гуанидина формулы (VI) где R описан выше, с получением соединения формулы (Ia) или (Ib), где R и R1 такие, как описано выше, X обозначает -NH- и R2 обозначает этокси; и необязательно их превращение в другие производные формулы (I); ст.4 с) с алкилизотиомочевиной формулы (VII) где R описан выше, с получением соединения формулы (Ia) или (Ib), где R и R1 такие, как описано выше, X обозначает -S- и R2 обозначает этокси; и необязательно их превращение в другие производные формулы (I); ст.4d) с метилизомочевиной с получением соединения формулы (Ia) или (Ib), где R1 такой, как описан выше, R представляет собой метил, X обозначает -О- и R2 обозначает этокси; и необязательно их превращение в другие производные формулы (I);(2) если А представляет собой группу -С(СН 3) 2-СН 2-; ст.5) взаимодействие 2-метокси-4,4-диметил-2-циклогексен-1-она с диэтилоксалатом в присутствии[LiN(TMS)2], с получением соединения формулы (VIII) ст.6) взаимодействие соединения формулы (VIII) с производным гидразина формулы (III) в соответствии с одной из предшествующих стадий 2 а или 2b с получением соединения формулы (IXa) или где R1 описан выше; ст. 7) взаимодействие соединения формулы (IXa) или (IXb) с этилформиатом в основных условиях с получением соединения формулы (Ха) или (Xb) ст. 8) взаимодействие соединения формулы (Ха) или (Xb) с гуанидином или с производным гуанидина формулы (VI) с получением соединения формулы (Ia) или (Ib) где R и R1 такие, как описано выше, X обозначает -NH-, и R2 обозначает этокси; и необязательно их превращение в другие производные формулы (I);(3) Если А представляет собой группу -СН 2-С (СН 3)2-: ст. 9) взаимодействие 2-метокси-5,5-диметил-2-циклогексен-1-она с диэтилоксалатом в присутствии гидрида натрия с получением соединения формулы (XI) ст.10) взаимодействие соединения формулы (XI) с производным гидразина формулы (III) в соответствии с одной из предшествующих стадий 2 а или 2b с получением соединения формулы (XIIa) или (XIIb) где R1 описан выше; ст. 11) взаимодействие соединения формулы (XIIa) или (XIIb) с ди-трет-бутилацеталем диметилформамида с получением соединения формулы (XIIIa) или (XIIIb) ст. 12) взаимодействие соединения формулы (XIIIa) или (XIIIb) с гуанидином или производным гуанидина формулы (VI) с получением соединения формулы (Ia) или (Ib) где R и R1 такие, как описано выше, X обозначает -NH- и R2 обозначает этокси; и необязательно их превращение в другие производные формулы (I);(4) когда в формуле (Ib) А обозначает группу -(CH2)2-, -СН 2-С(CH3)2-, группу -С(СН 3)2-СН 2-, R1 непосредственно связан с R2 таким образом, что получается тетрациклическая структура; ст.13) взаимодействие соединения формулы (IV), (IX), (XII), где R1 обозначает водород, полученный на стадиях 2, 6, 10 способа, с трифенилметилхлоридом с получением соединения формулы (XIV) где Tr обозначает тритил (трифенилметил); ст.14) взаимодействие соединения формулы (XIV) с ди-трет-бутилацеталем диметилформамида, как описано на стадии 3, с получением соединения формулы (XV) ст.15) взаимодействие соединения формулы (XV) с соответствующим производным гуанидина формулы (VI), как описано на стадии 4b, с получением соединения формулы (Ia) или (Ib) где R описан выше, А обозначает группу -(СН 2)2-, группу -СН 2-С(СН 3)2-, группу -С(СН 3)2-СН 2-, X обозначает -NH-, R1 обозначает тритил и R2 обозначает этокси; ст.16) выдерживание вышеупомянутого соединения формулы (Ia) или (Ib) в кислой среде с получением соответствующего соединения формулы (Ia) или (Ib), где R1 обозначает водород; ст.17) взаимодействие вышеупомянутого соединения формулы (Ia) или (Ib) с соответствующим алкилирующим агентом формулы (XVI) в присутствии трет-бутилата лития где n обозначает 2 или 3, с получением соединения формулы (Ib) где А, n и R такие, как определено выше; ст.18) выдерживание соединения формулы (Ib) в кислых условиях для превращения третбутоксикарбониламино группы в аминогруппу (снятие защиты) и взаимодействие полученного соединения с карбонатом цезия (Cs2CO3) с получением одного из двух соединений формулы (Ib) где А и R такие, как определено выше, и необязательно их превращение в другие производные формулы (I); (5) если R2 представляет собой объемную группу: ст.19) взаимодействие 2-этокси-2-циклогексенона с ди-трет-бутилацеталем диметилформамида, как описано на стадии 3, с получением соединения формулы (XVII) ст.20) взаимодействие соединения формулы (XVII) с производным формулы (VII), в соответствии со стадией 4 с, с получением соединения формулы (XVIII) где R описан выше, и последующую обработку его в кислых условиях с получением соединения формулы (XIX) ст.21) взаимодействие соединения формулы (XIX) с соединением формулы (XX) где R2 обозначает объемную группу, с получением соединения формулы (XXI) ст.22) взаимодействие соединения формулы (XXI) с производным гидразина формулы (III) согласно стадии 1, способа с получением соединения формулы (I), в которой R и R1 такие, как указано выше, X обозначает -S- и R2 обозначает объемную группу; и необязательно превращение его в другие производные формулы (I). Как указано выше, соединения формулы (I), которые получают по способу, который является объектом изобретения, например, как показано для описанных стадий 4 а, 4b, 4 с, 8, 12, 13, 18 и 22, могут быть удобным образом превращены в другие соединения формулы (I) при использовании хорошо известных условий реакций. В качестве примера соединения формулы (I): ст.23) где R2 обозначает этокси, можно превратить в соединения формулы (Ia) или (Ib), где R2 обозначает аминогруппу, обработкой гидроксидом аммония ст.24) где R2 обозначает этокси, можно превратить в соединения формулы (I), где R2 обозначает группу -NHR", обработкой амином формулы R"-NH2 (XXII) ст.25) где R2 обозначает этокси, можно превратить в соединения формулы (I), где R2 обозначает группу ОН-, кислотным или основным гидролизом ст.26) где R2 обозначает -ОН, можно превратить в соединения формулы (I), где R2 обозначает группу -NR"R"' или -N(OH)R", реакцией с производными формулы (XXIII) или (XXIV) в основных условиях и в присутствии подходящего конденсирующего агента. ст.27) где R обозначает водород и X обозначает -NH-, можно превратить в соединения формулы (I),где R обозначает заместитель отличный от водорода, как указано выше, и X обозначает -CONH-, реакцией с галогенангидридом кислоты, например хлоридом формулы R-COCl (XXV) ст.28) где R обозначает водород и X обозначает -NH-, можно превратить в соединения формулы (I),где R обозначает заместитель отличный от водорода, как указано выше, и X обозначает -NH-CO-NH-,реакцией с изоцианатом формулы R-NCO (XXVI) ст.29) где R обозначает водород и X обозначает -NH-, можно превратить в соединения формулы (I),где R обозначает арил и X обозначает -NH-, сначала превращением аминогруппы в йод реакцией с изоамилнитритом и дийодметаном или йодидом цезия в присутствии йода и Cul и последующим взаимодействием йодпроизводного с ариламином формулы R-NH2 (XXVII) в присутствии ацетата палладия и (2,2'бис(дифенилфосфино-1,1'-бинафталина (BINAP)(I), где R обозначает алкил, циклоалкил, циклоалкилалкил, арилалкил, гетероциклил, гетероциклилалкил и X обозначает -NH-, сначала превращением аминогруппы в йод, как описано на предыдущей стадии 29,и последующим взаимодействием йодпроизводного с алкил-, циклоалкил-, циклоалкилалкил-, арилалкил-, гетероциклил- или гетероциклилалкиламином формулы RNH2 (XXVII), где R такой, как определено выше; ст.30) где R обозначает водород и X обозначает -NH-, можно превратить в соединения формулы (I),где R обозначает арил и X обозначает простую связь, сначала превращением аминогруппы в йод, как на вышеупомянутой стадии 29, и последующим взаимодействием йодпроизводного с арилбороновой кислотой формулы R-B(OH)2 (XXVIII) в присутствии производного палладия ст.31) где R обозначает водород и X обозначает -NH-, можно превратить в соединения формулы (I),где R обозначает алкил или арилметил, реакцией с алкилальдегидом или арилальдегидом формулы RСНО (XXIX) в присутствии цианоборгидрида натрия (NaBH3CN) и уксусной кислоты(I), где R обозначает циклоалкил или гетероциклоалкил, реакцией с циклоалкилкетоном или гетероциклоалкилкетоном в присутствии натрийтриацетоксиборгидрида (NaBH(OAc)3) и трифторуксусной кислоты ст.32) где R такой, как определено выше, например метил, и X обозначает -S-, можно превратить в соединения формулы (I), где R обозначает необязательно замещенную алкильную, циклоалкильную, гетероциклильную, циклоалкилалкильную, арилалкильную или гетероциклилалкильную группу, сначала превращением RS-группы в RSO2-группу в условиях окисления и затем реакцией сульфонильного производного с амином формулы R-NH2 (XXVII), в которой R обозначает необязательно замещенную алкильную, циклоалкильную, гетероциклильную, циклоалкилалкильную, арилалкильную или гетероциклилалкильную группу ст.33) где R такой, как определено выше, например метил, и X обозначает -S-, можно превратить в соединения формулы (I), где R-такой, как определено в формуле (I), и X обозначает -O-, сначала превращением RS-группы в RSO2-группу, как на стадии 32, и затем реакцией сульфонильного производного с соединением формулы R-OH (XXX) ст.33 а) где R обозначает метил и X обозначает -O-, можно превратить в соединения формулы (I),где R такой, как определено в формуле (I), и X обозначает -O-, сначала превращением МеО-группы в НО-, затем реакцией с трифторметансульфорилирующим агентом с получением соответствующего трифторметансульфоната и, наконец, его взаимодействием с соединением формулы R-OH (XXX) ст.33b) где R обозначает метил и X обозначает -O-, можно превратить в соединения формулы (I),где R обозначает необязательно замещенную алкильную, циклоалкильную, гетероциклильную, циклоалкилалкильную, гетероциклилалкильную группу и X обозначает -NH-, сначала превращением МеОгруппы в НО-, затем реакцией с трифторметансульфорилирующим агентом с получением соответствующего трифторметансульфоната и, наконец, взаимодействием последнего с амином формулы R-NH2(XXVII), где R обозначает необязательно замещенную алкильную, циклоалкильную, гетероциклильную,циклоалкилалкильную, арилалкильную или гетероциклилалкильную группу ст.33 с) где R обозначает метил и X обозначает -O-, можно превратить в соединения формулы (I),где R обозначает арил и X обозначает -NH-, сначала превращением МеО-группы в НО-, затем реакцией с трифторметансульфорилирующим агентом с получением соответствующего трифторметансульфоната и,наконец, взаимодействием последнего с амином формулы R-NH2 (XXVII), где R обозначает необязательно замещенную арильную группу, в присутствии ацетата палладия и BINAP; ст.34) где А обозначает группу -(СН 2)2-, можно превратить в соединения формулы (I), где А обозначает группу -СН=СН-, в условиях дегидрирования в присутствии Pd или Pt катализатора. Вышеуказанный способ, в любом из вышеупомянутых вариантов, является аналогом способа, который можно осуществить в соответствии с хорошо известными в данной области техники способами. На стадии 1 способа 2-этокси-2-циклогексен-1-он подвергают взаимодействию с диэтилоксалатом в присутствии LiN(TMS)2 и подходящего растворителя, такого, например, как диоксан, тетрагидрофуран или диэтиловый эфир. На стадии 2 а соединение формулы (II) подвергают взаимодействию с соответствующим производным гидразина формулы (III) в присутствии низшего спирта, такого как метанол, этанол или их смеси. Предпочтительно вышеупомянутую реакцию проводят в этаноле при температуре кипения, чтобы получить смесь обоих соединений (IVa) и (IVb), в которой первое из упомянутых присутствует в значительных количествах. Разделение на индивидуальные вещества (IVa) и (IVb) проводят обычными способами,например препаративной ВЭЖХ. При использовании вместо стадии 2 а, стадии 2b способа, которая состоит во взаимодействии соединения формулы (II) с производным гидразина формулы (III) в присутствии уксусной кислоты, получают индивидуальное соединение формулы (IVa). Реакцию проводят предпочтительно при комнатной температуре. На стадии 2 с способа соединение формулы (IVa), где R1 обозначает водород, подвергают взаимодействию с соответствующим соединением формулы (IVc) в присутствии основания, такого как гидрид натрия, в подходящем растворителе, например тетрагидрофуране, диоксане или диметилформамиде, при температуре от комнатной до 100 С, с получением смеси соединений (IVa) и (IVb), в которой первое из упомянутых присутствует в значительных количествах. Разделение на индивидуальные вещества (IVa) и(IVb) проводят обычными способами, например, препаративной ВЭЖХ. На стадии 3 способа соединение формулы (IVa) или (IVb) подвергают взаимодействию с ди-третбутилацеталем диметилформамида в присутствии подходящего растворителя, такого, например, как диметилформамид, с получением соединения формулы (Va) или (Vb), соответственно. Предпочтительно- 12010904 проводят реакцию при температурах от комнатной до 70 С. Согласно одной из альтернативных стадий 4 а, 4b, 4 с или 4d способа соединение формулы (Va) или(Vb) подвергают взаимодействию с гуанидином, солями гуанидина или его производными, алкилизотиомочевиной или метилизомочевиной с получением соответствующего соединения формулы (Ia) или (Ib) посредством образования пиримидинового цикла. Любую из вышеуказанных реакций осуществляют по общепринятым методикам. Например, реакции с гуанидином или его солями, такими как гидрохлорид, карбонат или нитрат, или с производным гуанидина формулы (VI), как описано для стадий 4 а или 4b, проводят в присутствии растворителя, в качестве которого используют низшие спирты, в нейтральных или основных условиях, предпочтительно в этаноле с этилатом натрия или диазабициклоундеценом (DBU) при температуре кипения; или, альтернативно, в диметилформамиде при температуре от 80 С до температуры кипения в присутствии карбоната калия. Реакцию с алкилизотиомочевиной (VII), согласно стадии 4 с, проводят в присутствии ацетата калия и в подходящем растворителе, таком как диметилформамид, при температуре кипения. Реакцию с метилизомочевиной (ст.4d) проводят в подходящем растворителе, таком как ацетонитрил, и в присутствии основания, такого как карбонат калия, при температуре кипения. Реакции стадий 5 и 6 проводят согласно условиям, описанным для стадий 1, 2 а или 2b, и получают нужные соединения формулы (IXa) или (IXb), соответственно. Стадию 7 способа предпочтительно осуществляют путем взаимодействия производного формулы(IXa) или (IXb) с этилформиатом в основных условиях, предпочтительно в присутствии этилата натрия или гидрида натрия, и подходящего растворителя, например диэтилового эфира, тетрагидрофурана или диоксана, при температуре от комнатной до температуры кипения. Условия реакции на стадии 8 такие же, как условия, ранее описанные для стадий 4 а и 4b. На стадии 9 2-метокси-5,5-диметил-2-циклогексен-1-он подвергают взаимодействию с диэтилоксалатом в присутствии гидрида натрия и в подходящем растворителе, таком как диэтиловый эфир, тетрагидрофуран или диоксан, при температуре кипения. Условия реакций для последующей стадии 10 по существу такие же, как описанные ранее для стадий 2 а или 2b, и условия проведения стадий 11 и 12 соответствуют условиям стадий 3, 4 а и 4b, соответственно. Относительно стадии 13 способа специалисту в данной области техники понятно, что оба соединения формулы (IVa) или (IVb), где R1 обозначает атом водорода, являются таутомерными формами соединения, которое можно легко идентифицировать как соединение формулы (IV). Принимая это во внимание, данное производное подвергают взаимодействию с трифенилметилхлоридом с получением соединения формулы (XIV), в котором любой из двух атомов азота пиразольного цикла алкилирован тритильной(т.е. трифенилметильной) группой. Условия осуществления стадий 14 и 15 способа по существу соответствуют условиям, уже описанным для стадий 3, 4 а и 4b. Согласно стадии 16, тритильную группу соединений формулы (I) удаляют в кислых условиях, например действием трифторуксусной кислоты, и в присутствии подходящего растворителя, такого как дихлорметан, для того, чтобы получить соответствующее соединение формулы (I), где Последующее алкилирование полученного соединения производным формулы (XVI) на стадии 17 способа позволяет селективно алкилировать атом азота пиразольного цикла, который расположен вблизи-COOEt-группы; указанную реакцию можно проводить с трет-бутилатом лития и в подходящем растворителе, таком как диоксан, диэтиловый эфир или тетрагидрофуран. На стадии 18 вышеупомянутое соединение сначала превращают в свободное аминопроизводное,используя общепринятые методы, например, в кислых условиях, предпочтительно действием соляной кислоты, в подходящем растворителе, таком как диоксан, при температуре кипения, и затем подвергают циклизации в тетрациклическое производное в присутствии основания, такого как карбонат цезия(Cs2CO3), и в подходящем растворителе, таком как низший спирт, предпочтительно метанол, при температуре от комнатной до температуры кипения. Условия, используемые на стадиях 19 и 20 способа, по существу соответствуют условиям, уже описанным для стадий 3 и 4 с; последующую обработку кислотой соединения формулы (XVIII), которая дает соединение формулы (XIX), осуществляют предпочтительно водным раствором уксусной кислоты при температуре около 100 С. На стадии 21 соединение формулы (XIX) подвергают взаимодействию с соответствующим производным формулы (XX) в присутствии гидрида натрия и в подходящем растворителе, таком как диэтиловый эфир, тетрагидрофуран или диоксан, при температуре приблизительно от -50 С до комнатной. Условия стадии 22 способа по существу соответствуют условиям стадии 1 способа.- 13010904 Как ранее указано, соединения формулы (I), полученные таким образом, можно легко превратить в некоторые другие соединения формулы (I) по изобретению. Например, соединения формулы (I), содержащие в качестве R2 этоксигруппу или даже алкоксигруппу, можно превратить в целый ряд производных, используя способы, известные в данной области техники, для превращения сложноэфирных групп (-COOR2) в карбоксамиды (-CONH2), N-замещенные карбоксамиды (-CONHR") и карбоновые кислоты (-СООН), например, как описано на стадиях 23, 24 и 25. Условия проведения реакций являются известными в данной области и могут включать, например,при превращении сложноэфирной группы в карбоксамидную группу, реакцию с аммиаком или гидроксидом аммония в подходящем растворителе, таком как низший спирт, диметилформамид или их смеси; предпочтительно реакцию проводят с гидроксидом аммония в смеси метанол/диметилформамид при температуре от около 50 С до около 100 С. Аналогичные условия используют при получении N-замещенных карбоксамидов, где вместо аммиака или гидроксида аммония применяют соответствующие первичные амины. Сложноэфирные группы можно также превратить в производные карбоновых кислот в условиях основного или кислотного гидролиза, хорошо известных в данной области техники. На стадии 26 способа соединения формулы (I), где R2 обозначает карбоксильную группу (-СООН),можно превратить в карбоксамидные производные (-CONR"R"') или [-CON (ОН) R"], где R" и R'" такие,как указано ранее, а также охватывают соединения, где R" и R'" образуют вместе с атомом азота, к которому они присоединены, 5-6-членную гетероарильную или гетероциклильную группу, необязательно содержащую один дополнительный гетероатом, выбранный из N, О или S. Реакцию проводят в присутствии амина формулы (XXIII) или соединения формулы (XXIV), что возможно в отдельных случаях, в основных условиях, предпочтительно с N,N-диизопропил-Nэтиламином или триэтиламином, в подходящем растворителе, таком как дихлорметан, диметилформамид, тетрагидрофуран или диоксан, и в присутствии соответствующего конденсирующего агента, такого как(TBTU); могут также потребоваться каталитические количества гексафторфосфата (бензотриазол-1 илокси)трипирролидинофосфония (РуВОР). Кроме того, соединения формулы (I), где R-NH- обозначает аминогруппу (-NH2), можно легко превратить в соответствующие карбоксамидо (-NHCOR) или уреидо (-NHCONHR) производные, как описано на стадиях 27 или 28 способа, соответственно. Реакцию изоцианатом обычно проводят с гидридом натрия в диметилформамиде, тогда как реакцию с хлорангидридом кислоты можно проводить в подходящем растворителе, таком как пиридин, тетрагидрофуран, этилацетат или диоксан, или в их смеси при комнатной температуре. Соединения формулы (I), где R-NH- обозначает ариламино- или гетероариламиногруппу, можно получить из соответствующих йодпроизводных, которые, в свою очередь, можно получить из соответствующих соединений формулы (I), где R-NH- обозначает аминогруппу, как на стадии 29 способа. Получение йодпроизводных можно проводить в подходящем растворителе, таком как тетрагидрофуран, диэтиловый эфир или диметоксиэтан, при температуре от комнатной до около 70 С, и время реакции составляет от около 8 до около 48 ч. Последующее превращение йодпроизводного можно осуществить в подходящем растворителе, таком как диметилформамид, диметоксиэтан или ацетонитрил, и в присутствии каталитических количеств ацетата палладия, 2,2'-бис(дифенилфосфино)-1,1'-бинафталина (BINAP) и основания, такого как карбонат калия, фосфат калия или карбонат цезия, при температуре от комнатной до 110 С, и время реакции составляет от около 2 до около 24 ч. Соединения формулы (I), где R обозначает арил и X обозначает простую связь, можно получить,как описано на стадии 30, из вышеупомянутого йодопроизводного реакцией с арилбороновыми кислотами формулы (XXVIII) в подходящем растворителе, таком как диметилформамид, дихлорметан, метанол,диметоксиэтан или ацетонитрил, в присутствии трис(дибензилиденацетон)дипалладия(0) или тетракис(трифенилфосфино)палладия [Pd(PPh3)4], необязательно в присутствии фторида цезия, при температуре от комнатной до 100 С. Соединения формулы (I), где RNH- обозначает алкиламино, циклоалкиламино, циклоалкилалкиламино, гетероциклиламино, гетероциклилалкиламино, можно получать из соответствующего йодпроизводного, как описано на стадии 29 а способа. Реакцию можно проводить в подходящем растворителе,таком как диметилформамид, диоксан или ацетонитрил, или без растворителя при температуре от 40 до 120 С, время реакции составляет от 3 до 18 ч. Соединения формулы (I), где R-NH- обозначает аминогруппу, можно также превратить в соответствующие алкиламино- или арилметиламинопроизводные формулы (I), как описано на стадии 31, используя подходящий растворитель или смесь растворителей, например, включая смесь уксусной кислоты,метанола и воды (1:1:1). Соединения формулы (I), где R-NH- обозначает аминогруппу, можно также превратить в соответст- 14010904 вующие циклоалкиламино- или гетероциклоалкиламинопроизводные формулы (I), как описано на стадии 31 а, используя подходящий растворитель, такой как метиленхлорид, ацетонитрил, диметилформамид. Соединения формулы (I), где R-X- обозначает алкилтиогруппу (R-S-), можно превратить в целый ряд соединений формулы (I), где X обозначает -NH-, сначала окислением алкилтио- в алкилсульфонильную группу и затем ее замещением группой R-NH-, как описано на стадии 32. Окисление можно осуществлять оксоном в подходящем растворителе, предпочтительно в диметилформамиде или диметилсульфоксиде, при комнатной температуре; последующее замещение алкилсульфонильной группы соответствующим аминопроизводным проводят предпочтительно в диметилсульфоксиде, диметилформамиде,диметоксиэтане, диоксане, ацетонитриле, N-метилпирролидоне или диглиме при температуре от комнатной до около 100 С. Интересно, что если последнюю стадию проводят в диметилсульфоксиде как подходящем растворителе, растворитель может также действовать как окислитель, способный давать целевые соединения в случаях, если А обозначает группу -СН=СН-. Указанные последние производные затем выделяют из реакционной смеси общепринятыми способами, например хроматографией или препаративной ВЭЖХ. Согласно стадии 33 способа, соединения формулы (I), где X обозначает -O-, можно легко получить взаимодействием сульфонильного производного со спиртовым или фенольным производным формулы(XXX), где R такой, как в формуле (I). Реакцию можно проводить в присутствии основания, такого как карбонат калия или натрия, бутиллитий, амид лития, гидрид натрия или им подобные, в подходящем растворителе, таком как диметилформамид или тетрагидрофуран, и при температуре от комнатной до температуры около 100 С. Альтернативно, согласно стадиям 4d и 33 а, соединения формулы (I), где X обозначает -O-, можно получить взаимодействием соединений формулы (Va) и (Vb) с сульфатом метилизомочевины, используя подходящий растворитель, такой как диоксан, диметилформамид или ацетонитрил, в присутствии основания, такого как карбонат натрия или калия, при температуре от 50 до 100 С. Соединения формулы (I),где X обозначает -О- и R обозначает водород, можно получить взаимодействием соединений формулы(I), где X обозначает -О- и R обозначает метил, с триметилсилилхлоридом в присутствии йодида натрия и в подходящем растворителе, таком как диоксан, тетрагидрофуран или ацетонитрил, при комнатной температуре. Соединения формулы (I), где X обозначает -О- и R обозначает трифторсульфонильную группу, можно получить взаимодействием соединений формулы (I), где X обозначает -О- и R обозначает водород, с трифторметилирующим агентом, таким как ангидрид трифторметансульфоновой кислоты,трифторметансульфонилхлорид и N-фенил-бис(трифторметансульфонимид), необязательно в присутствии основания, такого как триэтиламин или N,N-диизопропил-N-этиламин (DIPEA), в подходящем растворителе, таком как дихлорметан, тетрагидрофуран или диоксан, при температуре от -78 С до комнатной. Соединения формулы (I), где X обозначает -О- и R описан выше, можно получать взаимодействием соединений формулы (I), где X обозначает -О- и R обозначает трифторметансульфонильную группу, со спиртом или фенолом формулы (XXX), где R такой, как в формуле (I), используя подходящий растворитель, такой как диоксан, тетрагидрофуран, диметоксиэтан, ацетонитрил, диметилформамид или диметилсульфоксид, при температуре от комнатной до около 90 С, необязательно в присутствии основания, такого как карбонат калия, трет-бутоксид калия или гидрид натрия. Альтернативно, реакцию можно проводить в подходящем растворителе, таком как толуол, диметилформамид, диметоксиэтан или ацетонитрил, в присутствии ацетата палладия, -BINAP и основания,такого, как фосфат калия (K3PO4) или карбонат калия или цезия (K2CO3 или Cs2CO3) при температуре от 0 до 100 С (ст. 33 с). Соединения формулы (I), где X обозначает -NH- и R обозначает необязательно замещенную алкильную, циклоалкильную, гетероциклильную, циклоалкилалкильную или гетероциклилалкильную группу, можно получать взаимодействием соединений формулы (I), где X обозначает -О- и R обозначает трифторметансульфонильную группу, с амином формулы R-NH2 (XXVII), где R такой, как в формуле (I),используя подходящий растворитель, такой как диоксан, тетрагидрофуран, диметоксиэтан, ацетонитрил,диметилформамид или диметилсульфоксид, в интервале температур от комнатной до 90 С, необязательно в присутствии основания, такого как карбонат калия или триэтиламин. Наконец, любое из вышеуказанных соединений формулы (I), где А представляет собой -СН 2-СН 2 группу, можно подвергать дегидрированию в присутствии палладиевого или платинового катализатора,необязательно на носителе, чтобы получить соответствующее ароматическое производное, в котором А представляет собой -СН=СН-, как описано на стадии 34 способа. См. экспериментальную часть для любого конкретного примера, относящегося к получению соединений формулы (I) по изобретению и их превращению в другие соединения формулы (I). Промежуточные соединения формулы (Va) или (Vb) согласно стадии 3 способа где R1 обозначает атом водорода или необязательно замещенную группу, выбранную из линейного или разветвленного C1-C6 алкила, C3-C6 циклоалкила, арила, арилалкила, гетероциклила или гетероциклилалкила, являются новыми и, следовательно, представляют собой дополнительный объект изобретения. В любом варианте способа получения соединений формулы (I) исходное вещество и любой другой реактант являются известными или легко получаемыми известными способами. Например, 2-этокси-2-циклогексен-1-он представляет собой известное соединение, которое можно легко получить кипячением циклогексан-1,2-диона с этанолом в толуоле в присутствии каталитических количеств п-толуолсульфоновой кислоты (TsOH). Аналогично, 2-метокси-4,4-диметил-2-циклогексен-1-он представляет собой известное соединение,которое можно получить эпоксидированием коммерчески доступного 4,4-диметил-2-циклогексен-1-она и последующей обработкой полученного эпоксида гидроксидом калия в метаноле. Наконец, 2-метокси-5,5-диметил-2-циклогексен-1-он можно получать по следующей схеме из коммерчески доступного 5,5-диметилциклогексан-1,3-дион Соединения формул (III), (VI), (VII), (XVI), (XXII), (XXIII), (XXIV), (XV), (XXVI), (XXVII),(XXVIII), (XXIX) и (XXX) известны или легко получаются известными способами. Например, при получении определенных гуанидинопроизводных формулы (VI), где R обозначает остаток довольно сложной химической структуры, можно придерживаться следующей схемы: Специалисту в данной области понятно из вышеизложенного, что при получении соединений формулы (I) по любому из вышеупомянутых вариантов способа необязательные функциональные группы в исходных веществах или промежуточных соединениях, которые могли бы вызвать нежелательные побочные реакции необходимо правильно защищать, используя общепринятые приемы. Превращение веществ с защитными группами в свободные соединения со снятой защитой можно также осуществлять по известным методикам. Должно быть понятно, что, если соединения формулы (I), полученные по способу, описанному выше, получаются в виде смеси изомеров, их разделение на отдельные изомеры формулы (I) с помощью общепринятых приемов охватывается объемом настоящего изобретения. Общеизвестные приемы для разделения рацематов включают, например, дробную кристаллизацию полученных из них диастереоизомерных солей или препаративную хиральную ВЭЖХ. Кроме того, соединения формулы (I) по изобретению можно также получить, применяя приемы комбинаторной химии, широко известные в данной области техники, например, осуществляя вышеуказанные реакции нескольких интермедиатов последовательным образом и используя условия твердофазного синтеза (SPS).- 16010904 Для общей справки по получению соединений формулы (I) по изобретению с помощью приемов комбинаторной химии см. экспериментальную часть заявки. Следовательно, дополнительным объектом настоящего изобретения является библиотека двух или более соединений формулы (Ia) или (Ib).R обозначает водород или необязательно замещенную группу, выбранную из амино, линейного или разветвленного C1-C6 алкила, C3-C10 циклоалкила, циклоалкилалкила, арила, арилалкила, гетероциклила или гетероциклилалкила;X обозначает простую связь или двухвалентный радикал,выбранный из -NR'-, -CONR'-, -NH-CO-NH-, -O-, -S- или -SO2-, где R' обозначает водород или необязательно замещенную группу, выбранную из линейного или разветвленного C1-C6 алкила, С 3-C6 циклоалкила, циклоалкилалкила, арила, арилалкила, гетероциклила или гетероциклилалкила или R и R' вместе с атомом азота, с которым они связаны, могут образовывать 5-6-членную гетероарильную или гетероциклильную группу, необязательно содержащую один дополнительный гетероатом, выбранный из N,О или S;R1, связанный с любым атомом азота пиразольного цикла, согласно формулам (Ia) или (Ib), представляет собой атом водорода или необязательно замещенную группу, выбранную из линейного или разветвленного C1-C6 алкила, C3-C6 циклоалкила, арила, арилалкила, гетероциклила или гетероциклилалкила, или в формуле (Ib) R1 обозначает двухвалентную группу - (СН 2)n-NH-, связанную с R2, где n обозначает 2 или 3;R2 обозначает группу, выбранную из -NR"R'", -N(OH)R", -OR" или -R", где каждый из R" и R'" независимо обозначает водород или необязательно замещенную группу, выбранную из линейного или разветвленного C1-C6 алкила, C3-C6 циклоалкила или циклоалкилалкила, арила, арилалкила, гетероциклила или гетероциклилалкила, или R" и R'" вместе с атомом азота, с которым они связаны, могут образовывать 5-6-членную гетероарильную или гетероциклильную группу, необязательно содержащую один дополнительный гетероатом, выбранный из N, О или S; А обозначает двухвалентную группу, выбранную из -СН 2-, -(СН 2)2-, -СН 2-С(СН 3)2-, -С(СН 3)2-СН 2 или -СН=СН-; или их фармацевтически приемлемых солей. Фармакология Соединения формулы (I) активны в качестве ингибиторов протеинкиназ и поэтому применимы, например, для ограничения нерегулируемой пролиферации опухолевых клеток. В терапии они могут быть использованы в лечении различных опухолей, таких как опухоли, о которых ранее сообщалось, а также в лечении других пролиферативных заболеваний клеток, таких как псориаз, пролиферация гладких клеток стенок сосудов, связанная с атеросклерозом, послеоперационный стеноз и рестеноз, и в лечении болезни Альцгеймера. Ингибирующую активность предполагаемых ингибиторов комплексов cdk/циклин и эффективность выбранных соединений определяют методом анализа, основанным на применении SPA техники (Amersham Pharmacia Biotech). Анализ состоит в переносе киназой остатка фосфата с радиоактивной меткой на биотинилированный субстрат. Полученному 33 Р-меченному биотинилированному продукту позволяют связываться с SPA гранулами, покрытыми стрептавидином (емкость по биотину 130 пмоль/мг), и испускаемый свет измеряют в сцинтилляционном счетчике. Оценка ингибирования активности комплекса cdk2/циклин А Реакция киназы: В каждую из 96 U-образных лунок планшета помещают 4 мкМ субстрата в house биотинилированном гистоне H1 (SigmaН-5505), 10 мкМ АТФ (0,1 мкКи Р 33-АТФ), 1,1 нМ комплексаCDK2/циклин А, ингибитор в общем объеме буфера 30 мкл (TRIS-HCl 10 мМ рН 7,5, MgCl2 10 мМ, DTT 7,5 мМ + 0,2 мг/мл BSA). После инкубации в течение 60 мин при комнатной температуре реакцию прекращают путем прибавления 100 мкл PBS буфера, содержащего 32 мМ ЭДТУ, 500 мкМ нерадиоактивного АТФ, 0,1% Тритона Х 100 и 10 мг/мл SPA гранул, покрытых стрептавидином. После инкубации в течение 20 мин отбирают по 110 мкл суспензии и переносят в 96-луночные планшеты OPTIPLATE, содержащие 100 мкл 5 М CsCl. Через 4 ч с планшетов считывают показания в течение 2 мин в радиоактивном ридере Packard ТОР-Count. Определение IC50: ингибиторы испытывают при различных концентрациях в интервале от 0,0015 до 10 мкМ. Экспериментальные данные анализируют с помощью компьютерной программы GraphPad Prizm,- 17010904 используя логистическое уравнение с четырьмя параметрами:Y = BOTTOM + (TOP-BOTTOM) / (1+10LOGIC50-X) SLOPE где х обозначает логарифм концентрации ингибитора, у обозначает ответ; у начинается в нижней части и поднимается вверх, образуя сигмоидную кривую. Расчет Ki: Экспериментальный метод: Реакцию проводят в буфере (10 мМ Трис, рН 7,5, 10 мМ MgCl2, 0,2 мг/мл BSA, 7,5 мМ DTT), содержащем 3,7 нМ фермента, гистона и АТФ (постоянное соотношение нерадиоактивный/меченый АТФ 1/3000). Реакцию останавливают действием ЭДТУ и субстрат улавливают на фосфомембране (96-луночные планшеты типа Multiscreen от Millipore). После обильного промывания с планшетов считывают показания на top-счетчике. Проводят контрольное (время равно нулю) для каждой концентрации АТФ и гистона. Планирование эксперимента: Скорости реакции измеряют при четырех концентрациях АТФ, субстрата (гистона) и ингибитора. 80-Точечная матрица концентраций строится на основе соответствующих значений Km для АТФ и субстрата и значений IC50 ингибитора (0,3-, 1-, 3-, 9-кратные значения Km илиIC50). Предварительный эксперимент по протеканию реакций во времени в отсутствие ингибитора и при различных концентрациях АТФ и субстрата позволяет сделать выбор одной конечной временной точки(10 мин) в линейном интервале реакции для эксперимента по определению Ki. Оценка кинетических параметров: Кинетические параметры оценивают с помощью одновременной нелинейной регрессии методом наименьших квадратов, используя [Eq. 1] (конкурентный ингибитор в отношении АТФ, механизм случайного выбора) и полный набор данных (80 точек): где А = [АТФ], В = [Субстрат], I = [ингибитор], Vm = максимальная скорость, Ka, Kb, Ki представляют собой константы диссоциации АТФ, субстрата и ингибитора, соответственно;иобозначают факторы кооперативности между связыванием субстрата и АТФ и связыванием субстрата и ингибитора,соответственно. Кроме того, выбранные соединения характеризуются на наборе ser/thre киназ, строго связанных с клеточным циклом (cdk2/циклин Е, cdk1/циклин B1, cdk5/p25, cdk4/циклин D1), и также для специфичности на MAPK, PKA, EGFR, IGF1-R, Aurora-2 и Cdc 7. Оценка ингибирования активности комплекса cdk2/циклин E Реакция киназы: В каждую из 96 U-образных лунок планшета помещают 10 мкМ субстрата вhouse биотинилированном гистоне H1 (SigmaН-5505), 30 мкМ АТФ (0,3 мкКи Р 33-АТФ), 4 нг комплекса GST-циклин E/CDK2, ингибитор в общем объеме буфера 30 мкл (TRIS-HCl 10 мМ рН 7,5, MgCl2 10 мМ, DTT 7,5 мМ + 0,2 мг/мл BSA). После инкубации в течение 60 мин при комнатной температуре реакцию прекращают путем прибавления 100 мкл PBS буфера, содержащего 32 мМ ЭДТУ, 500 мкМ нерадиоактивного АТФ, 0,1% Тритона Х 100 и 10 мг/мл SPA гранул, покрытых стрептавидином. После инкубации в течение 20 мин отбирают по 110 мкл суспензии и переносят в 96-луночные планшеты OPTIPLATE, содержащие 100 мкл 5 М CsCl. Через 4 ч с планшетов считывают показания в течение 2 мин в радиоактивном ридере Packard TOP-Count. Определение IC50: см. выше. Оценка ингибирования активности комплекса cdk1/циклин В 1 Реакция киназы: В каждую из 96 U-образных лунок планшета помещают 4 мкМ субстрата в house биотинилированном гистоне H1 (SigmaH-5505), 20 мкМ АТФ (0,2 мкКи Р 33-АТФ), 3 нг комплекса циклин B/CDK1, ингибитор в общем объеме буфера 30 мкл (TRIS-HCl 10 мМ рН 7,5, MgCl2 10 мМ, DTT 7,5 мМ + 0,2 мг/мл BSA). После инкубации в течение 20 мин при комнатной температуре, реакцию прекращают путем прибавления 100 мкл PBS + 32 мМ ЭДТУ + 0,1% Тритона Х 100 + 500 мкМ АТФ, содержащего 1 мг SPA гранул. Затем объем 110 мкл переносят в планшеты Optiplate. После инкубации в течение 20 мин для улавливания субстрата прибавляют 100 мкл 5 М CsCl, чтобы дать возможность стратификации гранул к верхней части Optiplate и выдерживают 4 ч до считывания показаний счетчика радиоактивности TOP-Count. Определение IC50: см. выше. Оценка ингибирования активности комплекса cdk5/p2 5 Оценку ингибирования активности cdk5/p25 осуществляют в соответствии со следующим протоколом. Реакция киназы: В каждую из 96 U-образных лунок планшета помещают 10 мкМ субстрата вhouse биотинилированном гистоне H1 (SigmaH-5505), 30 мкМ АТФ (0,3 мкКи Р 33-АТФ), 15 нг комплекса CDK5/p25, ингибитор в общем объеме буфера 30 мкл (TRIS-HCl 10 мМ рН 7,5, MgCl2 10 мМ,DTT 7,5 мМ + 0,2 мг/мл BSA). После инкубации в течение 35 мин при комнатной температуре реакцию прекращают путем прибавления 100 мкл PBS буфера, содержащего 32 мМ ЭДТУ, 500 мкМ нерадиоактивного АТФ, 0,1% Тритона Х 100 и 10 мг/мл SPA гранул, покрытых стрептавидином. После инкубации в- 18010904 течение 20 мин отбирают по 110 мкл суспензии и переносят в 96-луночные планшеты OPTIPLATE, содержащие 100 мкл 5 М CsCl. Через 4 ч с планшетов считывают показания в течение 2 мин в ридере счетчика радиоактивности Packard TOP-Count. Определение IC50: см. выше. Оценка ингибирования активности комплекса cdk4/циклин D1 Реакция киназы: В каждую из 96 U-образных лунок планшета помещают 0,4 мкМ субстрата GCTRb мыши (769-921) ( sc-4112 из Santa Cruz), 10 мкМ АТФ (0,5 мкКи Р 33-АТФ), 100 нг бакуловируса,экспрессированного GST-cdk4/GST-циклин D1, ингибитор в подходящих концентрациях в общем объеме буфера 50 мкл (TRIS-HCl 10 мМ рН 7,5, MgCl2 10 мМ, DTT 7,5 мМ + 0,2 мг/мл BSA). После инкубации в течение 40 мин при 37 С, реакцию прекращают путем прибавления 20 мкл ЭДТУ 120 мМ. Улавливание: 60 мкл переносят из каждой лунки в планшет Multiscreen для того, чтобы сделать возможным связывание субстрата с фосфоцеллюлозным фильтром. Планшеты затем три раза промывают(150 мкл на лунку) PBS, не содержащим Са/Mg и фильтруют в системе для фильтрации Multiscreen. Детектирование: фильтрам дают сушиться при 37 С, затем прибавляют сцинтиллятор (100 мкл на лунку) и меченный 35 Р фрагмент Rb определяют подсчетом радиоактивности в приборе Top-Count. Определение IC50: см. выше. Оценка ингибирования активности MAPK Реакция киназы: В каждую из 96 U-образных лунок планшета помещают 10 мкМ субстрата вhouse биотинилированном MBP (SigmaМ-1891), 15 мкМ АТФ (0,15 мкКи Р 33-АТФ), 30 нг GSTMAPK (Upstate Biothecnology14-173), ингибитор в общем объеме буфера 30 мкл (TRIS-HCl 10 мМ рН 7,5, MgCl2 10 мМ, DTT 7,5 мМ + 0,2 мг/мл BSA). После инкубации в течение 35 мин при комнатной температуре, реакцию прекращают путем прибавления 100 мкл PBS буфера, содержащего 32 мМ ЭДТУ, 500 мкМ нерадиоактивного АТФ, 0,1% Тритона Х 100 и 10 мг/мл SPA гранул, покрытых стрептавидином. После инкубации в течение 20 мин отбирают по 110 мкл суспензии и переносят в 96-луночные планшетыOPTIPLATE, содержащие 100 мкл 5 М CsCl. Через 4 ч с планшетов считывают показания в течение 2 мин в ридере счетчика радиоактивности Packard TOP-Count. Определение IC50: см. выше. Оценка ингибирования активности PKA Реакция киназы: В каждую из 96 U-образных лунок планшета помещают 10 мкМ субстрата вhouse биотинилированном гистоне H1 (SigmaH-5505), 10 мкМ АТФ (0,2 мкКи Р 33-АТФ), 0,45 U РКА (Sigma2645), ингибитор в общем объеме буфера 30 мкл (TRIS-HCl 10 мМ рН 7,5, MgCl2 10 мМ,DTT 7,5 мМ + 0,2 мг/мл BSA). После инкубации в течение 90 мин при комнатной температуре реакцию прекращают путем прибавления 100 мкл PBS буфера, содержащего 32 мМ ЭДТУ, 500 мкМ нерадиоактивного АТФ, 0,1% Тритона Х 100 и 10 мг/мл SPA гранул, покрытых стрептавидином. После инкубации в течение 20 мин отбирают по 110 мкл суспензии и переносят в 96-луночные планшеты OPTIPLATE, содержащие 100 мкл 5 М CsCl. Через 4 ч с планшетов считывают показания в течение 2 мин в ридере счетчика радиоактивности Packard TOP-Count. Определение IC50: см. выше. Оценка ингибирования активности EGFR Реакция киназы: В каждую из 96 U-образных лунок планшета помещают 10 мкМ субстрата вhouse биотинилированном МВР (SigmaМ-1891), 2 мкМ АТФ (0,04 мкКи Р 33-АТФ), 36 нг клеток насекомых, экспрессируемых GST-EGFR, ингибитор в общем объеме буфера 30 мкл (Hepes 50 мМ рН 7,5, MgCl2 3 мМ, DTT 1 мМ, NaVO3 3 мкМ, + 0,2 мг/мл BSA). После инкубации в течение 20 мин при комнатной температуре реакцию прекращают путем прибавления 100 мкл PBS буфера, содержащего 32 мМ ЭДТУ, 500 мкМ нерадиоактивного АТФ, 0,1% Тритона Х 100 и 10 мг/мл SPA гранул, покрытых стрептавидином. После инкубации в течение 20 мин отбирают по 110 мкл суспензии и переносят в 96 луночные планшеты OPTIPLATE, содержащие 100 мкл 5 М CsCl. Через 4 ч с планшетов считывают показания в течение 2 мин в ридере счетчика радиоактивности Packard TOP-Count. Определение IC50: см. выше. Оценка ингибирования активности IGF1-R Оценку ингибирования активности IGF1-R осуществляют в соответствии со следующим протоколом. Активация фермента: IGF1-R должен быть активирован аутофосфорилированием до начала эксперимента. Непосредственно перед анализом концентрированный раствор фермента (694 нМ) инкубируют в течение получаса при 28 С в присутствии 100 мкМ АТФ и затем доводят разбавление до рабочего в указанном буфере. Реакция киназы: В каждую из 96 U-образных лунок планшета помещают 10 мкМ биотинилированного IRS1 пептидного (PRIMM) субстрата, 0-20 мкМ ингибитора, 6 мкМ АТФ, 1 мкКи Р 33-АТФ и 6 нМGST-IGF1-R (предварительно инкубированного в течение 30 мин при комнатной температуре с 60 мкМ нерадиоактивного АТФ) в общем объеме буфера 30 мкл (50 мМ HEPES рН 7,9, 3 мМ MnCl2, 1 мМ DTT, 3 мкМ NaVO3). После инкубации в течение 35 мин при комнатной температуре реакцию останавливают- 19010904 прибавлением 100 мкл PBS буфера, содержащего 32 мМ ЭДТУ, 500 мкМ нерадиоактивного АТФ, 0,1% тритона Х 100 и 10 мг/мл SPA гранул, покрытых стрептавидином. После инкубации в течение 20 мин отбирают по 110 мкл суспензии и переносят в 96-луночные планшеты OPTIPLATE, содержащие 100 мкл 5 М CsCl. Через 4 ч с планшетов считывают показания в течение 2 мин в ридере счетчика радиоактивности Packard TOP-Count. Оценка ингибирования активности Aurora-2 Реакция киназы: В каждую из 96 U-образных лунок планшета помещают 8 мкМ биотинилированного пептида (4 повтора LRRWSLG), 10 мкМ АТФ (0,5 мкКи Р 33-АТФ), 7,5 нг Aurora 2, ингибитор в общем объеме буфера 30 мкл (50 мМ HEPES рН 7,0, 10 мМ MgCl2, 1 мМ DTT, 0,2 мг/мл BSA, 3 мкМ ортованадата). После инкубации в течение 60 мин при комнатной температуре реакцию останавливают добавлением 100 мкл суспензии гранул. Стратификация: В каждую лунку добавляют 100 мкл 5 М CsCl2 и выдерживают в течение 4 ч до подсчета радиоактивности на приборе Top-Count. Определение IC50: см. выше. Оценка ингибирования активности комплекса Cdc7/dbf4 Оценку ингибирования активности комплекса Cdc7/dbf4 осуществляют в соответствии со следующим протоколом. Субстрат Biotin-MCM2 транс-фосфорилирован комплексом Cdc7/Dbf4 в присутствии АТФ, меченной 33-АТФ. Фосфорилированный Biotin-MCM2 субстрат затем улавливается гранулами SPA, на которые нанесен стрептавидин, и степень фосфорилирования оценивают подсчетом -излучения. Оценку ингибирования активности Cdc7/dbf4 осуществляют в 96-луночном планшете в соответствии со следующим протоколом. В каждую лунку планшета прибавляют 10 мкл субстрата (биотинилированный МСМ 2, 6 мкМ конечная концентрация); 10 мкл фермента (Cdc7/Dbf4, 17,9 нМ конечная концентрация); 10 мкл испытываемого соединения (12 увеличивающихся концентраций в интервале от нМ до мкМ с получением кривой зависимости доза-ответ); 10 мкл смеси нерадиоактивного АТФ (2 мкМ конечная концентрация) и радиоактивного АТФ(мольное соотношение радиоактивного и нерадиоактивного АТФ 1/5000) используют затем, чтобы начать реакцию, которая имеет место при 37 С. Субстрат, фермент и АТФ разводят 50 мМ HEPES (рН 7,9), содержащей 15 мМ MgCl2, 2 мМ DTT, 3 мкМ NaVO3, 2 мМ глицерофосфата и 0,2 мг/мл BSA. Растворитель для испытываемых соединений содержит также 10% ДМСО. После инкубации в течение 60 мин реакцию останавливают добавлением в каждую лунку 100 мклPBS (рН 7,4), содержащего 50 мМ ЭДТУ, 1 мМ нерадиоактивного АТФ, 0,1% тритона Х 100 и 10 мг/мл гранул SPA, на которые нанесен стрептавидин. После инкубации в течение 20 мин отбирают 110 мкл суспензии и переносят в 96-луночные планшеты OPTIPLATE, содержащие 100 мкл 5 М CsCl. Через 4 ч с планшетов считывают показания в течение 2 мин в ридере счетчика радиоактивности Packard TOP-Count. Определение IC50: см. выше. Соединения по настоящему изобретению можно вводить или в виде отдельного средства, или, альтернативно, в сочетании с известными методами лечения рака, такими как радиационная терапия или химиотерапия в комбинации с цитостатическими или цитотоксическими агентами, агентами типа антибиотиков, алкилирующими агентами, антиметаболитными агентами, гормональными агентами, иммунологическими агентами, агентами типа интерферона, ингибиторами циклооксигеназы (например, ингибиторами СОХ-2), ингибиторами матричной металлопротеазы, ингибиторами теломеразы, ингибиторами тирозинкиназы, агентами, подавляющими рецепторы факторов роста, анти-HER агентами, анти-EGFR агентами, агентами, препятствующими ангиогенезу (например, ингибиторами ангиогенеза), ингибиторами фарнезилтрансферазы, ингибиторами пути трансдукции ras-raf сигнала, ингибиторами клеточного цикла, другими ингибиторами cdks, тубулин-связывающими агентами, ингибиторами топоизомеразы I,ингибиторами топоизомеразы II и им подобными. При составлении рецептуры в таких комбинированных продуктах используют соединения по изобретению в диапазоне доз, описанном ниже, и другой фармацевтически активный агент в установленном диапазоне доз. Соединения формулы (I) могут быть использованы последовательно в сочетании с известными противораковыми средствами в тех случаях, когда комбинированная рецептура не подходит. Соединения формулы (I) по настоящему изобретению, применимые для введения млекопитающим,например, человеку, можно вводить обычными путями и дозировка зависит от возраста, массы тела и состояния больного и способа введения. Например, приемлемая дозировка для перорального введения соединения формулы (I) может составлять от около 10 до около 500 мг на дозу, которую принимают 1-5 раз в день.- 20010904 Соединения по изобретению можно вводить в разнообразных лекарственных формах, например,перорально в виде таблеток, капсул, таблеток, покрытых сахаром или пленкой, жидких растворов или суспензий; ректально в виде суппозиториев; парентерально, например, внутримышечно или посредством внутривенных и/или интратекальных и/или интраспинальных инъекций или вливаний. Настоящее изобретение также включает фармацевтические композиции, содержащие соединение формулы (I) или его фармацевтически приемлемую соль совместно с фармацевтически приемлемым наполнителем, который может быть носителем или разбавителем. Фармацевтические композиции, содержащие соединения по изобретению, обычно получают следующими ниже общепринятыми методами и вводят в подходящей лекарственной форме. Например, твердые формы для перорального введения могут содержать вместе с активным соединением, разбавители, например лактозу, декстрозу, сахарозу, целлюлозу, кукурузный или картофельный крахмал; вещества, способствующие скольжению, например, диоксид кремния, тальк, стеариновую кислоту, стеарат магния или кальция и/или полиэтиленгликоли; связующие, например, крахмалы, аравийскую камедь, желатин, метилцеллюлозу, карбоксиметилцеллюлозу или поливинилпирролидон; разрыхлители, например, крахмал, альгиновую кислоту, альгинаты, или натрийкрахмалгликолят; вспенивающие и выделяющие пузырьки газа смеси; красители; подслащивающие агенты, увлажнители, такие как лецитин, полисорбаты, лаурилсульфаты и, вообще нетоксичные и фармакологически инертные вещества, используемые в фармацевтических рецептурах. Указанные фармацевтические препараты можно изготавливать известными методами, например смешиванием, гранулированием, таблетированием, способами для нанесения сахарного или пленочного покрытия. Жидкие дисперсии для перорального введения могут быть, например, в виде сиропов, эмульсий и суспензий. Например, сиропы могут содержать в качестве носителя сахарозу или сахарозу с глицерином и/или маннит и сорбит. Суспензии и эмульсии могут содержать в качестве примеров носителей природную камедь, агар,альгинат натрия, пектин, метилцеллюлозу, карбоксиметилцеллюлозу или поливиниловый спирт. Суспензии или растворы для внутримышечных инъекций могут содержать, наряду с активным соединением, фармацевтически приемлемый носитель, например стерильную воду, оливковое масло, этилолеат, гликоли, например, пропиленгликоль, и, если требуется, нужное количество гидрохлорида лидокаина. Растворы для внутривенных инъекций или вливаний могут содержать в качестве носителя стерильную воду или они могут быть в виде стерильных водных изотонических физиологических растворов, что предпочтительно, или они могут содержать пропиленгликоль в качестве носителя. Суппозитории могут содержать вместе с активным компонентом фармацевтически приемлемый носитель, например масло какао, полиэтиленгликоль, полиоксиэтиленовый эфир сорбита и жирной кислоты (сурфактант) или лецитин. Представленные ниже примеры приведены для того, чтобы лучше пояснить настоящее изобретение,никаким образом не ограничивая его. Примеры Получены различные соединения формулы (I), включающие, следовательно, соединения формулы(Ia) и (Ib) по изобретению. Хотя некоторые из них конкретно названы и перечислены в представленной ниже экспериментальной части, большинство удобно идентифицировать в соответствии с системой шифров в таблицах, приведенных в экспериментальной части, вместе с данными анализов. Каждый шифр, который однозначно идентифицирует только одно конкретное соединение формулы(I) состоит из пяти элементов Е-Х-М(С)-D. Шифр В обозначает любой заместитель R согласно формуле (I), соединенный с остальной частью молекулы через линкер X; каждая группа В представлена в виде соответствующей химической формулы в следующей ниже табл. I, в которой также указано положение присоединения к остальной части молекулы Х-М. Шифр X просто обозначает группу X в формуле (I); значения группы X представлены в табл. II, где также указано положение соединения X с остальной частью молекулы М. Шифр С обозначает группу R1, которая соединена с остальной частью молекулы через один из атомов азота пиразольного цикла согласно формуле (I). Каждая группа С представлена в виде соответствующей химической формулы в следующей ниже табл. III, в которой также указано положение присоединения к остальной части молекулы М. Шифр D обозначает группу R2, которая соединена с остальной частью молекулы через карбонильную группу согласно формуле (I). Каждая группа D представлена в виде соответствующей химической формулы в следующей ниже табл. IV, в которой также указано положение присоединения к остальной части молекулы М. И наконец, шифр М относится к центральной части молекулы (I), содержащей карбонильную группу в положении 3. Из всего вышеизложенного специалисту понятно, что М замещена группами -Х(шифр X), R1 (шифр С) и R2 (шифр D), что описано в формуле (I); каждая группа М представлена в виде- 21010904 соответствующей химической формулы в табл. V, где также указаны положения других заместителей. Таким образом, система шифров, используемая теперь для некоторых соединений формулы (I), может быть кратко изложена следующим образом: Просто как пример, в котором не подразумевается ограничение объема настоящего изобретения,рассмотрим соединение B66-X03-M00(CO1)-D01 (см. пример 36), которое представляет собой производное пиразолохиназолина формулы (Ia), где центральная часть представляет собой остаток М 00 в табл. V,R обозначает группу формулы В 66 в табл. I, X обозначает двухвалентную группу Х 03 в табл. II, R1 обозначает группу C01 в табл. III и R2 обозначает группу D01 в табл. IV, имеющее следующую структуру: Из всего вышеизложенного специалисту понятно, что когда R1 и R2 связаны вместе согласно формуле (Ib), этот дополнительный цикл уже включен в структуру остатка М и, следовательно, шифры С и D опускаются.
МПК / Метки
МПК: A61P 35/00, C07D 487/14, C07D 487/04, A61K 31/519
Метки: применение, пиразолохиназолина, киназ, ингибиторов, способ, производные, качестве, получения
Код ссылки
<a href="https://eas.patents.su/30-10904-proizvodnye-pirazolohinazolina-sposob-polucheniya-i-primenenie-v-kachestve-ingibitorov-kinaz.html" rel="bookmark" title="База патентов Евразийского Союза">Производные пиразолохиназолина: способ получения и применение в качестве ингибиторов киназ</a>
Предыдущий патент: Фосфолипазы, нуклеиновые кислоты, кодирующие их, и способы их получения и применения
Следующий патент: Сопряжённые гетероциклические соединения
Случайный патент: Способ индексирования подземного участка с целью получения геологической информации












