Оксадиазолзамещенные производные индазола для применения в качестве агонистов сфингозин 1-фосфата (s1p)
Номер патента: 16443
Опубликовано: 30.05.2012
Авторы: Гиблин Джерард Мартин Пол, Ахмед Махмуд, Майатт Джэймс, Риверс Дин Энрю, Нортон Дэвид
Формула / Реферат
1. Соединение формулы (I) или его соли
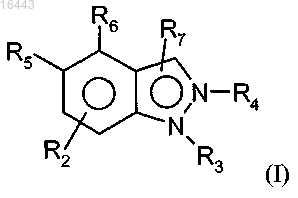
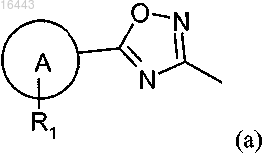
где один из R5 и R6 представляет собой водород или R2 и другой представляет собой (а)
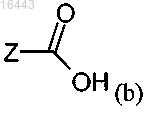
один из R3 и R4 представляет собой (b)
А представляет собой тиофен, пиридил или фенил;
R1 представляет собой два заместителя, независимо выбранных из хлора, брома, изопропокси, пропокси, метокси, 1-метилпропокси, циано, трифторметила, трифторметокси, циклогексила, пиперидина, пирролидинила, этила, 2-метилпропила, фенила и циклопентокси; и
R2 представляет собой водород; и
R7 представляет собой водород; и
Z представляет собой этилен или пропилен, каждый из которых необязательно замещен гемдиметилом.
2. Соединение формулы (IA) или его соли по п.1
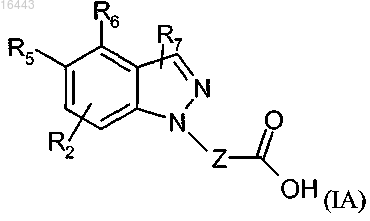
где R1, R2, R5, R6, R7 и Z определены в п.1.
3. Соединение формулы (IB) или его соли по п.1
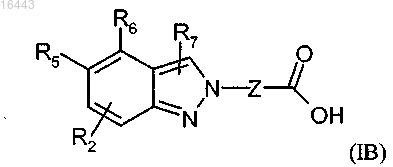
где R1, R2, R5, R6, R7 и Z определены в п.1.
4. Соединение по п.1, выбранное из
3-[5-(5-{3-хлор-4-[(1-метилэтил)окси]фенил}-1,2,4-оксадиазол-3-ил)-1H-индазол-1-ил]пропановой кислоты;
3-(5-{5-[3-хлор-4-(этилокси)фенил]-1,2,4-оксадиазол-3-ил}-1H-индазол-1-ил)пропановой кислоты;
3-[5-(5-{3-циано-4-[(1-метилэтил)окси]фенил}-1,2,4-оксадиазол-3-ил)-1H-индазол-1-ил]пропановой кислоты;
4-[5-(5-{3-циано-4-[(1-метилэтил)окси]фенил}-1,2,4-оксадиазол-3-ил)-1Н-индазол-1-ил]бутановой кислоты;
3-(5-{5-[4-[(1-метилэтил)окси]-3-(трифторметил)фенил]-1,2,4-оксадиазол-3-ил}-1Н-индазол-1-ил)пропановой кислоты;
4-[4-(5-{3-хлор-4-[(1-метилэтил)окси]фенил}-1,2,4-оксадиазол-3-ил)-1H-индазол-1-ил]бутановой кислоты;
4-[4-(5-{3-хлор-4-[(1-метилэтил)окси]фенил}-1,2,4-оксадиазол-3-ил)-1H-индазол-1-ил]бутановой кислоты;
3-[4-(5-{3-хлор-4-[(1-метилэтил)окси]фенил}-1,2,4-оксадиазол-3-ил)-1H-индазол-1-ил]пропановой кислоты;
3-(5-{5-[3-хлор-4-(пропилокси)фенил]-1,2,4-оксадиазол-3-ил}-1H-индазол-1-ил)пропановой кислоты;
3-[5-(5-{3-хлор-4-[(трифторметил)окси]фенил}-1,2,4-оксадиазол-3-ил)-1H-индазол-1-ил]пропановой кислоты;
3-(5-{5-[4-циклогексил-3-(трифторметил)фенил]-1,2,4-оксадиазол-3-ил}-1H-индазол-1-ил)пропановой кислоты;
3-(5-{5-[4-(метилокси)-3-(трифторметил)фенил]-1,2,4-оксадиазол-3-ил}-1H-индазол-1-ил)пропановой кислоты;
[5-(5-{3-циано-4-[(1-метилэтил)окси]фенил}-1,2,4-оксадиазол-3-ил)-1H-индазол-1-ил]уксусной кислоты;
3-(5-{5-[3-хлор-4-(метилокси)фенил]-1,2,4-оксадиазол-3-ил}-1H-индазол-1-ил)пропановой кислоты;
3-(5-{5-[3-этил-4-(1-пиперидинил)фенил]-1,2,4-оксадиазол-3-ил}-1H-индазол-1-ил)пропановой кислоты;
3-{5-[5-(4-циклогексил-3-этилфенил)-1,2,4-оксадиазол-3-ил]-1H-индазол-1-ил}пропановой кислоты;
3-(5-{5-[3-циано-4-(2-метилпропил)фенил]-1,2,4-оксадиазол-3-ил}-1H-индазол-1-ил)пропановой кислоты;
3-[5-(5-{3-бром-4-[(1-метилэтил)окси]фенил}-1,2,4-оксадиазол-3-ил)-1H-индазол-1-ил]пропановой кислоты;
3-(5-{5-[3-хлор-4-(2-метилпропил)фенил]-1,2,4-оксадиазол-3-ил}-1H-индазол-1-ил)пропановой кислоты;
4-(5-{5-[4-[(1-метилэтил)окси]-3-(трифторметил)фенил]-1,2,4-оксадиазол-3-ил}-1H-индазол-1-ил)бутановой кислоты;
3-{5-[5-(2-циано-4-бифенилил)-1,2,4-оксадиазол-3-ил]-1H-индазол-1-ил}пропановой кислоты;
3-(5-{5-[3-хлор-4-(1-пирролидинил)фенил]-1,2,4-оксадиазол-3-ил}-1H-индазол-1-ил)пропановой кислоты;
гидрохлорида 4-[5-(5-{5-хлор-6-[(1-метилэтил)окси]-3-пиридинил}-1,2,4-оксадиазол-3-ил)-1H-индазол-1-ил]бутановой кислоты;
гидрохлорида 4-[5-(5-{5-хлор-6-[(1-метилэтил)окси]-3-пиридинил}-1,2,4-оксадиазол-3-ил)-2H-индазол-2-ил]бутановой кислоты;
4-(5-{5-[2-(трифторметил)-4-бифенилил]-1,2,4-оксадиазол-4-ил}-1H-индазол-1-ил)бутановой кислоты;
4-(5-{5-[2-(трифторметил)-4-бифенилил]-1,2,4-оксадиазол-4-ил}-2H-индазол-2-ил)бутановой кислоты;
3-[4-(5-{3-циано-4-[(1-метилэтил)окси]фенил}-1,2,4-оксадиазол-3-ил)-1H-индазол-1-ил]пропановой кислоты;
3-[4-(5-{3-хлор-4-[(1-метилэтил)окси]фенил}-1,2,4-оксадиазол-3-ил)-2H-индазол-2-ил]пропановой кислоты;
3-[4-(5-{3-циано-4-[(1-метилэтил)окси]фенил}-1,2,4-оксадиазол-3-ил)-2H-индазол-2-ил]пропановой кислоты;
4-[4-(5-{3-циано-4-[(1-метилэтил)окси]фенил}-1,2,4-оксадиазол-3-ил)-1H-индазол-1-ил]бутановой кислоты;
4-(4-{5-[3-этил-4-(1-пиперидинил)фенил]-1,2,4-оксадиазол-3-ил}-1H-индазол-1-ил)бутановой кислоты;
4-(4-{5-[2-(трифторметил)-4-бифенилил]-1,2,4-оксадиазол-3-ил}-1H-индазол-1-ил)бутановой кислоты;
4-[4-(5-{3-хлор-4-[(трифторметил)окси]фенил}-1,2,4-оксадиазол-3-ил)-1H-индазол-1-ил]бутановой кислоты;
3-(4-{5-[4-[(1-метилэтил)окси]-3-(трифторметил)фенил]-1,2,4-оксадиазол-3-ил}-1H-индазол-1-ил)пропановой кислоты;
4-[4-(5-{5-хлор-6-[(1-метилэтил)окси]-3-пиридинил}-1,2,4-оксадиазол-3-ил)-1H-индазол-1-ил]бутановой кислоты;
4-(4-{5-[4-фенил-5-(трифторметил)-2-тиенил]-1,2,4-оксадиазол-3-ил}-1H-индазол-1-ил)бутановой кислоты;
4-[4-(5-{3-хлор-4-[(1-метилэтил)окси]фенил}-1,2,4-оксадиазол-3-ил)-2H-индазол-2-ил]бутановой кислоты;
натриевой соли 3-{5-[5-(3-циано-4-{[(1S)-1-метилпропил]окси}фенил)-1,2,4-оксадиазол-3-ил]-1H-индазол-1-ил}пропановой кислоты;
натриевой соли 3-{5-[5-(3-циано-4-{[(1R)-1-метилпропил]окси}фенил)-1,2,4-оксадиазол-3-ил]-1H-индазол-1-ил}пропановой кислоты;
3-(5-{5-[3-циано-4-(циклопентилокси)фенил]-1,2,4-оксадиазол-3-ил}-1H-индазол-1-ил)пропановой кислоты;
4-[5-(5-{3-хлор-4-[(1-метилэтил)окси]фенил}-1,2,4-оксадиазол-3-ил)-1H-индазол-1-ил]бутановой кислоты;
4-(5-{5-[4-фенил-5-(трифторметил)-2-тиенил]-1,2,4-оксадиазол-3-ил}-1H-индазол-1-ил)бутановой кислоты;
4-[5-(5-{3-[циано-4-[(1-метилэтил)окси]фенил}-1,2,4-оксадиазол-3-ил)-2H-индазол-2-ил]бутановой кислоты;
3-[5-(5-{3-хлор-4-[(1-метилэтил)окси]фенил}-1,2,4-оксадиазол-3-ил)-1H-индазол-1-ил]-2,2-диметилпропановой кислоты;
3-[5-(5-{3-хлор-4-[(1-метилэтил)окси]фенил}-1,2,4-оксадиазол-3-ил)-2H-индазол-2-ил]-2,2-диметилпропановой кислоты;
3-[4-(5-{3-хлор-4-[(1-метилэтил)окси]фенил}-1,2,4-оксадиазол-3-ил)-1H-индазол-1-ил]-2,2-диметилпропановой кислоты;
3-[4-(5-{5-хлор-6-[(1-метилэтил)окси]-3-пиридинил}-1,2,4-оксадиазол-3-ил)-1H-индазол-1-ил]-2,2-диметилпропановой кислоты;
3-[5-(5-{3-циано-4-[(1-метилэтил)окси]фенил}-1,2,4-оксадиазол-3-ил)-1H-индазол-1-ил]-2,2-диметилпропановой кислоты;
4-[5-(5-{3-циано-4-[(1-метилэтил)окси]фенил}-1,2,4-оксадиазол-3-ил)-1H-индазол-1-ил]-2,2-диметилбутановой кислоты;
3-[4-(5-{3-циано-4-[(1-метилэтил)окси]фенил}-1,2,4-оксадиазол-3-ил)-1H-индазол-1-ил]-2,2-диметилпропановой кислоты;
3-[5-(5-{5-хлор-6-[(1-метилэтил)окси]-3-пиридинил}-1,2,4-оксадиазол-3-ил)-1H-индазол-1-ил]-2,2-диметил-пропановой кислоты;
4-[4-(5-{3-циано-4-[(1-метилэтил)окси]фенил}-1,2,4-оксадиазол-3-ил)-1H-индазол-1-ил]-2,2-диметилбутановой кислоты;
4-[4-(5-{5-хлор-6-[(1-метилэтил)окси]-3-пиридинил}-1,2,4-оксадиазол-3-ил)-1H-индазол-1-ил]-2,2-диметилбутановой кислоты
или их солей.
5. Применение соединения по любому из пп.1-4 для лечения рассеянного склероза.
6. Фармацевтическая композиция, содержащая соединение по любому из пп.1-4.
Текст
ОКСАДИАЗОЛЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ ИНДАЗОЛА ДЛЯ ПРИМЕНЕНИЯ В КАЧЕСТВЕ АГОНИСТОВ СФИНГОЗИН 1-ФОСФАТА (S1P) Настоящее изобретение относится к соединениям формулы (I) или их солям Ахмед Махмуд (SG), Гиблин Джерард Мартин Пол, Майатт Джэймс, Нортон Дэвид (GB), Риверс Дин Энрю (SG) Медведев В.Н. (RU) обладающим фармакологической активностью, способам их получения, содержащим их фармацевтическим композициям и к их применению при лечении различных расстройств,опосредованных S1P1 рецепторами.(71)(73) Заявитель и патентовладелец: ГЛЭКСО ГРУП ЛИМИТЕД (GB) 016443 Настоящее изобретение относится к новым производным оксадиазола, обладающим фармакологической активностью, способам их получения, фармацевтическим композициям, содержащим их, и к их применению при лечении различных расстройств. Сфингозин 1-фосфат (S1P) представляет собой биоактивный липидный медиатор, образованный фосфорилированием сфингозина с помощью сфингозинкиназ и высокие уровни которого обнаружены в крови. S1P продуцируется и секретирует большим числом клеточных типов, включая клеточные типы гематопоэтической природы, такие как тромбоциты и тучные клетки (Okamoto et al. 1998, J. Biol. Chem. 273(42):27104; Sanchez и Hla. 2004, J. Cell. Biochem. 92:913). SIP обладает широким спектром биологической активности, включая регулирование клеточной пролиферации, дифференциацию, подвижность,васкуляризицию и активацию клеток воспаления и тромбоцитов (Pyne and Pyne, 2000, Biochem. J. 349:385). Было описано пять подтипов SlP-чувствительных рецепторов, S1P1 (Edg-1), S1P2 (Edg-5), S1P3(Edg-3), S1P4 (Edg-6) и S1P5 (Edg-8), образующих часть семейства рецепторов G-белок связанного эндотелиального гена дифференцировки (Chun et al. 2002, Pharmacological Reviews. 54:265, Sanchez and Hla,2004, J. Cellular. Biochemistry, 92:913). Эти 5 рецепторов демонстрируют различную экспрессию мРНК,широко экспрессируя S1P1-3, экспрессируя S1P4 в лимфоидных и гематопоэтических тканях, а S1P5,главным образом, в головном мозге и в меньшей степени в селезенке. Их сигналы через различные подмножества G-белков приводят к различным биологическим реакциям (Kluk and Hla, 2002, Biochem. etBiophysica Acta. 1582:72, Sanchez and Hla, 2004, J. Cellular. Biochem. 92:913). Предполагаемая роль рецептора S1P1 включает транспорт лимфоцитов, индукцию/супрессию цитокинов и эффекты на эндотелиальные клетки (Rosen и Goetzl, 2005, Nat. Rev. Immunol. 5:560). Агонисты рецептора S1P1 использовали в ряде аутоиммунных моделей и моделях трансплантации животных,включая модели экспериментального аутоиммунного энцефаломиелита (ЕАЕ) MS, для снижения тяжести вызванного заболевания (Brinkman et al. 2003, JBC. 277:21453; Fujino et al. 2003, J. Pharmacol. Exp.Ther. 305:70; Webb et al. 2004, J. Neuroimmunol. 153:108; Rausch et al. 2004, J. Magn Reson Imaging. 20:16). Как сообщалось, эта активность была опосредована эффектом агониста S1P1 на циркуляцию лимфоцитов в лимфатической системе. Обработка агонистами S1P1 приводила к депонированию лимфоцитов во вторичных лимфоидных органах, таких как лимфоузлы, включая модель обратимой периферической лимфопении у животных (Chiba et al. 1998, J. Immunology. 160:5037, Forrest et al. 2004, J. Pharmacol. Exp.Ther. 309:758; Sanna et al. 2004, JBC. 279:13839). Опубликованные данные в отношении агонистов предполагают, что обработка соединениями приводила к потери рецептора S1P1 на клеточной поверхности за счет интернализации (Graler and Goetzl, 2004, FASEB. J. 18:551; Matloubian et al. 2004, Nature. 427:355; Joet al. 2005, Chem. Biol. 12:703) и такое снижение рецепторов S1P1 на иммунных клетках способствовало сокращению транспорта Т-клеток из лимфоузлов обратно в кровяное русло. Делеция гена S1P1 вызывала смерть эмбриона. Эксперименты по изучению роли рецептора S1P1 в миграции и транспорте лимфоцитов включали адоптивный перенос меченых Т-клеток с дефицитом S1P1 у облученных мышей дикого типа. Был отмечен ослабленный выход клеток из вторичных лимфоидных органов (Matloubian et al. 2004, Nature. 427:355).S1P1 также приписывают роль в модуляции соединений эндотелиальных клеток (Allende et al. 2003,102:3665, Blood Singelton et al. 2005, FASEB. J. 19:1646). Что касается эндотелиальной активности, то известно, что агонисты S1P1 обладают эффектом на выделенные лимфоузлы, что может способствовать модулированию иммунного нарушения. Агонисты S1P1 вызывают закрытие эндотелиальных стромальных "ворот" лимфатических синусов, дренирующих лимфоузлы, и предотвращают выход лимфоцитов(Wei at al. 2005, Nat. Immunology. 6:1228). Было показано, что иммуносупрессивное соединение FTY720 (JP11080026-A) снижает циркуляцию лимфоцитов у животных и человека, обладает модулирующей заболевание активностью на модели иммунного нарушения животных и снижает уровень ремиссии при рецидивирующе-ремиттирующем рассеянном склерозе (Brinkman et al. 2002, JBC. 277:21453, Mandala et al. 2002, Science. 296:346, Fujino et al. 2003, J. Pharmacology and Experimental Therapeutics. 305:45658, Brinkman et al. 2004, American. J.Transplantation. 4:1019, Webb et al. 2004, J. Neuroimmunology. 153:108, Morris et al. 2005, Eur. J. Immunol. 35:3570, Chiba, 2005, Pharmacology and Therapeutics. 108:308, Kahan et al. 2003, Transplantation. 76:1079,Kappos et al. 2006, New Eng. J. Medicine. 335:1124). Это соединение является пролекарством, которое фосфорилировано in vivo сфингозинкиназой с образованием молекулы, которая обладает активностью агониста в отношении рецептора S1P1, S1P3, S1P4 и S1P5. Клинические исследования показали, что введение FTY720 приводит к брадикардии в течение первых 24 ч введения (Kappos et al. 2006, New Eng. J.Medicine. 335:1124). Брадикардия, как полагают, вызвана агонизмом в отношении рецептора S1P3, на основании ряда клеточных экспериментов и экспериментов на животных. К этим экспериментам относится использование животных с "нокаутом" S1P3, у которых в отличие от мышей дикого типа, отсутствует брадикардия после введения FTY720, и использование соединений, селективных в отношении S1P1(Hale et al. 2004, BioorganicMedicinal Chemistry Letters. 14:3501, Sanna et al. 2004, JBC. 279:13839,Koyrakh et al. 2005, American J. Transplantation. 5:529). В следующих патентных заявках описаны производные оксадиазола в качестве агонистов S1P1:-1 016443 В следующей патентной заявке описаны производные индол-оксадиазола в качестве противопикорнавирусных средств: WO 96/009822. В следующих патентных заявках описаны производные индолкарбоновой кислоты в качестве антагонистов рецептора лейкотриена, пестицидов и агрохимических фунгицидов соответственно: WO 06/090817, ЕР 0439785 и DE 3939238. В международной заявке WO 06/001463 описаны различные соединения в качестве агонистов S1P1 рецептора. В международной патентной заявке РСТ/ЕР 2007/064185 описаны соединения индол-оксадиазола в качестве агонистов S1P1 рецептора. В настоящее время был обнаружен структурно новый класс соединений, который относится к агонистам S1P1 рецептора. Таким образом, настоящее изобретение относится к соединениям формулы (I) или их солям где один из R5 и R6 представляет собой водород или R2 и другой представляет собой (а) А представляет собой фенил или 5- или 6-членное гетероарильное кольцо;R1 представляет собой водород или заместители в количестве до трех, независимо выбранные из галогена, C(1-4)алкила, С(1-4)алкокси, С(5-7)циклоалкила, С(5-7)циклоалкокси, трифторметокси, дифторметокси,трифторметила, циано, фенила, 5- или 6-членных гетероарильных колец, пиперидинила и пирролидинила;R2 представляет собой водород или заместители в количестве до трех, независимо выбранные из галогена, C(1-4)алкила, С(1-4)алкокси, трифторметокси, дифторметокси, трифторметила и циано;R7 представляет собой водород или галоген;Z представляет собой С(1-4)алкил, может быть необязательно в одном месте замещен N или О и может быть необязательно замещен на углероде заместителями в количестве до четырех, независимо выбранными из галогена, метила и гидроксила, при условии, что ни один из атомов углерода не замещен двумя гидроксильными группами. Таким образом, настоящее изобретение относится к соединениям формулы (IA) или их солям где A, R1, R2, R5, R6, R7 и Z являются такими, как определено для формулы (I). Соответственно, настоящее изобретение относится к соединениям формулы (IB) или их солям где A, R1, R2, R5, R6, R7 и Z являются такими, как определено для формулы (I). Соответственно, настоящее изобретение относится к соединениям формулы (II) или их фармацевтически приемлемым производным где один из R5 и R6 представляет собой водород или R2 и другой представляет собой (а)-2 016443 один из R3 и R4 представляет собой водород, а другой представляет собой (b) А представляет собой фенил или 5- или 6-членное гетероарильное кольцо;R1 представляет собой водород или заместители в количестве до трех, независимо выбранные из галогена, С(1-4)алкила, С(1-4)алкокси, трифторметокси, дифторметокси, трифторметила, циано и необязательно замещенного фенила или необязательно замещенных 5- или 6-членных гетероарильных колец;R2 представляет собой водород или заместители в количестве до трех, независимо выбранные из галогена, С(1-4)алкила, С(1-4)алкокси, трифторметокси, дифторметокси, трифторметила и циано;R7 представляет собой водород или галоген;Z представляет собой С(1-4)алкил, который необязательно замещен N или О и необязательно замещен галогеном или метилом. Когда R1 представляет собой фенил или 5- или 6-членное гетероарильное кольцо, он может быть замещен заместителями в количестве до трех, выбранными из галогена, С(1-4)алкила, C(1-4)алкокси,трифторметокси, дифторметокси, трифторметила и циано. Понятно, что для соединений формулы (II), где R4 представляет собой (b), R3 не будет присутствовать и связи в ароматических кольцах будут расположены так, как показано в формуле (IB), представленной выше. Термин "алкил", как группа или часть группы, например алкокси или гидроксиалкил, относится к алкильной группе с прямой или разветвленной цепью во всех изомерных формах. Термин "C(1-4) алкил" относится к алкильной группе, как определено выше, содержащей по меньшей мере 1 и самое большее 4 атома углерода. Примеры таких алкильных групп включают метил, этил, пропил, изопропил, н-бутил,изобутил, втор-бутил, трет-бутил, 1-метилпропил или 2-метилпропил. Примеры таких алкоксигрупп включают метокси, этокси, пропокси, изопропокси, бутокси, изобутокси, втор-бутокси, трет-бутокси или 1-метилпропокси. Подходящие С(5-7)циклоалкильные группы включают циклопентил, циклогексил и циклогептил. Подходящие С(5-7)циклоалкилоксигруппы включают циклопентокси, циклогексилокси и циклогептокси. Используемый в настоящем документе термин "галоген" относится к фтору (F), хлору (Cl), брому(Br) или йоду (I), и термин "гало" относится к галогену: фтор (-F), хлор (-Cl), бром (-Br) и йод (-I). Термин "гетероарил" обозначает ненасыщенное кольцо, содержащее один или несколько гетероатомов. Когда термин "гетероарил" обозначает 5-членную группу, она содержит гетероатом, выбранный из О, N или S, и может необязательно содержать дополнительно от 1 до 3 атомов азота. Когда гетероарил обозначает 6-членную группу, она содержит от 1 до 3 атомов азота. Примеры таких 5- или 6-членных гетероарильных колец включают пирролил, триазолил, тиадиазолил, тетразолил, имидазолил, пиразолил,изотиазолил, тиазолил, изоксазолил, оксазолил, оксадиазолил, фуразанил, фуранил, тиенил, пиридил,пиримидинил, пиразинил, пиридазинил и триазинил. Один из вариантов осуществления изобретения представляет собой соединение формулы (I), где А представляет собой тиофен, пиридил или фенил; иR1 представляет собой два заместителя, независимо выбранных из хлора, брома, изопропокси, пропокси, метокси, 1-метилпропокси, циано, трифторметила, трифторметокси, циклогексила, пиперидина,пирролидинила, этила, 2-метилпропила, фенила и циклопентокси; иZ представляет собой этилен или пропилен, каждый из которых необязательно замещен гемдиметилом. Один из вариантов осуществления изобретения представляет собой соединение формулы (I), гдеR1 представляет собой два заместителя, независимо выбранных из хлора, брома, изопропокси, пропокси, метокси, 1-метилпропокси, циано, трифторметила, трифторметокси, циклогексила, пиперидина,пирролидинила, этила, 2-метилпропила, фенила и циклопентокси; иZ представляет собой этилен или пропилен, каждый из которых необязательно замещен гемдиметилом.-3 016443 Один из вариантов осуществления изобретения касается соединения формулы (IA), гдеR1 представляет собой два заместителя, независимо выбранные из хлора, изопропокси, циано,трифторметила, трифторметокси, пиперидина, этила и фенила; иZ представляет собой этилен или пропилен. Один из вариантов осуществления изобретения касается соединения формулы (IA), гдеR1 представляет собой хлор и изопропокси; иZ представляет собой этилен или пропилен. Один из вариантов осуществления изобретения касается соединения формулы (IB), гдеR1 представляет собой два заместителя, независимо выбранных из хлора, изопропокси и циано; иZ представляет собой этилен или пропилен. Один из вариантов осуществления изобретения касается соединения формулы (I), гдеR1 представляет собой два заместителя, независимо выбранных из хлора, брома, изопропокси, пропокси, метокси, 1-метилпропокси, циано, трифторметила, трифторметокси, циклогексила, пиперидина,пирролидинила, этила, 2-метилпропила, фенила и циклопентокси; иZ представляет собой этилен или пропилен, каждый необязательно замещен гемдиметилом. Один из вариантов осуществления изобретения касается соединения формулы (IA), гдеR1 представляет собой хлор и изопропокси; иZ представляет собой этилен. Один из вариантов осуществления изобретения касается соединения формулы (IB), гдеR1 представляет собой два заместителя, независимо выбранных из хлора, изопропокси, фенила и трифторметила; иZ представляет собой пропилен. Один из вариантов осуществления изобретения касается соединения формулы (II), гдеR5 представляет собой (а) и R6 представляет собой водород; и/или А необязательно замещен тиофеном или фенилом; и/илиZ представляет собой этилен. Другой вариант осуществления изобретения касается соединения формулы (II), где-4 016443 Изобретение включает все оптические изомеры, такие как стереоизомерные формы соединений формулы (I), включая энантиомеры, диастереоизомеры и их смеси, такие как рацематы. Различные стереоизомерные формы могут быть разделены или отделены друг от друга обычными способами или любой данный изомер может быть получен путем обычного стереоселективного или асимметрического синтеза. Следующие соединения по изобретению представляют собой: 3-[5-(5-3-хлор-4-[(1-метилэтил)окси]фенил-1,2,4-оксадиазол-3-ил)-1H-индазол-1-ил]пропановую кислоту; 3-(5-5-[3-хлор-4-(этилокси)фенил]-1,2,4-оксадиазол-3-ил-1 Н-индазол-1-ил)пропановую кислоту; 3-[5-(5-3-циано-4-[(1-метилэтил)окси]фенил-1,2,4-оксадиазол-3-ил)-1H-индазол-1-ил]пропановую кислоту; 3-[5-(5-3-циано-4-[(1-метилэтил)окси]фенил-1,2,4-оксадиазол-3-ил)-1H-индазол-1-ил]пропановую кислоту; 4-[5-(5-3-циано-4-[(1-метилэтил)окси]фенил-1,2,4-оксадиазол-3-ил)-1 Н-индазол-1-ил]бутановую кислоту; 3-(5-5-[4-[(1-метилэтил)окси]-3-(трифторметил)фенил]-1,2,4-оксадиазол-3-ил-1 Н-индазол-1 ил)пропановую кислоту; 4-[4-(5-3-хлор-4-[(1-метилэтил)окси]фенил-1,2,4-оксадиазол-3-ил)-1H-индазол-1-ил]бутановую кислоту; 4-[4-(5-3-хлор-4-[(1-метилэтил)окси]фенил-1,2,4-оксадиазол-3-ил)-1H-индазол-1-ил]бутановую кислоту; 3-[4-(5-3-хлор-4-[(1-метилэтил)окси]фенил-1,2,4-оксадиазол-3-ил)-1H-индазол-1-ил]пропановую кислоту; 3-(5-5-[3-хлор-4-(пропилокси)фенил]-1,2,4-оксадиазол-3-ил-1H-индазол-1-ил)пропановую кислоту; 3-[5-(5-3-хлор-4-[(трифторметил)окси]фенил-1,2,4-оксадиазол-3-ил)-1H-индазол-1 ил]пропановую кислоту; 3-(5-5-[4-циклогексил-3-(трифторметил)фенил]-1,2,4-оксадиазол-3-ил-1H-индазол-1 ил)пропановую кислоту; 3-(5-5-[4-(метилокси)-3-(трифторметил)фенил]-1,2,4-оксадиазол-3-ил-1H-индазол-1 ил)пропановую кислоту;-5 016443 4-[4-(5-3-циано-4-[(1-метилэтил)окси]фенил-1,2,4-оксадиазол-3-ил)-1H-индазол-1-ил]бутановую кислоту; 4-(4-5-[3-этил-4-(1-пиперидинил)фенил]-1,2,4-оксадиазол-3-ил-1H-индазол-1-ил)бутановую кислоту; 4-(4-5-[2-(трифторметил)-4-бифенилил]-1,2,4-оксадиазол-3-ил-1H-индазол-1-ил)бутановую кислоту; 4-[4-(5-3-хлор-4-[(трифторметил)окси]фенил-1,2,4-оксадиазол-3-ил)-1H-индазол-1-ил]бутановую кислоту; 3-(4-5-[4-[(1-метилэтил)окси]-3-(трифторметил)фенил]-1,2,4-оксадиазол-3-ил-1H-индазол-1 ил)пропановую кислоту; 4-[4-(5-5-хлор-6-[(1-метилэтил)окси]-3-пиридинил-1,2,4-оксадиазол-3-ил)-1H-индазол-1 ил]бутановую кислоту; 4-(4-5-[4-фенил-5-(трифторметил)-2-тиенил]-1,2,4-оксадиазол-3-ил-1H-индазол-1-ил)бутановую кислоту; 4-[4-(5-3-хлор-4-[(1-метилэтил)окси]фенил-1,2,4-оксадиазол-3-ил)-2H-индазол-2-ил]бутановую кислоту; натриевую соль 3-5-[5-(3-циано-4-[(1S)-1-метилпропил]оксифенил)-1,2,4-оксадиазол-3-ил]-1Hиндазол-1-илпропановой кислоты; натриевую соль 3-5-[5-(3-циано-4-[(1R)-1-метилпропил]оксифенил)-1,2,4-оксадиазол-3-ил]-1Hиндазол-1-илпропановой кислоты; 3-(5-5-[3-циано-4-(циклопентилокси)фенил]-1,2,4-оксадиазол-3-ил-1H-индазол-1-ил)пропановую кислоту; 4-[5-(5-3-хлор-4-[(1-метилэтил)окси]фенил-1,2,4-оксадиазол-3-ил)-1H-индазол-1-ил]бутановую кислоту; 4-(5-5-[4-фенил-5-(трифторметил)-2-тиенил]-1,2,4-оксадиазол-3-ил-1H-индазол-1-ил)бутановую кислоту; 4-[5-(5-3-циано-4-[(1-метилэтил)окси]фенил-1,2,4-оксадиазол-3-ил)-2H-индазол-2-ил]бутановую кислоту; 3-[5-(5-3-хлор-4-[(1-метилэтил)окси]фенил-1,2,4-оксадиазол-3-ил)-1H-индазол-1-ил]-2,2 диметилпропановую кислоту; 3-[5-(5-3-хлор-4-[(1-метилэтил)окси]фенил-1,2,4-оксадиазол-3-ил)-2H-индазол-2-ил]-2,2 диметилпропановую кислоту; 3-[4-(5-3-хлор-4-[(1-метилэтил)окси]фенил-1,2,4-оксадиазол-3-ил)-1H-индазол-1-ил]-2,2 диметилпропановую кислоту; 3-[4-(5-5-хлор-6-[(1-метилэтил)окси]-3-пиридинил-1,2,4-оксадиазол-3-ил)-1H-индазол-1-ил]-2,2 диметилпропановую кислоту; 3-[5-(5-3-циано-4-[(1-метилэтил)окси]фенил-1,2,4-оксадиазол-3-ил)-1H-индазол-1-ил]-2,2 диметилпропановую кислоту; 4-[5-(5-3-циано-4-[(1-метилэтил)окси]фенил-1,2,4-оксадиазол-3-ил)-1H-индазол-1-ил]-2,2 диметилбутановую кислоту; 3-[4-(5-3-циано-4-[(1-метилэтил)окси]фенил-1,2,4-оксадиазол-3-ил)-1H-индазол-1-ил]-2,2 диметилпропановую кислоту; 3-[5-(5-5-хлор-6-[(1-метилэтил)окси]-3-пиридинил-1,2,4-оксадиазол-3-ил)-1H-индазол-1-ил]-2,2 диметилпропановую кислоту; 4-[4-(5-3-циано-4-[(1-метилэтил)окси]фенил-1,2,4-оксадиазол-3-ил)-1H-индазол-1-ил]-2,2 диметилбутановую кислоту; 4-[4-(5-5-хлор-6-[(1-метилэтил)окси]-3-пиридинил-1,2,4-оксадиазол-3-ил)-1H-индазол-1-ил]-2,2 диметилбутановую кислоту или их соли. Фармацевтически приемлемые производные соединений формулы (I) включают любую фармацевтически приемлемую соль, сложный эфир или соль такого сложного эфира соединения формулы (I), которые при введении пациенту дают (непосредственно или косвенно) соединения формулы (I) или его активного метаболита или остатка. Некоторые сложные эфиры соединений формулы (I) описаны в настоящем документе в качестве промежуточных соединений в синтезе некоторых из описанных примеров. Такие сложные эфиры могут также демонстрировать активность в качестве S1P1 агонистов и также являются частью настоящего изобретения. Соединения формулы (I) могут образовывать соли. Понятно, что для применения в медицине соли соединений формулы (I) должны быть фармацевтически приемлемыми. Подходящие фармацевтически приемлемые соли будут очевидны для специалистов в данной области и включают соли, описанные в J.Pharm. Sci., 1977, 66, 1-19, такие как кислотно-аддитивные соли, образованные с помощью неорганических кислот, например, таких как хлористо-водородная, бромисто-водородная, серная, азотная или фосфорная кислоты; и органических кислот, например янтарная, малеиновая, уксусная, фумаровая, лимонная, винная, бензойная, п-толуолсульфоновая, метансульфоновая или нафталинсульфоновая кислоты.-6 016443 Некоторые соединения формулы (I) могут образовывать соли кислотно-аддитивные с одним или несколькими эквивалентами кислоты. В объем настоящего изобретения включены все возможные стехиометрические и нестехиометрические формы. Соли могут также быть получены из фармацевтически приемлемых оснований, включая неорганические основания и органические основания. Соли, полученные из неорганических оснований, включают соли алюминия, аммония, кальция, меди, трехвалентного железа, двухвалентного железа, лития, магния, трехвалентного марганца, двухвалентного марганца, калия,натрия, цинка и т.п. Соли, полученные из фармацевтически приемлемых органических оснований,включают соли первичных, вторичных и третичных аминов; замещенные амины, включая встречающиеся в природе замещенные амины; и циклические амины. Конкретные фармацевтически приемлемые органические основания включают аргинин, бетаин, кофеин, холин, N,N'-дибензилэтилендиамин,диэтиламин, 2-диэтиламиноэтанол, 2-диметиламиноэтанол, этаноламин, этилендиамин, н-этилморфолин,н-этилпиперидин, глюкамин, глюкозамин, гистидин, гидрабамин, изопропиламин, лизин, метилглюкамин, морфолин, пиперазин, пиперидин, прокаин, пурины, теобромин, триэтиламин, триметиламин, трипропиламин, трис-(гидроксиметил)аминометан (TRIS, трометамол) и т.п. Также соли могут быть образованы из основных ионообменных смол, например полиаминных смол. Когда соединение по настоящему изобретению является основным, соли можно получить из фармацевтически приемлемых кислот, включая неорганические и органические кислоты. Такие кислоты включают уксусную, бензолсульфоновую,бензойную, камфорсульфоновую, лимонную, этансульфоновую, этандисульфоновую, фумаровую, глюконовую, глутаминовую, бромисто-водородную, хлористо-водородную, изэтиновую, молочную, малеиновую, яблочную, миндальную, метансульфоновую, муциновую, памовую, пантотеновую, фосфорную,пропановую, янтарную, серную, винную, п-толуолсульфоновую кислоты и т.п. Соединения формулы (I) можно получать в кристаллической или некристаллической форме, и в случае кристаллической формы могут необязательно быть гидратированными или сольватированными. В объем настоящего изобретения включены стехиометрические гидраты или сольваты, а также соединения,содержащие различные количества воды и/или растворителя. В другом варианте осуществления настоящее изобретение относится к способам получения соединения формулы (I). Специалист в данной области примет во внимание, что схемы 1-8 являются также применимыми для получения соединений формулы (I), где R6 представляет собой (а) (а не R5 представляет собой (а), как показано), используя соответствующие промежуточные соединения. Соединения формулы (IV) известны из литературы и являются коммерчески доступными для изомеров, где либо R6 представляет собой (а), либо R5 представляет собой (а). Один из способов, который можно использовать для получения соединений формулы (IA), показан на схеме 1. Схема 1 Соединения формулы (III) могут быть преобразованы в соединения формулы (IV) обработкой гидразин гидратом, альтернативно, соединения формулы (IV) могут быть коммерчески доступны или их можно получить способом, описанным в литературе.-7 016443 Соединения формулы (IV) могут быть преобразованы в соединения формулы (V) обработкой гидроксиламин гидрохлоридом и подходящим основанием, таким как бикарбонат натрия, в растворителе,таком как метанол или этанол, при повышенной температуре, такой как 50 С. Соединения формулы (V) могут быть преобразованы в соединения формулы (VII) обработкой карбоновой кислотой формулы (VI) в присутствии EDAC и HOBt в подходящем растворителе, таком как ДМФ. Такие реакции обычно проводят при повышенной температуре, такой как 50-80 С. Обычно кислоту (VI), EDAC и HOBt перемешивают некоторое время при комнатной температуре перед прибавлением соединения формулы (V). Кислоты формулы (VI) являются либо коммерчески доступными, либо их можно получить различными способами, как показано в последующем описании. Соединения формулы (VII) могут быть преобразованы в соединения формулы (IX) обработкой алкилирующим агентом (VIII) в присутствии основания, такого как карбонат цезия, в растворителе, таком как ДМФ или DMPU. Такие реакции могут быть проведены при повышенной температуре, такой как 80 С, или в микроволновом реакторе при температуре, такой как 140 С. Алкилирующие средства (VIII) являются обычно коммерчески доступными или могут быть получены с использованием стандартных способов. Соединения формулы (IX) могут быть преобразованы в соединения формулы (IA) обработкой основанием, таким как водный раствор гидроксида натрия, в спиртовом растворителе, таком как этанол или метанол. Для улучшения растворения могут быть добавлены сорастворители, такие как ТГФ. Реакция гидролиза может быть проведена при комнатной температуре или при повышенной температуре, такой как 50-80 С. Альтернативно, указанное преобразование может быть проведено с использованием твердого гидроксида натрия в этаноле в микроволновом реакторе при температуре, такой как 100 С. Альтернативно, такие взаимодействия могут быть выполнены в микроволновом реакторе, используя диметиламин в этаноле с добавлением воды при температуре, например, 160 С. Реакция между (VII) и (VIII) с целью получения (IX) может также давать изомерное соединение формулы (X) (схема 2). Обработка соединения формулы (VII) алкилирующим агентом формулы (VIII) с основанием, таким как карбонат цезия, в растворителе, таком как ДМФ, как описано ранее, приводит к получению смеси соединений формул (IX) и (X), которые обычно могут быть разделены с помощью хроматографии. Схема 2 Соединение формулы (X) может быть преобразовано в соединение формулы (IB) с помощью стадии гидролиза, как показано на схеме 3. Схема 3 Альтернативно, соединения формулы (IA) и (IB) могут быть получены способом, показанным на схемах 4-6. Соединения формул (XI) и (XII) могут быть получены из соединения формулы (IV) путем взаимодействия с алкилирующим агентом формулы (VIII) в присутствии основания, такого как карбонат цезия, в растворителе, таком как ДМФ. Обычно такие реакции осуществляют при повышенной температуре, такой как 80 С. В некоторых случаях соединения (XI) и (XII) подвергают разделению с помощью хроматографии, тогда как в других случаях смесь обоих используют в последующей реакции с получением смеси (IX) и (X), которую обычно можно разделить с помощью хроматографии. Соединения формулы (XI) могут быть преобразованы в соединения формулы (IX), как показано на схеме 5. Схема 5 Соединения формулы (XI) могут быть преобразованы в соединения формулы (XIII) обработкой гидроксиламином гидрохлоридом и основанием, таким как бикарбонат натрия, в растворителе, таком как этанол, при повышенной температуре, например 50 С. Соединения формулы (XIII) могут быть преобразованы в соединения формулы (IX) обработкой карбоновой кислотой формулы (VI) в присутствии EDAC и HOBt в подходящем растворителе, таком как ДМФ. Такие реакции обычно проводят при повышенной температуре, такой как 50-120 С. Иногда кислоту (VI), EDAC и HOBt перемешивают некоторое время при комнатной температуре перед добавлением соединения формулы (XII), альтернативно, все реагенты могут быть объединены и нагреваться вместе. Соединения формулы (IX) могут быть преобразованы в соединения формулы (IA), как описано ранее. Соединения формулы (XII) могут быть преобразованы в соединения формулы (X), как показано на схеме 6. Схема 6 Соединения формулы (XII) могут быть преобразованы в соединения формулы (XIV) обработкой гидроксиламином гидрохлоридом и основанием, таким как бикарбонат натрия, в растворителе, таком как этанол, при повышенной температуре, например 50 С.-9 016443 Соединения формулы (XIV) могут быть преобразованы в соединения формулы (X) обработкой карбоновой кислотой формулы (VI) в присутствии EDAC и HOBt в подходящем растворителе, таком как ДМФ. Такие реакции обычно проводят при повышенной температуре, такой как 80-120 С. Кислота (VI),EDAC и HOBt могут некоторое время перемешиваться при комнатной температуре перед прибавлением соединения формулы (IX), альтернативно, все реагенты могут быть объединены и нагреваться вместе. Соединения формулы (X) могут быть преобразованы в соединения формулы (IB), как описано выше. Соединения формулы (XI), где Z представляет собой -СН 2-СН 2- (показанные как соединения формулы (XVIII, могут также быть получены способами, показанными на схеме 7. Схема 7 Соединения формулы (XV) могут быть преобразованы в соединения формулы (XVI) обработкой уксусным ангидридом в растворителе, таком как хлороформ, при температуре в интервале между 5 и 15 С, с последующей обработкой основанием, таким как ацетат калия и изоамилнитрит, при температуре в интервале между комнатной и 80 С. Соединения формулы (XVI) могут быть преобразованы в соединения формулы (XVI), минуя образование изомера (XIX) обработкой этил 2-пропеноатом в присутствии основания, такого как DBU, и в растворителе, таком как ацетонитрил, при температуре нагревания с обратным холодильником. Соединения формулы (XVII) могут быть преобразованы в соединения формулы (XVIII) обработкой дицианоцинком в присутствии катализатора, такого как Pd2(dba)3, и лиганда, такого как DPPF, в растворителе, таком как 1,4-диоксан, при температуре нагревания с обратным холодильником. Альтернативно, соединения формулы (XVI) могут быть преобразованы в соединения формулы (IV) обработкой дицианоцинком [Zn(CN)2] в присутствии катализатора, такого как Pd(PPh3)4, в растворителе,таком как NMP, при температуре, такой как 80 С. Затем соединения формулы (IV) могут быть преобразованы в соединения формулы (XVIII) способом, подобным тому, который использовался для преобразования соединений формулы (XV) в соединения формулы (XVII). Соединения формулы (XIII) могут быть преобразованы в соединения формулы (IX) способом,представленным на схеме 8. Соединения формулы (VI) могут быть преобразованы в соединения формулы (XIX) обработкой оксалил хлоридом в присутствии ДМФ в растворителе, таком как дихлорметан, при комнатной температуре. Соединения формулы (XIII) могут быть преобразованы в соединения формулы (XXI) обработкой соединения формулы (XX) в присутствии основания, такого как триэтиламин, в растворителе, таком как дихлорметан, при 0 С. Соединения формулы (XXI) могут быть преобразованы в соединения формулы (IX) с последующим нагреванием при 100 С в присутствии растворителя, такого как ацетонитрил. Альтернативно, соединения формулы (XIII) могут быть преобразованы в соединения формулы (IX) обработкой соединением формулы (XX) и триэтиламином в растворителе, таком как ацетонитрил, при температуре в интервале между комнатной и 110 С. Соединения формулы (I) и их фармацевтически приемлемые соли, таким образом, могут быть использованы при лечении состояний или расстройств, которые опосредованы рецептором S1P1. В частности, соединения формулы (I) и их фармацевтически приемлемые соли могут быть использованы при лечении рассеянного склероза, аутоиммунных заболеваний, хронических воспалительных нарушений, астмы, воспалительных нейропатий, артрита, трансплантации, болезни Крона, язвенного колита, красной волчанки, псориаза, ишемического-реперфузного нарушения, твердых опухолей и опухолевого метастазирования, заболеваний, связанных с ангиогенезом, сосудистых заболеваний, болевых состояний, острых вирусных заболеваний, воспалительных состояний кишечника, инсулинзависимого и инсулиннезависимого диабета (здесь далее указываются как "расстройства по изобретению"). Необходимо учесть, что используемый в настоящем документе термин "лечение" включает профилактику, а также ослабление основных симптомов. Таким образом, изобретение также относится к соединению формулы (I) или его фармацевтически приемлемой соли для применения в качестве терапевтического средства, в частности, при лечении состояний или расстройств, опосредованных рецептором S1P1. В частности, изобретение относится к соединению формулы (I) или его фармацевтически приемлемой соли для применения в качестве терапевтического средства при лечении рассеянного склероза, аутоиммунных заболеваний, хронических воспалительных нарушений, астмы, воспалительных нейропатий, артрита, трансплантации, болезни Крона,язвенного колита, красной волчанки, псориаза, ишемического-реперфузного нарушения, твердых опухолей и опухолевого метастазирования, заболеваний, связанных с ангиогенезом, сосудистых заболеваний,болевых состояний, острых вирусных заболеваний, воспалительных состояний кишечника, инсулинзависимого и инсулиннезависимого диабета. Также изобретение относится к способу лечения состояний или расстройств у млекопитающих, включая людей, которые могут быть опосредованы рецептором S1P1,включающему введение больному терапевтически безопасного и эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. В другом аспекте изобретение относится к использованию соединения формулы (I) или его фармацевтически приемлемой соли в получении лекарственного средства для применения в лечении состояний или расстройств, опосредованных рецептором S1P1. Для использования соединений формулы (I) в терапии они, как правило, могут быть формулированы в фармацевтическую композицию в соответствии со стандартной фармацевтической практикой. Настоящее изобретение также относится к фармацевтической композиции, которая содержит соединение формулы (I) или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель или эксципиент.- 11016443 В другом аспекте настоящее изобретение относится к способу получения фармацевтической композиции, который включает смешивание соединения формулы (I) или его фармацевтически приемлемой соли и фармацевтически приемлемого носителя или эксципиента. Фармацевтическая композиция по изобретению, которую можно получить смешиванием обычно при температуре окружающей среды и атмосферном давлении, обычно является приемлемой для перорального, парентерального или ректального введения и, как таковая, может быть в форме таблеток, капсул, пероральных жидких препаратов, порошков, гранул, пастилок, восстанавливаемых порошков, инъецируемых растворов или раствором для инфузии или суспензий или суппозитории. Перорально вводимые композиции являются, как правило, предпочтительными. Активность и эффективность соединений по настоящему изобретению в отношении рецептора S1P1 могут быть определены с помощью исследований GTPS, осуществляемых на клонированном рецепторе человека, как описано в настоящем документе, или с помощью исследования связывания дрожжей, также описанном в настоящем документе. При проведении функциональных исследований, описанных в настоящем документе, соединения формулы (I) демонстрировали активность агониста в отношении рецептора S1P1. Таблетки и капсулы для перорального введения могут находиться в лекарственной форме для однократного приема и могут содержать обычные эксципиенты, такие как связывающие вещества (например,предварительно желатинированный маисовый крахмал, поливинилпирролидон или гидроксипропилметилцеллюлоза); наполнители (например, лактоза, микрокристаллическая целлюлоза или гидрофосфат кальция); смазывающие вещества, используемые для получения таблеток (например, стеарат магния,тальк или диоксид кремния); разрыхлители (например, картофельный крахмал или крахмал гликолят натрия) и приемлемые увлажнители (например, лаурилсульфат натрия). Таблетки могут быть покрыты оболочкой способами, хорошо известными в обычной фармацевтической практике. Пероральные жидкие препараты могут быть в форме, например, водной или масляной суспензии,растворов, эмульсий, сиропов или эликсиров или могут быть в форме сухого продукта для восстановления с помощью воды или другого подходящего носителя перед применением. Такие жидкие препараты могут содержать обычные добавки, такие как суспендирующие вещества (например, сорбитный сироп,производные целлюлозы или гидрогенизированные пищевые жиры), эмульгаторы (например, лецитин или гуммиарабик), неводные носители (которые могут включать пищевые масла, например миндальное масло, масляные сложные эфиры, этиловый спирт или фракционированные растительные масла), консерванты (например, метил или пропил-п-гидроксибензоаты или сорбиновая кислота) и, при желании,обычные ароматизаторы или красители, буферные соли и подсластители при необходимости. Препараты,предназначенные для перорального введения, могут быть формулированы соответствующим образом для обеспечения контролируемого высвобождения активного соединения. Для парентерального введения жидкие стандартные лекарственные формы получают, используя соединение по изобретению или его фармацевтически приемлемую соль и стерильный носитель. Препараты для инъекции могут быть в лекарственной форме для однократного введения, например в ампулах,или форме для многократного введения, используя соединение по изобретению или его фармацевтически приемлемую соль и стерильный носитель, необязательно с добавлением консерванта. Композиции могут принимать такие формы, как суспензии, растворы или эмульсии в масляных или водных носителях, и могут содержать используемые для получения лекарственной композиции вещества, такие как суспендирующие, стабилизирующие и/или диспергирующие вещества. Альтернативно, активный ингредиент может быть в порошкообразной форме для смешивания с подходящим носителем, например стерильной апирогенной водой, перед применением. Соединение, в зависимости от используемого носителя и концентрации, может быть или суспендировано, или растворено в носителе. При получении растворов для инъекции соединение может быть растворено и стерилизовано путем фильтрования перед наполнением в подходящий сосуд или ампулу и герметично закрыто. Преимущественно, адъюванты, такие как анестезирующие средства местного действия, консерванты и буферные средства, растворяют в носителе. Для повышения стабильности, после наполнения в сосуд, композиция может быть заморожена и вода может быть удалена в вакууме. Суспензии для парентерального введения получают, по существу, аналогичным способом, за исключением того, что соединение суспендируют в носителе, а не растворяют и стерилизацию не выполняют фильтрованием. Перед суспендированием в стерильном носителе соединение может быть стерилизовано обработкой этиленоксидом. Преимущественно поверхностно-активное вещество или увлажнитель включают в композицию для улучшения однородного распределения соединения. Лосьоны могут быть получены на водной или масляной основе и могут в основном также содержать один или несколько эмульгаторов, стабилизаторов, диспергирующих веществ, суспендирующих веществ, загустителей или красителей. Капли могут быть формулированы на водной или неводной основе, также содержать одно или несколько диспергирующих веществ, стабилизаторов, повышающих растворимость веществ или суспендирующих веществ. Они могут также содержать консервант. Соединения по изобретению могут также входить в состав композиций для ректального введения,таких как суппозитории или удерживающие клизмы, например, содержащие обычные основания для получения суппозиториев, такие как масло какао или другие глицериды.- 12016443 Соединения по изобретению могут также быть формулированы в виде препаратов длительного действия. Такие препараты длительного действия можно вводить с помощью прививки (например, подкожно или внутримышечно) или внутримышечной инъекцией. Таким образом, например, соединения по изобретению могут быть формулированы с подходящими полимерными или гидрофобными веществами(например, в виде эмульсии в соответствующем масле) или ионообменными смолами или в виде умеренно растворимых производных, например в виде умеренно растворимой соли. Для интраназального введения соединения по изобретению могут быть формулированы в виде растворов для введения с помощью подходящего дозирующего устройства или устройства для однократного введения или альтернативно в виде порошковой смеси с подходящим носителем для введения, используя подходящее устройство для доставки. Таким образом, соединения формулы (I) могут быть формулированы для перорального, буккального, парентерального, топического (включая глазное и назальное), длительного действия или ректального введения или в форме подходящей для введения, путем ингаляции или инсуффляции (или через рот или нос). Соединения формулы (I) или их фармацевтически приемлемые соли могут быть формулированы для топического введения в форме мазей, кремов, гелей, лосьонов, пессариев, аэрозолей или капель (например, глазных, ушных или капель в нос). Мази и крема могут, например, быть формулированы на водной или масляной основе с добавлением подходящих загустителей и/или желатинирующих веществ. Мази для нанесения на глаз могут быть получены стерильным способом, используя стерилизованные компоненты. Композиция может содержать от 0,1 до 99 мас.%, предпочтительно от 10 до 60 мас.%, активного вещества, в зависимости от способа введения. Доза соединения, применяемого в лечении указанных выше расстройств, обычно изменяется в зависимости от тяжести расстройства, веса больного и других соответствующих факторов. Однако, как правило, подходящие однократные дозы могут составлять от 0,05 до 1000 мг, от 1,0 до 500 мг или от 1,0 до 200 мг, и такие однократные дозы можно вводить более чем один раз в сутки, например два или три раза в сутки. Соединения формулы (I) или их фармацевтически приемлемые соли можно использовать в комбинированных препаратах. Например, соединения по изобретению можно использовать в сочетании с циклоспорином А или другими терапевтически активными соединениями. Предмет изобретения также включает изотопно меченые соединения, которые аналогичны указанным в формуле (I) и далее, не считая того, что один или несколько атомов заменены на атом, имеющий атомную массу или атомное число, отличное от атомной массы или атомного числа, обычно встречающегося в природе. Примеры изотопов, которые могут быть включены в соединения по изобретению,включают изотопы водорода, углерода, азота, кислорода, фосфора, фтора, йода и хлора, такие как 3 Н, 11 С,14 С, 18F, 123I и 125I. В объем настоящего изобретения включены соединения формулы (I) и фармацевтически приемлемые соли указанных соединений, которые содержат указанные выше изотопы и/или другие изотопы других атомов. Изотопно меченые соединения по настоящему изобретению, например, которые включают радиоактивные изотопы, такие как 3 Н, 14 С, используют в исследованиях распределения лекарственного вещества и/или субстрата в тканях. Меченные тритием, т.е. 3 Н, и углерод-14, т.е. 14 С, изотопы являются особенно предпочтительными для упрощения их получения и обнаружения. В частности, в PET (позитронно-эмиссионная томография) используют изотопы 11 С и 8F, а изотопы 125I, в частности, используют вSPECT (однофотонная эмиссионная компьютерная томография). Все используют в диагностической визуализации головного мозга. Кроме того, замена на тяжелые изотопы, такие как дейтерий, т.е. 2 Н, может обеспечить определенные терапевтические эффекты, обусловленные большей метаболической стабильностью, например повышенным in vivo временем полужизни или сниженными режимами дозирования,и, таким образом, могут быть предпочтительны в некоторых случаях. Обычно изотопно меченые соединения формулы (I) и далее по настоящему изобретению могут быть получены способами, показанными на схемах и/или в примерах ниже, путем замены неизотопно меченого реагента на легко доступный изотопно меченый реагент. Все публикации, включая, но не ограничиваясь патентами и патентными заявками, указанные в настоящем описании, включены в настоящий документ в качестве ссылки, как если бы каждая отдельная публикация была в частности и индивидуально включена в настоящем документе полностью в качестве ссылки. Следующие описания и примеры описывают получение соединений по изобретению. Следующие данные об оборудовании и программном обеспечении для аналитических способов приведены только с иллюстративной целью.- 13016443 Условия, оборудование и программное обеспечение для систем аналитической ЖХВР. Оборудование.Agilent 1100 Автоматическая пипетка для взятия образцов.Waters Acquity Бинарное устройство для растворения.Waters Acquity Устройство для взятия образца.Waters MassLynx версия 4,0 SP2 или версия 4,1. Пятиминутный способ. Колонка. Использовали колонку Waters Atlantis, размеры которой составляют 4,650 мм. Размер частиц постоянной фазы составляет 3 мкм. Растворители. А: Водный растворитель = вода + 0,05%-ная муравьиная кислота. В: Органический растворитель = ацетонитрил + 0,05%-ная муравьиная кислота. Способ. Рабочий цикл основного способа составляет 5 мин. Время/мин %В. Скорость потока. Скорость потока в указанном выше способе составляет 3 мл/мин. Двухминутный способ. Программное обеспечение.Waters MassLynx версия 4,1. Колонка. Используют колонку Waters Acquity ВЕН UPLC C18, размеры которой составляют 2,150 мм. Размер частиц постоянной фазы составляет 1,7 мкм. Растворители. А: Водный растворитель = вода + 0,05%-ная муравьиная кислота. В: Органический растворитель = ацетонитрил + 0,05%-ная муравьиная кислота. Разведенная промывка = 1:1 метанол:вода. Неразведенная промывка = вода. Способ. Рабочий цикл основного способа составляет 2 мин. Скорость потока в указанном выше способе составляет 1 мл/мин. Вводимый объем для общего способа составляет 0,5 мкл. Температура колонки составляет 40C. Диапазон УФ-детектирования составляет от 220 до 330 нм.MicroMass MassLynx v4,0. Колонка. Обычно используют колонку Supelco LCABZ, размеры которой составляют 20 мм - внутренний диаметр и 100 мм в длину. Размер частиц стационарной фазы составляет 5 мкм. Растворители. А:. Водный растворителе = вода + 0,1%-ная муравьиная кислота. В: Органический растворитель = MeCN:вода 95:5 + 0,05%-ная муравьиная кислота. Сложный растворитель = МеОН:вода 80:20 + 50 ммоль аммоний ацетат. Растворитель для промывки игл = МеОН:вода:ДМСО 80:10:10. Способы. Можно использовать один из пяти способов, в зависимости от расчетного времени удержания представляющего интерес соединения. Все способы имеют рабочий цикл основного способа, равный 15 мин, который включает в себя 10-минутную градиентную стадию, затем 5-минутную стадию на колонке и стадию восстановления равновесия.MDP 3,8-5,5 = 50-90% В. Скорость потока. Скорость потока во всех вышеуказанных способах составляет 20 мл/мин. Альтернативная система. Оборудование.Waters MassLynx версия 4 SP2. Колонка. Используют колонки Waters Atlantis, размеры которых составляют 19100 мм (малый размер) и 30100 мм (большой размер). Размер частиц стационарной фазы составляет 5 мм. Растворители. А: Водный растворитель = вода + 0,1%-ная муравьиная кислота. В: Органический растворитель = ацетонитрил + 0,1%-ная муравьиная кислота. Смешанный растворитель = метанол:вода 80:20. Растворитель для промывки игл = метанол. Способы. В зависимости от расчетного времени удерживания представляющего интерес соединения используют пять способов. Они имеют 13,5-минутный рабочий цикл, который включает 10-минутный градиент,затем 3,5-минутный колоночный поток и стадию восстановления равновесия.- 15016443 Большая/малая шкала 1,0-1,5 = 5-30% В. Большая/малая шкала 1,5-2,2 = 15-55% В. Большая/малая шкала 2,2-2,9 = 30-85% В. Большая/малая шкала 2,9-3,6 = 50-99% В. Большая/малая шкала 3,6-5,0 = 80-99% В (в течение 6 мин, затем 7,5-минутный поток и стадия восстановления равновесия). Скорость потока. Скорость потока во всех указанных выше способах составляет или 20 мл/мин (малая шкала), или 40 мл/мин (большая шкала). Пологие градиенты. Большой 1,5-2,3 мин = 13-29% В. Большой 1,9-2,3 мин = 25-41% В. Большой 2,3-2,6 мин = 37-53% В. Большой 2,6-3,1 мин = 49-65% В Большой 3,1-3,6 мин = 61-77% В. Условия, используемые для ЯМР. Оборудование.Bruker DRX600. Программное обеспечение. Интерфейс пользователя - ЯМР Kiosk. Контролирующее программное обеспечение - XWin ЯМР версия 3,0. Хроматография. Если не указано иное, все хроматографические исследования выполняли, используя колонки с силикагелем Сокращения: г - грамм; мг - миллиграмм; мл - миллилитр; мкл - микролитр;MDAP - масс-направленная автоматическая препаративная жидкостная хроматография;SCX - сильный обмен катионов. Общие химические методы получения. Промежуточные соединения в примерах получения необязательно могут быть получены из конкретных описанных веществ. Описание способа получения D1. 1H-Индазол-5-карбонитрил (D1) 2-Фтор-5-цианобензальдегид (1,1 г) растворяли в гидразин гидрате (19 мл) и перемешивали при комнатной температуре в течение 18 ч. Раствор затем дистиллируют и остаток очищают колоночной флэш-хроматографией на диоксиде кремния, элюируя DCM. Это дает указанное в заголовке соединение(300 мг). Описание способа получения D1 (альтернативный способ). 1H-Индазол-5-карбонитрил (D1) 5-Циано-3-фторбензальдегид (4 г, 26,8 ммоль) растворяли в гидразин гидрате и перемешивали при комнатной температуре в течение 18 ч. Раствор выливали на лед и полученный твердый продукт отделяли с помощью фильтрования и затем сушили в вакууме при температуре 60 С с получением указанного в заголовке соединения (1,27 г) в виде твердого продукта розового цвета. Дополнительное количество продукта было выделено из водного слоя. МС (ES): C8H5N3, требуется 143; найдено 144 (МН+). 1H-Индазол-5-карбонитрил также можно получить, как описано ранее (Halley and Sava 1997, Synth.Commun. 27 (7):1199-1207). Описание способа получения D2. 5-Цианоиндазол (D1) (500 мг), гидроксиламинHCl (485 мг) и NaHCO3 (1,47 г) растворяли/суспендировали в MeOH (18 мл), нагревали до температуры 50 С и перемешивали в течение 19 ч и в течение ночи. Реакционную смесь затем фильтровали, промывали МеОН и упаривали с получением указанного в заголовке соединения (584 мг) в виде твердого продукта белого цвета. МС (ES): C8H8N4O, требуется 176; найдено 177 (МН+). Описание способа получения D3. 3-Хлор-4-[(1-метилэтил)окси]бензойная кислота (D3)(19,9 г), затем изопропилбромидом (13,5 мл) и полученную смесь нагревали до температуры 70 С и перемешивали в течение ночи. Реакционную смесь затем охлаждали до комнатной температуры, упаривали досуха, вновь растворяли в EtOH, фильтровали и упаривали еще раз с получением промежуточного сложного эфира (22,24 г) в виде твердого продукта белого цвета. Это соединение представляло собой смесь 3:1 этилового и метилового сложных эфиров и использовалось сырым в последующей реакции. Сырое промежуточное соединение (22,24 г) растворяли в МеОН (75 мл), обрабатывали 2 М воднымNaOH (75 мл), нагревали до температуры 60 С и перемешивали в течение 2 ч. Реакционную смесь затем охлаждали до комнатной температуры, МеОН упаривали и оставшийся водный раствор подкисляли с помощью 5 M водной HCl (30 мл). Осадок отфильтровывали и сушили с получением указанного в заголовке соединения (15,1 г) в виде твердого продукта белого цвета.H (CDCl3, 400 МГц): 1,42 (6 Н, д), 4,70 (1 Н, с), 6,97 (1 Н, д), 7,97 (1 Н, д), 8,12 (1 Н, с). МС (ES): C10H11ClO3, требуется 214; найдено 213 (М-Н+). 3-Хлор-4-[(1-метилэтил)окси]бензойную кислоту можно получать, как описано в WO 2006047195. Описание способа получения D4. 5-(5-3-Хлор-4-[(1-метилэтил)окси]фенил-1,2,4-оксадиазол-3-ил)-1H-индазол (D4) 3-Хлор-4-[(1-метилэтил)окси]бензойную кислоту (D3) (712 мг), EDClHCl (699 мг) и HOBt (493 мг) растворяли в ДМФ (16,5 мл) и перемешивали при комнатной температуре в течение 10 мин. ДобавлялиN-гидрокси-1H-индазол-5-карбоксимидамид (D2) (584 мг) и смесь нагревали до температуры 80 С в течение 12 ч. Реакционную смесь затем охлаждали до комнатной температуры и оставляли стоять в течение выходных, упаривали досуха и вновь растворяли в Н 2 О. Этот раствор экстрагировали EtOAc (3) и объединенные экстракты промывали насыщенным солевым раствором, упаривали и дважды растирали вDCM, подвергали воздействию ультрафиолетового света в течение 4 мин и затем фильтровали, сушили и повторяли обработку еще раз с получением указанного в заголовке соединения (407 мг) в виде твердого продукта розового цвета. Н (d6-ДМСО, 400 МГц): 1,37 (6 Н, д), 4,89 (1 Н, с), 7,46 (1 Н, д), 7,73 (1 Н, д), 8,04 (1 Н, д), 8,13 (1 Н,д), 8,20 (1 Н, с), 8,28 (1 Н, с), 8,58 (1 Н, с). МС (ES): C18H15ClN4O2, требуется 354; найдено 355 (М+Н). Описание способа получения D5. Этил 3-[5-(5-3-хлор-4-[(1-метилэтил)окси]фенил-1,2,4-оксадиазол-3-ил)-1H-индазол-1-ил]пропаноат 5-(5-3-Хлор-4-[(1-метилэтил)окси]фенил-1,2,4-оксадиазол-3-ил)-1H-индазол (D4) (200 мг) растворяли в DMPU (2,8 мл) и обрабатывали Cs2CO3 (367 мг), затем этил 3-бромпропионатом (145 мкл). Полученную смесь нагревали до температуры 140 С в микроволновом реакторе в течение 1,5 ч. Реакционную смесь затем охлаждали до комнатной температуры, упаривали досуха и растворяли в Н 2 О. Этот раствор экстрагировали EtOAc (3) и объединенные экстракты промывали насыщенным солевым раствором и упаривали с получением указанного в заголовке соединения (240 мг) в виде масла коричневого цвета. МС (ES): C23H2335ClN4O4, требуется 454; найдено 455 (МН+). Описание способа получения D5 (альтернативный способ). Этил 3-[5-(5-3-хлор-4-[(1-метилэтил)окси]фенил-1,2,4-оксадиазол-3-ил)-1 Н-индазол-1-ил]пропаноат Раствор этил 3-5-[(гидроксиамино)(имино)метил]-1 Н-индазол-1-илпропаноата (D52) (2,04 г,7,38 ммоль), 3-хлор-4-[(1-метилэтил)окси]бензойную кислоту (D3) (1,743 г, 8,12 ммоль), EDC (2,123 г,11,08 ммоль) и HOBt (1,357 г, 8,86 ммоль) в N,N-диметилформамиде (ДМФ) (25 мл) перемешивали в течение ночи, затем нагревали при температуре 120 С в течение 4 ч. Смесь растворяли в EtOAc, затем промывали водой и NaHCO3 и очищали с помощью флэш-хроматографии, элюируя смесьюEtOAc/изогексан 10-90%, затем 10-30%. Растворитель упаривали с получением (1,95 г) твердого продукта белого цвета.MC (ES): C23H2335ClN4O4, требуется 454; найдено 455 (МН+). Описание способа получения D6. Метил 3-хлор-4-(этилокси)бензоат (D6) Метил-4-гидрокси-3-хлорбензоат (10 г, 53,6 ммоль) и карбонат калия (14,8 г, 107,2 ммоль) суспендировали в ДМФ (110 мл) и затем добавляли этилйодид (8,56 мл, 107,2 ммоль). Реакционную смесь нагревали до температуры 70 С в течение ночи. Реакционную смесь фильтровали и остаток промывали простым эфиром. Органические растворы упаривали в вакууме и затем растворяли в EtOAc и промывали- 18016443 водным NaOH и водой, сушили и упаривали досуха в вакууме с получением указанного в заголовке соединения (11,24 г) в виде масла желтого цвета. МС (ES): C10H1135ClO3, требуется 214; найдено 215 (МН+). Описание способа получения D7. 3-Хлор-4-(этилокси)бензойная кислота (D7) К перемешиваемой суспензии метил 3-хлор-4-(этилокси)бензоата (D6) (11,24 г, 52,4 ммоль) в метаноле (40 мл) добавляли 2 М водного NaOH (40 мл) и полученную смесь нагревали при температуре 60 С в течение 2 ч. Реакционную смесь распределяли между EtOAc и разбавленной соляной кислотой. Органические продукты отделяли, сушили и упаривали в вакууме с получением сырого продукта. Это вещество растирали в простом эфире с получением указанного в заголовке соединения в виде твердого продукта белого цвета (8,21 г). МС (ES): C9H935ClO3, требуется 200; найдено 201 (МН+). Описание способа получения D8. 3-Этил-4-(1-пиперидинил)бензонитрил (D8) 4-Амино-3-этилбензонитрил (3,0 г, 20,5 ммоль), 1,5-дибромпентан (11,1 мл, 82,1 ммоль), карбонат калия (5,67 г, 41,0 ммоль) и воду (39,6 мл) - всю смесь разделили поровну в десять пробирок для микроволновой обработки и каждую пробирку нагревали при температуре 160 С в течение 1 ч. Все реакционные смеси объединяли и дважды экстрагировали этилацетатом (40 мл) и объединенные органические фракции сушили (разделитель фаз) и концентрировали в вакууме. Добавляли дихлорметан, смесь фильтровали и затем фильтрат очищали с помощью хроматографии на силикагеле, элюируя смесью 2-5% этилацетат в гексане, с получением указанного в заголовке соединения в виде бесцветного масла (823 мг,3,85 ммоль). Анализ показал, что соединение содержало небольшое количество примеси дибромпентана. МС (ES): C14H18N2, требуется 214; найдено 215 (МН+). Описание способа получения D9. 3-Этил-4-(1-пиперидинил)бензойная кислота (D9) 3-Этил-4-(1-пиперидинил)бензонитрил (D8) (817 мг, 3,82 ммоль) и гидроксид калия (2,14 г,38,2 ммоль) в этаноле (35 мл) и воде (8 мл) нагревали до температуры 90 С (предельная температура) в течение 9 ч. Добавляли еще гидроксид калия (2,14 г, 38,2 ммоль) и воду (8 мл) и реакционную смесь нагревали в течение еще 18 ч. Реакционной смеси давали остыть и нейтрализовали водной HCl. Твердый продукт белого цвета отделяли с помощью фильтрования и полагали, что можно очистить фильтрат с помощью картриджа SCX, но эта попытка оказалась неудачной. Как твердый продукт, так и продуктSCX, оба, объединяли, добавляли метанол и затем смесь подкисляли с помощью уксусной кислоты. Смесь фильтровали с получением фильтрата, который затем помещали на картридж SCX, промывали метанолом и элюировали с помощью 2 М аммиака в метаноле. Согласно тестовой шкале это давало указанное в заголовке соединение в виде твердого продукта белого цвета (96 мг, 0,41 ммоль) и оставшееся вещество давало бесцветное масло (563 мг, 2,41 ммоль). МС (ES): C14H19NO2, требуется 233; найдено 234 (МН+).- 19016443 Описание способа получения D10. 3-Этил-4-йодбензонитрил (D10) К 4-амино-3-этилбензонитрилу (2,50 г, 17,1 ммоль), перемешиваемому в воде (14 мл) при температуре 0 С, добавляли по каплям концентрированную соляную кислоту (7,80 мл, 257 ммоль), затем по каплям раствор нитрита натрия (1,24 г, 18,0 ммоль) в воде (3,43 мл). Полученную смесь перемешивали в течение 15 мин и затем к раствору добавляли в течение 15 мин йодид калия (2,98 г, 18,0 ммоль) в воде(6,0 мл) при температуре 0 С. Смесь перемешивали при комнатной температуре в течение 2 ч. Смесь экстрагировали этилацетатом (3100 мл) и объединенные органические фракции промывали насыщенным солевым раствором (100 мл), сушили (разделитель фаз) и концентрировали в вакууме с получением указанного в заголовке соединения в виде твердого продукта коричневого цвета (4,21 г, 16,4 ммоль). Н (метанол-d4, 400 МГц): 8,02 (1 Н, д), 7,61 (1 Н, д), 7,24 (1 Н, дд), 2,80 (2 Н, кв), 1,21 (3 Н, т). Описание способа получения D11. 4-(1-Циклогексен-1-ил)-3-этилбензонитрил (D11)(907 мг, 7,20 ммоль), метоксида натрия (778 мг, 14,4 ммоль) и хлорида бис-(трифенилфосфин)палладия(II) (337 мг, 0,48 ммоль) в безводном метаноле (12 мл) нагревали при температуре 80 С в течение 10 мин в микроволновом реакторе. Реакционную смесь распределяли между этилацетатом (40 мл) и водой (40 мл), затем органический слой далее промывали водой (40 мл), сушили (разделитель фаз) и концентрировали в вакууме. Сырой продукт очищали с помощью хроматографии на силикагеле, элюируя смесью 0-5% EtOAc в гексане в течение 30 мин с получением указанного в заголовке соединения в виде масла желтого цвета (824 мг, 3,91 ммоль). Н (метанол-d4, 400 МГц): 7,56 (1 Н, д), 7,46 (1 Н, дд), 7,19 (1 Н, д), 5,61-5,56 (1 Н, м), 2,68 (2 Н, кв),2,23-2,16 (4 Н, м), 1,85-1,68 (4 Н, м), 1,20 (3 Н, т). Описание способа получения D12. 4-(1-Циклогексен-1-ил)-3-этилбензойная кислота (D12) 4-(1-Циклогексен-1-ил)-3-этилбензонитрил (D11) (824 мг, 3,91 ммоль) и гидроксид калия (2,19 г,39,1 ммоль) в этаноле (36 мл) и воде (8 мл) нагревали при температуре 90 С (предельная температура) в течение 20 ч. Реакционную смесь концентрировали в вакууме и остаток распределяли между этилацетатом (120 мл) и водной соляной кислотой (2 М, 50 мл), затем органическую фазу промывали дополнительным количеством соляной кислоты (2 М, 50 мл), сушили (разделитель фаз) и концентрировали в вакууме с получением указанного в заголовке соединения в виде масла желтого цвета (808 мг, 3,51 ммоль).LCMS (ES): C15H18O2, требуется 230; найдено 229 (М-Н+). Описание способа получения D13. 4-Циклогексил-3-этилбензойная кислота (D13)(70 мл) и гидрировали в H-Cube, используя картридж палладия на углероде. Раствор продукта концентрировали в вакууме с получением указанного в заголовке соединения в виде твердого продукта белого цвета (792 мг, 3,41 ммоль).- 20016443 Н (метанол-d4, 400 МГц): 7,82-7,68 (2 Н, м), 7,33 (1 Н, д), 2,83 (1 Н, м), 2,73 (2 Н, кв), 1,87 (2 Н, м),1,85-1,70 (3 Н, м), 1,58-1,30 (5 Н, м), 1,22 (3 Н, т). Описание способа получения D14. 1-Метилэтил 3-бром-4-[(1-метилэтил)окси]бензоат (D14) Смесь 3-бром-4-гидроксибензойной кислоты (2,00 г, 9,22 ммоль), 2-йодпропана (1,85 мл,18,4 ммоль) и карбоната калия (2,55 г, 18,4 ммоль) в ДМФ (175 мл) нагревали при температуре кипения с обратным холодильником в течение 5 ч. Реакционную смесь оставляли охлаждаться и фильтровали. Фильтрат концентрировали в вакууме и остаток распределяли между этилацетатом (150 мл) и водой(150 мл), потом подщелачивали 2 М NaOH. Органическую фазу сушили (разделитель фаз) и концентрировали в вакууме с получением указанного в заголовке соединения в виде масла желтого цвета (2,36 г,7,84 ммоль). Н (метанол-d4, 400 МГц): 8,05 (1 Н, д), 7,90 (1 Н, дд), 7,25 (1 Н, д), 5,10 (1 Н, с), 4,81 (1 Н, с), 1,32 (6 Н,д), 1,31 (6 Н, д). Описание способа получения D15. 3-Бром-4-[(1-метилэтил)окси]бензойная кислота (D15)(100 мл) и водный гидроксид натрия (2 М, 39 мл) нагревали при температуре кипения с обратным холодильником в течение 5 ч. Реакционную смесь концентрировали в вакууме и распределяли между этилацетатом (125 мл) и водой (125 мл), последнюю подкисляли с помощью 2 М HCl (40 мл). Водный слой экстрагировали далее этилацетатом (70 мл) и объединенные органические экстракты сушили (разделитель фаз) и концентрировали в вакууме с получением указанного в заголовке соединения в виде твердого продукта не совсем белого цвета (1,83 г, 7,06 ммоль). МС (ES): C10H11BrO3, требуется 258, 260; найдено 257, 259 (М-Н+). Описание способа получения D16. Этил 4-бром-3-хлорбензоат (D16) В суспензию 4-бром-3-хлорбензойной кислоты (5,00 г, 21,2 ммоль) в этаноле (50 мл) добавляли серную кислоту (5 мл) и полученную смесь нагревали при температуре кипения с обратным холодильником в течение 60 ч. Реакционную смесь распределяли между этилацетатом (50 мл) и водой (50 мл). Водный слой экстрагировали далее этилацетатом и объединенные органические фракции сушили (разделитель фаз) и концентрировали в вакууме с получением указанного в заголовке соединения в виде вещества масло/твердый продукт коричневого цвета (5,09 г, 19,3 ммоль). Н (d6-ДМСО, 400 МГц): 8,06 (1 Н, д), 7,96 (1 Н, д), 7,80 (1 Н, дд), 4,33 (2 Н, кв), 1,33 (3 Н, т). Описание способа получения D17. Этил 3-хлор-4-(2-метилпропил)бензоат (D17) К этил 4-бром-3-хлорбензоату (D16) (2,00 г, 7,60 ммоль) в атмосфере аргона добавляли раствор бромида изобутилцинка в ТГФ (0,5 М, 30 мл, 15,0 ммоль) и затем добавляли комплекс дихлорида дихлорметана 1,1'-бис-(дифенилфосфино)ферроцен-палладия(II) (930 мг, 1,14 ммоль). Реакционную смесь нагревали при температуре кипения с обратным холодильником в течение 4,5 ч. Смесь концентрировали- 21016443 в вакууме и остаток распределяли между этилацетатом (125 мл) и водой (125 мл). Образовывался твердый продукт, который отфильтровывали и отбрасывали. Органический слой промывали водой (100 мл),сушили (разделитель фаз) и концентрировали в вакууме. Сырой продукт очищали с помощью хроматографии на силикагеле, элюируя смесью 0-5% EtOAc в гексане в течение 30 мин с получением указанного в заголовке соединения в виде бесцветного масла (1,76 г, 7,33 ммоль). Н (d6-ДМСО, 400 МГц): 7,91 (1 Н, д), 7,80 (1 Н, дд), 7,46 (1 Н, д), 4,30 (2 Н, кв), 2,66 (2 Н, д), 1,88-2,01(1 Н, м), 1,32 (3 Н, т), 0,89 (6 Н, д). Описание способа получения D18. 3-Хлор-4-(2-метилпропил)бензойная кислота (D18) Раствор этил 3-хлор-4-(2-метилпропил)бензоата (D17) (1,76 г, 7,33 ммоль) и водного гидроксида натрия (2 М, 3,70 мл, 7,4 ммоль) в этаноле (30 мл) нагревали при температуре 40 С в течение 3 ч. Реакционную смесь концентрировали в вакууме и остаток распределяли между этилацетатом (100 мл) и водой(100 мл), последнюю подкисляли с помощью 2 М HCl (4 мл). Водный слой экстрагировали этилацетатом(100 мл) и объединенные органические экстракты сушили (разделитель фаз) и концентрировали в вакууме с получением указанного в заголовке соединения в виде твердого продукта белого цвета (1,35 г,6,36 ммоль). МС (ES): C11H1335ClO2, требуется 212; найдено 211 (М-Н+). Описание способа получения D19. Метил 3-циано-4-[(трифторметил)сульфонил]оксибензоат (D19) К раствору метил 3-циано-4-гидроксибензоата (3 г, 16,93 ммоль) и триэтиламина (3,54 мл,25,4 ммоль) в сухом дихлорметане (60 мл) при температуре 0 С в сильном токе аргона медленно, по каплям добавляли ангидрид трифторметансульфоновой кислоты (3,15 мл, 18,63 ммоль). Реакционную смесь оставляли нагреваться до комнатной температуры и перемешивали в течение 1 ч. Реакционную смесь промывали 10%-ным водным карбонатом калия (250 мл) и затем водной HCl (2 М, 250 мл), затем органическую фазу сушили (разделитель фаз) и растворитель удаляли в вакууме с получением указанного в заголовке соединения в виде масла темно-коричневого цвета (5,165 г, 16,70 ммоль). Н (CDCl3, 400 МГц): 8,44 (1 Н, д), 8,38 (1 Н, дд), 7,60 (1 Н, д), 3,99 (3 Н, с). Описание способа получения D20. Метил 2-циано-4-бифенилкарбоксилат (D20) Следующую реакцию проводили, разделив реакционную смесь на две партии в половинных количествах: метил 3-циано-4-[(трифторметил)сульфонил]оксибензоат (D19) (1,5 г, 4,85 ммоль), фенилбороновую кислоту (1,183 г, 9,70 ммоль), карбонат калия (2,011 г, 14,55 ммоль) и тетракистрифенилфосфин(0) палладия (0,561 г, 0,485 ммоль) растворяли в ДМФ (24 мл) и смесь нагревали в микроволновом реакторе в течение 30 мин при температуре 150 С. Две реакционные смеси объединяли и разбавляли этилацетатом (50 мл) и смесь фильтровали через кизельгур для удаления остатков палладия. Фильтрат концентрировали в вакууме для уменьшения количества ДМФ и затем остаток распределяли между насыщенным водным бикарбонатом натрия (50 мл) и этилацетатом (50 мл). Органическую фазу промывали далее бикарбонатом натрия (50 мл) и затем водой (50 мл), далее сушили (MgSO4), фильтровали и растворитель удаляли в вакууме. Твердый продукт коричневого цвета очищали с помощью хроматографии на силикагеле, элюируя смесью 0-25% EtOAc в изогексане в течение 35 мин с получением указанного в заголовке соединения в виде твердого продукта белого цвета (935 мг, 3,94 ммоль).(3 Н, с). Описание способа получения D21. 2-Циано-4-бифенилкарбоновая кислота (D21) К метил 2-циано-4-бифенилкарбоксилату (D20) (935 мг, 3,94 ммоль) добавляли этанол (18 мл), но растворение не происходило, поэтому добавляли дихлорметан (10 мл). Затем добавляли 2 М водный гидроксид натрия (2 мл, 4,00 ммоль) и реакционную смесь перемешивали в течение 2 ч. К смеси добавляли дихлорметан (20 мл) и 2 М водный HCl (10 мл). Слои отделяли и водный слой экстрагировали затем дихлорметаном (20 мл). Объединенные органические фазы сушили (разделитель фаз) и растворитель удаляли в вакууме с получением твердого продукта белого цвета, который растворяли в метаноле (30 мл) и добавляли водный гидроксид натрия (2 М, 3 мл). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч, затем добавляли воду (20 мл). Реакционную смесь перемешивали в течение еще 1 ч. Добавляли дихлорметан (60 мл) и смесь встряхивали и слои разделяли. Водную фазу экстрагировали дополнительным количеством дихлорметана (50 мл), затем объединенные органические фазы сушили(разделитель фаз) и растворитель удаляли в вакууме с получением указанного в заголовке соединения в виде твердого продукта белого цвета (849 мг, 3,80 ммоль). МС (ES): C14H9NO2, требуется 223; найдено 222 (М-Н+). Описание способа получения D22. Этил 4-хлор-3-(трифторметил)бензоат (D22) 4-Хлор-3-(трифторметил)бензойную кислоту (1 г, 4,45 ммоль) растворяли в этаноле (3 мл) и добавляли концентрированную серную кислоту (0,15 мл). Смесь нагревали в микроволновом реакторе при температуре 100 С в течение 5 мин и затем при температуре 120 С в течение 15 мин. Растворитель удаляли в вакууме и остаток распределяли между насыщенным водным бикарбонатом натрия (50 мл) и этилацетатом (50 мл). Водный слой экстрагировали дополнительным количеством EtOAc (50 мл) и органические фазы объединяли, сушили с разделителем фаз и концентрировали в вакууме с получением указанного в заголовке соединения (1,026 г) в виде бесцветного масла. Н (метанол-d4, 400 МГц): 1,40 (3 Н, т), 4,41 (2 Н, кв), 7,76 (1 Н, д), 8,21 (1 Н, дд), 8,33 (1 Н, д). Описание способа получения D22 (альтернативный способ). Этил 4-хлор-3-(трифторметил)бензоат (D22) Раствор 4-хлор-3-трифторметил бензойной кислоты (10 г, 44,5 ммоль) в этаноле (10 мл) поровну распределяли в два сосуда для микроволнового реактора. В каждый сосуд добавляли концентрированную серную кислоту (0,75 мл) (1,5 мл всего). Реакционные смеси нагревали в микроволновом реакторе при температуре 120 С в течение всего 30 мин. Реакционные смеси объединяли и концентрировали в вакууме. Остаток распределяли между EtOAc (100 мл) и водным бикарбонатом натрия (100 мл), органическую фазу отделяли, промывали водным бикарбонатом натрия (100 мл) и водой (2100 мл) и затем сушили (разделитель фаз) и растворитель удаляли в вакууме с получением указанного в заголовке соединения (4,126 г) в виде бесцветного масла. Н (400 МГц, метанол-d4) согласуется с предшествующим примером.- 23016443 Описание способа получения D23. 2-(Трифторметил)-4-бифенилкарбоновая кислота (D23) Реакционную смесь распределяли в 4 сосуда, используя квартет реагентов в каждом: к смеси 4-бром-3-(трифторметил)бензонитрила (4 г, 16,00 ммоль), фенилбороновой кислоты (3,90 г, 32,0 ммоль) и карбоната калия (6,63 г, 48,0 ммоль) в N,N-диметилформамиде (ДМФ) (64 мл) добавляли тетракистрифенилфосфин(0) палладия (1,849 г, 1,600 ммоль). Каждую реакционную смесь нагревали в микроволновом реакторе при температуре 150 С в течение 30 мин. Объединенные реакционные смеси фильтровали через целит, промывали этилацетатом и растворитель удаляли в вакууме. Остаток распределяли между этилацетатом (100 мл) и водой (100 мл) и органическую фазу промывали раствором бикарбоната натрия (100 мл). Органическую фазу сушили (MgSO4), фильтровали и растворитель удаляли в вакууме. Коричневое масло растирали в дихлорметане и фильтровали с получением твердого продукта бледножелтого цвета, 2-(трифторметил)-4-бифенилкарбоксамид (2,47 г), который использовали без дополнительной очистки. К 2-(трифторметил)-4-бифенилкарбоксамиду (2 г, 7,54 ммоль) в этаноле (80 мл) добавляли гидроксид калия (4,23 г, 75 ммоль), и воду и смесь нагревали до температуры 90 С в течение 18 ч. Реакционную смесь концентрировали в вакууме и остаток распределяли между дихлорметаном (100 мл) и 2 М HCl (100 мл). Органическую фазу отделяли и сушили (разделитель фаз) и растворитель удаляли в вакууме с получением сырого продукта. Очистка с использованием картриджа Biotage Horizon, обращенная фаза, элюирование смесью 5-100% MeCN в воде давала указанное в заголовке соединение в виде твердого продукта не совсем белого цвета (960 мг). МС (ES): C14H9F3O2, требуется 266; найдено 265 (М-Н+). Описание способа получения D23 (альтернативный способ). 2-(Трифторметил)-4-бифенилкарбоновая кислота (D23) Партия А: этил 4-хлор-3-(трифторметил)бензоата (D22) (1,0 г, 3,96 ммоль), фенилбороновой кислоты (724 мг, 5,94 ммоль), ацетата палладия (44 мг), (дициклогексилфосфино)бифенила (140,2 мг) и фторида калия (689 мг, 11,9 ммоль) в ТГФ (8 мл) нагревали в микроволновом реакторе при температуре 120 С всего в течение 40 мин. Партия В: смесь этил 4-хлор-3-(трифторметил)бензоата (D22) (500 мг, 1,98 ммоль), фенилбороновой кислоты (290 мг, 2,38 ммоль), ацетата палладия (2,2 мг), (дициклогексилфосфино)бифенила (7 мг) и фторида калия (344 мг, 5,8 ммоль) в ТГФ (4 мл) нагревали в микроволновом реакторе при температуре 120 С в течение 20 мин. Реакционные смеси партий А и В объединяли, фильтровали и фильтрат концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии (SiO2, от 0 до 5% EtOAc в гексане) с получением смеси исходного продукта и продукта конденсации. Это вещество растворяли в этаноле (10 мл) и 2 МNaOH (водн.) (5 мл) и затем нагревали при температуре кипения с обратным холодильником в течение 3 ч. Растворитель удаляли в вакууме и остаток распределяли между DCM и 2 М водного HCl. Водный слой затем экстрагировали DCM. Органические фазы объединяли и концентрировали в вакууме. Сырой продукт очищали с помощью хроматографии с обращенной фазой на Horizon, элюируя смесью от 5 до 100% MeCN в воде, с получением указанного в заголовке соединения в виде твердого продукта белого цвета (367 мг) (DN108121-170A2, GSK1869780A). МС (ES): C14H9F3O2, требуется 266; найдено 265 (М-Н+).- 24016443 Описание способа получения D24. Метил 3-циано-4-(2-метилпропил)бензоат (D24) К метил 3-циано-4-[(трифторметил)сульфонил]оксибензоату (D19) (1,5 г, 4,85 ммоль) добавляли бром(2-метилпропил)цинк (48,5 мл, 24,25 ммоль) в тетрагидрофуране (50 мл) в атмосфере аргона. К раствору затем добавляли комплекс 1,1'-бис-(дифенилфосфино)ферроцендихлор палладия(II) и дихлорметана (0,355 г, 0,485 ммоль) и реакционную смесь нагревали при температуре кипения с обратным холодильником в течение 6 ч. Смесь гасили водой (2 мл) и затем фильтровали через целит, промывая этилацетатом. Растворитель удаляли в вакууме. Остаток распределяли между этилацетатом (50 мл) и водой(50 мл) и органическую фазу сушили (разделитель фаз) и растворитель удаляли в вакууме. Остаток очищали с помощью хроматографии на силикагеле, элюируя смесью 0-15% EtOAc в изогексане в течение 40 мин. Обе партии собирали, в одной из них было указанное в заголовке соединения в виде бесцветного масла (233 мг, 1,072 ммоль). Н (CDCl3, 400 МГц): 8,28 (1 Н, д), 8,15 (1 Н, дд), 7,38 (1 Н, д), 3,94 (3 Н, с), 2,78 (2 Н, д), 2,02 (1 Н, м),0,96 (6 Н, д). Описание способа получения D25. 3-Циано-4-(2-метилпропил)бензойная кислота (D25) Метил 3-циано-4-(2-метилпропил)бензоат (D24) (233 мг, 1,072 ммоль) растворяли в этаноле (4 мл) и добавляли 2 M водный гидроксид натрия (1 мл, 2 ммоль). Реакционную смесь перемешивали в течение 1 ч. Добавляли 2 М водный HCl (10 мл) и смесь экстрагировали дихлорметаном (20 мл + 10 мл). Органические фазы отделяли и сушили с помощью разделителя фаз и объединяли, затем растворитель удаляли в вакууме с получением указанного в заголовке соединения в виде твердого продукта белого цвета (203 мг,0,999 ммоль). МС (ES): C12H13NO2, требуется 203; найдено 202 (М-Н+). Описание способа получения D26. 5-Формил-2-[(1S)-1-метилпропил]оксибензонитрил (D26)(2S)-2-Бутанол (0,99 г, 0,013 моль) растворяли в ДМФ (50 мл) и раствор охлаждали до температуры 0 С. Добавляли гидрид натрия (60%-ная дисперсия в минеральном масле, 1,54 г, 0,036 моль), порциями,после окончания добавления смесь перемешивали при температуре 0 С в течение 10 мин. Затем добавляли 2-фтор-5-формилбензонитрил (2,0 г, 0,013 моль) и реакционную смесь оставляли нагреваться до комнатной температуры (медленно, на ледяной бане), реакционную смесь перемешивали в течение ночи при комнатной температуре. Реакционную смесь затем охлаждали до температуры 0 С, гасили насыщенным солевым раствором и разбавляли EtOAc (25 мл). Смесь распределяли и органическую фракцию экстрагировали водой (30 мл), объединенные органические фракции сушили путем пропускания через картридж для разделения фаз и затем упаривали досуха при пониженном давлении с получением сырого продукта. Сырой остаток очищали на картридже 40+М Biotage, элюируя смесью от 20 до 50% EtOAc в гексане. Это давало указанное в заголовке соединение (220 мг) в виде твердого продукта белого цвета.- 25016443 Описание способа получения D27. 3-Циано-4-[(1S)-1-метилпропил]оксибензойная кислота (D27) К раствору 5-формил-2-[(1S)-1-метилпропил]оксибензонитрила (D26) (220 мг, 1,08 ммоль) в уксусной кислоте (20 мл) добавляли тетрагидрат пербората натрия (334 мг, 2,17 ммоль), реакционную смесь нагревали при температуре 50 С в течение выходных дней. Реакционную смесь концентрировали в вакууме. Добавляли воду (50 мл), добавляли EtOAc (30 мл) и слои распределяли, водный слой еще дважды экстрагировали EtOAc (30 мл) и объединенные органические фракции упаривали досуха при пониженном давлении с получением указанного в заголовке соединения (245 мг) в виде твердого продукта не совсем белого цвета. МС (ES): C12H13NO2, требуется 219; найдено 220 (МН+). Описание способа получения D28. 5-Формил-2-[(1R)-1-метилпропил]оксибензонитрил (D28)(2R)-2-Бутанол (0,99 г, 0,013 моль) растворяли в ДМФ (50 мл) и раствор охлаждали до температуры 0 С. К раствору добавляли гидрид натрия, 60%-ная дисперсия в минеральном масле (1,54 г, 0,036 моль),порциями, после завершения добавления смесь перемешивали при температуре 0 С в течение 10 мин. Добавляли затем 2-фтор-5-формилбензонитрил (2,0 г, 0,013 моль) и реакционную смесь оставляли нагреваться до комнатной температуры (медленно, на ледяной бане) и реакционную смесь перемешивали в течение ночи при комнатной температуре. Реакционную смесь затем охлаждали до температуры 0 С,гасили насыщенным солевым раствором и разбавляли EtOAc (25 мл). Смесь распределяли и органические фракция экстрагировали водой (30 мл), объединенные органические фракции сушили пропусканием через фазу разделительного картриджа и упаривали досуха при пониженном давлении с получением сырого продукта. Сырой остаток очищали на картридже 40+М Biotage, элюируя смесью от 20 до 50%EtOAc в гексане. Это давало указанное в заголовке соединения (310 мг) в виде масла желтого цвета. Н (d6-ДМСО, 400 МГц): 9,88 (1 Н, с), 8,30 (1 Н, с), 8,15 (1 Н, д), 7,49 (1 Н, д), 4,73-4,81 (1 Н, м), 1,631,79 (2 Н, м), 1,33 (3 Н, д), 0,95 (3 Н, т). Описание способа получения D29. 3-Циано-4-[(1R)-1-метилпропил]оксибензойная кислота (D29) К раствору 5-формил-2-[(1R)-1-метилпропил]оксибензонитрила (D37) (310 мг, 1,53 ммоль) в уксусной кислоте (30 мл) добавляли тетрагидрат пербората натрия (471 мг, 3,05 ммоль), реакционную смесь нагревали при температуре 50 С в течение выходных дней. Реакционную смесь концентрировали в вакууме и добавляли воду (50 мл), добавляли EtOAc (30 мл) и слои распределяли, водный слой экстрагировали еще дважды EtOAc (30 мл) и объединенные органические фракции упаривали досуха при пониженном давлении с получением указанного в заголовке соединения (315 мг) в виде твердого продукта не совсем белого цвета. МС (ES): C12H13NO2, требуется 219; найдено 220 (МН+). Описание способа получения D30. 1-Метилэтил 5-хлор-6-[(1-метилэтил)окси]-3-пиридинкарбоксилат (D30)(75 мл) и обрабатывали карбонатом серебра (12,4 г, 24,8 ммоль) и 2-йодпропаном (6,9 мл, 69,12 ммоль) и перемешивали при комнатной температуре в темноте в течение 18 ч. Смесь фильтровали и фильтрат упаривали с получением указанного в заголовке соединения, содержащего примеси (1,32 г).- 26016443 Н (d6-ДМСО): 1,31 (6 Н, д), 1,35 (6 Н, д), 5,13 (1 Н, с), 5,40 (1 Н, с), 8,22 (1 Н, д), 8,65 (1 Н, д). Описание способа получения D30 (альтернативный способ). 1-Метилэтил 5-хлор-6-[(1-метилэтил)окси]-3-пиридинкарбоксилат (D30)(200 мл) и обрабатывали карбонатом серебра (3,97 г, 14,40 ммоль) и 2-йодпропаном (3,46 мл, 34,6 ммоль) и перемешивали при комнатной температуре в темноте в течение 3 дней. Добавляли еще 2-йодпропан(3 мл) и перемешивали в течение 24 ч. Добавляли EtOAc (200 мл) и промывали водой (200 мл) и насыщенным NaHCO3 (50 мл), затем водой (200 мл). Сушили над MgSO4 и упаривали растворитель с получением 1,0 г указанного в заголовке соединения в виде прозрачного бесцветного масла, которое использовали, не характеризуя его дополнительно. Описание способа получения D30 (альтернативный способ). 1-Метилэтил 5-хлор-6-[(1-метилэтил)окси]-3-пиридинкарбоксилат (D30)Fluka, 5,4 г, 31,1 ммоль) и Ag2CO3 (21,45 г, 78 ммоль) в CHCl3 (200 мл) добавляли 2-йодпропан (12,42 мл,124 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 3 дней. Осадок отфильтровывали и растворитель удаляли в вакууме с получением указанного в заголовке соединения(4 г, 47%) в виде масла желтого цвета, которое использовали на следующей стадии без дополнительной очистки.MC (ES): C12H16ClNO3, требуется 257; найдено 258 [М+Н]+. Описание способа получения D31. 5-Хлор-6-[(1-метилэтил)окси]-3-пиридинкарбоновая кислота (D31) 1-Метилэтил 5-хлор-6-[(1-метилэтил)окси]-3-пиридинкарбоксилат (D30) (1,6 г, 6,21 ммоль) в изопропаноле (70 мл) и воде (35,0 мл) обрабатывали 2 н. гидроксидом натрия (6,21 мл, 12,42 ммоль) и перемешивали в течение 3 ч с получением отдельного продукта. Упаривали IPA, подкисляли с помощью ледяной уксусной кислоты и экстрагировали продукт EtOAc (100 мл). Сушили над MgSO4 и упаривали растворитель с получением 1,30 г указанного в заголовке соединения в виде твердого продукта белого цвета.MC (ES): C9H1035ClNO3, требуется 215; найдено 214 (М-Н+). Описание способа получения D31 (альтернативный способ). 5-Хлор-6-[(1-метилэтил)окси]-3-пиридинкарбоновая кислота (D31) К раствору 1-метилэтил 5-хлор-6-[(1-метилэтил)окси]-3-пиридинкарбоксилата (D30) (3 г,11,64 ммоль) в метаноле (25 мл) добавляли гидроксид натрия (29,1 мл, 58,2 ммоль) и перемешивали при комнатной температуре в течение ночи. Растворитель упаривали, затем нейтрализовали 2 M HCl и экстрагировали простым эфиром. Затем сушили над сульфатом магния и упаривали с получением грязного твердого продукта белого цвета. Растирание в DCM давало указанное в заголовке соединение в виде чистого твердого продукта белого цвета.- 27016443 МС (ES): C9H10ClNO3, требуется 215; найдено 216 [М+Н]+. Описание способа получения D32. 4-(1-Циклогексен-1-ил)-3-(трифторметил)бензамид (D32) 4-Бром-3-(трифторметил)бензонитрил (коммерческий) (1,2 г, 4,80 ммоль), 1-циклогексен-1 илбороновую кислоту (0,907 г, 7,20 ммоль), метоксид натрия (0,778 г, 14,40 ммоль) и хлорид бис-(трифенилфосфин)палладия(II) (0,337 г, 0,480 ммоль) добавляли в сухой метанол (12 мл) и смесь нагревали в микроволновом реакторе при температуре 80 С в течение 10 мин. Реакционную смесь распределяли между этилацетатом (40 мл) и водой (40 мл) и затем органическую фазу промывали еще водой(40 мл). Органическую фазу сушили (MgSO4), фильтровали и растворитель удаляли в вакууме. Сырой продукт очищали с помощью флэш-хроматографии на силикагеле, элюируя смесью 0-75% этилацетат в гексане с получением указанного в заголовке соединения в виде твердого продукта белого цвета (1,02 г). МС (ES): C14H14F3NO, требуется 269; найдено 270 (МН+). Описание способа получения D33. 4-Циклогексил-3-(трифторметил)бензамид (D33) 4-(1-Циклогексен-1-ил)-3-(трифторметил)бензамид (D32) (850 мг, 3,16 ммоль) растворяли в метаноле (63 мл) и гидрировали, используя H-Cube, в присутствии палладия на углероде при температуре 40 С со скоростью потока 2 мл/мин. Растворитель удаляли в вакууме с получением указанного в заголовке соединения в виде твердого продукта белого цвета (822 мг). МС (ES): C14H16F3NO, требуется 271; найдено 272 (МН+). Описание способа получения D34. 4-Циклогексил-3-(трифторметил)бензойная кислота (D34) К раствору 4-циклогексил-3-(трифторметил)бензамида (D33) (822 мг, 3,03 ммоль) в этаноле (40 мл) добавляли гидроксид калия (1,700 г, 30,3 ммоль) и воду (5 мл) и реакционную смесь нагревали при температуре 90 С (предельная температура) в течение 3 ч и перемешивали при комнатной температуре в течение 16 ч. Добавляли еще гидроксид калия (1,700 г, 30,3 ммоль) и реакционную смесь нагревали при температуре кипения с обратным холодильником в течение 27 ч. Добавляли еще 5 мл воды и реакционную смесь нагревали в течение 66 ч (выходных дней). Реакционную смесь концентрировали в вакууме и остаток распределяли между этилацетатом (25 мл) и водной соляной кислотой (2 M, 25 мл). Водный слой затем экстрагировали этилацетатом (25 мл) и объединенные органические фазы сушили (MgSO4), фильтровали и растворитель удаляли в вакууме с получением указанного в заголовке соединения в виде твердого продукта белого цвета (737 мг). МС (ES): C14H15F3O2, требуется 272; найдено 271 (М-Н+). Описание способа получения D35. 1-Метилэтил 4-[(1-метилэтил)окси]-3-(трифторметил)бензоат (D35)(40 мл) нагревали при температуре 70 С в течение 4 ч, затем добавляли 2-йодпропан (218 мкл,2,18 ммоль) и нагревание продолжали в течение 18 ч. Неорганический твердый продукт отфильтровывали и промывали этилацетатом. Фильтрат концентрировали в вакууме и распределяли между этилацетатом (150 мл) и водой (150 мл), содержащей небольшое количество водного гидроксида натрия. Органический слой сушили (разделитель фаз) и концентрировали в вакууме с получением сырого указанного в заголовке соединения (704 мг) в виде масла желтого цвета. МС (ES): C14H17F3O3, требуется 290; найдено 291 (МН+).- 28016443 Описание способа получения D36. 4-[(1-Метилэтил)окси]-3-(трифторметил)бензойная кислота (D36) К смеси 1-метилэтил 4-[(1-метилэтил)окси]-3-(трифторметил)бензоата (D35) (704 мг, 2,43 ммоль) в этаноле (110 мл) добавляли водный гидроксид натрия (2 М, 12,2 мл, 24,3 ммоль) и реакционную смесь нагревали при температуре кипения с обратным холодильником в течение 1 ч. Смесь концентрировали в вакууме и остаток распределяли между этилацетатом (100 мл) и водой (100 мл) и подкисляли с помощью водной соляной кислоты (2 М, 13 мл). Водный слой затем экстрагировали этилацетатом (100 мл) и объединенные органические слои сушили и концентрировали в вакууме с получением указанного в заголовке соединения в виде твердого продукта желтого цвета (563 мг). МС (ES): C11H11F3O3, требуется 248; найдено 247 (М-Н+). Описание способа получения D37. Метил 3-хлор-4-(пропилокси)бензоат (D37) Метил 4-гидрокси-3-хлорбензоат (10 г, 53,6 ммоль) растворяли в ДМФ (110 мл) и затем добавляли карбонат калия (14,8 г, 107,2 ммоль), затем н-пропилйодид (10,4 мл, 107,2 ммоль). Реакционную смесь нагревали при температуре 70 С в течение ночи, фильтровали и затем фильтрат распределяли междуEtOAc и водой. Органический слой отделяли, сушили и упаривали с получением указанного в заголовке соединения в виде масла желтого цвета (12,37 г).MC (ES): C11H1335ClO3, требуется 228; найдено 229 (МН+). Описание способа получения D38. 3-Хлор-4-(пропилокси)бензойная кислота (D38) Раствор метил 3-хлор-4-(пропилокси)бензоата (D37) (RD108825-58B1) (12,22 г, 0,053 моль) в этаноле (40 мл) и 2 М водном NaOH (40 мл) нагревали при температуре 60 С в течение 3 ч. Реакционную смесь оставляли охлаждаться и затем выдерживали при комнатной температуре в течение выходных дней. Реакционную смесь выливали в смесь разбавленной водной HCl и EtOAc. Органический слой отделяли, сушили и упаривали с получением твердого продукта, который растирали в простом эфире с получением указанного в заголовке соединения в виде твердого продукта белого цвета (7,7 г).MC (ES): C10H1135ClO3, требуется 214; найдено 213 (М-Н+). Описание способа получения D39. Этил 3-хлор-4-(1-пирролидинил)бензоат (D39) Смесь этил 4-бром-3-хлорбензоата (D16) (2,53 г, 9,62 ммоль), пирролидина (1,03 мл, 12,5 ммоль),трет-бутоксида натрия (1,29 г, 13,5 ммоль), BINAP (196 мг, 0,29 ммоль) и трис(дибензилиденацетон)дипалладия(0) (58 мг, 0,10 ммоль) в толуоле (120 мл) нагревали до температуры кипения в атмосфере аргона в течение 3 ч. Реакционную смесь оставляли охлаждаться и фильтровали. Твердый продукт промывали толуолом и затем фильтрат концентрировали. Остаток распределяли между этилацетатом (150 мл) и водой (100 мл), содержащей водный бикарбонат натрия (50 мл). Органическую фазу сушили (разделитель фаз) и концентрировали с получением масла оранжевого цвета. Масло очищали с помощью хроматографии с обращенной фазой, элюируя смесью 5-100% ацетонитрила в воде с получением указанного в заголовке соединения в виде масла оранжевого цвета (600 мг). Продукт содержал
МПК / Метки
МПК: C07D 413/04, A61P 37/00, A61K 31/4245, C07D 413/14
Метки: s1p, производные, применения, агонистов, 1-фосфата, оксадиазолзамещенные, качестве, сфингозин, индазола
Код ссылки
<a href="https://eas.patents.su/30-16443-oksadiazolzameshhennye-proizvodnye-indazola-dlya-primeneniya-v-kachestve-agonistov-sfingozin-1-fosfata-s1p.html" rel="bookmark" title="База патентов Евразийского Союза">Оксадиазолзамещенные производные индазола для применения в качестве агонистов сфингозин 1-фосфата (s1p)</a>












