Производные тетрагидронафталина и их применение в качестве ингибиторов воспаления
Номер патента: 15834
Опубликовано: 30.12.2011
Авторы: Шэке Хайке, Ревинкель Хартмут, Бэурле Штефан, Бергер Маркус, Шмеес Норберт
Формула / Реферат
1. Соединения общей формулы (Ia)
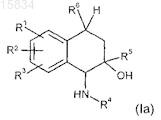
где
I) остатки R1, R2и R3 независимо друг от друга выбраны из -ОН, О-СН3, Cl, F, Н;
II) остаток R4 выбран из 2-метилхинолин-5-ила, 2-метилхиназолин-5-ила, 2-этилхиназолин-5-ила, 7-фтор-2-метилхиназолин-5-ила, 8-фтор-2-метилхиназолин-5-ила, 7,8-дифтор-2-метилхиназолин-5-ила, хинолин-2(1Н)-он-5-ила, 7-фторхинолин-2(1Н)-он-5-ила, 8-фторхинолин-2(1Н)-он-5-ила, изохромен-1-он-5-ила, 2-метилфталазин-1-он-5-ила, изохинолин-2(1H)-он-5-ила;
III) остаток R5 означает -CF3;
IV) остаток R6 выбран из -СН3, -СН2-СН3, -(СН2)2-СН3или -СН=СН2,
а также соли соединений общей формулы (Ia) с физиологически совместимыми анионами, отличающиеся тем, что соединения представлены в 1a,2a,4b-конфигурации основного вещества 1-амино-1,2,3,4-тетрагидронафталин-2-ола или в 5a,6a,8b-конфигурации основного вещества 5,6,7,8-тетрагидронафталин-1,6-диола.
2. Соединения по п.1, отличающиеся тем, что соединения имеют абсолютную конфигурацию (1S,2R,4R) или (1S,2R,4S) основного вещества 1-амино-1,2,3,4-тетрагидронафталин-2-ол или (5S,6R,8R) или (5S,6R,8S) конфигурацию основного вещества 5,6,7,8-тетрагидронафталин-1,6-диола.
3. Соединения по п.1 или 2, представляющие собой
(5a,6a,8b)-2-фтор-8-метил-5-[(2-метилхинолин-5-ил)амино]-6-(трифторметил)-5,6,7,8-тетрагидронафталин-1,6-диол;
(+)-(5a,6a,8b)-2-фтор-5-[(7-фтор-2-метилхиназолин-5-ил)амино]-8-метил-6-(трифторметил)-5,6,7,8-тетрагидронафталин-1,6-диол;
(-)-(5a,6a,8b)-2-фтор-5-[(7-фтор-2-метилхиназолин-5-ил)амино]-8-метил-6-(трифторметил)-5,6,7,8-тетрагидронафталин-1,6-диол;
(5a,6a,8b)-2-фтор-5-[(8-фтор-2-метилхиназолин-5-ил)амино]-8-метил-6-(трифторметил)-5,6,7,8-тетрагидронафталин-1,6-диол;
(5a,6a,8b)-5-[(7,8-дифтор-2-метилхиназолин-5-ил)амино]-2-фтор-8-метил-6-(трифторметил)-5,6,7,8-тетрагидронафталин-1,6-диол;
(5a,6a,8b)-2-фтор-8-метил-5-[(2-метилхиназолин-5-ил)амино]-6-(трифторметил)-5,6,7,8-тетрагидронафталин-1,6-диол;
5-{[(5a,6a,8b)-1,6-дигидрокси-2-фтор-8-метил-6-(трифторметил)-5,6,7,8-тетрагидронафталин-5-ил]амино}хинолин-2(1H)-он;
8-фтор-5-{[(1a,2a,4b)-6-фтор-2-гидрокси-5-метокси-4-метил-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}-хинолин-2(1Н)-он;
(+)-5-{[(1a,2a,4b)-6-фтор-2,5-дигидрокси-4-метил-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}-8-фторхинолин-2(1Н)-он;
(-)-5-{[(1a,2a,4b)-6-фтор-2,5-дигидрокси-4-метил-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}-8-фторхинолин-2(1H)-он;
5-{[(1a,2a,4b)-6-фтор-2,5-дигидрокси-4-метил-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}-2-метилфталазин-1-он;
(5a,6a,8b)-3-хлор-2-фтор-8-метил-5-[(2-метилхиназолин-5-ил)амино]-6-(трифторметил)-5,6,7,8-тетрагидронафталин-1,6-диол;
(5a,6a,8b)-3-хлор-2-фтор-5-[(7-фтор-2-метилхиназолин-5-ил)амино]-1-метокси-8-метил-6-(трифторметил)-5,6,7,8-тетрагидронафталин-6-ол;
(5a,6a,8b)-3-хлор-2-фтор-5-[(7-фтор-2-метилхиназолин-5-ил)амино]-8-метил-6-(трифторметил)-5,6,7,8-тетрагидронафталин-1,6-диол;
(5a,6a,8b)-3-хлор-2-фтор-5-[(8-фтор-2-метилхиназолин-5-ил)амино]-1-метокси-8-метил-6-(трифторметил)-5,6,7,8-тетрагидронафталин-6-ол;
(5a,6a,8b)-3-хлор-2-фтор-5-[(8-фтор-2-метилхиназолин-5-ил)амино]-8-метил-6-(трифторметил)-5,6,7,8-тетрагидронафталин-1,6-диол;
(5a,6a,8b)-3-хлор-5-[(7,8-дифтор-2-метилхиназолин-5-ил)амино]-2-фтор-8-метил-6-(трифторметил)-5,6,7,8-тетрагидронафталин-1,6-диол;
(5a,6a,8b)-3-хлор-2-фтор-8-метил-5-[(2-метилхинолин-5-ил)амино]-6-(трифторметил)-5,6,7,8-тетрагидронафталин-1,6-диол;
(+)-5-{[(1a,2a,4b)-7-хлор-2,5-дигидрокси-6-фтор-4-метил-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}хинолин-2(1H)-он;
(-)-5-{[(1a,2a,4b)-7-хлор-2,5-дигидрокси-6-фтор-4-метил-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}хинолин-2(1H)-он;
5-{[(1a,2a,4b)-7-хлор-2,5-дигидрокси-6-фтор-4-метил-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}-8-фторхинолин-2(1Н)-он;
(5a,6a,8b)-8-метил-5-[(2-метилхинолин-5-ил)амино]-6-(трифторметил)-5,6,7,8-тетрагидронафталин-1,6-диол;
(5a,6a,8b)-8-этил-5-[(2-метилхиназолин-5-ил)амино]-6-(трифторметил)-5,6,7,8-тетрагидронафталин-1,6-диол;
(+)-(5a,6a,8b)-8-этил-2-фтор-5-[(2-метилхиназолин-5-ил)амино]-6-(трифторметил)-5,6,7,8-тетрагидронафталин-1,6-диол;
(-)-(5a,6a,8b)-8-этил-2-фтор-5-[(2-метилхиназолин-5-ил)амино]-6-(трифторметил)-5,6,7,8-тетрагидронафталин-1,6-диол;
(5S,6R,8R)-8-этил-2-фтор-5-[(7-фтор-2-метилхиназолин-5-ил)амино]-6-(трифторметил)-5,6,7,8-тетрагидронафталин-1,6-диол;
(+)-(5a,6a,8b)-8-этил-2-фтор-5-[(8-фтор-2-метилхиназолин-5-ил)амино]-6-(трифторметил)-5,6,7,8-тетрагидронафталин-1,6-диол;
(-)-(5a,6a,8b)-8-этил-2-фтор-5-[(8-фтор-2-метилхиназолин-5-ил)амино]-6-(трифторметил)-5,6,7,8-тетрагидронафталин-1,6-диол;
(5a,6a,8b)-5-[(7,8-дифтор-2-метилхиназолин-5-ил)амино]-8-этил-2-фтор-6-(трифторметил)-5,6,7,8-тетрагидронафталин-1,6-диол;
5-{[(1a,2a,4b)-4-этил-6-фтор-2,5-дигидрокси-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}-хинолин-2(1Н)-он;
5-{[(1a,2a,4b)-4-этил-6-фтор-2-гидрокси-5-метокси-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}-8-фторхинолин-2(1H)-он;
(+)-5-{[(1a,2a,4b)-4-этил-6-фтор-2,5-дигидрокси-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}-8-фторхинолин-2(1Н)-он;
(-)-5-{[(1a,2a,4b)-4-этил-6-фтор-2,5-дигидрокси-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}-8-фторхинолин-2(1H)-он;
5-{[(1a,2a,4b)-4-этил-6-фтор-2,5-дигидрокси-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}-2-метилфталазин-1-он;
5-{[(1a,2a,4b)-4-тил-6-фтор-2,5-дигидрокси-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}-изохинолин-(2Н)-он;
5-{[(1a,2a,4b)-4-этил-6-фтор-2,5-дигидрокси-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}изохромен-1-он;
(5a,6a,8b)-5-[(2-этилхиназолин-5-ил)амино]-2-фтор-8-пропил-6-(трифторметил)-5,6,7,8-тетрагидронафталин-1,6-диол;
(5S,6R,8R)-8-этил-2,3-дифтор-5-[(2-метилхиназолин-5-ил)амино]-6-(трифторметил)-5,6,7,8-тетрагидронафталин-1,6-диол;
(+)-(5a,6a,8b)-8-этил-2,3-дифтор-5-[(7-фтор-2-метилхиназолин-5-ил)амино]6-(трифторметил)-5,6,7,8-тетрагидронафталин-1,6-диол;
(-)-(5a,6a,8b)-8-этил-2,3-дифтор-5-[(7-фтор-2-метилхиназолин-5-ил)амино]-6-(трифторметил)-5,6,7,8-тетрагидронафталин-1,6-диол;
(5S,6R,8R)-8-этил-2,3-дифтор-5-[(8-фтор-2-метилхиназолин-5-ил)амино]-6-(трифторметил)-5,6,7,8-тетрагидронафталин-1,6-диол;
(5S,6R,8R)-8-этил-2,3-дифтор-5-[(7,8-дифтор-2-метилхиназолин-5-ил)амино]-6-(трифторметил)-5,6,7,8-тетрагидронафталин-1,6-диол;
(+)-5-{[(1a,2a,4b)-4-этил-6,7-дифтор-2,5-дигидрокси-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}хинолин-2(1H)-он;
(-)-5-{[(1a,2a,4b)-4-этил-6,7-дифтор-2,5-дигидрокси-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}хинолин-2(1H)-он;
(5a,6a,8b)-8-этил-2,3-дифтор-5-[(2-метилхинолин-5-ил)амино]-6-(трифторметил)-5,6,7,8-тетрагидронафталин-1,6-диол;
5-{[(1a,2a,4b)-4-этил-6,7-дифтор-2,5-дигидрокси-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}фталазин-1-он;
(5a,6a,8b)-2-фтор-5-[(2-метилхиназолин-5-ил)амино]-8-проп-1-ил-6-(трифторметил)-5,6,7,8-тетрагидронафталин-1,6-диол;
(5a,6a,8a)-2-фтор-5-[(2-метилхиназолин-5-ил)амино]-8-проп-1-ил-6-(трифторметил)-5,6,7,8-тетрагидронафталин-1,6-диол;
(5a,6a,8b)-2-фтор-5-[(7-фторо-2-метилхиназолин-5-ил)амино]-8-проп-1-ил-6-(трифторметил)-5,6,7,8-тетрагидронафталин-1,6-диол;
5-{[(1a,2a,4b)-4-этил-6,7-дифтор-2,5-дигидрокси-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}хинолин-2(1H)-он;
5-{[(1a,2a,4b)-4-этил-6,7-дифтор-2,5-дигидрокси-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}изохинолин-1(2H)он;
5-{[(1S,2R,4R)-6-хлор-2,5-дигидрокси-4-метил-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}-1H-хинолин-2-он;
5-{[(1S,2R,4S)-6-хлор-2,5-дигидрокси-4-метил-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}-8-фтор-1H-хинолин-2-он;
5-{[(1S,2R,4S)-6-хлор-2,5-дигидрокси-4-метил-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}-2H-хинолин-1-он;
5-{[(1S,2R,4R)-6-хлор-2,5-дигидрокси-4-метил-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}-2Н-хинолин-1-он;
5-{[(1S,2R,4S)-6-хлор-2,5-дигидрокси-4-метил-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}изохромен-1-он;
5-{[(1S,2R,4R)-6-хлор-2,5-дигидрокси-4-метил-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}изохромен-1-он;
4-{[(1S,2R,4S)-6-хлор-2,5-дигидрокси-4-метил-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}-1,3-дигидроиндол-2-он;
4-{[(1S,2R,4R)-6-хлор-2,5-дигидрокси-4-метил-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}-1,3-дигидроиндол-2-он;
5-{[(1S,2R,4S)-хлор-2,5-дигидрокси-4-этил-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}-1H-хинолин-2-он;
5-{[(1a,2a,4b)-6-хлор-2,5-дигидрокси-4-этил-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}-1Н-хинолин-2-он;
5-{[(1S,2R,4S)-6-хлор-2,5-дигидрокси-4-этил-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}-8-фтор-1Н-хинолин-2-он;
5-{[(1S,2R,4R)-6-хлор-4-этил-2,5-дигидрокси-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}-8-фтор-1Н-хинолин-2-он;
5-{[(1S,2R,4S)-6-хлор-2,5-дигидрокси-4-этил-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}-2H-хинолин-1-он;
5-{[(1S,2R,4R)-6-хлор-4-этил-2,5-дигидрокси-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}-2H-хинолин-1-он;
5-{[(1S,2R,4S)-6-хлор-2,5-дигидрокси-4-этил-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}-изохромен-1-он;
5-{[(1S,2R,4R)-6-хлор-4-этил-2,5-дигидрокси-4-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}изохромен-1-он;
4-{[(1S,2R,4S)-6-хлор-2,5-дигидрокси-4-этил-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}-1,3-дигидроиндол-2-он;
4-{[(1S,2R,4R)-6-хлор-2,5-дигидрокси-4-этил-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}-1,3-дигидроиндол-2-он;
5-{[(1S,2R,4S)-6-хлор-2,5-дигидрокси-4-этил-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}-7-фтор-1Н-хинолин-2-он;
5-{[(1S,2R,4R)-6-хлор-4-этил-2,5-дигидрокси-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}-7-фтор-1Н-хинолин-2-он;
5-{[(1S,2R,4S)-6-хлор-2,5-дигидрокси-4-метил-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}-7-фтор-1H-хинолин-2-он;
5-{[(1S,2R,4R)-6-хлор-2,5-дигидрокси-4-метил-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}-7-фтор-1Н-хинолин-2-он;
(5a,6a,8b)-2-хлор-8-этил-5-[(индазол-5-ил)амино]-6-(трифторметил)-5,6,7,8-тетрагидронафталин-1,6-диол;
6-{[(1a,2a,4b)-6-хлор-2,5-дигидрокси-4-этил-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}-4-метилбензо[d][1,2]оксазин-1-он;
5-{[(1a,2a,4b)-7-изопропил-2,5-дигидрокси-4-этил-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}-1H-хинолин-2-он;
(5a,6a,8b)-8-этил-3-изопропил-5-[2-метилхиназолин-5-иламино]-6-(трифторметил)-5,6,7,8-тетрагидронафталин-1,6-диол;
5-{[(1a,2a,4b)-7-изопропил-2,5-дигидрокси-4-этил-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}-2H-хинолин-1-он;
4-{[(1a,2a,4b)-7-изопропил-2,5-дигидрокси-4-этил-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}-1,3-дигидроиндол-2-он;
5-{[(1a,2a,4b)-7-изопропил-2,5-дигидрокси-4-этил-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}изохромен-1-он;
5-{[(1a,2a,4b)-7-изопропил-2,5-дигидрокси-4-этил-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}-8-фтор-1Н-хинолин-2-он;
5-{[(1a,2a,4b)-7-изопропил-2,5-дигидрокси-4-этил-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}-8-фтор-1H-хинолин-2-он;
5-{[(1a,2a,4b)-7-хлор-2,5-дигидрокси-4-этил-6-метил-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}-1Н-хинолин-2-он;
5-{[(1S,2R,4R)-7-хлор-2,5-дигидрокси-6-метил-4-этил-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}-2Н-хинолин-1-он;
5-{[(1a,2a,4a)-7-хлор-2,5-дигидрокси-6-метил-4-этил-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}изохромен-1-он;
4-{[(1a,2a,4b)-7-хлор-2,5-дигидрокси-6-метил-4-этил-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}-1,3-дигидроиндол-2-он;
5-{[(1a,2a,4b)-7-хлор-2,5-дигидрокси-4-этил-6-метил-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}-8-фтор-1H-хинолин-2-он;
5-{[(1S,2R,4R)-7-хлор-2,5-дигидрокси-4-этил-6-метил-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}-8-фтор-1H-хинолин-2-он;
(5a,6a,8b)-3-хлор-8-этил-2-метил-5-[2-метилхиназолин-5-иламино]-6-(трифторметил)-5,6,7,8-тетрагидронафталин-1,6-диол;
5-{[(1S,2R,4S)-7-хлор-2,5-дигидрокси-4-этил-6-метил-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}-7-фтор-1Н-хинолин-2-он;
5-{[(1a,2a,4b)-7-хлор-2,5-дигидрокси-4-этил-6-метил-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}-7-фтор-1Н-хинолин-2-он;
5-{[(1S,2R,4R)-7-хлор-2,5-дигидрокси-4-этил-6-метил-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}-7-фтор-1H-хинолин-2-он;
(5S,6R,8R)-8-этил-2,3-дифтор-5-[(2-метилхиназолин-5-ил)амино]-6-(трифторметил)-5,6,7,8-тетрагидронафталин-1,6-диол;
5-{[(1S,2R,4R)-4-этил-7-фтор-2,5-дигидрокси-6-метил-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}хинолин-2(1Н)-он;
5-{[(1S,2R,4R)-4-этил-7-фтор-2,5-дигидрокси-6-метил-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}-7-фторхинолин-2(1H)-он;
5-{[(1S,2R,4R)-4-этил-7-фтор-2,5-дигидрокси-6-метил-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}-8-фторхинолин-2(1Н)-он;
5-{[(1S,2R,4R)-4-этил-7-фтор-2,5-дигидрокси-6-метил-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}изохинолин-1(2Н)-он;
(5S,6R,8R)-8-этил-3-фтор-5-[(7-фтор-2-метилхиназолин-5-ил)амино]-2-метил-6-(трифторметил)-5,6,7,8-тетрагидронафталин-1,6-диол;
(5S,6R,8R)-8-этил-3-фтор-5-[(8-фтор-2-метилхиназолин-5-ил)амино]-2-метил-6-(трифторметил)-5,6,7,8-тетрагидронафталин-1,6-диол;
5-{[(1S,2R,4S)-4,6-диэтил-7-фтор-2,5-дигидрокси-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}хинолин-2(1Н)-он;
5-{[(1S,2R,4R)-4,6-диэтил-7-фтор-2,5-дигидрокси-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}хинолин-2(1Н)-он;
5-{[(1S,2R,4S)-4,6-диэтил-7-фтор-2,5-дигидрокси-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}-7-фторхинолин-2(1Н)-он;
5-{[(1S,2R,4R)-4,6-диэтил-7-фтор-2,5-дигидрокси-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}-7-фторхинолин-2(1Н)-он;
5-{[(1S,2R,4R)-4,6-диэтил-2,5-дигидрокси-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}-1Н-хинолин-2-он;
5-{[(1S,2R,4R)-4,6-диэтил-2,5-дигидрокси-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}-1Н-хинолин-2-он;
5-{[(1S,2R,4S)-4,6-диэтил-2,5-дигидрокси-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}-8-фтор-1H-хинолин-2-он;
5-{[(1S,2R,4R)-4,6-диэтил-2,5-дигидрокси-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}-8-фтор-1Н-хинолин-2-он;
(5S,6R,8S)-2,8-диэтил-5-[2-метилхиназолин-5-иламино]-6-(трифторметил)-5,6,7,8-тетрагидронафталин-1,6-диол;
5-{[(1a,2a,4b)-7-хлор-2,5-дигидрокси-4-этил-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}-1Н-хинолин-2-он;
5-{[(1a,2a,4b)-7-хлор-2,5-дигидрокси-4-этил-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}-8-фтор-1Н-хинолин-2-он;
5-{[(1S,2R,4R)-6-хлор-4-этил-2,5-дигидрокси-7-фтор-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}хинолин-2(1Н)-он;
5-{[(1S,2R,4R)-6-хлор-4-этил-2,5-дигидрокси-7-фтор-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}-7-фторхинолин-2(1H)-он;
5-{[(1S,2R,4R)-6-хлор-4-этил-2,5-дигидрокси-7-фтор-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}-8-фторхинолин-2(1H)-он;
(5S,6R,8R)-2-хлор-8-этил-3-фтор-5-[(2-метилхиназолин-5-ил)амино]-6-(трифторметил)-5,6,7,8-тетрагидронафталин-1,6-диол;
(5S,6R,8R)-2-хлор-8-этил-3-фтор-5-[(7-фтор-2-метилхиназолин-5-ил)амино]-6-(трифторметил)-5,6,7,8-тетрагидронафталин-1,6-диол;
5-{[(1a,2a,4b)-7-фтор-2,5-дигидрокси-4-этил-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}-7-фтор-1Н-хинолин-2-он;
5-{[(5S,6R,8R)-8-этил-3-фтор-1,6-дигидрокси-6-(трифторметил)-5,6,7,8-тетрагидронафталин-5-ил]амино}-8-фторхинолин-2(1H)-он;
5-{[(1a,2a,4b)-7-фтор-2,5-дигидрокси-4-метил-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}-7-фтор-1Н-хинолин-2-он;
5-{[(1a,2a,4b)-7-фтор-2,5-дигидрокси-4-метил-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}-8-фтор-1Н-хинолин-2-он;
5-{[(1a,2a,4b)-7-бром-2,5-дигидрокси-4-этил-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}-1Н-хинолин-2-он;
5-{[(1S,2R,4R)-7-бром-2,5-дигидрокси-4-этил-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}-7-фтор-1Н-хинолин-2-он;
5-{[(1a,2a,4b)-7-бром-2,5-дигидрокси-4-этил-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}-8-фтор-1Н-хинолин-2-он;
5-{[(1a,2a,4b)-6-фтор-2,7-дигидрокси-4-метил-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}-1H-хинолин-2-он;
(5a,6a,8b)-8-этил-1,6-дигидрокси-5-(2-оксо-1,2-дигидрохинолин-5-иламино)-6-(трифторметил)-5,6,7,8-тетрагидронафталин-2-карбонитрил;
(5a,6a,8b)-8-этил-1,6-дигидрокси-5-(8-фтор-2-оксо-1,2-дигидрохинолин-5-иламино)-6-(трифторметил)-5,6,7,8-тетрагидронафталин-2-карбонитрил;
(5a,6a,8b)-8-этил-1,6-дигидрокси-5-[(1-оксо-1,2-дигидроизохинолин-5-ил)амино]-6-(трифторметил)-5,6,7,8-тетрагидронафталин-2-карбонитрил;
(5a,6a,8b)-1,6-дигидрокси-8-метил-5-[(2-оксо-2,3-дигидро-1H-индол-4-ил)амино]-6-(трифторметил)-5,6,7,8-тетрагидронафталин-2-карбонитрил;
(5a,6a,8b)-5-[(8-фтор-2-оксо-1,2-дигидрохинолин-5-ил)амино]-1,6-дигидрокси-8-метил-6-(трифторметил)-5,6,7,8-тетрагидронафталин-2-карбонитрил;
5-{[(5S,6R,8R)-8-этил-1,6-дигидрокси-3-фтор-5-[(2-оксо-1,2-дигидрохинолин-5-ил)амино]-6-(трифторметил)-5,6,7,8-тетрагидронафталин-2-карбонитрил;
(5a,6a,8b)-8-этил-1,6-дигидрокси-3-фтор-5-[(8-фтор-2-оксо-1,2-дигидрохинолин-5-ил)амино]-6-(трифторметил)-5,6,7,8-тетрагидронафталин-2-карбонитрил;
5-{[(1S,2R,4S)-2,5-дигидрокси-4-метил-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}-7-фтор-1H-хинолин-2-он;
5-[(1S,2R,4R)-2,5-дигидрокси-4-метил-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}-7-фтор-1Н-хинолин-2-он;
5-[(1S,2R,4S)-2,5-дигидрокси-4-метил-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}-8-фтор-1Н-хинолин-2-он;
5-{[(1S,2R,4R)-2,5-дигидрокси-4-метил-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}-8-фтор-1Н-хинолин-2-он;
5-{[(1a,2a,4b)-4-этил-2,5-дигидрокси-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}-6-фтор-1Н-хинолин-2-он;
5-{[(1a,2a,4b)-4-этил-6-фтор-2,5-дигидрокси-7-метил-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}-1H-хинолин-2-он;
5-{[(1a,2a,4b)-4-этил-6-фтор-2,5-дигидрокси-7-метил-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}-7-фтор-1H-хинолин-2-он;
5-{[(1a,2a,4b)-4-этил-6-фтор-2,5-дигидрокси-7-метил-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}-8-фтор-1Н-хинолин-2-он;
5-{[(1a,2a,4b)-4-этил-6-фтор-2,5-дигидрокси-7-метил-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}-2H-хинолин-1-он;
(5a,6a,8b)-8-этил-2-фтор-3-метил-5-[2-метилхиназолин-5-иламино]-6-(трифторметил)-5,6,7,8-тетрагидронафталин-1,6-диол;
(5S,6R,8R)-8-этил-2,3-дифтор-5-[(2-метил-1-оксихинолин-5-ил)амино]-6-(трифторметил)-5,6,7,8-тетрагидронафталин-1,6-диол;
5-{[(1a,2a,4b)-2,5-дигидрокси-6,7-диметил-4-этил-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}-1Н-хинолин-2-он;
5-{[(1a,2a,4b)-2,5-дигидрокси-6,7-диметил-4-этил-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}-8-фтор-1Н-хинолин-2-он;
5-{[(1a,2a,4b)-2,5-дигидрокси-6,7-диметил-4-этил-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1-ил]амино}-2Н-хинолин-1-он;
5-{[(5S,6R,8R)-2-хлор-8-этил-1,6-дигидрокси-3-фтор-2-6-(трифторметил)-5,6,7,8-тетрагидронафталин-5-ил]амино}хинолин-2(1H)-он;
5-{[(5S,6R,8R)-3-хлор-8-этил-1,6-дигидрокси-2-6-(трифторметил)-5,6,7,8-тетрагидронафталин-5-ил]амино}-7-фторхинолин-2(1H)-он;
(5S,6R,8R)-2,3-дихлор-8-этил-5-[(7-фтор-2-метилхиназолин-5-ил)амино]-6-(трифторметил)-5,6,7,8-тетрагидронафталин-1,6-диол;
(5S,6R,8R)-2-хлор-8-этил-5-[(7-фтор-2-метилхиназолин-5-ил)амино]-6-(трифторметил)-5,6,7,8-тетрагидронафталин-1,6-диол или
(5S,6R,8R)-3-хлор-8-этил-5-[(7-фтор-2-метилхиназолин-5-ил)амино]-6-(трифторметил)-5,6,7,8-тетрагидронафталин-1,6-диол.
4. Применение соединений по пп.1, 2 или 3 для получения лекарственных средств.
5. Применение соединений по пп.1, 2 или 3 для получения лекарственных средств для лечения воспалительных заболеваний.
6. Энантиомерно чистые сложные эфиры формулы (VII)
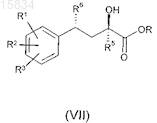
где R1, R2, R3, R5и R6 имеют значения, приведенные в п.1, a R означает этил.
Текст
Дата публикации и выдачи патента Номер заявки Изобретение относится к многократно замещенным производным тетрагидронафталина формулы к способу их получения и их применению в качестве ингибиторов воспаления.(71)(73) Заявитель и патентовладелец: БАЙЕР ШЕРИНГ ФАРМА АКЦИЕНГЕЗЕЛЬШАФТ (DE) 015834 Данная патентная заявка испрашивает приоритет европейской заявки ЕР 06090031,3 (дата подачи 15.03.2006), кроме того, она претендует на все преимущества даты подачи заявки на патент США 60/784441 (дата подачи 22.03.2006, предварительная заявка США). Изобретение относится к производным тетрагидронафталина, способу их получения и их применению в качестве ингибиторов воспаления. Из уровня техники (WO 2005/034939) известны циклические ингибиторы воспаления общей формулы (I) причем эти соединения в ходе эксперимента проявляют активные диссоциации между противовоспалительными и нежелательными метаболическими действиями. К тому же эти соединения обладают улучшенной избирательностью по сравнению с другими стероидными рецепторами. Неожиданно было обнаружено, что соединения формул (Ia) являются особенно диссоциированными, принимая во внимание побочные действия, которые in vitro можно измерить в виде ТАТ индукции. Поэтому настоящее изобретение относится к стереоизомерам общей формулы (Ia)I) остатки R1, R2 и R3 независимо друг от друга выбраны из -ОН, О-СН 3, Cl, F, Н;IV) остаток R6 выбран из -СН 3, -СН 2-СН 3, -(СН 2)2-СН 3 или -СН=СН 2,а также к солям соединений общей формулы (Ia) с физиологически совместимыми анионами, причем соединения представлены в 1,2,4-конфигурации основного вещества 1-амино-1,2,3,4-тетрагидронафталин-2-ола или в 5,6,8-конфигурации основного вещества 5,6,7,8-тетрагидронафталин-1,6 диола. Определения. Реагенты, которые при необходимости используются во время синтеза, имеются в продаже или опубликованные синтезы соответствующих реагентов относятся к уровню техники или могут применяться аналогично опубликованным синтезам. В качестве особенно предпочтительных стереоизомеров описанного соединения следует назвать те(1,2,3,4)-тетрагидронафталины, которые содержат (1S,2R,4R) или (1S,2R,4S) как абсолютную конфигурацию у 1-амино-1,2,3,4-тетрагидронафталин-2-ол основного вещества. Исходя из правил номенклатуры ИЮПАК при 1,6-дигидрокси замещении тетрагидронафталина это соответствует (5S,6R,8R)конфигурации основного вещества 5,6,7,8-тетрагидронафталин-1,6-диола (см. примеры) или (5S,6R,8S)конфигурации. Согласно изобретению стереоизомеры могут также находиться в виде солей с физиологически совместимыми анионами, например в виде гидрохлорида, сульфата, нитрата, фосфата, пивалата, малеата,фумарата, тартрата, бензоата, мезилата, цитрата или сукцината. Соединения согласно изобретению получают тем, что а) согласно известным из уровня техники методам генерируют предшественники с открытой цепью общей формулы (II), в которой остатки R1, R2, R3, R4 и R5 имеют значения, приведенные в п.1 формулы изобретения которые потом или без дополнительного реагента, или путем добавления неорганических или органических кислот или кислот Льюиса при температурах в пределах от -70 до +80 С (предпочтительно в пределах от -30 до +80 С) циклизуют и перегруппировывают до получения соединений общей формулы (III). Каталитическое гидрирование, которое при необходимости может быть проведено диастереоселективно,потом дает соединения общей формулы (Ib), в которой R6 соответствует этильной группе;b) полученные согласно известным из уровня техники методам стиролы общей формулы (IV) при необходимости посредством проведенной энантиоселективной еновой реакции с помощью хиральных кислот Льюиса переводят в соединения общей формулы (V). В качестве хиральных кислот Льюиса для энантиоселективного генерирования четвертичной спиртовой функции могут применяться (R)- или (S)SEGPHOS-PdCl2 (Mikami et al. Tetrah. Asymm. 2004, 15, 3885-89), (R)- или (S)-BINOL-Ti(OiPr)2 (Ding et который затем или без дополнительного реагента, или посредством добавления неорганических или органических кислот или кислот Льюиса при температурах в пределах от -70 до +80 С (предпочтительно в пределах от -30 до +80 С) циклизуют до получения соединений общей формулы (Ia). В вышеприведенных формулах в общем определенные остатки R1, R2, R3, R4, R5 и R6 имеют значения, приведенные в п.1-2 015834 формулы изобретения. Таким образом, стереоизомеры общей формулы (Ia) можно получить следующим образом: имины общей формулы (VI) или (II) или без дополнительного реагента в растворителе или концентрированных органических кислотах или посредством добавления неорганических или органических кислот или кислот Льюиса при температурах в пределах от -70 до +80 С (предпочтительно в пределах от -30 до +80 С) циклизуют до получения стереоизомеров общей формулы (Ia) или (III), а также их непосредственных предшественников формулы (V). Новые имины (IV) для циклизации равным образом являются объектом настоящего изобретения, в особенности те, которые раскрыты с помощью примеров. Особенно предпочтительным способом является метод получения соединений общей формулы (V),в которой в качестве катализаторов энантиоселективной еновой реакции используют [Cu(S,S)-бис-(третбутилоксазолин)] (SbF6)2 или [Cu(R,R)-бис-(трет-бутилоксазолин)] (SbF6)2 и достигают избытков энантиомеров до 95%, которые могут быть еще повышены путем кристаллизации. Энантиомерно чистые соединения формулы (V) путем хроматографических методов разделения на силикагеле на стадии гидрированного альдегида или имина затем могут быть переведены в энантиомерно чистые соединения формулы (VI). Альтернативно для получения энантиомерно чистого соединения формулы (VI) могут использоваться диастереоселективные методы гидрирования. В качестве катализаторов для указанного выше каталитического гидрирования пригодны: 1) палладий на угле; 2) никель Ренея; 3) родиевые катализаторы с хиральными лигандами, такие как описаны в нижеследующих публикациях:Weissenstein et al., Adv. Synth.Catal. 2003, 345,160-164,Imwinkelried et al., Chimia 1997, 51, 300; 4) иридиевые катализаторы с хиральными лигандами, такие как описаны в нижеследующих публикациях:Pfaltz et al., Org.Lett. 2004, 6, 2023-2026,Blaser et al., Chimia 1999, 53, 275; 5) рутениевые катализаторы с хиральными лигандами, такие как описаны в нижеследующей публикации:Chirality 2000, 12, 514-522. Таким образом, другим объектом изобретения являются энантиомерно чистые сложные эфиры формулы (VII) которые могут быть получены путем диастереоселективных методов гидрирования или разделения диастереомеров. Связывание веществ к глюкокортикоидному рецептору (ГР) и другим стероидным гормональным рецепторам (минералкортикоидный рецептор (МР), прогестероновый рецептор (ПР) и андрогеновый рецептор (АР контролируется с помощью рекомбинантно полученных рецепторов. Препарирования цитозоля Sf9 клеток, которые были инфицированы рекомбинантными бакуловирусами, которые кодируют ГР, используют для исследований связывания. В отличие от стандартного вещества [3 Н]-дексаметазон вещества показывают высокое сродство к ГР. Как существенный, молекулярный механизм противовоспалительного действия глюкокортикоидов рассматривается переданное посредством ГР ингибирование транскрипции цитокинов, сцепления молекул, энзимов и других провоспалительных факторов. Это ингибирование достигается путем взаимодействия ГР с другими факторами транскрипции, например АР-1 и NF-каппа-В (для обзора см. Cato ACBand Wade E, BioEssays 18, 371-378, 1996). Согласно изобретению стереоизомеры общей формулы (Ia) ингибируют вызванную посредством липополисахарида (ЛПС) секрецию цитокина IL-8 в человеческой моноцитарной клеточной линии ТНР-1. Противовоспалительное действие стереоизомеров общей формулы (Ia) было испытано в ходе эксперимента на животных посредством исследования воспаления, вызванного кротоновым маслом, у крыс и мышей (J. Exp. Med. (1995), 182, 99-108). Для этого животным местно нанесли на уши спиртовой раствор кротонового масла. Испытуемые вещества нанесли одновременно или за 2 ч до кротонового масла-3 015834 также местно или системно. Через 16-24 ч вес ушей измеряли как меру воспалительного отека, активность пероксидазы как меру для диффузии гранулоцитов и активность эластазы как меру для диффузии нейтрофильных гранулоцитов. Стереоизомеры общей формулы (Ia) в этом тесте ингибировали три указанных выше воспалительных параметра как после местного, так и после системного нанесения. Одним из самых частых нежелательных действий глюкокортикоидной терапии является так называемый "стероидный диабет" [ср. Hatz, H.J., Glucocorticoide: Immunologische Grundlagen, Pharmakologieund Therapierichtlinien, Wissenschaftliche Verlagsgesellschaft mbH, Stuttgart, 1998]. Причиной этому является стимуляция глюконеогенеза в печени посредством индукции отвечающих за это энзимов и посредством свободных аминокислот, которые образуются из расщепления белков (катаболическое действие глюкокортикоидов). Ключевым энзимом катаболического обмена веществ в печени является тирозинаминотрансфераза (ТАТ). Активность этого энзима может быть определена фотометрически из печеночных гомогенатов и представляет собой хорошую меру для нежелательных метаболических действий глюкокортикоидов. Для измерения ТАТ индукции через 8 ч после приема испытуемых веществ животных умерщвляли, извлекали печень и измеряли активность ТАТ в гомогенате. В этом тесте стереоизомеры общей формулы (Ia) в дозах, в которых они действуют противовоспалительно, не индуцировали или индуцировали только в незначительной мере тирозинаминотрансферазу. Исходя из их противовоспалительного и дополнительного противоаллергического, иммунодепрессивного и антипролиферативного действия согласно изобретению стереоизомеры общей формулы (Ia) могут применяться в качестве лекарств для лечения или профилактики следующих болезненных состояний у млекопитающих и людей: при этом понятие "заболевание" относится к нижеследующим показаниям:(i) заболевания легких, сопровождающиеся воспалительными, аллергическими и/или пролиферативными процессами: хронические обструктивные заболевания легких любого генеза, прежде всего бронхиальная астма; бронхит различного генеза; все формы рестриктивных заболеваний легких, прежде всего аллергический альвеолит; все формы отека легких, прежде всего токсический отек легких; саркоидозы и гранулематозы, в особенности болезнь Бека;(ii) ревматические заболевания/аутоиммунные заболевания/заболевания суставов, сопровождающиеся воспалительными, аллергическими и/или пролиферативными процессами: все формы ревматических заболеваний, в особенности ревматоидный артрит, острая ревматическая лихорадка, ревматическая полимиалгия; реактивный артрит; воспалительные заболевания мягких частей тела другого генеза; артритические симптомы при дегенеративных заболеваниях суставов (артрозы); травматические артритиды; коллагеновые заболевания любого генеза, например системная красная волчанка, склеродермия,полимиозит, дерматомиозитный синдром Шегрена, синдром Стилла, синдром Фелти;(iii) аллергии, сопровождающиеся воспалительными и/или пролиферативными процессами: все виды аллергических реакций, например отек Квинке, сенная лихорадка, укусы насекомых, аллергические реакции на лекарства, препараты крови, контрастные вещества и т.д., анафилактический шок, крапивница, контактный дерматит;(iv) воспаления стенок сосудов (васкулиты): узловатый панартериит, артериит темпоральный, узловатая эритема;(v) дерматологические заболевания, сопровождающиеся воспалительными, аллергическими и/или пролиферативными процессами: атопический дерматит (прежде всего у детей); псориаз; красный волосяной лишай; эритематозные заболевания, вызванные различными вредными факторами, например излучением,химикатами, ожогами и т.д.; буллезные кожные болезни; лихеноидные заболевания; кожный зуд (например, аллергического генеза); себорейная экзема; розацеа; обыкновенная пузырчатка; многоформная экссудативная эритема; баланит-вульвит; выпадение волос, такое как круговидное облысение; кожная лимфома Т-клеток;(vii) заболевания печени, сопровождающиеся воспалительными, аллергическими и/или пролиферативными процессами: острая диссоциация печеночных клеток; острые гепатиты различного генеза, например вирусный, токсический, вызванный приемом лекарств; хронически агрессивный и/или хронически перемежающийся гепатит;(xi) заболевания уха, горла, носа, сопровождающиеся воспалительными, аллергическими и/или пролиферативными процессами: аллергический ринит, сенной насморк; наружный отит, например вызванный контактной экземой, инфекцией и т.д.; воспаление среднего уха;(xii) неврологические заболевания, сопровождающиеся воспалительными, аллергическими и/или пролиферативными процессами: отек головного мозга, прежде всего обусловленный опухолью; рассеянный склероз; острый энцефаломиелит; менингит; различные виды судорожных припадков, например молниеносные салаамовы судороги;(xiv) онкологические заболевания, сопровождающиеся воспалительными, аллергическими и/или пролиферативными процессами: острый лимфалейкоз; злокачественные лимфомы; лимфогранулематозы; лимфосаркомы; обширные метастазирования, прежде всего при раке молочной железы, бронхогенном раке и раке предстательной железы;(xvii) тяжелые шоковые состояния, например анафилактический шок, синдром системного воспалительного ответа (SIRS);(хх) заместительная терапия при: врожденной первичной недостаточности надпочечников, например врожденный адреногенитальный синдром; приобретенной первичной недостаточности надпочечников, например болезнь Аддисона, аутоиммунный адреналит, постинфекционный, опухоли, метастазы и т.д.; врожденной вторичной недостаточности надпочечников, например врожденный гипопитуитаризм; приобретенной вторичной недостаточности надпочечников, например постинфекционной, опухолях и т.д. Особую эффективность проявляют лекарственные средства, содержащие стереоизомеры общей формулы (Ia), при следующих заболеваниях: 1) заболевания легких; 2) ревматические заболевания/аутоиммунные заболевания; 3) дерматологические заболевания; 4) дегенеративные заболевания суставов; 5) воспаление стенки сосуда; 6) реакция "трансплантат против хозяина"; 7) тяжелые шоковые состояния; 8) рвота, сопровождающаяся воспалительными, аллергическими и/или пролиферативными процессами; 9) боль, вызванная воспалением. Сверх этого, согласно изобретению стереоизомеры общей формулы (Ia) могут использоваться для терапии и профилактики других не указанных выше болезненных состояний, для которых в настоящее время применяются синтетические глюкокортикоиды (для этого см. Hatz, H.J., Glucocorticoide:mbH, Stuttgart, 1998). Все ранее названные показания от (i) до (хх) подробно описаны в Hatz, H.J., Glucocorticoide:mbH, Stuttgart, 1998. Для терапевтических воздействий при указанных выше болезненных состояниях приемлемая доза является различной и зависит, например, от силы действия соединения общей формулы (Ia), "хозяина",способа применения, вида и тяжести состояний, которые лечатся, а также применения как профилактического или терапевтического средства. Изобретение относится к применению заявляемых соединений/стереоизомеров для получения лекарственных средств. Кроме того, изобретение относится к:(i) применению одного из стереоизомеров согласно изобретению согласно формуле (Ia) или их смесей для получения лекарства для лечения заболевания;(ii) способу лечения заболевания, причем способ включает применение согласно изобретению стереоизомера формулы (Ia), причем количества, достаточного для подавления заболевания;(iii) фармацевтической композиции для лечения заболевания, лечение которого включает стереоизомеры согласно изобретению, или их смесей и по меньшей мере одно фармацевтическое вспомогательное вещество и/или носитель. В общем удовлетворительных результатов можно ожидать у животных, если ежедневные дозы содержатся в пределах от 1 до 100000 мкг соединения согласно изобретению на 1 кг массы тела. Для более крупных млекопитающих, например людей, рекомендованная ежедневная доза находится в пределах от 1 до 100000 мкг на 1 кг массы тела. Предпочтительна доза от 10 до 30000 мкг на 1 кг массы тела, особенно предпочтительна доза от 10 до 10000 мкг на 1 кг массы тела. Например, целесообразно принимать эту дозу несколько раз в день. Для лечения острых шоковых состояний (например, анафилактический шок) могут выдаваться однократные дозы, которые явно являются выше указанных доз. Составление фармацевтических препаратов на основе новых соединений происходит известным образом, при котором действующее вещество перерабатывают с используемыми в галеновых препаратах веществами-носителями, наполнителями, средствами, влияющими на распад, связывающими веществами, стабилизаторами влажности, веществами, придающими скользкость, абсорбентами, разбавителями, улучшителями вкуса, красителями и т.д., и переводят в желаемую форму применения. При этом ссылка делается на-6 015834 Для перорального применения в особенности пригодны таблетки, драже, капсулы, пилюли, порошки, грануляты, пастилки, суспензии, эмульсии или растворы. Для парентерального применения возможны инъекционные и инфузионные препараты. Для внутрисуставной инъекции могут применяться приготовленные соответствующим образом суспензии кристаллов. Для внутримышечной инъекции могут быть применены водные и масляные растворы для инъекций или суспензии и соответствующие препараты пролонгированного действия. Для ректального применения новые соединения могут применяться в виде суппозиторий, капсул,растворов (например, в виде клизм) и мазей как для системной, так и для местной терапии. Для легочного применения новых соединений их можно применять в виде аэрозолей и ингалятов. Для местного применения на глаза, в наружный слуховой проход, среднее ухо, носовую полость и придаточные полости носа, новые соединения могут применяться в виде капель, мазей и настоек в соответствующих фармацевтических композициях. Для местного нанесения возможны препараты в виде гелей, мазей, жировых мазей, кремов, паст,присыпок, молочка и настоек. Дозировка соединений общей формулы (Ia) в этих композициях должна составлять 0,01-20% для того, чтобы достичь необходимого фармакологического действия. Также изобретение включает соединения общей формулы (Ia) согласно изобретению в качестве терапевтического действующего вещества. Далее к изобретению относятся соединения общей формулы(Ia) согласно изобретению в качестве терапевтического действующего вещества вместе с фармацевтически совместимыми и приемлемыми вспомогательными веществами и носителями. Равным образом изобретение относится к фармацевтической композиции, содержащей одно из фармацевтически активных соединений согласно изобретению или его смесь, или его фармацевтически совместимую соль и одну фармацевтически совместимую соль или фармацевтически совместимые вспомогательные вещества и носители. Кроме того, изобретение относится к комбинированному лечению или комбинированным композициям, в которых глюкокортикоидный рецептор (ГР) агонист формулы (Ia) или его фармацевтически приемлемую соль, или фармацевтическую композицию, содержащую ГР агонист формулы (Ia) или их фармацевтически приемлемую соль, вводят или одновременно (при необходимости в ту же самую композицию) или друг за другом вместе с одним или несколькими лекарственными средствами для лечения одного из указанных выше болезненных состояний. Например, для лечения ревматоидного артрита, остеоартрита, ХОЗЛ (хронического обструктивного заболевания легких), астмы или аллергического ринита,ГР агонист настоящего изобретения может быть скомбинирован с одним или несколькими лекарственными средствами для лечения такого состояния. Если такая комбинация вводится путем ингаляции, то комбинируемое лекарственное средство может быть выбрано из следующего перечня:PDE4 ингибитор, включая ингибитор изоформы PDE4D; избирательный агонист 2 адренорецептора, такой как, например, метапротеренол, изопротеренол,изопреналин, альбутерол, сальбутамол, формотерол, сальметерол, тербуталин, орципреналин, битолтеролмезилат, пирбутерол или индакатерол; антагонист мускариновлгл рецептора (например, М 1, М 2 или М 3 антагонист, такой как, например,избирательный М 3 антагонист), такой как, например, ипратропийбромид, титропийбромид, окситропийбромид, пирензепин или телензепин; модулятор функции хемокинового рецептора (как, например, CCR1 рецептор антагонист) или ингибитор функции р 38 киназы. Для другого объекта настоящего изобретения такая комбинация с ГР агонистом формулы (Ia) или его фармацевтически приемлемой солью используется для лечения ХОЗЛ, астмы или аллергического ринита и может применяться путем ингаляции или перорально в комбинации с ксантином (как, например, аминофилин или теофилин), которые также могут вводиться путем ингаляции или перорально. Экспериментальная часть Пример 1-7 015834 ТГФ и при комнатной температуре добавляют 39 мл (556 ммоль) дибромметана. Перемешивают в последующие 30 мин и добавляют по каплям при 0 С 68,8 мл (68,8 ммоль) 1 М раствор хлорида титана(IV) в дихлорметане. Охлаждающую ванну удаляют и спустя 30 мин при комнатной температуре добавляют по каплям 13,6 г (80,8 ммоль) 1-(3-фтор-2-метоксифенил)этан-1-она (Chem. Commun. 2000, 14, 1323-4) в 139 мл ТГФ. Перемешивают в последующие 1,5 ч при комнатной температуре. Разбавляют простым диэтиловым эфиром и реакционную смесь осторожно добавляют в смесь из 4 M соляной кислоты и льда. Фазы разделяют, экстрагируют простым диэтиловым эфиром, промывают водой, сушат над сульфатом натрия и растворитель удаляют. Исходный продукт очищают колоночной хроматографией на силикагеле(гексан/простой изопропиловый эфир 0-5%) и получают 9,5 г 2-фтор-6-(1-метиленэтил)анизола. К 1,56 г (5,7 ммоль) 1,1'-би-2-нафтола добавляют 5,7 мл (2,85 ммоль) 0,5 М раствора тетраизопропилата титана в толуоле и красный раствор перемешивают в течение 2 ч при комнатной температуре. Добавляют 9,5 г (57,2 ммоль) 2-фтор-6-(1-метиленэтил)анизола и 12,5 мл (95 ммоль) этилтрифторпирувата и смесь нагревают в течение 18 ч до 140 С. После охлаждения сразу очищают колоночной хроматографией на силикагеле (гексан/этилацетат 05%) и получают 8,9 г сложного этилового эфира 4-(3-фтор-2-метоксифенил)-2-гидрокси-2(трифторметил)пент-4-еновой кислоты. 8,9 г сложного этилового эфира (26,5 ммоль) 4-(3-фтор-2 метоксифенил)-2-гидрокси-2-(трифторметил)пент-4-еновой кислоты растворяют в 200 мл метанола и 2 мл уксусной кислоты и добавляют 890 мг палладия на угле (10-й). Суспензию взбалтывают 1,5 ч под атмосферой водорода при нормальном давлении до наводороживания в 560 мл. Смесь отфильтровывают через целит, причем основательно промывают повторно этилацетатом. После удаления растворителя получают 8,6 г сложного этилового эфира 4-(3-фтор-2-метоксифенил)-2-гидрокси-2-(трифторметил)пентановой кислоты. 8,6 г (25,4 ммоль) сложного этилового эфира 4-(3-фтор-2-метоксифенил)-2 гидрокси-2-(трифторметил)пентановой кислоты охлаждают в 350 мл простого диэтилового эфира до-30 С и через 15 мин добавляют порционно 1,7 г (44,7 ммоль) твердого алюмогидрида лития. Перемешивают 1,5 ч, причем температуру повышают до -15 С, затем добавляют по каплям один за другим этилацетат и воду и перемешивают в течение последующего часа, пока не образуется хорошо фильтрующийся осадок. Суспензию фильтруют через целит, причем основательно повторно промывают этилацетатом. Фазы фильтрата разделяют и еще раз экстрагируют этилацетатом. Промывают насыщенным раствором хлорида натрия, сушат над сульфатом натрия, и растворитель удаляют в вакууме. Разделение с помощью колоночной хроматографии на силикагеле (гексан/простой диизопропиловый эфир 0-15%) дает 3,1 г(2R,4R)-4-(3-фтор-2-метоксифенил)-2-гидрокси-2-(трифторметил)пентанала,1 Н-ЯМР (300 МГц, CDCl3): =1,13 (d, 3 Н), 2,25 (dd, 1H), 2,58 (dd, 1H), 3,33 (qdd,1H), 3,92 (s, 3 Н),3,98 (s, 1 Н), 6,92-6,99 (m, 3 Н), 9,12 (s, 1H); 0,72 г (2R,4S)-4-(3-фтор-2-метоксифенил)-2-гидрокси-2-(трифторметил)пентанала,1 Н-ЯМР (300 МГц, CDCl3): =1,21 (d, 3 Н), 2,33 (dd, 1H), 2,39 (dd, 1 Н), 3,30 (qdd, 1H), 3,74 (s, 1H) 3,94 (s, 3 Н), 6,90-6,99 (m, 3 Н), 9,71 (s, 1H), и 2,0 г спирта 175 мг (0,60 ммоль) (2R,4R)-4-(3-фтор-2-метоксифенил)-2-гидрокси-2-(трифторметил)пентанала, 103 мг (0,63 ммоль) 5-амино-2-метилхинолин и 0,3 мл тетраэтилат титана перемешивают в 20 мл толуола 2 ч при 100 С. После охлаждения выливают на воду и энергично перемешивают. Суспензию фильтруют через целит, причем основательно повторно промывают этилацетатом. Фазы фильтрата разделяют и еще раз экстрагируют этилацетатом. Сушат над сульфатом натрия и растворитель удаляют в вакууме и получают 230 мг (2R,4R)-4-(3-фтор-2-метоксифенил)-1-[(2-метилхинолин-5-ил)имино]-2(трифторметил)пентан-2-ола в виде исходного продукта. К 230 мг сырого имина в 12 мл CH2Cl2 добавляют по каплям при -30 С 6 мл (6 ммоль) 1 М раствора бортрибромида. Оставляют нагреваться до комнатной температуры и перемешивают 2 ч. Исходную смесь смешивают с нас. раствором NaHCO3, фазы разделяют, водную фазу экстрагируют с помощью CH2Cl2, объединенные органические фазы высушивают (Na2SO4) и концентрируют в вакууме. Колоночная хроматография на силикагеле (гексан/сложный эфир уксусной кислоты 0-75%) дает 145 мг продукта. 1 Н-ЯМР (300 МГц, CDCl3): =1,39 (d, 3 Н), 1,82 (dd, 1H), 2,39 (dd, 1H), 2,64 (s,3H), 3,40 (m, 1H), 4,95(5,6,8)-2-Фтор-5-[(7-фтор-2-метилхиназолин-5-ил)амино]-8-метил-6-(трифторметил)-5,6,7,8-8 015834 тетрагидронафталин-1,6-диол. Аналогично примеру 1 подвергают взаимодействию 250 мг (0,85 ммоль) (2R,4R)-4-(3-фтор-2 метоксифенил)-2-гидрокси-2-(трифторметил)пентанал, 185 мг (1,05 ммоль) 5-амино-7-фтор-2 метилхиназолин и 0,4 мл тетраэтилата титана до получения (2R,4R)-4-(3-фтор-2-метоксифенил)-1-[(7 фтор-2-метилхиназолин-5-ил)имино]-2-(трифторметил)пентан-2-ола. 430 мг полученного таким образом сырого имина циклизуют аналогично примеру 1 при -30 С с помощью 8 мл (8 ммоль) 1 М раствора бортрибромида до получения целевого продукта. Колоночная хроматография на силикагеле (гексан/сложный эфир уксусной кислоты 0-75%) дает 67 мг продукта. 1 Н-ЯМР (300 МГц, CD3OD): =1,44 (d, 3H), 1,88 (dd, 1H), 2,43 (dd, 1H), 2,74 (s, 3H), 3,40 (qdd, 1H),5,25 (s, 1H), 6,69 (d, 1H), 6,70 (dd, 1H), 6,74 (d, 1H), 6,85 (dd,1H), 9,49 (s,1H). Пример 2 А/2 В.(5,6,8)-2-Фтор-5-[(7-фтор-2-метилхиназолин-5-ил)амино]-8-метил-6-(трифторметил)-5,6,7,8 тетрагидронафталин-1,6-диол отщепляют с помощью препаративной хиральной ВЭЖХ (Chiracel OD 5 мк) в энантиомерно чистые соединения:(5,6,8)-2-Фтор-5-[(8-фтор-2-метилхиназолин-5-ил)амино]-8-метил-6-(трифторметил)-5,6,7,8 тетрагидронафталин-1,6-диол. Аналогично примеру 1 подвергают взаимодействию 150 мг (0,5 ммоль) (2R,4R)-4-(3-фтор-2 метоксифенил)-2-гидрокси-2-(трифторметил)пентанала, 90 мг (0,5 ммоль) 5-амино-8-фтор-2 метилхиназолина и 0,2 мл тетраэтилата титана до получения (2R,4R)-4-(3-фтор-2-метоксифенил)-1-[(8 фтор-2-метилхиназолин-5-ил)имино]-2-(трифторметил)пентан-2-ола. 230 мг полученного таким образом сырого имина аналогично примеру 1 при -30 С с 4 мл (4 ммоль) 1 М раствора бортрибромида циклизуют до получения целевого продукта. Колоночная хроматография на силикагеле (гексан/сложный эфир уксусной кислоты 50%) дает 42 мг продукта. 1 Н-ЯМР (300 МГц, CD3OD): =1,42 (d, 3 Н), 1,85 (dd, 1H), 2,42 (dd, 1H), 2,80 (s, 3 Н), 3,41 (qdd, 1 Н),5,16 (s, 1 Н), 6,73-6,80 (m, 1 Н), 6,83 (dd, 1H), 7,50 (dd, 1H), 9,58 (s, 1H). Пример 4(5,6,8)-5-[(7,8-Дифтор-2-метилхиназолин-5-ил)амино]-2-фтор-8-метил-6-(трифторметил)5,6,7,8-тетрагидронафталин-1,6-диол. Аналогично примеру 1 подвергают взаимодействию 150 мг (0,5 ммоль) (2R,4R)-4-(3-фтор-2 метоксифенил)-2-гидрокси-2-(трифторметил)пентанала, 100 мг (0,51 ммоль) 5-амино-7,8-дифтор-2 метилхиназолина и 0,2 мл тетраэтилата титана до получения (2R,4R)-1-[(7,8-дифтор-2 метилхиназолин-5-ил)имино]-4-(3-фтор-2-метоксифенил)-2-(трифторметил)пентан-2-ола. 240 мг полученного таким образом сырого имина аналогично примеру 1 при -30 С с 4 мл (4 ммоль) 1 М раствора бортрибромида циклизуют до получения целевого продукта. Колоночная хроматография на силикагеле(гексан/сложный эфир уксусной кислоты 50%) дает 30 мг продукта. 1 Н-ЯМР (300 МГц, CD3OD): =1,44 (d, 3 Н), 1,87 (dd, 1H), 2,43 (dd, 1H), 2,79 (s, 3 Н), 3,40 (qdd, 1H),5,20 (s, 1H), 6,71 (dd, 1H), 6,77 (dd, 1H), 6,85 (dd, 1H), 9,52 (s,1H).(5,6,8)-2-Фтор-8-метил-5-[(2-метилхиназолин-5-ил)амино]-6-(трифторметил)-5,6,7,8 тетрагидронафталин-1,6-диол. Аналогично примеру 1 подвергают взаимодействию 135 мг (0,46 ммоль) (2R,4R)-4-(3-фтор-2 метоксифенил)-2-гидрокси-2-(трифторметил)пентанала, 100 мг (0,63 ммоль) 5-амино-2-метилхиназолин и 0,23 мл тетраэтилат титана до получения (2R,4R)-4-(3-фтор-2-метоксифенил)-1-[(2-метилхиназолин 5-ил)имино]-2-(трифторметил)пентан-2-ола. 260 мг полученного таким образом сырого имина аналогично примеру 1 при -30 С с 5 мл (5 ммоль) 1 М раствора бортрибромида циклизуют до получения целевого продукта. Колоночная хроматография на силикагеле (гексан/сложный эфир уксусной кислоты 0-75%) дает 56 мг продукта. 1 Н-ЯМР (300 МГц, CD3OD): =1,44 (d, 3 Н), 1,87 (dd, 1H), 2,44 (dd, 1 Н), 2,77 (s, 3 Н), 3,41 (qdd, 1H),5,23 (s, 1H), 6,73 (dd, 1 Н), 6,83 (dd, 1H), 6,87 (d, 1H), 7,14 (d, 1H), 7,74 (t, 1H), 9,56 (s, 1H). Пример 6 5-[(5,6,8)-1,6-Дигидрокси-2-фтор-8-метил-6-(трифторметил)-5,6,7,8-тетрагидронафталин-5 ил]аминохинолин-2(1 Н)-он. Аналогично примеру 1 подвергают взаимодействию 250 мг (0,46 ммоль) (2R,4R)-4-(3-фтор-2 метоксифенил)-2-гидрокси-2-(трифторметил)пентанала, 132 мг (0,63 ммоль) 5-аминохинолона и 0,4 мл тетраэтилата титана до получения 5-[(2R,4R)-4-(3-фтор-2-метоксифенил)-2-гидрокси-2(трифторметил)пентилиден]аминохинолин-2(1 Н)-она. 64 мг очищенного колоночной хроматографией имина (силикагель, гексан/сложный эфир уксусной кислоты 0-75%) циклизуют аналогично примеру 1 при -30 С с 1,5 мл (1,5 ммоль) 1 М раствора бортрибромида до получения целевого продукта. Колоночная хроматография на силикагеле (гексан/сложный эфир уксусной кислоты 0-75%) дает 52 мг продукта. 1 Н-ЯМР (300 МГц, CD3OD): =1,42 (d, 3 Н), 1,84 (dd, 1H), 2,42 (dd, 1H), 3,40 (qdd, 1H), 5,08 (s, 1H),6,47 (d, 1H), 6,54 (d, 1H), 6,65 (d, 1H), 6,71 (dd, 1H), 6,83 (dd, 1H), 7,32 (t, 1H), 8,17 (d, 1H). Пример 7 8-Фтор-5-[(1,2,4)-6-фтор-2-гидрокси-5-метокси-4-метил-2-(трифторметил)-1,2,3,4 тетрагидронафталин-1-ил]аминохинолин-2(1 Н)-он. 5-Амино-8-фторхинолин-2(1 Н)-он. 5,8-Дифторхинолин-2(1H)-он и 1,18 г (8,2 ммоль) Cu2O примешивают в 620 мл этиленгликоля под 8 бар с газообразн. NH3. Реакционную смесь в течение 19 ч нагревают до 190 С. После охлаждения реакционной смеси и удаления растворителя исходный продукт очищают колоночной хроматографией (силикагель, гексан; CH2Cl2/МеОН 0-5%). Получают 1,03 г 5-амино-8-фторхинолин-2(1H)-она в виде светложелтого твердого вещества. Н-ЯМР (300 МГц, ДМСО-d6): =5,58 (s, 2H), 6,23 (dd, 1H), 6,31 (d, 1H), 7,03 (dd, 1H), 8,05 (dd, 1H),11,28 (s, 1H). Аналогично примеру 1 подвергают взаимодействию 300 мг (1,01 ммоль) (2R,4R)-4-(3-фтор-2 метоксифенил)-2-гидрокси-2-(трифторметил)пентанала, 180 мг (1,01 ммоль) 5-амино-8-фторхинолона и 0,48 мл тетраизопропилата титана в 9 мл ксилола до получения 8-фтор-5-[(2R,4R)-4-(3-фтор-2 метоксифенил)-2-гидрокси-2-(трифторметил)пентилиден]аминохинолин-2(1H)-она. 80 мг очищенного колоночной хроматографией имина (силикагель, гексан; CH2Cl2/i-PrOH 0-5%) циклизуют аналогично примеру 1 при -40 С с 1,7 мл (1,5 ммоль) 1 М раствора бортрибромида до получения целевого продукта и до расщепленного простого эфира примера 8. 1 Н-ЯМР (300 МГц, CD3OD): =1,38 (d, 3 Н), 1,85 (dd, 1H), 2,39 (dd, 1H), 3,38 (m, 1H), 3,88 (s, 3H),5,03 (s, 1H), 6,43 (dd, 1H), 6,51 (d, 1H), 6,80-7,05 (m, 2 Н), 7,15 (dd, 1H), 8,14 (dd, 1H). Пример 8 5-[(1,2,4)-6-Фтор-2,5-дигидрокси-4-метил-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1 ил]амино-8-фторхинолин-2(1 Н)-он получают после хроматографической очистки из примера 7. 1 Н-ЯМР (300 МГц, CD3OD): =1,40 (d, 3 Н), 1,83 (dd, 1H), 2,40 (dd, 1H), 3,38 (m, 1H), 5,03 (s, 1H),6,45 (dd, 1H), 6,48 (d, 1H) 6,49 (dd, 1H), 6,70 (dd, 1H), 6,82 (t, 1H), 7,07 (dd, 1H), 7,17 (dd, 1H), 8,13 (dd,1H). Пример 8 А/8 В. 5-[(1,2,4)-6-Фтор-2,5-дигидрокси-4-метил-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1 ил]амино-8-фторхинолин-2(1 Н)-он расщепляется с помощью препаративной хиральной ВЭЖХ (Chiracel 5-[(1,2,4)-6-Фтор-2,5-дигидрокси-4-метил-2-(трисфторметил)-1,2,3,4-тетрагидронафталин-1 ил]амино-2-метилфталазин-1-он. Аналогично примеру 1 подвергают взаимодействию 295 мг (1,0 ммоль) (2R,4R)-4-(3-фтор-2 метоксифенил)-2-гидрокси-2-(трифторметил)пентанала, 217 мг (1,0 ммоль) 5-амино-2-метилфталазин-1 он и 0,53 мл тетраэтилата титана до получения 5-[(2R,4R)-4-(3-фтор-2-метоксифенил)-2-гидрокси-2(трифторметил)пентилиден]амино-2-метилфталазин-1-она. 590 мг полученного таким образом сырого имина аналогично примеру 1 при -30 С циклизуют с 10 мл (10 ммоль) 1 М раствора бортрибромида до получения целевого продукта. Колоночная хроматография на силикагеле (гексан/сложный эфир уксусной кислоты 0-60%) дает 204 мг продукта. 1 Н-ЯМР (300 МГц, CD3OD): =1,43 (d, 3 Н), 1,86 (dd, 1H), 2,43 (dd, 1H), 3,40 (qdd, 1H), 3,79 (s, 3 Н),5,18 (s, 1H), 6,71 (dd, 1H), 6,84 (dd, 1H), 7,16 (d, 1H), 7,59 (t, 1H), 7,60 (d, 1H), 8,50 (s, 1H).(5,6,8)-2-Фтор-8-метил-5-[(2-метилхинолин-5-ил)амино]-6-(трифторметил)-5,6,7,8 тетрагидронафталин-1,6-диол. Аналогично примеру 1 подвергают взаимодействию 175 мг (0,60 ммоль) (2R,4S)-4-(3-фтор-2 метоксифенил)-2-гидрокси-2-(трифторметил)пентанала, 103 мг (0,63 ммоль) 5-амино-2-метилхинолин и 0,3 мл тетраэтилата титана до получения (2R,4S)-4-(3-фтор-2-метоксифенил)-1-[(2-метилхинолин-5 ил)имино]-2-(трифторметил)пентан-2-ола. 230 мг полученного таким образом сырого имина аналогично примеру 1 при -30 С циклизуют с 5 мл (5 ммоль) 1 М раствора бортрибромида до получения целевого продукта. Колоночная хроматография на силикагеле (гексан/сложный эфир уксусной кислоты 0-75%) дает 135 мг продукта. 1 Н-ЯМР (300 МГц, CD3OD): =1,60 (d, 3 Н), 2,21 (d, 1H), 2,33 (dd, 1H), 2,70 (s, 3 Н), 3,43 (qd, 1H), 5,16(5,6,8)-2-Фтор-5-[(2-метилхиназолин-5-ил)амино]-8-метил-6-(трифторметил)-5,6,7,8 тетрагидронафталин-1,6-диол. Аналогично примеру 1 подвергают взаимодействию 135 мг (0,46 ммоль) (2R,4S)-4-(3-фтор-2 метоксифенил)-2-гидрокси-2-(трифторметил)пентанала, 100 мг (0,63 ммоль) 5-амино-2-метилхиназолина и 0,23 мл тетраэтилата титана до получения (2R,4S)-4-(3-фтор-2-метоксифенил)-1-[(2-метилхиназолин 5-ил)имино]-2-(трифторметил)пентан-2-ола. 260 мг полученного таким образом сырого имина аналогично примеру 1 при -30 С циклизуют с 5 мл (5 ммоль) 1 М раствора бортрибромида до получения целевого продукта. Колоночная хроматография на силикагеле (гексан/сложный эфир уксусной кислоты 0-75%) дает 56 мг продукта. 1 Н-ЯМР (300 МГц, CD3OD): =1,58 (d, 3 Н), 2,20 (dd, 1H), 2,44 (dd, 1H), 2,77 (s, 3 Н), 3,41 (qdd, 1H),5,16 (s, 1H), 6,73-6,87 (m, 3 Н), 7,14 (d, 1H), 7,74 (t, 1H), 9,56 (s, 1H). Пример 12(5,6,8)-2-Фтор-5-[(8-фтор-2-метилхиназолин-5-ил)амино] 8-метил-6-(трифторметил)-5,6,7,8 тетрагидронафталин-1,6-диол. Аналогично примеру 1 подвергают взаимодействию 170 мг (0,58 ммоль) (2R,4S)-4-(3-фтор-2 метоксифенил)-2-гидрокси-2-(трифторметил)пентанала, 124 мг (0,70 ммоль) 5-амино-8-фтор-2 метилхиназолин и 0,31 мл тетраэтилат титана до получения (2R,4S)-4-(3-фтор-2-метоксифенил)-1-[(8 фтор-2-метилхиназолин-5-ил)имино]-2-(трифторметил)пентан-2-ола. 295 мг полученного таким образом сырого имина аналогично примеру 1 при -20 С циклизуют с 2,6 мл (2,6 ммоль) 1 М раствора бортрибромида до получения целевого продукта. Колоночная хроматография на силикагеле (гексан/сложный эфир уксусной кислоты 50%) дает 25 мг продукта. 1 Н-ЯМР (300 МГц, CD3OD): =1,55 (d, 3 Н), 2,16 (dd, 1H), 2,29 (dd, 1H), 2,79 (s, 3 Н), 3,38 (qdd, 1H),- 12015834 5,15 (s, 1H), 6,74 (dd, 1H), 6,81-6,87 (m, 2H), 7,52 (dd, 1H), 9,62 (s, 1H). Пример 13(5,6,8)-5-[(7,8-Дифтор-2-метилхиназолин-5-ил)амино]-2-фтор-8-метил-6-(трифторметил)5,6,7,8-тетрагидронафталин-1,6-диол. Аналогично примеру 1 подвергают взаимодействию 170 мг (0,58 ммоль) (2R,4S)-4-(3-фтор-2 метоксифенил)-2-гидрокси-2-(трифторметил)пентанала, 124 мг (0,60 ммоль) 5-амино-7,8-дифтор-2 метилхиназолина и 0,31 мл тетраэтилата титана до получения (2R,4S)-1-[(7,8-дифтор-2 метилхиназолин-5-ил)имино]-4-(3-фтор-2-метоксифенил)-2-(трифторметил)пентан-2-ола. 85 мг очищенного колоночной хроматографией имина (силикагель, гексан/сложный эфир уксусной кислоты 0-30%) циклизуют аналогично примеру 1 при -20 С с 0,72 мл (0,72 ммоль) 1 М раствора бортрибромида до получения целевого продукта. Препаративная тонкослойная хроматография на силикагеле (гексан/сложный эфир уксусной кислоты 50%) дает 15 мг продукта. 1 Н-ЯМР (300 МГц, CD3OD): =1,55 (d, 3 Н), 2,15 (dd, 1H), 2,30 (dd, 1H), 2,78 (s, 3 Н), 3,37 (qdd, 1H),5,16 (s, 1H), 6,72 (dd, 1H), 6,83 (dd, 2H), 6,86 (dd, 1H), 9,58 (s, 1H). Пример 14(5,6,8)-3-Хлор-2-фтор-8-метил-5-[(2-метилхиназолин-5-ил)амино]-6-(трифторметил)-5,6,7,8 тетрагидронафталин-1,6-диол. 4-(4-Хлор-3-фтор-2-метоксифенил)-2-гидрокси-2-(трифторметил)пентанал. К 10 г (68,2 ммоль) 3-хлор-2-фторфенола в 68 мл дихлорметана и 7,7 мл (98,5 ммоль) пиридина добавляют по каплям при 0 С 5,1 мл (71,6 ммоль) ацетилхлорида. Смесь перемешивают в течение 1 ч и добавляют 100 мл 1 М соляной кислоты. Экстрагируют с помощью дихлорметана и промывают водой. После высушивания над сульфатом натрия и удаления растворителя в вакууме количественно получают 13 г сложного эфира 3-хлор-2-фторфенилуксусной кислоты. 13 г (68,2 ммоль) сложного эфира 3-хлор-2 фторфенилуксусной кислоты в 6,9 мл 1,2-дихлорбензола добавляют по каплям при охлаждении льдом до получения 9,2 г (68,9 ммоль) трихлорида алюминия в 6,9 мл 1,2-дихлорбензола и по окончании смесь перемешивают в течение 6 ч при 100 С. Оставляют охлаждаться, разбавляют дихлорметаном и осторожно выливают в смесь из 4 М соляной кислоты и льда. Фазы разделяют, экстрагируют с помощью дихлорметана, промывают насыщенным раствором хлорида натрия и сушат над сульфатом натрия. Исходный продукт очищают колоночной хроматографией на силикагеле (гексан/этилацетат 10-50%) и получают 11,4 г 1-(4-хлор-3-фтор-2-гидроксифенил)этан-1-она и 0,74 г 1-(2-хлор-3-фтор-4-гидроксифенил)этан 1-она. 11,4 г (60,4 ммоль) 1-(4-хлор-3-фтор-2-гидроксифенил)этан-1-он в растворяют 120 мл ацетона и добавляют 15,5 г (112 ммоль) карбоната калия и 6,9 мл (110 ммоль) метилйодида. Смесь перемешивают 7 ч при 70 С и по окончании растворитель в значительной мере удаляют. Остаток выливают в воду и экстрагируют простым метил-t-бутиловым эфиром. Промывают насыщенным раствором хлорида аммония, сушат над сульфатом натрия и после удаления растворителя в вакууме получают 11,3 г 1-(4-хлор-3 фтор-2-метоксифенил)этан-1-она. 27,1 г (415 ммоль) цинковой пыли и 640 мг (2,3 ммоль) хлорида свинца(II) суспендируют в 400 мл ТГФ и при комнатной температуре добавляют 26 мл (230 ммоль) дибромметана. Перемешивают в последующие 30 мин и добавляют по каплям при охлаждении ледяной ванной 46,1 мл (46,1 ммоль) 1 М раствора хлорида титана(IV) в дихлорметане. Через 30 мин при 5-10 С добавляют по каплям 9,3 г (46,1 ммоль) 1-(4-хлор-3-фтор-2-метоксифенил)этан-1-она в 92 мл ТГФ при 5 С. Перемешивают в последующие 15 ч при комнатной температуре. Разбавляют простым диэтиловым эфиром и реакционную смесь осторожно добавляют в смесь из 4 М соляной кислоты и льда. Фазы разделя- 13015834 ют, экстрагируют простым диэтиловым эфиром, промывают водой, сушат над сульфатом натрия и растворитель удаляют. Исходный продукт очищают колоночной хроматографией на силикагеле (гексан/этилацетат 10-40%) и получают 2,68 г 3-хлор-2-фтор-6-(1-метиленэтил)анизол. К 760 мг (2,67 ммоль) 1,1'-би-2-нафтола добавляют 2,68 мл (1,34 ммоль) 0,5 М раствора тетраизопропилата титана в толуоле и красный раствор перемешивают в течение 1 ч при комнатной температуре. 5,07 г (28,1 ммоль) 3-хлор-2 фтор-6-(1-метиленэтил)анизола и 3,25 мл (26,7 ммоль) этилтрифторпирувата добавляют и смесь нагревают в течение 17 ч до 140 С. После охлаждения сразу очищают колоночной хроматографией на силикагеле (пентан/простой диэтиловый эфир 25-40%) и получают 1,47 г сложного этилового эфира 4-(4-хлор 3-фтор-2-метоксифенил)-2-гидрокси-2-(трифторметил)пент-4-еновой кислоты. 1,47 г (3,97 ммоль) сложного этилового эфира 4-(4-хлор-3-фтор-2-метоксифенил)-2-гидрокси-2-(трифторметил)пент-4-еновой кислоты охлаждают в 40 мл простого диэтилового эфира до -15 С и через 10 мин порционно добавляют 300 мг (7,9 ммоль) твердого алюмогидрида лития. Перемешивают 1 час, причем смесь нагревают до 0 С и выливают в насыщенный раствор хлорида аммония. Добавляют насыщенный раствор винной кислоты и перемешивают 30 мин. Фазы разделяют и многократно экстрагируют этилацетатом. Промывают насыщенным раствором хлорида натрия, сушат над сульфатом натрия, и растворитель удаляют в вакууме. Разделение с помощью колоночной хроматографии на силикагеле (гексан/этилацетат 0-50%) дает 0,38 г 4-(4-хлор-3-фтор-2-метоксифенил)-2-гидрокси-2-(трифторметил)пент-4-енала и 0,15 г спирта. 0,27 г 4-(4 хлор-3-фтор-2-метоксифенил)-2-гидрокси-2-(трифторметил)пент-4-енал растворяют в 14 мл метанол и добавляют 0,3 мл уксусной кислоты и 27 мг палладия на угле (10%-ный). Суспензию взбалтывают 2 ч под атмосферой водорода при нормальном давлении до наводороживания в 46 мл. Смесь отфильтровывают через целит, причем основательно промывают повторно этилацетатом. После удаления растворителя получают 0,27 г 4-(4-хлор-3-фтор-2-метоксифенил)-2-гидрокси-2-(трифторметил)пентанал в виде смеси диастереомеров. 1 Н-ЯМР (300 МГц, CDCl3): =1,18 (d, 1,5H), 1,29 (d, 1,5H), 2,23 (dd, 0,5H), 2,30 (dd, 0,5H), 2,38 (dd,0,5H), 2,55 (dd, 0,5H), 3,24 (m, 1H), 3,95 (s, 3H), 6,84 (dd, 1H), 7,05 (dd, 1H), 9,18 (s, 0,5H), 9,73 (s, 0,5H). 100 мг (0,3 ммоль) 4-(4-хлор-3-фтор-2-метоксифенил)-2-гидрокси-2-(трифторметил)пентанал, 48 мг(0,3 ммоль) 5-амино-2-метилхиназолин и 0,1 мл тетраэтилата титана перемешивают в 9 мл толуола 2 ч при 100 С. После охлаждения выливают на воду и энергично перемешивают. Суспензию фильтруют через целит, причем основательно повторно промывают этилацетатом. Фазы фильтрата разделяют и еще раз экстрагируют этилацетатом. Сушат над сульфатом натрия и растворитель удаляют в вакууме и получают 130 мг 4-(3-фтор-2-метоксифенил)-1-[(2-метилхинолин-5-ил)имино]-2-(трифторметил)пентан-2-ола в виде исходного продукта. К 130 мг сырого имина в 6 мл CH2Cl2 при -30 С добавляют по каплям 3 мл(3 ммоль) 1 М раствора бортрибромида. Оставляют нагреваться в течение 3 ч до -5 С. Исходную смесь смешивают с нас. раствором NaHCO3, фазы разделяют, водную фазу экстрагируют этилацетатом, объединенные органические фазы высушивают (Na2SO4) и концентрируют в вакууме. Колоночная хроматография на силикагеле (гексан/сложный эфир уксусной кислоты 0-75%) дает 30 мг в виде смеси соединения, указанного в заголовке, и (5 а,6 а,8 а)-3-хлор-2-фтор-8-метил-5-[(2-метилхиназолин-5-ил)амино]-6(трифторметил)-5,6,7,8-тетрагидронафталин-1,6-диол (пример 23). Препаративная тонкослойная хроматография на аминофазе (Merck) с этилацетат/метанол/триэтиламин 25:3:1 дает 5 мг продукта. 1 Н-ЯМР (300 МГц, CDCl3): =1,43 (d, 3 Н), 1,79 (dd, 1H), 2,42 (dd, 1H), 2,82 (s, 3 Н), 3,44 (qdd, 1H),5,02 (d, 1H), 6,62 (d, 1H), 6,71 (d, 1H), 6,87 (d, 1H), 7,14 (d, 1H), 7,72 (t, 1H), 9,55 (s,1H). Пример 15(5,6,8)-3-Хлор-2-фтор-5-[(7-фтор-2-метилхиназолин-5-ил)амино]-1-метокси-8-метил-6(трифторметил)-5,6,7,8-тетрагидронафталин-6-ол. Аналогично примеру 14 подвергают взаимодействию 100 мг (0,3 ммоль) 4-(4-хлор-3-фтор-2 метоксифенил)-2-гидрокси-2-(трифторметил)пентанала, 54 мг (0,3 ммоль) 5-амино-7-фтор-2 метилхиназолина и 0,1 мл тетраэтилата титана до получения 4-(4-хлор-3-фтор-2-метоксифенил)-1-[(7 фтор-2-метилхиназолин-5-ил)имино]-2-(трифторметил)пентан-2-ола. 150 мг сырого имина циклизуют аналогично примеру 14 при -30 С с 2,5 мл (2,5 ммоль) 1 М раствора бортрибромида до получения целевого продукта. Колоночная хроматография на силикагеле (гексан/сложный эфир уксусной кислоты 50%) и последующая препаративная тонкослойная хроматография на аминофазе (Merck) с этилаце- 14015834 тат/метанол/триэтиламин 25:3:1 дает 3,4 мг продукта и 3 мг дигидрокси соединения примера 16. 1 Н-ЯМР (300 МГц, CDCl3): =1,41 (d, 3 Н), 1,94 (dd, 1H), 2,45 (dd, 1H), 2,85 (s, 3 Н), 3,45 (ddq,1H),4,01 (s, 3 Н), 4,91 (d, 1H), 6,45 (d, 1H), 6,54 (br, 1H), 6,95 (d, 1H), 7,01 (d, 1H), 9,62 (s, 1H). Пример 16(5,6,8)-3-Хлор-2-фтор-5-[(7-фтор-2-метилхиназолин-5-ил)амино]-8-метил-6-(трифторметил)5,6,7,8-тетрагидронафталин-1,6-диол. В виде продукта из примера 15 после хроматографического разделения получают 1 Н-ЯМР (300 МГц, CDCl3): =1,44 (d, 3 Н), 1,81 (dd, 1H), 2,49 (dd, 1H), 2,87 (s, 3H), 3,42 (qdd, 1H),4,94 (d, 1H), 6,48 (d, 1H), 6,82 (d, 1H), 6,95 (d, 1H), 9,90 (s, 1H). Пример 17(5,6,8)-3-Хлор-2-фтор-5-[(8-фтор-2-метилхиназолин-5-ил)амино] 1-метокси-8-метил-6(трифторметил)-5,6,7,8-тетрагидронафталин-6-ол. Аналогично примеру 14 подвергают взаимодействию 100 мг (0,3 ммоль) 4-(4-хлор-3-фтор-2 метоксифенил)-2-гидрокси-2-(трифторметил)пентанала, 53 мг (0,3 ммоль) 5-амино-8-фтор-2 метилхиназолина и 0,1 мл тетраэтилата титана до получения 4-(4-хлор-3-фтор-2-метоксифенил)-1-[(8 фтор-2-метилхиназолин-5-ил)имино]-2-(трифторметил)пентан-2-ола. 140 мг сырого имина циклизуют аналогично примеру 14 при -30 С с 2,5 мл (2,5 ммоль) 1 М раствора бортрибромида до получения целевого продукта. Колоночная хроматография на силикагеле (гексан/сложный эфир уксусной кислоты 50%) и последующая препаративная тонкослойная хроматография на аминофазе (Merck) с этилацетат/метанол/триэтиламин 25:3:1 дает 3 мг продукта и 16 мг дигидрокси соединения примера 18. 1 Н-ЯМР (300 МГц, CDCl3): =1,40 (d, 3 Н), 1,96 (dd, 1H), 2,42 (dd, 1H), 2,93 (s, 3 Н), 3,45 (ddq,1H),4,01 (s, 3 Н), 5,92 (br, 1H), 6,59 (dd, 1H), 7,10 (d, 1H), 7,50 (dd, 1H), 9,60 (s, 1H). Пример 18(5,6,8)-3-Хлор-2-фтор-5-[(8-фтор-2-метилхиназолин-5-ил)амино] 8-метил-6-(трифторметил)5,6,7,8-тетрагидронафталин-1,6-диол. В виде продукта из примера 17 после хроматографического разделения получают 1- 15015834 Аналогично могут быть получены пример 19 5-[(1,2,4)-7-Хлор-2,5-дигидрокси-6-фтор-4-метил-2-(трифторметил)-1,2,3,4 тетрагидронафталин-1-ил]аминохинолин-2(1H)-он. Аналогично примеру 14 подвергают взаимодействию 100 мг (0,3 ммоль) 4-(4-хлор-3-фтор-2 метоксифенил)-2-гидрокси-2-(трифторметил)пентанала, 48 мг (0,3 ммоль) 5-аминохинолона и 0,1 мл тетраэтилата титана до получения 5-[4-(4-хлор-3-фтор-2-метоксифенил)-2-гидрокси-2-(трифторметил)пентилиден]аминохинолин-2(1H)-она. 130 мг сырого имина циклизуют аналогично примеру 14 при-30 С с 2,5 мл (2,5 ммоль) 1 М раствора бортрибромида до получения целевого продукта. Колоночная хроматография на силикагеле (гексан/сложный эфир уксусной кислоты 50%) и последующая препаративная тонкослойная хроматография на аминофазе (Merck) с этилацетат/метанол/триэтиламин 25:3:1 и препаративная ВЭЖХ дает 11 мг продукта. 1 Н-ЯМР (300 МГц, CD3OD): =1,38 (d, 3H), 1,84 (dd, 1H), 2,42 (dd, 1H), 3,36 (qdd, 1H), 5,09 (s, 1H),6,48 (d, 1H), 6,54 (d, 1H), 6,68 (d, 1H), 6,70 (d, 1H), 7,34 (t, 1H), 8,19 (d, 1 Н). Пример 21 А/21 В. 5-[(1,2,4)-7-хлор-2,5-дигидрокси-6-фтор-4-метил-2-(трифторметил)-1,2,3,4 тетрагидронафталин-1-ил]аминохинолин-2(1 Н)-он расщепляется посредством препаративной хиральной ВЭЖХ (Chiracel OD 20 мк) в энантиомерно чистые соединения: энантиомер 1: аналитическая ВЭЖХ: Rt=8,5 мин (Chiralpak AD 5 мк, 2504,6 мм, гексан/этанол 5%95% в 20 мин, 1 мл/мин текучесть); энантиомер 2: аналитическая ВЭЖХ: Rt=9,6 мин (Chiralpak AD 5 мк, 2504,6 мм, гексан/этанол 5%95% в 20 мин, 1 мл/мин текучесть).- 16015834 Аналогично может быть получен пример 22(5,6,8)-3-Хлор-2-фтор-8-метил-5-[(2-метилхиназолин-5-ил)амино]-6-(трифторметил)-5,6,7,8 тетрагидронафталин-1,6-диол. Препаративная тонкослойная хроматография смеси диастереомеров из примера 14 на аминофазе(5,6,8)-8-Метил-5-[(2-метилхинолин-5-ил)амино]-6-(трифторметил)-5,6,7,8 тетрагидронафталин-1,6-диол. 2-Гидрокси-4-(2-метоксифенил)-2-(трифторметил)пентанал. Сложный этиловый эфир 4-(3-хлор-2-метоксифенил)-2-гидрокси-2-(трифторметил)пент-4-еновой кислоты может быть получен аналогично примеру 14 из ацетилхлорида и 2-хлорфенол. Последовательность реакции с водородом над палладием на угле и алюмогидрид лития аналогично примеру 14 дает в этом случае смесь из 2-гидрокси-4-(2-метоксифенил)-2-(трифторметил)пентанал и 4-(3-хлор-2 метоксифенил)-2-гидрокси-2-(трифторметил)пентанала, которая не была разделена. Аналогично примеру 1 подвергают взаимодействию 160 мг смеси из 4-(3-хлор-2-метоксифенил)-2-гидрокси-2(трифторметил)пентанала и 2-гидрокси-4-(2-метоксифенил)-2-(трифторметил)пентанала, 86 мг(0,55 ммоль) 5-амино-2-метилхинолина и 0,3 мл тетраэтилата титана до получения соответствующих иминов. 230 мг сырого имина циклизуют аналогично примеру 1 при -30 С с 4 мл (4 ммоль) 1 М раствора бортрибромида до получения целевых продуктов. Колоночная хроматография на силикагеле (гексан/сложный эфир уксусной кислоты 50%) и последующая препаративная тонкослойная хроматография на силикагеле с гексан/2-пропанол 17% позволяет разделение отдельных продуктов. 1 Н-ЯМР (300 МГц, CDCl3): =1,61 (d, 3 Н), 2,24 (dd, 1H), 2,33 (dd, 1H), 2,74 (s, 3 Н), 3,43 (qdd, 1H),4,68 (br, 1H), 5,17 (br, 1H), 6,70 (d, 1H), 6,76 (d, 1H), 6,95 (m, 2H), 7,24 (d, 1H), 7,55 (m, 2H), 8,07 (d, 1H).(5,6,8)-8-Метил-5-[(2-метилхинолин-5-ил)амино]-6-(трифторметил)-5,6,7,8 тетрагидронафталин-1,6-диол. В виде продукта из примера 24 после хроматографического разделения получают 1 Н-ЯМР (300 МГц, CDCl3): =1,51 (d, 3 Н), 1,98 (dd, 1H), 2,48 (dd, 1H), 2,77 (s, 3 Н), 3,47 (m, 1H), 4,69(5,6,8)-8-Метил-5-[(2-метилхинолин-5-ил)амино]-6-(трифторметил)-5,6,7,8 тетрагидронафталин-1,6-диол. В виде продукта из примера 24 после хроматографического разделения получают 1 Н-ЯМР (300 МГц, CDCl3):1,47 (d, 3 Н), 2,00 (dd, 1H), 2,47 (dd, 1H), 2,73 (s, 3 Н), 3,45 (m, 1H), 5,03(5,6,8)-8-Метил-5-[(2-метилхинолин-5-ил)амино]-6-(трифторметил)-5,6,7,8 тетрагидронафталин-1,6-диол. Аналогично примеру 1 подвергают взаимодействию 100 мг смеси из 4-(3-хлор-2-метоксифенил)-2 гидрокси-2-(трифторметил)пентанала и 2-гидрокси-4-(2-метоксифенил)-2-(трифторметил)пентанала, 80 мг (0,42 ммоль) 5-амино-7,8-дифтор-2-метилхиназолина и 0,3 мл тетраэтилата титана до получения соответствующих иминов. 180 мг сырого имина циклизуют аналогично примеру 1 при -30 С с 4 мл (3 ммоль) 1 М раствора бортрибромида до получения целевых продуктов. Колоночная хроматография на силикагеле (гексан/сложный эфир уксусной кислоты 50%) и последующая препаративная тонкослойная хроматография на силикагеле с гексан/2-пропанол 17% дает 7 мг продукта. 1 Н-ЯМР (300 МГц, CDCl3): =1,45 (d, 3 Н), 1,94 (dd, 1H), 2,45 (dd, 1H), 2,91 (s, 3 Н), 3,46 (m, 1H), 4,85- 18015834 Аналогично может быть получен пример 28(5,6,8)-8-Этил-2-фтор-5-[(2-метилхиназолин-5-ил)амино]-6-(трифторметил)-5,6,7,8 тетрагидронафталин-1,6-диол. 4-(3-Фтор-2-метоксифенил)-2-гидрокси-2-(трифторметил)гексанал. 29,04 г (3-фтор-2-метоксифенил)борной кислоты, 25 г 2-бром-1-бутен и тетракис (трифенилфосфин)палладий растворяют в 174 мл толуола и 17,4 мл 1-пропанола. Смесь в течение 5 ч нагревают в закрытой емкости до 120 С и после охлаждения добавляют в воду. Водную фазу трижды экстрагируют простым диэтиловым эфиром, объединенные органические фазы промывают насыщенным раствором хлорида натрия и высушивают над Na2SO4. После осторожно удаленного растворителя остаток очищают колоночной хроматографией на силикагеле (гексан/простой диэтиловый эфир). Получают 16,6 г (49,7%) 6-(бут-1-ен-2-ил)-2-фтороанизол. К 4,0 г (22,2 ммоль) 6-(бут-1-ен-2-ил)-2-фтороанизола и 2,8 г молекулярного сита в 5,85 мл (44,4 ммоль) этилтрифторпирувата добавляют по каплям при 0 С в течение 30 мин 1005 мг (1,1 ммоль) [CuS,S)-бисфенилоксазолин)(Н 2 О)2](SbF6)2, в 56 мл дихлорметана. Перемешивают реакционную смесь 16 ч при 0 С и очищают реакционную смесь с помощью колоночной хроматографии на силикагеле (гексан/этилацетат). Получают 7,2 г (92,6%) энантиомерно обогащенного сложного этилового эфира (R)-4-(3-фтор-2-метоксифенил)-2-гидрокси-2-(трифторметил)гекс-4-еновой кислоты в виде E/Z смеси (E/Z соотношение 2:1, Е: прибл. 9%-е, Z: прибл. 58%-е). 9,3 г (26,6 ммоль) сложного этилового эфира (E/Z)-4-(3-фтор-2-метоксифенил)-2-гидрокси-2-(трифторметил)гекс-4-еновой кислоты растворяют в 300 мл простой диэтиловый эфир под аргоном и охлаждают до -15 С. 2,02 г алюмогидрида лития добавляют порционно за 30 мин в виде твердого вещества и перемешивают в течение последующего часа, причем повышают температуру до -5 С. После следующих 30 мин при -5 С добавляют по каплям 4 мл этилацетата и смесь перемешивают еще 10 мин. Выливают в смесь из льда и насыщенного раствора хлорида аммония и энергично перемешивают. Фазы разделяют и экстрагируют многократно этилацетатом и простым диэтиловым эфиром. Объединенные органические экстракты промывают насыщенным раствором хлорида натрия и высушивают над Na2SO4. Растворитель отгоняют, и остаток очищают колоночной хроматографией на силикагеле (гексан/этилацетат). Получают 5,9 г (72,6%) (Е/Z)-4-(3 фтор-2-метоксифенил)-2-гидрокси-2-трифторметил-гекс-4-енала и 2,0 г(E/Z)-4-(3-фтор-2 метоксифенил)-2-трифторметил-гекс-4-ен-1,2-диола. 1,51 г (4,9 ммоль) (Е/Z)-4-(3-фтор-2-метоксифенил)2-гидрокси-2-(трифторметил)гекс-4-енал добавляют в 40 мл метанол и 1,2 мл уксусной кислоты растворяют и 80 мг палладия на угле (10%-ный). Суспензию взбалтывают под атмосферой водорода при нормальном давлении до полного взаимодействия. Смесь отфильтровывают через целит, причем основательно промывают повторно этилацетатом. После удаления растворителя и разделения колоночной хроматографией на силикагеле (гексан/простой диизопропиловый эфир 10-25%) получают 530 мг энантиомерно обогащенного (2R,4R)-4-(3-фтор-2-метоксифенил)-2-гидрокси-2-(трифторметил)гексанала 1 Н-ЯМР (300 МГц, CDCl3): =0,77 (d, 3 Н), 1,65 (m, 2H), 2,32 (dd, 1H), 2,55 (dd, 1H), 3,14 (m, 1H),3,91 (s, 3 Н), 3,97 (s, 1H), 6,86 (dd, 1H), 6,95-6,99 (m, 2 Н), 8,99 (s, 1H) и 620 мг энантиомерно обогащенного(s, 1H), 3,92 (s, 3 Н), 6,84 (dd,1H), 6,93-6,99 (m, 2 Н), 9,67 (s, 1H). 113 мг (0,37 ммоль) (2R,4R)-4-(3-фтор-2-метоксифенил)-2-гидрокси-2-(трифторметил)гексанал,103 мг (0,37 ммоль) 5-амино-2-метилхиназолин и 0,2 мл тетраэтилат титана перемешивают в 15 мл толуола 1,5 ч при 100 С. После охлаждения выливают на воду и энергично перемешивают. Суспензию фильтруют через целит, причем основательно повторно промывают этилацетатом. Фазы фильтрата разделяют и еще раз экстрагируют этилацетатом. Сушат над сульфатом натрия и растворитель удаляют в вакууме и получают 178 мг (2R,4R)-4-(3-фтор-2-метоксифенил)-1-[(2-метилхиназолин-5-ил)имино]-2(трифторметил)гексан-2-ола в виде исходного продукта. К 178 мг сырого имина в 20 мл CH2Cl2 добавляют по каплям при -20 С 1,6 мл (1,6 ммоль) 1 М раствора бортрибромида. Оставляют нагреваться до комнатной температуры и перемешивают 1,5 ч. Выливают в нас. раствор NaHCO3, фазы разделяют, водную фазу экстрагируют с помощью CH2Cl2, объединенные органические фазы высушивают (Na2SO4) и концентрируют в вакууме. Колоночная хроматография на силикагеле (гексан/сложный эфир уксусной кислоты 50%) дает 20 мг продукта. 1 Н-ЯМР (300 МГц, CD3OD): =0,99 (t, 3 Н), 1,81 (ddq, 1H), 2,04 (m, 2H), 2,43 (dd, 1H), 2,82 (s, 3 Н),3,43 (d, 1H), 5,14 (s, 1H), 6,73 (dd,1H), 6,82 (m, 2H), 7,20 (d, 1H), 7,77 (t, 1H), 9,63 (s, 1H). Пример 29 А/29 В.(5,6,8)-8-Этил-2-фтор-5-[(2-метилхиназолин-5-ил)амино]-6-(трифторметил)-5,6,7,8 тетрагидронафталин-1,6-диол расщепляется с помощью препаративной хиральной ВЭЖХ (Chiralpak AD 5 мк) в энантиомерно чистые соединения:(44,4 ммоль) этилтрифторпирувата добавляют по каплям при 0 С за 30 мин 1005 мг (1,1 ммоль) [Cu(R,R)2,2-бис-(4,5-дигидро-4-трет-бутилоксазолин-2-ил)пропан(H2O)2](SbF6)2, комплекс (J. Org. Chem. 1998, 63,4541-4544) в 56 мл дихлорметана. Перемешивают реакционную смесь 16 ч при 0 С и реакционную смесь очищают с помощью колоночной хроматографии на силикагеле (гексан/этилацетат). Получают 7,2 г (%) сложного этилового эфира (R)-4-(3-фтор-2-метоксифенил)-2-гидрокси-2-(трифторметил)гекс-4 еновой кислоты с избытком энантиомеров больше 90% в виде E/Z смеси. Аналогично примеру 29 полученный таким образом ненасыщенный сложный эфир с помощью алюмогидрида лития и водорода под палладиевым катализом переводят в почти энантиомерно чистый альдегид. 120 мг (0,4 ммоль) (R,R)-4-(3-фтор-2-метоксифенил)-2-гидрокси-2-(трифторметил)гексанал и 75 мг(0,42 ммоль) этилата титана. Реакционную смесь нагревают 2 ч до 100 С, после охлаждения выливают в воду и энергично перемешивают. Суспензию фильтруют через целит, причем основательно повторно промывают этилацетатом. Фазы фильтрата разделяют и еще раз экстрагируют этилацетатом. Сушат над сульфатом натрия и растворитель удаляют в вакууме и получают 205 мг (2R,4R)-4-(3-фтор-2 метоксифенил)-1-[(7-фтор-2-метилхинолин-5-ил)имино]-2-(трифторметил)гексан-2-ола в виде исходного продукта. Сырой имин растворяют в 18 мл CH2Cl2 и охлаждают до -40 С. 3,4 мл (3,4 ммоль) 1M раствораBBr3 медленно добавляют по каплям в дихлорметан за 5 мин и оставляют нагреваться 1 час до 0 С, спустя 30 мин при 0 С выливают в смесь из нас. NaHCO3 и льда. Многократно экстрагируют этил ацетатом,промывают насыщенным раствором NaCl и сушат над Na2SO4. Очистка колоночной хроматографией на силикагеле (150 мл) с этилацетатом дает 37 мг продукта (аналитическая ВЭЖХ: Rt=9,2 мин (Chiralcel OD 5 мк, 2504,6 мм, гексан/этанол 10%, 1 мл/мин текучесть в виде (-)-энантиомера. 1 Н-ЯМР (300 МГц, CD3OD): =0,96 (t, 3 Н), 1,76 (ddq, 1H), 2,02 (dd, 1H), 2,06 (ddq, 1H), 2,41 (dd, 1H),2,77 (s, 3 Н), 3,39 (m, 1 Н), 5,13 (s, 1 Н), 6,58 (d, 1H), 6,73 (dd, 1H), 6,77 (d, 1H), 6,88 (dd, 1H), 9,51 (s, 1H).(5R,6S,8S)-8-Этил-2-фтор-5-[(7-фторо-2-метилхиназолин-5-ил)амино]-6-(трифторметил)-5,6,7,8 тетрагидронасфталин-1,6-диол. Сложный этиловый эфир 3-[1-(3-фтор-2-метоксифенил)циклопропил]-2-оксопропионовой кислоты. К 26 г (180 ммоль) 2,6-дифторанизола и 14,6 мл (198 ммоль) циклопропилцианида в 500 мл толуола при 0 С за 40 мин добавляют по каплям 396 мл 0,5-молярного (198 ммоль) раствора бис(триметилсилил)амида калия в толуоле. Перемешивают 18 ч при комнатной температуре и смешивают при охлаждении льдом с водой и 1 М серной кислоты. Органическую фазу отделяют и водную фазу многократно экстрагируют этилацетатом. Промывают рассолом, высушивают с помощью сульфата натрия и концентрируют в вакууме. После хроматографической очистки на силикагеле (гексан/этилацетат 10-20%) получают 12,7 г 1-(3-фтор-2 метоксифенил)циклопропилнитрила. 12,7 г (66,1 ммоль) нитрила медленно смешивают в толуол при 78 С с 82,7 мл (99,2 ммоль) раствор (20% в толуоле) гидрида диизобутилалюминия и через 3 ч при -78 С добавляют по каплям 11,1 мл изопропанола. Оставляют нагреваться до -5 С и добавляют 150 мл 10-го водного раствора винной кислоты. После разбавления простым эфиром сильно перемешивают, органическую фазу отделяют и водную фазу многократно экстрагируют этилацетатом. Промывают рассолом,высушивают с помощью сульфата натрия и концентрируют в вакууме. Получают 11,8 г альдегид в виде желтого масла. Раствор 16,3 г (60,7 ммоль) сложного этилового эфира 2-диэтилфосфоно-2 этоксиуксусной кислоты в 60 мл тетрагидрофуран смешивают при охлаждении льдом в течение 20 мин с 33,4 мл (66,8 ммоль) 2 М раствора диизопропиламида лития в тетрагидрофуран-гептан-толуол и перемешивают 30 мин при 0 С. В течение 30 мин добавляют по каплям раствор 11,8 г (60,7 ммоль) I в 61 мл тетрагидрофурана при 0 С. Спустя 20 ч при КТ добавляют ледяную воду и многократно экстрагируют с помощью простого эфира и этилацетата. Промывают насыщенным раствором хлорида аммония, сушат над сульфатом натрия и концентрируют. Исходный продукт омыляют с 170 мл 2 М натрового щелока в 170 мл этанола в течение 15 ч при комнатной температуре. Получают 13,9 г кислоты, которую перемешивают с 87 мл 2 N серной кислоты при 90 С в течение 16 ч. После охлаждения подщелачивают карбонатом калия, промывают с помощью простого эфира и подкисляют соляной кислотой. После экстракции этилацетатом, промывания насыщенным раствором хлорида натрия и удаления растворителя получают 10,2 г сырой кетокислоты. 10,2 г (40,6 ммоль) 3-[1-(3-фтор-2-метоксифенил)циклопропил]-2 оксопропионовой кислоты и 4,5 мл (85,3 ммоль) серной кислоты (96-ая) нагревают в 200 мл этанола 1 ч в колбе с обратным холодильником. Исходную смесь концентрируют в вакууме, остаток добавляют в ледяную воду и подщелачивают насыщенным раствором гидрокарбоната натрия. Многократно экстрагируют сложным эфиром уксусной кислоты, промывают насыщенным раствором хлорида натрия, высушивают (сульфат натрия) и концентрируют в вакууме. После хроматографической очистки на силикагеле (гексан/этилацетат 20%) получают 9,6 г сложного этилового эфира 3-[1-(3-фтор-2-метоксифенил)циклопропил]-2-оксопропионовой кислоты. 1 Н-ЯМР (CDCl3): =0,90 (m, 4H), 1,29 (t, 3 Н), 3,09 (s, 2H), 3,99 (d, 3H), 4,20 (q, 2H), 6,87 (ddd, 1H),6,95 (d, 1H), 7,07 (d, 1H). 3-[1-(3-Фтор-2-метоксифенил)циклопропил]-2-гидрокси-2-(трифторметил)пропанал. 9,6 г (34,3 ммоль) сложного этилового эфира 3-[1-(3-фтор-2-метоксифенил)циклопропил]-2 оксопропионовой кислоты и 34,5 мл (233 ммоль) (трифторметил)триметилсилана в 343 мл ДМФ смешивают с 46,9 г карбоната цезия при 0 С. Перемешивают 2 ч при 0 С и затем реакционную смесь добавляют в воду. Многократно экстрагируют сложным эфиром уксусной кислоты, промывают насыщенным раствором хлорида натрия, высушивают с помощью сульфата натрия и концентрируют в вакууме. После хроматографической очистки на силикагеле (гексан/этилацетат 10-40%) получают 10,4 г сложного этилового эфира 3-[1-(3-фтор-2-метоксифенил)циклопропил]-2-гидрокси-2-(трифторметил)пропановой кислоты в виде желтого масла. Это масло смешивают в 297 мл простого диэтилового эфира при 0 С с 2,25 г(59,4 ммоль) алюмогидрида лития и еще 1 ч перемешивают при КТ. К исходной смеси при 0 С осторожно добавляют 20 мл насыщенного раствора хлорида аммония и 15 мин сильно перемешивают. Многократно экстрагируют простым диэтиловым эфиром, промывают насыщенным раствором хлорида натрия,высушивают с помощью сульфата натрия и концентрируют в вакууме. После хроматографической очистки на силикагеле(гексан/этилацетат 10-50%) получают 5,6 г 3-[1-(3-фтор-2- 21015834 метоксифенил)циклопропил]-2-(трифторметил)пропан-1,2-диола. К 5,6 г (18,1 ммоль) диола в 100 мл дихлорметана и 61 мл ДМСО добавляют 12,4 мл (89 ммоль) триэтиламина и порционно за 10 мин 11 г(70 ммоль) пиридинового SO3 комплекса. Перемешивают в течение 3 ч и добавляют насыщенный раствор хлорида аммония. Смесь перемешивают последующие 15 мин, фазы разделяют и экстрагируют с помощью дихлорметана. Промывают водой и сушат над сульфатом натрия. Растворитель удаляют в вакууме и после хроматографической очистки на силикагеле (гексан/этилацетат, 0-50%) получают 5,9 г продукта. 1 Н-ЯМР (CDCl3): =0,68-0,76 (m, 2H), 0,90-1,02 (m, 2H), 2,03 (d, 1H), 2,91 (d, 1 Н), 3,85 (s, 1H), 4,03(s, 3 Н), 6,80 (d, 1H), 6,87 (ddd, 1H), 6,98 (dd, 1H), 9,26 (s, 1H). Аналогично примеру 29 из 800 мг (2,61 ммоль) 3-[1-(3-фтор-2-метоксифенил)циклопропил]-2 гидрокси-2-(трифторметил)пропанала и 500 мг (2,82 ммоль) 5-амино-7-фтор-2-метилхиназолина получают количественно 1-[(7-фтор-2-метилхиназол-5-ил)имино]-3-[1-(3-фтор-2-метоксифенил)циклопропил]-2-(трифторметил)пропан-2-ол. Обработка с помощью 24 мл (24 ммоль) раствора BBr3 и последующая дефлегмация в течение 14 ч дает 55 мг (1R,2S,Z) 4-этилена 6-фтор-1-[(7-фтор-2-метилхиназолин 5-ил)амино]-2-(трифторметил)-1,2,3,4-тетрагидронафталин-2,5-диола после хроматографии на силикагеле (гексан/этилацетат от 25 до 50%) и препаративной хиральной ВЭЖХ на Chiracel OD-H 5 мк (аналитическая ВЭЖХ: Rt=10,4 мин (Chiralcel OD 10 мк, 2504,6 мм, гексан/этанол 7%, 1 мл/мин текучесть) в виде (+)-энантиомера. 1 Н-ЯМР (300 МГц, CD3OD): =1,77 (d, 3 Н), 2,57 (d, 1H), 2,80 (s, 3 Н), 3,14 (d, 1H), 4,64 (s, 1H), 5,86(q,1H), 6,26 (dd, 1H), 6,77-6,97 (m, 2H), 7,02 (dd, 1H), 9,57 (s, 1H). 20 мг (1R,2S,Z) 4-этилиден-6-фтор-1-[(7-фтор-2-метилхиназолин-5-ил)амино]-2-(трифторметил)1,2,3,4-тетрагидронафталин-2,5-диол растворяют при КТ под N2 в 1 мл этилацетата и 0,07 мл Et3N и смешивают c 2 мг Pd-C(10%). Смесь взбалтывают 2 ч под атмосферой водорода; (Н 2-поглощение: 17 мл) и реакционную смесь фильтруют через целит, причем основательно подвергают последующей промывке с помощью ЭА. Концентрируют до прибл. 4 мл и перемешивают 3 ч с 40 мг активированного MnO2. Реакционную смесь фильтруют через целит, подвергают последующей промывке этилацетатом и концентрируют. Препаративная тонкослойная хроматография на силикагеле (гексан/2-пропанол 15%) дает 2 мг целевого продукта в виде желтого масла 1 Н-ЯМР (300 МГц, CD3OD): =0,96 (t, 3 Н), 1,76 (ddq, 1H), 2,02 (dd, 1H), 2,06 (ddq, 1H), 2,41 (dd, 1H),2,77 (s, 3 Н), 3,39 (m, 1H), 5,13 (s, 1H), 6,58 (d, 1H), 6,73 (dd, 1H), 6,77 (d, 1H), 6,88 (dd, 1H), 9,51 (s, 1H) и 1 мг другого диастереомера. Пример 31(5,6,8)-8-Этил-2-фтор-5-[(8-фтор-2-метилхиназолин-5-ил)амино]-6-(трифторметил)-5,6,7,8 тетрагидронафталин-1,6-диол. Аналогично примеру 29 подвергают взаимодействию 123 мг (0,40 ммоль) (2R,4R)-4-(3-фтор-2 метоксифенил)-2-гидрокси-2-(трифторметил)гексанала, 72 мг (0,60 ммоль) 5-амино-8-фтор-2 метилхиназолина и 0,22 мл тетраэтилата титана до получения (2R,4R)-4-(3-фтор-2-метоксифенил)-1[(8-фтор-2-метилхиназолин-5-ил)имино]-2-(трифторметил)гексан-2-ола. 170 мг сырого имина циклизуют аналогично примеру 29 при -30 С с 2,8 мл (2,8 ммоль) 1 М раствора бортрибромида до получения целевого продукта. После хроматографической очистки на силикагеле (дихлорметан/этилацетат 0-40%) получают 21 мг продукта. 1 Н-ЯМР (300 МГц, CD3OD): =0,97 (t, 3 Н), 1,77 (m, 1H), 2,03 (dd, 1H), 2,04 (m, 1H), 2,42 (dd, 1H),2,84 (s, 3 Н), 3,42 (dddd, 1H), 5,10 (s, 1H), 6,71 (dd,1H), 6,78 (dd, 1H), 6,90 (dd, 1H), 7,56 (dd, 1H), 9,63 (s,1H). Пример 31 А/31 В.(5,6,8)-8-Этил-2-фтор-5-[(8-фтор-2-метилхиназолин-5-ил)амино]-6-(трифторметил)-5,6,7,8 тетрагидронафталин-1,6-диол расщепляется с помощью препаративной хиральной ВЭЖХ (Chiralcel ODH 5 мк) в энантиомерно чистые соединения:(5,6,8)-5-[(7,8-Дифтор-2-метилхиназолин-5-ил)амино]-8-этил-2-фтор-6-(трифторметил)-5,6,7,8 тетрагидронафталин-1,6-диол. Аналогично примеру 29 подвергают взаимодействию 138 мг (0,45 ммоль) (2R,4S)-4-(3-фтор-2 метоксифенил)-2-гидрокси-2-(трифторметил)гекстанала, 89 мг (0,45 ммоль) 5-амино-7,8-дифтор-2 метилхиназолина и 0,24 мл тетраэтилата титана до получения (2R,4S)-1-[(7,8-дифтор-2 метилхиназолин-5-ил)имино]-4-(3-фтор-2-метоксифенил)-2-(трифторметил)пентан-2-ола. 210 мг сырого имина циклизуют аналогично примеру 29 при -30 С с 3,5 мл (3,5 ммоль) 1 M раствора бортрибромида до получения целевого продукта. После хроматографической очистки на силикагеле (дихлорметан/этилацетат 0-40%) получают 21 мг продукта. 1 Н-ЯМР (300 МГц, CD3OD): =0,97 (t, 3 Н), 1,78 (m, 1H), 2,04 (dd, 1H), 2,06 (m, 1H), 2,42 (dd, 1H),2,84 (s, 3 Н), 3,39 (m, 1H), 5,13 (s, 1H), 6,72 (dd, 1H), 6,76 (dd, 1H), 6,90 (dd, 1H), 9,56 (s, 1H). Пример 33 5-[(1,2,4)-4-Этил-6-фтор-2,5-дигидрокси-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1 ил]амино-хинолин-2(1H)-он. Аналогично примеру 29 подвергают взаимодействию 300 мг (0,97 ммоль) (2R,4S)-4-(3-фтор-2 метоксифенил)-2-гидрокси-2-(трифторметил)гекстанала, 132 мг (0,97 ммоль) 5-аминохинол-2(1 Н)-она и 0,44 мл тетраэтилата титана до получения 5-[(2R,4S)-4-(3-фтор-2-метоксифенил)-2-гидрокси-2(трифторметил)гексилиден]аминохинолин-2(1H)-она. 250 мг сырого имина циклизуют аналогично примеру 29 при -20 С с 2 мл (2 ммоль) 1 М раствора бортрибромида до получения целевого продукта. Препаративная тонкослойная хроматография на силикагеле (гексан/2-пропанол 17%) дает 11,5 мг целевого продукта 1 Н-ЯМР (300 МГц, CD3OD): =0,97 (t, 3 Н), 1,78 (m, 1H), 1,96-2,15 (m, 2H), 2,40 (dd, 1H), 3,42 (dddd,1H), 5,03 (s, 1H), 6,49 (d, 1H), 6,53 (d, 1H), 6,70 (d, 1 Н), 6,75 (dd, 1H), 6,88 (dd, 1H), 7,36 (t, 1H), 8,23 (d,1H). Пример 34 5-[(1,2,4)-4-Этил-6-фтор-2-гидрокси-5-метокси-2-(трифторметил)-1,2,3,4-тетрагидронафталин 1-ил]амино-8-фторхинолин-2(1H)-он. Аналогично примеру 29 конденсируют 4-(3-фтор-2-метоксифенил)-2-гидрокси-2(трифторметил)гексанал и 5-амино-8-фторхинолин-2(1H)-он до получения 8-фтор-5-[4-(3-фтор-2- 23015834 метоксифенил)-2-гидрокси-2-(трифторметил)гексилиден]аминохинолин-2(1H)-она. Взаимодействие с 1 М раствора бортрибромида после колоночной хроматографии на силикагеле (гексан/этилацетат 33100%) и препаративной ВЭЖХ дает как целевой продукт, так и простые метиловые эфиры расщепленных соединений примера 35 и 44. 1 Н-ЯМР (400 МГц, CD3OD): =0,92 (t, 3 Н), 1,70 (m, 1H), 1,86 (m, 1H), 2,02 (dd, 1H), 2,32 (dd, 1H),3,65 (m, 1H), 3,90 (s, 3 Н), 4,94 (s, 1H), 6,33 (dd, 1H), 6,54 (d, 1H), 6,90-7,00 (m, 2H), 7,17 (dd, 1H), 8,17 (d,1H). Пример 35 5-[(1,2,4)-4-Этил-6-фтор-2,5-дигидрокси-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1 ил]амино-8-фторхинолин-2(1H)-он. В качестве продукта из примера 34 после хроматографического разделения получают 1 Н-ЯМР (400 МГц, CD3OD): =0,93 (t, 3 Н), 1,73 (m, 1H), 1,90-2,02 (m, 2H), 2,85 (dd, 1H), 3,60 (m,1H), 4,92 (s, 1H), 6,34 (dd, 1H), 6,53 (d, 1H), 6,70 (dd, 1 Н), 6,84 (dd, 1H), 7,17 (dd, 1H), 8,17 (dd, 1H). Пример 35 А/35 В. 5-[(1,2,4)-4-Этил-6-фтор-2,5-дигидрокси-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1 ил]амино-8-фторхинолин-2(1H)-он расщепляется с помощью препаративной хиральной ВЭЖХ (Chiralcel OD-H 5 мк) в энантиомерно чистые соединения: 5-[(1,2,4)-4-Этил-6-фтор-2,5-дигидрокси-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1 ил]амино-2-метилфталазин-1-он. Аналогично примеру 29 подвергают взаимодействию 265 мг (0,86 ммоль) 4-(3-фтор-2 метоксифенил)-2-гидрокси-2-(трифторметил)гексанал, 150 мг (0,86 ммоль) 5-амино-2-метилфталазин-1 он и 0,42 мл тетраэтилат титана до получения 5-[4-(3-фтор-2-метоксифенил)-2-гидрокси-2(трифторметил)гексилиден]амино-2-метилфталазин-1-она. 410 мг сырого имина циклизуют аналогично примеру 29 при -20 С с 3,5 мл (3,5 ммоль) 1 М раствора бортрибромида до получения целевого продукта. Колоночная хроматография на силикагеле (гексан/сложный эфир уксусной кислоты 50%) и последующая препаративная тонкослойная хроматография на силикагеле с дихлорметан/метанол 9:1 дает 10 мг продукта и 8,6 мг 8 а соединения (пример 45). 1 Н-ЯМР (300 МГц, CD3OD): =0,85 (t, 3 Н), 1,66 (m, 1H), 1,90 (dd, 1H), 1,91 (m, 1H), 2,29 (dd, 1H),3,29 (dddd, 1H), 3,72 (s,3H), 4,89 (s, 1H), 6,63 (dd, 1H), 6,77 (dd, 1H), 6,98 (t, 1H), 7,51 (m, 2H), 8,43 (s, 1H).- 24015834 Аналогично могут быть получены пример 37(5,6,8)-8-Этил-2-фтор-5-[(2-метилхиназолин-5-ил)амино]-6-(трифторметил)-5,6,7,8 тетрагидронафталин-1,6-диол. Получают аналогично примеру 29 из соответствующего (2R,4S)-4-(3-фтор-2-метоксифенил)-2 гидрокси-2-(трифторметил)гексанала. 1 Н-ЯМР (300 МГц, CD3OD): =1,14 (t, 3 Н), 2,00 (m, 1H), 2,13 (m, 1H), 2,15 (dd, 1H), 2,45 (dd, 1H),2,80 (s, 3 Н), 3,11 (m, 1H), 5,28 (s, 1H), 6,78 (dd, 1H), 6,89 (dd, 1H), 6,98 (d, 1H), 7,18 (d, 1H), 7,79 (t, 1H),9,63 (s, 1H). Пример 40(5,6,8)-8-Этил-2-фтор-5-[(7-фторо-2-метилхиназолин-5-ил)амино]-6-(трифторметил)-5,6,7,8 тетрагидронафталин-1,6-диол. Получают аналогично примеру 30 из соответствующего (2R,4S)-4-(3-фтор-2-метоксифенил)2 гидрокси-2-(трифторметил)гексанала. 1 Н-ЯМР (300 МГц, CD3SOCD3): =1,05 (t, 3H), 1,92-1,99 (m, 2H), 2,15 (dd, 1 Н), 2,25 (dd, 1 Н), 2,69 (s,3 Н), 2,95 (m, 1 Н), 5,43 (d, 1H), 6,16 (s, 1H), 6,67 (dd, 1H), 6,76 (d, 1H), 6,80 (d, 1H), 6,99 (dd, 1H), 7,23 (d,1H), 9,61 (s, 1H), 9,69 (s, 1H).(5,6,8)-8-Этил-2-фтор-5-[(8-фтор-2-метилхиназолин-5-ил)амино]-6-(трифторметил)-5,6,7,8 тетрагидронафталин-1,6-диол. Аналогично примеру 31 подвергают взаимодействию 123 мг (0,40 ммоль) (2R,4R)-4-(3-фтор-2 метоксифенил)-2-гидрокси-2-(трифторметил)гексанала, 72 мг (0,60 ммоль) 5-амино-8-фтор-2 метилхиназолина и 0,22 мл тетраэтилата титана до получения (2R,4S)-4-(3-фтор-2-метоксифенил)-1[(8-фтор-2-метилхиназолин-5-ил)имино]-2-(трифторметил)гексан-2-ола. 170 мг сырого имина циклизуют аналогично примеру 31 при -30 С с 2,8 мл (2,8 ммоль) 1 М раствора бортрибромида до получения целевого продукта. После хроматографической очистки на силикагеле (дихлорметан/этилацетат 0-40%) получают 68 мг продукта. 1 Н-ЯМР (300 МГц, CD3OD): =1,14 (t, 3 Н), 1,98 (m, 1H), 2,09-2,15 (m, 2H), 2,43 (dd, 1H), 2,83 (s, 3 Н),3,10 (m, 1H), 5,21 (s, 1H), 6,77 (dd, 1H), 6,88 (dd, 1 Н), 6,89 (dd, 1H), 7,57 (dd, 1H), 9,67 (s, 1H) Пример 42(5,6,8)-5-[(7,8-Дифтор-2-метилхиназолин-5-ил)амино]-8-этил-2-фтор-6-(трифторметил)-5,6,7,8 тетрагидронафталин-1,6-диол. Аналогично примеру 32 подвергают взаимодействию 138 мг (0,45 ммоль) (2R,4S)-4-(3-фтор-2 метоксифенил)-2-гидрокси-2-(трифторметил)гекстанала,89 мг (0,45 ммоль) 5-амино-7,8-дифтор-2 метилхиназолина и 0,24 мл тетраэтилата титана до получения (2R,4S)-1-[(7,8-дифтор-2 метилхиназолин-5-ил)имино]-4-(3-фтор-2-метоксифенил)-2-(трифторметил)пентан-2-ола. 210 мг сырого имина циклизуют аналогично примеру 32 при -30 С с 3,5 мл (3,5 ммоль) 1 М раствора бортрибромида до получения целевого продукта. После хроматографической очистки на силикагеле (дихлорметан/этилацетат 0-40%) получают 41 мг продукта. 1 Н-ЯМР (300 МГц, CD3OD): =1,14 (t, 3 Н), 1,96 (m, 1H), 2,09-2,20 (m, 2H), 2,42 (dd, 1H), 2,83 (s, 3 Н),3,10 (m, 1H), 5,22 (s, 1H), 6,76 (dd, 1H), 6,86 (dd, 1 Н), 6,92 (dd, 1H), 9,62 (s, 1H) Пример 43 5-[(1,22,4)-4-Этил-6-фтор-2,5-дигидрокси-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1 ил]аминохинолин-2(1H)-он. Аналогично примеру 29 подвергают взаимодействию 300 мг (0,97 ммоль) (2R,4S)-4-(3-фтор-2 метоксифенил)-2-гидрокси-2-(трифторметил)гекстанала, 132 мг (0,97 ммоль) 5-амино-хинол-2(1 Н)-она и 0,44 мл тетраэтилата титана до получения 5-[(2R,4S)-4-(3-фтор-2-метоксифенил)-2-гидрокси-2(трифторметил)гексилиден]аминохинолин-2(1H)-она. 250 мг сырого имина циклизуют аналогично примеру 29 при -20 С с 2 мл (2 ммоль) 1 М раствора бортрибромида до получения целевого продукта. Пре- 26015834 паративная тонкослойная хроматография на силикагеле (гексан/2-пропанол 17%) дает 15,4 мг целевого продукта. 1 Н-ЯМР (300 МГц, CD3OD): =1,13 (t, 3 Н), 1,97 (m, 1H), 2,08-2,15 (m, 2H), 2,43 (dd, 1H), 3,09 (m,1H), 5,13 (s, 1H), 6,50 (d, 1H), 6,67 (d, 1H), 6,71 (d, 1H), 6,76 (dd, 1H), 6,88 (dd, 1H), 7,38 (t, 1H), 8,23 (d,1H). Пример 44 5-[(1,2,4)-4-Этил-6-фтор-2,5-дигидрокси-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1 ил]амино-8-фторхинолин-2(1H)-он. В качестве продукта из примера 34 после хроматографического разделения получают 1 Н-ЯМР (300 МГц, CD3OD): =1,07 (t, 3 Н), 1,90 (m, 1 Н), 2,00-2,13 (m, 2H), 2,17 (s, 1H), 2,37 (dd, 1H),3,04 (m, 1H), 4,99 (s, 1H), 6,50 (d, 1H), 6,55 (dd, 1 Н), 6,68 (dd, 1H), 6,85 (dd, 1H), 7,18 (dd, 1H), 7,43 (d, 1H),8,15 (dd, 1H). Пример 44 А/44 В. 5-[(1,2,4)-4-Этил-6-фтор-2,5-дигидрокси-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1 ил]амино-8-фторхинолин-2(1H)-он расщепляется с помощью препаративной хиральной ВЭЖХ (Chiralcel OD-H 5 мк) в энантиомерно чистые соединения: 5-[(1,2,4)-4-Этил-6-фтор-2,5-дигидрокси-2-(трифторметил)-1,2,3,4-тетрагидронафталин-1 ил]амино-2-метилфталазин-1-он. В качестве продукта из примера 36 после хроматографического разделения получают 1 Н-ЯМР (300 МГц, CD3OD): =1,01 (t, 3 Н), 1,83 (m, 1H), 2,00 (m, 1H), 2,02 (dd, 1 Н), 2,30 (dd, 1H),2,97 (m, 1 Н), 3,70 (s,3H), 5,08 (s, 1H), 6,63 (dd, 1H), 6,77 (dd, 1H), 7,15 (dd, 1H), 7,51 (d, 1H), 7,52 (d, 1H),8,44 (s, 1H). Аналогично могут быть получены пример 46(5,6,8)-5-[(2-Этилхиназолин-5-ил)амино]-2-фтор-8-пропил-6-(трифторметил)-5,6,7,8 тетрагидронафталин-1,6-диол. Аналогично примеру 31 подвергают взаимодействию 112 мг (0,37 ммоль) (4-(3-фтор-2 метоксифенил)-2-гидрокси-2-(трифторметил)гексанала, 60 мг (0,37 ммоль) 5-амино-2-этилхиназолина и 0,2 мл тетраэтилата титана до получения 1-[(2-этилхиназолин-5-ил)имино]-4-(3-фтор-2-метоксифенил)-2(трифторметил)гексан-2-ола. 280 мг сырого имина циклизуют аналогично примеру 31 при -20 С с 2,4 мл(2,4 ммоль) 1 М раствора бортрибромида до получения целевого продукта. После хроматографической очистки на силикагеле (этилацетат) получают 4 мг целевого продукта и 11 мг 8 а соединения (пример 49). 1 Н-ЯМР (300 МГц, CD3OD): =0,99 (t, 3 Н), 1,46 (t, 3H), 1,80 (m, 1H), 2,04 (dd, 1 Н), 2,05 (m, 1H), 2,43(5,6,8)-5-[(2-Этилхиназолин-5-ил)амино]-2-фтор-8-пропил-6-(трифторметил)-5,6,7,8 тетрагидронафталин-1,6-диол. В качестве продукта из примера 36 после хроматографического разделения получают 1 Н-ЯМР (300 МГц, CD3OD): =0,14 (t, 3 Н), 1,45 (t, 3H), 2,00 (m, 1H), 2,13 (1H), 2,15 (dd, 1H), 2,46(5S,6R,8R)-8-Этил-2,3-дифтор-5-[(2-метилхиназолин-5-ил)амино]-6-(трифторметил)-5,6,7,8 тетрагидронафталин-1,6-диол. 4-(3,4-Дифтор-2-метоксифенил)-2-гидрокси-2-(трифторметил)гексанал. К 20 г (153,7 ммоль) 2,3-дифторфенола в 150 мл дихлорметана и 17,5 мл пиридина при 0 С добавляют по каплям 14 мл (161 ммоль) хлорида пропионовой кислоты. Перемешивают смесь в течение 2 ч и добавляют 100 мл 2 М соляной кислоты. Экстрагируют с помощью дихлорметана и промывают водой. После высушивания над сульфатом натрия и удаления растворителя в вакууме получают 30,1 г 2,3 дифторфенилового сложного эфира пропионовой кислоты. 30,1 г (161 ммоль) 2,3-дифторфенилового сложного эфира пропионовой кислоты в 16 мл 1,2-дихлорбензол добавляют по каплям к 21,5 г(161 ммоль) трихлорида алюминия в 16 мл 1,2-дихлорбензола и по окончании смесь перемешивают в течение 6 ч при 100 С. Оставляют охлаждаться, разбавляют дихлорметаном и выливают осторожно в смесь из 2 М соляной кислоты и льда. Фазы разделяют, экстрагируют с помощью дихлорметана, промывают насыщенным раствором хлорида натрия и сушат над сульфатом натрия. Исходный продукт очищают колоночной хроматографией на силикагеле (гексан/этилацетат 10-20%), очищают и получают 21,5 г 1-(3,4-дифтор-2-гидроксифенил)пропан-1-она. 21,4 г (115 ммоль) 1-(3,4-дифтор-2-гидроксифенил)пропан-1-она растворяют в 170 мл ацетона и добавляют 29,5 г карбоната калия и 13 мл (209 ммоль) метилйодида. Смесь 4 ч кипятят в колбе с обратным холодильником, 12 ч перемешивают при комнатной температуре и по окончании в значительной мере удаляют растворитель. Остаток выливают в воду и экстрагируют простым диэтиловым эфиром. Промывают водой, сушат над сульфатом натрия и после удаления растворителя в вакууме получают 21,2 г 1-(3,4-дифтор-2-метоксифенил)пропан-1-он. 31,2 г (476 ммоль) цинковой пыли и 740 мг (2,65 ммоль) хлорида свинца(II) суспендируют в 320 мл ТГФ и при 0 С добавляют 30 мл (265 ммоль) дибромметана. Перемешивают в последующие 30 мин при комнатной температуре и прибавляют по каплям при 0 С 53 мл (53 ммоль) 1M раствора хлорида титана(IV) в дихлорметане. Охлаждающую ванну удаляют и через час реакционную смесь снова охлаждают до 0 С. 10,6 г (53 ммоль) 1-(3,4-дифтор-2-метоксифенил)пропан-1-она добавляют по каплям в 106 мл ТГФ. Перемешивают в течение 1 ч при комнатной температуре. Разбавляют простым диэтиловым эфиром и реакционную смесь осторожно добавляют в смесь из 4 М соляной кислоты и льда. Фазы разделяют, экстрагируют простым диэтиловым эфиром, промывают насыщенным раствором хлорид натрия, сушат над сульфатом натрия и растворитель удаляют. Исходный продукт очищают колоночной хроматографией на силикагеле (гексан/простой диизопропиловый эфир 20-40%), очищают и получают 4,3 г 2,3 дифтор-6-(1-метиленпропил)анизол. К 23,6 г (119 ммоль) 2,3-дифтор-6-(1-метиленпропил)анизола,31,4 мл (238 ммоль) этилтрифторпирувата и 10 г молекулярного сита при 0 С в течение 30 мин добавляют по каплям 2,58 г (2,98 ммоль) [CuR,R)-бис-трет-бутилоксазолин)(Н 2 О)2](SbF6)2, в 85 мл дихлорметана. Перемешивают реакционную смесь 16 ч при 0 С и реакционную смесь очищают с помощью колоночной хроматографии на силикагеле (гексан/этилацетат 0-10%). Получают 16,7 г сложного этилового эфира (R)-4-(3,4-дифтор-2-метоксифенил)-2-гидрокси-2-(трифторметил)гекс-4-еновой кислоты в видеE/Z смеси с избытком энантиомеров более 80%. 16,7 г (45,3 ммоль) сложного этилового эфира Е/Z-4-(3,4 дифтор-2-метоксифенил)-2-гидрокси-2-(трифторметил)гекс-4-еновой кислоты охлаждают в 600 мл простого диэтилового эфира до -5 С и в течение 10 мин порционно добавляют 3,44 мг (90,7 ммоль) твердого алюмогидрида лития. Перемешивают 2 ч при комнатной температуре и выливают в насыщенный раствор хлорида аммония. Суспензию фильтруют через целит, причем основательно повторно промывают этилацетатом. Фазы фильтрата разделяют и еще раз экстрагируют этилацетатом. Промывают насыщенным раствором хлорида натрия, сушат над сульфатом натрия, растворитель удаляют в вакууме и получают таким образом 13,9 сырого Е/Z-4-(3,4-дифтор-2-метоксифенил)-2-(трифторметил)гекс-4-ен-1,2-диола. 16 г (49 ммоль) (Е/Z-4-(3,4-дифтор-2-метоксифенил)-2-(трифторметил)гекс-4-ен-1,2-диола растворяют в 680 мл метанола и 9,4 мл уксусной кислоты и добавляют 1,07 г палладия на угле (10%-ный). Суспензию взбалтывают под атмосферой водорода при нормальном давлении до полного взаимодействия. Смесь отфильтровывают через целит, причем основательно повторно промывают этилацетатом. После удаления растворителя получают 16,1 г сырого 4-(3,4-дифтор-2-метоксифенил)-2-(трифторметил)гексан-1,2 диола в виде смеси диастереомеров. К 16,1 г (49 ммоль) 4-(3,4-дифтор-2-метоксифенил)-2- 29
МПК / Метки
МПК: C07D 215/38, C07D 311/76, C07D 237/32, C07D 239/74, C07D 209/34, C07D 215/60, A61K 31/47, A61K 31/502, C07D 217/24, A61K 31/517, C07D 215/22, C07D 231/56, C07D 265/02, A61P 29/00
Метки: тетрагидронафталина, качестве, ингибиторов, производные, воспаления, применение
Код ссылки
<a href="https://eas.patents.su/30-15834-proizvodnye-tetragidronaftalina-i-ih-primenenie-v-kachestve-ingibitorov-vospaleniya.html" rel="bookmark" title="База патентов Евразийского Союза">Производные тетрагидронафталина и их применение в качестве ингибиторов воспаления</a>
Предыдущий патент: Иммуногенная композиция
Следующий патент: Производные 4-окса(тиа)метилпиперидина и их применение в качестве противодиабетических средств
Случайный патент: Фунгицидные смеси












