Производные хинолина и изохинолина, способ их получения и их применение в качестве ингибиторов воспаления
Номер патента: 8540
Опубликовано: 29.06.2007
Авторы: Шэке Хайке, Бергер Маркус, Шоттелиус Арндт, Шмеес Норберт, Кроликевич Конрад, Леманн Манфред, Ярох Штефан, Скубалла Вернер, Ревинкель Хартмут
Формула / Реферат
1. Соединения общей формулы I
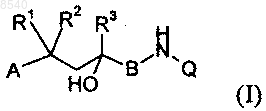
в которой А обозначает арильную, бензильную или фенетильную группу, каждая из которых необязательно может быть замещена одним либо несколькими остатками из группы, включающей C1-C5алкил, C1-C5алкоксигруппу, C1-C5алкилтиогруппу, C1-C5перфторалкил, галоген, гидроксигруппу, цианогруппу, нитрогруппу, -О-(СН2)n-О-, -О-(СН2)n-СН2-, -О-СН=СН-, -(СН2)n+2-, где n обозначает 1 или 2, а концевые атомы кислорода и/или атомы углерода соединены с непосредственно расположенными рядом углеродными атомами кольца, или группу NR4R5, где R4 и R5 независимо друг от друга могут представлять собой водород, C1-C5алкил или (СО)-C1-C5алкил,
R1 и R2 независимо друг от друга представляют собой атом водорода, метильную либо этильную группу или вместе с углеродным атомом цепи образуют С3-С6циклоалкильное кольцо,
R3 представляет собой C1-C3алкильную группу или при определенных условиях частично либо полностью фторированную C1-C3алкильную группу,
В обозначает необязательно замещенную метильной либо этильной группой метиленовую группу или карбонильную группу и
Q обозначает присоединенную через любое положение хинолинильную или изохинолинильную группу, которая необязательно может быть замещена одним либо несколькими остатками из группы, включающей C1-C5алкил, который необязательно может быть замещен 1-3 гидроксигруппами и/или 1-3 COOR6-группами, C1-C5алкоксигруппу, C1-C5алкилтиогруппу, C1-C5перфторалкил, галоген, гидроксигруппу, кислородный атом карбонила, цианогруппу, нитрогруппу, группу NR4R5, где R4 и R5 независимо друг от друга могут представлять собой водород, C1-C5алкил или (СО)-C1-C5алкил, группу COOR6, где R6 представляет собой водород или C1-C5алкильную группу, группу (CO)NR7R8, где R7 и R8 независимо друг от друга представляют собой водород или C1-C5алкильную группу, и (С1-С5алкилен)-О-(СО)-(C1-C5)алкил,
а также их рацематы или представленные раздельно стереоизомеры и необязательно их физиологически совместимые соли.
2. Соединения по п.1, в которых Q обозначает присоединенную через любое положение хинолинильную или изохинолинильную группу, которая необязательно может быть замещена одним либо несколькими остатками из группы, включающей C1-C5алкил, который необязательно может быть замещен 1-3 гидроксигруппами или 1-3 COOR6-группами, кислородный атом карбонила, группу COOR6, где R6 представляет собой водород или C1-C5алкильную группу, группу (CO)NR7R8, где R7 и R8 независимо друг от друга представляют собой водород или C1-C5алкильную группу, и (C1-C5алкил)-О-(СО)-(C1-C5)алкильную группу.
3. Соединения общей формулы I
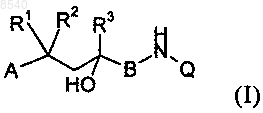
в которой А обозначает арильную, бензильную или фенетильную группу, каждая из которых необязательно может быть замещена одним либо несколькими остатками из группы, включающей C1-C5алкил, C1-C5алкоксигруппу, C1-C5алкилтиогруппу, C1-C5перфторалкил, галоген, гидроксигруппу, цианогруппу, нитрогруппу, -О-(СН2)n-О-, -О-(СН2)n-СН2-, -О-СН=СН-, -(СН2)n+2-, где n обозначает 1 или 2, а концевые атомы кислорода и/или атомы углерода соединены с непосредственно расположенными рядом углеродными атомами кольца, или группу NR4R5, где R4 и R5 независимо друг от друга могут представлять собой водород, C1-C5алкил или (СО)-C1-C5алкил,
R1 и R2 независимо друг от друга представляют собой атом водорода, метильную либо этильную группу или вместе с углеродным атомом цепи образуют C3-C6циклоалкильное кольцо,
R3 представляет собой C1-C3алкильную группу или при определенных условиях частично либо полностью фторированную C1-C3алкильную группу,
В обозначает необязательно замещенную метильной либо этильной группой метиленовую группу или карбонильную группу и
Q обозначает присоединенную через любое положение хинолинильную или изохинолинильную группу, которая необязательно может быть замещена одним либо несколькими остатками из группы, включающей C1-C5алкил, C1-C5алкоксигруппу, C1-C5алкилтиогруппу, C1-C5перфторалкил, галоген, гидроксигруппу, цианогруппу, нитрогруппу и группу NR4R5, где R4 и R5 независимо друг от друга могут представлять собой водород, C1-C5алкил или (СО)-C1-C5алкил,
а также их рацематы или представленные раздельно стереоизомеры и необязательно их физиологически совместимые соли.
4. Соединения по п.2 или 3, в которых В обозначает метиленовую группу.
5. Соединения по п.2 или 3, в которых А обозначает арильный остаток.
6. Соединения по п.5, в которых А обозначает арильный остаток, который необязательно может быть замещен одним либо несколькими остатками из группы, включающей C1-C5алкил, C1-C5алкокси-группу, C1-C5перфторалкил, галоген, гидроксигруппу, нитрогруппу, -О-(СН2)n-О-, -О-(СН2)n-СН2-, -О-СН=СН- и -(СН2)n+2-, где n обозначает 1 или 2, а концевые атомы кислорода и/или атомы углерода соединены с непосредственно расположенными рядом углеродными атомами кольца.
7. Соединения по п.2 или 3, в которых R1 и R2 вместе с углеродным атомом цепи образуют C3-C6циклоалкильное кольцо.
8. Соединения по п.2 или 3, отличающиеся тем, что Q обозначает присоединенную через любое положение необязательно замещенную хинолинильную группу.
9. Соединения по п.5, отличающиеся тем, что А обозначает замещенный гидроксигруппой либо метоксигруппой и атомом галогена фенильный остаток.
10. Соединения по п.1, отличающиеся тем, что они представляют собой (+)-энантиомеры.
11. Соединения по п.1, отличающиеся тем, что они представляют собой (-)-энантиомеры.
12. Применение соединений по п.1 для получения лекарственных средств.
13. Применение соединений по п.1 для получения лекарственного средства, предназначенного для лечения воспалительных заболеваний.
14. Фармацевтические препараты, содержащие по меньшей мере одно соединение по п.1 или смеси таких соединений, а также фармацевтически приемлемые носители.
Текст
008540 Настоящее изобретение относятся к производным хинолина и изохинолина, к способу их получения и их применению в качестве ингибиторов воспаления. Из уровня техники, в частности из заявок DE 10038639 и WO 02/10143, известны ингибиторы воспаления общей формулы где остаток Аr включает фталиды, тиофталиды, бензоксазиноны или фталазиноны. Эти соединения при их применении в экспериментальных исследованиях проявляют различную активность в отношении противовоспалительных и нежелательных метаболических эффектов и тем самым они превосходят описанные до настоящего времени нестероидные глюкокортикоиды или обладают, по меньшей мере, таким же хорошим действием. Однако избирательность подобных соединений из уровня техники по отношению к другим стероидным рецепторам требует дальнейшего совершенствования. Исходя из этого, в основу настоящего изобретения была положена задача предложить соединения с улучшенной избирательностью по отношению к другим стероидным рецепторам. Указанная задача решается с помощью соединений,охарактеризованных в формуле изобретения. В соответствии с этим настоящее изобретение относится к соединениям общей формулы I в которой А обозначает арильную, бензильную или фенетильную группу, каждая из которых необязательно может быть замещена одним либо несколькими остатками из группы, включающей C1-C5 алкил,C1-C5 алкоксигруппу, C1-C5 алкилтиогруппу, C1-C5 перфторалкил, галоген, гидроксигруппу, цианогруппу,нитрогруппу, -О-(СН 2)n-О-, -О-(СН 2)n-СН 2-, -О-СН=СН-, -(СН 2)n+2-, где n обозначает 1 или 2, а концевые атомы кислорода и/или атомы углерода соединены с непосредственно расположенными рядом углеродными атомами кольца, или группу NR4R5, где R4 и R5 независимо друг от друга могут представлять собой водород, C1-C5 алкил или (СО)-С 1-С 5 алкил,R1 и R2 независимо друг от друга представляют собой атом водорода, метильную либо этильную группу или вместе с углеродным атомом цепи образуют C3-C6 циклоалкильное кольцо,R3 представляет собой C1-C3 алкильную группу или при определенных условиях частично либо полностью фторированную C1-C3 алкильную группу,В обозначает необязательно замещенную метильной либо этильной группой метиленовую группу или карбонильную группу иQ обозначает присоединенную через любое положение хинолинильную или изохинолинильную группу, которая необязательно может быть замещена одним либо несколькими остатками из группы,включающей C1-C5 алкил, который необязательно может быть замещен 1-3 гидроксигруппами и/или 1-3COOR6-группами, С 1-С 5 алкоксигруппу, С 1-С 5 алкилтиогруппу, С 1-С 5 перфторалкил, галоген, гидроксигруппу, кислородный атом карбонила, цианогруппу, нитрогруппу, группу NR4R5, где R4 и R5 независимо друг от друга могут представлять собой водород, С 1-С 5 алкил или (СО)-С 1-С 5 алкил, группу COOR6, где R6 представляет собой водород или С 1-С 5 алкильную группу, группу (CO)NR7R8, где R7 и R8 независимо друг от друга представляют собой водород или С 1-С 5 алкильную группу, и (С 1-С 5 алкилен)-О-(СО)-(С 1 С 5)алкил,а также к их рацематам или представленным раздельно стереоизомерам и необязательно к их физиологически совместимым солям. В качестве группы А предпочтительной является арильная группа. Арильная группа включает фенил и нафтил, предпочтителен из которых фенил. Замещенные арильные, бензильные или фенетильные группы дополнительно к соединению с цепью несут в кольце 1-3 заместителя, предпочтительно 2 заместителя. Следующие схемы замещения в кольце А являются особым объектом изобретения: 2,5-двузамещенные фенильные производные и 2,4-двузамещенные фенильные производные, причем положение 1 занято соединением с цепью. Особым объектом изобретения являются соединения, несущие в арильном остатке один или несколько заместителей из группы, включающей С 1-С 5 алкил, С 1-С 5 алкоксигруппу, С 1-С 5 перфторалкил,галоген, гидроксигруппу, нитрогруппу, -О-(СН 2)n-О-, -О-(СН 2)n-СН 2-, -О-СН=СН- и -(СН 2)n+2-, где n обозначает 1 или 2, а концевые атомы кислорода и/или атомы углерода соединены с непосредственно расположенными рядом углеродными атомами кольца. К наиболее предпочтительным относятся соединения формулы I, где А обозначает фенильное кольцо, которое дополнительно к соединению с цепью замещено гидрокси- либо метоксигруппой и галогеном. С 1-С 5 Алкильные группы в группе A, R3, R4, R5, R6, R7 и R8 могут иметь прямую либо разветвленную-1 008540 цепь и представлять собой метильную, этильную, н-пропильную, изопропильную, н-бутильную, изобутильную, трет-бутильную, н-пентильную, 2,2-диметилпропильную, 2-метилбутильную или 3-метилбутильную группу, предпочтительной из которых является метильная или этильная группа. При определенных условиях они могут быть замещены 1-3 гидроксигруппами и/или 1-3 COOR6-группами. Предпочтительны из них гидроксигруппы. Под (С 1-С 5 алкилен)-О-(СО)-(С 1-С 5)алкильной группой имеется в виду, например, -СН 2-О-СО-СН 3 группа. В качестве частично либо полностью фторированной С 1-С 3 алкильной группы могут рассматриваться следующие частично либо полностью фторированные группы: фторметил, дифторметил, трифторметил, фторэтил, 1,1-дифторэтил, 1,2-дифторэтил, 1,1,1-трифторэтил, тетрафторэтил и пентафторэтил. Предпочтительной из них является трифторметильная или пентафторэтильная группа. Алкильные остатки R1 и R2 могут образовывать вместе с углеродным атомом цепи 3-6-членное кольцо. Предпочтительным является циклопропильное кольцо. С 1-С 5 Алкоксигруппы в группах А и Q могут иметь прямую либо разветвленную цепь и представлять собой метокси-, этокси-, н-пропокси-, изопропокси-, н-бутокси-, изобутокси-, трет-бутокси-, нпентокси-, 2,2-диметилпропокси-, 2-метилбутокси- или 3-метилбутоксигруппу. Предпочтительной из них является метокси- или этоксигруппа. С 1-С 5 Алкилтиогруппы в группах А и Q могут иметь прямую либо разветвленную цепь и представлять собой метилтио-, этилтио-, н-пропилтио-, изопропилтио-, н-бутилтио-, изобутилтио-, трет-бутилтио-,н-пентилтио-, 2,2-диметилпропилтио-, 2-метилбутилтио- или 3-метилбутилтиогруппу. Предпочтительной из них является метилтио- или этилтиогруппа. Понятием "атом галогена", соответственно "галоген", обозначают атом фтора, хлора, брома или иода. Предпочтительным является атом фтора, хлора или брома. Группа NR4R5 может представлять собой, например, NH2, N(H)CH3, N(CH3)2, N(H)(CO)CH3,N(CH3)(CO)CH3, N[(CO)CH3]2, N(H)CO2CH3, N(CH3)CO2CH3 или N(CO2CH3)2. В качестве алкильных остатков R4 и R5 предпочтителен С 1-С 3 алкил, а в качестве ацильных остатков 4R и R5 предпочтителен (СО)-С 1-С 3 алкил. В качестве группы NR7R8 может рассматриваться, например, NH2, N(H)CH3, N(CH3)2, N(C2H5)2,NH(C2H5), N(C3H7)2, N(C4H9)2 или N(C5H11)2. Предпочтительными для остатка В являются метиленовая группа и карбонильная группа. Особенно предпочтительна из них метиленовая группа. Объектом изобретения являются соединения общей формулы I, в которой Q обозначает присоединенную через любое положение, необязательно замещенную хинолинильную группу. Остаток Q через любой углеродный атом кольца может быть соединен с (NН)-группой цепи. Предпочтительными для хинолинового кольца являются положения 4, 5 и 8, а для изохинолинового кольца положение 1. Еще одним объектом изобретения являются соединения общей формулы I, в которой А обозначает арильную, бензильную или фенетильную группу, каждая из которых необязательно может быть замещена одним либо несколькими остатками из группы, включающей С 1-С 5 алкил, С 1 С 5 алкоксигруппу, С 1-С 5 алкилтиогруппу, С 1-С 5 перфторалкил, галоген, гидроксигруппу, цианогруппу,нитрогруппу, -О-(СН 2)n-О-, -О-(СН 2)n-СН 2-, -О-СН=СН-, -(СН 2)n+2-, где n обозначает 1 или 2, а концевые атомы кислорода и/или атомы углерода соединены с непосредственно расположенными рядом углеродными атомами кольца, или группу NR4R5, где R4 и R5 независимо друг от друга могут представлять собой водород, С 1-С 5 алкил или (СО)-С 1-С 5 алкил,R1 и R2 независимо друг от друга представляют собой атом водорода, метильную либо этильную группу или вместе с углеродным атомом цепи образуют С 3-С 6 циклоалкильное кольцо,R3 представляет собой С 1-С 3 алкильную группу или при определенных условиях частично либо полностью фторированную С 1-С 3 алкильную группу,В обозначает необязательно замещенную метильной либо этильной группой метиленовую группу или карбонильную группу иQ обозначает присоединенную через любое положение хинолинильную или изохинолинильную группу, которая необязательно может быть замещена одним либо несколькими остатками из группы,включающей С 1-С 5 алкил, С 1-С 5 алкоксигруппу, С 1-С 5 алкилтиогруппу, С 1-С 5 перфторалкил, галоген, гидроксигруппу, цианогруппу, нитрогруппу и группу NR4R5, где R4 и R5 независимо друг от друга могут представлять собой водород, С 1-С 5 алкил или (СО)-С 1-С 5 алкил,а также их рацематы или представленные раздельно стереоизомеры и необязательно их физиологически совместимые соли. Еще одним объектом изобретения являются соединения общей формулы I, где Q обозначает присоединенную через любое положение хинолинильную или изохинолинильную группу, которая необязательно может быть замещена одним либо несколькими остатками из группы, включающей С 1-С 5 алкил,который необязательно может быть замещен 1-3 гидроксигруппами или 1-3 COOR6-группами, кислородный атом карбонила, группу COOR6, где R6 представляет собой водород или С 1-С 5 алкильную группу,группу (CO)NR7R8, где R7 и R8 независимо друг от друга представляют собой водород или С 1-С 5 алкиль-2 008540 ную группу, и (С 1-С 5 алкил)-О-(СО)-(С 1-С 5)алкильную группу. Объектом изобретения являются соединения общей формулы I, где Q обозначает однозамещенную хинолинильную группу. Объектом изобретения являются соединения, в которых В обозначает метиленовую группу, a Q обозначает необязательно замещенную хинолинильную группу. Еще одним объектом изобретения являются соединения, в которых А обозначает необязательно замещенную фенильную группу, Q обозначает необязательно замещенную хинолинильную группу, а В обозначает метиленовую группу. Предлагаемые в изобретении соединения общей формулы I благодаря наличию асимметрических центров могут быть представлены в виде различных стереоизомеров. Как рацематы, так и представленные раздельно стереоизомеры являются объектом настоящего изобретения. Особым объектом настоящего изобретения являются представленные раздельно стереоизомеры, т.е.(+)-энантиомеры и (-)-энантиомеры. Кроме того, предлагаемые в изобретении соединения в тех случаях, когда они содержат гидроксигруппу в -положении по отношению к атому азота хинолинила или изохинолинила, отличаются наличием кето-енольной таутомерии. Согласно изобретению обе формы являются объектом изобретения,даже если, например, в экспериментальной части представлена только одна из обеих таутомерных форм. Настоящее изобретение относится далее к способу получения соединений формулы I, а также к их применению в качестве лекарственных средств. Применение указанных соединений для получения лекарственных средств, предназначенных для лечения заболеваний, так или иначе обусловленных воспалительными процессами, также является объектом изобретения. Способы получения соединений, известные из заявок WO 98/54159, WO 00/32584 и WO 02/10143,могут использоваться также для получения предлагаемых в настоящем изобретении соединений. Для присоединения характерной для соединений согласно изобретению хинолиновой или изохинолиновой группы можно проводить следующие операции: А 1). Для случая, когда В обозначает СО-Кетокислоту общей формулы II, где A, R1 и R2 имеют значения, указанные для формулы (I), с помощью аминохинолина, аминоизохинолина либо (частично) гидрированного производного хинолина,соответственно изохинолина (Q-NH2) по известной специалисту методике переводят в -кетоамид формулы (III), где A, R1 и R2 имеют указанные выше значения. Так, например, используя известные из химии пептидов дегидратизирующие агенты сочетания, такие как дициклогексилкарбодиимид, или за счет предварительного превращения кислоты в соответствующий хлорангидрид кислоты, например, с помощью тионилхлорида либо РОСl3, и последующего взаимодействия с Q-NH2 получают -кетоамид (III) Соединение (III) либо с использованием соединения щелочного металла, например реактива Гриньяра или алкиллития, либо реакцией с соединением формулы (IV) где R3 имеет указанное выше значение, a R9 представляет собой С 1-С 5 алкильную группу, в присутствии катализатора, например фторидных солей или оснований, таких, в частности, как карбонаты щелочных металлов (Journ. Am. Chem. Soc. 111, 1989, с. 393), превращают в указанное в заголовке соединение формулы (I). А 2). Для случая, когда В обозначает СО В качестве альтернативы те же -кетокислоты (II) можно по обычным методам, например с помощью тионилхлорида в метаноле либо этаноле или с помощью метилиодида и карбоната щелочного металла, этерифицировать с образованием соединений формулы (V) где A, R1 и R2 имеют указанные выше значения, a R10 представляет собой С 1-С 4 алкил, и затем аналогично описанной в разделе А 1) и последовательно осуществляемой реакции при получении из соединения (III) соединения (I) превращать их в соединение формулы (VI) Сложный эфир в стандартных условиях, например с использованием водного раствора гидроксида щелочного металла, омыляют с образованием кислоты (VI; R10 обозначает Н). Затем эту кислоту по реакции сочетания взаимодействием с аминохинолином либо аминоизохинолином или (частично) гидрированным производным хинолина, соответственно изохинолина (Q-NH2) с использованием обычного активатора реакции, например тионилхлорида, при необходимости в присутствии катализатора, такого как диметиламинопиридин, превращают в указанное в заголовке соединение формулы (I). Б). Для случая, когда В обозначает необязательно замещенную метилом либо этилом метиленовую группу а). Соединение общей формулы (VII) или (VIII) где А, В, R1, R2 и R3 имеют указанные выше значения, a LG обозначает любую уходящую группу, такую как галогенид или сульфонат, с целью получения указанного в заголовке соединения формулы (I) подвергают взаимодействию с соединением общей формулы (IX) или (X) где R12 представляет собой атом водорода, С 1-С 5 ацильную группу или алкокси- либо арилоксикарбонильную группу, a Q имеет указанное выше значение, при этом остаток R12 отщепляют или образующийся в качестве промежуточного продукта оксазолидинон (ср., например, S.J. Brickner, D.K. Hutchinson,M.R. Barbachyn, P.R. Manninen, D.A. Ulanowicz, S.A. Garmon, K.C. Grega, S.K. Hendges, D.S. Toops, C.W.Ford, G.E. Zurenko, Journ. Med. Chem. 39, 1996, с. 673) расщепляют, например, с помощью водных гидроксидов щелочных металлов. б). Согласно другому варианту соединения формулы (VII) или (VIII) подвергают взаимодействию с азотными нуклеофилами, например с азидными солями или аммиаком, при этом в первом случае затем следует реакция восстановления, осуществляемая по известной специалисту методике, например с помощью комплексных гидридов, таких как алюмогидрид лития, или катализируемый переходным метал-4 008540 лом гидрогенолиз, с получением в результате соединений формулы (XI) Остатки R1-R3, А и В в приведенной формуле имеют значения, идентичные указанным выше. в). Соединение формулы (XI) при катализе основаниями, например в присутствии третичных аминооснований или карбонатов либо гидроксидов щелочных металлов, или при катализе переходными металлами, например палладиевом катализе (J.P. Wolfe, S. Wagaw, J.-F. Marcoux, S.L. Buchwald, Acс. Chem.Res. 31, 1998, с 805; J.F. Hartwig, Acc. Chem. Res. 31, 1998, с. 852), можно переводить с использованием галогенированного хинолина или изохинолина в указанное в заголовке соединение формулы (I). г). В завершение следует назвать еще одну возможность получения указанного в заголовке соединения формулы (I), заключающуюся в том, что его синтезируют путем восстановительного аминирования соединения формулы (XII) с помощью Q-NH2, используя при этом в качестве восстановителя, например цианоборогидрид натрия или триацетоксиборогидрид натрия.R11 в приведенной формуле представляет собой метил либо этил в соответствии со значениями заместителей, указанными в разделе Б) для метиленовой группы. В тех случаях, когда соединения общей формулы (I) представлены в виде солей, такими солями могут быть, например, гидрохлориды, сульфаты, нитраты, фосфаты, пивалаты, малеаты, фумараты, тартраты, бензоаты, мезилаты, цитраты или сукцинаты. Если предлагаемые в изобретении соединения представлены в виде рацемических смесей, то с помощью обычных, известных специалисту методов разделения рацематов их можно разделять на чистые,оптически активные формы. Так, например, рацемические смеси можно разделять хроматографией на уже обладающем оптической активностью носителе (материал CHIRALPAK AD) на чистые изомеры. Другая возможность состоит в том, что свободную гидроксигруппу в составе рацемического соединения общей формулы I этерифицируют оптически активной кислотой, после чего полученные сложные диастереоизомерные эфиры разделяют путем фракционированной кристаллизации или хроматографическим путем и разделенные эфиры омыляют соответственно с образованием оптически чистых изомеров. В качестве оптически активной кислоты может использоваться, например, миндальная кислота, камфорсульфоновая кислота или винная кислота. Связывание соединений с глюкокортикоидным рецептором (GR) и с другими рецепторами стероидных гормонов (минералкортикоидным рецептором (MR), прогестероновым рецептором (PR) и андрогенным рецептором (AR исследуют с помощью полученных рекомбинатным путем рецепторов. В этих исследованиях используют цитозольные препараты клеток Sf9, инфицированных рекомбинатными бакуловирусами, которые кодируют GR. В отличие от сравнительной субстанции [3 Н]-дексаметазона соединения по изобретению проявляют аффинность к GR, степень которой варьируется от высокой до очень высокой. Кроме того, описанные в данном изобретении хинолины и изохинолины формулы I обладают высокой избирательностью по отношению к глюкокортикоидному рецептору. Так, соединение, представленное в примере 4, характеризуется следующим профилем действия: IC50(GR) = 0,6-1,3 нМ; IC50(MR),IC50(PR), IC50(AR) 1 мкМ. В качестве важного молекулярного механизма противовоспалительного действия глюкокортикоидов рассматривается опосредованное рецептором GR подавление транскрипции цитокинов, адгезионных молекул, ферментов и других факторов, способствующих воспалительным процессам. Это подавление инициируется взаимодействием GR с другими факторами транскрипции, например АР-1 и NF-каппа-В(см. обзорную статью Cato, ACB and Wade E, в BioEssays 18, 1996, cc. 371-378). Предлагаемые в изобретении соединения общей формулы I ингибируют стимулированную липополисахаридом (ЛПС) секрецию цитокина IL-8 в человеческих моноцитах линии ТНР-1. Концентрацию цитокинов определяли в супернатанте с помощью коммерчески доступного набора для ELISA-анализа(твердофазного иммуноферментного анализа). Противовоспалительную эффективность соединений общей формулы I исследовали в опытах на животных (крысах и мышах) на примере воспаления, индуцированного кротоновым маслом (Journ. Exp.Med. 182, 1995, cc. 99-108). С этой целью уши подопытных животных (местное применение) обрабатывали раствором кротонового масла в этаноле. Обработку исследуемыми соединениями (также при местном или системном применении) проводили одновременно либо за 2 ч до обработки кротоновым маслом. Через 16-24 ч измеряли вес ушей в качестве меры определения воспалительного отека, активность пероксидазы в качестве меры определения диффузии гранулоцитов и активность эластазы в качестве меры-5 008540 определения диффузии нейтрофильных гранулоцитов. Как было установлено в ходе проведенных опытов, соединения общей формулы I способны подавлять все три указанных параметра воспаления как при местном, так и системном применении. Одним из наиболее часто проявляющихся при глюкокортикоидной терапии нежелательных эффектов является так называемый "стероидный диабет" [ср. Hatz, HJ, Glucocorticoide: Immunologische Grundlagen, Pharmakologie und Therapierichtlinien, изд-во Wissenschafliche Verlagsgesellschaft mbH, Stuttgart(1998)]. Причина данного эффекта обусловлена стимуляцией глюконеогенеза в печени в результате индукции ответственных за это ферментов и действием свободных аминокислот, образующихся при расщеплении белков (катаболическое действие глюкокортикоидов). Ключевым ферментом катаболического обмена веществ в печени является тирозин-аминотрансфераза (ТАТ). Активность данного фермента можно выявлять фотометрическим путем на гомогенатах печени, и этот показатель является достоверной мерой для определения нежелательных метаболических эффектов глюкокортикоидов. Для исследования индукции ТАТ животных через 8 ч после обработки тестируемыми соединениями умерщвляют, удаляют у них печень и на гомогенате определяют активность ТАТ. В ходе опытов было установлено, что соединения общей формулы I при их применении в дозах, в которых они проявляют противовоспалительную эффективность, не индуцируют тирозин-аминотрансферазу вовсе или индуцируют ее лишь в минимальной степени. Благодаря своему противовоспалительному и дополнительно к этому противоаллергическому, иммуносупрессивному и антипролиферативному действию предлагаемые в изобретении соединения общей формулы I могут применяться в качестве медикаментов для лечения или профилактики следующих заболеваний млекопитающих животных и человека. При этом под понятием "ЗАБОЛЕВАНИЕ" имеются в виду следующие показания: 1) заболевания легких, сопровождающиеся воспалительными, аллергическими и/или пролиферативными процессами: хронически обструктивные заболевания легких любого генеза, прежде всего бронхиальная астма,бронхит различного генеза,все формы рестриктивных заболеваний легких, прежде всего аллергический альвеолит,все формы отека легких, прежде всего токсический отек легких,саркоидозы и гранулематозы, прежде всего болезнь Бека; 2) ревматические заболевания/аутоиммунные заболевания/заболевания суставов, сопровождающиеся воспалительными, аллергическими и/или пролиферативными процессами: все формы ревматических заболеваний, прежде всего ревматоидный артрит, острая ревматическая лихорадка, ревматическая полимиалгия,реактивный артрит,воспалительные заболевания мягких тканей иного генеза,артритные симптомы при дегенеративных заболеваниях суставов (артрозы),травматические артриты,коллагенозы любого генеза, например системная красная волчанка, склеродермия, полимиозит,дерматомиозит, синдром Шегрена, синдром Стилла, синдром Фелти; 3) аллергии, сопровождающиеся воспалительными и/или пролиферативными процессами: все формы аллергических реакций, например отек Квинке, сенной насморк, укус насекомого, аллергические реакции на лекарственные средства, препараты крови, контрастные вещества и т.п., анафилактический шок, крапивница, контактный дерматит; 4) воспаления стенки сосуда (васкулиты): надозный панартериит, темпоральный артериит, узловая эритема; 5) дерматологические заболевания, сопровождающиеся воспалительными, аллергическими и/или пролиферативными процессами: атопический дерматит (прежде всего у детей),псориаз,красный волосяной лишай,эритематозные заболевания, обусловленные различными патогенными факторами, например лучевым воздействием, химикалиями, ожогами и т.п.,буллезные дерматозы,заболевания лишайного характера,кожный зуд (например, аллергического генеза),себорейная экзема,розацеа,обыкновенная пузырчатка,многоформная экссудативная эритема,баланит,вульвит,выпадение волос, такое как круговидное облысение,-6 008540 кожная Т-клеточная лимфома; 6) заболевания почек, сопровождающиеся воспалительными, аллергическими и/или пролиферативными процессами: нефротический синдром,все типы нефритов; 7) заболевания печени, сопровождающиеся воспалительными, аллергическими и/или пролиферативными процессами: острый распад печеночных клеток,острый гепатит различного генеза, например вирусный, токсический, индуцированный лекарственными средствами,хронически агрессивный и/или хронически перемежающийся гепатит; 8) заболевания желудочно-кишечного тракта, сопровождающиеся воспалительными, аллергическими и/или пролиферативными процессами: региональный энтерит (болезнь Крона),язвенный колит,гастрит,рефлюкс-эзофагит,гастроэнтериты иного генеза, например эндемический спру; 9) проктологические заболевания, сопровождающиеся воспалительными, аллергическими и/или пролиферативными процессами: экзема заднего прохода,трещины,геморрой,идиопатический практит; 10) заболевания глаз, сопровождающиеся воспалительными, аллергическими и/или пролиферативными процессами: аллергический кератит, увеит, ирит,конъюнктивит,блефарит,неврит зрительного нерва,хориоидит,симпатическая офтальмия; 11) заболевания в области уха, горла, носа, сопровождающиеся воспалительными, аллергическими и/или пролиферативными процессами: аллергический ринит, сенной насморк,наружный отит, например, обусловленный контактной экземой, инфекцией и т.п.,средний отит; 12) неврологические заболевания, сопровождающиеся воспалительными, аллергическими и/или пролиферативными процессами: отек головного мозга, прежде всего отек головного мозга, обусловленный опухолью,множественный склероз,острый энцефаломиелит,менингит,различные формы судорожных припадков, например BNS-судороги; 13) заболевания крови, сопровождающиеся воспалительными, аллергическими и/или пролиферативными процессами: приобретенная гемолитическая анемия,идиопатическая тромбоцитопения; 14) опухолевые заболевания, сопровождающиеся воспалительными, аллергическими и/или пролиферативными процессами: острый лимфолейкоз,злокачественная лимфома,лимфогранулематоз,лимфосаркома,широкое метастазирование, прежде всего при раке молочной железы, бронхов и предстательной железы; 15) эндокринные заболевания, сопровождающиеся воспалительными, аллергическими и/или пролиферативными процессами: эндокринная орбитопатия,тиреотоксический криз,тиреоидит Де Кервена,аутоиммунный тиреоидит Хашимото,-7 008540 базедова болезнь; 16) трансплантация органов и тканей, реакция "трансплантат против хозяина" (17): тяжелые шоковые состояния, например анафилактический шок, системный воспалительный фактор иммунного ответа; 18) заместительная терапия при врожденной первичной недостаточности надпочечников, такой, например, как конгенитальный адреногенитальный синдром,приобретенной первичной недостаточности надпочечников, такой, например, как болезнь Аддисона, аутоиммунный адреналит, постинфекционный, опухоли, метастазы и т.п.,врожденной вторичной недостаточности надпочечников, такой, например, как конгенитальный гипопитуитаризм,приобретенной вторичной недостаточности надпочечников, такой, например, как постинфекционная, опухоли и т.п.; 19) рвота, сопровождающаяся воспалительными, аллергическими и/или пролиферативными процессами, например, в сочетании с антагонистом 5-НТЗ при рвоте, обусловленной цитостатиками; 20) боли воспалительного генеза, например, люмбаго. Кроме того, предлагаемые в изобретении соединения общей формулы I могут применяться также для терапии и профилактики не указанных выше болезней, для борьбы с которыми в настоящее время используют синтетические глюкокортикоиды [ср. Hatz, HJ, Glucocorticoide: Immunologische Grundlagen,Pharmakologie und Therapierichtlinien, изд-во Wissenschafliche Verlagsgesellschaft mbH, Stuttgart, 1998]. Все вышеназванные показания 1)-20) подробно описаны у Hatz, HJ, в Glucocorticoide: Immunologische(1998). Для достижения требуемого терапевтического действия при вышеназванных болезнях назначаемая доза может варьироваться в зависимости, например, от эффективности соединения общей формулы I, от индивидуальных особенностей пациента, методики введения и типа и степени тяжести заболевания, а также от того, предусматривается ли применение в профилактических или терапевтических целях. Изобретение относится далее 1) к применению предлагаемого в изобретении соединения формулы I или смеси таких соединений для получения медикамента, предназначенного для лечения соответствующего заболевания; 2) к способу лечения соответствующего заболевания, заключающемуся в том, что в составе медикамента пациенту, нуждающемуся в подобном медикаменте, вводят такое количество соединения согласно изобретению, которое подавляет болезнь; 3) к фармацевтической композиции для лечения соответствующего заболевания, каковое лечение предусматривает использование одного из предлагаемых в изобретении соединений либо смеси таких соединений и по меньшей мере одного фармацевтического вспомогательного вещества и/или носителя. В принципе, удовлетворительных результатов для животных можно ожидать при введении им суточной дозы, содержащей от 1 до 100000 мкг соединения по изобретению на кг веса тела. Для крупных млекопитающих, в том числе и для человека, рекомендуется суточная доза в пределах от 1 до 100000 мкг/кг веса тела. Предпочтительной является доза в пределах от 10 до 30000 мкг/кг веса тела, более предпочтительна доза от 10 до 10000 мкг/кг веса тела. При необходимости эту дозу целесообразно вводить несколько раз в сутки. Для лечения острого шока (например, анафилактического шока) можно назначать разовые дозы, заметно превышающие указанные выше пределы. Состав для фармацевтических препаратов на основе новых соединений получают по известной технологии путем переработки действующего вещества с традиционно используемыми в галенике носителями, наполнителями, веществами, способствующими распаду, связующими, средствами удержания влаги, смазывающими веществами, абсорбентами, разбавителями, вкусовыми добавками, красителями и т.п. и переводят в требуемую для применения форму. В этой связи можно сослаться на публикациюRemington's Pharmaceutical Science, 15-е изд., изд-во Mack Publishing Company, East Pennsylvania, 1980. Для перорального применения могут назначаться прежде всего таблетки, драже, капсулы, пилюли,порошки, гранулы, пастилки, суспензии, эмульсии или растворы. Для парентерального введения могут назначаться композиции для инъекции и инфузии. Для внутрисуставной инъекции могут применяться соответствующим образом приготовленные кристаллические суспензии. Для внутримышечной инъекции могут применяться водные и масляные растворы или суспензии и соответствующие препараты в депо-форме. Для ректального введения новые соединения могут применяться в форме суппозиториев, капсул,растворов (например, в виде клизм) и мазей, при этом имеется в виду как системная, так и местная терапия. Для пульмонального применения новые соединения могут назначаться в виде аэрозолей и ингаляционных средств. При местном применении на глазах, для слухового прохода, среднего уха, полости носа и околоно-8 008540 совых пазух новые соединения могут использоваться в соответствующих фармацевтических композициях в виде капель, мазей и настоек. Для местного применения могут назначаться композиции в виде гелей, мазей, жирных мазей, кремов, паст, пудры, молочка и настоек. Для достижения удовлетворительного фармакологического эффекта дозировка соединений общей формулы I в этих композициях должна составлять от 0,01 до 20%. Изобретение относится также к применению предлагаемых в нем соединений общей формулы I в качестве терапевтического действующего вещества. Изобретение относится далее к применению предлагаемых в нем соединений общей формулы I в качестве терапевтического действующего вещества вместе с фармацевтически совместимыми и приемлемыми вспомогательными веществами и носителями. Изобретение относится также к фармацевтической композиции, содержащей одно из фармацевтически активных, предлагаемых в нем соединений или их смесь либо фармацевтически приемлемую соль такого соединения и фармацевтически приемлемую соль или фармацевтически приемлемые вспомогательные вещества и носители. Ниже изобретение более подробно поясняется на примерах, которые не ограничивают его объем. Синтез важных предварительных продуктов, не представленных в экспериментальной части описания,относится к уровню техники, и соответствующую информацию об этих продуктах можно получить из заявок WO 98/54159 и WO 02/10143. Экспериментальная часть Пример 1. 1-(Хинолин-8-иламино)-4-(5-фтор-2-метоксифенил)-4-метил-2-(трифторметил)пентан-2 ол.(WO 00/32584) и 99 мг (0,68 ммоль) 8-аминохинолина в течение 20 ч нагревают в 0,2 мл 3,4,5,6 тетрагидро-2-(1 Н)-пиримидона (DMPU) до 130 С. После очистки реакционной смеси на силикагеле с использованием смеси гексан-этилацетат (0-20%) получают 230 мг продукта. 1 Н-ЯМР (CDCl3): = 1,47 (s, 3 Н), 1,65 (s, 3 Н), 2,25 (d, 1H), 2,85 (d, 1H), 3,30 (АВ-система, 2H), 3,85 200 мг (0,46 ммоль) 1-(хинолин-8-иламино)-4-(5-фтор-2-метоксифенил)-4-метил-2-(трифторметил) пентан-2-ола в 20 мл CH2Cl2 смешивают при 0 С с 9 мл 1-молярного раствора трибромида бора в CH2Cl2. После 20-часовой выдержки при комнатной температуре смесь сливают в насыщенный раствор NaHCO3,перемешивают в течение 20 мин и экстрагируют CH2Cl2. Затем объединенные органические экстракты промывают водой, сушат (Na2SO4) и концентрируют под вакуумом. После хроматографии на силикагеле с использованием смеси гексан-этилацетат (0-25%) получают 190 мг продукта. 1 Н-ЯМР (CDCl3):= 1,48 (s, 3 Н), 1,62 (s, 3 Н), 2,20 (d, 1H), 3,18 (d, 1H), 3,35 (s, 2H), 6,45 (d, 1H), 6,52 Аналогично примеру 1 200 мг (0,48 ммоль) 2-[2-(5-фтор-2-метоксифенил)-2-метилпропил]-2(трифторметил)оксирана подвергают взаимодействию с 99 мг (0,68 ммоль) 5-аминохинолина. После хроматографии на силикагеле с использованием смеси гексан-этилацетат (0-70%) получают 58 мг продукта. 1 Аналогично примеру 2 58 мг (0,13 ммоль) 1-(хинолин-5-иламино)-4-(5-фтор-2-метоксифенил)-4 метил-2-(трифторметил)пентан-2-ола в 6 мл CH2Cl2 подвергают взаимодействию с 2,6 мл 1-молярного раствора трибромида бора в CH2Cl2. После хроматографии на силикагеле с использованием смеси гексан-этилацетат (0-70%) получают 22 мг продукта. 1 Н-ЯМР (CDCl3):= 1,48 (s, 3 Н), 1,54 (s, 3 Н), 2,45 (d, 1H), 2,82 (d, 1H), 3,20 (dd, 1H), 3,40 (dd, 1H),5,05 (шир., 1H), 6,25 (d, 1H), 6,70 (m, 1H), 6,85 (dd, 1H), 6,95 (dd, 1H), 7,45 (dd, 1H), 7,53 (d, 1H), 7,58 (d,1H), 8,32 (d, 1H), 8,68 (d, 1H). Пример 5. 1-(Хинолин-4-иламино)-4-(5-фтор-2-метоксифенил)-4-метил-2-(трифторметил)пентан-2 ол. 1-Амино-4-(5-фтор-2-метоксифенил)-4-метил-2-(трифторметил)пропан-2-ол. 1,0 г (3,4 ммоль) 2-[2-(5-фтор-2-метоксифенил)-2-метилпропил]-2-(трифторметил)оксирана в 68 мл ТГФ в течение 6 ч нагревают с обратным холодильником с 1,1 г азида натрия и 180 мг хлорида аммония в 14 мл воды и 26 мл этанола. После этого смесь концентрируют, разбавляют простым эфиром, промывают водой, сушат (Na2SO4) и концентрируют. После хроматографии на силикагеле с использованием смеси гексан-этилацетат (0-15%) получают 950 мг 1-азидо-4-(5-фтор-2-метоксифенил)-4-метил-2-(трифторметил)пропан-2-ола. Последний растворяют в 29 мл ТГФ и при 0 С порциями смешивают с 270 мг алюмогидрида лития. Через 1 ч смесь обрабатывают этилацетатом и водой и фильтруют через целит. Этилацетатную фазу сушат (Na2SO4) и концентрируют под вакуумом. Таким путем получают 920 мг амина. 1 Н-ЯМР (CDCl3):= 1,4 (s, 3 Н), 1,5 (s, 3 Н), 2,15 (d, 1H), 2,45 (d, 1H), 2,55 (d, 1H), 2,75 (d, 1H), 2,80(1,6 ммоль) 4-хлорхинолина и 183 мг (1,6 ммоль) диазабицикло[2,2,2]октана в течение 3 ч нагревают до 150 С. Затем смесь растворяют в CH2Cl2 и воде. После этого водную фазу экстрагируют CH2Cl2, объединенные органические экстракты промывают водой, сушат (Na2SO4) и концентрируют под вакуумом. После хроматографии на силикагеле с использованием смеси СН 2 Сl2-метанол (0-10%) получают 305 мг продукта. 1 Н-ЯМР (D6-ДМСО):= 1,40 (s, 3 Н), 1,57 (s, 3 Н), 2,10 (d, 1H), 2,88 (d, 1H), 3,05 (dd, 1H), 3,15 (dd,1H), 3,80 (s, 3 Н), 5,96 (d, 1H), 6,00 (s, 1H), 6,26 (шир. t, 1 Н), 6,98 (d, 1H), 7,02 (td, 1H), 7,10 (dd, 1H), 7,45 (t,1H), 7,60 (t, 1H), 7,77 (d, 1H), 7,95 (d, 1H), 8,30 (d, 1H). Пример 6. 1-(Хинолин-4-иламино)-4-(5-фтор-2-гидроксифенил)-4-метил-2-(трифторметил)пентан-2 ол. Аналогично примеру 2 200 мг (0,46 ммоль) 1-(хинолин-4-иламино)-4-(5-фтор-2-метоксифенил)-4 метил-2-(трифторметил)пентан-2-ола подвергают взаимодействию с 9 мл 1-молярного раствора трибромида бора в CH2Cl2. После хроматографии на силикагеле с использованием смеси СН 2 Сl2-метанол (015%) получают 138 мг продукта. 1 Н-ЯМР (D6-ДМСО):= 1,40 (s, 3 Н), 1,58 (s, 3 Н), 1,95 (d, 1H), 3,00-3,50 (m, 3 Н), 6,05 (m+d, 2H), 6,65 Аналогично примеру 1 200 мг (0,68 ммоль) 2-[2-(5-фтор-2-метоксифенил)-2-метилпропил]-2(трифторметил)оксирана подвергают взаимодействию с 99 мг (0,68 ммоль) 1-аминоизохинолина. После хроматогрфии на силикагеле с использованием смеси гексан-этилацетат (0-60%) получают 65 мг продукта. 1 Н-ЯМР (CDCl3):= 1,45 (s, 3 Н), 1,72 (s, 3 Н), 2,40 (d, 1H), 3,00 (d, 1H), 3,40 (d, 1H), 3,88 (s, 3H), 4,23 Аналогично примеру 2 65 мг (0,15 ммоль) 4-(5-фтор-2-метилфенил)-1-(изохинолин-1-иламино)-4 метил-2-(трифторметил)пентан-2-ола подвергают взаимодействию с 2,7 мл 1-молярного раствора трибромида бора в CH2Cl2. После хроматографии на силикагеле с использованием смеси гексан-этилацетат-5 С смешивают с 4,1 мл тионилхлорида и через 15 мин с 4 мл метанола. После 15-часовой выдержки при комнатной температуре смесь разбавляют водой и экстрагируют этилацетатом. Органические экстракты промывают водой, сушат (Na2SO4) и концентрируют. Таким путем получают 9,3 г метилового эфира 4-метил-2-оксо-4-фенилпентановой кислоты. Последний в 558 мл ДМФ при -5 С смешивают с 15,5 мл (104,63 ммоль) (трифторметил)триметилсилана и 20,5 г (63,28 ммоль) карбоната цезия и в течение 16 ч перемешивают при комнатной температуре. Далее к смеси добавляют воду, экстрагируют этилацетатом, промывают органическую фазу водой и сушат (Na2SO4). Сконцентрированный промежуточный продукт растворяют в 200 мл ТГФ и добавляют 50 мл 1-молярного раствора фторида тетрабутиламмония в ТГФ. После этого перемешивают в течение 2 ч, добавляют воду, экстрагируют этилацетатом,промывают органическую фазу водой и сушат (Na2SO4). После хроматографии на силикагеле с использованием смеси гексан-этилацетат (0-30%) получают 8,35 г метилового эфира 2-гидрокси-4-метил-4-фенил 2-(трифторметил)пентановой кислоты. Затем этот эфир (8,3 г, 28,59 ммоль) растворяют в 180 мл ТГФ и в течение 2,5 ч малыми порциями добавляют 1,52 г (36,20 ммоль) алюмогидрида лития. После полного превращения по каплям добавляют 5 мл этилацетата, а затем еще через 10 мин осторожно добавляют 10 мл воды. Затем отфильтровывают от образовавшегося осадка и тщательно промывают этилацетатом. После хроматографии на силикагеле с использованием смеси гексан-этилацетат (0-35%) получают 5,40 г 4 метил-4-фенил-2-(трифторметил)пентан-1,2-диола. Далее к диолу (5,40 г, 20,59 ммоль) в 43 мл ТГФ добавляют 5,6 г (21,35 ммоль) трифенилфосфина, а затем при охлаждении льдом - 4,3 мл (27,31 ммоль) диэтилового эфира азодикарбоновой кислоты. Затем реакционную смесь в течение 3 ч нагревают с обратным холодильником и после охлаждения концентрируют. После хроматографии на силикагеле с использованием смеси гексан-этилацетат (0-15%) получают 4,18 г продукта. 1 Н-ЯМР (CDCl3):= 1,37 (s, 3 Н), 1,41 (s, 3 Н), 2,20 (m, 1H), 2,27 (d, 1H), 2,55 (d, 1H), 2,67 (d, 1H),7,18-7,35 (m, 5H). 1-(Хинолин-5-иламино)-4-метил-4-фенил-2-(трифторметил)пентан-2-ол. Аналогично примеру 1 подвергают взаимодействию 300 мг (1,22 ммоль) 2-(2-метил-2 фенилпропил)-2-(трифторметил)оксирана и 882 мг (6,12 ммоль) 5-аминохинолина. После хроматографии на силикагеле с использованием смеси гексан-этилацетат (0-75%) получают 85 мг продукта. 1 Н-ЯМР (CDCl3):= 1,45 (s, 3 Н), 1,60 (s, 3 Н), 2,30 (d, 1H), 2,36 (d, 1H), 3,02 (dd, 1H), 3,05 (s, 1H),3,25 (dd, 1H), 4,24 (dd, 1H), 6,11 (d, 1H), 7,28-7,56 (m, 8H), 8,04 (d, 1H), 8,86 (dd, 1H). Аналогично примеру 1 подвергают взаимодействию 500 мг (2,05 ммоль) 2-(2-метил-2 фенилпропил)-2-(трифторметил)оксирана и 650 мг (4,10 ммоль) 5-амино-2-метилхинолина. После хроматографии на силикагеле с использованием смеси гексан-этилацетат (0-70%) получают 485 мг продукта. 1 Н-ЯМР (CDCl3):= 1,44 (s, 3 Н), 1,59 (s, 3 Н), 2,30 (d, 1H), 2,35 (d, 1H), 2,72 (s, 3H), 3,01 (dd, 1H),3,04 (s, 1H), 3,23 (dd, 1H), 4,18 (dd, 1H), 6,04 (d, 1H), 7,21 (d, 1H), 7,30 (dt, 1H), 7,37-7,51 (m, 6H), 7,92 (d,1H). Пример 11. Амид N-(хинолин-5-ил)-4-(5-фтор-2-метоксифенил)-2-гидрокси-4-метил-2-(трифторметил)пентановой кислоты. 540 мг (2,13 ммоль) 4-(5-фтор-2-метоксифенил)-4-метил-2-оксопентановой кислоты (WO 00/32584) в 15 мл ДМФ при -5 С в атмосфере аргона смешивают с 0,18 мл тионилхлорида. После 20-минутного перемешивания в диапазоне температур от -3 до +3 С добавляют 470 мг (3,26 ммоль) 5-аминохинолина. После этого дают смеси нагреться до комнатной температуры, затем перемешивают еще 16 ч, смешивают с 10%-ной лимонной кислотой, экстрагируют этилацетатом, промывают органическую фазу водой и сушат (Na2SO4). После хроматографии на силикагеле с использованием смеси гексан-этилацетат (0-75%) получают 680 мг амида N-(хинолин-4-ил)-4-(5-фтор-2-метоксифенил)-4-метил-2-оксопентановой кислоты, который растворяют в 22 мл ДМФ и охлаждают до 0 С. После этого раствор смешивают с 1,80 мл(трифторметил)триметилсилана и 2,43 г карбоната цезия и в течение 16 ч перемешивают при комнатной температуре. Затем добавляют воду, экстрагируют этилацетатом, промывают органическую фазу водой и сушат над сульфатом натрия. Сконцентрированный промежуточный продукт растворяют в 10 мл ТГФ и добавляют 5,5 мл 1-молярного раствора фторида тетрабутиламмония. После этого перемешивают в течение 1,5 ч, добавляют воду, экстрагируют этилацетатом, промывают органическую фазу водой и сушат над сульфатом натрия. После хроматографии на силикагеле с использованием смеси гексан-этилацетат Метиловый эфир 1,3-бензодиоксол-4-карбоновой кислоты. 50 г 2,3-дигидроксибензойной кислоты в 450 мл метанола при комнатной температуре по каплям смешивают с 50 мл тионилхлорида. Затем раствор в течение 5 ч нагревают до 60 С и перемешивают еще в течение ночи при комнатной температуре. После этого растворитель полностью удаляют под вакуумом, оставшееся масло растворяют в диэтиловом эфире и экстрагируют насыщенным раствором бикарбоната. После промывки рассолом, сушки сульфатом натрия и удаления под вакуумом растворителя получают 46 г метилового эфира 2,3-дигидроксибензойной кислоты. Последний смешивают с 56,7 г карбоната калия в 575 мл ДМФ и 20,2 мл дибромметана и смесь в течение 5 ч нагревают до 100 С в атмосфере аргона. После этого смесь еще в течение ночи перемешивают при комнатной температуре. Затем смешивают с водой и трижды экстрагируют этилацетатом. Органическую фазу несколько раз промывают водой и сушат над сульфатом натрия. Растворитель удаляют под вакуумом и таким путем получают 50,2 г метилового эфира 1,3-бензодиоксол-4-карбоновой кислоты в виде твердого вещества коричневого цвета.tпл: 55-57C. 4-(1,3-Бензодиоксол-4-ил)-4-метил-2-оксопентановая кислота. 4,76 г метилового эфира 1,3-бензодиоксол-4-карбоновой кислоты в 65 мл сухого ТГФ при комнатной температуре по каплям добавляют к 21 мл 3-молярного раствора метилмагнийхлорида в ТГФ в атмосфере аргона. После этого перемешивают в течение 3 ч и затем медленно смешивают с 1 н. соляной кислотой. После экстракции этилацетатом и промывки органической фазы водой сушат сульфатом натрия и отгоняют растворитель под вакуумом. Таким путем получают 5,0 г 1-(1,3-бензодиоксол-4-ил)-1 метилэтанола в виде масла коричневого цвета. 3,6 г этого масла и 5,4 г этилового эфира 2-(триметилсилилокси)акриловой кислоты в 80 мл дихлорметана при -70 С смешивают с 18 мл тетрахлорида олова.- 12008540 После 15-минутного перемешивания при -70 С раствор сливают на полунасыщенный раствор карбоната натрия, смешивают с этилацетатом и интенсивно перемешивают. Затем фазы разделяют и водную фазу дважды экстрагируют этилацетатом. Органическую фазу промывают рассолом, сушат сульфатом натрия и отгоняют растворитель под вакуумом. Таким путем получают масло желтого цвета, которое смешивают с 60 мл 1 н. раствора едкого натра и 120 мл метанола и в течение 3 ч перемешивают при комнатной температуре. После этого под вакуумом отгоняют метанол и экстрагируют водную фазу диэтиловым эфиром. Затем подкисляют водную фазу, добавляя к ней 120 мл 1 н. соляной кислоты, и трижды экстрагируют диэтиловым эфиром. Эфирную фазу сушат и под вакуумом удаляют растворитель. Таким путем получают 4,2 г 4-(1,3-бензодиоксол-4-ил)-4-метил-2-оксопентановой кислоты в виде масла желтого цвета. МС (EI): М+ = 250 (М=250). 4-(1,3-Бензодиоксол-4-ил)-N-(хинолин-5-ил)-4-метил-2-оксопентанамид. 100 мг 4-(1,3-бензодиоксол-4-ил)-4-метил-2-оксопентановой кислоты в 1 мл диметилацетамида при 0 С смешивают с 0,034 мл тионилхлорида и перемешивают в течение 20 мин. Затем добавляют 61 мг 5 аминохинолина и перемешивают в течение ночи при комнатной температуре. После этого сливают на раствор гидрокарбоната натрия и трижды экстрагируют этилацетатом. Далее промывают рассолом, сушат и удаляют растворитель под вакуумом. Оставшееся масло разделяют толстослойной хроматографией(силикагель, смесь ацетон-гексан, 1:1). Таким путем получают 25 мг 4-(1,3-бензодиоксол-4-ил)-N(хинолин-5-ил)-4-метил-2-оксопентанамида в виде пенистого вещества желтого цвета. МС (EI): М+ = 376,3 (М=376,4). 4-(1,3-Бензодиоксол-4-ил)-N-(хинолин-5-ил)-2-гидрокси-4-метил-2-(трифторметил)пентанамид. 22 мг 4-(1,3-бензодиоксол-4-ил)-N-(хинолин-5-ил)-4-метил-2-оксопентанамида и 0,04 мл трифторметилтриметилсилана в 1 мл ДМФ при 0 С смешивают с 11 мг карбоната цезия. Через 2 ч на кончике шпателя добавляют хлорид тетрабутиламмония и еще через 20 мин реакционный раствор сливают на воду. Далее трижды экстрагируют этилацетатом, промывают водой и рассолом, сушат и удаляют растворитель под вакуумом. Оставшееся масло разделяют путем хроматографии на силикагеле. Таким путем получают 11 мг 4-(1,3-бензодиоксол-4-ил)-N-(хинолин-5-ил)-2-гидрокси-4-метил-2-(трифторметил)пентанамида в виде твердого вещества. tпл: 164-167C. Пример 13. N-(Хинолин-5-ил)-4-(2-хлорфенил)-2-гидрокси-4-метил-2-(трифторметил)пентанамид.N-(Хинолин-5-ил)-4-(2-хлорфенил)-4-метил-2-оксопентанамид. Из 200 мг 4-(2-хлорфенил)-4-метил-2-оксопентановой кислоты (WO 00/32584) согласно принятой методике для 4-(1,3-бензодиоксол-4-ил)-N-(хинолин-5-ил)-4-метил-2-оксопентанамида после хроматографии на силикагеле получают 152 мг N-(хинолин-5-ил)-4-(2-хлорфенил)-4-метил-2-оксопентанамида. МС (EI): М+ = 366, 368 (3:1): (М=366,8).N-(Хинолин-5-ил)-4-(2-хлорфенил)-2-гидрокси-4-метил-2-(трифторметил)пентанамид. Из 142 мг N-(хинолин-5-ил)-4-(2-хлорфенил)-4-метил-2-оксопентанамида согласно принятой методике для 4-(1,3-бензодиоксол-4-ил)-N-(хинолин-5-ил)-2-гидрокси-4-метил-2-(трифторметил)пентанамида(пример 12) после хроматографии на силикагеле получают 82 мг N-(хинолин-5-ил)-4-(2-хлорфенил)-2 гидрокси-4-метил-2-(трифторметил)пентанамида. tпл: 210-214 С. Пример 14. N-(Хинолин-5-ил)-4-(2-хлор-5-фторфенил)-2-гидрокси-4-метил-2-(трифторметил)пентанамид.N-(Хинолин-5-ил)-4-(2-хлор-5-фторфенил)-4-метил-2-оксопентанамид. Из 520 мг 4-(2-хлор-5-фторфенил)-4-метил-2-оксопентановой кислоты (WO 02/10143) согласно принятой методике для 4-(1,3-бензодиоксол-4-ил)-N-(хинолин-5-ил)-4-метил-2-оксопентамида (пример 12) после хроматографии на силикагеле получают 400 мг N-(хинолин-5-ил)-4-(2-хлор-5-фторфенил)-4 метил-2-оксопентанамида. tпл:145-146C.N-(Хинолин-5-ил)-4-(2-хлор-5-фторфенил)-2-гидрокси-4-метил-2-(трифторметил)пентанамид. Из 384 мг N-(хинолин-5-ил)-4-(2-хлор-5-фторфенил)-4-метил-2-оксопентанамида согласно принятой методике для 4-(1,3-бензодиоксол-4-ил)-N-(хинолин-5-ил)-2-гидрокси-4-метил-2-(трифторметил) пентанамида (пример 12) получают после хроматографии на силикагеле 60 мг N-(хинолин-5-ил)-4-(2 хлор-5-фторфенил)-2-гидрокси-4-метил-2-(трифторметил)пентанамида. tпл: 188-189 С. Пример 15. N-(Хинолин-5-ил)-3-[1-(2-хлор-4-фторфенил)циклопропил]-2-гидрокси-2-(трифторметил)пропанамид.N-(Хинолин-5-ил)-3-[1-(2-хлор-4-фторфенил)циклопропил]-2-оксопропанамид. Из 512 мг 3-[1-(2-хлор-4-фторфенил)циклопропил]-2-оксопропионовой кислоты (WO 02/10143) согласно принятой методике для 4-(1,3-бензодиоксол-4-ил)-N-(хинолин-5-ил)-2-гидрокси-4-метил-2(трифторметил)пентанамида (пример 12) получают после хроматографии на силикагеле 535 мг N(хинолин-5-ил)-3-[1-(2-хлор-4-фторфенил)циклопропил]-2-оксопропанамида в виде пенистого вещества.N-(Хинолин-5-ил)-3-[1-(2-хлор-4-фторфенил)циклопропил]-2-гидрокси-2-(трифторметил)пропанамид. Из 535 мг N-(хинолин-5-ил)-3-[1-(2-хлор-4-фторфенил)циклопропил]-2-оксопропанамида согласно принятой методике для 4-(1,3-бензодиоксол-4-ил)-N-(хинолин-5-ил)-2-гидрокси-4-метил-2-(трифторметил)пентанамида (пример 12) после хроматографии на силикагеле получают 200 мг N-(хинолин-5-ил)3-[1-(2-хлор-4-фторфенил)циклопропил]-2-гидрокси-2-(трифторметил)пентанамида. tпл: 220-221 С. Пример 16. 4-(4-Бром-2-метоксифенил)-1-(хинолин-5-иламино)-2-гидрокси-4-метил-2-(трифторметил)пентан-2-ол. Аналогично примеру 1 подвергают взаимодействию 200 мг 2-[2-(4-бром-2-метоксифенил)-2 метилпропил]-2-(трифторметил)оксирана (WO 00/32585) и 5-аминохинолин. После хроматографии на силикагеле с использованием смеси гексан-этилацетат (1:1) получают 43 мг 4-(4-бром-2-метоксифенил)1-(хинолин-5-иламино)-2-гидрокси-4-метил-2-(трифторметил)пентан-2-ола. tпл: 181 С. Пример 17. 4-(5-Бром-2-метоксифенил)-N-(хинолин-5-ил)-2-гидрокси-4-метил-2-(трифторметил) пентанамид. 1-(5-Бром-2-метоксифенил)-1-метилэтанол. 62 мл 3-молярного раствора метилмагнийбромида в тетрагидрофуране в течение одного часа при 0 С по каплям добавляют к 18,6 г метилового эфира 5-бром-2-метоксибензойной кислоты и 180 мл диэтилового эфира. Через 16 ч при комнатной температуре и при охлаждении льдом смешивают с насыщенным раствором хлорида аммония и этилацетатом. Этилацетатную фазу промывают водой, сушат(Na2SO4) и упаривают. После дистилляции с использованием трубки с шаровым расширением (tкип: 140C/0,04 гПа) получают 16,7 г кристаллического 1-(5-бром-2-метоксифенил)-1-метилэтанола. tпл: 6668C. Этиловый эфир 4-(5-бром-2-метоксифенил)-4-метил-2-оксопентановой кислоты. 9,8 г 1-(5-бром-2-метоксифенил)-1-метилэтанола и 15,24 г этилового эфира 2-(триметилсилилокси)акриловой кислоты в 150 мл дихлорметана при -70 С смешивают с 5,6 мл тетрахлорида олова. Через 20 мин при -70 С раствор сливают на полунасыщенный раствор карбоната калия и смешивают с дихлорметаном. Дихлорметановую фазу промывают раствором карбоната калия, 1-молярной соляной кислотой и водой, сушат (Na2SO4) и концентрируют. После дистилляции с использованием трубки с шаровым расширением получают 5,2 г этилового эфира 4-(5-бром-2-метоксифенил)-4-метил-2-оксопентановой кислоты. tкип: 160C/0,04 гПа. 4-(5-Бром-2-метоксифенил)-4-метил-2-оксопентановая кислота. Этиловый эфир 4-(5-бром-2-метоксифенил)-4-метил-2-оксопентановой кислоты в 30 мл метанола и 12 мл 1-молярного раствора едкого натра перемешивают в течение 1 ч при комнатной температуре и отгоняют метанол. После этого смешивают с водой и гексаном, водную фазу при охлаждении льдом подкисляют разбавленной соляной кислотой и смешивают с этилацетатом. Этилацетатную фазу промывают водой, сушат (Na2SO4) и концентрируют. После кристаллизации из гексана получают 1,8 г 4-(5-бром-2 метоксифенил)-4-метил-2-оксопентановой кислоты. tпл: 80 С. 4-(5-Бром-2-метоксифенил)-N-(хинолин-5-ил)-4-метил-2-оксопентанамид. Из 630 мг 4-(5-бром-2-метоксифенил)-4-метил-2-оксопентановой кислоты согласно принятой методике для 4-(1,3-бензодиоксол-4-ил)-N-(хинолин-5-ил)-4-метил-2-оксопентанамида (пример 12) после хроматографии на силикагеле получают 730 мг 4-(5-бром-2-метоксифенил)-N-(хинолин-5-ил)-4-метил-2 оксопентанамида. tпл: 133-135C. 4-(5-Бром-2-метоксифенил)-N-(хинолин-5-ил)-2-гидрокси-4-метил-2-(трифторметил)пентанамид. Из 617 мг 4-(5-бром-2-метоксифенил)-N-(хинолин-5-ил)-4-метил-2-оксопентанамида согласно при- 14008540 нятой методике для 4-(1,3-бензодиоксол-4-ил)-N-(хинолин-5-ил)-2-гидрокси-4-метил-2-(трифторметил) пентанамида (пример 12) после хроматографии на силикагеле получают 484 мг 4-(5-бром-2-метоксифенил)-N-(хинолин-5-ил)-2-гидрокси-4-метил-2-(трифторметил)пентанамида. tпл: 243-245 С. Пример 18. 4-(4-Бром-2-метоксифенил)-N-(хинолин-5-ил)-2-гидрокси-4-метил-2-(трифторметил) пентанамид. 4-(4-Бром-2-метоксифенил)-N-(хинолин-5-ил)-4-метил-2-оксопентанамид. Из 630 мг 4-(4-бром-2-метоксифенил)-4-метил-2-оксопентановой кислоты (WO 98/54159) согласно принятой методике для 4-(1,3-бензодиоксол-4-ил)-N-(хинолин-5-ил)-4-метил-2-оксопентанамида (пример 12) после хроматографии на силикагеле получают 363 мг 4-(4-бром-2-метоксифенил)-N-(хинолин-5-ил)4-метил-2-оксопентанамида. tпл: 114-115 С. 4-(4-Бром-2-метоксифенил)-N-(хинолин-5-ил)-2-гидрокси-4-метил-2-(трифторметил)пентанамид. Из 528 мг 4-(4-бром-2-метоксифенил)-N-(хинолин-5-ил)-4-метил-2-оксопентанамида согласно принятой методике для 4-(1,3-бензодиоксол-4-ил)-N-(хинолин-5-ил)-2-гидрокси-4-метил-2-(трифторметил) пентанамида (пример 12) после хроматографии на силикагеле получают 280 мг 4-(4-бром-2 метоксофенил)-N-(хинолин-5-ил)-2-гидрокси-4-метил-2-(трифторметил)пентанамида. tпл: 208-209 С. Пример 19. N-(Хинолин-5-ил)-2-гидрокси-4-метил-4-фенил-2-(трифторметил)пентанамид.N-(Хинолин-5-ил)-4-метил-2-оксо-4-фенилпентанамид. Из 515 мг 4-метил-2-оксо-4-фенилпентановой кислоты (WO 98/54159) согласно принятой методике для 4-(1,3-бензодиоксол-4-ил)-N-(хинолин-5-ил)-4-метил-2-оксопентанамида (пример 12) после хроматографии на силикагеле получают 370 мг N-(хинолин-5-ил)-4-метил-2-оксо-4-фенилпентанамида. tпл: 9899 С.N-(Хинолин-5-ил)-2-гидрокси-4-метил-4-фенил-2-(трифторметил)пентанамид. Из 200 мг N-(хинолин-5-ил)-4-метил-2-оксо-4-фенилпентанамида согласно принятой методике для 4-(1,3-бензодиоксол-4-ил)-N-(хинолин-5-ил)-2-гидрокси-4-метил-2-(трифторметил)пентанамида (пример 12) после хроматографии на силикагеле получают 85 мг N-(хинолин-5-ил)-2-гидрокси-4-метил-4-фенил 2-(трифторметил)пентанамида. tпл: 181-182C. Пример 20. 4-(5-Фтор-2-метоксифенил)-1-(2-метоксихинолин-5-иламино)-4-метил-2-(трифторметил)пентан-2-ол. 1-Оксид 5-нитрохинолина. Раствор 25,5 г (146 ммоль) 5-нитрохинолина в 544 мл уксусной кислоты и 272 мл 30%-ного водного раствора Н 2 О 2 в течение 100 мин нагревают до 62-69 С. Затем реакционную смесь сливают на насыщенный раствор NaCl и экстрагируют этилацетатом. Объединенные экстракты путем добавления толуола концентрируют до объема примерно 50 мл. После колоночной хроматографии на силикагеле с использованием смеси этилацетат-МеОН получают 12,3 г продукта в виде твердого вещества желтого цвета. 1H-ЯМР (CDCl3):= 7,5 (dd, 1 Н), 7,85 (t, 1H), 8,45 (d, 1H), 8,5 (d, 1H), 8,6 (d, 1H),9,15(d, 1H). 2-Метокси-5-нитрохинолин. Суспензию из 1 г (5 ммоль) 1-оксида 5-нитрохинолина, 1,23 г (6,4 ммоль) хлорангидрида толуолсульфокислоты и 1,4 мл (9,9 ммоль) триэтиламина в 30 мл МеОН перемешивают в течение 20 ч при комнатной температуре. Твердое вещество отфильтровывают с помощью вакуум-фильтра и промывают МеОН. Таким путем получают 565 мг продукта светло-желтого цвета. 1 Н-ЯМР (CDCl3):= 4,1 (s, 3 Н), 7,15 (d, 1 Н), 7,7 (t, 1H), 8,15 (d, 2H), 8,8 (d, 1H). 5-Амино-2-метоксихинолин. 550 мг (2,7 ммоль) 2-метокси-5-нитрохинолина перемешивают в 15 мл этилацетата в присутствии 138 мг 10%-ного палладия на активированном угле в течение 5 ч в атмосфере водорода. После этого смесь фильтруют и фильтрат концентрируют. Таким путем получают 520 мг масла светло-желтого цвета. 1- 15008540 комплекса пиридин-триоксид серы. Через 3 ч при 12-18 С и охлаждении льдом смесь гидролизуют насыщенным раствором NH4Cl и экстрагируют этилацетатом. Объединенные экстракты сушат (Na2SO4) и концентрируют. Таким путем получают 1,57 г продукта в виде масла светло-желтого цвета. 1(dd, 1H), 6,85-7,0 (m, 2H), 9,05 (s, 1H). 4-(5-Фтор-2-метоксифенил)-1-(2-метоксихинолин-5-иламино)-4-метил-2-(трифторметил)пентан-2 ол. 300 мг (0,97 ммоль) 4-(5-фтор-2-метоксифенил)-2-гидрокси-4-метил-2-(трифторметил)пентаналя и 202 мг (1,16 ммоль) 5-амино-2-метоксихинолина в 10 мл уксусной кислоты в течение 5 ч нагревают с обратным холодильником. Затем смесь выдерживают для охлаждения до комнатной температуры, добавляют к ней 640 мг (3 ммоль) триацетоксиборогидрида натрия и перемешивают при комнатной температуре в течение 15 ч. После добавления толуола смесь концентрируют, остаток растворяют в этилацетате, промывают насыщенным раствором NаНСО 3, сушат и концентрируют. После колоночной хроматографии на силикагеле с использованием смеси гексан-этилацетат получают 146 мг продукта в виде бесцветного масла. 1 100 мг (0,21 ммоль) 4-(5-фтор-2-метоксифенил)-1-(2-метоксихинолин-5-иламино)-4-метил-2-(трифторметил)пентан-2-ола в 9 мл CH2Cl2 при комнатной температуре смешивают с 4 мл 1-молярного раствора трибромида бора в CH2Cl2. Затем через 15 ч смесь при комнатной температуре сливают в насыщенный раствор NaHCO3, 10 мин перемешивают и экстрагируют этилацетатом. Объединенные органические экстракты сушат (Na2SO4) и концентрируют под вакуумом. После хроматографии на силикагеле с использованием смеси гексан-этилацетат получают 73 мг продукта. 1 Н-ЯМР (CDCl3):= 1,5 (s, 3 Н), 1,6 (s, 3 Н), 2,35 (d, 1H), 2,8 (d, 1H), 3,2 (d, 1H), 3,3 (шир., 1H), 3,4 (d,1H), 4,05 (s, 3H), 6,0 (m, 1H), 6,7 (dd, 1H), 6,8 (td, 1H), 6,85 (d, 1H), 7,1 (dd, 1H), 7,35 (m, 2H), 7,95 (d, 1H). 2-Этокси-5-нитрохинолин. Суспензию из 1 г (5 ммоль) 1-оксида 5-нитрохинолина, 1,23 г (6,4 ммоль) хлорангидрида толуолсульфокислоты и 1,4 мл (9,9 ммоль) триэтиламина в 30 мл ЕtOН перемешивают в течение 60 ч при комнатной температуре. Твердое вещество отфильтровывают с помощью вакуум-фильтра и промываютEtOH. Таким путем получают 870 мг продукта. 1 Н-ЯМР (CDCl3):= 1,45 (t, 3 Н), 4,55 (q, 2 Н), 7,1 (d, 1H), 7,65 (t, 1H), 8,1 (d, 2H), 8,8 (d, 1H). 5-Амино-2-этоксихинолин. 860 мг (3,9 ммоль) 2-этокси-5-нитрохинолина перемешивают в 25 мл этилацетата в присутствии 235 мг 10%-ного палладия на активированном угле в течение 4,5 ч в атмосфере водорода. Затем смесь фильтруют и фильтрат концентрируют. Таким путем получают 720 мг масла светло-желтого цвета. 1H-ЯМР (CDCl3):= 1,45 (t, 3 Н), 4,5 (q, 2H), 6,65 (d, 1H), 6,85 (d, 1H), 7,3 (d, 1H), 7,4 (t, 1H), 8,0 (d,1H). 1-(2-Этоксихинолин-5-иламино)-4-(5-фтор-2-метоксифенил)-4-метил-2-(трифторметил)пентан-2-ол. Аналогично примеру 20 подвергают взаимодействию 500 мг (1,6 ммоль) 4-(5-фтор-2-метоксифенил)-2-гидрокси-4-метил-2-(трифторметил)пентаналя и 363 мг (1,9 ммоль) 5-амино-2-этоксихинолина и таким путем получают 338 мг продукта. 1 Н-ЯМР (CDCl3):= 1,4 (t, 3 Н), 1,45 (s, 3 Н), 1,65 (s, 3 Н), 2,3 (d, 1H), 2,8 (d, 1H), 3,1 (d, 1H), 3,2 (s,1H), 3,3 (d, 1H), 3,85 (s, 3H), 4,55 (q, 2H), 5,95 (m, 1H), 6,8 (m, 2H), 6,95 (td, 1H), 7,1 (dd, 1H), 7,35 (m, 2H),7,85 (d, 1H). 5-Амино-2-хинолон. 1,45 г (8,3 ммоль) 5-амино-2-метоксихинолина нагревают с обратным холодильником в 29 мл 6 н. НСl в течение 4,5 ч. Затем выдерживают для охлаждения до комнатной температуры, разбавляют водой,подщелачивают NаНСО 3, экстрагируют этилацетатом, сушат объединенные органические экстракты(Na2SO4) и концентрируют. После очистки остатка хроматографией на силикагеле с использованием смеси гексан-этилацетат получают 670 мг твердого вещества желтого цвета. 1 Н-ЯМР ([D]6-ДМСО):= 5,85 (s, 2H), 6,25 (d, 1H), 6,35 (d, 1H), 6,45 (d, 1 Н), 7,1 (t, 1H), 8,1 (d, 1H),11,4 (шир.s, 1H). 4-(5-Фтор-2-метоксифенил)-1-(2-гидроксихинолин-5-иламино)-4-метил-2-(трифторметил)пентан-2 ол и 4-(5-фтор-2-метоксифенил)-1-(2-хинолон-5-иламино)-4-метил-2-(трифторметил)пентан-2-ол. Аналогично примеру 20 подвергают взаимодействию 226 мг (0,73 ммоль) 4-(5-фтор-2 метоксифенил)-2-гидрокси-4-метил-2-(фторметил)пентаналя и 140 мг (0,87 ммоль) 5-амино-2-хинолина и таким путем получают 200 мг продукта. 1 2-Хлор-5-нитрохинолин. К 84 мл 100%-ной азотной кислоты по каплям осторожно добавляют 69 мл 96%-ной серной кислоты. Затем при охлаждении льдом добавляют 25 г (152 ммоль) 2-хлорхинолина и в течение 1 ч нагревают смесь до 60 С. После охлаждения до комнатной температуры смесь осторожно вносят в смесь воды со льдом. После 15-минутного перемешивания твердое вещество промывают водой и сушат под вакуумом при 40 С. После колоночной хроматографии на силикагеле с использованием смеси гексан-этилацетат получают 10,7 г твердого вещества белого цвета. 1 Н-ЯМР (CDCl3):= 7,65 (d, 1H), 7,85 (t, 1H), 8,35 (d, 1H), 8,4 (d, 1H), 9,0 (d, 1H). 2-Амино-5-нитрохинолин. 450 мг (2,2 ммоль) 2-хлор-5-нитрохинолина, 10 мл 25%-ной аммиачной воды и 10 мл ТГФ в течение 8 ч перемешивают в сосуде, работающем под давлением, при 120 С. Затем смесь разбавляют растворомNaCl и экстрагируют этилацетатом. Объединенные органические фазы сушат (Na2SO4) и концентрируют. Таким путем получают 370 мг продукта. 1H-ЯМР ([D]6-ДМСО):= 6,9 (шир.s, 2H), 7,0 (d, 1H), 7,65 (t, 1H), 7,8 (d, 1H), 7,9 (d, 1H), 8,35 (d,1H). 2-Ацетиламино-5-нитрохинолин. 360 мг (1,9 моль) 2-амино-5-нитрохинолина в течение 15 ч перемешивают с 4 мл (50 ммоль) пиридина и 2 мл (21 ммоль) ацетангидрида при комнатной температуре. После этого смесь сливают в насыщенный раствор NaHCO3, перемешивают в течение 30 мин, разбавляют насыщенным раствором NaCl и экстрагируют этилацетатом. Экстракты сушат (Na2SO4) и концентрируют. Таким путем получают 410 мг продукта желтого цвета. 1(d, 1H). 2-Ацетиламино-5-аминохинолин. 400 мг (1,7 ммоль) 2-ацетиламино-5-нитрохинолина и 105 мг 10%-ного палладия на активированном угле перемешивают в 20 мл смеси этилацетат-МеОН (3:1) в течение 4 ч в атмосфере водорода при комнатной температуре. Затем смесь фильтруют, концентрируют и очищают посредством колоночной хроматографии на силикагеле с использованием смеси гексан-этилацетат. Таким путем получают 210 мг продукта. 1H-ЯМР ([D]6-ДМСО):= 2,15 (s, 3H), 5,9 (s, 2H), 6,6 (d, 1H), 6,95 (d, 1H), 7,35 (t, 1 Н), 8,1 (d, 1 Н),8,5 (d, 1H). 1-(2-Ацетиламинохинолин-5-иламино)-4-(5-фтор-2-метоксифенил)-4-метил-2-(трифторметил)пентан-2-ол. Аналогично примеру 20 263 мг (0,86 ммоль) 4-(5-фтор-2-метоксифенил)-2-гидрокси-4-метил-2(трифторметил)пентаналя подвергают взаимодействию с 205 мг (1,0 ммоль) 2-ацетиламино-5 аминохинолина и таким путем получают 197 мг продукта. 1 Раствор 535 мг (1,05 ммоль) 1-(2-ацетиламинохинолин-5-иламино)-4-(5-фтор-2-метоксифенил)-4 метил-2-(трифторметил)пентан-2-ола в 18 мл смеси EtOH-ТГФ (2:1) в течение 90 мин нагревают с обратным холодильником с 12 мл 3 н. раствора едкого натра. После этого смесь разбавляют насыщенным NaCl и экстрагируют этилацетатом. Экстракты сушат (Na2SO4) и концентрируют под вакуумом. После колоночной хроматографии на силикагеле с помощью этилацетата получают 380 мг продукта в виде масла желтого цвета. 1 Н-ЯМР ([D]6-ДМСО):= 1,35 (s, 3 Н), 1,55 (s, 3 Н), 2,05 (d, 1 Н), 2,7-3,0 (m, 3 Н), 3,8 (s, 3 Н), 5,05 (m,1H), 5,55 (d, 1H), 6,05 (шир., 1H), 6,25 (s, 2H), 6,6 (d, 1 Н), 6,75 (d, 1H), 6,9-7,2 (m, 3 Н), 7,85 (d, 1H). МС (ES): m/е = 452. Пример 29. 1-(2-Аминохинолин-5-иламино)-4-(5-фтор-2-гидроксифенил)-4-метил-2-(трифторметил) пентан-2-ол. 2-Метиламино-5-нитрохинолин. 1,0 г (4,8 ммоль) 2-хлор-5-нитрохинолина и 20 мл 2-молярного раствора метиламина в метаноле в течение 8 ч нагревают в сосуде, работающем под давлением, до 120 С. После добавления толуола смесь концентрируют. Остаток очищают посредством колоночной хроматографии на силикагеле с использованием смеси гексан-этилацетат. Таким путем получают 580 мг продукта. 1 Н-ЯМР (CDCl3):= 3,1 (d, 3 Н), 4,95 (шир., 1H), 6,8 (d, 1H), 7,55 (t, 1H), 7,95 (2d, 2 Н), 8,6 (d, 1H). 2-Ацетил(метил)амино-5-нитрохинолин. 580 мг (2,4 ммоль) 2-метиламино-5-нитрохинолина перемешивают с 4 мл (50 ммоль) пиридина и 2 мл(21 ммоль) ацетангидрида в течение 15 ч при комнатной температуре и в течение 4,5 ч при 60 С. После этого смесь разбавляют этилацетатом, сливают в насыщенный раствор NaHCO3, перемешивают в течение 30 мин и экстрагируют этилацетатом. Экстракты сушат (Na2SO4) и концентрируют. Остаток очищают хроматографией на силикагеле с использованием смеси гексан-этилацетат. Таким путем получают 660 мг твердого вещества желтого цвета. 1 Н-ЯМР (CDCl3):= 2,35 (s, 3 Н), 3,6 (s, 3 Н), 7,75 (t, 1H), 7,9 (d, 1H), 8,25 (d, 1H), 8,3 (d, 1H), 9,0 (d, 1H). 2-Ацетил(метил)амино-5-аминохинолин. 650 мг (2,7 ммоль) 2-ацетил(метил)амино-5-нитрохинолина и 161 мг 10%-ного палладия на активированном угле в течение 2 ч перемешивают в 25 мл этилацетата при комнатной температуре в атмосфере водорода. Затем смесь фильтруют и концентрируют. Таким путем получают 490 мг продукта. 1H-ЯМР (CDCl3):= 2,2 (s, 3 Н), 3,5 (s, 3 Н), 4,2 (шир., 2 Н), 6,8 (d, 1H), 7,4 (d, 1H), 7,45 (d, 1H), 7,5 (t,1H), 8,2 (d, 1H). 1-(2-(Ацетил(метил)амино)хинолин-5-иламино)-4-(5-фтор-2-метоксифенил)-4-метил-2-(трифторметил)пентан-2-ол. Аналогично примеру 20 подвергают взаимодействию 576 мг (1,9 ммоль) 4-(5-фтор-2-метоксифенил)-2-гидрокси-4-метил-2-(трифторметил)пентаналя и 480 мг (2,2 ммоль) 2-ацетил(метил)амино-5 аминохинолина и таким путем получают 330 мг продукта. 1 Н-ЯМР (CDCl3):= 1,45 (s, 3 Н), 1,55 (s, 3 Н), 2,2 (s, 3 Н), 2,4 (d, 1H), 2,75 (d, 1H), 3,15 (dd, 1H), 3,2 200 мг (0,39 ммоль) 1-(2-(ацетил(метил)амино)хинолин-5-иламино)-4-(5-фтор-2-метоксифенил)-4 метил-2-(трифторметил)пентан-2-ола в 17 мл CH2Cl2 смешивают при 0 С с 7,6 мл 1-молярного раствора трибромида бора в CH2Cl2. Через 15 ч при комнатной температуре добавляют еще 7,6 мл 1-молярного раствора трибромида бора в CH2Cl2 и в течение 20 ч перемешивают при комнатной температуре. Далее смесь сливают в насыщенный раствор NаНСО 3, разбавляют насыщенным раствором NaCl и этилацетатом, перемешивают 15 мин и экстрагируют этилацетатом. Объединенные органические экстракты сушат(Na2SO4) и концентрируют. После хроматографии на силикагеле с использованием смеси гексанэтилацетат получают 98 мг продукта. 1 Н-ЯМР (CDCl3):= 1,4 (t, 3 Н), 1,55 (s, 3 Н), 2,3 (d, 1H), 2,45 (s, 3H), 2,6 (d, 1H), 2,95 (t, 1H), 3,25 (dd,1H), 3,65 (s, 3H), 3,95 (s, 1H), 4,1 (m, 1H), 5,7 (шир.s, 1H), 6,45 (dd, 1H), 6,6 (td, 1H), 6,9 (dd, 1H), 7,6 (d,1H), 7,95 (d, 1H), 8,05 (s, 1H). 45 мг (0,07 ммоль) 1-(6,8-дибром-2-(метиламино)хинолин-5-иламино)-4-(5-фтор-2-гидроксифенил)4-метил-2-(трифторметил)пентан-2-ола и 50 мг 10%-ного палладия на активированном угле в течение 90 мин перемешивают в 2 мл в атмосфере водорода. Затем смесь фильтруют и концентрируют. После колоночной хроматографии на силикагеле с использованием смеси этилацетат-МеОН получают 19 мг продукта. 1 Н-ЯМР ([D]6-ДМСО):= 1,4 (s, 3H), 1,55 (s, 3H), 1,9 (d, 1H), 2,8 (d, 3H и m, 1 Н), 3,05 (d, 1 Н), 3,15 300 мг (0,97 ммоль) 4-(5-фтор-2-метоксифенил)-2-гидрокси-4-метил-2-(трифторметил)пентаналя и 184 мг (1,16 ммоль) 5-амино-2-метилхинолина нагревают в 10 мл уксусной кислоты в течение 6 ч до 125 С. Затем после охлаждения до комнатной температуры смешивают с 320 мг (1,51 ммоль) триацетоксиборогидрида натрия и оставляют для перемешивания в течение последующих 16 ч. После добавления еще 320 мг (1,51 ммоль) триацетоксиборогидрида натрия и 2-часового перемешивания добавляют толуол и концентрируют под вакуумом. Остаток растворяют в этилацетате, органическую фазу промывают насыщенным раствором гидрокарбоната натрия и насыщенным раствором хлорида натрия и сушат над сульфатом натрия. После хроматографии на силикагеле с использованием смеси гексан-этилацетат (060%) получают 221 мг продукта. 1 Н-ЯМР (CDCl3):= 1,46 (s, 3 Н), 1,57 (s, 3 Н), 2,33 (d, 1H), 2,72 (s, 3H), 2,78 (d, 1H), 3,12 (dd, 1H),3,30 (dd, 1H), 3,84 (s, 3H), 4,23 (шир., 1H), 6,01 (d, 1H), 6,80 (dd, 1H), 6,94 (ddd, 1H), 7,12 (dd, 1H), 7,21 (d,1H), 7,41 (t, 1H), 7,46 (d, 1H), 7,88 (d, 1H). Пример 36. 4-(5-Фтор-2-гидроксифенил)-4-метил-1-(2-метилхинолин-5-иламино)-2-(трифторметил)пентан-2-ол. Аналогично примеру 35 153 мг (0,34 ммоль) 4-(5-фтор-2-метоксифенил)-4-метил-1-(2-метилхинолин-5-иламино)-2-(трифторметил)пентан-2-ола в 17 мл CH2Cl2 подвергают взаимодействию с 6,8 мл 1-молярного раствора трибромида бора в CH2Cl2. После хроматографии на силикагеле с использованием смеси гексан-этилацетат (0-55%) получают 99 мг продукта. 1 Амид 5-аминохинолин-2-карбоновой кислоты. 840 мг (4,16 ммоль) метилового эфира 5-аминохинолин-2-карбоновой кислоты растворяют в 70 мл 7 н. раствора аммиака в метаноле. Далее смесь перемешивают в течение 3,5 ч при 40 С, а затем в течение 20 ч при комнатной температуре. После удаления растворителя под вакуумом проводят очистку на силикагеле с использованием смеси гексан-этилацетат (0-100%), а также смеси этилацетат-метанол (0-10%). Таким путем получают 690 мг (88% от теории) продукта. 1 Н-ЯМР (ДМСO-d6):= 6,11 (s, 2 Н), 6,78 (d, 1 Н), 7,27 (d, 1H), 7,51 (t, 1H), 7,70 (s, 1H), 7,96 (d, 1H),8,20 (s, 1H), 8,68 (d, 1H). Амид 5-[4-(5-фтор-2-метоксифенил)-2-гидрокси-4-метил-2-трифторметилпентилиденамино]хинолин-2-карбоновой кислоты. Раствор 290 мг (1,55 ммоль) амида 5-аминохинолин-2-карбоновой кислоты, 616 мг (2,0 ммоль) 4-(5 фтор-2-метоксифенил)-2-гидрокси-4-метил-2-трифторметилпентаналя, 3,80 мл концентрированной уксусной кислоты в 30 мл толуола в течение 20 ч кипятят с обратным холодильником с использованием водоотделителя. Затем растворитель удаляют под вакуумом. После очистки остатка на силикагеле с использованием смеси гексан-этилацетат (0-70%) получают 438 мг (59% от теории) продукта. 1 Н-ЯМР (300 МГц, ДMCO-d6):= 1,33 (s, 3 Н), 1,53 (s, 3 Н), 2,20 (d, 1H), 3,33 (d, 1H), 3,77 (s, 3 Н),- 21008540 6,31 (s, 1H), 6,48-6,55 (m, 1H), 6,70-6,75 (m, 3H), 7,59 (s, 1H), 7,70 (t, 1H), 7,82 (шир., 1H), 7,98 (d, 1H), 8,31(50%) и смешивают с 101 мг (2,65 ммоль) борогидрида натрия. Через 20 ч растворитель удаляют под вакуумом. В результате последующей перекристаллизации остатка и очистки сконцентрированного маточного раствора на силикагеле с использованием смеси гексан-этилацетат (0-50%) получают 116 мг (46% от теории) продукта. 1 220 мг (0,46 ммоль) амида 5-[4-(5-фтор-2-метоксифенил)-2-гидрокси-4-метил-2-трифторметилпентиламино]хинолин-2-карбоновой кислоты растворяют в 5,0 мл дихлорметана и смешивают с 9,2 мл 1 н. раствора трибромида бора в дихлорметане. Через 20 ч реакцию прекращают при комнатной температуре добавлением к реакционной смеси метанола. Затем под вакуумом удаляют растворитель, растворяют остаток в насыщенном растворе гидрокарбоната натрия и этилацетате, экстрагируют этилацетатом и сушат объединенные органические фазы над сульфатом натрия. После удаления растворителя и очистки на силикагеле с использованием смеси гексан-этилацетат (0-100%) получают 60 мг (28% от теории) продукта. 1 Н-ЯМР (300 МГц, ДМСО-d6):= 1,40 (s, 3H), 1,57 (s, 3H), 1,93 (d, 1H), 2,98 (dd, 1 Н), 3,16-3,20 (m,2 Н), 5,52 (шир., 1H), 5,99 (шир., 1 Н), 6,68 (dd, 1H), 6,78-6,84 (m, 1 Н), 7,01 (dd, 1H), 7,32 (d, 1H), 7,45 (t,1H), 7,71 (s, 1H), 8,03 (d, 1 Н), 8,21 (s, 1H), 8,46 (d, 1H), 9,73 (s, 1H). Пример 39. Нитрил 5-[4-(5-фтор-2-метоксифенил)-2-гидрокси-4-метил-2-трифторметилпентиламино]хинолин-2-карбоновой кислоты. Нитрил 5-[4-(5-фтор-2-метоксифенил)-2-гидрокси-4-метил-2-трифторметилпентилиденамино]хинолин-2-карбоновой кислоты. 220 мг (0,46 ммоль) амида 5-[4-(5-фтор-2-метоксифенил)-2-гидрокси-4-метил-2-трифторметилпентилиденамино]хинолин-2-карбоновой кислоты и 1,80 мл (3,2 ммоль) триэтиламина растворяют в 18 мл дихлорметана и смешивают с 0,44 мл (1,38 ммоль) трифторуксусного ангидрида. Через 2 мин реакцию прекращают добавлением к реакционной смеси воды. Затем трижды экстрагируют этилацетатом и промывают объединенные органические фазы 1 н. раствором гидроксида натрия. После сушки над сульфатом натрия, удаления растворителя под вакуумом, а также хроматографии на силикагеле с использованием смеси гексан-этилацетат (0-100%) получают 190 мг (90% от теории) продукта. 1 Н-ЯМР (300 МГц, CDCl3):= 1,37 (s, 3 Н), 1,57 (s, 3 Н), 2,30 (d, 1H), 3,47 (d, 1H), 3,80 (s, 3H), 4,69 (s,1H), 6,38-6,43 (m, 1H), 6,59-6,60 (m, 2H), 6,80 (dd, 1H), 7,54 (s, 1H), 7,65 (t, 1H), 7,74 (d, 1H), 8,03 (d, 1H),8,44 (d, 1H). Нитрил 5-[4-(5-фтор-2-метоксифенил)-2-гидрокси-4-метил-2-трифторметилпентиламино]хинолин 2-карбоновой кислоты. Аналогично примеру 37 90 мг (0,2 ммоль) нитрила 5-[4-(5-фтор-2-метоксифенил)-2-гидрокси-4 метил-2-трифторметилпентилиденамино]хинолин-2-карбоновой кислоты подвергают взаимодействию с 31 мг (0,8 ммоль) натрия в 5,0 мл метанола и 1,0 мл тетрагидрофурана. После соответствующей переработки и хроматографии на силикагеле с использованием смеси гексан-этилацетат (0-100%) получают 50 мг (54% от теории) продукта. 1 Н-ЯМР (300 МГц, ДМСО-d6):= 1,38 (s, 3 Н), 1,56 (s, 3 Н), 2,05 (d, 1H), 2,88-3,11 (m, 3 Н), 3,78 (s,3 Н), 5,82-5,84 (m, 1 Н), 5,94 (s, 1H), 6,14 (d, 1H), 6,89-7,09 (m, 3 Н), 7,31 (d, 1H), 7,54 (t, 1H), 7,93 (d, 1H),8,61 (d, 1H). Амид 8-аминохинолин-2-карбоновой кислоты. Аналогично примеру 37 120 мг (0,59 ммоль) метилового эфира 8-аминохинолин-2-карбоновой кислоты подвергают взаимодействию с 10 мл 7 н. раствора аммиака в метаноле. После очистки на силикагеле с использованием смеси гексан-этилацетат получают 79 мг (72% от теории) продукта. 1 Н-ЯМР (300 МГц, ДМСО-d6):= 6,51 (шир., 2 Н), 6,84 (d, 1H), 7,04 (d, 1H), 7,35 (t, 1 Н), 7,58 (шир.,1 Н), 8,03 (d, 1 Н), 8,27 (d, 1 Н), 8,87 (шир., 1 Н). Амид 8-[4-(5-фтор-2-метоксифенил)-2-гидрокси-4-метил-2-трифторметилпентилиденамино]хинолин-2-карбоновой кислоты. Аналогично примеру 37 535 мг (2,86 ммоль) смеси амидов 5- и 8-аминохинолин-2-карбоновой кислоты подвергают взаимодействию с 1,06 г (3,43 ммоль) 4-(5-фтор-2-метоксифенил)-2-гидрокси-4-метил 2-(трифторметил)пентаналя в 4,50 мл концентрированной уксусной кислоты и 20 мл толуола. Через 40 ч проводят очистку на силикагеле с использованием смеси гексан-этилацетат (0-40%) и таким путем получают 624 мг (46% от теории) требуемого продукта. 1 Н-ЯМР (300 МГц, CDCl3):= 1,37 (s, 3 Н), 1,60 (s, 3 Н), 2,27 (d, 1 Н), 3,46 (d, 1H), 3,70 (s, 3H), 5,08 (s,1H), 5,60 (шир., 1H), 6,34-6,48 (m, 2H), 6,83 (dd, 1H), 7,00 (d, 1H), 7,49-7,59 (m, 2H), 7,65-7,78 (m, 2H), 8,32(s, 2H). Амид 8-[4-(5-фтор-2-метоксифенил)-2-гидрокси-4-метил-2-трифторметилпентиламино]хинолин-2 карбоновой кислоты. 703 мг (1,47 ммоль) амида 8-[4-(5-фтор-2-метоксифенил)-2-гидрокси-4-метил-2-трифторметилпентилиденамино]хинолин-2-карбоновой кислоты в 10 мл метанола и 5,0 мл тетрагидрофурана смешивают с 449 мг (11,8 ммоль) борогидрида натрия. Затем через 16 ч концентрируют растворитель, растворяют остаток в воде и этилацетате, экстрагируют этилацетатом и сушат объединенные органические фазы над сульфатом натрия. После удаления растворителя и очистки на силикагеле с использованием смеси гексан-этилацетат (0-50%), а также смеси дихлорметан-метанол (0-7%) получают 358 мг (51% от теории) продукта. 1 185 мг (0,386 ммоль) амида 8-[4-(5-фтор-2-метоксифенил)-2-гидрокси-4-метил-2-трифторметилпентиламино]хинолин-2-карбоновой кислоты в 5,0 мл диметилформамида смешивают с 397 мг(2,80 ммоль) дифосфорпентоксида. Через пять дней при комнатной температуре отфильтровывают нерастворимые компоненты. Затем фильтрат разбавляют этилацетатом и насыщенным раствором хлорида натрия. Далее экстрагируют этилацетатом, сушат объединенные органические фазы над сульфатом натрия, после чего концентрируют растворитель. Остатки диметилформамида удаляют под высоким вакуумом. После очистки на силикагеле с использованием смеси гексан-этилацетат (0-30%) получают 102 мг (57% от теории) продукта. 1 2-Хлор-5-нитрохинолин. 10,0 г (61,1 ммоль) 2-хлорхинолина растворяют в 34 мл концентрированной серной кислоты. Затем при 0 С порциями добавляют 8,4 г (76,4 ммоль) нитрата калия. Через 20 ч при комнатной температуре реакционную смесь сливают на смесь воды со льдом и водную фазу экстрагируют этилацетатом. Объединенные органические фазы промывают насыщенным раствором гидрокарбоната натрия и сушат над сульфатом натрия. После удаления растворителя под вакуумом и хроматографии на силикагеле с использованием смеси гексан-этилацетат (10-100%) получают 5,06 г (40% от теории) продукта. 1H-ЯМР (300 МГц, CDCl3):= 7,62 (d, 1 Н), 7,84 (t, 1H), 8,33 (d, 1H), 8,39 (d, 1H), 8,98 (d, 1H). 5-Нитро-2-винилхинолин. 5,06 г (24,5 ммоль) 2-хлор-5-нитрохинолина, 1,26 г (4,9 ммоль) трифенилфосфина и 8,0 г (25,2 ммоль) три-н-бутилвинилолова растворяют в 60 мл толуола. После добавления 2,75 г (2,5 ммоль) трис(дибензилиденацетон)дипалладия реакционную смесь кипятят с обратным холодильником в течение 20 ч. Затем фильтруют через целит и промывают этилацетатом. Далее фильтрат смешивают с насыщенным раствором хлорида аммония. После этого экстрагируют этилацетатом и сушат объединенные органические фазы над сульфатом натрия. После удаления растворителя под вакуумом и последующей хроматографии на силикагеле с использованием смеси гексан-этилацетат (5-20%) получают 3,05 г (62% от теории) продукта. 1(m., 2H), 8,95 (d, 1H). 2-Этилхинолин-5-иламин. 1,0 г (5,0 ммоль) 5-нитро-2-винилхинолина растворяют в 30 мл этилацетата. После добавления 100 мг палладия на активированном угле и 50 мг карбоната натрия реакционную смесь выдерживают для перемешивания в атмосфере водорода в течение 20 ч при комнатной температуре. Затем смесь фильтруют через целит и промывают этилацетатом. После удаления растворителя под вакуумом и хроматографии на силикагеле с использованием смеси гексан-этилацетат (0-100%), а затем с помощью смеси этилацетатметанол (0-30%) получают 720 мг (84% от теории) продукта. 1 Н-ЯМР (300 МГц, ДМСО-d6):= 1,29 (t, 3 Н), 2,86 (q, 2 Н), 5,87 (шир., 2 Н), 6,63 (d, 1H), 7,09 (d, 1H),7,25 (d, 1H), 7,35 (t, 1H), 8,41 (d, 1H). 1-(2-Этилхинолин-5-илимино)-4-(5-фтор-2-метоксифенил)-4-метил-2-(трифторметил)пентан-2-ол. Аналогично примеру 37 334 мг (1,94 ммоль) 2-этилхинолина-5-иламина подвергают взаимодействию с 500 мг (1,62 ммоль) 4-(5-фтор-2-метоксифенил)-2-гидрокси-4-метил-2-трифторметилпентаналя в 2,20 мл концентрированной уксусной кислоты и 15 мл толуола. После очистки на силикагеле с использованием смеси гексан-этилацетат (0-100%) получают 600 мг (80% от теории) соответствующего имина. 1H-ЯМР (300 МГц, CDCl3):= 1,38 (s, 3 Н), 1,41 (t, 3 Н), 1,57 (s, 3H), 2,30 (d, 1 Н), 3,03 (q, 2H), 3,42 (d,1H), 3,80 (s, 3H), 4,88 (s, 1H), 6,40-6,56 (m, 3H), 6,81 (dd, 1H), 7,37 (d, 1H), 7,47-7,55 (m, 2H), 7,92 (d, 1H),8,20 (d, 1H). 1-(2-Этилхинолин-5-иламино)-4-(5-фтор-2-метоксифенил)-4-метил-2-(трифторметил)пентан-2-ол. 600 мг (1,3 ммоль) 1-(2-этилхинолин-5-илимино)-4-(5-фтор-2-метоксифенил)-4-метил-2-(трифторметил)пентан-2-ола в 5,0 мл метанола при 0 С смешивают с 197 мг (5,2 ммоль) борогидрида натрия. После этого через 2 ч при комнатной температуре добавляют воду и под вакуумом удаляют метанол. Затем экстрагируют водную фазу дихлорметаном, сушат объединенные органические фазы над сульфатом натрия и под вакуумом удаляют растворитель. После очистки на силикагеле с использованием смеси гексан-этилацетат (0-100%) получают 400 мг (66% от теории) продукта. 1 Н-ЯМР (300 МГц, CDCl3):= 1,37 (t, 3 Н), 1,46 (s, 3 Н), 1,57 (s, 3 Н), 2,33 (d, 1 Н), 2,78 (d, 1H), 2,98 (q,2H), 3,13 (dd, 1H), 3,19 (шир., 1H), 3,30 (dd, 1H), 3,84 (s, 3H), 4,24 (шир., 1H), 6,01 (d, 1H), 6,80 (dd, 1H),6,91-6,98 (m, 1H), 7,12 (dd, 1H), 7,23 (d, 1H), 7,38-7,49 (m, 2H), 7,91 (d, 1H). Пример 43. 1-(2-Этилхинолин-5-иламино)-4-(5-фтор-2-гидроксифенил)-4-метил-2-(трифторметил) пентан-2-ол. 230 мг (0,49 ммоль) 1-(2-этилхинолин-5-илимино)-4-(5-фтор-2-метоксифенил)-4-метил-2-(трифторметил)пентан-2-ола в 4,5 мл дихлорметана при 0 С смешивают с 7,30 мл (7,30 ммоль) 1-молярного рас- 24008540 твора трибромида бора. Через 23 ч при комнатной температуре реакцию прекращают добавлением к реакционной смеси 30 мл метанола. Затем реакционную смесь в течение 1 ч выдерживают для перемешивания при комнатной температуре, после чего под вакуумом удаляют растворитель. После хроматографии на силикагеле с использованием смеси этилацетат-метанол (0-10%) получают 60 мг (27% от теории) продукта. 1(2,09 ммоль) 3-[1-(5-фтор-2-метоксифенил)циклопроп-1-ил]-2-гидрокси-2-(трифторметил)пропаналя и 2,80 мл концентрированной уксусной кислоты в 19 мл толуола. Через 6 ч проводят хроматографическую очистку на силикагеле с использованием смеси гексан-этилацетат (0-100%) и таким путем получают 810 мг (90% от теории) продукта. МС (ES+): m/z (отн. инт-сть, %) = 433 (М+1, 100). 1-(Хинолин-5-иламино)-3-[1-(5-фтор-2-метоксифенил)циклопроп-1-ил]-2-(трифторметил)пропан-2-ол. Аналогично примеру 1 810 мг (1,87 ммоль) 1-(хинолин-5-илимино)-3-[1-(5-фтор-2-метоксифенил)циклопроп-1-ил]-2-(трифторметил)пропан-2-ола подвергают взаимодействию с 288 мг (7,61 моль) борогидрида натрия в 6,0 мл метанола и 3,0 мл тетрагидрофурана. После хроматографии на силикагеле с использованием смеси гексан-этилацетат (0-100%) получают 660 мг (81% от теории) продукта. 1 Аналогично примеру 38 подвергают взаимодействию 330 мг (0,76 ммоль) 1-(хинолин-5-иламино)-3[1-(5-фтор-2-метоксифенил)циклопроп-1-ил]-2-(трифторметил)пропан-2-ола с 3,80 мл (3,80 ммоль) 1 молярного раствора трибромида бора в 6,90 мл дихлорметана. Через 2 ч реакцию обрывают. После перекристаллизации из этилацетата и метанола получают 292 мг (91% от теории) продукта. 1 3-[1-(5-Фтор-2-метоксифенил)циклопроп-1-ил]-1-(2-метилхинолин-5-илимино)-2-(трифторметил) пропан-2-ол. Аналогично примеру 1 352 мг (2,23 ммоль) 5-амино-2-метилхинолина подвергают взаимодействию с 650 мг (2,12 ммоль) 3-[1-(5-фтор-2-метоксифенил)циклопроп-1-ил]-2-гидрокси-2-(трифторметил)пропаналя и 2,80 мл концентрированной уксусной кислоты в 19 мл толуола. После хроматографии на силикагеле с использованием смеси гексан-этилацетат (0-100%) получают 870 мг (92% от теории) продукта. МС (ES+): m/z (отн. инт-сть, %) = 447(М+1, 100).- 25008540 3-[1-(5-Фтор-2-метоксифенил)циклопроп-1-ил]-1-(2-метилхинолин-5-иламино)-2-(трифторметил) пропан-2-ол. Аналогично примеру 37 870 мг (1,95 ммоль) 3-[1-(5-фтор-2-метоксифенил)циклопроп-1-ил]-1-(2-метилхинолин-5-илимино)-2-(трифторметил)пропан-2-ола подвергают взаимодействию с 96 мг (2,53 ммоль) борогидрида натрия в 6,0 мл метанола и 3,0 мл тетрагидрофурана. После перекристаллизации из гексана и этилацетата получают 790 мг (90% от теории) продукта. 1 Аналогично примеру 38 395 мг (0,88 ммоль) 3-[1-(5-фтор-2-метоксифенил)циклопроп-1-ил]-1-(2-метилхинолин-5-иламино)-2-(трифторметил)пропан-2-ола подвергают взаимодействию с 4,30 мл (4,3 ммоль) 1-молярного раствора трибромида бора в 8,0 мл дихлорметана. Через 1 ч при 0 С реакцию прекращают. Путем последующей перекристаллизации из этилацетата, ацетона и метанола получают 257 мг (67% от теории) продукта. МС (ES+): m/z (отн. инт-сть, %) = 435 (М+1, 100). Пример 48. 4-(5-Фтор-2-метоксифенил)-4-метил-2-трифторметил-1-(2-(трифторметил)хинолин-5 иламино)пентан-2-ол.Journ. Org. Chem., 1999, cc. 937-941) 1,2 г (7,18 ммоль) (Е)-4-(диметиламино)-1,1,1-трифтор-3-бутен-2-она подвергают взаимодействию с 2,03 г (7,18 ммоль) трифторуксусного ангидрида и 1,30 мл (14,36 ммоль) анилина в 72 мл 1,2-дихлорэтана, а затем в 36 мл ксилола. После соответствующей переработки и очистки на силикагеле с использованием смеси гексан-этилацетат (0-100%) получают 1,01 г (71% от теории) продукта. 5-Нитро-2-(трифторметил)хинолин. 1,52 г (7,7 ммоль) 2-(трифторметил)хинолина растворяют в 7,90 мл концентрированной серной кислоты и при 0 С порциями добавляют 1,47 г нитрата калия. Через 20 ч при комнатной температуре раствор сливают на смесь воды со льдом. Затем экстрагируют этилацетатом, промывают объединенные органические фазы насыщенным раствором гидрокарбоната натрия и сушат над сульфатом натрия. После удаления растворителя и хроматографии на силикагеле с использованием смеси гексан-этилацетат (10100%) получают 390 мг (21% от теории) продукта. 1 Н-ЯМР (300 МГц, CDCl3):= 7,92-8,00 (m, 2H), 8,53-8,58 (m, 2H), 9,26 (d, 1 Н). 5-Амино-2-(трифторметил)хинолин. 390 мг (1,61 ммоль) 5-нитро-2-(трифторметил)хинолина растворяют в 13 мл метанола. После добавления 39 мг палладия на активированном угле и 19 мг карбоната калия реакционную смесь выдерживают для перемешивания в течение 20 ч при комнатной температуре в атмосфере водорода. После этого фильтруют через целит и промывают этилацетатом. После удаления растворителя под вакуумом и хроматографии на силикагеле с использованием смеси гексан-этилацетат (0-100%) получают 250 мг (73% от теории) продукта. 1 Н-ЯМР (300 МГц, CDCl3):= 4,28 (шир., 2 Н), 6,92 (d, 1H), 7,58-7,69 (m, 3 Н), 8,36 (d, 1H). 4-(5-Фтор-2-метоксифенил)-4-метил-2-трифторметил-1-(2-(трифторметил)хинолин-5-илимино) пентан-2-ол. Аналогично примеру 37 250 мг (1,18 ммоль) 5-амино-2-(трифторметил)хинолина подвергают взаимодействию с 438 мг (1,42 ммоль) 4-(5-фтор-2-метоксифенил)-2-гидрокси-4-метил-2-(трифторметил)пентаналя и 1,30 мл концентрированной уксусной кислоты в 20 мл толуола. После хроматографии на силикагеле с использованием смеси гексан-этилацетат (0-100%) получают 500 мг (84% от теории) продукта. 1H-ЯМР (300 МГц, CDCl3):= 1,38 (s, 3 Н), 1,58 (s, 3 Н), 2,31 (d, 1H), 3,47 (d, 1H), 3,80 (s, 3H), 4,75 (s,- 26008540 1H), 6,39-6,45 (m, 1H), 6,51-6,58 (m, 2H), 6,82 (dd, 1H), 7,55 (s, 1H), 7,64 (t, 1H), 7,78 (d, 1H), 8,10 (d, 1H),8,49 (d, 1H). 4-(5-Фтор-2-метоксифенил)-4-метил-2-трифторметил-1-(2-(трифторметил)хинолин-5-иламино)пентан-2-ол. Аналогично примеру 37 500 мг (0,99 ммоль) 4-(5-фтор-2-метоксифенил)-4-метил-2-трифторметил 1-(2-(трифторметил)хинолин-5-илимино)пентан-2-ола подвергают взаимодействию с 154 мг (4,04 ммоль) борогидрида натрия в 5,0 мл метанола. После очистки на силикагеле с использованием смеси гексанэтилацетат (0-100%) получают 420 мг (84% от теории) продукта. 1 Н-ЯМР (300 МГц, CDCl3):= 1,47 (s, 3 Н), 1,55 (s, 3 Н), 2,42 (d, 1H), 2,74 (d, 1H), 3,03 (s, 1H), 3,16 100 мг (0,20 ммоль) 4-(5-фтор-2-метоксифенил)-4-метил-2-трифторметил-1-(2-(трифторметил) хинолин-5-иламино)пентан-2-ола в 2,0 мл дихлорметана смешивают при комнатной температуре с 4,0 мл(4,0 ммоль) 1-молярного раствора трибромида бора. Через 20 ч реакцию прекращают при комнатной температуре добавлением к смеси 20 мл метанола. Затем реакционную смесь выдерживают для перемешивания при комнатной температуре в течение 30 мин, а затем удаляют растворитель под вакуумом. После хроматографии на силикагеле с использованием смеси гексан-этилацетат (0-100%) получают 79 мг 1-(1,2-Дигидроксиэтил)-5-нитрохинолин. К раствору 3,18 г (15,88 ммоль) 5-нитро-2-винилхинолина в 140 мл ацетона и 21 мл воды при 0 С добавляют 336 мг (2,5 ммоль) гидрата N-оксида метилморфолина и 10,22 мл раствора тероксида осмия в изопропаноле и реакционную смесь выдерживают для перемешивания в течение 24 ч при комнатной температуре. После этого удаляют растворитель под вакуумом и растворяют остаток в этилацетате. Органическую фазу промывают водой и насыщенным раствором хлорида натрия. Водную фазу экстрагируют дихлорметаном, диэтиловым эфиром и этилацетатом. Объединенные органические фазы сушат над сульфатом натрия. После удаления растворителя и очистки на силикагеле с использованием смеси гексан-этилацетат (0-100%), а также смеси этилацетат-метанол (0-20%) получают 1,64 г (44% от теории) продукта. 1H-ЯМР (300 МГц, ДМСО-d6):= 3,62-3,81 (m, 2 Н), 4,78-4,84 (m, 2 Н), 5,76 (d, 1 Н), 7,90-7,96 (m,2 Н), 8,37-8,42 (m, 2 Н), 8,83 (d, 1H). 5-Нитрохинолин-2-карбальдегид. К раствору 1,64 г (7,0 ммоль) 1-(1,2-дигидроксиэтил)-5-нитрохинолина в 42 мл тетрагидрофурана и 7,0 мл воды добавляют 2,99 г (14,0 моль) периодата натрия. Через 20 ч при комнатной температуре добавляют этилацетат и промывают органическую фазу насыщенным раствором хлорида натрия. После сушки органической фазы над сульфатом натрия, удаления растворителя и очистки на силикагеле с использованием смеси гексан-этилацетат (0-100%) получают 1,40 г (99% от теории) продукта. 1(s, 1H). 2-(Гидроксиметил)-5-нитрохинолин. 700 мг (3,46 ммоль) 5-нитрохинолин-2-карбальдегида растворяют в 13 мл метанола и 7,0 мл тетрагидрофурана и при 0 С смешивают с 523 мг (13,9 ммоль) борогидрида натрия. Через 5 ч реакцию пре- 27008540 кращают добавлением к смеси воды. Затем удаляют растворитель под вакуумом, растворяют остаток в дихлорметане и воде, экстрагируют водную фазу дихлорметаном и сушат объединенные органические фазы над сульфатом натрия. После удаления растворителя и очистки на силикагеле с использованием смеси гексан-этилацетат (0-100%) получают 390 мг (55% от теории) продукта. 1H-ЯМР (300 МГц, CDCl3):= 4,13 (шир., 1 Н), 4,99 (s, 2H), 7,55 (d, 1H), 7,82 (t, 1H), 8,36-8,41 (m,2H), 8,99 (d, 1H). 2-(Ацетоксиметил)-5-нитрохинолин. Раствор 390 мг (1,91 ммоль) 2-(гидроксиметил)-5-нитрохинолина и 2,5 мл уксусного ангидрида в 5,0 мл пиридина выдерживают для перемешивания в течение 20 ч при комнатной температуре. После многократного соиспарения с толуолом и последующей хроматографии на силикагеле с использованием смеси гексан-этилацетат (0-100%) получают 410 мг (87% от теории) продукта. 1 Н-ЯМР (300 МГц, CDCl3):= 2,23 (s, 3 Н), 5,42 (s, 2H), 7,70 (d, 1H), 7,81 (t, 1H), 8,37-8,40 (m, 2H),9,02 (d, 1H). 2-(Ацетоксиметил)-5-аминохинолин. Раствор 410 мг (1,67 моль) 2-(ацетоксиметил)-5-нитрохинолина в 61 мл ацетона в течение 2 ч выдерживают для перемешивания в атмосфере водорода при комнатной температуре в присутствии 410 мг никеля Ренея. Затем отфильтровывают через целит с помощью вакуум-фильтра и дополнительно промывают ацетоном. После удаления растворителя и последующей хроматографии на силикагеле с использованием смеси гексан-этилацетат (10-100%) получают 230 мг (64% от теории) продукта. 1 Н-ЯМР (300 МГц, CDCl3):= 2,19 (s, 3 Н), 4,20 (шир., 2 Н), 5,37 (s, 2H), 6,81 (dd, 1H), 7,41 (d, 1H),7,51-7,53 (m, 2H), 8,19 (d, 1H). 1-(2-(Ацетоксиметил)хинолин-5-илимино)-4-(5-фтор-2-метоксифенил)-4-метил-2-(трифторметил) пентан-2-ол. Аналогично примеру 37 230 мг (1,06 ммоль) 2-(ацетоксиметил)-5-аминохинолина подвергают взаимодействию с 273 мг (0,88 ммоль) 4-(5-фтор-2-метоксифенил)-2-гидрокси-4-метил-2-(трифторметил)пентаналя и 1,20 мл концентрированной уксусной кислоты в 20,0 мл толуола. После хроматографии на силикагеле с использованием смеси гексан-этилацетат (0-100%) получают 360 мг (81% от теории) продукта. 1(s, 3 Н), 4,84 (s, 1H), 5,40 (s, 2H), 6,42-6,56 (m, 3 Н), 6,82 (dd, 1H), 7,45-7,60 (m, 3H), 7,95 (d, 1H), 8,31 (d, 1H). 1-(2-(Ацетоксиметил)хинолин-5-иламино)-4-(5-фтор-2-метоксифенил)-4-метил-2-(трифторметил) пентан-2-ол. Раствор 170 мг (0,34 ммоль) 1-(2-(ацетоксиметил)хинолин-5-илимино)-4-(5-фтор-2-метоксифенил)4-метил-2-(трифторметил)пентан-2-ола в 1,5 мл метанола и 0,8 мл тетрагидрофурана смешивают с 53 мг(1,38 ммоль) борогидрида натрия. Через 3 ч при комнатной температуре реакцию прекращают добавлением к реакционной смеси воды. Затем экстрагируют этилацетатом, промывают объединенные органические фазы насыщенным раствором хлорида натрия и сушат над сульфатом натрия. После удаления растворителя и последующей хроматографии на силикагеле с использованием смеси гексан-этилацетат Взаимодействием 170 мг (0,34 ммоль) 1-(2-(ацетоксиметил)хинолин-5-иламино)-4-(5-фтор-2 метоксифенил)-4-метил-2-(трифторметил)пентан-2-ола с 53 мг (1,38 ммоль) борогидрида натрия в 1,5 мл метанола и 0,8 мл тетрагидрофурана получают 43 мг (27% от теории) продукта (ср. пример 14). 1 290 мг (0,62 ммоль) 4-(5-фтор-2-метоксифенил)-1-(2-(гидроксиметил)хинолин-5-иламино)-4-метил 2-(трифторметил)пентан-2-ола в 7,0 мл дихлорметана при комнатной температуре смешивают с 12,5 мл(12,5 ммоль) 1-молярного раствора трибромида бора. Через 20 ч при комнатной температуре реакцию прекращают добавлением к реакционной смеси метанола. Затем под вакуумом удаляют растворитель,растворяют остаток в насыщенном растворе гидрокарбоната натрия и этилацетате, экстрагируют этилацетатом и сушат объединенные органические фазы над сульфатом натрия. После удаления растворителя и очистки на силикагеле с использованием смеси гексан-этилацетат (0-70%), а также смеси этилацетатметанол (0-10%) получают 160 мг (51% от теории) продукта. 1 Н-ЯМР (300 МГц, ДМСО-d6):= 1,46 (s, 3 Н), 1,56 (s, 3 Н), 1,93 (d, 1H), 2,94 (dd, 1 Н), 3,09-3,21 (m,2 Н), 4,67 (d, 2 Н), 5,34-5,37 (m, 1 Н), 5,51 (t, 1H), 5,91 (d, 1H), 5,98 (s, 1H), 6,73 (dd, 1 Н), 6,81-6,87 (m, 1 Н),7,01 (dd, 1H), 7,14 (d, 1H), 7,32 (t, 1H), 7,54 (d, 1H), 8,28 (d, 1H), 9,74 (s, 1H). Пример 53. Метиловый эфир 5-[4-(5-фтор-2-метоксифенил)-2-гидрокси-4-метил-2-(трифторметил)пентиламино]хинолин-2-карбоновой кислоты. Метиловый эфир 5-аминохинолин-2-карбоновой кислоты. 2,8 г нитрата калия при 0 С порциями добавляют к раствору 3,5 г (20,21 ммоль) хинолин-2 карбоновой кислоты в 12 мл концентрированной серной кислоты. Через 4 дня при комнатной температуре реакционную смесь сливают на смесь воды со льдом. Выпавшее в осадок твердое вещество отфильтровывают с помощью вакуум-фильтра, промывают небольшим количеством воды и сушат под высоким вакуумом. Сырой продукт растворяют в 50 мл метанола. После добавления 10 мл концентрированной серной кислоты реакционный раствор кипятят с обратным холодильником, а затем перемешивают в течение 36 ч при комнатной температуре. Далее реакционный раствор концентрируют до одной трети от первоначального объема и сливают на смесь воды со льдом. После этого экстрагируют этилацетатом,промывают объединенные органические фазы насыщенным раствором гидрокарбоната натрия, затем насыщенным раствором хлорида натрия, сушат над сульфатом натрия и удаляют растворитель под вакуумом. Сырой продукт растворяют в 80 мл смеси метанол-ацетон (50%) и смешивают с палладием на активированном угле и карбонатом калия. Далее в течение 20 ч перемешивают при комнатной температуре в атмосфере водорода. После отфильтровывания через целит с помощью вакуум-фильтра и промывки ацетоном удаляют растворитель под вакуумом и очищают остаток на силикагеле с использованием смеси гексан-этилацетат (0-60%). Таким путем получают 850 мг (27% от теории) продукта. 1 Н-ЯМР (300 МГц, CDCl3):= 4,07 (s, 3 Н), 6,90 (d, 1H), 7,58 (t, 1H), 7,75 (d, 1H), 8,12 (d, 1H), 8,33(d, 1H). Метиловый эфир 5-[4-(5-фтор-2-метоксифенил)-2-гидрокси-4-метил-2-(трифторметил)пентилиденамино]хинолин-2-карбоновой кислоты. Аналогично примеру 37 200 мг (1,0 ммоль) метилового эфира 5-аминохинолин-2-карбоновой кислоты подвергают взаимодействию с 371 мг (1,2 ммоль) 4-(5-фтор-2-метоксифенил)-2-гидрокси-4-метил 2-(трифторметил)пентаналя и 1,10 мл концентрированной уксусной кислоты в 20 мл толуола. После хроматографии на силикагеле с использованием смеси гексан-этилацетат (0-100%) получают 420 мгH-ЯМР (300 МГц, CDCl3):= 1,38 (s, 3 Н), 1,59 (s, 3 Н), 2,29 (d, 1H), 3,47 (d, 1H), 3,80 (s, 3H), 4,10 (s,3H), 4,79 (s, 1H), 6,40-6,45 (m, 1H), 6,53-6,56 (m, 2H), 6,81 (dd, 1H), 7,54 (s, 1H), 7,60 (t, 1H), 8,18 (d, 1H),8,23 (d, 1H), 8,45 (d, 1H). Метиловый эфир 5-[4-(5-фтор-2-метоксифенил)-2-гидрокси-4-метил-2-(трифторметил)пентиламино]хинолин-2-карбоновой кислоты. Аналогично примеру 40 420 мг (0,85 ммоль) метилового эфира 5-[4-(5-фтор-2-метоксифенил)-2 гидрокси-4-метил-2-(трифторметил)пентилиденамино]хинолин-2-карбоновой кислоты растворяют в 10 мл метанола и смешивают с 130 мг (3,41 ммоль) борогидрида натрия. После хроматографии на силикагеле с использованием смеси гексан-этилацетат (0-100%) получают 75 мг (18% от теории) продукта. 1 Н-ЯМР (300 МГц, CDCl3):= 1,46 (s, 3 Н), 1,56 (s, 3 Н), 2,36 (d, 1H), 2,78 (d, 1H), 3,04 (s, 1H), 3,15 Раствор 60 мг (0,12 ммоль) метилового эфира 5-[4-(5-фтор-2-метоксифенил)-2-гидрокси-4-метил-2(трифторметил)пентиламино]хинолин-2-карбоновой кислоты в 10 мл метанола смешивают с 0,5 мл (0,5 ммоль) 1 н. раствора едкого натра. Через 2,5 ч под вакуумом удаляют растворитель и очищают остаток на силикагеле с использованием смеси дихлорметан-метанол (6-25%). Таким путем получают 47 мг (82% от теории) продукта. 1 Метиламид 5-аминохинолин-2-карбоновой кислоты. 76 мг (0,376 ммоль) метилового эфира 5-аминохинолин-2-карбоновой кислоты растворяют в 10 мл 2-молярного раствора метиламина в метаноле. После кипячения с обратным холодильником в течение 90 мин и последующей выдержки в течение 16 ч при комнатной температуре удаляют растворитель под пониженным давлением и очищают остаток на силикагеле с использованием смеси гексан-этилацетат (0-80%). Таким путем получают 72 мг (95% от теории) продукта. 1H-ЯМР (300 МГц, ДМСО-d6):= 2,87 (d, 3 Н), 6,10 (s, 2 Н), 6,77 (d, 1H), 7,27 (d, 1H), 7,51 (t, 1H),7,95 (d, 1H), 8,68 (d, 1H), 8,79-8,80 (m, 1H). Метиламид 5-[4-(5-фтор-2-метоксифенил)-2-гидрокси-4-метил-2-(трифторметил)пентилиденамино] хинолин-2-карбоновой кислоты. Аналогично примеру 37 220 мг (1,08 ммоль) метиламида 5-аминохинолин-2-карбоновой кислоты подвергают взаимодействию с 550 мг (1,78 ммоль) 4-(5-фтор-2-метоксифенил)-2-гидрокси-4-метил-2(трифторметил)пентаналя и 3,0 мл концентрированной уксусной кислоты в 30 мл толуола. После хроматографии на силикагеле с использованием смеси гексан-этилацетат (0-70%) получают 259 мг (48% от теории) продукта. 1(0,4 ммоль) тетраэтилата титана, а также с 94 мг (2,6 ммоль) борогидрида натрия. Через 5 ч реакцию прекращают добавлением к реакционной смеси насыщенного раствора хлорида натрия и этилацетата. Затем отфильтровывают нерастворимые компоненты смеси. После этого фильтрат экстрагируют этилацетатом,сушат объединенные органические фазы над сульфатом натрия и под вакуумом удаляют растворитель. После хроматографии на силикагеле с использованием смеси гексан-этилацетат (0-50%) получают 110 мг
МПК / Метки
МПК: C07D 217/24, C07D 215/40, A61K 31/47, A61P 29/00, C07D 405/12
Метки: ингибиторов, качестве, производные, изохинолина, способ, хинолина, получения, воспаления, применение
Код ссылки
<a href="https://eas.patents.su/30-8540-proizvodnye-hinolina-i-izohinolina-sposob-ih-polucheniya-i-ih-primenenie-v-kachestve-ingibitorov-vospaleniya.html" rel="bookmark" title="База патентов Евразийского Союза">Производные хинолина и изохинолина, способ их получения и их применение в качестве ингибиторов воспаления</a>
Предыдущий патент: Производные пиридина, пригодные для ингибирования системы обмена натрия/кальция
Следующий патент: Тетрапептид, регулирующий уровень глюкозы в крови при сахарном диабете
Случайный патент: Способ получения циклогексанола и циклогексанона












