Производные бензо[c]хинолизина и их применение в качестве ингибиторов 5&alpha- редуктаз
Формула / Реферат
1. Полностью или частично восстановленные соединения ряда бензо[с]хинолизина формулы (I)
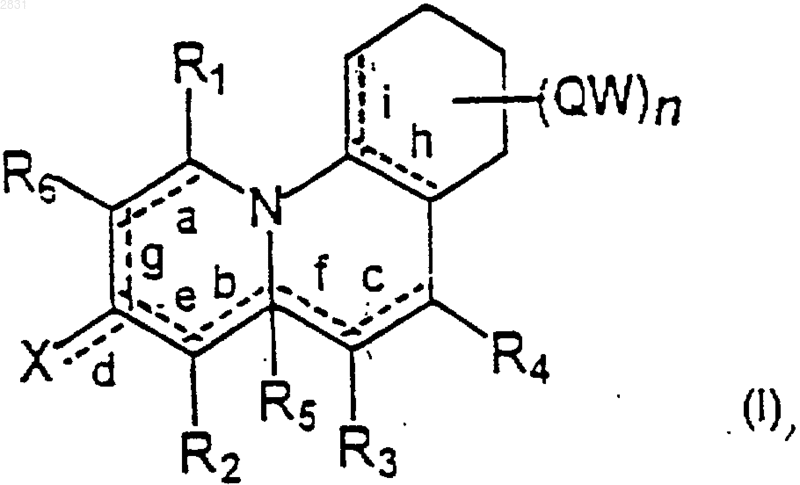
где R1, R2, R3, R4, R6, одинаковые или различные, выбирают из группы, состоящей из Н, C1-8алкила, С2-8алкенила, С2-8алкинила, циклопропана, циклобутана, циклопентана, циклогексана, циклогептана, циклооктана, норборнана, камфана, адамантана, фенила, бифенила, нафтила, насыщенного или ароматического гетероцикла, содержащего один или несколько атомов N, галогена, CN, азида NRR', C1-8алкиламино, ариламино, C1-8алкилокси, арилокси, COOR, CONRR', C(=O)R, где R и R', одинаковые или различные, выбирают из группы, состоящей из Н, С1-8алкила, циклопропана, циклобутана, циклопентана, циклогексана, циклогептана, циклооктана, норборнана, камфана, адамантана, фенила, бифенила, нафтила, насыщенного или ароматического гетероцикла, содержащегo один или несколькo атомов N, фенил-, бифенил-, нафтил-С1-8алкила;
R5 выбирают из группы, состоящей из Н, С1-8алкила, C1-8алкилфенила, -бифенила, -нафтила, COOR, CN, фенила, бифенила, нафтила, насыщенного или ароматического гетероцикла, содержащего один или несколько атомов N, насыщенного или ароматического С1-8алкилгетероцикла, содержащего один или несколько атомов N, насыщенный или ароматический C1-8алкилгетероцикл, содержащий один или несколько атомов N-рибозофосфата;
Х выбирают из группы, состоящей из О, C(=О)R, COOR, NO2, CONR'R, где R и R' такие, как определено выше;
Q выбирают из группы, состоящей из простой связи, C1-8алкила, С2-8алкенила, С2-8алкинила, циклопропана, циклобутана, циклопентана, циклогексана, циклогептана, циклооктана, норборнана, камфана, адамантана, СО, CONR, NR, где R такой, как определено выше;
W выбирают из группы, состоящей из Н, С1-8алкила, С2-8алкенила, С2-8алкинила, циклопропана, циклобутана, циклопентана, циклогексана, циклогептана, циклооктана, норборнана, камфана, адамантана, трифторметила, C1-8алкокси, С1-8алкокси-С1-8алкила, фенил-, бифенил-, нафтил-С1-8алкила, фенила, бифенила, нафтила, фенилокси, бифенилокси, нафтилокси, фениламино, бифениламино, нафтиламино, С1-8алкилкарбонила, фенилкарбонила, бифенилкарбонила, нафтилкарбонила, фенилкарбоксила, бифенилкарбоксила, нафтилкарбоксила, фенилкарбоксиамида, бифенилкарбоксиамида, нафтилкарбоксиамида, галогена, CN, NRR', C1-8алкиламино, насыщенного или ароматического гетероцикла, содержащего один или несколько атомов N, где группы алкил, алкенил, алкинил, циклопропан, циклобутан, циклопентан, циклогексан, циклогептан, циклооктан, норборнан, камфан, адамантан, фенил, бифенил, нафтил, насыщенный или ароматический гетероцикл, содержащий один или несколько атомов N, могут быть замещены; n равно целому числу между 1 и 4;
символ --- oзначает, что соответствующие связи а, b, с, d, e, f, g, h и i могут быть одинарной или двойной связью, при условии, что, когда b или f представляет собой двойную связь, то группа R5 отсутствует;
их фармацевтически приемлемые соли или сложные эфиры.
2. Соединения ряда бензо[с]хинолизина формулы (1) по п.1, где R5 представляет Н, С1-8алкилфенил, -бифенил, -нафтил, COOR, CN, фенил, бифенил, нафтил, насыщенный или ароматический гетероцикл, содержащий один или несколько атомов N, насыщенный или ароматический C1-8алкилгетероцикл, содержащий один или несколько атомов N; или группа насыщенного или ароматического С1-8алкилгетероцикла, содержащего один или несколько атомов N-рибозофосфата;
Х=О, СОOH;
Q представляет одинарную связь, СО, CONR, NR (где R такой, как определено выше);
W представляет Н, F, Cl, Br, Me, трет-бутил, С1-8алкокси, 2,5-диметилгексил, трифторметил, 2,5-(дитрифторметил)фенил, 4-метоксифенил, 4-фторфенил, фенил, фенил-С1-8алкил, С1-8алкилкарбонил, фенилкарбонил;
n=1 и 2;
R1, R2, R3, R4, R6 представляют Н, Me, CN, фенил, COOR, CONRR' (где R и R' такие, как определено выше).
3. Соединения ряда бензо[с]хинолизина по п.1 формулы
2,3,4,4а,5,6,6а,7,8,9,10,10а-додекагидро-(1Н)-бензо[с]хинолизин-3-он;
8-хлор-2,3,4,4а,5,6,6а,7,8,9,10,10а-додекагидро-(1Н)-бензо[с]хинолизин-3-он;
2,3,4,4а,5,6,6а,7,8,9,10,10а-додекагидро-8-метил-(1Н)-бензо[с]хинолизин-3-он;
2,3,4,4а,5,6,6а,7,8,9,10,10а-додекагидро-4-метил-(1Н)-бензо[с]хинолизин-3-он;
2,3,4,4а,5,6,6а,7,8,9,10,10а-додекагидро-1-метил-(1Н)-бензо[с]хинолизин-3-он;
2,3,5,6,6а,7,8,9,10,10а-декагидро-(1Н)-бензо[с]хинолизин-3-он;
8-хлор-2,3,5,6,6а,7,8,9,10,10а-декагидро-(1Н)-бензо[с]-хинолизин-3-он;
2,3,5,6,6а,7,8,9,10,10а-декагидро-8-метил-(1Н)-бензо[с]хинолизин-3-он;
2,3,5,6,6а,7,8,9,10,10а-декагидро-4-метил-(1Н)-бензо[с]хинолизин-3-он;
2,3,5,6,6а,7,8,9,10,10а-декагидро-1-метил-(1Н)-бензо[с]хинолизин-3-он;
(4аa,6аb,10аa)-3,4,5,6,6a,7,8,9,10,10а-декагидро-(4аН)-бензо[с]хинолизин-3-он;
(4ab,6аb,10аa)-3,4,5,6,6a,7,8,9,10,10а-декагидро-(4аН)-бензо[с]хинолизин-3-он;
3,4,5,6,6а,7,8,9,10,10а-декагидро-(4аН)-бензо[с]хинолизин-3-он;
8-хлор-3,4,5,6,6а,7,8,9,10,10а-декагидро-(4аН)-бензо[с]хинолизин-3-он;
3,4,5,6,6а,7,8,9,10,10а-декагидро-8-метил-(4аН)-бензо[с]хинолизин-3-он;
3,4,5,6,6а,7,8,9,10,10а-декагидро-4-метил-(4аН)-бензо[с]хинолизин-3-он;
3,4,5,6,6а,7,8,9,10,10а-декагидро-1-метил-(4аН)-бензо[с]хинолизин-3-он;
8-хлор-2,3,5,6,6а,7,8,9,10,10а-декагидро-4-метил-(1Н)-бензо[с]хинолизин-3-он;
2,3,5,6,6а,7,8,9,10,10а-декагидро-4,8-диметил-(1Н)-бензо[с]хинолизин-3-он;
8-хлор-2,3,5,6,6а,7,8,9,10,10а-декагидро-1-метил-(1Н)-бензо[с]хинолизин-3-он;
2,3,5,6,6а,7,8,9,10,10а-декагидро-1,4-диметил-(1Н)-бензо[с]хинолизин-3-он;
8-хлор-3,4,5,6,6а,7,8,9,10,10а-декагидро-4-метил-(4аН)-бензо[с]хинолизин-3-он;
3,4,5,6,6а,7,8,9,10,10а-декагидро-4,8-диметил-(4аН)-бензо[с]хинолизин-3-он;
8-хлор-3,4,5,6,6а,7,8,9,10,10а-декагидро-1-метил-(4аН)-бензо[с]хинолизин-3-он;
3,4,5,6,6а,7,8,9,10,10а-декагидро-1,8-диметил-(4аН)-бензо[с]хинолизин-3-он;
2,3,5,6,6а,7,8,9,10,10а-декагидро-5-метил-(1Н)-бензо[с]хинолизин-3-он;
8-хлор-2,3,5,6,6а,7,8,9,10,10а-декагидро-5-метил-(1Н)-бензо[с]хинолизин-3-он;
2,3,5,6,6а,7,8,9,10,10а-декагидро-5,8-диметил-(1Н)-бензо[с]хинолизин-3-он;
2,3,5,6,6а,7,8,9,10,10а-декагидро-4,5-диметил-(1Н)-бензо[с]хинолизин-3-он;
2,3,5,6,6а,7,8,9,10,10а-декагидро-1,5-диметил-(1Н)-бензо[с]хинолизин-3-он;
3,4,5,6,6а,7,8,9,10,10а-декагидро-5-метил-(4аН)-бензо[с]хинолизин-3-он;
8-хлор-3,4,5,6,6а,7,8,9,10,10а-декагидро-5-метил-(4аН)-бензо[с]хинолизин-3-он;
3,4,5,6,6а,7,8,9,10,10а-декагидро-5,8-диметил-(4аН)-бензо[с]хинолизин-3-он;
3,4,5,6,6а,7,8,9,10,10а-декагидро-4,5-диметил-(4аН)-бензо[с]хинолизин-3-он;
3,4,5,6,6а,7,8,9,10,10а-декагидро-1,5-диметил-(4аН)-бензо[с]хинолизин-3-он;
8-хлор-2,3,5,6,6а,7,8,9,10,10а-декагидро-4,5-диметил-(1Н)-бензо[с]хинолизин-3-он;
2,3,5,6,6а,7,8,9,10,10а-декагидро-4,5,8-триметил-(1Н)-бензо[с]хинолизин-3-он;
8-хлор-2,3,5,6,6а,7,8,9,10,10а-декагидро-1,5-диметил-(1Н)-бензо[с]хинолизин-3-он;
2,3,5,6,6а,7,8,9,10,10а-декагидро-1,4,5-триметил-(1Н)-бензо[с]хинолизин-3-он;
8-хлор-3,4,5,6,6а,7,8,9,10,10а-декагидро-4,5-диметил-(4аН)-бензо[с]хинолизин-3-он;
3,4,5,6,6а,7,8,9,10,10а-декагидро-4,5,8-триметил-(4аН)-бензо[с]хинолизин-3-он;
8-хлор-3,4,5,6,6а,7,8,9,10,10а-декагидро-1,5-диметил-(4аН)-бензо[с]хинолизин-3-он;
3,4,5,6,6а,7,8,9,10,10а-декагидро-1,5,8-триметил-(4аН)-бензо[с]хинолизин-3-он;
2,3,5,6,6а,7,8,9,10,10а-декагидро-6-метил-(1Н)-бензо[с]хинолизин-3-он;
8-хлор-2,3,5,6,6а,7,8,9,10,10а-декагидро-6-метил-(1H)-бензо[с]хинолизин-3-он;
2,3,5,6,6а,7,8,9,10,10а-декагидро-6,8-диметил-(1Н)-бензо[с]хинолизин-3-он;
2,3,5,6,6а,7,8,9,10,10а-декагидро-4,6-диметил-(1Н)-бензо[с]хинолизин-3-он;
2,3,5,6,6а,7,8,9,10,10а-декагидро-1,6-диметил-(1Н)-бензо[с]хинолизин-3-он;
3,4,5,6,6а,7,8,9,10,10а-декагидро-6-метил-(4аН)-бензо[с]хинолизин-3-он;
8-хлор-3,4,5,6,6а,7,8,9,10,10а-декагидро-6-метил-(4аН)-бензо[с]хинолизин-3-он;
3,4,5,6,6а,7,8,9,10,10а-декагидро-6,8-диметил-(4аН)-бензо[с]хинолизин-3-он;
3,4,5,6,6а,7,8,9,10,10а-декагидро-4,6-диметил-(4аН)-бензо[с]хинолизин-3-он;
3,4,5,6,6а,7,8,9,10,10а-декагидро-1,6-диметил-(4аН)-бензо[с]хинолизин-3-он;
8-хлор-2,3,5,6,6а,7,8,9,10,10а-декагидро-4,6-диметил-(1Н)-бензо[с]хинолизин-3-он;
2,3,5,6,6а,7,8,9,10,10а-декагидро-4,6,8-триметил-(1Н)-бензо[с]хинолизин-3-он;
8-хлор-2,3,5,6,6а,7,8,9,10,10а-декагидро-1,6-диметил-(1Н)-бензо[с]хинолизин-3-он;
2,3,5,6,6а,7,8,9,10,10а-декагидро-1,4,6-триметил-(1Н)-бензо[с]хинолизин-3-он;
8-хлор-3,4,5,6,6а,7,8,9,10,10а-декагидро-4,6-диметил-(4аН)-бензо[с]хинолизин-3-он;
3,4,5,6,6а,7,8,9,10,10а-декагидро-4,6,8-триметил-(4аН)-бензо[с]хинолизин-3-он;
8-хлор-3,4,5,6,6а,7,8,9,10,10а-декагидро-1,6-диметил-(4аН)-бензо[с]хинолизин-3-он;
3,4,5,6,6а,7,8,9,10,10а-декагидро-1,6,8-триметил-(4аН)-бензо[с]хинолизин-3-он;
2,3,5,6,6а,7,8,9,10,10а-декагидро-5,6-диметил-(1Н)-бензо[с]хинолизин-3-он;
8-хлор-2,3,5,6,6а,7,8,9,10,10а-декагидро-5,6-диметил-(1Н)-бензо[с]хинолизин-3-он;
2,3,5,6,6а,7,8,9,10,10а-декагидро-5,6,8-триметил-(1Н)-бензо[с]хинолизин-3-он;
2,3,5,6,6а,7,8,9,10,10а-декагидро-4,5,6-триметил-(1Н)-бензо[с]хинолизин-3-он;
2,3,5,6,6а,7,8,9,10,10а-декагидро-1,5,6-триметил-(1Н)-бензо[с]хинолизин-3-он;
3,4,5,6,6а,7,8,9,10,10а-декагидро-5,6-диметил-(4аН)-бензо[с]хинолизин-3-он;
8-хлор-3,4,5,6,6а,7,8,9,10,10а-декагидро-5,6-диметил-(4аН)-бензо[с]хинолизин-3-он;
3,4,5,6,6а,7,8,9,10,10а-декагидро-5,6,8-триметил-(4аН)-бензо[с]хинолизин-3-он;
3,4,5,6,6а,7,8,9,10,10а-декагидро-4,5,6-триметил-(4аН)-бензо[с]хинолизин-3-он;
3,4,5,6,6а,7,8,9,10,10а-декагидро-1,5,6-триметил-(4аН)-бензо[с]хинолизин-3-он;
8-хлор-2,3,5,6,6а,7,8,9,10,10а-декагидро-4,5,6-триметил-(1H)-бензо[с]хинолизин-3-он;
2,3,5,6,6а,7,8,9,10,10а-декагидро-4,5,6,8-тетраметил-(1Н)-бензо[с]хинолизин-3-он;
8-хлор-2,3,5,6,6а,7,8,9,10,10а-декагидро-1,5,6-триметил-(1Н)-бензо[с]хинолизин-3-он;
2,3,5,6,6а,7,8,9,10,10а-декагидро-1,4,5,6-тетраметил-(1Н)-бензо[с]хинолизин-3-он;
8-хлор-3,4,5,6,6а,7,8,9,10,10а-декагидро-4,5,6-триметил-(4аН)-бензо[с]хинолизин-3-он;
3,4,5,6,6а,7,8,9,10,10а-декагидро-4,5,6,8-тетраметил-(4аН)-бензо[с]хинолизин-3-он;
8-хлор-3,4,5,6,6а,7,8,9,10,10а-декагидро-1,5,6-триметил-(4аН)-бензо[с]хинолизин-3-он;
3,4,5,6,6а,7,8,9,10,10а-декагидро-1,5,6,8-тетраметил-(4аН)-бензо[с]хинолизин-3-он;
5,6,6а,7,8,9,10,10а-октагидро-(3Н)-бензо[с]хинолизин-3-он;
8-хлор-5,6,6а,7,8,9,10,10а-октагидро-(3Н)-бензо[с]хинолизин-3-он;
5,6,6а,7,8,9,10,10а-октагидро-8-метил-(3Н)-бензо[с]хинолизин-3-он;
5,6,6а,7,8,9,10,10а-октагидро-4-метил-(3Н)-бензо[с]хинолизин-3-он;
8-хлор-5,6,6а,7,8,9,10,10а-октагидро-4-метил-(3Н)-бензо[с]хинолизин-3-он;
5,6,6а,7,8,9,10,10а-октагидро-4,8-диметил-(3Н)-бензо[с]хинолизин-3-он;
2,3,5,6,7,8,9,10-октагидро-(1Н)-бензо[с]хинолизин-3-он;
8-хлор-2,3,5,6,7,8,9,10-октагидро-(1Н)-бензо[с]хинолизин-3-он;
2,3,5,6,7,8,9,10-октагидро-8-метил-(1Н)-бензо[с]хинолизин-3-он;
2,3,5,6,6а,7,8,9-октагидро-(1Н)-бензо[с]хинолизин-3-он;
8-хлор-2,3,5,6,6а,7,8,9-октагидро-(1Н)-бензо[с]хинолизин-3-он;
2,3,5,6,6а,7,8,9-октагидро-8-метил-(1Н)-бензо[с]хинолизин-3-он;
4а-бензил-3,4,5,6,6а,7,8,9,10,10а-декагидро-(4аН)-бензо[с]хинолизин-3-он;
4а-бензил-8-хлор-3,4,5,6,6а,7,8,9,10,10а-декагидро-(4аН)-бензо[с]хинолизин-3-он;
4а-бензил-3,4,5,6,6а,7,8,9,10,10а-декагидро-8-метил-(4аН)-бензо[с]хинолизин-3-он;
4а-бензил-3,4,5,6,6а,7,8,9,10,10а-декагидро-4-метил-(4аН)-бензо[с]хинолизин-3-он;
4а-бензил-3,4,5,6,6а,7,8,9,10,10а-декагидро-1-метил-(4аН)-бензо[с]хинолизин-3-он;
3,4,5,6,6а,7,8,9,10,10а-декагидро-4а-(4-пиридил)метил-(4аН)-бензо[с]хинолизин-3-он;
8-хлор-3,4,5,6,6а,7,8,9,10,10а-декагидро-4а-(4-пиридил)-метил-(4аН)-бензо[с]хинолизин-3-он;
3,4,5,6,6а,7,8,9,10,10а-декагидро-8-метил-4а-(4-пиридил)метил-(4аН)-бензо[с]хинолизин-3-он;
3,4,5,6,6а,7,8,9,10,10а-декагидро-4-метил-4а-(4-пиридил)метил-(4аН)-бензо[с]хинолизин-3-он;
3,4,5,6,6а,7,8,9,10,10а-декагидро-1-метил-4а-(4-пиридил)метил-(4аН)-бензо[с]хинолизин-3-он.
4. Способ получения соединений по любому из пп.1-3, где
группу сложного эфира соединения формулы (2)
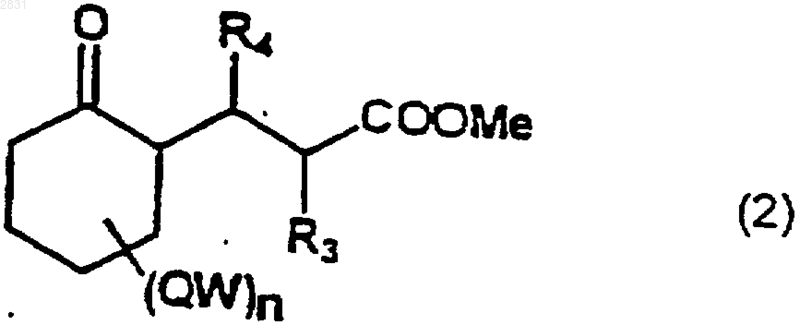
(где R3, R4 и (WQ)n такие, как определено в п.1) циклизуют в енамид (3)

(где R3, R4 и (WQ)n такие, как определено в п.1), который восстанавливают в амид (4)
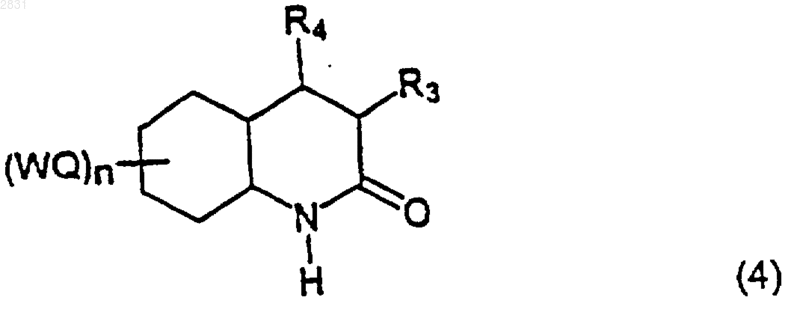
(где R3, R4 и (WQ)n такие, как определено в п.1),
который защищают защитной группой Воc, получая соединение (5)
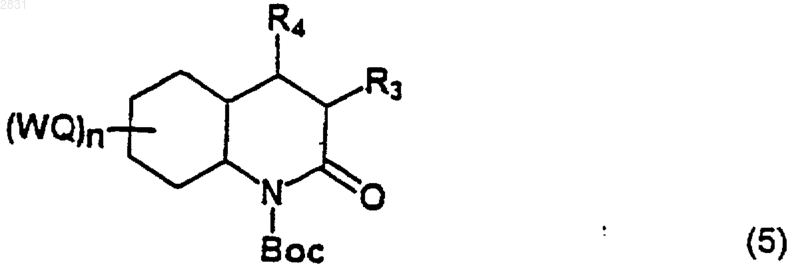
(где R3, R4 и (WQ)n такие, как определено в п.1), которое восстанавливают в соединение (6)
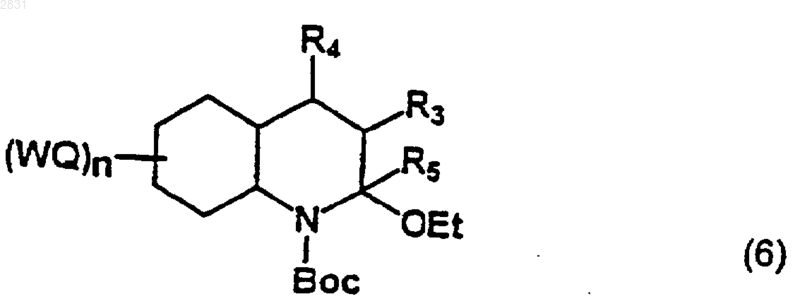
(где R3, R4, R5 и (WQ)n такие, как определено в п.1)
и соединение (6) подвергают взаимодействию с силиловым простым эфиром формулы (8)
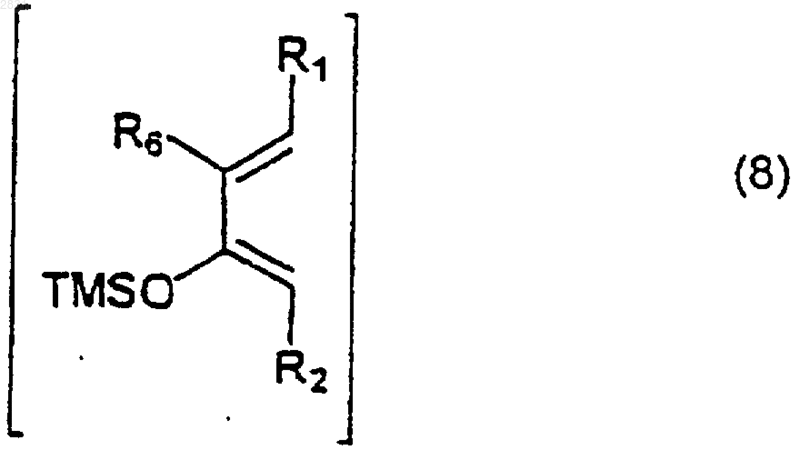
(где R1, R2 и R3 такие, как определено в п.1),
полученным "in situ" взаимодействием винилкетона (7)
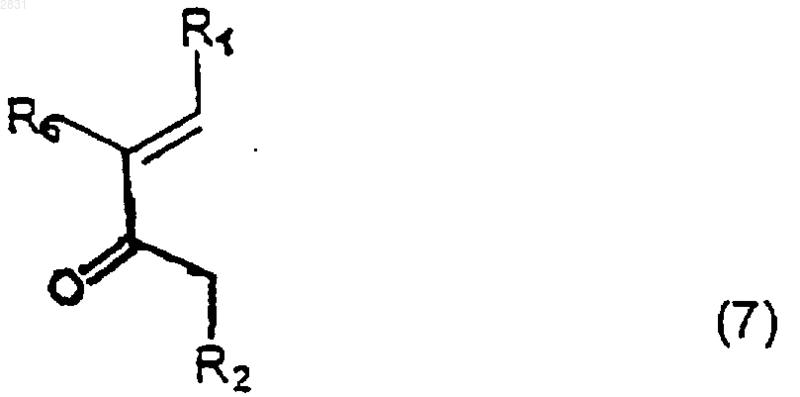
(где R1, R2, R6 такие, как определено выше)
с силилирующим агентом, как например триметилсилилтрифторметансульфоновым ангидридом (TMSOTf), и, наконец, гидролизуют, например, гидрокарбонатом натрия, получая конечное соединение формулы (I), где Х=О.
5. Способ по п.4, где возможное введение двойных связей в положение а или b осуществляют взаимодействием дихлордицианохинона (DDQ) с соответствующими силиловыми эфирами енолов или окислением ацетатом ртути насыщенного соединения, полученного, как заявлено выше, и возможное превращение группы Х проводят через соответствующие трифлаты (трифторметансульфонаты) енолов и последующее карбонилирование в присутствии диацетата палладия, трифенилфосфина и подходящего нуклеофильного реагента.
6. Способ по п.4, где взаимодействие между соединением (6) и силиловым простым эфиром (8) проводят в присутствии TiCl4.
7. Способ по п.4, где взаимодействие между соединением (6) и силиловым простым эфиром (8) проводят в присутствии TMSOTf.
8. Способ получения соединения формулы (I) по любому из пп.1-3, где
карбонильную группу соединения формулы (2)
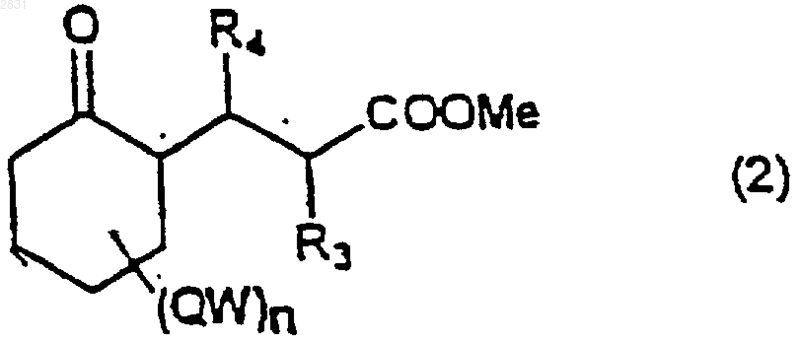
(где R3, R4, QW и n такие, как определено выше)
защищают в виде кеталя, получая соединение (9)
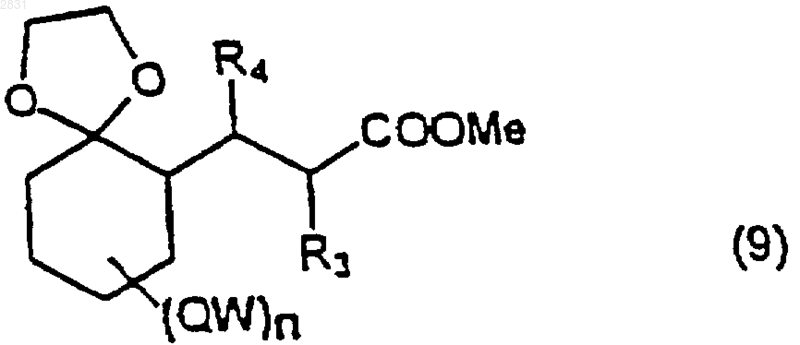
(где R3, R4, QW и n такие, как определено выше),
которое восстанавливают в соответствующий альдегид (10)
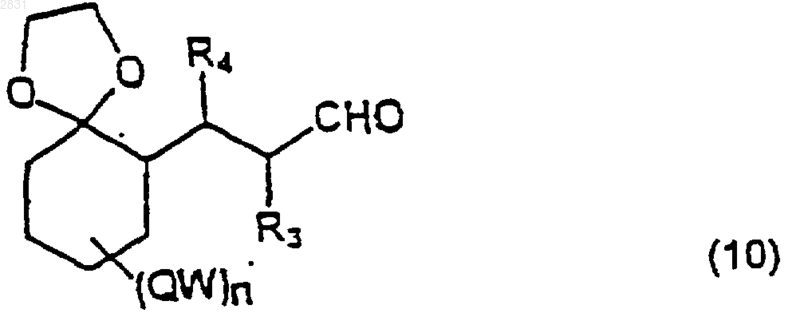
(где R3, R4, QW и n такие, ъръ определено выше)
при помощи DIBAL и такой альдегид превращают в оксим (11)
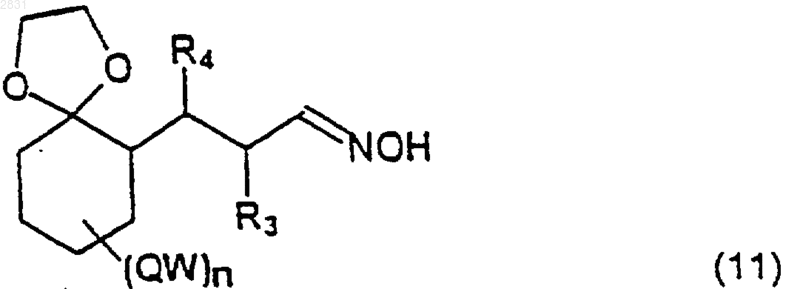
(где R3, R4, QW и n такие, как определено выше),
который подвергают взаимодействию с производным метиленциклопропана (12)

(где R1, R2, R6 такие, как определено выше), получая изоксазолин (13)
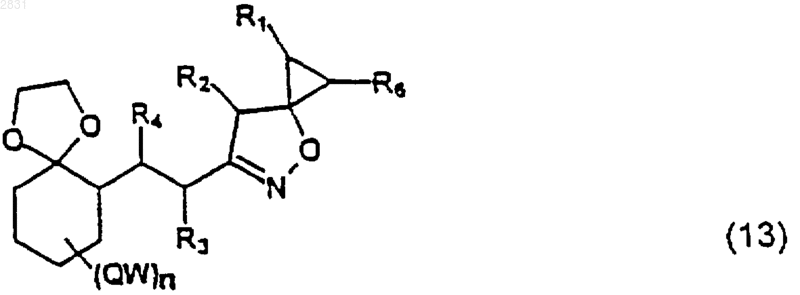
(где R1, R2, R3, R4, R6, QW и n такие, как определено выше),
который освобождают от защитной группы, превращая в соответствующий изоксазолин (14)

(где R1, R2, R3, R4, R6, QW и n такие, как определено выше),
который перегруппировывают в конечный продукт формулы (I), где Х=О, i или h представляет двойную связь и другие заместители такие, как определено выше.
9. Соединение формулы (6)
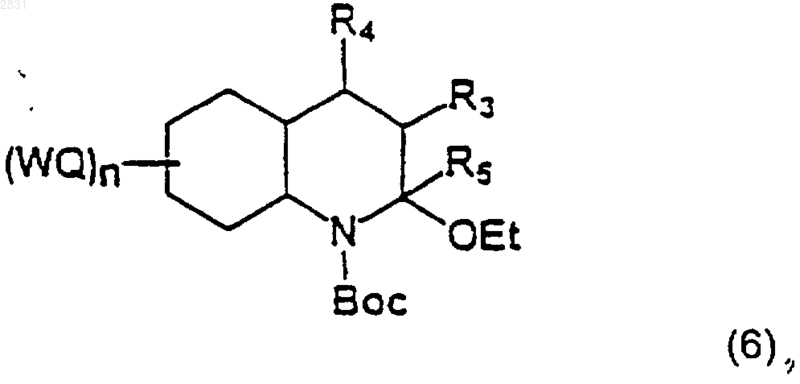
где W, Q, n, R3, R4, R5 такие, как определено в п.1.
10. Фармацевтическая композиция, где действующее начало представляет собой соединение формулы (I) по п.1 или смеси их в комбинации с подходящими фармацевтически приемлемыми наполнителями.
11. Применение фармацевтической композиции по п.10 для ингибирования изоферментов 5aR-I и/или 5aR-II.
12. Фармацевтическая композиция по п.10 в форме, подходящей для местного применения.
13. Способ лечения патологий, имеющих отношение к ферментам 5a-редуктазам, введением пациенту фармацевтически активного количества фармацевтической композиции по п.10.
14. Способ по п.13, где патологиями, которые лечат, являются угри, алопеция, рак предстательной железы и гипертрофия предстательной железы у мужчин и гирсутизм у женщин.
15. Применение соединений формулы (I) по п.1 в качестве ингибиторов ферментов, стероидных 5a-редуктаз, у растений.
16.Регулирующая рост растений агрохимическая композиция, содержащая в качестве действующего начала соединение формулы (I) по п.1 или его смесь, возможно в комбинации с добавками, обычно используемыми в сельском хозяйстве для этой цели.
17. Способ регулирования роста растений, где эффективное количество композиции по п.16 распределяют на семенах и/или на растениях, которые нужно обработать.
Текст
1 Данное изобретение относится к полностью и частично насыщенным производным бензо[с]хинолизина общей формулы (I), их фармацевтически приемлемым солям или сложным эфирам, способам их получения и содержащей их композиции для фармацевтического и сельскохозяйственного применения. Область изобретения Данное изобретение относится к производным бензо[с]хинолизина общей формулы (I)Q выбирают из группы, состоящей из одинарной (простой) связи, C1-8 алкила, С 2-8 алкенила, С 2-8 алкинила, циклоалкила, СО, CONR,NR, где R такой, как определено выше;W выбирают из группы, состоящей из Н,C1-8 алкила, С 2-8 алкенила, С 2-8 алкинила, циклоалкила, трифторметила, С 1-8 алкокси, С 1-8 алкоксиС 1-8 алкила, арилС 1-8 алкила, арила, арилокси,ариламино, С 1-8 алкилкарбонила, арилкарбонила,арилкарбоксила, арилкарбоксиамида, галогена,CN, NRR', С 1-8 алкиламино, гетероцикла, где группы алкил, алкенил, алкинил, циклоалкил,арил, гетероцикл могут быть замещены; n равно целому числу между 1 и 4; символозначает, что соответствующие связи а, b, с, d, e, f, g, h и i могут быть одинарной или двойной связью, при условии, что, когда b или f представляет собой двойную связь,то группа R5 отсутствует; их фармацевтически приемлемым солям или сложным эфирам, способам их получения и использования в качестве ингибиторов стероидных 5-редуктаз. Уровень техники Фермент, известный как стероидная 5 редуктаза (в дальнейшем обозначаемый как 5 редуктаза), представляет собой систему, образованную двумя изоферментами (тип I и тип II или 5R-I и 5R-II соответственно), которая превращает тестостерон в дигидротестостерон, 002831(5R-I) присутствует, в основном, в печени и коже, тогда как изофермент типа II (5R-II) присутствует, в основном, в ткани простаты и мужских половых органах и его активность играет существенную роль в процессе эмбрионального развития для дифференциации наружных половых органов. Продуцирование дигидротестостерона ассоциируется с некоторыми патологиями, которые широко распространены,как, например, доброкачественная гипертрофия предстательной железы, рак предстательной железы, алопеция и угри у мужчин и гирсутизм у женщин. Более конкретно, изофермент I играет роль в патологиях, относящихся к коже, тогда как изофермент II принимает участие в патологиях предстательной железы. В последние годы многие международные исследователи пытались выделить новые соединения, способные ингибировать фермент 5-редуктазу, для лечения вышеуказанных патологий, особенно, если возможно, действовать селективно только на один из двух изоферментов. Ингибиторы 5 редуктазы, а также изоферментов 5R-I и 5RII, были уже описаны [см., например, J. Med.Chem. 36, 4313-4315 (1993), J. Med. Chem. 37,3871-3874 (1994), J. Med. Chem. 40, 1112 (1997),J. Med. Chem. 40, 3466 (1997)], например финастерид с успехом использовали при лечении доброкачественной гипертрофии предстательной железы. В Европейских патентах ЕР-703221, ЕР 591582, ЕР-591583, ЕР-532190 и ЕР-531026 описываются бензохинолин-3-оны в качестве ингибиторов 5-редуктазы, тогда как в WO 94/21614 описываются замещенные производные 3 фенантридинона, имеющие такое же действие. В журнале Chemical Society, Perkin Transaction 1, vol. 3, 1979, pages 584-590, описывается бензо[с]хинолизин (см. соединение 8) без указания на какое-нибудь его применение. Следовательно, очевидна важность разработки новых соединений, способных ингибировать действие фермента 5-редуктазы и, в частности, способных действовать селективно на изофермент 5R-I, который, так сказать, ответственен за широко распространенные патологии, оказывающие большое влияние, как например, на алопецию у мужчин и гирсутизм у женщин. Следовательно, данное изобретение относится также к способу лечения патологий,имеющих отношение к ферментам 5 редуктазам, в частности, для лечения угрей,алопеции, рака предстательной железы и простатической гипертрофии у мужчин и гирсутизма у женщин. Кроме того, было также обнаружено, и это представляет собой другую цель данного изобретения, что соединение формулы 3 5-редуктазы, в растениях и, следовательно,может селективно регулировать рост растений в светлых и темных условиях. Соединения по данному изобретению можно использовать в качестве фитофармацевтических средств в сельском хозяйстве, позволяющих улучшать морфогенез и развитие коммерчески полезных растений, или в качестве гербицидов, способных ингибировать рост засоряющих посевы растений. Данные соединения можно, следовательно, использовать в сельскохозяйственных (агрохимических) композициях для регулирования роста растений, в частности, композициях, которые распределяют на семенах и/или растениях, которые нужно обработать. Подробное описание изобретения Данное изобретение относится к новым соединениям, способным ингибировать фермент 5-редуктазу, либо селективно в отношении одного из 5R-I и 5R-II, либо обоих этих изоферментов, которые можно использовать для лечения патологий, опосредованных этим ферментом, или для сельскохозяйственных применений в качестве регуляторов роста растений или гербицидов. Продукты по данному изобретению имеют общую формулу где заместители R1, R2, R3, R4, R5, R6, X, Q, W, n и символ такие, как определено выше. По данному изобретению группы С 1-8 алкил, С 2-8 алкенил и С 2-8 алкинил означают линейные или разветвленные алкильные радикалы,как например, метил, этил, пропил, изопропил,бутил, пентил, гексил, гептил, октил, этилен,пропен, бутен, изобутен, ацетилен, пропин, бутин и т.д. Циклоалкил означает циклопропан, циклобутан, циклопентан, циклогексан, циклогептан,циклооктан, норборнан, камфан, адамантан. Арил означает фенил, дифенил и нафтил. Гетероцикл означает, в частности, насыщенные или ароматические гетероциклы, содержащие один или несколько атомов N, более конкретно, пиридин, имидазол, пиррол, индол,триазолы, пирролидин, пиперидин. Фосфат означает анион моно-, ди- или трифосфорной кислоты. Галоген означает фтор, хлор, бром, иод. Заместители вышеуказанной группы W,предпочтительно, представляют собой галоген,OR, фенил, NRR', CN, COOR, CONRR', C1-8 алкил (где R и R' такие, как определено выше). Особенно предпочтительны по данному изобретению соединения формулы (I), гдеR5 представляет Н, C1-8 алкиларил, COOR,CN, арил, гетероцикл, C1-8 алкилгетероцикл или группа С 1-8 алкилгетероциклрибозофосфат; Х=О, СООН;R1, R2, R3, R4, R6 представляют Н, Me, CN,фенил, COOR, CONRR' (где R и R' такие, как определено выше). Среди фармацевтически приемлемых сложных эфиров и солей по данному изобретению можно указать следующие: гидрохлорид, сульфат, цитрат, формиат, фосфат. Предпочтительными соединениями по данному изобретению являются 2,3,4,4 а,5,6,6 а,7,8,9,10,10 а-додекагидро(1 Н)-бензо[с]хинолизин-3-он; 8-хлор-2,3,4,4 а,5,6,6 а,7,8,9,10,10 адодекагидро-(1 Н)-бензо[с]хинолизин-3-он; 2,3,4,4 а,5,6,6 а,7,8,9,10,10 а-додекагидро-8 метил-(1 Н)-бензо[с]хинолизин-3-он; 2,3,4,4 а,5,6,6 а,7,8,9,10,10 а-додекагидро-4 метил-(1 Н)-бензо[с]хинолизин-3-он; 2,3,4,4 а,5,6,6 а,7,8,9,10,10 а-додекагидро-1 метил-(1 Н)-бензо[с]хинолизин-3-он; 2,3,5,6,6 а,7,8,9,10,10 а-декагидро-(1 Н)бензо[с]хинолизин-3-он; 8-хлор-2,3,5,6,6 а,7,8,9,10,10 а-декагидро(1 Н)-бензо[с]хинолизин-3-он; 2,3,5,6,6 а,7,8,9,10,10 а-декагидро-8-метил(1 Н)-бензо[с]хинолизин-3-он; 2,3,5,6,6 а,7,8,9,10,10 а-декагидро-4-метил(1 Н)-бензо[с]хинолизин-3-он; 2,3,5,6,6 а,7,8,9,10,10 а-декагидро-1-метил(1 Н)-бензо[с]хинолизин-3-он; 5,6,6 а,7,8,9,10,10 а-октагидро-4-метил-(3 Н)бензо[с]хинолизин-3-он; 8-хлор-5,6,6 а,7,8,9,10,10 а-октагидро-4 метил-(3 Н)-бензо[с]хинолизин-3-он; 5,6,6 а,7,8,9,10,10 а-октагидро-4,8-диметил(3 Н)-бензо[с]хинолизин-3-он; 2,3,5,6,7,8,9,10-октагидро-(1 Н)бензо[с]хинолизин-3-он; 8-хлор-2,3,5,6,7,8,9,10-октагидро-(1 Н)бензо[с]хинолизин-3-он; 2,3,5,6,7,8,9,10-октагидро-8-метил-(1 Н)бензо[с]хинолизин-3-он; 2,3,5,6,6 а,7,8,9-октагидро-(1 Н)бензо[с]хинолизин-3-он; 8-хлор-2,3,5,6,6 а,7,8,9-октагидро-(1 Н)бензо[с]хинолизин-3-он; 2,3,5,6,6 а,7,8,9-октагидро-8-метил-(1 Н)бензо[с]хинолизин-3-он; 4 а-бензил-3,4,5,6,6 а,7,8,9,10,10 адекагидро-(4 аН)-бензо[с]хинолизин-3-он; 4 а-бензил-8-хлор-3,4,5,6,6 а,7,8,9,10,10 адекагидро-(4 аН)-бензо[с]хинолизин-3-он; 4 а-бензил-3,4,5,6,6 а,7,8,9,10,10 адекагидро-8-метил-(4 аН)-бензо[с]хинолизин-3 он; 4 а-бензил-3,4,5,6,6 а,7,8,9,10,10 адекагидро-4-метил-(4 аН)-бензо[с]хинолизин-3 он; 4 а-бензил-3,4,5,6,6 а,7,8,9,10,10 адекагидро-1-метил-(4 аН)-бензо[с]хинолизин-3 он; 3,4,5,6,6 а,7,8,9,10,10 а-декагидро-4 а-(4 пиридил)метил-(4 аН)-бензо[с]хинолизин-3-он; 8-хлор-3,4,5,6,6 а,7,8,9,10,10 а-декагидро-4 а(4-пиридил)-метил-(4 аН)-бензо[с]хинолизин-3 он; 3,4,5,6,6 а,7,8,9,10,10 а-декагидро-8-метил 4 а-(4-пиридил)-метил-(4 аН)-бензо[с]хинолизин 3-он; 3,4,5,6,6 а,7,8,9,10,10 а-декагидро-4-метил 4 а-(4-пиридил)-метил-(4 аН)-бензо[с]хинолизин 3-он; 3,4,5,6,6 а,7,8,9,10,10 а-декагидро-1-метил 4 а-(4-пиридил)-метил-(4 аН)-бензо[с]хинолизин 3-он. Додекагидробензо[с]хинолизин-3-оны и декагидробензо[с]хинолизин-3-оны по данному изобретению, у которых двойные связи i и h отсутствуют, можно получить, как показано на схеме 1, в соответствии с общим получением бензо[с]хинолизин-3-онов, уже описанным в патенте WO 97/29107, в частности, например,исходя из соединений формулы 2 где R3, R4, W, Q и n такие, как определено выше. Соединения 2 коммерчески доступны или их можно получить по известным методикам. 8 Как можно увидеть на схеме 1, получение соединений по данному изобретению включает в себя циклизацию сложного эфира 2 в енамид 3 нагреванием при 120 С соединений 2 в муравьиной кислоте в присутствии гидрокарбоната аммония. Енамид 3 восстанавливают в трансконденсированный амид 4, например цианоборогидридом натрия при рН 4, с последующей защитой амидогруппы защитной группой, например трет-бутоксикарбонилом (трет-Вос),получая соединение 5; соединение 5 восстанавливают в соединение 6, например (когда R5 представляет Н) борогидридом натрия в этаноле(рН 4), особенно хорошие выходы получают,когда восстановление проводят при помощиLiЕt3 ВН в ТГФ при -78 С с последующим добавлением 2N раствора НСl в безводном этаноле вплоть до рН 4. Полученное таким образом соединение 6 после этого подвергают взаимодействию с силилоксидиеном 8, полученным "insitu", исходя из винилкетонов 7 (где R1, R2 и R6 такие, как определено выше) и силилирующего агента, как, например, триметилсилилтрифторметансульфонового ангидрида (TMSOTf), и затем гидролизуют, например, гидрокарбонатом натрия, получая соединения формулы (I), где Х=O. Возможное введение двойных связей и превращение группы Х в одну из других групп,указанных выше, можно легко провести по известным методикам, исходя из соответствующего соединения формулы (I), полученного, как указано. Например, введение двойных связей в положение а и/или b можно осуществить взаимодействием дихлордицианохинона (DDQ) с соответствующими силиловыми эфирами енолов или окислением ацетатом ртути (II) соответствующего насыщенного соединения, полученного, как описано выше. В соответствии с другим вариантом данного изобретения двойную связь в положении "а" можно получить непосредственно проведением взаимодействия между продуктами 6 и 8 (где R1 представляет ОСН 3 и R2 и R6 представляют Н) в присутствии TiCl4 или TMSOTf в качестве кислот Льюиса (продукт 8, как определено выше,является в этом случае коммерчески доступным продуктом). Действуя этим путем, можно также управлять стереохимическим положением атома водорода в положении 4a (R5=Н) конечного соединения. В частности, при использовании TiCl4 получают соединение, у которого вышеуказанный атом водорода находится на одной стороне с водородом в положении 10 а, тогда как при использовании TMSOTf вышеуказанный атом водорода находится на противоположной стороне относительно водорода в положении 10 а. Превращение группы Х можно проводить через образование соответствующих трифлатов(трифторметансульфонатов) енолов и их карбонилирование в присутствии диацетата палладия,трифенилфосфина и подходящего нуклеофильного реагента (спирт, амин, нитрогруппа). 9 Соединения по данному изобретению, где присутствуют двойные связи i или h и b, можно получить, как показано на схеме 2, например, исходя из вышеуказанных соединений формулы 2. Ключевой стадией данного способа является термическая перегруппировка-циклизация изоксазолин-5-спироциклопропана 14 в конечный продукт 1. Этот способ уже применяли для синтеза других полициклических соединений с головным мостиковым атомом азота, как описано в J. Org. Chem., 1988, 53, 2426 и в J. Med.Chem., 1997, 40, 1112. Как можно увидеть из схемы 2, получение соединений по данному изобретению включает в себя защиту карбонила соединения 2 (где R3 и R4 такие,как определено выше) в виде кеталя, например этиленгликолятом при кислотном катализе, с последующим восстановлением группы сложного эфира в соединении 9 в альдегид 10, например с помощьюDIBAL при -78 С. За превращением альдегида 10 в оксим 11, проведенным, например, взаимодействием с гидрохлоридом гидроксиламина в пиридине,следует циклоприсоединение к метиленциклопропану 12 (где R1, R2, R6 такие, как определено выше) оксида нитрила, генерированного "in situ" взаимодействием оксима 11 с гипохлоритом натрия и триэтиламином. Изоксазолин-5-спироциклопропан 13 затем освобождают от защитной группы при кислотном катализе и подвергают термической перегруппировке в кипящем ДМФ в течение 3-6 ч, получая соединения 1. Октагидробензо[с]хинолизин-3-оны формулы 1, где R1, R2, R3, R4, R6 представляют Н,QW представляет Н или -CH2CONH-трет-Вu (в положении 8), n=1 и присутствуют обе двойные связи b и h (или i), можно получить, например,исходя из соединения 2, где R3, R4 представляют Н и QW представляет Н или 5-(N-третбутил)ацетамидо и n=1. Пример 1. Получение метил-3-[2-(1,3-диоксолан-2 ил)циклогексил]пропаноата [соединение 9, где(QW)n=Н, R3=R4=Н]. В колбе, снабженной устройством ДинаСтарка, метиловый сложный эфир 2 (20,0 г, 109 ммоль), этиленгликоль (60 мл, 1,08 моль) и пТsОН (0,8 г, 5 ммоль) растворяют в толуоле (550 мл), и получаемый раствор нагревают при кипячении с обратным холодильником. Через 4 ч реакция завершается и смесь промывают 2NNaHCO3, водой и сушат над Na2SO4. После фильтрования и выпаривания растворителя получат сырое желтое масло. Это масло очищают перегонкой при пониженном давлении, получая чистый 9 [15,9 г, 64%, т.кип. 127-130 С (2 мбар)]. Пример 2. Получение 3-[2-(1,3-диоксолан-2-ил)циклогексил]пропаналя [соединение 10, где 10 медленно добавляют DIBAL-H (1,2 М раствор в толуоле, 116 мл, 135 ммоль). После 3 ч перемешивания смесь выливают в воду (110 мл) и оставляют для нагревания до комнатной температуры. После фильтрования через слой целита органическую фазу сушат над Na2SO4. После фильтрования и выпаривания растворителя остаточное сырое масло очищают хроматографией(петролейный эфир-EtOAc, 2:1, Rf 0,30), получая чистый альдегид 10 в виде масла (6,6 г, 48%). Пример 3. Получение оксима 3-[2-(1,3-диоксолан-2 ил)циклогексил]пропаналя [соединение 11, гдеNH2OH.HCl (2,76 г, 40,0 ммоль) в пиридине (120 мл) перемешивают в течение 2 ч при комнатной температуре. Эту смесь экстрагируют Et2O, и органический слой промывают водой и сушат над Na2SO4. После фильтрования и выпаривания растворителя полученное сырое масло очищают хроматографией (петролейный эфир-EtOAc,1,5:1, Rf 0,5). Перекристаллизация из смеси Еt2O-петролейный эфир дает чистый оксим 11CH2Cl2 (35 мл), охлажденный при -60 С. Смеси дают нагреться до 0 С и медленно добавляют в течение 3,5 ч NaClO (8% раствор, 54 мл). Раствор перемешивают в течение 21 ч, затем фазы разделяют, водный слой экстрагируют СН 2 Сl2(3 х 25 мл) и объединенные органические слои сушат над Na2SO4. После фильтрования и испарения растворителя получают сырой продукт 13(4,89 г, 73%), его используют без очистки в следующей реакции. Пример 5. Получение 6-[2-(2-оксоциклогексил)этил]4-окса-5-азаспиро-[2,4]гепт-5-ена [соединение 14, где (QW)n=H, R1=R2=R3=R4=R6=Н]. Изоксазолин 13 (3,64 г, 13,7 ммоль) и пTsOH (392 мг, 2,23 ммоль) растворяют в ацетоне(90 мл) и воде (30 мл), и получаемый раствор перемешивают при комнатной температуре в течение 7 дней. Продукт экстрагируют СН 2 Сl2,органическую фазу промывают NaHCO3 (2N) и сушат над Na2SO4. После фильтрования и выпаривания растворителя получают желтое сырое масло (2,36 г). Это масло очищают сначала хроматографией (CH2Cl2-EtOAc, 12,5:1, Rf 0,35) и затем перекристаллизацией из смеси Еt2Oпетролейный эфир, получая чистый изоксазолин 14 (1,43 г, 47%, т.пл. 109 С).(QW)n=Н, R1=R2=R3=R4=R6=Н и h=двойная связь] и 2,3,5,6,6 а,7,8,9-октагидро-(3 Н)-бензо[с] хинолизин-3-она [соединение 1, где (QW)n=Н,R1=R2=R3=R4=R6=Н и i=двойная связь]. Изоксазолин 14 (476 мг, 2,15 ммоль), растворенный в сухом ДМФ (50 мл), нагревают при кипячении с обратным холодильником в течение 3 ч. После отгонки растворителя получают желтое сырое масло (470 мг), содержащее смесь продуктов перегруппировки. Это масло очищают хроматографией (CH2Cl2-MeOH, 20:1), получая сырой 1 (163 мг, 37%, Rf 0,36, масло) в виде смеси 10:1 двух изомеров, имеющих двойную связь в положении h или i соответственно. Пример 7. Получение метил-3-2-(1,3-диоксолан-2 ил)-5-(N-трет-бутил)ацетамидо]циклогексил] пропаноата [соединение 9, где (QW)=5-(N-третбутил)ацетамидо, n=1, R3=R4=Н]. Получение проводят, как в примере 1. Исходя из соединения 2 [где (QW)=5-(N-третбутил)ацетамидо, n=1, R3=R4=Н] (32,14 г, 108 ммоль), сырой кеталь 9 (22,2 г, 60%) получают в виде масла. Часть (100 мг) этого сырого масла очищают хроматографией (CH2Cl2-MeOH, 30:1,1% Et3N, Rf 0,31, масло), получая 9 в виде смеси цис- и транс-изомеров. Пример 8. Получение оксима 3-2-(1,3-диоксолан-2 ил)-5-(N-трет-бутил)ацетамидо]циклогексил] пропаналя [соединение 11, где (QW)=5-(N-третбутил)ацетамидо, n=1, R3=R4=Н]. Раствор кеталя [соединение 9, где (QW)=5(N-трет-бутил)ацетамидо, n=1, R3=R4=Н] (22,1 г,64,7 ммоль) в толуоле (500 мл) охлаждают при-78 С; затем медленно добавляют в течение 4 чDIBAL-H (1M раствор в толуоле, 288 мл), и получаемый раствор перемешивают в течение 3 ч. После добавления воды (260 мл) смеси дают нагреться до комнатной температуры, экстрагируют СН 2 Сl2 (4 х 200 мл) и органический слой сушат над Na2SO4. После фильтрования и выпаривания растворителя получают сырое масло(17,2 г), которое используют без очистки для следующей стадии. Затем при перемешивании к раствору перегнанного оксалилхлорида (10,9 мл, 125 ммоль) в СН 2 Сl2 (270 мл), охлажденному при-60 С, добавляют ДМСО (15 мл, 211 ммоль) с последующим медленным добавлением (25 мин) раствора вышеуказанного сырого масла в СН 2 Сl2 (260 мл). Через 15 мин в течение 15 мин медленно добавляют Et3N (56 мл). После 5 мин перемешивания смесь нагревают до комнатной температуры и промывают водой (535 мл); после разделения фаз водную фазу экстрагируют СН 2 Сl2 (3 х 250 мл) и объединенные органические слои сушат над Na2SO4. После фильтрова 002831 12 ния и выпаривания растворителя альдегид [соединение 10, где (QW)=5-(N-трет-бутил) ацетамидо, n=1, R3=R4=Н] получают в виде сырого масла (14,6 г), используемого в следующей реакции без очистки. Раствор этого альдегида (14,6 г) в пиридине (210 мл) добавляют к раствору NH2OH.HCl(13,7 г, 196,9 ммоль) в пиридине (107 мл) и получаемую смесь перемешивают при комнатной температуре в течение 20 ч. Смесь выливают в СН 2 Сl2 (800 мл) и промывают водой; после разделения фаз водную фазу экстрагируют СН 2 Сl2(3 х 200 мл) и объединенные органические слои сушат над Na2SO4. После фильтрования и выпаривания растворителя получают сырой оксим(QW)=5-(N-третбутил)ацетамидо, n=1, R3=R4=Н] (11,3 г). Этот оксим очищают хроматографией, элюируя СНСl3-МеОН, 50:1, 1% Et3N, и затем СНСl3 МеОН, 3:1, 1% Et3N (Rf 0,32), получая чистый оксим [соединение 11, где (QW)=5-(N-третбутил)ацетамидо, n=1, R3=R4=Н] (7,41 г, 35%,масло) в виде смеси 1:1 E/Z-диастереоизомеров. Пример 9. Получение 6-[2-[2-(1,3-диоксолан-2-ил)-5(N-трет-бутил)ацетамидо]циклогексил]этил-4 окса-5-азаспиро[2,4]гепт-5-ена [соединение 13,где (QW)=5-(N-трет-бутил)ацетамидо, n=1,R1=R2=R3=R4=R6=Н]. Получение проводят, как в примере 4. Исходя из вышеполученного оксима [соединение 11, гдеR3=R4=R6=H] (4,96 г, 58%) получают в виде сырого масла, используемого в следующей реакции без очистки. Пример 10. Получение 6-[2-[2-оксо-5-[(N-трет-бутил) ацетамидо]циклогексил]этил]-4-окса-5-азаспиро[2,4]-гепт-5-ена [соединение 14, где (QW)=5-(Nтрет-бутил)ацетамидо, n=1, R1=R2=R3=R4= R6=Н]. Сырой изоксазолин 13 [где (QW)=5-(Nтрет-бутил)ацетамидо, n=1, R1=R2=R3=R4=R6=Н](4,92 г, 13,1 ммоль) растворяют в ацетоне (150 мл) и к раствору медленно добавляют при комнатной температуре и энергичном перемешивании Н 2SO4 (1,7 М раствор в ацетоне, 9,8 мл). После завершения реакции добавляют Nа 2 СО 3 вплоть до рН 7; после фильтрования и выпаривания растворителя получают сырой продукт 14. Этот продукт очищают хроматографией,элюируя CH2Cl2-MeOH, 60:1 и затем 20:1 (Rf 0,28), получая чистый продукт 14 в виде масла(QW)=5-(N-трет-бутил)ацетамидо,n=1,R1=R2=R3=R4=R6=Н] (947 мг, 2,83 ммоль) в ДМФ (109 мл) нагревают при кипячении с обратным холодильником в течение 3 ч. После перегонки растворителя при пониженном давлении получают сырое масло, содержащее смесь продуктов перегруппировки. Хроматографическое разделение (CH2Cl2-MeOH, 25:1,1% NН 3) дает чистый продукт 1 (161 мг, 18%, Rf 0,32, масло) в виде смеси двух изомеров, имеющих двойную связь в положении h или i соответственно. Пример 12. Получение(+/-)-транс-Конденсированный N-Boc-амид 5 [где (QW)n=Н, R3=R4=Н], полученный известными способами, восстанавливают в соединение 6 [где (QW)n=Н, R3=R4=Н] по следующей методике: раствор 5 (4,1 ммоль в 12 мл ТГФ) охлаждают до -78 С и к нему медленно добавляют 1 М раствор LiEt3BH в ТГФ (8,2 мл). После перемешивания 15 мин при -78 С по каплям добавляют 2N НСl в безводном EtOH до тех пор, пока не будет достигнуто значение рН 3,5-4, с последующим немедленным добавлением 18 мл этанола. Смесь оставляют для нагревания до 0 С и через 30 мин разбавляют СН 2 Сl2. После обычной обработки продукт очищают колоночной флэш-хроматографией и получают с выходом 80% в виде липкого масла. К раствору соединения 6 [где (QW)n=Н,R3=R4=Н] (500 мг, 1,76 ммоль в 10 мл СН 2 Сl2) при 0 С по каплям добавляют 1-метокси-3 триметилсилилокси-1,3-бутадиен [соединение 8,где R1=МеО, R2=Н, R6=Н] (608 мг, 3,53 ммоль),NEt3 (0,5 мл, 3,53 ммоль) и TMSOTf (4,4 ммоль,0,85 мл), смесь оставляют для нагревания до комнатной температуры при перемешивании в течение 30 мин. Затем смесь обрабатывают NaHCO3 (насыщенный) в течение 24 мин при перемешивании. Обычная обработка и очистка колоночной флэш-хроматографией дает изомер 4a(+/-)(4 а, 6 а, 10 а)-3,4,5,6,6 а,7,8,9,10,10 адекагидро-(4 аН)-бензо[с]хинолизин-3-онTiCl4 (0,155 мг, 2 М раствор в CH2Cl2) смесь оставляют для нагревания до комнатной температуры при перемешивании в течение 1 ч. Затем смесь обрабатывают NаНСО 3 (насыщенный) в течение 30 мин при перемешивании. Обычная обработка и очистка колоночной флэшхроматографией дает изомер 4 а (+/-)(4 а, 6 а,10 а)-3,4,5,6,6 а,7,8,9,10,10 а-декагидро-(4 аН)бензо[с]хинолизин-3-она [соединение 1, где(QW)n=H, R1=R2=R3=R4=R6=Н и а=двойная связь] в виде масла с выходом 16%. Испытание на активность. Ингибирующую активность полученных соединений в отношении изоферментов 1 и 2 5-редуктазы определяли с использованием клеточных систем (например, клеток СНО),экспрессирующих изоферменты 2 и 1 человека. Образцы инкубируют в присутствии тестостерона, меченого тритрием, и затем измеряют количество меченого дигидротестостерона, образованного в отсутствие и в присутствии ингибитора. Соединения обнаруживали высокую ингибирующую активность для фермента 5 редуктазы (особенно изофермента 1) с ингибированием более чем 50% при концентрации 10100 нМ. Например, смесь 10:1 2,3,5,6,7,8,9,10 октагидро-(1 Н)-бензо[с]хинолизин-3-онаh=двойная связь] и 2,3,5,6,6 а,7,8,9-октагидро(3 Н)-бензо[с]хинолизин-3-она [соединение 1,где (QW)n=H, R1=R2=R3=R4=R6=H и i=двойная связь], полученная в соответствии с примером 6,была селективным ингибитором для изофермента типа 1, имея величину IC50 58 нМ, тогда как величина IC50 для изофермента типа 2 не поддавалась определению. Для терапевтического введения соединения по данному изобретению получают в форме фармацевтических композиций, содержащих активное начало и органические или неорганические наполнители, пригодные для перорального, парентерального или местного введения композиций. Фармацевтические композиции могут, следовательно, быть в твердой форме(драже, суппозитории, кремы, мази), жидкой форме (растворы, суспензии, эмульсии) и могут возможно содержать стабилизаторы, консерванты, увлажнители, эмульгатор, буферы или соли,используемые для уравновешивания осмотического давления, которые обычно используют в данной области. Введение соединений обычно 15 проводят в соответствии со способами воздействия и количествами, применяемыми для известных агентов, используемых для таких же целей, и с учетом возраста и состояния пациентов. Схема 1. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Полностью или частично восстановленные соединения ряда бензо[с]хинолизина формулы (I) где R1, R2, R3, R4, R6, одинаковые или различные, выбирают из группы, состоящей из Н, C1-8 алкила, С 2-8 алкенила, С 2-8 алкинила, циклопропана, циклобутана, циклопентана, циклогексана,циклогептана, циклооктана, норборнана, камфана, адамантана, фенила, бифенила, нафтила,насыщенного или ароматического гетероцикла,содержащего один или несколько атомов N, галогена, CN, азида NRR', C1-8 алкиламино, ариламино, C1-8 алкилокси, арилокси, COOR, CONRR',C(=O)R, где R и R', одинаковые или различные,выбирают из группы, состоящей из Н, С 1-8 алкила, циклопропана, циклобутана, циклопентана,циклогексана, циклогептана, циклооктана, норборнана, камфана, адамантана, фенила, бифенила, нафтила, насыщенного или ароматическогоR5 выбирают из группы, состоящей из Н,С 1-8 алкила,C1-8 алкилфенила,-бифенила,-нафтила, COOR, CN, фенила, бифенила, нафтила, насыщенного или ароматического гетероцикла, содержащего один или несколько атомовN, насыщенного или ароматического С 1-8 алкилгетероцикла, содержащего один или несколько атомов N, насыщенный или ароматический C1-8 алкилгетероцикл, содержащий один или несколько атомов N-рибозофосфата; Х выбирают из группы, состоящей из О,C(=О)R, COOR, NO2, CONR'R, где R и R' такие,как определено выше;Q выбирают из группы, состоящей из простой связи, C1-8 алкила, С 2-8 алкенила, С 2-8 алкинила, циклопропана, циклобутана, циклопентана, циклогексана, циклогептана, циклооктана,норборнана, камфана, адамантана, СО, CONR,NR, где R такой, как определено выше;W выбирают из группы, состоящей из Н,С 1-8 алкила, С 2-8 алкенила, С 2-8 алкинила, циклопропана, циклобутана, циклопентана, циклогексана, циклогептана, циклооктана, норборнана,камфана, адамантана, трифторметила, C1-8 алкокси, С 1-8 алкокси-С 1-8 алкила, фенил-, бифенил-, нафтил-С 1-8 алкила, фенила, бифенила,нафтила, фенилокси, бифенилокси, нафтилокси,фениламино, бифениламино, нафтиламино, С 1-8 алкилкарбонила, фенилкарбонила, бифенилкарбонила, нафтилкарбонила, фенилкарбоксила,бифенилкарбоксила, нафтилкарбоксила, фенилкарбоксиамида, бифенилкарбоксиамида, нафтилкарбоксиамида, галогена, CN, NRR', C1-8 алкиламино, насыщенного или ароматического гетероцикла, содержащего один или несколько атомов N, где группы алкил, алкенил, алкинил,циклопропан, циклобутан, циклопентан, циклогексан, циклогептан, циклооктан, норборнан,камфан, адамантан, фенил, бифенил, нафтил,насыщенный или ароматический гетероцикл,содержащий один или несколько атомов N, могут быть замещены; n равно целому числу между 1 и 4; символoзначает, что соответствующие связи а, b, с, d, e, f, g, h и i могут быть одинарной или двойной связью, при условии, что, когда b или f представляет собой двойную связь,то группа R5 отсутствует; их фармацевтически приемлемые соли или сложные эфиры. 2. Соединения ряда бензо[с]хинолизина формулы (1) по п.1, где R5 представляет Н, С 1-8 алкилфенил, -бифенил, -нафтил, COOR, CN,фенил, бифенил, нафтил, насыщенный или ароматический гетероцикл, содержащий один или несколько атомов N, насыщенный или ароматический C1-8 алкилгетероцикл, содержащий один или несколько атомов N; или группа насыщенного или ароматического С 1-8 алкилгетероцикла, 17 содержащего один или несколько атомов Nрибозофосфата; Х=О, СОOH; 5,6,6 а,7,8,9,10,10 а-октагидро-4,8-диметил(3 Н)-бензо[с]хинолизин-3-он; 2,3,5,6,7,8,9,10-октагидро-(1 Н)бензо[с]хинолизин-3-он; 8-хлор-2,3,5,6,7,8,9,10-октагидро-(1 Н)бензо[с]хинолизин-3-он; 2,3,5,6,7,8,9,10-октагидро-8-метил-(1 Н)бензо[с]хинолизин-3-он; 2,3,5,6,6 а,7,8,9-октагидро-(1 Н)бензо[с]хинолизин-3-он; 8-хлор-2,3,5,6,6 а,7,8,9-октагидро-(1 Н)бензо[с]хинолизин-3-он; 2,3,5,6,6 а,7,8,9-октагидро-8-метил-(1 Н)бензо[с]хинолизин-3-он; 4 а-бензил-3,4,5,6,6 а,7,8,9,10,10 адекагидро-(4 аН)-бензо[с]хинолизин-3-он; 4 а-бензил-8-хлор-3,4,5,6,6 а,7,8,9,10,10 адекагидро-(4 аН)-бензо[с]хинолизин-3-он; 4 а-бензил-3,4,5,6,6 а,7,8,9,10,10 адекагидро-8-метил-(4 аН)-бензо[с]хинолизин-3 он; 4 а-бензил-3,4,5,6,6 а,7,8,9,10,10 адекагидро-4-метил-(4 аН)-бензо[с]хинолизин-3 он; 4 а-бензил-3,4,5,6,6 а,7,8,9,10,10 адекагидро-1-метил-(4 аН)-бензо[с]хинолизин-3 он; 3,4,5,6,6 а,7,8,9,10,10 а-декагидро-4 а-(4 пиридил)метил-(4 аН)-бензо[с]хинолизин-3-он; 8-хлор-3,4,5,6,6 а,7,8,9,10,10 а-декагидро-4 а(4-пиридил)-метил-(4 аН)-бензо[с]хинолизин-3 он; 3,4,5,6,6 а,7,8,9,10,10 а-декагидро-8-метил 4 а-(4-пиридил)метил-(4 аН)-бензо[с]хинолизин 3-он; 3,4,5,6,6 а,7,8,9,10,10 а-декагидро-4-метил 4 а-(4-пиридил)метил-(4 аН)-бензо[с]хинолизин 3-он; 3,4,5,6,6 а,7,8,9,10,10 а-декагидро-1-метил 4 а-(4-пиридил)метил-(4 аН)-бензо[с]хинолизин 3-он. 4. Способ получения соединений по любому из пп.1-3, где группу сложного эфира соединения формулы (2)(где R3, R4 и (WQ)n такие, как определено в п.1),который защищают защитной группой Воc, получая соединение (5)(где R3, R4, R5 и (WQ)n такие, как определено в п.1) и соединение (6) подвергают взаимодействию с силиловым простым эфиром формулы (8)(где R3, R4, QW и n такие, как определено выше) при помощи DIBAL и такой альдегид превращают в оксим (11)(где R1, R2, R6 такие, как определено выше) с силилирующим агентом, как например триметилсилилтрифторметансульфоновым ангидридом (TMSOTf), и, наконец, гидролизуют, например, гидрокарбонатом натрия, получая конечное соединение формулы (I), где Х=О. 5. Способ по п.4, где возможное введение двойных связей в положение а или b осуществляют взаимодействием дихлордицианохинона(DDQ) с соответствующими силиловыми эфирами енолов или окислением ацетатом ртути насыщенного соединения, полученного, как заявлено выше, и возможное превращение группы Х проводят через соответствующие трифлаты(трифторметансульфонаты) енолов и последующее карбонилирование в присутствии диацетата палладия, трифенилфосфина и подходящего нуклеофильного реагента. 6. Способ по п.4, где взаимодействие между соединением (6) и силиловым простым эфиром (8) проводят в присутствии TiCl4. 7. Способ по п.4, где взаимодействие между соединением (6) и силиловым простым эфиром (8) проводят в присутствии TMSOTf. 8. Способ получения соединения формулы(I) по любому из пп.1-3, где карбонильную группу соединения формулы (2)(где R1, R2, R3, R4, R6, QW и n такие, как определено выше),который освобождают от защитной группы,превращая в соответствующий изоксазолин (14)(где R1, R2, R3, R4, R6, QW и n такие, как определено выше),который перегруппировывают в конечный продукт формулы (I), где Х=О, i или h представляет двойную связь и другие заместители такие, как определено выше. 9. Соединение формулы (6) где W, Q, n, R3, R4, R5 такие, как определено в п.1. 10. Фармацевтическая композиция, где действующее начало представляет собой соединение формулы (I) по п.1 или смеси их в комбинации с подходящими фармацевтически приемлемыми наполнителями. 11. Применение фармацевтической композиции по п.10 для ингибирования изоферментов 5R-I и/или 5R-II. 12. Фармацевтическая композиция по п.10 в форме, подходящей для местного применения. 13. Способ лечения патологий, имеющих отношение к ферментам 5-редуктазам, введением пациенту фармацевтически активного ко 24 личества фармацевтической композиции по п.10. 14. Способ по п.13, где патологиями, которые лечат, являются угри, алопеция, рак предстательной железы и гипертрофия предстательной железы у мужчин и гирсутизм у женщин. 15. Применение соединений формулы (I) по п.1 в качестве ингибиторов ферментов, стероидных 5-редуктаз, у растений. 16. Регулирующая рост растений агрохимическая композиция, содержащая в качестве действующего начала соединение формулы (I) по п.1 или его смесь, возможно в комбинации с добавками, обычно используемыми в сельском хозяйстве для этой цели. 17. Способ регулирования роста растений,где эффективное количество композиции по п.16 распределяют на семенах и/или на растениях, которые нужно обработать.
МПК / Метки
МПК: C07D 455/04, A01N 43/90, A61K 31/4375, A61P 5/00
Метки: ингибиторов, редуктаз, производные, 5&alpha, применение, качестве, бензо[c]хинолизина
Код ссылки
<a href="https://eas.patents.su/13-2831-proizvodnye-benzochinolizina-i-ih-primenenie-v-kachestve-ingibitorov-5alpha-reduktaz.html" rel="bookmark" title="База патентов Евразийского Союза">Производные бензо[c]хинолизина и их применение в качестве ингибиторов 5&alpha- редуктаз</a>
Предыдущий патент: Фармацевтический препарат на основе силденафила
Следующий патент: Способ и раствор для бурения или эксплуатации скважины, способ предотвращения поглощения раствора
Случайный патент: Способы и композиции для лечения или предупреждения туберкулеза












