Способ получения амидов
Номер патента: 13638
Опубликовано: 30.06.2010
Авторы: Тоблер Ханс, Зайферт Готтфрид, Эренфройнд Йозеф, Боннет Пол, Джоунз Ян, Целлер Мартин, Шах Шаилеш С., Жиордано Фанни, Вальтер Харальд, Корси Камилла, Джордж Нэйл
Формула / Реферат
1. Способ получения соединения формулы (I)
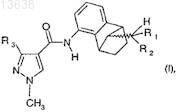
где R1и R2, каждый независимо друг от друга, означают водород или C1-C5-алкил и R3 означает CF3или CF2H,
который включает в себя:
(a) взаимодействие соединения формулы (II)
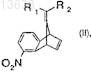
где R1и R2 имеют значения, которые определены для формулы (I),
по меньшей мере с одним восстановителем с образованием соединения формулы (III)
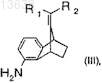
где R1и R2 имеют значения, которые определены для формулы (I); и
(b) взаимодействие полученного соединения по меньшей мере с одним восстановителем с образованием соединения формулы (IV), где восстановителем, используемым на стадии (b), является водород в присутствии родиевого катализатора
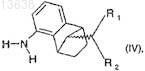
где R1и R2 имеют значения, которые определены для формулы (I); и
(с) превращение полученного соединения в соединение формулы (I) в результате взаимодействия с соединением формулы (V)

где Q означает хлор, фтор, бром, йод, гидроксигруппу или C1-C6-алкоксигруппу и R3 имеет значение, определенное для формулы (I).
2. Способ по п.1, в котором в соединении формулы (I) R1 и R2означают метил и R3 означает CF2H.
3. Способ по п.1, в котором на технологической стадии (с) соединение формулы (IV) подвергают взаимодействию с соединением формулы (V), где Q означает хлор, фтор или бром и R3 имеет значение, определенное для формулы (I).
4. Способ по п.1, в котором на технологической стадии (с) соединение формулы (IV) подвергают взаимодействию с соединением формулы (V), где Q означает хлор, бром, йод или гидроксигруппу и R3имеет значение, определенное для формулы (I).
5. Способ по п.4, в котором на технологической стадии (a) используют один восстановитель.
6. Способ по п.4, в котором соединение формулы (III), полученное на технологической стадии (a), подвергают взаимодействию с образованием соединения формулы (IV) непосредственно без выделения промежуточного продукта.
7. Способ по п.4, в котором на технологической стадии (с) соединение формулы (IV) подвергают взаимодействию с соединением формулы (V), где Q означает гидроксигруппу и R3 имеет значение, определенное для формулы (I).
8. Способ по п.4, в котором в соединении формулы (I) R1 и R2означают метил и R3 означает CF2H.
9. Способ по п.4, в котором на технологической стадии (b) в качестве восстановителя используют водород в присутствии родиевого катализатора, и соединение формулы (III)
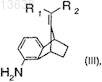
где R1и R2 имеют значения, которые определены для формулы (I),
подвергают взаимодействию с образованием соединения формулы (IV)
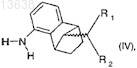
где R1и R2 имеют значения, которые определены для формулы (I),
в которой отношение соединения формулы (IVa, син)
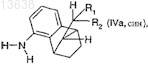
где R1и R2 имеют значения, которые определены для формулы (I),
к соединению формулы (IVb, анти)
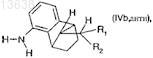
где R1и R2 имеют значения, которые определены для формулы (I),
составляет более 90:10.
10. Соединение формулы (IV)

где R1и R2 имеют значения, которые определены для формулы (I) в п.1,
в которой отношение соединения формулы (IVa, син)
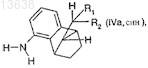
где R1и R2 имеют значения, которые определены для формулы (I) по п.1,
к соединению формулы (IVb, анти)
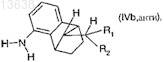
где R1и R2 имеют значения, которые определены для формулы 1 в п.1,
составляет от 90:10 до 99:1.
11. Применение для получения соединения формулы (I) по п.1 соединения формулы (IV)
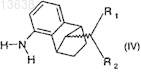
где R1и R2 имеют значения, которые определены для формулы (I) в п.1,
в которой отношение соединения формулы (IVa, син)
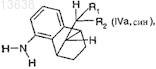
где R1и R2 имеют значения, которые определены для формулы (I) в п.1,
к соединению формулы (IVb, анти)
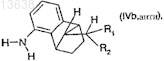
где R1и R2 имеют значения, которые определены для формулы (I) в п.1,
составляет от 90:10 до 99:1.
12. Способ получения соединения формулы (IV)
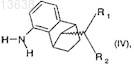
где R1и R2, каждый независимо, означают водород или C1-C5-алкил,
который включает в себя:
(a) взаимодействие соединения формулы (II)

где R1и R2 имеют значения, которые определены для формулы (IV),
по меньшей мере с одним восстановителем с образованием соединения формулы (III)
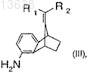
где R1и R2 имеют значения, которые определены для формулы (IV); и
(b) превращение полученного соединения с использованием по меньшей мере одного восстановителя в соединение формулы (IV), где восстановителем, используемым на стадии (b), является водород в присутствии родиевого катализатора.
13. Способ получения соединения формулы (I) по п.1
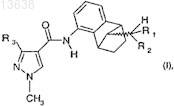
где R1и R2, каждый независимо, означают водород или C1-C5-алкил и R3 означает CF3или CF2H, который включает в себя перед стадией (а) по п.1:
(аа) взаимодействие 6-нитроантраниловой кислоты с нитритом, выбранным из изоамилнитрита и трет-бутилнитрита, и с соединением формулы (С)
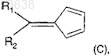
где R1и R2 имеют значения, которые определены для формулы (I),
с образованием соединения формулы (II)

где R1и R2 имеют значения, которые определены для формулы (I).
14. Соединение формулы (II)
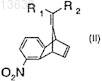
где R1и R2, каждый независимо, означают водород или C1-C5-алкил.
15. Применение соединения формулы (II) для получения способом по п.14 соединения формулы (I).
16. Соединение формулы (IIA)
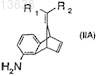
где R1и R2, каждый независимо, означают водород или C1-C5-алкил.
17. Способ получения соединения формулы (I)
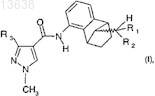
где R1и R2, каждый независимо, означают водород или C1-C5-алкил и R3 означает CF3или CF2H, который включает в себя:
(a) взаимодействие соединения формулы (II)

где R1и R2 имеют значения, которые определены для формулы (I),
с восстановителем с образованием соединения формулы (III)
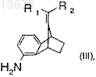
где R1и R2 имеют значения, которые определены для формулы (I); и
(b) взаимодействие полученного соединения с восстановителем с образованием соединения формулы (IV), где восстановителем, используемым на стадии (b), является водород в присутствии родиевого катализатора
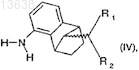
где R1и R2 имеют значения, которые определены для формулы (I); и
(d) взаимодействие соединения формулы (Va)
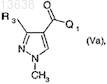
где Q1означает хлор, фтор, бром, йод или C1-C6-алкоксигруппу и R3имеет значение, определенное для формулы (I),
с соединением формулы (VII)
где L имеет значение, определенное для формулы (VI),
с образованием соединения формулы (VI)
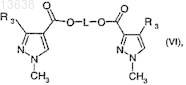
где L означает цепь C1-C6-алкилена и R3имеет значение, определенное для формулы (I); и
(e) превращение соединения формулы (VI) в соединение формулы (I) в результате взаимодействия с соединением формулы (IV).
18. Кристаллическая модификация В (9-изопропил-1,2,3,4-тетрагидро-1,4-метанонафтален-5-ил)амида син-3-дифторметил-1-метил-1Н-пиразол-4-карбоновой кислоты, при этом указанная кристаллическая модификация характеризуется картиной порошковой дифракции рентгеновских лучей, выраженной в значениях межплоскостных расстояний d и относительных интенсивностей, и указанная картина порошковой дифракции рентгеновских лучей содержит следующие характеристические линии: 13,42 Å (сильная), 9,76 Å (средняя), 6,93 Å (средняя), 6,74 Å (средняя), 4,79 Å (средняя), 4,73 Å (средняя) и 3,66 Å (средняя).
19. Кристаллическая модификация по п.18, дополнительно характеризуемая наличием на термограмме, полученной при дифференциальной сканирующей калориметрии, эндотермического сигнала с пиком в диапазоне от 120 до 128°С.
20. Кристаллическая модификация по п.18, по существу, в чистой форме.
21. Композиция для борьбы с болезнями, вызванными фитопатогенами у полезных растений, или с фитопатогенами на материале для размножения растений, которая, кроме обычных инертных адъювантов, используемых для приготовления композиции, содержит в качестве активного ингредиента, по меньшей мере, кристаллическую модификацию В (9-изопропил-1,2,3,4-тетрагидро-1,4-метанонафтален-5-ил)амида син-3-дифторметил-1-метил-1Н-пиразол-4-карбоновой кислоты по любому пп.18-20 в количестве, эффективном для фунгицидного действия.
22. Способ борьбы с болезнями, вызванными фитопатогенами у полезных растений, или с фитопатогенами на материале для размножения растений, который заключается в применении на полезных растениях, в месте обитания растений или на материале для размножения растений композиции по п.21.
Текст
013638 Настоящее изобретение относится к способу получения бензонорборнен-5-иламидов пиразолил-4-карбоновых кислот, а также к новым промежуточным продуктам для применения в таком способе. Настоящее изобретение, кроме того, относится к новой кристаллической модификации (9-изопропил-1,2,3,4-тетрагидро-1,4-метанонафтален-5-ил)амида син-3-дифторметил-1 метил-1 Н-пиразол-4-карбоновой кислоты, композициям, содержащим такую модификацию, и к их применению для борьбы с заражением культурных растений грибами. Бензонорборнен-5-иламиды пиразолил-4-карбоновых кислот, например (9-изопропил-1,2,3,4 тетрагидро-1,4-метанонафтален-5-ил)амид 3-дифторметил-1-метил-1 Н-пиразол-4-карбоновой кислоты,являются полезными фунгицидами, которые описаны, например, в WO 04/035589. В WO 04/035589 описан способ получения бензонорборнен-5-иламидов пиразолил-4-карбоновой кислоты (см. схему 1). Схема 1 Согласно WO 04/035589 3-нитродегидробензол, образованный, например, из 6-нитроантралиновых кислот формулы (А), где R2 и R3 могут представлять собой, в числе прочего, водород, сначала подвергают взаимодействию по реакции Дильса-Альдера с циклическим 1,4-диеном формулы (В), где R4, R5, R6 иR7 могут означать, в числе прочего, водород и Y может означать, среди прочего, -СНi)-С 3 Н 7)-, с образованием соединения 5-нитробензонорборнадиена формулы (С). Последующее каталитическое восстановление в стандартных условиях (например, Ra/Ni или Pd/C) в растворителе (например, метаноле) восстанавливает как нитрогруппу, так и эндоциклическую двойную связь в 2,3-положении и дает 5-аминобензонорборнен формулы (D). 5-Аминобензонорборнен формулы (D) затем может быть подвергнут взаимодействию с производным кислоты формулы (Е), где Het, среди прочего, может означать замещенный цикл пиразола и Q означает хлор, фтор, бром или гидроксигруппу, в растворителе (например,дихлорметане) с образованием бензонорборнен-5-иламида пиразолил-4-карбоновой кислоты формулы(F). Взаимодействие с соединениями формулы (Е), где Q означает хлор, фтор или бром, имеет место,например, в присутствии основания (например, триэтиламина). Соединения формулы (F) также могут быть получены в результате взаимодействия 5-аминобензонорборнена формулы (D) с производным кислоты формулы (Е), где Het имеет значение,определенное выше, и Q означает гидроксигруппу, в присутствии активирующего агента (например, хлорангидрида бис-(2-оксо-3-оксазолидинил)фосфиновой кислоты) в присутствии 2 экв. основания. В случае такого способа синтеза при получении 9-монозамещенных бензонорборнен-5-иламидов пиразолил-4-карбоновых кислот образуется множество региоизомеров. Например, при получении бензонорборнен-5-иламида пиразолил-4-карбоновой кислоты формулы (F), где R4, R5, R6 и R7 означают водород и Y означает -СНi)-С 3 Н 7)-, следующие пять региоизомеров образуются на стадии реакции ДильсаАльдера, в которой образуется соединение 5-нитробензонорбонадиен формулы (С) В описанном способе получения 9-монозамещенный региоизомер (IA) получают только с небольшим выходом. Разделение региоизомеров и/или разделение стереоизомерных форм можно осуществить на стадии соединения нитробензонорборнадиена формулы (С), 5-аминобензонорборненов формулы (D) или бензонорборнен-5-иламидов пиразолил-4-карбоновых кислот формулы (F), и обычно разделение осуществля-1 013638 ют с использованием стандартных способов, таких как, например, фракционная кристаллизация, фракционная перегонка, или с использованием хроматографических способов. Ввиду низкого выхода 9-замещенного региоизомера такой способ реакции не подходит для получения, особенно в большом масштабе, 9-замещенных бензонорборнен-5-иламидов пиразолил-4 карбоновых кислот формулы (F). Поэтому целью настоящего изобретения является способ получения 9-монозамещенных бензонорборнен-5-иламидов пиразолил-4-карбоновых кислот, который делает возможным получение таких соединений экономически выгодным образом с высокими выходами и хорошего качества. Соответственно настоящее изобретение относится к способу получения соединений формулы (I) где R1 и R2, каждый независимо, друг от друга, означают водород или C1-C5-алкил и(а) взаимодействие соединения формулы (II) где R1 и R2 имеют значения, которые определены для формулы (I),по меньшей мере с одним восстановителем с образованием соединения формулы (III) где R1 и R2 имеют значения, которые определены для формулы (I); и(b) взаимодействие указанного соединения по меньшей мере с одним восстановителем с образованием соединения формулы (IV) где R1 и R2 имеют значения, которые определены для формулы (I); и(с) превращение полученного соединения в соединение формулы (I) в результате взаимодействия с соединением формулы (V)R3 имеет значение, определенное для формулы (I). Алкильные группы в определениях заместителей могут иметь неразветвленную или разветвленную цепь и представляют собой, например, метил (СН 3), этил (С 2 Н 5), н-пропил (н-С 3 Н 7), изопропил (i-С 3 Н 7),н-бутил (н-С 4 Н 9), втор-бутил (втор-С 4 Н 9), изобутил (i-С 4 Н 9), трет-бутил (трет-С 4 Н 9) и пентил, а также их разветвленные изомеры. Алкоксигруппы в определениях заместителей могут иметь неразветвленную или разветвленную цепь и представляют собой, например, метокси-, этокси-, н-пропокси-, изопропокси-, н-бутокси-, вторбутокси-, изобутокси-, трет-бутокси-, пентилокси- и гексилоксигруппу, а также разветвленные изомеры пентилокси- и гексилоксигруппы.-2 013638 9-Монозамещенные бензонорборнены пиразолил-4-карбоновых кислот формулы (I) являются хиральными молекулами и могут встречаться в различных стереоизомерных формах. Они показаны в виде энантиомеров формул II-IIV: где R1, R2 и R3 имеют значения, которые определены для формулы (I). Способ согласно изобретению включает получение таких стереоизомерных форм формул II-IIV и получение смесей таких стереоизомерных форм в любом соотношении. В контексте настоящего изобретения подразумевают, что соединения формулы (Ia, син) где R1, R2 и R3 имеют значения, которые определены для формулы (I),являются соединениями формулы II; соединениями формулы III или смесью соединений формулы II и соединений формулы III в любом соотношении. В контексте настоящего изобретения подразумевают, что соединения формулы (Ia, син) предпочтительно представляют собой рацемическую смесь соединений формулы II и соединений формулы III. В контексте настоящего изобретения подразумевают, что соединения формулы (Ib, анти) где R1, R2 и R3 имеют значения, которые определены для формулы (I),представляют собой соединения формулы IIII; соединения формулы IIV или смесь соединений формулыIIII и соединений формулы IIV в любом соотношении. В контексте настоящего изобретения подразумевается, что соединения формулы (Ib, анти) предпочтительно представляют собой рацемическую смесь соединений формулы IIII и соединений формулы IIV.-3 013638 Соединения формулы (IV) могут встречаться в различных стереоизомерных формах, которые представлены формулами IVI, IVII-IVIV: где R1 и R2 имеют значения, которые определены для формулы (I). Способ согласно изобретению включает получение таких стереоизомерных форм формул IVI-IVIV и получение смесей таких стереоизомерных форм в любом соотношении. В контексте настоящего изобретения подразумевают, что соединения формулы (IVa, син) где R1 и R2 имеют значения, которые определены для формулы I,являются соединениями формулы IVI; соединениями формулы IVII или смесью соединений формулы IVI и соединений формулы IVII в любом соотношении. В контексте настоящего изобретения подразумевают, что соединения формулы (IVa, син) предпочтительно представляют собой рацемическую смесь соединений формулы IVI и соединений формулы(IVII). В контексте настоящего изобретения подразумевают, что соединения формулы (IVb, анти) где R1 и R2 имеют значения, которые определены для формулы (I),являются соединениями формулы IVIII; соединениями формулы IVIV или смесью соединений формулыIVIII и соединений формулы IVIV в любом соотношении. В контексте настоящего изобретения подразумевают, что соединения формулы (IVb, анти) предпочтительно представляют собой рацемическую смесь соединений формулы IVIII и соединений формулыIVIV. В контексте настоящего изобретения подразумевают, что "рацемическая смесь" двух энантиомеров представляет собой смесь двух энантиомеров в основном в соотношении, равном 1:1. Способ согласно изобретению особенно подходит для получения соединений формулы (I), в которых R1 и R2 означают метил. Способ согласно изобретению еще более подходит для получения соединений формулы (I), в которых R1 и R2 означают метил и R3 означает CF2H. В способе согласно изобретению предпочтение отдается применению соединений формулы (II), в которых R1 и R2 означают метил. В способе согласно изобретению предпочтение отдается применению соединений формулы (III), в которых R1 и R2 означают метил. В способе согласно изобретению предпочтение отдается применению соединений формулы (IV), в которых R1 и R2 означают метил. Технологическая стадия (a). В одном варианте настоящего изобретения на технологической стадии (a) используют один восстановитель. Подходящим восстановителем для технологической стадии (a) является, например, водород в присутствии металлического катализатора. Походящие количества восстановителя для применения на технологической стадии (a) в данном варианте изобретения составляют, например, до 4 экв., предпочтительно 4 экв. для данной реакции. Технологическую стадию (a) предпочтительно осуществляют в закрытом сосуде.-4 013638 В одном варианте способа согласно изобретению, в котором технологическую стадию (a) осуществляют в закрытом сосуде, избыток водорода, например, вводят в реакционную смесь, в которой уже присутствует металлический катализатор. Затем измеряют расход водорода в ходе реакции. В данном варианте осуществления способа согласно изобретению реакцию предпочтительно останавливают, когда израсходовано требуемое количество водорода. Подходящими металлическими катализаторами являются, например, платиновые катализаторы, такие как, например, катализаторы платина/уголь или PtO2; палладиевые катализаторы, такие как, например, Pd/C; катализаторы на основе родия, такие как, например, Rh/C, Rh/Al2O3 или Rh2O3; никелевые катализаторы, такие как, например, никель Ренея; или катализаторы на основе иридия, такие как, например, Ir(COD)Ру(Рсу); и их смеси. Предпочтительны платиновые катализаторы, палладиевые катализаторы, родиевые катализаторы или никелевые катализаторы; особенно предпочтительны палладиевые катализаторы, родиевые катализаторы или никелевые катализаторы и наиболее предпочтительны Pd/C, Rh/C или никель Ренея. Подходящие количества металлического катализатора для данной реакции составляют, например,от 0,001 до 0,5 экв., особенно от 0,01 до 0,1 экв. Указанную реакцию предпочтительно осуществляют в присутствии инертного растворителя. Подходящими растворителями, например, являются спирты, такие как метанол, этанол, пропанол или изопропанол, или апротонные растворители, такие как тетрагидрофуран, трет-бутилметиловый эфир, диоксан, толуол или этилацетат и их смеси. Особенно предпочтительны тетрагидрофуран или метанол. Температуры обычно составляют от -40 до 80 С, предпочтительна температура в диапазоне от-20 до 50 С и особенно предпочтительная температура в диапазоне от 0 до 30 С. В одном варианте температуры находятся в диапазоне от 20 до 30 С. Реакция может быть осуществлена при атмосферном давлении или при повышенном давлении,предпочтительно атмосферное давление или повышенное давление до 6 бар и особенно предпочтительно атмосферное давление. Время реакции для данной реакции обычно составляет от 1 до 60 ч, предпочтительно от 1 до 6 ч. В следующем варианте осуществления настоящего изобретения (вариант способа (а 2, используют более одного восстановителя на технологической стадии (a). Предпочтительно применение двух разных восстановителей на следующих друг за другом подстадиях общего способа восстановления. Промежуточные продукты, получаемые на первой подстадии, могут быть выделены посредством выбора подходящих условий реакции и затем могут быть использованы на второй подстадии, чтобы получить соединения формулы (III). Вариант способа (а 2), первая подстадия. Подходящим восстановителем для первой подстадии варианта способа (а 2) является, например,элементарное железо, олово или цинк в присутствии кислоты. Особенно предпочтительным восстановителем является элементарное железо в присутствии кислоты. В одном варианте осуществления первой подстадии варианта способа (а 2) соединение формулы (II) где R1 и R2 имеют значения, которые определены для формулы (I),подвергают взаимодействию с элементным железом в присутствии кислоты с образованием соединения формулы (IIA) где R1 и R2 имеют значения, которые определены для формулы (I). Соединения формулы (IIA) могут быть выделены посредством подбора подходящих условий реакции и затем использованы на второй подстадии варианта способа (а 2). Соединения формулы (IIA) также могут быть непосредственно использованы на второй подстадии варианта способа (а 2) без выделения. Подходящие количества железа для первой подстадии варианта способа (а 2) составляют, например,по меньшей мере 5 экв.; предпочтительно для данной реакции используют от 5 до 10 экв. Подходящими кислотами являются, например, органические кислоты, такие как, например, муравьиная кислота, уксусная кислота или пропионовая кислота; или неорганические кислоты, такие как, например, соляная или серная кислота. Предпочтение отдается органическим кислотам и особенно предпочтительна уксусная кислота.-5 013638 Реакцию предпочтительно осуществляют в присутствии инертного растворителя. Подходящими растворителями являются, например, вода; спирты, такие как метанол, этанол, пропанол или изопропанол; или апротонные растворители, такие как тетрагидрофуран, трет-бутилметиловый эфир, диоксан,толуол или этилацетат; и их смеси; спирты являются особенно предпочтительными. Температуры обычно составляют от 0 до 120 С, предпочтителен диапазон температур от 0 до 100 С и особенно предпочтителен диапазон температур от 20 до 60 С. В одном варианте температуры находятся в диапазоне от 20 до 30 С. Реакция может быть осуществлена при атмосферном давлении или при повышенном давлении. Время реакции для данной реакции обычно составляет от 1 до 60 ч, предпочтительно от 1 до 6 ч. Вариант способа (а 2), вторая подстадия. На второй подстадии варианта способа (а 2) соединения, образованные на первой подстадии, подвергают взаимодействию со следующим восстановителем, который отличается от восстановителя на первой подстадии, с образованием соединений формулы (III). Подходящими восстановителями для второй подстадии варианта способа (а 2) являются восстановители, указанные для технологической стадии (a). Подходящие количества восстановителя для второй подстадии варианта способа (а 2) составляют,например, до 2 экв.; предпочтительно для данной реакции используют 2 экв. Вторую подстадию варианта способа (а 2) предпочтительно осуществляют в закрытом сосуде. В одном варианте способа согласно изобретению, в котором вторую подстадию варианта способа(а 2) осуществляют в закрытом сосуде, избыток водорода вводят, например, в реакционную смесь, в которой уже присутствует металлический катализатор. Затем измеряют расход водорода на протяжении периода протекания реакции. В данном варианте осуществления способа согласно изобретению реакцию предпочтительно останавливают, когда израсходовано требуемое количество водорода. Подходящими металлическими катализаторами являются, например, платиновые катализаторы, такие как, например, катализаторы платина/уголь или PtO2; палладиевые катализаторы, такие как, например, Pd/C; катализаторы на основе родия, такие как, например, Rh/C, Rh/Al2O3 или Rh2O3; никелевые катализаторы, такие как, например, никель Ренея; или катализаторы на основе иридия, такие как, например, Ir(COD)Ру(Рсу); и их смеси. Предпочтительны платиновые катализаторы, палладиевые катализаторы, родиевые катализаторы или никелевые катализаторы; особенно предпочтительны палладиевые катализаторы, родиевые катализаторы или никелевые катализаторы и наиболее предпочтительны Pd/C, Rh/C или никель Ренея. Подходящие количества металлического катализатора для данной реакции составляют, например,от 0,001 до 0,5 экв., особенно от 0,01 до 0,1 экв. Реакцию предпочтительно осуществляют в присутствии инертного растворителя. Подходящими растворителями, например, являются спирты, такие как метанол, этанол, пропанол или изопропанол, или апротонные растворители, такие как тетрагидрофуран, трет-бутилметиловый эфир, диоксан, толуол или этилацетат и их смеси. Особенно предпочтительны тетрагидрофуран или метанол. Температуры обычно составляют от -40 до 80 С, предпочтительна температура в диапазоне от -20 до 50 С и особенно предпочтительна температура в диапазоне от 0 до 30 С. В одном варианте температуры находятся в диапазоне от 20 до 30 С. Реакция может быть осуществлена при атмосферном давлении или при повышенном давлении,предпочтительно атмосферное давление или повышенное давление до 6 бар и особенно предпочтительно атмосферное давление. Время реакции для данной реакции обычно составляет от 1 до 60 ч, предпочтительно от 1 до 6 ч. Соединения формулы (II) могут быть получены, например, с помощью последовательности реакций, которая указана ниже (см. схему 2). Схема 2 9-Алкилиден-5-нитробензонорборнадиены формулы (II), где R1 и R2 имеют значения, которые определены для формулы (I), могут быть получены посредством реакции присоединения Дильса-Альдера образованного in situ дегидробензола формулы В [полученного, например, исходя из 6-нитроантраниловой кислоты (соединение формулы А)] посредством диазотирования с использованиемC1-8-алкилнитрита, такого как, например, изоамилнитрит, трет-амилнитрит, н-амилнитрит или трет-бутилнитрит, как описано в L. Paquette et al., J. Mer. Chem. Soc. 99, 3734 (1977), или из других подходящих предшественников [см. Н. Pellissier et al., Tetrahedron, 59, 701 (2003), R. Muneyuki and H. Tanida,-6 013638J. Org. Chem. 31, 1988 (1966)], к фульвену формулы (С), где R1 и R2 имеют значения, которые определены для формулы (I). Указанная реакция может быть осуществлена аналогично реакции, описанной вR. Muneyuki and H. Tanida, J. Org. Chem. 31, 1988 (1966), P. Knochel et al., Angew. Chem. 116, 4464 (2004),J.W. Сое et al., Organic Letters 6, 1589 (2004), L. Paquette et al., J. Amer. Chem. Soc. 99, 3734 (1977),R.N. Warrener et al., Molecules, 6, 353 (2001) и R.N. Warrener et al., Molecules, 6, 194 (2001). Подходящими апротонными растворителями для данной стадии являются, например, диэтиловый эфир, бутилметиловый эфир, этилацетат, дихлорметан, ацетон, тетрагидрофуран, толуол, 2-бутанон или диметоксиэтан. Подходящие температуры реакции находятся в диапазоне от температуры окружающей среды до 100 С, предпочтительно от 35 до 80 С. Фульвены формулы (С) могут быть получены согласно способу, аналогичному способу, описанному в М. Neuenschwander et al., Helv. Chim. Acta, 54, 1037 (1971), там же 48, 955 (1965), R.D. Little et al., J.Org. Chem. 49, 1849 (1984), I. Erden et al., J. Org. Chem. 60, 813 (1995), S. Collins et al., J. Org. Chem. 55,3395 (1990), J. Thiele, Chem. Ber. 33, 666 (1900) и Liebigs Ann. Chem. 1, 348 (1906). Фульвены общей формулы (С) где R1 и R2 имеют значения, которые определены для формулы (I), могут быть получены посредством взаимодействия циклопента-1,3-диена с соединением формулы (F) где R1 и R2 имеют значения, которые определены для формулы (I), в присутствии основания. Реакцию для получения соединений формулы (С) предпочтительно осуществляют в присутствии инертного растворителя. Подходящими растворителями являются, например, диметилформамид; диметилсульфоксид; N-метил-2-пирролидон; простые эфиры, такие как, например, тетрагидрофуран, третбутилметиловый эфир, диэтиловый эфир, бутилметиловый эфир, диметоксиэтан; спирты, такие как, например, C1-C10-спирты, такие как, например, метанол или этанол; или ароматические растворители, такие как, например, толуол, ксилен или дихлорбензол. Подходящими основаниями являются, например, аминные основания, такие как, например, пирролидин, морфолин, тиоморфолин или пиперидин; алканоляты, такие как, например, метанолят натрия или этанолят натрия, или гидроксиды, такие как, например, KOH или NaOH; предпочтителен пирролидин. Подходящие количества основания для реакции составляют, например, от 0,01 до 2 экв., особенно от 0,25 до 0,8 экв. Температуры обычно составляют от -20 до 80 С, предпочтителен диапазон температур от -10 С до температуры окружающей среды. Время реакции для данной реакции обычно составляет от 30 мин до 24 ч, предпочтительно от 1 до 6 ч. Пример А 1. Получение 6,6-диметилфульвена. 950 г (5 экв.) метанола, 543 г (1,3 экв.) ацетона и 397 г (6 моль) циклопентадиена смешивают вместе и охлаждают до -5 С. Добавляют 107 г (0,25 экв.) пирролидина. Реакционную смесь перемешивают в течение 2 ч при -5 С. Реакцию останавливают добавлением уксусной кислоты и воды. После разделения фаз органическую фазу экстрагируют насыщенным раствором хлорида натрия. Растворитель удаляют в вакууме. Получают 535 г 6,6-диметилфульвена (чистота: 93%; выход: 78%). 6-Нитроантраниловая кислота доступна, например, согласно Н. Seidel, Chem. Ber. 34, 4351 (1901). Технологическая стадия (b). В одном варианте настоящего изобретения на технологической стадии (b) используют один восстановитель. Подходящим восстановителем для технологической стадии (b) является, например, водород в присутствии металлического катализатора. Подходящие количества восстановителя для данной реакции составляют, например, до 1 экв., предпочтительно 1 экв. для данной реакции. Технологическую стадию (b) предпочтительно осуществляют в закрытом сосуде. В одном варианте способа согласно изобретению, в котором технологическую стадию (b) осуществляют в закрытом сосуде, избыток водорода, например, вводят в реакционную смесь, в которой уже присутствует металлический катализатор. Затем контролируют расход водорода на протяжении периода протекания реакции. В данном варианте осуществления способа согласно изобретению реакцию предпочтительно останавливают, когда израсходовано требуемое количество водорода. Подходящими металлическими катализаторами являются, например, платиновые катализаторы, такие как, например, катализаторы платина/уголь (Pt/C)или PtO2; палладиевые катализаторы, такие как,например, Pd/C; катализаторы на основе родия, такие как, например, Rh/C, Rh/Al2O3 или Rh2O3; никелевые катализаторы, такие как, например, никель Ренея; или катализаторы на основе иридия, такие как,-7 013638 например, Ir(COD)Ру(Рсу); и их смеси. Особенно предпочтительны Pd/C или Rh/C. Подходящие количества металлического катализатора для данной реакции составляют, например,от 0,001 до 0,5 экв., особенно от 0,01 до 0,1 экв. Указанную реакцию предпочтительно осуществляют в присутствии инертного растворителя. Подходящими растворителями, например, являются спирты, такие как метанол, этанол, пропанол или изопропанол, или апротонные растворители, такие как тетрагидрофуран, трет-бутилметиловый эфир, диоксан, толуол, этилацетат или дихлорметан, и их смеси; особенно предпочтительны тетрагидрофуран или метанол. Температуры обычно составляют от -40 до 80 С, предпочтительна температура в диапазоне от -20 до 50 С и особенно предпочтительна температура в диапазоне от 0 до 30 С. В одном варианте температуры находятся в диапазоне от 20 до 30 С. Реакция может быть осуществлена при атмосферном давлении или при повышенном давлении,предпочтительно атмосферное давление или повышенное давление до 150 бар и особенно предпочтительно атмосферное давление или повышенное давление до 100 бар. Время реакции для данной реакции обычно составляет от 1 до 100 ч, предпочтительно от 1 до 24ч. Технологическая стадия с). Особенно подходящими для применения на технологической стадии с) являются соединения формулы (V), где Q означает хлор, фтор, бром или йод и R3 имеет значение, определенное для формулы (I). Более подходящими являются соединения формулы (V), где Q означает хлор, фтор или бром и R3 имеет значение, определенное для формулы (I). Особенно подходящими являются соединения формулы (V),где Q означает хлор и R3 имеет значение, определенное для формулы (I). В реакциях согласно изобретению с соединениями формулы (V), где Q означает хлор, фтор или бром и R3 имеет значение, определенное для формулы (I) (вариант способа (c1, соединения формулы(V) используют в эквимолярном количестве в количестве, меньшем, чем эквимолярное количество, или в избытке по отношению к соединениям формулы (IV), предпочтительно в эквимолярном количестве или в избыточном количестве вплоть до 3-кратного избытка, особенно предпочтительно использование эквимолярного количества или избыточного количества вплоть до 1,5-кратного избытка, еще более предпочтительно использование эквимолярного количества. Реакцию согласно варианту способа (c1) предпочтительно осуществляют в присутствии инертного растворителя. Подходящими растворителями являются, например, хлорбензол, дихлорметан, хлороформ,толуол, тетрагидрофуран, диэтиловый эфир, бутилметиловый эфир или вода и их смеси, особенно предпочтительными являются толуол или дихлорметан. Реакцию согласно варианту способа (c1) предпочтительно осуществляют в присутствии основания. Подходящими основаниями являются, например, аминные основания, такие как, например,триэтиламин или пиридин; или неорганические основания, такие как карбонаты, например K2CO3 илиNa2CO3, или гидроксиды, например NaOH или KOH; предпочтительны триалкиламины и особенно предпочтителен триэтиламин. Подходящие количества основания для реакции составляют, например, от 1 до 1,5 экв., особенно от 1 до 1,2 экв. Температуры обычно составляют от 0 до 100 С, предпочтителен диапазон температур от 10 до 50 С и особенно предпочтителен диапазон температур от 15 до 30 С. Реакция может быть осуществлена при атмосферном давлении или при повышенном давлении, при этом предпочтительно атмосферное давление. Время реакции для данной реакции обычно составляет от 1 до 48 ч, предпочтительно от 1 до 24 ч. Также особенно подходящими для применения на технологической стадии с) являются соединения формулы (V), где Q означает гидроксигруппу и R3 имеет значение, определенное для формулы (I). В реакциях согласно изобретению с соединениями формулы (V), где Q означает гидроксигруппу иR3 имеет значение, определенное для формулы (I) (вариант способа (с 2, соединения формулы (V) используют в эквимолярном количестве, в количестве, меньшем, чем эквимолярное количество, или в избытке по отношению к соединениям формулы (IV), предпочтительно в эквимолярном количестве или в избыточном количестве вплоть до 3-кратного избытка, особенно предпочтительно использование эквимолярного количества или избыточного количества вплоть до 1,5-кратного избытка, еще более предпочтительно использование эквимолярного количества. Реакции согласно изобретению в случае варианта способа (с 2), т.е. с использованием соединений формулы (V), где Q означает гидроксигруппу и R3 имеет значение, определенное для формулы (I), предпочтительно осуществляют в присутствии активирующего агента. Подходящим активирующим агентом является, например, хлорангидрид бис-(2-оксо-3 оксазолидинил)фосфиновой кислоты. Реакцию согласно варианту способа (с 2) предпочтительно осуществляют в присутствии инертного растворителя. Подходящими инертными растворителями являются, например, дихлорметан и хлороформ и их смеси; особенно предпочтительным является дихлорметан.-8 013638 Реакцию согласно варианту способа (с 2) предпочтительно осуществляют в присутствии основания. Подходящими основаниями являются, например, аминные основания, такие как, например,триэтиламин или пиридин; особенно предпочтительным является триэтиламин. Подходящие количества основания для данной реакции составляют, например, по меньшей мере 2 экв., особенно от 2 до 3 экв. Температуры обычно составляют от 0 до 100 С, предпочтителен диапазон температур от 10 до 50 С и особенно предпочтителен диапазон температур от 15 до 30 С. Реакция может быть осуществлена при атмосферном давлении или при повышенном давлении, при этом предпочтительно атмосферное давление. Время реакции для данной реакции обычно составляет от 1 до 48 ч, предпочтительно от 1 до 24 ч. Также подходящими для применения на технологической стадии с) являются соединения формулы(V), в которых Q означает C1-C6-алкоксигруппу и R3 имеет значение, определенное для формулы (I). Особенно подходящими являются соединения формулы (V), в которых Q означает метокси- или этоксигруппу и R3 имеет значение, определенное для формулы (I). В реакциях согласно изобретению с использованием соединений формулы (V), в которых Q означает C1-C6-алкоксигруппу и R3 имеет значение, определенное для формулы (I) (вариант способа (с 3, соединения формулы (V) используют в эквимолярном количестве, в количестве, меньшем, чем эквимолярное количество, или в избытке по сравнению с соединениями формулы (IV). Реакцию согласно варианту способа (с 3) предпочтительно осуществляют в присутствии инертного растворителя. Подходящими растворителями являются, например, хлорбензол, дихлорметан, хлороформ,толуол, тетрагидрофуран, диэтиловый эфир или бутилметиловый эфир и их смеси; хлорбензол или толуол являются предпочтительными в качестве растворителя. Реакция также может быть осуществлена в отсутствии растворителя. Реакцию согласно варианту способа (с 3) предпочтительно осуществляют в присутствии основания. Подходящими основаниями являются, например, аминные основания, такие как, например,триэтиламин или пиридин; неорганические основания, такие как карбонаты, например K2CO3 илиNa2CO3, или гидроксиды, например NaOH или KOH; или алкоксиды, такие как, например, трет-бутоксид калия. Предпочтительным является, например, трет-бутоксид калия. Подходящие количества основания для реакции составляют, например, от 1 до 1,5 экв., особенно от 1 до 1,2 экв. Температуры обычно составляют от 0 до 120 С, предпочтителен диапазон температур от 50 до 100 С и особенно предпочтителен диапазон температур от 70 до 100 С. Реакция может быть осуществлена при атмосферном давлении или при повышенном давлении, при этом предпочтительно атмосферное давление. Время реакции для данной реакции обычно составляет от 1 до 48 ч, предпочтительно от 1 до 24 ч. Соединения формулы (V) описаны в WO 04/035589 или могут быть получены способами, описанными в данной публикации. Предпочтительным вариантом способа согласно изобретению является способ получения соединений формулы (I), в которых R1 и R2 означают метил и R3 означает CF2H, который включает в себя:(a) взаимодействие соединения формулы (II), где R1 и R2 означают метил, с водородом в присутствии катализатора родия на угле с образованием соединения формулы (III), где R1 и R2 означает метил,при этом в качестве растворителя используют тетрагидрофуран; и(b) взаимодействие указанного соединения с водородом в присутствии катализатора никеля Ренея с образованием соединения формулы (IV), где R1 и R2 означают метил, при этом в качестве растворителя используют тетрагидрофуран; и(c) превращение полученного соединения в соединение формулы (I) в результате взаимодействия с соединением формулы (V), где Q означает гидроксигруппу и R3 означает CF2H, в присутствии хлорангидрида бис-(2-оксо-3-оксазолидинил)фосфиновой кислоты, при этом в качестве растворителя используют дихлорметан и реакцию осуществляют в присутствии триэтиламина. Выбрав подходящие условия реакции для стадии реакции (a), соединение формулы (III), полученное на стадии реакции (a), можно превратить в соединение формулы (IV) непосредственно без выделения промежуточных продуктов в результате полного гидрирования. Указанный предпочтительный вариант осуществления настоящего изобретения является особенным преимуществом способа согласно изобретению. В указанном предпочтительном варианте более предпочтительно используют всего 5 экв. восстановителя на стадиях реакции (a) и (b) вместе. В случае указанного предпочтительного варианта осуществления настоящего изобретения водород в присутствии металлического катализатора предпочтительно используют в качестве восстановителя на стадии реакции (a) и стадии реакции (b). В случае указанного предпочтительного варианта осуществления настоящего изобретения один и тот же металлический катализатор предпочтительно используют на стадии реакции (a) и стадии реакции(b). Подходящие количества металлического катализатора для указанного предпочтительного варианта составляют, например, от 0,001 до 0,5 экв., предпочтительно от 0,01 до 0,1 экв. Предпочтительно комбинацию стадий реакции (a) и (b) в данном предпочтительном варианте осуществления способа согласно изобретению осуществляют в закрытом сосуде. В случае указанной комбинации избыток водорода, например, вводят в реакционную смесь, в которой уже присутствует металлический катализатор. Расход водорода затем контролируют на протяжении периода протекания реакции. В данном предпочтительном варианте осуществления способа согласно изобретению реакцию предпочтительно останавливают, когда израсходовано требуемое количество водорода, которое более предпочтительно составляет 5 экв. В данном варианте реакция может быть осуществлена при атмосферном давлении или при повышенном давлении до 150 бар, при этом предпочтительно атмосферное давление или повышенное давление до 50 бар, особенно предпочтительно атмосферное давление или повышенное давление до 20 бар и еще более предпочтительно атмосферное давление или повышенное давление до 6 бар. Время реакции в случае указанного предпочтительного варианта реакции обычно составляет от 1 до 100 ч, предпочтительно от 1 до 24 ч. Настоящее изобретение более подробно объясняется в следующих примерах. Пример Р 1. Получение 9-изопропилиден-5-аминобензонорборнена (соединениеZ2.11) 5,0 г 9-изопропилиден-5-нитробензонорборнадиена (соединенияZ1.11) (22 ммоль) гидририровали в 50 мл тетрагидрофурана в присутствии 1,5 г 5% Rh/C при 25 С и атмосферном давлении. После поглощения 4 экв. водорода (2,01 л или 102% от теоретического количества) смесь фильтровали, растворитель удаляли в вакууме и остаток очищали хроматографией на колонке с силикагелем, используя смесь гексан/этилацетат (6:1) в качестве элюента. Получали 2,76 г 9-изопропилиден-5-аминобензонорборнена в форме твердого вещества (т.пл. 81-82 С; выход: 62,9% от теоретического). 1 Н-ЯМР (CDCl3), м.д.: 6,90 (т, 1 Н), 6,67 (д, 1 Н), 6,46 (д, 1 Н), 3,77 (м, 1 Н), 3,73 (м, 1 Н), 3,35 (уш, участвуют в обмене D2O, 2 Н), 1,89 (м, 2 Н), 1,63 (2 с, 6 Н), 1,26 (м, 2 Н),13 С-ЯМР (CDCl3), м.д.: 148,73, 147,65, 138,30, 131,75, 126,19, 113,12, 110,89, 110,19, 43,97, 39,44,26,98, 26,06, 19,85, 19,75. Пример Р 2. Получение 9-изопропилиден-5-аминобензонорборнена (соединениеZ2.11). В стальном автоклаве объемом 1 л 5% родий на активированном угле (43,1 г, влажный, содержание воды 70%) добавляли к 225 г метанола. Использовали давление водорода 7 бар и перемешивание осуществляли при температуре окружающей среды. К полученной смеси в течение 2 ч добавляли раствор 96,7 г 9-изопропилиден-5-нитро-1,4-дигидро-1,4-метанонафталина в 120 г тетрагидрофурана и 24 г метанола. Параллельно продолжали использовать водород при давлении 7 бар. Реакцию останавливали через 30 мин после прекращения добавления. Реакционную смесь фильтровали через целлюлозу и промывали метанолом. Фильтрат концентрировали досуха путем выпаривания. К полученному остатку добавляли метанол. Преципитированный неочищенный продукт отфильтровывали и концентрировали досуха выпариванием. Остаток подвергали хроматографии на силикагеле, используя смесь этилацетат/гексан (1:6). Получали 9-изопропилиден-5-аминобензонорборнен. Пример Р 3. Получение 9-изопропил-5-аминобензонорборнена (соединениеZ3.11) 0,2 г 9-изопропилиден-5-аминобензонорборнена (Z2.11) гидрировали в течение 24 ч в 40 мл тетрагидрофурана в присутствии 0,1 г RaNi (обработанного EtOH) при 25 С и давлении 100 бар. Смесь фильтровали, растворитель удаляли в вакууме и остаток очищали хроматографией на колонке с силикагелем,используя смесь гексан/этилацетат (6:1) в качестве элюента. 9-Изопропил-5-аминобензонорборнен(Z3.11) получали в форме твердого вещества (соотношение син/анти 29:71; выход: 82% от теоретического). Пример Р 4. Получение 9-изопропил-5-аминобензонорборнена (соединениеZ3.11). 41,4 г 9-изопропилиден-5-нитробензонорборнадиена (соединениеZ1.11) в 1 л тетрагидрофурана полностью гидрировали в присутствии 22 г 5% Pd/C при 25 С и нормальном давлении в течение 4 ч. Реакционную смесь фильтровали, растворитель удаляли в вакууме и очистку хроматографией на силикагеле осуществляли, используя смесь этилацетат/гексан (1:7) в качестве элюента. Получали 29,9 гH-HMP (CDCl3), м.д.: 6,89 (т, 1 Н), 6,63 (д, 1 Н), 6,46 (д, 1 Н), 3,55 (уш. участвуют в обмене D2O, 2 Н),3,16 (м, 1 Н), 3,13(м, 1 Н), 1,87 (м,2 Н), 1,48 (д,1 Н), 1,42 (м, 1 Н), 1,12 (м, 2 Н), 0,90 (м, 6 Н); 13 С-ЯМР (CDCl3), м.д.: 150,72, 138,74, 133,63, 126,15, 112,94, 111,53, 68,05, 45,21, 40,61, 26,25, 24,47,23,55, 20,91 (2). Определение син/анти осуществляли на основе экспериментов NOE-ЯМР. Пример Р 5. Получение (9-изопропил-1,2,3,4-тетрагидро-1,4-метанонафтален-5-ил)амида 3-дифторметил-1-метил-1 Н-пиразол-4-карбоновой кислоты (соединениеA.11) 1,9 г хлорангидрида бис-(2-оксо-3-оксазолидинил)фосфиновой кислоты (7,2 ммоль, 1,4 экв.) добавляли при температуре окружающей среды к раствору 1 г 9-изопропил-5-аминобензонорборнена (соединениеZ3.11, соотношение син/анти 90:10; 5 ммоль), 1,7 мл триэтиламина (12,1 ммоль, 2,4 экв.) и 1,2 г 3-дифторметил-1-метил-1 Н-пиразол-4-карбоновой кислоты (6,2 ммоль, 1,4 экв.) в 40 мл дихлорметана и перемешивание осуществляли в течение 20 ч. После добавления воды и насыщенного раствора NaHCO3 органическую фазу экстрагировали этилацетатом. Очистка на силикагеле в смеси этилацетат/гексан (2:3) и последующая кристаллизация из гексана давали 1,31 г (9-изопропил-1,2,3,4-тетрагидро-1,4 метанонафтален-5-ил) амида 3-дифторметил-1-метил-1 Н-пиразол-4-карбоновой кислоты (т.пл. 124125 С; соотношение син/анти 92:8 согласно 1 Н-ЯМР; выход: 73%). Кристаллическое вещество анализировали, используя дифференциальную сканирующую калориметрию и дифракцию рентгеновских лучей,и идентифицировали в виде кристаллической модификации В (9-изопропил-1,2,3,4-тетрагидро-1,4 метанонафтален-5-ил)амида син-3-дифторметил-1-метил-1 Н-пиразол-4-карбоновой кислоты (см. фиг. 7). Пример Р 6. Получение (9-изопропил-1,2,3,4-тетрагидро-1,4-метанонафтален-5-ил)амида 3-дифторметил-1-метил-1 Н-пиразол-4-карбоновой кислоты (соединениеA.11) К раствору 100 г 9-изопропил-5-аминобензонорборнена (соединениеZ3.11, соотношение син/анти 90:10; 0,5 моль, 50% раствор в хлорбензоле) и 55,7 г триэтиламина (0,55 моль, 1,1 экв.) в 200 г хлорбензола при 40 С в течение 2 ч добавляли 97,3 г 3-дифторметил-1-метил-1 Н-пиразол-4 карбонилхлорида (50% раствор в хлорбензоле, 0,5 моль, 1 экв.) и перемешивание осуществляли в течение 1 ч. После добавления воды и соляной кислоты (устанавливается значение рН 6-7) органическую фазу экстрагировали хлорбензолом. Органическую фазу концентрировали отгонкой хлорбензола. После последующей кристаллизации из смеси метанол/вода (3:1) получали 126 г (9-изопропил-1,2,3,4 тетрагидро-1,4-метанонафтален-5-ил)амида 3-дифторметил-1-метил-1 Н-пиразол-4-карбоновой кислоты(т.пл. 124-125 С; чистота: 99,2%; соотношение син/анти 95:5 согласно ГХ, выход: 70%). Кристаллическое вещество анализировали, используя дифференциальную сканирующую калориметрию и дифракцию рентгеновских лучей, и идентифицировали в виде кристаллической модификации В (9-изопропил 1,2,3,4-тетрагидро-1,4-метанонафтален-5-ил)амида син-3-дифторметил-1-метил-1 Н-пиразол-4-карбоновой кислоты (см. фиг. 8). Смесь 110,4 г 6-нитроантраниловой кислоты (0,6 моль) и 98,5 г 6,6-диметилфульвена (1,5 экв.) в 700 мл диметоксиэтана по каплям при 72 С добавляли к раствору 96,3 г трет-бутилнитрита (1,4 экв.) в 2 л 1,2-диметоксиэтана в атмосфере азота. Начиналось выделение газа и температура смеси поднималась до 79 С. Выделение газа затихало через 30 мин. После перемешивания в течение 3 ч при температуре флегмы растворителя смесь охлаждали до температуры окружающей среды. Растворитель удаляли в вакууме и остаток очищали хроматографией на колонке с силикагелем, используя смесь гексан/этилацетат(95:5) в качестве элюента. Получали 76,7 г 9-изопропилиден-5-нитробензонорборнадиена в форме твердого вещества желтого цвета (т.пл. 94-95 С). 1 Н-ЯМР (CDCl3), м.д.: 7,70 (д, 1 Н), 7,43 (д, 1 Н), 7,06 (т, 1 Н), 6,99 (м, 2 Н), 5,34 (уш.с, 1 Н), 4,47 (уш.с,1 Н), 1,57 (2 д, 6 Н); 13 С-ЯМР (CDCl3), м.д.: 159,83, 154,30, 147,33, 144,12, 142,89, 141,93, 125,23 (2), 119,32, 105,68,50,51, 50,44, 19,05, 18,90. Пример Р 8. Получение 9-изопропилиден-5-нитробензонорборнадиена 98,5 г 6,6-диметилфульвена в 500 г метилэтилкетона нагревали до 60 С. Раствор 182 г 6-нитроантраниловой кислоты в 700 г метилэтилкетона добавляли в течение 2 ч при 60 С в атмосфере азота и параллельно добавляли 216 г трет-амилнитрита в течение 2,5 ч. Растворитель удаляли в вакууме при 60 С. Добавляли 200 г ксилена и затем добавляли 1200 г гексана. Полученную суспензию фильтровали и промывали гексаном. Растворитель удаляли в вакууме при 60 С и к неочищенному продукту добавляли 200 г метанола. Неочищенный продукт, который кристаллизовался, отфильтровывали при 0 С и промывали 100 г метанола. После удаления остаточного растворителя в вакууме при 60 С получали 120 г 9-изопропилиден-5-нитробензонорборнадиена (т.пл. 93 С). Пример Р 9. Получение 9-изопропилиден-5-аминобензонорборнадиена (соединениеZ4.11) Порошковое железо добавляли к 2,72 г 9-изопропилиден-5-нитробензонорборнадиена (соединениеZ1.11), растворенного в 50 мл тетрагидрофурана и 61 мл уксусной кислоты (5% в воде), и перемешивание осуществляли в течение 20 ч при 30 С. Неочищенный продукт отфильтровывали и добавляли этилацетат. Затем осуществляли промывку водным раствором NaHCO3 и насыщенным раствором хлорида натрия и осуществляли сушку при добавлении Na2SO4. Сырой продукт очищали на колонке с силикагелем (элюент: 1:3 этилацетат:гексан). Получали 2,01 г 9-изопропилиден-5-аминобензонорборнадиена в форме кристаллов бежевого цвета (выход: 85%; т.пл. 121-123 С). 1 Н-ЯМР (CDCl3): 6,95 (м, 2 Н), 6,80 (м, 2 Н), 6,39 (д, 1 Н), 4,41 (м, 1 Н), 4,37 (м, 1 Н), 3,91 (уш. участвуют в обмене D2O, 2H), 1,58 (с, 3 Н), 1,57 (с, 3 Н); 13 С-ЯМР (CDCl3): 160,8, 151,6, 143,0, 141,9, 139,1, 134,2, 125,3, 113,2, 112,5, 101,5, 50,9, 46,3, 19,0,18,8. Пример Р 10. Получение (9-изопропил-1,2,3,4-тетрагидро-1,4-метанонафтален-5-ил)амида 3-дифторметил-1-метил-1 Н-пиразол-4-карбоновой кислоты (соединениеA.11) 6,2 г 9-изопропил-5-аминобензонорборнена (соединениеZ3.11, соотношение син/анти 90:10; 30 ммоль, 1,05 экв.) и 1,6 г трет-бутоксида калия (14,7 ммоль, 0,5 экв.) добавляли к раствору 6 г этилово- 12013638 го эфира 3-дифторметил-1-метил-1 Н-пиразол-4-карбоновой кислоты (29 ммоль) в 60 мл хлорбензола. Реакционную смесь нагревали до 95 С и растворитель хлорбензол полностью удаляли в вакууме. Реакционную смесь нагревали до 120 С и перемешивали в течение 20 ч. Затем добавляли 30 мл хлорбензола. Органическую фазу дважды экстрагировали водой сначала при низком рН, затем при высоком рН. Органическую фазу концентрировали отгонкой хлорбензола. Получали 8 г (9-изопропил-1,2,3,4-тетрагидро 1,4-метанонафтален-5-ил)амида 3-дифторметил-1-метил-1 Н-пиразол-4-карбоновой кислоты в форме масла коричневого цвета (грубый выход: 33%). Получение исходных соединений формулы (V) описано в следующем примере. Пример А 2. Получение 3-дифторметил-1-метил-1 Н-пиразол-4-карбонилхлорида 69,5 г тионилхлорида (0,58 моль, 1,17 экв.) добавляли при 110 С в течение 2 ч к раствору 88 г 3-дифторметил-1-метил-1 Н-пиразол-4-карбоновой кислоты (0,5 моль) в 440 г хлорбензола. Реакционную смесь перемешивали в течение 1 ч при 110 С. Реакционную смесь концентрировали до получения раствора неочищенного продукта. Получали 190 г 3-дифторметил-1-метил-1 Н-пиразол-4-карбонилхлорида(50% в хлорбензоле, выход: 98%). Раствор неочищенного продукта использовали без дополнительной очистки. Следующие соединения формулы (I) могут быть получены на основе приведенных выше примеров. Таблица 1 Соединения формулы (I) Предпочтительные соединения формулы (II) перечислены в табл. 2. Таблица 2 Соединения формулы (II)- 14013638 Предпочтительные соединения формулы (III) перечислены в табл. 3. Таблица 3 Соединения формулы (III) Предпочтительные соединения формулы (IV) перечислены в табл. 4. Таблица 4 Соединения формулы (IV)- 15013638 Предпочтительные соединения формулы (IIA) перечислены в табл. 5. Таблица 5 Соединения формулы (IIA) Исходные вещества в случае способа согласно настоящему изобретению отличаются тем, что они легко доступны и обладают подходящими для обработки свойствами и, кроме того, являются недорогими. В особенно предпочтительном варианте (bb) осуществления настоящего изобретения восстановителем, используемым на стадии (b), является водород в присутствии родиевого катализатора. Указанный предпочтительный вариант (bb) делает возможным простое получение соединений формулы (I), в которых отношение син-изомеров формулы (Ia) к антиизомерам формулы (Ib) значительно выше, чем отношение, описанное в WO 04/035589; в общем достигаются отношения син/анти полученных 9-монозамещенных бензонорборнен-5-иламидов пиразолил-4-карбоновой кислоты более чем 90:10. Последовательность реакций, описанная в WO 04/035589 (схема 1), дает отношение син/антиизомеров 9-монозамещенных бензонорборненов пиразолил-4-карбоновой кислоты, являющихся фунгицидами, сдвинутое в пользу антиизомера. Получение отдельных син/антиизомеров согласно известному уровню техники, как правило, осуществляют, используя обычные способы, такие как, например, хроматографические способы. Напротив, согласно особенно предпочтительному варианту (bb) данного способа можно легко получить соединения формулы (I), в которых отношение соединений формулы (Ia, син) к соединениям формулы (Ib, анти) составляет от 90:10 до 99:1. Поэтому конкретным преимуществом особенно предпочтительного варианта (bb) данного способа является то, что легко можно получить смеси соединений формулы (I), которые имеют соотношение син/анти с большим преимуществом син-изомера. В контексте настоящего изобретения "смесь соединений формулы (I), которая имеет соотношение син/анти с большим преимуществом син-изомера" понимают как смесь соединений формулы (I), в которой отношение соединений формулы (Ia, син) к соединениям формулы (Ib, анти) составляет от 90:10 до 99:1. В способе согласно изобретению соотношение син/анти в конечных продуктах, полученных данным способом, 9-монозамещенных бензонорборнен-5-иламидах пиразолил-4-карбоновой кислоты формулы (I), по существу, определяют по соотношению син/анти 5-аминобензонорборненов формулы (IV),образованных при осуществлении технологической стадии (b). При осуществлении технологической стадии (с) амидирование 5-аминобензонорборненов с образованием конечных продуктов способа, соединений формулы (I) доля син-изомеров остается, по существу,без изменения. После осуществления технологической стадии (с) доля син-изомеров соединений формулы (I) может быть увеличена посредством фракционной кристаллизации с использованием подходящих раствори- 16013638 телей, например с использованием смеси трет-бутилметилового эфир/гексан или метанола в качестве растворителя. В указанном особенно предпочтительном варианте (bb) способа согласно изобретению соединения формулы (III), полученные согласно технологической стадии (а) где R1 и R2 имеют значения, которые определены для формулы (I),подвергают взаимодействию (bb) с водородом в присутствии родиевого катализатора с образованием соединения формулы (IV) где R1 и R2 имеют значения, которые определены для формулы (I) и где отношение соединений формулы (IVa, син) к соединениям формулы (IVb, анти) составляет более 90:10. Полученные соединения затем используют на технологической стадии (с). После осуществления технологической стадии (с) доля син-изомеров, по существу, не изменяется. Указанный особенно предпочтительный вариант способа соответственно дает соединения формулы (I), в которых отношение соединений формулы (Ia, син) к соединениям формулы (Ib, анти) составляет более 90:10,Технологическая стадия (bb). Подходящими родиевыми катализаторами являются, например, Rh/C, RhAl2O3 или Rh2O3 и их смеси. Особое предпочтение отдается Rh/C. Реакцию предпочтительно осуществляют в присутствии инертного растворителя. Подходящими растворителями являются, например, спирты, такие как метанол, этанол, пропанол или изопропанол, или апротонные растворители, такие как тетрагидрофуран, трет-бутилметиловый эфир, этилацетат, диоксан или толуол, и их смеси; особенно предпочтительными являются этанол или метанол. Температуры обычно составляют от 0 до 80 С, при этом предпочтителен диапазон температур от 0 до 25 С. Время реакции для данной реакции обычно составляет от 1 до 100 ч, предпочтительно от 1 до 24 ч. Также в особенно предпочтительном варианте (bb) осуществления настоящего изобретения благодаря выбору подходящих условий реакции для стадии реакции (a) соединение формулы (III), полученное на стадии реакции (a), можно подвергнуть взаимодействию с образованием соединения формулы (IV) непосредственно, без выделения промежуточных продуктов, путем полного гидрирования. Указанный особенно предпочтительный вариант осуществления настоящего изобретения обеспечивает важное преимущество способа согласно изобретению. В случае такой предпочтительной схемы осуществления варианта (bb) всего 5 экв. восстановителя предпочтительно используют на стадиях реакции (a) и (b) вместе. В случае такой предпочтительной схемы осуществления варианта (bb) один и тот же металлический катализатор предпочтительно используют на стадии реакции (a) и стадии реакции (b). Подходящие количества металлического катализатора для указанной предпочтительной схемы осуществления варианта (bb) составляют, например, от 0,001 до 0,5 экв., в частности от 0,01 до 0,1 экв. Комбинацию стадий реакции (a) и (b) в случае данной предпочтительной схемы осуществления варианта(bb) предпочтительно осуществляют в закрытом сосуде. В такой схеме избыток водорода вводят, например, в реакционную смесь, в которой уже присутствует металлический катализатор. Затем контролируют расход водорода на протяжении периода протекания реакции. В случае указанной предпочтительной схемы осуществления варианта (bb) реакцию предпочтительно останавливают, когда израсходовано требуемое количество водорода, которое более предпочтительно составляет 5 экв. В случае указанной предпочтительной схемы осуществления варианта (bb) реакция может быть проведена при атмосферном давлении или при повышенном давлении до 150 бар, при этом предпочтительным является атмосферное давление или повышенное давление до 50 бар, особенно предпочтительно атмосферное давление и повышенное давление до 20 бар и еще более предпочтительно атмосферное давление или повышенное давление до 6 бар. Время реакции в указанном предпочтительном варианте осуществления реакции обычно составляет от 1 до 100 ч, предпочтительно от 1 до 24 ч. Описанный выше особенно предпочтительный вариант (bb) осуществления способа согласно изобретению более подробно объясняется в следующем примере.- 17013638 Пример Р 11. Получение 9-изопропил-5-аминобензонорборнена (соединениеZ3.11). 95 г (0,42 моль) 9-изопропилиден-5-нитро-бензонорборнадиена (Z1.11) в 1 л тетрагидрофурана полностью гидрировали при 25 С и нормальном давлении в присутствии 50 г 5% Rh/C. Через 3 дня расходование водорода заканчивалось. Реакционную смесь фильтровали, растворитель удаляли в вакууме и осуществляли очистку хроматографией на силикагеле, используя смесь этилацетат/гексан (1:4) в качестве элюента. Получали 71,8 г (85% от теоретического) 9-изопропил-5-аминобензонорборнена в форме масла с соотношением син/анти 92:8 по данным 1 Н-ЯМР. Соединения формулы (IV) где R1 и R2 имеют значения, которые определены для формулы (I), в которой отношение соединений формулы (IVa, син) где R1 и R2 имеют значения, которые определены для формулы (I),к соединениям формулы (IVb, анти) где R1 и R2 имеют значения, которые определены для формулы (I),составляет от 90:10 до 99:1,являются полезными промежуточными продуктами при получении соединений формулы (I) и созданы специально для данного способа согласно изобретению. Настоящее изобретение соответственно также относится к таким соединениям. Особенно полезными для получения соединений формулы (I) являются соединения формулы (IV), в которых отношение соединений формулы (IVa, син) к соединениям формулы (IVb, анти) составляет от 91:9 до 99:1. Еще более полезными для получения соединений формулы (I) являются соединения формулы (IV),в которых отношение соединений формулы (IVa, син) к соединениям формулы (IVb, анти) составляет от 92:8 до 98:2. Еще более полезными для получения соединений формулы (I) являются соединения формулы (IV),в которых отношение соединений формулы (IVa, син) к соединениям формулы (IVb, анти) составляет примерно 95:5. Особенно подходящими в качестве промежуточных продуктов для получения соединений формулы(I) являются соединения формулы (IV), в которых R1 и R2 означают метил. Как описано на схеме 2, 6-нитроантраниловая кислота (соединение формулы А на схеме 2) может быть использована для получения соединений формулы (II). Было обнаружено, что 6-нитроантраниловая кислота может быть легко и с высоким региоселективным выходом получена согласно следующей схеме: Схема 3 На приведенной схеме 3-нитрофталимид (соединение формулы Е) превращают в результате взаимодействия с водным раствором основания, таким как, например, водный раствор гидроксида натрия, и последующего взаимодействия с водным раствором кислоты, таким как, например, водный раствор соляной кислоты, в 6-нитрофталамовую кислоты (соединение формулы D). 6-Нитрофталамовую кислоту получают с высоким региоселективным выходом; обычно достигают более 70% на основании измерения относительно исходного вещества 3-нитрофталимида. Затем на второй стадии 6-нитрофталамовую кислоту превращают в требуемую 6-нитроантраниловую кислоту (соединение формулы А). На данной стадии 6-нитрофталамовая кислота,например, может быть подвергнута взаимодействию сначала с водным раствором основания, таким как,например, водный раствор гидроксида натрия, и гипохлоритом натрия и затем водным раствором кислоты, таким как, например, водный раствор соляной кислоты.- 18013638 3-Нитрофталимид является коммерчески доступным. Схема 2 более подробно объясняется в следующем примере. Пример A3. Получение 6-нитроантраниловой кислоты.(a) Получение 6-нитрофталамовой кислоты. Суспензию 57,6 г 3-нитрофталимида (0,3 моль) в 672 г воды охлаждали до 5 С. За максимально короткий период времени добавляли 80 г 30% раствора гидроксида натрия (0,6 моль, 2 экв.). Через 2 ч при 5 С реакционную смесь добавляли при 5 С к 65 г 32% раствора соляной кислоты (0,57 моль, 1,9 экв.),который перед этим разбавляли 72 мл воды. Значение рН доводили до 2,0-2,5 и неочищенный продукт,который выпадал в виде кристаллов, отфильтровывали и дважды промывали водой. Получали 6-нитрофталамовую кислоту с выходом 73%.(b) Получение 6-нитроантраниловой кислоты. Суспензию 126,3 г 6-нитрофталамовой кислоты (0,6 моль) в 429 г воды охлаждали до 5 С. Добавляли 80 г 30% раствора гидроксида натрия (0,6 моль, 1 экв.) в течение 0,5 ч при 5 С. Реакционную смесь вместе с 288 г 15,2% раствора гипохлорита натрия (0,6 моль, 1 эквивалент) медленно добавляли к раствору гидроксида натрия (235,2 г 30% раствора гидроксида натрия (1,76 моль, 3 экв.), разбавленного 280 г воды), предварительно нагретого до 43 С. Во время добавления температуру поддерживали на уровне 40-45 С. Через 1 ч при 40-45 С реакционную смесь добавляли к смеси 268 г 32% соляной кислоты (2,35 моль, 3,9 экв.) и 200 г воды. Во время добавления температуру поддерживали на уровне 20-45 С. Неочищенный продукт, который выпадал в виде кристаллов, отфильтровывали и 3 раза промывали водой. Получали 6-нитроантраниловую кислоту с выходом 70%. Настоящее изобретение, кроме того, относится к способу получения соединений формулы (IV) где R1 и R2, каждый независимо, означают водород или C1-C5-алкил, который включает в себя:(a) взаимодействие соединения формулы (II) где R1 и R2 имеют значения, которые определены для формулы (IV),по меньшей мере с одним восстановителем с образованием соединения формулы (III) где R1 и R2 имеют значения, которые определены для формулы (IV); и(b) превращение полученного соединения с использованием по меньшей мере одного восстановителя в соединение формулы (IV). В данном способе согласно изобретению для получения соединений формулы (IV) подстадию a)(получение соединений формулы (III и подстадию (b) (получение соединения формулы (IV осуществляют, как описано выше. Также в данном способе согласно изобретению для получения соединений формулы (IV) благодаря выбору подходящих условий реакции для стадии реакции (a) соединение формулы (III), полученное на стадии реакции (a), может быть подвергнуто взаимодействию, например, описанным выше образом, с образованием соединения формулы (IV) непосредственно, без выделения промежуточных продуктов,путем полного гидрирования. Настоящее изобретение, кроме того, относится к способу получения соединений формулы (I) где R1 и R2, каждый независимо, означают водород или C1-C5-алкил и(аа) взаимодействие 6-нитроантраниловой кислоты с нитритом, выбранным из изоамилнитрита и трет-бутилнитрита, и с соединением формулы (С) где R1 и R2 имеют значения, которые определены для формулы (I),с образованием соединения формулы (II) где R1 и R2 имеют значения, которые определены для формулы (I), и(a) взаимодействие полученного соединения с восстановителем с образованием соединения формулы (III) где R1 и R2 имеют значения, которые определены для формулы (I); и(b) взаимодействие полученного соединения с восстановителем с образованием соединения формулы (IV) где R1 и R2 имеют значения, которые определены для формулы (I); и(с) превращение полученного соединения в соединение формулы (I) посредством взаимодействия с соединением формулы (V) где Q означает хлор, бром, йод или гидроксигруппу и R3 имеет значение, определенное для формулы (I). В данном способе получения соединений формулы (I) стадии реакции (а), (b) и (с) осуществляют,как описано выше. Подходящими апротонными растворителями для стадии реакции (аа) являются, например, диэтиловый эфир, бутилметиловый эфир, этилацетат, дихлорметан, ацетон, тетрагидрофуран,толуол, 2-бутанон или диметоксиэтан. Подходящие температуры для стадии реакции (аа) составляют от температуры окружающей среды до 100 С, предпочтительно от 35 до 80 С. Особенно предпочтительным вариантом данного способа является способ получения соединений формулы (I), в которых R1 и R2 означают метил и R3 означает CF2H, который включает в себя:(аа) взаимодействие 6-нитроантраниловой кислоты с трет-бутилнитритом и с соединением формулы (С), где R1 и R2 означают метил, с образованием соединения формулы (II), где R1 и R2 означают метил; и(a) взаимодействие полученного соединения с водородом в присутствии катализатора родий/уголь с образованием соединения формулы (III), где R1 и R2 означают метил; и(b) взаимодействие полученного соединения с водородом в присутствии катализатора никеля Ренея с образованием соединения формулы (IV), где R1 и R2 означают метил; и(c) превращение полученного соединения в соединение формулы (I) в результате взаимодействия с соединением формулы (V), где Q означает гидроксигруппу и R3 означает CF2H, в присутствии активирующего агента, предпочтительно в присутствии хлорангидрида бис-(2-оксо-3-оксазолидинил)фосфиновой кислоты, при этом реакцию осуществляют в присутствии основания, предпочтительно в присутствии триэтиламина.- 20013638 Более предпочтительным вариантом данного способа является способ получения соединений формулы (I), где R1 и R2 означают метил и R3 означает CF2H, который включает в себя:(аа) взаимодействие 6-нитроантраниловой кислоты с трет-бутилнитритом и с соединением формулы (С), где R1 и R2 означают метил, с образованием соединения формулы (II), где R1 и R2 означают метил, при этом в качестве растворителя используют диметоксиэтан, и(a) взаимодействие полученного соединения с водородом в присутствии катализатора родий/уголь с образованием соединения формулы (III), где R1 и R2 означают метил, при этом в качестве растворителя используют тетрагидрофуран; и(b) взаимодействие полученного соединения с водородом в присутствии катализатора никеле Ренея с образованием соединения формулы (IV), где R1 и R2 означают метил, при этом в качестве растворителя используют тетрагидрофуран; и(c) превращение полученного соединения в соединение формулы (I) в результате взаимодействия соединения формулы (V), где Q означает гидроксигруппу и R3 означает CF2H, в присутствии хлорангидрида бис-(2-оксо-3-оксазолидинил)фосфиновой кислоты, при этом в качестве растворителя используют дихлорметан и реакцию осуществляют в присутствии триэтиламина. Соединения формулы (II) где R1 и R2, каждый независимо, означают водород или C3-C5-алкил,являются новыми и были созданы специально для осуществления способа согласно изобретению. Соответственно настоящее изобретение также относится к соединениям формулы (II), где R1 и R2,каждый независимо, означают водород или C1-C5-алкил. Особенно предпочтительны соединения формулы (II), где R1 и R2 означают метил. Некоторые соединения формулы (III) где R1 и R2, каждый независимо, означают водород или C1-C5-алкил,являются новыми и были созданы специально для осуществления способа согласно изобретению. Соответственно настоящее изобретение также относится к соединениям формулы (II), где R1 и R2,каждый независимо, означают водород или C1-C5-алкил, за исключением 9-изопропилиден-5 аминобензонорборнена. Некоторые соединения формулы (IV) где R1 и R2, каждый независимо, означают водород или C1-C5-алкил,являются новыми и были созданы специально для осуществления способа согласно изобретению. Соответственно настоящее изобретение также относится к соединениям формулы (IV), где R1 и R2,каждый независимо, означают водород или C1-C6-алкил, за исключением 9-изопропил-5 аминобензонорборнена. Соединения формулы (IIA) где R1 и R2, каждый независимо, означают водород или C1-C5-алкил,являются новыми и были созданы специально для осуществления способа согласно изобретению. Соответственно настоящее изобретение также относится к соединениям формулы (IIA), где R1 и R2,каждый независимо, означают водород или C1-C5-алкил. Особенно предпочтительны соединения формулы (IIA), где R1 и R2 означают метил. где R1 и R2, каждый независимо, означают водород или C1-C5-алкил и R3 означает CF3 или CF2H,также могут быть получены с использованием соединений формулы (VI) где L означает C1-C6-алкиленовую цепь и R3 имеет значение, определенное для формулы (I),посредством(d) взаимодействия соединения формулы (Va) где Q1 означает хлор, фтор, бром, йод или C1-C6-алкоксигруппу и R3 имеет значение, определенное для формулы (I),с соединением формулы (VII)HO-L-OH,(VII) где L имеет значение, определенное для формулы (VI),с образованием соединения формулы (VI); и(e) превращения полученного соединения в соединение формулы I в результате взаимодействия с соединением формулы (IV) где R1 и R2 имеют значения, которые определены для формулы (I). В данном способе соединения формулы (IV) могут быть получены, как описано выше. Настоящее изобретение также относится к получению соединений формулы (I) с использованием соединений формулы (VI) и осуществлению технологических стадий (d) и (е). Алкиленовые цепи в определениях заместителей соединений формулы (VI) могут быть неразветвленными или разветвленными и представляют собой, например, цепь метилена или цепь этилена или неразветвленные или разветвленные C3-C6-алкиленовые цепи, такие как -СН 2-СН 2-СН 2- в качестве неразветвленной цепи С 3-алкилена или -СН 2-С(СН 3)2-СН 2- в качестве разветвленной цепи С 5-алкилена. Технологическая стадия (d). Особенно подходящими для применения на технологической стадии (d) являются соединения формулы (Va), где Q1 означает хлор, фтор, бром или йод и R3 имеет значение, определенное для формулы (I). Особенно предпочтительными являются соединения формулы (Va), где Q1 означает хлор и R3 имеет значение, определенное для формулы (I). Особенно подходящими для применения на технологической стадии (d) являются соединения формулы (VII), где L означает этиленовую цепь. В реакциях согласно изобретению соединения формулы (Va) используют, например, в эквимолярных количествах или в избытке по сравнению с соединениями формулы (VII), предпочтительно в избытке до 4-кратного, особенно предпочтительно в 2-4-кратном избытке, еще более предпочтительно в 2-кратном избытке. Реакцию предпочтительно осуществляют в присутствии инертного растворителя. Подходящими растворителями являются, например, хлорбензол, дихлорметан, хлороформ, толуол, тетрагидрофуран,диэтиловый эфир, бутилметиловый эфир или вода, и их смеси, при этом особенно предпочтительным является хлорбензол.- 22013638 Реакцию предпочтительно осуществляют в присутствии основания. Подходящими основаниями являются, например, аминные основания, такие как, например,триэтиламин или пиридин; или неорганические основания, такие как карбонаты, например K2CO3 илиNa2CO3, или гидроксиды, например NaOH или KOH, при этом предпочтительны триалкиламины и особенно предпочтителен триэтиламин. Подходящие количества основания для реакции составляют, например, от 1 до 1,5 экв., главным образом от 1 до 1,2 экв. Температуры обычно составляют от 0 до 150 С, предпочтительным является диапазон температур от 50 до 100 С и особенно предпочтителен диапазон температур от 60 до 100 С. Реакция может быть осуществлена при атмосферном давлении или при повышенном давлении,предпочтительным является атмосферное давление. Время реакции для данной реакции обычно составляет от 1 до 48 ч, предпочтительно от 1 до 24 ч. Соединения формулы (VII) коммерчески доступны или могут быть получены согласно известным способам. Технологическая стадия (e). В реакциях согласно изобретению соединения формулы (IV) используют, например, в эквимолярных количествах или в избытке по сравнению с соединениями формулы (VI), предпочтительно в избыточном количестве до 4-кратного избытка, особенно предпочтителен 2-4-кратный избыток, еще более предпочтителен 2-кратный избыток. Реакция может быть осуществлена в присутствии инертного растворителя. Подходящими растворителями являются, например, хлорбензол, дихлорметан, хлороформ, толуол, ксилен, тетрагидрофуран,диэтиловый эфир или бутилметиловый эфир и их смеси, особенно предпочтительным является хлорбензол. Реакция также может быть осуществлена в отсутствие растворителя. Реакцию предпочтительно осуществляют в присутствии основания. Подходящими основаниями являются, например, аминные основания, такие как, например,триэтиламин или пиридин; неорганические основания, такие как карбонаты, например K2CO3 илиNa2CO3, или гидроксиды, например NaOH или KOH; или алкоксиды, такие как, например, трет-бутоксид калия, предпочтителен, например, трет-бутоксид калия. Подходящие количества основания для реакции составляют, например, от 1 до 1,5 экв., особенно от 1 до 1,2 экв. Температуры обычно составляют от 0 до 150 С, при этом предпочтительным является диапазон температур от 50 до 150 С и особенно предпочтителен диапазон температур от 80 до 120 С. Реакция может быть осуществлена при атмосферном давлении или при повышенном давлении, при этом атмосферное давление является предпочтительным. Время реакции для данной реакции обычно составляет от 1 до 48 ч, предпочтительно от 1 до 24 ч. Описанный выше способ, к которому также относится настоящее изобретение, объясняется со ссылкой на следующие примеры. Пример Р 12. Получение 2-(3-дифторметил-1-метил-1 Н-пиразол-4-карбонилокси)этилового эфира 3 дифторметил-1-метил-1 Н-пиразол-4-карбоновой кислоты (соединениеZ4.02) 6,2 г этиленгликоля (0,1 моль, 0,5 экв.), 22,2 г триэтиламина (0,22 ммоль, 1,1 экв.) и 50 мл хлорбензола добавляли при температуре окружающей среды к 49% раствору 38,9 г 3-дифторметил-1-метил-1 Нпиразол-4-карбонилхлорида (0,2 моль) в хлорбензоле. Реакционную смесь перемешивали в течение 5 ч при 80 С. Добавляли воду и органическую фазу экстрагировали метилизобутилкетоном. Добавляли 7 г активированного угля и реакционную смесь фильтровали. Органическую фазу концентрировали. Получали 35,9 г 2-(3-дифторметил-1-метил-1 Н-пиразол-4-карбонилокси)этилового эфира 3-дифторметил-1 метил-1 Н-пиразол-4-карбоновой кислоты (выход: 95%). 1 6,9 г 9-изопропил-5-аминобензонорборнена (соединениеZ3.11, отношение син/анти 90:10; 32,8 ммоль, 2,05 экв.) и 1,9 г трет-бутоксида калия (16 ммоль, 1 экв.) добавляли к раствору 6 г (16 ммоль) 2-(3-дифторметил-1-метил-1 Н-пиразол-4-карбонилокси)этилового эфира 3-дифторметил-1-метил-1 Нпиразол-4-карбоновой кислоты (соединениеZ4.02, полученное согласно примеру Р 12) в 60 мл хлорбензола. Реакционную смесь нагревали до 95 С и растворитель хлорбензол полностью удаляли в вакууме. Реакционную смесь нагревали до 120 С и перемешивали в течение 20 ч. Затем добавляли 30 мл хлорбензола. Органическую фазу дважды экстрагировали водой сначала при низком рН, затем при высоком рН. Органическую фазу концентрировали отгонкой хлорбензола. Получали 8 г (9-изопропил-1,2,3,4 тетрагидро-1,4-метанонафтален-5-ил)амида 3-дифторметил-1-метил-1 Н-пиразол-4-карбоновой кислоты в форме масла коричневого цвета (выход сырого продукта: 51%). Предпочтительные соединения формулы (VI) перечислены в табл. 6. Таблица 6 Соединения формулы (VI) Соединения формулы (VI) отличаются доступностью и хорошими свойствами, необходимыми для обработки и, кроме того, являются недорогими. Соединения формулы (VI) где L означает цепь C1-C6-алкилена и R3 означает CF3 или CF2H,являются новыми и были созданы специально для осуществления способа согласно изобретению. Соответственно настоящее изобретение также относится к соединениям формулы (VI), где L означает цепь C1-C6-алкилена и R3 означает CF3 или CF2H. Предпочтительны соединения формулы (VI), где L означает цепь этилена. Предпочтительны соединения формулы (VI), где R3 означает CF2H. Особенно предпочтительны соединения формулы (VI), где L означает цепь этилена и R3 означает CF2H. Для лучшего представления указанные выше реакции суммированы на схеме 4.(1) получению соединений формулы (I), исходя из соединений формулы (II), с использованием стадий (a), (b) и (с);(2) получению соединений формулы (I), исходя из соединений формулы (II), с использованием стадий а 2), (b) и (с);(3) получению соединений формулы (IV), исходя из соединений формулы (II), с использованием стадий (a) и (b);(4) получению соединений формулы (IV), исходя из соединений формулы (II), с использованием стадий а 2) и (b);(5) получению соединений формулы (I), исходя из соединений формулы А, с использованием стадий (aa), (a), (b) и (с);(6) получению соединения формулы (I), исходя из соединений формулы А, с использованием стадий (aa), а 2), (b) и с);(7) получению соединений формулы (I), исходя из соединения формулы (I), с использованием стадий a), (b), (d) и (e) и(8) получению соединений формулы (I), исходя из соединения формулы (I), с использованием стадий (а 2), (b), (d) и (e). Изобретение также относится к промежуточным продуктам для применения в указанных выше способах. Настоящее изобретение, кроме того, относится к новой кристаллической модификации(9-изопролил-1,2,3,4-тетрагидро-1,4-метанонафтален-5-ил)амида син-3-дифторметил-1-метил-1 Н-пиразол 4-карбоновой кислоты, к содержащим указанное соединение композициям и к их применению для борьбы с заражением культурных растений грибами.(9-Изопропил-1,2,3,4-тетрагидро-1,4-метанонафтален-5-ил)амид 3-дифторметил-1-метил-1 Н-пиразол 4-карбоновой кислоты (соединениеA.11) является эффективным против ряда заболеваний, вызванных фитопатогенными грибами. Указанный амид представляет собой хиральную молекулу, которая может встречаться в 4 стереоизомерных формах, показанных в виде энантиомеров формул А.11 (син 1), А.11 Согласно изобретению (9-изопропил-1,2,3,4-тетрагидро-1,4-метанонафтален-5-ил)амид син-3 дифторметил-1-метил-1 Н-пиразол-4-карбоновой кислоты означает рацемическую смесь соединений формулы А.11 (син 1) и соединений формулы А.11 (син 2). Кристаллическое вещество (9-изопропил-1,2, 3,4-тетрагидро-1,4-метанонафтален-5-ил)амид син-3 дифторметил-1-метил-1 Н-пиразол-4-карбоновой кислоты, имеющее одну точку плавления 110-112 С(чистота диастереомера 90%), описано в WO 04/035589. Указанное кристаллическое вещество определяют в данном описании как "кристаллическая модификация А" (9-изопропил-1,2,3,4-тетрагидро-1,4 метанонафтален-5-ил) амида син-3-дифторметил-1-метил-1 Н-пиразол-4-карбоновой кислоты. Различные кристаллические модификации химических соединений могут иметь очень разные физические свойства, что может приводить к непредвиденным проблемам при промышленном получении и обработке таких соединений. Характеристики кристаллических модификаций часто оказывают решающее влияние на возможность выделения (фильтрование), возможность перемешивания (объем кристалла), поверхностную активность (пенообразование), скорость сушки, растворимость, качество, возможность приготовления композиций и стабильность при хранении и биологическую эффективность, например, фармацевтически активных соединений и соединений, активных при использовании в сельском хозяйстве. Свойства, связанные, например, с измельчением и приготовлением препаратов (например, гранулированием) продуктов, могут быть совершенно разными в зависимости от соответствующей кристаллической модификации. Так как в зависимости от предполагаемого способа приготовления препарата важными являются разные физические свойства соответствующих продуктов, особенно полезно найти оптимально подходящую кристаллическую форму для соответствующего способа приготовления препарата. Кроме того, модификация может внезапно превратиться в другую нежелательную модификацию в определенных термодинамических условиях. Количество полиморфных состояний непредсказуемо. Наиболее стабильное полимерное состояние может не образоваться, так как скорость образования новых кристаллов из раствора может быть очень низкой. Поэтому целью настоящего изобретения является специальное получение новых кристаллических модификаций (9-изопропил-1,2,3,4-тетрагидро-1,4-метанонафтален-5-ил)амида син-3-дифторметил-1 метил-1 Н-пиразол-4-карбоновой кислоты с хорошими свойствами в отношении приготовления препарата активного ингредиента и возможности его хранения. Настоящее изобретение относится к кристаллической модификации В (9-изопропил-1,2,3,4 тетрагидро-1,4-метанонафтален-5-ил)амида син-3-дифторметил-1-метил-1 Н-пиразол-4-карбоновой кислоты, при этом указанная кристаллическая модификация характеризуется картиной порошковой дифракции рентгеновских лучей, выраженной в виде межплоскостных расстояний d и относительных интенсивностей, при этом указанная картина порошковой дифракции рентгеновских лучей содержит следующие характеристические линии: 13,42(сильная), 9,76(средняя), 6,93(средняя), 6,74(средняя), 4,79(средняя), 4,73(средняя) и 3,66(средняя). Картина порошковой дифракции рентгенов- 26013638 ских лучей была получена с использованием усовершенствованного рентгеновского дифрактометра для исследования порошков Bruker-AXS D8, источник: Cu K1. Кристаллическая модификация В отличается от кристаллической модификации А по термодинамической стабильности, физическим параметрам, таким как картина поглощения ИК-излучения и спектры комбинационного рассеяния света, в рентгеновских структурных исследованиях и по своей растворимости в воде и других жидких носителях, обычно используемых в агрохимических препаратах. Модификация В имеет значительные преимущества по сравнению с модификацией А. Таким образом, например, ДСК, тесты на растворимость и другие эксперименты показали, что модификация В неожиданно обладает значительно повышенной термодинамической стабильностью по сравнению с модификацией А. Например, растворимость в воде модификации В ниже, чем растворимость в воде модификации А в соответствующих диапазонах температур. В водных дисперсиях полиморф с наиболее низкой растворимостью является наиболее стабильным. Полиморф с более высокой растворимостью является нестабильным, так как окружающая водная фаза будет сверхнасыщенной по сравнению с более стабильным полиморфом, приводя к растворению более нестабильного полиморфа и кристаллизации более стабильного полиморфа. Возникающее в результате изменение размеров частиц может приводить к изменению стабильности образуемой дисперсии. Для фунгицида особенно важно, чтобы агрохимический препарат гарантировал высокую и воспроизводимую стабильность в течение длительного периода времени. Указанные непременные условия выполняют благодаря включению соединения (9-изопропил-1,2,3,4-тетрагидро-1,4-метанонафтален-5 ил)амида син-3-дифторметил-1-метил-1 Н-пиразол-4-карбоновой кислоты в кристаллической модификации В вследствие высокой термодинамической стабильности указанной модификации по сравнению с кристаллической модификацией А. В частности, это проявляется в твердой дозированной форме агрохимического препарата. Если активный ингредиент подвергается процессу превращения, то это также может влиять на стабильность твердого препарата. Соответственно агрохимически активные ингредиенты или их полиморфные формы, которые представляют особый интерес для разработки новых активных ингредиентов, являются ингредиентами, которые обладают высокой стабильностью и не имеют указанных выше недостатков. Кристаллическая модификация В удовлетворяет таким условиям. Кристаллическую модификацию В получали, как описано в примерах Р 5, Р 6 и Р 14. Кристаллическую модификацию А получали, как описано в примере А 4. Кристаллическую модификацию В также можно получить кристаллизацией на затравках из смесей метанол/вода; обычно можно использовать введение 10% затравки. Например, кристаллическую модификацию В также можно получить кристаллизацией на затравках из смеси 20% вода/метанол. Модификация В имеет картину порошковой дифракции рентгеновских лучей с характеристическими линиями с межплоскостными расстояниями (d-значениями в ангстремах): 13,42(сильная), 9,76(средняя), 6,93(средняя), 6,74(средняя), 4,79(средняя), 4,73(средняя) и 3,66(средняя) (см. табл. 7 или фиг. 1), Напротив, модификация А имеет картину порошковой дифракции рентгеновских лучей с характеристическими линиями с межплоскостными расстояниями (d-значениями): 21,98(средняя), 10,8 1 (слабая), 8,79(слабая), 6,51(слабая), 4,65(средняя) и 4,20(средняя) (см. табл. 8 или фиг. 2). Картины порошковой дифракции рентгеновских лучей получали, используя усовершенствованный рентгеновский дифрактометр для исследования порошков Bruker-AXS D8, источник: Cu K1. Таблица 7 Характеристика модификации В(картина порошковой дифракции рентгеновских лучей)(картина порошковой дифракции рентгеновских лучей) В спектре комбинационного рассеяния света модификация В отличается от модификации А по форме и относительной интенсивности многих полос (см. фиг. 3 и 4). Например, можно использовать микроскоп для исследования комбинационного рассеяния Thermo Electron Almega (785 нм, установочные параметры для высокого разрешения) для регистрации каждого из спектров комбинационного рассеяния света. Характеристикой модификации В также является термограмма, полученная в ДСК (дифференциальная сканирующая калориметрия, см. фиг. 5). Модификация В имеет эндотермический пик в диапазоне от 120 до 128 С в зависимости от чистоты. Например, кристаллическая модификация В в очищенной форме имеет пик при температуре 128 С и эндотермический сигнал около 90 Дж/г. Такая термограмма характерно отличается от термограммы модификации А (см. фиг. 6), которая имеет эндотермический пик около 112 С и эндотермический сигнал 76 Дж/г. Измерение осуществляли на ДСК Metler Toledo 820 в закрытом тигле при скорости нагревания 10 К/мин. Обычно количество образца составляет около 5 мг. Настоящее изобретение предпочтительно относится к кристаллической модификации В(9-изопропил-1,2,3,4-тетрагидро-1,4-метанонафтален-5-ил)амида син-3-дифторметил-1-метил-1 Н-пиразол 4-карбоновой кислоты, при этом указанная кристаллическая модификация характеризуется картиной порошковой дифракции рентгеновских лучей, выраженной в значениях межплоскостных расстояний d и относительных интенсивностях, и указанная картина порошковой дифракции рентгеновских лучей содержит следующие характеристические линии: 13,42(сильная), 9,76(средняя), 6,93(средняя), 6,74(средняя), 6,23(слабая), 5,66(средняя), 4,84(средняя), 4,79(средняя), 4,73(средняя), 3,98(средняя), 3,81(средняя) и 3,66(средняя). Настоящее изобретение предпочтительно относится к кристаллической модификации В(9-изопропил-1,2,3,4-тетрагидро-1,4-метанонафтален-5-ил)амида син-3-дифторметил-1-метил-1 Н-пиразол 4-карбоновой кислоты, при этом указанная кристаллическая модификация характеризуется картиной порошковой дифракции рентгеновских лучей, изображенной на фиг. 1. Настоящее изобретение предпочтительно относится к кристаллической модификации В(9-изопропил-1,2,3,4-тетрагидро-1,4-метанонафтален-5-ил)амида син-3-дифторметил-1-метил-1 Нпиразол-4-карбоновой кислоты, при этом указанная кристаллическая модификация характеризуется наличием на термограмме, полученной при дифференциальной сканирующей калориметрии, эндотермического сигнала с пиком в диапазоне от 120 до 128 С. Настоящее изобретение предпочтительно относится к кристаллической модификации В(9-изопропил-1,2,3,4-тетрагидро-1,4-метанонафтален-5-ил)амида син-3-дифторметил-1-метил-1 Н-пиразол 4-карбоновой кислоты, по существу, в чистой форме. Согласно изобретению термин "по существу, чистая" означает присутствие предпочтительно по меньшей мере 75 мас.% кристаллической модификации В (9-изопропил-1,2,3,4-тетрагидро-1,4 метанонафтален-5-ил)амида син-3-дифторметил-1-метил-1 Н-пиразол-4-карбоновой кислоты, более предпочтительно по меньшей мере 80 мас.% Настоящее изобретение предпочтительно относится к кристаллической модификации В(9-изопропил-1,2,3,4-тетрагидро-1,4-метанонафтален-5-ил)амида син-3-дифторметил-1-метил-1 Н-пиразол 4-карбоновой кислоты в чистой форме. Согласно изобретению термин "чистая" означает присутствие по меньшей мере 90 мас.% кристаллической модификации В (9-изопропил-1,2,3,4-тетрагидро-1,4- 28013638 метанонафтален-5-ил)амида син-3-дифторметил-1-метил-1 Н-лиразол-4-карбоновой кислоты, более предпочтительно по меньшей мере 95 мас.%, еще более предпочтительно по меньшей мере 98 мас.%. Настоящее изобретение предпочтительно относится к кристаллической модификации В(9-изопропил-1,2,3,4-тетрагидро-1,4 метанонафтален-5-ил)амида син-3-дифторметил-1-метил-1 Н-пиразол-4-карбоновой кислоты. Кристаллическую модификацию В (9-изопропил-1,2,3,4-тетрагидро-1,4-метанонафтален-5-ил)амида син-3-дифторметил-1-метил-1 Н-пиразол-4-карбоновой кислоты можно использовать против микроорганизмов, которые вызывают заболевания полезных растений, в частности против фитопатогенных грибов. Кристаллическая модификация В особенно эффективна против фитопатогенных грибов, относящихся к следующим классам:Oomycetes (например, Phytophthora, Peronospora, Pseudoperonospora, Albugo, Bremia, Pythium,Pseudosclerospora, Plasmopara). Согласно изобретению "полезные растения" обычно включают следующие виды растений: семечковые плодовые; косточковые плодовые; виноград; землянику; томаты; картофель; перец; латук; сахарную свеклу; арахис; пшеницу; рожь; ячмень; тритикале; овес; рис; кукурузу; хлопок; сою; рапс; зернобобовые культуры; подсолнечник; кофе; чай; сахарный тростник; банан; овощи, такие как огурцы, бобы и тыквы; табак; фруктовые и декоративные растения в садоводстве и виноградарстве; дерновые и газонные растения. Следует понимать, что термин "полезные растения" также включает (1) растения, которым придана толерантность к гербицидам, подобным бромоксинилу, или к классам гербицидов в результате обычных способов селекции или генетической инженерии; (2) растения, которые были трансформированы с использованием технологии рекомбинантных ДНК так, что они способны синтезировать один или несколько избирательно действующих токсинов, таких как токсины, известные, например, из продуцирующих токсины бактерий, особенно бактерий рода Bacillus; (3) растения, которые были трансформированы с использованием технологии рекомбинантных ДНК так, что они способны синтезировать вещества против патогенов, обладающие избирательным действием, такие как, например, так называемые "связанные с патогенезом белки"; и (4) растения, которые также могут иметь одну или несколько "особенностей,связанных с продуктивностью" (особенностей, которые обеспечивают повышенное качество продукта),таких как особенности, которые изменяют состав жирных кислот растения/семени, например обеспечивают измененные уровни олеиновой кислоты и/или стеариновой кислоты, или особенности, которые обеспечивают получение промышленных продуктов, таких как, например, фармацевтические средства(включая антитела), а также промышленные ферменты (например фитаза, ксиланаза, глюканаза). Кристаллическая модификация В также эффективна для защиты природных веществ растительного и/или животного происхождения, их обработанных форм или технических материалов от поражения грибами. Количество применяемой кристаллической модификации В будет зависеть от различных факторов,таких как объект обработки, такой как, например, растения, почва или семена; тип обработки, такой как,например, распыление, опыление или протравливание семян; цель обработки, например профилактическая или терапевтическая; тип грибов, против которых ведется борьба, или время применения. Кристаллическая модификация В также может быть использована вместе с другими фунгицидами,бактерицидами, гербицидами, инсектицидами, средствами против нематод, средствами против моллюсков или смесями нескольких таких активных ингредиентов. Кристаллическая модификация В может применяться в любой обычной форме, например в форме концентрата суспензии (SC), концентрата эмульсии (ЕС) или жидкого концентрата для обработки семян (FS). При использовании кристаллической модификации В ее наносят на полезные растения, место их обитания или материал для размножения обычно в виде композиции (в обычной форме), которая описана выше. Кристаллическую модификацию В используют посредством обработки грибов, полезных растений,мест их обитания или материала для размножения кристаллической модификацией В. Кристаллическую модификацию В можно использовать до или после инфекции полезных растений или материала для размножения грибами. Подразумевают, что термин "место обитания" полезного растения в используемом в данном описании смысле охватывает место, на котором полезные растения выращивают, где высевают материал для размножения полезных растений или где материал для размножения полезных растений будет помещен в почву. Примером такого места обитания является поле, на котором выращивают хлебные злаки. Подразумевают, что термин "материал для размножения растений" означает генеративные части растения, такие как семена, которые можно использовать для размножения растений, и вегетативный материал, например черенки или клубни, например, картофеля; предпочтительно термин "материал- 29013638 для размножения растений" означает семена. Кристаллическая модификация В применима для борьбы со следующими болезнями полезных растений: виды Altenaria на фруктах и овощах; виды Ascochyta на бобовых культурах, Botrytis cinerea на землянике, томатах, подсолнечнике, бобовых культурах, овощах и винограде, например Botrytis cinerea на винограде, Cercospora arachidicola на арахисе; Cochliobolus sativus на злаковых; виды Colletotrichum на бобовых культурах; виды Erysiphe на злаковых; такие как Erysiphe graminis на пшенице и Erysiphe graminis на ячмене,Erysiphe cichoracearum и Sphaerotheca fuliginea на тыквенных; виды Fusarium на злаковых и кукурузе; Gaumannomyces graminis на злаковых и газонных растениях; виды Helminthosporium на кукурузе, рисе и картофеле, Hemileia Vastatrix на кофе; виды Microdochium на пшенице и ржи, Mycosphaerella fijiensis на бананах; виды Phakopsora на сое, такие как Phakopsora pachyrizi на сое; виды Puccinia на злаковых, широколистных и многолетних растениях, такие как Puccinia recondita на пшенице, Puccinia striiformis на пшенице и Puccinia recondita на ячмене; виды Pseudocercosporella на злаковых, такие как Pseudocercosporella herpotrichoides на пшенице,Phragmidium mucronatum на розах; виды Podosphaera на фруктовых растениях; виды Pyrenophora на ячмене, такие как Pyrenophora teres на ячмене; Pyricularia oryzae на рисе;Urocystis occulta на ржи; виды Uromyces на бобах; виды Ustilago на злаковых и кукурузе; виды Venturia на фруктовых растениях, такие как Venturia inequalis на яблоне; виды Monilinia на фруктовых растениях и/или виды Penicillium на цитрусовых и яблонях. В случае применения на полезных растениях используемая норма кристаллической модификации В составляет 5-2000 г активного ингредиента/га, в частности от 10 до 1000 г активного ингредиента/га, например 50, 75, 100 или 200 г активного ингредиента/га; при использовании в форме композиции норма обычно находится в диапазоне от 20 до 4000 г суммарной композиции на 1 га. При использовании для обработки семян обычно достаточно от 0,001 до 50 г кристаллической модификации В на 1 кг семян,предпочтительно от 0,01 до 10 г/кг семян. Настоящее изобретение, кроме того, относится к фунгицидной композиции, содержащей в качестве активного ингредиента кристаллическую модификацию В (9-изопропил-1,2,3,4-тетрагидро-1,4 метанонафтален-5-ил)амида син-3-дифторметил-1-метил-1 Н-пиразол-4-карбоновой кислоты в эффективном в качестве фунгицида количестве вместе с подходящим носителем. Указанные композиции согласно изобретению можно применять в любой обычной форме, например в форме сдвоенной упаковки, концентрата суспензии (SC), суспензионной эмульсии (SE), диспергируемых в воде гранул (WG), эмульгируемых гранул (EG), масляной дисперсии (OD), смешиваемого с маслами жидкого вещества (OF), суспензии частиц ультра малого объема (SU), смачиваемого порошка(WP), технического концентрата (ТК), диспергируемого концентрата (DC), порошка для сухой обработки семян (DS), жидкого концентрата для обработки семян (FS), диспергируемого в воде порошка для обработки семян (WS) или любого технически осуществимого препарата в комбинации с приемлемыми для сельского хозяйства адъювантами. Такие композиции могут быть получены обычным способом, например смешиванием активного ингредиента или активных ингредиентов с подходящими инертными компонентами для приготовления композиций (разбавителями, растворителями, наполнителями и необязательно другими используемыми для приготовления композиций ингредиентами, такими как поверхностно-активные вещества, биоциды,антифризами, связующие вещества, загустители и соединения, которые оказывают адъювантное действие). В частности, препараты для применения в распыляемых формах, такие как диспергируемые в воде концентраты (например, SC, DC, SE и т.п.), увлажняемые порошки и гранулы, могут содержать поверхностно-активные вещества, такие как увлажнители и диспергирующие вещества и другие соединения,которые оказывают адъювантное действие, например продукт конденсации формальдегида с нафталин- 30
МПК / Метки
МПК: A01N 43/26, C07C 211/45, C07C 205/06, C07D 231/14
Метки: амидов, способ, получения
Код ссылки
<a href="https://eas.patents.su/30-13638-sposob-polucheniya-amidov.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения амидов</a>
Предыдущий патент: Способ получения липида из клеток
Следующий патент: Связующий материал, содержащий модифицированную серу, и способ получения материала, содержащего модифицированную серу












