Ингибиторы гидролазы амидов жирных кислот
Формула / Реферат
1. Ингибитор гидролазы амидов жирных кислот, представленный следующей структурой:
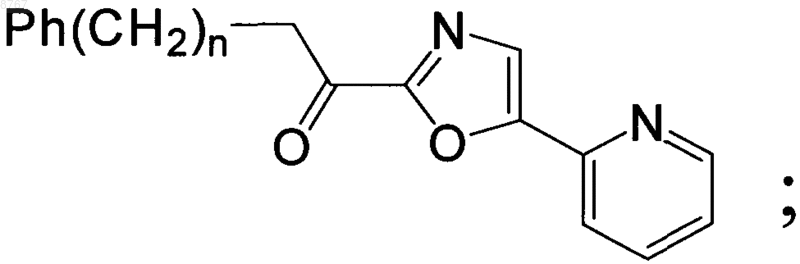
где n - целое число от 2 до 8.
2. Ингибитор гидролазы амидов жирных кислот по п.1, отличающийся тем, что ингибитор представлен следующей формулой:
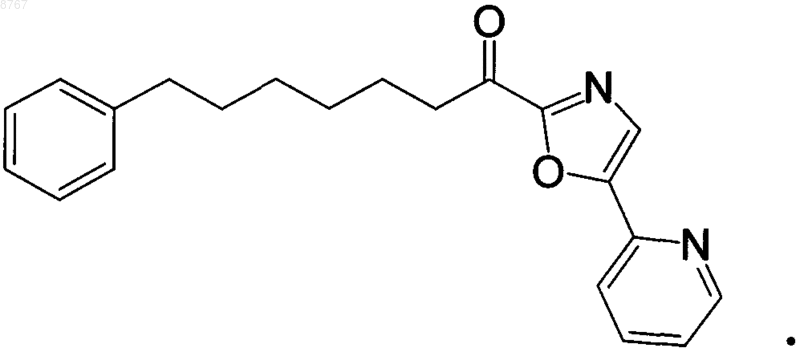
3. Способ ингибирования гидролазы амидов жирных кислот, включающий контактирование гидролазы амидов жирных кислот с ингибитором, концентрация которого обеспечивает ингибирование, представленным следующей структурой:
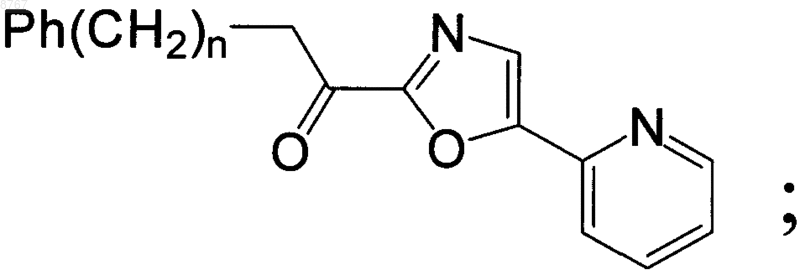
где n - целое число от 2 до 8.
4. Способ по п.3, отличающийся тем, что ингибитор представлен следующей формулой:
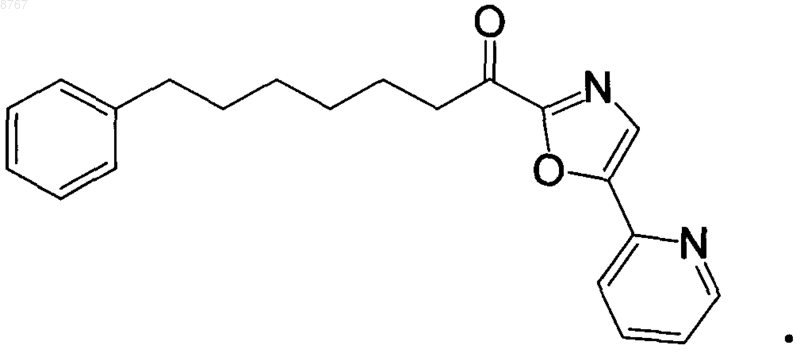
Текст
008767 Область изобретения Настоящее изобретение касается ингибиторов гидролазы жирных кислот. Более конкретно, изобретение касается ингибиторов гидролазы жирных кислот такого типа, который имеет гетероциклическую головную группу, присоединенную к хвостовой области. Уровень техники Гидролаза амидов жирных кислот (ГАЖК) представляет собой интегральный мембранный белок, который гидролизирует широкий диапазон олеил- и арахидониламидов, СВ 1-агонист 2-арахидонилглицерина, соответствующего 1-арахидонилглицерина и 1-олеилглицерина, а также метиларахидонат, что иллюстрирует диапазон субстратов - биологически активных амидов или сложных эфиров жирных кислот. (W. Lang, et al. J. Med. Chem., 1999, 42, 896-902; S.K. Goparaju, et al. FEBS Lett., 1998,442, 69-73; Y. Kurahashi, et al. Biochem. Biophys. Res. Commun., 1997, 237, 512-515; T. Bisogno, et al.Biochem. J., 1997, 322, 671. Di Marzo, V., T. Bisogno, et al. Biochem. J., 1998, 331, 15-19). Распределение ГАЖК в ЦНС предполагает, что она также осуществляет деструкцию нейромодуляторных амидов жирных кислот на участках (сайтах) их действия и глубоко вовлекается в их регулирование (Е.A. Thomas,et al. J. Neurosci. Res., 1997,50, 1047-1052). Хотя ряд первичных амидов жирных кислот гидролизируется ферментом, ГАЖК, по-видимому,наиболее эффективно воздействует на субстраты арахидонила и олеила (В.F. Cravat, et al. Nature, 1996,384, 83-87; D.K. Giang, et al. Proc. Natl. Acad. Sci. USA, 1997, 94, 2238-2242). В ранних исследованиях ГАЖК упоминался как гидролаза олеамида и амидогидролаза анандамида. Класс ингибитора ГАЖК, представленного формулой (1), был описан Дэйлом Боджером (DaleBoger, патент US 6462054). Имеется необходимость в ингибиторах ГАЖК, имеющих головную группу, присоединенную к хвостовой области, причем головная группа содержит один или более гетероциклов для достижения повышенной активности в отношении ингибирования гидролазы амидов жирных кислот. Сущность изобретения Изобретение направлено на создание усовершенствованных конкурентных ингибиторов ГАЖК, которые содержат -кетогетероциклический фармакофор и связывающую подгруппу, имеющую-ненасыщенность. Эти -кетогетероциклический фармакофор и связывающая подгруппа присоединены друг к другу предпочтительно углеводородной цепью. Усовершенствование заключается в использовании гетероциклического фармакофора, выбранного из оксазолов, включающих арилзамещенные заместители в их 5 положении. Улучшенные конкурентные ингибиторы ГАЖК проявляют повышенную активность по отношению к обычным конкурентным ингибиторам ГАЖК. В одном аспекте изобретение направлено на создание ингибитора гидролазы амидов жирных кислот, представленного следующей формуло:(1) где n - целое число от 2 до 8. В следующем предпочтительном варианте осуществления ингибитор гидролазы амидов жирных кислот представлен следующей структурой:(2) В следующем аспекте изобретения предложены способы ингибирования гидролазы амидов жирных кислот. Способ включает стадию контакта гидролазы амидов жирных кислот с ингибитором описанного выше типа при его ингибирующей концентрации. Краткое описание чертежей На фиг. 1 представлены таблицы, в которых приведены величины Ki для различных исследованных соединений. На фиг. 2 представлено продолжение второй таблицы фиг. 1, в которой приведены величины Ki для 4- и 5-гетероарилзамещенных -кетооксазольных ингибиторов ГАЖК. На фиг. 3 представлена таблица, в которой приведены величины Ki для -кетооксазолпиридиновых ингибиторов ГАЖК.-1 008767 На фиг. 4 представлена таблица, показывающая систематическое изменение в боковой цепи и ее влияние на активность указанных соединений. В этом ряду соединений указана головная группа, приведенная в качестве примера. На фиг. 5 приведена таблица, в которой представлены ингибиторы первого поколения и их величины IC50 с ГАЖК. На фиг. 6 приведена таблица, в которой представлены ингибиторы второго поколения и их величины IC50 с ГАЖК. На фиг. 7 представлен ряд реакций, иллюстрирующих синтез замещенных оксазольных ингибиторов. На фиг. 8 представлена гистограмма, показывающая уменьшенные тепловые болевые отклики через 60 мин после инъекции OL-135 (10 мг/кг, i.p.), при испытании по удалению хвоста. На фиг. 9 представлена гистограмма, показывающая уменьшенные тепловые болевые отклики через 60 мин после инъекции OL-135 (10 мг/кг, i.p.), при испытании горячей пластиной. На фиг. 10 представлена гистограмма, которая показывает блокирование SR 141716A болеутоляющих эффектов OL-135 при испытании погружением хвоста. На фиг. 11 представлена гистограмма, которая показывает блокирование SR 141716A болеутоляющих эффектов OL-135 при испытании горячей пластиной. Подробное описание Разработаны улучшенные конкурентные ингибиторы ГАЖК с использованием-Кетогетероциклический фармакофор и связывающая подгруппа присоединены к друг другу предпочтительно углеводородной цепью. Усовершенствование заключается в использовании гетероциклического фармакофора, выбранного из оксазолов, которые включают алкильные или арильные заместители в 5 положениях. Усовершенствованные конкурентные ингибиторы ГАЖК проявляют повышенную активность по сравнению с обычными конкурентными ингибиторами ГАЖК, в которых используют гетероциклические фармакофоры, не содержащие азол, и/или гетероциклические фармакофоры, в которых отсутствуют арильные или алкильные заместители. Описанные здесь усовершенствованные конкурентоспособные ингибиторы подтверждают, что введение ненасыщенности в цепь жирной кислоты увеличивает потенциал ингибитора. Введение бензольного кольца оказалось особенно эффективным. Точно так же было подтверждено, что электрофильный карбонил требуется для сильного ингибирования фермента со стороны описанных здесь конкурентных ингибиторов ГАЖК. Методики Исследование ингибирования. Все испытания ферментов были выполнены при 20-23 С с использованием солюбилизированного мембранного экстракта плазмы печени, содержащего ГАЖК, в буферном растворе для реакции, содержащем 125 мМ Tris, 1 мМ ЭДТК (EDTA), 0,2% глицерина, 0,02% Triton Х-100, 0,4 мМ HEPES и имеющем рН 9,0 (M.P. Patricelli, et al. Bioorg. Med. Chem. Lett., 1998, 8, 613-618; и J.E. Patterson, et al. J. Am.Chem. Soc., 1996, 118, 5938-5945). Начальные скорости гидролиза отслеживали путем контроля за разложением 14 С-олеамида до олеиновой кислоты, как было описано ранее (B.F. Cravatt, et al. Science, 1995,268, 1506-1509; М.Р. Patricelli, et al. Bioorg. Med. Chem. Lett. 1998, 8, 613-618). Ингибирование было обратимым, соответствие по методу независимых от времени линейных наименьших квадратов использовали для построения всех кривых прохождения реакции, и величины R2 всегда составляли 0,97. Величины IC50 были определены для ингибирования, наблюдаемого при 3-5 различных концентрациях ингибитора (от трех или более испытаний при каждой концентрации ингибитора) с использованием формулыIC50=[I]/[(K0/Ki-1], где K0 - скорость контрольной реакции без ингибитора, а Ki - скорость реакции в присутствии ингибитора при концентрации [I] (K. Conde-Frieboes, et al. J. Am. Chem. Soc., 1996, 118, 55195525). Величины Ki были определены методом Диксона (Dixon) (точки пересечения с осью x взвешенных линейных аппроксимаций [I] по отношению к графикам обратной скорости (1/скорость) при постоянной концентрации субстрата, преобразованные в величины Ki с использованием формулы Ki=-xint/[1+[S]/Km]). В предыдущей работе показано, что ферменты крысы и человека очень близки (84%), проявляют почти идентичные специфичности к субстрату и включают идентичные обобщающие типичные последовательности нуклеотидов амидазы и связывающие SH3 домены, позволяя предположить, что наблюдения,проведенные для ГАЖК крысы, будут подобны или идентичны для ГАЖК человека (B.F. Cravatt, et al.Nature, 1996, 384, 83-87; и D.K. Giang, et al. Proc. Natl. Acad. Sci. USA, 1997, 94, 2238-2242). Подробное описание чертежей На фиг. 1 представлены две таблицы, в которых приведены величины Ki для различных исследованных составов. В первой таблице показано, что оксазол является более чем в 1000 раз более сильнодействующим, чем тиазол. Во второй таблице показаны изменения в гетероцикле в 4- и 5-м положениях головной группы оксазола и их воздействие на величины Ki.-2 008767 На фиг. 2 приведено продолжение второй таблицы фиг. 1. Одна тенденция, отмеченная для приведенных данных, заключается в увеличении активности с гетероциклами, содержащими азот. На фиг. 3 представлена таблица величин Ki для -кетооксазолпиридиновых ингибиторов ГАЖК. Явные тенденции отмечены в сноске к таблице. Как видно из фиг. 2, для соединений с головной оксазольной группой, замещенной арилом в 4- и 5-м положениях, введение в кольцо основного азота приводит к значительному увеличению активности. С изменением положения азота не наблюдается никакого существенного изменения величины Ki. На фиг. 4 представлена таблица, в которой показаны модификации в боковой цепи жирных кислот и их влияние на Ki. Тенденция здесь немного отличается от той, которая установлена для ранее исследованного оксазолпиридинового ингибитора. Насыщенная группа додеканоила в этом 5-(2-пиридил)замещенном оксазоле дает более низкую величину Ki, чем предпочтительная боковая цепь алкилфенила. Различие между соединениями 185 и 200 составляет лишь фактор, равный двум. На фиг. 5 представлена таблица, в которой показаны ингибиторы первого поколения и их IC50 с ГАЖК. Для этого фермента ценность величины IC50 является приблизительно в 10 раз большей, чем соответствующие величины Ki. Трифторметилкетон включен для сравнения с разработанными ингибиторами. Величины IC50 хорошо соответствуют величинам Ki соединений. На фиг. 6 представлена таблица, в которой показаны ингибиторы второго поколения и величины ихIC50 с ГАЖК. Ингибиторы второго поколения показывают более сильные изменения величины их IC50 по сравнению с соответствующими величинами Ki. На фиг. 7 представлена последовательность реакций, которая иллюстрирует синтез замещенных оксазольных ингибиторов. Первая реакция в верхней части страницы показывает ацилирование в положение 2 оксазола. Сначала в оксазол вводят литий взаимодействием с н-бутиллитием, осуществляют трансметаллирование взаимодействием с хлоридом цинка, получают купрат присоединением йодида меди (I),а затем купрат ацилируют хлоридом кислоты. Остальные две реакции показывают ретросинтез гетероцикла с замещением в 4- или 5-м положении. В последней реакции X представляет собой галоген или какую-либо другую уходящую группу. На фиг. 8 представлена гистограмма, показывающая уменьшенные тепловые болевые отклики через 60 мин после инъекции OL-135 (10 мг/кг, i.p.) при испытании по удалению хвоста. При этом введение основы не дает никакого эффекта, в то время как после введения OL-135 наблюдается выраженная задержка реакции [р 0,001; N=12 мышей в группе; результаты показаны как средние значениястандартное отклонение]. На фиг. 9 представлена гистограмма, показывающая уменьшенные тепловые болевые отклики через 60 мин после инъекции OL-135 (10 мг/кг, i.p.) при испытании горячей пластиной. При этом введение основы не дает никакого эффекта, а после введения OL-135 наблюдается некоторая задержка реакции[р 0,01; N=12 мышей в группе; результаты показаны как средние значениястандартное отклонение]. На фиг. 10 представлена гистограмма, которая показывает блокирование болеутоляющих эффектовOL-135 веществом SR 141716A при испытании путем погружения хвоста. Мыши получили i.p. инъекцию основы или SR 141716A (3 мг/кг); 10 мин спустя всем мышам вводили OL-135 (10 мг/кг, i.p.) и затем оценивали в испытании погружением хвоста через 1 ч после второй инъекции (р 0,001 для мышей с введенным OL-135, которым предварительно вводили основу, либо по сравнению с их прединъекционным базовым временем задержки, либо по сравнению с мышами с введенным OL-135, которые предварительно были обработаны SR 141716A). Результаты представлены как средние значениястандартные отклонения, N=6 мышей в группе. На фиг. 11 представлена гистограмма, которая показывает блокирование SR 141716A болеутоляющих эффектов OL-135 при испытании горячей пластиной. Мыши получили i.p. инъекцию основы илиSR 141716A (3 мг/кг); через 10 мин всем мышам вводили OL-135 (10 мг/кг, i.p.) и затем оцененивали в испытании горячей пластиной через 1 ч после второй инъекции (р 0,001 для мышей с введеннымOL-135, которым предварительно вводили основу, либо по сравнению с их прединъекционным базовым временем задержки, либо по сравнению с мышами, получившими OL-135, которые предварительно были обработаны SR 141716 А). Результаты представлены как средние величиныстандартные отклонения,N=6 мышей в группе. Экспериментальная часть 1-Оксо-1-[5-(2-пиридил)оксазол-2-ил]-2-фенилэтан (195). Это вещество получали из 5-(2-пиридил)оксазола и фенилуксусной кислоты с использованием процедуры, рассмотренной ниже. К раствору 5-(2-пиридил)оксазола (Giardina, et al. J. Med. Chem., 1997, 40,1794-1807), 94,4 мг, 0,65 ммоля, 1,0 экв., в безводном ТГФ (5,0 мл) при -78 С по каплям добавляли раствор BuLi в смеси гексанов (2,5 М, 0,29 мл, 0,725 ммоля, 1,1 экв.) в атмосфере N2, и полученный раствор перемешивали при -78 С в течение 20 мин. К этой смеси добавляли раствор ZnCl2 в ТГФ (0,5 М, 2,60 мл,1,30 ммоля, 2,0 экв.), и смесь подогревали до 0 С. После перемешивания при 0 С в течение 45 мин к смеси добавляли CuI (107 мг, 0,56 ммоля, 1,0 экв.). Полученную смесь затем перемешивали при 0 С в тече-3 008767 ние 10 мин и к этой смеси по каплям добавляли раствор 2-фенилэтан-1-оилхлорида в безводном ТГФ (3,0 мл), и смесь перемешивали еще 1 ч при 0 С. Реакционную смесь разбавляли смесью 1:1 гексана и этилацетата (60 мл) и промывали последовательно 15% NH4OH (230 мл), водой (30 мл) и насыщенным водным раствором NaCl (30 мл). Органический слой сушили над безводным Na2SO4, фильтровали и выпаривали. Колоночной хроматографией (SiO2, 1,512 см, 20% EtOАс-гексаны) получали соединение 195 (5,7 мг, 0,022 ммоля, 3%) в виде желтого масла: MALDI-FTMS (NBA-Nal) m/z 265,0963 (C16H12N2O2+Н+ по расчету дает 265,0971). 1-Оксо-1-[5-(2-пиридил)оксазол-2-ил]-3-фенилпропан (196). Это вещество получали из 5-(2-пиридил)оксазола и гидрокоричной (-фенилпропионовой) кислоты с использованием процедуры, описанной для соединения 195. Колоночной хроматографией (SiO2,1,512 см, 20% EtOАс-гексаны) получали соединение 196 (46,9 мг, 0,169 ммоля, 26%) в виде желтого кристаллического порошка: Тпл=67-70 С; MALDI-FTMS (NBA-Nal) m/z 279,1120 (C17H14N2O2+Н+ по расчету дает 279,1128). 1-Оксо-1-[5-(2-пиридил)оксазол-2-ил]-4-фенилбутан (197). Это вещество получали из 5-(2-пиридил)оксазола и 4-фенилмасляной кислоты с использованием процедуры, описанной для соединения 195. Колоночной хроматографией (SiO2, 1,512 см, 20% EtOАсгексаны) получали соединение 197 (28,3 мг, 0,097 ммоля, 15%) в виде желтого кристаллического порошка: Тпл=69-72 С; MALDI-FTMS (NBA-Nal) m/z 293,1287 (C18H16N2O2+Н+ по расчету дает 293,1284). 1-Оксо-1-[5-(2-пиридил)оксазол-2-ил]-5-фенилпентан (198). Это вещество получали из 5-(2-пиридил)оксазола и 5-фенилпентановой кислоты с использованием процедуры, описанной для соединения 195. Колоночной хроматографией (SiO2, 1,512 см, 20% EtOАсгексаны) получали соединение 198 (39,5 мг, 0,129 ммоля, 20%) в виде желтого кристаллического порошка: Тпл=49-51 С; MALDI-FTMS (NBA-Nal) m/z 307,1440 (C19H18N2O2+H+ по расчету дает 307,1441). 1-Оксо-1-[5-(2-пиридил)оксазол-2-ил]-6-фенилгексан (199). Это вещество получали из 5-(2-пиридил)оксазола и 6-фенилгексановой кислоты с использованием процедуры, описанной для соединения 195. Колоночной хроматографией (SiO2, 1,512 см, 20% EtOАсгексаны) получали соединение 199 (50,0 мг, 0,156 ммоля, 24%) в виде бледно-желтого кристаллического порошка: Тпл=43,5-45,5 С; MALDI-FTMS (NBA-Nal) m/z 321,1607 (C20H20N2O2+Н+ по расчету дает 321,1597). 1-Оксо-1-[5-(2-пиридил)оксазол-2-ил]-7-фенилгептан (200). Это вещество получали из 5-(2-пиридил)оксазола и 7-фенилгептановой кислоты с использованием процедуры, описанной для соединения 195. Колоночной хроматографией (SiO2, 1,512 см, 20% EtOАсгексаны) получали соединение 200 (70,9 мг, 0,212 ммоля, 33%) в виде бледно-желтого кристаллического порошка: Тпл=45-48 С; MALDI-FTMS (NBA-Nal) m/z 335,1756 (C21H22N2O2+Н+ по расчету дает 335,1754). 1-Оксо-1-[5-(2-пиридил)оксазол-2-ил]-8-фенилоктан (201). Это вещество получали из 5-(2-пиридил)оксазола и 8-фенилоктановой кислоты с использованием процедуры, описанной для соединения 195. Колоночной хроматографией (SiO2, 1,512 см, 20% EtOАсгексаны) получали соединение 201 (62,6 мг, 0,180 ммоля, 28%) в виде бледно-желтого кристаллического порошка: Тпл=72-73 С; MALDI-FTMS (NBA-Nal) m/z 349,1905 (C22H24N2O2+Н+ по расчету дает 349,1910). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Ингибитор гидролазы амидов жирных кислот, представленный следующей структурой: где n - целое число от 2 до 8. 2. Ингибитор гидролазы амидов жирных кислот по п.1, отличающийся тем, что ингибитор представлен следующей формулой: 3. Способ ингибирования гидролазы амидов жирных кислот, включающий контактирование гидролазы амидов жирных кислот с ингибитором, концентрация которого обеспечивает ингибирование, представленным следующей структурой: где n - целое число от 2 до 8. 4. Способ по п.3, отличающийся тем, что ингибитор представлен следующей формулой:-Кетооксазол, тиазол, оксадиазол и тиадиазол ингибиторы гидролазы амидов жирных кислот (ГАЖК) Замещенные -кетооксазольные ингибиторы гидролазы амидов жирных кислот-5 008767 Замещенные -кетооксазольные ингибиторы гидролазы амидов жирных кислот (ГАЖК)-Кетооксазолпиридиновые ингибиторы гидролазы амидов жирных кислот (ГАЖК) Фиг. 3 Модификации в боковой цепи жирных кислот Фиг. 7 Тест по удалению хвоста Фиг. 9 Тест путем погружения хвоста Предварительная обработка- 10008767 Тест горячей пластиной Предварительная обработка
МПК / Метки
МПК: C07D 413/04, C07D 417/04, A61K 31/421, A61K 31/422, C07D 263/30, A61K 31/427, C07D 277/20, A61K 31/426, A61P 25/00
Метки: гидролазы, жирных, амидов, ингибиторы, кислот
Код ссылки
<a href="https://eas.patents.su/12-8767-ingibitory-gidrolazy-amidov-zhirnyh-kislot.html" rel="bookmark" title="База патентов Евразийского Союза">Ингибиторы гидролазы амидов жирных кислот</a>
Предыдущий патент: Интерферон-бета при тяжелом остром респираторном синдроме (sars)
Следующий патент: Композиция для улучшения познавательной способности и памяти
Случайный патент: Состав литого взрывчатого материала












