Производные 5-0-дезозаминил-6-0-метилэритронолида а, способ их получения и их применение для получения биологически активных продуктов
Формула / Реферат
1. Соединения формулы (I):
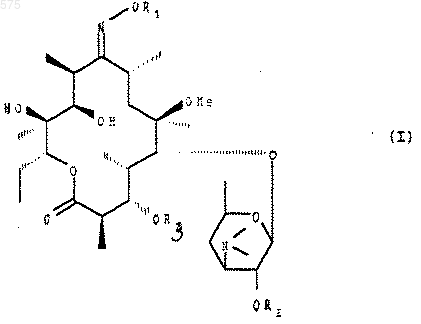
в которой
или R1 представляет радикал алкил, содержащий до 8 атомов углерода, замещенный одним или несколькими радикалами алкила, содержащими до 8 атомов углерода, или одним или несколькими радикалами арила, содержащими до 14 атомов углерода,
или R1 представляет радикал арил, содержащий до 14 атомов углерода, который может быть замещен одним или несколькими радикалами алкил, алкенил или алкинил, содержащими до 8 атомов углерода, алкокси или алкилтио, содержащими до 8 атомов углерода, нитро, СF3 или одним или несколькими атомами галогена,
или R1 представляет радикал:
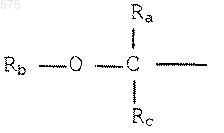
в котором Ra представляет радикал алкил или алкокси, содержащий до 8 атомов углерода,
Rb - представляет радикал алкил, содержащий до 8 атомов углерода, который может быть замещен гетероатомом,
Rc - представляет атом водорода или радикал алкил, содержащий до 8 атомов углерода,
R2 и R3, идентичные или различные, представляют радикал триалкилсилил, в котором радикал алкил содержит до 8 атомов углерода,
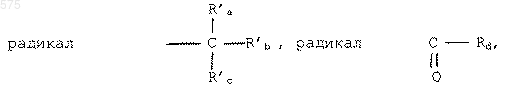
в которых R'a, R'b, R'c и Rd представляют радикал алкил, содержащий до 8 атомов углерода, или радикал аралкил, содержащий до 8 атомов углерода, который может быть замещен одним или несколькими заместителями, указанными выше для R1.
2. Соединения по п.1 формулы (I), в которых R1 представляет радикал
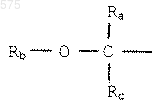
в котором Ra, Rb и Rc имеют указанное в п.1 значение.
3. Соединения по п.2 формулы (I), в которых Ra, Rb и Rc представляют радикал метил.
4. Соединения по пп.1-3 формулы (I), в которых R2 и R3 представляют оба радикал триалкилсилил.
5. Соединения по п.4 формулы (I), в которых R2 и R3 представляют радикал триметилсилил.
6. Соединение по п.1 формулы (I), которое представляет собой 9-0-(1-метокси-1-метилэтил)оксим 3-0-де(2,6-дидеокси-3-С-метил-3-0-метил-альфа-L-рибо-гексопиранозил)-2'0,3-0-бис(триметилсилил)-6-0-метилэритромицина.
7. Способ получения соединений формулы (I), определенных в одном из пп.1-6, отличающийся тем, что соединение формулы (II)
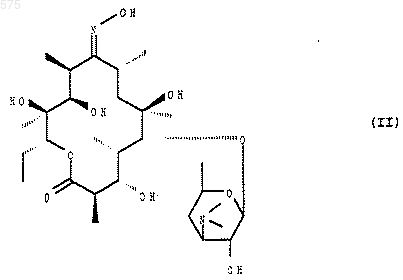
подвергают воздействию агента блокировки оксима в положении 9, чтобы получить соединение формулы (III)
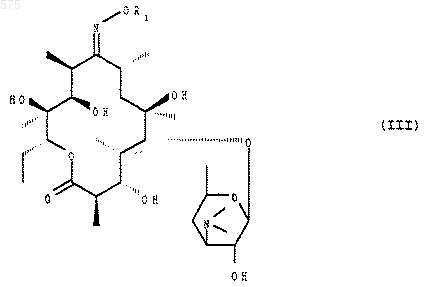
в котором R1 имеет указанное выше значение, которое подвергают воздействию агента блокировки гидроксила в положении 3 и в положении 2', чтобы получить соединение формулы (IV)
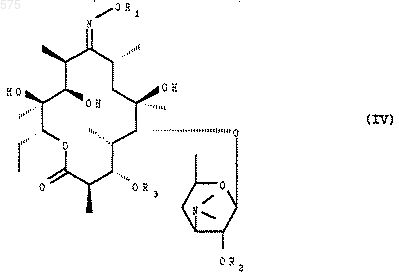
в котором R1, R2 и R3 имеют указанное выше значение, которое обрабатывают агентом метилирования гидроксила в положении 6, чтобы получить соответствующее соединение формулы (I).
8. Способ по п.7, отличающийся тем, что метилирование соединения формулы (IV) осуществляют с помощью метилиодида в присутствии основания.
9. Соединения формулы
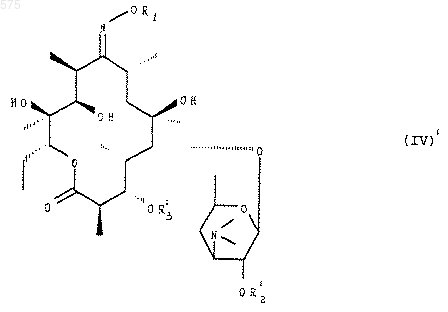
в которой R1 имеет указанные в п.1 значения, R2' и R3' означают Н или имеют значения, указанные для R2 и R3 в п.1.
10. Соединения по п.9, представляющие собой следующие продукты:
9-0-(1-метокси-1-метилэтил)оксим 3-0-де(2,6-дидеокси-3-С-метил-3-0-метил-альфа-L-рибо-гексопиранозил) эритромицина;
9-0-(1-метокси-1-метилэтил)оксим 3-0-де(2,6-дидеокси-3-С-метил-3-0-метил-альфа-L-рибо-гексопиранозил)-2'0,3-0-бис(триметилсилил)эритромицина.
11. Способ получения соединений формулы VI

в котором Z представляет защитную группу, такую как остаток карбоновой кислоты, содержащей до 8 атомов углерода, радикал триалкилсилил, третичный бутил и трифенилметил, отличающийся тем, что соединение формулы (I) по п.1 подвергают операциям, представляющим собой высвобождение оксима в положении 9, высвобождение гидроксила в положении 3 и 2', защиту гидроксила в положении 2'.
12. Способ по п.11, отличающийся тем, что соединение формулы (I) подвергают действию муравьиной кислоты в присутствии бисульфита натрия или метабисульфита натрия, чтобы получить непосредственно соединение формулы (V)

которое подвергают действию защитного агента гидроксильной группы в положении 2' и получают соединение формулы (VI).
13. Способ по п.11, отличающийся тем, что соединение формулы (I) подвергают действию агента высвобождения гидроксила в положении 3 и в положении 2', чтобы получить соединение формулы (VII)
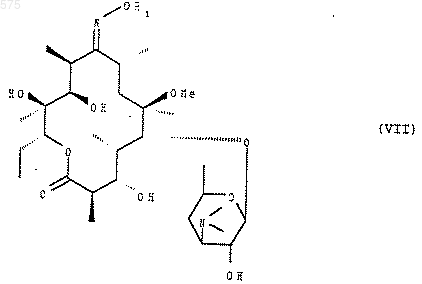
в котором R1 имеет указанное в п.1 значение, которое подвергают действию защитного агента группы ОН в положении 2', чтобы получить соединение формулы (VIII)
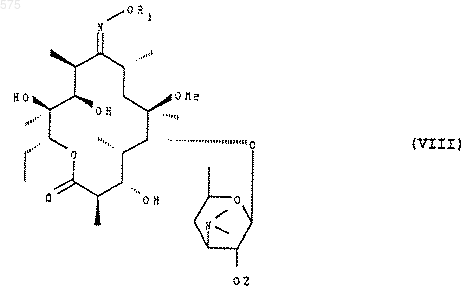
в которой R1 имеет указанное выше значение и Z представляет защитную группу, которое подвергают действию агента высвобождения группы 9-оксо и получают соединение формулы (VI).
Текст
1 Настоящее изобретение относится к новым производным 5-0-дезозаминил-6-0-метилэритронолида А, способа их получения и их применения для получения биологически активных продуктов. Объектом настоящего изобретения являются соединения формулы (I): в которых: или R1 представляет радикал алкил, содержащий до 8 атомов углерода, замещенный одним или несколькими радикалами алкила,содержащими до 8 атомов углерода, или одним или несколькими радикалами арила, содержащими до 14 атомов углерода; или R1 представляет радикал арил, содержащий до 14 атомов углерода, который может быть замещен одним или несколькими радикалами алкила, алкенила или алкинила, содержащими до 8 атомов углерода, алкокси или алкилтио, содержащими до 8 атомов углерода, нитро,СF3 или одним или несколькими атомами галогена; или R1 представляет радикал:Ra представляет радикал алкил или алкокси, содержащий до 8 атомов углерода;Rb - представляет радикал алкил, содержащий до 8 атомов углерода, который может быть замещен гетероатомом;Rc - представляет атом водорода или радикал алкил, содержащий до 8 атомов углерода;R2 и R3, идентичные или различные, представляют радикал триалкилсилил, в котором радикал алкил содержит до 8 атомов углерода; в которых R'a, R'b, R'c и Rd представляют радикал алкил, содержащий до 8 атомов углерода, или радикал аралкил, содержащий до 8 атомов углерода, который может быть замещен одним или несколькими заместителями, указанными выше для R1. В определении соединений согласно изобретению:- радикал алкил, алкенил или алкинил преимущественно означают радикал метил, этил, 000575 2 пропил, изопропил, н-бутил, изобутил, третичный бутил, децил или додецил, винил, аллил,этинил, пропинил, циклобутил, циклопентил или циклогексил,- галоген преимущественно означает фтор или хлор, или бром,- радикал арил преимущественно означает радикал фенил, или радикал нафтил,- радикал аралкил означает преимущественно радикал (C6H5)-(СН 2)a, где а - целое число от 1 до 6, например число 1, 2, 3 или 4; радикал аралкил может быть, например, радикалом бензил, в случае необходимости замещенным, или радикал тритил,- радикал алкилокси преимущественно означает радикал метокси, этокси, пропилокси,изопропилокси, н-бутилокси, изобутилокси,третичный бутилокси, н-пентилокси, изопентилокси, вторичный пентилокси, третичный пентилокси, неопентилокси, н-гексилокси, вторичный гексилокси, третичный гексилокси- радикал алкилтио может принимать те же самые значения, заменяя атом кислорода на атом серы, например метилтио, этилтио. Кроме того, атом серы может быть окисленным и представлять собой,например,метилсульфинил, метилсульфонил. Соединения согласно изобретению могут быть использованы для получения соединений формулы (VI): в которых Z представляет атом водорода или защитную группу, такую как остаток карбоновой кислоты, содержащей до 8 атомов углерода,радикал триалкилсилил или третичный бутил. Соединения формулы (VI) описаны и заявлены в заявке на европейский патент 0 487 411 в качестве промежуточных продуктов, используемых, в частности, для получения антибиотических продуктов. Более конкретно, объектом данного изобретения являются соединения формулы (I), в которых R1 представляет радикал: в котором Ra, Rb и Rc имеют указанные выше значения, в частности, соединения, в которыхRa, Rb и Rc означают радикал метил, а также соединения формулы (I), в которых R2 и R3 означают оба радикал триалкилсилил, в частности 3 соединения, в которых R2 и R3 означают радикал триметилсилил. Более конкретным объектом изобретения является соединение формулы (I), получение которого дается ниже в экспериментальной части. Объектом данного изобретения является также способ получения соединений формулы(I), описанных выше, отличающийся тем, что подвергают соединение формулы (II) воздействию агента блокировки оксима в положении 9, чтобы получить соединение формулы в котором R1 имеет указанное выше значение,которое подвергают воздействию агента блокировки гидроксила в положении 3 и/или 2', для получения соединения формулы (IV):- группы 3-ОН и 2'-ОН блокируют группами триметилсилила,- метилирование осуществляют с помощью метилиодида в присутствии основания, например, гидроксида калия, гидроксида натрия, гидрида, такого как гидрид натрия, третичного бутилата щелочного металла, такого как например, третичного бутилата калия, или же в присутствии 1,5-диазабицикло[4,3,0]нон-5-ена или 1,8-диазабицикло-[5,4,0]ундец-7-ена. Объектом настоящего изобретения являются новые химические продукты формулы (III) и формулы (IV), полученные при осуществлении способа согласно изобретению. Более конкретно, изобретение относится к продуктам формулы (III) и формулы (IV), способ получения которых приведен в экспериментальной части. Изобретение относится также к применению соединений формулы (I), заключающемуся в том, что подвергают соединение формулы (I) следующим операциям:- высвобождение оксима в положении 9,- высвобождение гидроксила в положении 3 и 2',- защита гидроксила в положении 2'. В частности, настоящее изобретение касается применения, заключающегося в том, что соединение формулы (I) подвергают воздействию муравьиной кислоты в присутствии бисульфита натрия или метабисульфита натрия,чтобы получить непосредственно соединение формулы (V): которое подвергают воздействию защитного агента гидроксила в положении 2', чтобы получить соединение формулы (VI): в которой R1, R2 и R3 имеют указанное выше значение, которое подвергают воздействию агента метилирования гидроксила в положении 6 с получением соответствующего соединения формулы (I). Соединение формулы (II), используемое в качестве исходного продукта, представляет собой известный продукт, описанный авторами Маhieu и Coll., в журнале J. Med. Chem., 17(9),953-956 (1974). В предпочтительном варианте осуществления способа согласно изобретению: в которой Z представляет защитную группу,такую как остаток карбоновой кислоты, содержащей до 8 атомов углерода, или радикал три 5 алкилсилил, третичный бутил или трифенилметил. Изобретение также касается применения,отличающегося тем, что подвергают соединение формулы (I) воздействию агента высвобождения гидроксила в положениях 3 и 2', чтобы получить соединение формулы (VII): в которой R1 имеет указанное выше значение,которое подвергают воздействию защитного агента группы ОН в положении 2', чтобы получить соединение формулы (VIII): в которой R1 имеет указанное выше значение, aZ означает защитную группу, определенную выше, которое подвергают воздействию агента высвобождения группы 9-оксо, чтобы получить соответствующее соединение формулы (VI): в которой Z имеет указанное выше значение. Следующие примеры иллюстрируют изобретение, не ограничивая его. Пример 1. 9-0-(1-метокси-1-метилэтил) оксим 3-0-де(2,6-дидеокси-3-С-метил-3-0-метилальфа-L-рибо-гексопиранозил)-2',3-0-бис(триметилсилил) 6-0-метилэритромицина. Стадия А. 9-0-(1-метокси-1-метилэтил) оксим 3-0-де(2,6-дидеокси-3-С-метил-3-0-метилальфа-L-рибо-гексопиранозил)-эритромицина. Перемешивают в течение получаса при комнатной температуре 8,14 г 9-оксима 3-0 де(2,6-дидеокси-3-С-метил-3-0-метил-альфа-L 000575 6 рибогексапиранозил)эритромицина, 81,5 мл метиленхлорида, 9,65 мл 2-метоксипропена и 2,44 г 98%-го хлоргидрата пиридиния. Добавляют 80 мл насыщенного раствора NaHCO3, перемешивают 3 мин. Декантируют органическую фазу,которую промывают с помощью 50 мл соленой воды. Повторно экстрагируют водные фазы с помощью 50 мл CH2Cl2. Высушивают органическую фазу над Na2SO4 и выпаривают растворитель при уменьшенном давлении. Извлекают 9 г целевого продукта. Выход 98,5%. Результаты анализа: ЯМР (CDCl3, 300 МГц) 0,84 (т): СН 3-CH2; 1,07 (д) - 1,09 (д) - 1,23(д): Н'1; 5,23 (дд): Н 13; 2,36 - 4,48 - 3,58: Н подвижные. Стадия Б. 9-0-(1-метокси-1-метилэтил) оксим 3-0-де(2,6-дидеокси-3-С-метил-3-0-метилальфа-L-рибо-гексопиранозил)-2',3-0-бис(триметилсилил)эритромицина. Перемешивают смесь из 6,62 г продукта,полученного на предыдущей стадии, 66 мл СН 2 Сl2, 2,95 мл N-триметилсилилимидазола, 1,7 мл триметилсилилхлорида в течение 45 мин при окружающей температуре. Добавляют 50 мл насыщенного раствора NаНСО 3. Декантируют органическую фазу, которую промывают с помощью 40 мл CH2Cl2. Высушивают органическую фазу над Na2SO4 и выпаривают растворитель при пониженном давлении. Извлекают 7,5 г целевого продукта. Выход: 92,9 %. Результаты анализа: ЯМР (CDCl3, 300 МГц) 0,12-0,16 OTMS; 0,84 (т): СН 3-CH2; 1,16(дд): H'2; 3,22 (с) ОМе; 3,45 (м): Н'5; 3,58 (д): Н 5; 3,66: Н 8 Е; 3,66 (с): Н 11; 3,98 (дл): Н 3; 4,2 (дд): Н'1; 5,14 (дд): H13; 1,90 (с) -3,10 - 4,44: ОН. Стадия С. 9-0-(1-метокси-1-метилэтил) оксим 3-0-де(2,6-дидеокси-3-С-метил-3-0-метилальфа-L-рибо-гексопиранозил)-2',3-0-бис(триметилсилил) 6-0-метилэритромицина. Перемешивают 1,24 г продукта, полученного на предыдущей стадии, 8,7 мл смеси диметилсульфоксида/тетрагидрофурана 1/1, 190 мкл метилиодида, 161 мг порошкообразного 90%-го гидроксида калия, в течение 2 ч при окружающей температуре. Добавляют 10 мл AcOEt и 10 мл 0,5 М раствора мононатриевого фосфата. После декантирования и реэкстрагирования вAcOEt промывают органическую фазу с помощью 5 мл воды, высушивают ее над Na2SО 4 и концентрируют фильтрат при пониженном давлении. Получают 1,2 г целевого продукта. Выход: 95 %. Результаты анализа:(сл) 1 Н Н 11; 4,24 (д) : H'1; 5,15 (дд): H13; 3,29 и 4,52: ОН. Применение 1. 2'-0-ацетил-3-0-де(2,6 дидеокси-3-С-метил-3-0-метил-альфа-L-рибогексопиранозил) 6-0-метилэритромицин. Стадия А. 3-0-де(2,6-дидеокси-3-С-метил 3-0-метил-альфа-L-рибо-гексопиранозил)6-0 метилэритромицин. Перемешивают смесь из 513 мг продукта примера 1, 5 мл этанол/вода 1/1, 425 мг бисульфита натрия, 115 мкл муравьиной кислоты в течение получаса при температуре кипения с обратным холодильником. После охлаждения до окружающей температуры добавляют 5 мл насыщенного раствора NaHCO3. Перемешивают смесь в течение 5 мин, затем экстрагируют два раза с помощью AcOEt. Промывают экстрагированные фазы с помощью 5 мл насыщенного раствора NaCl. Высушивают органическую фазу над Na2SO4 и выпаривают растворитель в вакууме. Получают 180 мг целевого продукта,после хроматографии на двуокиси кремния с элюентом: AcOEt 95/МеОН 3/ТЕА 2. Выход 48%. Результаты анализа: ЯМР (CDCl3, 250 МГц) Спектр, идентичный данным литературы: 5,17 (д): H13; 4,38 (д): H'1; 3,93 (сл): Н подвиж.; 3,85 (с): Н 11; 3,68 (с): Н 5; 3,54 - 3,62 (м): Н 3, H'5: 3,24 (м): H'2; 2,98 (с): ОМе; 2,25 (с):- 1,11: СН 3-СН; 0,83 (т): СН 3-СН 2. Стадия В. 2'-0-ацетил-3-0-де(2,6-дидеокси 3-С-метил-3-0-метил-альфа-L-рибо-гексопиранозил)6-0-метилэритромицин. Подвергают продукт, полученный на предыдущей стадии, воздействию уксусного ангидрида и получают целевой продукт. Применение 2. 2'-0-ацетил-3-0-де(2,6 дидеокси-3-С-метил-3-0-метил-альфа-L-рибогексопиранозил)6-0-метилэритромицин. Стадия А. 9-0-(1-метокси-1-метилэтил) оксим 3-0-де(2,6-дидеокси-3-С-метил-3-0-метилальфа-L-рибо-гексопиранозил)6-0-метилэритромицина. Добавляют к смеси из 2,75 г продукта примера 1 5,5 мл тетрагидрофурана, быстро и при окружающей температуре, 8,25 мл одномолярного раствора фторида тетрабутиламмония в тетрагидрофуране, затем перемешивают в течение 45 мин. Затем добавляют смесь из 15 мл этилацетата и 15 мл ледяной воды. После декантированиия реэкстрагируют органическую фазу 8 с помощью 3 мл воды. Добавляют к водной фазе 0,82 мл концентрированного гидроксида аммония. Экстрагируют водную фазу этилацетатом. Промывают органическую фазу с помощью 3 мл насыщенного водного раствора хлорида натрия,затем высушивают ее над сульфатом натрия, и выпаривают растворитель при пониженном давлении. Извлекают 2,17 г целевого продукта. Выход: 95,7 %. Результаты анализа: ЯМР (CDCl3, 300 МГц) 0,84 (т): СН 3-СН 2; 0,97 (д) - 1,10 (д) - 1,18(м): Н'3; 2,66: Н 10 и Н 2; 2,98 (с) : ОМе в положении 6; 3,22 (с): ОМе цепь; 3,26 Н'2; 3,54:Н 3 и H'5; 3,68 (с) -3,83 (д): H5 и Н 11; 3,73 (м) Н 8 Е; 4,38 (д): H'1; 5,23 (дд): Н 13. Стадия Б. 9-0-(1-метокси-1-метилэтил) оксим 2'-0-ацетил-3-0-де(2,6-дидеокси-3-С-метил 3-0-метил-альфа-L-рибо-гексопиранозил)6-0 метилэритромицина. Смесь из 2,17 г продукта, приготовленного на предыдущей стадии, 22 мл CH2Cl2, 390 мкл уксусного ангидрида перемешивают в течение полутора часов при окружающей температуре. Добавляют 22 мл насыщенного раствора бикарбоната натрия. Промывают органическую фазу с помощью 10 мл соленой воды. Реэкстрагируют водные фазы с помощью CH2Cl2. Высушивают органическую фазу над сульфатом натрия, затем выпаривают растворитель при пониженном давлении. Полученный остаток обрабатывают с помощью 4,25 мл изопропилового эфира, затем 14,9 мл гептана. После перемешивания в течении 5 мин остаток обезвоживают, затем промывают гептаном. После высушивания извлекают 1,72 г целевого продукта (бесцветные кристаллы). Т.пл. = 200 С. Выход 74,7 %. Результаты анализа: ЯМР (СDСl3, 300 МГц) 0,83 (т): СН 3-СН 2; 0,92 (д) - 0,97 (д) - 1,17(дд) : H'2; 5,23 (дд) : H13; 1,72 (д) -3,32 - 4,63: H подвижные. Стадия С. 2'-0-ацетил-3-0-де(2,6-дидеокси 3-С-метил-3-0-метил-альфа-L-рибо-гексопиранозил) 6-0-метилэритромицин. Смесь из 180 мг продукта, полученного на предыдущей стадии, 1,8 мл этанола/воды 1/1, 23 мкл 98%-ой муравьиной кислоты, 180 мг бисульфита натрия перемешивают в течение 3 с половиной часов при температуре кипения с обратным холодильником. Охлаждают при окружающей температуре и добавляют 1,8 мл насыщенного раствора бикарбоната натрия. Затем после 3-х мин перемешивания экстрагируют 2 раза СН 2 Сl2. Промывают органическую фазу с 9 помощью 2 мл насыщенного водного раствораNaCl. Высушивают органическую фазу над сульфатом натрия, выпаривают растворитель при пониженном давлении. После очитки остатка путем хроматографии на двуокиси кремния,элюируя этилацетатом, содержащим 2% тетрагидрофурана, извлекают 43 мг целевого продукта. Выход 27%. Результаты анализа: ИК: в которых R'a, R'b, R'c и Rd представляют радикал алкил, содержащий до 8 атомов углерода, или радикал аралкил, содержащий до 8 атомов углерода, который может быть замещен одним или несколькими заместителями, указанными выше для R1. 2. Соединения по п.1 формулы (I), в которых R1 представляет радикал в которой или R1 представляет радикал алкил, содержащий до 8 атомов углерода, замещенный одним или несколькими радикалами алкила,содержащими до 8 атомов углерода, или одним или несколькими радикалами арила, содержащими до 14 атомов углерода,или R1 представляет радикал арил, содержащий до 14 атомов углерода, который может быть замещен одним или несколькими радикалами алкил, алкенил или алкинил, содержащими до 8 атомов углерода, алкокси или алкилтио,содержащими до 8 атомов углерода, нитро, СF3 или одним или несколькими атомами галогена,или R1 представляет радикал: в котором Ra, Rb и Rc имеют указанное в п.1 значение. 3. Соединения по п.2 формулы (I), в которых Ra, Rb и Rc представляют радикал метил. 4. Соединения по пп.1-3 формулы (I), в которых R2 и R3 представляют оба радикал триалкилсилил. 5. Соединения по п.4 формулы (I), в которых R2 и R3 представляют радикал триметилсилил. 6. Соединение по п.1 формулы (I), которое представляет собой 9-0-(1-метокси-1-метилэтил) оксим 3-0-де(2,6-дидеокси-3-С-метил-3-0-метил-альфа-L-рибо-гексопиранозил)-2'0,3-0 бис(триметилсилил)-6-0-метилэритромицина. 7. Способ получения соединений формулы(I), определенных в одном из пп.1-6, отличающийся тем, что соединение формулы (II) подвергают воздействию агента блокировки оксима в положении 9, чтобы получить соединение формулы (III) в котором Ra представляет радикал алкил или алкокси, содержащий до 8 атомов углерода,Rb - представляет радикал алкил, содержащий до 8 атомов углерода, который может быть замещен гетероатомом,Rc - представляет атом водорода или радикал алкил, содержащий до 8 атомов углерода,R2 и R3, идентичные или различные, представляют радикал триалкилсилил, в котором радикал алкил содержит до 8 атомов углерода,в котором R1 имеет указанное выше значение,которое подвергают воздействию агента блоки 11 ровки гидроксила в положении 3 и в положении 2', чтобы получить соединение формулы (IV) в котором R1, R2 и R3 имеют указанное выше значение, которое обрабатывают агентом метилирования гидроксила в положении 6, чтобы получить соответствующее соединение формулы (I). 8. Способ по п.7, отличающийся тем, что метилирование соединения формулы (IV) осуществляют с помощью метилиодида в присутствии основания. 9. Соединения формулы в которой R1 имеет указанные в п.1 значения, R2' и R3' означают Н или имеют значения, указанные для R2 и R3 в п.1. 10. Соединения по п.9, представляющие собой следующие продукты: 9-0-(1-метокси-1-метилэтил)оксим 3-0-де(2,6-дидеокси-3-С-метил-3-0-метил-альфа-Lрибо-гексопиранозил) эритромицина; 9-0-(1-метокси-1-метилэтил)оксим 3-0 де(2,6-дидеокси-3-С-метил-3-0-метил-альфа-Lрибо-гексопиранозил)-2'0,3-0-бис(триметилсилил)эритромицина. 11. Способ получения соединений формулы VI в котором Z представляет защитную группу,такую как остаток карбоновой кислоты, содержащей до 8 атомов углерода, радикал триалкилсилил, третичный бутил и трифенилметил, от 12 личающийся тем, что соединение формулы (I) по п.1 подвергают операциям, представляющим собой высвобождение оксима в положении 9,высвобождение гидроксила в положении 3 и 2',защиту гидроксида в положении 2'. 12. Способ по п.11, отличающийся тем, что соединение формулы (I) подвергают действию муравьиной кислоты в присутствии бисульфита натрия или метабисульфита натрия, чтобы получить непосредственно соединение формулы которое подвергают действию защитного агента гидроксильной группы в положении 2' и получают соединение формулы (VI). 13. Способ по п.11, отличающийся тем, что соединение формулы (I) подвергают действию агента высвобождения гидроксила в положении 3 и в положении 2', чтобы получить соединение формулы (VII) в котором R1 имеет указанное в п.1 значение,которое подвергают действию защитного агента группы ОН в положении 2', чтобы получить соединение формулы (VIII) в которой R1 имеет указанное выше значение иZ представляет защитную группу, которое подвергают действию агента высвобождения группы 9-оксо и получают соединение формулы
МПК / Метки
МПК: C07H 17/08
Метки: продуктов, 5-0-дезозаминил-6-0-метилэритронолида, биологически, активных, применение, получения, производные, способ
Код ссылки
<a href="https://eas.patents.su/7-575-proizvodnye-5-0-dezozaminil-6-0-metileritronolida-a-sposob-ih-polucheniya-i-ih-primenenie-dlya-polucheniya-biologicheski-aktivnyh-produktov.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 5-0-дезозаминил-6-0-метилэритронолида а, способ их получения и их применение для получения биологически активных продуктов</a>
Предыдущий патент: Состав для осветляющего окрашивания кератиновых волокон, содержащий прямой краситель
Следующий патент: Способ связывания и инактивации вирусов
Случайный патент: Устройство для ввода внутриматочной системы











