Макроциклические карбоновые кислоты и ацилсульфонамиды в качестве ингибиторов репликации вируса гепатита с
Номер патента: 11857
Опубликовано: 30.06.2009
Авторы: Догерти Джордж Эндрю, Кондроски Кевин Рональд, Стенджел Питер Джон, Вуддард Бенджамин Т., Джианг Ютонг, Венгловски Стивен Марк, Маддуру Мачендер Р., Джоси Джон Энтони, Блэтт Лоренс М., Кеннеди Эйприл Лайн, Эндрьюс Стивен Вейд
Формула / Реферат
1. Макроциклическая карбоновая кислота или ацилсульфонамид, имеющие формулу I, VIII или IX
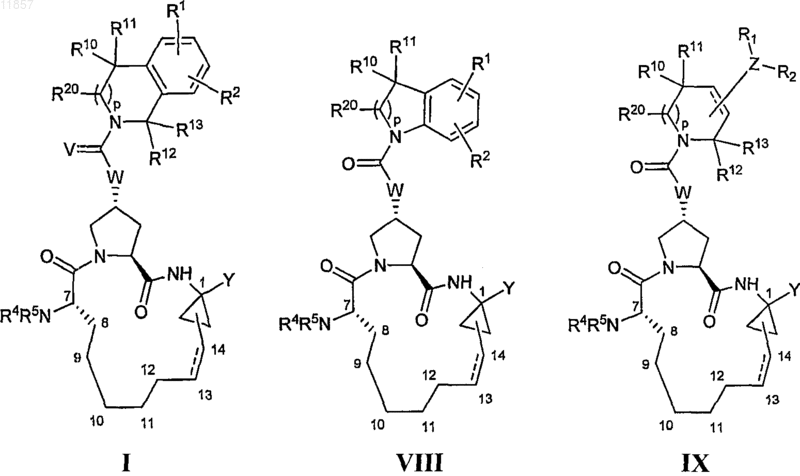
где
(a) R1 и R2, каждый независимо, представляют собой H, галоген, циано, гидрокси, С1-6алкил, С1-6алкокси, C1-6алкил, возможно замещенный не более чем тремя атомами фтора, тиазолил, C(O)NR6R7, NR6R7, C(O)OR8, NHC(O)R8, OCHnNR6R7 или OCHnR9a; где R9a представляет собой имидазолил или пиразолил; указанный тиазолил в определении R1 и R2 является необязательно замещенным C1-6алкилом,
(b) R4 представляет собой H;
(c) R5 представляет собой C(O)NR6R7, C(O)R8, C(O)OR8 или (CO)CHR21NH(CO)R22;
(d) R6 и R7, каждый независимо, представляют собой H, С1-6алкил, С3-7циклоалкил или R6 и R7 вместе с азотом, к которому они присоединены, образуют пиперидинил, пиперазинил или морфолинил;
(e) R8 представляет собой C1-6алкил, С3-7циклоалкил, С4-10алкилциклоалкил, при этом все они могут быть замещены фенилом; или R8 представляет собой тетрагидрофурановое кольцо, присоединенное посредством атома углерода в положении С3 или С4 тетрагидрофуранового кольца; или R8 представляет собой тетрагидропирановое кольцо, присоединенное по положению С4 тетрагидропиранового кольца;
(f) Y представляет собой сульфонимидную группу формулы -C(O)NHS(O)2R9, где R9 представляет собой C1-6алкил, С3-7циклоалкил, или R9 представляет собой фенил или нафтил, возможно замещенный не более чем тремя группами гало, циано, нитро, C1-6алкила, C1-6алкокси, или R9 представляет собой C1-6алкил, возможно замещенный не более чем тремя атомами фтора, или R9 представляет собой 5-членное гетероароматическое кольцо, содержащее 1-3 гетероатома, выбранные из N и S, возможно замещенное до двух раз галогеном; или Y представляет собой карбоксильную группу;
(g) R10 и R11, каждый независимо, представляют собой H, C1-6алкил или R10 и R11 вместе с атомом углерода, к которому они присоединены, образуют циклопропил, циклобутил, циклопентил или циклогексил;
(h) р=0 или 1;
(i) R12 и R13, каждый независимо, представляют собой H, (CH2)nNR6R7 или R12 и R13, каждый, представляют собой C1-6алкил, возможно замещенный (CH2)nOR8;
(j) R20 представляет собой H;
(k) n=0-3;
(l) V представляет собой О или S;
(m) W представляет собой О или NR15, где R15 представляет собой H;
(n) пунктирная линия означает возможную двойную связь;
(о) R21 представляет собой C1-6алкил, С3-7циклоалкил;
(р) R22 представляет собой C1-6алкил и
(q) Z представляет собой присоединенный фенил, конденсированную С6 арильную систему или конденсированную 5-9-членную гетероарильную циклическую систему, содержащую 1 или 2 гетероатома, выбранные из N и S.
2. Макроциклическая карбоновая кислота или ацилсульфонамид, имеющие формулу II
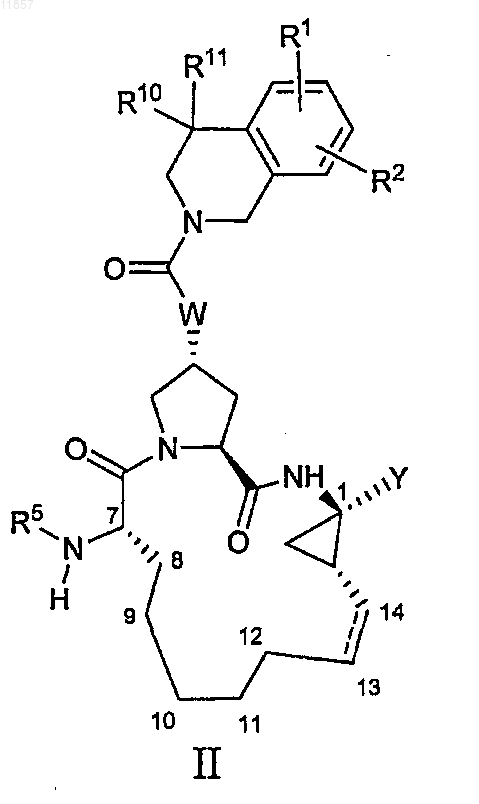
где
(a) R1 и R2, каждый независимо, представляют собой H, галоген, циано, гидрокси, С1-3алкил, C1-3алкокси;
(b) R5 представляет собой C(O)NR6R7, C(O)R8, C(O)OR8;
(c) R6 и R7, каждый независимо, представляют собой H, C1-6алкил, С3-7циклоалкил;
(d) R8 представляет собой С1-6алкил, С3-7циклоалкил, С4-10алкилциклоалкил или 3-тетрагидрофурил;
(e) Y представляет собой сульфонимидную группу формулы -C(O)NHS(O)2R9, где R9 представляет собой С1-3алкил, С3-7циклоалкил или фенил, который возможно замещен не более чем двумя группами гало, циано, нитро, С1-3алкила, С1-3алкокси, или Y представляет собой карбоксильную группу;
(f) R10 и R11, каждый независимо, представляют собой H, C1-6алкил или R10 и R11 вместе с атомом углерода, к которому они присоединены, образуют циклобутил;
(g) W представляет собой О или NH;
(h) пунктирная линия означает возможную двойную связь.
3. Макроциклическая карбоновая кислота или ацилсульфонамид по п.1, имеющие общую формулу III
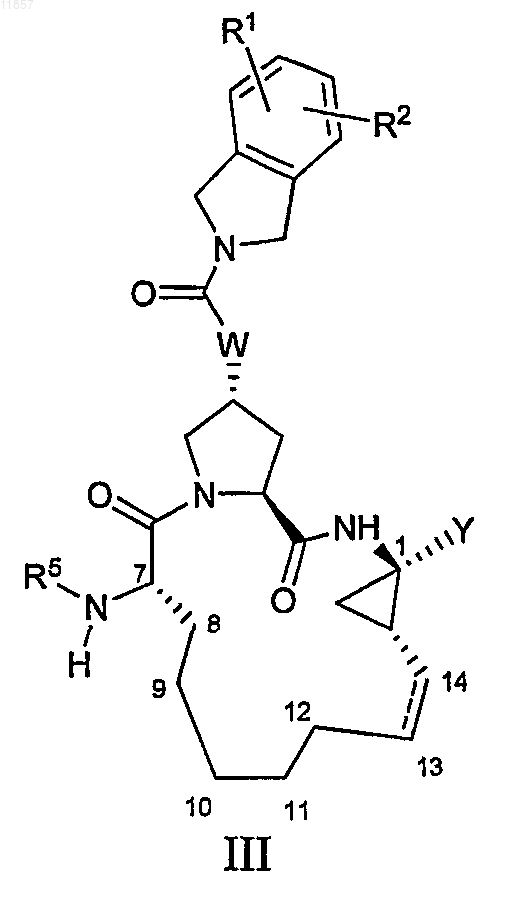
где
(a) R1 и R2, каждый независимо, представляют собой H, галоген, циано, гидрокси, С1-3алкил, C1-3алкокси;
(b) R5 представляет собой C(O)NR6R7, C(O)R8, C(O)OR8;
(c) R6 и R7, каждый независимо, представляют собой H, C1-6алкил, С3-7циклоалкил или R6 и R7 вместе с атомом азота, к которому они присоединены, образуют пиперидинил, пиперазинил или морфолинил;
(d) R8 представляет собой С1-6алкил, С3-7циклоалкил, С4-10алкилциклоалкил или 3-тетрагидрофурил;
(e) Y представляет собой сульфонимидную группу формулы -C(O)NHS(O)2R9, где R9 представляет собой С1-3алкил, С3-7циклоалкил или фенил, возможно замещенный не более чем двумя группами гало, циано, нитро, гидрокси, С1-3алкила, С3-7циклоалкила, С1-3алкокси, или Y представляет собой карбоксильную группу;
(f) W выбирают из О, NH;
(g) пунктирная линия означает возможную двойную связь.
4. Макроциклический ацилсульфонамид, имеющий общую формулу IV
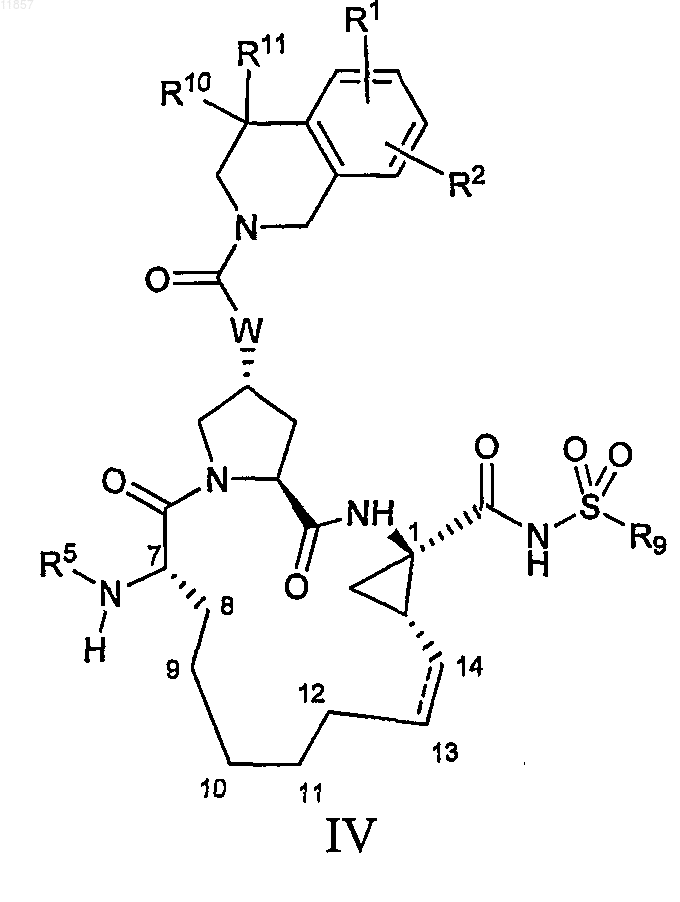
где
(a) R1 и R2, каждый независимо, представляют собой H, галоген, циано, гидрокси, C1-3алкил, C1-3алкокси;
(b) R5 представляет собой C(O)OR8, C(O)NHR8;
(c) R8 представляет собой С1-6алкил, С3-7циклоалкил, 3-тетрагидрофурил;
(d) R9 представляет собой С1-3алкил, С3-7циклоалкил или фенил, который возможно замещен не более чем двумя группами гало, циано, C1-3алкила, C1-3алкокси;
(e) R10 и R11, каждый независимо, представляют собой H, C1-6алкил или R10 и R11 вместе с атомом углерода, к которому присоединены, образуют циклобутил;
(f) W представляет собой О или NH;
(g) пунктирная линия означает возможную двойную связь.
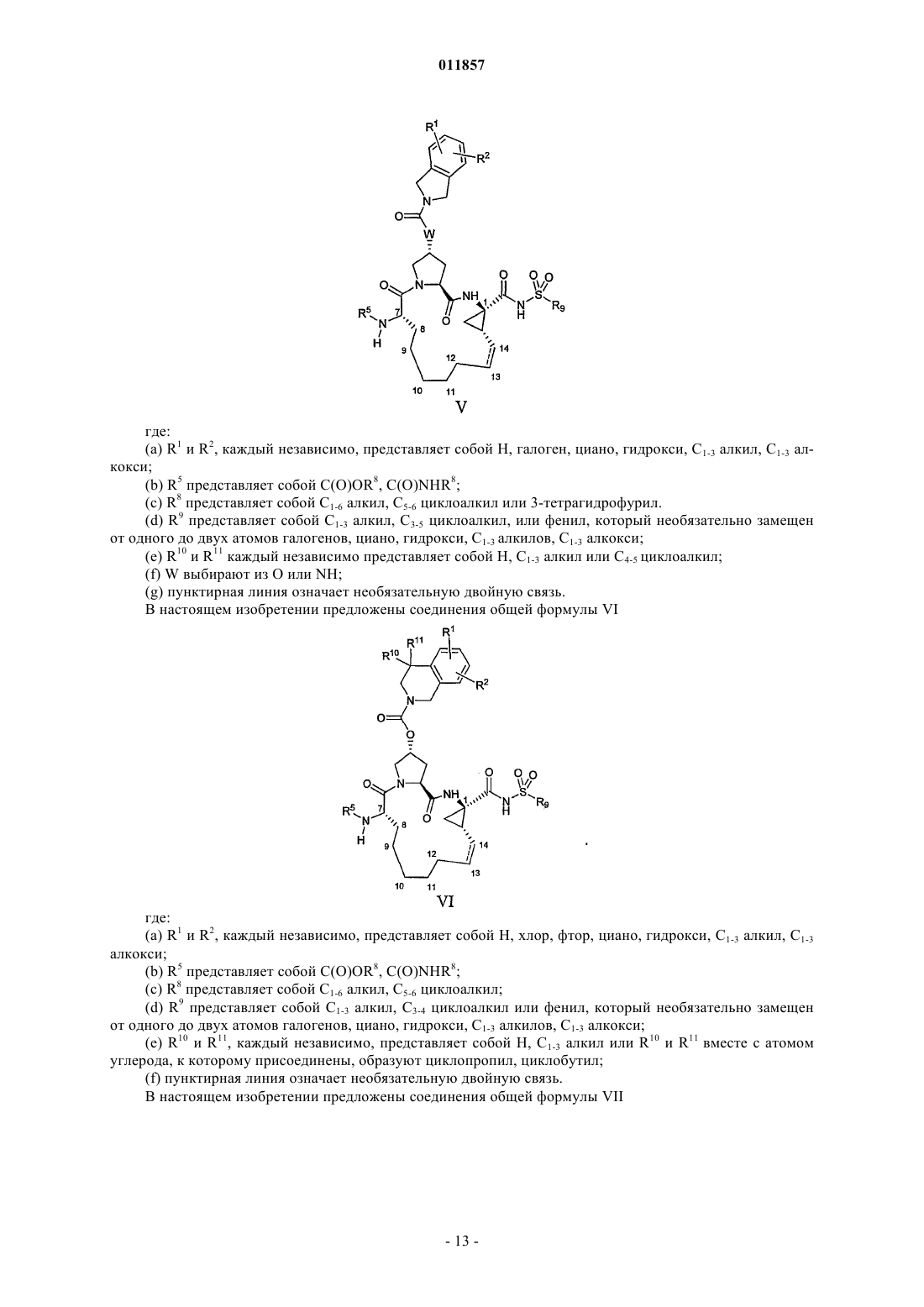
5. Макроциклический ацилсульфонамид, имеющий общую формулу V
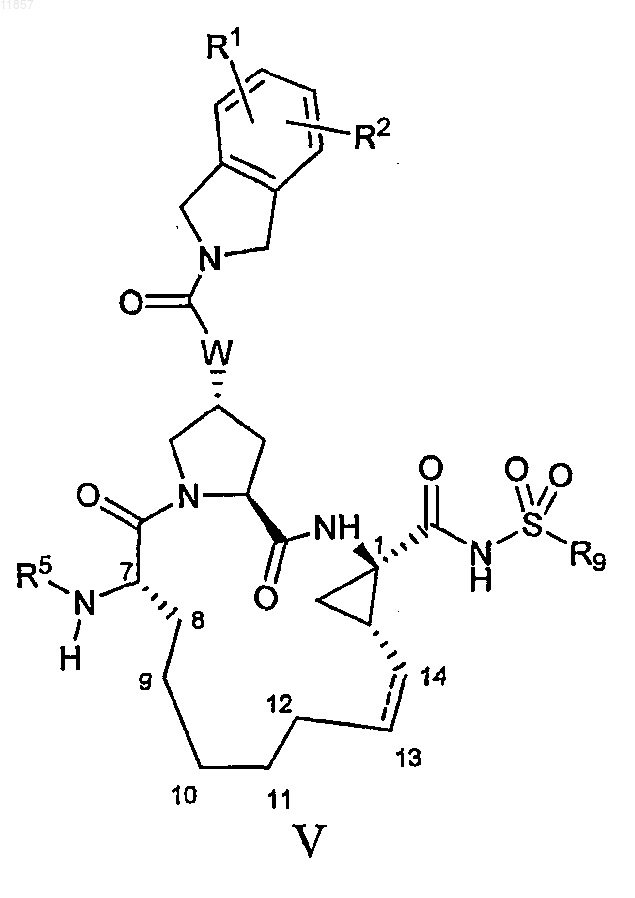
где
(a) R1 и R2, каждый независимо, представляют собой H, галоген, циано, гидрокси, C1-3алкил, C1-3алкокси;
(b) R5 представляет собой C(O)OR8 или C(O)NHR8;
(c) R8 представляет собой C1-6алкил, С3-7циклоалкил или 3-тетрагидрофурил;
(d) R9 представляет собой С1-3алкил, С3-4циклоалкил или фенил, который возможно замещен не более чем двумя группами гало, циано, С1-3алкиыр, С1-3алкокси;
(e) W представляет собой О или NH;
(f) пунктирная линия означает возможную двойную связь.
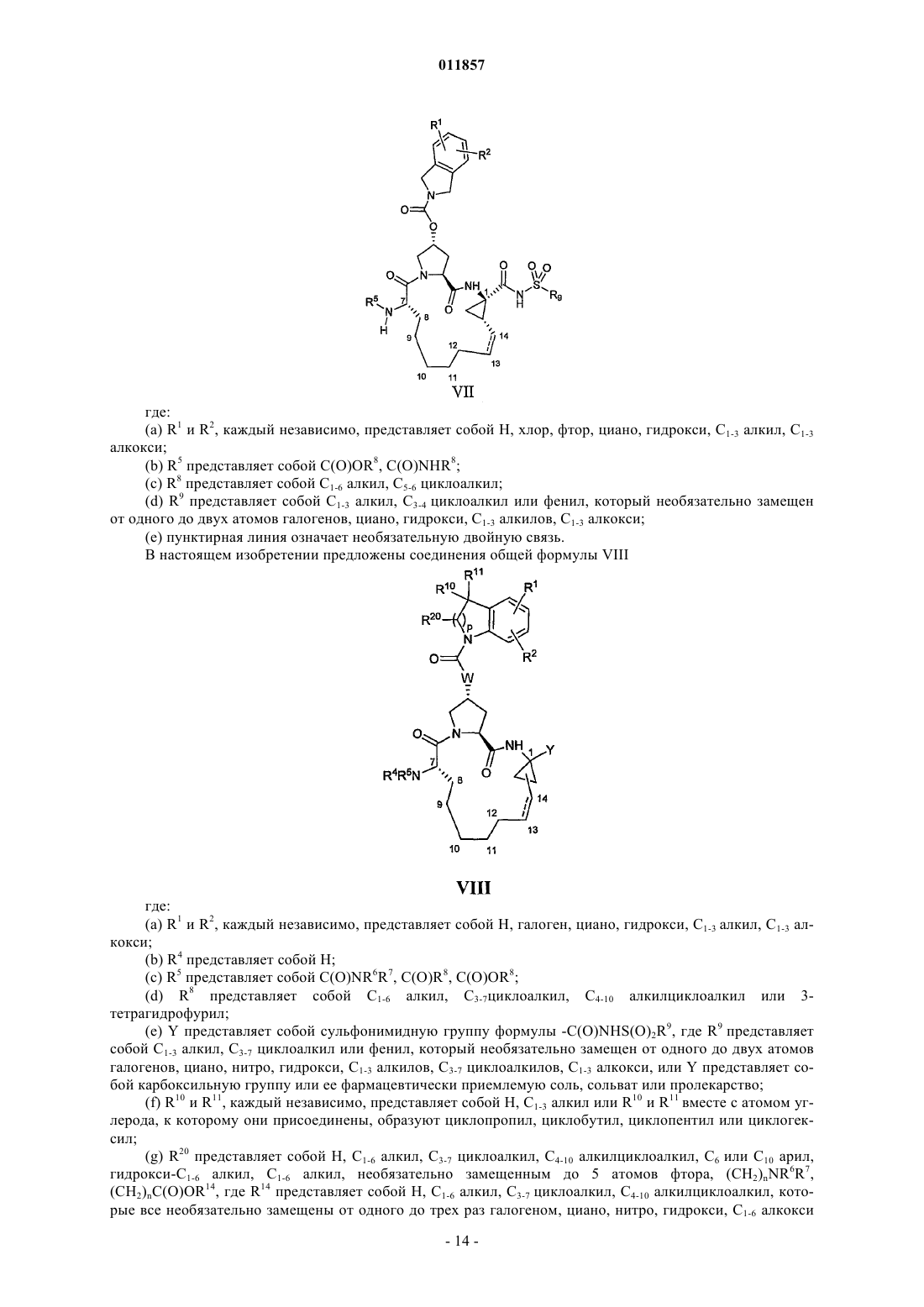
6. Макроциклический ацилсульфонамид, имеющий общую формулу VI
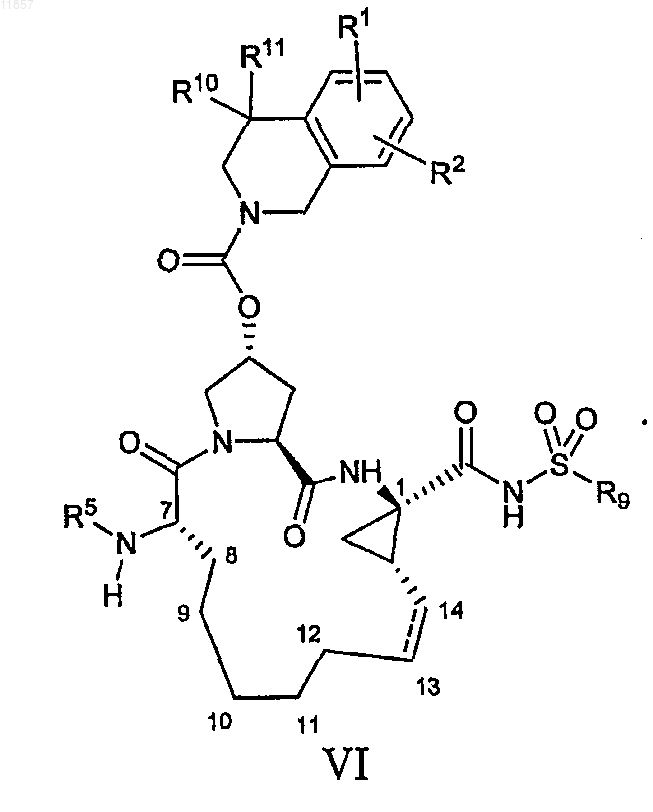
где
(a) R1 и R2, каждый независимо, представляют собой H, галоген, циано, гидрокси, С1-3алкил, С1-3алкокси;
(b) R5 представляет собой C(O)OR8, C(O)NHR8;
(c) R8 представляет собой C1-6алкил, С3-7циклоалкил;
(d) R9 представляет собой С1-3алкил, С3-7циклоалкил или фенил, который возможно замещен не более чем двумя группами гало, циано, C1-3алкила, С1-3алкокси;
(e) R10 и R11, каждый независимо, представляют собой H, С1-6алкил или R10 и R11 вместе с атомом углерода, к которому присоединены, образуют циклобутил;
(f) пунктирная линия означает возможную двойную связь.
7. Макроциклический ацилсульфонамид, имеющий общую формулу VII
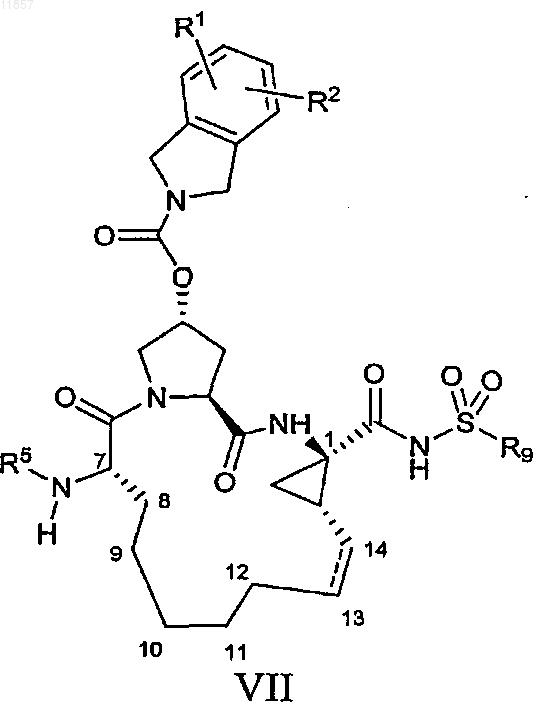
где
(a) R1 и R2, каждый независимо, представляют собой H, галоген, циано, гидрокси, C1-3алкил, С1-3алкокси;
(b) R5 представляет собой C(O)OR8, C(O)NHR8;
(c) R8 представляет собой C1-6алкил, С3-7циклоалкил;
(d) R9 представляет собой С1-3алкил, С3-7циклоалкил или фенил, который возможно замещен не более чем двумя группами гало, циано, С1-3алкила, С1-3алкокси;
(e) пунктирная линия означает возможную двойную связь.
8. Соединение по п.1, имеющее формулу
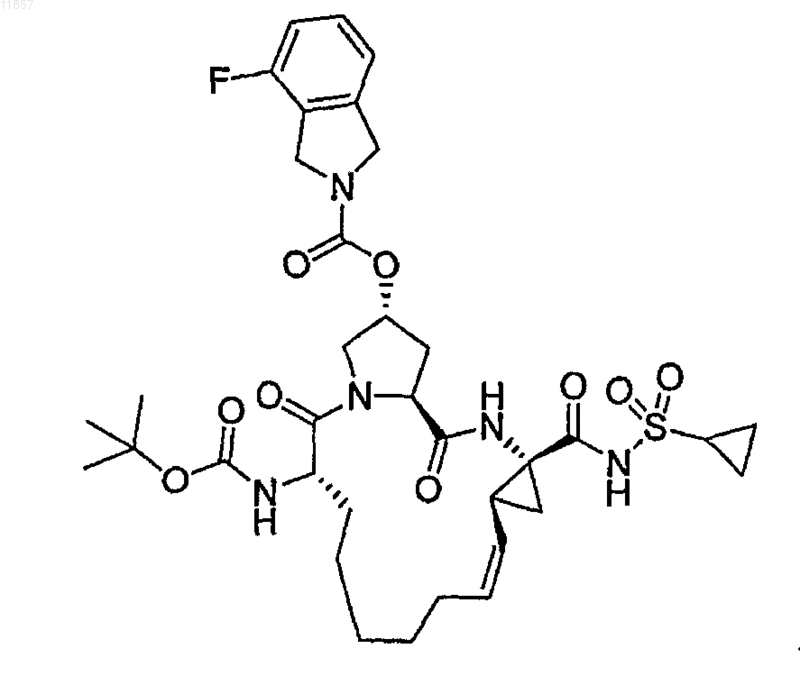
9. Фармацевтическая композиция для лечения заболеваний печени, включающая:
(a) эффективное количество соединения по любому из пп.1-8 или фармацевтически приемлемой соли указанного соединения и
(b) фармацевтически приемлемый носитель.
10. Способ лечения вирусной инфекции гепатита С у индивидуума, включающий введение пациенту эффективного количества соединения по любому из пп.1-8.
11. Способ по п.10, в котором достигается продолжительный вирусный ответ.
12. Способ лечения фиброза печени у индивидуума, включающий введение пациенту эффективного количества соединения полюбому из пп.1-8.
13. Способ усиления функции печени у пациента с вирусной инфекцией гепатита С, включающий введение индивидууму эффективного количества соединения по любому из пп.1-8.
14. Способ по пп.10, 12 или 13, отличающийся тем, что он дополнительно включает введение пациенту эффективного количества нуклеозидного аналога.
15. Способ по п.14, отличающийся тем, что нуклеозидный аналог выбран из группы, включающей рибавирин, левовирин, вирамидин, L-нуклеозид и изаторибин.
16. Способ по пп.10, 12 или 13, отличающийся тем, что он дополнительно включает введение индивидууму пирфенидона или его аналога, вводимого перорально, ежедневно в количестве приблизительно от 400 до 3600 мг.
17. Способ по пп.10, 12 или 13, отличающийся тем, что он дополнительно включает введение индивидууму эффективного количества ингибитора NS5B РНК-зависимой РНК-полимеразы.
18. Способ по пп.10, 12 или 13, отличающийся тем, что он дополнительно включает введение индивидууму эффективного количества антагониста фактора некроза опухоли, выбранного из группы, состоящей из этанерсепта, инфликсимаба и адалимумаба.
19. Способ по пп.10, 12 или 13, отличающийся тем, что он дополнительно включает введение индивидууму эффективного количества тимозина-a.
20. Способ по п.19, отличающийся тем, что тимозин-a вводят подкожно два раза в неделю в количестве приблизительно от 1,0 до 1,6 мг.
21. Способ по пп.10, 12 или 13, отличающийся тем, что способ дополнительно включает введение индивидууму эффективного количества интерферона-гамма (ИФН-g).
22. Способ по п.21, отличающийся тем, что ИФН-g вводят подкожно в количестве приблизительно от 10 до 300 мкг.
23. Способ по пп.10, 12 или 13, отличающийся тем, что он дополнительно включает введение индивидууму эффективного количества интерферона-альфа (ИФН-a).
24. Способ по п.23, отличающийся тем, что ИФН-a представляет собой моноПЭГилированный (30 кДа, линейный) консенсусный ИФН-a, вводимый с интервалом от каждые 8 дней до каждые 14 дней.
25. Способ по п.23, отличающийся тем, что ИФН-a представляет собой моноПЭГилированный (30 кДа, линейный) консенсусный ИФН-a, вводимый один раз каждые 7 дней.
26. Способ по п.23, отличающийся тем, что ИФН-a представляет собой INFERGEN консенсусный ИФН-a.
27. Способ по пп.10, 12 или 13, отличающийся тем, что он дополнительно включает введение эффективного количества агента, выбранного из 3'-азидотимидина, 2',3'-дидеоксиинозина, 2',3'-дидеоксицитидина, 2,3-дидегидро-2',3'-дидеокситимидина, комбивира, абакавира, адефовира, дипоксила, цидофовира и ингибитора инозинмонофосфатдегидрогеназы.
28. Применение эффективного количества соединения по любому из пп.1-8 в производстве фармацевтической композиции для лечения фиброза печени у пациента.
29. Применение эффективного количества соединения по любому из пп.1-8 в производстве фармацевтической композиции для усиления функции печени у пациента с вирусной инфекцией гепатита С.
Текст
011857 ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ Настоящее изобретение относится к соединениям, способам их синтеза, композициям и способам лечения вирусной инфекции гепатита С. В частности, настоящее изобретение раскрывает новые пептидные аналоги, фармацевтические композиции, содержащие такие аналоги, и способы использования этих аналогов при лечении вирусной инфекции гепатита С. ОПИСАНИЕ УРОВНЯ ТЕХНИКИ Вирус гепатита С (ВГС) является самой распространенной в США хронической инфекцией, передаваемой через кровь. Хотя число новых заражений снизилось, количество хронических больных является значительным и по данным Центров по контролю и профилактики заболеваний в США насчитывается приблизительно 3,9 млн (1,8%) зараженных человек. Хроническое заболевание печени является десятым в списке лидирующих причин смертности среди взрослых в США и насчитывает приблизительно 25,000 смертей ежегодно (или приблизительно 1% от всех смертей). Исследования показывают, что 40% хронических заболеваний печени связаны с вирусом гепатита С, в результате получается приблизительно 800010000 смертей каждый год. Связанная с вирусом гепатита С конечная стадия заболевания печени является самой частой причиной пересадки печени среди взрослых. Антивирусная терапия хронического гепатита С динамично развивалась за последнюю декаду со значительными улучшениями, наблюдаемыми в эффективности лечения. Тем не менее, даже при комбинированном лечении, используя интерферон-, конъюгированный с ПЭГ, плюс рибавирин, у 40-50% пациентов лечение не удавалось, то есть пациенты демонстрировали либо отсутствие лечебного эффекта или рецидив заболевания. Обычно для таких пациентов отсутствовала эффективная альтернатива лечения. В частности, пациенты с запущенным фиброзом или циррозом печени, выявляемом при биопсии,имеют значительный риск развития осложнений запущенных заболеваний печени, включая асцит, желтуху, варикозное кровотечение, энцефалопатию и прогрессирующее нарушение работы печени; также заметно возрастает риск гепатоцеллюлярной карциномы. Широкая распространенность хронической формы гепатита С вирусной инфекции несет серьезные последствия для общественного здравоохранения в виде ближайшего бремени хронических заболеваний печени в США. Данные, полученные от Национальной Исследовательской Службы по Здоровью и Питанию (NHANES III), указывают, что значительное увеличение числа заражений пришлось на конец 60-х начало 80 г., особенно среди людей в возрасте от 20 до 40 лет. Приблизительно подсчитано, что количество людей с затяжной формой ГС вирусной инфекции 20 лет и более может увеличиться в четыре раза за промежуток времени с 1990 по 2015 годы с 750000 до свыше 3 млн. Пропорциональное увеличение числа людей, зараженных в течение 30 или 40 лет, могло бы быть даже больше. Поскольку риск хронических заболеваний печени, связанных с ВГС, имеет отношение к продолжительности заражения, риск цирроза постепенно увеличивается для людей, зараженных более 20 лет, это приведет в результате к значительному увеличению заболеваний, связанных с циррозом, и смертности среди пациентов, зараженных между 1965-1985 г. ВГС представляет собой вирус семейства флавивирусов с линейной молекулой РНК положительной полярности. Геном ВГС представлен однонитевой молекулой РНК протяженностью около 9500 нуклеотидов и содержит единственную открытую рамку считывания (ORF), несущую информацию о единственном большом вирусспецифичном полипротеине размером около 3000 аминокислотных остатков. В зараженных клетках этот полипротеин расщепляется на многочисленные участки клеточными и вирусными протеазами с получением структурных и неструктурных (NS) протеинов вируса. В случае ВГС образование зрелых неструктурных протеинов (NS2, NS3, NS4, NS4A, NS4B, NSSA и NS5B) осуществляется двумя вирусными протеазами. Первая вирусная протеза расщепляет связь NS2-NS3 полипротеина. Вторая вирусная протеза это сериновая протеаза, содержащая N-концевой участок NS3 (далее именуемая как "NS3 протеаза"). NS3 протеаза является медиатором всех последующих расщеплений на участках ниже положения NS3 в полипротеине (т.е. участках, расположенных между C-окончанием NS3 и Сокончанием полипротеина). NS3 протеаза проявляет активность как в цис-положении при расщеплении участка NS3-NS4, так и в транс-, для остальных NS4A-NS4B, NS4B-NS5A, и NS5A-NS5B участков. Считается, что белок NS4A, является многофункциональным полипротеином и способствует активности NS3 протеазы и возможно участвует в мембранной локализации NS3 и других вирусных репликазных компонентов. Очевидно, образование комплекса между NS3 и NS4A необходимо для процессов, медиируемыхNS3, и улучшает протеолитическую эффективность на всех участках, распознаваемых NS3. ПротеазаNS3 также проявляет нуклеозид трифосфатазную и РНК-хеликазную активность. NS5 В представляет собой РНК-зависимую РНК полимеразу, вовлеченную в репликацию РНК ВГС. Литература(1996) J. Hepatol. 24: 555-563; U. S. Patent No. 5,082, 659; Европеская патентная заявка EP 294,160; ПатентWandl et al. (1992) Br. J. Haematol. 81:516-519; Европейская патентная заявка 294,160; патент Канады 1,321, 348; Европейская патентная заявка 276,120; Wandl et al. (1992) Sem. Oncol. 19: 88-94; Balish etet al. (1987) Current Eye Res. 6: 273-276; патенты США 6,172,046; 6,245,740; 5,824,784; 5,372,808; 5,980,884; опубликованные международные патентные заявки WO 96/21468; WO 96/11953; WO 00/59929;Sclerosis 1 Suppl. 1: S44-S47; Chu et al., Tet. Lett. (1996), 7229-7232; Девятая Конференция по Антивирусным Исследованиям (Ninth Conference on Antiviral Research), Урабандай, Фукишима, Япония (1996) (Antiviral Research, (1996), 30: 1, A23 (реферат 19; Steinkuhler et al., Biochem., 37: 8899-8905; Ingallinella etal., Biochem., 37: 8906-8914. КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ В настоящем изобретении предложены соединения следующей общей формулы Согласно одному из аспектов в настоящем изобретении предложены макроциклическая карбоновая кислота или ацилсульфонамид, отвечающие формулам I, VIII или IX(a) R1 и R2, каждый независимо, представляет собой H, галоген, циано, гидрокси, C1-6 алкил, C1-6 ал-2 011857 кокси, C1-6 алкил, возможно замещенный не более чем 3 атомами фтора, тиазолил, C(O)NR6R7, NR6R7,C(O)OR8, NHC(O)R8, OCHnNR6R7 или OCHnR9a; где R9a представляет собой имидазолил или пиразолил; указанный тиазолил в определении R1 и R2 является необязательно замещенным C1-6 алкилом,(b) R4 представляет собой H;(e) R8 представляет собой С 1-6 алкил, С 3-7 циклоалкил, С 4-10 алкилциклоалкил, при этом все они могут быть замещены фенилом; или R8 представляет собой тетрагидрофурановое кольцо, присоединенное посредством атома углерода в положении С 3 или C4 тетрагидрофуранового кольца; или R8 представляет собой тетрагидропирановое кольцо, присоединенное по положению C4 тетрагидропиранового кольца;(f) Y представляет собой сульфонимидную группу формулы -C(O)NHS(O)2R9, где R9 представляет собой C1-6 алкил, С 3-7 циклоалкил, или R9 представляет собой фенил или нафтил, возможно замещенный не более чем тремя группами гало, циано, нитро, C1-6 алкила, C1-6 алкокси, или R9 представляет собой C1-6 алкил, возможно замещенный не более чем тремя атомами фтора, или R9 представляет собой 5-членное гетероароматическое кольцо, содержащее 1-3 гетероатома, выбранные из N и S, возможно замещенное до двух раз галогеном; или Y представляет собой карбоксильную группу;(i) R12 и R13, каждый независимо, представляет собой H, CHnNR6 R7, или R12 и R13 каждый представляет собой C1-6 алкил, возможно замещенный CHnOR8;(n) пунктирная линия означает возможную двойную связь;(q) Z представляет собой присоединенный фенил, конденсированную С 6 арильную систему или конденсированную 5-9-членную гетероарильную циклическую систему, содержащую 1 или 2 гетероатома, выбранные из N и S. Согласно следующему аспекту в настоящем изобретении предложены макроциклическая карбоновая кислота или ацилсульфонамид, отвечающие формуле II(e) Y представляет собой сульфонимидную группу формулы -C(O)NHS(O)2R9, где R9 представляет собой С 1-3 алкил, С 3-7 циклоалкил или фенил, который возможно замещен не более чем двумя группами гало, циано, нитро, С 1-3 алкил, C1-3 алкокси, или Y представляет собой карбоксильную группу;(h) пунктирная линия означает возможную двойную связь. Согласно еще одному аспекту в настоящем изобретении предложены макроциклическая карбоновая кислота или ацилсульфонамид, отвечающие общей формуле III(f) Y представляет собой сульфонимидную группу формулы -C(O)NHS(O)2R9, где R9 представляет собой C1-3 алкил, С 3-7 циклоалкил или фенил, возможно замещенный не более чем двумя группами гало,циано, нитро, гидрокси, C1-3 алкила, С 3-7 циклоалкила, C1-3 алкокси, или Y представляет собой карбоксильную группу;(h) пунктирная линия означает возможную двойную связь. Согласно следующему аспекту в настоящем изобретении предложен макроциклический ацилсульфонамид, отвечающий общей формуле IV(d) R9 представляет собой С 1-3 алкил, С 3-7 циклоалкил или фенил, который возможно замещен не более чем двумя группами гало, циано, С 1-3 алкила, С 1-3 алкокси;(g) пунктирная линия означает возможную двойную связь. Согласно другому аспекту в настоящем изобретении предложен макроциклический ацилсульфонамид, отвечающий общей формуле V(d) R9 представляет собой C1-3 алкил, С 3-4 циклоалкил или фенил, который возможно замещен не более чем двумя группами гало, циано, С 1-3 алкила, С 1-3 алкокси;(f) пунктирная линия означает возможную двойную связь. Согласно следующему аспекту в настоящем изобретении предложен макроциклический ацилсульфонамид, отвечающий общей формуле VI(c) R8 представляет собой C1-6 алкил, С 3-7 циклоалкил,(d) R9 представляет собой С 1-3 алкил, С 3-7 циклоалкил или фенил, который возможно замещен не более чем двумя группами гало, циано, C1-3 алкила, C1-3 алкокси;(f) пунктирная линия означает возможную двойную связь. Согласно еще одному аспекту в настоящем изобретении предложен макроциклический ацилсульфонамид, отвечающий общей формуле VII(d) R9 представляет собой С 1-3 алкил, С 3-7 циклоалкил или фенил, который возможно замещен не более чем двумя группами гало, циано, C1-3 алкила, C1-3 алкокси;(e) пунктирная линия означает возможную двойную связь. Согласно другому аспекту в настоящем изобретении предложено соединение формулы Согласно другому аспекту в настоящем изобретении предложены фармацевтические композиции,содержащие NS3 ингибитор, который представляет собой какое-либо соединение формулы I-IX, или его терапевтически приемлемую соль, или эфир в смеси с фармацевтически приемлемым носителем. Настоящее изобретение также включает любое фармацевтически приемлемое пролекарственное производное соединения формулы I-IX, где пролекарство способно обеспечить увеличение всасывания желуднокишечным трактом или печенью. Согласно еще одному аспекту в настоящем изобретении предложен способ лечения пациента с вирусной инфекцией гепатита С, включающий введение пациенту терапевтически эффективного количества соединения формулы I-IX, или его терапевтически приемлемой соли, или эфира, или фармацевтической композиции, описанной выше. Также предложен способ лечения пациента с вирусной инфекцией гепатита С, включающий введение пациенту терапевтически эффективного количества соединения формулы I-IX, или его терапевтически приемлемой соли или эфира, или фармацевтической композиции, содержащей соединение формулыI-IX, или фармацевтически приемлемую соль указанного соединения в комбинации с одним или более дополнительным антивирусным агентом (агентами), в количестве, эффективном для улучшения продолжительного вирусного ответа у пациента. Кроме того, в настоящем изобретении предложен способ лечения фиброза печени, включающий введение пациенту эффективного количества соединения формулы I-IX. Также предложен способ усиления функции печени у пациента с вирусной инфекцией гепатита С,включающий введение пациенту эффективного количества соединения формулы I-IX. Согласно одному из вариантов реализации изобретения предложенные способы лечения вирусной инфекции гепатита С, лечения фиброза печени и усиления функции печени дополнительно включают введение пациенту эффективного количества нуклеозидного аналога, при этом указанный нуклеозидный аналог может быть выбран из группы, включающей рибавирин, левовирин, вирамидин, L-нуклеозид и-6 011857 изаторибин. Согласно другому варианту реализации указанные способы дополнительно включают введение пациенту пирфенидона или его аналога, вводимого перорально, ежедневно в количестве примерно от 400 до 3600 мг. Согласно еще одному варианту реализации изобретения предложенные способы лечения вирусной инфекции гепатита С, лечения фиброза печени и усиления функции печени дополнительно включают введение пациенту эффективного количества ингибитора NS5B РНК-зависимой РНК полимеразы. Согласно следующему варианту реализации предложенные способы дополнительно включают введение пациенту эффективного количества антагониста фактора некроза опухоли, выбранного из группы, включающей этанерсепт, инфликсимаб и адалимумаб. Согласно другому варианту реализации предложенные способы лечения вирусной инфекции гепатита С, лечения фиброза печени и усиления функции печени дополнительно включают введение пациенту эффективного количества тимозина-, при этом введение тимозина- может осуществляться подкожно два раза в неделю в количестве примерно от 1,0 до 1,6 мг. Согласно следующему варианту реализации предложенные способы лечения вирусной инфекции гепатита С, лечения фиброза печени и усиления функции печени дополнительно включают введение пациенту эффективного количества интерферона-гамма (ИФН-), при этом введение ИФН- может осуществляться подкожно в количестве примерно от 10 до 300 мкг. Согласно еще одному варианту реализации предложенные способы лечения вирусной инфекции гепатита С, лечения фиброза печени и усиления функции печени дополнительно включают введение пациенту эффективного количества интерферона-альфа (ИФН-), при этом указанный ИФН- может представлять собой моноПЭГилированный (30 кДа, линейный) консенсусный ИФН-, вводимый с интервалом от каждых 8 дней до каждых 14 дней. В частности, введение указанного моноПЭГилированного (30 кДа, линейного) консенсусного ИФН- может осуществляться один раз каждые 7 дней. Согласно одному из вариантов реализации ИФН- представляет собой INFERGEN консенсусный ИФН-. Согласно еще одному варианту реализации предложенные способы лечения вирусной инфекции гепатита С, лечения фиброза печени и усиления функции печени дополнительно включают введение эффективного количества агента, выбранного из группы, включающей 3'-азидотимидин, 2',3'дидеоксиинозин, 2',3'-дидеоксицитидин, 2,3-дидегидро-2',3'-дидеокситимидин, комбивир, абакавир, адефовир, дипоксил, цидофовир и ингибитор инозинмонофосфатдегидрогеназы. В настоящем изобретении также предложено применение эффективного количества соединения формулы I-IX для получения фармацевтической композиции для лечения фиброза печени у пациента. Согласно другому аспекту в настоящем изобретении предложено применение эффективного количества соединения формулы I-IX для получения фармацевтической композиции для усиления функции печени у пациента с вирусной инфекцией гепатита С. ОПРЕДЕЛЕНИЯ В контексте данного описания термин печеночный фиброз, применяемый наряду с термином фиброз печени, относится к росту рубцовой ткани в печени, который происходит при хронической форме вирусной инфекции гепатита. Термины индивид, организм-носитель вируса, субъект и пациент являются взаимозаменяемыми и относятся к млекопитающим, включая, но, не ограничиваясь, приматами, включая обезьян и человека. В контексте данного описания, термин функция печени относится к нормальной функции печени,включая, но, не ограничиваясь, синтетической функцией, включая, но, не ограничиваясь, синтезом протеинов, таких как сывороточные протеины (например, альбумин, факторы свертывания крови, щелочная фосфатаза, аминотрансферазы (например, аланиновая трансаминаза, аспартамовая трансаминаза), 5'нуклеозидаза, -глютаминилтранспептидаза и так далее), синтез билирубина, синтез холестерина и синтез желчных кислот; метаболическая функция печени, включая, но, не ограничиваясь, метаболизмом углеводов, метаболизмом аминокислот и аммиака, гормональным метаболизмом и липидным метаболизмом; детоксификация экзогенных лекарственных средств; гемодинамическая функция, включая внутренностную и портальную динамику кровообращения; и тому подобное. Термин продолжительный вирусный ответ (SVR; также именуемый как продолжительный ответ или длительный ответ) в данном контексте относится к ответу пациента на программу лечения вирусной инфекции гепатита С, исходя из титра ВГС в сыворотке. Как правило, продолжительный вирусный ответ относится к отсутствию (не обнаружению) РНК ВГС (например, меньшечем 500, меньше чем 200 или меньше чем 100 геномных копий на миллилитр сыворотки) в сыворотке пациента за период в течение по меньшей мере одного месяца, по меньшей мере двух месяцев, по меньшей мере трех месяцев, по меньшей мере четырех месяцев, по меньшей мере пяти месяцев, по меньшей мере шести месяцев вслед за прекращением лечения. Термин "пациенты, не поддающиеся лечению", как используется здесь, относится обычно к пациентам, зараженным ВГС, у которых отсутствует лечебный эффект после предварительной терапии ВГС(именуемые как пациенты с отсутствием лечебного эффекта) или которые первоначально отвечали на-7 011857 проводимое лечение, но у которых лечебный эффект не сохраняется (именуемые как пациенты с рецидивом заболевания). Обычно предварительная терапия может включать монотерапию -интерфероном или комбинированную терапию -интерфероном и каким-нибудь антивирусным агентом, например рибавирином. Как используется здесь, термины лечение и терапия и тому подобное относятся к получению желательного фармакологического и/или физиологического эффекта. Эффект может быть профилактическим, исходя из полностью или частично предотвращенного заболевания или его симптомов, и/или может быть терапевтическим, исходя из частичного или полного избавления от заболевания и/или неблагоприятного повреждения, присущего данному заболеванию. Лечение, как используется здесь, охватывает любое лечение заболевания у млекопитающего, а именно у человека, и включает: (а) предотвращение заболевания у пациента, который может быть предрасположен к заболеванию, но при диагностике выявлено, что заболевание отсутствует; (b) подавление заболевания, т.е. остановка его развития; и (с) освобождение от заболевания, т.е. регрессия заболевания. Термины индивид, организм-носитель вируса, субъект и пациент являются взаимозаменяемыми и относятся к млекопитающим, включая, но, не ограничиваясь мышами, обезьянами, человеком, млекопитающими животными фермерских и охотничьих хозяйств и домашними млекопитающими животными. Термин специфичный аналог пирфенидона и все грамматические варианты относятся к и ограничиваются всеми и каждым аналогом пирфенидона, указанным в табл. 1. Как используется здесь, агонист рецептора интерферона I типа относится к любому лиганду человеческого рецептора интерферона I типа природного происхождения или не природного происхождения, который связывает и вызывает сигнальную трансдукцию через рецептор. Агонисты рецепторов интерферона I типа включают интерфероны, охватывающие интерфероны природного происхождения, модифицированные интерфероны, синтетические интерфероны, гетерологические интерфероны, смешанные интерфероны; антитела, специфичные к интерфероновым рецепторам; непептидные химические агонисты и тому подобное. Как используется здесь, термин агонист рецептора интерферона II типа относится к любому лиганду человеческого рецептора интерферона II типа природного происхождения или не природного происхождения, который связывает и вызывает сигнальную трансдукцию через рецептор. Агонисты рецепторов интерферона II типа включают природный человеческий интерферон-, представителей рекомбинантного интерферона-, представителей гликозилированного интерферона-, представителей интерферона-, конъюгированного с ПЭГ, модифицированных или измененных представителей интерферона-,интерферон- гибридные белки, агонисты антител, специфичных к рецепторам, непептидные агонисты и тому подобное. Как используется здесь, термин агонист рецептора интерферона III типа относится к любому лиганду человеческого IL-28 рецептора (IL-28R) природного происхождения или не природного происхождения, аминокислотная последовательность которого описана у Sheppard и др., выше, и который связывает и вызывает сигнальную трансдукцию через рецептор. Как используется здесь, термин агонисты рецепторов интерферона относятся к любому из агонистов рецептора интерферона I типа, агонистов рецептора интерферона II типа или агонистов рецептора интерферона III типа. Термин дозированное введение, используемый здесь, относится к введению антивирусного агента пациенту, нуждающемуся в этом, где введение может включать одну или более доз антивирусного агента из устройства введения лекарственных средств. Таким образом, термин дозированное введение,как используется здесь, включает, но не ограничивается, установкой продолжительной системы введения(например, насос или другое управляемое устройство для инъекции); однократную подкожную инъекцию вслед за установкой системы для продолжительного введения. Непрерывная доставка, как используется здесь (например, в следующем контексте непрерывная доставка соединения к ткани), означает продвижение лекарственного средства к месту доставки, например к ткани, некоторым способом, который обеспечит доставку желаемого количества вещества к ткани за выбранный промежуток времени, где приблизительно то же самое количество лекарственного средства получает пациент каждую минуту в течение выбранного промежутка времени. Контролируемое высвобождение, как используется здесь (например, в следующем контексте контролируемое высвобождение лекарственного средства), включает высвобождение соединения (например, агониста рецептора интерферона I типа или II типа, например интерферона-) с выбранной или иным образом контролируемой скоростью, интервалом и/или количеством, на которое в значительной степени не влияют условия применения. Контролируемое высвобождение, таким образом, охватывает,но не обязательно ограничивается в основном непрерывной доставкой и систематической доставкой (например, прерывистой доставкой за период времени, которая нарушается регулярными или нерегулярными временными интервалами). Систематическая или временная доставка, как используется в контексте доставки лекарствен-8 011857 ных средств, означает доставку лекарственного средства систематически, особенно по регулярной схеме,за предварительно выбранный отрезок времени (например, иной, чем период, связанный с инъекцией ударной дозы вещества). Систематическая или временная доставка лекарственного средства включает доставку лекарственного средства при возрастающей, уменьшающейся, постоянной или пульсирующей скорости или диапазоне скоростей (например, количество лекарственного средства за единицу времени или объем лекарственной формы за единицу времени) и также включает доставку, которая является непрерывной или в значительной степени непрерывной или постоянной. Термин устройство для контролируемой доставки лекарственного средства охватывает любое устройство, где высвобождение (например, скорость, время высвобождения) лекарственного средства или другой желательной субстанции, содержащейся в нем, контролируется с помощью или определяется самим устройством и не поддается влиянию окружающих условий использования или где высвобождение происходит при скорости, которая является воспроизводимой в окружающих условиях использования. Постоянный в значительной степени, как используется здесь в следующем контексте, постоянное в значительной степени вливание или постоянная в значительной степени доставка относится к доставке лекарства способом, который не прерывается в течение предварительно выбранного временного интервала, где количество лекарства, полученного пациентом в течение любого 8-часового интервала в предварительно выбранном периоде действия, никогда не упадет до нуля. Более того, постоянная в значительной степени доставка может также охватывать доставку лекарства при постоянной, предварительно выбранной скорости, или диапазоне скоростей (например, количество лекарства за единицу времени или объем лекарственной формы за единицу времени), которая не нарушается в течение предварительно выбранного периода доставки лекарства. Состояние, устойчивое в значительной степени, как используется здесь в контексте какого-либо биологического параметра, который может изменяться как функция от времени, означает, что этот биологический параметр имеет постоянное значение в течение промежутка времени, такого, что область под кривой, определяемая значениями биологического параметра как функции от времени в течение любого 8-часового интервала в периоде действия (ОПК 8 ч), не более чем на 20% больше или на 20% меньше или предпочтительно не более чем на 15% больше или на 15% меньше и более предпочтительно не более чем на 10% больше или на 10% меньше средней области под кривой биологического параметра за 8-часовой промежуток в течение периода действия (ОПК 8 ч средняя). ОПК 8 ч средняя определяется как частное (q) от области под кривой биологического параметра за полное время действия (ОПК общая), разделенная на количество 8-часовых интервалов за период действия (число/3 дня), то есть, q = (ОПК общая)/(число/3 дня). Например, концентрация в сыворотке лекарственного средства сохраняется в устойчивом состоянии, в течение периода действия лекарства,когда область под кривой концентрации лекарственного средства в сыворотке в течение любого 8-часового интервала за время действия (ОПК 8 ч) не более чем на 20% больше или на 20% меньше средней области под кривой концентрации лекарственного средства в сыворотке за любой 8-часовой интервал во время действия (ОПК 8 ч средняя), то есть ОПК 8 ч не более чем на 20% больше или на 20% меньше ОПК 8 ч средней для концентрации лекарственного средства в сыворотке за время действия лекарства. Перед тем, как настоящее изобретение будет более детально описано, отметим, что это изобретение не ограничивается конкретными описанными вариантами реализации изобретения, по существу, они конечно могут изменяться. Также понятно, что терминология, используемая здесь, только для целей описания конкретных вариантов реализации изобретения не подразумевает ограничений, поскольку объем притязаний настоящего изобретения может быть ограничен только прилагаемой формулой изобретения. Там, где представлен диапазон значений, понятно, что каждое промежуточное значение до одного знака после запятой в единицах нижнего граничного значения, по меньшей мере, если не указано другое,между верхним и нижним граничным значением этого диапазона и любого другого заявляемого диапазона или промежуточное значение в этом заявленном диапазоне охватывается этим изобретением. Верхнее и нижнее граничные значения этих более маленьких диапазонов также могут независимо быть включены в эти более маленькие диапазоны и также охватываются настоящим изобретением, при условии исключения любого граничного значения в заявленном диапазоне. Там, где заявленный диапазон включает один или оба граничных значения, диапазоны, исключающие или один или оба граничных значения,также включены в объем притязаний настоящего изобретения. По меньшей мере, если не указано иное, все технические или научные термины, используемые здесь, имеют то же самое значение, как обычно понимается специалистом в данной области техники, к которой изобретение принадлежит. Хотя любые методы и материалы, подобные или эквивалентные тем,что описаны здесь, могут также быть использованы в практической части или исследованиях настоящего изобретения, предпочтительные способы и материалы описываются здесь. Все публикации, использованные здесь, приводятся для ссылки с целью описания и раскрытия способов и/или материалов в связи с которыми публикации цитируются. Должно быть отмечено, что как используется здесь и в прилагаемой формуле изобретения формы единственного числа включают множественное число, по меньшей мере, если не указано иное. Таким-9 011857 образом, например отсылка к какому-нибудь способу включает множество таких способов и отсылка к какой-либо дозе включает отсылку к одной или более дозам и их эквивалентам, известным специалисту в области техники, и так далее. Публикации, обсуждаемые здесь, являются публикациями, раскрытыми до даты подачи настоящей заявки. Ничего из представленного здесь не рассматривается в качестве допущения того, что настоящее изобретение не дает право датировать задним числом такую публикацию на основании более раннего изобретения. Также представленные даты публикации могут отличаться от фактической даты публикации, которая может нуждаться в независимом подтверждении. ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ В настоящем изобретении предложены соединения формул I-IX, фармацевтические композиции и формы, содержащие любое соединение формулы I-IX или фармацевтически приемлемую соль указанного соединения. Предложенные соединения подходят для лечения вирусной инфекции гепатита С и других заболеваний, как обсуждается ниже. КОМПОЗИЦИИ В настоящем изобретении предложены соединения следующей общей формулы Согласно одному из аспектов в настоящем изобретении предложены макроциклическая карбоновая кислота или ацилсульфонамид, отвечающие формулам I, VIII или IX(a) R1 и R2, каждый независимо, представляет собой H, галоген, циано, гидрокси, С 1-6 алкил, С 1-6 алкокси, C1-6 алкил, возможно замещенный не более чем 3-мя атомами фтора, тиазолил, C(O)NR6R7, NR6R7,C(O)OR8, NHC(O)R8, OCHnNR6R7 или OCHnR9a; где R9a представляет собой имидазолил или пиразолил; указанный тиазолил в определении R1 и R2 является необязательно замещенным C1-6 алкилом,(b) R4 представляет собой H;(e) R8 представляет собой C1-6 алкил, С 3-7 циклоалкил, С 4-10 алкилциклоалкил, при этом все они могут быть замещены фенилом; или R8 представляет собой тетрагидрофурановое кольцо, присоединенное- 10011857 посредством атома углерода в положении С 3 или С 4 тетрагидрофуранового кольца; или R8 представляет собой тетрагидропирановое кольцо, присоединенное по положению С 4 тетрагидропиранового кольца;(f) Y представляет собой сульфонимидную группу формулы -C(O)NHS(O)2R9, где R9 представляет собой C1-6 алкил, С 3-7 циклоалкил, или R9 представляет собой фенил или нафтил, возможно замещенный не более чем тремя группами гало, циано, нитро, С 1-6 алкила, С 1-6 алкокси, или R9 представляет собой C1-6 алкил, возможно замещенный не более чем тремя атомами фтора, или R9 представляет собой 5-членное гетероароматическое кольцо, содержащее 1-3 гетероатома, выбранные из N и S, возможно замещенное до двух раз галогеном; или Y представляет собой карбоксильную группу;(i) R12 и R13, каждый независимо, представляет собой H, CHnNR6 R7 или R12 и R13 каждый представляет собой C1-6 алкил, возможно замещенный CHnOR8;(n) пунктирная линия означает возможную двойную связь;(q) Z представляет собой присоединенный фенил, конденсированную С 6 арильную систему или конденсированную 5-9-членную гетероарильную циклическую систему, содержащую 1 или 2 гетероатома, выбранные из N и S. В настоящем изобретении также предложены соединения общей формулы II(e) Y представляет собой сульфонимидную группу формулы -C(O)NHS(O)2R9, где R9 представляет собой C1-3 алкил, С 3-7 циклоалкил или фенил, который необязательно замещен от одного до двух атомов галогенов, циано, нитро, гидрокси, C1-3 алкилов, С 3-7 циклоалкилов, С 1-3 алкокси, или Y представляет собой карбоксильную группу или ее фармацевтически приемлемую соль, сольват или пролекарство;(h) пунктирная линия означает необязательную двойную связь. В настоящем изобретении предложены соединения общей формулы III(e) Y представляет собой сульфонимидную группу формулы -C(O)NHS(O)2R9, где R9 представляет собой C1-3 алкил, С 3-7 циклоалкил или фенил, который необязательно замещен от одного до двух атомов галогенов, циано, нитро, гидрокси, C1-3 алкилов, С 3-7 циклоалкилов, C1-3 алкокси, или Y представляет собой карбоксильную группу или ее фармацевтически приемлемую соль, сольват или пролекарство;(g) пунктирная линия означает необязательную двойную связь. В настоящем изобретении предложены соединения общей формулы IV(d) R9 представляет собой C1-3 алкил, С 3-4 циклоалкил или фенил, который необязательно замещен от одного до двух атомов галогенов, циано, гидрокси, C1-3 алкилов, C1-3 алкокси;(g) пунктирная линия означает необязательную двойную связь. В настоящем изобретении предложены соединения общей формулы V(d) R9 представляет собой C1-3 алкил, С 3-5 циклоалкил, или фенил, который необязательно замещен от одного до двух атомов галогенов, циано, гидрокси, C1-3 алкилов, C1-3 алкокси;(e) R10 и R11 каждый независимо представляет собой H, C1-3 алкил или С 4-5 циклоалкил;(g) пунктирная линия означает необязательную двойную связь. В настоящем изобретении предложены соединения общей формулы VI(d) R9 представляет собой C1-3 алкил, С 3-4 циклоалкил или фенил, который необязательно замещен от одного до двух атомов галогенов, циано, гидрокси, C1-3 алкилов, C1-3 алкокси;(f) пунктирная линия означает необязательную двойную связь. В настоящем изобретении предложены соединения общей формулы VII(d) R9 представляет собой C1-3 алкил, С 3-4 циклоалкил или фенил, который необязательно замещен от одного до двух атомов галогенов, циано, гидрокси, C1-3 алкилов, C1-3 алкокси;(e) пунктирная линия означает необязательную двойную связь. В настоящем изобретении предложены соединения общей формулы VIII(e) Y представляет собой сульфонимидную группу формулы -C(O)NHS(O)2R9, где R9 представляет собой C1-3 алкил, С 3-7 циклоалкил или фенил, который необязательно замещен от одного до двух атомов галогенов, циано, нитро, гидрокси, C1-3 алкилов, С 3-7 циклоалкилов, C1-3 алкокси, или Y представляет собой карбоксильную группу или ее фармацевтически приемлемую соль, сольват или пролекарство;(g) R20 представляет собой H, C1-6 алкил, С 3-7 циклоалкил, С 4-10 алкилциклоалкил, C6 или C10 арил,гидрокси-С 1-6 алкил, C1-6 алкил, необязательно замещенным до 5 атомов фтора, (CH2)nNR6R7,(CH2)nC(O)OR14, где R14 представляет собой H, C1-6 алкил, C3-7 циклоалкил, С 4-10 алкилциклоалкил, которые все необязательно замещены от одного до трех раз галогеном, циано, нитро, гидрокси, C1-6 алкокси- 14011857 или фенилом, или R14 представляет собой С 6 или С 10 арил, который является необязательно замещенным от одного до трех атомов галогена, циано, нитро, гидрокси, C1-6 алкилов, С 3-7 циклоалкилов, С 4-10 алкилциклоалкилов, С 2-6 алкенилов, C1-6 алкокси, гидрокси-С 1-6 алкилов, С 1-6 алкилов, необязательно замещенных до 5 атомами фтора, C1-6 алкокси, необязательно замещенных до 5 атомов фтора; указанный С 6 или С 10 арил в определении R12 и R13 является необязательно замещенным от одного до трех атомами галогена, циано, нитро, гидрокси, C1-6 алкилов, С 3-7 циклоалкилов, С 4-10 алкилциклоалкилов, С 2-6 алкенилов, C1-6 алкокси, гидрокси-C1-6 алкилов, C1-6 алкилов, необязательно замещенных до 5 атомов фтора, C1-6 алкокси,необязательно замещенных до 5 атомов фтора;(i) пунктирная линия означает необязательную двойную связь. В настоящем изобретении предложены соединения общей формулы IX(e) Y представляет собой сульфонимидную группу формулы -C(O)NHS(O)2R9 , где R9 представляет собой С 1-3 алкил, С 3-7 циклоалкил, или фенил, который необязательно замещен от одного до двух атомов галогенов, циано, нитро, гидрокси, C1-3 алкилов, С 3-7 циклоалкилов, C1-3 алкокси, или Y представляет собой карбоксильную группу или ее фармацевтически приемлемую соль, сольват или пролекарство;(g) R20 представляет собой H, C1-6 алкил, С 3-7 циклоалкил, С 4-10 алкилциклоалкил, C6 или С 10 арил,гидрокси-С 1-6 алкил, C1-6 алкил, необязательно замещенным до 5 атомов фтора, (CH2)nNR6R7,(CH2)nC(O)OR14, где R14 представляет собой H, С 1-6 алкил, С 3-7 циклоалкил, С 4-10 алкилциклоалкил, которые все необязательно замещены от одного до трех раз галогеном, циано, нитро, гидрокси, С 1-6 алкокси или фенилом, или R14 представляет собой С 6 или С 10 арил, который является необязательно замещенным от одного до трех атомов галогена, циано, нитро, гидрокси, С 1-6 алкилов, С 3-7 циклоалкилов, С 4-10 алкилциклоалкилов, С 2-6 алкенилов, C1-6 алкокси, гидрокси-С 1-6 алкилов, С 1-6 алкилов, необязательно замещенных до 5 атомов фтора, C1-6 алкокси, необязательно замещенных до 5 атомов фтора; указанный C6 или С 10 арил в определении R12 и R13 является необязательно замещенным от одного до трех атомов галогена,циано, нитро, гидрокси, С 1-6 алкилов, С 3-7 циклоалкилов, С 4-10 алкилциклоалкилов, С 2-6 алкенилов, C1-6 алкокси, гидрокси-C1-6 алкилов, C1-6 алкилов, необязательно замещенных до 5 атомов фтора, C1-6 алкокси,необязательно замещенных до 5 атомов фтора;(i) пунктирная линия означает необязательную двойную связь;(j) где Z представляет собой конденсированный или присоединенный арил гетероарильной кольцевой системы. В настоящем изобретении также предложены композиции, включая фармацевтические композиции,содержащие соединения общей формулы I-IX или их соли, эфиры или другие производные. Предложен- 15011857 ные фармацевтические композиции содержат соединение согласно настоящему изобретению и фармацевтически приемлемый эксципиент. Из уровня техники известно множество различных фармацевтически приемлемых эксципиентов, поэтому нет необходимости приводить перечень подходящих эксципиентов в настоящем описании. Фармацевтически приемлемые эксципиенты описаны во множестве публикаций, включая, например, A. Gennaro (2000) "Remington: The Science and Practice of Pharmacy", 20th edition, Lippincott, Williams,Wilkins; Pharmaceutical Dosage Forms and Drug Delivery Systems (1999) H. C.A. H. Kibbe et al., eds., 3d ed. Amer. Pharmaceutical Assoc. Фармацевтически приемлемые эксципиенты, такие как разбавители, адъюванты, носители или растворители, легко доступны для ознакомления и приобретения. Кроме того, фармацевтически приемлемые вспомогательные вещества, такие как регуляторы рН, буферные агенты, регулирующие концентрацию агенты, стабилизаторы, увлажнители и тому подобное легко доступны для ознакомления и приобретения. В большинстве вариантов реализации изобретения соединение согласно настоящему изобретению ингибирует энзиматическую активность протеазы NS3 вируса гепатита С (ВГС). Ингибирует ли соединение NS3 ВГС, может быть легко определено известными методами. Обычные методы охватывают определение, расщепляется ли полипротеин ВГС или другой полипептид, включающий участок распознавания NS3, протеазой NS3 в присутствии агента. В большинстве вариантов осуществления изобретения описываемое соединение ингибирует NS3 энзиматическую активность, по меньшей мере приблизительно на 10%, по меньшей мере приблизительно на 15%, по меньшей мере приблизительно на 20%, по меньшей мере приблизительно на 25%, по меньшей мере приблизительно на 30%, по меньшей мере приблизительно на 40%, по меньшей мере приблизительно на 50%, по меньшей мере приблизительно на 60%, по меньшей мере приблизительно на 70%, по меньшей мере приблизительно на 80%, по меньшей мере приблизительно на 90% или более, по сравнению с энзиматической активностью NS3 в отсутствие соединения. Во многих вариантах реализации изобретения соединение согласно изобретению ингибирует энзиматическую активность NS3 протеазы ВГС с IC50 меньше, чем 50 М (мкМ), например, соединение по изобретению ингибирует энзиматическую активность NS3 протеазы ВГС с IC50 меньше чем 40 М,меньше чем 25 М, меньше чем 10 М, меньше чем 1 М, меньше чем 100 нМ, меньше чем 80 нМ,меньше чем 60 нМ, меньше чем 50 нМ, меньше чем 25 нМ, меньше чем 10 нМ или меньше чем 1 нМ или меньше. Во многих вариантах реализации изобретения предложенное в настоящем изобретении соединение ингибирует репликацию ВГС. Например, соединение согласно изобретению ингибирует репликацию ВГС, по меньшей мере приблизительно на 10%, по меньшей мере приблизительно на 15%, по меньшей мере приблизительно на 20%, по меньшей мере приблизительно на 25%, по меньшей мере приблизительно на 30%, по меньшей мере приблизительно на 40%, по меньшей мере приблизительно на 50%, по меньшей мере приблизительно на 60%, по меньшей мере приблизительно на 70%, по меньшей мере приблизительно на 80%, по меньшей мере приблизительно на 90% или более по сравнению с репликацией ВГС в отсутствие соединения. Ингибирует ли соединение репликацию ВГС, может быть определено методами, известными в уровне техники, включая исследование на репликацию вируса in vitro. ЛЕЧЕНИЕ ВИРУСНОЙ ИНФЕКЦИИ ГЕПАТИТА С Способы и композиции, приведенные в настоящем описании, в общем случае подходят для лечения вирусной инфекции гепатита С. Эффективность способа согласно изобретению при лечении вирусной инфекции гепатита С может быть определена по снижению вирусной нагрузки, снижению времени сероконверсии (вирус не обнаруживается в сыворотке пациента), увеличению скорости продолжительного вирусного ответа на лечение,снижению заболеваемости или смертности в клинических случаях или посредством другого индикатора ответа на заболевание. Обычно эффективное количество соединения формулы I-IX и необязательно один или более дополнительных антивирусных агентов, представляет собой количество, которое является эффективным для снижения вирусной нагрузки или улучшает продолжительный вирусный ответ на терапию. Эффективность способа согласно изобретению при лечении вирусной инфекции гепатита С может быть определена путем измерения вирусной нагрузки или измерения параметров, связанных с инфекцией гепатита С, включая, но не ограничиваясь такими параметрами, как фиброз печени, увеличение концентрации трансаминазы в сыворотке и некровоспалительной активности в печени. Индикаторы фиброза печени обсуждаются в деталях ниже. Предложенный способ включает введение эффективного количества соединения формулы I-IX необязательно в комбинации с эффективным количеством одного или более дополнительных антивирусных агентов. В некоторых вариантах реализации изобретения эффективное количество соединения формулы I-IX и необязательно одного или более дополнительных антивирусных агентов представляет количество, эффективное для снижения титра вируса до необнаруживаемого уровня, например, приблизи- 16011857 тельно от 1000 до 5000, от 500 до 1000 или от 100 до 500 геномных копий/мл сыворотки. В некоторых вариантах реализации изобретения эффективное количество соединения формулы I-IX и необязательно одного или более дополнительных антивирусных агентов представляет количество, эффективное для снижения вирусной нагрузки до уровня ниже 100 геномных копий/мл сыворотки. В некоторых вариантах реализации изобретения эффективное количество соединения формулы I-IX и необязательно одного или более дополнительных антивирусных агентов представляет количество, эффективное для достижения снижения 1.5-log (логарифм), 2-log, 2.5-log, 3-log, 3.5-log, 4-log, 4.5-log, или 5log титра вируса в сыворотке пациента. В некоторых вариантах реализации изобретения эффективное количество соединения формулы I-IX и необязательно одного или более дополнительных антивирусных агентов представляет количество, эффективное для улучшения продолжительного вирусного ответа, например отсутствие (не обнаружение) РНК ВГС (например, меньше чем 500, меньше чем 200 или меньше чем 100 геномных копий на миллилитр сыворотки) в сыворотке пациента за период в течение по меньшей мере одного месяца, по меньшей мере двух месяцев, по меньшей мере трех месяцев, по меньшей мере четырех месяцев, по меньшей мере пяти месяцев, по меньшей мере шести месяцев вслед за прекращением лечения. Эффективность способа согласно изобретению при лечении вирусной инфекции гепатита С может быть определена, как отмечено выше, путем измерения параметров, связанных с инфекцией гепатита С,таких как фиброз печени. Способы определения степени фиброза печени обсуждаются в деталях ниже. В некоторых вариантах реализации изобретения концентрация маркеров фиброза печени в сыворотке указывает на его степень. В качестве одного, не ограничивающего объем притязаний, примера измеряют концентрацию аланин аминотрансферазы (АЛТ) в сыворотке, используя стандартные исследования. Обычно, концентрация АЛТ меньше чем приблизительно 45 международных единиц (ME) считается нормальной. В некоторых вариантах реализации изобретения эффективное количество соединения формулы I-IX и необязательно одного или более дополнительных антивирусных агентов представляет количество, эффективное для снижения концентрации АЛТ ниже чем 45 МЕ/мл сыворотки. Терапевтически эффективное количество соединения формулы I-IX и необязательно одного или более дополнительных антивирусных агентов представляет количество, эффективное для снижения концентрации маркеров фиброза печени в сыворотке по меньшей мере приблизительно на 10%, по меньшей мере приблизительно на 15%, по меньшей мере приблизительно на 20%, по меньшей мере приблизительно на 25%, по меньшей мере приблизительно на 30%, по меньшей мере приблизительно на 40%, по меньшей мере приблизительно на 50%, по меньшей мере приблизительно на 60%, по меньшей мере приблизительно на 70%, по меньшей мере приблизительно на 80%, по меньшей мере приблизительно на 90% или более по сравнению с концентрацией маркеров у пациента без проведения лечения или пациента, получавшего плацебо. Способы измерения маркеров в сыворотке включают иммунологические методы, например иммуноферментный твердофазный анализ (ELISA), радиоиммуноанализ и тому подобное,используя антитела, специфичные для данного маркера в сыворотке. Во многих вариантах реализации изобретения эффективное количество соединения формулы I-IX и необязательно одного или более дополнительных антивирусных агентов представляет синергическое количество. Как используется здесь синергическая комбинация или синергическое количество соединения формулы I-IX и дополнительного антивирусного агента представляет собой комбинированную дозу, которая является более эффективной в терапевтическом или профилактическом лечении вирусной инфекции ГС, чем постепенное улучшение в результате лечения, которое предполагается или ожидается только от дополнительной комбинации (i) терапевтической или профилактической пользы соединения формулы I-IX, когда оно вводится в той же самой дозе в виде монотерапии и (ii) терапевтической или профилактической пользы дополнительного антивирусного агента, когда он вводится в той же самой дозе в виде монотерапии. В некоторых вариантах реализации изобретения выбранное количество соединения формулы I-IX и выбранное количество дополнительного антивирусного агента являются эффективным, когда используются в комбинированной терапии для лечения заболевания, но выбранное количество соединения формулы I-IX и/или выбранное количество дополнительного антивирусного агента является неэффективным, когда используется в монотерапии для лечения заболевания. Таким образом, изобретение охватывает (1) режимы, при которых выбранное количество дополнительного антивирусного агента улучшает терапевтическую пользу выбранного количества соединения формулы I-IX, когда они используются в комбинированной терапии для лечения заболевания, причем выбранное количество антивирусного агента не приносит терапевтическую пользу, когда оно используется в монотерапии для лечения заболевания; (2) режимы, при которых выбранное количество соединения формулы I-IX улучшает терапевтическую пользу выбранного количества дополнительного антивирусного агента, когда они используются в комбинированной терапии для лечения заболевания, причем выбранное количество соединения формулыI-IX не приносит терапевтическую пользу, когда оно используется в монотерапии для лечения заболевания; (3) режимы, при которых выбранное количество соединения формулы I-IX и выбранное количество дополнительного антивирусного агента обеспечивают терапевтическую пользу, когда они используются- 17011857 в комбинированной терапии для лечения заболевания, причем каждое из выбранных количеств соединения формулы I-IX и дополнительного антивирусного агента соответственно не приносит терапевтическую пользу, когда они используется в монотерапии для лечения заболевания. Как используется здесь,синергетически эффективное количество соединения формулы I-IX и дополнительного антивирусного агента и их грамматические эквиваленты следует считать включенными в любой режим, охваченный режимами (1)-(3), перечисленными выше. ФИБРОЗ Настоящее изобретение обеспечивает способы лечения фиброза печени (включая формы фиброза печени, являющиеся следствием или связанные с вирусной инфекцией гепатита С), которые обычно включают введение терапевтического количества соединения формулы I-IX и необязательно одного или более дополнительных антивирусных агентов, а также режимы дозирования, как обсуждается ниже. Эффективное количество соединений формулы I-IX с или без одного или более дополнительных антивирусных агентов, режимы дозирования также обсуждаются ниже. Эффективность лечения соединением формулы I-IX и необязательно одним или более дополнительным антивирусным агентом для снижения фиброза печени и функции печени определяется любым из числа хорошо известных способов определения фиброза печени и функции печени. Снижение фиброза печени определяется при анализе образца печеночной ткани, полученной при биопсии. Анализ биопсии печени включает оценку двух главных характеристик: некровоспалительный процесс, оцениваемый по степени для измерения серьезности заболевания и текущей активности заболевания, и поражение фиброзом и паренхимными или сосудистыми изменениями для оценки стадии как отражения длительного развития болезни. См., например, Brunt (2000) Hepatol. 31: 241-246; и METAVIR (1994) Hepatology 20: 15-20. На основании анализа биопсии печени устанавливаются индексы. Существуют различные стандартные системы градации, которые обеспечивают количественную оценку степени и серьезности фиброза. Они включают METAVIR, Knodell, Scheuer, Ludwig и Ishalc системы градации. Система градации METAVIR основывается на анализе различных признаков биопсии печени,включая фиброз (портальный фиброз, центродолевой фиброз и цирроз); некроз (частичный и лобулярный некроз, ацидофильная ретракция и баллонирующая дистрофия); воспаление (воспаление портальных трактов, портальное лимфоидное скопление и распространение портального воспаления); изменения желчных протоков; индекс Кноделля (Knodell) (стадия перипортального некроза, лобулярного некроза,портального воспаления, фиброза и полной степени активности заболевания). Определение каждой стадии в системе METAVIR является следующим: стадия 0 - нет фиброза; стадия 1 - стеллатное разрастание портального тракта, но без образования септ; стадия 2 - удлинение портального тракта с небольшим образованием септ; стадия 3 - многочисленные септы без цирроза; и стадия 4 - цирроз. Система градации Кноделля (Knodell), также называемая как Индекс Гистологической Активности(ИГА), классифицирует степень активности заболевания, основываясь на стадиях по четырем категориям гистологических признаков: I) перипортальный и/или мостовидный некроз; II) интралобулярная дегенерация и фокальный некроз; III) портальное воспаление и IV) фиброз. В системе градации Кноделля(мостовидный фиброз) и стадия 4 - цирроз. Чем выше стадия заболевания, тем более серьезно повреждена ткань печени. Knodell (1981) Hepatol. 1: 431. В системе градации Scheuer стадии являются следующими: стадия 0 - нет фиброза; стадия 1 - удлиненные фиброзно-измененные портальные тракты; стадия 2 - перипортальные или портопортальные септы, но нетронутая архитектоника; стадия 3 - фиброз с нарушением архитектоники, но отсутствие очевидного цирроза; стадия 4 - вероятный или определенный цирроз. Scheuer (1991) J. Hepatol. 13: 372. Система градации Исхака (Ishak) описана в Ishak (1995) J. Hepatol. 22: 696-699. Стадия 0 - нет фиброза; стадия 1 - фиброз некоторых портальных трактов с короткими фиброзными септами или без них; стадия 2 - фиброз большинства портальных трактов с короткими фиброзными септами или без них; стадия 3 - фиброз большинства портальных трактов с редкими портопортальными септами (мостовидный фиброз); стадия 4 - фиброз портальных трактов с выраженными мостовидным фиброзом (портопортальные или портоцентральные септы); стадия 5 - выраженный мостовидный фиброз (портопортальные или портоцентральные септы) с единичными узлами (ранний цирроз); стадия 6 - цирроз, вероятный или определяемый цирроз. Положительные эффекты лечения фиброза могут быть также измерены и оценены с использованием системы критериев Чайлда-Пью (Child-Pugh), которая включает многокомпонентную систему критериев, в основе которых лежит оценка нарушений концентрации в сыворотке билирубина, альбумина,протромбинового времени, наличие и серьезность асцита, наличие и серьезность энцефалопатии. На основании выявления и серьезности нарушения этих критериев, пациенты могут быть отнесены к одной из трех категорий по возрастанию серьезности заболевания: А, В или С. В некоторых вариантах реализации изобретения терапевтически эффективное количество соединения формулы I-IX и необязательно одного или более дополнительных антивирусных агентов представляет собой количество, которое осуществляет изменение одной единицы или более в стадии фиброза, осно- 18011857 вываясь на биопсии печени до и после лечения. В конкретных вариантах реализации изобретения, терапевтически эффективное количество соединения формулы I-IX и необязательно одного или более дополнительных антивирусных агентов снижает фиброз печени, по меньшей мере на одну единицу в системах градации METAVIR, Knodell, Scheuer, Ludwig, или Ishak. Вторичные или косвенные индексы функции печени также могут быть использованы для оценки эффективности лечения соединением формулы I-IX. Морфометрическая компьютеризированная полуавтоматическая оценка фиброза печени, основываемая на специфическом окрашивании коллагеном и/или сывороточными маркерами фиброза печени, также может быть измерена в качестве показателя эффективности описываемого способа лечения. Вторичные индексы функции печени включают, но не ограничиваются, уровнем трансаминазы в сыворотке, протромбиновым временем, билирубином, подсчетом тромбоцитов, портальным давлением, уровнем альбумина и оценкой критериев Чайлда-Пью (ChildPugh). Терапевтически эффективное количество соединения формулы I-IX и необязательно одного или более дополнительных антивирусных агентов представляет количество, эффективное для увеличения индекса функции печени по меньшей мере приблизительно на 10%, по меньшей мере приблизительно на 20%, по меньшей мере приблизительно на 25%, по меньшей мере приблизительно на 30%, по меньшей мере приблизительно на 35%, по меньшей мере приблизительно на 40%, по меньшей мере приблизительно на 45%, по меньшей мере приблизительно на 50%, по меньшей мере приблизительно на 55%, по меньшей мере приблизительно на 60%, по меньшей мере приблизительно на 65%, по меньшей мере приблизительно на 70%, по меньшей мере приблизительно на 75%, по меньшей мере приблизительно на 80%, по меньшей мере приблизительно на 80% или более по сравнению с индексом функции печени у пациента без проведения лечения или пациента, получавшего плацебо. Специалист в данной области техники может легко измерить такие индексы функции печени, используя стандартные исследовательские методы, многие из которых являются коммерчески доступными и которые используются обычно в клинических условиях. Сывороточные маркеры фиброза печени могут быть также измерены в качестве показателя эффективности описываемого способа лечения. Сывороточные маркеры включают, но не ограничиваются, гиалуронат, N-терминальный проколлаген III пептид, 7S домен типа IV коллагена, С-терминальный проколлаген I пептид и ламинин. Дополнительные биохимические маркеры фиброза печени включают -2 макроглобулин, гаптоглобулин, гамма глобулин, аполипопротеин А и гамма глютамил транспептидаза. Терапевтически эффективное количество соединения формулы I-IX и необязательно одного или более дополнительных антивирусных агентов представляет количество, эффективное для снижения концентрации маркеров фиброза печени в сыворотке, по меньшей мере приблизительно на 10%, по меньшей мере приблизительно на 15%, по меньшей мере приблизительно на 20%, по меньшей мере приблизительно на 25%, по меньшей мере приблизительно на 30%, по меньшей мере приблизительно на 40%, по меньшей мере приблизительно на 50%, по меньшей мере приблизительно на 60%, по меньшей мере приблизительно на 70%, по меньшей мере приблизительно на 80%, по меньшей мере приблизительно на 90% или более по сравнению с концентрацией маркеров у пациента без проведения лечения или пациента, получавшего плацебо. Специалист в данной области техники может легко измерить такие сывороточные маркеры фиброза печени, используя стандартные исследовательские методы, многие из которых являются коммерчески доступными и которые используются обычно в клинических условиях. Способы измерения маркеров в сыворотке включают иммунологические методы, например иммуноферментный твердофазный анализ (ELISA), радиоиммуноанализ и тому подобное, используя антитела, специфичные для данного маркера в сыворотке. Количественные тесты функциональных резервов печени также могут быть использованы для оценки эффективности лечения агонистами рецепторов интерферона и пирфенидона (или аналогов пирфенидона). Они включают: выведение индоцианина зеленого (ICG), способность удаления галактозы(GEC), аминопириновый дыхательный тест (ABT), выведение антипирина, выведение моноэтилглицинксилидида (MEG-X) и выведение кофеина. В контексте данного описания, осложнение, связанное с циррозом печени относится к заболеваниям, которые представляют собой последствия декомпенсационных заболеваний печени, т.е. или происходят вслед за, или являются результатом развития фиброза печени и включают, но не ограничиваются, развитие асцитов, варикозного кровотечения, портальной гипертензии, желтухи, прогрессирующей печеночной недостаточности, энцефалопатии, гепатоцеллюлярной карциномы, отсутствия функционирования печени, требующее ее пересадки, и летальный исход, связанный с заболеваниями печени. Терапевтически эффективное количество соединения формулы I-IX и необязательно одного или более дополнительных антивирусных агентов представляет количество, эффективное для снижения степени (например, вероятности, что у пациента будет развиваться заболевание) нарушений, связанных с циррозом печени, по меньшей мере приблизительно на 10%, по меньшей мере приблизительно на 20%, по меньшей мере приблизительно на 25%, по меньшей мере приблизительно на 30%, по меньшей мере приблизительно на 35%, по меньшей мере приблизительно на 40%, по меньшей мере приблизительно на 45%, по меньшей мере приблизительно на 50%, по меньшей мере приблизительно на 55%, по меньшей- 19011857 мере приблизительно на 60%, по меньшей мере приблизительно на 65%, по меньшей мере приблизительно на 70%, по меньшей мере приблизительно на 80% или более по сравнению с пациентами без проведения лечения или пациентами, получавшими плацебо. Эффективность лечения соединением формулы I-IX и необязательно одним или более антивирусным агентом в отношении снижения степени нарушений, связанных с циррозом печени, может быть легко определена специалистами в области техники. Снижение фиброза печени увеличивает функцию печени. Причем, изобретение обеспечивает методы увеличения функции печени, обычно включающие введение терапевтически эффективного количества соединения формулы I-IX и необязательно одного или более дополнительных антивирусных агентов. Функции печени включают, но не ограничиваются, синтетической функцией, включая, но не ограничиваясь, синтез протеинов, таких как сывороточные протеины (например, альбумин, факторы свертывания крови, щелочная фосфатаза, аминотрансферазы (например, аланиновая трансаминаза, аспартамовая трансаминаза), 5'-нуклеозидаза, -глютаминилтранспептидаза и так далее), синтез билирубина, синтез холестерина и синтез желчных кислот; метаболическая функция печени, включает, но не ограничиваясь,метаболизм углеводов, метаболизм аминокислот и аммиака, гормональный метаболизм и липидный метаболизм; детоксификацию экзогенных лекарственных средств; гемодинамическую функцию, включая внутренностную и портальную динамику кровообращения; и тому подобное. Улучшение функции печени может быть легко устанавлено специалистами в области техники, с помощью хорошо проверенных тестов по функциям печени. Причем синтез маркеров функции печени,таких как альбумин, щелочная фосфатаза, аланиновая трансаминаза, аспартамовая трансаминаза, билирубин и тому подобное, может быть определен измерением уровня маркеров в сыворотке, используя стандартные иммунологические и энзиматические исследования. Внутренностная циркуляция и портальная гемодинамика может быть измерена путем портального заклинивающего давления и/или сопротивления, используя стандартные методы. Метаболические функции могут быть измерены определением уровня аммиака в сыворотке. Также может быть определено, попадают ли значения концентрации сывороточных протеинов,обычно выделяемых печенью, в нормальный диапазон значений посредством стандартных иммунологических и энзиматических исследований. Специалисту в данной области известны нормальные диапазоны для таких сывороточных протеинов. Далее приводятся не ограничивающие объем притязаний примеры. Обычная концентрация аланиновой трансаминазы составляет около 45 ME на миллилитр сыворотки. Обычная концентрация аспартамовой трансаминазы составляет от 5 до 40 единиц на миллилитр сыворотки. Билирубин измеряется стандартными исследованиями. Нормальный уровень билирубина обычно меньше чем 1,2 мг/дл. Концентрация сывороточного альбумина измеряется, используя стандартные исследования. Обычный уровень сывороточного альбумина находится в диапазо не от 35 до 55 г/л. Длительность протромбинового времени измеряется, также используя стандартные исследования. Обычное протромбиновое время длится меньше 4 с по сравнению с контролем. Терапевтически эффективное количество соединения формулы I-IX и необязательно одного или более дополнительных антивирусных агентов представляет количество, эффективное для увеличения функции печени по меньшей мере приблизительно на 10%, по меньшей мере приблизительно на 20%, по меньшей мере приблизительно на 30%, по меньшей мере приблизительно на 40%, по меньшей мере приблизительно на 50%, по меньшей мере приблизительно на 60%, по меньшей мере приблизительно на 70%, по меньшей мере приблизительно на 80% или более. Например, терапевтически эффективное количество соединения формулы I-IX и необязательно одного или более дополнительных антивирусных агентов представляет количество, эффективное для снижения повышенной концентрации сывороточных маркеров функции печени, по меньшей мере приблизительно на 10%, по меньшей мере приблизительно на 20%, по меньшей мере приблизительно на 30%, по меньшей мере приблизительно на 40%, по меньшей мере приблизительно на 50%, по меньшей мере приблизительно на 60%, по меньшей мере приблизительно на 70%, по меньшей мере приблизительно на 80% или более, или снижения концентрации сывороточных маркеров функции печени до нормального диапазона. Терапевтически эффективное количество соединения формулы I-IX и необязательно одного или более дополнительных антивирусных агентов представляет количество, эффективное для увеличения пониженной концентрации сывороточных маркеров функции печени, по меньшей мере приблизительно на 10%, по меньшей мере приблизительно на 20%, по меньшей мере приблизительно на 30%, по меньшей мере приблизительно на 40%, по меньшей мере приблизительно на 50%, по меньшей мере приблизительно на 60%, по меньшей мере приблизительно на 70%, по меньшей мере приблизительно на 80% или более, или увеличения концентрации сывороточных маркеров функции печени до нормального диапазона. Агонисты рецепторов интерферона I типа. В любом из вышеописанных способов, в некоторых предпочтительных вариантах реализации изобретения вводятся агонисты рецепторов интерферона I типа. Агонисты рецепторов интерферона I типа включают какой-нибудь Интерферон (ИФН)-; какой-нибудь ИФН-; какой-нибудь ИФН-тау; какойнибудь IFN-; агонисты антител, специфичные к рецепторам интерферона I типа, включая непептидные- 20011857 агонисты. Интерферон-Альфа Любой известный ИФН- может быть использован в настоящем изобретении. Термин интерферон-альфа относится к семейству родственных полипептидов, которые ингибируют вирусную репликацию и клеточную пролиферацию и регулируют иммунный ответ. Термин ИФН- включает ИФНприродного происхождения, синтетические ИФН-, производные ИФН- (например, ИФН-, конъюгированный с ПЭГ, гликозилированный ИФН- и тому подобное); и аналоги природного происхождения или синтетические ИФН-; в основном любой ИФН-, который обладает антивирусными свойствами,как описывается для ИФН- природного происхождения. Подходящие альфа-интерфероны включают, но не ограничиваются, ИФН- природного происхождения (включая, но не ограничиваясь, природного происхождения ИФН-2 а, ИФН-2b); рекомбинантный интерферон-альфа-2b, такой как Intron-A интерферон, доступный от Schering Corporation, Kenilworth, N. J.; рекомбинантный интерферон-альфа-2 а, такой как Roferon интеферон, доступный от Hoffmann-La Roche, Nutley, N. J.; рекомбинантный интерферон-альфа-2 С, такой как Berofor альфа 2 интерферон, доступный от Boehringer Ingelheim Pharmaceutical, Inc., Ridgefield, Conn.; интерферон альфа-nl, очищенная смесь натуральных интерферонов, таких как Sumiferon, доступные от Sumitomo, Japan или такжеWellferon интерферон альфа-n1 (ИНС), доступный от Glaxo-Wellcome Ltd., London, Great Britain; и интерферон-альфа-n3 смесь натуральных альфа интерферонов, выполненных Interferon Sciences и доступных от Purdue Frederick Co., Norwalk, Conn., под торговой маркой Alferon. Термин интерферон-альфа также охватывает консенсусные ИФН-. Консенсусные ИФН- (также называемые как КИФН и ИФН-кон и консенсусный интерферон) включают, но не ограничиваются аминокислотными последовательностями, обозначаемыми IFN-conl (ИФН-кон 1), IFN-con2 (ИФНкон 2), и IFN-con3 (ИФН-кон 3), которые раскрыты в патентах США 4,695,623 и 4,897,471; и консенсусный интерферон по определению консенсусной последовательности интерферонов-альфа природного происхождения (например, Infergen, InterMune, Inc., Brisbane, Calif.). IFN-conl (ИФН-кон 1) представляет собой консенсусный интерфероновый агент в продукте Infergen alfacon-1. Продукт консенсусного интерферона Infergen именуется здесь в дальнейшем с помощью его брэнда (Infergen) или общим наименованием (интерферон альфакон-1). Последовательность ДНК, кодирующая ИФН-кон, может быть синтезирована как описано в вышеупомянутых патентах или другими стандартными методами. Использование КИФН представляет особый интерес. Также подходящими для использования в настоящем изобретении являются гибридные полипептиды, включающие ИФН- и гетерологичный полипептид. Подходящие ИФН- гибридные полипептиды включают, но не ограничиваются Albuieron-alpha (Альбуиерон-альфа) (гибридный продукт человеческого альбумина и ИФН-; Human Genome Sciences; смотреть, например, Osborn et al. (2002) J.Pharmacol. Exp. Therap. 303: 540-548). Также подходящими для применения в настоящем изобретении являются генно-смешанные формы ИФН-. Смотреть, например, Masci et al. (2003) Curr. Oncol. Rep. 5: 108-113. Интерферон-альфа, конъюгированный с ПЭГ. Термин ИФН- также охватывает производные ИФН-, которые являются трансформированными (например, являются химически модифицированными) для изменения некоторых их свойств, таких как период полувыведения из сыворотки. Таким образом термин ИФН- включает гликозилированный ИФН-; ИФН-, конъюгированный с полиэтиленгликолем (ИФН- с ПЭГ, ПЭГилированный ИФН) и тому подобное. ПЭГилированный ИФН- и способы его получения обсуждаются в патентах США 5,382,657; 5,981,709; и 5,951,974. ПЭГилированный ИФН- охватывает конъюгаты с ПЭГ любой из вышеописанных молекул ИФН-, включая, но не ограничиваясь, конъюгированный с ПЭГ интерферон альфа 2 а (Roferon, Hoffman La-Roche, Nutley, N. J.), интерферон альфа 2b (Intron, Schering-Plough, Madison, N. J.), интерферон альфа-2 с (Berofor Alpha, Boehringer Ingelheim, Ingelheim, Germany); и консенсусный интерферон по определению консенсусной последовательности интерферонов-альфа природного происхождения (Infergen, InterMune, Inc., Brisbane, Calif.). Любой из вышеупомянутых полипептидов ИФН- может быть модифицирован одним или более фрагментами полиэтиленгликоля, то есть конъюгирован с ПЭГ. Молекула полиэтиленгликоля ПЭГилированного ИФН- полипептида, конъюгируется к одной или более аминокислотной боковой цепи полипептида ИФН-. В некоторых вариантах реализации изобретения ПЭГилированный ИФН- содержит фрагменты ПЭГ только на одной аминокислоте. В других вариантах реализации изобретения, ПЭГилированный ИФН- содержит фрагменты ПЭГ на двух или более аминокислотах, например, ИФН- содержит фрагменты ПЭГ, присоединенные к двум, трем, четырем, пяти, шести, семи, восьми, девяти или десяти различным аминокислотным остаткам. ИФН- может быть соединен с ПЭГ напрямую (то есть без связующих групп) через амино-группу,сульфгидрильную группу, гидроксильную группу или карбоксильную группу. В некоторых вариантах реализации изобретения, ПЭГилированный ИФН- конъюгирован с ПЭГ на или около амино окончании (N-окончание) полипептида ИФН-, например фрагмент ПЭГ конъюгирован- 21011857 с полипептидом ИФН- на одном или более аминокислотных остатках от аминокислоты 1 через аминокислоту 4, или от аминокислоты 5 через аминокислоту 10. В других вариантах реализации изобретения, ПЭГилированный ИФН- конъюгирован с ПЭГ на одном или более аминокислотном остатке от приблизительно 10 к приблизительно 28. В некоторых вариантах реализации изобретения, ПЭГилированный ИФН- конъюгирован с ПЭГ на или около карбоксильном окончании (С-окончание) полипептида ИФН-, например, на одной или более аминокислот 156-166 или из аминокислот 150 до 155. В других вариантах реализации изобретения, ПЭГилированный ИФН- конъюгирован с ПЭГ на одном или более аминокислотном остатке из аминокислот 100-114. Конъюгация полиэтиленгликоля с аминокислотными остатками на или около рецепторсвязывающими и/или активными участками доменов протеина ИФН- может нарушить функционирование этих доменов. В некоторых вариантах реализации изобретения аминокислоты, на которых конъюгации с ПЭГ избегают, включают аминокислотные остатки от аминокислот 30-40; и аминокислотные остатки от аминокислот 113-149. В некоторых вариантах реализации изобретения ПЭГ присоединяется к ИФН- через связывающую(линкерную) группу. Линкерная группа представляет собой любую биосовместимую связывающую группу, где биосовместимость указывает, что соединение или группа не является токсичной и может быть использована in vitro или in vivo без нанесения вреда, причинения заболеваний, болезней, смерти. Подходящие биосовместимые группы включают, но не ограничиваются, эфирной группой, амидной группой, имидной группой, карбаматной группой, карбоксильной группой, гидроксильной группой, углеводами, сукцинимидной группой (включая, например, сукцинимидил сукцинат (SSA), сукцинимидил пропионат (SPA), сукцинимидил бутаноат (SBA), сукцинимидил карбоксиметилат (SCM), сукцинимидил сукцинамид (SSA) или N-гидрокси сукцинимид (NHS, эпоксидными группами, оксикарбонилимидазольной группой (включая, например, карбонилдимидазол (CDI, нитрофенильной группой (включая,например, нитрофенил карбонат (NPC) или трихлорфенил карбонат (TPC, тризилатной группой, альдегидной группой, изоцианатной группой, винилсульфоновой группой, тирозиновой группой, цистиновой группой, гистидиновой группой или первичным амином. Способы получения сукцинимидил пропионата (SPA) и сукцинимидил бутаноата (SBA) - эфиров,активируемых ПЭГ, описаны в патенте США 5672662 (Harris, et al.) и WO 97/03106. Способы присоединения ПЭГ к ИФН- полипептиду известны в уровне техники и любой известный способ может быть использован. См., например, Park и др., Anticancer Res., 1:373-376 (1981); Zaplipsky и Lee, Polyethylene Glycol Chemistry: Biotechnical and Biomedical Applications, J. M. Harris, ed., PlenumPress, NY, Глава 21 (1992); патенты США 5,985,265; 5,672,662 (Harris, et al.) и WO 97/03106. ПЭГилированный ИФН- и способы его получения, обсуждаются, например, в патентах США 5382657; 5981709; 5985265 и 5951974. ПЭГилированный ИФН- охватывает конъюгаты с ПЭГ любой из вышеописанных молекул ИФН-, включая, но не ограничиваясь, конъюгированный с ПЭГ интерферон альфа 2 а (Roferon, Hoffman La Roche, Nutley, N. J.), где ПЭГилированный Roferon известен какIngelheim, Ingelheim, Germany); и консенсусный интерферон по определению консенсусной последовательности интерферонов-альфа природного происхождения (Infergen, InterMune, Inc., Brisbane, Calif.),где ПЭГилированный Infergen известен как PEG-Infergen. Во многих вариантах реализации изобретения ПЭГ представляет собой молекулу монометоксиполиэтиленгликоля, которая взаимодействует с первичной аминовой группой полипептида ИФН-. Способы модифицирования полипептидов монометоксиПЭГ путем восстановительного алкилирования известны из уровня техники. См., например, Chamow et al. (1994) Bioconj. Chem. 5: 133-140. [00100] В одном,не ограничивающем объем притязаний, примере ПЭГ конъюгируется с ИФН- через линкер - сукцинимидил пропионат SPA. Эфиры SPA и ПЭГ и способы их получения описаны в патенте США 5672662. SPA-связи обеспечивают соединение со свободными аминогруппами полипептида ИФН-. Например, молекула ПЭГ соединяется ковалентно через связь, которая включает амидную связь между пропионильной группой фрагмента ПЭГ и эпсилон аминогруппой выступающего на поверхности лизинового остатка в ИФН- полипептиде. Такая связь может быть образована, например, конденсацией-метокси, омега пропановой кислоты активированного эфира ПЭГ (mПЭГspa).В одном, не ограничивающем объем притязаний, примере конъюгат одного моноПЭГилированного КИФН, предпочтительный для использования здесь, имеет линейный ПЭГ фрагмент около 30 кД, присоединенный с помощью ковалентной связи к полипептиду КИФН, где ковалентная связь представляет собой амидную связь между пропионильной группой фрагмента ПЭГ и эпсилон-аминогруппой выступающего на поверхности лизинового остатка в полипептиде КИФН, где выступающий на поверхности лизиновый остаток выбран изlys31, lys50, lys71, lys84, lys121,lys122, lys134, lys135 и lys165, и амидная связь образуется при конденсации метокси, омега-пропановой кислоты активированного эфира ПЭГ.- 22011857 Полиэтиленгликоль Полиэтиленгликоль (ПЭГ), подходящий для конъюгации с каким-нибудь полипептидом ИФН-,растворим в воде при комнатной температуре и имеет общую формулу R(O-CH2-CH2)nO-R, где R представляет собой водород или защитную группу, такую как алкильную или алканоильную, и где n представялет собой целое число от 1 до 1000. Если R представляет защитную группу, то она обычно содержит от 1 до 8 атомов углерода. Во многих вариантах реализации изобретения ПЭГ имеет по меньшей мере одну гидроксильную группу, например терминальную гидроксильную группу, где гидроксильная группа модифицируется с образованием функциональной группы для взаимодействия с аминогруппой, например эпсилонаминогруппой лизинового остатка, свободной аминогруппой на N-окончании полипептида или любой другой аминогруппой, такой как аминогруппа аспарагина, глютамина, аргинина или гистидина. В других вариантах реализации изобретения ПЭГ трансформируют так, что он сам вступает в химическую реакцию с ИФН- полипептидом, например свободная карбоксильная группа на карбоксильном окончании ИФН- полипептида. Подходящие производные ПЭГ, которые способны вступать во взаимодействие со свободной карбоксильной группой на карбоксильном окончании полипептида ИФНвключают, но не ограничиваются ПЭГ-аминами, и гидразиновыми производными ПЭГ (например, ПЭГNH-NH2). В других вариантах реализации изобретения ПЭГ трансформируют так, что он включает терминальную тиокарбоксильную группу -COSH, которая селективно взаимодействует с аминогруппами с образованием амидных производных. Благодаря химической природе тиокислот селективность некоторых аминогрупп по сравнению с другими улучшается. Например, -SH демонстрирует достаточную способность уходящей группы в реакции с N-концевой аминогруппой при соответствующих значениях рН, таких что -аминогруппы в лизиновых остатках протонируются и остаются ненуклеофильными. С другой стороны реакции при подходящих значениях рН могут заставлять некоторые из доступных лизиновых остатков взаимодействовать селективно. В других вариантах реализации изобретения ПЭГ включает химически активный эфир, такой как Nгидрокси сукцинимидат на конце ПЭГ-цепи. Такой N-гидрокси сукцинимидат, содержащий ПЭГмолекулу, взаимодействует с селективной аминогруппой при конкретных значениях рН, таких как нейтральные 6,5-7,5. Например, N-концевые аминогруппы могут быть селективно модифицированы при нейтральных значениях рН. Однако если химическая активность реагентов была бы сверхвысокой, доступные NH2 группы лизина могут также прореагировать. ПЭГ может быть напрямую конъюгирован с ИФН- полипептидом или через линкер. В некоторых вариантах реализации изобретения линкер добавляется к ИФН- полипептиду, образуя модифицированный линкером ИФН- полипептид. Такие линкеры обеспечивают различные функциональные группы,например химически активные группы, такие как сульфгидрильная, амино или карбоксильная группа для соединения реагента ПЭГ с модифицированным линкером ИФН- полипептида. В некоторых вариантах реализации изобретения ПЭГ, конъюгированный с полипептидом ИФН-,является линейным. В других вариантах реализации изобретения ПЭГ, конъюгированный с полипептидом ИФН-, является разветвленным. Разветвленные производные ПЭГ, такие как описаны в патентах США 5643575, звездчатые ПЭГи и сильноразветвленные ПЭГи, такие как описаны в ShearwaterPolymers, Inc. Каталог Производные полиэтиленгликоля 1997-1998. Звездчатые ПЭГи описаны в уровне техники, включая, например, патент США 6046305. ПЭГ имеет молекулярный вес от приблизительно 2 до приблизительно 100 кДа, где термин приблизительно применительно для ПЭГ указывает, что при получении полиэтиленгликоля некоторые молекулы имеют больший вес, некоторые меньший, чем заявляемый молекулярный вес. Например, ПЭГ,подходящий для конъюгации с ИФН-, имеет молекулярный вес от приблизительно 2 до приблизительно 5 кДа, от приблизительно 5 до приблизительно 10 кДа, от приблизительно 10 до приблизительно 15 кДа,от приблизительно 15 до приблизительно 20 кДа, от приблизительно 20 до приблизительно 25 кДа, от приблизительно 25 до приблизительно 30 кДа, от приблизительно 30 до приблизительно 40 кДа, от приблизительно 40 до приблизительно 50 кДа, от приблизительно 50 до приблизительно 60 кДа, от приблизительно 60 до приблизительно 70 кДа, от приблизительно 70 до приблизительно 80 кДа, от приблизительно 80 до приблизительно 90 кДа, от приблизительно 90 до приблизительно 100 кДа. Получение конъюгатов ПЭГ-ИФН-. Как обсуждается выше, фрагменты ПЭГ могут присоединены напрямую или через линкер к аминокислотным остаткам на или около N-окончания, внутри, или на, или около С-окончания ИФН- полипептида. Конъюгация может быть осуществлена в растворе или твердой фазе.N-терминальное соединение. Методы присоединения ПЭГ фрагментов к аминокислотным остаткам на или около N-окончания полипептида ИФН- известны в уровне техники. См., например, патент США 5985265. В некоторых вариантах реализации изобретения известные методы для селективного получения Nтерминально химически модифицированного ИФН- используются. Например, может быть использован- 23011857 способ модификации протеинов путем восстановительного алкилирования, в котором используется различная химическая активность отличающихся типов первичных аминогрупп (лизин в сравнении с Nокончанием), доступных для трансформации конкретных протеинов. При соответствующих условиях реакции селективная трансформация протеина на N-окончании с карбонильной группой, содержащей полимер, улучшается. Реакция осуществляется при рН, которое позволяет соединению воспользоваться разницей рKа между -аминогруппами лизиновых остатков и -аминогруппами N-терминального остатка протеина. Путем такой селективной трансформации присоединение фрагмента ПЭГ к ИФН- контролируется: конъюгация с полимером имеет место преимущественно на N-окончание ИФН- и значительная модификация других химически активных групп, таких как аминогруппы лизиновых боковых цепей,не происходит. С-терминальное соединение Процедуры N-терминального специфического соединения, такие как описаны в патенте США 5985265, обеспечивают преимущественно моноПЭГилированные продукты. Однако процедуры очистки, направленные на удаление избытка реагентов и незначительные множественные ПЭГилированные продукты, удаляют N-терминально защищенные полипептиды. В условиях терапии такие процессы приведут к значительному увеличению производственных затрат. Например, исследование структуры тщательно охарактеризованной аминокислотной последовательности Infergen Alfacon-1 КИФН полипептида демонстрирует, что отсечение (ограничение) равно приблизительно 5% на карбоксильном окончании и,таким образом, существует только одна основная С-терминальная последовательность. Таким образом, в некоторых вариантах реализации изобретения, N-терминально ПЭГилированный ИФН- не используется; вместо него используется ИФН- полипептид, конъюгированный с ПЭГ по С-окончанию. Таким образом, эффективный синтетический и также терапевтический подход для получения моно ПЭГилированных продуктов Infergen представлен следующим образом: ПЭГ-реагент, который является селективным для С-окончания может быть подготовлен с или без спейсеров. Например, полиэтиленгликоль, модифицированный как метиловый эфир на одном конце и имеющий аминогруппу на другом конце, может быть использован в качестве исходного материала. Подготовка или получение растворимого в воде карбодиимида в качестве конденсирующего агента может быть осуществлены. Соединение ИФН- (например, Infergen Alfacon-1 КИФН или консенсусного интерферона) с растворенным в воде карбодиимидом в качестве конденсирующего агента обычно осуществляется в водной среде с подходящей буферной системой при оптимальном значении рН для получения амидной связи. ПЭГ с высоким молекулярным весом может быть присоединен к протеину ковалентно для увеличения молекулярного веса. Выбранные реагенты будут зависеть от исследований оптимизации процесса. Примером подходящего реагента, не ограничивающим объем притязаний, является EDAC или 1-этил-3-(3 диметиламинопропил)карбодиимид. Растворимость EDAC в воде дает возможность прямого добавления к реакции без необходимости предварительного растворения в органическом растворителе. Избыток реагента и изомочевина, образующаяся в качестве побочного продукта в результате реакции образования межмолекулярных связей, являются растворимыми в воде и могут легко быть удалены диализом или гель-фильтрацией. Концентрированный раствор EDAC в воде готовится для облегчения добавления небольшого молярного количества к реакционной смеси. Исходный раствор готовится и используется незамедлительно, принимая во внимание неустойчивость реагентов в воде. Большинство из синтетических протоколов в литературе предлагает оптимальную реакционную среду при рН диапазоне между 4,7 и 6,0. Однако реакция конденсации протекают без значительных потерь в выходе до значения рН 7,5. Вода может быть использована в качестве растворителя. Принимая во внимание предполагаемое использование Infergen, предпочтительно средой будет буферный раствор 2-(N-морфолино) этансульфоновой кислоты, предварительно титрованный до рН между 4,7 и 6,0. Однако 0,1 М фосфат при рН 7-7,5 может быть также использован, принимая во внимание тот факт, что продукт находится в том же самом буфере. Соотношение ПЭГ амина к молекуле ИФН- подбирается так, что С-терминальный(е) карбоксильный(е) остаток (остатки) селективно конъюгируются с ПЭГ с получением моноПЭГилированного производного(производных). Даже при использовании ПЭГ амина, который был упомянут выше по названию или структуре, такие производные приведены только для примера, и другие группы, такие как гидразиновые производные ПЭГ-NH-NH2, которые также будут конденсироваться с карбоксильной группой ИФН-, могут быть использованы. В дополнении к водной фазе, реакции также могут быть проведены в твердой фазе. Полиэтиленгликоль может быть выбран из списка соединений с молекулярным весом в диапазоне от 30040000. Выбор различных полиэтиленликолей может также руководствоваться эффективностью связывания и биологическим характеристиками очищенных производных in vitro и in vivo, т.е. временем циркуляции и антивирусной активности и т.д. Дополнительно, подходящие спейсеры могут быть добавлены к C-окончанию протеина. Спейсеры могут содержать химически активные группы, такие как SH, NH2 или COOH для связывания с соответствующим ПЭГ реагентом для получения производных ИФН- с высоким молекулярным весом. Комбини- 24011857 рованная методика твердой/растворенной фазы может быть разработана для получения C-терминальных ПЭГилированных интерферонов. Например, С-окончание ИФН- размещается на твердой фазе, используя спейсер Gly-Gly-Cys-NH2 и затем моноПЭГилируется в растворе, используя активированный дитиопиридил-ПЭГ реагент соответствующего молекулярного веса. Поскольку связывание на C-окончании не зависит от защиты N-окончания, представленные процессы и продукты будут выгодными с точки зрения расходов (треть протеина не расходуется по сравнению с методами N-терминального ПЭГилирования) и способствует экономии при лечении вирусной инфекции. Существуют, может быть, более химически активные карбоксильные группы аминокислотных остатков где-нибудь в другом месте в молекуле для взаимодействия с ПЭГ реагентом и проводящие к моноПЭГилированию на этом участке или к множественному ПЭГилированию при добавлении к COOH наC-окончании ИФН-. Понятно, что эти реакции будут минимальными при стерической свободе на Сокончании молекулы и стерических препятствиях, налагаемых карбодиимидами и ПЭГ реагентами, как в разветвленных цепях молекулы. Таким образом, это является предпочтительным способом ПЭГ модификации для Infergen и таких подобных протеинов, природных или полученных рекомбинантным способом,которые могут иметь защиту N-окончания для изменения степени улучшения эффективности и поддержания более высокой биологической активности in vivo. Другой способ улучшения С-терминального ПЭГилирования является следующим. Селективность С-терминального ПЭГилирования улучшается стерически громоздкими реагентами, которые исключают реакции на карбоксильных остатках, которые скрыты в спиралях или внутри ИФН-. Например, один такой реагент мог бы быть разветвленной цепью ПЭГ с молекулярным весом 40 кДа и этот агент мог бы быть синтезирован следующим образом: OH3C-(CH2CH2O)n-CH2CH2NH2 + Глутаминовая кислота, то есть, HOCO-CH2CH2CH(NH2)-COOH конденсируются с подходящим агентом, например, дициклогексил карбодиимидом или водорастворимым EDC для получения разветвленной цепи ПЭГ агента ОН 3 С(CH2CH2O)n-CH2CH2NHCOCH(NH2)CH2OCH3-(CH2OCH2)n-CH2CH2NHCOCH2EDAC - 1-этил-3-(3-диметиламинопропил)карбодиимид Этот реагент может быть использован в избытке для соединения аминогруппы и свободной и доступной карбоксильной группы с образованием пептидной связи. Если желательно, ПЭГилированный ИФН- отделяется от не ПЭГилированного ИФН-, используя известные методы, включая, но не ограничиваясь ионообменной хроматографией, эксклюзионной хроматографией и их комбинацией. Например, где конъюгат ПЭГ и ИФН- представляет собой моноПЭГилированный ИФН-, продукты сначала отделяются ионообменной хроматографией с получением материала, имеющего зарядные характеристики моноПЭГилированного материала (другой мультиПЭГилированный материал, имеющий те же самые кажущие заряды, может присутствовать), и затем моноПЭГилированный материал оделяется, используя эксклюзионную хроматографию. ИФНТермин интерферон-бета (ИФН-) включает ИФН- полипептиды, которые являются полипептидами природного происхождения; неприродного происхождения и аналогами полипептидов ИФН- природного и неприродного происхождения, которые сохраняют антивирусную активность родственных полипептидов ИФН- природного и не природного происхождения. Любой из множества бета-интерферонов может быть доставлен способом продолжительной доставки по настоящему изобретению. Подходящие бета-интерфероны включают, но не ограничиваются ИФН природного происхождения; ИФН- 1a, например Avonex (Biogen, Inc.), и Rebif (Serono, SA); ИФН 1b (Betaseron; Berlex) и подобные. Формы ИФН- могут включать N-защищенные виды, где N-терминальная аминокислота ацилиро- 25011857 вана ацильными группами, такими как формильная группа, ацетильная группа, малонильная группа и тому подобное. Также подходящим для использования является консенсусный ИФН-. ИФН- полипептиды могут быть получены известными методами. ДНК последовательности, кодирующие ИФН-, могут быть синтезированы, используя стандартные методы. Во многих вариантах осуществления изобретения, ИФН- полипептиды являются продуктами экспрессии полученных ДНК последовательностей, трансформированных или трансфектированных в бактериальные клетки-хозяева,например E. coli, или эукариотические клетки-хозяева (например дрожжи, клетки млекопитающих, такие как CHO клетки и тому подобное). В этих вариантах осуществления изобретения, ИФН- представляет собой рекомбинантный ИФН-. Когда клетка-хозяин представляет собой бактериальную клетку-хозяин,ИФН- модифицируется включением N-терминального метионина. Понятно, что ИФН-, описанный здесь, может включать один или более модифицированных аминокислотных остатков, например путем гликозилирования, химических модификаций и тому подобное. ИФН-тау Термин интерферон-тау включает полипептиды ИФН-тау, которые являются полипептидами природного происхождения, неприродного происхождения и аналогами полипептидов ИФН-тау природного и неприродного происхождения, которые сохраняют антивирусную активность родственных полипептидов ИФН-тау природного и неприродного происхождения. Подходящие тау интерфероны включают, но не ограничиваются ИФН-тау природного происхождения; Tauferon (Pepgen Corp.); и подобные. [00133] ИФН-тау может включать аминокислотную последовательность, как установлено в любой одной из GenBank КаталогеP15696; Р 56828; Р 56832; P56829;P56831; Q29429; Q28595; Q28594; S08072; Q08071; Q08070; Q08053; P56830; P28169; P28172; и Р 28171. Последовательность любого известного ИФН-тау полипептида может быть изменена различными способами, известными в уровне техники для создания целевых изменений в последовательности. Разновидность полипептида будет обычно в значительной степени подобна последовательностям, представленным здесь, т.е. будет отличаться по меньшей мере на одну аминокислоту и может отличаться по меньшей мере на две, но не более чем на десять аминокислот. Изменения последовательности могут представлять собой замены, вставки, исключения. Консервативные аминокислотные заместители обычно включают заместители в следующих группах: (глицин, аланин); (валин, изолейцин, лейцин); (аспартамовая кислота,глутаминовая кислота); (аспарагин, глутамин); (серин, треонин); (лизин, аргинин); или (фенилаланин,тирозин). Представляющие интерес модификации, которые могут или не могут изменять первичную аминокислотную последовательность, включают химическую трансформацию полипептидов, например ацетилирование или карбоксилирование; изменения в аминокислотной последовательности, которые вводят или исключают участки гликозилирования; изменения аминокислотной последовательности, которые делают протеин восприимчивей к ПЭГилированию, и тому подобное. Также включают модификации гликозилирования, например выполненные модификацией образцов гликозилирования полипептида во время его синтеза и обработки или дальнейшие стадии обработки, например воздействие на полипептид энзимов, которые затрагивают гликозилирование, такие как ферменты гликозилирования млекопитающих или энзимы дегликозилирования. Также включают последовательности, которые имеют фосфорилированные аминокислотные остатки, например фосфотирозин, фосфосерин или фосфотреонин. Формы ИФН-тау могут включать N-защищенные виды, где N-терминальная аминокислота ацилирована ацильными группами, такими как формильная группа, ацетильная группа, малонильная группа и тому подобное. Также подходящим для использования является консенсусный ИФН-тау. ИФН-тау полипептиды могут быть получены известными методами. ДНК последовательности, кодирующие ИФН-тау, могут быть синтезированы, используя стандартные методы. Во многих вариантах осуществления изобретения, ИФН-тау полипептиды являются продуктами экспрессии полученных ДНК последовательностей, трансформированных или трансфектированных в бактериальные клетки-хозяева,например E. coli, или эукариотические клетки-хозяева (например дрожжи, клетки млекопитающих, такие как CHO клетки и тому подобное). В этих вариантах осуществления изобретения, ИФН-тау представляет собой рекомбинантный ИФН-тау. Когда клетка-хозяин представляет собой бактериальную клеткухозяин, ИФН-тау модифицируется включением N-терминального метионина. Понятно, что ИФН-тау, описанный здесь, может включать один или более модифицированных аминокислотных остатков, например, путем гликозилирования, химических модификаций и тому подобное. ИФНТермин интерферон-омега (ИФН-) включает ИФН- полипептиды, которые являются полипептидами природного происхождения; неприродного происхождения и аналогами полипептидов ИФНприродного и неприродного происхождения, которые сохраняют антивирусную активность родственных полипептидов ИФН- природного и неприродного происхождения. Любой известный омега интерферон может быть доставлен способом продолжительной доставки по настоящему изобретению. Подходящие ИФН- включают, но не ограничиваются ИФН- природного- 26011857 происхождения; рекомбинантный ИФН-, например Biomed 510 (BioMedicines); и подобные. ИФН- может включать аминокислотную последовательность, как установлено в любой одной изGenBank Каталоге NP002168; или ААА 70091. Последовательность любого известного ИФН- полипептида может быть изменена различными способами, известными в уровне техники для создания целевых изменений в последовательности. Разновидность полипептида будет обычно в значительной степени подобна последовательностям, представленным здесь, то есть будет отличаться по меньшей мере на одну аминокислоту и может отличаться по меньшей мере на две, но не более чем десять аминокислот. Изменения последовательности могут представлять собой замены, вставки, исключения. Консервативные аминокислотные заместители обычно включают заместители в следующих группах: (глицин, аланин);(валин, изолейцин, лейцин); (аспартамовая кислота, глутаминовая кислота); (аспарагин, глутамин); (серин, треонин); (лизин, аргинин) или (фенилаланин, тирозин). Представляющие интерес модификации, которые могут или не могут изменять первичную аминокислотную последовательность, включают химическую трансформацию полипептидов, например ацетилирование или карбоксилирование; изменения в аминокислотной последовательности, которые вводят или исключают участки гликозилирования; изменения аминокислотной последовательности, которые делают протеин восприимчивей к ПЭГилированию, и тому подобное. Также включают модификации гликозилирования, например выполненные модификацией образцов гликозилирования полипептида во время его синтеза и обработки или дальнейшие стадии обработки, например воздействие на полипептид энзимов, которые затрагивают гликозилирование, такие как ферменты гликозилирования млекопитающих или энзимы дегликозилирования. Также включают последовательности, которые имеют фосфорилированные аминокислотные остатки, например фосфотирозин, фосфосерин или фосфотреонин. Формы ИФН- могут включать N-защищенные виды, где N-терминальная аминокислота ацилирована ацильными группами, такими как формильная группа, ацетильная группа, малонильная группа и тому подобное. Также подходящим для использования является консенсусный ИФН-. ИФН- полипептиды могут быть получены известными методами. ДНК последовательности, кодирующие ИФН-, могут быть синтезированы, используя стандартные методы. Во многих вариантах осуществления изобретения ИФН- полипептиды являются продуктами экспрессии полученных ДНК последовательностей, трансформированных или трансфектированных в бактериальные клетки-хозяева,например E. coli, или эукариотические клетки-хозяева (например дрожжи, клетки млекопитающих, такие как CHO клетки и тому подобное). В этих вариантах осуществления изобретения, ИФН- представляет собой рекомбинантный ИФН-. Когда клетка-хозяин представляет собой бактериальную клетку-хозяин,ИФН- модифицируется включением N-терминального метионина. Понятно, что ИФН-, описанный здесь, может включать один или более модифицированных аминокислотных остатков, например, путем гликозилирования, химическими модификациями и тому подобное. Агонисты рецепторов интерферона III типа. В любом из вышеописанных способов, агонист рецепторов интерферона представляет собой в некоторых вариантах осуществления изобретения агонист рецепторов интерферона III типа (например,интерфероновый агонист III типа). Тип III интерфероновых агонистов включает какой-нибудь IL-28b полипептид; и IL-28 а полипептид; и IL-29 (интерлейкин-29) полипептид; рецептор антитела, специфичного для III типа интерфероновых рецепторов; и любой другой агонист III типа интерфероновых рецепторов, включая не полипептидные агонисты.IL-28A, IL-28B и IL-29 (именуемые в дальнейшем как интерфероны III типа или ИФН III) описаны в Sheppard et al. (2003) Nature 4: 63-68. Каждый полипептид связывает гетеродимерный рецептор,состоящий из рецептора IL-10 (интерлейкина)цепи и рецептор IL-28a. Sheppard et al. (2003), выше. Аминокислотные последовательности IL-28A, IL-28B и IL-29 обнаружены в каталоге GenBank под номерами NP742150, NP742151 и NP42152, соответственно. Аминокислотная последовательность ИФН полипептида III типа может быть изменена различными способами, известными в уровне техники для создания целевых изменений в последовательности. Разновидность полипептида будет обычно в значительной степени подобна последовательностям, представленным здесь, то есть будет отличаться по меньшей мере на одну аминокислоту и может отличаться по меньшей мере на две, но не более чем на десять аминокислот. Изменения последовательности могут представлять собой замены, вставки, исключения. Сканирующие мутации, которые обычно вводят аланин или другие остатки, могут быть использованы для определения ключевых аминокислот. Специфические аминокислотные заместители, представляющие интерес, включают консервативные и не консервативные изменения. Консервативные аминокислотные заместители обычно включают заместители в следующих группах: (глицин, аланин); (валин, изолейцин, лейцин); (аспартамовая кислота, глутаминовая кислота); (аспарагин, глутамин); (серии, треонин); (лизин, аргинин); или (фенилаланин, тирозин). Представляющие интерес модификации, которые могут или не могут изменять первичную аминокислотную последовательность, включают химическую трансформацию полипептидов, например ацетилирование или карбоксилирование; изменения в аминокислотной последовательности, которые вводят- 27011857 или исключают участки гликозилирования; изменения аминокислотной последовательности, которые делают протеин восприимчивей к ПЭГилированию и тому подобное. Также включают модификации гликозилирования, например выполненные модификацией образцов гликозилирования полипептида во время его синтеза и обработки или дальнейшие стадии обработки, например воздействие на полипептид энзимов, которые затрагивают гликозилирование, такие как ферменты гликозилирования млекопитающих или энзимы дегликозилирования. Также включают последовательности, которые имеют фосфорилированные аминокислотные остатки, например фосфотирозин, фосфосерин или фосфотреонин. В изобретение включены полипептиды, которые были модифицированы, используя обычные химические техники для улучшения их резистентности к протеолитической деструкции, оптимизировать свойства растворимости или сделать их более подходящими в качестве терапевтических агентов. Например, основная цепь пептида может быть циклизована для улучшения стабильности (смотреть Friedler и др.(2000) J. Biol. Chem. 275: 23783-23789). Могут быть использованы аналоги, которые включают остатки, отличные от L-аминокислот природного происхождения, например D-аминокислот или синтетических аминокислот не природного происхождения. Протеин может быть конъюгирован с ПЭГ для улучшения стабильности. Полипептиды могут быть соединены с альбумином. Полипептиды могут быть приготовлены способом in vitro, используя обычные методы, известные в уровне техники, получены рекомбинантными методами или могут быть выделены из клеток принужденных или производящих протеин по своей природе. Конкретная последовательность и способ получения определяются благоприятной возможностью, экономическими выгодами, требуемой чистотой и тому подобное. Если желательно, различные группы могут быть введены в полипептид во время синтеза или экспрессии, что допустимо для связывания к другим молекулам или к поверхности. Причем цистеины могут быть использованы для получения тиоэфиров, гистидины для связывания металл-ионных комплексов, карбоксильные группы для формирования амидов или эфиров, аминогруппы для формирования амидов и тому подобное. Агонисты рецепторов интерферона II типа Агонисты рецепторов интерферона II типа включают любой природного происхождения или не природного происхождения лиганд человеческого рецептора интерферона II типа, который связывает и вызывает сигнальную трансдукцию через рецептор. Агонисты рецепторов интерферона II типа включают интерфероны, представляющие собой интерфероны природного происхождения, модифицированные интерфероны, синтетические интерфероны, интерфероны, конъюгированные с ПЭГ, гибридные протеины, включающие интерферон и какой-нибудь гетерологичный протеин, смешанные интерфероны; антитела, специфичные к рецепторам интерферона, непептидные химические агонисты, и тому подобное. Специфический пример агонистов рецепторов интерферона II типа представляет собой ИФН- и его варианты. Поскольку представленное изобретение иллюстрирует использование ИФН- полипептида,легко понять, что любой агонист рецепторов интерферона II типа может быть использован в описанном методе. Интерферон-гамма. Последовательности нуклеиновых кислот, кодирующих ИФН-, могут быть доступны из общественных баз данных, например Genbank, журнальных публикаций и так далее. Поскольку различные полипептиды млекопитающих ИФН- представляют интерес для лечения заболеваний человека, обычно человеческий протеин будет использоваться. Последовательность, кодирующая ИФН- человека, может быть обнаружена в Genbank, номера по каталогу X13274; V00543; и NM000619. Соответствующие геномные последовательности могут быть обнаружены в Genbank, номера по каталогу J00219; М 37265; иJ.B.С 259: 6790. ИФН-lb (Actimmune; человеческий интерферон) представляет собой одноцепочечный полипептид из 140 аминокислот. Его получают рекомбинантным способом в E. coli и снимают гликозильные группы. Rinderknecht и др. (1984) J. Biol. Chem. 259: 6790-6797. Рекомбинантный ИФН-, как обсуждается в патенте США 6,497,871, также подходит для использования здесь. ИФН- для использования в способах по изобретению может быть любым из природных ИФН-,рекомбинантных ИФН- и их производных, обладающих активностью ИФН-, а именно активностью человеческого ИФН-. Человеческий ИФН- проявляет антивирусные и антипролиферативные свойства интерферонов, также различные другие иммуномодуляторные активности, как известно в уровне техники. Хотя ИФН- определяется последовательностями, как представлено выше, получение протеина и протеолитическая обработка может привести в результате к его технологическим вариантам. Необработанная последовательность, представленная Gray и др., выше, состоит из 166 аминокислот (аа). Хотя рекомбинантный ИФН-, производимый в E. coli первоначально содержал 146 аминокислот, (начинающийся с 20 аминокислоты) было последовательно обнаружено, что природный человеческий ИФН- расщепляется после остатка 23, с получением 143 аа протеина, или 144 аа, если терминальный метионин присутствует, как необходимо для экспрессии у бактерий. Во время очистки зрелый протеин может быть дополнительно расщеплен на С-окончании после остатка 162 (ссылаясь на последовательность Gray и др.), с получением протеина из 139 аминокислот или 140 аминокислот, если исходный метионин присут- 28011857 ствует, например, если потребуется для бактериальной экспрессии. N-терминальный метионин представляет собой артефакт, кодированный мРНК трансляционным стартовым сигналом AUG, который в конкретном случае экспрессии E.coli не обрабатывается. В других микробиологических системах или эукариотических системах экспрессии метионин может быть удален. В способах по изобретению любой из природных пептидов ИФН-, его вариантов и модификаций или комбинации одного или более пептидов может быть использована. ИФН- пептиды, представляющие интерес, включают фрагменты и могут быть различным образом транкированы на карбоксильном окончании по отношению к полной последовательности. Такие фрагменты продолжают проявлять характерные свойства человеческого гамма-интерферона, такие длинные, что аминокислоты от 24 до приблизительно 149 (нумерация остатков необработанного полипептида) присутствуют. Внешние последовательности могут быть заменены аминокислотной последовательностью вслед за аминокислотой 155 без потери активности. См., например, патент США 5690 925. Природные ИФН- фрагменты включают молекулы, различным образом продлевающие от аминокислотных остатков 24-150; 24-151, 24-152; 24153, 24-155; и 24-157. Любой из этих вариантов и другие варианты, известные в уровне техники и обладающие ИФН- активностью, могут быть использованы в представленных способах. Аминокислотная последовательность ИФН- полипептида может быть изменена различными способами, известными в уровне техники, для создания целевых изменений в последовательности. Разновидность полипептида будет обычно в значительной степени подобна последовательностям, представленным здесь, то есть будет отличаться по меньшей мере на одну аминокислоту и может отличаться по меньшей мере на две, но не более чем на десять аминокислот. Изменения последовательности могут представлять собой замены, вставки, исключения. Сканирующие мутации, которые обычно вводят аланин или другие остатки, могут быть использованы для определения ключевых аминокислот. Специфические аминокислотные заместители, представляющие интерес, включают консервативные и не консервативные изменения. Консервативные аминокислотные заместители обычно включают заместители в следующих группах: (глицин, аланин); (валин, изолейцин, лейцин); (аспартамовая кислота, глутаминовая кислота); (аспарагин, глутамин); (серин, треонин); (лизин, аргинин); или (фенилаланин, тирозин). Представляющие интерес модификации, которые могут или не могут изменять первичную аминокислотную последовательность, включают химическую трансформацию полипептидов, например ацетилирование или карбоксилирование; изменения в аминокислотной последовательности, которые вводят или исключают участки гликозилирования; изменения аминокислотной последовательности, которые делают протеин восприимчивей к ПЭГилированию и тому подобное. В одном варианте осуществления изобретения изобретение рассматривает использование вариантов ИФН- с одним или более участков гликозилирования и/или ПЭГилирования неприродного происхождения, которые разработаны для обеспечения гликозил- и/или конъюгированных с ПЭГ трансформированных полипептидов со сниженным коэффициентом очистки сыворотки, такие как варианты ИФН- полипептидов, описанных в Международной патентной заявке WO 01/36001. Также включают модификации гликозилирования, например,выполненные модификацией образцов гликозилирования полипептида во время его синтеза и обработки или дальнейшие стадии обработки, например воздействие на полипептид энзимов, которые затрагивают гликозилирование, такие как ферменты гликозилирования млекопитающих или энзимы дегликозилирования. Также включают последовательности, которые имеют фосфорилированные аминокислотные остатки, например фосфотирозин, фосфосерин или фосфотреонин. В изобретение включены полипептиды, которые были модифицированы, используя обычные химические техники для улучшения их резистентности к протеолитической деструкции, оптимизацию свойств растворимости или выполнение их более подходящими в качестве терапевтических агентов. Например,основная цепь пептида может быть циклизована для улучшения стабильности (смотреть Friedler et al.(2000) J. Biol. Chem. 275: 23783-23789). Могут быть использованы аналоги, которые включают остатки,отличные от L-аминокислот природного происхождения, например D-аминокислот или синтетических аминокислот не природного происхождения. Протеин может быть конъюгирован с ПЭГ для улучшения стабильности. Полипептиды могут быть соединены с альбумином. Полипептиды могут быть приготовлены способом in vitro, используя обычные методы, известные в уровне техники, получены рекомбинантными методами или могут быть выделены из клеток принужденных или производящих протеин по своей природе. Конкретная последовательность и способ получения определяются благоприятной возможностью, экономическими выгодами, требуемой чистотой и тому подобное. Если желательно различные группы могут быть введены в полипептид во время синтеза или экспрессии, что допустимо для связывания к другим молекулам или к поверхности. Причем цистеины могут быть использованы для получения тиоэфиров, гистидины для связывания металл ионных комплексов, карбоксильные группы для формирования амидов или эфиров, аминогруппы для формирования амидов и тому подобное. Полипептиды могут быть также выделены и очищены в соответствии с обычными методами рекомбинантного синтеза. Лизат может быть приготовлен генной экспрессией и лизат очищают, используя ВЭЖХ, эксклюзионную хроматографию, электрофорез в геле, аффинную хроматографию или другие- 29011857 способы очистки. В большинстве своем композиции, которые используются, включают по меньшей мере около 20% по весу желаемого продукта, более обычно по меньшей мере 75% по весу, предпочтительно по меньшей мере 95% по весу и для терапевтических целей обычно по меньшей мере приблизительно 99.5% по весу, по отношению к загрязняющим веществам, относящимся к получению продукта и его очистки. Обычно проценты основываются на содержании общего протеина. Пирфенидон и его аналоги Пирфенидон (5-метил-1-фенил-2-(1 Н)-пиридон) и специфические аналоги пирфенидона описываются для лечения фибротических состояний. Фибротическое состояние это то, что подлежит лечению введением соединения, обладающего антифибротической активностью. ПирфенидонR1 может также включать заместители в карбоциклических и гетероциклических фрагментах с заместителями, такими как галоген, нитро, амино, гидроксил, алкокси, карбоксил, циано, тио, алкил, арил,гетроалкил, гетероарил и их комбинации, например 4-нитрофенил, 3-хлофенил, 2,5-динитрофенил, 4 метоксифенил, 5-метилпирролил, 2,5-дихлорциклогексил, гуанидинилциклогексинил и тому подобное.X - может быть любым количеством заместителей (от 1 до 3) в карбоциклическом или гетероциклическом кольце. Заместители могут быть одинаковые или различные. Заместители включают водород,алкил, гетероалкил, арил, гетероарил, галоген, нитро, карбоксил, гидроксил, циано, амино, тио, алкиламино, галоарил и тому подобное. Заместители могут быть необязательно, в свою очередь, замещены от 1-3 заместителей из группы,состоящей из алкила, арила, нитро, алкокси, гидроксила и галогена. Примеры включают метил, 2,3 диметилфенил, фенил, п-толил, 4-хлорфенил, 4-нитрофенил, 2,5-дихлорфенил, фурил, тиенил и тому подобное. Специфические примеры включают соединения, перечисленные в таблице.
МПК / Метки
МПК: A61K 38/00, C08H 1/00
Метки: макроциклические, ацилсульфонамиды, качестве, репликации, гепатита, ингибиторов, кислоты, вируса, карбоновые
Код ссылки
<a href="https://eas.patents.su/30-11857-makrociklicheskie-karbonovye-kisloty-i-acilsulfonamidy-v-kachestve-ingibitorov-replikacii-virusa-gepatita-s.html" rel="bookmark" title="База патентов Евразийского Союза">Макроциклические карбоновые кислоты и ацилсульфонамиды в качестве ингибиторов репликации вируса гепатита с</a>
Предыдущий патент: Способы получения масляных тел, содержащих активные ингредиенты
Следующий патент: Способ культивирования микроорганизмов рода thraustochytriales с использованием оптимизированной низкосолевой среды
Случайный патент: Производные арилоксифенила и арилсульфанилфенила