Производные арилоксифенила и арилсульфанилфенила
Номер патента: 7475
Опубликовано: 27.10.2006
Авторы: Смит Гаррик Пол, Греве Даниель, Миккельсен Гитте, Андерсен Ким, Руланд Томас, Рен Стефен П.
Формула / Реферат
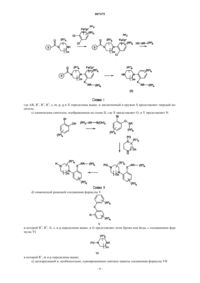
1. Соединение общей формулы I
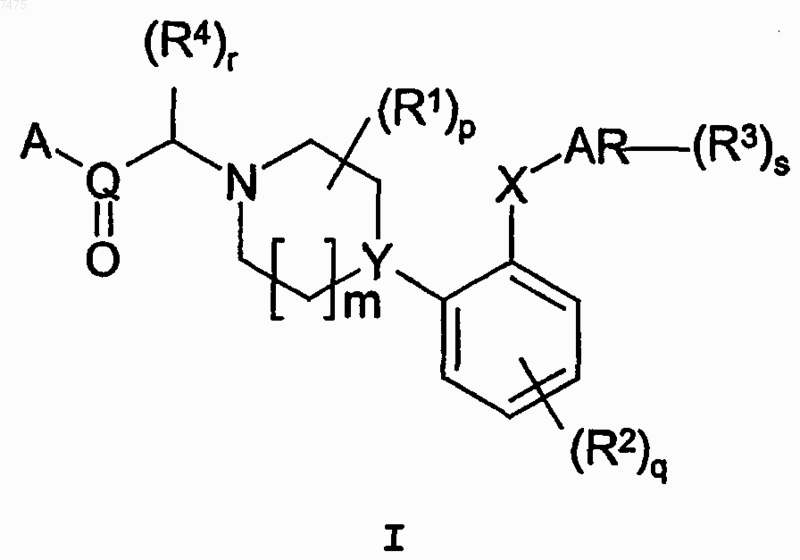
где Y представляет N;
X представляет О или S;
m равно 1;
р равно 0, 1, 2, 3 или 4;
q равно 0, 1 или 2;
s равно 0, 1, 2 или 3;
r равно 0, 1 или 2;
Q представляет С;
А представляет OR6, где R6 представляет водород;
AR представляет фенил;
каждый R4 отдельно представляет C1-6алкил, С3-8циклоалкил или С3-8циклоалкил-С1-6алкил;
каждый R1 независимо выбран из группы, состоящей из C1-6алкила, или два R1, присоединенные к одному и тому же атому углерода, могут образовывать 3-6-членный спироприсоединенный циклоалкил;
каждый R2 независимо выбран из группы, состоящей из галогена, циано, нитро, C1-6алк(ен/ин)ила, C1-6алк(ен/ин)илокси, C1-6алк(ен/ин)илсульфанила, гидрокси, гидрокси-С1-6алк(ен/ин)ила, галоген-С1-6алк (ен/ин)ила, галоген-С1-6алк(ен/ин)илокси, С3-8циклоалк(ен)ила, С3-8циклоалк(ен)ил-С1-6алк(ен/ин)ила, ацила, C1-6алк(ен/ин)илоксикарбонила, С1-6алк(ен/ин)илсульфонила или -NR9R10, где R9 и R10 независимо представляют водород, C1-6алк(ен/ин)ил, С3-8циклоалк(ен)ил, С3-8циклоалк(ен)ил-C1-6алк(ен/ин)ил или арил, или R9 и R10 вместе образуют 3-7-членное кольцо, которое необязательно содержит еще один гетероатом;
каждый R3, которым замещен AR, независимо выбран из группы, состоящей из галогена, циано, нитро, C1-6алк(ен/ин)ила, C1-6 алк(ен/ин)илокси, C1-6алк(ен/ин)илсульфанила, гидрокси, гидрокси-С1-6алк (ен/ин)ила, галоген-С1-6алк(ен/ин)ила, галоген-C1-6алк(ен/ин)илокси, С3-8циклоалк(ен)ила, С3-8циклоалк (ен)ил-С1-6алк(ен/ин)ила, C1-6алк(ен/ин)илсульфонила, арила, арил-C1-6алк(ен/ин)илокси, арил-С1-6алк (ен/ин)ила, C1-6алк(ен/ин)илоксикарбонила, ацила, -NHCO-C1-6алк(ен/ин)ила, -CONR11R12, где R11 и R12 независимо представляют водород, C1-6алк(ен/ин)ил, С3-8циклоалк(ен)ил, С3-8циклоалк(ен)ил-C1-6алк (ен/ин)ил или арил, или R11 и R12 вместе с азотом, к которому они присоединены, образуют 3-7-членное кольцо, которое необязательно содержит еще один гетероатом;
или NR13R14, где R13 и R14 независимо представляют водород, C1-6алк(ен/ин)ил, С3-8циклоалк(ен)ил, С3-8циклоалк(ен)ил-C1-6алк(ен/ин)ил или арил; или R13 и R14 вместе с азотом, к которому они присоединены, образуют 3-7-членное кольцо, которое необязательно содержит еще один гетероатом;
или два соседних заместителя R3 вместе образуют кольцо, конденсированное с кольцом AR, выбранное из группы, состоящей из
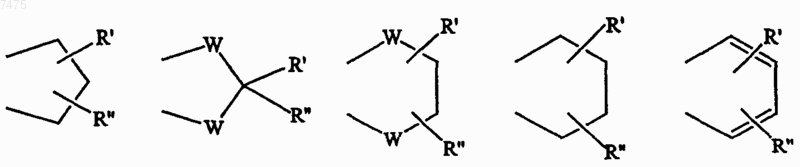
где W представляет О или S и R' и R" представляют водород или C1-6алкил;
или два соседних R3 заместителя вместе образуют конденсированную гетероароматическую систему, содержащую один или два гетероатома, конденсированных с AR,
или их кислотно-аддитивные соли.
2. Соединения по п.1, где X представляет S.
3. Соединение по любому из указанных выше пунктов, где р равно 1 или 2.
4. Соединение по любому из указанных выше пунктов, где q равно 0.
5. Соединение по любому из указанных выше пунктов, где r равно 0 или 1.
6. Соединение по любому из указанных выше пунктов, где s равно 1 или 2.
7. Соединение по пп.1-6, где AR представляет фенил, r и q оба равны 0, р равно 1 или 2, s равно 1 или 2, r равно 0 или 1, m равно 1, R1 представляет СН3, А представляет ОН, Q представляет С, Y представляет N и X представляет S.
8. Соединение по п.7, где R3 независимо выбран из галогена, C1-6алкокси или C1-6алкила.
9. Соединение по п.8, где R3 выбран из группы, состоящей из Cl, F, ОСН3, трет-бутила, 2-пропила или метила.
10. Соединение по любому из предыдущих пунктов, где R4 представляет СН3.
11. Соединение по п.1, где указанное соединение представляет собой
(+/-)-{4-[2-(4-метоксифенилсульфанил)фенил]транс-2,5-диметилпиперазин-1-ил}уксусную кислоту,
(+/-)-{4-[2-(4-хлорфенилсульфанил)фенил]транс-2,5-диметилпиперазин-1-ил}уксусную кислоту,
(+/-)-{4-[2-(4-трет-бутилфенилсульфанил)фенил]транс-2,5-диметилпиперазин-1-ил}уксусную кислоту,
(+/-)-{4-[2-(4-фторфенилсульфанил)фенил]транс-2,5-диметилпиперазин-1-ил}уксусную кислоту,
(+/-)-{4-[2-(4-трет-бутилфенилсульфанил)фенил]-2-метилпиперазин-1-ил}уксусную кислоту,
(+/-)-{4-[2-(4-изопропилфенилсульфанил)фенил]-2-метилпиперазин-1-ил}уксусную кислоту,
(+/-)-2-{4-[2-(4-трет-бутилфенилсульфанил)фенил]транс-2,5-диметилпиперазин-1-ил}уксусную кислоту,
{4-[5-хлор-2-(4-метоксифенилсульфанил)фенил]-2(R)-метилпиперазин-1-ил}уксусную кислоту,
{4-[2-(4-метоксифенилсульфанил)фенил]-2(R),5(S)-диметилпиперазин-1-ил}уксусную кислоту,
{4-[5-хлор-2-(4-метоксифенилсульфанил)фенил]-2,2-диметилпиперазин-1-ил}уксусную кислоту,
(+/-)-{4-[5-хлор-2-(4-трифторметилфенилсульфанил)фенил]-2-метилпиперазин-1-ил}уксусную кислоту,
{4-[5-хлор-2-(3-метоксифенилсульфанил)фенил]-2(R)-метилпиперазин-1-ил}уксусную кислоту,
(+/-)-{4-[2-(4-фенилфенилокси)фенил]-2-метилпиперазин-1-ил}уксусную кислоту,
(+/-)-{4-[2-(4-метилфенилсульфанил)фенил]транс-2,5-диметилпиперазин-1-ил}уксусную кислоту,
(+/-)-{4-[2-(4-изопропилфенисульфанил)фенил]транс-2,5-диметилпиперазин-1-ил}уксусную кислоту,
(+/-)-{4-[2-(2,4-диметилфенисульфанил)фенил]транс-2,5-диметилпиперазин-1-ил}уксусную кислоту,
(+/-)-2-{4-[2-(4-трет-бутилфенисульфанил)фенил]-3-метилпиперазин-1-ил}пропионовую кислоту,
{4-[2-(4-изопропилфенисульфанил)фенил]пиперазин-1-ил}уксусную кислоту,
(+/-)-2-{4-[2-(4-метоксифенисульфанил)фенил]-3-метилпиперазин-1-ил}пропионовую кислоту,
или их фармацевтически приемлемую кислотно-аддитивную соль.
12. Фармацевтическая композиция, включающая соединение по пп.1-11 или его фармацевтически приемлемую кислотно-аддитивную соль и по меньшей мере один фармацевтически приемлемый носитель или разбавитель.
13. Применение соединения по пп.1-11 или его фармацевтически приемлемой кислотно-аддитивной соли для изготовления лекарственного препарата для лечения заболеваний, выбранных из группы, состоящей из шизофрении, включая как позитивные, так и негативные симптомы шизофрении, и других психозов, и при улучшении познавательной функции при состояниях, при которых познавательные процессы уменьшены, т.е. болезни Альцгеймера, деменции вследствие множественных инфарктов, деменции при СПИД, болезни Хантингтона, болезни Паркинсона, бокового амиотрофического склероза или заболеваний, при которых мозг поврежден внутренними или внешним влияниями, таким как травма головы или инсульт, и судорожных расстройств, таких как эпилепсия, мышечная спастичность или миоклонус.
14. Способ лечения заболевания, выбранного из группы, состоящей из шизофрении, включая как позитивные, так и негативные симптомы шизофрении, и при улучшении познавательной функции при состояниях, при которых познавательные процессы уменьшены, т.е. болезни Альцгеймера, деменции вследствие множественных инфарктов, деменции при СПИД, и судорожных расстройств, таких как эпилепсия, мышечная спастичность или миоклонус в живом организме животного, в том числе человека, включающий введение терапевтически эффективного количества соединения по пп.1-11 или его фармацевтически приемлемой кислотно-аддитивной соли.
Текст
007475 Настоящее изобретение относится к новым соединениям, которые представляют собой ингибиторы транспортера глицина и, по существу, эффективны при лечении расстройств в ЦНС. Предпосылки изобретения Глутаминовая кислота представляет собой основную возбудительную аминокислоту в центральной нервной системе млекопитающих (ЦНС) и действует через два класса рецепторов, соответственно ионотропные и метаботропные рецепторы. Ионотропные глутаматные рецепторы делятся на 3 подтипа на основании сродства агонистов к указанным рецепторам, а именно, на рецепторы N-метил-D-аспартата (NMDA), (R,S)-2-амино-3-(3 гидрокси-5-метилизоксазол-4-ил)пропановой кислоты (АМРА) и каиновой кислоты (или каината). Рецептор NMDA содержит участки связывания для модуляторных соединений, таких как глицин и полиамины. Связывание глицина с его рецептором усиливает активацию рецептора NMDA. Такая активация рецептора NMDA может быть потенциальной мишенью для лечения шизофрении и других заболеваний, связанных с дисфункцией рецептора NMDA. Активации можно достичь ингибитором транспортера глицина. Молекулярное клонирование выявило существование двух типов транспортеров глицина, GlyT-1 иGlyT-2, причем GlyT-1 можно далее подразделить на GlyT-1a, GlyT-1b и GlyT-1c. Рецептор NMDA блокируется соединениями, такими как фенциклидин, которые индуцируют психотическое состояние, напоминающее шизофрению. Аналогичным образом, антагонисты NMDA, такие как кетамин, вызывают негативные и когнитивные симптомы, аналогичные шизофрении. Это указывает на то, что дисфункция рецептора NMDA вовлечена в патофизиологию шизофрении. Рецептор NMDA связан с рядом заболеваний, таких как боль (Yaksh Pain 1989, 37, 111-123), мышечная спастичность, миоклонус и эпилепсия (Truong et al. Movement Disorders 1988, 3, 77-87), нарушение способности к обучению и памяти (Rison et al. Neurosci. Biobehav. Rev. 1995, 19, 533-552). Считают, что антагонисты или ингибиторы транспортера глицина очень полезны при лечении шизофрении (Javitt WO 97/20533). Антагонисты или ингибиторы транспорта глицина можно применять для лечения как позитивных,так и негативных симптомов шизофрении и других психозов и при улучшении познавательной функции при состояниях, при которых познавательные процессы уменьшены, т.е. болезнь Альцгеймера, деменция вследствие множественных инфарктов, деменция при СПИД, болезнь Хантингтона, болезнь Паркинсона,боковой амиотрофический склероз или заболевания, при которых мозг поврежден внутренним или внешним влиянием, таким как травма головы или инсульт. Аналогичным образом, антагонисты транспортера глицина могут оказать благоприятное воздействие на судорожные расстройства, такие как эпилепсия, мышечная спастичность или миоклонус. Имеются сообщения о клинических испытаниях глицина, Javitt et al. Am. J.Psychiatry 1994, 151,1234-1236 and Leiderman et al. Biol. Psychiatry 1996, 39, 213-215. Сообщают, что лечение высокими дозами глицина облегчают симптомы шизофрении. Существует необходимость в более эффективных соединениях для лечения заболеваний, связанных с NMDA. Настоящее изобретение предоставляют соединения, которые представляют собой мощные ингибиторы транспортера глицина и, следовательно, их можно применять при лечении заболеваний, связанных с дисфункцией NMDA. Сущность изобретения Настоящее изобретение предоставляет соединения общей формулы IQ представляет С, P-OR5 или S=O, в которой R5 представляет водород или С 1-6 алкил; А представляет OR6, где R6 представляет водород, С 1-6 алкил, арил или арил-С 1-6 алкил, где арил может быть замещен галогеном, CF3, OCF3, CN, NO2 или С 1-6 алкилом;AR представляет фенил или гетероарил; каждый R4 отдельно представляет C1-6 алкил, С 3-8 циклоалкил или С 3-8 циклоалкил-С 1-6 алкил;-1 007475 пунктирная линия представляет необязательную связь; каждый R1, которые могут быть одинаковыми или различными, независимо выбран из группы, состоящей из С 1-6 алкила, или два R1, соединенные с одним и тем же атомом углерода, могут образовывать 3-6-членный спироприсоединенный циклоалкил; каждый R2, которые могут быть одинаковыми или различными, независимо выбран из группы, состоящей из галогена, циано, нитро, C1-6 алк(ен/ин)ила, C1-6 алк(ен/ин)илокси, C1-6 алк(ен/ин)илсульфанила,гидрокси,гидрокси-С 1-6 алк(ен/ин)ила,галоген-С 1-6 алк(ен/ин)ила,галоген-С 1-6 алк(ен/ин)илокси,С 3-8 циклоалк(ен)ила, С 3-8 циклоалк(ен)ил-С 1-6 алк(ен/ин)ила, ацила, C1-6 алк(ен/ин)илоксикарбонила,C1-6 алк(ен/ин)илсульфонила или -NR9R10, где R9 и R10 независимо представляют галоген, C1-6 алк(ен/ин) ил, С 3-8 циклоалк(ен)ил, С 3-8 циклоалк(ен)ил-C1-6 алк(ен/ин)ил или арил или R9 и R10 вместе образуют 3-7 членное кольцо, которое необязательно содержит еще один гетероатом; каждый R3, которым замещен AR, могут быть одинаковыми или различными, независимо выбирают из группы, состоящей из галогена, циано, нитро, С 1-6 алк(ен/ин)ила, C1-6 алк(ен/ин)илокси, C1-6 алк(ен/ин) илсульфанила, гидрокси, гидрокси-С 1-6 алк(ен/ин)ила, галоген-С 1-6 алк(ен/ин)ила, галоген-С 1-6 алк(ен/ин) илокси, С 3-8 циклоалк(ен)ила, С 3-8 циклоалк(ен)ил-С 1-6 алк(ен/ин)ила, C1-6 алк(ен/ин)илсульфонила, арила,арил-С 1-6 алк(ен/ин)илокси, арил-С 1-6 алк(ен/ин)ила, С 1-6 алк(ен/ин)илоксикарбонила, ацила, -NHCO-C1-6 алк(ен)ил, С 3-8 циклоалк(ен)ил-С 1-6 алк(ен/ин)ил или арил или R11 и R12 вместе с азотом, к которому они присоединены, образуют 3-7-членное кольцо, которое необязательно содержит еще один гетероатом; или NR13R14, где R13 и R14 независимо представляют водород, C1-6 алк(ен/ин)ил, С 3-8 циклоалк(ен)ил,С 3-8 циклоалк(ен)ил-C1-6 алк(ен/ин)ил или арил; или R13 и R14 вместе с азотом, к которому они присоединены, образуют 3-7-членное кольцо, которое необязательно содержит еще один гетероатом; или два соседних R3 заместителя вместе образуют кольцо, конденсированное с кольцом AR, выбранное из группы, состоящей из где W представляет О или S, a R' и R" представляют водород или C1-6 алкил; или два соседних R3 заместителя вместе образуют гетероарил, содержащий один или два гетероатома, конденсированных с AR,или их кислотно-аддитивные соли. В случае, когда р, q, r или s равны 0, заместителями являются атомы водорода. Если Y представляет С, присутствует пунктирная линия. Пунктирная линия не присутствует, еслиY представляет N или СН. Изобретение предоставляет указанное выше соединение формулы I для применения в качестве лекарственного препарата. Изобретение предоставляет фармацевтическую композицию, включающую указанное выше соединение формулы I или его фармацевтически приемлемую кислотно-аддитивную соль и по меньшей мере один фармацевтически приемлемый носитель или разбавитель. Изобретение предоставляет применение указанного выше соединения формулы I или его фармацевтически приемлемой кислотно-аддитивной соли для изготовления лекарственного препарата для лечения заболеваний, выбранных из группы, состоящей из шизофрении, включая как позитивные, так и негативные симптомы шизофрении и других психозов, и при улучшении познавательной функции при состояниях, при которых познавательные процессы уменьшены, т.е. болезни Альцгеймера, деменции вследствие множественных инфарктов, деменции при СПИД, болезни Хантингтона, болезни Паркинсона, бокового амиотрофического склероза или заболеваний, при которых мозг поврежден внутренними или внешним влиянием, таким как травма головы или инсульт, и судорожных расстройств, таких как эпилепсия,мышечная спастичность или миоклонус. Изобретение предоставляет способ лечения заболеваний, выбранных из группы, состоящей из шизофрении, включая как позитивные, так и негативные симптомы шизофрении и других психозов, и при улучшении познавательной функции при состояниях, при которых познавательные процессы уменьшены, т.е. болезни Альцгеймера, деменции вследствие множественных инфарктов, деменции при СПИД,болезни Хантингтона, болезни Паркинсона, бокового амиотрофического склероза или заболеваний, при которых мозг поврежден внутренним или внешним влиянием, таким как травма головы или инсульт, и судорожных расстройств, таких как эпилепсия, мышечная спастичность или миоклонус в живом организме животного, в том числе человека, включающий введение терапевтически эффективного количества указанного выше соединения формулы I или его фармацевтически приемлемой кислотно-аддитивной соли.-2 007475 Подробное описание изобретения Предпочтительным вариантом реализации изобретения является соединение, где Y представляет N. Предпочтительным вариантом реализации изобретения является соединение, где X представляет S. Предпочтительным вариантом реализации изобретения является соединение, где Q представляет С. Предпочтительным вариантом реализации изобретения является соединение, где А представляет ОН. Предпочтительным вариантом реализации изобретения является соединение, где р равно 1 или 2. Предпочтительным вариантом реализации изобретения является соединение, где m равно 1. Предпочтительным вариантом реализации изобретения является соединение, где q равно 0. Предпочтительным вариантом реализации изобретения является соединение, где r равно 0 или 1. Предпочтительным вариантом реализации изобретения является соединение, где s равно 1 или 2. Предпочтительным вариантом реализации изобретения является соединение, где AR представляет фенил, тиофен, пиридил, пиримидил, тиазолил, имидазолил или бензотизолил. Предпочтительным вариантом реализации, указанным выше, является соединение, где R4 представляет СН 3. Предпочтительным вариантом реализации изобретения является соединение, где AR представляет фенил, и r и q равны 0, р равно 1 или 2, s равно 1 или 2, r равно 0 или 1, m равно 1, R1 представляет СН 3,А представляет ОН, Q представляет С, Y представляет N и X представляет S. Еще более предпочтительным вариантом реализации, указанным выше, является соединение, где R3 независимо выбран из галогена, C1-6 алкокси или C1-6 алкила. Еще более предпочтительным вариантом реализации, указанным выше, является соединение, где R3 независимо выбран из группы, состоящей из Cl, F, ОСН 3, трет-бутила, 2-пропила или метила. Особенно предпочтительными вариантами реализации изобретения являются соединения изобретения, представляющие собой одно из следующих соединений:(+/-)-4-[2-(4-метоксифенилсульфанил)фенил]транс-2,5-диметилпиперазин-1-илуксусную кислоту,(+/-)-4-[2-(4-хлорфенилсульфанил)фенил]транс-2,5-диметилпиперазин-1-илуксусную кислоту,(+/-)-4-[2-(4-трет-бутилфенилсульфанил)фенил]транс-2,5-диметилпиперазин-1-илуксусную кислоту,(+/-)-4-[2-(4-фторфенилсульфанил)фенил]транс-2,5-диметилпиперазин-1-илуксусную кислоту,(+/-)-4-[2-(4-трет-бутилфенилсульфанил)фенил]-2-метилпиперазин-1-илуксусную кислоту,(+/-)-4-[2-(4-изопропилфенилсульфанил)фенил]-2-метилпиперазин-1-илуксусную кислоту,(+/-)-2-4-[2-(4-трет-бутилфенилсульфанил)фенил]транс-2,5-диметилпиперазин-1-илуксусную кислоту,4-[5-хлор-2-(4-метоксифенилсульфанил)фенил]-2(R)-метилпиперазин-1-илуксусную кислоту,4-[2-(4-метоксифенилсульфанил)фенил]-2(R),5(S)-диметилпиперазин-1-илуксусную кислоту,4-[5-хлор-2-(4-метоксифенилсульфанил)фенил]-2,2-диметилпиперазин-1-илуксусную кислоту,(+/-)-4-[5-хлор-2-(4-трифторметилфенилсульфанил)фенил]-2-метилпиперазин-1-илуксусную кислоту,4-[5-хлор-2-(3-метоксифенилсульфанил)фенил]-2(R)-метилпиперазин-1-илуксусную кислоту,(+/-)-4-[2-(4-фенилфенилокси)фенил]-2-метилпиперазин-1-илуксусную кислоту,(+/-)-4-[2-(4-метилфенилсульфанил)фенил]транс-2,5-диметилпиперазин-1-илуксусную кислоту,(+/-)-4-[2-(4-изопропилфенисульфанил)фенил]транс-2,5-диметилпиперазин-1-илуксусную кислоту,(+/-)-4-[2-(2,4-диметилфенилсульфанил)фенил]транс-2,5-диметилпиперазин-1-илуксусную кислоту,(+/-)-2-4-[2-(4-трет-бутилфенисульфанил)фенил]-3-метилпиперазин-1-илпропионовую кислоту,4-[2-(4-изопропилфенисульфанил)фенил]пиперазин-1-илуксусную кислоту,(+/-)-2-4-[2-(4-метоксифенисульфанил)фенил]-3-метилпиперазин-1-илпропионовую кислоту,или их фармацевтически приемлемую кислотно-аддитивную соль. Определение заместителей Галоген означает фтор, хлор, бром или йод. Выражение С 1-6 алк(ен/ин)ил означает С 1-6 алкильную, С 2-6 алкенильную или С 2-6 алкинильную группу. Выражение "С 3-8 циклоалк(ен)ил" означает С 3-8 циклоалкильную или циклоалкенильную группу. Термин C1-6 алкил относится к разветвленной и неразветвленной алкильной группе, имеющей от 1 до 6 атомов углерода включительно, включая, но не ограничиваясь ими, метил, этил, 1-пропил, 2-пропил,1-бутил, 2-бутил, 2-метил-2-пропил и 2-метил-1-пропил. Аналогичным образом, С 2-6 алкенил или С 2-6 алкинил соответственно означают такие же группы,имеющие от 2 до 6 атомов углерода, содержащие соответственно одну двойную связь или одну тройную связь, включая, но не ограничиваясь ими, этинил, пропенил, бутенил, этинил, пропинил и бутинил. Термин С 3-8 циклоалкил означает моноциклический или бициклический карбоцикл, имеющий от трех до восьми атомов С, включая, но не ограничиваясь ими, циклопропил, циклопентил, циклогексил и т.д. Термин С 3-8 циклоалкенил означает моноциклический или бициклический карбоцикл, имеющий от трех до восьми атомов С, и включающий одну двойную связь.-3 007475 Термины С 3-8 циклоалк(ен)ил-С 1-6 алк(ен/ин)ил, С 3-8 циклоалк(ен)ил и C1-6 алк(ен/ин)ил определены выше. Термины C1-6 алк(ен/ин)илокси, C1-6 алк(ен/ин)илсульфанил, гидрокси-С 1-6 алк(ен/ин)ил, галоген-С 1-6 алк(ен/ин)ил, галоген-C1-6 алк(ен/ин)илокси, C1-6 алк(ен/ин)илсульфонил и т.д. обозначают такие группы, где C1-6 алк(ен/ин)ил определен выше. Используемый в данном описании термин C1-6 алк(ен/ин)илоксикарбонил относится к группам формулы C1-6 алк(ен/ин)ил-O-СО-, в которой C1-6 алк(ен/ин)ильные группы определены выше. Используемый термин ацил относится к формильной, C1-6 алк(ен/ин)илкарбонильной, арилкарбонильной, арил-C1-6 алк(ен/ин)илкарбонильной, С 3-8 циклоалк(ен)илкарбонильной или С 3-8 циклоалк(ен)илС 1-6 алк(ен/ин)илкарбонильной группе. Используемый термин 3-7-членное кольцо, необязательно содержащее еще один гетероатом, относится к кольцевым системам, таким как 1-мофолинил, 1-пиперидинил, 1-азепинил, 1-пиперазинил, 1 гомопиперазинил, 1-имидазолил, 1-пирролил или 1-пиразолил, все из которых могут быть далее замещены C1-6 алкилом. Термин гетероарил может представлять собой 5-членные моноциклические кольца, такие как 3 Н 1,2,3-оксатиазол, 1,3,2-оксатиазол, 1,3,2-диоксазол, 3 Н-1,2,3-дитиазол, 1,3,2-дитиазол, 1,2,3-оксадиазол,1,2,3-тидиазол, 1 Н-1,2,3-тиазол, изоксазол, оксазол, изотиазол, тиазол, 1 Н-имидазол, 1 Н-пиразол, 1 Нпиррол, фуран или тиофен, и 6-членные моноциклические кольца, такие как 1,2,3-оксатиазин, 1,2,4 оксатиазин, 1,2,5-оксатиазин, 1,4,2-оксатиазин, 1,4,3-оксатиазин, 1,2,3-диоксазин, 1,2,4-диоксазин, 4 Н 1,3,2-диоксазин, 1,4,2-диоксазин, 2 Н-1,5,2-диоксазин, 1,2,3-дитиазин, 1,2,4-дитиазин 4H-1,3,2-дитиазин,1,4,2-дитиазин, 2 Н-1,5,2-дитиазин, 2 Н-1,2,3-оксадиазин, 2 Н-1,2,4-оксадиазин, 2 Н-1,2,5-оксадиазин, 2 Н 1,2,6-оксадиазин, 2 Н-1,3,4-оксадиазин, 2 Н-1,2,3-тиадиазин, 2 Н-1,2,4-тиадизин, 2 Н-1,2,5-тиадизин, 2 Н 1,2,6-тиадизин, 2 Н-1,3,4-тиадизин, 1,2,3-триазин, 1, 2, 4-триазин, 2 Н-1,2-оксазин, 2 Н-1,3-оксазин, 2 Н-1,4 оксазин, 2 Н-1,2-тиазин, 2 Н-1,3-тиазин, 2 Н-1,4-тиазин, пиразин, пиридазин, пиримидин, 4 Н-1,3-оксатиин,1,4-оксатиин, 4 Н-1,3-диоксин, 1,4-диоксин, 4 Н-1,3-дитиин, 1,4-дитиин, пиридин, 2 Н-пиран или 2 Н-тиин. Термин арил относится к карбоциклическим, ароматическим системам, таким как фенил и нафтил. Кислотно-аддитивные соли изобретения представляют собой предпочтительно фармацевтически приемлемые соли соединений изобретения, образованные с нетоксичными кислотами. Примерами таких органических солей являются соли малеиновой, фумаровой, бензойной, аскорбиновой, янтарной, щавелевой, бис-метиленсалициловой, метансульфоновой, этандисульфоновой, уксусной, пропионовой, винной, салициловой, лимонной, глюконовой, молочной, яблочной, миндальной, коричной, цитраконовой,аспарагиновой, стеариновой, пальмитиновой, итаконовой, гликолевой, парааминобензойной, глутаминовой, бензолсульфоновой и теофиллинуксусной кислот, а также соли 8-галогентеофиллинов, например 8 бромтеофиллина. Примерами таких неорганических солей являются соли хлористо-водородной, бромисто-водородной, серной, сульфаминовой, фосфорной и азотной кислот. Кроме того, соединения данного изобретения могут существовать в несольватированной, а также в сольватированной формах с фармацевтически приемлемыми растворителями, такими как вода, этанол и подобные растворители. В целом, в целях настоящего изобретения сольватированные формы считают эквивалентными несольватированным формам. Некоторые из соединений настоящего изобретения содержат хиральные центры, и такие соединения существуют в форме изомеров (т.е. энантиомеров или диастереомеров). Изобретение включает все такие изомеры и любые их смеси, включая рацемические смеси. Рацемические формы можно разделить на оптические антиподы известными способами, например,выделяя их диастереомерные соли с оптически активной кислотой, и высвобождая оптически активное аминосоединение обработкой основанием. Другой способ преобразования рацематов в оптические антиподы основан на хроматографии на оптически активной матрице. Рацемические соединения настоящего изобретения можно также преобразовать в их оптические антиподы, например, фракционной кристаллизацией d-или l-(тартраты, манделаты или камфорсульфонаты)солей. Соединения настоящего изобретения можно также разделить преобразованием в дистереомерные производные. Для разделения оптических изомеров можно использовать дополнительные способы преобразования оптических изомеров, известные специалистам в данной области. Такие способы включают способы,обсужденные J.Jaques, A.Collet and S.Wilen in "Enantiomers, Racemates, and Resolutions", John Wiley andSons, New York (1981). Оптически активные соединения можно также получить из оптически активных исходных веществ. Фармацевтические композиции Фармацевтические композиции изобретения можно изготовить обычными способами, принятыми в данной области. Например, таблетки можно изготовить смешиванием активного ингредиента с обычными адъювантами и/или разбавителями и последующим прессованием смеси в обычной таблетировочной машине. Примеры адъювантов или разбавителей включают кукурузный крахмал, картофельный крахмал,тальк, стеарат магния, желатин, лактозу, смолы и им подобные вещества. Можно использовать любые-4 007475 другие адъюванты или добавки, обычно используемые для таких целей, такие как красящие агенты,агенты, улучшающие вкус и запах, консерванты и т.д., при условии, что они совместимы с активными ингредиентами. Растворы для инъекций можно получить растворением активного ингредиента и возможных добавок в части растворителя для инъекций, предпочтительно стерильной воде, доведением раствора до желательного объема, стерилизацией раствора и заполнением им подходящих ампул или флаконов. Можно добавлять любые подходящие добавки, обычно используемые в данной области, такие как придающие тоничность агенты, консерванты, антиоксиданты и т.д. Фармацевтические композиции данного изобретения или композиции, которые изготовлены в соответствии с данным изобретением, можно вводить любым подходящим путем, например орально в виде таблеток, капсул, порошков, сиропов и т.д. или парентерально в форме растворов для инъекций. Для получения таких композиций можно использовать способы, известные в данной области, и можно использовать любые фармацевтически приемлемые носители, разбавители, эксципиенты или другие добавки,обычно используемые в данной области. Для удобства соединения изобретения вводят в дозированной лекарственной форме, содержащей указанные соединения в количестве приблизительно от 0,01 до 100 мг. Общая суточная доза обычно находится в диапазоне приблизительно 0,05-500 мг и наиболее предпочтительно приблизительно от 0,1 до 50 мг активного соединения изобретения. Соединения изобретения получают следующими общими способами. Алкилирование амина формулы II алкилирующим агентом формулы III где L представляет удобную уходящую группу, такую как галоген или тозилат. Заместители AR, R1-R4,Y, Q, X, A, m, p, q, r и s определены выше. Реакцию обычно проводят в подходящем растворителе, таком как этанол, N,N-диметилформамид или ацетонитрил, содержащем органическое основание, такое как карбонат калия или цезия, или органическое основание, такое как N-этилдиизопропиламин, при повышенной температуре 40-120 С. Соединения формулы I, где Q представляет углерод, и А представляетOR6, где R6 представляет водород, можно получить из соответствующих сложных эфиров COOR6, где R6 представляет нерастворимый полимер или C1-6 алкил, арил или арил-С 1-6 алкил. Превращение можно выполнять в основных условиях, например, с использованием водного гидроксида натрия в спиртовом растворителе, или в кислотных условиях, когда R6 представляет трет-бутильную группу или нерастворимый полимер. Соединения формулы II можно получить любой из следующих реакций:a) химическим превращением соединения формулы IV в которой R1, R2, m, p, q, X, Y и Z определены выше, в соответствующее соединение диазония и последующей реакцией с соединением HX-AR-(R3)s, где AR, X, R3 и s определены выше;b) химическим синтезом, изображенным на схеме I где AR, R1, R2, R3, s, m, р, q и X определены выше, и заключенный в кружок S представляет твердый носитель; с) химическим синтезом, изображенным на схеме II, где X представляет О, и Y представляет N.d) химической реакцией соединения формулы V в которой R2, R3, X, s, и q определены выше, и G представляет атом брома или йода, с соединением формулы VI в которой R1, m и p определены выше; е) дегидратацией и, необязательно, одновременным снятием защиты соединения формулы VII в которой R1, R2, R3, X, m, p, q и s определены выше, и R представляет или атом водорода, или группу ВОС;f) гидрированием двойной связи в соединении формулы VIIIg) дезоксигенированием и снятием защиты соединения формулы VII в которой R1, R2, R3, X, m, p, q и s определены выше, и R представляет или атом водорода, или группу ВОС. Диазотирование с последующей реакцией с соединением HS-Ar-(R3)s в соответствии со способом а) выполняют добавлением соли диазония соответствующего анилина к раствору натриевой соли тиофенола в воде, содержащей суспензию меди. Исходное вещество формулы IV получают, как указано ниже. Проводят реакцию производного фторнитробензола с производным пиперазина в растворителе, таком как ДМФА, NMP или другой диполярный апротонный растворитель, содержащий органическое основание, такое как триэтиламин, для получения производного ортонитрофенилпиперазина. Затем нитрогруппу восстанавливают с использованием стандартных методик, известных специалистам в данной области,для получения исходного вещества формулы IV. В качестве производных 2,5-диметилпиперазина получали N-бензил-2(R),5(S)-диметилпиперазин в соответствии с известными из литературы методиками (Aicher et al. J. Med. Chem. 2000, 43, 236-249). Nбензил-2(S),5(R)-диметилпиперазин получали в соответствии с патентной заявкой WO 00/71535. Последовательность реакций в способе b) осуществляют в соответствии со способами, описанными в патентной заявке WO 01/49681. Диамины или коммерчески доступны, или синтезируются способами,известными химикам, специалистам в данной области. Комплексные соединения железа, подобные гексафторфосфату 6-1,2-дихлорбензол-5-циклопентадиенилжелеза (II), и замещенные аналоги синтезируют в соответствии с методиками, известными из литературы (Pearson et al. J. Org. Chem. 1996, 61, 1297-1305), или синтезируют способами, известными химикам, специалистам в данной области. Исходное вещество в способе с) получают сочетанием ортобромфенола с подходящей арилбороновой кислотой или сложным боронатным эфиром по методике, известной из литературы (Evans et al., Tet.Lett, 1998, 39, 2947-2940). Полученный бромид простого биарилового эфира затем подвергают сочетанию, используя палладиевый катализатор, с защищенным пиперазином, где защитная группа обычно может представлять собой, но не исключительно, производное трет-бутилоксикарбонила (ВОС) или бензилоксикарбонил (CBZ), и защитную группу (PG) затем удаляют кислотным отщеплением, например, с использованием хлористого водорода в спиртовом растворителе для удаления группы ВОС или каталитического гидрогенолиза в случае CBZ, удаленного для получения промежуточных соединений формулыII, где X представляет О, и Y представляет N. Общие способы удаления подходящих защитных групп-7 007475 описаны в руководстве Protective Groups in Organic Synthesis T.W.Greene and P.G.M. Wuts, Wiley Interscience, (1991) ISBN 0471623016. Реакцию соединения формулы V с диамином формулы VI в способе d) проводили способом, аналогично описанному у Nishiyama et al. Tetrahedron Lett. 1998, 39, 617-620. Исходное вещество формулы VI получали способом, аналогично описанному у Schopfer et al. Tetrahedron 2001, 57, 3069-3073. Реакцию дегидратации и, необязательно, одновременное снятие защиты соединения формулы VII в способе е) проводили способом, аналогично описанному у Palmer et al. J. Med. Chem. 1997, 40, 1982-1989. Исходное вещество формулы VII получали из соединения формулы VII, в которой R представляет группу ВОС, снятием защиты хлористоводородной кислотой в метаноле. Соединения формулы VII можно получить, как описано у Palmer et al. J. Med. Chem. 1997, 40, 1982-1989. Восстановление двойной связи в соответствии со способом f) в целом проводят каталитическим гидрированием при низком давлении (3 атм.) в аппарате Парра или используя восстанавливающие агенты, такие как диборан или производные бороводорода, полученные in situ из NaBH4 в трифторуксусной кислоте в инертных растворителях, таких как тетрагидрофуран (ТГФ), диоксан или диэтиловый эфир. Дезоксигенирование промежуточных соединений третичных спиртов формулы VII в способе g), гдеR представляет ВОС, проводили модифицированным Бартоном способом восстановления, аналогично описанному у Hansen et al. Synthesis 1999, 1925-1930. Промежуточные третичные спирты получали из соответствующих подходящих замещенных 1-бром-фенилсульфанилбензолов или их соответствующих простых эфиров формулы IX способом, аналогично описанному у Palmer et al J. Med. Chem. 1997, 40,1982-1989. Соответствующим образом замещенные 1-бромфенилсульфанилбензолы были получены способом, аналогично описанному в литературе, реакцией подходящих замещенных тиофенолов с подходящими замещенными арилйодидами в соответствии с Schopfer and Schlapbach Tetrahedron 2001, 57 30693073 Bates et al., Org.Lett. 2002, 4, 2803-2806 and Kwong et al. Org.Lett. 2002, 4, (в печати). Соответствующие замещенные 1-бромфеноксибензолы можно получить, как описано у Buck et al. Org. Lett. 2002, 4,1623-1626. Удаление группы ВОС проводили стандартными способами, известными специалистам в данной области. Примеры Общие способы Данные анализа жидкостной хроматографией-масс-спектрометрией (ЖХ-МС) получали на приборе РЕ Sciex API 150EX, оборудованном источником IonSpray и устройством Shimadzu LC-8A/SLC-10A LC. Колонка: 304,6 мм Waters Symmetry с размером частиц 3,5 мкм; cистема растворителя: А=вода/трифторуксусная кислота (100:0,05) и В=вода/ацетонитрил/трифторуксусная кислота (5:95:0,03); метод: элюирование в линейном градиенте 90% А к 100% В за 4 мин и при объемном расходе 2 мл/мин. Чистоту определяли интегрированием УФ (254 нм) и следом ELSD. Величины времени удерживания(RT) выражены в минутах. Очистку препаративной ЖХ-МС проводили на том же приборе. Колонка: 5020 мм YМС ODS-A с размером частиц 5 мкм; метод: элюирование в линейном градиенте 80% А к 100% В за 7 мин и при скорости потока 22,7 мл/мин. Сбор фракции производили при МС детекции в расщепленном потоке. Спектры 1 Н ЯМР регистрировали при 500,13 мГц на приборе Bruker Avance DRX500 или при 250,13 мГц на приборе Bruker AC 250. В качестве растворителей использовали дейтерированные метиленхлорид(99,8% D), хлороформ (99,8% D) или диметилсульфоксид (99,8% D). TMS использовали в качестве внутреннего эталонного стандарта. Величины химического сдвига выражены в величинах м.д. Следующие аббревиатуры используются для множественности сигналов ЯМР: с=синглет, д=дублет, т=триплет,к=квартет, кв=квинтет, г=гептет, дд=двойной дублет, дт=двойной триплет, дк=двойной квартет,тт=триплет триплетов, м=мультиплет и ш=широкий синглет. Для ионообменной хроматографии использовали следующие материалы: SCX-колонки (1 г) от Varian Mega Bond Elut, каталожныйChrompack 220776. Перед использованием SCX-колонки предварительно кондиционировали 10% раствором уксусной кислоты в метаноле (3 мл). Для декомплексообразования облучением использовали источник ультрафиолетового света (300 Вт) от Philipps. В качестве исходных полимерных носителей для твердофазного синтеза использовали смолу Ванга (1,03 ммоль/г,Rapp-Polymere, Tuebingen, Germany). Получение промежуточных соединений формулы IV 2-(3-Метилпиперазин-1-ил)фениламин. 2-Фторнитробензол (7,1 г, 50 ммоль) растворяли в ДМФА (100 мл), содержащем триэтиламин (10 г,100 ммоль) и помещали в атмосферу азота. К реакционной смеси добавляли 2-метилпиперазин (5,0 г, 50 ммоль). Реакционную смесь нагревали до 80 С в течение 16 ч. Реакционной смеси давали возможность охладиться до комнатной температуры перед тем как количество растворителя уменьшали до половины-8 007475 объема в вакууме. Этилацетат (200 мл) и ледяную воду (250 мл) добавляли к раствору и продукт экстрагировали диэтиловым эфиром (2200 мл). Водную фазу насыщали хлоридом натрия и экстрагировали этилацетатом (2200 мл). Органические фазы объединяли, промывали насыщенным раствором соли, сушили над сульфатом магния, фильтровали и фильтрат концентрировали в вакууме. Продукт (10,5 г) растворяли в этаноле (250 мл). Палладий на катализаторе из активированного угля (10% мас./мас., 2 г) добавляли к раствору и раствор гидрировали в аппарате Парра при 3 бар в течение 3 ч. Раствор фильтровали и выпаривали, получая анилиновый продукт. Выход (8,0 г; 83%). Следующие промежуточные соединения получали аналогичным образом: 2-(3,5-диметилпиперазин-1-ил)фениламин,2-(3,3-диметилпиперазин-1-ил)фениламин,4-метокси-2-(3-метилпиперазин-1-ил)фениламин,2-(2(S),5(R)-диметилпиперазин-1-ил)фениламин. 2(R),5(S)-Диметил-1-N-бензилпиперазин (6,0 г, 2 9 ммоль) растворяли в диметилформамиде (100 мл) и триэтиламине (6,4 мл, 4 4 ммоль) и смесь помещали в атмосферу азота. К раствору добавляли 2 фторнитробензол (3,5 мл, 31 ммоль). Реакционную смесь нагревали при 100 С в течение 72 ч. Раствор выпаривали в вакууме и повторно растворяли в этилацетате (100 мл). Затем раствор промывали насыщенным раствором бикарбоната натрия (100 мл) и насыщенным раствором соли (100 мл). Выделенную органическую фазу сушили над сульфатом магния, фильтровали и фильтрат выпаривали в вакууме. Неочищенный продукт затем очищали флэш-хроматографией, элюируя смесью этилацетат/метанол/ триэтиламин 85:10:5. Продукт (8,2 г) растворяли в этаноле (250 мл). Катализатор палладия на активированном угле (10% мас./мас., 2,2 г) добавляли к раствору и раствор гидрировали в аппарате Парра при 3 бар в течение 3 ч. Раствор фильтровали и выпаривали, получая анилиновый продукт. Выход (5,2 г, 87%). Следующее промежуточное соединение получали аналогичным образом: 2-(2(R),5(S-диметилпиперазин-1-ил)фениламин,4-хлор-2-(3,3-диметилпиперазин-1-ил)фениламин. 2,2-Диметилпиперазин (9,55 г, 84 ммоль) растворяли в диметилформамиде (140 мл). К раствору добавляли триэтиламин (12,07 мл, 83,6 ммоль) и реакционную смесь помещали в атмосферу азота. Раствор нагревали до 80 С и добавляли 4-хлор-2-фторнитробензол (13,5 г, 76 ммоль) в виде раствора в диметилформамиде (35 мл). Реакционную смесь перемешивали при 40 С в течение 16 ч. Растворитель удаляли в вакууме и остаток растворяли в этаноле (250 мл). Добавляли хлорид аммония (28 г) и порошок цинка (17 г). Реакционную смесь кипятили с обратным холодильником при 80 С в течение 1 ч и затем перемешивали при 40 С в течение 72 ч. Затем реакционную смесь фильтровали и фильтрат выпаривали в вакууме. Затем твердое вещество промывали этилацетатом и затем небольшим количество метанола. Выход: 16,04 г, 88%. Следующие промежуточные соединения получали аналогичным образом: 4-хлор-2-(3-(R)-метилпиперазин-1-ил)фениламин,4-хлор-2-(3-(S)-метилпиперазин-1-ил)фениламин. Получение промежуточных соединений формулы II способом а). 1-[2-(4-Хлорфенилсульфанил)фенил]-3-метилпиперазин 2-(3-метилпиперазин-1-ил)фениламин (0,96 г, 5 ммоль) растворяли в воде (30 мл), содержащей концентрированную серную кислоту (0,28 мл, 5,2 ммоль), раствор охлаждали до 0 С и добавляли нитрит натрия (0,36 г, 5,2 ммоль). Реакционную смесь перемешивали в течение 30 мин перед тем как рН реакционной смеси доводили до рН 7 ацетатом натрия. Раствор соли диазония затем добавляли по каплям к раствору 4-хлортиофенола в 2 М NaOH (4 мл), содержащем суспензию меди (0,3 г, 5 ммоль). После добавления смесь нагревали до 60 С в течение 30 мин перед тем, как дать возможность охладиться до комнатной температуры, и добавляли этилацетат (10 мл). Смесь фильтровали и отделяли органический слой. Водный слой экстрагировали этилацетатом (210 мл). Объединенные органические экстракты сушили над сульфатом магния, фильтровали и выпаривали в вакууме. Неочищенный продукт очищали флэш-хроматографией с использованием силикагеля, элюируя смесью этилацетат/метанол/аммиак 96:3:1. Чистый продукт выделяли в виде бесцветного масла. Выход(0,18 г, 11%). 1 Н ЯМР (CDCl3, 500 мГц) 1,12 (д, 3 Н), 2,6-2,72 (шир.м, 2 Н), 3,0-3,15 (м, 5 Н), 6,9 (м, 2 Н), 7,08 (д, 1 Н),7,15 (м, 1 Н), 7,25-7,35 (м, 4 Н); МС (МН+) 319,1. Следующие промежуточные соединения получали аналогичным образом: 1-[2-(4-хлорфенилсульфанил)фенил]-3,5-диметилпиперазин,(+/-)-(4-[2-(4-метоксифенилсульфанил)фенил]транс-2,5-диметилпиперазин,(+/-)-4-[2-(4-хлорфенилсульфанил)фенил]транс-2,5-диметилпиперазин.(+/-)-4-[2-(4-трет-бутилфенилсульфанил)фенил]транс-2,5-диметилпиперазин,(+/-)-4-[2-(4-фторфенилсульфанил)фенил]транс-2,5-диметилпиперазин,(+/-)-4-[2-(4-трет-бутилфенилсульфанил)фенил]-2-метилпиперазин,(+/-)-4-[2-(4-изопропилфенилсульфанил)фенил]-2-метилпиперазин,4-[5-хлор-2-(4-метоксифенилсульфанил)фенил]-2(R)-метилпиперазин,-9 007475 4-[2-(4-метоксифенилсульфанил)фенил]-2(R),5(S)-диметилпиперазин. Получение промежуточных соединений II в соответствии со способом В,где А представляет нерастворимый полимер Получение комплексных соединений железа Гексафторфосфат 6-1,2-дихлорбензол-5-циклопентадиенилжелеза(II). Ферроцен (167 г), безводный трихлорид алюминия (238 г) и порошкообразный алюминий (24 г) суспендировали в 1,2-дихлорбензоле (500 мл) и нагревали до 90 С в атмосфере азота в течение 5 ч при интенсивном перемешивании. Смесь охлаждали до комнатной температуры и воду (1000 мл) добавляли осторожно небольшими порциями при одновременном охлаждении на ледяной бане. Добавляли диэтиловый эфир (500 мл), и смесь перемешивали при комнатной температуре в течение 30 мин. Смесь экстрагировали диэтиловым эфиром (3300 мл). Водную фазу фильтровали и водный гексафторфосфат аммония (60 г в 50 мл воды) добавляли небольшими порциями при перемешивании. Продукту давали возможность образовать осадок при комнатной температуре. Через 3 ч осадок отфильтровывали, интенсивно промывали водой и сушили в вакууме (50 С), получая 81 г (21%) указанного в заголовке соединения в виде светло-желтого порошка. 1 Н ЯМР (ДМСО-d6): 5,29 (с, 5 Н), 6,48 (м, 2 Н), 7,07 (м, 2 Н). Получение аминов, связанных с полистиролом 4-[(Пиперазин-1-ил)карбонилоксиметил]феноксиметилполистирол. 4-[(4-Нитрофенокси)карбонилоксиметил]феноксиметилполистирол (267 г, 235 ммоль) суспендировали в безводном N,N-диметилформамиде (2 л). Добавляли N-метилморфолин (238,0 г, 2,35 моль) и пиперазин (102,0 г, 1,17 моль) и смесь перемешивали при комнатной температуре в течение 16 ч. Смолу отфильтровывали и промывали N,N-диметилформамидом (21 л), тетрагидрофураном (21 л), водой(1500 мл), метанолом (21 л), тетрагидрофураном (21 л) и метанолом (11 л). Наконец, смолу промывали дихлорметаном (3500 мл) и сушили в вакууме (25 С, 36 ч), получая почти бесцветную смолу(240,0 г). Аналогичным образом получили следующие диамины, связанные с полистиролом: 4-[(2,5-диметилпиперазин-1-ил)карбонилоксиметил]феноксиметилполистирол,4-[(3-метилпиперазин-1-ил)карбонилоксиметил]феноксиметилполистирол. Получение связанных со смолой гексафторфосфатов 6-арил-5-циклопентадиенилжелеза(II) Гексафторфосфат 4-(4-[6-(2-хлорфенил)-5-циклопентадиенилжелезо(II)]пиперазин-1-илкарбонилоксиметил)феноксиметилполистирола. 4-(Пиперазин-1-ил)карбонилоксиметил)феноксиметилполистирол (115,1 г, 92 ммоль) суспендировали в безводном тетрагидрофуране (1,6 л) и добавляли гексафторфосфат 6-1,2-дихлорбензол-5 циклопентадиенилжелеза(II) (76,0 г, 184 ммоль) с последующим добавлением карбоната калия (50,9 г,368 ммоль). Реакционную смесь перемешивали при 60 С в течение 16 ч. После охлаждения до комнатной температуры смолу отфильтровывали и промывали тетрагидрофураном (2500 мл), водой (2250 мл),тетрагидрофураном (2500 мл), водой (2250 мл), метанолом (2250 мл), дихлорметаном (2250 мл) и метанолом (2250 мл). Наконец, смолу промывали дихлорметаном (3500 мл) и сушили в вакууме (25 С,36 ч), получая темно-оранжевую смолу (142 г). Аналогичным образом получали следующие комплексные соединения железа: гексафторфосфат 4-(4-[6- (2-хлорфенил)-5-циклопентадиенилжелезо(II)]-2,5-диметилпиперазин 1-илкарбонилоксиметил)феноксиметилполистирола,гексафторфосфат 4-(4-[6-(2-хлорфенил)-5-циклопентадиенилжелезо(II)]-3-метилпиперазин-1-ил карбонилоксиметил)феноксиметилполистирола. Получение орто(арилсульфанил)фенилпиперазинов(+/-)-1[2-(4-Метилфенилсульфанил)фенил]транс-2,5-диметилпиперазин. К раствору 4-метилтиофенола (1,4 г, 9,8 ммоль) в смеси 1:1 тетрагидрофуран/диметилформамид (5 мл) осторожно добавляли гидрид натрия (7,4 ммоль, 60% в минеральном масле) при комнатной температуре (предостережение: выделение водорода). Смесь перемешивали в течение еще 30 мин после прекращения выделения водорода. Затем добавляли гексафторфосфат 4-(4-[6-(2-хлорфенил)-5-циклопентадиенилжелезо(II)]транс-2,5-диметилпиперазин-1-илкарбонилоксиметил)феноксиметилполистирола (3,5 г, 2,45 ммоль) и смесь перемешивали при 55 С в течение 6 ч. После охлаждения до комнатной температуры смолу отфильтровывали и промывали тетрагидрофураном (250 мл), N,Nдиметилформамидом (250 мл), водой (250 мл), метанолом (350 мл), тетрагидрофураном (350 мл) и затем метанолом и тетрагидрофураном (каждого по 50 мл, 5 циклов). Наконец, смолу промывали дихлорметаном (350 мл) и сушили в вакууме (25 С, 12 ч), получая темно-оранжевую смолу. Полученную таким образом смолу и 0,5 М раствор 1,10-фенантролина в смеси 3:1 пиридин/вода (20 мл) помещали в проницаемую для света реакционную пробирку. Суспензию перемешивали вращением при облучении видимым светом в течение 12 ч. Смолу отфильтровывали и промывали метанолом (225 мл), водой (225 мл) и тетрагидрофураном (325 мл) до тех пор, пока промывные растворы становились бесцветными(приблизительно 5 циклов), и процедуру облучения повторяли до тех пор, пока полностью не завершалась декомплексообразование (приблизительно 5 циклов). После полного завершения декомплексообразования смолу промывали дихлорметаном (325 мл) и сушили в вакууме (25 С, 12 ч), получая светлокоричневую смолу. 3,7 г (24 ммоль) полученной таким образом смолы суспендировали в смеси 1:1 трифторуксусной кислоты и дихлорметана (2 мл) и перемешивали при комнатной температуре в течение 2,5 ч. Смолу отфильтровывали и промывали дихлорметаном (50,5 мл). После выпаривания из фильтрата летучих растворителей в вакууме получали оранжевое масло. Неочищенный продукт очищали препаративной ЖХ-МС и затем ионообменной хроматографией. ЖХ/МС (m/z) 313,2 (МН+); RT=2,17; чистота (УФ, ELSD): 87,1%, 98,7%; выход: 47,8 мг (6%). Следующие арилпиперазины получали аналогичным образом:(+/-)-1-[2-(4-изопропилфенилсульфанил)фенил]транс-2,5-диметилпиперазин,(+/-)-1-[2-(2,4-диметилфенилсульфанил)фенил]транс-2,5-диметилпиперазин,(+/-)-1-[2-(4-трет-бутилфенилсульфанил)фенил]транс-2,5-диметилпиперазин,(+/-)-1-[2-(4-метоксифенилсульфанил)фенил]-2-метилпиперазин,(+/-)-1-[2-(4-изопропилфенилсульфанил)фенил]пиперазин. Получение промежуточных соединений формулы III,где А представляет нерастворимый полимер 4-[Хлорацетоксиметил]феноксиметилполистирол. Смолу Ванга (10 г, 10,3 ммоль) суспендировали в дихлорметане (100 мл) и охлаждали до 0 С. Добавляли диизопропилэтиламин (9 мл, 52 ммоль). Медленно добавляли хлорацетилхлорид. Реакционную смесь перемешивали при 0 С в течение 30 мин и затем давали возможность нагреться до комнатной температуры. Реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Смолу отфильтровывали и промывали N,N-диметилформамидом (3100 мл), дихлорметаном (2100 мл), диметилформамидом (3100 мл) и дихлорметаноном (2100 мл) и сушили в вакууме (25 С, 16 ч). Следующую смолу получали аналогичным образом: 4-[2-хлорпропионилоксиметил]феноксиметилполистирол. Получение промежуточных соединений II способом с) 4-(2-Бромфенокси)бифенил. Смесь 2-бромфенола (2,08 г, 12 ммоль), 4-бифенилбороновой кислоты (4,75 г, 24 ммоль), Cu(OАс)2(2,20 г, 12 ммоль) и триэтиламина (6,1 г, 60 ммоль) и диоксана (100 мл) перемешивали в течение 48 ч. Неочищенную смесь выпаривали на силикагеле и очищали колоночной хроматографией, элюируя смесью этилацетат/гептан 1:9. Выход: 0,73 г (19%). 1 Н ЯМР (CDCl3, 500 мГц) 7,65 (м, 1 Н), 7,55 (м, 4 Н), 7,43 (м, 2 Н), 7,25-7,38 (м, 2 Н), 7,00-7,08 (м, 4 Н); МС (m/z) 325,1.(+/-)-1-[2-(Бифенил-4-илокси)фенил]-3-метилпиперазин. Смесь 4-(2-бромфенокси)бифенила (0,73 г, 2,25 ммоль), рац-2-метилпиперазина (0,285 г, 0,285 ммоль), Pd2dba3 (0,022 г, 1 мол.%), рац-бинафтила (0,043 г, 3 мол.%) и NaOBut (0,300 г, 3,12 ммоль) в безводном толуоле (15 мл) в атмосфере аргона и перемешивали при 90 С в течение ночи. После охлаждения до комнатной температуры смесь фильтровали и выпаривали на силикагеле и очищали колоночной хроматографией, элюируя смесью этилацетат/гептан 1:2. Выход: 0,264 г (34%). 1 Н ЯМР (CDCl3, 500 мГц) 7,55 (м, 2 Н), 7,49 (м, 2 Н), 7,38 (м, 2 Н), 7,27 (м, 1 Н), 7,10 (м, 1 Н), 6,90-7,00(м, 5 Н), 3,30-3,35 (м, 2 Н), 2,88 (м, 1 Н), 2,62-2,80 (м, 3 Н), 2,30-2,40 (м, 1 Н), 1,60-2,00 (ш, 1 Н), 0,99 (д, 3 Н); МС (m/z) 345,1. Получение соединений изобретения Пример 1. 1 а. Гидрохлорид (+/-)-4-[2-(4-метоксифенилсульфанил)фенил]транс-2,5-диметилпиперазин-1 илуксусной кислоты. 4-[2-(4-Метоксифенилсульфанил)фенил]транс-2,5-диметилпиперазин (0,5 г, 1,5 ммоль) и N-этилдиизопропиламид (0,315 мл, 1,8 ммоль) растворяли в ацетонитриле (10 мл) и помещали в атмосферу азота. Добавляли этилбромацетат (0,19 мл, 1,7 ммоль) и смесь перемешивали при окружающей температуре в течение 16 ч. К смеси затем добавляли небольшое количество силикагеля и растворитель выпаривали в вакууме. Продукт, адсорбированный на силикагеле, загружали на кремниевый картридж и элюировали смесью дихлорметан/гептан/этилацетат (60:35:5). Сложный эфир выделяли из соответствующих фракций в виде светлого масла (300 мг, 48%). Затем сложный эфир растворяли в этаноле (10 мл) и добавляли 2NNaOH (5 мл). Реакционную смесь перемешивали в течение 16 ч при комнатной температуре. Реакционную смесь выпаривали в вакууме и остаток растворяли в этилацетате (50 мл). Добавляли 2N НСl (15 мл) и фазы разделяли. Водную фазу повторно экстрагировали этилацетатом (250 мл). Объединенные органические фракции сушили (MgSO4), фильтровали и выпаривали. Остаток растворяли в небольшом количестве дихлорметана, осаждали добавлением гептана и растворитель удаляли в вакууме. Выход (280 мг,100%). Н ЯМР (CDCl3, 500 мГц) 0,87 (д, 3 Н), 1,35 (д, 3 Н), 3,04 (м, 1 Н), 3,12 (м, 2 Н), 3,6 (м, 3 Н), 4,11 (д,1 Н), 4,31 (д, 1H), 3,81 (с, 3H), 6,55 (д, 1 Н), 7,02 (д, 2 Н), 7,13 (дд, 1 Н), 7,2 (м, 1 Н), 7,42 (д, 2 Н); ЖХ-МС (m/z) (MH)+ 387,4; RT=2,22; (УФ, ELSD) 98%, 97%; и следующие соединения получали аналогичным образом: 1b. Гидрохлорид (+/-)-4-[2-(4-хлорфенилсульфанил)фенил]транс-2,5-диметилпиперазин-1-ил уксусной кислоты. 1 Н ЯМР (CDCl3, 500 мГц) 0,80 (д, 3 Н), 1,28 (д, 3H), 2,98-3,18 (м, 3 Н), 3,64 (м, 3H), 4,06 (д, 1 Н), 4,29H ЯМР (ДMCO-d6, 500 мГц) 7,60 (м, 4 Н), 7,40 (м, 2 Н), 7,32 (м, 1 Н), 6,95-7,20 (м, 6 Н), 5,00-6,50 (ш,1 Н), 4,00-4,10 (м, 1 Н), 3,80-3,90 (м, 1 Н), 3,20-3,50 (м, 6 Н), 3,05-3,15 (м, 1 Н), 1,17 (м, 3H); ЖХ-МС (m/z) 403,0; RT=2,45; чистота: (УФ, ELSD) 96,7%, 99,4%; выход: 0,116 г (43%). Пример 2. 2 а. Гидрохлорид (+/-)-4-[2-(4-метилфенилсульфанил)фенил]транс-2,5-диметилпиперазин-1-ил уксусной кислоты. Раствор [2-(4-метилфенилсульфанил)фенил]транс-2,5-диметилпиперазина (10 мг, 0,03 ммоль) и диизопропилэтиламина (0,02 мл, 0,11 ммоль) добавляли к 4-[хлорацетоксиметил]феноксиметилполистиролу (100 мг, 0,09 ммоль). Реакционную смесь перемешивали встряхиванием в течение ночи при 70 С. Смолу отфильтровывали и промывали N,N-диметилформамидом (4 мл), метанолом (4 мл) и дихлорметаном (4 мл). Смолу суспендировали в смеси 1:1 трифторуксусной кислоты и дихлорметана(1,5 мл) и встряхивали при комнатной температуре в течение 1 ч. Реакционную смесь перемешивали встряхиванием в течение ночи при 70 С. Смолу отфильтровывали и промывали дихлорметаном (1 мл). Органические экстракты собирали и выпаривали в вакууме. Неочищенный продукт очищали препаративной ЖХ-МС. ЖХ-МС (m/z) 371,1 (МН)+; RT=2,24; чистота (УФ, ELSD) 100%, 100%; выход: 1,6 мг. Следующие соединения получали аналогичным образом. 2b. Гидрохлорид (+/-)-4-[2-(4-изопропилфенилсульфанил)фенил]транс-2,5-диметилпиперазин-1 илуксусной кислоты. ЖХ-МС (m/z) 399,0 (МН)+; RT=2,48; чистота (УФ, ELSD) 98,3%, 100%; выход: 2,2 мг. 2 с. Гидрохлорид (+/-)-4-[2-(2,4-диметилфенилсульфанил)фенил]транс-2,5-диметилпиперазин-1 илуксусной кислоты. ЖХ-МС (m/z) 385,0 (МН)+; RT=2,37; чистота (УФ, ELSD) 99,8%, 100%; выход: 4,7 мг. 2d. Гидрохлорид(+/-)-2-4-[2-(4-трет-бутилфенилсульфанил)фенил]-3-метилпиперазин-1-ил пропионовой кислоты. ЖХ-МС (m/z) 386,7 (МН)+; RT=2,14; чистота (УФ, ELSD) 91,9%, 99,2%; выход: 3,2 мг. 2 е. Гидрохлорид (+/-)-4-[2-(4-изопропилфенилсульфанил)фенил]пиперазин-1-илуксусной кислоты. ЖХ-МС (m/z) 370,8 (МН)+; RT=2,35; чистота (УФ, ELSD) 89,0%, 99,9%; выход: 3,2 мг. 2f. Гидрохлорид (+/-)-2-4-[2-(4-метоксифенилсульфанил)фенил]-3-метилпиперазин-1-илпропионовой кислоты. ЖХ-МС (m/z) 386,7 (МН)+; RT=2,63; чистота (УФ, ELSD) 91,9%, 99,2%; выход: 3,2 мг. Фармакологическое испытание Соединения изобретения испытывали в хорошо известном и надежном тесте измерения захвата глицина. Захват [3 Н]-глицина. Клетки, трансфицированные человеческим GlyT-1b, высевали в 96-луночные планшеты. Перед экспериментом клетки промывали дважды HBS (10 мМ Hepes-tris (рН 7,4), 2,5 мМ KСl, 1 мМ СаСl2, 2,5 мМMgSO4) и предварительно инкубировали с испытуемым соединением в течение 6 мин. Затем 10 нМ 3 Нглицина добавляли в каждую лунку и инкубацию продолжали в течение 15 мин. Клетки промывали дважды в HBS. Добавляли сцинтилляционную жидкость и подсчет планшетов проводили на сцинтилляционном счетчике Trilux (Wallac). Результаты испытания показали, что все соединения изобретения проявили ингибирование ниже 2000 нМ в качестве IС 50 в указанном выше анализе. Большинство соединений были в концентрации от 150 нМ до 850 нМ. Эксперименты микродиализа у грызунов показали, что введение отобранных соединений изобретения привели к возросшей концентрации глицина в головном мозге. Кроме того, на модели психоза у грызунов отобранные соединения изобретения устраняли симптомы гиперактивности, вызванной амфетамином. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение общей формулы I- 13007475 каждый R1 независимо выбран из группы, состоящей из C1-6 алкила, или два R1, присоединенные к одному и тому же атому углерода, могут образовывать 3-6-членный спироприсоединенный циклоалкил; каждый R2 независимо выбран из группы, состоящей из галогена, циано, нитро, C1-6 алк(ен/ин)ила,C1-6 алк(ен/ин)илокси, C1-6 алк(ен/ин)илсульфанила, гидрокси, гидрокси-С 1-6 алк(ен/ин)ила, галоген-С 1-6 алк(ен/ин)ила, галоген-С 1-6 алк(ен/ин)илокси, С 3-8 циклоалк(ен)ила, С 3-8 циклоалк(ен)ил-С 1-6 алк(ен/ин)ила,ацила, C1-6 алк(ен/ин)илоксикарбонила, С 1-6 алк(ен/ин)илсульфонила или -NR9R10, где R9 и R10 независимо представляют водород, C1-6 алк(ен/ин)ил, С 3-8 циклоалк(ен)ил, С 3-8 циклоалк(ен)ил-C1-6 алк(ен/ин)ил или арил, или R9 и R10 вместе образуют 3-7-членное кольцо, которое необязательно содержит еще один гетероатом; каждый R3, которым замещен AR, независимо выбран из группы, состоящей из галогена, циано,нитро, C1-6 алк(ен/ин)ила, C1-6 алк(ен/ин)илокси, C1-6 алк(ен/ин)илсульфанила, гидрокси, гидрокси-С 1-6 алк(ен/ин)ил или арил, или R11 и R12 вместе с азотом, к которому они присоединены, образуют 3-7-членное кольцо, которое необязательно содержит еще один гетероатом; или NR13R14, где R13 и R14 независимо представляют водород, C1-6 алк(ен/ин)ил, С 3-8 циклоалк(ен)ил,С 3-8 циклоалк(ен)ил-C1-6 алк(ен/ин)ил или арил; или R13 и R14 вместе с азотом, к которому они присоединены, образуют 3-7-членное кольцо, которое необязательно содержит еще один гетероатом; или два соседних заместителя R3 вместе образуют кольцо, конденсированное с кольцом AR, выбранное из группы, состоящей из где W представляет О или S и R' и R" представляют водород или C1-6 алкил; или два соседних R3 заместителя вместе образуют конденсированную гетероароматическую систему, содержащую один или два гетероатома, конденсированных с AR,или их кислотно-аддитивные соли. 2. Соединения по п.1, где X представляет S. 3. Соединение по любому из указанных выше пунктов, где р равно 1 или 2. 4. Соединение по любому из указанных выше пунктов, где q равно 0. 5. Соединение по любому из указанных выше пунктов, где r равно 0 или 1. 6. Соединение по любому из указанных выше пунктов, где s равно 1 или 2. 7. Соединение по пп.1-6, где AR представляет фенил, r и q оба равны 0, р равно 1 или 2, s равно 1 или 2, r равно 0 или 1, m равно 1, R1 представляет СН 3, А представляет ОН, Q представляет С, Y представляет N и X представляет S. 8. Соединение по п.7, где R3 независимо выбран из галогена, C1-6 алкокси или C1-6 алкила. 9. Соединение по п.8, где R3 выбран из группы, состоящей из Cl, F, ОСН 3, трет-бутила, 2-пропила или метила. 10. Соединение по любому из предыдущих пунктов, где R4 представляет СН 3. 11. Соединение по п.1, где указанное соединение представляет собой(+/-)-4-[2-(4-изопропилфенисульфанил)фенил]транс-2,5-диметилпиперазин-1-илуксусную кислоту,(+/-)-4-[2-(2,4-диметилфенисульфанил)фенил]транс-2,5-диметилпиперазин-1-илуксусную кислоту,(+/-)-2-4-[2-(4-трет-бутилфенисульфанил)фенил]-3-метилпиперазин-1-илпропионовую кислоту,4-[2-(4-изопропилфенисульфанил)фенил]пиперазин-1-илуксусную кислоту,(+/-)-2-4-[2-(4-метоксифенисульфанил)фенил]-3-метилпиперазин-1-илпропионовую кислоту,или их фармацевтически приемлемую кислотно-аддитивную соль. 12. Фармацевтическая композиция, включающая соединение по пп.1-11 или его фармацевтически приемлемую кислотно-аддитивную соль и по меньшей мере один фармацевтически приемлемый носитель или разбавитель. 13. Применение соединения по пп.1-11 или его фармацевтически приемлемой кислотно-аддитивной соли для изготовления лекарственного препарата для лечения заболеваний, выбранных из группы, состоящей из шизофрении, включая как позитивные, так и негативные симптомы шизофрении, и других психозов, и при улучшении познавательной функции при состояниях, при которых познавательные процессы уменьшены, т.е. болезни Альцгеймера, деменции вследствие множественных инфарктов, деменции при СПИД, болезни Хантингтона, болезни Паркинсона, бокового амиотрофического склероза или заболеваний, при которых мозг поврежден внутренними или внешним влияниями, таким как травма головы или инсульт, и судорожных расстройств, таких как эпилепсия, мышечная спастичность или миоклонус. 14. Способ лечения заболевания, выбранного из группы, состоящей из шизофрении, включая как позитивные, так и негативные симптомы шизофрении, и при улучшении познавательной функции при состояниях, при которых познавательные процессы уменьшены, т.е. болезни Альцгеймера, деменции вследствие множественных инфарктов, деменции при СПИД, и судорожных расстройств, таких как эпилепсия, мышечная спастичность или миоклонус в живом организме животного, в том числе человека,включающий введение терапевтически эффективного количества соединения по пп.1-11 или его фармацевтически приемлемой кислотно-аддитивной соли.
МПК / Метки
МПК: C07D 295/15, A61P 25/18, A61P 25/28, A61K 31/495, C07D 241/04, A61P 25/08
Метки: арилоксифенила, арилсульфанилфенила, производные
Код ссылки
<a href="https://eas.patents.su/16-7475-proizvodnye-ariloksifenila-i-arilsulfanilfenila.html" rel="bookmark" title="База патентов Евразийского Союза">Производные арилоксифенила и арилсульфанилфенила</a>
Предыдущий патент: Способ индукции дифференцировки клеток
Следующий патент: Система и способ впрыска паров топлива
Случайный патент: Способ и устройство для подводной выемки грунта