Производные пролина и их применение в качестве ингибиторов дипептидилпептидазы iv
Формула / Реферат
1. Соединение формулы (I)
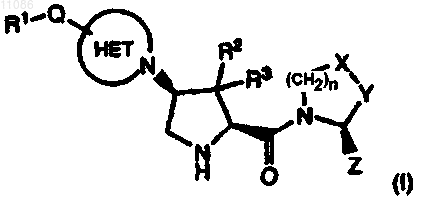
или его фармацевтически приемлемая соль, или его сольват, или соли, где
R1 является -(C1-C6)алкилом, -(C1-C6)алкокси, (C1-C6)арилалкилом, -NRaRb, гидрокси, циано, арилом или гетероарилом, где указанный -(C1-C6)алкил, указанный арил или указанный гетероарил необязательно независимо замещены 1-3 -СООН, -С(О)(C1-C6)алкокси, -С(О)(C1-C6)алкилами, -C(O)NRaRb, циано, галогенами, нитро, трифторметилами, (C1-C6)алкилами, -(C1-C6)алкокси, (С3-C6)циклоалкилами или фенилами, где
Ra и Rb независимо являются водородом, -(C1-C6)алкилом, арилом или гетероарилом, или Ra и Rb, взятые вместе с атомом азота, к которому они присоединены, образуют 4-6-членное гетероциклическое кольцо, где указанное кольцо необязательно содержит дополнительные один или два гетероатома азота, кислорода или серы в кольце;
R2 и R3 независимо являются водородом, галогеном, -(C1-C6)алкилом или (C3-C6)циклоалкилом;
Q является ковалентной связью, -С(О)- или -SO2-;
HET является гетероциклоалкильной кольцевой группой, необязательно замещенной:
(А) 1-4 -(C1-C6)алкилами, необязательно замещенными 1-6 атомами галогена, (C1-C6)алкокси, циано, галогеном, гидрокси или -NRaRb, или
(В) (C1-C6)арилалкилом, необязательно замещенным 1-6 атомами галогена, (C1-C6)алкокси, циано, галогеном, гидрокси или -NRaRb;
n равно 0 или 1;
если n равно 0, X является -CH2- и Y является -CH2-, -CHF или -CF2-; или
если n равно 1, X является -CH2-, -CHF- или -CF2- и Y является -CH2-, -CHF или -CF2-, при условии, что X и Y не являются оба CH2; и
Z является водородом или циано.
2. Соединение по п.1 или его фармацевтически приемлемая соль, где
R1 является арилом или гетероарилом, необязательно независимо замещенным 1-3 циано, галогенами, нитро, трифторметилами, -(C1-C6)алкилами, -(C1-C6)алкокси, -(C3-C6)циклоалкилами или фенилами;
R2 является -Н или -(C1-C6)алкилом;
R3 является -Н или -(C1-C6)алкилом; и
HET является азетидинилом, пиперазинилом, пиперидинилом, пирролидинилом, 5,6-дигидро-8Н-имидазо[1,2-а]пиразин-7-илом, 5,6-дигидро-8Н-[1,2,4]триазоло[4,3-а]пиразин-7-илом или 7,8-дигидро-5Н-пиридо[4,3-а]пиримидин-6-илом.
3. Соединение по п.1 или его фармацевтически приемлемая соль, где
R1 является бензоизотиазолилом, бензизоксазолилом, изотиазолилом, изоксазолилом, оксазолопиридилом, пиразинилом, пиридинилом, пиримидинилом, хинолинилом, хиноксалинилом, тиадиазолилом, триазинилом или 1,1-диоксо-1Н-1,2-бензоизотиазолилом;
R2 и R3 являются -Н;
Q является ковалентной связью;
HET является пиперазинилом.
4. Соединение по п.3 или его фармацевтически приемлемая соль, где R1 является пиридинилом или пиримидинилом.
5. Соединение по п.4 или его фармацевтически приемлемая соль, где n равно 1, X является -CF2- и Y является -CH2-.
6. Соединение по п.1, выбранное из группы, состоящей из
((2S,4S)-4-(3-(трифторметил)-5,6-дигидро-[1,2,4]триазоло[4,3-а]пиразин-7(8Н)-ил)пирролидин-2-ил)-(3,3-дифторпирролидин-1-ил)метанона,
(3,3-дифторпирролидин-1-ил)-((2S,4S)-4-(4-(оксазоло[5,4-b]пиридин-2-ил)пиперазин-1-ил)пирролидин-2-ил)метанона,
(3,3-дифторпирролидин-1-ил)-((2S,4S)-4-(4-(4-метилпиримидин-2-ил)пиперазин-1-ил)пирролидин-2-ил)метанона,
((2S,4S)-4-(2-(трифторметил)-7,8-дигидропиридо[4,3-d]пиримидин-6(5Н)-ил)пирролидин-2-ил)-(3,3-дифторпирролидин-1-ил)метанона,
((S)-3-фторпирролидин-1-ил)-((2S,4S)-4-[4-(3-трифторметилпиридин-2-ил)пиперазин-1-ил]пирролидин-2-ил)метанона,
((S)-3-фторпирролидин-1-ил)-[(2S,4S)-4-(2-трифторметил-7,8-дигидро-5Н-пиридо[4,3-d]пиримидин-6-ил)пирролидин-2-ил]метанона,
(3,3-дифторпирролидин-1-ил)-[(2S,4S)-4-(4-оксазоло[4,5-с]пиридин-2-илпиперазин-1-ил)пирролидин-2-ил]метанона,
[(2S,4S)-4-(2-циклопропил-7,8-дигидро-5Н-пиридо[4,3-d]пиримидин-6-ил)пирролидин-2-ил]-(3-фторазетидин-1-ил)метанона,
(3,3-дифторпирролидин-1-ил)-[(2S,4S)-4-(2-этокси-7,8-дигидро-5Н-пиридо[4,3-d]пиримидин-6-ил)пирролидин-2-ил]метанона,
2-{4-[(3S,5S)-5-(3-фторазетидин-1-карбонил)пирролидин-3-ил]пиперазин-1-ил}никотинонитрил,
((S)-3-фторпирролидин-1-ил)-[(2S,4S)-4-(4-оксазоло[5,4-b]пиридин-2-илпиперазин-1-ил)пирролидин-2-ил]метанона,
(3-фторазетидин-1-ил)-[(2S,4S)-4-(2-трифторметил-7,8-дигидро-5Н-пиридо[4,3-d]пиримидин-6-ил)пирролидин-2-ил]метанона,
2-{4-[(3S,5S)-5-((S)-3-фторпирролидин-1-карбонил)пирролидин-3-ил]пиперазин-1-ил}никотинонитрила,
(3-фторазетидин-1-ил)-{(2S,4S)-4-[4-(2-трифторметилхинолин-4-ил)пиперазин-1-ил]пирролидин-2-ил}метанона,
((3R*,4S*)-3,4-дифторпирролидин-1-ил)-[(2S,4S)-4-(2-трифторметил-7,8-дигидро-5Н-пиридо[4,3-d]пиримидин-6-ил)пирролидин-2-ил]метанона и
((3R*,4S*)-3,4-дифторпирролидин-1-ил)-[(2S,4S)-4-(4-оксазоло[5,4-b]пиридин-2-илпиперазин-1-ил)пирролидин-2-ил]метанона, или фармацевтически приемлемой соли указанного соединения.
7. (3,3-Дифторпирролидин-1-ил)-((2S,4S)-4-(4-(пиримидин-2-ил)пиперазин-1-ил)пирролидин-2-ил)метанон или фармацевтически приемлемая соль указанного соединения.
8. Фармацевтическая композиция, содержащая:
(a) соединение по пп.1-5 или 7, или его фармацевтически приемлемую соль, или его сольват, или соли; и
(b) фармацевтически приемлемый носитель, наполнитель, разбавитель или эксципиент.
9. Способ ингибирования дипептидилпептидазы IV у млекопитающих, включающий введение указанному млекопитающему, нуждающемуся в таком лечении, терапевтически эффективного количества соединения по пп.1-5 или 7, или его фармацевтически приемлемой соли, или его сольвата, или соли.
10. Способ лечения состояния, опосредованного дипептидилпептидазой IV у млекопитающих, включающий введение указанному млекопитающему, нуждающемуся в таком лечении, терапевтически эффективного количества соединения по пп.1-5 или 7, или его фармацевтически приемлемой соли, или его сольвата, или соли.
11. Способ по п.10, где подвергаемым лечению состоянием является диабет 2 типа, диабет 1 типа, нарушенная толерантность к глюкозе, гипергликемия, метаболический синдром (синдром X и/или синдром резистентности к инсулину), глюкозурия, метаболический ацидоз, артрит, катаракта, диабетическая невропатия, диабетическая нефропатия, диабетическая ретинопатия, диабетическая кардиомиопатия, ожирение, состояния, осложненные ожирением, гипертензия, гиперлипидемия, атеросклероз, остеопороз, хрупкость, потеря костной ткани, перелом костей, острый коронарный синдром, низкий рост вследствие дефицита гормона роста, бесплодие вследствие синдрома поликистоза яичников, тревога, депрессия, бессонница, хроническая усталость, эпилепсия, расстройства питания, хроническая боль, алкогольная зависимость, заболевания, связанные с моторикой кишечника, язвы, синдром раздраженной толстой кишки, синдром воспаления толстой кишки; синдром короткой толстой кишки; и профилактика развития заболеваний при диабете 2 типа.
12. Способ по п.11, где указанным состоянием является диабет 2 типа.
13. Способ лечения диабета, включающий введение указанному млекопитающему, нуждающемуся в таком лечении, терапевтически эффективного количества соединения по пп.1-5 или 7, или его фармацевтически приемлемой соли, или его сольвата, или соли.
Текст
ИСПРАВЛЕННОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ К ЕВРАЗИЙСКОМУ ПАТЕНТУ 2005.04.29 ПРОИЗВОДНЫЕ ПРОЛИНА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ ДИПЕПТИДИЛПЕПТИДАЗЫ IV В настоящем изобретении представлены соединения формулы (I) и стереоизомеры,фармацевтически приемлемые соли соединений и стереоизомеров, где R1, R2, R3, HET, n, Q, x, Y иZ такие, как представлено в описании; их композиции и их применение для лечения диабетических осложнений, включая диабетическую невропатию, диабетическую нефропатию, диабетическую микроангиопатию и подобные. Юлэн Бернар, Пиотровски Дэвид Уолтер (US) Медведев В.Н., Павловский А.Н. (RU) Примечание: библиография отражает состояние при переиздании 011086 Настоящее изобретение относится к селективным ингибиторам фермента дипептидилпептидазы IV(DPP-IV), их фармацевтическим композициям и их применению для лечения заболеваний и состояний,связанных с белками, которые подвергаются процессингу DPP-IV.DPP-IV (ЕС 3.4.14.5) представляет собой сериновую протеазу, которая предпочтительно гидролизует N-концевой дипептид из белков, имеющих пролин или аланин в положении 2. Полагают, что DPP-IV вовлечена в диабеты, толерантность к глюкозе, ожирение, регулирование аппетита, липидемию, остеопороз, метаболизм нейропептидов и активацию Т-клеток, среди прочих. Следовательно, введение ингибиторов DPP-IV in vivo предотвращает расщепление N-конца субстратных пептидов, тем самым, обеспечивая более высокие концентрации циркулирования таких пептидов, и терапевтические преимущества,связанные с такими повышенными концентрациями.DPP-IV вовлечена в контроль гомеостаза глюкозы, так как ее субстраты включают инкретиновые пептиды глюкагоноподобного пептида 1 (GLP-1) и желудочного ингибирующего полипептида (GIP). Отщепление N-концевых аминокислот от таких пептидов делает их функционально неактивными. Было показано, что GLP-1 является эффективной противодиабетической терапией у пациентов с диабетом 2 типа, и что он снижает связанную с пищей потребность в инсулине у пациентов с диабетом 1 типа. Полагают, что GLP-1 и GIP регулируют насыщение, липидемию и остеогенез. Экзогенный GLP-1 был предложен в качестве лечения пациентам, страдающим от острого коронарного синдрома, стенокардии и ишемической болезни сердца. Введение ингибиторов DPP-IV in vivo предотвращает расщепление GLP-1 и GIP, что дает более высокие концентрации циркулирования этих пептидов, увеличивает секрецию инсулина и улучшает толерантность к глюкозе. Основываясь на таких наблюдениях, считают, что ингибиторы DPP-IV являются агентами для лечения диабета 2 типа, заболевания, при котором нарушена толерантность к глюкозе. Кроме того, лечение ингибиторами DPP-IV позволяет предотвратить расщепление нейропептида Y(NPY), пептида, связанного с множеством расстройств центральной нервной системы, и пептида YY,который связан с желудочно-кишечными состояниями, такими как язвы, синдром раздраженной толстой кишки и воспаление толстой кишки. Несмотря на раннее открытие инсулина и его последующее широкое применение при лечении диабетов и более позднее открытие и применение сульфонилмочевин (например, хлорпропамида, толбутамида, ацетогексамида), бигуанидов (например, фенформина), метформина, тиазолидиндионов (например,розиглитазона) и пиоглитазона в качестве пероральных гипогликемических средств, лечение диабетов остается менее чем удовлетворительным. Применение инсулина, необходимое пациентам с диабетом 1 типа и 10% пациентов с диабетом 2 типа, для которых доступные в настоящее время пероральные гипогликемические средства являются неэффективными, требует многократного суточного введения, обычно инъекциями, производимыми самим пациентом. Определение подходящей дозы инсулина делает необходимым частое определение концентрации глюкозы в моче или крови. Введение избыточной дозы инсулина вызывает гипогликемию,последствия которой включают от аномального уровня глюкозы в крови до комы или даже смерти. Лечение диабетов 2 типа обычно включает сочетание диеты, физических упражнений, пероральных лекарственных средств и, в более тяжелых случаях, инсулина. Однако клинически доступные гипогликемические средства могут оказывать побочные эффекты, которые ограничивают их применение. Постоянная необходимость в гипогликемических средствах, которые обладают меньшим количеством побочных эффектов или являются эффективными там, где другие средства неэффективны, очевидна. Плохо контролируемая гипергликемия является непосредственной причиной множества осложнений (катаракты, невропатии, нефропатии, ретинопатии, кардиомиопатии), которые характеризуют развитый диабет 2 типа. Кроме того, диабет 2 типа является сочетанным заболеванием, которое часто смешано с гиперлипидемией, атеросклерозом и гипертонией, добавляя значимости общей заболеваемости и смертности, относящимся к этим заболеваниям. Эпидемиологические доказательства четко определяют гиперлипидемию как основной фактор риска сердечно-сосудистых заболеваний (ССЗ) вследствие атеросклероза. Атеросклероз признается ведущей причиной смерти в Соединенных Штатах и Западной Европе. ССЗ особенно распространены среди пациентов с диабетом, по крайней мере, частично из-за существования множества независимых факторов риска, таких как непереносимость глюкозы, гипертрофия левого желудочка и гипертензия, у этой группы населения. Поэтому успешное лечение гиперлипидемии у населения, и в частности у пациентов с диабетом, имеет исключительное медицинское значение. Гипертензия (высокое кровяное давление) представляет собой состояние, которое может возникнуть у множества пациентов, у которых неизвестно средство, вызывающее ее или заболевание. Такая идиопатическая гипертензия часто связана с расстройствами, такими как ожирение, диабет и гипертриглицеридемия, и известно, что гипертензия непосредственно связана с сердечной недостаточностью,почечной недостаточностью и ударом. Гипертензия также может вносить свой вклад в развитие атеросклероза и коронарной болезни. Гипертензия, вместе с резистентностью к инсулину и гиперлипидемией,включает созвездие симптомов, которые характеризуют метаболический синдром, также известный как синдром резистентности к инсулину (IRS) и синдром X.-1 011086 Ожирение является хорошо известным и широко распространенным фактором риска развития атеросклероза, гипертензии и диабета. Доля ожирения и его последствий увеличивается во всем мире. В настоящее время доступны несколько фармакологических средств, которые эффективно и приемлемо снижают тучность. Остеопороз является прогрессирующим системным заболеванием, характеризуемым низкой плотностью костей и микроархитектурным нарушением костной ткани, с последующим увеличением хрупкости костей и предрасположенности к переломам. Остеопороз и следствия нарушенной прочности костей являются важной причиной хрупкости и повышенной заболеваемости и смертности. Заболевание сердца является основной проблемой здоровья по всему миру. Инфаркты миокарда являются значительной причиной смертности среди пациентов с заболеванием сердца. Острый коронарный синдром характеризует пациентов, которые имели или имеют высокий риск развития острого инфаркта миокарда (ИМ). Хотя существуют способы лечения, доступные для лечения диабетов, гипергликемии, гиперлипидемии, гипертензии, ожирения и остеопороза, все еще существует постоянная потребность в альтернативных и улучшенных способах лечения. Различные показания для ингибиторов DPP-IV описаны в Augustyns et al., Curr. Medicinal Chem., 6,311 (1999); Ohnuki et al., Drugs of the Future, 1999, 24, 665-670 (1999); Villhauer et al., Annual Reports inet al., Curr. Opin. Invest. Drugs, 4, 412-420 (2003). Недавно были получены перорально вводимые соединения, которые ингибируют DPP-IV, такие как описан в международной заявке WO 02/14271. Полагают, что ингибиторы, такие как описано в WO 02/14271, действуют посредством ингибирования расщепления природных гормонов, GLP-1 и GIP. Поэтому важно, чтобы подходящая концентрация ингибитора DPP-IV была доступна в плазме для ингибирования DPP-IV одновременно с секрецией такихGLP-1 и GIP гормонов. Для достижения таких концентраций в плазме предпочтительно, чтобы соединение-ингибитор DPP-IV сохраняло более высокую концентрацию в плазме в течение времени, по сравнению с той, которая ожидается для других соединений-ингибиторов DPP-IV, таких как описано в WO 02/14271. Поэтому существует необходимость в перорально вводимом соединении-ингибиторе DPP-IV, которое имеет эквивалентное или лучшее ингибирующее действие в отношении DPP-IV, и которое сохраняет более высокие концентрации в плазме в течение времени. Настоящее изобретение относится к соединениям, имеющим структуру формулы (I) или их пролекарству, или фармацевтически приемлемой соли указанного соединения, или сольвату указанного соединения, или соли, гдеR1 является -(C1-C6)алкилом, -(C1-C6)алкокси, (C1-C6)арилалкилом, -NRaRb, гидрокси, циано, арилом или гетероарилом, где указанный -(C1-C6)алкил, указанный арил или указанный гетероарил необязательно независимо замещены 1-3 -СООН, -С(О)(C1-C6)алкокси, -С(О)(C1-C6)алкилами, -C(O)NRaRb, циано,галогенами, нитро, трифторметилами, (C1-C6)алкилами, -(C1-C6)алкокси, (C3-C6)циклоалкилами или фенилами, и где Ra и Rb независимо являются водородом, (C1-C6)алкилом, арилом или гетероарилом, или Ra и Rb, взятые вместе с атомом азота, к которому они присоединены, образуют 4-6-членное гетероциклическое кольцо, где указанное кольцо необязательно содержит дополнительные один или два гетероатома азота, кислорода или серы в кольце;HET является гетероциклоалкильной кольцевой группой, необязательно замещенной:X является -CH2-, -CHF- или -CF2- и Y является -CH2-, -CHF или -CF2-, при условии, что если n равно 1, X и Y не являются оба CH2, и если n равно 0, X является -CH2-; иZ является водородом или циано. Настоящее изобретение также относится к фармацевтическим композициям, содержащим терапевтически эффективное количество соединения в соответствии с настоящим изобретением, или фармацевтически приемлемой соли соединения, или сольвата соединения, или соли, и фармацевтически приемле-2 011086 мый носитель, наполнитель, разбавитель или эксципиент. Настоящее изобретение также относится к способу лечения диабета, включающему введение млекопитающему, нуждающемуся в таком лечении, терапевтически эффективного количества соединения в соответствии с настоящим изобретением или его пролекарства, или фармацевтически приемлемой соли соединения или пролекарства, или сольвата соединения, пролекарства или соли. Предпочтительно, лечимым диабетом является диабет 2 типа. Кроме того, настоящее изобретение относится к способу лечения состояния, опосредованного дипептидилпептидазой IV у млекопитающего, включающему введение млекопитающему, нуждающемуся в таком лечении, терапевтически эффективного количества соединения в соответствии с настоящим изобретением или его пролекарства, или фармацевтически приемлемой соли соединения или пролекарства,или сольвата соединения, пролекарства или соли. Соединения и фармацевтические композиции в соответствии с настоящим изобретением полезны для лечения диабетов, предпочтительно диабетов 2 типа. Соединения и фармацевтические композиции в соответствии с настоящим изобретением также полезны для лечения связанных с дипептидилпептидазой IV состояний, которые включают, но не ограничиваются ими, диабет 2 типа, диабет 1 типа, нарушенную толерантность к глюкозе, гипергликемию, метаболический синдром (синдром X и/или синдром резистентности к инсулину), глюкозурию, метаболический ацидоз, артрит, катаракту, диабетическую невропатию, диабетическую нефропатию, диабетическую ретинопатию, диабетическую кардиомиопатию, ожирение, состояния, осложненные ожирением,гипертензию, гиперлипидемию, атеросклероз, остеопороз, хрупкость, потерю костной ткани, перелом костей, острый коронарный синдром, низкий рост вследствие дефицита гормона роста, бесплодие вследствие синдрома поликистоза яичников, тревогу, депрессию, бессонницу, хроническую усталость, эпилепсию, расстройства питания, хроническую боль, алкогольную зависимость, заболевания, связанные с моторикой кишечника, язвы, синдром раздраженной толстой кишки, синдром воспаления толстой кишки; синдром короткой толстой кишки; и профилактики развития заболеваний при диабете 2 типа. Термины, используемые для описания настоящего изобретения, имеют следующие значения. Фраза фармацевтически приемлемый означает, что обозначенные носитель, наполнитель, разбавитель, эксципиент(ы) и/или соль обычно химически и/или физически совместимы с другими ингредиентами, составляющими композицию, и физиологически совместимы с реципиентом. Содержание атомов углерода в различных углеродсодержащих группах в данном описании может быть обозначено префиксом, указывающим на минимальное и максимальное число атомов углерода в группе, например префиксы (Са-Cb)алкил и (Са-Cb)алкил означают алкильную группу с целым числом от а до b атомов углерода включительно. Таким образом, например, (C1-C6)алкил и C1-6 алкил относятся к алкильной группе, содержащей 1-6 атомов углерода включительно. Термин алкил означает прямую или разветвленную цепь атомов углерода, где алкильная группа необязательно содержит одну или несколько двойных или тройных связей, или сочетание двойных и тройных связей. Примеры алкильных групп включают метил, этил, пропил, изопропил, бутил, изобутил,винил, аллил, 2-метилпропенил, 2-бутенил, 1,3-бутадиенил, этинил, пропаргил и подобные. Термин алкокси относится к прямой или разветвленной одновалентной насыщенной алифатической углеводородной цепи, связанной с атомом кислорода, который присоединен к основной структуре. Примеры алкоксигрупп включают метокси, этокси, пропокси, бутокси, изобутокси, трет-бутокси и подобные. Термин циклоалкил означает насыщенную моноциклическую или бициклическую циклоалкильную группу. Циклоалкильные группы могут быть необязательно конденсированы с ароматическими углеводородами, такими как бензол, с образованием конденсированных циклоалкильных групп, таких как инданил и подобные. Примеры циклоалкильных групп включают циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и подобные. Термин галоген или гало означает атомы и заместители хлора, брома, фтора и йода. Термин арил означает моноциклическую или полициклическую ароматическую углеводородную группу, например антраценил, фторенил, нафтил, фенантренил, фенил и подобные. Термин арилалкил означает алкильную группу, такую как определено выше, в которой по крайней мере один из атомов водорода заменен арильной группой, такой как определено выше. Примеры арилалкильных групп включают, в числе других, бензильные группы. Термин гетероциклоалкил также используемый в виде ссылки HET выше, относится к насыщенной 4-8-членной гетероциклической системе колец, необязательно конденсированной с 5-6-членной ароматической или гетероароматической системой колец. Примеры гетероциклоалкильных групп включают гомопиперазинил, пиперазинил, пиперидил, пирролидинил, азетидинил, 2-азабицикло[2.2.1]гептанил, 3 азабицикло[3.1.0]гексанил,2,5-диазабицикло[2.2.1]гептанил,5,6,7,8-тетрагидро-2 Н-имидазо[1,2-а]пиразинил,5,6,7,8-тетрагидро[1,2,4]триазоло[4,3-а]пиразинил,4,5,6,7-тетрагидропиразоло[1,5-а]пиразинил, 5,6,7,8-тетрагидропиридо[3,4-d]пиримидил, 5,6,7,8-тетрагидропиридо[4,3-d]пиримидил, октагидропирроло[3,4-b]пирролил, октагидропирроло[3,4-с]пирролил, 6-азабицикло[3.2.1]октанил, 3,8 диазабицикло[3.2.1]октанил, 2,3-дигидроспиро[инден-1,4'-пиперидил], спиро[инден-1,4'-пиперидил],-3 011086 1-окса-8-азаспиро[4.5]деканил, 8-азабицикло[3.2.1]октанил, 2,3,4,5-тетрагидробензо[f][1,4]оксазепинил,гексагидро-2 Н-пирроло[3,4-d]изотиазолил-1,1-диоксид, 2,7-диазаспиро[4.4]нонанил, 6,7,8,9-тетрагидро 5 Н-[1,2,4]триазоло[4,3-g][1,4]диазепинил, 5,6-дигидро-8 Н-имидазо[1,2-а]пиразинил, 5,6-дигидро-8 Н[1,2,4]триазоло[4,3-а]пиразинил, 7,8-дигидро-5 Н-пиридо[4,3-а]пиримидил, 7,8-дигидро-5 Н-пиридо[4,3d]пиримидил, пиразоло[1,5-а]пиримидил и подобные. Термин гетероарил означает моноциклическую или полициклическую гетероциклическую систему колец. Примеры гетероарильных групп включают бензоизотиазолил, бензизоксазолил, бензоксазолил,бензотиазолил, бензофуранил, бензотиенил, бензимидазолил, циннолинил, фуранил, фуропиридил, имидазолопиримидил, имидазолил, индазолил, индолил, изохинолил, изотиазолил, изоксадиазолил, изоксазолил, оксазолопиридил, оксадиазолил, оксазолил, фталазинил, птеридинил, пиразинил, пиридазинил,пирролопиримидил, пирролопиридил, пиразолопиримидил, пиразолил, пиридил, пиримидил, пирролил,хиназолил, хинолил, хиноксалинил, тетразолил, тиазолил, тиадиазолил, тиазолопиридил, тиенопиридил,тиенил, триазинил, триазолил, 1,1-диоксо-1 Н-1,2-бензоизотиазолил, оксазолопиридил и подобные. Термин оксо означает карбонильную группу, образованную сочетанием атома углерода и атома кислорода. Термин замещенный означает, что атом водорода в молекуле заменен другим атомом или молекулой. Атом или молекула, заменяющие атом водорода, обозначены как заместитель. Символ "-" означает ковалентную связь. Фраза инертный растворитель относится к растворителю или смеси растворителей, которые не взаимодействуют с исходными веществами, реагентами, промежуточными соединениями или продуктами, таким образом, отрицательно не влияя на их желаемые свойства. Термины лечить, леченный или лечение в данном описании включают превентивное (например, профилактическое), смягчающее и целительное применение или результаты. Фраза терапевтически эффективное количество означает количество соединения в соответствии с настоящим изобретением, которое (i) лечит или предотвращает определенное заболевание, состояние или расстройство, (ii) ослабляет, облегчает или уничтожает один или более симптомов определенного заболевания, состояния или расстройства, или (iii) предотвращает или замедляет появление одного или более симптомов определенного заболевания, состояния или расстройства, представленного в данном описании. Термин млекопитающее относится к отдельному животному, которое является членом таксономического класса Mammalia. Класс Mammalia включает, например, человека, обезьяну, шимпанзе, гориллу, крупный рогатый скот, свинью, лошадь, овцу, собаку, кошку, мышь и крысу. В настоящем изобретении предпочтительным млекопитающим является человек. Предпочтительно, соединения в соответствии с настоящим изобретением имеют структуру формулы (I), гдеR1 является арилом или гетероарилом, необязательно независимо замещенным 1-3 циано, галогенами, нитро, трифторметилами, -(C1-C6)алкилами, -(C1-C6)алкокси, -(С 3-С 6)циклоалкилами или фенилами;HET является азетидинилом, пиперазинилом, пиперидинилом, пирролидинилом, 5,6-дигидро-8 Нимидазо[1,2-а]пиразин-7-илом, 5,6-дигидро-8 Н-[1,2,4]триазоло[4,3-а]пиразин-7-илом или 7,8-дигидро 5 Н-пиридо[4,3-а]пиримидин-6-илом. Более предпочтительно, соединения в соответствии с настоящим изобретением имеют структуру формулы (IA) где R1 является бензоизотиазолилом, изотиазолилом, изоксазолилом, оксазолопиридилом, пиразинилом,пиридинилом, пиримидинилом, хинолинилом, хиноксалинилом, тиадиазолилом, триазинилом или 1,1 диоксо-1 Н-1,2-бензоизотиазолилом. В настоящем изобретении для соединений формулы (IA) предпочтительно R1 является пиридинилом или пиримидинилом и более предпочтительно R1 является пиридинилом или пиримидинилом, n равно 1, X является -CF2- и Y является -CH2-. В настоящем изобретении наиболее предпочтительным является соединение (3,3 дифторпирролидин-1-ил)-2S,4S)-4-(4-(пиримидин-2-ил)пиперазин-1-ил)пирролидин-2-ил)метанон или его пролекарство, или фармацевтически приемлемая соль указанного соединения или указанного проле-4 011086 карства. В альтернативном варианте соединения, выбранные из группы, состоящей из 2S,4S)-4-(3-(трифторметил)-5,6-дигидро-[1,2,4]триазоло[4,3-а]пиразин-7(8 Н)-ил)пирролидин-2 ил)-(3,3-дифторпирролидин-1-ил)метанона,(3,3-дифторпирролидин-1-ил)-2S,4S)-4-(4-(оксазоло[5,4-b]пиридин-2-ил)пиперазин-1 ил)пирролидин-2-ил)метанона,(3,3-дифторпирролидин-1-ил)-2S,4S)-4-(4-(4-метилпиримидин-2-ил)пиперазин-1-ил)пирролидин 2-ил)метанона,2S,4S)-4-(2-(трифторметил)-7,8-дигидропиридо[4,3-d]пиримидин-6(5 Н)-ил)пирролидин-2-ил)-(3,3 дифторпирролидин-1-ил)метанона,S)-3-фторпирролидин-1-ил)-2S,4S)-4-[4-(3-трифторметилпиридин-2-ил)пиперазин-1 ил]пирролидин-2-ил)метанона,S)-3-фторпирролидин-1-ил)-[(2S,4S)-4-(2-трифторметил-7,8-дигидро-5 Н-пиридо[4,3-d]пиримидин 6-ил)пирролидин-2-ил]метанона,(3,3-дифторпирролидин-1-ил)-[(2S,4S)-4-(4-оксазоло[4,5-с]пиридин-2-илпиперазин-1 ил)пирролидин-2-ил]метанона,[(2S,4S)-4-(2-циклопропил-7,8-дигидро-5 Н-пиридо[4,3-d]пиримидин-6-ил)пирролидин-2-ил]-(3 фторазетидин-1-ил)метанона,(3,3-дифторпирролидин-1-ил)-[(2S,4S)-4-(2-этокси-7,8-дигидро-5 Н-пиридо[4,3-d]пиримидин-6 ил)пирролидин-2-ил]метанона,2-4-[(3S,5S)-5-(3-фторазетидин-1-карбонил)пирролидин-3-ил]пиперазин-1-илникотинонитрила,S)-3-фторпирролидин-1-ил)-[(2S,4S)-4-(4-оксазоло[5,4-b]пиридин-2-илпиперазин-1 ил)пирролидин-2-ил]метанона,(3-фторазетидин-1-ил)-[(2S,4S)-4-(2-трифторметил-7,8-дигидро-5 Н-пиридо[4,3-d]пиримидин-6 ил)пирролидин-2-ил]метанона,2-4-[(3S,5S)-5-S)-3-фторпирролидин-1-карбонил)пирролидин-3-ил]пиперазин-1 илникотинонитрила,(3-фторазетидин-1-ил)-(2S,4S)-4-[4-(2-трифторметилхинолин-4-ил)пиперазин-1-ил]пирролидин-2 илметанона,3R,4S)-3,4-дифторпирролидин-1-ил)-[(2S,4S)-4-(2-трифторметил-7,8-дигидро-5 Н-пиридо[4,3d]пиримидин-6-ил)пирролидин-2-ил]метанона и 3R,4S)-3,4-дифторпирролидин-1-ил)-[(2S,4S)-4-(4-оксазоло[5,4-b]пиридин-2-илпиперазин-1 ил)пирролидин-2-ил]метанона или их пролекарства, или фармацевтически приемлемой соли указанного соединения или указанного пролекарства, являются предпочтительными. Все соединения в соответствии с настоящим изобретением содержат по крайней мере два стереогенных центра, а именно (2S,4S)пирролидин-2-ил стереогенных центра, показанных ниже в формуле (I) Соединения в соответствии с настоящим изобретением могут быть разделены на чистые энантиомеры методами, известными специалистам в данной области, например образованием диастереоизомерных солей, которые могут быть разделены, например, кристаллизацией; образованием диастереоизомерных производных или комплексов, которые могут быть разделены, например, кристаллизацией, газожидкостной или жидкостной хроматографией; селективной реакцией одного энантиомера со специфическим к данному энантиомеру реагентом, например, ферментной этерификацией; или газожидкостной или жидкостной хроматографией в хиральной окружающей среде, например, на хиральной подложке, например,диоксиде кремния, со связанным хиральным лигандом, или в присутствии хирального растворителя. Должно быть понятно, что если желаемый стереоизомер превращен в другую химическую сущность одним из методов разделения, описанным выше, то требуется дополнительная стадия выделения желаемой энантиомерной формы. Альтернативно, определенные стереоизомеры могут быть синтезированы с использованием оптически активных исходных веществ, асимметричным синтезом с использованием оптически активных реагентов, подложек, катализаторов или растворителей, или превращением одного стереоизомера в другой асимметричным превращением. Если указанные соединения содержат один или более дополнительных стереогенных центров, специалисту в данной области будет понятно, что все диастереоизомеры и диастереоизомерные смеси соединений, иллюстрируемых и обсуждаемых в данном описании, включены в объем настоящего изобретения. Такие диастереоизомеры могут быть выделены методами, известными специалистам в данной области, например, кристаллизацией, газожидкостной или жидкостной хроматографией. Альтернативно, промежуточные соединения в процессе синтеза могут существовать в виде рацеми-5 011086 ческих смесей и могут быть подвергнуты разделению методами, известными специалистам в данной области, например, образованием диастереоизомерных солей, которые могут быть разделены, например,кристаллизацией; образованием диастереоизомерных производных или комплексов, которые могут быть разделены, например, кристаллизацией, газожидкостной или жидкостной хроматографией; селективной реакцией одного энантиомера со специфическим к данному энантиомеру реагентом, например, ферментной этерификацией; или газожидкостной или жидкостной хроматографией в хиральной окружающей среде, например, на хиральной подложке, например, диоксиде кремния, со связанным хиральным лигандом, или в присутствии хирального растворителя. Должно быть понятно, что если желаемый стереоизомер превращен в другую химическую сущность одним из методов разделения, описанным выше, то требуется дополнительная стадия выделения желаемой энантиомерной формы. Альтернативно, определенные стереоизомеры могут быть синтезированы асимметричным синтезом с использованием оптически активных реагентов, подложек, катализаторов или растворителей, или превращением одного стереоизомера в другой асимметричным превращением. Определенные соединения формулы (I) могут существовать в различных стабильных конформационных формах, которые могут быть разделены. Асимметрия кручения вследствие ограниченного вращения вокруг асимметричной одинарной связи, например, из-за пространственного затруднения или деформации кольца, может дать возможность разделения различных конформационных структур. Настоящее изобретение включает каждый конформационный изомер соединений формулы (I) и их смеси. Специалистам-практикам будет понятно, что определенные соединения формулы (I) могут существовать в таутомерной форме, т.е. что равновесие существует между двумя изомерами, которые находятся в быстром равновесии друг с другом. Характерным примером таутомерии является кетоенольная таутомерия,т.е. Примеры таких соединений в соответствии с настоящим изобретением включают, в числе прочих,гидроксипиридины (пиридоны) и гидроксипиримидины (пиримидоны). В частности, специалисту в данной области будет понятно, что гидроксипиридин в соответствии с настоящим изобретением может существовать в виде двух отдельных таутомеров, например Соотношение, в котором один таутомер присутствует по отношению к другому, зависит от различных факторов, включая схему замещения и тип растворителя. Другие примеры в соответствии с настоящим изобретением будут очевидны специалистам в данной области. Все таутомерные формы формулы(I) включены в объем настоящего изобретения. Соединения в соответствии с настоящим изобретением могут существовать в несольватированных и в сольватированных формах с фармацевтически приемлемыми растворителями, такими как вода, этанол и подобные, и подразумевается, что настоящее изобретение охватывает несольватированные формы,сольватированные формы и смеси сольватированных форм. Определенные соединения формулы (I) и их соли, и сольваты могут существовать в более чем одной кристаллической форме. Полиморфы соединений, представленных формулой (I), являются частью настоящего изобретения и могут быть получены кристаллизацией соединения формулы (I) в различных условиях. Например, с использованием различных растворителей или различных смесей растворителей для перекристаллизации; кристаллизации при различных температурах; различных методов охлаждения,варьирующихся от очень быстрого до очень медленного охлаждения во время кристаллизации. Полиморфы также могут быть получены нагреванием или плавлением соединения формулы (I) с последующим постепенным или быстрым охлаждением. Присутствие полиморфов может быть определено ЯМР спектроскопией твердой пробы, ИК-спектроскопией, дифференциальной сканирующей калориметрией,порошковой рентгенографией и другими подобными методами. Настоящее изобретение также включает меченные изотопами соединения, которые идентичны соединениям формулы (I), но в которых один или несколько атомов заменены атомом, имеющим атомную массу или массовое число, отличающееся от атомной массы или массового числа, обычно существующего в природе. Примеры изотопов, которые могут быть введены в соединения в соответствии с настоящим изобретением, включают изотопы водорода, углерода, азота, кислорода, серы и фтора, такие как 2H, 3H,13C, 14C, 15N, 16O, 17O, 35S, 36Cl, 125I, 129I и 18F соответственно. Соединения в соответствии с настоящим изобретением, их пролекарства и фармацевтически приемлемые соли соединений или пролекарств, кото-6 011086 рые содержат указанные выше изотопы и/или другие изотопы других атомов, включены в объем настоящего изобретения. Определенные меченные изотопами соединения в соответствии с настоящим изобретением, например те, в которых присутствуют радиоактивные изотопы, такие как 3 Н и 14 С, полезны в исследованиях распределения лекарственных средств и/или субстратов тканей. Тритированные (т.е. 3H) и углерод-14 (т.е. 14C) изотопы особенно предпочтительны из-за простоты их получения и определимости. Далее, замещение более тяжелыми изотопами, такими как дейтерий (т.е. 2H), может давать определенные терапевтические преимущества, исходящие из большей метаболической стабильности, например, увеличенный период полураспада in vivo или пониженную дозировку, и, следовательно, могут быть предпочтительными в некоторых обстоятельствах. Меченные изотопами соединения формулы (I) в соответствии с настоящим изобретением и их пролекарства обычно получают с применением методик, описанных на схемах и/или в примерах ниже, заменяя не меченные изотопами реагенты легко доступными мечеными изотопами реагентами. Фармацевтически приемлемые соли, применительно к соединениям в соответствии с настоящим изобретением, включают фармацевтически приемлемые неорганические и органические соли указанного соединения. Эти соли могут быть получены in situ во время конечного выделения и очистки соединения,или отдельным взаимодействием соединения или пролекарства с подходящей органической или неорганической кислотой и выделением полученной соли. Типичные представители солей включают, но не ограничиваются ими, гидробромид, гидрохлорид, гидройодид, сульфат, бисульфат, нитрат, ацетат, трифторацетат, оксалат, безилат, пальмитат, памоат, малонат, стеарат, лаурат, малат, борат, бензоат, лактат,фосфат, гексафторфосфат, бензолсульфонат, тозилат, формиат, цитрат, малеат, фумарат, сукцинат, тартрат, нафтилат, мезилат, глюкогептонат, лактобионат и лаурилсульфонат и подобные. Они также могут включать катионы на основе щелочных и щелочно-земельных металлов, таких как натрий, литий, калий,кальций, магний и подобные, а также катионы нетоксичного аммония, четвертичного аммония и амина,включая, но, не ограничиваясь ими, аммоний, тетраметиламмоний, тетраэтиламмоний, метиламин, диметиламин, триметиламин, триэтиламин, этиламин и подобные. Дополнительные примеры представлены в,например, Berge et al., J. Pharm. Sci., 66, 1-19 (1977). Соединения в соответствии с настоящим изобретением могут быть выделены и применяться per se или в виде их фармацевтически приемлемых солей, или сольватов. В соответствии с настоящим изобретением соединения с множеством основных атомов азота могут образовывать соли с переменным количеством эквивалентов кислоты. Специалистам-практикам будет понятно, что все такие соли включены в объем настоящего изобретения. Пролекарство соединения формулы (I) может быть получено обычным способом с функциональной группой соединения, такой как амино, гидрокси или карбоксигруппы. Термин пролекарство относится к соединению, которое превращается in vivo в соединение формулы (I), или фармацевтически приемлемую соль, или сольват соединения. Превращение может осуществляться различными механизмами, такими как гидролиз в крови. Обсуждение применения пролекарств представлено в Т. Higuchi and W.Stella, "Prodrugs as Novel Delivery Systems," Vol. 14 of the ACS. Symposium Series, and in Bioreversible Carriers in Drug Design, ed. Edward B. Roche, American Pharmaceutical Association and Pergamon Press, 1987. Например, если соединение в соответствии с настоящим изобретением содержит функциональную группу амина, пролекарство может быть получено замещением атома водорода в группе амина группой,такой как R-карбонил, RO-карбонил, NRR'-карбонил, где R и R', каждый независимо, являются (C1 С 10)алкилом, (С 3-С 7)циклоалкилом, бензилом, или R-карбонил является природным -аминоацилом или природным -аминоацилом-природным -аминоацилом, -C(OH)C(O)OY', где Y' является H, (C1C6)алкилом или бензилом, -C(OY0)Y1, где Y0 является (C1-C4)алкилом и Y1 является (C1-C6)алкилом, карбокси(C1-C6)алкилом, амино(C1-C6)алкилом или моно-N- или ди-N,N-(C1-C6)алкиламиноалкилом,-C(Y2)Y3, где Y2 является H или метилом и Y3 является моно-N- или ди-N,N-(C1-C6)алкиламино, морфолино, пиперидин-1-илом или пирролидин-1-илом. Так же, если соединение в соответствии с настоящим изобретением содержит спиртовую функциональную группу, пролекарство может быть получено заменой атома водорода в спиртовой группе группой,такой как(C1-C6)алканоилоксиметил,1-C1-C6)алканоилокси)этил,1-метил-1-C1C6)алканоилокси)этил, (C1-C6)алкоксикарбонилоксиметил, N-(C1-C6)алкоксикарбониламинометил, сукциноил, (C1-C6)алканоил, -амино (С 1-С 4)алканоил, арилацил и -аминоацил или -аминоацил-аминоацил, где каждый -аминоацил независимо выбирают из природных L-аминокислот, P(O)(OH)2,-P(O)(O(C1-C6)алкил)2 или гликозила (радикала, полученного удалением гидроксильной группы гемиацеталя карбогидрата). Если соединение в соответствии с настоящим изобретением содержит функциональную группу карбоновой кислоты, пролекарство может включать сложный эфир, полученный заменой атома водорода кислотной группы группой, такой как (C1-C8)алкил, (С 2-С 12)алканоилоксиметил, 1-(алканоилокси)этил,имеющей от 4 до 9 атомов углерода, 1-метил-1-(алканоилокси)этил, имеющий от 5 до 10 атомов углерода, алкоксикарбонилоксиметил, имеющий от 3 до 6 атомов углерода, 1-(алкоксикарбонилокси)этил,имеющий от 4 до 7 атомов углерода, 1-метил-1-(алкоксикарбонилокси)этил, имеющий от 5 до 8 атомов-7 011086 углерода, N-(алкоксикарбонил)аминометил, имеющий от 3 до 9 атомов углерода, 1-(N(алкоксикарбонил)амино)этил, имеющий от 4 до 10 атомов углерода, 3-фталидил, 4-кротонолактонил,гамма-бутиролактон-4-ил, ди-N,N-(C1-C2)алкиламино(С 2-С 3)алкил (такой как -диметиламиноэтил), карбамоил-(C1-C2)алкил, N,N-ди(С 1-С 2)алкилкарбамоил-(С 1-С 2)алкил и пиперидино-, пирролидино- или морфолино(С 2-С 3)алкил. В общем, соединения формулы (I) в соответствии с настоящим изобретением могут быть получены способами, известными в области химии, особенно применительно к представленному описанию. Определенные способы получения соединений формулы (I) в соответствии с настоящим изобретением показаны на представленных ниже схемах реакций. Другие способы описаны в экспериментальном разделе. Способы, описанные в схемах и примерах, представлены для иллюстрации настоящего изобретения и не ограничивают его никаким образом. Некоторые из исходных веществ для реакций, представленных на схемах и в примерах, получают как показано ниже. Все другие исходные соединения могут быть получены из известных коммерческих источников, таких как Sigma-Aldrich Corporation, St. Louis, МО. В представленном ниже описании используются следующие аббревиатуры: ВОС - трет-бутоксикарбонил,Cbz - бензилоксикарбонил,ДМФА - N,N-диметилформамид,NMP - N-метил-2-пирролидинон,DMAC - N,N-диметилацетамид,ДМЭ - диметоксиэтан,ДМСО - диметилсульфоксид,EtOAc - этилацетат,EtOH - этанол,MeOH - метанол,ТФК - трифторуксусная кислота,ТФУА - трифторуксусный ангидрид,ТЭА - триэтиламин,ТГФ - тетрагидрофуран,DIPEA - диизопропилэтиламин,EDC - 1-(3-диметиламинопропил)-3-карбодиимид,DCC - дициклогексилкарбодиимид,CDI - 1,1'-карбонилдиимидазол,HATU - гексафторфосфат О-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония,НОАТ - 1-гидрокси-7-азабензотриазол,HOBT - N-гидроксибензотриазол иEEDQ - 2-этокси-1-этоксикарбонил-1,2-дигидрохинолин. Обобщенный способ получения соединений формулы (I) изображен на схеме 1 ниже. Схема 1 На схеме 1 с соединения формулы (II), полученного как описано на схеме 2, где Р является азотзащитной группой, снимают защиту известными методами. Если Р является ВОС, снятие защиты обычно проводят первой обработкой соединения (II), растворенного в растворителе, таком как EtOAc, эфир, диоксан или вода, при необязательном охлаждении при подходящей температуре, такой как около 0 С, с кислотой (например, хлористым водородом) в течение подходящего периода времени, например от около 5 мин до около часа. Раствор нагревают до комнатной температуры (КТ), перемешивают в течение дополнительного количества времени, обычно в течение от 30 мин до около 16 ч. Предпочтительно, реакционную смесь перемешивают в течение около 15 мин, нагревают до комнатной температуры, затем перемешивают в течение еще 30 мин. Альтернативно, соединение (II) растворяют в ТФК и, через подходящий период времени (например, от около 30 мин до около 24 ч), избыток ТФК удаляют в вакууме и остаточный продукт растирают с растворителем, таким как эфир. Если Р является Cbz, снятие защиты проводят гидрогенолизом в присутствии катализатора, такого как 10% палладий или гидроксид палладия, в подходящем растворителе, таком как EtOH или EtOAc, при давлении от около 30 ф./д 2 до около 60 ф./д 2,в течение достаточного периода времени, обычно в течение ночи, при температуре от около 20 до около 80 С. Предпочтительно, гидрогенолиз проводят при давлении около 45 ф./д 2 при комнатной температуре.-8 011086 Соединения формулы (II) могут быть получены сочетанием подходящим образом замещенного производного карбоновой кислоты (III) с подходящим образом замещенным производным амина (IV), как показано на схеме 2 ниже. Схема 2 Сочетание обычно проводят объединением соединений (III) и (IV) в инертном к реакции растворителе, предпочтительно апротонном растворителе, таком как ацетонитрил, дихлорметан, ДМФ, ТГФ или хлороформ. Затем добавляют связующий агент, такой как EDC, HATU, DCC, EEDQ, CDI, пивалоилхлорид или диэтилфосфорилцианид, необязательно в присутствии основания, такого как ТЭА или пиридин,и, необязательно, в присутствии адъюванта, такого как НОВТ или НОАТ. Сочетание обычно проводят при температуре от около 0 до около 50 С, в течение подходящего периода времени, например от около 1 до около 24 ч, например около 16 ч. Обсуждение других условий, используемых для сочетания карбоновых кислот, представлено в Houben-Weyl, Vol. XV, Part II, Е. Wunsch, Ed., G. Theime Veriag. (1974),Stuttgart; M. Bodansky. "Principles of Peptide Synthesis". Springer-Veriag Berlin (1984); и "The Peptides:Analysis, Synthesis and Biology" (ed. E. Gross and J. Meienhpfer), Vols. 1-5 (Academic Press NY 1979-1983). Соединения формул (III) и (IV) могут быть получены известными способами или, альтернативно, согласно примерам способов получения, описанным ниже. Примеры способов получения аминов формулы (IV) представлены в публикации международной заявкиWO 2003/101958 и в патенте США 6710040,описание которых включено в данное описание посредством ссылки. Альтернативно, соединения формулы (II) могут быть получены как описано на схеме 3. Схема 3 На схеме 3 соединения формулы (II) получают восстановительным аминированием защищенного кетона (V), полученного, как показано на схеме 4 ниже, с подходящим образом замещенным гетероциклоалкиламином (VI). Такие реакции аминирования хорошо известны специалистам в данной области. См., например, A.F. Abdel-Magid et at., J. Org. Chem., 61, 3849 (1996); R.F. Borch et al., J. Am. Chem. Soc.,93,2897 (1971); and S. Bhattacharyya et al., Synlett, 1079 (1995). Амины формулы (VI) хорошо известны в данной области и могут быть получены из коммерческих источников или получены известными методами. См., например, D.A. Horton et al., Chem. Rev., 102, 893-930 (2003). H. Fukui et al., Heterocycles, 56,257-264 (2002). M.Y. Chu-Moyer et al., J. Org. Chem., 60, 5721-5725 (1995). и J.P. Yevich et al., J. Med.Chem., 29, 359-369 (1986). Обычно соединения (V) и (VI) конденсируют в присутствии восстанавливающего агента, такого как боргидрид натрия, цианоборгидрид натрия, триацетоксиборгидрид натрия, триацетоксиборгидрид тетраметиламмония или водород, в присутствии катализатора (10% Pd/C, оксид платины и т.д.), необязательно в присутствии кислоты (например, уксусной кислоты (АсОН), хлористо-водородной кислоты и т.д.). Сочетание обычно проводят в инертном к реакции растворителе, таком как 1,2-дихлорэтан, ТГФ, ДМФ,EtOH или MeOH. Реакцию проводят при подходящей температуре, такой как от 0 до 50 С, в подходящий период времени, например от около 1 до около 24 ч, например в течение около 16 ч. Соединения формулы (V) могут быть получены, как описано на схеме 4 ниже, начиная с соответствующей коммерчески доступной карбоновой кислоты (VII), кетокарбоновой кислоты (IX) или кетоэфира На схеме 4, стадия 1, защищенную кислоту (VII) подвергают сочетанию с амином (IV), как описано выше на схеме 2, с получением спирта (VIII). На схеме 4, стадия 2, спирт (VIII) окисляют до кетона (Va) обработкой соединения (VIII) окисляющим агентом в инертном к реакции растворителе. Примеры подходящих окисляющих агентов включают пиридин/триоксид серы в ДМСО; водный гипохлорит натрия в присутствии бромида натрия и свободнорадикального катализатора TEMPO (2,2,6,6-тетраметил-1-пиперидинилокси); реагенты на основе хрома,такие как триоксид хрома, дихромат пиридиния или хлорхромат пиридиния; и оксалилхлорид в ДМСО в присутствии третичного амина. Примеры инертного к реакции растворителя включают дихлорметан,EtOAc, толуол или пиридин. Окисление обычно проводят при температуре от около -78 до около 50 С, в течение от около 1 до около 24 ч, например в течение около 16 ч. Такие реакции окисления хорошо известны специалистам в данной области. См., например, М. Tamaki et al., J. Org. Chem., 66, 3593 (2001) иX-l. Qiu et al., J. Org. Chem., 67. 7162 (2002). На схеме 4, стадия 3, защищенную кетокарбоновую кислоту (IX) сначала подвергают сочетанию с амином (IV), как показано на схеме 2 ниже, с получением соединения (Va), которое затем алкилируют с получением кетона (V). Алкилирование обычно проводят образованием енамина в результате взаимодействия кетона (Va) с вторичным амином, например пирролидином, пиперидином или морфолином, с последующей обработкой алкилирующим агентом, необязательно в присутствии основания, такого как карбонат калия. Обычно реакцию проводят в растворителе, таком как бензол, толуол, ацетонитрил или диоксан. Такие превращения хорошо известны специалистам в данной области. См., например, G. Storket al., Tetrahedron, 51, 4195 (1995). На схеме 4, стадия 5, защищенный кетоэфир (X), где R является алкильной или арилалкильной группой, алкилируют в условиях, описанных для стадии 4 получения кетоэфира (XI). На схеме 4, стадия 6, кетоэфир (XI) омыляют с получением соответствующей карбоновой кислоты,которую на стадии 7 подвергают сочетанию с подходящим образом замещенным амином (IV), как описано выше на схеме 2. Стадию омыления обычно проводят растворением соединения (XI) в смешиваемом с водой растворителе, таком как MeOH или EtOH, и воде в присутствии основания, такого как гидроксид лития или гидроксид натрия. Омыление проводят при подходящей температуре, такой как от около 0 до около 100 С, предпочтительно, при комнатной температуре, в течение подходящего периода времени, например от около 1 до около 24 ч, например в течение около 16 ч. Предпочтительно, фармацевтическая композиция в соответствии с настоящим изобретением содержит терапевтически эффективное количество соединения формулы (IA) или его пролекарства, фармацевтически приемлемой соли соединения, или пролекарства, или сольвата соединения, пролекарства или соли, и фармацевтически приемлемый носитель, наполнитель, разбавитель или эксципиент. Более предпочтительно, фармацевтическая композиция в соответствии с настоящим изобретением содержит терапевтически эффективное количество соединения (3,3-дифторпирролидин-1-ил)-2S,4S)-4(4-(пиримидин-2-ил)пиперазин-1-ил)пирролидин-2-ил)метанона или его пролекарства, фармацевтически приемлемой соли указанного соединения, или пролекарства, или сольвата указанного соединения, пролекарства или соли, и фармацевтически приемлемый носитель, наполнитель, разбавитель или эксципиент.- 10011086 Фармацевтические композиции, полученные объединением соединений в соответствии с настоящим изобретением и фармацевтически приемлемых носителей, наполнителей или разбавителей, затем легко вводят в различных дозированных формах, таких как таблетки, порошки, пастилки, сиропы, растворы для инъекций и подобные. Такие фармацевтические композиции могут, при желании, содержать дополнительные ингредиенты, такие как вкусовые добавки, связующие агенты, эксципиенты и подобные. Таким образом, для перорального введения могут использоваться таблетки, содержащие различные эксципиенты, такие как цитрат натрия, карбонат кальция и/или фосфат кальция, вместе с различными разрыхлителями, такими как крахмал, альгиновая кислота и/или определенные комплексные силикаты,вместе со связующими агентами, такими как поливинилпирролидон, сахароза, желатин и/или аравийская камедь. Кроме того, для получения таблеток часто используют смазывающие агенты, такие как стеарат магния, лаурилсульфат натрия и тальк. Твердые композиции подобного типа также могут применяться в качестве наполнителей для мягких и твердых желатиновых капсул. Предпочтительные материалы для этих целей включают лактозу или молочный сахар и полиэтиленгликоли с высокой молекулярной массой. Если для перорального применения желательны водные суспензии или эликсиры, активный фармацевтический агент в них может быть объединен с различными подсластителями или вкусовыми добавками, красителями и, при желании, эмульгирующими или суспендирующими агентами, вместе с разбавителями, такими как вода, этанол, пропиленгликоль, глицерин и/или их сочетания. Для парентерального введения применяются растворы соединений или композиций в соответствии с настоящим изобретением в конопляном или арахисовом масле, водном пропиленгликоле или в стерильных водных растворах. Такие водные растворы должны быть подходящим образом забуферены, при необходимости, и водный разбавитель должен быть сделан изотоничным достаточным количеством физиологического раствора или глюкозы. Такие конкретные водные растворы особенно подходят для внутривенного, внутримышечного, подкожного и внутрибрюшинного введения. Применяемая для этих целей стерильная водная среда является легко получаемой стандартными методиками, известными специалистам в данной области. Для интраназального введения или введения ингаляцией соединения или композиции в соответствии с настоящим изобретением обычно вводят в виде раствора или суспензии из контейнера с помповым распылением, приводимого пациентом в действие нажатием или накачкой, или в виде аэрозольного спрея из контейнера под давлением или распылителя с использованием подходящего газа-вытеснителя,например дихлордифторметана, трихлорформетана, дихлортетрафторэтана, диоксида углерода или другого подходящего газа. В случае применения аэрозоля под давлением, дозировка может определяться с помощью клапана, который выпускает отмеренное количество. Контейнер под давлением или распылитель может содержать раствор или суспензию соединения в соответствии с настоящим изобретением. Капсулы и картриджи (сделанные, например, из желатина) для применения в ингаляторе или аппарате для вдувания, могут быть получены таким образом, чтобы содержать порошковую смесь соединения или соединений в соответствии с настоящим изобретением и подходящую порошковую наполнитель, такую как лактоза или крахмал. Способы получения различных фармацевтических композиций с определенным количеством активного ингредиента известны специалистам в данной области или станут очевидны им в свете данного описания. Примеры способов получения фармацевтических композиций представлены в Remington'sPharmaceutical Sciences, Mack Publishing Company, Easton, Pa., 19th Edition (1995). В другом аспекте настоящее изобретение относится к фармацевтической композиции, которая содержит терапевтически эффективное количество первого соединения формулы (I), его пролекарства и фармацевтически приемлемой соли указанного соединения или пролекарства; второе соединение, которое представляет собой противодиабетический агент, выбранный из инсулина и аналогов инсулина; инсулинотропина; бигуанидов; 2-антагонистов и имидазолинов; глитазонов; ингибиторов редуктазы альдозы; ингибиторов фосфорилазы гликогена; ингибиторов дегидрогеназы сорбита; ингибиторов окисления жирных кислот; ингибиторов -глюкозидазы; -агонистов; ингибиторов фосфодиэстеразы; агентов,снижающих жиры; агентов против ожирения; ванадата и комплексов ванадия и комплексов пероксованадия; антагонистов амилина; антагонистов глюкагона; стимуляторов секреции гормона роста; ингибиторов глюконеогенеза; аналогов соматостатина; антилиполитических агентов; пролекарство противодиабетических агентов или фармацевтически приемлемую соль противодиабетических агентов и пролекарств. В другом аспекте настоящее изобретение относится к набору, включающему первую лекарственную форму, содержащую соединение формулы (I) или его пролекарство или фармацевтически приемлемую соль соединения или пролекарства, сольват соединения, пролекарства или соли; и вторую лекарственную форму, содержащую противодиабетический агент, выбранный из инсулина и аналогов инсулина; инсулинотропина; бигуанидов; 2-антагонистов и имидазолинов; глитазонов; ингибиторов редуктазы альдозы; ингибиторов фосфорилазы гликогена; ингибиторов дегидрогеназы сорбита; ингибиторов окисления жирных кислот; ингибиторов -глюкозидазы; -агонистов; ингибиторов фосфодиэстеразы; агентов, снижающих жиры; агентов против ожирения; ванадата и комплексов ванадия и комплексов пероксо- 11011086 ванадия; антагонистов амилина; антагонистов глюкагона; стимуляторов секреции гормона роста; ингибиторов глюконеогенеза; аналогов соматостатина; антилиполитических агентов; пролекарство противодиабетических агентов или фармацевтически приемлемую соль противодиабетических агентов и пролекарств; и контейнер, содержащий первую дозированную форму (а) и вторую дозированную форму (b). В предпочтительном варианте осуществления набора как первая, так и вторая дозированные формы независимо содержат фармацевтически приемлемый носитель или разбавитель. В другом аспекте настоящее изобретение относится к способу ингибирования дипептидилпептидазы IV, включающему введение млекопитающему, нуждающемуся в таком лечении, терапевтически эффективного количества соединения формулы (I) или его пролекарства, фармацевтически приемлемой соли указанного соединения, или пролекарства, или сольвата указанного соединения, пролекарства или соли; либо в чистом виде, либо в сочетании с противодиабетическим агентом, описанным выше. В другом аспекте настоящее изобретение относится к способу лечения состояния, опосредованного ингибированием дипетидилпептидазы IV, включающему введение млекопитающему, нуждающемуся в таком лечении, терапевтически эффективного количества соединения (I) или его пролекарства, фармацевтически приемлемой соли указанного соединения, или пролекарства, или сольвата указанного соединения, пролекарства или соли; либо в чистом виде, либо в сочетании с противодиабетическим агентом,описанным выше. В одном из вариантов осуществления лечимым состоянием является диабет 2 типа, диабет 1 типа,нарушенная толерантность к глюкозе, гипергликемия, метаболический синдром (синдром X и/или синдром резистентности к инсулину), глюкозурия, метаболический ацидоз, артрит, катаракта, диабетическая невропатия, диабетическая нефропатия, диабетическая ретинопатия, диабетическая кардиомиопатия,ожирение, состояния, осложненные ожирением, гипертензия, гиперлипидемия, атеросклероз, остеопороз,хрупкость, потеря костной ткани, перелом костей, острый коронарный синдром, низкий рост вследствие дефицита гормона роста, бесплодие вследствие синдрома поликистоза яичников, тревога, депрессия, бессонница, хроническая усталость, эпилепсия, расстройства питания, хроническая боль, алкогольная зависимость, заболевания, связанные с моторикой кишечника, язвы, синдром раздраженной толстой кишки,синдром воспаления толстой кишки; синдром короткой толстой кишки; и профилактика развития заболеваний при диабете 2 типа. В предпочтительном варианте осуществления подвергаемым лечению состоянием является диабет 2 типа. В другом аспекте настоящее изобретение относится к способу идентификации агента, способствующего секреции инсулина при диабете, включающему введение агента формулы (I) не получающей пищи KK/H1J мыши с симптомами диабета; и оценку реакции мыши на последующую пероральную стимуляцию глюкозой, в котором, если у данной мыши наблюдается улучшение симптомов, указанный агент идентифицируют для лечения диабета 2 типа, диабета 1 типа, нарушенной толерантности к глюкозе, гипергликемии, метаболического синдрома (синдрома X и/или синдрома резистентности к инсулину),глюкозурии, метаболическог оацидоза, артрита, катаракты, диабетической невропатии, диабетической нефропатии, диабетической ретинопатии, диабетической кардиомиопатии, ожирения, состояний, осложненных ожирением, гипертензии, гиперлипидемии, атеросклероза, остеопороза, хрупкости, потери костной ткани, перелома костей, острого коронарного синдрома, низкого роста вследствие дефицита гормона роста, бесплодия вследствие синдрома поликистоза яичников, тревоги, депрессии, бессонницы, хронической усталости, эпилепсии, расстройств питания, хронической боли, алкогольной зависимости, заболеваний, связанных с моторикой кишечника, язв, синдрома раздраженной толстой кишки, синдрома воспаления толстой кишки; синдрома короткой толстой кишки; и профилактики развития заболеваний при диабете 2 типа. Настоящее изобретение также относится к терапевтическим способам лечения или профилактики указанных выше состояний у млекопитающих, включая человека, в которых соединение формулы (I) в соответствии с настоящим изобретением вводят как часть соответствующего режима дозирования, разработанного для получения всех преимуществ данной терапии. Соответствующий режим дозирования,количество каждой вводимой дозы и интервалы между дозированием соединения зависят от применяемого соединения формулы (I) в соответствии с настоящим изобретением, типа применяемой фармацевтической композиции, характеристик подвергаемого лечению пациента и тяжести состояний. В общем, эффективная доза для соединений в соответствии с настоящим изобретением составляет от 0,01 до 30 мг/кг/день, предпочтительно от 0,01 до 5 мг/кг/день активного соединения однократной или многократными дозами. Однако может быть необходимым некоторое изменение дозы в зависимости от состояния подвергаемого лечению пациента. В любом случае специалист, ответственный за дозирование,определяет соответствующую дозу для конкретного пациента. Специалистам в данной области будет понятно, что кг относится к массе пациента, измеренной в килограммах. Соединения или композиции в соответствии с настоящим изобретением могут вводиться однократной (например, один раз в сутки) или многократными дозами или через постоянное вливание. Соединения в соответствии с настоящим изобретением также могут вводиться отдельно или в сочетании с фармацевтически приемлемыми носителями, наполнителями или разбавителями, однократно или много- 12011086 кратными дозами. Подходящие фармацевтические носители, наполнители и разбавители включают инертные твердые разбавители или наполнители, стерильные водные растворы и различные органические растворители. Соединения или композиции в соответствии с настоящим изобретением могут вводиться пациенту,нуждающемуся в таком лечении, различными удобными способами введения, включая пероральный и парентеральный (например, внутривенно, подкожно или внутримозговым введением). Далее, фармацевтические композиции в соответствии с настоящим изобретением могут вводиться интраназально, в виде суппозиториев или с использованием растворимой композиции, т.е. композиции, при которой лекарственное средство растворяется во рту без необходимости применения воды. Иллюстративные примеры. Если не указано иначе, все реагенты получены из коммерческих источников. Флэш-хроматографию проводят методом, описанным W.С. Still et al., в J. Org. Chem. 1978, 43, 2923. Примеры получения. Соединения и промежуточные соединения в соответствии с настоящим изобретением обычно называют согласно рекомендациям IUPAC (Международного союза теоретической и прикладной химии) по правилам Номенклатуры органической химии и Каталога CAS. Пример получения 1. трет-Бутил-(2S)-2-[(3,3-дифторпирролидин-1-ил)карбонил]-4-оксопирролидин-1-карбоксилат. Стадия 1. трет-Бутил-(2S,4R)-2-[(3,3-дифторпирролидин-1-ил)карбонил]-4-гидроксипирролидин-1 карбоксилат. ТЭА (0,77 мл, 5,5 ммоль) добавляют к суспензии гидрохлорида 3,3-дифторпирролидина (0,79 г,5,5 ммоль; Synlett, 55 (1995 в 10 мл дихлорметана. Через 5 мин добавляют (4R)-1-(третбутоксикарбонил)-4-гидрокси-L-пролин (1,16 г, 5 ммоль), НОВТ (0,74 г, 5,5 ммоль) и EDC (1,05 г,5,5 ммоль). После перемешивания реакционной смеси в течение ночи смесь промывают последовательно насыщенным бикарбонатом натрия и насыщенным раствором соли, сушат над сульфатом магния, фильтруют и концентрируют. Остаток очищают хроматографией (Biotage Flash 40S (A Dynax Corp.; Charlottesville, VA), 9:1 дихлорметан:метанол) с получением 1,07 г светло-розовой пены. Дополнительный продукт (0,26 г) получают повторным экстрагированием водного слоя дихлорметаном с получением общего выхода 1,33 г (83%). МС m/z 321 (МН+). Стадия 2. ДМСО (0,57 мл, 8 ммоль) в 3 мл дихлорметана по каплям добавляют к раствору оксалилхлорида(0,38 мл, 4,4 ммоль) в 10 мл дихлорметана при температуре -65 С. Через 5 мин добавляют раствор продукта со стадии 1 (1,28 г, 4 ммоль) в 20 мл дихлорметана. Через 15 мин добавляют ТЭА (2,79 мл,20 ммоль). Реакционную смесь нагревают до КТ. Через 2 ч смесь выливают на лед. Органический слой отделяют, последовательно промывают 10% раствором NaHCO3 и насыщенным раствором соли, сушат(MgSO4) и концентрируют. Остаток очищают хроматографией (Biotage Flash 40S, 95:5 дихлорметан:MeOH) с получением 765 мг (60%) указанного в заголовке соединения. МС m/z 319 (МН+). Альтернативно,трет-бутил-(2S)-2-[(3,3-дифторпирролидин-1-ил)карбонил]-4-оксопирролидин-1 карбоксилат может быть получен согласно следующей методике. 1-(трет-Бутоксикарбонил)-4-оксо-L-пролин (6,88 г, 30 ммоль) НОВТ (4,46 г, 33 ммоль), EDC(6,326 г, 33 ммоль) и гидрохлорид 3,3-дифторпирролидина (4,25 г, 31,5 ммоль) растворяют в 100 мл дихлорметана и реакционную смесь охлаждают до температуры 0 С на ледяной бане перед добавлением ТЭА (8,4 мл, 60 ммоль). Затем реакционную смесь нагревают до КТ. После перемешивания в течение ночи добавляют насыщенный бикарбонат натрия (100 мл) и водный слой экстрагируют дихлорметаном. Объединенные органические слои промывают насыщенным раствором соли, сушат над сульфатом магния, фильтруют и концентрируют. Остаток очищают хроматографией (Biotage Flash 40 М, элюируя смесью 1:10 дихлорметан:гексан) с получением 7,85 г указанного в заголовке соединения (выход 82%). МС (EI) m/z 319,3 (МН+). Пример получения 2. трет-Бутил-(2S)-2-[(3R,4S)-3,4-дифторпирролидин-1-ил]карбонил-4-оксопирролидин-1 карбоксилат. Стадия 1. трет-Бутил-(2S,4R)-2-[(3R,4S)-3,4-дифторпирролидин-1-ил]карбонил-4-гидроксипирролидин-1-карбоксилат.(4R)-1-(трет-бутоксикарбонил)-4-гидрокси-L-пролин (2,31 г, 10 ммоль) подвергают сочетанию с гидрохлоридом (3R,4S)-rel-3,4-дифторпирролидина (1,44 г, 10 ммоль, пример получения 4) по методике,аналогично описанной в примере получения 1, стадия 1, с получением 2,15 г (67%) указанного в заголовке соединения в виде не совсем белой пены. МС m/z 321 (МН+). Стадия 2. Продукт со стадии 2 (1,97 г, 6,15 ммоль) окисляют по методике, аналогично описанной в примере получения 1, стадия 2, с получением 0,74 г (38%) указанного в заголовке соединения в виде светло- 13011086 желтого твердого вещества. МС m/z 319 (МН+). Пример получения 3.(4S)-1-(трет-Бутоксикарбонил)-4-(4-пиримидин-2-илпиперазин-1-ил)-L-пролин. 1-(трет-Бутоксикарбонил)-4-оксо-L-пролин (1,0 г, 4,4 ммоль), 2-пиперазин-1-илпиримидин (0,73 г,4,4 ммоль) и уксусную кислоту (275 мкл, 4,6 ммоль) растворяют в 20 мл безводного 1,2-дихлорэтана и добавляют триацетоксиборгидрид натрия (1,85 г, 8,7 ммоль). После перемешивания при КТ в течение 24 ч реакционную смесь гасят насыщенным NaHCO3. pH доводят до 7 добавлением твердого NaHCO3 и концентрированной HCl, смесь экстрагируют дихлорметаном, сушат над MgSO4, фильтруют и концентрируют с получением 1,0 (61%) неочищенного вещества, которое является достаточно чистым для дальнейшего применения. МС m/z 378 (МН+). Пример получения 4. Гидрохлорид (3R,4S)-rel-3,4-дифторпирролидина. Стадия 1. Бензиловый эфир 2,5-дигидропиррол-1-карбоновой кислоты. 3-Пирролин (10 г, 0,145 моль) добавляют к суспензии бикарбоната натрия (14 г, 0,17 моль) в толуоле (100 мл). Смесь охлаждают до температуры 0 С и по каплям добавляют бензилхлорформиат (23 мл,0,16 моль). После перемешивания в течение ночи раствор разбавляют дихлорметаном, промывают холодной водой и насыщенным раствором соли, сушат над сульфатом магния и концентрируют до бледножелтого масла, которое перегоняют в вакууме. Т.кип. 119-126 С (0,32 мм). Стадия 2. Бензиловый эфир 6-оксо-3-азабицикло[3.1.0]гексан-3-карбоновой кислоты. Указанное в заголовке соединение со стадии 1 (3,0 г, 15 ммоль) растворяют в смеси ацетонитрила(100 мл) и воды (70 мл), содержащей тетраацетат этилендиамина, дигидрат динатриевой соли (11 мл,0,03 ммоль). Раствор охлаждают до температуры 0 С и добавляют 1,1,1-трифторацетон (14,5 мл,160 ммоль) в течение 10 мин. Порциями добавляют пероксимоносульфат калия (45 г, 74 ммоль) в течение 40 мин, сохраняя pH на уровне 7 добавлением бикарбоната натрия. Смесь перемешивают при температуре 0 С в течение 1,5 ч, затем выливают в воду и экстрагируют дихлорметаном. Объединенные экстракты сушат над сульфатом магния и концентрируют до бесцветного масла (3,45 г, 100%). Стадия 3. Бензиловый эфир (3RS,4RS)-3-фтор-4-гидроксипирролидин-1-карбоновой кислоты. Смесь тригидрофторида ТЭА (1,96 мл, 12 ммоль) и указанное в заголовке соединение со стадии 2(2,62 г, 12 ммоль) нагревают до температуры 155 С в течение 3 ч, охлаждают и распределяют между водой и дихлорметаном. Водную фазу снова экстрагируют дихлорметаном и объединенные органические экстракты промывают насыщенным раствором соли, сушат над сульфатом магния и концентрируют. Остаток очищают флэш-хроматографией (1% метанол в дихлорметане) с получением указанного в заголовке соединения в виде бледного масла (1,14 г, 40%). Стадия 4. Бензиловый эфир (3R, 4S)-rel-3,4-дифторпирролидин-1-карбоновой кислоты. Раствор указанного в заголовке соединения со стадии 3 в дихлорметане (15 мл) охлаждают до температуре -50 С и добавляют трифторид [бис(2-метоксиэтил)амино]серы (1,3 мл, 6,9 ммоль). Раствор нагревают до комнатной температуры в течение 18 ч, затем распределяют между водой и EtOAc. Водную фазу снова экстрагируют EtOAc и объединенные органические экстракты промывают насыщенным раствором соли, сушат над сульфатом магния и концентрируют. Остаток очищают флэш-хроматографией(дихлорметан) с получением продукта в виде коричневого масла (1,14 г, 40%). Стадия 5. Раствор указанного в заголовке соединения со стадии 4 (675 мг, 2,8 ммоль) в EtOH (10 мл), содержащем 10% Pd/C (200 мг), гидрируют при давлении 40 ф./д 2 в аппарате Пара в течение 18 ч. Раствор фильтруют через диатомовую землю и фильтрат концентрируют досуха с получением желтого твердого вещества (400 мг, 100%). Пример получения 5. трет-Бутиловый эфир (S)-2-(3-фторазетидин-1-карбонил)-4-оксопирролидин-1-карбоновой кислоты. Стадия 1. Гидрохлорид бензгидрил-3-фторазетидина. 1-Бензгидрилацетидин-3-ол (5,0 г, 20,9 ммоль) растворяют в 50 мл бензола, раствор охлаждают до температуры 15 С и по каплям добавляют трифторид (диэтиламино)серы (10,1 г, 62,7 ммоль). После перемешивания в течение ночи при комнатной температуре добавляют насыщенный бикарбонат натрия. Смесь экстрагируют EtOAc, сушат над сульфатом магния, фильтруют и концентрируют. Остаток очищают хроматографией (Biotage 40S, 10% EtOAc/гексан). Продукт растворяют в EtOAc, обрабатываютHCl (15 мл, 2N в эфире), быстро нагревают и концентрируют. Твердое вещество растирают с эфиром,фильтруют и сушат с получением 2,58 г указанного в заголовке соединения. МС m/z 242,3 (МН+). Стадия 2. Гидрохлорид 3-фторазетидина. Раствор продукта со стадии 1 (2,58 г, 9,3 ммоль) в 30 мл метанола, содержащего 10% Pd/C (0,38 г),гидрируют при давлении 30-50 ф./д 2 в аппарате Пара в течение 60 ч. Раствор фильтруют через диатомовую землю и фильтрат концентрируют досуха. Твердое вещество перекристаллизовывают изN-трет-Вос-4-оксо-L-пролин (917 мг, 4 ммоль), указанное в заголовке соединение со стадии 2(446 мг, 4 ммоль) и HATU (1,673 г, 4,4 ммоль) смешивают в атмосфере азота в безводном метиленхлориде. Раствор охлаждают на ледяной бане перед добавлением ДИЭА (1,4 мл, 8 ммоль). Реакционную смесь нагревают до КТ и перемешивают в течение ночи. Добавляют насыщенный бикарбонат натрия, фазы разделяют и водную фазу экстрагируют метиленхлоридом. Объединенные органические части промывают насыщенным раствором соли и сушат над сульфатом магния. Неочищенный продукт (2,11 г) очищают хроматографией (Biotage Flash 40S, 95:5 EtOAc:MeOH) с получением указанного в заголовке соединения в виде светло-розовой пены (1,06 г, 92%). МС m/z 287,3 (МН+). Пример получения 6. трет-Бутиловый эфир (S)-2-S)-3-фторпирролидин-1-карбонил)-4-оксопирролидин-1-карбоновой кислоты.N-трет-Вос-4-оксо-L-пролин (2,29 г, 10 ммоль), гидрохлорид (S)-3-фторпирролидина (1,38 г,11 ммоль) и ТЭА (2,09 мл, 15 ммоль) смешивают в безводном метиленхлориде (30 мл) в атмосфере азота. Добавляют НОВТ (2,03 г, 15 ммоль) и смесь охлаждают до температуры 0 С на ледяной бане перед добавлением EDC (2,20 г, 11 ммоль). Реакционную смесь нагревают до КТ и перемешивают в течение ночи. Смесь промывают насыщенным бикарбонатом натрия и насыщенным раствором соли и сушат над сульфатом магния. Неочищенный материал (3,15 г) перекристаллизовывают из смеси гексан:EtOAc (2:1) с получением указанного в заголовке соединения в виде светло-желтых игольчатых кристаллов (2,18 г,73%). МС m/z 301,3 (МН+). Пример получения 7. трет-Бутиловый эфир (2S,4S)-2-(3,3-дифторпирролидин-1-карбонил)-4-пиперазин-1-илпирролидин 1-карбоновой кислоты. Стадия 1. Бензиловый эфир 4-[(3S,5S)-1-трет-бутоксикарбонил-5-(3,3-дифторпирролидин-1 карбонил)пирролидин-3-ил]пиперазин-1-карбоновой кислоты. К раствору указанного в заголовке соединения примера получения 1 (1,59 г, 5 ммоль) и 1(бензилоксикарбонил)пиперазина (1,21 г, 5,5 ммоль) в 1,2-дихлорэтане (20 мл) добавляют АсОН (0,3 мл,1,05 экв.) с последующим добавлением триацетоксиборгидрида натрия (2,119 г, 10 ммоль). Реакционную смесь перемешивают при КТ в течение 4 ч. Добавляют насыщенный бикарбонат натрия и продукт экстрагируют метиленхлоридом. Органическую фазу промывают насыщенным раствором соли и сушат над сульфатом магния. После выпаривания неочищенный продукт (2,28 г желтой пены) очищают флэшхроматографией, элюируя EtOAc, с получением указанного в заголовке соединения в виде белой пены(1,28 г, 49%). МС m/z 523,3 (МН+). Стадия 2. Продукт со стадии 1 (1 г, 1,91 ммоль) растворяют в EtOH (50 мл) и осторожно добавляют 10% Pd/C(1 г, 1 экв. мас./мас.), с последующим добавлением 1,4-циклогексадиена (1,81 мл, 10 экв.). Смесь осторожно перемешивают в плотно закрытой колбе при КТ в течение ночи. Реакционную смесь фильтруют через диатомовую землю и концентрируют с получением продукта в виде желтого полутвердого вещества (785 мг, 100%). МС m/z 389,4 (МН+). Пример получения 8. трет-Бутиловый эфир (S)-2-(3,3-дифторацетидин-1-карбонил)-4-оксопирролидин-1-карбоновой кислоты.(получен, как описано в WO 2000/47582) и DIPEA (0,35 мл, 2 ммоль) смешивают в безводном метиленхлориде (10 мл) и охлаждают до температуры 0 С. Добавляют НОВТ (405 мг, 3 ммоль) одной порцией,затем добавляют гидрохлорид EDC (422 мг, 2,2 ммоль). Реакционную смесь нагревают до КТ и перемешивают в течение ночи. Добавляют насыщенный бикарбонат натрия, органический слой отделяют и водную фазу экстрагируют метиленхлоридом. Объединенные органические экстракты дважды промывают насыщенным раствором соли, сушат над сульфатом магния, фильтруют и концентрируют. Неочищенный продукт (570 мг) растирают со смесью гексан:метиленхлорид (10:1), фильтруют и сушат в вакуумной печи с получением 510 мг (выход 84%) указанного в заголовке соединения в виде светло-оранжевого порошка. МС m/z 305,1 (МН+). Пример получения 9. Гидрохлорид (2S,4S)-4-фторпирролидин-2-карбонитрила. Стадия 1. 1-(2,5-Диоксопирролидин-1-иловый) эфир 2-трет-бутилового эфира (2S,4S)-4 фторпирролидин-1,2-дикарбоновой кислоты. К раствору N-трет-ВОС-цис-4-фтор-L-пролина (700 мг, 3 ммоль) в безводном ДМФА (8 мл) при температуре 0 С добавляют N-гидроксисукцинимид (380 мг, 3,3 ммоль) одной порцией, с последующим добавлением 1,3-диизопропилкарбодиимида (391 мг, 3,1 ммоль) маленькими порциями. Реакционную смесь нагревают до КТ и перемешивают в течение ночи. Смесь разбавляют 100 мл воды, осадок собирают, промывают холодной водой и сушат в вакуумной печи в течение ночи. Продукт (1,093 г) используют без дальнейшей очистки. МС m/z 331,3 (МН+). Стадия 2. трет-Бутиловый эфир (2S,4S)-2-карбамоил-4-фторпирролидин-1-карбоновой кислоты. Указанное в заголовке соединение со стадии 1 (1,03 г, 3,12 ммоль) растворяют в диоксане (12 мл)- 15011086 при КТ и раствор обрабатывают концентрированным водным гидроксидом аммония (10 ммоль) по каплям. Полученный густой раствор перемешивают при КТ в течение 3 ч, затем подкисляют 6N HCl до pH 4-5 и экстрагируют метиленхлоридом (2). Объединенные экстракты промывают насыщенным бикарбонатом натрия и насыщенным раствором соли, сушат над сульфатом магния, фильтруют и концентрируют с получением 562 мг (выход 78%) прозрачного масла. МС m/z 233,3 (МН+). Стадия 3. трет-Бутиловый эфир (2S,4S)-2-циано-4-фторпирролидин-1-карбоновой кислоты. К раствору указанного в заголовке соединения со стадии 2 (550 мг, 2,37 ммоль) и сухого пиридина(0,4 мл, 2 экв.) в безводном метиленхлориде (15 мл) при температуре 0 С добавляют раствор ТФУА в 2 мл метиленхлорида в атмосфере азота. Раствор перемешивают при температуре 0 С в течение 2 ч, затем при КТ в течение 1 ч. Реакционную смесь промывают насыщенным водным бикарбонатом натрия и насыщенным раствором соли, сушат над сульфатом магния, фильтруют и концентрируют. Остаток очищают флэш-хроматографией на силикагеле с получением 458 мг (выход 90%) масла, которое затвердевает при стоянии. МС m/z 215,3 (МН+). Стадия 4. Указанное в заголовке соединение со стадии 3 (400 мг) растворяют в сухом ацетонитриле (8 мл) и добавляют 0,5 мл 4N HCl в диоксане в атмосфере азота. Полученный раствор перемешивают при КТ в течение ночи, полученный белый осадок фильтруют и сушат в вакуумной печи с получением 128 мг (выход 46%) указанного в заголовке соединения. МС m/z 115,1 (МН+). Дополнительный продукт может быть получен из фильтрата. Пример получения 10. Гидрохлорид (2S)-4,4-дифторпирролидин-2-карбонитрила. Стадия 1. N-трет-BOC-4,4-дифторпирролидин-2-карбонитрил. К раствору амида N-трет-ВОС-4,4-дифторпирролидин-L-пролина (250 мг, 1 ммоль) и сухого пиридина (97 мкл, 1,2 экв.) в безводном метиленхлориде при температуре 0 С добавляют раствор ТФУА(252 мг, 1,2 экв.) в 1 мл безводного метиленхлорида. Раствор нагревают до КТ и перемешивают в течение 36 ч. Реакцию гасят насыщенным хлоридом аммония, органическую фазу последовательно промывают 1N HCl, насыщенным бикарбонатом натрия и насыщенным раствором соли, сушат над сульфатом магния, фильтруют и концентрируют с получением 252 мг белого полутвердого вещества. МС m/z 233,1(МН+). Стадия 2. Указанное в заголовке соединение со стадии 1 (245 мг) растворяют в сухом ацетонитриле (10 мл) и добавляют 0,5 мл 4N HCl. Полученный раствор перемешивают при КТ в течение 5 ч и растворители удаляют. Остаток растирают с EtOAc, твердое вещество фильтруют и затем сушат в высоком вакууме с получением 105 (выход 59%) указанного в заголовке соединения в виде белого твердого вещества. МС m/z 133,2 (МН+). Соединения формулы (I), их стереоизомеры и фармацевтически приемлемые соли соединений и стереоизомеров могут быть получены, как описано в представленных ниже примерах. Соединения в соответствии с настоящим изобретением в виде свободных оснований могут быть получены из их солей обычными методами, такими как описано в примере 113 ниже. Пример 1. Дигидрохлорид 2S,4S)-4-(4-(3-(трифторметил)фенил)пиперазин-1-ил)пирролидин-2-ил)-(3,3 дифторпирролидин-1-ил)метанона. Стадия 1. трет-Бутил (2S,4S)-2-[(3,3-дифторпирролидин-1-ил)карбонил]-4-4-[3-(трифторметил)фенил]пиперазин-1-илпирролидин-1-карбоксилат. Указанное в заголовке соединение примера получения 1 (96 мг, 0,3 ммоль), 1-[3-(трифторметил)фенил]пиперазин (70 мг, 0,3 ммоль) и АсОН (18 мкл, 0,3 ммоль) растворяют в 8 мл безводного 1,2 дихлорэтана. Добавляют триацетоксиборгидрид натрия (127 мг, 0,6 ммоль). После перемешивания реакционной смеси при КТ в течение 3 ч, реакцию гасят насыщенным бикарбонатом натрия, экстрагируютEtOAc, промывают насыщенным раствором соли, сушат над сульфатом магния, фильтруют и концентрируют. Неочищенный продукт очищают хроматографией (Biotage Flash 40S, 95:5 дихлорметан:MeOH) с получением 126 мг (79%) указанного в заголовке соединения в виде белой пены. МС m/z 533 (МН+). Стадия 2. Продукт со стадии 1 (120 мг, 0,225 ммоль) обрабатывают 4N HCl в диоксане (5 мл). Через 2 ч при КТ смесь концентрируют досуха, растирают с эфиром, фильтруют и сушат в вакууме с получением 92 мг указанного в заголовке соединения в виде белого твердого вещества. МС m/z 433 (МН+). Используя соответствующие исходные вещества, гидрохлориды соединений примеров 2-112, указанных в табл. 1 ниже, получают по методике, аналогично описанной в примере 1. Стадия 1. трет-Бутиловый эфир (S)-2-(3,3-дифторпирролидин-1-карбонил)-4-оксопирролидин-1 карбоновой кислоты. 1-трет-Бутиловый эфир (S)-4-оксопирролидин-1,2-дикарбоновой кислоты (6,6 кг, 1,0 экв.) загружают в реактор с последующим добавлением дихлорметана (15 объемов). Реакционную смесь охлаждают до температуры 0 С. В течение 30 мин добавляют триэтиламин (4,82 л, 1,2 экв.). Смесь превращается из суспензии в прозрачный раствор в конце добавления триэтиламина. Смесь выстаивают при температуре от 0 до 5 С в течение 10 мин. Медленно добавляют пивалоилхлорид (3,65 кг, 1,05 экв.), сохраняя температуру реакции от 0 до 5 С. Реакционная смесь снова превращается в суспензию. Образец реакционной смеси берут для определения завершения реакции посредством ВЭЖХ (с использованием диэтиламина для получения производного) после выстаивания в течение 1 ч при температуре от 0 до 5 С. В указанную- 23011086 выше смесь загружают гидрохлорид 3,3-дифторпирролидина (4,13 кг, 1,0 экв.) в течение 10 мин при температуре от -10 до 0 С. Медленно добавляют триэтиламин (4,0 л, 1,0 экв.) в течение 70 мин при температуре от -10 до 0 С. После завершения добавления триэтиламина смесь перемешивают в течение 1 ч при температуре от 0 до 5 С. Завершение реакции подтверждают ВЭЖХ (1% исходного вещества). Реакцию гасят водой (10 объемов) при температуре от 0 до 5 С. Смесь нагревают до температуры от 20 до 25 С. Слои разделяют и органический слой промывают 0,5 М HCl (5 объемов). Органический слой снова промывают объединенным 5% NaHCO3 (2 объема) и полунасыщенным раствором соли (1,64 М, 3 объема). Органический раствор концентрируют при атмосферном давлении до плохо перемешиваемого объема(приблизительно 20 л). Добавляют этилацетат (12,6 объемов, 82,8 л), раствор концентрируют при атмосферном давлении до 6 объемов. Смесь выстаивают при температуре от 60 до 65 С в течение 2 ч и охлаждают до комнатной температуры в течение более 3 ч. Смесь выстаивают при температуре от 20 до 25 С в течение 8 ч. Добавляют гептан (8 объемов) и смесь гранулируют в течение минимум 2 ч. Твердое вещество фильтруют, промывают смесью 2:1 гептан/этилацетат (1 объем) и сушат в лотковой сушилке при температуре от 25 до 35 С в течение минимум 12 ч. Выход: 7,26 кг, 79%. Чистота по ВЭЖХ: 99,7%. Маточный раствор (86 л) концентрируют до 12 л в низком вакууме при температуре от 65 до 70 С. Смесь охлаждают до температуры от 60 до 65 С. Медленно добавляют этилацетат (4,0 л) в течение 15 мин. Смесь охлаждают до температуры от 20 до 25 С в течение 2 ч и выстаивают при этой температуре в течение по крайней мере 2 ч. Твердое вещество отфильтровывают и промывают смесью гептан/этилацетат(3:1 об./об., 1,7 л). Сушка в лотковой сушилке в течение 12 ч при температуре от 35 до 45 С дает 435 г продукта. Чистота по ВЭЖХ: 96,4%. Стадия 2. трет-Бутиловый эфир (2S,4S)-2-(3,3-дифторпирролидин-1-карбонил)-4-(4-пиримидин-2 илпиперазин-1-ил)пирролидин-1-карбоновой кислоты. В реактор загружают ТГФ (20 объемов), 2-пиперазин-1-илпиримидин (2,17 кг, 1,05 экв.) и продукт со стадии 1 (4,00 кг, 1,0 экв.). Смесь выстаивают при температуре от 20 до 25 С до тех пор, пока все вещества не растворятся, около 30 мин. Добавляют уксусную кислоту (0,792 кг, 1,05 экв.). Смесь перемешивают в течение 1 ч, во время чего реакционная смесь становится мутной. Реакционную смесь кипятят с обратным холодильником в течение 30 мин и затем концентрируют при температуре от 60 до 70 С до тех пор, пока в верхних слоях не установится стабильная температура 66,9 С, что указывает на полное удаление воды из системы. При необходимости добавляют еще ТГФ. В конце добавляют ТГФ для доведения общего объема в реакторе до 15 объемов от лимита реагента. Реакционную смесь охлаждают до температуры от -3 до 7 С и отбирают образец для подтверждения завершения образования имина через ВЭЖХ (с использованием триацетоксиборгидрида натрия для восстановления имина). К суспензии порциями добавляют триацетоксиборгидрид натрия (5,33 кг, 2,0 экв.) при температуре от -5 до 15 С. Реакционную смесь нагревают до температуры от 20 до 25 С и выстаивают в течение 12 ч. Результаты ВЭЖХ подтверждают завершение реакции на 99,8%. Добавляют водный раствор бикарбоната натрия (10% мас./мас., 10 объемов). Суспензию концентрируют с удалением 10 объемов ТГФ в низком вакууме при температуре от 30 до 60 С. К суспензии добавляют этилацетат (10 объемов) после охлаждения до температуры от 20 до 25 С. Органическую фазу отделяют и водную фазу проверяют ВЭЖХ. Она содержит менее 2% продукта. Органическую фазу промывают водой (5 объемов), насыщенным раствором соли(5 объемов) и концентрируют до небольшого объема (2 объема) в низком вакууме при температуре от 45 до 50 С. К суспензии добавляют гептан (10 объемов) при температуре от 45 до 50 С в течение более 30 мин. Смесь охлаждают до температуры от 20 до 25 С и гранулируют в течение 2 ч. Твердое вещество собирают фильтрованием, промывают гептаном (2 объема). Сушка в лоточной сушилке в течение 12 ч при температуре от 35 до 45 С дает 5,35 кг (91,3%) продукта. Стадия 3. (3,3-Дифторпирролидин-1-ил)-[(2S,4S)-4-(4-пиримидин-2-илпиперазин-1-ил)пирролидин 2-ил]метанон. В реактор загружают воду (19 л, 2 объема) с последующим добавлением продукта со стадии 2(9,57 кг, 1,0 экв.). К суспензии медленно добавляют концентрированную HCl (37 мас.% в воде, 19,1 л,2 объема) при температуре от 20 до 30 С в течение более 4 ч. Суспензия превращается в раствор после добавления 12 л HCl. Реакционную смесь охлаждают до температуры от 5 до 15 С. К смеси медленно добавляют 50% водный раствор NaOH при перемешивании до получения от pH 10 до 11. pH тщательно отслеживают с помощью pH-метра во время нейтрализации. Общий объем добавленного 50% NaOH составляет 12,45 л. Смесь нагревают до температуры от 20 до 25 С и дважды экстрагируют этилацетатом(115 л, 12 объемов и 57 л, 6 объемов соответственно). Образец водного слоя после второго экстрагирования анализируют ВЭЖХ, и анализ показывает только 1% продукта в данном водном растворе. Органические слои объединяют и обрабатывают сульфатом магния (5 кг) в течение 1 ч. Смесь фильтруют. Осадок на фильтре промывают этилацетатом (10 л). Фильтрат загружают обратно в реактор через 0,2 микроновый проходной фильтр для безпылевой работы. (Все последующие операции осуществляют в безпылевых условиях.) Раствор концентрируют до 20 л (2 объема) в низком вакууме при температуре от 50 до 60 С. Смесь охлаждают до температуры от 20 до 25 С в течение более 30 мин. При охлаждении до комнатной температуры возникает кристаллизация. Смесь выстаивают в течение 30 мин. Медленно добавляют гексан (20 л, 2 объема) в течение более 1 ч. Смесь гранулируют в течение 2 ч. Твердый продукт- 24011086 собирают фильтрованием и промывают смесью гексан/этилацетат (10 л, 1:1 об./об.). Фильтр продувают азотом в течение минимум 2 ч. Продукт сушат в лотковой сушилке при температуре 44 С в течение 12 ч. Выход: 5,7 кг, 75,9%. Т.пл. 156 С. МС m/z 367 (МН+). 1 Н ЯМР (400 МГц, D2O):8,15 (д, 2 Н, J=5,0 Гц, СН пиримидина), 6,55 (т, 1 Н, J=4,8 Гц, СН пиримидина), 3,87-3,81 (дд, 1 Н, H2b, пролина, ротомер), 3,78-3,50 (м, 4 Н, N-CH2 пирролидина), 3,55-3,40 (м, 4 Н,N-CH2 пиперазина), 2,97 (дд, 1 Н, J=10,2, 6,6 Гц, Н 5 а пролина), 2,85-2,75 (м, 1 Н, H4b пролина), 2,69 (дд, 1 Н,J=10,0, 9,1 Гц, H5b пролина), 2,55-2,20 (м, 7 Н, перекрывание N-CH пиперазана, CH2 пирролидина и H3b пролина), 1,47-1,38 (м, 1 Н, H3a пролина). Альтернативно, дигидрохлорид указанного в заголовке соединения получают по методике примера 1. Пример 114. Дигидрохлорид(2S,4S)-4-(4-пиримидин-2-илпиперазин-1-ил)-2-[(3,3,4,4-тетрафторпирролидин-1 ил)карбонил]пирролидин-1-карбоксилат DIPEA (261 мл, 1,5 ммоль) по каплям добавляют к суспензии указанного в заголовке соединения примера получения 3 (114 мг, 0,3 ммоль), HATU (128 мг, 0,33 ммоль) и гидрохлорида 3,3,4,4-тетрафторпирролидина (54 мг, 0,3 ммоль) в 5 мл дихлорметана. После перемешивания в течение ночи добавляют насыщенный раствор бикарбоната натрия, смесь экстрагируют дихлорметаном, экстракты сушат над сульфатом магния и концентрируют. Остаток очищают хроматографией(Biotage Flash 40S, EtOAc) с получением указанного в заголовке соединения. МС m/z 503 (МН+). Стадия 2. Раствор продукта со стадии 1 в EtOAc/MeOH обрабатывают 4 М HCl в диоксане (около 5 мл). Через 18 ч растворитель удаляют, остаток помещают в ацетонитрил и концентрируют. Твердое вещество помещают в гексан, фильтруют и сушат с получением 50 мг (33%, две стадии) указанного в заголовке соединения. МС m/z 403 (МН+). С использованием подходящих исходных веществ получают гидрохлориды соединений примеров 115-122, указанных в табл. 2, по методике, аналогично описанной в примере 114. Таблица 2 Пример 124. Дигидрохлорид 2S,3R,4S)-4-(3-(трифторметил)пиридин-2-ил)пиперазин-1-ил)-3-метилпирролидин-2-ил)(3,3-дифторпирролидин-1-ил)метанона. Стадия 1. Указанное в заголовке соединение примера получения 1 (5,6 г, 20 ммоль) растворяют в бензоле(50 мл), содержащем 4 А молекулярных сит (7,9 г), и обрабатывают пирролидином (2,0 мл, 24 ммоль). Раствор фильтруют и концентрируют досуха с получением оранжевой пены (7,0 г, 100% выход). Стадия 2. Раствор продукта со стадии 1 (7,0 г, 20 ммоль) в ацетонитриле (100 мл) добавляют к измельченному карбонату калия (5,2 г, 38 ммоль) и обрабатывают метилйодидом (1,5 мл, 24 ммоль). Смесь нагревают до температуры 90 С в течение 16 ч, охлаждают до КТ и концентрируют. Остаток помещают в хлороформ(150 мл) и добавляют смесь АсОН (5 мл) и воды (45 мл). Через 3 ч при КТ слои разделяют, водный слой экстрагируют хлороформом (325 мл), и объединенные органические фазы промывают насыщенным бикарбонатом натрия (225 мл) и насыщенным раствором соли, и концентрируют до коричневого масла. Масло растворяют в эфире (75 мл), фильтруют и концентрируют до бледно-коричневого твердого вещества (0,97 г, 16% выход). Стадия 3. К смеси продукта со стадии 2 (74 мг, 0,25 ммоль), 1-(3-трифторметил)пиридин-2-илпиперазина(63 мг, 0,28 ммоль), АсОН (16 мкл) и ацетата натрия (23 мг, 0,28 ммоль) в MeOH (1 мл) добавляют цианоборгидрид натрия (21 мг, 0,28 ммоль). Смесь перемешивают при КТ в течение 65 ч и затем концентрируют. Остаток помещают в EtOAc (20 мл), раствор промывают 1N гидроксидом натрия (23 мл) и насыщенным раствором соли (5 мл), сушат над сульфатом магния и концентрируют досуха. Остаток очищают препаративной ВЭЖХ (Shimadzu, Columbia, MD; 3050 см Waters-Xterra C18 колонка - Waters Instrument Co., Milford, MA; 30 мл/мин градиент 15% ацетонитрил с 0,1% гидроксида аммония в течение более 10 мин) с получением бесцветного твердого вещества (35,7 мг, выход 26%). Стадия 4.HCl (4 М) в диоксане (0,5 мл) добавляют к раствору продукта со стадии 3 (35 мг, 0,064 ммоль) в ацетонитриле (1 мл). Через 16 ч смесь концентрируют досуха и остаток растирают с простым эфиром (2 мл). Указанное в заголовке соединение получают в виде твердого вещества (32 мг, 96% выход). МС m/z 448,4(МН+). С использованием подходящих исходных веществ получают гидрохлориды соединений примеров 125-127, указанных в табл. 3, по методике, аналогично описанной в примере 124. Таблица 3 Пример 128. Дигидрохлорид (2,4-дифторфенил)-4-[(3S,5S)-5-(3,3-дифторпирролидин-1-карбонил)пирролидин 3-ил]пиперазин-1-илметанона. Стадия 1. трет-Бутиловый эфир (2S,4S)-4-[4-(2,4-дифторбензоил)пиперазин-1-ил]-2-[(3,3 дифторпирролидин-1-карбонил)пирролидин-1-карбоновой кислоты. Указанное в заголовке соединение примера получения 7 (97 мг, 0,25 ммоль), 2,4-дифторбензойной кислоты (40 мг, 0,25 ммоль) и HATU (95 мг, 0,3 ммоль) смешивают в безводном метиленхлориде в атмосфере азота и охлаждают до температуры 0 С на ледяной бане перед добавлением ДИЭА (32 мг, 45 мкл,0,3 ммоль). Реакционную смесь нагревают до КТ и перемешивают в течение ночи. Реакцию гасят насыщенным бикарбонатом натрия и водный слой экстрагируют метиленхлоридом. Объединенные органические экстракты промывают насыщенным раствором соли и сушат над сульфатом магния. Неочищенный продукт очищают флэш-хроматографией с использованием смеси метиленхлорид:MeOH (95:5) с получением конечного продукта в виде белого порошка (132 мг, 100%). МС m/z 529,4 (МН+). Стадия 2. Раствор продукта со стадии 1 в ацетонитриле (120 мг) обрабатывают 4N HCl в диоксане (1 мл). Реакционную смесь перемешивают при КТ в течение ночи и выпаривают. Остаток растворяют в воде,фильтруют и лиофилизируют в течение ночи с получением указанного в заголовке соединения в виде белого порошка (100 мг, 96%). МС m/z 429,2 (МН+). С использованием подходящих исходных веществ получают гидрохлориды соединений примеров 129-133, указанных в табл. 4, по методике, аналогично описанной в примере 128. Биологические методики. Применение соединений формулы (I), их пролекарств и стереоизомеров, и фармацевтически приемлемых солей соединений, пролекарств и стереоизомеров, для лечения или профилактики состояний, перечисленных выше, у млекопитающих может быть продемонстрировано с помощью обычных анализов,известных специалистам в соответствующей области, включая in vivo и in vitro анализы, описанные ниже. Такие анализы также являются средствами, с помощью которых активность соединений формулы (I),их пролекарств и стереоизомеров, и фармацевтически приемлемых солей соединений, пролекарств и стереоизомеров, может быть сравнена с активностью других соединений.In vitro анализ ингибирования DPP-IV. Ингибирование DPP-IV может быть продемонстрировано in vitro в следующем анализе, по адаптированным методам, описанным у Scharpe et al., A. Clin. Chem., 2299 (1988) и Lodja, Z. Czechoslovak Medicine, 181 (1988). 150 мкл раствора ферментного субстрата пипеткой наносят в лунки микротитровального 96-луночного полистирольного планшета и выдерживают при температуре 4 С. Раствор ферментного субстрата содержит 50 мкМ гидрохлорида Gly-Pro-метоксинафтиламида в 50 мМ Tris буфера для анализов pH 7,3, содержащего 0,1 М хлорида натрия, 0,1% (об./об.) Triton и 50 мкЕд./мл DPP-IV (MP Biomedicals, Livermore, CA; исходный раствор DPP-IV 5 мЕд./мл). Добавляют 5 мкл на лунку соединения формулы (I), доводя конечные концентрации соединений формулы (I) в интервале от 3 мкМ до 10 нМ на лунку. Контроль. Фермент не добавляют в 4 лунки в качестве контроля реагента. 5 мкл 3 мМ Diprotin A (Bachera Bioscience, Inc.; King of Prussia, PA) добавляют в четыре лунки в качестве контроля положительного количества, доводя конечную концентрацию Diprotin А до 100 мкМ. Для измерения общей ферментной активности (т.е. отрицательного контроля), без влияния какого-либо соединения формулы (I), 5 мкл дистиллированной воды добавляют в четыре лунки. Все пробы инкубируют в течение ночи (от 14 до 18 ч) при температуре 37 С. Реакцию гасят добавлением 10 мкл раствора Fast Blue В (0,5 мг/мл Fast Blue В) в буфере, содержащем 0,1 М ацетата натрияpH 4,2 и 10% (об./об.) Triton X-100 в каждую лунку с последующим встряхиванием в течение приблизительно 5 мин при комнатной температуре. Планшеты анализируют на спектрофотометре Spectramax (Molecular Devices; Sunnyvale, CA) или эквивалентном оборудовании (максимум абсорбции при 525 нм). Данные IC50 для соединений получают измерением активности DPP-IV в интервале концентрация соединений от 10 нМ до 3 мкМ.In vivo анализ снижения глюкозы. Влияние на снижение глюкозы ингибиторов DPP-IV, включая соединения формулы (I), может быть представлено на 4-6-недельных взрослых мышах KK/H1J (Jackson Labs; Bar Harbor, ME) в контексте перорального теста на толерантность к глюкозе. Пероральные тесты на толерантность к глюкозе (OGTT) применяются на человеке начиная с 1930-х годов, как описано у Pincus et al., Anm. J. Med. Sci., 782 (1934) и обычно применяют для диагностики диабета у человека, хотя не для оценки эффективности терапевтических агентов у человека. Мышей KK используют для оценки: (i) глитазонов (Fujita et al. Diabetes, 804 (1983); Fujiwara et al.,Diabetes, 1549 (1988); и Izumi et al., Biopharm Drug. Dispos., 247 (1997; (ii) метформина (Reddi et al., Diabet. Metabol., 44 (1993; (iii) ингибиторов глюкозидазы (Hamada et al., Jap. Pharmacol. Ther., 17 (1968) и(Kameda et al., Arzneim. Forsch./Drug Res., 39044 (1982) и Multer et al., Horm. Metabl. Res., 469 (1990. Мышей KK получают из полученной разведением линии, впервые полученной и описанной Kondo,et al., Bull. Exp. Anim., 107 (1957). У этих мышей спонтанно развивается наследственная форма полигенных диабетов, которая прогрессирует с причинением почечных, относящихся к сетчатке и неврологиче- 27011086 ских осложнений, аналогичных тем, которые наблюдают у людей с диабетом, однако, им не требуется введение инсулина или других лекарственных средств для выживания. Другой аспект настоящего изобретения относится к применению мышей KK для оценки эффекта стимулирующих секрецию агентов в контексте перорального теста на толерантность к глюкозе. Мышей заставляют голодать в течение ночи (от около 1 до около 18 ч), но дают свободный доступ к воде. После голодания (время t=0) 0,25 мкл крови отбирают из ретро-орбитальной пазухи и добавляют к 0,025% гепаринизированного физиологического раствора (100 мкл) на льду. Затем мышам (10 на группу) перорально вводят раствор соединения формулы (I) в 0,5% метилцеллюлозе (0,2 мл/мышь). Две контрольных группы получают только 0,5% метилцеллюлозу. Во время t=15 мин у мышей берут кровь, как описано выше, и затем им дают 1 мг/кг глюкозы в дистиллированной воде (0,2 мл/мышь). Первой контрольной группе дают глюкозу. Второй контрольной группе дают воду. Во время t=45 мин у мышей снова берут кровь, как описано выше. Образцы крови центрифугируют, плазму собирают и анализируют на содержание глюкозы на анализаторе глюкозы Roche-Hitachi 912 (Roche Diagnostics Corp.; Indianapolis, IN). Данные могут быть выражены в процентах (%) отклонения ингибирования глюкозы по отношению к двум контрольным группам (т.е. уровню глюкозы у животных, получающих глюкозу, но не получающих тестируемое соединение, представляющему 0% ингибирование, и концентрации глюкозы у животных, получающих только воду, представляющей 100% ингибирование). Соединения формулы (I) обычно демонстрируют ингибирующее действие, выраженное как IC50, по отношению к DPP-IV, которое 1000 нМ. Обычно предпочтительные соединения имеют IC50100 нМ. Например,дигидрохлорид 2S,4S)-4-(4-(3-цианопиразин-2-ил)пиперазин-1-ил)пирролидин-2-ил)3R,4S)-3,4-дифторпирролидин-1-ил)метанона имеет IC50 3,5 нМ. Сравнительные эксперименты по фармакокинетике у крыс. Эксперименты по фармакокинетике у крыс проводят для демонстрации улучшения концентраций в плазме, сохраняемых в течение времени, для соединений в соответствии с настоящим изобретением по сравнению со структурно похожими соединениями известного уровня техники, в общем описанными в международной заявке WO 02/14271. Более конкретно, концентрации в плазме в течение времени измеряют у крыс, которым вводят (а) дигидрохлорид (3,3-дифторпирролидин-1-ил)-2S,4S)-4-(4-(пиримидин 2-ил)пиперазин-1-ил)пирролидин-2-ил)метанона (далее CPD 113), который получают по методике примера 113, и (b) сравнительный гидрохлорид 2S,4S)-4-(4-(пиримидин-2-ил)пиперазин-1 ил)пирролидин-2-ил)(пирролидин-1-ил)метанона (далее сравнительное соединение), которое может быть получено по методике примера 1, описанного в WO 02/14271. В этом эксперименте самцов крыс Sprague-Dawley (200-250 г) с имплантированной в яремную вену канюлей (JVC), которых получают из Charles River Laboratories. Каждое соединение вводят двум крысам через пероральный желудочный зонд. Пероральную дозу вводят в растворе 0,5% метилцеллюлозы в объеме 10 мл/кг. Количество каждого введенного соединения составляет 5 мг/кг массы тела. Образцы крови(0,25 мл) собирают несколько раз в течение от 0 до 24 ч и помещают в пробирки, содержащие гепарин лития (Becton Dickinson, Microtainer). Затем образцы крови центрифугируют при 12000 об/мин в течение 10 мин. Аликвоты плазмы отбирают для определения концентраций соединения в плазме (анализ фармакокинетики). Образцы плазмы замораживают при температуре -70 С до проведения анализа. Образцы плазмы крыс анализируют для определения концентрации соединений с помощью ЖХ/МС/МС (масс спектрометр Applied Biosystems API 4000). Коротко, стандартные кривые соединения получают для плазмы контрольных крыс с динамическим диапазоном 1,0-2000 нг/мл. Аликвоты (0,02 мл) как стандартов, так и образцов помещают в пробирки Marsh в 96-луночном блоке. Белки осаждают добавлением 0,1 мл ацетонитрила, содержащего 0,1 мкг/мл внутреннего стандарта. 96-луночные блоки встряхивают и затем центрифугируют при 3000 об/мин в течение 5 мин. Полученную надосадочную жидкость удаляют, помещают в новый 96-луночный блок и сушат при температуре 50 С в токе азота. Остатки восстанавливают в подвижной фазе (60% 5 мМ ацетата аммония и 40% ацетонитрила). Затем аликвоты (0,01 мл) впрыскивают в ЖХ/МС/МС для анализа. Измеренные средние концентрации в плазме представлены в следующей таблице. Как показано соответствующими концентрациями в плазме, CPD 113 достигает и сохраняет значительно более высокие концентрации в плазме по сравнению со сравнительным соединением. или его фармацевтически приемлемая соль, или его сольват, или соли, гдеR1 является -(C1-C6)алкилом, -(C1-C6)алкокси, (C1-C6)арилалкилом, -NRaRb, гидрокси, циано, арилом или гетероарилом, где указанный -(C1-C6)алкил, указанный арил или указанный гетероарил необязательно независимо замещены 1-3 -СООН, -С(О)(C1-C6)алкокси, -С(О)(C1-C6)алкилами, -C(O)NRaRb, циано,галогенами, нитро, трифторметилами, (C1-C6)алкилами, -(C1-C6)алкокси, (С 3-C6)циклоалкилами или фенилами, гдеRa и Rb независимо являются водородом, -(C1-C6)алкилом, арилом или гетероарилом, или Ra и Rb,взятые вместе с атомом азота, к которому они присоединены, образуют 4-6-членное гетероциклическое кольцо, где указанное кольцо необязательно содержит дополнительные один или два гетероатома азота,кислорода или серы в кольце;HET является гетероциклоалкильной кольцевой группой, необязательно замещенной:n равно 0 или 1; если n равно 0, X является -CH2- и Y является -CH2-, -CHF или -CF2-; или если n равно 1, X является -CH2-, -CHF- или -CF2- и Y является -CH2-, -CHF или -CF2-, при условии,что X и Y не являются оба CH2; иZ является водородом или циано. 2. Соединение по п.1 или его фармацевтически приемлемая соль, гдеR1 является арилом или гетероарилом, необязательно независимо замещенным 1-3 циано, галогенами, нитро, трифторметилами, -(C1-C6)алкилами, -(C1-C6)алкокси, -(C3-C6)циклоалкилами или фенилами;HET является азетидинилом, пиперазинилом, пиперидинилом, пирролидинилом, 5,6-дигидро-8 Нимидазо[1,2-а]пиразин-7-илом, 5,6-дигидро-8 Н-[1,2,4]триазоло[4,3-а]пиразин-7-илом или 7,8-дигидро 5 Н-пиридо[4,3-а]пиримидин-6-илом. 3. Соединение по п.1 или его фармацевтически приемлемая соль, гдеHET является пиперазинилом. 4. Соединение по п.3 или его фармацевтически приемлемая соль, где R1 является пиридинилом или пиримидинилом. 5. Соединение по п.4 или его фармацевтически приемлемая соль, где n равно 1, X является -CF2- и
МПК / Метки
МПК: A61K 31/496, C07D 413/14, C07D 241/00, C07D 417/14, C07D 498/04, C07D 249/00, C07D 235/00, C07D 487/04, C07D 403/14, C07D 401/14, A61P 3/10
Метки: производные, ингибиторов, пролина, применение, дипептидилпептидазы, качестве
Код ссылки
<a href="https://eas.patents.su/30-11086-proizvodnye-prolina-i-ih-primenenie-v-kachestve-ingibitorov-dipeptidilpeptidazy-iv.html" rel="bookmark" title="База патентов Евразийского Союза">Производные пролина и их применение в качестве ингибиторов дипептидилпептидазы iv</a>
Предыдущий патент: Средство для профилактики или лечения глаукомы
Следующий патент: Соединения и фармацевтические композиции для лечения воспалительных заболеваний
Случайный патент: N-([1,2,4]триазолазинил)бензолсульфонамиды и пиридинсульфонамиды и их применение в качестве гербицидов












