2′,4′-дифтор-2′-метилзамещенные нуклеозидные производные в качестве ингибиторов репликации рнк вируса гепатита с
Формула / Реферат
1. Соединение формулы I
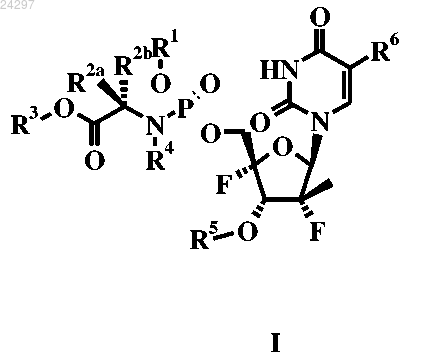
где R1 представляет собой С6-10арил;
каждый R1c представляет собой C1-7алкил;
R2a и R2b представляют собой (i) независимо H, C1-7алкил;
R3 представляет собой C1-7алкил;
R4 представляет собой H;
R5 представляет собой H, C(=O)R1c или P(=O)(OR1)(NR4R7);
R6 представляет собой H или гало;
R7 представляет собой C(R2aR2b)COOR3,
или его фармацевтически приемлемые соли.
2. Соединение по п.1, где R6 представляет собой H или Br.
3. Соединение по п.2, где R1 представляет собой нафтил или фенил.
4. Соединение по п.3, где R2a представляет собой H.
5. Соединение по п.4, где R2b представляет собой метил.
6. Соединение по п.5, где R3 представляет собой изопропил.
7. Соединение по п.6, где R5 представляет собой H.
8. Соединение по п.6, где R5 представляет собой C(=O)R1c.
9. Соединение по п.8, где R1c представляет собой этил.
10. Соединение по п.6, где R5 представляет собой P(=O)(OR1)(NR4R7).
11. Соединение по п.10, где R1 представляет собой нафтил.
12. Соединение по п.11, где R4 представляет собой H и R7 представляет собой CH(CH3)С(=О)OCH(CH3)2.
13. Соединение, выбранное из группы, состоящей из
(S)-2-{[(2S,3S,4R,5R)-5-(2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-2,4-дифтор-3-гидрокси-4-метилтетрагидрофуран-2-илметокси]феноксифосфориламино}пропионовой кислоты изопропилового эфира;
(S)-2-[[(2S,3S,4R,5R)-5-(2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-2,4-дифтор-3-гидрокси-4-метилтетрагидрофуран-2-илметокси]-(нафтален-1-илокси)фосфориламино]пропионовой кислоты изопропилового эфира;
(S)-2-[[(2S,3S,4R,5R)-5-(2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-2,4-дифтор-3-гидрокси-4-метилтетрагидрофуран-2-илметокси]-(нафтален-2-илокси)фосфориламино]пропионовой кислоты изопропилового эфира;
(S)-2-[[(2S,3S,4R,5R)-5-(2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-2,4-дифтор-3-[((S)-1-изопропоксикарбонил-этиламино)-(нафтален-2-илокси)фосфорилокси]-4-метилтетрагидрофуран-2-илметокси]-(нафтален-2-илокси)фосфориламино]пропионовой кислоты изопропилового эфира;
(S)-2-[[(2S,3S,4R,5R)-5-(2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-2,4-дифтор-4-метил-3-пропионилокситетрагидрофуран-2-илметокси]-(нафтален-1-илокси)фосфориламино]пропионовой кислоты изопропилового эфира;
(S)-2-[(S)-[(2S,3S,4R,5R)-5-(2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-2,4-дифтор-3-гидрокси-4-метилтетрагидрофуран-2-илметокси]-(нафтален-2-илокси)фосфориламино]пропионовой кислоты изопропилового эфира;
(S)-2-[(R)-[(2S,3S,4R,5R)-5-(2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-2,4-дифтор-3-гидрокси-4-метилтетрагидрофуран-2-илметокси]-(нафтален-2-илокси)фосфориламино]пропионовой кислоты изопропилового эфира;
(S)-2-[(R)-[(2S,3S,4R,5R)-5-(2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-2,4-дифтор-3-гидрокси-4-метилтетрагидрофуран-2-илметокси]-(нафтален-1-илокси)фосфориламино]пропионовой кислоты изопропилового эфира;
(S)-2-[(S)-[(2S,3S,4R,5R)-5-(2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-2,4-дифтор-3-гидрокси-4-метилтетрагидрофуран-2-илметокси]-(нафтален-1-илокси)фосфориламино]пропионовой кислоты изопропилового эфира;
(S)-2-{(S)-[(2S,3S,4R,5R)-5-(2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-2,4-дифтор-3-гидрокси-4-метилтетрагидрофуран-2-илметокси]феноксифосфориламино}пропионовой кислоты изопропилового эфира;
(S)-2-{(R)-[(2S,3S,4R,5R)-5-(2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-2,4-дифтор-3-гидрокси-4-метилтетрагидрофуран-2-илметокси]феноксифосфориламино}пропионовой кислоты изопропилового эфира;
(S)-2-[(S)-[(2S,3S,4R,5R)-5-(5-бромо-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-2,4-дифтор-3-гидрокси-4-метилтетрагидрофуран-2-илметокси]-(нафтален-1-илокси)фосфориламино]пропионовой кислоты изопропилового эфира;
(S)-2-[(S)-[(2S,3S,4R,5R)-5-(5-бромо-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-2,4-дифтор-3-гидрокси-4-метилтетрагидрофуран-2-илметокси]-(нафтален-2-илокси)фосфориламино]пропионовой кислоты изопропилового эфира;
(S)-2-[(R)-[(2S,3S,4R,5R)-5-(5-бромо-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-2,4-дифтор-3-гидрокси-4-метилтетрагидрофуран-2-илметокси]-(нафтален-1-илокси)фосфориламино]пропионовой кислоты изопропилового эфира;
(S)-2-[(R)-[(2S,3S,4R,5R)-5-(5-бромо-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-2,4-дифтор-3-гидрокси-4-метилтетрагидрофуран-2-илметокси]-(нафтален-2-илокси)фосфориламино]пропионовой кислоты изопропилового эфира;
(S)-2-[[(2S,3S,4R,5R)-5-(5-бромо-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-2,4-дифтор-3-гидрокси-4-метилтетрагидрофуран-2-илметокси]-(нафтален-2-илокси)фосфориламино]пропионовой кислоты изопропилового эфира.
14. Применение соединения по любому из пп.1-13 в качестве терапевтически активного вещества.
15. Фармацевтическая композиция, содержащая соединение по любому из пп.1-13 и терапевтически инертный носитель.
16. Применение соединения по любому из пп.1-13 для лечения или профилактики инфекции вируса гепатита C (ВГС).
17. Применение соединения по любому из пп.1-13 при получении лекарственного средства для лечения или профилактики инфекции вируса гепатита C (ВГС).
18. Способ лечения инфекции вируса гепатита C (ВГС), включающий введение нуждающемуся в этом пациенту терапевтически эффективного количества соединения по любому из пп.1-13.
Текст
2',4'-ДИФТОР-2'-МЕТИЛЗАМЕЩЕННЫЕ НУКЛЕОЗИДНЫЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ РЕПЛИКАЦИИ РНК ВИРУСА ГЕПАТИТА С Также раскрыты фармацевтические композиции, содержащие соединения формулы I, способы применения соединений формулы I и/или композиций, содержащих соединения формулы I, для лечения ВГС. Область, к которой относится изобретение Настоящее изобретение относится к нуклеозидным производным в качестве ингибиторов репликации РНК репликона ВГС. В частности, изобретение относится к применению пуриновых и пиримидиновых нуклеозидных производных в качестве ингибиторов субгеномной репликации РНК вируса гепатитаC (ВГС) и фармацевтическим композициям, содержащим такие соединения. Вирус гепатита C является основной причиной хронических заболеваний печени во всем мире. Пациенты, инфицированные ВГС, подвергаются риску развития цирроза печени и последующей гепатоцеллюлярной карциномы, и, следовательно, ВГС является основным показанием для трансплантации печени. Только два утвержденных способа лечения в настоящее время доступны для лечения ВГС-инфекции(R.G. Gish, Sem. Liver. Dis., 1999, 19, 35). Это монотерапия интерфероном- и совсем недавняя комбинированная терапия нуклеозидным аналогом рибавирином (Virazole) с интерфероном-. Многие из лекарств, одобренных для лечения вирусных инфекций, представляют собой нуклеозиды или аналоги, и большинство из этих препаратов нуклеозидных аналогов ингибируют репликацию вируса вследствие преобразования в соответствующие трифосфаты через ингибирование ферментов вирусной полимеразы. Это преобразование в трифосфат обычно опосредовано клеточными киназами и, следовательно, прямую оценку нуклеозидов в качестве ингибиторов репликации ВГС удобно проводить только с использованием клеточного анализа. Для ВГС нет истинного клеточного анализа репликации вируса или животной модели инфекции. Вирус гепатита C относится к семейству Flaviridae. Он представляет собой РНК вирус, РНК-геном,кодирующий большой полипротеин, который после процессинга производит необходимый комплекс репликации для синтеза потомственной РНК. Считается, что большинство из неструктурных белков, кодируемых РНК геномом ВГС, участвуют в репликации РНК. Lohmann et al. [V. Lohmann et al., Science,1999, 285, 110-113] описали конструкцию клеточной линии гепатомы человека (Huh7), в которую, как было показано, вводили субгеномные молекулы РНК ВГС и они реплицировались с высокой эффективностью. Считается, что механизм репликации РНК в этих клеточных линиях идентичен репликации полногеномной РНК ВГС в инфицированных гепатоцитах. Субгеномные клоны кДНК ВГС, используемые для выделения этих клеточных линий, легли в основу разработки клеточного анализа для идентификации нуклеозидных аналогов - ингибиторов ВГС репликации. Краткое изложение изобретения Соединения формулы I полезны для лечения заболеваний, опосредованных вирусом гепатита C(ВГС) и для фармацевтических композиций, содержащих такие соединения. В настоящем изобретении предложено соединение формулы IR7 представляет собой C(R2aR2b)COOR3,или его фармацевтически приемлемые соли. В настоящем изобретении предложен способ лечения инфекции вируса гепатита C (ВГС), включающий введение нуждающемуся в этом пациенту терапевтически эффективного количества соединения формулы I. В настоящем изобретении предложена композиция, содержащая соединение формулы I и фармацевтически приемлемый эксципиент. Подробное описание изобретения Было показано, что соединения формулы I являются ингибиторами субгеномной репликации вируса гепатита C в клеточной линии гепатомы. Эти соединения обладают потенциалом эффективности в качестве противовирусных препаратов для лечения ВГС-инфекции у человека. Термин "алкил", используемый здесь, обозначает линейный или с разветвленной цепочкой углеводородный остаток, содержащий от 1 до 12 атомов углерода. Предпочтительно термин "алкил" означает линейный или с разветвленной цепочкой углеводородный остаток, содержащий от 1 до 7 атомов углерода. Наиболее предпочтительными являются метил, этил, пропил, изопропил, н-бутил, изобутил, третбутил или пентил. Алкил может быть незамещенным или замещенным. Заместители выбраны из одного или более циклоалкила, нитро, амино, алкиламино, диалкиламино, алкилкарбонила и циклоалкилкарбонила. Термин "циклоалкил", используемый здесь, обозначает возможно замещенный циклоалкил, содержащий от 3 до 7 атомов углерода, например циклопропил, циклобутил, циклопентил, циклогексил или циклогептил. Термин "алкокси", используемый здесь, обозначает возможно замещенную линейную или с разветвленной цепочкой алкилоксигруппу, где "алкильная" часть определена выше, такую как метокси,этокси, н-пропилокси, изопропилокси, н-бутилокси, изобутилокси, трет-бутилокси, пентилокси,гексилокси, гептилокси, включая их изомеры. Термин "алкоксиалкил", используемый здесь, обозначает алкоксигруппу, как определено выше, которая присоединена к алкильной группе, определенной выше. Примерами являются метоксиметил, метоксиэтил, метоксипропил, этоксиметил, этоксиэтил, этоксипропил, пропилоксипропил, метоксибутил,этоксибутил, пропилоксибутил, бутилоксибутил, трет-бутилоксибутил, метоксипентил, этоксипентил,пропилоксипентил, включая их изомеры. Термин "алкенил", используемый здесь, обозначает незамещенный или замещенный углеводородный радикал, имеющий от 2 до 7 атомов углерода, предпочтительно от 2 до 4 атомов углерода, и имеющий одну или две олефиновые двойные связи, предпочтительно одну олефиновую двойную связь. Примерами являются винил, 1-пропенил, 2-пропенил (аллил) или 2-бутенил (кротил). Термин "алкинил", используемый здесь, обозначает незамещенный или замещенный углеводородный радикал, имеющий от 2 до 7 атомов углерода, предпочтительно от 2 до 4 атомов углерода, и имеющую одну или, где возможно, две тройные связи, предпочтительно одну тройную связь. Примерами являются этинил, 1-пропинил, 2-пропинил, 1-бутинил, 2-бутинил или 3-бутинил. Термин "гидроксиалкил", используемый здесь, обозначает линейную или с разветвленной цепочкой алкильную группу, как определено выше, где 1, 2, 3 или более атомов водорода замещены гидроксигруппой. Примерами являются гидроксиметил, 1-гидроксиэтил, 2-гидроксиэтил, 1-гидроксипропил,2-гидроксипропил, 3-гидроксипропил, гидроксиизопропил, гидроксибутил и т.п. Термин "галогеналкил", используемый здесь, означает линейную или с разветвленной цепочкой алкильную группу, как определено выше, где 1, 2, 3 или более атомов водорода замещены галогеном. Примерами являются 1-фторметил, 1-хлорметил, 1-бромметил, 1-иодметил, трифторметил, трихлорметил,трибромметил, трийодометил, 1-фторэтил, 1-хлорэтил, 1-бромэтил, 1-йодэтил, 2-фторэтил, 2-хлорэтил,2-бромэтил, 2-йодэтил, 2,2-дихлорэтил, 3-бромпропил или 2,2,2-трифторэтил и т.п. Термин "алкилтио", используемый здесь, означает линейную или с разветвленной цепочкой (алкил)-S-группу, в которой "алкильная" часть такая, как определено выше. Примерами являются метилтио,этилтио, н-пропилтио, изопропилтио, н-бутилтио, изобутилтио или трет-бутилтио. Термин "арил", используемый здесь, обозначает возможно замещенный фенил и нафтил (например,1-нафтил, 2-нафтил или 3-нафтил). Подходящие заместители для арила могут быть выбраны из тех, которые указаны для алкила; кроме того, однако, галоген, гидрокси и возможно замещенный алкил, галогеналкил, алкенил, алкинил и арилокси представляют собой заместители, которые могут быть включены в список заместителей. Термин "гетероциклил", используемый здесь, обозначает возможно замещенные насыщенные, частично ненасыщенные или ароматические моноциклические, бициклические или трициклические гетероциклические системы, которые содержат один или более гетероатомов, выбранных из азота, кислорода и серы, которые также могут быть конденсированы с возможно замещенным насыщенным, частично ненасыщенным или ароматическим моноциклическим карбоциклом или гетероциклом. Примерами подходящих гетероциклов являются оксазолил, изоксазолил, фурил, тетрагидрофурил,1,3-диоксоланил, дигидропиранил, 2-тиенил, 3-тиенил, пиразинил, изотиазолил, дигидрооксазолил, пиримидинил, тетразолил, 1-пирролидинил, 2-пирролидинил, 3-пирролидинил, пирролидинонил,(N-оксид)пиридинил, 1-пирролил, 2-пирролил, триазолил например 1,2,3-триазолил или 1,2,4-триазолил,1-пиразолил, 2-пиразолил, 4-пиразолил, пиперидинил, морфолинил (например, 4-морфолинил), тиоморфолинил (например, 4-тиоморфолинил), тиазолил, пиридинил, дигидротиазолил, имидазолидинил, пиразолинил, пиперазинил, 1-имидазолил, 2-имидазолил, 4-имидазолил, тиадиазолил, например 1,2,3-тиадиазолил, 4-метилпиперазинил, 4-гидроксипиперидин-1-ил.-2 024297 Подходящие заместители для гетероциклила могут быть выбраны из заместителей, указанных для алкила; в дополнение, однако, возможно замещенный алкил, алкенил, алкинил, оксогруппа (=О) или аминосульфонил представляют собой заместители, которые могут быть включены в список заместителей. Термин "ацил" ("алкилкарбонил"), используемый здесь, обозначает группу формулы C(=O)R, где R означает водород, незамещенный или замещенный линейный или разветвленный остаток углеводородной цепи, содержащей от 1 до 7 атомов углерода, или фенильную группу. Наиболее предпочтительными ацильными группами являются такие, в которых R представляет собой водород, незамещенный линейный или разветвленный углеводородный остаток, содержащий от 1 до 4 атомов углерода, или фенильную группу. Термин "галоген" означает фтор, хлор, бром или йод, предпочтительно фтор, хлор, бром. В изображениях указанных соединений в данном описании утолщенная коническая линия обозначает заместитель, который находится выше плоскости кольца, которому принадлежит асимметричный атом углерода и пунктирная линия обозначает заместитель, который находится ниже плоскости кольца, которому принадлежит асимметричный атом углерода. Соединения формулы I обладают стереоизомерией. Эти соединения могут быть любыми изомерами соединения формулы I или смесями этих изомеров. Соединения и промежуточные соединения по настоящему изобретению, имеющие один или более асимметрических атомов углерода, могут быть получены в виде рацемических смесей стереоизомеров, которые могут быть разделены. Соединения формулы I демонстрируют таутомерию, это означает, что соединения по данному изобретению могут существовать в виде двух или более химических соединений, которые способны легко взаимопревращаться. Во многих случаях это означает просто обмен атома водорода между двумя другими атомами, с любым из которых он образует ковалентную связь. Таутомерные соединения существуют в динамическом равновесии друг с другом, так что попытки получить отдельные вещества обычно приводят к образованию смеси, которая проявляет все химические и физические свойства, ожидаемые на основе структур е компонентов. Наиболее распространенным типом таутомерии является такой, в который вовлечены карбонильные или кетосоединения и ненасыщенные гидроксильные соединения, или енолы. Структурными изменениями является сдвиг атома водорода между атомами углерода и кислорода с перестройкой связей. Например, у многих алифатических альдегидов и кетонов, таких как ацетальдегид, кетоформа является преобладающей; у фенолов енольная форма является основным компонентом. Соединения формулы I, которые являются основными, могут образовывать фармацевтически приемлемые соли с неорганическими кислотами, такими как галогенводородные кислоты (например, хлористо-водородна кислота и бромисто-водородна кислота), серная кислота, азотная кислота и фосфорная кислота и т.п., а также с органическими кислотами (например, уксусной кислотой, винной кислотой, янтарной кислотой, фумаровой кислотой, малеиновой кислотой, яблочной кислотой, салициловой кислотой, лимонной кислотой, метансульфоновой кислотой и п-толуолсульфокислотой и т.п.). Образование и выделение таких солей может быть осуществлено способами, известными в данной области. Ингибиторы ВГС В настоящем изобретении предложено соединение формулы IR7 представляет собой C(R2aR2b)COOR3,или его фармацевтически приемлемые соли. В настоящем изобретении предложено соединение формулы I, где R4 представляет собой H. В настоящем изобретении предложено соединение формулы I, где R6 представляет собой H или Br.-3 024297 В настоящем изобретении предложено соединение формулы I, где R6 представляет собой H. В настоящем изобретении предложено соединение формулы I, где R6 представляет собой Br. В настоящем изобретении предложено соединение формулы I, где R4 представляет собой H и R6 представляет собой H или Br. В настоящем изобретении предложено соединение формулы I, где R4 представляет собой H, a R6 представляет собой Br. В настоящем изобретении предложено соединение формулы I, где R1 представляет собой нафтил или фенил. В настоящем изобретении предложено соединение формулы I, где R1 представляет собой нафтил. В настоящем изобретении предложено соединение формулы I, где R1 представляет собой фенил. В настоящем изобретении предложено соединение формулы I, где R1 представляет собой фенил, a 4R представляет собой H. В настоящем изобретении предложено соединение формулы I, где R1 представляет собой фенил, R6 представляет собой H и R4 представляет собой H. В настоящем изобретении предложено соединение формулы I, где R1 представляет собой нафтил, a 4R представляет собой H. В настоящем изобретении предложено соединение формулы I, где R1 представляет собой нафтил,4R представляет собой H, a R6 представляет собой H. В настоящем изобретении предложено соединение формулы I, где R1 представляет собой нафтил, a 3R представляет собой изопропил. В настоящем изобретении предложено соединение формулы I, где R1 представляет собой нафтил,4R представляет собой H, a R3 представляет собой изопропил. В настоящем изобретении предложено соединение формулы I, где R1 представляет собой нафтил,4R представляет собой H, R6 представляет собой H, a R3 представляет собой изопропил. В настоящем изобретении предложено соединение формулы I, где R1 представляет собой нафтил,4R представляет собой H, R6 представляет собой H, R2a представляет собой H, a R3 представляет собой изопропил. В настоящем изобретении предложено соединение формулы I, где R1 представляет собой нафтил,4R представляет собой H, R6 представляет собой H, R2a представляет собой H, R2b представляет собой метил, a R3 представляет собой изопропил. В настоящем изобретении предложено соединение формулы I, где R5 представляет собой H. В настоящем изобретении предложено соединение формулы I, где R1 представляет собой нафтил, a 5R представляет собой H. В настоящем изобретении предложено соединение формулы I, где R1 представляет собой нафтил,4R представляет собой H, a R5 представляет собой H. В настоящем изобретении предложено соединение формулы I, где R1 представляет собой нафтил,4R представляет собой H, R6 представляет собой H, a R5 представляет собой H. В настоящем изобретении предложено соединение формулы I, где R1 представляет собой нафтил,4R представляет собой H, R6 представляет собой H, R2a представляет собой H, a R5 представляет собой H. В настоящем изобретении предложено соединение формулы I, где R1 представляет собой нафтил,4R представляет собой H, R6 представляет собой H, R2a представляет собой H, R2b представляет собой метил, a R5 представляет собой H. В настоящем изобретении предложено соединение формулы I, где R1 представляет собой нафтил,4R представляет собой H, R6 представляет собой H, R2a представляет собой H, R2b представляет собой метил, R3 представляет собой изопропил, a R5 представляет собой H. В настоящем изобретении предложено соединение формулы I, где R5 представляет собой C(=O)R1c. В настоящем изобретении предложено соединение формулы I, где R1 представляет собой нафтил,4R представляет собой H, R6 представляет собой H, R2a представляет собой H, R2b представляет собой метил, R3 представляет собой изопропил, a R5 представляет собой C(=O)R1c. В настоящем изобретении предложено соединение формулы I, где R1c представляет собой этил. В настоящем изобретении предложено соединение формулы I, где R1 представляет собой нафтил,4R представляет собой H, R6 представляет собой H, R2a представляет собой H, R2b представляет собой метил, R3 представляет собой изопропил, a R5 представляет собой С(=О)CH2CH3. В настоящем изобретении предложено соединение формулы I, где R5 представляет собойP(=O)(OR1)(NR4R7). В настоящем изобретении предложено соединение формулы I, где R1 представляет собой нафтил,4R представляет собой H, R6 представляет собой H, R2a представляет собой H, R2b представляет собой метил, R3 представляет собой изопропил, a R5 представляет собой P(=O)(OR1)(NR4R7). В настоящем изобретении предложено соединение формулы I, где R1 представляет собой нафтил. В настоящем изобретении предложено соединение формулы I, где R1 представляет собой нафтил,4-4 024297 собой нафтил. В настоящем изобретении предложено соединение формулы I, где R4 представляет собой H, a R7 представляет собой CH(CH3)С(=О)OCH(CH3)2. В настоящем изобретении предложено соединение формулы I, где R1 представляет собой нафтил,4R представляет собой H, R6 представляет собой H, R2a представляет собой H, R2b представляет собой метил, R3 представляет собой изопропил, R5 представляет собой P(=O)(OR1)(NR4R7), R1 представляет собой нафтил, R4 представляет собой H, a R7 представляет собой CH(CH3)С(=О)OCH(CH3)2. В настоящем изобретении предложено соединение, выбранное из группы, состоящей из:-5 024297 В настоящем изобретении предложен способ лечения инфекции вируса гепатита C (ВГС), включающий введение нуждающемуся в этом пациенту терапевтически эффективного количества соединения формулы I. В настоящем изобретении предложен вышеуказанный способ, дополнительно включающий введение модулятора иммунной системы или противовирусного средства, которое ингибирует репликацию ВГС, или их комбинаций. В настоящем изобретении предложен вышеуказанный способ, где модулятор иммунной системы представляет собой интерферон или химическое производное интерферона. В настоящем изобретении предложены вышеуказанные способы, где противовирусное средство выбрано из группы, состоящей из ингибитора протеазы ВГС, ингибитора геликазы ВГС, ингибитора праймазы ВГС, ингибитора слияния ВГС и их комбинации. В настоящем изобретении предложен способ ингибирования репликации ВГС в клетке, включающий введение соединения формулы I. В настоящем изобретении предложена композиция, содержащая соединение формулы I и фармацевтически приемлемый эксципиент. В настоящем изобретении предложено применение соединения формулы I при изготовлении лекарственного средства для лечения ВГС. В настоящем изобретении предложены соединение, композиция или способ, как здесь описано. Соединения Примеры индивидуальных соединений, охватываемых настоящим изобретением и находящихся в его объеме, представлены в табл. 1. Эти примеры и способы приведены далее для более четкого понимания и осуществления настоящего изобретения квалифицированными специалистами. Они не должны рассматриваться как ограничивающие объем изобретения, а лишь в качестве его иллюстрирования и воплощения. В основном номенклатура, использованная в настоящем изобретении, основана на AUTONOMTMv.4.0, компьютеризованной системе генерации названий химических соединений по ИЮПАК института Бельштейн. Если наблюдается несоответствие между изображенной структурой и названием, данным для этой структуры, изображенная структура обладает более высоким весом. Кроме того, если стереохимия структуры или части структуры не обозначены, например, связью или пунктирной линией, структура или часть структуры должны интерпретироваться как охватывающие все их стереоизомеры. В табл. 1 изображены примеры соединений в соответствии с формулой I. Синтез. Общие схемы. Вышеописанные способы раскрыты более подробно далее. Исходное соединение 1 может быть получено в соответствии со способами, описанными Sofia, M.J. et al., J. Med. Chem. (2010), 53(19), 72027218 и Clark, J.L. et al., J. Med. Chem. (2005), 48(17), 5504-5508. Йодирование с последующим удалением йода в щелочной среде может привести к промежуточному соединению 3, в котором защита 3'гидроксила с помощью бензоильной группы приводит к промежуточному соединению 4. Стереоспецифичная реакция превращения промежуточного соединения 4 в 5 является ключевой стадией. Аналогичное превращение для введения фтора в 4'-положении описано ранее Ajmera, S. et al., J. Med. Chem.(1988), 31(6), 1094-1098 и Moffatt, J.G. et al., J. Am. Chem. Soc. (1971), 93(17), 4323-4324. Замещение 5' йода бензоатом натрия дает промежуточное соединение 6. Заключительно, депротекция 3',5'бензоильных групп в промежуточном соединении 6 дает нуклеозидные промежуточное соединение 7-8 024297 В данных ниже общих схемах R1 может быть H, низшим галоалкилом или арилом, где арил может быть фенилом или нафтилом, возможно замещенным одним или более низшим алкилом, низшим алкенилом, низшим алкинилом, низшим алкокси, гало, низшим галоалкилом, -N(R1a)2, ациламино,-SO2N(R1a)2, -COR1b, -SO2(R1c), -NHSO2(R1c), нитро или циано, каждый R1a может быть независимо Н или низшим алкилом, каждый R1b может быть независимо -OR1a или -N(R1a)2, каждый R1c может быть низшим алкилом, R2a и R2b представляют собой:(i) независимо H, низший алкил, -(CH2)rN(R1a)2, низший гидроксиалкил, -CH2SH, -(CH2)S(O)pMe,-(CH2)3NHC(=NH)NH2, (1H-индол-3-ил)метил, (1H-индол-4-ил)метил, -(CH2)mC(=O)R1b, арил и арил низший алкил, где арил может быть возможно замещен одним или более гидрокси, низшим алкилом, низшим алкокси, гало, нитро или циано;(iv) R2a и R2b, оба, представляют собой низший алкил, R3 может быть H, низшим алкилом, низшим галоалкилом, фенилом или фенил низшим алкилом, R4 может быть H, низшим алкилом или R2b и R4 вместе образуют (CH2)3, R5 может быть H, C(=O)R1c, C(=O)R1b, P(=O)(OR1)(OR1a) или P(=O)(OR1)(NR4R7), R6 может быть H, метилом или гало, R7 может быть C(R2aR2b)COOR3, m может быть 0-3, n может быть 4 или 5, p может быть 0-2, а r может быть 1-6. Схема 1 Нуклеозид 7 также может быть благополучно конвертирован в 5'-галогенированное промежуточное соединение 8 посредством взаимодействия с NCS, NBS или NIS в подходящих условиях (схема 2). Схема 2 Фосфорамидатные соединения настоящего изобретения могут быть получены посредством конденсации нуклеозида 7 или 8 с подходящим образом замещенным фосфохлоридатным соединением 11 в присутствии сильного основания (схема 3). Конденсация может быть проведена в отношении незащищенных нуклеозидов 7 или 8. Связанный продукт 12 в формуле I может быть дополнительно дериватизирован в продукт 13. Оба соединения 12 или 13 в формуле I первоначально получаются в виде смеси двух диастереомеров в реакции связывания и могут быть разделены на соответствующие хиральные энантиомеры с помощью хиральных колонок, хиральной ВЭЖХ или хиральной СКЖХ хроматографией. Дозирование и введение. Как показано в приведенной таблице, соединения формулы I обладают потенциалом эффективности в качестве противовирусных препаратов для лечения ВГС инфекции в организме человека или метаболизируются в соединение, которое проявляет такую активность. В другом варианте осуществления изобретения активное соединение или его производное или соли можно вводить в комбинации с другим противовирусным средством, таким как противгепатитное средство, в том числе соединение формулы I. Когда активное соединение или его производное или соль вводят в комбинации с другим противовирусным средством, активность может быть увеличена по сравнению с исходным соединением. Это может быть легко оценено путем получения производного и тестирование его анти-ВГС активности в соответствии со способом, описанным в настоящем изобретении. Введение активного соединения может находиться в диапазоне от непрерывного (капельное внутривенное вливание) до нескольких пероральных введений в день (например, четыре раза в день) и может включать пероральное, местное парентеральное, внутримышечное, внутривенное, подкожное, трансдермальное (которое может включать средство, усиливающее проницаемость), буккальное и суппозиторное введение, среди других путей введения. 4'-F замещенные производные нуклеозидов, а также их фармацевтически приемлемые соли могут применяться в качестве лекарственных средств в виде любого фармацевтического препарата. Фармацевтический препарат можно вводить энтерально, или перорально, например в виде таблеток, таблеток с покрытием, драже, твердых и мягких желатиновых капсул, растворов, эмульсий, сиропов или суспензий,или ректально, например в виде суппозиториев. Они также могут быть введены парентерально (внутримышечно, внутривенно, подкожно или внутримышечными инъекциями или инфузиями), например в виде растворов для инъекций, назально, например в форме назальных спреев или ингаляционных спреев,местно и т.д. Для изготовления фармацевтических препаратов 4'-замещенные производные нуклеозидов, а также их фармацевтически приемлемые соли могут быть приготовлены вместе с терапевтически инертным неорганическим или органическим наполнителем для производства таблеток, таблеток с покрытием, драже,твердых и мягких желатиновых капсул, растворов, эмульсий или суспензий. Соединения формулы I могут быть сформулированы в смеси с фармацевтически приемлемым носителем. Например, соединения по настоящему изобретению можно вводить перорально в виде фармакологически приемлемых солей. Поскольку соединения по настоящему изобретению являются по большей части растворимыми в воде, их можно вводить внутривенно в физиологическом солевом растворе (например, забуференном до pH около 7,2 до 7,5). С этой целью могут применяться обычные буферы, такие как фосфаты, бикарбонаты или цитраты. Конечно, любой специалист в данной области может изменить препараты в рамках раскрытия настоящего изобретения с целью получить многочисленные препараты для конкретного способа введения без придания композициям по настоящему изобретению неустойчиво- 10024297 сти или снижения их терапевтической активности. В частности, модификация данных соединений с целью сделать их более растворимыми в воде или другом носителе, например, может быть легко достигнута путем незначительных изменений (образование солей, этерификации и т.д.), которые приняты в пределах обычной квалификации в данной области техники. Кроме того, в пределах обычной квалификации в данной области можно модифицировать пути введения и режим дозирования конкретного соединения с целью контролировать фармакокинетику данных соединений для максимально полезного эффекта у пациентов. Для парентеральных препаратов носитель обычно содержит стерильную воду или водный раствор хлорида натрия, хотя другие ингредиенты, включая те, которые помогают диспергированию, могут быть включены. Конечно, в случае, когда необходимо использовать стерильную воду и поддерживать ее стерильность, композиции и носители также должны быть стерилизованы. Также могут быть получены суспензии для инъекций, в которых могут применяться подходящие жидкие носители, суспендирующие агенты и т.п. Подходящими эксципиентами для таблеток, таблеток с покрытием, драже, а твердых желатиновых капсул являются, например, лактоза, кукурузный крахмал и его производные, тальк и стеариновая кислота или ее соли. Если необходимо, таблетки или капсулы могут быть покрыты энтеросолюбильной оболочкой или обладать замедленным высвобождением с помощью стандартных методик. Подходящими эксципиентами для мягких желатиновых капсул являются, например, растительные масла, воски, жиры, полутвердые и жидкие полиолы. Подходящими наполнителями для инъекционных растворов являются, например, вода, физиологический раствор, спирты, полиолы, глицерин или растительные масла. Подходящими наполнителями для суппозиториев являются, например, природные и отвержденные масла, воски, жиры, полужидкие или жидкие полиолы. Подходящими наполнителями для растворов и сиропов для энтерального применения являются, например, вода, полиолы, сахароза, инвертный сахар и глюкоза. Фармацевтические препараты по настоящему изобретению также могут быть представлены в виде препаратов с замедленным высвобождением или других подходящих препаратов. Фармацевтические препараты могут также содержать консерванты, солюбилизаторы, стабилизаторы, смачивающие агенты, эмульгаторы, подсластители, красители, ароматизаторы, соли для регулирования осмотического давления, буферы, маскирующие агенты или антиоксиданты. Фармацевтические препараты могут также содержать другие терапевтически активные средства,известные в данной области. Дозировка может варьироваться в широких пределах и, конечно, будет адаптирована к индивидуальным требованиям в каждом конкретном случае. Для перорального введения суточная доза, составляющая от приблизительно 0,01 до приблизительно 100 мг/кг веса тела в день, должна быть подходящей при монотерапии и/или комбинированной терапии. Предпочтительная суточная доза составляет от приблизительно 0,1 до приблизительно 500 мг/кг массы тела, более предпочтительно от приблизительно 0,1 до приблизительно 100 мг/кг веса тела и наиболее предпочтительно от 1,0 до приблизительно 100 мг/кг веса тела в день. Типичный препарат будет содержать от приблизительно 5 до приблизительно 95%(мас./мас.) активного соединения. Суточную дозу можно вводить в виде однократной дозы или в разделенных дозах, как правило от 1 до 5 доз в день. В некоторых фармацевтических лекарственных формах пролекарственные формы соединений, особенно ацилированные (ацетилированные или другие) производные, пиридиновые эфиры и различные солевые формы данных соединений являются предпочтительными. Специалисту в данной области будет понятно, как легко модифицировать данные соединения в пролекарственные формы с целью облегчения доставки активных соединений в целевые участки организма-хозяина или пациента. Специалист в данной области также воспользуется благоприятными фармакокинетических параметрами пролекарственных форм в соответствующих случаях для доставки данных соединений в целевые участки в организме хозяина или пациента, чтобы максимизировать ожидаемый эффект соединения. Показания и способ лечения. Соединения по настоящему изобретению и их изомерные формы, а также их фармацевтически приемлемые соли полезны при лечении и профилактике ВГС инфекции. В настоящем изобретении предложен способ лечения инфекции вируса гепатита C (ВГС), включающий введение нуждающемуся в этом пациенту терапевтически эффективного количества соединения формулы I. В настоящем изобретении предложен способ ингибирования репликации ВГС в клетках, включающий введение соединения формулы I. Комбинированная терапия. Соединения по изобретению и их изомерные формы, а также их фармацевтически приемлемые соли полезны при лечении и профилактики ВГС инфекции сами по себе или при использовании в комбинации с другими соединениями, направленными на вирусные или клеточные элементы или функции, участ- 11024297 вующие в жизненном цикле ВГС. Классы соединений, используемых в изобретении, включают, без ограничения, все классы ВГС противовирусных препаратов. Для комбинированной терапии классы средств по механизму химической реакции, которые могут быть полезны в комбинации с соединениями по настоящему изобретению, включают, например, нуклеозидные и ненуклеозидные ингибиторы полимеразы ВГС, ингибиторы протеазы, ингибиторы геликазы,ингибиторы NS4B и лекарственные средства, которые функционально ингибируют внутренний сайт связывания рибосом (IRES) и другие лекарственные средства, которые ингибируют присоединение ВГС клеток или связывание вирусов, трансляцию РНК ВГС, транскрипцию ВГС РНК, репликацию или созревание ВГС, сборку или высвобождение вируса. Конкретные соединения в этих классах и используемые в изобретении включают, без ограничения, макроциклические, гетероциклические и линейные ингибиторы протеазы ВГС, такие как телапревир (VX-950), боцепревир (SCH-503034), нарлапревир (SCH-9005 18),ITMN- 191 (R-7227), TMC-435350 (т.е. TMC-435), МК- 7009, BI-201335, BI-2061 (цилупревир),BMS-650032, ACH-1625, ACH-1095 (ингибитор NS4A кофактора ВГС протеазы), VX-500, VX-8 13,РНХ-1766, РНХ 2054, IDX- 136, IDX-316, ABT-450 ЕР-0 13420 (и родственные соединения) и VBY-376; нуклеозидные ингибиторы ВГС полимеразы (репликазы), полезные для настоящего изобретения, включают, без ограничения, R7128, PSI-785 1, IDX-184, IDX-102, R1479, UNX-08189, PSI-6130, PSI-938 иPSI-879 и различные другие нуклеозидные и нуклеотидные аналоги и ингибиторы ВГС, включая (без ограничения) полученные как 2'-С-метилмодифицированные нуклеоз(т)иды, 4'-азамодифицированные нуклеоз(т)иды и 7'-деазамодифицированные нуклеоз(т)иды. Ненуклеозидные ингибиторы ВГС полимеразы (репликазы), используемые в изобретении, включают, без ограничения, ВГС-796, ВГС-371, VCH-759, VCH-916, VCH-222, ANA-598, MK-3281, ABT-333,ABT-072, PF-00868554, BI-207127, GS-9190, А-837093, JKT-109, GL-59728 и GL-60667. Кроме того, соединения по изобретению могут применяться в комбинации с антагонистами циклофиллина и иммунофилина (например, без ограничения, соединения Debio, NM-811, а также циклоспорин и его производные), ингибиторами киназы, ингибиторами белков теплового шока (например, HSP90 иHSP70), другими иммуномодулирующими средствами, которые могут включать в себя, без ограничения,интерфероны (альфа-, бета-, омега-, гамма-,-лямбда или синтетические), такие как интрон A, роферон-A,канферон-A300, адваферон, инферген, хумоферон, сумиферон МР, альфаферон, ИФН-, ферон и т.п.; полиэтиленгликолевыми (пэгилированными производными интерферона) соединениями, такими как ПЭГ-интерферона -2a (Пегасис), ПЭГ-интерферон 2b (PEGINTRON), пегилированный интерферон-con1 и т.п.; препаратами и производными интерферона длительного действия, таких как альбумин,слитый интерферон, альбуферон, локтерон, и т.п.; интерферонами с различными типами систем контролируемой доставки (например, ITCA-638, омега-интерферон, доставляемый подкожной системой доставки Duros); соединениями, которые стимулируют синтез интерферона в клетках, такими как ресихимод и т.п.; интерлейкинами; соединениями, которые усиливают развитие ответа Т-клеток-хелперов типа 1, такими как SCV-07 и т.п.; агонистами toll-подобных рецепторов, такими как CpG-10101 (актилон), изоторабамин, ANA773 и т.п.; тимозин -1; ANA-245 и ANA-246; гистамин дигидрохлорид; пропагерманий; тетрахлородкаоксидом; амплигеном; IMP-321; КРН-7000; антителами, такими как цивацир, XTL-6865 и т.п., и профилактическими и терапевтическими вакцинами, такими как инновак С, ВГС E1E2/MF59 и т.п. Кроме того, любой из вышеописанных способов, включающих введение ингибитора NS5A, тип агониста рецептора интерферона типа I (например, IFN-) и агониста рецептора интерферона типа II (например,IFN-) может быть дополнен введением эффективного количества антагониста TNF-. Иллюстративные,без ограничения, TNF- антагонисты, которые подходят для использования в таких комбинированных препаратах, включают ENBREL, REMICADE и HUMIRA. Кроме того, соединения по изобретению могут применяться в комбинации с антипротозойными средствами и другими противовирусными препаратами, которые считаются эффективными в лечении ВГС инфекции, такие как, без ограничения, пролекарство нитазоксанид. Нитазоксанид может быть использован в качестве средства в комбинации с соединениями, описанными в настоящем изобретении, а также в комбинации с другими средствами, используемыми при лечении ВГС инфекции, такими как ПЭГинтерфероном -2a и рибавирином. Соединения по изобретению также могут применяться с альтернативными формами интерферонов и обработанными полиэтиленгликолем интерферонами, рибавирином или его аналогами (например, тарабаварин, левоворин), микроРНК, соединениями малых интерферирующих РНК (например,SIRPLEX-140-N и т.п.), нуклеотидными или нуклеозидными аналогами, иммуноглобулинами, гепатопротекторами, противовоспалительными средствами и другими ингибиторами NS5A. Ингибиторы других мишеней жизненного цикла ВГС включают ингибиторы NS3 геликазы; ингибиторы кофактора NS4A; антисмысловые олигонуклеотидные ингибиторы, такие как ISIS-14803, AVI-4065 и т.п.; векторкодируемые короткие шпильки РНК (shRNA); ВГС специфичные рибозимы, такие как гептазим, RPI,13919 и т.п.; ингибиторы встраивания, такие как ХЕПЭКС-С, HuMax-HepC и т.п.; ингибиторы альфаглюкозидазы, такие как цельгозивир, UT-231B и т.п.; KPE-02003002 и BIVN 401 и IMPDH ингибиторы. Другие иллюстративные соединения - ингибиторы ВГС включают те, которые описаны в следующихWO 03/037895; WO 02/100851; WO 02/100846; WO 99/01582; WO 00/09543; WO 02/18369; WO 98/17679,WO 00/056331; WO 98/22496; WO 99/07734; WO 05/073216, WO 05/073195 и WO 08/021927. Кроме того, комбинации, например, рибавирина и интерферона можно вводить в виде множественной комбинированной терапии по меньшей мере с одним из соединений по изобретению. Настоящее изобретение не ограничивается вышеупомянутыми классами или соединениями и предусматривает известные и новые соединения и комбинации биологически активных агентов. Предполагается, что комбинированная терапия по настоящему изобретению включает любую химически совместимую комбинацию соединения группы настоящего изобретения с другими соединениями группы по изобретению или другими соединениями внешних относительно изобретения групп при условии, что комбинация не снижает противовирусной активности соединения группы настоящего изобретения или противовирусной активности самой фармацевтической композиции. Комбинированная терапия может быть последовательной, т.е. лечение с помощью сначала одного агента, а затем второго агента (например, где каждое лечение включает различные соединения по настоящему изобретению или где одно лечение включает соединение согласно изобретению и другое включает одно или более биологически активное вещество) или это может быть лечение обоими агентами одновременно (параллельно). Последовательная терапия может включать достаточно времени после завершения первой терапии перед началом второй терапии. Лечение обоими агентами одновременно может проводиться одной суточной дозой или раздельными дозами. Комбинированная терапия необязательно должна быть ограничена двумя агентами и может включать три или более агента. Дозировки как для одновременной, так и для последовательной комбинированной терапии будут зависеть от скоростей всасывания, распределения, метаболизма и выведения компонентов комбинированной терапии, а также других факторов, известных специалистам в данной области техники. Значения дозировки будут также изменяться в зависимости от тяжести состояния, подлежащего облегчению. Следует также понимать, что для любого конкретного субъекта конкретные режимы и схемы дозирования могут быть скорректированы с течением времени в соответствии с потребностью индивида и заключения специалиста в данной области, назначающего или наблюдающего за проведением комбинированной терапии. В настоящем изобретении предложен способ лечения инфекции вируса гепатита C (ВГС), включающий введение нуждающемуся в этом пациенту терапевтически эффективного количества соединения формулы I. В настоящем изобретении предложен вышеуказанный способ, дополнительно включающий введение модулятора иммунной системы или противовирусного средства, которое ингибирует репликацию ВГС, или их комбинаций. В настоящем изобретении предложен вышеуказанный способ, где модулятор иммунной системы представляет собой интерферон или химическое производное интерферона. В настоящем изобретении предложены вышеуказанные способы, где противовирусное средство выбрано из группы, состоящей из ингибитора протеазы ВГС, ингибитора геликазы ВГС, ингибитора праймазы ВГС, ингибитора слияния ВГС и их комбинации. Примеры Сокращения, используемые в данном описании:MeSO2 - метилсульфонил или Ms,DABCO - 1,4-диазабицикло[2,2,2]октан,ms - масс-спектр,DAST - диэтиламиносератрифторид,МТБЭ - метил-трет-бутиловый эфир,DBA - дибензилиденацетон,NCA - N-карбоксиангидрид,DBN - 1,5-диазабицикло[4.3.0]нон-5-ен,NBS - N-бромсукцинимид,DBU - 1,8-диазабицикло[5.4.0]ундец-7-ен,NMM - N-метилморфолин,NMP - N-метилпирролидон,ДХЭ - 1,2-дихлорэтан,РСС - пиридинийхлорхромат,DCC - N,N'-дициклогексилкарбодиимид,PDC - дихромат пиридина,ДХМ - дихлорметан,Pr - пропил,DEAD - диэтилазодикарбоксилат,Ph - фенил,DIAD - диизопропилазодикарбоксилат, фунтов/кв.дюйм (psi),DIPEA - диизопропилэтиламин,пир - пиридин,DIBAL-H - диизобутилалюминийгидрид,КТ - комнатная температура,RT - время удерживания,DMA - N,N-диметилацетамид,TBDMS - трет-бутилдиметилсилил или трет-BuMe2Si,DMAP - 4-N,N'-диметиламинопиридин,Et3N или TEA - триэтиламин,ДМФ - N,N-диметилформамид,Tf - трифлат или CF3SO2,ДМСО - диметилсульфоксид,ТФУ - трифторуксусная кислота,ДФФЭ - 1,1'-бис-(дифенилфосфино)этан,TMHD - 2,2,6,6-тетраметилгептан-2,6-дион,DPPF - 1,1'-бис-(дифенилфосфино)ферроцен,ТСХ - тонкослойная хроматография,EtOAc - этилацетат,ТГФ - тетрагидрофуран,Et2O - диэтиловый эфир,TMS - триметилсилил или Me3Si,Et - этил,TsOH или pTsOH - моногидрат п-толуолсульфоновой кислоты,LiHMDS - литий гексаметилдисилазан,Ts - 4-Me-C6H4SO2 или тозил,I-Pr - изопропил,UNCA - N-уретан-N-карбоксиангидрид,EtOH - этанол. Обычные номенклатуры, включая префиксы нормальный (N), изо (I-), вторичный (втор-), третичный (трет-) и нео, имеют свои обычные значения при использовании их с алкильной частью (J. Rigaudy иD.P. Klesney, Nomenclature in Organic Chemistry, IUPAC 1979, Pergamon Press, Oxford). Основные условия. Соединения по настоящему изобретению могут быть получены с помощью различных способов,изображенных в иллюстративных реакциях, описанных в разделе "Примеры". Исходные материалы и реагенты, используемые при получении этих соединений, как правило, либо доступны от коммерческих поставщиков, таких как Aldrich Chemical Co, либо их получают способами,известными специалистам в данной области, следуя методикам, описанным по ссылкам, таким как FieserCarbon Compounds, Elsevier Science Publishers, 1989, Vol. 1-5 and Supplemental; and Organic Reactions,WileySons: New York, 1991, Vol. 1-40. Необходимо понимать, что схемы реакций синтеза, показанные в разделе "Примеры", просто иллюстрируют некоторые способы, которыми могут быть синтезированы- 14024297 соединения по настоящему изобретению, квалифицированными специалистами в данной области техники могут быть сделаны или предложены различные модификации этих реакционных схем со ссылкой на раскрытие сведений содержащихся в настоящем изобретении. Исходные вещества и промежуточные соединения реакционных схем синтеза могут быть выделены и очищены, если необходимо, с использованием обычных способов, включая, но не ограничиваясь ими,фильтрование, дистилляцию, кристаллизацию, хроматографию и т.п. Такие вещества могут быть охарактеризованы обычными параметрами, включая физические константы и спектральные данные. Если не указано иное, описанные здесь реакции обычно проводят в инертной атмосфере при атмосферном давлении в диапазоне реакционных температур от -78 до примерно 150C, часто от около 0 до примерно 125C или наиболее часто и обычно при комнатной температуре (или температуре окружающей среды), например около 20C. Различные заместители соединений по изобретению могут присутствовать в исходных соединениях, добавляться к любому из промежуточных соединений или добавляться после образования конечных продуктов известными способами с помощью реакций замещения или конверсии. Если сами заместители являются реактивными, то заместители могут быть защищены сами по себе в соответствии со способами,известными в данной области. Различные защитные группы известны в данной области и могут быть использованы. Примеры многих возможных групп можно найти в "Protective Groups in Organic Synthesis"Green et al., John WileySons, 1999. Например, нитрогруппы могут быть добавлены нитрированием, и нитрогруппа может быть преобразована в другие группы, такие как амино - восстановлением и галоген диазотированием аминогруппы и заменой диазогруппы на галоген. Ацильные группы могут быть добавлены ацилированием Фриделя-Крафтса. Ацильные группы могут быть затем преобразованы в соответствующие алкильные группы различными способами, в том числе восстановлением Вольфа-Кижнера и восстановлением по Клемменсону. Аминогруппы можно алкилировать с образованием моно- и диалкиламиногрупп; а меркапто и гидроксильные группы можно алкилировать с образованием соответствующих эфиров. Первичные спирты можно окислить с помощью окислителей, известных в данной области, с образованием карбоновых кислот или альдегидов, а вторичные спирты могут быть окислены с образованием кетонов. Таким образом, реакции замещения или модификации могут быть использованы для получения различных заместителей по всей молекуле исходного материала, промежуточных соединений или конечных продуктов, в том числе выделенных продуктов. Примеры получения Получение 1. Получение промежуточного соединения хирального 1-2R,3R,4R,5S)-3-фтор-4-гидрокси-5(йодометил)-3-метил-тетрагидрофуран-2-ил)пиримидин-2,4(1H,3H)-диона М.М. 370.12 C10H12FIN2O4 Хиральный 1-2R,3R,4R,5R)-3-фтор-4-гидрокси-5-гидроксиметил-3-метилтетрагидрофуран-2-ил)1H-пиримидин-2,4-дион (6.14 г, 23.6 ммоль), PPh3 (9 г, 34.4 ммоль), имидазол (2.4 г, 34.4 ммоль) и безводный ТГФ (100 мл) добавили в 3-горлышковую колбу (500 мл), смесь перемешивали при 20C в атмосфере азота в течение 20 мин. Затем I2 (6.6 г, 26 ммоль), растворенный в безводном ТГФ (100 мл), добавили в смесь по каплям при 20C в течение 30 мин, после добавления всю смесь перемешивали при 20C в атмосфере азота в течение 18 ч. ТСХ показала, что исходный материал был израсходован, затем добавили воду (50 мл), смесь экстрагировали этилацетатом (3150 мл), органический слой промыли солевым раствором, высушили над Na2SO4, удалили растворитель с помощью пониженного давления, осадок очистили посредством хроматографической колонки с силикагелем (ДХМ:MeOH = 100:1 до 50:1) с получением соединения, указанного в заголовке, в виде белого осадка (8.2 г, 94%).LC-MS (M+H)+ = 371.0. Получение 2. Получение промежуточного соединения хирального 1-2R,3R,4R)-3-фтор-4-гидрокси-3-метил-5 метилентетрагидрофуран-2-ил)пиримидин-2,4(1H,3 Н)-диона(3.73 г, 69 ммоль) в атмосфере азота, после добавления смесь нагрели до 65C и перемешивали в атмосфере азота в течение 14 ч, ТСХ показала, что исходный материал был израсходован, затем смесь охладили до КТ, в не добавили ионообменную смолу IR-120 (Н) для выравнивания pH до 8, отфильтровали и удалили растворитель с помощью пониженного давления, неочищенный продукт очистили посредством хроматографической колонки с силикагелем (ДХМ:MeOH = 15:1) с получением соединения, указанного в заголовке, в виде белого осадка (3.3 г, 59%).LC-MS (M+H)+ = 243.1. Получение 3. Получение промежуточного соединения хирального бензойной кислоты (3R,4R,5R)-5-(2,4-диоксо 3,4-дигидро-2H-пиримидин-1-ил)-4-фтор-4-метил-2-метилен-тетрагидро-фуран-3-илового эфира(900 мл) при 0C добавили BzCl (15.9 г, 113.4 ммоль) по каплям. Реакционную смесь перемешивали при 0C в течение 0.5 ч, затем добавили насыщенный NaHCO3, чтобы погасить реакцию. Смесь экстрагировали этилацетатом (3300 мл). Объединенный органический экстракт промыли Н 2 О, солевым раствором,высушили над Na2SO4, и сконцентрировали. Остаток очистили посредством хроматографической колонки с силикагелем (ДХМ:MeOH = 160:1 до 120:1) с получением соединения, указанного в заголовке, в виде белого осадка (17 г, 65%).LC-MS (M+H)+ = 347.1. Получение 4. Получение промежуточного соединения хирального М.М. 492.22 C17H15F2IN2O5 К смеси хиральной бензойной кислоты (3R,4R,5R)-5-(2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)4-фтор-4-метил-2-метилентетрагидрофуран-3-илового эфира (17 г, 49 ммоль) и AgF (31 г, 245 ммоль) в безводном ТГФ (600 мл) при 0C добавили ТГФ раствор (600 мл) I2 (24.8 г, 98 ммоль) по каплям. После завершения добавления реакционную смесь нагрели до комнатной температуры и перемешивали в течение 3 ч. ТСХ анализ показала, что исходный материал был полностью израсходован и произошло образование требуемого продукта. Реакционную смесь погасили водным раствором NaS2O3 (5%, 300 мл). Смесь экстрагировали этилацетатом (3350 мл). Объединенный органический экстракт промыли солевым раствором, высушили над Na2SO4 и сконцентрировали. Остаток очистили посредством хроматографической колонки с силикагелем (ДХМ:MeOH = 120:1) с получением соединения, указанного в заголовке, в виде белого осадка (11 г, 45%).- 16024297 Получение 5. Получение промежуточного соединения хирального(2R,3S,4R,5R)-5-(2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)-2,4-дифтор-O-2(йодометил)-4-метилтетрагидрофуран-3-ил бензоат (0.56 г, 1.15 ммоль), бензоат натрия (0.825 г,5.73 ммоль) и 18-crown-6 (0.03 г, 0.115 ммоль) суспендировали в ДМСО (20 мл), раствор нагрели до 100C и перемешивали в атмосфере азота в течение 18 ч, затем охладили до КТ, в него добавили воду(30 мл), смесь экстрагировали этилацетатом (330 мл), органический слой промыли Н 2 О, солевым раствором и Н 2 О, удалили растворитель с помощью пониженного давления, остаток очистили посредством колоночной хроматографии на силикагеле (РЕ:ЕА = 1:2) с получением соединения, указанного в заголовке, в виде бесцветного масла (0.34 г, 61%).LC-MS (M+Na)+ = 509.1. Получение 6. Получение промежуточного соединения хирального 1-2R,3R,4S,5S)-3,5-дифтор-4-гидрокси-5(гидроксиметил)-3-метил-тетрагидрофуран-2-ил)пиримидин-2,4(1H,3H)-диона(2R,3S,4R,5R)-5-(2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)-2,4-дифтор-O-2 бензоилметил-4-метилтетрагидрофуран-3-ил бензоат (0.34 г, 0.7 ммоль) растворили в метаноле и добавили раствор аммония в метаноле (7 н., 20 мл). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Смесь сконцентрировали, а остаток очистили посредством колоночной хроматографии на силикагеле (ДХМ:MeOH = 20:1) и препаративной ВЭЖХ с получением соединения, указанного в заголовке, в виде белого осадка (0.074 г, 38%).H ЯМР (300 МГц, ДМСО-d6):(ppm) 11.575 (s, 1H), 7.666-7.639 (d, 1H, J=8.1 Гц), 6.324-6.266 (d,1H, J=17.4 Гц), 6.056-6.037 (d, 1H, J=5.7 Гц), 5.821 (brs, 1H), 5.713-5.686 (d, 1H, J=8.1 Гц), 4.057-4.023 (m,1H), 3.636 (s, 2H), 1.313-1.238 (d, 3H, J=22.5 Гц) Получение 7. Получение промежуточного соединения хирального 5-бромо-1-2R,3R,4S,5S)-3,5-дифтор-4 гидрокси-5-гидроксиметил-3-метилтетрагидрофуран-2-ил)-1H-пиримидин-2,4-диона М.М. 357.11 C10H11BrF2N2O5 В 2 мл пробирке для микроволновой печи хиральный 1-2R,3R,4S,5S)-3,5-дифтор-4-гидрокси-5(гидроксиметил)-3-метил-тетрагидрофуран-2-ил)пиримидин-2,4(1H,3H)-дион (70 мг, 0.252 ммоль), NBS(67.2 мг, 0.377 ммоль) растворили в ДМФ (0.7 мл). Реакционную смесь закрыли и нагревали в условиях микроволнового излучения при 80C в течение 10 мин. ЖХ/МС анализ показал полное расходование исходного материала и образование требуемого продукта в качестве основного. Растворитель эвапорировали, а остаток очистили посредством 24 г силикагелевого картриджа, элюируя 0-70% EtOAc в гексанах с получением соединения, указанного в заголовке, в виде белого осадка (94 мг, 90%)(S)-Изопропил 2-аминопропаноата гидрохлорид (Oakwood, 500 мг, 2.98 ммоль) и фенилфосфородихлоридат (Aldrich, 662 мг, 2.98 ммоль) суспендировали в безводном ДХМ (25 мл). Реакционную смесь охладили до -78C. Триэтиламин (604 мг, 830 мкл, 5.97 ммоль) добавили по каплям. Реакционную смесь перемешивали при -78C в течение 1 ч, затем дали нагреться до комнатной температуры и перемешивали в течение ночи. Растворитель удалили, остаток промыли безводным эфиром. Фильтрат сконцентрировали с получением неочищенного (2S)-изопропил 2-(хлор(фенокси)фосфориламино)пропаноата в виде светло-желтого масла (0.8 г, 88%) и использовали без дополнительной очистки. Стадия B. К раствору хирального 1-2R,3R,4S,5S)-3,5-дифтор-4-гидрокси-5-(гидроксиметил)-3 метилтетрагидрофуран-2-ил)пиримидин-2,4(1H,3H)-диона (42 мг, 151 мкмоль), полученного в Получении 6 в ТГФ (8.00 мл), добавили ТГФ раствор (Aldrich, 1 М) трет-бутилмагния хлорида (377 мкл,377 мкмоль) по каплям. Смесь перемешивали при комнатной температуре в течение 15 мин с последующим добавлением ТГФ раствора (0.5 М) (2S)-изопропил 2-(хлор(фенокси)фосфориламино)пропаноата(755 мкл, 377 мкмоль). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч с последующим добавлением ТГФ раствора (Aldrich, 1 М) трет-бутилмагния хлорида (189 мкл,189 мкмоль), ТГФ раствора (0.5 М) (2S)-изопропил 2-(хлор(фенокси)фосфориламино)пропаноата(378 мкл, 189 мкмоль). Реакционную смесь затем перемешивали при комнатной температуре в течение 2 ч. Метанол (2 мл) добавили, чтобы погасить реакцию, смесь очистили посредством флэшхроматографии (силикагель, 0-15% MeOH в ДХМ) и высушили под вакуумом с получением соединения,указанного в заголовке, в виде светло-желтого осадка (18 мг, 22%). М.М. 597.51 C26H30F2N3O9P Стадия A. Нафтален-1-ол (Aldrich, 1.5 г, 10.4 ммоль) и оксихлорид фосфора (V) (Aldrich, 1.6 г, 0.97 мл,10.4 ммоль) суспендировали в безводном эфире (37.5 мл) и температуру снизили до -78C. Триэтиламин(1.05 г, 1.45 мл, 10.4 ммоль) добавили по каплям и реакционную смесь перемешивали при -78C в течение 1 ч. Реакционную смесь нагрели до комнатной температуры и перемешивали в течение ночи. Смесь отфильтровали, а фильтрат сконцентрировали с получением неочищенного нафтален-1-ил фосфородихлоридата в виде светло-желтого масла (2 г, 74%) и использовали на следующей стадии без дополнительной очистки. Стадия B.(S)-Изопропил 2-аминопропаноата гидрохлорид (Oakwood, 1.28 г, 7.64 ммоль) и нафтален-1-ил фосфородихлоридат (2 г, 7.66 ммоль) суспендировали в безводном ДХМ (35 мл). Реакционную смесь охладили до -78C. Триэтиламин (1.55 г, 2.13 мл, 15.3 ммоль) добавили по каплям. Реакционную смесь перемешивали при -78C в течение 1 ч, затем нагрели до комнатной температуры и перемешивали в те- 18024297 чение 5 ч. Растворитель удалили, а остаток промыли безводным этиловым эфиром и отфильтровали. Фильтрат сконцентрировали с получением неочищеного (2S)-изопропил 2-(хлор(нафтален-1 илокси)фосфориламино)пропаноата в виде светло-желтого масла (2.5 г, 92%) и использовали без дополнительной очистки. Стадия C. К раствору хирального 1-2R,3R,4S,5S)-3,5-дифтор-4-гидрокси-5-(гидроксиметил)-3 метилтетрагидрофуран-2-ил)пиримидин-2,4(1H,3H)-диона (150 мг, 539 мкмоль) полученного в Получении 6 в ТГФ (24 мл), добавили ТГФ раствор (Aldrich, 1 М) трет-бутилмагния хлорида (1.35 мл,1.35 ммоль) по каплям. Смесь перемешивали при комнатной температуре в течение 15 мин с последующим добавлением ТГФ раствора(2S)-изопропил-2-(хлор(нафтален-1 илокси)фосфориламино)пропаноата (2.7 мл, 1.35 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч, затем добавили дополнительное количество ТГФ раствора (Aldrich,1 М) трет-бутилмагния хлорида (0.68 мл, 0.68 ммоль) и ТГФ раствора (0.5 М) (2S)-изопропил-2(хлор(нафтален-1-илокси)фосфориламино)пропаноата (1.35 мл, 0.68 ммоль). Реакционную смесь затем перемешивали при комнатной температуре в течение 3 ч. Метанол (6 мл) добавили, чтобы погасить реакцию, смесь очистили посредством флэш-хроматографии (силикагель, 0-15% MeOH в ДХМ) и высушили под вакуумом с получением соединения, указанного в заголовке, в виде белого осадка (0.2 г, 62%). М.М. 597.51 C26H30F2N3O9P Стадия A. Нафтален-2-ол (Aldrich, 2 г, 13.9 ммоль) и оксихлорид фосфора (V) (Aldrich, 2.13 г, 1.29 мл,13.9 ммоль) суспендировали в безводном эфире (50 мл) и температуру понизили до -78C. Триэтиламин(1.4 г, 1.93 мл, 13.9 ммоль) добавили по каплям и реакционную смесь перемешивали при -78C в течение 1 ч. Реакционную смесь нагрели до комнатной температуры и перемешивали в течение ночи. Смесь отфильтровали, а фильтрат сконцентрировали с получением неочищенного нафтален-2-илфосфородихлоридата в виде светло-желтого масла (2.5 г, 69%) и использовали на следующей стадии без дополнительной очистки. Стадия B.(S)-Изопропил-2-аминопропаноата гидрохлорид (Oakwood, 500 мг, 2.98 ммоль) и нафтален-2-илфосфородихлоридат (724 мг, 2.98 ммоль) суспендировали в безводном ДХМ (25 мл). Реакционную смесь охладили до -78C. Триэтиламин (604 мг, 830 мкл, 5.97 ммоль) добавили по каплям. Реакционную смесь перемешивали при -78C в течение 1 ч, затем дали нагреться до комнатной температуры и перемешивали в течение 5 ч. Растворитель удалили, а остаток промыли безводным этиловым эфиром и отфильтровали. Фильтрат сконцентрировали с получением неочищенного (2S)-изопропил-2-(хлор(нафтален-2 илокси)фосфориламино)пропаноата в виде светло-желтого масла (0.8 г, 75%) и использовали без дополнительной очистки. Стадия C. К раствору хирального 1-2R,3R,4S,5S)-3,5-дифтор-4-гидрокси-5-(гидроксиметил)-3 метилтетрагидрофуран-2-ил)пиримидин-2,4(1H,3H)-диона (60 мг, 216 мкмоль) полученного в Получении 6 в ТГФ (8 мл), добавили ТГФ раствор (Aldrich, 1 М) трет-бутилмагния хлорида (539 мкл, 539 мкмоль) по каплям. Смесь перемешивали при комнатной температуре в течение 15 мин с последующим добавлением ТГФ раствора (0.5 М), (2S)-изопропил-2-(хлор(нафтален-2-илокси)фосфориламино)пропаноата (1.08 мл,539 мкмоль). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч, затем добавили дополнительное количество ТГФ раствора (Aldrich, 1 М) трет-бутилмагния хлорида (270 мкл,270 мкмоль) и ТГФ раствора (0.5 М) (2S)-изопропил 2-(хлор(нафтален-2-илокси)фосфориламино)пропаноата (0.54 мл, 270 мкмоль). Реакционную смесь затем перемешивали при комнатной температуре в течение 18 ч. Метанол (2 мл) добавили, чтобы погасить реакцию, смесь очистили посредством флэш-хроматографии (силикагель, 1- 18% MeOH в ДХМ) и высушили под вакуумом с получением соединения, указанного в заголовке, в виде белого осадка (75 мг, 58%). М.М. 916.81 C42H48F2N4O13P2 В способе, описанном для получения (S)-2-(2S,3S,4R,5R)-5-(2,4-диоксо-3,4-дигидро-2Hпиримидин-1-ил)-2,4-дифтор-3-гидрокси-4-метилтетрагидрофуран-2-илметокси]-(нафтален-2 илокси)фосфориламино]пропионовой кислоты изопропилового эфира в примере 3, стадия C, (S)-2(2S,3S,4R,5R)-5-(2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-2,4-дифтор-3-[S)-1 изопропоксикарбонилэтиламино)-(нафтален-2-илокси)фосфорилокси]-4-метилтетрагидрофуран-2 илметокси]-(нафтален-2-илокси)фосфориламино]пропионовой кислоты изопропиловый эфир получили в качестве второго продукта: белый осадок, 8 мг (4%). М.М. 653.58 C29H34F2N3O9P К раствору (S)-2-(2S,3S,4R,5R)-5-(2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-2,4-дифтор-3 гидрокси-4-метилтетрагидро-фуран-2-илметокси]-(нафтален-1-илокси)фосфориламино]пропионовой кислоты изопропилового эфира, полученного в примере 2 (86 мг, 144 мкмоль) в ТГФ (10 мл), добавили пропионилхлорид (66.6 мг, 720 мкмоль) и DMAP (87.9 мг, 720 мкмоль). Реакционную смесь перемешивали при комнатной температуре в течение 5 ч. Смесь разбавили этилацетатом, промыли водой, солевым раствором. Органический слой отделили, высушили над MgSO4 и сконцентрировали. Остаток очистили посредством флэш-хроматографии (силикагель, 40 г, 0-15% MeOH в ДХМ) с получением соединения,указанного в заголовке, в виде белого осадка (45 мг, 48%).(S)-2-(2S,3S,4R,5R)-5-(2,4-Диоксо-3,4-дигидро-2H-пиримидин-1-ил)-2,4-дифтор-3-гидрокси-4 метилтетрагидрофуран-2-илметокси]-(нафтален-2-илокси)фосфориламино]пропионовой кислоты изопропиловый эфир, полученный в примере 3 (50 мг), разделили с помощью хиральной СКЖХ хроматографии с получением хирального (S)-2-[(S)-[(2S,3S,4R,5R)-5-(2,4-диоксо-3,4-дигидро-2H-пиримидин-1 ил)-2,4-дифтор-3-гидрокси-4-метилтетрагидрофуран-2-илметокси]-(нафтален-2 илокси)фосфориламино]пропионовой кислоты изопропилового эфира в виде белого осадка (27 мг, 54%)(S)-2-(2S,3S,4R,5R)-5-(2,4-Диоксо-3,4-дигидро-2H-пиримидин-1-ил)-2,4-дифтор-3-гидрокси-4 метилтетрагидрофуран-2-илметокси]-(нафтален-2-илокси)фосфориламино]пропионовой кислоты изопропиловый эфир, полученный в примере 3 (50 мг), разделили с помощью хиральной СКЖХ хроматографии с получением хирального (S)-2-[(R)-[(2S,3S,4R,5R)-5-(2,4-диоксо-3,4-дигидро-2H-пиримидин-1 ил)-2,4-дифтор-3-гидрокси-4-метилтетрагидрофуран-2-илметокси]-(нафтален-2 илокси)фосфориламино]пропионовой кислоты изопропилового эфира в виде белого осадка (12 мг, 24%).(S)-2-(2S,3S,4R,5R)-5-(2,4-Диоксо-3,4-дигидро-2H-пиримидин-1-ил)-2,4-дифтор-3-гидрокси-4 метилтетрагидрофуран-2-илметокси]-(нафтален-1-илокси)фосфориламино]пропионовой кислоты изопропиловый эфир, полученный в примере 2 (100 мг), разделили с помощью хиральной СКЖХ хроматографии с получением хирального (S)-2-[(R)-[(2S,3S,4R,5R)-5-(2,4-диоксо-3,4-дигидро-2H-пиримидин-1 ил)-2,4-дифтор-3-гидрокси-4-метилтетрагидрофуран-2-илметокси]-(нафтален-1 илокси)фосфориламино]пропионовой кислоты изопропилового эфира в виде белого осадка (24 мг, 24%).(S)-2-(2S,3S,4R,5R)-5-(2,4-Диоксо-3,4-дигидро-2H-пиримидин-1-ил)-2,4-дифтор-3-гидрокси-4 метилтетрагидрофуран-2-илметокси]-(нафтален-1-илокси)фосфориламино]пропионовой кислоты изопропиловый эфир, полученный в примере 2 (100 мг), разделили с помощью хиральной СКЖХ хроматографии с получением хирального (S)-2-[(S)-[(2S,3S,4R,5R)-5-(2,4-диоксо-3,4-дигидро-2H-пиримидин-1 ил)-2,4-дифтор-3-гидрокси-4-метилтетрагидрофуран-2-илметокси]-(нафтален-1 илокси)фосфориламино]пропионовой кислоты изопропилового эфира в виде белого осадка (53 мг, 53%).(S)-2-[(2S,3S,4R,5R)-5-(2,4-Диоксо-3,4-дигидро-2H-пиримидин-1-ил)-2,4-дифтор-3-гидрокси-4 метилтетрагидрофуран-2-илметокси]феноксифосфориламинопропионовой кислоты изопропиловый эфир, полученный в рримере 1 (0.18 г), разделили с помощью хиральной СКЖХ хроматографии с получением хирального (S)-2-(S)-[(2S,3S,4R,5R)-5-(2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-2,4-дифтор 3-гидрокси-4-метилтетрагидрофуран-2-илметокси]феноксифосфориламинопропионовой кислоты изопропилового эфира в виде белого осадка (60 мг, 33%).(S)-2-[(2S,3S,4R,5R)-5-(2,4-Диоксо-3,4-дигидро-2H-пиримидин-1-ил)-2,4-дифтор-3-гидрокси-4 метилтетрагидрофуран-2-илметокси]феноксифосфориламинопропионовой кислоты изопропиловый эфир, полученный в примере 1 (0.18 г), разделили с помощью хиральной СКЖХ хроматографии с получением хирального (S)-2-(R)-[(2S,3S,4R,5R)-5-(2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-2,4-дифтор 3-гидрокси-4-метилтетрагидрофуран-2-илметокси]феноксифосфориламинопропионовой кислоты изопропилового эфира в виде белого осадка (28 мг, 16%).- 22024297 Стадия A. К раствору хирального 5-бромо-1-(2R,3R,4S,5S)-3,5-дифтор-4-гидрокси-5-гидроксиметил-3 метилтетрагидрофуран-2-ил)-1H-пиримидин-2,4-диона (50 мг, 0.14 ммоль), полученного в Получении 7,в ТГФ (3 мл) при 0C добавили ТГФ раствор (Aldrich, 1 М) трет-бутилмагния хлорида (0.35 мл,0.35 ммоль) по каплям. Смесь перемешивали при 0C в течение 15 мин с последующим добавлением ТГФ раствора (0.5 М) (2S)-изопропил 2-(хлор(нафтален-1-илокси)фосфориламино)пропаноата, полученного в примере 2, стадия B (0.7 мл, 0.35 ммоль). Реакционную смесь нагрели до комнатной температуры и перемешивали в течение 2 ч. Метанол (2 мл) добавили, чтобы погасить реакцию. Смесь очистили посредством флэш-хроматографии (5-10% MeOH в ДХМ) с получением (S)-2-(2S,3S,4R,5R)-5-(5-бромо 2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-2,4-дифтор-3-гидрокси-4-метилтетрагидрофуран-2 илметокси]-(нафтален-1-илокси)фосфориламино]пропионовой кислоты изопропилового эфира в виде белого осадка (50 мг, 52%). Стадия B.(S)-2-(2S,3S,4R,5R)-5-(5-Бромо-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-2,4-дифтор-3 гидрокси-4-метилтетрагидрофуран-2-илметокси]-(нафтален-1-илокси)фосфориламино]пропионовой кислоты изопропиловый эфир (50 мг) разделили с помощью хиральной СКЖХ хроматографии с получением хирального (S)-2-[(S)-[(2S,3S,4R,5R)-5-(5-бромо-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-2,4 дифтор-3-гидрокси-4-метилтетрагидрофуран-2-илметокси]-(нафтален-1 илокси)фосфориламино]пропионовой кислоты изопропилового эфира в виде белого осадка (11 мг, 22%).(S)-2-(2S,3S,4R,5R)-5-(5-Бромо-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-2,4-дифтор-3 гидрокси-4-метилтетрагидрофуран-2-илметокси]-(нафтален-2-илокси)фосфориламино]пропионовой кислоты изопропиловый эфир, полученный в примере 16 (50 мг), разделили с помощью хиральной СКЖХ хроматографии с получением хирального (S)-2-[(S)-[(2S,3S,4R,5R)-5-(5-бромо-2,4-диоксо-3,4-дигидро 2H-пиримидин-1-ил)-2,4-дифтор-3-гидрокси-4-метилтетрагидрофуран-2-илметокси]-(нафтален-2 илокси)фосфориламино]пропионовой кислоты изопропилового эфира в виде белого осадка (27 мг, 54%). М.М. 676.41 C26H39Br2N3O9P В процессе разделения (S)-2-(2S,3S,4R,5R)-5-(5-бромо-2,4-диоксо-3,4-дигидро-2H-пиримидин-1 ил)-2,4-дифтор-3-гидрокси-4-метилтетрагидрофуран-2-илметокси]-(нафтален-1 илокси)фосфориламино]пропионовой кислоты изопропилового эфира (50 мг) с помощью хиральной СКЖХ хроматографии в примере 12, стадия B, хиральный (S)-2-[(R)-[(2S,3S,4R,5R)-5-(5-бромо-2,4 диоксо-3,4-дигидро-2H-пиримидин-1-ил)-2,4-дифтор-3-гидрокси-4-метилтетрагидрофуран-2-илметокси](нафтален-1-илокси)фосфориламино]пропионовой кислоты изопропиловый эфир получили в качестве второго продукта: белый осадок (8 мг, 16%). М.М. 676.41 C26H39Br2N3O9P В процессе разделения (S)-2-(2S,3S,4R,5R)-5-(5-бромо-2,4-диоксо-3,4-дигидро-2H-пиримидин-1 ил)-2,4-дифтор-3-гидрокси-4-метилтетрагидрофуран-2-илметокси]-(нафтален-2 илокси)фосфориламино]пропионовой кислоты изопропилового эфира, полученного в примере 16 (50 мг),с помощью хиральной СКЖХ хроматографии хиральный (S)-2-[(R)-[(2S,3S,4R,5R)-5-(5-бромо-2,4 диоксо-3,4-дигидро-2H-пиримидин-1-ил)-2,4-дифтор-3-гидрокси-4-метилтетрагидрофуран-2-илметокси](нафтален-2-илокси)фосфориламино]пропионовой кислоты изопропиловый эфир получили в качестве второго продукта: белый осадок (16 мг, 32%). М.М. 676.41 C26H39Br2N3O9P К раствору хирального 5-бромо-1-2R,3R,4S,5S)-3,5-дифтор-4-гидрокси-5-гидроксиметил-3 метилтетрагидрофуран-2-ил)-1H-пиримидин-2,4-диона (92 мг, 0.26 ммоль), полученного в Получении 7,в ТГФ (3 мл) при 0 С добавили ТГФ раствор (Aldrich, 1 М) трет-бутилмагния хлорида (0.64 мл,0.64 ммоль) по каплям. Смесь перемешивали при 0 С в течение 15 мин с последующим добавлением ТГФ раствора (0.5 М) (2S)-изопропил 2-(хлор(нафтален-2-илокси)фосфориламино)пропаноата, полученного в примере 3, стадия B (1.29 мл, 0.64 ммоль). Реакционную смесь нагрели до комнатной температуры и перемешивали в течение 2 ч. Метанол (2 мл) добавили, чтобы погасить реакцию. Смесь очистили посредством флэш-хроматографии (5-10% MeOH в ДХМ) с получением соединения, указанного в заголовке, в виде белого осадка (56 мг, 32%).LC-MS (М)+ = 676.0. Биологические примеры. Анализ репликона ВГС. Этот анализ измеряет способность соединений формулы I ингибировать репликацию РНК ВГС и,таким образом, их потенциальную ценность для лечения ВГС инфекций. Данный анализ использует репортер в качестве единственного показателя внутриклеточного уровня РНК репликона ВГС. Ген люциферазы Renilla ввели в первую открытую рамку считывания генотипированного конструкта репликона 1bNK5.1 (N. Krieger et al., J. Virol. 2001, 75(10):4614) сразу после внутренней последовательности сайта связывания рибосомы (IRES), слитого с геном неомицинфосфотрансферазы (NPTII) через саморасщепляемый пептид 2 А из вируса ящура (M.D. RyanJ. Drew, EMBO 1994, 13(4):928-933). После in vitro транскрипции РНК электропорировали в клетки гепатомы человека Huh7, устойчивые к G418 колонии были отделены и размножены. Стабильно выделенная клеточная линия 2209-23 содержала репликативную субгеномную РНК ВГС, и активность люциферазы Renilla, эксперссируемой репликоном отражала его уровень РНК в клетках. Анализ проводили в повторных планшетах, один в матово-белых и один в прозрачных, с целью измерить противовирусную активность и цитотоксичность химических соединений в параллелях, чтобы быть уверенным, что наблюдаемая активность не является результатом сниженной- 24024297 пролиферации клеток или гибели клеток. Клетки ВГС репликона (2209-23), которые экспрессируют репортер люциферазы Renilla, культивировали в среде Дульбекко MEM (Invitrogen cat no. 10569-010) с 5% фетальной бычьей сывороткой (FBS,Invitrogen cat. no. 10082-147), высевали на 96-луночные планшеты в количестве 5000 клеток/лунку и инкубировали в течение ночи. 24 ч спустя различные разведения химических соединений в ростовой среде добавили к клеткам, которые затем инкубировали при 37C в течение трех дней. По окончании времени инкубации клетки в белых планшетах собрали и люциферазную активность измеряли с помощью системы анализа люциферазы R. luciferase (Promega cat no. E2820). Все реагенты, описанные в следующем абзаце, находились в составе набора производителя, и для получения реагентов следовали инструкциям производителя. Клетки один раз промыли 100 мкл фосфатно-солевого буфера (pH 7.0) (PBS) на лунку и лизировали с помощью 20 мкл 1 R. luciferase Assay лизирующим буфером перед инкубацией при комнатной температуре в течение 20 мин. Планшет затем поместили в микропланшетный люминометрCentra LB 960 (Berthold Technologies), в каждую лунку добавили 100 мкл R. luciferase Assay буфера и сигнал измеряли с использвоанием 2-секундной задержки, 2-секундная программа измерений. IC50, концентрация лекарства, необходимая для снижения уровня репликонов на 50% по сравнению с контрольным значением необработанных клеток, может быть подсчитана на основе кривой процентов снижения люциферазной активности против концентрации лекарственного средства, как описано выше. Для анализа цитотоксичности использовали реагент WST-1 от компании Diagnostic (cat no. 1644807). 10 мкл WST-1 реагента добавили в каждую лунку прозрачных планшетов, включая лунки, которые содержали только среду в качестве контроля. Затем клетки инкубировали в течение 2 ч при 37C,значения ОП измерили с использованием микропланшетного ридера MRX Revelation (Lab System) при 450 нм (референсный фильтр на 650 нм). Снова CC50, концентрация лекарства, необходимая для снижения клеточной пролиферации на 50% по сравнению с контрольным уровнем необработанных клеток,может быть подсчитана на основе кривой процента снижения значения WST-1 против концентрации лекарственного средства, как описано выше. Иллюстративные биологические данные показаны в табл. 2. Таблица 2 Следует понимать, что отсылка на лечение в настоящем изобретении распространяется как на профилактику, так и на лечение существующих состояний и что лечение животных включает лечение как людей, так и других млекопитающих. Кроме того, лечение инфекции вируса гепатита C (ВГС), как используется здесь, также включает лечение или профилактику заболевания или состояния, связанного с или опосредованного инфекцией вирусом гепатита C (ВГС), или их клинических симптомов. Признаки, раскрытые в вышеприведенном описании, или последующей формуле изобретения, или в прилагаемых фигурах, выраженные в их конкретных формах или в терминах средств для выполнения описанной функции, или способ или процесс для достижения описанного результата, при необходимости, могут отдельно или в любой комбинации таких элементов быть использованы для реализации настоящего изобретения в его различных формах. Изложенное выше изобретение было описано в некоторых деталях с целью иллюстрирования и в качестве примера для наглядности и понимания. Для специалиста в данной области очевидно, что в рамках формулы изобретения могут быть осуществлены изменения и модификации. Поэтому следует понимать, что приведенное выше описание предназначено для иллюстрации, а не ограничения. Объем изобретения, следовательно, не должен быть ограничен приведенным выше описанием, но должен определяться с учетом формулы изобретения, наряду с полным объемом эквивалентов, к которым применима указанная формула изобретения. Все патенты, патентные заявки и публикации, цитируемые в данном описании, включены в качестве ссылки во всей своей полноте для всех целей в той же степени, как если бы каждый отдельный патент,заявка на патент или публикация были отдельно описаны.R7 представляет собой C(R2aR2b)COOR3,или его фармацевтически приемлемые соли. 2. Соединение по п.1, где R6 представляет собой H или Br. 3. Соединение по п.2, где R1 представляет собой нафтил или фенил. 4. Соединение по п.3, где R2a представляет собой H. 5. Соединение по п.4, где R2b представляет собой метил. 6. Соединение по п.5, где R3 представляет собой изопропил. 7. Соединение по п.6, где R5 представляет собой H. 8. Соединение по п.6, где R5 представляет собой C(=O)R1c. 9. Соединение по п.8, где R1c представляет собой этил. 10. Соединение по п.6, где R5 представляет собой P(=O)(OR1)(NR4R7). 11. Соединение по п.10, где R1 представляет собой нафтил. 12. Соединение по п.11, где R4 представляет собой H и R7 представляет собой(S)-2-(2S,3S,4R,5R)-5-(5-бромо-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-2,4-дифтор-3 гидрокси-4-метилтетрагидрофуран-2-илметокси]-(нафтален-2-илокси)фосфориламино]пропионовой кислоты изопропилового эфира. 14. Применение соединения по любому из пп.1-13 в качестве терапевтически активного вещества. 15. Фармацевтическая композиция, содержащая соединение по любому из пп.1-13 и терапевтически инертный носитель. 16. Применение соединения по любому из пп.1-13 для лечения или профилактики инфекции вируса гепатита C (ВГС). 17. Применение соединения по любому из пп.1-13 при получении лекарственного средства для лечения или профилактики инфекции вируса гепатита C (ВГС). 18. Способ лечения инфекции вируса гепатита C (ВГС), включающий введение нуждающемуся в этом пациенту терапевтически эффективного количества соединения по любому из пп.1-13.
МПК / Метки
МПК: C07H 19/06, A61P 31/14, A61K 31/7072
Метки: рнк, гепатита, ингибиторов, репликации, вируса, нуклеозидные, 2',4'-дифтор-2'-метилзамещенные, качестве, производные
Код ссылки
<a href="https://eas.patents.su/28-24297-24-diftor-2-metilzameshhennye-nukleozidnye-proizvodnye-v-kachestve-ingibitorov-replikacii-rnk-virusa-gepatita-s.html" rel="bookmark" title="База патентов Евразийского Союза">2′,4′-дифтор-2′-метилзамещенные нуклеозидные производные в качестве ингибиторов репликации рнк вируса гепатита с</a>
Следующий патент: Рычаг автомобильной подвески и способ его изготовления
Случайный патент: Высококонцентрированные стабильные растворы мелоксикама
































