Макроциклические производные индола, пригодные в качестве ингибиторов вируса гепатита с
Номер патента: 19008
Опубликовано: 30.12.2013
Авторы: Вендевилль Сандрин Мари Элен, Тахри Абделлах, Линь Тсе-И, Рабуассон Пьер Жан-Мари Бернар, Амссомс Кати Ингрид Эдуард
Формула / Реферат
1. Соединение формулы (I)

включая его стереохимически изомерные формы, и N-оксиды, соли, гидраты и сольваты, где
R1 означает двухвалентную цепь, выбранную из
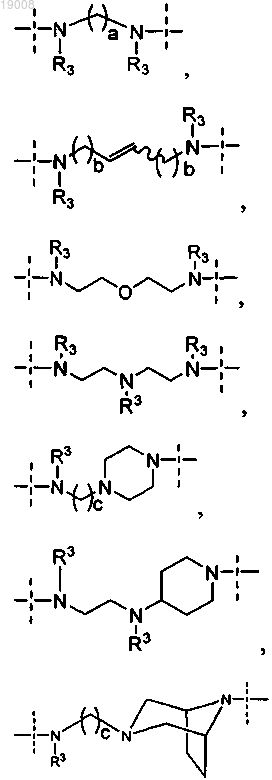
и
каждая группа R3 независимо выбрана из группы, состоящей из водорода, C1-4алкила и C3-5циклоалкила;
а равно 3, 4, 5 или 6;
каждый b независимо равен 1 или 2;
с равно 1 или 2;
макроцикл А содержит от 14 до 18 атомов в цикле, в частности макроцикл А имеет 17 или 18 атомов в цикле;
каждая группа R2 независимо означает водород, галоген или C1-4алкокси;
группы R4 и R5 означают водород или R4 и R5 вместе образуют двойную связь или метиленовую группу с образованием конденсированного циклопропила;
R6 является водородом или метилом;
R7 означает С3-7циклоалкил, необязательно замещенный галогеном.
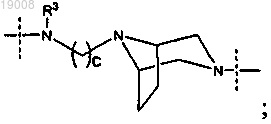
2. Соединение по п.1, где
R1 выбирают из -N(R3)-(СН2)4-N(R3)-,
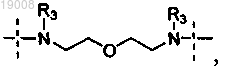

и
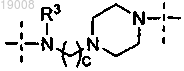
и каждая группа R3 независимо выбрана из водорода и метила.
3. Соединение по любому из пп.1 или 2, где R2 расположен в пара-положении бензольной группы относительно связи, связывающей указанный бензол с индольной группой.
4. Соединение по любому из пп.1-3, где R2 выбирают из фтора и метокси.
5. Соединение по любому из пп.1-4, где R7 выбирают из циклогексила и 2-фторциклогексила.
6. Соединение по любому из пп.1-5, где R4 и R5 вместе образуют двойную связь.
7. Соединение по любому из пп.1-5, где соединения формулы (I) имеют стереохимическую конфигурацию, как представлено формулой (IA)
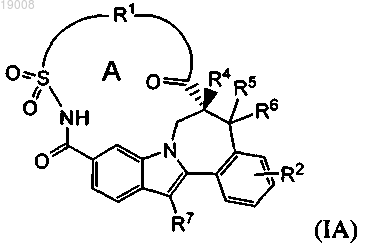
8. Соединение по любому из пп.1-3, имеющее одну из структурных формул II-1, II-2, II-3, III-1, III-2, III-3, III-4, IV-1, IV-2 или IV-3
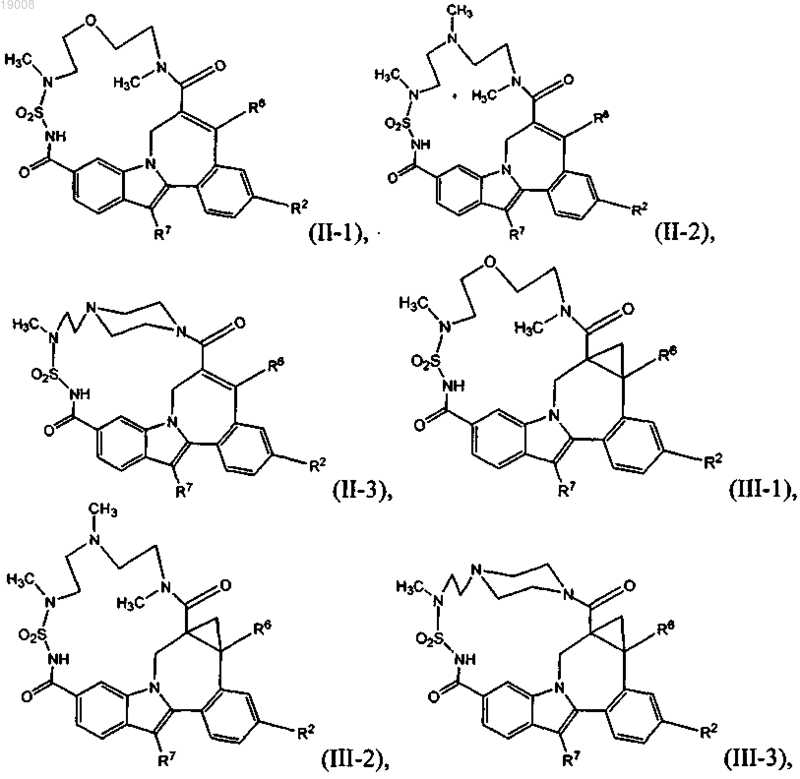
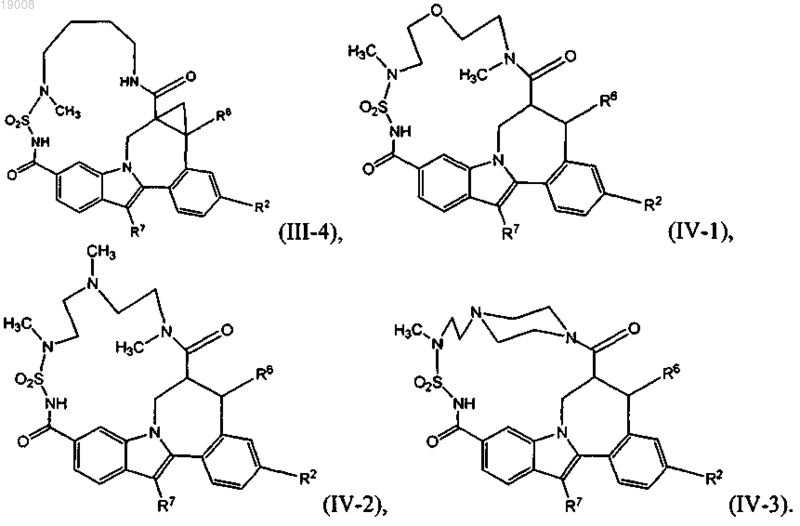
9. Соединение, имеющее структуру формулы

10. Фармацевтическая композиция, содержащая носитель и в качестве активного ингредиента соединение по любому из пп.1-9, в эффективном против вируса количестве.
11. Фармацевтическая композиция по п.10, содержащая в качестве активного ингредиента соединение по п.9.
12. Фармацевтическая композиция по п.10 или 11, дополнительно содержащая по меньшей мере одно другое соединение, проявляющее эффективность против HCV.
13. Фармацевтическая композиция по любому из пп.10-12, дополнительно содержащая по меньшей мере одно соединение, проявляющее эффективность против ВИЧ.
14. Применение соединения по любому из пп.1-9 в качестве лекарственного средства.
15. Применение фармацевтической композиции по любому из пп.10-13 в качестве лекарственного средства.
16. Применение соединения по любому из пп.1-9 для ингибирования репликации HCV.
17. Применение фармацевтической композиции по любому из пп.10-13 для ингибирования репликации HCV.
18. Применение соединения по любому из пп.1-9 для производства лекарственного средства для ингибирования репликации HCV.
Текст
МАКРОЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ ИНДОЛА, ПРИГОДНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ ВИРУСА ГЕПАТИТА С Вендевилль Сандрин Мари Элен,Рабуассон Пьер Жан-Мари Бернар,Линь Тсе-И, Тахри Абделлах, Амссомс Кати Ингрид Эдуард (BE) включая их стереохимически изомерные формы, соли, гидраты, сольваты, где R1, R2, R4, R5, R6 и R7 имеют значения, определенные в формуле изобретения. Настоящее изобретение также относится к способам получения указанных соединений, фармацевтическим композициям, содержащим соединения, и к их применению в терапии HCV-инфекции. Область изобретения Изобретение относится к макроциклическим производным индола, оказывающим ингибирующее действие на репликацию вируса гепатита С (HCV). Изобретение также касается композиций, содержащих указанные соединения в качестве активных ингредиентов, а также способов получения указанных соединений и композиций. Предыдущий уровень техники Вирус гепатита С является основной причиной хронического заболевания печени, распространенного по всему миру, и становится центром внимания большинства медицинских исследований. HCV является членом семейства вирусов Flaviviridae рода hepacivirus и тесно связан с родом flavivirus, который включает ряд вирусов, причастных к болезни человека, таких как вирус денге и вирус желтой лихорадки,и с семейством вирусов животных pestivirus, которое включает вирус диареи крупного рогатого скота(BVDV). Геном вируса HCV представлен положительно-смысловой одноцепочечной линейной РНК, содержащей около 9600 оснований. Геном включает как 5'-, так и 3'-нетранслируемые области, которые принимают вторичные структуры РНК, и центральную открытую рамку считывания, которая кодирует единственный полипротеин, размером около 3010-3030 аминокислотных остатков. Полипротеин кодирует десять генных продуктов, которые образуются из полипротеина-предшественника посредством организованной серии ко- и посттрансляционных эндопротеолитических расщеплений, опосредованных как протеазами хозяина, так и вирусными протеазами. Структурные белки вирусов включают ядерный нуклеокапсидный белок и два гликопротеина вирусной оболочки Е 1 и Е 2. Участки РНК HCV, кодирующие неструктурные (NS) белки с несколькими существенными для вируса ферментативными функциями (хеликаза, полимераза, протеаза), также кодируют белки с неизвестной функцией. Репликация вирусного генома опосредуется РНК-зависимой РНК-полимеразой, информацию о которой несет участок неструктурного белка РНК 5b (NS5B). В дополнение к полимеразе, функции геликазы и протеазы, обусловленные бифункциональным белком, кодированным участком NS3, как показано, являются существенными для репликации РНК вируса HCV. Помимо сериновой протеазы, кодированной участком NS3, HCV также кодирует металлопротеиназу в области NS2. Репликация HCV предпочтительно протекает в гепатоцитах, но не является непосредственно цитопатической, приводя к стабильной инфекции. В частности, оказалось, что недостаток сильной ответной реакции Т-лимфоцитов и большая склонность вируса к мутации стимулируют высокую частоту хронической инфекции. Существует 6 основных генотипов HCV и более 50 подтипов, которые географически распределены различным образом. HCV типа 1 является доминирующим генотипом в США и Европе. Например, HCV типа 1 насчитывает от 70 до 75% всех HCV инфекций в Соединенных Штатах. Большая генетическая гетерогенность HCV имеет важные диагностические и клинические последствия, возможно, объясняя трудности в разработке вакцин и недостаточную ответную реакцию на лечение. Как оценивается, 170 млн человек во всем мире инфицировано вирусом гепатита С (HCV). После появления первоначальной острой инфекции у большинства инфицированных индивидуумов развивается хронический гепатит, который может перейти в фиброз печени, приводящий к циррозу, конечной стадии заболевания печени, и НСС (гепатоклеточная карцинома) (National Institutes of Health Consensus Development Conference Statement: Management of Hepatitis С. Hepatology, 36, 5 Suppl. S3-S20, 2002). Цирроз печени, возникающий вследствие инфекции HCV, приводит примерно к 10000 смертям в год только в США и является основной причиной для трансплантации печени. Передача HCV может происходить за счет контакта с зараженной кровью и продуктами крови, например, после переливания крови или внутривенного введения лекарственных средств. Включение диагностических тестов, используемых при скрининге крови,привело к снижению случаев распространения инфекции HCV после переливания крови. Однако, принимая во внимание медленное прогрессирование заболевания печени до конечной стадии заболевания,существующие инфекции будут продолжать еще в течение десятилетий представлять собой серьезную медицинскую и экономическую проблему (Kim, W.R. Hepatology, 36, 5 Suppl. S30-S34, 2002). Существующая в настоящее время терапия основана на (пэгилированном) интерфероне-альфа (IFN) в комбинации с рибавирином. Такая комбинированная терапия проводит к стойкому вирологическому ответу более чем у 40% больных, инфицированных вирусами генотипа 1, и примерно у 80% больных,инфицированных генотипами 2 и 3. Помимо ограниченного действия на HCV типа 1, комбинированная терапия имеет значительные побочные действия и плохо переносится большинством пациентов. Например, в зарегистрированных исследованиях с использованием пэгилированного интерферона и рибавирина заметные побочные действия приводили к приостановке лечения у приблизительно от 10 до 14 процентов больных. Основные побочные эффекты комбинированной терапии включают симптомы подобного гриппу заболевания, гематологические нарушения и нейропсихиатрические симптомы. Разработка более эффективного, удобного и легче переносимого лечения является главной задачей общественного здравоохранения. Таким образом, лечение такого хронического заболевания представляет собой неудовлетворенную клиническую потребность, поскольку существующая терапия только частично эффективна и ограничена нежелательными побочными эффектами. Одной областью особого интереса был поиск ингибиторов NS5b РНК-зависимой РНК-полимеразы(RdRp). Близкие структурные гомологи данной полимеразы не существуют в неинфицированной клетке хозяина, и обнаружение ингибиторов указанной выше полимеразы предоставит более конкретный тип действия. Ингибиторы, которые в настоящее время рассматриваются, могут быть классифицированы либо как нуклеозидные ингибиторы (N1), либо как ненуклеозидные ингибиторы (NNI). N1 непосредственно конкурируют с нуклеотидными субстратами за связывание с высококонсервативными активными участками. Большей специфичности можно достичь ингибиторами NNI, которые могут взаимодействовать вне высококонсервативного активного участка у уникального аллостерического участка, присущего только структурно родственным полимеразам. Описаны производные индола с ингибирующей HCV активностью. Международная публикацияWO 2007/092000 описывает тетрациклические производные индола в качестве ингибиторов HCV NS5B для лечения и/или предотвращения инфицирования вирусом HCV. Заявка US 2008/0146537 описывает конденсированные с циклопропилом индолобензазепиновые ингибиторы HCV NS5B. Международная публикация WO 2008/075103 описывает макроциклические производные индола, пригодные для лечения или предотвращения инфекции вирусом гепатита С. В настоящее время предварительные клинические испытания претерпели много неудач, тем самым,выдвигая на первый план необходимость продолжить поиск новых ингибиторов NS5b. До сих пор существует высокая медицинская потребность в безопасной и эффективной терапии, направленной против вируса HCV. Такие ингибиторы HCV могут преодолеть недостатки существующей терапии инфекцииHCV, такие как побочные эффекты, ограниченная эффективность, появление устойчивости и нарушения соблюдения режима терапии, а также улучшить устойчивый вирусологический ответ. В частности, в случаях, где терапевтические соединения имеют подходящую биодоступность и благоприятный фармакокинетический и метаболический профиль. Сущность изобретения Было обнаружено, что некоторые макроциклические производные индола проявляют противовирусную активность у субъектов, инфицированных вирусом HCV, с пригодными свойствами относительно одного или более следующих параметров: противовирусная эффективность, благоприятный мутантный профиль, отсутствие токсичности, благоприятный фармакокинетический и метаболический профиль и легкость получения и введения. Следовательно, указанные соединения пригодны в лечении или борьбе с инфекциями HCV. Настоящее изобретение относится к ингибиторам репликации HCV, которые могут быть представлены формулой (I) включая их стереохимически изомерные формы и N-оксиды, соли, гидраты и сольваты, гдеR1 представляет собой двухвалентную цепь, выбранную из каждая группа R3 независимо выбрана из группы, состоящей из водорода, C1-4 алкила иC3-5 циклоалкила; а равно 3, 4, 5 или 6; каждый b независимо равен 1 или 2; с равно 1 или 2; макроцикл А содержит от 14 до 18 атомов в цикле; каждая группа R2 независимо означает водород, галоген или С 1-4 алкокси; группы R4 и R5 означают водород, или R4 и R5 вместе образуют двойную связь или метиленовую группу с образованием конденсированного циклопропила;R6 является водородом или метилом;R7 означает С 3-7 циклоалкил, необязательно замещенный галогеном. Изобретение также относится к способам получения соединений формулы (I), включая их стереохимически изомерные формы и N-оксиды, четвертичные амины, комплексы с металлами, соли, гидраты и сольваты, их промежуточные соединения и применение промежуточных соединений в получении соединений формулы (I). Изобретение относится к соединениям формулы (I) как таковым, включая их стереохимически изомерные формы и N-оксиды, четвертичные амины, комплексы с металлами, соли, гидраты или сольваты,для их применения в качестве лекарственного средства. Изобретение относится к соединениям формулы(I) как таковым, включая их стереохимически изомерные формы и N-оксиды, четвертичные амины, комплексы с металлами, соли, гидраты или сольваты, для лечения гепатита С. Изобретение также относится к фармацевтическим композициям, содержащим носитель и эффективное против вирусов количество соединения формулы (I), как указано в описании. Фармацевтические композиции могут содержать комбинации упомянутых выше соединений с другими средствами, направленными против вируса HCV. Фармацевтические композиции могут содержать комбинации упомянутых выше соединений со средствами против вируса ВИЧ. Изобретение также относится к указанным выше фармацевтическим композициям для введения субъекту, страдающему от инфекции HCV. Изобретение также относится к применению соединения формулы (I), включая его стереохимически изомерные формы и N-оксиды, четвертичные амины, комплексы с металлами, соли, гидраты или сольваты, для производства лекарственного средства для ингибирования репликации HCV. Изобретение также относится к применению соединения формулы (I), включая его стереохимически изомерные формы и N-оксиды, четвертичные амины, комплексы с металлами, соли, гидраты или сольваты, для производства лекарственного средства для предотвращения или лечения состояний, ассоциированных с HCV. Изобретение также относится к способу ингибирования репликации вируса HCV у теплокровных животных, где указанный способ включает введение эффективного количества соединения формулы (I), включая его стереохимически изомерные формы и N-оксиды, четвертичные амины, комплексы с металлами,соли, гидраты или сольваты. Изобретение также относится к способу предотвращения или лечения состояний, ассоциированных с HCV, у теплокровных животных, где указанный способ включает введение эффективного количества соединения формулы (I), включая его стереохимически изомерные формы и Nоксиды, четвертичные амины, комплексы с металлами, соли, гидраты или сольваты. Подробное описание изобретения Далее будет описано настоящее изобретение. В следующих параграфах различные аспекты или варианты осуществления изобретения определены в деталях. Каждый аспект или вариант осуществления изобретения, определенный таким образом, может быть объединен с любым другим аспектом(ами) или вариантом(ами) осуществления изобретения, если четко не указано иное. В частности, любой признак,указанный как предпочтительный или благоприятный, может быть комбинирован с любым другим признаком или признаками, указанными как предпочтительные или благоприятные, для разработки конкретного случая осуществления изобретения. Как употребляют в описании выше и ниже, следующие определения используют, если не указано иное. В описании настоящего изобретения термины "субъект" или "инфицированный субъект" или"больной" относятся к индивидууму, инфицированному вирусом HCV, при необходимости лечения. Термин "галоид" или "галоген" является обобщенным для фтора, хлора, брома и йода. Как употребляют в описании, "C1-4 алкил", как группа или часть группы, означает насыщенные углеводородные радикалы с прямой или разветвленной цепью, содержащие от 1 до 4 атомов углерода, такие как, например, метил, этил, проп-1-ил, проп-2-ил, бут-1-ил, бут-2-ил, изобутил, 2-метилпроп-1-ил;"C1-3 алкил", как группа или часть группы, означает насыщенные углеводородные радикалы с прямой или разветвленной цепью, содержащие от 1 до 3 атомов углерода, такие как, например, метил, этил, проп-1 ил, проп-2-ил. Термин "C1-6 алкилен", как группа или часть группы, относится к C1-6 алкильным группам, которые являются двухвалентными, т.е. с двумя простыми связями для присоединения к двум другим группам. Неограничивающие примеры алкиленовых групп включают метилен, этилен, метилметилен, пропилен,этилэтилен, 1-метилэтилен и 1,2-диметилэтилен. Термин "С 3-7 циклоалкил" является обобщенным для циклопропила, циклобутила, циклопентила,циклогексила и циклогептила. Термин "С 3-5 циклоалкил" обозначает циклопропил, циклобутил и циклопентил. Термин "C1-4 алкокси" или "C1-4 алкилокси", как группа или часть группы, относится к радикалу формулы -ORa, где Ra является C1-4 алкилом, как определено выше. Неограничивающие примеры подходящей C1-4 алкоксигруппы включают метокси, этокси, пропокси, изопропокси, бутокси, изобутокси, вторбутокси и трет-бутокси. Следует отметить, что положения радикала на любом фрагменте молекулы, используемом в определениях, могут быть где угодно на таком фрагменте до тех пор, пока он является химически устойчивым. Радикалы, используемые в определениях переменных, включают все возможные изомеры, если не указано иное. Например, пиперидинил включает пиперидин-1-ил, пиперидин-2-ил, пиперидин-3-ил и пиперидин-4-ил; пентил включает пент-1-ил, пент-2-ил и пент-3-ил. В случае, когда любая переменная встречается более одного раза в любой составной части, каждое определение является независимым. Всякий раз, когда используется термин "соединения формулы (I)" или "соединения согласно настоящему изобретению" или подобные термины, он предназначен включать соединения формулы (I),включающие их стереохимически изомерные формы и их N-оксиды, четвертичные амины, комплексы с металлами, соли, гидраты и сольваты. Один вариант осуществления изобретения включает соединения формулы (I) или любую их подгруппу, определенную в описании, включая их возможные стереохимически изомерные формы, а также N-оксиды, соли, гидраты и сольваты. Другой вариант осуществления изобретения включает соединения формулы (I) или любые их подгруппы, определенные в описании, включая их возможные стереохимически изомерные формы, а также N-оксиды, соли, гидраты и сольваты. Всякий раз, когда используется термин "необязательно замещенный", он предназначен включать незамещенный, а также замещенный по меньшей мере одним из определенных замещающих радикалов. Например, "C1-4 алкил, необязательно замещенный хлором", предназначен включать незамещенныйC1-4 алкил, а также C1-4 алкил, замещенный хлором. Соединения формулы (I) могут иметь один или более центров хиральности и могут существовать в виде стереохимически изомерных форм. Термин "стереохимически изомерные формы", как он использован в описании, означает все возможные соединения, построенные из одинаковых атомов, связанных одинаковой последовательностью связей, но имеющие различные трехмерные структуры, которыми соединения формулы (I) могут обладать. Согласно примерам, где (R) или (S) используют для обозначения абсолютной конфигурации хирального атома в заместителе, обозначение приведено, принимая во внимание соединение целиком, а не отдельный заместитель. В одном аспекте настоящее изобретение предоставляет соединения формулы (I) включая их стереохимически изомерные формы и N-оксиды, соли, гидраты и сольваты, где R1, R2,R , R , R6, R7 и А имеют такое же значение, как определено в описании. Варианты осуществления настоящего изобретения касаются соединений формулы (I) или любой их подгруппы, как определено в описании, где одно или более определений для R1, R2, R4, R5, R6 и R7, предусмотренных в вариантах осуществления изобретения ниже, используют: отдельные подгруппы соединений формулы (I) являются соединениями формулы (II), (III) или (IV) 4 где R1, R2, R4, R5, R6, R7 и А имеют такие же значения, как определены в описании. В одном варианте осуществления изобретения R1 является двухвалентной цепью, выбранной из В отдельном варианте осуществления изобретения R1 выбирают из и где а и с являются такими, как определено в описании выше, или где а равно 4 или 5, с равно 1 или 2. В другом отдельном варианте осуществления изобретения R1 выбирают из, понятно, что группа R1 может быть ориентирована в двух направлениях, т.е. пиперазинильный фрагмент может быть соединен с сульфонамидной группой, в то время как алифатический амин соединен с карбонильной группой, или пиперазинильный фрагмент соединен с карбонильной группой, и алифатический амин соединен с сульфонамидной группой., тогда пиперазинильный фрагмент соединен Предпочтительно, когда R1 является с карбонильной группой и алифатический амин соединен с сульфонамидной группой. В частном варианте осуществления изобретения R1 выбирают из В предпочтительном варианте осуществления изобретения R1 является В другом варианте осуществления изобретения R1 является В другом варианте осуществления изобретения R1 является В другом предпочтительном варианте осуществления изобретения R1 является Каждую группу R3 независимо выбирают из группы, состоящей из водорода, C1-4 алкила и С 3-5 циклоалкила. В частном варианте осуществления изобретения R3 независимо выбирают из группы,состоящей из водорода, метила, этила, изопропила и циклопропила. В более конкретном варианте осуществления изобретения каждую группу R3 независимо выбирают из группы, состоящей из водорода и метила; или R3 означает метил. Макроцикл А содержит от 14 до 18 атомов в цикле. В частном варианте осуществления изобретения макроцикл А содержит 16, 17 или 18 атомов в цикле. В более конкретном варианте осуществления изобретения А содержит 17 атомов в цикле. Группу R2 выбирают из группы, состоящей из водорода, галогена или C1-4 алкокси. В конкретном варианте осуществления изобретения R2 выбирают из группы, состоящей из водорода, хлора, фтора или метокси. В более конкретном варианте осуществления изобретения R2 означает водород, или метокси,или хлор; или, альтернативно, R2 означает фтор или метокси; или в предпочтительном варианте осуществления изобретения R2 означает метокси. В другом варианте осуществления изобретения группа R2 расположена в мета- или пара-положении бензольного кольца по отношению к связи, связывающей бензол с индольной группой. В предпочтительном варианте осуществления изобретения группа R2 расположена в пара-положении бензольного кольца по отношению к связи, связывающей данный бензол с индольной группой. Группы R4 и R5 означают водород, или R4 и R5 вместе образуют двойную связь или метиленовую группу с образованием конденсированного циклопропила. В частном варианте осуществления изобрете-6 019008 ния R4 и R5 означают водород, или R4 и R5 вместе образуют метиленовую группу с образованием конденсированного циклопропила. В другом частном варианте осуществления изобретения R4 и R5 вместе образуют двойную связь. В другом варианте осуществления изобретения группу R6 выбирают из водорода и метила. В отдельном варианте осуществления изобретения R6 означает водород, когда соединение формулы (I) является соединением формулы (III) или (IV). В другом частном варианте осуществления изобретения R6 означает метил, когда соединением формулы (I) является соединение формулы (II). Группа R7 означает C3-7 циклоалкил, необязательно замещенный галогеном. В частном варианте осуществления изобретения R7 выбирают из циклопентила, циклогексила и фторциклогексила (в частности, 2-фторциклогексила). В предпочтительном варианте осуществления изобретения R7 означает циклогексил. Отдельная подгруппа соединений формулы (I) представлена соединениями формулы (I), где R4 и R5 вместе образуют двойную связь и где используют одно или более определений для R1, R2, R6 и R7 в соответствии с вариантами осуществления изобретения. Более конкретной подгруппой соединений формулы(I) являются соединения формулы (II), где R1, R2, R4, R5, R6, R7 и А имеют такое же значение, как определено в описании. Более специфическими являются такие соединения, представленные следующими структурными формулами (II-1), (II-2) и (II-3), где R2, R6 и R7 имеют такое же значение, как определено в описании для соединений формулы (I) или их подгрупп. В частном варианте осуществления изобретение предоставляет соединения, независимо, формулы(II), (II-1), (II-2) и (II-3), где R6 означает водород или метил, более предпочтительно где R6 означает метил. В другом варианте осуществления изобретение предоставляет соединения формулы (II) или их подгруппы, где R7 означает циклогексил или 2-фторциклогексил. В другом варианте осуществления изобретение предоставляет соединения формулы (II) или их подгруппы, где R2 означает водород, метокси или хлор. Альтернативно, изобретение предоставляет соединения формулы (II) или их подгруппы, где R2 означает фтор или метокси. Частной подгруппой соединений формулы (I) являются соединения формулы (III), где R1, R2, R4, R5,6 7R , R и А имеют такое же значение, как определено в описании. Более специфическими являются такие соединения, представленные следующими структурными формулами (III-1), (III-2), (III-3) и (III-4), гдеR2, R6 и R7 имеют такое же значение, как определено в описании для соединений формулы (I). В частности, изобретение предоставляет соединения, независимо, формулы (III), (III-1), (III-2), (III3) и (III-4), где R6 означает водород. В другом варианте осуществления изобретение предоставляет соединения формулы (III) или их подгруппы, где R7 означает циклогексил или 2-фторциклогексил. В другом варианте осуществления изобретение предоставляет соединения формулы (III) или их подгруппы, где R2 означает водород, метокси или хлор. Частная подгруппа соединений формулы (I) представлена соединениями формулы (IV), где R1, R2,4 5R , R , R6, R7 и А имеют такое же значение, как определено в описании. Более специфическими являются такие соединения, представленные следующими структурными формулами (IV-1), (IV-2) и (IV-3), где R2,R6 и R7 имеют такое же значение, как определено в описании для соединений формулы (I). В другом варианте осуществления изобретение предоставляет соединения формулы (IV) или их подгруппы, где R7 означает циклогексил или 2-фторциклогексил. В другом варианте осуществления изобретение предоставляет соединения формулы (IV) или их подгруппы, где R2 означает водород, метокси или хлор. В конкретном варианте осуществления настоящее изобретение предоставляет соединения формулы(II-1), (III-1) и (IV-1). Другой вариант настоящего изобретения касается соединений формулы (II-2), (III2) и (IV-2). Другой вариант настоящего изобретения касается соединений формулы (II-3), (III-3) и (IV-3). В определенном варианте осуществления изобретение предоставляет соединения формулы (I), выбранные из группы, состоящей из В особенности, настоящее изобретение предоставляет соединения формулы (I), выбранные из Альтернативно, настоящее изобретение предоставляет соединения формулы (I), выбранные из В особенности, настоящее изобретение предоставляет соединения формулы (I), выбранные из Если не упомянуто или не указано иное, химическое обозначение соединения охватывает смесь некоторых или всех возможных стереохимически изомерных форм, которые указанное соединение может иметь. Указанная выше смесь может содержать все диастереомеры и/или энантиомеры основной молекулярной структуры указанного соединения. Все стереохимически изомерные формы соединений согласно настоящему изобретению, в чистом виде или в виде смеси с любой другой формой, предназначены быть включенными в объем настоящего изобретения. Чистые стереоизомерные формы соединений и промежуточных соединений, как отмечено в данном описании, определены как изомеры, по существу не содержащие других энантиомерных или диастереомерных форм той же основной молекулярной структуры указанных соединений или промежуточных соединений. В частности, термин "стереоизомерно чистый" относится к соединениям или промежуточным соединениям, имеющим избыток стереоизомера по меньшей мере 80% (т.е. минимум 90% одного изомера и максимум 10% других возможных изомеров), вплоть до избытка стереоизомера 100% (т.е. 100% одного изомера и отсутствие других), более конкретно к соединениям или промежуточным соединениям,имеющим избыток стереоизомера от 90 до 100%, еще более конкретно, имеющим избыток стереоизомера от 94 до 100%, и наиболее конкретно, имеющим избыток стереоизомера от 97 до 100%. Термины"энантиомерно чистый" и "диастереомерно чистый" следует понимать аналогичным образом, но имеющим отношение к избытку энантиомера и избытку диастереомера соответственно в рассматриваемых смесях. Чистые стереоизомерные формы соединений и промежуточных соединений согласно данному изо- 11019008 бретению могут быть получены с использованием известных в данной области способов. Например,энантиомеры могут быть отделены друг от друга путем селективной кристаллизации их диастереомерных солей, образованных с оптически активными кислотами или основаниями. Примерами являются винная кислота, дибензоилвинная кислота, дитолуоилвинная кислота и камфорсульфоновая кислота. Альтернативно, энантиомеры могут быть разделены хроматографическими методами с использованием хиральных стационарных фаз. Указанные чистые стереохимически изомерные формы могут быть получены из соответствующих чистых стереохимически изомерных форм подходящих исходных веществ при условии, что реакция протекает стереоспецифически. Предпочтительно, если желателен определенный стереоизомер, указанное соединение синтезируют стереоспецифическими способами получения. В данных способах преимущественно будут использованы энантиомерно чистые исходные вещества. Диастереомерные рацематы соединений формулы (1) или любой их подгруппы могут быть получены традиционными способами. Подходящие физические способы разделения, которые предпочтительно можно использовать, представляют собой, например, селективную кристаллизацию и хроматографию,например колоночную хроматографию. Для некоторых из соединений формулы (1), их N-оксидов, солей, гидратов, сольватов, четвертичных аминов, или комплексов с металлами и промежуточных соединений, используемых для их получения, абсолютная стереохимическая конфигурация не была определена экспериментально. Специалист в данной области способен определить абсолютную конфигурацию таких соединений с использованием способов, известных в данной области, например таких, как дифракция рентгеновских лучей. В варианте осуществления изобретения настоящее изобретение относится к соединениям формулы где R1, R2, R6, R7 и А имеют такое же значение, как определено в описании. В более конкретном варианте осуществления настоящее изобретение относится к соединениям формулы (IIIA-1), (IIIA-2), (IIIA-3), (IIIA-4), (IIIB-1), (IIIB-2), (IIIB-3), (IIIB-4), (IVA-1), (IVA-2), (IVA-3),(IVB-1), (IVB-2) и (IVB-3). где R2, R6 и R7 имеют такое же значение, как определено в описании. В другом варианте осуществления изобретения, при необходимости, соединения формулы (I) или их подгруппы имеют стереохимическую конфигурацию, иллюстрируемую формулой (IA) Настоящее изобретение предназначено включать все изотопы атомов, существующих в настоящих соединениях. Изотопы включают те атомы, которые имеют тот же самый атомный номер, но различные массовые числа. В качестве общего примера и без ограничения изотопы водорода включают тритий и дейтерий. Изотопы углерода включают С-13 и С-14. Что касается терапевтического применения, соли соединений формулы (I) представлены такими солями, у которых противоион является фармацевтически приемлемым. Однако соли кислот и оснований,которые не являются фармацевтически приемлемыми, также могут найти применение, например, в получении или очистке фармацевтически приемлемого соединения. Все соли, являются ли они фармацевтически приемлемыми или нет, включены в объем настоящего изобретения. Фармацевтически приемлемые соли кислоты или основания, как отмечено в описании выше, предназначены включать терапевтически активные нетоксичные аддитивные соли кислоты и основания, которые соединения формулы (I) могут образовывать. Фармацевтически приемлемые аддитивные соли кислоты можно получить обычным образом путем обработки основания такой подходящей кислотой. Подходящие кислоты включают, например, неорганические кислоты, такие как галогенводородные кислоты,например хлористо-водородная или бромисто-водородная кислота, серная, азотная, фосфорная и т.п. кислоты; или органические кислоты, такие как, например, уксусная, пропановая, гидроксиуксусная, молочная, пировиноградная, щавелевая (т.е. этандиовая), малоновая, янтарная (т.е. бутандиовая), малеиновая,- 14019008 фумаровая, яблочная (т.е. гидроксибутандиовая кислота), винная, лимонная, метансульфоновая, этансульфоновая, бензолсульфоновая, п-толуолсульфоновая, цикламовая, салициловая, п-аминосалициловая,памовая и т.п. кислоты. В свою очередь, указанные солевые формы могут быть преобразованы при обработке подходящим основанием в формусвободного основания. Соединения формулы (I) или любая их подгруппа, содержащие кислый протон, также могут быть преобразованы в их нетоксичные аддитивные соли металлов или аминов путем обработки подходящими органическими и неорганическими основаниями. Подходящие формы основных солей включают, например, соли аммония, соли щелочных и щелочно-земельных металлов, например лития, натрия, калия,магния, соли кальция и т.п., соли с органическими основаниями, например бензатином, N-метил-Dглюкамином, соли гидрабамина и соли с аминокислотами, такими как, например, аргинин, лизин и т.п. Термин "четвертичный амин", как он использован ранее в данном описании, относится к определению четвертичных аммониевых солей, которые соединения формулы (I) или любая их подгруппа способны образовывать при реакции между основным азотом соединения формулы (I) или любой его подгруппы и подходящим средством кватернизации, таким как, например, необязательно замещенный алкилгалогенид, арилгалогенид и арилалкилгалогенид, например метилйодид или бензилйодид. Другие реагенты с подходящими удаляемыми группами также можно использовать, такие как алкилтрифторметансульфонаты, алкилметансульфонаты и алкил-п-толуолсульфонаты. Четвертичный амин содержит положительно заряженный азот. Фармацевтически приемлемые противоионы включают хлор, бром, йод,трифторацетат и ацетат. Выбранный противоион может быть введен с использованием ионообменных смол. Подразумевается, что N-оксидные формы настоящих соединений включают соединения формулы(I) или любую их подгруппу, где один или несколько атомов азота окислены до так называемого Nоксида. Следует понимать, что соединения формулы (I) или любая их подгруппа могут обладать металлсвязывающими, хелатирующими, комплексообразующими свойствами и, следовательно, могут существовать в виде металлокомплексов и хелатов металлов. Предполагается, что такие металлопроизводные соединений формулы (I) или любой их подгруппы включены в объем настоящего изобретения. Некоторые из соединений формулы (I) или любая их подгруппа и промежуточные соединения также могут существовать в одной или более таутомерных формах. Подразумевается, что такие формы, хотя и не указаны подробно в приведенной выше формуле, включены в объем настоящего изобретения. Таким образом, соединения и промежуточные соединения могут существовать в виде смеси таутомеров или в виде индивидуального таутомера. В изобретении особое предпочтение отдается соединениям формулы I или любой их подгруппе, которые в описанном ниже анализе ингибирования имели величину ингибирования менее чем 100 мкМ,предпочтительно менее чем 50 мкМ, более предпочтительно менее чем 10 мкМ, предпочтительно менее чем 5 мкМ, еще более предпочтительно менее чем 1 мкМ, предпочтительно менее чем 100 нМ и в особенности менее чем 10 нМ, как определено подходящим анализом, таким как анализы, используемые в примерах ниже. Понятно, что определенные выше подгруппы соединений формулы (I), а также любая другая подгруппа, указанная в описании, предназначены включать стереохимически изомерные формы и любые Nоксиды, соли, четвертичные амины, гидраты, сольваты и металлокомплексы таких соединений. Получение соединений формулы (I). Общие схемы синтеза. Соединения формулы (I) могут быть синтезированы следующими различными способами А, В, С,D, E, F и G, описанными ниже, из производных индола А-1 где R2, R4, R5, R6 и R7 являются такими, как определено для соединений формулы (I) или их подгрупп;Ra выбирают из метила и трет-бутила;Rb выбирают из метила. Соединения формулы А-1 являются либо известными соединениями в данной области, либо могут быть получены, как описано в заявке US 20070270406A1, международных публикациях WO 2007/054741 и WO 2007/092000. Способ А. Схематическое представление синтеза соединений формулы (I) дано на схеме 1. Способ начинается с соединения формулы А-1. Соединения формулы А-2 могут быть получены посредством региоселективного гидролиза сложного эфира, содержащего Rb-группу, в щелочных условиях, используя гидроксид, такой как LiOH илиNaOH, в полярных растворителях, таких как вода, спирт, такой как метанол или этанол, тетрагидрофуран(ТГФ) или их смеси. Данный способ может быть использован в случае, если Rb является метильной группой и Ra является трет-бутильной группой или Ra является метильной группой. Монозащищенный бифункциональный R1-производный реагент формулы PG-R1-H, где группа R1 является такой, как определено для соединений формулы (I) или их подгрупп, может быть конденсирован с карбоновой кислотой соединений А-2 с образованием амидной связи, приводя к соединениям А-3."PG", как определено в описании, является подходящей защитной группой для амина, выбранной из защитных групп, известных в данной области. Предпочтительно PG является трет-бутоксикарбонильной(Boc) защитной группой или 4-нитробензолсульфонильной (нозильной) группой. Образование амидных связей может быть осуществлено стандартными методиками, такими, которые используют для связывания аминокислот в пептидном синтезе. Пептидный синтез включает взаимодействие карбоновой кислоты одного вещества с аминогруппой другого вещества с образованием связывающей амидной связи с сопровождающейся дегидратацией. Образование амидной связи можно осуществлять путем взаимодействия исходных веществ в присутствии связующего реагента или путем превращения карбоксильной функциональности в активную форму, такую как активный сложный эфир,смешанный ангидрид или хлорангидрид или бромангидрид карбоновой кислоты. Общие описания таких реакций связывания и используемых в них веществ можно найти в руководствах по химии пептидов,например, М. Bodanszky, "Peptide Chemistry", 2nd rev. ed., Springer-Verlag, Berlin, Germany (1993). Схема 1 Примеры реакций связывания с образованием амидной связи включают азидный метод, метод смешанных ангидридов карбоновой кислоты и угольной кислоты (изобутилхлорформиат), карбодиимидный(дициклогексилкарбодиимид (DCC), диизопропилкарбодиимид (DIC) или водорастворимый карбодиимид, такой как N-этил-N'-[3-(диметиламино)пропил]карбодиимид (EDC метод, метод активированных эфиров (например, п-нитрофенил, п-хлорфенил, трихлорфенил, пентахлорфенил, пентафторфенил, Nгидроксисукцинимидо и подобные сложные эфиры), метод с К-реагентом Вудворда, метод с 1,1 карбонилдиимидазолом (CDI или N,N'-карбонилдиимидазол), метод с применением фосфорсодержащих реагентов и методы с применением реакций окисления-восстановления. Некоторые из указанных выше методов могут быть улучшены путем добавления подходящих катализаторов, например в карбодиимидном методе при добавлении 1-гидроксибензотриазола или 4-диметиламинопиридина (4-DMAP). Также связующими средствами являются (бензотриазол-1-илокси)-трис-(диметиламино)фосфония гексафторфосфат, или как таковой, или в присутствии 1-гидроксибензотриазола или 4-DMAP; или 2-(1 Нбензотриазол-1-ил)-N,N,N',N'-тетраметилурония тетрафторборат или О-(7-азабензотриазол-1-ил)- 16019008N,N,N',N'-тетраметилурония гексафторфосфат. Указанные реакции связывания могут быть осуществлены либо в растворе (жидкая фаза), либо в твердой фазе. Реакции связывания предпочтительно проводят в инертном растворителе, таком как галогенированные углеводороды, например дихлорметан (DCM), хлороформ, диполярные апротонные растворители, такие как ацетонитрил, диметилформамид (ДМФ), диметилацетамид, ДМСО, НМРТ, простые эфиры,такие как тетрагидрофуран (ТГФ). Во многих примерах реакции связывания осуществлены в присутствии подходящего основания, такого как третичный амин, например триэтиламин, диизопропилэтиламин (DIPEA), N-метилморфолин, Nметилпирролидин, 4-DMAP или 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU). Температура реакции может колебаться между 0 и 50 С, время реакции может составлять интервал между 15 мин и 24 ч. Удаление защитной группы способами, известными в данной области, может привести к получению соединений А-4. Указанные способы включают взаимодействие соединений А-3 с трифторуксусной кислотой (ТФУ) в подходящем растворителе, таком как DCM, когда PG является Вос-защитная группа,или взаимодействие соединений А-3 с тиолсодержащей меркаптоуксусной кислотой или тиофенолом, в растворе или в твердой фазе, в присутствии основания, такого как карбонат цезия или LiOH, в подходящем растворителе, таком как ДМФ, ТГФ, когда PG является нозил. В случае, когда Ra означает третбутильную группу, и PG является Вос-защитная группа, удаление PG, как описано выше, может привести к соединению А-4 с Ra, означающим ОН. Затем соединения А-4 подвергают взаимодействию с сульфамидом в подходящем растворителе, например, диоксане, в условиях нагревания, т.е. 100 С. Данная реакция может протекать при микроволновом излучении и приводить к соединениям А-5. Другой способ введения сульфамидного фрагмента может состоять из взаимодействия соединения А-4 с аминосульфонилхлоридом в присутствии подходящего основания, такого как триэтиламин, DIPEA или пиридин, в подходящем растворителе, таком как хлорсодержащий растворитель, подобный DCM, или в ДМФ, ТГФ. Сложноэфирная функция соединений А-5, т.е. -CO-O-Ra, затем может быть гидролизована, используя условия, известные в данной области, и включая омыление в основной среде, как описано выше, с образованием соединений А-6. Нагревание может потребоваться для завершения данной реакции. Кислые условия также могут быть использованы для гидролиза сложноэфирной функции соединений А-5,например ТФУ в подходящем растворителе, подобном DCM, когда Ra представляет собой третбутильную группу. Соединения (I) могут быть получены макроциклизацией путем образования внутримолекулярной ацилсульфамидной связи в присутствии связующих средств, таких как CDI, который превращает карбоксильную группу в активный ацилимидазол при нагревании. Затем, полученный ацилимидазол может быть очищен до добавления подходящего основания, такого как DBU, для осуществления замыкания кольца, которое может происходить в условиях нагревания. Растворители, используемые для указанных реакций, могут включать ацетонитрил или ТГФ. Другие связующие средства, такие как средства, известные в данной области, также могут быть использованы для достижения замыкания кольца. Способ В. Схема 2 Альтернативный способ, приводящий к соединениям А-4, иллюстрированный на схеме 2, может заключаться в образовании амидной связи между соединениями А-2 и реагентом, представленным симметричной двухвалентной цепью R1, используемым в избытке по сравнению с соединениями А-2. Указанная амидная связь может быть образована, как описано выше, в частности, с использованием связующего средства,такого какDIPEA, и в подходящем растворителе, подобном DCM, ДМФ, или более предпочтительно ТГФ. Далее соединения А-4 могут взаимодействовать, как описано выше в способе А, с получением соединений (I). Соединения могут быть непосредственно получены из соединений А-2 способом, подобным описанному выше способу синтеза соединений А-3, но используя реагент, представленный двухвалентной цепью R1, включающей один сульфамидный фрагмент вместо защитной группы. Такой сульфамидный фрагмент может быть введен в цепь R1 на H-R1-H при нагревании реагента формулы H-R1-Н, который может быть либо монозащищенным подходящей защитной группой (т.е. PG-R1-H), либо незащищенным,если реагент представлен симметричной цепью, с сульфамидом в подходящем растворителе, таком как диоксан, в условиях микроволнового излучения. Далее защитная группа может быть удалена способами,известными в данной области, например реакцией с ТФУ в дихлорметане, когда защитной группой является Вос-защитная группа, приводящей к дериватизированной R1-цепи, включающей моносульфамид. Способ D. Соединения формулы А-3 или А-4 могут подвергаться модификации функциональной группы, такой как алкилирование или восстановительное аминирование, до удаления PG у соединений А-3 и/или реакции, приводящей к сульфамиду А-4. Способ Е. Схема 4 Сложный эфир, несущий Ra-группу, соединений А-1 (Ra является, например, трет-бутильной группой, Rb является метильной группой) может быть гидролизован, как описано выше, в кислых условиях,используя, например, ТФУ в подходящем растворителе, подобном DCM, с получением производного карбоновой кислоты Е-2. Взаимодействие соединений Е-2 с сульфамидным фрагментом, введенным в монозащищенную двухвалентную цепь R1, может привести к ацилсульфамидным соединениям Е-3 в условиях, описанных для последней стадии способа А. Предпочтительно связующим средством, используемым для активации карбоксильной группы, может быть CDI, в подходящем растворителе, подобном ацетонитрилу или ТГФ,в условиях нагревания. Добавление сульфамидной цепи в присутствии основания, такого как DBU, в результате может привести к соединениям Е-3. PG является подходящей защитной группой для амина, выбранной из групп, известных в данной области. Предпочтительно в способе Е, PG является Вос-защитная группа. Удаление защитной группы PG у соединений Е-3 способами, известными в данной области, может привести к соединениям Е-4. Указанные способы включают взаимодействие соединений Е-3 с ТФУ в подходящем растворителе, таком как DCM, когда PG является Вос-защитная группа. Далее сложноэфирная функция соединений Е-4 (Rb означает метильную группу) может быть гидролизована в условиях, известных в данной области и включающих омыление в основной среде, как описано выше, приводя к соединениям Е-5. Альтернативно, соединения Е-3 могут подвергаться реакции омыления в основной среде для гидролиза сложного эфира, содержащего Rb-группу, до удаления защитной группы у амина в условиях, опи- 18019008 санных выше и приводящих к соединениям Е-5. Соединения (I) могут быть получены макроциклизацией соединений Е-5 путем образования внутримолекулярной амидной связи в присутствии связующих средств, как описано в способе А. Предпочтительно указанная стадия образования амидной связи может быть осуществлена в условиях сильного разведения. Способ F. Схема 5 Соединения F-3 могут быть получены реакцией образования амида, исходя из соединений А-2 и алкиленамина, как описано для второй стадии способа А. Последующий гидролиз сложного эфира в основных или кислых условиях, как описано ранее, может привести к соединениям F-4. Далее ацилсульфамидная связь может быть образована способом, описанным для последней стадии способа А, используя алкиленсульфамидное соединение и получая соединения F-5. Альтернативно, ацилсульфамидная группа может быть введена в соединение формулы Е-2 до гидролиза сложного эфира, включающего Rb-группу, и связывания полученной карбоновой кислоты с алкенамином, как описано выше, приводя к соединению F-5. Образование макроцикла, т.е. соединения формулы F-6, которое является соединением формулы (I), содержащим следующую двухвалентную цепь, как R1 может быть осуществлено реакцией метатезиса олефинов в присутствии подходящего металла-катализатора, такого как, например,Ru-основанный катализатор, как описано Miller, S.J., Blackwell, Н.Е., Grubbs, R.H. J. Am. Chem. Soc. 118,(1996), 9606-9614; Kingsbury, J.S., Harrity, J.P.A., Bonitatebus, P.J., Hoveyda, A.H., J. Am. Chem. Soc. 121,(1999), 791-799; и Huang et al., J. Am. Chem. Soc. 121, (1999), 2674-2678; например, катализатор HoveydaGrubbs. Устойчивые на воздухе рутениевые катализаторы, такие как бис-(трициклогексилфосфин)-3-фенил 1 Н-инден-1-илиденрутения хлоридM1) или бис-(трициклогексилфосфин)[(фенилтио)метилен]рутения(IV) дихлорид, могут быть использованы. Другими катализаторами, которые могут быть использованы, являются катализаторы Граббса первого и второго поколения, т.е. бензилиден-бис-(трициклогексилфосфин)дихлоррутений и(1,3-бис-(2,4,6-триметилфенил)-2 имидазолидинилиден)дихлор(фенилметилен)(трициклогексилфосфин)рутений соответственно. Особый интерес представляют катализаторы Hoveyda-Grubbs первого и второго поколения, которыми являются дихлор(о-изопропоксифенилметилен)(трициклогексилфосфин)рутений(II) и 1,3-бис-(2,4,6 триметилфенил)-2-имидазолидинилиден)дихлор(о-изопропоксифенилметилен)рутений соответственно. Также, другие катализаторы, содержащие другие переходные металлы, такие как Мо, могут быть использованы для данной реакции. Реакции метатезиса могут быть осуществлены в подходящем растворителе, таком как, например,простые эфиры, например ТГФ, диоксан; галогенированные углеводороды, например дихлорметан,CHCl3, 1,2-дихлорэтан и т.п., углеводороды, например толуол. Указанные реакции осуществляют при повышенных температурах в атмосфере азота. Соединения формулы (I) или любая их подгруппа или любые их подгруппы могут быть превращены друг в друга посредством реакций трансформации функциональной группы, известных в данной области. Например, аминогруппы могут быть N-алкилированы, нитрогруппы могут быть восстановлены до аминогрупп, атом галогена может быть обменен на другой галоген. Соединения формулы F-6 могут быть подвергнуты каталитическому гидрированию с использованием, например, Pd/C в качестве катализатора, в подходящем растворителе, таком как метанол, этанол,ТГФ, уксусная кислота или их смесь, с получением соединений формулы F-7, где алкен двухвалентной цепи R1 восстановлен до соответствующего алкана. Соединения формулы F-6, принадлежащие к группе соединений формулы (II), могут быть превращены в соединения F-7, имеющие структуру соединений формулы (IV), после указанной стадии гидрирования. В общем, соединения формулы (II) могут быть превращены в соединение формулы (IV) путем каталитического гидрирования, как показано ниже. Схема 6 Соединения формулы (I) могут быть превращены в соответствующие формы N-оксидов известными в данной области способами, предназначенными для превращения трехвалентного азота в его Nоксидную форму. Указанная реакция N-окисления может быть в основном осуществлена путем взаимодействия исходного вещества формулы (I) с соответствующей органической или неорганической перекисью. Соответствующие неорганические перекиси включают, например, перекись водорода, перекиси щелочного металла или щелочно-земельного металла, например перекись натрия, перекись калия; соответствующие органические перекиси могут включать пероксикислоты, такие как, например, бензолкарбопероксикислота или галогензамещенная бензолкарбопероксикислота,например 3 хлорбензолкарбопероксикислота, пероксиалкановые кислоты, например пероксиуксусная кислота, алкилгидроперекиси, например трет-бутилгидроперекись. Подходящими растворителями являются, например, вода, низшие спирты, например, этанол и т.п., углеводороды, например толуол, кетоны, например 2-бутанон, галогенированные углеводороды, например дихлорметан, и смеси указанных растворителей. Чистые стереохимически изомерные формы соединений формулы (I) могут быть получены способами, известными в данной области. Диастереомеры могут быть разделены физическими методами, такими как селективная кристаллизация и хроматографические методы, например противоточное распределение, жидкостная хроматография и т.п. Соединения формулы (I) могут быть получены в виде рацемических смесей энантиомеров, которые могут быть отделены один от другого способами разделения, известными в данной области. Рацемические соединения формулы (I), которые являются в меру основными или кислотными, могут быть превращены в соответствующие диастереомерные солевые формы путем взаимодействия с подходящей хиральной кислотой, соответственно хиральным основанием. Далее указанные диастереомерные солевые формы разделяют, например, селективной или фракционированной кристаллизацией, и энантиомеры выделяются отсюда посредством щелочи или кислоты. Альтернативный способ разделения энантиомерных форм соединений формулы (I) включает жидкостную хроматографию, в частности жидкостную хроматографию с использованием хиральной стационарной фазы. Указанные чистые стереохимически изомерные формы также могут быть получены из соответствующих чистых стереохимически изомерных форм соответствующих исходных веществ, при условии, что реакция протекает стереоспецифически. Предпочтительно, если специфический стереоизомер является желательным, тогда указанное соединение может быть синтезировано стереоспецифическими методами получения. В указанных методах преимущественно могут быть использованы энантиомерно чистые исходные вещества. Способ G описывает синтез энантиомерно чистых исходных веществ А-2, принадлежащих к группам соединений (III) и (IV). Рацемическая смесь А-2 может быть подвергнута взаимодействию с хиральным вспомогательным компонентом, таким как (S)-4-бензил-2-оксазолидинон, после превращения ее в ацилхлорид способами,известными в данной области, такими как взаимодействие А-2 с оксалилхлоридом в подходящем растворителе, подобном ТГФ, в присутствии каталитического количества ДМФ. Затем, хлорангидрид может взаимодействовать с анионом (S)-4-бензил-2-оксазолидинона, образованным реакцией с сильным основанием, таким как бутиллитий, в подходящем растворителе, таком как ТГФ, при низких температурах,обычно при -78 С, и в инертной атмосфере, с получением диастереоизомеров G1 и G2, которые могут быть выделены способами, известными в данной области, такими как хроматография на силикагеле. Далее удаление хирального вспомогательного компонента из каждого из диастереоизомеров G1 иG2 может быть выполнено обработкой основанием, таким как NaOH, в подходящем растворителе, таком как метанол, вода, ТГФ, с получением энантиомерно чистых соединений А-2' и А-2. Используя указанные энантиомерно чистые исходные вещества, можно получить энантиомерно чистые соединения формулы (I), содержащие один стереоцентр, такие как соединения формулы (IIIA), (IIIB). Чистые стереохимически изомерные формы соединений формулы (I) или любых их подгрупп могут быть получены способами, известными в данной области. Диастереомеры могут быть разделены физическими способами, такими как селективная кристаллизация и хроматографические методы, например,противоточное распределение, жидкостная хроматография и т.п. Соединения формулы (I) или любые их подгруппы могут быть получены в виде рацемических смесей энантиомеров, которые могут быть отделены один от другого методами разделения, известными в данной области. Рацемические соединения формулы (I) или любые их подгруппы, которые являются в меру основными или кислотными, могут быть превращены в соответствующие диастереомерные солевые формы путем взаимодействия с подходящей хиральной кислотой, соответственно хиральным основанием. Далее указанные диастереомерные солевые формы разделяют, например, селективной или фракционированной кристаллизацией, и энантиомеры выделяются отсюда посредством щелочи или кислоты. Альтернативный способ разделения энантиомерных форм соединений формулы (I) или любых их подгрупп включает жидкостную хроматографию, в частности жидкостную хроматографию с использованием хиральной стационарной фазы. Указанные чистые стереохимически изомерные формы также могут быть произведены из соответствующих чистых стереохимически изомерных форм соответствующих исходных веществ, при условии, что реакция протекает стереоспецифически. Предпочтительно, если специфический стереоизомер является желательным, тогда указанное соединение может быть синтезировано стереоспецифическими методами получения. В указанных методах преимущественно могут быть использованы энантиомерно чистые исходные вещества. В другом аспекте настоящее изобретение относится к фармацевтической композиции, содержащей терапевтически эффективное количество соединения формулы (I) или любых его подгрупп, как определено в описании, и фармацевтически приемлемый носитель. Терапевтически эффективное количество в данном контексте означает количество, достаточное для профилактического действия, стабилизации или уменьшения вирусной инфекции и, в частности, вирусной инфекции HCV, у инфицированных субъектов или субъектов, подверженных риску инфицирования. В другом аспекте данное изобретение относится к способу получения фармацевтической композиции, как указано в описании, который включает равномерное смешивание фармацевтически приемлемого носителя с терапевтически эффективным количеством соединения формулы (I) или любых его подгрупп, как указано в описании. В связи с этим согласно варианту осуществления настоящего изобретения соединения формулы (I) или любая их подгруппа могут быть получены в виде различных фармацевтических форм для введения. Понятно, что все композиции, обычно используемые для системного введения лекарственных средств,включены как подходящие композиции. Для получения фармацевтических композиций согласно настоящему изобретению эффективное количество отдельного соединения, необязательно в солевой форме или в виде металлокомплекса, в качестве активного ингредиента смешивают в виде однородной смеси с фармацевтически приемлемым носителем, где носитель может иметь различные формы в зависимости от формы препарата, желаемой для введения. Указанные фармацевтические композиции желательно получить в единичной дозированной форме, в особенности, для введения перорально, ректально, чрескожно или путем парентеральной инъекции. Например, при получении композиций в пероральной дозированной форме любые из обычных фармацевтических сред могут быть использованы, такие как, например,вода, гликоли, масла, спирты и т.п. в случае пероральных жидких препаратов, таких как суспензии, сиропы, эликсиры, эмульсии и растворы; или твердые носители, такие как крахмалы, сахара, каолин, лубриканты, связующие вещества, дезинтегрирующие средства и т.п.в случае порошков, пилюль, капсул и таблеток. Благодаря легкости их введения таблетки и капсулы представляют наиболее благоприятные пероральные единичные дозированные формы, в случае которых с очевидностью используют твердые фармацевтические носители. Для парентеральных композиций носитель, как правило, будет включать стерилизованную воду, по меньшей мере, в значительной степени, хотя другие ингредиенты, например те, которые способствуют растворимости, могут быть включены в состав. Например, могут быть получены растворы для инъекций, в которых носитель включает физиологический раствор, раствор глюкозы или смесь физиологического раствора и раствора глюкозы. Также могут быть получены суспензии для инъекций, в случае которых можно использовать подходящие жидкие носители, суспендирующие средства и тому подобное. Также включены препараты в твердом виде, которые предназначены для преобразования, незадолго до применения, в жидкие препараты. В композициях, подходящих для чрескожного введения, носитель необязательно включает средство, усиливающее проницаемость, и/или подходящее смачивающее средство, необязательно в сочетании с подходящими вспомогательными добавками любой природы в небольших долях, где указанные добавки не оказывают существенного вредного воздействия на кожу. Соединения согласно настоящему изобретению могут быть введены путем ингаляции или вдувания в ротовую полость посредством способов и препаратов, используемых в данной области для введения таким путем. Таким образом, в целом, соединения согласно настоящему изобретению могут быть введены в легкие в виде раствора, суспензии или сухого порошка, раствор является предпочтительным. Любая система, разработанная для доставки растворов, суспензий или сухих порошков посредством ингаляции или вдувания в ротовую полость, является подходящей для введения данных соединений. Таким образом, настоящее изобретение также относится к фармацевтической композиции, приспособленной для введения путем ингаляции или вдувания через рот, включающей соединение формулы (I) или любые его подгруппы и фармацевтически приемлемый носитель. Предпочтительно соединения согласно настоящему изобретению вводят путем ингаляции раствора в дозах, распыляемых посредством небулайзера или аэрозольного баллона. Наиболее предпочтительно получать описанные выше фармацевтические композиции в единичной дозированной форме для легкости введения и однородности дозировки. Единичная дозированная форма,используемая в изобретении, относится к физически дискретным единицам, подходящим в виде единичных доз, где каждая единица содержит предопределенное количество активного ингредиента, рассчитанное для оказания желаемого терапевтического эффекта, в сочетании с требуемым фармацевтическим носителем. Примерами таких единичных дозированных форм являются таблетки (включающие таблетки с насечкой или покрытые оболочкой), капсулы, пилюли, суппозитории, пакетики с порошками, облатки,растворы или суспензии для инъекций и т.п., и отдельное их множество. Соединения формулы (I) и любая их подгруппа проявляют противовирусные свойства. Вирусные инфекции и связанные с ними заболевания, подвергаемые лечению при использовании соединений и способов согласно настоящему изобретению, включают такие инфекции, вызванные HCV и другими патогенными флавивирусами, такими как желтая лихорадка, лихорадка денге (типы 1-4), энцефалит СентЛуиса, японский энцефалит, энцефалит долины Муррея, вирус Западного Нила и вирус Кунжин. Заболевания, связанные с HCV, включают прогрессирующий фиброз печени, воспаление и некроз, приводящие к циррозу, конечной стадии заболевания печени, и НСС, а для других патогенных флавивирусов состояния включают желтую лихорадку, лихорадку денге, геморрагическую лихорадку и энцефалит. Однако соединения согласно изобретению также могут привлечь внимание благодаря тому факту,что они не проявляют активность против других вирусов, в частности против ВИЧ. ВИЧ- 22019008 инфицированные больные часто страдают от сопутствующих инфекций, таких как HCV. Лечение таких больных ингибитором HCV, который также ингибирует ВИЧ, может привести к появлению устойчивых штаммов ВИЧ. Благодаря их противовирусным свойствам, особенно их действию против вируса HCV, соединения формулы (I) или любая их подгруппа, включая их стереохимически изомерные формы и их N-оксиды,четвертичные амины, металлокомплексы, соли, гидраты и сольваты, являются пригодными в лечении индивидуумов, испытывающих вирусную инфекцию, особенно инфекцию HCV, и для профилактики таких инфекций. В целом, соединения согласно настоящему изобретению могут быть пригодны в лечении теплокровных животных, зараженных вирусами, в частности флавивирусами, такими как HCV.Следовательно, соединения согласно настоящему изобретению или любая их подгруппа могут быть применены в качестве лекарственных средств. Указанное применение в качестве лекарственного средства или способа лечения включает системное введение инфицированным вирусом субъектам или субъектам, чувствительным к вирусным инфекциям, эффективного количества для лечения состояний, связанных с вирусной инфекцией, в частности инфекцией HCV. Настоящее изобретение также относится к применению данных соединений или любой их подгруппы в производстве лекарственного средства для лечения или предотвращения вирусных инфекций, особенно инфекции HCV. Кроме того, настоящее изобретение относится к способу лечения теплокровного животного, зараженного вирусом, или подверженного риску заражения вирусом, в частности вирусом HCV, где указанный способ включает введение эффективного против вируса количества соединения формулы (I) или любых его подгрупп, как определено в описании. Настоящее изобретение также относится к комбинации соединения формулы (I) или любой его подгруппы, как определено в описании, с другими средствами против HCV. В варианте осуществления изобретение относится к комбинации соединения формулы (I) или любой его подгруппы по меньшей мере с одним средством против HCV. В частном варианте осуществления изобретение относится к комбинации соединения формулы (I) или любой его подгруппы по меньшей мере с двумя средствами против HCV. В частном варианте осуществления изобретение относится к комбинации соединения формулы (I) или любой его подгруппы по меньшей мере с тремя средствами против HCV. В частном варианте осуществления изобретение относится к комбинации соединения формулы (I) или любой его подгруппы по меньшей мере с четырьмя средствами против HCV. Комбинация ранее известного соединения против HCV, такого как интерферон- (IFN-), пэгилированный интерферон-, рибавирин или их комбинация, и соединения формулы (I) или любой его подгруппы может быть применена в качестве лекарственного средства в комбинированной терапии. В варианте осуществления изобретения "комбинированная терапия" относится к продукту, содержащему обязательно (а) соединение формулы (I) и (b) по меньшей мере одно другое соединение против вируса HCV, в качестве комбинированного препарата для одновременного, раздельного или последовательного применения в лечении инфекций HCV, в частности в лечении инфекций вирусом HCV. Соединения против вируса HCV охватывают средства, выбранные из ингибиторов полимеразыHCV, R-7128, МК-0608, VCH759, PF-868554, GS9190, NM283, валопицитабина, PSI-6130, XTL-2125,NM-107, R7128 (R4048), GSK625433, R803, R-1626, BILB-1941, HCV-796, JTK-109 и JTK-003, ANA-598,IDX-184, MK-3281, MK-1220, производных бензимидазола, производных бензо-1,2,4-тиадиазина, производных фенилаланина, А-831 и А-689; ингибиторов протеаз HCV (NS2-NS3 и NS3-NS4A), соединений,описанных в международной публикации WO 02/18369 (см., например, с. 273, строчки 9-22 и от с. 274,строчка 4 до с. 276, строчка 11), BI-1335, TMC435350, MK7009, ITMN-191, BILN-2061, VX-950, BILN2065, BMS-605339, VX-500, SCH 503034; ингибиторов других мишеней в жизненном цикле HCV, включающих ингибиторы хеликазы и металлопротеиназы, ISIS-14803; иммуномодуляторов, таких как -, - и, rIFN-, инферген + актиммун, IFN-омега с DUROS, албуферон, локтерон, ребиф, пероральный IFN-,IFN- 2b XL, AVI-005, пэгилированный-инферген, пэгилированные производные соединения интерферона-, такие как пэгилированный rIFN- 2b, пэгилированный rIFN- 2 а, пэгилированный IFN-, соединения, которые стимулируют синтез интерферона в клетках, интерлейкины, агонисты Толл-подобных рецепторов (TLR), соединения, которые усиливают развитие ответа Т-хелперов 1 типа, и тимозин; других противовирусных средств, таких как рибавирин, аналоги рибавирина, такие как ребетол, копегус и вирамидин (тарибавирин), амантадин и телбивудин, ингибиторов внутренней посадки рибосомы, ингибиторов альфа-глюкозидазы 1, таких как МХ-3253 (целгосивир) и UT-231B, гепатопротекторов, таких как IDN-6556, ME-3738, LB-84451 и MitoQ, ингибиторов вирусов широкого спектра, таких как ингибиторы IMPDH (например, соединения документов US 5807876, US 6498178, US 6344465, US 6054472, международных публикаций WO 97/40028, WO 98/40381, WO 00/56331, микофеноловая кислота и ее производные, и включающие, но не ограничивающиеся ими, VX-497, VX-148, и/или VX-944); и других лекарственных средств для лечения HCV, таких как задаксин, нитазоксадин, BIVN-401 (виростат), PYN-17 971, NOV-205, tarvacin, EHC-18, NIM811, DEBIO-025, VGX-410C, EMZ-702, AVI 4065, бавитуксимаб и оглуфанид; или комбинаций любых из описанных выше соединений. Таким образом, для борьбы с инфекциями HCV или для лечения инфекций HCV соединения формулы (I) или любые их подгруппы могут быть введены совместно в комбинации, например, с интерфероном- (IFN-), пэгилированным интерфероном-, рибавирином или с их комбинацией, а также терапевтическими средствами, основанными на антителах, таргетированных против эпитопов HCV, короткой интерферирующей РНК (si RNA), рибозимов, ДНКзимов, антисмысловой РНК, низкомолекулярных антагонистов, например, протеазы NS3, хеликазы NS3 и полимеразы NS5B. Комбинации согласно настоящему изобретению могут быть применены в качестве лекарственных средств. В связи с этим, настоящее изобретение относится к применению соединения формулы (I) или любой его подгруппы, как определено выше, для производства лекарственного средства, пригодного для ингибирования активности HCV у млекопитающего, инфицированного вирусами HCV, где указанное лекарственное средство применяют в комбинированной терапии, где указанная комбинированная терапия предпочтительно включает соединение формулы (I) и по меньшей мере одно другое соединение, ингибирующее HCV, например IFN-, пэгилированный IFN-, рибавирин или их комбинацию. Кроме того, известно, что большой процент больных, инфицированных вирусом 1 иммунодефицита человека (ВИЧ), также инфицированы HCV, т.е. они являются соинфицированными вирусами HCV/ВИЧ. Инфекция ВИЧ, по-видимому, неблагоприятно воздействует на все стадии заражения HCV, приводя к повышенной персистенции вируса и ускоренному развитию связанного с HCV заболевания печени. В свою очередь, инфекция HCV может воздействовать на лечение инфекции ВИЧ, увеличивая случаи печеночной токсичности, вызванной противовирусными лекарственными средствами. Кроме того, настоящее изобретение относится к комбинациям соединения формулы (I) или любой его подгруппы со средствами против вируса HCV. Также, комбинация одного или более дополнительных соединений против вируса HCV и соединения формулы (I) или любых его подгрупп может быть применена в качестве лекарственного средства. В частности, указанная комбинация может быть использована для ингибирования репликации HCV и ВИЧ. Термин "комбинированная терапия" также охватывает продукт, содержащий (а) соединение формулы (I) или любую его подгруппу, (b) по меньшей мере одно соединение против вируса HCV и (с) необязательно, по меньшей мере одно другое соединение против HCV, в качестве комбинированного препарата для одновременного, раздельного или последовательного применения в лечении инфекций HCV и ВИЧ, в частности в лечении инфекций HCV и ВИЧ, или для предотвращения или лечения состояний,связанных с вирусами HCV и ВИЧ. Таким образом, настоящее изобретение относится к продукту, содержащему (а) соединение формулы (I) или любую его подгруппу и (b) одно или более дополнительные соединения, проявляющие активность против вируса ВИЧ, в качестве комбинированного препарата для одновременного, раздельного или последовательного применения в лечении инфекций HCV и ВИЧ. Различные лекарственные средства могут быть комбинированы в одном препарате вместе с фармацевтически приемлемыми носителями. Указанные соединения, проявляющие активность против ВИЧ, могут быть любыми известными антиретровирусными соединениями, такими как сурамин, пентамидин, тимопентин, кастаноспермин, декстран (сульфат декстрана), фоскарнет натрия (тринатрия фосфоноформиат); нуклеозидные ингибиторы обратной транскриптазы (NRTI), например, зидовудин (AZT), диданозин (ddI), залцитабин (ddC), ламивудин (3 ТС), ставудин (d4T), эмтрицитабин (FTC), абакавир (ABC), амдоксовир (DAPD), элвуцитабин(АСН-126443), AVX 754 -)-dOTC), фозивудина тидоксил (FZT), фосфазид, HDP-990003, KP-1461, MIV210, рацивир (PSI-5004), UC-781 и т.п.; ненуклеозидные ингибиторы обратной транскриптазы (NNRTIs),такие как делавирдин (DLV), эфавиренз (EFV), невирапин (NVP), дапивирин (ТМС 120), этравирин(ТМС 125), рилпивирин (ТМС 278), DPC-082, (+)-каланолид A, BILR-355 и т.п.; нуклеотидные ингибиторы обратной транскриптазы (NtRTI), например терофовир R)-РМРА) и тенофовир дисопроксил фумарат (TDF) и т.п.; конкурирующие с нуклеотидом ингибиторы обратной транскриптазы (NcRTI), например, NcRTI-I и т.п.; ингибиторы транс-действующих белков, такие как ТАТ-ингибиторы, например, RO5-3335, BI-201 и т.п.; ингибиторы REV; ингибиторы протеаз, например, ритонавир (RTV), саквинавир(AG-1343), атазанавир (BMS 232,632), дирунавир (TMCl 14), фосампренавир (GW433908 или VX-175),бреканавир (GW-640385, VX-385), Р-1946, PL-337, PL-100, типранавир (PNU-140690), AG-1859, AG1776, Ro-0334649 и т.п.; ингибиторы входа, которые включают слитые ингибиторы (например, энфувирдит (Т-20, ингибиторы присоединения и ингибиторы корецепторов, последние включают антагонистыCCR5 (например, анкривирок, CCR5mAb004, маравирок (UK-427,857), PRO-140, ТАК-220, ТАК-652,викривирок (SCH-D, SCH-417,690 и антагонисты CXR4 (например, AMD-070, KRH-27315), примерами ингибиторов входа являются PRO-542, TNX-355, BMS-488043, BlockAide/CR, FP 21399, hNMO1, нонакин, VGV-I; ингибитором созревания является, например, РА-457; ингибиторы вирусной интегразы, например, ралтегравир (МК-0518), элвитегравир (JTK-303, GS-9137), BMS-538158; рибозимы; иммуномодуляторы; моноклональные антитела; генная терапия; вакцины; siPHK; антисмысловые РНК; бактерици- 24019008 ды; ингибиторы цинковых пальцев. Следовательно, HCV-инфицированные больные, также страдающие от состояний, связанных с ВИЧ или даже другими патогенными ретровирусами, такими как AIDS, AIDS-родственный комплекс (ARC),прогрессирующей генерализованной лимфаденопатии (PGL), а также хроническими заболеваниями CNS,вызванными ретровирусами, такими как, например, опосредованная ВИЧ деменция и рассеянный склероз, могут успешно подвергаться лечению настоящими соединениями. Композиции могут быть получены в подходящих фармацевтических дозированных формах, таких как дозированные формы, описанные выше. Любой из активных ингредиентов может быть получен отдельно, и препараты могут быть введены совместно, или один препарат, содержащий к тому же, если желательно, другие активные ингредиенты, может быть предоставлен. Как используют в описании, термин "композиция" предназначен охватить продукт, содержащий определенные ингредиенты, а также любой продукт, который получен, прямо или косвенно, путем комбинирования определенных ингредиентов. Термин "терапевтически эффективное количество", как он использован в описании, означает такое количество активного соединения или компонента или фармацевтического средства, которое вызывает биологический или медицинский ответ в ткани, системе, включающий ослабление симптомов заболевания, у подвергаемого лечению животного или человека, которого добивается, в свете настоящего изобретения, исследователь, ветеринар, лечащий врач или другой клиницист. Поскольку настоящее изобретение также относится к комбинациям, содержащим два или более средства, "терапевтически эффективное количество" в контексте комбинаций также означает такое количество средств, вместе взятых, комбинированное действие которых вызывает желаемый биологический или медицинский ответ. Например, терапевтически эффективное количество композиции, содержащей (а) соединение формулы (I) и (b) другое средство, проявляющее активность против HCV, должно быть количеством соединения формулы (I) и количеством другого средства, проявляющего активность против HCV, которое, когда взято вместе, имеет комбинированное действие, являющееся терапевтически эффективным. В целом, подразумевается, что противовирусное эффективное суточное количество будет составлять от 0,01 до 500 мг/кг веса тела, более предпочтительно от 0,1 до 50 мг/кг веса тела. Может оказаться удобным вводить требуемую дозу в виде двух, трех, четырех или более субдоз с подходящими интервалами в течение дня. Указанные субдозы могут быть получены в виде единичных дозированных форм,например, содержащих от 1 до 1000 мг и, в частности, от 5 до 200 мг активного ингредиента на единичную дозированную форму. Точная дозировка и частота введения зависят от конкретного используемого соединения формулы(I), конкретного состояния, подвергаемого лечению, тяжести состояния, подвергаемого лечению, возраста, веса, пола, степени нарушения и общего физического состояния отдельного больного, а также другого лекарственного средства, которое может принимать индивидуум, что хорошо известно специалистам в данной области. Кроме того, очевидно, что указанное эффективное суточное количество может быть снижено или повышено в зависимости от ответной реакции субъекта, подвергаемого лечению, и/или в зависимости от оценки врача, предписывающего соединения согласно настоящему изобретению. Отмеченные выше диапазоны эффективного суточного количества, следовательно, являются только руководящими указаниями. В одном варианте осуществления настоящего изобретения, изобретение предоставляет изделие, содержащее композицию, проявляющую эффективность в лечении инфекции HCV или в ингибировании полимеразы NS5B вируса HCV; и упаковочный материал, включающий этикетку, на которой указано,что композиция может быть использована для лечения инфицирования вирусом гепатита С, где композиция содержит соединение формулы (I) или любую его подгруппу или комбинацию, описанную выше. Другой вариант осуществления настоящего изобретения относится к набору или контейнеру, содержащему соединение формулы (I) или любую его подгруппу в количестве, эффективном для использования в качестве стандарта или средства в тесте или анализе для определения способности возможных фармацевтических препаратов ингибировать полимеразу NS5B вируса HCV, рост HCV или и то и другое. Данный аспект изобретения может найти свое применение в фармацевтических исследовательских программах. Соединения и комбинации согласно настоящему изобретению могут быть использованы в высокопроизводительных анализах мишеней, таких как исследования, направленные на измерения эффективности указанной комбинации в лечении инфекции HCV. Примеры Следующие примеры предназначены иллюстрировать настоящее изобретение и не ограничивать его. Если не указано иное, очистку синтезированных соединений колоночной хроматографией или флэшхроматографией осуществляли на колонке с силикагелем. Пример 1. Синтез соединения 1. Раствор NaOH (6,38 г) в 25 мл воды добавляли к перемешиваемому раствору 1 а (10-трет-бутил 6 метил 13-циклогексил-3-метокси-7 Н-индоло[2,1-а][2]бензазепин-6,10-дикарбоксилата, синтезированного, как описано в заявке США 2007270406 А 1, в ТГФ (100 мл) и МеОН (150 мл). Через 1 ч реакционную смесь концентрировали при пониженном давлении, затем разбавляли охлажденной льдом водой (150 мл). рН полученного раствора доводили до рН 6 уксусной кислотой (АсОН). Осадок собирали фильтрованием, промывали водой и сушили в вакууме с получением 1,90 г (98%) 1b в виде желтоватого порошка: m/zHATU (1,17 г, 3,08 ммоль) добавляли в атмосфере азота к перемешиваемому раствору 1b (1,00 г,2,05 ммоль), DIPEA (1,07 мл, 6,15 ммоль) и 2,2'-окси-бис-(N-метилэтанамина) (1,08 г, 8,20 ммоль) в 30 мл сухого ТГФ. Через 1 ч реакцию гасили водой (100 мл) и реакционную смесь экстрагировали этилацетатом (EtOAc). Органический слой последовательно сушили (Na2SO4), фильтровали и упаривали. Остаток растирали в воде, фильтровали и сушили с получением 1,15 г (93%) конечного соединения 1 с в виде желтоватого порошка: m/z = 602 (М+Н)+. Стадия 3. Раствор 1 с (1,15 г, 1,91 ммоль) и сульфамида (1,84 г, 19,1 ммоль) в диоксане (10 мл) нагревали при 100 в СВЧ-печи в течение 20 мин. Реакционную смесь охлаждали до комнатной температуры, затем ТФУ (3,0 г, 26,3 ммоль) добавляли к раствору 1d (1,15 г, 1,70 ммоль) в дихлорметане (3 мл). Через 1 ч реакционную смесь концентрировали в вакууме. Остаток растирали в эфире, фильтровали и промывали эфиром, затем очищали хроматографией (градиент от EtOAc до EtOAc/EtOH, 9:1) с получением 802 мг (76%) желаемого продукта 1e: m/z = 625 (М+Н)+. Стадия 5. Карбонилдиимидазол (389 мг, 2,40 ммоль) добавляли к перемешиваемому раствору 1 е (500 мг, 0,80 ммоль) в сухом ТГФ (3 мл). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч: полное превращение в промежуточное соединение 1f наблюдали. Полученный раствор упаривали,затем остаток очищали флэш-хроматографией (градиент от EtOAc до CH3CN от 1:0 до 0:1) с получением 550 мг конечного продукта 1f, который использовали как таковой на следующей стадии: m/z = 675DBU (244 мг, 0,32 ммоль) добавляли к раствору 1f (550 мг) в ацетонитриле (25 мл). Реакционную смесь перемешивали в течение ночи при комнатной температуре, затем концентрировали при пониженном давлении. Остаток растворяли в воде (30 мл) и рН полученного раствора доводили до 5. Осадок собирали фильтрованием, промывали водой и сушили. Перекристаллизацией из этанола с последующей очисткой колоночной хроматографией (градиент от EtOAc до EtOAc/EtOH 9:1) получали 380 мг (78%) указанного в заголовке продукта 1 в виде белого порошка: m/z = 607 (М+Н)+. 1 Н ЯМР (ДМСО-d6)1,15 (м, 1 Н), 1,40 (м, 3H), 1,71 (м, 2 Н), 1,88 (м, 1 Н), 2,01 (м, 3H), 2,56 (м, 3H),2,77 (м, 1 Н), 2,99 (с, 3H), 3,26 (м, 2 Н), 3,50-3,71 (м, 6 Н), 3,87 (с, 3H), 4,44 (д, J=14,1 Гц, 1 Н), 5,09 (д, J=15,0 Гц, 1 Н), 6,95 (с, 1 Н), 7,13 (с, 1 Н), 7,19 (д, J=8,6 Гц, 1 Н), 7,47 (д, J=8,0 Гц, 1 Н), 7,54 (д, J=8,3 Гц, 1 Н), 7,88H-cube, используя 10% Pd на углеродном картридже. Затем, растворитель упаривали и остаток очищали колоночной хроматографией (CH2Cl2/CH3CN, 9:1) с получением 23 мг (41%) желаемого продукта 2 в виде белого порошка: m/z = 609 (М+Н)+. Примеры 3 и 4. Синтез соединений 3 и 4. Рацемическую смесь 2 очищали хроматографией SFC в течение 6,5 мин, используя хиральную колонку CHIRALCEL OD-H (25010 мм, с покрытием на 5-мкм силикагеле) и 55% метанол/45% CO2 в качестве подвижной фазы, при скорости потока 10 мл/мин и получали два чистых энантиомера 3 и 4. При данных условиях время удерживания составляло 4,25 и 5,54 мин. Пример 5. Синтез соединения 5. Соединение 5 а синтезировали с 96% выходом из промежуточного соединения 1b и 2-[4-(третбутилоксикарбонил)пиперазин-1-ил]этиламина способом, описанным для синтеза промежуточного соединения 1c: m/z = 699 (М+Н)+. Трифторуксусную кислоту (5,00 г, 43,9 ммоль) добавляли к 740 мг промежуточного соединения 5 а. Через 1 ч при комнатной температуре растворитель упаривали. Остаток растирали в EtOH/Et2O, фильтровали и сушили в высоком вакууме с получением 380 мг (64%) желаемого продукта 5b в виде желтоватого порошка: m/z = 543 (M+H)+. Стадия 3. Раствор 5b (380 мг, 0,700 ммоль) и сульфамида (673 мг, 7,00 ммоль) в диоксане (10 мл) нагревали при 100 С в СВЧ-печи в течение 15 мин. Затем, реакционную смесь последовательно охлаждали при комнатной температуре, концентрировали в вакууме, растирали в воде и фильтровали. Очистка колоночной хроматографией (градиент EtOAc/CH2Cl2 от 1:1 до 1:0) привела к 210 мг (46%) желаемого продукта 5 с: m/z = 622 (М+Н)+. Стадия 4. Указанный в заголовке продукт 5d синтезировали с 11% выходом способом (стадии 5 и 6), описанным для синтеза соединения 1, с последующей перекристаллизацией из этанола с получением желаемого продукта в виде белого порошка, m/z = 604 (М+Н)+. Пример 6. Синтез соединения 6.
МПК / Метки
МПК: C07D 515/18, C07D 513/18, A61K 31/55, A61P 31/14
Метки: пригодные, качестве, гепатита, ингибиторов, индола, макроциклические, производные, вируса
Код ссылки
<a href="https://eas.patents.su/30-19008-makrociklicheskie-proizvodnye-indola-prigodnye-v-kachestve-ingibitorov-virusa-gepatita-s.html" rel="bookmark" title="База патентов Евразийского Союза">Макроциклические производные индола, пригодные в качестве ингибиторов вируса гепатита с</a>
Предыдущий патент: Фунгицидная композиция
Следующий патент: Урацилсодержащие соединения и гербициды, включающие такие соединения
Случайный патент: Эмульсионные лекарственные формы производных пиразолона












