5-фенилизоксазол-3-карбоксамиды с противоопухолевыми активностями, модулирующие hsp90
Номер патента: 19793
Опубликовано: 30.06.2014
Авторы: Кабри Вальтер, Карминати Паоло, Пизано Клаудио, Симони Даниэле, Джаннини Джузеппе, Барукелло Риккардо
Формула / Реферат
1. Соединение общей формулы I
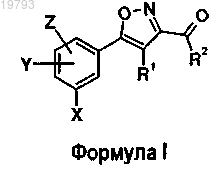
в которой X представляет собой атом галогена, С1-6алкил;
Y и Z, одинаковые или разные, представляют собой атом галогена, R3, OR3;
R3 представляет собой атом водорода или С1-6алкил;
R1 представляет собой NHC(=D)R4 или NR5R6;
D представляет собой О или S;
R7 представляет собой атом водорода или С1-6алкил;
R4 представляет собой С1-6алкил, необязательно замещенный одним алкокси или амино; С2-6алкенил, арил, необязательно замещенный одним или несколькими алкокси, атомами галогена или гетероциклоалкилалкилами; С3-10циклоалкил, необязательно замещенный одним или несколькими С1-6алкилами, галогеналкилами, алкокси, амино или аминоалкилами; норборнил, адамантил, гетероарил, необязательно замещенный одним или несколькими С1-6алкилами, алкиламинокарбонилами; (С4-7)гетероциклоалкил, необязательно замещенный одним или несколькими С1-6алкилами; или гетероциклоалкилалкил, необязательно замещенный одним или несколькими С1-6алкилами;
R5 и R6 независимо представляют собой атом водорода, С1-6алкил, С2-6алкенил, (С3-10)циклоалкил, (С4-7)гетероциклоалкил, необязательно замещенный одним или несколькими С1-6алкилами; аралкил, необязательно замещенный алкокси; гетероаралкил, необязательно замещенный одним или несколькими С1-6алкилами, гидроксиалкилами, алкоксикарбонилами;
R2 представляет собой NR8R9;
R8 и R9, одинаковые или разные, выбраны из Н, C1-6алкила, необязательно замещенного атомом галогена; галогеналкила; или R8 и R9, взятые вместе с атомом азота, к которому они присоединены, образуют гетероцикл, который может содержать один или два дополнительных гетероатома, выбранных из О, S или N, и который необязательно может быть замещен одним или двумя алкилами или атомами галогена,
его таутомеры, геометрические изомеры, оптически активные формы, такие как энантиомеры, диастереомеры и их рацематные формы, а также их фармацевтически приемлемые соли.
2. Соединение по п.1, в котором R1 представляет собой NHC(=D)R4.
3. Соединение по пп.1 и 2, в котором X представляет собой атом галогена или С1-6алкил.
4. Соединение по п.1, выбранное из группы, состоящей из
этиламида 4-ацетиламино-5-(5-хлор-2,4-дигидроксифенил)изоксазол-3-карбоновой кислоты SST0072AA1;
этиламида 5-(5-хлор-2,4-дигидроксифенил)-4-(4-метоксибензоиламино)изоксазол-3-карбоновой кислоты SST0081AA1;
этиламида 5-(5-хлор-2,4-дигидроксифенил)-4-(3,4-диметоксибензоиламино)изоксазол-3-карбоновой кислоты SST0100AA1;
этиламида 5-(5-хлор-2,4-дигидроксифенил)-4-(3,4,5-триметоксибензоиламино)изоксазол-3-карбоновой кислоты SST0101AA1;
этиламида 5-(5-хлор-2,4-дигидроксифенил)-4-(2,2-диметилпропиониламино)изоксазол-3-карбоновой кислоты SST0091AA1;
этиламида 4-[(адамантан-1-карбонил)амино]-5-(5-хлор-2,4-дигидроксифенил)изоксазол-3-карбоновой кислоты SST0093AA1;
этиламида 4-акрилоиламино-5-(5-хлор-2,4-дигидроксифенил)изоксазол-3-карбоновой кислоты SST0098AA1;
этиламида 5-(5-хлор-2,4-дигидроксифенил)-4-[(3-метилтиофен-2-карбонил)амино]изоксазол-3-карбоновой кислоты SST0092AA1;
этиламида 5-(5-хлор-2,4-дигидроксифенил)-4-(3-морфолин-4-илпропиониламино)изоксазол-3-карбоновой кислоты SST0099AA1;
этиламида 4-(4-бромбензоиламино)-5-(5-хлор-2,4-дигидроксифенил)изоксазол-3-карбоновой кислоты SST0102AA1;
этиламида 5-(2,4-дигидрокси-5-изопропилфенил)-4-(4-метоксибензоиламино)изоксазол-3-карбоновой кислоты SST0107AA1;
этиламида 4-ацетиламино-5-(2,4-дигидрокси-5-изопропилфенил)изоксазол-3-карбоновой кислоты SST0113AA1;
этиламида 5-(2,4-дигидрокси-5-изопропилфенил)-4-(2,2-диметилпропиониламино)изоксазол-3-карбоновой кислоты SST0114AA1;
этиламида 5-(2,4-дигидрокси-5-изопропилфенил)-4-[(3-метилтиофен-2-карбонил)амино]изоксазол-3-карбоновой кислоты SST0115AA1;
этиламида 5-(2,4-дигидрокси-5-изопропилфенил)-4-(3-морфолин-4-илпропиониламино)изоксазол-3-карбоновой кислоты SST0116AA1;
4-(3-(4-метилпиперазин-1-ил)пропанамидо)-N-этил-4-(2,4-дигидрокси-5-изопропилфенил)изоксазол-3-карбоксамида SST0203AA1;
[5-(2,4-дигидрокси-5-изопропилфенил)-3-этилкарбамоилизоксазол-4-ил]амида 1Н-индол-6-карбоновой кислоты SST0220AA1;
гидрохлорида этиламида 5-(2,4-дигидрокси-5-изопропилфенил)-4-(4-морфолин-4-илметилбензоиламино)изоксазол-3-карбоновой кислоты SST0201CL1;
этиламида 4-(циклогексанкарбониламино)-5-(2,4-дигидрокси-5-изопропилфенил)изоксазол-3-карбоновой кислоты SST0221AA1;
этиламида 5-(2,4-дигидрокси-5-изопропилфенил)-4-[(транс-4-пентилциклогексанкарбонил)амино]изоксазол-3-карбоновой кислоты SST0222AA1;
этиламида 5-(2,4-дигидрокси-5-изопропилфенил)-4-[(4-трифторметилциклогексанкарбонил)амино]изоксазол-3-карбоновой кислоты SST0223AA1;
N5-(3-(этилкарбамоил)-5-(2,4-дигидрокси-5-изопропилфенил)изоксазол-4-ил)-N3-этилизоксазол-3,5-дикарбоксамида SST0211AA1;
этиламида 5-(2,4-дигидрокси-5-изопропилфенил)-4-[(4-метоксициклогексанкарбонил)амино]изоксазол-3-карбоновой кислоты SST0226AA1;
этиламида 4-[(4-трет-бутилциклогексанкарбонил)амино]-5-(2,4-дигидрокси-5-изопропилфенил)изоксазол-3-карбоновой кислоты SST0227AA1;
этиламида 4-[(4-аминоциклогексанкарбонил)амино]-5-(2,4-дигидрокси-5-изопропилфенил)изоксазол-3-карбоновой кислоты SST0228CL1;
этиламида 4-[(4-аминометилциклогексанкарбонил)амино]-5-(2,4-дигидрокси-5-изопропилфенил)изоксазол-3-карбоновой кислоты SST0229CL1;
4-(4-метоксибензиламино)-5-(5-хлор-2,4-дигидроксифенил)-N-этилизоксазол-3-карбоксамида SST0207AA1;
4-((3-метилтиофен-2-ил)метиламино)-5-(5-хлор-2,4-дигидроксифенил)-N-этилизоксазол-3-карбоксамида SST0206AA1;
5-(5-хлор-2,4-дигидроксифенил)-4-(циклогексиламино)-N-этилизоксазол-3-карбоксамида SST0208AA1;
4-(1-метилпиперидин-4-иламино)-5-(5-хлор-2,4-дигидроксифенил)-N-этилизоксазол-3-карбоксамида SST0209AA1;
метил-5-((3-(этилкарбамоил)-5-(5-хлор-2,4-дигидроксифенил)изоксазол-4-иламино)метил)изоксазол-3-карбоксилата SST0210AA1;
4-((3-(гидроксиметил)изоксазол-5-ил)метиламино)-5-(5-хлор-2,4-дигидроксифенил)-N-этилизоксазол-3-карбоксамида SST0212AA1;
4-(4-метоксибензамидо)-5-(5-хлор-2,4-дигидроксифенил)-N-(2,2,2-трифторэтил)изоксазол-3-карбоксамида SST0204AA1;
4-(4-метоксибензамидо)-5-(5-хлор-2,4-дигидроксифенил)изоксазол-3-ил-(3,3-дифторазетидин-1-ил)метанона SST0205AA1 и
5-(5-хлор-2,4-дигидроксифенил)-4-(4-метоксибензоиламино)изоксазол-3-ил-(4-метилпиперазин-1-ил)метанона SST0123AA1.
5. Применение соединения по любому из пп.1-4 для получения лекарственного средства.
6. Применение по п.5 для получения лекарственного средства для лечения патологического состояния, при котором модуляция активности Hsp90 приведет к улучшению самочувствия пациента.
7. Применение по п.6, где патологическое состояние представляет собой нейродегенеративное заболевание, воспалительное заболевание, злокачественную опухоль, аутоиммунное заболевание, ишемию головного мозга или паразитемию, включая малярию.
8. Применение по п.7, где нейродегенеративное заболевание представляет собой болезнь Паркинсона, болезнь Гентингтона, болезнь Альцгеймера, деменцию с тельцами Леви, амиотрофический боковой склероз, спинальную и бульбарную мышечную атрофию или спинально-церебеллярную атаксию и злокачественная опухоль представляет собой злокачественную опухоль молочных желез, поджелудочной железы, легкого, плевры, брюшной полости, лица и шеи, мочевого пузыря, головного мозга, предстательной железы, яичников, глаз или метастатическую злокачественную опухоль.
9. Фармацевтическая композиция для лечения злокачественной опухоли, неврологического заболевания, воспалительного заболевания, аутоиммунного заболевания, ишемии головного мозга или паразитемии, содержащая по меньшей мере одно соединение по пп.1-4 в качестве активного ингредиента вместе с фармацевтически приемлемым инертным наполнителем.
10. Способ получения фармацевтической композиции по п.9, включающий смешивание по меньшей мере одного соединения по пп.1-4 с фармацевтически приемлемой солью и/или фармацевтически приемлемым носителем.
11. Способ лечения пациента, пораженного злокачественной опухолью, включающий введение эффективного количества соединения по пп.1-4.
12. Соединение формулы VII
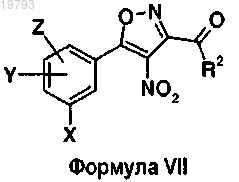
в которой X, Y, Z и R2 имеют указанные выше значения, в качестве промежуточного продукта при синтезе соединений по п.1.
13. Способ получения соединений формулы VII
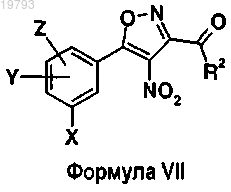
в которой X, Y, Z и R2 имеют указанные выше значения, включающий стадию взаимодействия соединений формулы VI
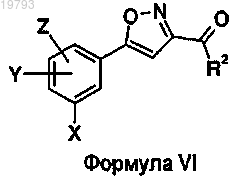
в которой X, Y, Z и R2 имеют указанные выше значения, с HNO3/AC2O.
14. Соединение формулы II
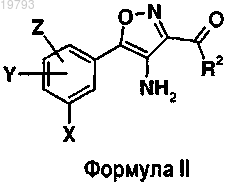
в которой X, Y, Z и R2 имеют указанные выше значения, в качестве промежуточного продукта при получении соединений по п.1.
15. Способ получения соединений формулы II
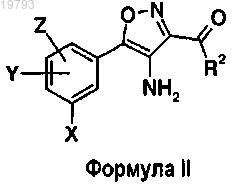
в которой X, Y, Z и R2 имеют указанные выше значения, включающий стадию взаимодействия соединений формулы VII, описанной выше, с Zn/NH4Cl в смеси ТГФ/Н2О.
16. Способ получения соединений по п.1, где R1 представляет собой NHC(=D)R4, D и R4 имеют указанные выше значения, включающий стадию взаимодействия соединений формулы II
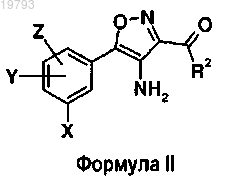
в которой X, Y, Z и R2 имеют указанные выше значения, с хлорангидридом карбоновой кислоты формулы ClCOR4 и затем с реагентом Лоуссона в том случае, когда D представляет собой S.
17. Способ получения соединений по п.1, в которых R1 представляет собой NR5R6; R5 и R6 представляют собой С1-6алкил, С2-6алкенил, С3-10циклоалкил, бензил, аралкил, гетероарилкил или С4-7гетероциклоалкил или один из R5 и R6 представляет собой Н, включающий стадию взаимодействия соединений формулы II, в которой X, Y, Z и R2 имеют указанные выше значения, с одним или несколькими эквивалентами соединения формулы R-CHO или (R')(R')C=O (в значении кетона), где фрагменты R-C и R' имеют значение R5 или R6, указанное выше, в полярном растворителе в присутствии кислоты и восстановителя.
18. Способ по п.17, где полярный растворитель представляет собой МеОН, кислота представляет собой АсОН и восстановитель представляет собой NaCNBH4.
Текст
Изобретение относится к соединениям формулы I, обладающим противоопухолевыми активностями посредством ингибирования белка теплового шока 90 (Hsp90) в качестве молекулярного шаперона, как одной из возможных биологических мишеней. Изобретение включает применение таких соединений в медицине в отношении злокачественной опухоли, а также других заболеваний, которые реагируют на ингибирование Hsp90, и фармацевтическую композицию, содержащую такие соединения. Область техники, к которой относится изобретение Настоящее изобретение относится к арилизоксазольным производным, обладающим противоопухолевыми активностями за счет ингибирования белка теплового шока 90 (Hsp90) в качестве молекулярного шаперона, как одной из возможных биологических мишеней. Изобретение включает применение таких соединений в медицине в отношении злокачественной опухоли, а также других заболеваний, которые реагируют на ингибирование Hsp90, и фармацевтическую композицию, содержащую такие соединения. Уровень техники Белки теплового шока (Hsp) играют ключевую роль при защите клетки от различных стрессовых для клетки факторов (т.е. токсичного ксенобиотика, химиотерапии, радиации), действуя как защитный фактор против мисфолдинга (неправильного сворачивания) незаменимых белков, вовлеченных в поддержание функциональных характеристик клетки. Белки Hsp90, представители таких молекулярных шаперонов, являются белками, которые играют ключевую роль в конформационном созревании, стабильности и функционировании так называемых белков-"клиентов", многие из которых, такие как Bcr-Abl, р 53,Raf-1, Akt, ErbB2, EGFR, Hif и другие белки, принадлежат к семейству онкогенных белков, а также к рецепторам стероидных гормонов. Ингибирование Hsp90 инициирует разрушение белкового комплексаHsp90-клиент, и затем его разрушение, опосредованное протеасомой, вызывает утрату функции и ингибирование роста клеток. Примечательно, что белок теплового шока 90 стал важной мишенью при нескольких заболеваниях. В частности, совсем недавно была установлена роль Hsp90 в регулировании и поддержании трансформированного фенотипа при злокачественных опухолях и нейродегенеративных заболеваниях, а также его роли при грибковых и вирусных инфекциях (Solit D.B. и др., Drug Discov. Today, 2008, 13(1-2), 38). В частности, также сообщалось, что ингибирование Hsp90 полезно при лечении нейродегенеративных заболеваний, таких как деменция с тельцами Леви, амиотрофический боковой склероз, спинальная и бульбарная мышечная атрофия, спинально-церебеллярная атаксия, болезни Паркинсона, Гентингтона и Альцгеймера (Taylor D.M. и др., Cell Stress Chaperones, 2007, 12, 2, 151; Yang Z. и др., Nat. Med., 2007, 13, 3, 348; Katsuno M. и др., Proc. Natl. Acad. Sci. USA, 2005, 12, 46, 16801; GalloEngl. J. Med., 2005, 353, 1489; Dou F. и др., Int. J. Mol. Sci., 2007, 8, 51); воспалительные заболевания (Vega V.L. и др., Mol. Biol. Cell., 2003, 14, 764; Poulaki V. и др., Faseb J., 2007, 21, 2113); ишемия головного мозга (Lu А. и др., J. Neurochem., 2002, 81, 2, 355) и малярия (Kumar R. и др., J. Biosci., 2007, 32, 3, 531). Кроме того, многие белки-клиенты Hsp90 чрезмерно экспрессируются в злокачественной опухоли,часто в мутированных формах, и несут ответственность за неограниченную пролиферацию и выживаемость клеток злокачественной опухоли. Примечательно, что Hsp90, полученный из клеток опухоли, имеет чрезвычайно высокую активность АТФазы с повышенной аффинностью связывания с ингибиторамиHsp90, которая в нормальных клетках находится в латентной форме, обеспечивая специфическую мишень ингибиторам Hsp90 в клетках опухоли с незначительным ингибированием функции Hsp90 в нормальных клетках (Chiosis G. и др., ACS Chem. Biol., 2006, 1, 5, 279). Кроме того, недавно также было установлено, что Hsp90 является важным внеклеточным медиатором при опухолевой инвазии (Eustace В.K. и др., Nature Cell Biol., 2004, 6, 6, 507; Koga F. и др., Cell cycle, 2007, 6, 1393). Поэтому при разработке противоопухолевых лекарственных средств Hsp90 считается основной терапевтической мишенью, поскольку ингибирование одной мишени отражается на всех характерных признаках злокачественной опухоли. После открытия того, что два природных соединения, гелданамицин и радицикол, способны ингибировать функцию Hsp90 путем связывания с АТФ-связывающим карманом на его N-терминальном домене, интерес к ингибиторам Hsp90 вырос. Было показано, что природный антибиотик гелданамицин обладает сильной противоопухолевой активностью в отношении раковых клеток человека (Whitesell L. и др., Cancer Res., 1992, 52, 1721), хотя и значительной токсичностью, препятствующей его клиническому исследованию (Supko J.G. и др., Cancer Chemother. Pharmacol., 1995, 36, 305). Первым в классе ингибиторов Hsp90, с которого начались клинические испытания, был аналог гелданамицина 17-AAG (17-аллиламиногелданамицин). Несмотря на то что данное производное гелданамицина характеризуется высокой активностью in vitro, интерес к нему был омрачен плохой растворимостью в сочетании с гепатотоксичными свойствами. Некоторые из указанных проблем частично были решены с открытием 17-диметиламиноэтилгелданамицина. Было обнаружено, что радицикол - природный макроциклический антибиотик с противогрибковой активностью, ингибирует белок Hsp90 путем взаимодействия с иным участком, чем гелданамицин(Sharma S.V. и др., Oncogene, 1998, 16, 2639). Однако вследствие присущей ему химической нестабильности он лишен активности in vivo. Еще один важный класс ингибиторов относится к структуре с пуриновым ядром. Такой класс производных разработан благодаря их структурной гомологии с АТФ. Было обнаружено, что среди многих ингибиторов, разработанных в рамках данного семейства, высокой in vitro и in vivo активностью обладает PU24FCl (He Н. и др., J. Med. Chem., 2006, 49, 381). Кампании по проведению скрининга высокой пропускной способности позволили открыть бензи-1 019793 зоксазольные производные, наделенные Hsp90-ингибиторными свойствами и содержащие резорциновый фрагмент в положении 3 (Gopalsamy А. и др., J. Med. Chem., 2008, 51, 373). Среди ингибиторов Hsp90 разного класса компанией Vernalis Ltd. были открыты 4,5 диарилпиразолы (Cheung K.M. и др., Bioorg. Med. Chem. Lett., 2005, 15, 3338); 3-арильные, 4 карбоксамидные производные пиразолов (Brough P.А. и др., Bioorg. Med. Chem. Lett., 2005, 15, 5197), 4,5 диарилизоксазолы (Brough P.А. и др., J. Med. Chem., 2008, 51, 196), 3,4-диарилпиразолрезорциновое производное (Dymock B.W. и др., J. Med. Chem., 2005, 48, 4212; Smith N.F. и др., Mol. Cancer Ther., 2006, 5, 6,1628) и тиено[2,3-d]пиримидин (WO 2005034950, AACR 2009, Denver, Colorado, poster 4684). В патентной заявке WO 2003013517 сообщается о 3-арил-5-аминоизоксазольных производных в качестве ингибиторов киназы, применимых в качестве противораковых средств. В патентной заявке WO 2002070483 описаны гетероциклические диамидные соединения общей формулы 1 в качестве средств, применимых для регулирования беспозвоночных паразитов. Однако до сих пор нет данных об Hsp90-ингибиторах, полностью соответствующих требованиям безопасности и стабильности. Следовательно, потребность в сильных и селективных Hsp90-ингибиторах остается интересной и перспективной целью. В настоящее время авторы настоящего изобретения обнаружили, что 4-аминозамещенные арилизоксазолы обладают высокими и неожиданными Hsp90 ингибиторными свойствами. Описание изобретения Настоящее изобретение относится к новому классу замещенных 4-амино-5-арилизоксазольных соединений и их применению в качестве Hsp90-ингибиторов. Основными отличительными признаками соединений по настоящему изобретению являются ядро изоксазольного цикла с одним ароматическим заместителем в 5-положении и ограниченным классом амидозаместителей в 3-положении, связанных сNH-заместителем типа амина, амида, уреидо, карбамата и т.д. в 4-положении. В изобретении предлагаются соединения формулы I или их соль, N-оксид, гидрат или сольват для получения композиции для ингибирования активности Hsp90 в которой X представляет собой атом галогена, алкил, алкенил, галогеналкил, арил, гетероарил,бензил, амино, алкиламино или аминокарбонил;Y и Z, одинаковые или разные, представляют собой атом галогена, нитро, галогеналкил, R3, OR3,амино, алкиламино или аминокарбонил;R3 представляет собой атом водорода, алкил;R7 представляет собой атом водорода или алкил;R4 представляет собой алкил, необязательно замещенный одним алкокси или амино; алкенил, арил,необязательно замещенный одним или несколькими алкокси, атомами галогена или гетероциклоалкилалкилами; циклоалкил, необязательно замещенный одним или несколькими алкилами, галогеналкилами,алкокси, амино или аминоалкилами; норборнил, адамантил, гетероарил, необязательно замещенный одним или несколькими алкилами, алкиламинокарбонилами; гетероциклоалкил, необязательно замещенный одним или несколькими алкилами; или гетероциклоалкилалкил, необязательно замещенный одним или несколькими алкилами;R5 и R6 независимо представляют собой атом водорода, алкил, циклоалкил, гетероциклоалкил, необязательно замещенный одним или несколькими алкилами; алкенил, бензил, арил, аралкил, необязательно замещенный алкокси; гетероарил, гетероаралкил, необязательно замещенный одним или несколькими алкилами, гидроксиалкилами, алкокси, алкоксикарбонилами; или R5 и R6, взятые вместе с атомом азота, к которому они присоединены, могут образовывать необязательно замещенное 5-7-членное гетероциклическое кольцо, которое необязательно замещено атомом галогена, гидроксилом, алкоксилом,алкилом, арилом, аралкилом, алкилкарбонилом или аминокарбонилом.R8 и R9, одинаковые или разные, выбраны из Н, алкила, необязательно замещенного атомом галогена; галогеналкила, арила, циклоалкила, гетероциклоалкила и гетероарила; или R8 и R9, взятые вместе с атомом азота, к которому они присоединены, образуют гетероцикл, который может содержать один или два дополнительных гетероатома, выбранных из О, S или N, и который необязательно может быть замещен одним или двумя алкилами или атомами галогена; их таутомеры, геометрические изомеры, оптически активные формы, такие как энантиомеры, диастереомеры и их рацематные формы, а также их фармацевтически приемлемые соли. Вариант осуществления настоящего изобретения представляет собой вариант осуществления соединений формулы I для применения в качестве лекарственных средств. В дополнительном варианте осуществления изобретения упомянутое лекарственное средство применяется для лечения субъекта, пораженного злокачественными опухолями, нейродегенеративными заболеваниями, воспалительными заболеваниями, ишемией головного мозга или малярией. В предпочтительном варианте осуществления изобретения упомянутое лекарственное средство применяется для лечения злокачественных опухолей. В еще одном предпочтительном варианте осуществления изобретения упомянутое лекарственное средство применяется для лечения воспалительных заболеваний. В еще одном предпочтительном варианте осуществления изобретения упомянутое лекарственное средство применяется для лечения аутоиммунных заболеваний. В еще одном предпочтительном варианте осуществления изобретения упомянутое лекарственное средство применяется для лечения ишемии головного мозга. В еще одном предпочтительном варианте осуществления изобретения упомянутое лекарственное средство применяется для лечения паразитемии, включая малярию. Кроме того, в изобретении предлагается способ получения соединений формулы I, которые могут быть получены с помощью традиционных способов синтеза и описаны ниже. Соединения формулы I, в которых R1 представляет собой NHC(=D)ER4, D представляет собой О и Е отсутствует, можно получать, например, путем взаимодействия соединения формулы II в которой X, Y, Z и R2 имеют указанные выше значения, с хлорангидридом карбоновой кислоты формулы ClCOR4 в апротонном растворителе (например, DCM) в присутствии основания, такого какNEt3. Соответствующие соединения, где D представляет собой S, можно получать путем взаимодействия последнего с реагентом Лоуссона в толуоле в температурном диапазоне от комнатной температуры (RT) до 90 С. Соединения формулы I, где R1 представляет собой NR5R6 и где R5 и R6 представляют собой алкил,циклоалкил, гетероциклоалкил, аралкил или гетероаралкил, можно получать, например, путем взаимодействия соединения формулы II, в которой X, Y, Z и R2 имеют указанные выше значения, с одним или несколькими эквивалентами соединений формулы R-CHO или R'=O (в значении кетона), где фрагментыR-C и R' имеют значения, указанные выше для R5 и/или R6, в полярном растворителе (например, МеОН) в присутствии кислоты, такой как АсОН, и восстановителя, такого как NaCNBH4. Альтернативно, соединения формулы I, где R1 представляет собой NR5R6 и где R5 и R6 представляют собой алкил, алкенил, аралкил или гетероаралкил, можно получать, например, путем взаимодействия соединения формулы II, в которой X, Y, Z и R2 имеют указанные выше значения, с одним или несколькими эквивалентами соединений формулы R-X1, где R имеет значение, описанное выше для R5 и/или R6,и X1 обозначает удаляемую группу, такую как Cl, Br или Tf, в апротонном растворителе (например,DCM) в присутствии основания, такого как NEt3. Альтернативно, соединения формулы I, где R1 представляет собой NR5R6 и где R5 и/или R6 представляют собой арил или гетероарил, можно получать, например, путем взаимодействия соединения формулы III в которой X, Y, Z и R2 имеют указанные выше значения,с амином формулы IV где R5 и R6 имеют указанные выше значения, в присутствии катализатора, такого как Pd(dba)2/P(tBu)3. Соединения формулы III можно получать, как описано в патентной заявке WO 04072051, посредством бромирования соответствующего 4-Н-изоксазольного производного бромом в уксусной кислоте в присутствии ацетата натрия. Соединения формулы I, где R1 представляет собой NHC(=D)ER4, можно получать, например, путем взаимодействия соединения формулы V в которой X, Y, Z, D и R2 имеют указанные выше значения, с соединением формулы ER4, в которой Е представляет собой NR7 и R4 имеет указанные выше значения, в апротонном растворителе (например,ТГФ) в присутствии основания. Соединения формулы II, в которой X, Y, Z и R2 имеют указанные выше значения, можно получать,например, путем взаимодействия соединений формулы VI в которой X, Y, Z и R2 имеют указанные выше значения, с HNO3/AC2O с получением нитропроизводных формулы VII (Chimichi S. и др., Heterocycles, 1989, 29, 1965) в которой X, Y, Z и R2 имеют указанные выше значения, которые, в свою очередь, подвергаются восстановлению (например, с помощью Zn/NH4Cl, как сообщалось в публикации Pascual A., HelveticaChim. Act., 1989, 72, 3, 556). Вариант осуществления настоящего изобретения представляет собой вариант получения соединений формулы VII, в которой X, Y, Z и R2 имеют указанные выше значения, в качестве промежуточного продукта при получении соединений формулы I. Еще один вариант осуществления настоящего изобретения представляет собой вариант получения соединений формулы II, в которой X, Y, Z и R2 имеют указанные выше значения, в качестве промежуточного продукта при получении соединений формулы I. Во всех упомянутых превращениях любую мешающую реакционноспособную группу можно защищать и затем снимать защиту согласно общепринятым процедурам, описанным в органической химии(см., например, Greene Т.W. и P.G.M. Wuts "Protective Groups in Organic Synthesis", J. WileySons, Inc.,3rd Ed., 1999) и хорошо известным специалистам в данной области. Все упомянутые превращения являются только примерами общепринятых процедур, описанных в органической химии (см., например, March J., "Advanced Organic Chemistry", J. WileySons, Inc., 4th Ed.,1992) и хорошо известных специалистам в данной области. Термин "алкил" относится к линейным или разветвленным алкильным группам, содержащим от 1 до 20 атомов углерода или предпочтительно от 1 до 12 атомов углерода либо еще более предпочтительно от 1 до приблизительно 6 атомов углерода. Примерами низшей алкильной группы являются такие группы, как метил, этил, н-пропил, изопропил, н-бутил, изобутил, необутил, трет-бутил, пентил, изопентил,н-гексил и т.п. Упомянутый "алкил" необязательно может быть замещен одним или несколькими возможными заместителями типа гидроксила, атома галогена, амино и т.п. Термин "циклоалкил" относится к насыщенной или частично ненасыщенной (но не ароматической) карбоциклической группе с одним циклом, содержащим от 3 до 10 атомов углерода. Примеры "С 3-С 10 циклоалкила" включают циклопропил, циклобутил, циклопентил, циклогексил и т.п. Упомянутый циклоалкил необязательно может быть замещен одним или несколькими гидроксилами, атомами галогена,низшими алкилами, галогеналкилами, низшими алкокси, амино, аминокарбонилами, алкилкарбонилами или алкоксикарбонилами. Термин "галогеналкил" относится к CF3- или CHF2-фрагментам или к указанным выше алкильным группам, содержащим CF3- или CHF2-фрагменты. Термин "алкенил" относится к линейным или разветвленным алкенильным группам, предпочтительно содержащим от 2 до 12 атомов углерода или более предпочтительно от 2 до 6 атомов углерода,также называемых "низшей" алкенильной группой, и содержащим по меньшей мере 1 или 2 участка с алкенильной ненасыщенностью. Предпочтительные алкенильные группы включают этенил (-СН=СН 2),пропенил (аллил, -СН 2 СН=СН 2) и т.п. Термин "алкенил" включает радикалы с цис- и транс-ориентацией или, альтернативно, Z- и Е-радикалы. Термин "алкокси" относится к группе -OR, где R включает "алкил", "циклоалкил" и "гетероциклоалкил". Термин "алкоксикарбонил" относится к группе -С(О)OR, где R включает "алкил", "циклоалкил" и гетероциклоалкил. Термин "амино" относится к группе -NH2. Термин "алкиламино" относится к группе -NHR, где R представляет собой "алкил". Термин "циклоалкиламино" относится к группе -NHR, где R представляет собой "циклоалкил". Термин "ариламино" относится к группе -NHR, где R представляет собой "арил". Термин "аминоалкил" относится к группе H2NR-, где R представляет собой "алкилен". Термин "низший", когда он связан с терминами "алкил", "алкокси", "алкиламино", "аминоалкил" или "гетероаралкил", означает, что соответствующая алкильная группа содержит от 1 до 6 атомов углерода. Термины "гетероциклоалкил" и "гетероцикл" относятся к насыщенному или частично ненасыщенному (но не ароматическому) четырех-, пяти-, шести- или семичленному циклу, содержащему один или два атома азота, кислорода или серы, которые могут быть одинаковыми или разными, и циклы которых могут быть замещены амино или алкилом. Предпочтительный гетероциклоалкил включает азетидин,пирролидин, пиперидин, пиперазин, кетопиперазин, 2,5-дикетопиперазин, морфолин и тиоморфолин. Термин "гетероциклоалкилалкил" относится к указанным выше алкильным группам, содержащим гетероциклоалкильный заместитель; включающим 2-(1-пирролидинил)этил, 4-морфолинилметил, 4 морфолинилэтил, (1-метил-4-пиперидинил)метил, (1-метил-4-пиперазинил)этил и т.п. Термин "арил" относится к ароматической карбоциклической группе с одним циклом, содержащим от 6 до 14 атомов углерода (например, фенилу) или с несколькими циклами, которые могут быть связаны через боковые группы или могут быть конденсированными. Предпочтительный арил включает фенил,нафтил, фенантренил, бифенил и т.п. Упомянутый "арил" может содержать от 1 до 3 заместителей, выбранных из гидроксила, атома галогена, галогеналкила, циано, низшего алкила, низшего алкокси, амино,гетероциклоалкилалкила и низшего аминоалкила или низшего алкиламино. Термин "гетероарил" относится к моноциклической гетероароматической или бициклической гетероароматической группе с конденсированными циклами. Конкретные примеры гетероароматических групп включают пиридил, пирролил, фурил, тиенил, имидазолил, оксазолил, изоксазолил, тиазолил, изотиазолил, пиразолил, бензофурил, [2,3-дигидро]бензофурил, изобензофурил, бензотиенил, бензотриазолил, индолил и изобензотиенил. Упомянутый "гетероарил" может содержать от 1 до 3 заместителей, выбранных из гидроксила, гидроксиалкила, атома галогена, галогеналкила, нитро, циано, низшего алкила,низшего алкокси, амино, низшего аминоалкила, низшего алкиламино, аминокарбонила и алкоксикарбонила. Термин "аралкил" относится к указанным выше алкильным группам, содержащим один или несколько арильных заместителей, включающим бензил, фенетил, дифенилметил и т.п. Термин "гетероаралкил" относится к указанным выше алкильным группам, содержащим гетероарильный заместитель. Предпочтительный гетероаралкил представляет собой низший гетероаралкил, содержащий гетероарильный радикал, связанный с низшим алкилом. Термин "аминокарбонил" относится к группе -C(O)NRR', где каждый из R, R' независимо включает Н, "алкил", "алкенил", "алкинил", "циклоалкил", "гетероциклоалкил", "арил" и "гетероарил". Авторы изобретения установили, что производные (I) и их фармацевтически приемлемые соли, полученные согласно изобретению, представляют собой средства, применимые для лечения болезненных состояний, расстройств и патологических состояний, опосредованных Hsp90; в частности, для лечения злокачественных опухолей, нейродегенеративных заболеваний, воспалительных заболеваний; ишемии головного мозга и малярии. Фармацевтические композиции будут содержать по меньшей мере одно соединение формулы I в качестве активного ингредиента в таком количестве, которое создает значительный терапевтический эффект. Композиции, предусмотренные настоящим изобретением, являются вполне традиционными, их получают с помощью способов, которые представляют собой общепринятую практику в фармацевтической индустрии, например, такие как способы, проиллюстрированные в публикации Remington's Pharmaceutical Science Handbook, Mack Pub. N.Y., последнее издание. Согласно выбранным способам введения композиции будут находиться в твердой или жидкой форме, подходящей для перорального, парентерального или наружного введения. Композиции согласно настоящему изобретению содержат наряду с активным ингредиентом по меньшей мере один фармацевтически приемлемый носитель или инертный наполнитель. Особенно полезными для приготовления препарата могут быть вспомогательные средства,например солюбилизирующие средства, диспергаторы, суспендирующие средства и эмульгаторы. Обычно соединения по настоящему изобретению вводят в "терапевтически эффективном количестве". Фактически вводимое количество соединения, как правило, будет определяться врачом с учетом соответствующих обстоятельств, включая состояние, подлежащее лечению, выбранный способ введения,вводимое соединение как таковое, комбинацию лекарственных средств, возраст, массу тела и реакцию конкретного пациента, серьезность симптомов у пациента и т.п. Терапевтически эффективную дозу любого соединения сначала можно оценивать либо из анализа клеточных культур, либо на животных моделях, обычно на мышах, крысах, морских свинках, кроликах, собаках или свиньях. Животную модель также можно применять для определения подходящего диапазона концентраций и способа введения. Такую информацию затем можно применять для определения применимых доз и способов введения человеку. При расчете эквивалентной дозировки для человека (HED) рекомендуется применять таблицу пересчета, приводимую в руководстве для индустрии Управления по контролю за пищевыми продуктами и лекарственными средствами (Guidance for Industry and Reviewers document, 2002, U.S. Food и Drug Administration, Rockville, Maryland, USA). Обычно эффективная доза будет составлять от 0,01 до 100 мг/кг, предпочтительно от 0,05 до 50 мг/кг. Терапевтически эффективную дозу любого соединения сначала можно оценивать либо из анализа клеточных культур, либо на животных моделях, обычно мышах, крысах, морских свинках, кроликах,собаках или свиньях. Точная эффективная доза для конкретного человека будет зависеть от серьезности болезненного состояния, общего самочувствия субъекта, возраста, массы тела и пола субъекта, режима питания, времени и периодичности введения, комбинации(ий) лекарственных средств, чувствительности реакции и переносимости/реакции на терапию. Такое количество можно определять при проведении стандартного исследования и на основе мнения врача-клинициста. Композиции могут вводиться пациенту по отдельности или могут вводиться в комбинации с другими средствами, лекарственными средствами или гормонами. При введении терапевтического средства лекарственное средство также может содержать фармацевтически приемлемый носитель. Такие носители включают антитела и другие полипептиды, гены и другие терапевтические средства, такие как липосомы, при условии, что носитель не вызывает продукцию антител, вредных при индивидуальном приеме композиции, и которые можно вводить при отсутствии чрезмерной токсичности. Подходящие носители могут представлять собой большие, медленно метаболизируемые макромолекулы, такие как белки, полисахариды, полимолочные кислоты, полигликолевые кислоты, полимерные аминокислоты, сополимеры на основе аминокислот и инактивированные вирусные частицы. Исчерпывающее обсуждение фармацевтически приемлемых носителей имеется в публикации Remington's Pharmaceutical Sciences (Mack Pub. Co., N.J. 1991). Фармацевтически приемлемые носители в терапевтических композициях дополнительно могут содержать жидкости, такие как вода, физиологический раствор, глицерин и этанол. Кроме того, в таких композициях могут присутствовать вспомогательные вещества, такие как увлажняющие средства или эмульгаторы, буферные вещества для поддержания рН и т.п. Такие носители облегчают получение препаратов на основе фармацевтических композиций в виде таблеток, пилюль,драже, капсул, жидкостей, гелей, сиропов, взвесей, суспензий и т.п. для приема пациентом внутрь. После получения композиции по изобретению можно вводить непосредственно субъекту. Субъекты, подлежащие лечению, могут представлять собой животных; в частности, лечению может подвергаться человек. Лекарственное средство согласно настоящему изобретению можно вводить с помощью ряда способов, включая, но не ограничиваясь перечисленным, пероральный, внутривенный, внутримышечный,внутриартериальный, интрамедуллярный, интратекальный, интравентрикулярный, трансдермальный способ или аппликации, наносимые на кожу, подкожный, внутрибрюшинный, интраназальный, энтеральный, наружный, сублингвальный, интравагинальный или ректальный способы. Композиции для перорального введения могут принимать форму нерасфасованных жидких растворов или суспензий или нерасфасованных порошков. Однако более часто композиции представлены в стандартных лекарственных формах, чтобы облегчить точную дозировку. Термин "стандартные лекарственные формы" относится к физически дискретным элементам, подходящим в качестве однократных доз для человека и других млекопитающих, где каждый элемент содержит заданное количество активного материала, рассчитанное на создание требуемого терапевтического эффекта, в соединении с подходящим фармацевтически инертным наполнителем. Типичные стандартные лекарственные формы включают заполненные предварительно отмеренными жидкими композициями ампулы или шприцы, или пилюли,таблетки, капсулы или т.п. в случае твердых композиций. В таких композициях соединение по изобретению обычно является незначительным в количественном выражении компонентом (от приблизительно 0,1 до приблизительно 50 мас.% или предпочтительно от приблизительно 1 до приблизительно 40 мас.%) по сравнению с остальной частью, представляющей собой различные наполнители или носители и вспомогательные технологические добавки, помогающие при образовании требуемой лекарственной формы. Дозированное лечение может представлять собой схему однократного применения или схему многократного применения лекарственного средства. Как описано выше, соединения по настоящему изобретению благодаря их ингибирующим свойствам в отношении Hsp90 применимы в качестве лекарственных средств для лечения расстройств, при которых такое ингибирование приводит к улучшению самочувствия пациента. В частности, лечению могут подвергаться пациенты, страдающие от злокачественных опухолей, нейродегенеративных заболеваний,-6 019793 воспалительных заболеваний, ишемии головного мозга и малярии. Объектами настоящего изобретения являются фармацевтические композиции, содержащие одно или несколько соединений формулы I, описанной ранее, в комбинации с инертными наполнителями и/или фармакологически приемлемыми разбавителями. Композиции, о которых идет речь, вместе с соединениями формулы I могут содержать известные действующие начала. Дополнительным объектом настоящего изобретения является способ получения фармацевтических композиций, характеризующийся смешиванием одного или нескольких соединений формулы I с подходящими инертными наполнителями, стабилизаторами и/или фармацевтически приемлемыми разбавителями. Вариантом осуществления данного изобретения является вариант осуществления соединений описанной ранее формулы I, в которой R1 представляет собой NHC(D)ER4 с D, представляющим собой О, и Е, представляющим собой NR5R6 или отсутствующим. Еще одним вариантом осуществления данного изобретения является вариант осуществления соединений описанной ранее формулы I, в которой X представляет собой алкил или галоген. Еще один вариант осуществления настоящего изобретения состоит из соединений, выбранных из группы, состоящей из этиламида 4-ацетиламино-5-(5-хлор-2,4-дигидроксифенил)изоксазол-3-карбоновой кислоты SST0072AA1; этиламида 5-(5-хлор-2,4-дигидроксифенил)-4-(4-метоксибензоиламино)изоксазол 3-карбоновой кислоты мида 5-(2,4-дигидрокси-5-изопропилфенил)-4-(3,4,5-триметоксибензоиламино)изоксазол-3-карбоновой кислоты; этиламида 4-[(адамантан-1-карбонил)амино]-5-(2,4-дигидрокси-5-изопропилфенил)изоксазол-3 карбоновой кислоты; этиламида 4-акрилоиламино-5-(2,4-дигидрокси-5-изопропилфенил)изоксазол-3 карбоновой кислоты; этиламида 4-(4-бромбензоиламино)-5-(2,4-дигидрокси-5 изопропилфенил)изоксазол-3-карбоновой кислоты; этиламида 5-(2,4-дигидрокси-5-изопропилфенил)-4(4-метоксибензолсульфониламино)изоксазол-3-карбоновой кислоты; этиламида 4-амино-5-(2,4 дигидрокси-5-изопропилфенил)изоксазол-3-карбоновой кислоты; этиламида 5-(2,4-дигидрокси-5 изопропилфенил)-4-(толуол-4-сульфониламино)]изоксазол-3-карбоновой кислоты и этиламида 5-(2,4 дигидрокси-5-изопропилфенил)-4-[бис-(толуол-4-сульфониламино)]изоксазол-3-карбоновой кислоты. Предпочтительные соединения выбраны из группы, состоящей из этиламида 4-ацетиламино-5-(5 хлор-2,4-дигидроксифенил)изоксазол-3-карбоновой кислоты SST0072AA1; этиламида 5-(5-хлор-2,4 дигидроксифенил)-4-(4-метоксибензоиламино)изоксазол-3-карбоновой кислоты SST0081AA1; этиламида 5-(5-хлор-2,4-дигидроксифенил)-4-(3,4-диметоксибензоиламино)изоксазол-3-карбоновой кислотыSST0123AA1. Еще более предпочтительные соединения выбраны из группы, состоящей из этиламида 5(5-хлор-2,4-дигидроксифенил)-4-(2,2-диметилпропиониламино)изоксазол-3-карбоновой кислотыSST0113AA1, этиламида 5-(2,4-дигидрокси-5-изопропилфенил)-4-(2,2-диметилпропиониламино)изоксазол-3 карбоновой кислоты SST0114AA1 и этиламида 5-(2,4-дигидрокси-5-изопропилфенил)-4-[(3-метилтиофен-2 карбонил)амино]изоксазол-3-карбоновой кислоты SST0115AA1. Следующие иллюстративные примеры никоим образом не являются исчерпывающим списком того,что настоящее изобретение намеревается охранять. Примеры Сокращения. АС 2 О - уксусный ангидрид,AcOEt - этилацетат,BF3OEt2 - диэфират трехфтористого бора,Boc - трет-бутоксикарбонил,DCM - дихлорметан,DIPEA - диизопропилэтиламин,DMF - диметилформамид,МеОН - метанол,EtOH - этанол,Et2O - простой диэтиловый эфир,RP-HPLC (ОФ-ВЭЖХ) - высокоэффективная жидкостная хроматография с обращенной фазой,RT - комнатная температура,Rt - время удерживания,Tf - трифлат,TEA - триэтиламин,TFA - трифторуксусная кислота. Общие замечания. Течение реакций и смеси продуктов обычно контролировали с помощью тонкослойной хроматографии (ТСХ) на пластинках с силикагелем F254 Merck. Колоночную флэш-хроматографию осуществляли с применением силикагеля (230-400 меш Merck). Спектры ядерного магнитного резонанса (1 Н и 13 С ЯМР) снимали на спектрометре Bruker AC-200 или на спектрометре Varian Mercury Plus 300 или 400 и химические сдвиги выражали в миллионных долях (м.д.) относительно тетраметилсилана в качестве внутреннего стандарта. Константы взаимодействия даны в Гц. Масс-спектры получали с помощью массспектрометра ESI MICROMASS ZMD2000. Все операции по сушке проводили над безводным сульфатом натрия. Колоночную флэшхроматографию (среднего давления) осуществляли с применением силикагеля (230-400 меш Merck). Соединения по примеру 1 синтезировали согласно процедуре, описанной на схеме 1. Схема 1 Пример 1. Этиламид 4-ацетиламино-5-(5-хлор-2,4-дигидроксифенил)изоксазол-3-карбоновой кислоты SST0072AA1. Стадия i. 1-(5-Хлор-2,4-дигидроксифенил)этанон. К суспензии 4-хлорбензол-1,3-диола (20 г, 0,138 моль) в BF3OEt2 (100 мл) в атмосфере азота добавляли по каплям уксусную кислоту (17,5 мл). Реакционную смесь перемешивали при 90 С в течение 3,5 ч и затем давали ей возможность охладиться до комнатной температуры (RT), что вызывало выпадение твердого вещества. Смесь выливали в 10% (мас./об.) водный раствор ацетата натрия (350 мл). Затем полученную смесь энергично перемешивали в течение 2,5 ч, получая при этом светло-коричневое твердое вещество, которое отфильтровывали, промывали водой и сушили на воздухе в течение ночи, получая при этом указанное в заголовке соединение 1-(5-хлор-2,4-дигидроксифенил)этанон (11,3 г, 44%). 1H ЯМР (200 МГц, CDCl3) : 2,56 (с, 3 Н), 6,11 (с, 1 Н), 6,59 (с, 1 Н), 7,70 (с, 1 Н), 12,48 (с, 1 Н). Стадия ii. 1-[2,4-бис-(Бензилокси)-5-хлорфенил]этанон. К смеси 1-(5-хлор-2,4-дигидроксифенил)этанона (11 г, 0,059 моль) и карбоната калия (20,34 г, 0,147 моль) в ацетонитриле (180 мл) добавляли бензилбромид (17,5 мл, 0,147 моль). Смесь кипятили с обратным холодильником в течение 6 ч при перемешивании, затем давали ей возможность охладиться до комнатной температуры и перемешивали в течение ночи. Смесь фильтровали и твердый остаток промывалиDCM (350 мл). Объединенные органические фильтраты упаривали в вакууме, получая при этом бледножелтое твердое вещество. Последнее растирали в смеси гексан/EtOAc (175/7,5) и фильтровали, получая при этом указанное в заголовке соединение 1-[2,4-бис-(бензилокси)-5-хлорфенил]этанон (20,4 г, выход 93%) в виде не совсем белого твердого вещества. 1H ЯМР (200 МГц, CDCl3) : 2,54 (с, 3 Н), 5,07 (с, 2 Н), 5,15 (с, 2 Н), 6,55 (с, 1 Н), 7,36-7,42 (м, 10 Н),7,91 (с, 1 Н). Стадия iii. Этил-4-(2,4-бис-(бензилокси)-5-хлорфенил)-2-гидрокси-4-оксобут-2-еноат. Металлический натрий (1,35 г, 58 ммоль) разрезали на небольшие куски, промывали гексаном для удаления керосина и порциями добавляли к безводному EtOH (100 мл) в атмосфере азота в течение 20 мин. Реакционную смесь дополнительно перемешивали в течение 10 мин, пока не прореагировал весь натрий. В течение 5 мин порциями добавляли 1-[2,4-бис-(бензилокси)-5-хлорфенил]этанон (10 г, 27,3 ммоль) и затем дополнительно перемешивали полученную суспензию в течение 5 мин при комнатной температуре. Добавляли диэтилоксалат (6 мл, 43 ммоль), получая при этом обильный осадок, окрашенный в желтый цвет. Реакционную смесь нагревали при кипячении с обратным холодильником в течение 4 ч, получая при этом темный гомогенный раствор, который после охлаждения давал твердую массу, к которой добавляли уксусную кислоту (6 мл). Смесь растирали, получая при этом твердое желтое вещество, которое отфильтровывали, последовательно промывали водой, EtOH и Et2O и затем сушили в вакууме, получая при этом указанное в заголовке соединение этил-4-(2,4-бис-(бензилокси)-5-хлорфенил)-2 гидрокси-4-оксобут-2-еноат (12,4 г, 98%) в виде твердого вещества желтого цвета. 1H ЯМР (200 МГц, CDCl3) : 1,28 (т, J=7,4 Гц, 3 Н), 4,28 (кв, J=7,4 Гц, 2 Н), 5,11 (с, 2 Н), 5,18 (с, 2 Н),6,58 (с, 1 Н), 7,35-7,40 (м, 10 Н), 8,02 (с, 1 Н), 15,36 (ушир., 1 Н). Стадия iv. Этил-5-(2,4-бис-(бензилокси)-5-хлорфенил)изоксазол-3-карбоксилат. К суспензии 4-(2,4-бис-(бензилокси)-5-хлорфенил)-2-гидрокси-4-оксобут-2-еноата (5,0 г, 10,7 ммоль) в EtOH (100 мл) добавляли гидрохлорид гидроксиламина (0,89 г, 12,8 ммоль). Реакционную смесь кипятили с обратным холодильником в течение 3,5 ч и затем давали ей возможность охладиться до комнатной температуры. Полученную суспензию фильтровали, последовательно промывали EtOH (210 мл), водой (210 мл) и EtOH (210 мл) и сушили в вакууме, получая при этом указанное в заголовке соединение этил-5-(2,4-бис-(бензилокси)-5-хлорфенил)изоксазол-3-карбоксилат (3,97 г, 80%) в виде хлопьевидного светло-желтого твердого вещества. 1EtOH (50 мл) добавляли раствор этиламина в МеОН (2 М, 80 ммоль, 40 мл) и нагревали реакционную смесь до 80 С при перемешивании в течение 18 ч, получая при этом желтый гомогенный раствор, которому давали возможность охладиться до RT. После охлаждения до 4 С образовывалось бесцветное хлопьевидное твердое вещество. После фильтрования, промывания холодным EtOH и сушки в вакууме получали требуемое соединение. 1[М+Н]+ 463,4/464,8. Стадия vi. Этиламид 5-(2,4-бис-бензилокси-5-хлорфенил)-4-нитроизоксазол-3-карбоновой кислоты. Суспензию этиламида 5-(2,4-бис-бензилокси-5-хлорфенил)изоксазол-3-карбоновой кислоты (1 г, 2,2 ммоль) в Ас 2 О (20 мл) охлаждали до 0 С и при перемешивании по каплям добавляли HNO3 (0,26 мл, 4,3 ммоль), поддерживая температуру в диапазоне 0-5 С. После завершения добавления смесь перемешивали в течение 70 ч при 5-10 С и затем выливали в лед и экстрагировали DCM (340 мл). Экстракт сушили и концентрировали в вакууме. Полученное твердое вещество желтого цвета растирали в Et2O и фильтровали, получая при этом 5-[2,4-бис-(бензилокси)-5-хлорфенил]-N-этил-4-нитроизоксазол-3-карбоксамидH ЯМР (200 МГц, CDCl3) : 1,26 (т, J=7,4 Гц, 3 Н), 3,46-3,55 (м, 2 Н), 5,0 (с, 2 Н), 5,10 (с, 2 Н), 6,57 (м,2 Н), 7,23-7,29 (м, 2H), 7,32-7,37 (м, 8 Н), 7,66 (с, 1 Н). Стадия vii. Этиламид 4-амино-5-(2,4-бис-бензилокси-5-хлорфенил)изоксазол-3-карбоновой кислоты. К раствору NH4Cl (2,7 г, 50 ммоль) в воде (15 мл) добавляли раствор этиламида 5-(2,4-бисбензилокси-5-хлорфенил)-4-нитроизоксазол-3-карбоновой кислоты (1 г, 1,97 ммоль) в ТГФ (7 мл). Затем при 0 С при перемешивании в течение 15 мин порциями добавляли порошок цинка (цинковую пыль)(4 г, 61 ммоль). После 30 мин при 0 С смесь фильтровали и полученный на фильтре осадок промывали МеОН. Объединенный фильтрат упаривали в вакууме, получая при этом 5-[2,4-бис-(бензилокси)-5 хлорфенил]-4-амино-N-этилизоксазол-3-карбоксамид (820 мг, 82%). 1[М+Н]+ 478,3/479,4. Стадия viii. Этиламид 4-ацетиламино-5-(2,4-бис-бензилокси-5-хлорфенил)изоксазол-3-карбоновой кислоты. К раствору ацетилхлорида (1,45 ммоль) в DCM по каплям добавляли 5-[2,4-бис-(бензилокси)-5 хлорфенил]-4-амино-N-этилизоксазол-3-карбоксамид (1,45 ммоль, 700 мг) и TEA (1,74 ммоль, 0,24 мл). Смесь перемешивали в течение 5 ч, разбавляли DCM и промывали 1 н. раствором HCl. Органический экстракт сушили и фильтровали. Растворители удаляли в вакууме, получая при этом сырой (неочищенный) остаток, который очищали флэш-хроматографией на силикагеле. 1 Н ЯМР (200 МГц, CDCl3) : 1,28 (т, J=7,4 Гц, 3 Н), 1,81 (с, 3 Н), 3,43-3,52 (м, 2 Н), 4,99 (с, 2 Н), 5,14(с, 2 Н), 6,61 (с, 1 Н), 6,86 (ушир., 1 Н), 7,27-7,45 (м, 10 Н), 7,66 (с, 1 Н), 7,75 (с, 1 Н), 8,40 (с, 1 Н). Стадия ix. Этиламид 4-ацетиламино-5-(5-хлор-2,4-дигидроксифенил)изоксазол-3-карбоновой кислоты. Раствор этиламида 4-ацетиламино-5-(2,4-бис-бензилокси-5-хлорфенил)изоксазол-3-карбоновой кислоты (0,35 ммоль) в DCM (10 мл) в инертной атмосфере охлаждали до 0 С и по каплям добавляли BCl3 в DCM (1 M, 1,05 ммоль, 1,05 мл). Реакционную смесь перемешивали при 0 С в течение 20 мин, затем охлаждающую баню удаляли и перемешивали смесь в течение дополнительных 50 мин. Смесь снова охлаждали и затем гасили путем осторожного добавления насыщенного водного раствора NaHCO3 (20 мл).DCM удаляли в вакууме и добавляли воду (20 мл). Затем смесь экстрагировали EtOAc (200 мл). Фазы разделяли и органическую фазу промывали водой (230 мл), насыщенным водным раствором NaCl (50 мл), затем сушили и фильтровали. Растворитель удаляли в вакууме, сырой продукт очищали флэшхроматографией на силикагеле. 1[М+Н]+ 340,0/341,9. Соединения по примерам 2-14 синтезировали согласно процедурам, описанным на стадиях viii и ix примера 1 с применением хлорангидридного производного, подходящего для образования амида (т.е. стадия viii). Пример 2. Этиламид 5-(5-хлор-2,4-дигидроксифенил)-4-(4-метоксибензоиламино)изоксазол-3 карбоновой кислоты SST0081AA1. Стадия viii. Этиламид 5-(2,4-бис-бензилокси-5-хлорфенил)-4-(4-метоксибензоиламино)изоксазол-3 карбоновой кислоты. 1viii. Этиламид 5-(2,4-бис-бензилокси-5-хлорфенил)-4-(3-морфолин-4-илпропиониламино)изоксазол-3-карбоновой кислоты. Раствор этиламида 4-акрилоиламино-5-(2,4-бис-бензилокси-5-хлорфенил)изоксазол-3-карбоновой кислоты по примеру 7 (стадия viii) (170 мг, 0,32 ммоль) и морфолина (1 мл) в EtOH (5 мл) кипятили с обратным холодильником в течение 1 ч. Растворители удаляли при пониженном давлении, остаток подвергали хроматографии на силикагеле (элюент: AcOEt/MeOH:95/5). 1[М+Н]+ 480,1/482,2/483,5. Соединение по примеру 11 синтезировали согласно процедурам, описанным на схеме 1 (стадии viix) примера 1, исходя из этиламида 5-(2,4-бис-бензилокси-5-изопропилфенил)изоксазол-3-карбоновой кислоты вместо этиламида 5-(2,4-бис-бензилокси-5-хлорфенил)изоксазол-3-карбоновой кислоты и применяя подходящее производное хлорангидрида для образования амида (т.е. на стадии viii). Пример 11. Этиламид 5-(2,4-дигидрокси-5-изопропилфенил)-4-(4-метоксибензоиламино)изоксазол 3-карбоновой кислоты SST0107AA1. Стадия vi. Этиламид 5-(2,4-бис-бензилокси-5-изопропилфенил)-4-нитроизоксазол-3-карбоновой кислоты. 1 Н ЯМР (200 МГц, CDCl3) : 1,22-1,26 (м, 9 Н), 3,24-3,38 (м, 1 Н), 3,43-3,57 (м, 2 Н), 5,02 (с, 4 Н), 6,54[М+Н]+ 440,4. Соединения по примерам 12-21 синтезировали согласно процедуре, описанной в примере 11 (стадии viii-ix), исходя из одинакового промежуточного продукта: этиламида 4-амино-5-(2,4-бис-бензилокси 5-изопропилфенил)изоксазол-3-карбоновой кислоты и применяя на стадии viii соответствующий хлорангидрид. Пример 12. Этиламид 4-ацетиламино-5-(2,4-дигидрокси-5-изопропилфенил)изоксазол-3-карбоновой кислоты SST0113AA1. Стадия viii. Этиламид 4-ацетиламино-5-(2,4-бис-бензилокси-5-изопропилфенил)изоксазол-3 карбоновой кислоты. 1 Н ЯМР (200 МГц, CDCl3) : 1,22-1,29 (м, 9 Н), 1,77 (с, 3 Н), 3,28-3,36 (м, 1 Н), 3,40-3,50 (м, 2 Н), 5,03[М+Н]+ 484,2. Соединение по примеру 22 синтезировали согласно процедуре, описанной в примерах 11-21 (стадии[М+Н]+ 472,3. Соединения по примерам 23-26 синтезировали согласно процедуре, описанной в примере 12 (стадии viii-ix), применяя на стадии viii соответствующий хлорангидрид. Пример 23. Этиламид 5-(2,4-дигидрокси-5-изопропилфенил)-4-[(4-метоксициклогексанкарбонил)амино]изоксазол-3-карбоновой кислоты SST0226AA1. 1[М+Н]+ 445,2. Соединение по примеру 27 синтезировали согласно процедуре, описанной на схеме 2, с первой стадией, соответствующей условиям реакции, описанным для стадии ix схемы 1. Схема 2ii. 4-(4-Метоксибензиламино)-5-(5-хлор-2,4-дигидроксифенил)-N-этилизоксазол-3 карбоксамид. Раствор 4-амино-5-(5-хлор-2,4-дигидроксифенил)-N-этилизоксазол-3-карбоксамида (298 мг, 1 ммоль) и п-метоксибензальдегида (2 ммоль) в смеси ди-МеОН/АсОН (1%) (15 мл) кипятили с обратным холодильником в течение ночи. К охлажденной суспензии добавляли цианоборгидрид натрия (125 мг, 2 ммоль) и перемешивали смесь в течение 3 ч. Остаток обрабатывали 5%-ным водным раствором NaHCO3(10 мл) и экстрагировали AcOEt. Объединенные органические экстракты промывали насыщенным раствором соли, сушили и упаривали при пониженном давлении. Сырой продукт реакции очищали хроматографией (AcOEt/низкокипящий петролейный эфир). 1[М+Н]+ 418,3/420,2. Соединения по примерам 28-32 синтезировали из одинакового промежуточного продукта 4-амино 5-(5-хлор-2,4-дигидроксифенил)-N-этилизоксазол-3-карбоксамида согласно процедуре, описанной на схеме 2 (стадия ii), с применением соответствующего альдегидного или кетонного производного вместо метоксибензальдегида. Пример 28. 4-3-Метилтиофен-2-ил)метиламино)-5-(5-хлор-2,4-дигидроксифенил)-N-этилизоксазол-3-карбоксамид SST0206AA1. 1 Пример 32. 4-3-(Гидроксиметил)изоксазол-5-ил)метиламино)-5-(5-хлор-2,4-дигидроксифенил)-Nэтилизоксазол-3-карбоксамид SST0212AA1. К раствору метил-5-3-(этилкарбамоил)-5-(5-хлор-2,4-дигидроксифенил)изоксазол-4-иламино)метил)изоксазол-3-карбоксилата (0,34 ммоль, 150 мг) в EtOH 95% (5 мл) при 0 С порциями добавляли боргидрид натрия (2 экв.). Спустя 30 мин к смеси добавляли несколько капель 5%-ного раствора HCl и выпаривали растворитель в вакууме. Сырую реакционную смесь разбавляли Н 2 О (10 мл) и экстрагировалиAcOEt (210 мл). Объединенные органические фазы промывали насыщенным раствором соли, сушили и фильтровали. Растворитель удаляли в вакууме, а сырой продукт очищали флэш-хроматографией на силикагеле (AcOEt/низкокипящий петролейный эфир). 1[М+Н]+ 409,1/411,1. Соединение по примеру 33 синтезировали согласно процедуре, описанной на схеме 3. Схема 3 Пример 33. 4-(4-Метоксибензамидо)-5-(5-хлор-2,4-дигидроксифенил)-N-(2,2,2-трифторэтил)изоксазол-3-карбоксамид SST0204AA1. Стадия i. 5-[2,4-бис-(Бензилокси)-5-хлорфенил]изоксазол-3-карбоновая кислота. Смесь этил-5-(2,4-бис-(бензилокси)-5-хлорфенил)изоксазол-3-карбоксилата (200 мг, 0,43 ммоль),метанола (10 мл), воды (6-7 мл) и LiOH (16 мг, 0,65 ммоль) оставляли стоять при 50-60 С в течение 24 ч. Раствор концентрировали в вакууме для удаления метанола и оставшийся водный раствор экстрагировали Et2O для удаления остатков непрореагировавшего исходного материала. Водный раствор подкисляли 1 М раствором HCl и экстрагировали тремя порциями AcOEt. Объединенные органические экстракты промывали насыщенным водным раствором хлорида натрия и сушили над сульфатом натрия. Растворитель удаляли при пониженном давлении, получая при этом остаток, который подвергали хроматографии на силикагеле (DCM/метанол: 9/1). 1[М+Н]+ 436,2/438,4. Стадия ii. 5-[2,4-бис-(Бензилокси)-5-хлорфенил]-N-(2,2,2-трифторэтил)изоксазол-3-карбоксамид. К суспензии 3-(2,4-бис-(бензилокси)-5-хлорфенил)изоксазол-5-карбоновой кислоты (310 мг, 0,7 ммоль) в толуоле (5 мл) добавляли тионилхлорид (0,26 мл, 3,55 ммоль). Полученную смесь нагревали до 110 С в течение 5 ч и затем ей давали возможность вернуться к комнатной температуре (RT). После концентрирования в вакууме к раствору добавляли DCM (15 мл) с последующим добавлением гидрохлорида 2,2,2-трифторэтиламина (114 мг, 0,84 ммоль), TEA (0,22 мл, 1,6 ммоль). Смесь перемешивали при RT в течение ночи. Раствор разбавляли DCM (15 мл), промывали 1 н. раствором HCl (15 мл), водой (15 мл) и насыщенным раствором соли (15 мл), сушили над сульфатом натрия и упаривали в вакууме. Остаток подвергали хроматографии на силикагеле (элюент: Et2O/низкокипящий петролейный эфир). 1iii. 5-[2,4-бис-(Бензилокси)-5-хлорфенил]-N-(2,2,2-трифторэтил)-4-нитроизоксазол-3 карбоксамид. Данную стадию выполняли согласно процедуре, описанной для стадии vi на схеме 1. 1iv. 5-(2,4-бис-(Бензилокси)-5-хлорфенил)-4-амино-N-(2,2,2-трифторэтил)изоксазол-3 карбоксамид. Данную стадию выполняли согласно процедуре, описанной для стадии vii на схеме 1. 1v. 5-[2,4-бис-(Бензилокси)-5-хлорфенил]-4-(4-метоксибензамидо)-N-(2,2,2-трифторэтил)изоксазол-3-карбоксамид. Данную стадию выполняли согласно процедуре, описанной для стадии viii на схеме 1. 1vi. 4-(4-Метоксибензамидо)-5-(5-хлор-2,4-дигидроксифенил)-N-(2,2,2-трифторэтил)изоксазол-3-карбоксамид. Данную стадию выполняли согласно процедуре, описанной для стадии ix на схеме 1. 1[М+Н]+ 486,3/487,5/488,1. Соединение по примеру 34 синтезировали согласно процедуре, описанной в примере 33, исходя из одинакового промежуточного продукта 5-[2,4-бис-(бензилокси)-5-хлорфенил]изоксазол-3-карбоновой кислоты, с применением 3,3-дифторазетидина вместо 2,2,2-трифторэтила на стадии ii. Пример 34. 4-(4-Метоксибензамидо)-5-(5-хлор-2,4-дигидроксифенил)изоксазол-3-ил-(3,3 дифторазетидин-1-ил)метанон SST0205AA1. Стадия ii. 5-(2,4-бис-(Бензилокси)-5-хлорфенил)изоксазол-3-ил)(3,3-дифторазетидин-1-ил)метанон. 1[М+Н]+ 480,1/481,5/482,2. Соединение по примеру 35 синтезировали согласно процедуре, описанной в примере 1 (стадии v-ix) с применением на стадии v N-метилпиперазина вместо этиламина. Пример 35. 5-(5-Хлор-2,4-дигидроксифенил)-4-(4-метоксибензоиламино)изоксазол-3-ил-(4 метилпиперазин-1-ил)метанон SST0123AA1. Стадия v. [5-(2,4-бис-Бензилокси-5-хлорфенил)изоксазол-3-ил]-(4-метилпиперазин-1-ил)метанон. К суспензии этил-5-(2,4-бис-(бензилокси)-5-хлорфенил)изоксазол-3-карбоксилата (2,1 ммоль) вEtOH (5 мл) добавляли N-метилпиперазин (25,4 ммоль) и реакционную смесь нагревали 90 С при перемешивании в течение 18 ч. Реакционную смесь выливали в смесь воды (15 мл) и AcOEt (30 мл). После обычной экстракции органический слой промывали водой и насыщенным раствором соли, сушили надNa2SO4 и упаривали. Полученное твердое вещество очищали колоночной хроматографией (CHCl3/MeOH: 95/0,5) на силикагеле, получая при этом требуемое соединение (620 мг, 57%). 1[М+Н]+ 487,9/488,9. Препарат 1 синтезировали согласно процедуре, описанной в примере 1 (стадия ix), исходя из этиламида 5-(2,4-бис-бензилокси-5-хлорфенил)-4-нитроизоксазол-3-карбоновой кислоты. Препарат 1. Этиламид 4-нитро-5-(5-хлор-2,4-дигидроксифенил)изоксазол-3-карбоновой кислотыSST0068AA1. Данное соединение получали согласно процедуре, описанной для стадии ix в примере 1, исходя из этиламида 5-(2,4-бис-бензилокси-5-хлорфенил)-4-нитроизоксазол-3-карбоновой кислоты. 1SST0090AA1. Данное соединение получали согласно процедуре, описанной для стадии vii в примере 1, исходя из этиламида 4-нитро-5-(5-хлор-2,4-дигидроксифенил)изоксазол-3-карбоновой кислоты с последующим снятием стандартной бензильной защиты с применением условий реакции, описанных в примере 1 для стадии ix. 1[М+Н]+ 460,2/461,3. Биологические результаты Материалы и способы Анализ цитотоксичности. Чтобы оценить влияние соединений на выживаемость клеток, применяли тест с использованием сульфородамина В. Для испытания влияния соединений на рост клеток использовали клетки немелкоклеточной карциномы легких NCI-H460. Опухолевые клетки выращивали в среде RPMI 1640, содержащей 10% фетальной бычьей сыворотки (GIBCO). Опухолевые клетки высевали в 96-луночные планшеты для культур тканей приблизительно при 10% конфлюентности и давали возможность прикрепиться и восстановиться в течение по меньшей мере 24 ч. Затем в каждую лунку добавляли различные концентрации лекарственных средств, чтобы рассчитать значение их IC50 (концентрации, которая ингибирует 50% выживаемости клеток). Планшеты инкубировали при 37 С в течение 72 ч. В конце обработки планшеты промывали путем удаления супернатанта и 3-кратного добавления физиологического раствора, забуференного фосфатом (ФСБ). Добавляли 200 мкл ФСБ и 50 мкл холодной 80%-ной трихлоруксусной кислоты (ТСА). Планшеты инкубировали на льду в течение по меньшей мере 1 ч. ТСА удаляли, планшеты промывали 3 раза путем погружения в дистиллированную воду и сушили на бумаге и при 40 С в течение 5 мин. Затем добавляли 200 мкл 0,4%-ного раствора сульфородамина В в 1% уксусной кислоте. Планшеты инкубировали при комнатной температуре в течение 30 мин. Сульфородамин В удаляли, планшеты промывали путем 3-кратного погружения в 1%-ный раствор уксусной кислоты, затем сушили на бумаге и при 40 С в течение 5 мин. Затем добавляли 200 мкл 10 мМ трис-буфера и оставляли планшеты на 20 мин при перемешивании. Выживаемость клеток определяли на спектрофлуориметре Multiskan в виде оптической плотности при 540 нм. Количество убитых клеток рассчитывали как уменьшение связывания сульфородамина В в процентах по сравнению с контрольными культурами клеток. Значения IC50 рассчитывали с помощью программы "ALLFIT". Флуоресцентная поляризация (FP). Для получения 10 мМ стоковых растворов GM-BODIPY (PerkinElmer, CUSN60342000MG) предварительно растворяли в ДМСО и хранили перед применением при -20 С. Для образования 2,2 мкМ стоковых растворов Hsp90 (Stressgen, SPP-776) предварительно растворяли в буфере для анализа (HFB), содержащем 20 мМ HEPES (K) рН 7,3, 50 мМ KCl, 5 мМ MgCl2, 20 мМNa2MoO4 и 0,01% NP40 и хранили перед применением при -80C. Для получения стоковых растворов соединения предварительно растворяли в DMSO и хранили растворы при -20 С. В день эксперимента растворы соединений готовили путем серийных разведений вHFB. Перед каждым применением добавляли свежий бычий гамма-глобулин (0,1 мг/мл) и 2 мМ DTT. Флуоресцентную поляризацию (FP) измеряли в 96-луночных планшетах (96F) Opti-Plate (PerkinElmer, Zaventem, Belgium) с применением планшетного анализатора (многофункциональный планшетный анализатор Wallac Envision 2101, Perkin Elmer, Zaventem, Belgium). Чтобы оценить аффинность связывания молекул, к 125 нМ Hsp90 добавляли 50 мкл раствора GM-BODIPY (100) в присутствии 5 мкл испытуемых соединений при увеличивающихся концентрациях. Планшеты встряхивали на планшетном шейкере при 4 С в течение 4 ч и регистрировали значения FP в мР (единицах миллиполяризации). Значения IC50 рассчитывали в виде концентрации ингибитора, при которой замещается 50% метки; каждая точка данных являлась результатом усреднения по трем параллельным лункам и определялась графически с применением нелинейного анализа методом наименьших квадратов. Обработку кривых осуществляли с применением программного обеспечения Prism GraphPad (GraphPad software, Inc., San Diego, CA). Антипролиферативную активность новых ингибиторов Hsp90 оценивали на клетках немелкоклеточной карциномы легких NCI-H460 и на клетках линии А 431 эпителиальной карциномы человека. Обнаружено, что большинство молекул, для которых оценивали аффинность связывания на каталитическом участке Hsp90, являются эффективными с субмикромолярными значениями IC50 (см. таблицу). В соответствии с их высокой специфичностью в отношении каталитического АТФ-связывающего участка Hsp90 все соединения в результате обладали сильной антипролиферативной активностью. Значения IC50 в анализе связывания FP рассчитывали как ингибирующую концентрацию, при которой замещается 50% метки; каждая точка данных являлась результатом усреднения по трем параллельным лункам и определялась графически с применением нелинейного анализа методом наименьших квадратов. Обработку кривых осуществляли с применением программного обеспечения Prism GraphPad software program (GraphPad software, Inc., San Diego, CA). Антипролиферативные значения IC50 оценивали как концентрацию лекарственного средства, необходимую для 50%-ного уменьшения роста клеток по сравнению с необработанными контрольными образцами после 72-часового воздействия лекарственного средства. Опубликованные значения IC50SD рассчитывали с помощью программы ALLFIT. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение общей формулы I в которой X представляет собой атом галогена, С 1-6 алкил;Y и Z, одинаковые или разные, представляют собой атом галогена, R3, OR3;R3 представляет собой атом водорода или С 1-6 алкил;R7 представляет собой атом водорода или С 1-6 алкил;R4 представляет собой С 1-6 алкил, необязательно замещенный одним алкокси или амино; С 2-6 алкенил, арил, необязательно замещенный одним или несколькими алкокси, атомами галогена или гетероциклоалкилалкилами; С 3-10 циклоалкил, необязательно замещенный одним или несколькими С 1-6 алкилами, галогеналкилами, алкокси, амино или аминоалкилами; норборнил, адамантил, гетероарил,необязательно замещенный одним или несколькими С 1-6 алкилами, алкиламинокарбонилами;(С 4-7)гетероциклоалкил, необязательно замещенный одним или несколькими С 1-6 алкилами; или гетероциклоалкилалкил, необязательно замещенный одним или несколькими С 1-6 алкилами;R5 и R6 независимо представляют собой атом водорода, С 1-6 алкил, С 2-6 алкенил, (С 3-10)циклоалкил,(С 4-7)гетероциклоалкил, необязательно замещенный одним или несколькими С 1-6 алкилами; аралкил, необязательно замещенный алкокси; гетероаралкил, необязательно замещенный одним или несколькими С 1-6 алкилами, гидроксиалкилами, алкоксикарбонилами;R8 и R9, одинаковые или разные, выбраны из Н, C1-6 алкила, необязательно замещенного атомом галогена; галогеналкила; или R8 и R9, взятые вместе с атомом азота, к которому они присоединены, образуют гетероцикл, который может содержать один или два дополнительных гетероатома, выбранных из О,S или N, и который необязательно может быть замещен одним или двумя алкилами или атомами галогена,его таутомеры, геометрические изомеры, оптически активные формы, такие как энантиомеры, диастереомеры и их рацематные формы, а также их фармацевтически приемлемые соли. 2. Соединение по п.1, в котором R1 представляет собой NHC(=D)R4. 3. Соединение по пп.1 и 2, в котором X представляет собой атом галогена или С 1-6 алкил. 4. Соединение по п.1, выбранное из группы, состоящей из этиламида 4-ацетиламино-5-(5-хлор-2,4-дигидроксифенил)изоксазол-3-карбоновой кислотыSST0208AA1; 4-(1-метилпиперидин-4-иламино)-5-(5-хлор-2,4-дигидроксифенил)-N-этилизоксазол-3-карбоксамида SST0209AA1; метил-5-3-(этилкарбамоил)-5-(5-хлор-2,4-дигидроксифенил)изоксазол-4-иламино)метил)изоксазол-3-карбоксилата SST0210AA1; 4-3-(гидроксиметил)изоксазол-5-ил)метиламино)-5-(5-хлор-2,4-дигидроксифенил)-N-этилизоксазол-3-карбоксамида SST0212AA1; 4-(4-метоксибензамидо)-5-(5-хлор-2,4-дигидроксифенил)-N-(2,2,2-трифторэтил)изоксазол-3 карбоксамида SST0204AA1; 4-(4-метоксибензамидо)-5-(5-хлор-2,4-дигидроксифенил)изоксазол-3-ил-(3,3-дифторазетидин-1 ил)метанона SST0205AA1 и 5-(5-хлор-2,4-дигидроксифенил)-4-(4-метоксибензоиламино)изоксазол-3-ил-(4-метилпиперазин-1 ил)метанона SST0123AA1. 5. Применение соединения по любому из пп.1-4 для получения лекарственного средства. 6. Применение по п.5 для получения лекарственного средства для лечения патологического состояния, при котором модуляция активности Hsp90 приведет к улучшению самочувствия пациента. 7. Применение по п.6, где патологическое состояние представляет собой нейродегенеративное заболевание, воспалительное заболевание, злокачественную опухоль, аутоиммунное заболевание, ишемию головного мозга или паразитемию, включая малярию. 8. Применение по п.7, где нейродегенеративное заболевание представляет собой болезнь Паркинсона, болезнь Гентингтона, болезнь Альцгеймера, деменцию с тельцами Леви, амиотрофический боковой склероз, спинальную и бульбарную мышечную атрофию или спинально-церебеллярную атаксию и злокачественная опухоль представляет собой злокачественную опухоль молочных желез, поджелудочной железы, легкого, плевры, брюшной полости, лица и шеи, мочевого пузыря, головного мозга, предстательной железы, яичников, глаз или метастатическую злокачественную опухоль. 9. Фармацевтическая композиция для лечения злокачественной опухоли, неврологического заболевания, воспалительного заболевания, аутоиммунного заболевания, ишемии головного мозга или паразитемии, содержащая по меньшей мере одно соединение по пп.1-4 в качестве активного ингредиента вместе с фармацевтически приемлемым инертным наполнителем. 10. Способ получения фармацевтической композиции по п.9, включающий смешивание по меньшей мере одного соединения по пп.1-4 с фармацевтически приемлемой солью и/или фармацевтически приемлемым носителем. 11. Способ лечения пациента, пораженного злокачественной опухолью, включающий введение эффективного количества соединения по пп.1-4. 12. Соединение формулы VII в которой X, Y, Z и R2 имеют указанные выше значения, в качестве промежуточного продукта при синтезе соединений по п.1. 13. Способ получения соединений формулы VII в которой X, Y, Z и R2 имеют указанные выше значения, включающий стадию взаимодействия соединений формулы VI в которой X, Y, Z и R2 имеют указанные выше значения, с HNO3/AC2O. 14. Соединение формулы II в которой X, Y, Z и R2 имеют указанные выше значения, в качестве промежуточного продукта при получении соединений по п.1. 15. Способ получения соединений формулы II в которой X, Y, Z и R2 имеют указанные выше значения, включающий стадию взаимодействия соединений формулы VII, описанной выше, с Zn/NH4Cl в смеси ТГФ/Н 2 О. 16. Способ получения соединений по п.1, где R1 представляет собой NHC(=D)R4, D и R4 имеют указанные выше значения, включающий стадию взаимодействия соединений формулы II в которой X, Y, Z и R2 имеют указанные выше значения, с хлорангидридом карбоновой кислоты формулы ClCOR4 и затем с реагентом Лоуссона в том случае, когда D представляет собой S. 17. Способ получения соединений по п.1, в которых R1 представляет собой NR5R6; R5 и R6 представляют собой С 1-6 алкил, С 2-6 алкенил, С 3-10 циклоалкил, бензил, аралкил, гетероарилкил или С 4-7 гетероциклоалкил или один из R5 и R6 представляет собой Н, включающий стадию взаимодействия соединений формулы II, в которой X, Y, Z и R2 имеют указанные выше значения, с одним или несколькими эквивалентами соединения формулы R-CHO или (R')(R')C=O (в значении кетона), где фрагментыR-C и R' имеют значение R5 или R6, указанное выше, в полярном растворителе в присутствии кислоты и восстановителя. 18. Способ по п.17, где полярный растворитель представляет собой МеОН, кислота представляет собой АсОН и восстановитель представляет собой NaCNBH4.
МПК / Метки
МПК: A61K 31/5025, A61P 23/00, A61P 25/00, C07D 261/18, C07D 413/12, A61K 31/422, A61P 35/00, C07D 498/04, A61K 31/42
Метки: hsp90, модулирующие, противоопухолевыми, 5-фенилизоксазол-3-карбоксамиды, активностями
Код ссылки
<a href="https://eas.patents.su/26-19793-5-fenilizoksazol-3-karboksamidy-s-protivoopuholevymi-aktivnostyami-moduliruyushhie-hsp90.html" rel="bookmark" title="База патентов Евразийского Союза">5-фенилизоксазол-3-карбоксамиды с противоопухолевыми активностями, модулирующие hsp90</a>
Предыдущий патент: Способ подачи шихты в доменную печь
Следующий патент: Комплекс для доставки млекопитающему минерала
Случайный патент: Мутанты интерлейкина-18, их продуцирование и применение












