Производные карбаматов алкилтиазолов, их получение и их применение в терапии
Номер патента: 18995
Опубликовано: 30.12.2013
Авторы: Абуабделла Ахмед, Герлитцер Йохен, Хэмли Питер, Раве Антуан
Формула / Реферат
1. Соединение общей формулы (I)

в которой R2 обозначает атом водорода;
n обозначает целое число, равное 1 или 2;
m обозначает целое число, равное 2;
A обозначает ковалентную связь или C1-8алкилен;
R1 обозначает группу R5, возможно замещенную одной или несколькими группами R6 и/или R7;
R5 обозначает группу, выбранную из пиридинила и хинолинила;
R6 обозначает атом галогена, циано, -CH2CN, нитро, гидроксильную группу, C1-6алкил, C1-6алкокси, C1-6галоалкил, C1-6галоалкокси, C3-7циклоалкил, С3-7циклоалкил-C1-3алкилен, С3-7циклоалкил-С1-3алкилен-O, NR8R9, NR8COR9, NR8CO2R9, NR8SO2R9, CONR8R9, SO2R8 или SO2NR8R9;
R7 обозначает группу, выбранную из тиенила, изоксазолила, пиразолила, фенила, пиридинила, пиримидинила, нафталенила, хинолинила, изохинолинила, причем одна или несколько групп R7 могут быть замещены одной или несколькими группами R6, одинаковыми или разными;
R3 обозначает атом водорода, фтора, C1-6алкильную группу или трифторметильную группу;
R4 обозначает тиазол, возможно замещенный одним или несколькими заместителями, выбранными из атома галогена, C1-6алкила, C1-6галоалкила, CONR8R9 или пиридинила;
R8 и R9 обозначают независимо друг от друга атом водорода или C1-6алкил или образуют с одним или несколькими атомами, с которыми они связаны, в случае NR8R9 цикл, выбранный из пирролидинового, пиперидинового или морфолинового циклов,
в форме основания или соли присоединения с кислотой, причем следующие соединения исключены:
2-(3-{[2-(4-хлорфенил)-4-метилтиазол-5-ил]метоксикарбониламино}пиперидин-1-ил)бензоат метила;
2-(3-{[2-(4-хлорфенил)-4-метилтиазол-5-ил]метоксикарбониламино}пиперидин-1-ил)бензойная кислота;
3-(3-{[2-(4-хлорфенил)-4-метилтиазол-5-ил]метоксикарбониламино}пиперидин-1-ил)бензоат метила;
3-(3-{[2-(4-хлорфенил)-4-метилтиазол-5-ил]метоксикарбониламино}пиперидин-1-ил)бензойная кислота.
2. Соединение формулы (I) по п.1, отличающееся тем, что A обозначает C1-8алкилен, в форме основания или соли присоединения с кислотой.
3. Соединение формулы (I) по п.1 или 2, отличающееся тем, что
R1 обозначает группу R5, возможно замещенную одной или несколькими группами R6 и/или R7;
R5 обозначает пиридинил или хинолинил;
R6 обозначает атом галогена, циано, -CH2CN, C1-6алкил, C1-6алкокси, C1-6галоалкил, С3-7циклоалкил, C3-7циклоалкил-С1-3алкилен-О-, NR8R9, NR8COR9, NR8CO2R9, NR8SO2R9, CONR8R9, SO2R8 или SO2NR8R9;
R7 обозначает группу, выбранную из тиенила, изоксазолила, пиразолила, фенила, пиридинила, пиримидинила, нафталенила, хинолинила, изохинолинила, причем одна или несколько групп R7 могут быть замещены одной или несколькими группами R6, одинаковыми или разными;
R8 и R9 обозначают независимо друг от друга атом водорода или C1-6алкил или образуют с одним или несколькими атомами, с которыми они связаны, цикл, выбранный из пирролидинового, пиперидинового, морфолинового циклов,
в форме основания или соли присоединения с кислотой.
4. Соединение формулы (I) по любому из пп.1-3, отличающееся тем, что R3 обозначает атом водорода,
C1-6алкил или трифторметил, в форме основания или соли присоединения с кислотой.
5. Способ получения соединения формулы (I) по любому из пп.1-4, включающий стадию, заключающуюся в том, что вводят во взаимодействие амин общей формулы (II)
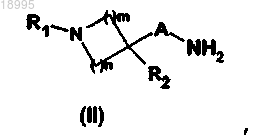
в которой A, R1, R2, m и n такие, как определены в общей формуле (I) по п.1,
и карбонат общей формулы (III)
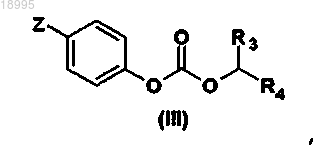
в которой Z обозначает атом водорода или нитрогруппу;
R3 и R4 такие, как определены в общей формуле (I) по п.1,
в присутствии основания в растворителе при температуре от комнатной температуры до температуры кипения растворителя.
6. Способ получения соединения формулы (I) по любому из пп.1-4, включающий стадию, заключающуюся в том, что вводят во взаимодействие амин общей формулы (II)
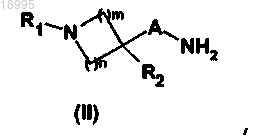
в которой A, R1, R2, m и n такие, как определены в общей формуле (I) по п.1,
с фенилхлорформиатом или 4-нитрофенилом, в присутствии основания в растворителе при температуре от 0°C до комнатной температуры, для получения производного карбамата общей формулы (IV)
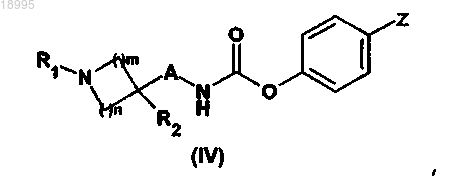
в которой A, R1, R2, m и n такие, как определены в общей формуле (I) по п.1; и
Z обозначает атом водорода или нитрогруппу,
затем превращают полученный таким образом карбамат общей формулы (IV) в соединение общей формулы (I) действием спирта общей формулы
которой R3 и R4 такие, как определены в общей формуле (I) по п.1,
в присутствии основания в растворителе при температуре от комнатной температуры до температуры кипения растворителя.
7. Применение соединения формулы (I) по любому из пп.1-4 в виде основания или соли присоединения с фармацевтически приемлемой кислотой в качестве лекарственного средства, предназначенного для предупреждения или лечения острых или хронических болей, головокружения, тошноты, рвоты, нарушений пищевого поведения, неврологических и психиатрических патологий, нейродегенеративных заболеваний, острых или хронических, эпилепсии, нарушений сна, сердечно-сосудистых заболеваний, почечной ишемии, рака, нарушений иммунной системы, аллергических заболеваний, инфекционных заболеваний, вызванных паразитами, вирусами или бактериями, воспалительных заболеваний, остеопороза, глазных болезней, легочных заболеваний, заболеваний желудочно-кишечного тракта или недержания мочи.
8. Фармацевтическая композиция, содержащая по меньшей мере одно соединение формулы (I) по любому из пп.1-4 в форме основания или соли присоединения с фармацевтически приемлемой кислотой и, возможно, один или несколько фармацевтически приемлемых эксципиентов, предназначенная для предупреждения или лечения острых или хронических болей, головокружения, тошноты, рвоты, нарушений пищевого поведения, неврологических и психиатрических патологий, нейродегенеративных заболеваний, острых или хронических, эпилепсии, нарушений сна, сердечносо-судистых заболеваний, почечной ишемии, рака, нарушений иммунной системы, аллергических заболеваний, инфекционных заболеваний, вызванных паразитами, вирусами или бактериями, воспалительных заболеваний, остеопороза, глазных болезней, легочных заболеваний, заболеваний желудочно-кишечного тракта или недержания мочи.
9. Применение соединения формулы (I) по любому из пп.1-4 в форме основания или соли присоединения с фармацевтически приемлемой кислотой для получения лекарственного средства, предназначенного для предупреждения или лечения патологии, в которой участвуют эндогенные каннабиноиды и/или любые другие субстраты, метаболизируемые ферментом FAAH.
10. Применение соединения формулы (I) по любому из пп.1-4 в форме основания или соли присоединения с фармацевтически приемлемой кислотой для получения лекарственного средства, предназначенного для предупреждения или лечения острых или хронических болей, головокружения, тошноты, рвоты, нарушений пищевого поведения, неврологических и психиатрических патологий, нейродегенеративных заболеваний, острых или хронических, эпилепсии, нарушений сна, сердечно-сосудистых заболеваний, почечной ишемии, рака, нарушений иммунной системы, аллергических заболеваний, инфекционных заболеваний, вызванных паразитами, вирусами или бактериями, воспалительных заболеваний, остеопороза, глазных болезней, легочных заболеваний, заболеваний желудочно-кишечного тракта или недержания мочи.
Текст
Соединение общей формулы (I) в которой R2 обозначает атом водорода; n обозначает целое число, равное 1 или 2; m обозначает целое число, равное 2; A обозначает ковалентную связь или C1-8 алкилен; R1 обозначает группу R5, возможно замещенную одной или несколькими группами R6 и/или R7; R5 обозначает группу, выбранную из пиридинила и хинолинила; R6 обозначает атом галогена, циано,-CH2CN, нитро, гидроксильную группу, C1-6 алкил, C1-6 алкокси, С 1-6 галоалкил, C1-6 галоалкокси,C3-7 циклоалкил, С 3-7 циклоалкил-C1-3 алкилен, С 3-7 циклоалкил-C1-3 алкилен-О, NR8R9, NR8COR9,NR8CO2R9, NR8SO2R9, CONR8R9, SO2R8 или SO2NR8R9; R7 обозначает группу, выбранную из тиенила, изоксазолила, пиразолила, фенила, пиридинила, пиримидинила, нафталенила,хинолинила, изохинолинила, причем одна или несколько групп R7 могут быть замещены одной или несколькими группами R6, одинаковыми или разными; R3 обозначает атом водорода,фтора, C1-6 алкильную группу или трифторметильную группу; R4 обозначает тиазол, возможно замещенный одним или несколькими заместителями, выбранными из атома галогена, C1-6 алкила,C1-6 галоалкила, CONR8R9 или пиридинила; в виде основания или соли присоединения с кислотой. Применение в терапии. Объектом изобретения являются производные карбаматов алкилтиазолов, их получение и их применение в терапии. В настоящее время все еще существует потребность в открытии и разработке продуктов, являющихся ингибиторами фермента FAAH. Соединения по изобретению отвечают этой цели. Соединения по изобретению соответствуют общей формуле (I)A обозначает ковалентную связь или C1-8 алкилен;R1 обозначает группу R5, возможно замещенную одной или несколькими группами R6 и/или R7;R5 обозначает группу, выбранную из пиридинила и хинолинила;R7 обозначает группу, выбранную из тиенила, изоксазолила, пиразолила, фенила, пиридинила, пиримидинила, нафталенила, хинолинила, изохинолинила, причем одна или несколько групп R7 могут быть замещены одной или несколькими группами R6, одинаковыми или разными;R3 обозначает атом водорода, фтора, C1-6 алкильную группу или трифторметильную группу;R4 обозначает тиазол, возможно замещенный одним или несколькими заместителями, выбранными из атома галогена, C1-6 алкила, C1-6 галоалкила, CONR8R9 или пиридинила;R8 и R9 обозначают независимо друг от друга атом водорода или C1-6 алкил,или образуют с одним или несколькими атомами, с которыми они связаны, в случае NR8R9 цикл, выбранный из пирролидинового, пиперидинового или морфолинового циклов. Следующие соединения, описанные в документе ЕР 1780210, исключены из общей формулы (I): 2-(3-[2-(4-хлорфенил)-4-метилтиазол-5-ил]метоксикарбониламинопиперидин-1-ил)бензоат метила; 2-(3-[2-(4-хлорфенил)-4-метилтиазол-5-ил]метоксикарбониламинопиперидин-1-ил)бензойная кислота; 3-(3-[2-(4-хлорфенил)-4-метилтиазол-5-ил]метоксикарбониламинопиперидин-1-ил)бензоат метила; 3-(3-[2-(4-хлорфенил)-4-метилтиазол-5-ил]метоксикарбониламинопиперидин-1-ил)бензойная кислота. Из соединений общей формулы (I) первая подгруппа соединений состоит из соединений, в которыхA обозначает C1-8 алкилен, более конкретно метилен или этилен. Из соединений общей формулы (I) вторая подгруппа соединений состоит из соединений, в которыхR3 обозначает атом водорода, C1-6 алкил, более конкретно метил, или трифторметил. Из соединений общей формулы (I) третья подгруппа соединений состоит из соединений, в которыхR4 обозначает тиазол, возможно замещенный одним или несколькими заместителями, выбранными из атома галогена, более конкретно хлора, C1-6 алкила, более конкретно метила, C1-6 галоалкила, более конкретно трифторметила, пиридинила, CONR8R9; R8 и R9 обозначают независимо друг от друга атом водорода или C1-6 алкил, более конкретно метил. Из соединений общей формулы (I) четвертая подгруппа соединений состоит из соединений общей формулы (I), в которой одновременно R1, и/или R2, и/или R3, и/или R4, и/или n, и/или m, и/или A такие,как определены в указанных выше группах. Из соединений общей формулы (I) можно назвать следующие соединения (номенклатура IUPAC,программное обеспечение AutoNom): 1) 6'-[тиофен-3-ил-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил-4-ил]метилкарбамат тиазол-4 илметила; 2) 2-[6'-тиофен-3-ил-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил-4-ил]этилкарбамат тиазол-4 илметила; 3) 6'-[(4-метилтиофен-3-ил)-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил-4-ил]метилкарбамат тиазол-4 илметила; 4) 2-[6'-(4-метилтиофен-3-ил)-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил-4-ил]этилкарбамат тиазол-4 илметила; 5) 2-[6'-(5-цианотиофен-2-ил)-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил-4-ил]этилкарбамат тиазол-4-1 018995(6'-хинолин-6-ил-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил-4-ил)метилкарбамат тиазол-4 илметила; 126) [2-(6'-хинолин-6-ил-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил-4-ил)]этилкарбамат тиазол-4 илметила; 127) (6'-изохинолин-4-ил-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил-4-ил)метилкарбамат тиазол-4 илметила; 128) [2-(6'-изохинолин-4-ил-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил-4-ил)]этилкарбамат тиазол-4 илметила; 129) (6'-изохинолин-5-ил-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил-4-ил)метилкарбамат тиазол-4 илметила; 130) (6'-изохинолин-5-ил-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил-4-ил)этилкарбамат тиазол-4 илметила; 131) 2-[5'-(4-фторфенил)-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил-4-ил]этилкарбамат 2-карбамоилтиазол-4-илметила; 132) 2-[5'-(4-фторфенил)-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил-4-ил]этилкарбамат 2-метилкарбамоилтиазол-4-илметила; 133) 2-[5'-(4-фторфенил)-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил-4-ил]этилкарбамат 4-карбамоилтиазол-2-илметила; 134) 2-[5'-(4-фторфенил)-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил-4-ил]этилкарбамат 4-метилкарбамоилтиазол-2-илметила в форме основания или соли присоединения с кислотой. Соединения общей формулы (I) могут содержать один или несколько асимметрических атомов углерода. Они могут быть в форме энантиомеров или диастереоизомеров. Соединения общей формулы (I) могут также быть в форме стереоизомеров цис (Z) или транс (Е). Эти стереоизомеры, энантиомеры и диастереоизомеры, а также их смеси, включая рацемические смеси, относятся к изобретению. Соединения общей формулы (I) могут быть в форме оснований или солей присоединения с кислотами. Такие соли присоединения также относятся к изобретению. Эти соли преимущественно получают с использованием фармацевтически приемлемых кислот, но соли других кислот, пригодных, например, для очистки или выделения соединений формулы (I), также относятся к изобретению. В рамках изобретения: под Ct-z, где t и z могут обозначать величины от 1 до 8, понимают углеродную цепочку, которая может содержать от t и z атомов углерода, например углеродную цепочку C1-3, которая может содержать от 1 до 3 атомов углерода; под алкилом понимают алифатическую группу, насыщенную, линейную или разветвленную; например, C1-6 алкил обозначает углеродную цепочку, содержащую от 1 до 6 атомов углерода, линейную или разветвленную, более конкретно метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, пентил, гексил; под алкиленом понимают двухвалентную алкильную группу, насыщенную, линейную или разветвленную; например, C1-3 алкилен обозначает двухвалентную углеродную цепочку, содержащую от 1 до 3 атомов углерода, линейную или разветвленную, более конкретно метилен, этилен, 1-метилэтилен, пропилен; под циклоалкилом понимают циклическую алкильную группу, например С 3-7 циклоалкил представляет собой циклическую углеродную группу, содержащую от 3 до 7 атомов углерода, более конкретно циклопропил, циклобутил, циклопентил, циклогексил, циклогептил; под алкокси понимают группу -О-алкильную с алифатической цепочкой, насыщенной, линейной или разветвленной; под тиоалкилом понимают -S-алкильную группу с алифатической цепочкой, насыщенной, линейной или разветвленной; под галоалкилом понимают алкильную группу, один или несколько атомов водорода которой замещены атомом галогена; под галоалкокси понимают алкоксигруппу, один или несколько атомов водорода которой замещены атомом галогена; под галотиоалкилом понимают тиоалкильную группу, один или несколько атомов водорода которой замещены атомом галогена; под атомом галогена понимают фтор, хлор, бром или йод;"(+/-)" обозначает соединение в виде рацемической смеси. Соединения по изобретению можно получить разными способами, которые иллюстрируют нижеследующие схемы. Так, первый способ (схема 1) заключается в том, чтобы ввести во взаимодействие амин общей формулы (II), в которой А, R1, R2, m и n такие, как определены в общей формуле (I), определение которой дано выше, и карбонат общей формулы (III), в которой Z обозначает атом водорода или нитрогруппу, R3 и R4 такие, как определены в общей формуле (I), определение которой дано выше, в присутствии основания, такого как триэтиламин, пиридин, N,N-диметиламинопиридин или диизопропилэтиламин, в растворителе, таком как толуол или дихлорэтан, при температуре от комнатной температуры до температуры кипения с обратным холодильником растворителя. Вариант получения соединений общей формулы (I) (схема 1) заключается во введении во взаимодействие амина общей формулы (II), такого как определен выше, и фенилхлорформиат или 4 нитрофенил в присутствии основания, такого как триэтиламин или диизопропилэтиламин в растворителе, таком как дихлорметан или тетрагидрофуран, при температуре от 0C до комнатной температуры до получения производного карбамата общей формулы (IV), в которой A, R1, R2, m и n такие, как определены в общей формуле (I), определение которой дано выше, и Z обозначает атом водорода или нитрогруппу. Полученное таким образом производное карбамата общей формулы (IV) затем превращают в соединение общей формулы (I) действием спирта общей формулы HOCHR3R4 (IIIa), в которой R3 и R4 такие,как определены в общей формуле (I), определение которой дано выше, в присутствии основания, такого как триэтиламин, пиридин, N,N-диметиламинопиридин или диизопропилэтиламин, в растворителе, таком как толуол или дихлорэтан, при температуре от комнатной температуры до температуры кипения с обратным холодильником растворителя. Второй способ (схема 2) заключается в том, чтобы ввести во взаимодействие на первой стадии амин общей формулы (IIa), в которой A, R2, m и n такие, как определены в общей формуле (I), определение которой дано выше, и PG обозначает защитную группу, такую как Boc (трет-бутилоксикарбонил), Cbz(бензилоксикарбонил), бензил или бензгидрил, и карбонат общей формулы (III), такой как определена выше, в условиях, описанных выше в отношении взаимодействия амина общей формулы (II) с карбонатом общей формулы (III), с последующей реакцией снятия защиты, например, в присутствии раствора соляной кислоты (5N) в изопропаноле или диоксане, для получения промежуточного продукта общей формулы (Ia), в которой A, R2, R3, R4, m и n такие, как определены в общей формуле (I). Вариант получения промежуточных продуктов общей формулы (Ia) (схема 2) заключается в приведении во взаимодействие амина общей формулы (II), такого как определен выше, и фенилхлорформиата или 4-нитрофенила в присутствии основания, такого как триэтиламин или диизопропилэтиламин в растворителе, таком как дихлорметан или тетрагидрофуран, при температуре от 0C до комнатной температуры до получения производного карбамата общей формулы (IVa), в которой А, R2, m и n такие, как определены в общей формуле (I), определение которой дано выше, PG такая, как определена выше, и Z обозначает атом водорода или нитрогруппу. Полученное таким образом производное карбамата общей формулы (IVa) затем превращают в соединение общей формул (Ia) действием спирта общей формулыHOCHR3R4 (IIIa) такой, как определена выше, в присутствии основания, такого как триэтиламин, пиридин, N,N-диметиламинопиридин или диизопропилэтиламин, в растворителе, таком как толуол или дихлорэтан, при температуре от комнатной температуры до температуры кипения с обратным холодильником растворителя, с последующей реакцией снятия защиты, например, в присутствии раствора соляной кислоты (5N) в изопропаноле или диоксане. Затем соединение общей формулы (I) получают взаимодействием соединения общей формулы (Ia) и производного общей формулы (V), в которой R1 такой, как определен в общей формуле (I), и U1 обозначает атом галогена или группу O-трифталатную с использованием условий проведения реакций нуклеофильного ароматического или гетероароматического замещения, например, при помощи основания, такого как триэтиламин, диизопропилэтиламин, пиридин или N,N-диметиламинопиридин в растворителе,таком как дихлорметан, дихлорэтан, ацетонитрил, N,N-диметилформамид, диоксан или тетрагидрофуран при температуре от комнатной температуры до температуры кипения с обратным холодильником растворителя. Это превращение можно также осуществлять в условиях N-арилирования илиN-гетероарилирования Buchwald, например, при помощи катализатора, содержащего палладий или медь. В соответствии со схемой 2 соединения общей формулы (I), в которой R1 обозначает группу R5, замещенную, в частности, группой R6 типа C1-6 алкила, C3-7 циклоалкила или C3-7 циклоалкил-C1-3 алкилена,или группой R7, такой как определена в общей формуле (I), определение которой дано выше, можно также получить реакцией сочетания, катализируемой переходным металлом, например палладием(0), проводимой между соединением общей формулы (Ib), в которой A, R2, R3, R4, R5, m и n такие, как определены в общей формуле (I), и U2 обозначает атом хлора, брома или йода или трифталатную группу, при этомU2 находится в положении, в которое намерены ввести группу R6 или R7 (схема 2): или реакцией типа Suzuki, например, с использованием алкилбороновой кислоты, циклоалкила,арила или гетероарила,или реакцией типа Stille, например, с использованием триалкилстаннатного производного арила или гетероарила,или реакцией типа Ngishi, например, с использованием цинкатного производного галогенида алкила, циклоалкила, арила или гетероарила. Промежуточный продукт общей формулы (Ib), такой как определена выше, предварительно получают взаимодействием амина общей формулы (Ia), такой как определена выше, и производного общей формулы (Va), в которой R5, U1 и U2 такие, как определены выше, с использованием реакций нуклеофильного замещения, ароматического или гетероароматического, или N-арилирования, илиN-гетероарилирования Buchwald, например, при помощи катализатора, содержащего палладий или медь. Вариант получения промежуточных продуктов общей формулы (Ib) (схема 2) заключается в приведении во взаимодействие на первой стадии амина общей формулы (IIb), в которой A, R5, R2, m и n такие,как определены в общей формуле (I), которая определена выше, и U2 такой, как определен выше, и карбоната общей формулы (III), такой как определена выше, в условиях, описанных выше в отношении взаимодействия амина общей формулы (II) с карбонатом общей формулы (III) для получения промежуточного продукта общей формулы (Ib), в которой A, R5, R2, R3, R4, m и n такие, как определены в общей формуле (I), и U2 такой, как определен выше. Схема 2 Соединения общих формул (II), (IIa), (IIb), (III), (IIIa), (V) и (Va), а также другие реагенты являются коммерчески доступными, или описаны в литературе или могут быть получены способами, которые описаны в литературе или являются известными специалисту. В частности, карбонат общей формулы (III) можно получить любым способом, описанным в литературе, например взаимодействием спирта общей формулы HOCHR3R4 (IIIa), в которой R3 и R4 такие, как определены в общей формуле (I), такой как описана выше, с фенилхлорформиатом или 4-нитрофенилом в присутствии основания, такого триэтиламин, N-метилморфолин или диизопропилэтиламин в растворителе, таком как дихлорметан или тетрагидрофуран, при температуре от 0C до комнатной температуры. Нижеследующие примеры иллюстрируют получение нескольких соединений по изобретению. Эти примеры не ограничивают изобретение, а только иллюстрируют его. Микроанализы, спектры ИК и ЯМР и/или ЖХ-МС (жидкостная хроматография в сочетании с масс-спектрометрией) подтверждают структуры и чистоту полученных продуктов.PF (C) обозначает точку плавления в градусах Цельсия. Номера, указанные в скобках в названиях примеров, соответствуют номерам в 1 колонке нижеследующей таблицы. Номенклатура UICPA (Международный Совет чистой и прикладной химии - английское сокращение IUPAC) использовалась для наименования соединений в нижеследующих примерах. Пример 1. 2-[5'-(4-Фторфенил)-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил-4-ил]этилкарбамат тиазол 4-илметила (соединение 30). 1.1. 2-(5'-Бром-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил-4-ил)этанол. В автоклав вводят 11 г (46,43 ммоль) 2,5-дибромпиридина, 6 г (46,43 ммоль) пиперидин-4 илэтанола и 6,74 г (48,76 ммоль) карбоната калия в 8 мл DMSO. Затем нагревают до 160C в течение 20 ч. Охлаждают до комнатной температуры, затем обрабатывают реакционную смесь этилацетатом и водой. Отделяют водную фазу, экстрагируют ее дважды этилацетатом, объединенные органические фазы промывают насыщенным водным раствором натрия хлорида, сушат их над сульфатом магния и концентрируют фильтрат при пониженном давлении. Таким образом, получают 11 г продукта в виде масла, который используют как таковой на следующей стадии. 1.2. 2-[5'-(4-Фторфенил)-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил-4-ил]этанол. В инертной атмосфере вводят 3,6 г (12,63 ммоль) 2-(5'-бром-3,4,5,6-тетрагидро-2 Н[1,2']бипиридинил-4-ил)этанола, полученного на стадии 1.1, 3,53 г (25,25 ммоль) 4-фторфенилбороновой кислоты, 5,23 г (37,87 ммоль) карбоната калия и 4,88 г (15,15 ммоль) тетрабутиламмония бромида, суспендированного в 20 мл воды. Затем добавляют 0,142 г (0,63 ммоль) Pd(OAc)2. Затем реакционную смесь нагревают с обратным холодильником в течение 24 ч. Оставляют охлаждаться до комнатной температуры, соли отделяют фильтрованием через целит, затем фильтрат обрабатывают этилацетатом, отделяют водную фазу, экстрагируют ее дважды этилацетатом, объединенные органические фазы промывают насыщенным водным раствором натрия хлорида и сушат их над сульфатом магния. После выпаривания растворителя полученный остаток очищают хроматографией на силикагеле,элюируя смесью 50/50 этилацетата и циклогексана. Таким образом получают 1,6 г продукта в виде белого порошка.PF (C)=118-120C. 1.3. 22-[5'-(4-Фторфенил)-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил-4-ил]этилизоиндол-1,3-дион. В раствор 2 г (6,66 ммоль) 2-[5'-(4-фторфенил)-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил-4 ил]этанола, полученный на стадии 1.2, 2,096 г (7,99 ммоль) трифенилфосфина и 1,077 г (7,32 ммоль) фталамида в 40 мл тетрагидрофурана, охлажденный примерно до -2C, вводят по каплям в инертной атмосфере раствор 1,61 г (7,99 ммоль) диизопропилазодикарбоксилата (DIAD) в 4 мл тетрагидрофурана, поддерживая температуру реакционной среды от -2 до 0C. Перемешивание продолжают при 0C в течение 1 ч, затем при комнатной температуре в течение 12 ч. Концентрируют при пониженном давлении, остаток обрабатывают дихлорметаном и водой. Отделяют водную фазу, затем экстрагируют ее дважды дихлорметаном. Объединяют органические фазы и промывают их последовательно водным раствором соляной кислоты (1 н.), затем насыщенным водным раствором гидрогенокарбоната натрия и насыщенным водным раствором натрия хлорида. Органическую фазу сушат над сульфатом натрия и концентрируют фильтрат при пониженном давлении. Полученный таким образом остаток очищают хроматографией на силикагеле, элюируя смесью 20/80 этилацетата и циклогексана. Таким образом получают 2,1 г целевого продукта в виде белого порошка.PF (C)=180-182C. 1.4. 2-[5'-(4-Фторфенил)-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил-4-ил]этиламин. В раствор 1,3 г (3,03 ммоль) 22-[5'-(4-фторфенил)-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил-4 ил]этилизоиндол-1,3-диона, полученного на стадии 1.3, в 30 мл этанола медленно вводят при комнатной температуре 0,485 г (15,13 ммоль) гидразинмоногидрата. Затем реакционную смесь нагревают с обратным холодильником в течение 3 ч. Оставляют для охлаждения до комнатной температуры, отделяют не растворившееся вещество фильтрованием и концентрируют фильтрат при пониженном давлении. Остаток обрабатывают 20 мл простого эфира и перемешивают при комнатной температуре в течение 1 ч. Повторно отделяют не растворившееся вещество и концентрируют фильтрат при пониженном давлении. Таким образом получают 0,70 г целевого продукта в виде белого порошка.PF (C)=88-94C. 1 Н ЯМР (CDCl3)(м.д): 8,3 (д, 1H); 7,55 (дд, 1H); 7,35 (м, 2H); 7,05 (д, 1H); 7,1 (д, 1H); 6,65 (д, 1H); 4,25 (уш. д, 2H); 3,0-2,8 (м, 4H); 1,8 (м, 2H); 1,6-1,1 (м, 5H). 1.5. 2-[5'-(4-Фторфенил)-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил-4-ил]этилкарбамат тиазол-4 илметила. Нагревают до 70C в течение 12 ч раствор 0,3 г (1,07 ммоль) 2-[5'-(4-фторфенил)-3,4,5,6-тетрагидро 2 Н-[1,2']бипиридинил-4-ил]этиламина, полученного на стадии 1.4, 0,35 г (1,18 ммоль)N,N-диизопропилэтиламина в 5 мл 1,2-дихлорэтана. Оставляют для охлаждения до комнатной температуры, отделяют не растворившееся вещество фильтрованием и концентрируют фильтрат при пониженном давлении. Остаток обрабатывают дихлорметаном и водой, отделяют водную фазу, экстрагируют три раза дихлорметаном, промывают объединенные органические фазы насыщенным водным раствором натрия хлорида и сушат над сульфатом натрия. После выпаривания растворителя полученный остаток очищают хроматографией на силикагеле, элюируя смесью 95/5 дихлорметана и метанола. Таким образом получают 0,3 г чистого продукта в виде белого порошка. ЖХ-МС: М+Н=441.(1,07 ммоль) 2-[5'-(4-фторфенил)-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил-4-ил]этиламина, описанного в примере 1 (стадия 1.3), 0,35 г (1,18 ммоль) (4-нитрофенил)карбоната тиазол-2-илметила (ЕР 486948 А 2) и после хроматографии на силикагеле, элюируя смесью 98/2 дихлорметана и метанола, получают 0,25 г чистого продукта в виде белого порошка. ЖХ-МС: М+Н=441.(0,53 ммоль) 2-[5'-(4-фторфенил)-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил-4-ил]этиламина, описанного в примере 1 (стадия 1.3), 0,22 г (0,8 ммоль) (4-нитрофенил)карбоната тиазол-5-илметила и после хроматографии на силикагеле, элюируя смесью 40/60 этилацетата и циклогексана, получают 0,180 г чистого продукта в виде белого порошка. ЖХ-МС: М+Н=441. 4.1. 2-[6'-(4-Фторфенил)-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил-4-ил]этанол. В инертной атмосфере вводят 3,6 г (12,63 ммоль) 2-(6'-бром-3,4,5,6-тетрагидро-2 Н[1,2']бипиридинил-4-ил)этанола (WO 2004/099176), 3,53 г (25,25 ммоль) 4-фторфенилбороновой кислоты,5,23 г (37,87 ммоль) карбоната калия и 4,88 г (15,15 ммоль) тетрабутиламмония бромида, суспендированного в 20 мл воды. Затем добавляют 0,142 г (0,63 ммоль) Pd(OAc)2. Затем реакционную смесь нагревают с обратным холодильником в течение 24 ч. Оставляют для охлаждения до комнатной температуры, соли отделяют фильтрованием через целит,затем фильтрат обрабатывают этилацетатом, отделяют водную фазу, экстрагируют ее дважды этилацетатом, объединенные органические фазы промывают насыщенным водным раствором натрия хлорида и сушат их над сульфатом натрия. После выпаривания растворителя полученный остаток очищают хроматографией на силикагеле,элюируя смесью 99/1 дихлорметана и метанола. Так получают 3,6 г продукта в виде белого порошка.(6,66 ммоль) 2-[6'-(4-фторфенил)-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил-4-ил]этанола, полученного на стадии 4.1, 2,096 г (7,99 ммоль) трифенилфосфина, 1,077 г (7,32 ммоль) фталимида, 1,61 г (7,99 ммоль) диизопропилазодикарбоксилата (DIAD) и после хроматографии на силикагеле, элюируя смесью 15/85 этилацетата и циклогексана, получают 1,4 г чистого продукта в виде белого порошка.(3,03 ммоль) 2-2-[6'-(4-фторфенил)-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил-4-ил]этилизоиндол-1,3 диона, полученного на стадии 4.2, и 0,485 г (15,13 ммоль) гидразинмоногидрата получают 0,8 г продукта в виде бесцветной жидкости, которую используют как таковую на следующей стадии. 1H ЯМР (CDCl3)(м.д): 8,2 (д, 1H); 8,15 (д, 1H); 7,75 (дд, 1H); 7,35 (уш. т, 2H); 7,2 (д, 1H); 6,75 (д,1H); 4,75 (уш. д, 2H); 3,2-3,0 (м, 4H); 2,15 (м, 2H); 1,8-1,3 (м, 5H). 4.4. 2-[6'-(4-Фторфенил)-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил-4-ил]этилкарбамат 4 нитрофенила. В раствор 5 г (16,7 ммоль) 2-[6'-(4-фторфенил)-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил-4 ил]этиламина, полученного на стадии 4.3, 4,32 г (33,40 ммоль) N,N-диизопропилэтиламина и 0,10 г(0,84 ммоль) N,N-диметиламинопиридина в 80 мл дихлорметана, охлажденный примерно до 0C, вводят маленькими порциями 3,7 г (18,37 ммоль) хлорформиата 4-нитрофенила. Перемешивание продолжают при 0C в течение 1 ч, затем при комнатной температуре в течение 2 ч. В реакционную среду вводят воду, отделяют водную фазу, экстрагируют несколько раз дихлорметаном, промывают объединенные органические фазы насыщенным водным раствором натрия хлорида,сушат их над сульфатом натрия и концентрируют фильтрат при пониженном давлении. После хроматографии на силикагеле, элюируя смесью 98/2 дихлорметана и метанола, получают 4,6 г продукта в виде белого порошка.PF (C)=138-142C. 4.5. 2,2,2-Трифтор-1-тиазол-2-илэтанол. В раствор 2 г (17,68 ммоль) тиазол-2-карбоксальдегида, 0,88 мл (0,88 ммоль) раствора 1 М фторида тетрабутиламмония в THF, в 88 мл THF, медленно вводят примерно при 0C (ледяная баня) 2,7 г(19,44 ммоль) трифторметилтриметилсилана (TMS-CF3). Перемешивание продолжают при комнатной температуре в течение 2 ч. Вводят в реакционную среду 25 мл водного раствора соляной кислоты 1 н. и этилацетата. Водную фазу отделяют, экстрагируют дважды этилацетатом, последовательно промывают объединенные органические фазы насыщенным водным раствором бикарбоната натрия, затем насыщенным водным раствором натрия хлорида и сушат их над сульфатом натрия. После выпаривания растворителя полученный осадок очищают хроматографией на силикагеле, элюируя смесью 98/2 дихлорметана и метанола. Получают 2,33 г продукта в виде твердого вещества бежевого цвета.PF (C)=90-92C. 4.6. (+/-)-2-[6'-(4-Фторфенил)-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил-4-ил]этилкарбамат 2,2,2 трифтор-1-тиазол-2-илэтила. Нагревают до 80C в течение 12 ч раствор 0,465 г (1 ммоль) 2-[6'-(4-фторфенил)-3,4,5,6-тетрагидро 2 Н-[1,2']бипиридинил-4-ил]этилкарбамата 4-нитрофенила, полученного на стадии 4.4, 0,19 г (1,5 ммоль)N,N-диизопропилэтиламина, 0,006 г (0,05 ммоль) N,N-диметиламинопиридина и 0,20 г (1,1 ммоль) 2,2,2 трифтор-1-тиазол-2-илэтанола, полученного на стадии 4.5, в 5 мл 1,2-дихлорэтана. Оставляют для охлаждения до комнатной температуры, отделяют не растворившееся твердое вещество фильтрованием и концентрируют фильтрат при пониженном давлении. Остаток обрабатывают дихлорметаном и водой, отделяют водную фазу, экстрагируют два раза дихлорметаном, последовательно промывают объединенные органические фазы насыщенным 1 н. водным раствором гидроксида натрия,затем насыщенным водным раствором натрия хлорида и сушат их над сульфатом натрия. После выпаривания растворителя полученный остаток очищают хроматографией на силикагеле, элюируя смесью 98/2 дихлорметана и метанола. Таким образом получают 0,23 г продукта в виде белого порошка. ЖХ-МС: М+Н=509.(8,84 ммоль) тиазол-4-карбоксальдегида, 0,10 мл (0,10 ммоль) 1 М раствора тетрабутиламмония фторида в THF, 1,38 г (9,72 ммоль) трифторметилтриметилсилана (TMS-CF3) и после хроматографии на силика- 11018995(+/-)-2-[6'-(4-Фторфенил)-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил-4-ил]этилкарбамат 2,2,2-трифтор-1-тиазол-4-илэтила. Выполняют операции в соответствии с протоколом, описанным в примере 4 (стадия 4.6). Из 0,183 г (1 ммоль) 2-[6'-(4-фторфенил)-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил-4-ил]этилкарбамата 4-нитрофенила, описанного в примере 4 (стадия 4.4), 0,19 г (1,5 ммоль) N,N-диизопропилэтиламина,0,006 г (0,05 ммоль) N,N-диметиламинопиридина, 0,51 г (1,1 ммоль) 2,2,2-трифтор-1-тиазол-4-илэтанола,полученного на стадии 5.1, и после хроматографии на силикагеле, элюируя смесью 40/60 этилацетата и циклогексана с последующей кристаллизацией в смеси простого диэтилового эфира и гексана, получают 0,240 г чистого продукта в виде белого порошка. ЖХ-МС: М+Н=509. 6.1. 2,2,2-Трифтор-1-тиазол-5-илэтанол. Действуют методом, описанным в примере 4 (стадия 4.5). Из 2 г (17,68 ммоль) тиазол-5 карбоксальдегида, 0,88 мл (0,88 ммоль) 1 М раствора фторида тетрабутиламмония в THF, 2,765 г (19,44 ммоль) трифторметилтриметилсилана (TMS-CF3) и после хроматографии на силикагеле, элюируя смесью 98/2 дихлорметана и метанола, получают 2,23 г чистого продукта в виде бесцветного масла. 6.2. (+/-)-2-[6'-(4-Фторфенил)-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил-4-ил]этилкарбамат 2,2,2 трифтор-1-тиазол-5-илэтила. Выполняют действия в соответствии с протоколом, описанным в примере 4 (стадия 4.6). Из 0,464 г (1 ммоль) 2-[6'-(4-фторфенил)-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил-4-ил]этилкарбамата 4-нитрофенила, описанного в примере 4 (стадия 4.4), 0,19 г (1,5 ммоль) N,N-диизопропилэтиламина,0,006 г (0,05 ммоль) N,N-диметиламинопиридина, 0,201 г (1,1 ммоль) 2,2,2-трифтор-1-тиазол-5 илэтанола, полученного на стадии 6.1, и после хроматографии на силикагеле, элюируя смесью 98/2 дихлорметана и метанола, получают 2,240 г чистого продукта в виде смолы. ЖХ-МС: М+Н=509. 1 7.1. Метансульфонат 2-[1-(6-хлорхинолин-2-ил)пиперидин-4-ил]этила. В раствор 4 г (13,76 ммоль) 2-[1-(6-хлорхинолин-2-ил)пиперидин-4-ил]этанола (WO 2004/099176),3,55 г (27,51 ммоль) диизопропилэтиламина и 0,84 г (6,88 ммоль) N,N-диметиламинопиридина в 30 мл дихлорметана, охлажденного примерно до 0C, вводят по каплям в инертной атмосфере раствор 2,36 г(20,63 ммоль) мезилхлорида в 3 мл дихлорметана. Продолжают перемешивать при 0C в течение 2 ч,затем при комнатной температуре в течение 1 ч. В реакционную среду добавляют воду, отделяют водную фазу, несколько раз экстрагируют дихлорметаном, промывают объединенные органические фазы насыщенным водным раствором натрия хлорида, сушат их над сульфатом натрия и концентрируют фильтрат при пониженном давлении. Таким образом получают 5,1 г продукта в виде масла, который используют как таковой на следующей стадии. 7.2. 2-[4-(2-Азидоэтил)пиперидин-1-ил]-6-хлорхинолин. Нагревают с обратным холодильником в течение 4 ч в инертной атмосфере раствор 5 г(13,55 ммоль) метансульфоната 2-[1-(6-хлорхинолин-2-ил)пиперидин-4-ил]этила, полученного на стадии 7.1, и 1,76 г (27,11 ммоль) азотида натрия в 30 мл N,N-диметилформамида. Оставляют для охлаждения до комнатной температуры, затем концентрируют при пониженном давлении. Остаток обрабатывают дихлорметаном и водой, отделяют водную фазу, экстрагируют два раза дихлорметаном, промывают объединенные органические фазы насыщенным водным раствором натрия хлорида и сушат их над сульфатом натрия. После выпаривания растворителя получают 3,8 г продукта в виде масла, которое используют как таковое на следующей стадии. 7.3. 2-[1-(6-Хлорхинолин-2-ил)пиперидин-4-ил]этиламин. В раствор 3,5 г (11,08 ммоль) 2-[4-(2-азидоэтил)пиперидин-1-ил]-6-хлорхинолина, полученного на стадии 7.2, в 100 мл THF/вода (1/1) вводят малыми порциями при комнатной температуре 4,36 г(16,62 ммоль) трифенилфосфина. Продолжают перемешивать при комнатной температуре в течение 10 ч. Концентрируют при пониженном давлении. Вводят этилацетат, отделяют водную фазу, экстрагируют три раза этилацетатом, промывают объединенные органические фазы насыщенным водным раствором натрия хлорида, сушат их над сульфатом натрия и концентрируют фильтрат при пониженном давлении. После хроматографии на силикагеле, элюируя смесью 90/10/1 дихлорметана, метанола и аммиака 28%, получают 1,77 г чистого продукта в виде масла, которое кристаллизуется при комнатной температуре.H ЯМР (CDCl3)(м.д): 7,7 (д, 1H); 7,5 (м, 2H); 7,35 (м, 1H); 6,95 (д, 1H); 4,45 (уш. д, 2H); 2,9 (уш. тд, 2H); 2,7 (т, 2H); 1,7 (м, 2H); 1,6-1,1 (м, 5H). 7.4. 2-[1-(6-Хлорхинолин-2-ил)пиперидин-4-ил]этилкарбамат 4-нитрофенила. Выполняют действия, описанные в примере 4 (стадия 4.4). Из 5 г (17,25 ммоль) 2-[1-(6 хлорхинолин-2-ил)пиперидин-4-ил]этиламина, полученного на стадии 7.3, 3,825 г (18,98 ммоль) хлорформиата 4-нитрофенила, 4,46 (34,51 ммоль) N,N-диизопропилэтиламина, 0,105 г (0,86 ммоль)N,N-диметиламинопиридина и после растирания в смеси простого диизопропилового эфира и гексана получают 7,8 г чистого продукта в виде белого порошка.(+/-)-2-[1-(6-Хлорхинолин-2-ил)пиперидин-4-ил]этилкарбамат 2,2,2-трифтор-1-тиазол-2 илэтила. Выполняют действия в соответствии с протоколом, описанным в примере 4 (стадия 4.6). Из 0,455 г (1 ммоль) 2-[1-(6-хлорхинолин-2-ил)пиперидин-4-ил]этилкарбамата 4-нитрофенила, полученного на стадии 7.4, 0,19 г (1,5 ммоль) N,N-диизопропилэтиламина, 0,006 г (0,05 ммоль)N,N-диметиламинопиридина, 0,201 г (1,1 ммоль) 2,2,2-трифтор-1-тиазол-2-илэтанола, описанного в примере 5 (стадия 5.5), и после хроматографии на силикагеле, элюируя смесью 98/2 дихлорметана и метанола с последующей кристаллизацией в смеси простого диэтилового эфира и гексана, получают 0,3 г чистого продукта в виде белого порошка. ЖХ-МС: М+Н=499. 8.1. 2-[5'-Бром-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил-4-ил]этилкарбамат трет-бутила. В автоклав вводят 10,37 г (43,80 ммоль) 2,5-дибромпиридина, 10 г (43,80 ммоль) 2-пиперидин-4 илэтилкарбамата трет-бутила и 6,05 г (43,8 ммоль) карбоната калия. Затем нагревают до 130C в течение 12 ч. Оставляют для охлаждения до комнатной температуры, затем реакционную смесь обрабатывают хлороформом и насыщенным водным раствором гидрогенокарбоната натрия. Водную фазу отделяют,экстрагируют два раза хлороформом, промывают объединенные органические фазы насыщенным водным раствором натрия хлорида, сушат их над сульфатом натрия и концентрируют фильтрат при пониженном давлении. После хроматографии на силикагеле, элюируя смесью 95/5 дихлорметана и метанола, получают 6,9 г чистого продукта в виде белого порошка.PF (C): 108-110C. 8.2. 2-[5'-Бром-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил-4-ил]этиламин. В раствор 6,9 г (17,95 ммоль) 2-(5'-бром-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил-4 ил)этилкарбамата трет-бутила, полученный на стадии 8.1, в 100 мл дихлорметана, охлажденный на водя- 13018995 ной бане со льдом, медленно вводят 20,47 г (179,54 ммоль) трифторуксусной кислоты. Продолжают перемешивать при комнатной температуре в течение 2 ч. Реакционную смесь опрокидывают в смесь ледяной воды с 28% аммиака. Отстаивают, экстрагируют два раза водную фазу дихлорметаном. Промывают объединенные органические фазы насыщенным водным раствором натрия хлорида, сушат их над сульфатом натрия и концентрируют при пониженном давлении. Получают 4,9 г продукта в виде масла, который используют как таковой на следующей стадии. 8.3. 2-(5'-Бром-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил-4-ил)этилкарбамат тиазол-2-илметила. Выполняют действия в соответствии с порядком работ, описанным в примере 1 (стадия 1.4). Из 4,3 г (15,13 ммоль) 2-[5'-бром-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил-4-ил]этиламина, полученного на стадии 8.2, 4,66 г (16,64 ммоль) (4-нитрофенил)карбоната тиазол-2-илметила (ЕР 486948 А 2), 2,93 г(22,70 ммоль) N,N-диизопропилэтиламина, 0,09 г (0,76 ммоль) N,N-диметиламинопиридина, и после хроматографии на силикагеле, элюируя смесью 20/80 этилацетата и циклогексана, получают 2,6 г чистого продукта в виде белого порошка. 8.4. 2-[5'-(4-Этоксифенил)-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил-4-ил]этилкарбамат тиазол-2 илметила. В инертной атмосфере вводят 0,425 г (1 ммоль) 2-(5'-бром-3,4,5,6-тетрагидро-2 Н[1,2']бипиридинил-4-ил)этилкарбамата тиазол-2-илметила, полученного на стадии 8.3, 0,2 г (1,2 ммоль) 4-этоксифенилбороновой кислоты, 0,977 г (3 ммоль) карбоната цезия, суспендированного в 5 мл смеси 9/1 тетрагидрофурана и воды. Затем вводят 0,082 г (0,1 ммоль) PdCl2dppfCH2Cl2. Затем нагревают примерно до 75C в течение 2 ч. Оставляют для охлаждения до комнатной температуры, отделяют соли фильтрованием через целит,затем обрабатывают фильтрат этилацетатом и водой, отделяют водную фазу, экстрагируют дважды этилацетатом, промывают объединенные органические фазы насыщенным водным раствором натрия хлорида и сушат их над сульфатом натрия. После выпаривания растворителя полученный остаток очищают хроматографией на силикагеле, элюируя смесью 98/2 дихлорметана и метанола. Полученное твердое вещество затем перекристаллизовывают в изопропаноле. Получают 0,39 г продукта в форме белого порошка. ЖХ-МС: М+Н=467.N,N-диметиламинопиридина получают 8,6 г продукта в виде масла, используемого как таковое на следующей стадии. 9.2. 4-[2-(Тиазол-5-илметоксикарбониламино)этил]пиперидин-1-карбоксилат трет-бутила. Выполняют действия в соответствии с порядком работ, описанным в примере 4 (стадия 4.6). Из 8,6 г (21,86 ммоль) 4-[2-(4-нитрофеноксикарбониламино)этил]пиперидин-1-карбоксилата трет-бутила,полученного на стадии 9.1, 2,77 г (24,04 ммоль) тиазол-2-илметанола, 5,65 г (43,72 ммоль)N,N-диизопропилэтиламина и 0,134 г (1,09 ммоль) N,N-диметиламинопиридина получают 3,6 г продукта в виде масла, используемого как таковое на следующей стадии. 9.3. Гидрохлорид 2-пиперидин-4-илэтилкарбамата тиазол-5-илметила. В раствор 3,6 г (9,74 ммоль) 4-[2-(тиазол-5-илметоксикарбониламино)этил]пиперидин-1 карбоксилата трет-бутила, полученного на стадии 9.2, в 97 мл простого диэтилового эфира, охлажденного на водяной бане со льдом, вводят медленно 40 мл (160 ммоль) раствора соляной кислоты 4N в диоксане. Продолжают перемешивать при комнатной температуре в течение 12 ч. После выпаривания при пониженном давлении получают 2,4 г продукта в виде гидрохлорида, который используют как таковой на следующей стадии. 9.4. 2-[1-(6-Фторхинолин-2-ил)пиперидин-4-ил]этилкарбамат тиазол-5-илметила. В запаянную пробирку вводят 0,09 г (0,39 ммоль) 2-бром-6-фторхинолина, 0,1 г (0,33 ммоль) гидрохлорида 2-пиперидин-4-илэтилкарбамата тиазол-5-илметила, полученного на стадии 9.3, и 0,2 мл(1,14 ммоль) N,N-диизопропилэтиламина. Затем нагревают до 100C в течение 12 ч. Оставляют для охлаждения до комнатной температуры, затем обрабатывают реакционную смесь дихлорметаном и насыщенным водным раствором хлорида аммония. Водную фазу отделяют, экстрагируют два раза дихлорметаном, промывают объединенные органические фазы насыщенным водным раствором натрия хлорида, сушат над сульфатом натрия и концентрируют фильтрат при пониженном давлении. После хроматографии на силикагеле, элюируя смесью 95/5 дихлорметана и метанола, получают 0,039 г чистого продукта в виде белого порошка. ЖХ-МС: М+Н=415.(м, 2H). В таблице иллюстрируются химические структуры и физические свойства нескольких соединений по изобретению. На этой таблице: в колонке "основание или соль" "основание" означает соединение в виде свободного основания,"CF3COOH" означает соединение в виде трифторацетата, "HCl" означает соединение в виде гидрохлорида; в колонке "А" "1" обозначает -CH2-, "2" обозначает -СН 2-СН 2-; все соединения, содержащие асимметричный углерод, находятся в форме рацемической смеси. Методы ЖХ-МС (М+Н). Ацетонитрил + 0,5% трифторуксусная кислота/H2O + 0,05% трифторуксусная кислота. Колонки: Waters Xbridge C18 4 или YMC Jsphere 332. Расход: 1 мл/мин. Соединения по изобретению подвергались фармакологическим испытаниям, позволяющим определить их ингибирующее действие в отношении фермента FAAH (Fatty Acid Amido Hydrolase). Ингибирующая активность была выявлена в радиоферментативном тесте, основанном на измерении продукта гидролиза анандамида [этаноламин 1-3 Н] при помощи FAAH (Life Sciences (1995), 56, 19992005 и Journal of Biochemical and Biophysical Methods (2004), 60(2), 171-177). Изымали мозг мыши (за исключением мозжечка) и консервировали при -80C. Мембранные гомогенаты готовили перед самым употреблением гомогенизацией тканей при помощи устройства Precellys в реакционном буферном растворе (Tris-HCl 10 мМ рН 8, NaCl 150 мМ и этилендиаминтетрауксусная кислота (EDTA) 1 мМ). Ферментативную реакцию проводили в фильтрационных 96-луночных планшетах Multiscreen с конечным объемом 70 мкл. Реакционный буфер с добавлением бычьего сывороточного альбумина без жирных кислот (BSA, 1 мг/мл) использовали для ферментативной реакции, разведения соединений и анандамида(43 мкл/лунка), тестируемые соединения, разведенные в разных концентрациях (7 мкл/лунка, содержащая 1% DMSO), и мембранный препарат (10 мкл/лунка, т.е. 200 мкг ткани на одно опытное испытание). Через 20 мин предварительной инкубации соединений с ферментом при 25C реакция запускалась при помощи введения анандамида [этаноламин 1-3 Н] (специфическая активность 15-20 Ci/ммоль), разведенного холодным анандамидом (10 мкл/лунка, конечная концентрация 10 мкл, 0,01 мк Ci на одно опытное испытание). Через 20 мин инкубации соединений при 25C ферментативную реакцию останавливают путем введения раствора активированного угля 5 М, полученного в буфере NaCl 1,5 М и HCl 0,5 М[1-3 Н], извлекают фильтрованием в вакууме и подсчитывают методом жидкостной сцинтилляции. В этих условиях самые активные соединения по изобретению имеют CI50 (концентрация, ингибирующая на 50% контрольную ферментативную активность FAAH) от 0,001 до 1 мкМ, например, соединения 28 и 30 имеют CI50 соответственно 0,003 и 0,007 мкМ. Таким образом, выявлено, что соединения по изобретению обладают ингибирующей активностью в отношении FAAH. Активность in vivo соединений по изобретению оценивали в тесте на анальгезию. Так, интраперитонеальное введение (i.p) PBQ (фенилбензохинон, 2 мг/кг в 0,9% растворе хлорида натрия, содержащем 5% этанола) самцам мыши OF1 от 25 до 30 г вызывает абдоминальные растягивания, в среднем 30 перекрутов или сокращений в течение периода от 5 до 15 мин после инъекции. Тестируемые соединения, суспендированные в Tween 80 в концентрации 0,5%, вводят пероральным (р.о) или интраперитонеальным путем (i.p) за 60 или 120 мин до введения PBQ. В этих условиях наиболее сильнодействующие соединения по изобретению уменьшают на 35-80% число растягиваний, индуцированныхPBQ, в диапазоне доз от 1 до 30 мг/кг. Например, соединения 28 и 30 из таблицы уменьшают соответственно на 33 и на 80% число растягиваний, индуцированных PBQ, при введении дозы 30 мг/кг р.о. за 120 мин. Фермент FAAH (Chemystry and Physics of Lipids (2000), 108, 107-121) катализирует гидролиз эндогенных производных амидов или сложных эфиров разных жирных кислот, таких какN-арахидоноилэтаноламин (анандамид), N-пальмитоилэтаноламин, N-олеоилэтаноламин, олеамид или 2-арахидоноилглицерин. Эти производные имеют разную фармакологическую активность, взаимодействуя среди прочих с рецепторами каннабиноидов и ваниллоидов. Соединения по изобретению блокируют этот путь деградации и повышают тканевый показатель этих эндогенных веществ. Их можно использовать в этом качестве для предупреждения и лечения патологий, в которых участвуют эндогенные каннабиноиды и/или все другие субстраты, метаболизируемые ферментом FAAH. Можно, например, назвать следующие заболевания и расстройства: боль, в частности острые или хронические боли типа нейрогенных: мигрень, нейропатические боли, включая формы, связанные с вирусом герпеса, и диабетом и химиотерапией, острые или хронические боли, связанные с воспалительными заболеваниями: артрит, ревматоидный артрит, остеоартрит, спондилит, подагра, васкулярит, болезнь Крона, синдром раздраженной ободочной кишки, периферические острые или хронические боли, головокружения, тошнота, рвота, в частности вызванные химиотерапией, нарушения пищевого поведения, в частности анорексия и кахексия различного происхождения; неврологические и психиатрические патологии: дрожание, дискинезия, дистония, спастичность, обсессивно-компульсивные расстройства, синдром Туретта, все формы депрессии и тревожности любой природы и происхождения, нарушения настроения, психозы, острые и хронические нейродегенеративные заболевания: болезнь Паркинсона,болезнь Альцгеймера, старческая деменция, хорея Хантингтона, поражения, связанные с церебральной ишемией и черепно-мозговыми и медуллярными травмами, эпилепсия, нарушения сна, включая апноэ,сердечно-сосудистые заболевания, в частности гипертензия, сердечная аритмия, атеросклероз, сердечный приступ, ишемия сердца, почечная ишемия, рак: доброкачественные опухоли кожи, папилломы и церебральные опухоли, опухоли простаты, церебральные опухоли (глиобластомы, медуллоэпителиомы,медуллобластомы, нейробластомы, опухоли эмбрионарного происхождения, астроцитомы, астробластомы, эпендиомы, олигоденроглиомы, опухоль плексуса, нейроэпителоимы, опухоль эпифиза, эпендимобластомы, злокачественные менингиомы, саркоматозы, злокачественные меланомы, шванномы), нарушения иммунной системы, в частности аутоимунные болезни: псориаз, красная волчанка, заболевания конъюнктивной или коннективной ткани, синдром Sjogrer's, анкилозирующий спондилит, недифференцированный спондилоартрит, болезнь Behcet's, гемолитические аутоимунные анемии, рассеянный склероз, боковой амиотрофический склероз, амилоз, отторжение трансплантатов, болезни, повреждающие плазмоцитарную линию, аллергические заболевания; гиперчувствительность немедленного или замедленного типа, аллергический ринит или конъюнктивит, контактные дерматиты, инфекционные заболевания, вызванные паразитами, вирусами или бактериями: СПИД, менингит, воспалительные заболевания, в частности болезни суставов: артрит, ревматоидный артрит, остеоартрит, спондилит, подагра, васкулярит,болезнь Крона, синдром раздраженной ободочной кишки, остеопороз, глазные болезни: повышенное глазное давление, глаукома, легочные заболевания: заболевания дыхательных путей, бронхоспазм, кашель, астма, хронический бронхит, хронические обструктивные заболевания дыхательных путей, эмфизема, заболевания желудочно-кишечного тракта: синдром раздраженной ободочной кишки, кишечные воспалительные заболевания, язвы, диарея, недержание мочи и воспаление мочевого пузыря. Применение соединений по изобретению в форме фармацевтически приемлемого основания, соли присоединения с кислотой, гидрата или сольвата для получения лекарственного средства, предназначенного для лечения указанных выше патологий, относится к настоящему изобретению. Объектом изобретения также являются лекарственные средства, содержащие соединение формулы(I) или фармацевтически приемлемую соль присоединения с кислотой или гидрат или сольват соединения формулы (I). Эти лекарственные средства находят применение в терапии, в частности для лечения указанных выше патологий. В соответствии с другим из его аспектов настоящее изобретение относится к фармацевтическим композициям, содержащим в качестве активного вещества по меньшей мере одно соединение по изобретению. Эти фармацевтические композиции содержат эффективную дозу соединения по изобретению или фармацевтически приемлемую соль присоединения с кислотой или гидрат или сольват этого соединения и возможно один или несколько фармацевтически приемлемых эксципиентов. Указанные эксципиенты выбирают в зависимости от фармацевтической формы и требуемого способа введения из традиционных эксципиентов, известных специалисту. В фармацевтических композициях по настоящему изобретению для перорального, сублингвального, подкожного, внутримышечного, внутривенного, тонического, местного, интратрахеального, интраназального, чрескожного, легочного, глазного или ректального введения активное вещество указанной выше формулы (I) или его возможную соль присоединения с кислотой или гидрат или сольват можно вводить в стандартной форме в смеси с традиционными фармацевтическими эксципиентами животным и людям для профилактики или лечения указанных выше нарушений или заболеваний. К соответствующим стандартным лекарственным формам относятся формы для перорального введения, такие как таблетки, мягкие или твердые желатиновые капсулы, порошки, гранулы, жевательная резинка и растворы или суспензии питьевые, формы для подъязычного, через рот, интратрахеального,интраокулярного, интраназального введения, путем ингаляции, формы для подкожного, внутримышечного или внутривенного введения и формы для ректального или вагинального введения. Для тонического нанесения можно использовать соединения по изобретению в составе кремов, мазей или лосьонов. В качестве примеров стандартная лекарственная форма соединения по изобретению в форме таблетки может содержать следующие компоненты: Указанные стандартные формы дозированы так, чтобы позволить суточный прием от 0,01 до 20 мг активного вещества на 1 кг веса тела в зависимости от галеновой формы. В отдельных особых случаях, когда показаны большие или меньшие дозировки, такие дозировки также относятся к изобретению. В соответствии с традиционной практикой надлежащую дозировку каждому пациенту определяет врач в зависимости от способа введения, массы тела и ответа этого пациента. В соответствии с другим из своих аспектов изобретение также относится к способу лечения указанных выше патологий, который включает введение эффективной дозы соединения по изобретению, одной из его солей с фармацевтически приемлемой кислотой, сольвата или гидрата указанного соединения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение общей формулы (I)A обозначает ковалентную связь или C1-8 алкилен;R1 обозначает группу R5, возможно замещенную одной или несколькими группами R6 и/или R7;R5 обозначает группу, выбранную из пиридинила и хинолинила;R7 обозначает группу, выбранную из тиенила, изоксазолила, пиразолила, фенила, пиридинила, пиримидинила, нафталенила, хинолинила, изохинолинила, причем одна или несколько групп R7 могут быть замещены одной или несколькими группами R6, одинаковыми или разными;R3 обозначает атом водорода, фтора, C1-6 алкильную группу или трифторметильную группу;R4 обозначает тиазол, возможно замещенный одним или несколькими заместителями, выбранными из атома галогена, C1-6 алкила, C1-6 галоалкила, CONR8R9 или пиридинила;R8 и R9 обозначают независимо друг от друга атом водорода или C1-6 алкил или образуют с одним или несколькими атомами, с которыми они связаны, в случае NR8R9 цикл, выбранный из пирролидинового, пиперидинового или морфолинового циклов,- 23018995 в форме основания или соли присоединения с кислотой, причем следующие соединения исключены: 2-(3-[2-(4-хлорфенил)-4-метилтиазол-5-ил]метоксикарбониламинопиперидин-1-ил)бензоат метила; 2-(3-[2-(4-хлорфенил)-4-метилтиазол-5-ил]метоксикарбониламинопиперидин-1-ил)бензойная кислота; 3-(3-[2-(4-хлорфенил)-4-метилтиазол-5-ил]метоксикарбониламинопиперидин-1-ил)бензоат метила; 3-(3-[2-(4-хлорфенил)-4-метилтиазол-5-ил]метоксикарбониламинопиперидин-1-ил)бензойная кислота. 2. Соединение формулы (I) по п.1, отличающееся тем, что A обозначает C1-8 алкилен, в форме основания или соли присоединения с кислотой. 3. Соединение формулы (I) по п.1 или 2, отличающееся тем, чтоR1 обозначает группу R5, возможно замещенную одной или несколькими группами R6 и/или R7;R5 обозначает пиридинил или хинолинил;R7 обозначает группу, выбранную из тиенила, изоксазолила, пиразолила, фенила, пиридинила, пиримидинила, нафталенила, хинолинила, изохинолинила, причем одна или несколько групп R7 могут быть замещены одной или несколькими группами R6, одинаковыми или разными;R8 и R9 обозначают независимо друг от друга атом водорода или C1-6 алкил или образуют с одним или несколькими атомами, с которыми они связаны, цикл, выбранный из пирролидинового, пиперидинового, морфолинового циклов,в форме основания или соли присоединения с кислотой. 4. Соединение формулы (I) по любому из пп.1-3, отличающееся тем, что R3 обозначает атом водорода, C1-6 алкил или трифторметил, в форме основания или соли присоединения с кислотой. 5. Способ получения соединения формулы (I) по любому из пп.1-4, включающий стадию, заключающуюся в том, что вводят во взаимодействие амин общей формулы (II) в которой A, R1, R2, m и n такие, как определены в общей формуле (I) по п.1,и карбонат общей формулы (III) в которой Z обозначает атом водорода или нитрогруппу;R3 и R4 такие, как определены в общей формуле (I) по п.1,в присутствии основания в растворителе при температуре от комнатной температуры до температуры кипения растворителя. 6. Способ получения соединения формулы (I) по любому из пп.1-4, включающий стадию, заключающуюся в том, что вводят во взаимодействие амин общей формулы (II) в которой A, R1, R2, m и n такие, как определены в общей формуле (I) по п.1,с фенилхлорформиатом или 4-нитрофенилом, в присутствии основания в растворителе при температуре от 0C до комнатной температуры, для получения производного карбамата общей формулы (IV)Z обозначает атом водорода или нитрогруппу,затем превращают полученный таким образом карбамат общей формулы (IV) в соединение общей формулы (I) действием спирта общей формулы которой R3 и R4 такие, как определены в общей формуле (I) по п.1,в присутствии основания в растворителе при температуре от комнатной температуры до температуры кипения растворителя. 7. Применение соединения формулы (I) по любому из пп.1-4 в виде основания или соли присоединения с фармацевтически приемлемой кислотой в качестве лекарственного средства, предназначенного для предупреждения или лечения острых или хронических болей, головокружения, тошноты, рвоты, нарушений пищевого поведения, неврологических и психиатрических патологий, нейродегенеративных заболеваний, острых или хронических, эпилепсии, нарушений сна, сердечно-сосудистых заболеваний,почечной ишемии, рака, нарушений иммунной системы, аллергических заболеваний, инфекционных заболеваний, вызванных паразитами, вирусами или бактериями, воспалительных заболеваний, остеопороза, глазных болезней, легочных заболеваний, заболеваний желудочно-кишечного тракта или недержания мочи. 8. Фармацевтическая композиция, содержащая по меньшей мере одно соединение формулы (I) по любому из пп.1-4 в форме основания или соли присоединения с фармацевтически приемлемой кислотой и, возможно, один или несколько фармацевтически приемлемых эксципиентов, предназначенная для предупреждения или лечения острых или хронических болей, головокружения, тошноты, рвоты, нарушений пищевого поведения, неврологических и психиатрических патологий, нейродегенеративных заболеваний, острых или хронических, эпилепсии, нарушений сна, сердечносо-судистых заболеваний, почечной ишемии, рака, нарушений иммунной системы, аллергических заболеваний, инфекционных заболеваний, вызванных паразитами, вирусами или бактериями, воспалительных заболеваний, остеопороза, глазных болезней, легочных заболеваний, заболеваний желудочно-кишечного тракта или недержания мочи. 9. Применение соединения формулы (I) по любому из пп.1-4 в форме основания или соли присоединения с фармацевтически приемлемой кислотой для получения лекарственного средства, предназначенного для предупреждения или лечения патологии, в которой участвуют эндогенные каннабиноиды и/или любые другие субстраты, метаболизируемые ферментом FAAH. 10. Применение соединения формулы (I) по любому из пп.1-4 в форме основания или соли присоединения с фармацевтически приемлемой кислотой для получения лекарственного средства, предназначенного для предупреждения или лечения острых или хронических болей, головокружения, тошноты,рвоты, нарушений пищевого поведения, неврологических и психиатрических патологий, нейродегенеративных заболеваний, острых или хронических, эпилепсии, нарушений сна, сердечно-сосудистых заболеваний, почечной ишемии, рака, нарушений иммунной системы, аллергических заболеваний, инфекционных заболеваний, вызванных паразитами, вирусами или бактериями, воспалительных заболеваний, остеопороза, глазных болезней, легочных заболеваний, заболеваний желудочно-кишечного тракта или недержания мочи.
МПК / Метки
МПК: A61K 31/4535, A61P 37/00, A61P 33/00, A61P 1/08, A61P 25/00, A61P 35/00, A61P 9/00, A61P 19/10, C07D 213/74, A61K 31/427, C07D 211/26, C07D 417/14, C07D 277/24, A61K 31/4709, A61P 29/00, A61K 31/4545, A61P 1/00
Метки: алкилтиазолов, производные, получение, применение, терапии, карбаматов
Код ссылки
<a href="https://eas.patents.su/26-18995-proizvodnye-karbamatov-alkiltiazolov-ih-poluchenie-i-ih-primenenie-v-terapii.html" rel="bookmark" title="База патентов Евразийского Союза">Производные карбаматов алкилтиазолов, их получение и их применение в терапии</a>
Предыдущий патент: Производные бициклического амида для усиления глутаматергических синаптических ответов
Следующий патент: Устройство подавления шума для протектора шины
Случайный патент: Микроэлементная добавка в кормовые смеси для животных и птицы в биодоступной форме












