Производные 7-алкинил-1,8-нафтиридонов, их получение и их применение в терапии
Номер патента: 16552
Опубликовано: 30.05.2012
Авторы: Боно Франсуаз, Алам Антуан, Дюкло Оливье, Мак Корт Гари
Формула / Реферат
1. Соединение, отвечающее формуле (I)
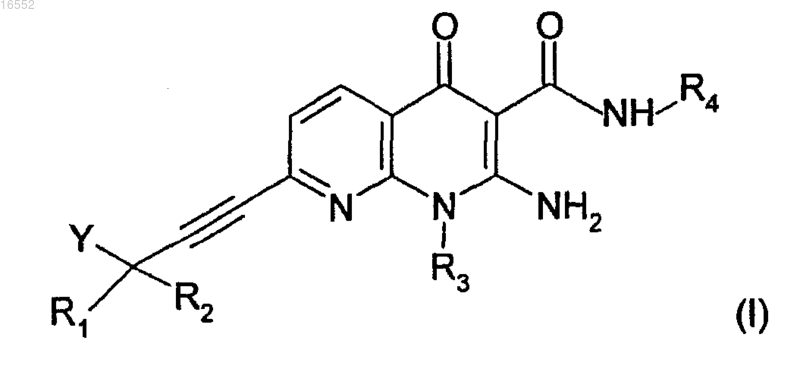
в которой R1 и R2 обозначают, независимо один от другого, атом водорода, (C1-C7)алкильную группу, возможно замещенную одной или несколькими (C1-C7)алкоксигруппами;
R3 обозначает (C1-C7)алкильную группу;
R4 обозначает атом водорода, (C1-C4)алкильную группу;
Y обозначает (C1-C4)алкоксигруппу, группу -NRR', -O(СН2)n-C(O)-NRR', где R и R' являются такими, как определено ниже, и n представляет собой целое число, равное 1 или 2;
R и R' обозначают, независимо один от другого, атом водорода, -СО-(C1-C4)алкил или группу -COOR", где R" обозначает (C1-C4)алкильную группу;
в форме основания или соли присоединения с кислотой, а также энантиомера или диастереоизомера, включая их смесь.
2. Соединения по п.1, для которых Y обозначает (C1-C4)алкоксигруппу, в форме основания или соли присоединения с кислотой, а также энантиомера или диастереоизомера, включая их смесь.
3. Соединения по п.1, для которых Y обозначает группу -NRR', где R и R' являются такими, как в п.1, в форме основания или соли присоединения с кислотой, а также энантиомера или диастереоизомера, включая их смесь.
4. Соединения по п.1, для которых Y обозначает группу -О(СН2)n-С(О)-NRR', где R и R' являются такими, как в п.1, и n представляет собой целое число, равное 1 или 2, в форме основания или соли присоединения с кислотой, а также энантиомера или диастереоизомера, включая их смесь.
5. Соединение по п.1, выбранное из группы, включающей
метил{3-[7-амино-8-этил-6-(метилкарбамоил)-5-оксо-5,8-дигидро-1,8-нафтиридин-2-ил]проп-2-ин-1-ил}карбамат;
хлоргидрат 2-амино-7-(3-амино-3-метилбут-1-ин-1-ил)-1-этил-N-метил-4-оксо-1,4-дигидро-1,8-нафтиридин-3-карбоксамида;
(±)-2-амино-7-(3,4-диметокси-3-метилбут-1-ин-1-ил)-1-этил-N-метил-4-оксо-1,4-дигидро-1,8-нафтиридин-3-карбоксамид;
2-амино-7-[3-(2-амино-2-оксоэтокси)-3-метилбут-1-ин-1-ил]-1-этил-N-метил-4-оксо-1,4-дигидро-1,8-нафтиридин-3-карбоксамид;
2-амино-1-этил-7-(3-метоксипроп-1-ин-1-ил)-N-метил-4-оксо-1,4-дигидро-1,8-нафтиридин-3-карбоксамид.
6. Способ получения соединения формулы (I) по любому из пп.1-5, отличающийся тем, что соединение формулы (VII)
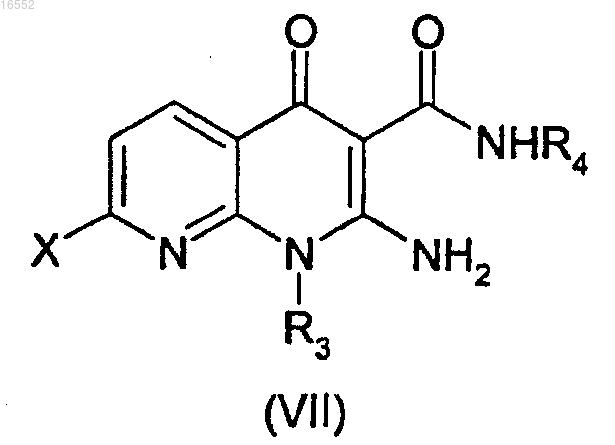
в которой X обозначает атом галогена и
R3 и R4 являются такими, как определено в п.1,
вводят в реакцию с соединением формулы (VIII)
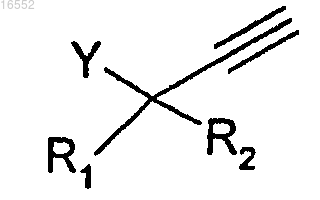
в которой Y, R1 и R2 являются такими, как определено в одном из предыдущих пунктов.
7. Лекарственное средство, отличающееся тем, что оно содержит соединение формулы (I) по любому из пп.1-5, или соль присоединения с фармацевтически приемлемой кислотой этого соединения, или энантиомер или диастереоизомер соединения формулы (I), или их смесь.
8. Фармацевтическая композиция, отличающаяся тем, что она содержит соединение формулы (I) по любому из пп.1-5, или фармацевтически приемлемую соль, или энантиомер или диастереоизомер этого соединения, или их смесь, а также по меньшей мере один фармацевтически приемлемый эксципиент.
9. Комбинация по меньшей мере одного соединения формулы (I) по любому из пп.1-5 по меньшей мере с одним химиотерапевтическим средством, выбранным среди
алкилирующих средств,
интеркалирующих средств,
антимикротрубочковых средств,
антимитотических средств,
антиметаболических средств,
антипролиферативных средств,
антибиотиков,
иммуномодулирующих средств,
противовоспалительных средств,
ингибиторов киназы,
антиангиогенных средств,
антиваскулярных средств,
эстрогенных и андрогенных гормонов,
для лечения или профилактики
злокачественных опухолей и их метастазов, таких как глиобластомы, множественные миеломы, миелодисплазийные синдромы, саркомы Капоши, солидные опухоли, лимфомы, меланомы, раки молочной железы, колоноректальные раки, раки легких, включая раки не с маленькими клетками, раки поджелудочной железы, раки предстательной железы, раки почек, опухоли головы и шеи, рак печени, раки яичников, раки дыхательного и торакального аппарата, опухолевые ангиогенезы, другие злокачественные опухоли, продуцирующие VEGFR-3 или вовлекающие процесс ангиогенеза или лимфангиогенеза;
неонкологических пролиферативных заболеваний и патологических ангиогенезов, связанных с VEGFR-3, таких как артрозы, рестенозы, псориаз, гемангиомы, глаукомы, гломерулонефриты, диабетические нефропатии, нефросклерозы, тромботические микроангиопатические синдромы, циррозы печени, атеросклерозы, отторжения при пересадке органа, заболевания глаз, вовлекающие процессы ангиогенеза или лимфангиогенеза, такие как диабетическая ретинопатия или пятнистое перерождение;
воспалений (хронических или нехронических), инфекций, вызванных микроорганизмами, и аутоиммунных заболеваний, таких как ревматоидный полиартрит; или
редких заболеваний, таких как лимфангиолейомиоматоз.
10. Применение соединения формулы (I) по любому из пп.1-5 для получения лекарственного средства, предназначенного для лечения заболеваний, в которых участвует VEGFR-3.
11. Применение соединения формулы (I) по любому из пп.1-5 для получения лекарственного средства, предназначенного для лечения и/или профилактики злокачественных опухолей и их метастазов.
12. Применение соединения формулы (I) по п.11 для получения лекарственного средства, предназначенного для лечения и/или профилактики глиобластом, множественных миелом, миелодисплазийных синдромов, сарком Капоши, кожных ангиосарком, солидных опухолей, лимфом, меланом, рака молочной железы, колоноректального рака, рака легких, включая немелкоклеточный рак, рака поджелудочной железы, рака предстательной железы, рака почек, опухолей головы и шеи, рака печени, рака яичников, рака дыхательного и торакального аппарата, других злокачественных опухолей, продуцирующих VEGFR-3 или вовлекающих процесс ангиогенеза или лимфангиогенеза.
13. Применение соединения формулы (I) по любому из пп.1-5 для получения лекарственного средства, предназначенного для лечения и/или профилактики неонкологических пролиферативных заболеваний и патологических ангиогенезов, связанных с VEGFR-3.
14. Применение соединения формулы (I) по п.13 для получения лекарственного средства, предназначенного для лечения и/или профилактики таких заболеваний, как артрозы, рестенозы, псориаз, гемангиомы, лимфангиомы, глаукомы, гломерулонефриты, диабетические нефропатии, нефросклерозы, тромботические микроангиопатические синдромы, циррозы печени, атеросклерозы, отторжения при пересадке органа, заболевания глаз, вовлекающие процессы ангиогенеза или лимфангиогенеза.
15. Применение соединения формулы (I) по любому из пп.1-5 для получения лекарственного средства, предназначенного для лечения и/или профилактики хронических или нехронических воспалений, инфекций, вызванных микроорганизмами, и ревматоидного полиартрита.
16. Применение соединения формулы (I) по любому из пп.1-5 для получения лекарственного средства, предназначенного для лечения и/или профилактики лимфангиолейомиоматоза.
Текст
Алам Антуан, Боно Франсуаз, Дюкло Оливье, Мак Корт Гари (FR) Медведев В.Н. (RU) в которой R1 и R2 обозначают, независимо один от другого, атом водорода, (С 1-С 7)алкильную группу,в известных случаях замещенную одной или несколькими алкоксигруппами; R3 обозначает (С 1 С 7)алкильную группу; R4 обозначает атом водорода, (С 1-С 4)алкильную группу; Y обозначает (С 1 С 4)алкоксигруппу, группу -NRR', -О(СН 2)n-С(О)-NRR', где R и R' являются такими, как определено ниже, и n представляет собой целое число, равное 1 или 2; и R и R' обозначают, независимо один от другого, атом водорода, группу -СО-(С 1-С 4)алкил или группу -COOR", где R" обозначает (С 1 С 4)алкильную группу. Кроме того, изобретение относится к способам получения и применения в терапии этих соединений. 016552 Настоящее изобретение относится к производным 7-алкинил-1,8-нафтиридонов, их получению и их применению в терапии. Объектом изобретения являются соединения, отвечающие формуле (I) в которой R1 и R2 обозначают, независимо один от другого, атом водорода, (C1-C7)алкильную группу. возможно замещенную одной или несколькими алкоксигруппами;Y обозначает (C1-C4)алкоксигруппу, группу -NRR', -O(СН 2)n-C(O)-NRR', где R и R' являются такими, как определены ниже, и n представляет собой целое число, равное 1 или 2;R и R' обозначают, независимо один от другого, атом водорода, -СО-(C1-C4)алкил или группу-COOR", где R" обозначает (C1-C4)алкильную группу. Соединения формулы (I) могут содержать один или несколько асимметрических атомов углерода. Следовательно, они могут существовать в форме энантиомеров или диастереоизомеров. Указанные энантиомеры, диастереоизомеры, так же как их смесь, включая их рацемическую смесь, являются частью изобретения. Соединения формулы (I) могут существовать в форме оснований или солей присоединения с кислотами или основаниями, в частности с фармацевтически приемлемыми кислотами или основаниями. Указанные соли присоединения являются частью изобретения. Эти соли предпочтительно получают с фармацевтически приемлемыми кислотами или основаниями, но соли других кислот или оснований, используемых, например, для очистки или выделения соединений формулы (I), равным образом, являются частью изобретения. Соединения согласно изобретению, равным образом, могут существовать в форме гидратов или сольватов, а именно в форме ассоциатов или комбинаций с одной или несколькими молекулами воды или с растворителем. Такие гидраты или сольваты, равным образом, являются частью изобретения. В рамках настоящего изобретения, если в тексте нет другого упоминания, подразумевают следующее: алкильная группа: насыщенная алифатическая группа, линейная или разветвленная, содержащая от 1 до 7 атомов углерода (благоприятно от 1 до 4 атомов углерода); в качестве примеров можно назвать метильную, этильную, пропильную, изопропильную, бутильную, изобутильную, трет-бутильную, пентильную, гексильную, гептильную и т.д. группы; алкоксигруппа: группа -О-алкил, в которой алкильная группа такая, как определено выше; атом галогена: фтор, хлор, бром или йод. Среди соединений, являющихся объектом изобретения, можно назвать подгруппу соединений, для которых Y обозначает (C1-C14)алкоксигруппу. Среди соединений, являющихся объектом изобретения, можно назвать вторую подгруппу соединений, для которых Y обозначает группу -NRR', в которой R и R' являются такими, как определено ниже. Среди соединений, являющихся объектом изобретения, можно назвать третью подгруппу соединений, для которых Y обозначает -О(СН 2)n-С(О)-NRR', где R и R' являются такими, как определено ниже, иn представляет собой целое число, равное 1 или 2. Среди соединений, являющихся объектом изобретения, можно, в частности, назвать следующие соединения: метил 3-[7-амино-8-этил-6-(метилкарбамоил)-5-оксо-5,8-дигидро-1,8-нафтиридин-2-ил]проп-2-ин 1-илкарбамат; хлоргидрат 2-амино-7-(3-амино-3-метилбут-1-ин-1-ил)-1-этил-N-метил-4-оксо-1,4-дигидро-1,8 нафтиридин-3-карбоксамида;-2-амино-7-(3,4-диметокси-3-метилбут-1-ин-1-ил)-1-этил-N-метил-4-оксо-1,4-дигидро-1,8 нафтиридин-3-карбоксамид; 2-амино-7-[3-(2-амино-2-оксоэтокси)-3-метилбут-1-ин-1-ил]-1-этил-N-метил-4-оксо-1,4-дигидро 1,8-нафтиридин-3-карбоксамид; 2-амино-1-этил-7-(3-метоксипроп-1-ин-1-ил)-N-метил-4-оксо-1,4-дигидро-1,8-нафтиридин-3 карбоксамид. В соответствии с изобретением соединения формулы (I) могут быть получены согласно способу,представленному на схеме 1. Согласно схеме 1 2,6-дигалогеноникотиновую кислоту формулы (II), в которой группы X обозначают атомы галогена (предпочтительно хлора или брома), которая является либо коммерческой, либо получена согласно способам, известным специалистам в данной области, монозамещают в положении 2 амином формулы R3-NH2 (где R3 такой, как определен перед этим в отношении соединений формулы (I),являющихся предметом изобретения) при температуре, находящейся в интервале от 20 до 150 С, в протонном растворителе, таком как спирт или вода, и в известных случаях - в запаянной трубке. Получают производное 2-аминоникотиновой кислоты формулы (III), которое превращают во фторид кислоты формулы (IV) действием цианурилфторида при комнатной температуре в присутствии основания, такого как триэтиламин или пиридин, в инертном растворителе, таком как дихлорметан, как описано в работе Олаха с коллегами (G. Olah et coll.) в Synthsis (1973), 487, или другими способами, известными специалистам в данной области, такими как описанные Мукаямой и Танакой (MUKAIYAMA et TANAKA) в Chem. Lett.(1976), 303 или Ишикавой и Сасаки (ISHIKAWA et SASAKI) в Chem. Lett. (1976), 1407. Ацилфториды формулы (IV),очень реакционноспособные, но стабильные, затем вводят в реакцию с N-замещенным цианоацетамидом формулы (IV) в присутствии сильного основания, такого как гидрид натрия, в полярном апротонном растворителе, таком как диметилформамид. Когда на стадии конденсации производного (IV) с производным (V) используют 2 экв. гидрида натрия, а затем после перемешивания при комнатной температуре в течение промежутка времени от 10 до 16 ч вводят третий эквивалент NaH, образующееся депротонированное соединение (VI) циклизуется in situ при той же самой температуре, непосредственно давая с высоким выходом аминопиридино[2,3-b]пиридон формулы (VII) (способ В).N-Алкилцианоацетамиды формулы (V) получают, вводя цианоуксусную кислоту в реакцию с алкилхлорформиатом (таким как этилхлорформиат или изобутилхлорформиат) в присутствии основания,такого как триэтиламин, при температуре меньше или равной 0 С, затем образовавшийся промежуточный смешанный ангидрид вводят в реакцию с избытком амина формулы R4-NH2 (где R4 такой, как определен перед этим в отношении соединений формулы (I), являющихся объектом изобретения). Для получения пиридино[2,3-b]пиридинона формулы (I), являющегося объектом настоящего изобретения, промежуточное галогенсодержащее соединение формулы (VII) связывают согласно способам,известным специалистам в данной области, с соответствующим производным пропаргилового спиртаR1R2CH(Y)CCH формулы (VIII), в которой R1, R2 и Y такие, как определены для соединений формулы(I). Например, промежуточное соединение (VII) вводят в реакцию сочетания Соногаширы (Sonogashira) с соответствующим алкином формулы (VIII) в присутствии PdCl2(PPh3)2, йодида меди, триэтиламина и диметилформамида при температуре, находящейся в интервале от 80 до 120 С. Эта реакция может быть осуществлена в запаянной трубке под действием микроволнового излучения. Если необходимо, в ходе реакционных стадий, представленных на схеме 1, некоторые реакционноспособные функциональные группы, находящиеся в группах Y, R1, R2 и R3, могут быть временно защищены защитными группами, известными специалистам в данной области, и такими, как описанные в"Protective Groups in Organic Synthsis", Green et al., 2nd Edition (John WileySons, Inc., New York). На схеме 1 исходные соединения и реагенты, когда способ их получения не описан, являются коммерчески доступными или описаны в литературе или могут быть получены согласно способам, которые описаны или которые известны специалистам в данной области.-2 016552 В изобретении равным образом описаны соединения формулы (VII), точно указанные на схеме 1. Эти соединения используют в качестве промежуточных продуктов синтеза соединений формулы (I). Следующие примеры иллюстрируют получение некоторых соединений согласно изобретению. Эти примеры не являются ограничивающими и приведены только для того, чтобы проиллюстрировать настоящее изобретение. Номера соединений, представленных в примерах, соответствуют номерам соединений, данным в приведенной ниже таблице, которая иллюстрирует химические структуры и физические свойства некоторых соединений согласно изобретению. Пример 1.-2-Амино-7-(3,4-диметокси-3-метилбут-1-ин-1-ил)-1-этил-N-метил-4-оксо-1,4 дигидро-1,8-нафтиридин-3-карбоксамида (соединение 1). 1.1. 2-(Аминоэтил)-6-хлорникотиновая кислота. При комнатной температуре в течение 72 ч перемешивали раствор 18,0 г (84,4 ммоль) 2,6-дихлорникотиновой кислоты в 180 мл 70%-ного раствора этиламина в воде. Затем избыток амина испаряли при пониженном давлении, потом добавляли 10%-ный водный раствор уксусной кислоты до осаждения продукта. Бежевое твердое вещество сушили на воздухе, промывали холодной водой и сушили в сушильном шкафу. Получали 10,5 г желаемого продукта. Температура плавления = 158-160 С. Выход = 62%. 1.2. Фторид 2-(аминоэтил)-6-хлорникотиновой кислоты. К суспензии 5,0 г (24,8 ммоль) 2-(аминоэтил)-6-хлорникотиновой кислоты в 125 мл дихлорметана добавляли 2 мл (24,8 ммоль) пиридина и 4,2 мл (49,8 ммоль) 2,4,6-трифтортриазина. Перемешивали смесь в течение 3 ч при комнатной температуре, затем фильтровали. Твердое вещество промывали 50 мл дихлорметана и фильтрат промывали два раза 60 мл смеси воды со льдом. Сушили органическую фазу над Na2SO4 и выпаривали растворитель при пониженном давлении. Получали 5,01 г продукта в форме оранжевого масла. Выход = 99%. 1.3. N-Метилцианоацетамид. К охлажденному до -30 С раствору 10,0 г (116,38 ммоль) 99%-ной цианоуксусной кислоты и 16,3 мл (116,9 ммоль) триэтиламина в 100 мл безводного ТГФ (THF) по каплям добавляли 12,28 мл(128,44 ммоль) этилхлорформиата, затем перемешивали при -30 С в течение 1,5 ч. Затем по каплям добавляли 300 мл метанола, насыщенного газообразным метиламином, затем перемешивали при комнатной температуре в течение ночи. Выпаривали растворители при пониженном давлении и очищали продукт фильтрованием на силикагеле, элюируя смесью дихлорметан:метанол (95:5). Получали 10,0 г продукта в форме бежевого твердого вещества. Температура плавления = 99 С. Выход = 87%. Способ А (пункты 1.4 и 1.5). 1.4. 3-[6-Хлор-2-(этиламино)-3-пиридинил]-2-циано-3-гидрокси-N-метил-2-пропенамид. К охлажденному до 0-5 С раствору 9,80 г (100 ммоль) N-метилцианоацетамида в 100 мл безводного диметилформамида добавляли небольшими порциями 3,98 г (100 ммоль) гидрида натрия в виде 60%-ного раствора в минеральном масле. По окончании выделения водорода смесь перемешивали в течение 10 мин при комнатной температуре, затем вновь охлаждали до 0-5 С. Тогда добавляли раствор 10,09 г (49,8 ммоль) фторида 2-(аминоэтил)-6-хлорникотиновой кислоты в 60 мл диметилформамида и перемешивали смесь при комнатной температуре в течение ночи. Добавляли 2,85 мл (49,8 ммоль) уксусной кислоты и выпаривали летучие соединения при пониженном давлении. Остаток извлекали в воду и продукт экстрагировали два раза смесью дихлорметан:метанол (95:5), затем один раз смесью этилацетат:ТГФ (2:1). Объединенные органические фазы сушили над MgSO4, затем органические растворители выпаривали при пониженном давлении. Получали 19,0 г продукта, который использовали таким как есть,на следующей стадии. 1.5. 2-Амино-7-хлор-1-этил-N-метил-4-оксо-1,4-дигидро-1,8-нафтиридин-3-карбоксамид. В течение 48 ч при 110 С нагревали раствор 19,0 г (49,8 ммоль) неочищенного продукта, полученного в результате стадии 7.4, в 600 мл н-бутанола. Выпаривали растворитель при пониженном давлении и растирали полученное твердое вещество в метаноле. Затем твердое вещество обезвоживали и сушили в сушильном шкафу. Получали 7,9 г желаемого продукта в форме бледно-желтого твердого вещества. Температура плавления = 283-286 С. Выход = 57%. Способ В (пункт 1.6 вместо пунктов 1.4 и 1.5).-3 016552 1.6. 2-Амино-7-хлор-1-этил-N-метил-4-оксо-1,4-дигидро-1,8-нафтиридин-3-карбоксамид. К охлажденному до 0-5 С раствору 0,483 г (4,93 ммоль) N-метилцианоацетамида в 7 мл безводного диметилформамида небольшими порциями добавляли 0,394 г (9,95 ммоль) гидрида натрия в виде 60%-ного раствора в минеральном масле. Продолжали перемешивание при данной температуре в течение 10 мин, затем добавляли раствор 1,0 г (4,93 ммоль) фторида 2-(аминоэтил)-6-хлорникотиновой кислоты в 5 мл диметилформамида. Перемешивали среду в течение 1 ночи при комнатной температуре,затем небольшими порциями добавляли 0,197 г (4,93 ммоль) гидрида натрия в виде 60%-ного раствора. Продолжали перемешивание при этой температуре в течение 10 мин, затем добавляли 0,56 мл(9,78 ммоль) уксусной кислоты. Затем добавляли 60 мл воды и сушили на воздухе твердое вещество, которое промывали водой, затем сушили его в сушильном шкафу. Получали 1,30 г желаемого продукта. Температура плавления = 283-284 С. МН+ = 281. Выход = 94%. 1 Н ЯМР (ДМСО-d6, 400 МГц,в м.д.):11,75 (с, 1 Н, очень ушир.); 11,00 (кв, 1 Н, ушир.); 8,45 (д,1 Н); 8,10 (с, 1 Н, ушир.); 7,40 (д, 1 Н); 4,40 (кв, 2 Н); 2,80 (д, 3 Н); 1,25 (т, 3 Н). 1.7. Получение -3,4-диметокси-3-метилбут-1-ин-1-ила. В трехгорлую колбу в атмосфере аргона наливали 1400 мл (0,7 моль) продажного раствора 0,5 М хлорида (или бромида) этинилмагния в тетрагидрофуране. Охлаждали на ледяной бане до 2 С и медленно добавляли раствор 30 г (0,327 моль) метоксиацетона в 600 мл тетрагидрофурана (реакция экзотермическая). Перемешивали в течение 1 ч при 2 С, затем выливали на смесь лед/NH4Claq насыщенный. Экстрагировали простым эфиром, затем органические фазы объединяли, сушили над сульфатом натрия,фильтровали и концентрировали при предельном вакууме. В конце концов, получали 38 г (выход неочищенного продукта количественный) -1-метокси-2-метил-3-бутин-2-ола в форме масла каштанового цвета, которое без последующей очистки использовали на следующей стадии. К раствору 2 г (17,52 ммоль) -1-метокси-2-метил-3-бутин-2-ола в 6 мл тетрагидрофурана, охлажденному на ледяной бане, добавляли 17,5 мл раствора 1 М трет-бутилата калия в тетрагидрофуране(Aldrich; 17,52 ммоль). Перемешивали 30 мин при комнатной температуре, затем добавляли 0,55 мл йодистого метила (35,04 ммоль). Перемешивали реакционную смесь при комнатной температуре в течение 3 ч, затем разбавляли простым эфиром и водой. После декантации органическую фазу промывали водой, сушили над сульфатом натрия, фильтровали и концентрировали при предельном вакууме. Получали 2,4 г желаемого продукта в форме желтого масла, содержащего остаточные количества простого эфира и тетрагидрофурана. Полученный -3,4-диметокси-3-метилбут-1-ин-1-ил вводили в следующую стадию без последующей очистки. 1.8. -2-Амино-7-(3,4-диметокси-3-метилбут-1-ин-1-ил)-1-этил-N-метил-4-оксо-1,4-дигидро-1,8 нафтиридин-3-карбоксамид. В трубку для микроволнового облучения объемом 80 мл помещали суспензию 1,5 г (5,34 ммоль) 2-амино-7-хлор-1-этил-N-метил-4-оксо-1,4-дигидро-[1,8]-нафтиридин-3-карбоксамида в 30 мл смеси ДМФ/Et3N (об./об.; 2/1). Через упомянутую суспензию в течение 10 мин барботировали аргон, затем последовательно добавляли 1,37 г -3,4-диметокси-3-метилбут-1-ин-1-ила (10,69 ммоль), 0,101 г CuI(0,53 ммоль) и 0,187 г дихлорида бис-(трифенилфосфин)палладия (0,27 ммоль). Запаянную трубку помещали в микроволновую печь (установка СЕМ, модель Discover) и смесь нагревали под давлением при 80 С в течение 45 мин (Р=100 Вт), затем охлаждали и выпаривали досуха. Остаток извлекали этилацетатом и водой. Водную фазу экстрагировали этилацетатом (3 раза), затем органические фазы объединяли, сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Полученный остаток очищали хроматографией на колонке с силикагелем (твердый осадок; градиентное элюирование смесью дихлорметан:метанол, от 100:0 до 98:2). Получали 1,37 г желаемого продукта в форме бледно-серого порошка. Температура плавления = 185-187 С. МН+ = 373. Выход = 69%. 1 Н ЯМР (ДМСО-d6, 400 МГц,в м.д.):11,75 (с, 1 Н, очень ушир.); 11,00 (кв, 1 Н, ушир.); 8,45 (д,1 Н); 8,00 (с, 1 Н, ушир.); 7,4 (д, 1 Н); 5,8 (с, 1 Н); 4,40 (кв, 2 Н); 3,5-3,3 (м+с, 5 Н); 2,8 (д, 3 Н); 1,45 (с, 3 Н); 1,2-4 016552 2.1. Метил(проп-2-ин-1-ил)карбамат. Раствор 1,3 мл пропаргиламина (18,95 ммоль, Aldrich) в 19 мл диоксана охлаждали до 0 С, затем добавляли 19 мл насыщенного водного раствора NaHCO3. Перемешивали в течение 30 мин при 0 С, затем добавляли 1,83 мл метилхлорформиата (23,68 ммоль). Перемешивали реакционную смесь в течение ночи, позволяя температуре постепенно подниматься до комнатной. Экстрагировали 4 раза простым эфиром, затем органические фазы объединяли, сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Получали 1,93 г желаемого продукта в форме желтого масла (выход = 90%), которое использовали без последующей очистки. 2.2. Метил 3-[7-амино-8-этил-6-(метилкарбамоил)-5-оксо-5,8-дигидро-1,8-нафтиридин-2-ил]проп 2-ин-1-илкарбамат. В трубку для микроволнового облучения объемом 10 мл помещали суспензию 0,8 г (2,85 ммоль) 2-амино-7-хлор-1-этил-N-метил-4-оксо-1,4-дигидро-[1,8]-нафтиридин-3-карбоксамида в 22 мл смеси ДМФ/Et3N (об./об.; 2,2/1). Через упомянутую суспензию в течение 10 мин барботировали аргон, затем последовательно добавляли 0,98 г метил(проп-2-ин-1-ил)карбамата (8,66 ммоль), 0,076 г CuI (0,40 ммоль) и 0,139 г дихлорида бис-(трифенилфосфин)палладия(II) (0,20 ммоль). Запаянную трубку помещали в микроволновую печь (установка СЕМ, модель Discover) и смесь нагревали под давлением при 90 С в течение 15 мин (Р=50 Вт). После возвращения к комнатной температуре смесь выпаривали, затем извлекали этилацетатом. Органическую фазу последовательно промывали насыщенными растворами NaHCO3aq затем NaClaq. Нерастворимое твердое вещество отделяли, затем растирали в метаноле, тетрагидрофуране и простом эфире. Получали 0,284 г твердого вещества, которое очищали хроматографией на колонке с силикагелем (твердый осадок после солюбилизации в смеси тетрагидрофуран/метанол, затем градиентное элюирование смесью дихлорметан:метанол, от 100:0 до 98:2). Получали 0,095 г желаемого продукта в форме белого твердого вещества. Температура плавления = 255 С. МН+ = 357. Выход = 9,3%. 1 Н ЯМР (ДМСО-d6, 400 МГц,в м.д.):11,70 (с, 1 Н, очень ушир.); 11,00 (кв, 1 Н, ушир.); 8,40 (д,1 Н); 8,00 (с, 1 Н, ушир.); 7,75 (т, 1 Н, ушир.); 7,40 (д, 1 Н); 4,40 (кв, 2 Н); 4,10 (д, 2 Н); 3,55 (с, 3 Н); 2,80 (д,3 Н); 1,20 (т, 3 Н). Пример 3. Хлоргидрат 2-амино-7-(3-амино-3-метилбут-1-ин-1-ил)-1-этил-N-метил-4-оксо-1,4 дигидро-1,8-нафтиридин-3-карбоксамида (соединение 4). В трубку для микроволнового облучения объемом 10 мл помещали суспензию 0,84 г (3,0 ммоль) 2-амино-7-хлор-1-этил-N-метил-4-оксо-1,4-дигидро-[1,8]-нафтиридин-3-карбоксамида в 20 мл смеси ДМФ/Et3N (об./об.; 7/3). Через упомянутую суспензию в течение 10 мин барботировали аргон, затем последовательно добавляли 0,50 г 2-метилбут-3-ин-2-амина (6,0 ммоль), 0,089 г CuI (0,47 ммоль) и 0,149 г дихлорида бис-(трифенилфосфин)палладия(II) (0,21 ммоль). Запаянную трубку помещали в микроволновую печь (установка СЕМ, модель Discover) и смесь нагревали под давлением при 90 С в течение 15 мин (Р=50 Вт), затем 25 мин при 100 С. После возвращения к комнатной температуре смесь выпаривали досуха, затем извлекали этилацетатом. Органическую фазу последовательно промывали насыщенными растворами NaHCO3aq, затем NaClaq, сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Полученный маслянистый остаток очищали хроматографией на колонке с диоксидом кремния (градиентное элюирование смесью дихлорметан:метанол, от 100:0 до 97:3). Получали 0,151 г (0,46 ммоль) желаемого продукта, который растворяли в 3 мл этилацетата, затем добавляли 0,13 мл (0,52 ммоль) солянокислого раствора 4 н. диоксана. После фильтрования и сушки в сушильном шкафу в вакууме получали 0,134 мг желаемого продукта в форме желтого твердого вещества. Температура плавления = 293 С. МН+ = 310. Выход = 12%. 1 Н ЯМР (ДМСО-d6, 400 МГц,в м.д.):11,75 (с, 1 Н, очень ушир.); 11,00 (кв, 1 Н, ушир.); 8,40 (д,1 Н); 8,10 (с, 1 Н, ушир.); 7,45 (д, 1 Н); 4,40 (кв, 2 Н); 3,50 (дд, 2 Н); 3,35 (с, 6 Н); 2,85 (д, 3 Н); 1,45 (с, 3 Н); 1,20 (т, 3 Н). Пример 4. 2-Амино-7-[3-(2-амино-2-оксоэтокси)-3-метилбут-1-ин-1-ил]-1-этил-N-метил-4-оксо-1,4 дигидро-1,8-нафтиридин-3-карбоксамид (соединение 6).-5 016552 4.1. Этил[(1,1-диметилпроп-2-ин-1-ил)окси]ацетат. Раствор 0,87 г (10,32 ммоль) 2-метилбут-3-ин-2-ола в 20 мл безводного ТГФ охлаждали до 0-5 С на ледяной бане, затем добавляли 10,32 мл (10,32 ммоль) раствора 1,0 М трет-бутилата калия в ТГФ(Aldrich). Перемешивали 10 мин в холодном состоянии, затем добавляли 1,89 г (11,35 ммоль) этилбромацетата. Перемешивали реакционную смесь в течение 45 мин при комнатной температуре, затем добавляли водный раствор 0,1 н. HCl и простой эфир. Органическую фазу сушили над сульфатом натрия,фильтровали и концентрировали в вакууме. Получали 1,45 г желаемого продукта в форме желтого масла,которое использовали без последующей очистки. Выход = 83%. 4.2. Этил(3-[7-амино-8-этил-6-(метилкарбамоил)-5-оксо-5,8-дигидро-1,8-нафтиридин-2-ил]-1,1 диметилпроп-2-ин-1-илокси)ацетат. Помещали 1,15 г (4,10 ммоль) 2-амино-7-хлор-1-этил-N-метил-4-оксо-1,4-дигидро-[1,8]нафтиридин 3-карбоксамида и 1,39 г (8,19 ммоль) этил[(1,1-диметилпроп-2-ин-1-ил)окси]ацетата в смесь 10 мл диметилформамида и 10 мл триэтиламина. В течение 15 мин через реакционную смесь барботировали аргон,затем последовательно добавляли 0,031 г (0,16 ммоль) CuI и 0,144 г (0,20 ммоль) дихлорида бис(трифенилфосфин)палладия(II). Реакционную смесь нагревали в течение 15 ч при 90 С. После возвращения к комнатной температуре реакционную смесь выливали на смесь вода/лед. После декантации полученную черную смолу солюбилизировали в этилацетате, затем промывали водой. Органическую фазу сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Получали 1,4 г масла каштанового цвета, которое очищали хроматографией на диоксиде кремния (градиентное элюирование смесью циклогексан/этилацетат, от 30:70 до 20:80) с получением 0,72 г желаемого продукта в форме желтого масла. Выход = 41%. 4.3. 2-Амино-7-[3-(2-амино-2-оксоэтокси)-3-метилбут-1-ин-1-ил]-1-этил-N-метил-4-оксо-1,4 дигидро-1,8-нафтиридин-3-карбоксамид. В запаянную трубку объемом 50 мл помещали 0,30 г (0,72 ммоль) этил(3-[7-амино-8-этил-6(метилкарбамоил)-5-оксо-5,8-дигидро-1,8-нафтиридин-2-ил]-1,1-диметилпроп-2-ин-1-илокси)ацетата в 30 мл метанола. Охлаждали раствор на ледяной бане и барботировали через него газообразный аммиак до насыщения. Нагревали в течение 8 ч при 80 С, затем выпаривали досуха. Полученный остаток очищали хроматографией на колонке с диоксидом кремния (твердый осадок после солюбилизации в смеси тетрагидрофуран/метанол, затем градиентное элюирование смесью дихлорметан/метанол, от 100:0 до 95:5) с получением 0,18 г желаемого продукта в форме белого твердого вещества. Температура плавления = 204 С. МН+ = 386. Выход = 64%. 1H ЯМР (ДМСО-d6, 400 МГц,в м.д.):11,85 (с, 1 Н, очень ушир.); 11,00 (кв, 1 Н, ушир.); 8,45 (д,1 Н); 7,45 (д, 1 Н); 7,20 (д, 2 Н, ушир.); 4,40 (кв, 2 Н); 3,95 (с, 2 Н); 2,80 (д, 3 Н); 1,60 (с, 6 Н); 1,20 (т, 3 Н). Таблица иллюстрирует химические структуры и физические свойства некоторых соединений формулы (I) согласно изобретению. В указанной таблице:Me и Et обозначают соответственно метильную и этильную группы; в столбце "соль" "-" обозначает соединение в форме свободного основания, тогда как "HCl" обозначает соединение в форме хлоргидрата; столбец "Тпл" указывает температуру плавления соединения, в С; в столбце "ЖХ/МС" (CL/SM) последовательно указаны использованный аналитический метод высокоэффективной жидкостной хроматографии (А или В), детализированный ниже, время удерживания определенного соединения в минутах и пик МН+, определяемый методом масс-спектрометрии. Метод А. Колонка: Gemini, 503 мм, 3 мкм. Растворитель А: H2O + 0,1% HCO2H. Растворитель В: CAN + 0,1% НСО 2 Н. Расход = 1 мл/мин. Градиент: от 95/5 (0 мин) до 0/100 (5,5 мин), до 0/100 (7,5 мин). Детектирование: 220 нМ. Ионизация: ЭСИ+ (ESI+). Метод В. Колонка: Kromasil, 502,1 мм, 3,5 мкм. Растворитель A: CH3CO2NH4 5 мМ. Растворитель В: CAN. Расход = 0,5 мл/мин. Градиент: от 100/0 (0 мин) до 0/100 (13 мин), до 0/100 (16 мин). Детектирование: 220 нМ.-6 016552 Ионизация: ЭСИ+ (ESI+). В столбце "хиральность" "/" обозначает ахиральное соединение и обозначает соединение в форме рацемической смеси. Соединения согласно изобретению явились предметом фармакологических испытаний, давших возможность определить их ингибирующее воздействие на фермент VEGFR-3. Измерение тирозинкиназной активности VEGFR-3 методом ИФА (ELISA). Ферментативную активность VEGFR-3 оценивали по тесту ИФА путем измерения интенсивности фосфорилирования субстрата поли-Glu-Tyr. Действие продуктов определялось количественно концентрацией, которая уменьшала полную активность фермента на 50% (IC50). Для определения IC50 продукт разбавляли в ДМСО в интервале концентраций от 3 до 1000 нМ. Накануне манипуляции 125 мкл субстрата поли-Glu-Tyr (250 мкг/мл в PBS 1, не содержащем ни Са 2+, ни Mg2+, ни бикарбоната натрия) помещали в каждую лунку планшета для ИФА (например, планшета для ИФА из набора SIGMA ProteinTyrosine Kinase Assay, Ref. PTK-101). Затем планшет покрывали клеем и инкубировали в течение ночи при 37 С. На другой день лунки опорожняли путем перевертывания, промывали приблизительно 300 мкл буферного раствора (PBS+0,05% Tween 20) и сушили новым инкубированием планшета в течение 2 ч при 37 С. В каждую лунку помещали 90 мкл реакционной смеси. Эта смесь содержала киназный буфер 1X с добавкой 30 мкМ АТФ и ингибитор в желаемой концентрации. Затем добавляли (за исключением отрицательных контрольных лунок, в которые добавляли 20 мкл буфера без фермента) 20 мкл VEGFR-3TK (Cell signaling, Ref. 7790), предварительно разбавленного в киназном буфере без АТФ. Затем планшеты инкубировали при осторожном перемешивании при комнатной температуре в течение 30 мин. После 3 промывок буферным раствором (300 мкл/лунку за промывку) в каждую лунку добавляли 100 мкл антител анти-фосфотирозин-HPR (1/30000) и планшеты вновь инкубировали в течение 30 мин при комнатной температуре при осторожном перемешивании. После 3 промывок буферным раствором (300 мкл/лунку за промывку) фосфорилирование субстрата выявляли добавлением 100 мкл на лунку субстрата ОФД (OPD),1 пастилка ОФД и 1 пастилка карбамида в 20 мл воды (приготовление непосредственно перед применением и в отсутствие света). После инкубирования в течение 7 мин при комнатной температуре и в отсутствие света реакцию останавливали добавлением 100 мкл 1,25 М (2,5 н.) H2SO4 на лунку и считывали поглощение на 492 нм. Полную активность оценивали по разности оптических плотностей, полученных на образцах, инкубированных в присутствии (стимулированных) и в отсутствие (нестимулированных)VEGFR-3. Соединения согласно изобретению показывали CI50 меньше 10 мкМ, для большей части меньше 1 мкМ. В качестве примеров соединения 4 и 5 таблицы показывают CI50 451 и 343 нМ соответственно. Таким образом, оказалось, что соединения согласно изобретению обладают ингибирующей активностью в отношении фермента VEGFR-3; следовательно, они могут быть использованы для получения лекарственных средств, в частности лекарственных средств, ингибирующих VEGFR-3.-7 016552 Таким образом, согласно другому из его аспектов объектом изобретения являются лекарственные средства, которые содержат соединение формулы (I), или соль присоединения этого последнего с фармацевтически приемлемой кислотой или фармацевтически приемлемым основанием, или гидрат или сольват, а также энантиомер или диастереоизомер, включая их смесь, соединения формулы (I). Другой аспект изобретения включает комбинацию по меньшей мере одного соединения согласно изобретению и по меньшей мере одного химиотерапевтического средства. В самом деле, соединения согласно настоящему изобретению могут быть использованы одни или в смеси по меньшей мере с одним химиотерапевтическим средством, которое может быть выбрано среди алкилирующих средств,интеркалирующих средств,антимикротрубочковых средств,антимитотических средств,антиметаболических средств,антипролиферативных средств,антибиотиков,иммуномодулирующих средств,противовоспалительных средств,ингибиторов киназы,антиангиогенных средств,антиваскулярных средств,эстрогенных и андрогенных гормонов и пролекарств или производных средств, упомянутых выше. Равным образом, можно комбинировать соединения согласно изобретению с лечением путем облучения. Комбинации соединений согласно изобретению с химиотерапевтическими средствами, указанными выше, и/или облучением являются другим объектом настоящего изобретения. Указанные выше химиотерапевтические средства и/или облучение могут быть назначены одновременно, раздельно или последовательно. Лечение будет подбираться практикующим врачом в зависимости от больного, нуждающегося в лечении. Эти лекарственные средства находят применение в терапии, в частности при лечении и профилактике злокачественных опухолей и их метастазов, таких как глиобластомы, множественные миеломы,миелодисплазийные синдромы, саркомы Капоши, солидные опухоли, лимфомы, меланомы, раки молочной железы, колоноректальные раки, раки легких, включая раки не с маленькими клетками, раки поджелудочной железы, раки предстательной железы, раки почек, опухоли головы и шеи, рак печени, раки яичников, раки дыхательного и торакального аппарата, опухолевые ангиогенезы, другие злокачественные опухоли, продуцирующие VEGFR-3 или вовлекающие процесс ангиогенеза или лимфангиогенеза; неонкологических пролиферативных заболеваний и патологических ангиогенезов, связанных сVEGFR-3, таких как артрозы, рестенозы, псориаз, гемангиомы, глаукомы, гломерулонефриты, диабетические нефропатии, нефросклерозы, тромботические микроангиопатические синдромы, циррозы печени,атеросклерозы, отторжения при пересадке органа, заболевания глаз, вовлекающие процессы ангиогенеза или лимфангиогенеза, такие как диабетическая ретинопатия или пятнистое перерождение; или воспалений (хронических или нехронических), инфекций, вызванных микроорганизмами, и аутоиммунных заболеваний, таких как ревматоидный полиартрит; или редких заболеваний, таких как лимфангиолейомиоматоз. Согласно другому из его аспектов настоящее изобретение касается фармацевтических композиций,содержащих в качестве действующего начала соединение согласно изобретению. Эти фармацевтические композиции содержат эффективную дозу по меньшей мере одного соединения согласно изобретению или фармацевтически приемлемой соли, гидрата или сольвата указанного соединения, а также по меньшей мере один фармацевтически приемлемый эксципиент. Указанные эксципиенты выбирают сообразно фармацевтической форме и желаемому способу введения среди обычных эксципиентов, которые известны специалистам в данной области. В фармацевтических композициях согласно настоящему изобретению для перорального, сублингвального, подкожного, внутримышечного, внутривенного, тонического, местного, локального, интратрахеального, интраназального, чрескожного или ректального введения указанное действующее начало формулы (I) или его соль, сольват или возможный гидрат могут быть введены в стандартной лекарственной форме введения, в смеси с классическими фармацевтическими эксципиентами, животным и людям для лечения или профилактики расстройств или болезней, указанных выше.-8 016552 Соответствующие стандартные лекарственные формы включают формы для перорального введения, такие как таблетки, мягкие или твердые желатиновые капсулы, порошки, гранулы и растворы или суспензии для перорального введения, формы для сублингвального, буккального, интратрахеального,внутриглазного, интраназального, ингаляционного введения, формы для местного, чрескожного, подкожного, внутримышечного или внутривенного введения, формы для ректального введения и имплантаты. Для тонического нанесения можно использовать соединения согласно изобретению в форме кремов,гелей, мазей или лосьонов. В качестве примера стандартная лекарственная форма соединения согласно изобретению в виде таблетки может содержать следующие компоненты: Согласно другому из его аспектов настоящее изобретение касается также способа лечения патологий, указанных выше, который заключается во введении пациенту эффективной дозы соединения согласно изобретению, или одной из его фармацевтически приемлемых солей, или одного из его гидратов или сольватов. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение, отвечающее формуле (I) в которой R1 и R2 обозначают, независимо один от другого, атом водорода, (C1-C7)алкильную группу, возможно замещенную одной или несколькими (C1-C7)алкоксигруппами;Y обозначает (C1-C4)алкоксигруппу, группу -NRR', -O(СН 2)n-C(O)-NRR', где R и R' являются такими, как определено ниже, и n представляет собой целое число, равное 1 или 2;R и R' обозначают, независимо один от другого, атом водорода, -СО-(C1-C4)алкил или группу-COOR", где R" обозначает (C1-C4)алкильную группу; в форме основания или соли присоединения с кислотой, а также энантиомера или диастереоизомера, включая их смесь. 2. Соединения по п.1, для которых Y обозначает (C1-C4)алкоксигруппу, в форме основания или соли присоединения с кислотой, а также энантиомера или диастереоизомера, включая их смесь. 3. Соединения по п.1, для которых Y обозначает группу -NRR', где R и R' являются такими, как в п.1, в форме основания или соли присоединения с кислотой, а также энантиомера или диастереоизомера,включая их смесь. 4. Соединения по п.1, для которых Y обозначает группу -О(СН 2)n-С(О)-NRR', где R и R' являются такими, как в п.1, и n представляет собой целое число, равное 1 или 2, в форме основания или соли присоединения с кислотой, а также энантиомера или диастереоизомера, включая их смесь. 5. Соединение по п.1, выбранное из группы, включающей метил 3-[7-амино-8-этил-6-(метилкарбамоил)-5-оксо-5,8-дигидро-1,8-нафтиридин-2-ил]проп-2-ин 1-илкарбамат; хлоргидрат 2-амино-7-(3-амино-3-метилбут-1-ин-1-ил)-1-этил-N-метил-4-оксо-1,4-дигидро-1,8 нафтиридин-3-карбоксамида;-2-амино-7-(3,4-диметокси-3-метилбут-1-ин-1-ил)-1-этил-N-метил-4-оксо-1,4-дигидро-1,8 нафтиридин-3-карбоксамид; 2-амино-7-[3-(2-амино-2-оксоэтокси)-3-метилбут-1-ин-1-ил]-1-этил-N-метил-4-оксо-1,4-дигидро 1,8-нафтиридин-3-карбоксамид; 2-амино-1-этил-7-(3-метоксипроп-1-ин-1-ил)-N-метил-4-оксо-1,4-дигидро-1,8-нафтиридин-3 карбоксамид. 6. Способ получения соединения формулы (I) по любому из пп.1-5, отличающийся тем, что соединение формулы (VII) в которой X обозначает атом галогена и в которой Y, R1 и R2 являются такими, как определено в одном из предыдущих пунктов. 7. Лекарственное средство, отличающееся тем, что оно содержит соединение формулы (I) по любому из пп.1-5, или соль присоединения с фармацевтически приемлемой кислотой этого соединения, или энантиомер или диастереоизомер соединения формулы (I), или их смесь. 8. Фармацевтическая композиция, отличающаяся тем, что она содержит соединение формулы (I) по любому из пп.1-5, или фармацевтически приемлемую соль, или энантиомер или диастереоизомер этого соединения, или их смесь, а также по меньшей мере один фармацевтически приемлемый эксципиент. 9. Комбинация по меньшей мере одного соединения формулы (I) по любому из пп.1-5 по меньшей мере с одним химиотерапевтическим средством, выбранным среди алкилирующих средств,интеркалирующих средств,антимикротрубочковых средств,антимитотических средств,антиметаболических средств,антипролиферативных средств,антибиотиков,иммуномодулирующих средств,противовоспалительных средств,ингибиторов киназы,антиангиогенных средств,антиваскулярных средств,эстрогенных и андрогенных гормонов,для лечения или профилактики злокачественных опухолей и их метастазов, таких как глиобластомы, множественные миеломы,миелодисплазийные синдромы, саркомы Капоши, солидные опухоли, лимфомы, меланомы, раки молочной железы, колоноректальные раки, раки легких, включая раки не с маленькими клетками, раки поджелудочной железы, раки предстательной железы, раки почек, опухоли головы и шеи, рак печени, раки яичников, раки дыхательного и торакального аппарата, опухолевые ангиогенезы, другие злокачественные опухоли, продуцирующие VEGFR-3 или вовлекающие процесс ангиогенеза или лимфангиогенеза; неонкологических пролиферативных заболеваний и патологических ангиогенезов, связанных сVEGFR-3, таких как артрозы, рестенозы, псориаз, гемангиомы, глаукомы, гломерулонефриты, диабетические нефропатии, нефросклерозы, тромботические микроангиопатические синдромы, циррозы печени,атеросклерозы, отторжения при пересадке органа, заболевания глаз, вовлекающие процессы ангиогенеза или лимфангиогенеза, такие как диабетическая ретинопатия или пятнистое перерождение; воспалений (хронических или нехронических), инфекций, вызванных микроорганизмами, и аутоиммунных заболеваний, таких как ревматоидный полиартрит; или редких заболеваний, таких как лимфангиолейомиоматоз. 10. Применение соединения формулы (I) по любому из пп.1-5 для получения лекарственного средства, предназначенного для лечения заболеваний, в которых участвует VEGFR-3. 11. Применение соединения формулы (I) по любому из пп.1-5 для получения лекарственного средства, предназначенного для лечения и/или профилактики злокачественных опухолей и их метастазов. 12. Применение соединения формулы (I) по п.11 для получения лекарственного средства, предназначенного для лечения и/или профилактики глиобластом, множественных миелом, миелодисплазийных синдромов, сарком Капоши, кожных ангиосарком, солидных опухолей, лимфом, меланом, рака молочной железы, колоноректального рака, рака легких, включая немелкоклеточный рак, рака поджелудочной железы, рака предстательной железы, рака почек, опухолей головы и шеи, рака печени, рака яичников, рака дыхательного и торакального аппарата, других злокачественных опухолей, продуцирующих VEGFR-3 или вовлекающих процесс ангиогенеза или лимфангиогенеза. 13. Применение соединения формулы (I) по любому из пп.1-5 для получения лекарственного средства, предназначенного для лечения и/или профилактики неонкологических пролиферативных заболеваний и патологических ангиогенезов, связанных с VEGFR-3. 14. Применение соединения формулы (I) по п.13 для получения лекарственного средства, предна- 10016552 значенного для лечения и/или профилактики таких заболеваний, как артрозы, рестенозы, псориаз, гемангиомы, лимфангиомы, глаукомы, гломерулонефриты, диабетические нефропатии, нефросклерозы, тромботические микроангиопатические синдромы, циррозы печени, атеросклерозы, отторжения при пересадке органа, заболевания глаз, вовлекающие процессы ангиогенеза или лимфангиогенеза. 15. Применение соединения формулы (I) по любому из пп.1-5 для получения лекарственного средства, предназначенного для лечения и/или профилактики хронических или нехронических воспалений,инфекций, вызванных микроорганизмами, и ревматоидного полиартрита. 16. Применение соединения формулы (I) по любому из пп.1-5 для получения лекарственного средства, предназначенного для лечения и/или профилактики лимфангиолейомиоматоза.
МПК / Метки
МПК: C07D 403/02, C07D 471/02, A61P 35/00, C07D 401/02, A61K 31/495
Метки: производные, терапии, применение, 7-алкинил-1,8-нафтиридонов, получение
Код ссылки
<a href="https://eas.patents.su/12-16552-proizvodnye-7-alkinil-18-naftiridonov-ih-poluchenie-i-ih-primenenie-v-terapii.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 7-алкинил-1,8-нафтиридонов, их получение и их применение в терапии</a>
Предыдущий патент: Способ получения спирта из углеродсодержащего сырья
Следующий патент: Упаковка для жидких продуктов
Случайный патент: Крышка ёмкости, предназначенной главным образом для напитков












