Азабициклоалкановые производные, их получение и их применение в терапии
Номер патента: 17802
Опубликовано: 29.03.2013
Авторы: Локхед Алистер, Словински Франк, Леклерк Одиль, Ваше Жюльен, Бен Аяд Омар, Саади Мурад
Формула / Реферат
1. Соединение формулы (I)
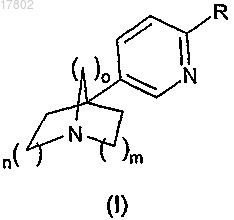
в которой
R означает либо атом водорода или галогена;
либо гидроксил, (C1-C6) алкокси, (С3-С7) циклоалкил-О- или (С3-С7) циклоалкил-(C1-C3) алкилен-О-;
либо гетероциклоалкильную, арильную или гетероарильную группу;
причем эта группа необязательно может быть замещена одной или несколькими группами, выбираемыми из атомов галогенов, (C1-C6) алкила, (С3-С7) циклоалкила, (С3-С7) циклоалкил -(C1-C3) алкилена, (C1-C6) алкокси, (С3-С7) циклоалкил-О-, (С3-С7) циклоалкил-(C1-C3) алкилен-О-, (C1-C6) фторалкила, (C1-С6) фторалкокси, нитрогруппы, цианогруппы, гидроксила, аминогруппы, (C1-C6) алкиламиногруппы или ди(C1-С6) алкиламиногруппы, гетероциклоалкила, арила, арил-(C1-С6) алкилена, гетероарила, гетероарил-(C1-C6) алкилена, арил-О-, -С(О)-(C1-C6) алкила, причем гетероциклоалкил необязательно замещен -С(О)О(СН3)3;
n означает 1 или 2;
m означает 1 или 2;
о означает 1 или 2;
в виде основания или аддитивной соли кислоты, в виде гидрата или сольвата;
причем случай, где n и о = 1 и m = 2 исключается;
и причем исключаются следующие соединения:
4-(6-фторпиридин-3-ил)-1-азабицикло[2.2.1]гептан;
4-(6-хлорпиридин-3-ил)-1-азабицикло[2.2.1]гептан;
4-(6-бромпиридин-3-ил)-1-азабицикло[2.2.1]гептан;
4-(пиридин-3-ил)-1-азабицикло[2.2.1]гептан,
где гетероциклоалкильная группа представляет собой 3-7-членную циклическую группу, содержащую 1-2 гетероатома, выбираемые из О, S или N;
арильная группа представляет собой циклическую ароматическую группу, включающую от 6 до 10 атомов углерода;
гетероарильная группа представляет собой 5-15-членную частично насыщенную или ароматическую циклическую группу, содержащую от 1 до 4 гетероатомов, выбираемых из О, S или N.
2. Соединение формулы (I) по п.1, отличающееся тем, что R означает
либо атом водорода или галогена;
либо гидроксил;
либо гетероциклоалкильную, арильную или гетероарильную группу; причем эта группа необязательно может быть замещена одной или несколькими группами, выбираемыми из атомов галогенов, (C1-C6) алкила, (C1-C6) алкокси, (C1-C6) фторалкила, (C1-С6) фторалкокси, нитрогруппы, цианогруппы, гидроксила, аминогруппы, (C1-C6) алкиламиногруппы или ди(C1-С6) алкиламиногруппы, гетероциклоалкила, арила, арил-(C1-С6) алкилена, гетероарила, арил-О-, -С(О)-(C1-C6) алкила, причем гетероциклоалкил необязательно замещен -С(О)О(СН3)3;
n означает 1 или 2;
m означает 1 или 2;
о означает 1 или 2;
в виде основания или аддитивной соли кислоты, а также в виде гидрата или сольвата.
3. Соединение формулы (I) по п.1 или 2, отличающееся тем, что
R означает
либо атом галогена;
либо гидроксил;
либо гетероциклоалкильную группу, либо арильную группу, либо гетероарильную группу;
причем эта группа необязательно может быть замещена одной или несколькими группами, выбираемыми из атомов галогенов, (C1-C6) алкила, (C1-C6) алкокси, (C1-C6) фторалкила, (C1-C6) фторалкокси, ди(C1-C6) алкиламиногруппы, гетероциклоалкила, арила, арил-(C1-C6) алкилена, гетероарила, арил-О-, -С(О)-(C1-C6) алкила, причем гетероциклоалкил необязательно замещен -С(О)О(СН3)3;
n означает 1 или 2;
m означает 1 или 2;
о означает 1;
в виде основания или аддитивной соли кислоты, а также в виде гидрата или сольвата.
4. Соединение формулы (I) по любому из пп.1-3, отличающееся тем, что n, m и о означают 1; в виде основания или аддитивной соли кислоты, а также в виде гидрата или сольвата.
5. Соединение формулы (I) по любому из пп.1-3, отличающееся тем, что n и m означают 2 и о означает 1; в виде основания или аддитивной соли кислоты, а также в виде гидрата или сольвата.
6. Лекарственное средство, отличающееся тем, что оно включает соединение формулы (I) по любому из пп.1-5 или аддитивную соль фармацевтически приемлемой кислоты этого соединения или его гидрат или сольват.
7. Фармацевтическая композиция, отличающаяся тем, что она включает соединение формулы (I) по любому из пп.1-5 или фармацевтически приемлемую соль, гидрат или сольват этого соединения, а также, по меньшей мере, фармацевтически приемлемый эксципиент.
8. Применение соединения формулы (I) по любому из пп.1-5 для получения лекарственного средства, предназначенного для лечения и предотвращения ухудшений познавательных способностей; расстройств внимания; нарушений исполнительных функций, связанных с болезнью Альцгеймера, патологическим или нормальным старением, болезнью Паркинсона, трисомией 21, психиатрическими патологиями, алкогольным синдромом Корсакова, васкулярными деменциями, черепно-мозговыми травмами; двигательных нарушений, наблюдаемых в случае болезни Паркинсона или других неврологических заболеваний или анатомогистопатологических расстройств, связанных с вышеуказанными нейродегенеративными заболеваниями; рассеянного склероза.
9. Применение соединения формулы (I) по любому из пп.1-5 для получения лекарственного средства, предназначенного для лечения и предотвращения нарушений мозгового кровообращения, гипоксических церебральных кризов, психиатрических патологий.
10. Применение соединения формулы (I) по любому из пп.1-5 для получения лекарственного средства, предназначенного для предотвращения симптомов, возникающих вследствие лишения табака, алкоголя, различных веществ, вызывающих зависимость.
11. Применение соединения формулы (I) по любому из пп.1-5 для получения лекарственного средства, предназначенного для лечения боли.
12. Применение соединения формулы (I) по любому из пп.1-5 для получения лекарственного средства, предназначенного для лечения ишемии нижних конечностей, облитерирующего артериита нижних конечностей, ишемии сердца, инфаркта миокарда, сердечной недостаточности, дефицита заживления кожи больных диабетом пациентов, варикозных язв в случае венозной недостаточности, септических шоков.
13. Применение соединения формулы (I) по любому из пп.1-5 для получения лекарственного средства, предназначенного для лечения воспалительных процессов.
14. Применение соединения формулы (I) по любому из пп.1-5 для получения лекарственного средства, предназначенного для лечения дерматологических патологий, астмы, язвенного неспецифического ректоколита.
Текст
Изобретение относится к соединениям общей формулы (I) в которой R означает либо атом водорода или галогена; либо гидроксил, (C1-C6) алкокси, (С 3 С 7) циклоалкил-О- или (С 3-С 7) циклоалкил-(C1-C3) алкилен-О-; либо гетероциклоалкильную,арильную или гетероарильную группу; причем эта группа необязательно может быть замещена одной или несколькими группами, выбираемыми из атомов галогенов, (C1-C6) алкила, (С 3-С 7) циклоалкила, (С 3-С 7) циклоалкил-(C1-С 3) алкилена, (C1-С 6) алкокси, (С 3-С 7) циклоалкил-О-, (С 3-С 7) циклоалкил-(C1-С 3) алкилен-О-, (C1-C6) фторалкила, (C1-C6) фторалкокси,нитрогруппы, цианогруппы, гидроксила, аминогруппы, (C1-C6) алкиламиногруппы или ди (C1-C6) алкиламиногруппы, гетероциклоалкила, арила, арил-(C1-C6)алкилена, гетероарила, гетероарил-(C1C6) алкилена, арил-О-, -С(О)-(C1-C6) алкила, причем гетероциклоалкил может быть необязательно замещен -С(О)О(СН 3)3; n означает 1 или 2; m означает 1 или 2; о означает 1 или 2; в виде основания или аддитивной соли кислоты, а также в виде гидрата или сольвата; способу получения и применению в терапии. Изобретение относится к азабициклоалкановым производным, их получению и их применению в терапии. В Международной патентной публикации WO 03/057697A описываются производные 5-(пиридин 3-ил)-1-азабицикло[3.2.1]октана, лиганды никотиновых рецепторов, которые пригодны при лечении или предотвращении нарушений, связанных с дисфункцией никотиновых рецепторов, особенно на уровне центральной нервной системы. Всегда существует необходимость в обнаружении и получении продуктов, обладающих аффинностью к никотиновым рецепторам. Изобретение соответствует этой цели, предлагая новые соединения, которые обладают аффинностью к никотиновым рецепторам. Объектом настоящего изобретения являются соединения, отвечающие общей формуле (I) в которой R означает либо атом водорода или галогена; либо гидроксил, (C1-C6) алкокси, (С 3-С 7) циклоалкил-О- или (С 3-С 7) циклоалкил-(C1-С 3) алкилен-О-; либо гетероциклоалкильную, арильную или гетероарильную группу; причем эта группа необязательно может быть замещена одной или несколькими группами, выбираемыми из атомов галогенов, (C1C6) алкила, (С 3-С 7) циклоалкила, (С 3-С 7) циклоалкил-(C1-C3) алкилена, (C1-C6) алкокси, (С 3-С 7) циклоалкил-О-, (С 3-С 7) циклоалкил-(C1-C3) алкилен-О-, (C1-C6) фторалкила, (C1-C6) фторалкокси, нитрогруппы,цианогруппы, гидроксила, аминогруппы, (C1-C6) алкиламиногруппы или ди(C1-С 6) алкиламиногруппы,гетероциклоалкила, арила, арил-(C1-С 6) алкилена, гетероарила, гетероарил-(C1-C6) алкилена, арил-О-,-С(О)-(C1-C6) алкила, причем гетероциклоалкил необязательно замещен -С(О)О(СН 3)3;m означает 1 или 2; о означает 1 или 2; причем случай, где n и о = 1 и m = 2 исключается; и причем исключаются следующие соединения: 4-(6-фторпиридин-3-ил)-1-азабицикло[2.2.1]гептан; 4 хлорпиридин-3-ил)-1-азабицикло[2.2.1]гептан; 4-(6-бромпиридин-3-ил)-1-азабицикло[2.2.1]гептан; 4-(пиридин-3-ил)-1-азабицикло[2.2.1]гептан. 4-(6-фторпиридин-3-ил)-1-азабицикло[2.2.1]гептан,4-(6-хлорпиридин-3-ил)-1-азабицикло[2.2.1]гептан,4-(6-бромпиридин-3-ил)-1-азабицикло [2.2.1] гептан и 4-(пиридин-3-ил)-1-азабицикло[2.2.1]гептан описываются в Международной патентной публикацииWO95/03306A как артроподицидные соединения. Соединения формулы (I) могут включать один или несколько стереогенных центров, как, например,один или несколько асимметрических атомов углерода. Следовательно, они могут существовать в форме энантиомеров или диастереоизомеров. Эти энантиомеры, диастереоизомеры, а также их смеси, включая рацемические смеси, составляют часть изобретения. Соединения формулы (I) также могут существоваться в виде оснований или аддитивных солей кислот. Такие аддитивные соли составляют часть изобретения. Эти соли могут быть получены с фармацевтически приемлемыми кислотами, однако, соли других кислот, пригодные, например, для очистки или выделения соединений формулы (I), также составляют часть изобретения. Соединения формулы (I) могут существовать в форме гидратов или сольватов, а именно, в форме ассоциаций или комбинаций с одной или несколькими молекулами воды или с растворителем. Такие гидраты и сольваты также составляют часть изобретения. В рамках настоящего изобретения: под обозначением (Ct-Cz) , где t и z могут принимать значения от 1 до 7, понимают углеродную цепь, которая может включать от t до z атомов углерода, например, (C1-C3) означает углеродную цепь,которая может включать от 1 до 3 атомов углерода; под атомом галогена понимают атом фтора, хлора, брома или иода; под алкилом понимают линейную или разветвленную насыщенную алифатическую группу. В качестве примеров можно назвать группы: метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, пентил и т.д.; под алкокси понимают радикал -О-алкил, алкильная группа которого представляет собой такую, как указанная выше; под алкиленом понимают линейную или разветвленную насыщенную двухвалентную алкильную группу, например, C1-3-алкилен означает линейную или разветвленную двухвалентную углеродную цепь из 1-3 атомов углерода, например, метилен, этилен, 1-метилэтилен, пропилен; под циклоалкилом понимают циклическую углеродную группу. В качестве примера можно назвать группы: циклопропил, циклобутил, циклопентил, циклогексил, и т.д.; под фторалкилом понимают алкил, один или несколько атомов водорода в котором заменены атомом фтора; под фторалкокси понимают алкокси, один или несколько атомов водорода в котором заменены атомом фтора; под гетероциклоалкилом понимают 3-7-членную циклическую группу, содержащую 1-2 гетероатома, выбираемые из О, S или N; в качестве примеров гетероциклоалкилов можно назвать группы: пирролидинил, пиперазинил, морфолинил; под арилом понимают циклическую ароматическую группу, включающую от 6 до 10 атомов углерода. В качестве примеров арильных групп можно назвать фенил или нафтил; под гетероарилом понимают 5-15-членную частично насыщенную или ароматическую циклическую группу, содержащую от 1 до 4 гетероатомов, выбираемых из О, S или N. В качестве примера можно назвать группы: индолил, фурил, пирролил, тиазолил, пиразолил, пиридинил, пиримидинил, бензодиоксолил, бензофурил, бензотиенил, бензоксадиазолил, бензотриазолил, хинолинил, изохинолинил, дибензофурил, дибензотиенил, имидазолил, триазолил, тетразолил, оксазолил, оксадиазолил, тиадиазолил, тиенил, изоксазолил, изотиазолил. Среди соединений формулы (I), объектов изобретения, первая подгруппа соединений образована соединениями, в которых:R означает либо атом водорода или галогена; либо гидроксил; либо гетероциклоалкильную, арильную или гетероарильную группу; причем эта группа необязательно может быть замещена одной или несколькими группами, выбираемыми из атомов галогенов, (C1C6) алкила, (C1-C6) алкокси, (C1-C6) фторалкила, (C1-C6) фторалкокси, нитрогруппы, цианогруппы, гидроксила, аминогруппы, (C1-C6) алкиламиногруппы или ди(C1-С 6) алкиламиногруппы, гетероциклоалкила,арила, арил-(C1-С 6) алкилена, гетероарила, арил-О-, -С(О)-(C1-C6) алкила, причем гетероциклоалкил необязательно замещен -С(О)О(СН 3)3;m означает 1 или 2; о означает 1 или 2. Среди соединений формулы (I), объектов изобретения, вторая подгруппа соединений образована соединениями, в которых:R означает либо атом галогена, более конкретно, атом хлора; либо гидроксил; либо гетероциклоалкил, более конкретно, пирролдинил или пиперазинил, либо арил, более конкретно, фенил или нафтил, либо гетероарил, более конкретно, пиразолил, индолил, пиридинил, бензофурил, хинолинил, бензотиенил, фурил, дибензофурил, пирролил, пиримидинил, бензотриазолил, дибензотиенил, бензоксадиазолил, тиазолил или изохинолинил; причем эта группа, необязательно может быть замещена одной или несколькими группами, более конкретно, одной или двумя группами, выбираемыми из атомов галогенов, более конкретно, атома фтора, (C1-C6) алкила, более конкретно, метила, (C1-C6) алкокси, более конкретно, метоксигруппы, (C1-C6) фторалкила, более конкретно, трифторметила, (C1-C6) фторалкокси, более конкретно, трифторметоксигруппы, ди (C1-C6) алкиламиногруппы, более конкретно,диметиламиногруппы, гетероциклоалкила, более конкретно, морфолинила, пирролидинила или пиперазинила, арила, более конкретно, фенила, арил-(C1-C6)алкилена, более конкретно, бензила, гетероарила,более конкретно, пиразолила, арил-О-, более конкретно, феноксигруппы, -С(О)-(C1-C6) алкила, более конкретно, -С(О)-СН 3; причем гетероциклоалкил необязательно замещен -С(О)О(СН 3)3;m означает 1 или 2; о означает 1. Среди соединений формулы (I), объектов изобретения, и второй подгруппы, указанной выше, третья подгруппа соединений образована соединениями, в которых n и m, и о означают 1. Среди соединений формулы (I), объектов изобретения, и второй подгруппы, указанной выше, четвертая подгруппа соединений образована соединениями, в которых n и m означают 2, и о означает 1. Из соединений формулы (I), объектов изобретения, можно назвать, в частности, следующие соединения: 1. 4-[6-(1-метил-1 Н-пиразол-4-ил)пиридин-3-ил]-1-азабицикло[2.2.1]гептан; 2. 5-[6-(1-метил-1 Н-пиразол-4-ил)пиридин-3-ил]-1-азабицикло[3.3.1]нонан; 3. 5-[6-(3,4-диметоксифенил)пиридин-3-ил]-1-азабицикло[3.3.1]нонан; 66. 5-[6-(2,4-диметоксипиримидин-5-ил)пиридин-3-ил]-1-азабицикло[3.3.1]нонан; 67. 5-[5-(1-азабицикло[3.3.1]нон-5-ил)пиридин-2-ил]-2,1,3-бензоксадиазол; 68. 5-(6-фенилпиридин-3-ил)-1-азабицикло[3.3.1]нонан; 69. 5-[6-(2,5-диметоксифенил)пиридин-3-ил]-1-азабицикло[3.3.1]нонан; 70. 5-6-[4-(трифторметил)фенил]пиридин-3-ил-1-азабицикло[3.3.1]нонан; 71. 5-(1-азабицикло[3.3.1]нон-5-ил)-4'-метокси-2,3'-бипиридин; 72. 4-[5-(1-азабицикло[3.3.1]нон-5-ил)пиридин-2-ил]изохинолин; 73. 5-6-[3,5-бис(трифторметил)фенил]пиридин-3-ил-1-азабицикло[3.3.1]нонан; 74. 5-[6-(тиазол-2-ил)пиридин-3-ил]-1-азабицикло[3.3.1]нонан; 75. 5-[6-(4-феноксифенил)пиридин-3-ил]-1-азабицикло[3.3.1]нонан; 76. 5-[6-(2-фторфенил)пиридин-3-ил]-1-азабицикло[3.3.1]нонан; 77. 5-(1-азабицикло[3.3.1]нон-5-ил)-6'-пирролидин-1-ил-2,3'-бипиридин; 78. трет-бутил-4-[5-(1-азабицикло[3.3.1]нон-5-ил)-2,3'-бипиридин-6'-ил]пиперазин-1-карбоксилат; 79. 5-[6-(2-метоксифенил)пиридин-3-ил]-1-азабицикло[3.3.1]нонан; 80. 5-[6-(2,4-диметоксифенил)пиридин-3-ил]-1-азабицикло[3.3.1]нонан; 81. 5-6-[3-(трифторметокси)фенил]пиридин-3-ил-1-азабицикло[3.3.1]нонан; 82. 3-[5-(1-азабицикло[3.3.1]нон-5-ил)пиридин-2-ил]-N,N-диметиламинофенил; 83. 4-[5-(1-азабицикло[2.2.1]гепт-4-ил)пиридин-2-ил]изохинолин; 84. 5-[5-(1-азабицикло[2.2.1]гепт-4-ил)пиридин-2-ил]изохинолин; 85. 4-(6-фенилпиридин-3-ил)-1-азабицикло[2.2.1]гептан; 86. 4-6-[3.5-бис(трифторметил)фенил]пиридин-3-ил-1-азабицикло[2.2.1]гептан; 87. 5-(1-азабицикло[2.2.1]гепт-4-ил)-4'-метокси-2,3'-бипиридин; 88. трет-бутил-4-[5-(1-азабицикло[2.2.1]гепт-4-ил)-2,3'-бипиридин-6'-ил]пиперазин-1-карбоксилат; 89. 5-[5-(1-азабицикло[3.3.1]нон-5-ил)пиридин-2-ил]изохинолин; 90. 5-(1-азабицикло[2.2.1]гепт-4-ил)-6'-фтор-2,3'-бипиридин; 91. 5-(1-азабицикло[3.3.1]нон-5-ил)-2'-фтор-2,3'-бипиридин; 92. 4-[6-(2-метоксифенил)пиридин-3-ил]-1-азабицикло[2.2.1]гептан; 93. 4-[6-(2,4-диметоксифенил)пиридин-3-ил]-1-азабицикло[2.2.1]гептан; 94. 4-[6-(2,5-диметоксифенил)пиридин-3-ил]-1-азабицикло[2.2.1]гептан; 95. 4-[6-(2-фторфенил)пиридин-3-ил]-1-азабицикло[2.2.1]гептан; 96. 4-[6-(4-метоксифенил)пиридин-3-ил]-1-азабицикло[2.2.1]гептан; 97. 4-[6-(2-нафтил)пиридин-3-ил]-1-азабицикло[2.2.1]гептан; 98. 4-[6-(4-феноксифенил)пиридин-3-ил]-1-азабицикло[2.2.1]гептан; 99. 4-6-[2-(трифторметил)фенил]пиридин-3-ил-1-азабицикло[2.2.1]гептан; 100. 5-[6-(2-нафтил)пиридин-3-ил]-1-азабицикло[3.3.1]нонан; 101. 5-(1-азабицикло[2.2.1]гепт-4-ил)-2'-фтор-2,3'-бипиридин; 102. 5-(1-азабицикло[3.3.1]нон-5-ил)-6'-фтор-2,3'-бипиридин; 103. 4-[6-(3-трифторметоксифенил)пиридин-3-ил]-1-азабицикло[2.2.1]гептан; 104. 5-[5-(1-азабицикло[3.3.1]нон-5-ил)пиридин-2-ил]хинолин; 105. 5-[6-(2-фторбифенил-4-ил)пиридин-3-ил]-1-азабицикло[3.3.1]нонан; 106. 1-3-[5-(1-азабицикло[3.3.1]нон-5-ил)пиридин-2-ил]фенилэтанон; 107. 1-3-[5-(1-азабицикло[2.2.1]гепт-4-ил)пиридин-2-ил]фенилэтанон; 108. 4-(6-(4-метилфенил)пиридин-3-ил)-1-азабицикло[2.2.1]гептан; 109. 4-[6-(2-фторбифенил-4-ил)пиридин-3-ил]-1-азабицикло[2.2.1]гептан; 110. 5-[5-(1-азабицикло[2.2.1]гепт-4-ил)пиридин-2-ил]хинолин; 111. 4-[6-(3-метоксифенил)пиридин-3-ил]-1-азабицикло[2.2.1]гептан; 112. 4-[6-(3,4-дифторфенил)пиридин-3-ил]-1-азабицикло[2.2.1]гептан; 113. 4-[6-(3-пиразол-1-илфенил)пиридин-3-ил]-1-азабицикло[2.2.1]гептан. В нижеследующем контексте, под защитной группой понимают группу, которая позволяет, с одной стороны, защищать реакционно-способную функциональную группу, такую, как гидроксил или амин, во время синтеза и, с другой стороны, регенерировать интактную реакционно-способную функциональную группу в конце синтеза. Примеры защитных групп, а также способы защиты и удаления защиты представлены в руководстве Green et al. "Protective Groups in Organic Synthesis", второе издание (John Wileyand Sons, Inc., Нью-Йорк), 1991. В нижеследующем контексте под удаляемой группой понимают группу, которая может быть легко отщеплена от молекулы путем разрыва гетеролитической связи с разделением электронной пары. Эта группа также может быть легко заменена другой группой, например, во время реакции замещения. Такими удаляемыми группами являются, например, галогены или активированная гидроксильная группа, такая как метансульфонат, бензолсульфонат, п-толуолсульфонат, трифлат, ацетат, и т.д. Примеры удаляемых групп, а также ссылки на их получение представлены в руководстве J. March "Advances in OrganicChemistry", третье издание, Wiley Interscience, 1985, стр. 310-316. Согласно изобретению и в случае, где n и m, и о означают 1, соединения общей формулы (I) можно получать способом, представленным на нижеследующей схеме 1. Соединение формулы (II) вводят во взаимодействие с этилбромацетатом общей формулы (III), в которой R1 означает (C1-С 4)алкил, в присутствии основания, такого как диизопропиламид лития, получая соединение общей формулы (IV). Гидрирование нитрильной функциональной группы в атмосфере водорода при давлении от 1 до 6 атмосфер в присутствии катализатора, такого как, например, никель Ренея,приводит к соединению общей формулы (V). Соединение общей формулы (V) восстанавливают с помощью восстановителя, такого как, например, литийалюминийгидрид, получая соединение формулы (VI). Соединение формулы (VI) превращают в соединение формулы (VII), например, в присутствии концентрированной бромоводородной кислоты. Соединение формулы (VII) в щелочной среде вводят во взаимодействие с основанием, таким как карбонат натрия, получая соединение формулы (VIII). Обработка этого соединения, например, оксихлоридом фосфора, приводит к соединению формулы (IX). Соединения общей формулы (I) затем могут быть получены из соединения формулы (IX) в соответствии с любыми известными специалисту в данной области способами, такими как, например,с помощью бороновой кислоты формулы R-B(OH)2, в которой R имеет указанное в случае общей формулы (I) значение, в присутствии катализатора на основе палладия, как, например, тетракистрифенилфосфинпалладий; с помощью соединения формулы R-H, в которой R имеет указанное в случае общей формулы (I) значение, в присутствии или отсутствии сильного основания, как, например, гидрид натрия, в растворителе, например, в диметилформамиде, или без растворителя; с помощью соединения формулы R-H, в которой R имеет указанное в случае общей формулы (I) значение, в присутствии основания, как, например, трет-бутилат натрия, катализатора на основе палладия, как, например, ацетат палладия(II), и лиганда, как, например, 2-дициклогексилфосфино-2'-(N,Nдиметиламино)бифенил; с помощью содержащего двухвалентное олово производного формулы R-Sn[(СН 2)3 СН 3)]3, в которойR имеет указанное в случае общей формулы (I) значение, в присутствии катализатора на основе палладия, как, например, бис(трифенилфосфин)дихлорпалладий; с помощью соединения формулы R-H, в которой R имеет указанное в случае общей формулы (I) значение, в присутствии н-бутиллития, хлорида цинка и катализатора на основе палладия, как, например,тетракистрифенилфосфинпалладий. Схема 1(I) можно получать способом, представленным на нижеследующей схеме 2. Соединение формулы (II) вводят во взаимодействие с этилакрилатом общей формулы (X), в которой R1 означает (C1-С 4)алкил, в присутствии основания, такого как тритон В, получая соединение общей формулы (XI). Соединение общей формулы (I) получают затем из промежуточных продуктов (XII)-(XVI) согласно стадиям, аналогичным стадиям, позволяющим получатьпромежуточные продукты (IV)-(IX), как описывается выше на схеме 1. Соединение формулы (II) является доступным при использовании способов, описываемых в литературе, как, например, в международной патентной публикации WO2004/111031. На схемах 1 и 2, исходные соединения и реагенты, когда способ их получения не описан, являются коммерчески доступными или описываются в литературе или же могут быть получены способами, которые там описаны или которые известны специалисту в данной области. Соединения общей формулы (I), соответствующие другим значениям n, m и о, могут быть получены путем адаптации способов, представленных на схемах 1 и 2, согласно классическим методам синтеза органической химии, адаптируемым специалистом в данной области. Объектом настоящего изобретения, согласно другому из его аспектов, также являются соединения формул (III)-(XVI). Эти соединения пригодны в качестве промежуточных продуктов синтеза соединений общей формулы (I). В частности, объектом данного изобретения является промежуточный продукт формулы (XVI). В нижеследующих примерах описывается получение некоторых соединений согласно изобретению. Эти примеры не являются ограничивающими объем изобретения и предназначены только для пояснения настоящего изобретения. Номера соединений, указанные в скобках в заголовках, соответствуют таковым,указанным в первой колонке нижеприводимой таблицы, в которой представлены химические структуры и физические свойства некоторых соединений согласно изобретению. Пример 1 (соединение 4). 5-(1-Азабицикло[3.3.1]нон-5-ил)пиридин-2-ол. 1.1. Диэтил-4-циано-4-(6-метоксипиридин-3-ил)гептандиоат. В колбу емкостью 250 мл в атмосфере аргона вводят 2,775 г (18,73 ммоль) (6-метоксипиридин-3 ил)ацетонитрила (WO2004/111031) в 125 мл безводного ацетонитрила. Добавляют 0,87 мл (1,87 ммоль) тритона В (40%-ный раствор в метаноле), реакционную смесь доводят до температуры кипения с обратным холодильником, затем по каплям добавляют 20,40 мл (187,30 ммоль) этилакрилата. Реакционную среду после этого перемешивают при кипячении с обратным холодильником в течение 48 ч, охлаждают до комнатной температуры и концентрируют при пониженном давлении. Таким образом полученный остаток выливают в насыщенный водный раствор хлорида аммония, экстрагируют два раза дихлорметаном. Органические фазы объединяют, сушат над сульфатом натрия, отфильтровывают и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле,элюируя смесью хлороформа, метанола и гидроксида аммония в пропорциях 90/10/1. Получают 7,981 г продукта в виде масла оранжевого цвета. 1 Н-ЯМР (CDCl3; 200 МГц):(м.д.): 8,18 (д, 1 Н); 7,45 (дд, 1 Н); 6,71 (д, 1 Н); 4,00 (кв, 4 Н); 3,87 (с,3H); 2,55-1,97 (м, 8 Н); 1, 14 (т, 6 Н). 1.2. Этил-3-[3-(6-метоксипиридин-3-ил)-6-оксопиперидин-3-ил]-пропаноат. В колбу для гидрирования вводят 1,999 г (5,74 ммоль) диэтил-4-циано-4-(6-метоксипиридин-3 ил)гептандиоата, такого, как полученный на стадии 1.1, в виде раствора в 115 мл этилового спирта, в присутствии 50% в воде никеля Ренея (0,1 экв.). Среду перемешивают при давлении водорода около 5 атмосфер при температуре 60 С в течение 6 ч, затем ее фильтруют через диатомовую землю, и растворитель удаляют путем выпаривания при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, элюируя смесью хлороформа, метанола и гидроксида аммония в пропорциях 90/10/1, с получением 1,231 г желательного соединения в виде воскообразного вещества желтого цвета. 1(кв, 2 Н); 3,96 (с, 3H); 3,80-3,37 (АВ, 2 Н); 2,52-1,88 (м, 8 Н); 1,21 (т, 3H). 1.3. 3-[3-(6-Метоксипиридин-3-ил)пиперидин-3-ил]пропан-1-ол. В колбу емкостью 250 мл при комнатной температуре вводят 2,321 г (7,58 ммоль) этил-3-[3-(6 метоксипиридин-3-ил)-6-оксопиперидин-3-ил]пропаноата, полученного на стадии 1.2, в виде раствора в 128 мл безводного тетрагидрофурана. Добавляют порциями 2,876 г (75,8 ммоль) литийалюминийгидрида, полученную смесь затем перемешивают при комнатной температуре в течение 3 ч. Эту смесь после этого гидролизуют с помощью насыщенного водного раствора сульфата натрия, фильтруют через целит и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, элюируя смесью хлороформа, метанола и гидроксида аммония в пропорциях 90/10/1, с получением 1,80 г желательного соединения в виде воскообразного вещества желтого цвета. 1 Н-ЯМР (CDCl3; 200 МГц):(м.д.): 7,94 (д, 1 Н); 7,37 (дд, 1 Н); 6,57 (д, 1 Н); 3,78 (с, 3H); 3,31 (т, 2 Н); 3,12-2,70 (АВ, 2 Н); 2,65 (т, 2 Н); 2,11 (шир.с, 2 Н); 2,01-0,97 (м, 8 Н). 1.4. Гидробромид (1:1) 5-[3-(3-бромпропил)пиперидин-3 ил] пиридин-2-ола. В герметически закрываемую пробирку вводят 0,100 г (0,4 ммоль) 3-[3-(6-метоксипиридин-3 ил)пиперидин-3-ил]пропан-1-ола, полученного на стадии 1.3, в виде раствора в 5 мл водного раствора бромоводорода (48 мас.% раствор). Реакционную среду перемешивают при температуре 110 С в течение 12 ч. Затем этот раствор приводят обратно к комнатной температуре, концентрируют при пониженном давлении. Полученный остаток два раза растворяют в метаноле и выпаривают при пониженном давлении, растирают в диэтиловом эфире, получая после фильтрации 0,150 г желательного соединения в виде порошка каштанового цвета. Температура плавления: 230 С. 1 Н-ЯМР (D2O; 200 МГц):(м.д.): 7,88 (дд, 1 Н); 7,51 (д, 1 Н); 6,80 (д, 1 Н); 3,65-3,27 (АВ, 2 Н); 3,31 (т,2 Н); 3,24-2,90 (м, 2 Н); 2,32-1,25 (м, 8 Н). 1.5. 5-(1-Азабицикло[3.3.1]нон-5-ил)пиридин-2-ол (соединение 4). В колбу емкостью 250 мл вводят 2,17 г (5,71 ммоль) гидробромида (1:1) 5-[3-(3-бромпропил)пиперидин-3-ил]пиридин-2 ола, полученного на стадии 1.4, в виде раствора в 114 мл хлороформа и 40 мл воды. Добавляют 3,94 г (28,54 ммоль) карбоната натрия, и реакционную смесь перемешивают при температуре 80 С в течение 2 ч. Эту смесь затем приводят обратно к комнатной температуре, выливают в делительную воронку и экстрагируют два раза хлороформом. Органические фазы объединяют, сушат над сульфатом натрия, отфильтровывают и концентрируют при пониженном давлении. Таким образом полученный остаток растирают в диэтиловом эфире, получая после фильтрации и высушивания 0,813 г желательного соединения в виде порошка белого цвета. Температура плавления: 191-192 С. 1 Н-ЯМР (d6-ДМСО; 200 МГц):(м.д.): 7,89 (дд, 1 Н); 7,41 (д, 1 Н); 6,65 (д, 1 Н); 3,70-3,34 (м, 6 Н); 2,70-1,83 (м, 8 Н). Пример 2 (соединение 5). 5-(6-Хлорпиридин-3-ил)-1-азабицикло[3.3.1]нонан. В герметически закрываемую пробирку вводят 1 г (4,59 ммоль) 5-(1-азабицикло[3.3.1]нон-5-ил)пиридин-2-ола, полученного в примере 1, в виде раствора в 12,8 мл (137,7 ммоль) оксихлорида фосфора и затем перемешивают при температуре 140 С в течение 45 мин. Реакционную смесь после этого приводят обратно к комнатной температуре, выливают на 200 г измельченного льда и перемешивают в течение 15 мин. Затем очень медленно реакционную смесь доводят до значения рН 10 с помощью концентрированного раствора гидроксида натрия. Реакционную смесь после этого экстрагируют два раза хлороформом,органические фазы затем объединяют, сушат над сульфатом натрия, фильтруют и концентрируют при пониженном давлении, получая 461 мг желательного соединения в виде порошка каштанового цвета. Температура плавления: 245-246 С. 1H-ЯМР (CDCl3; 200 МГц):(м.д.): 8,29 (д, 1 Н); 7,55 (дд, 1 Н); 7,23 (д, 1 Н); 3,30-3,10 (м, 6 Н); 2,422,00 (м, 4 Н); 1,92-1, 63 (м, 4 Н). Пример 3 (соединение 3). Гидрохлорид (2:1) 5-[6-(3,4-диметоксифенил)пиридин-3-ил]-1 азабицикло[3.3.1]нонана. В колбу емкостью 100 мл вводят 0,055 г (0,23 ммоль) 5-(6-хлорпиридин-3-ил)-1-азабицикло[3.3.1] нонана, полученного в примере 2, в виде раствора в 12 мл смеси 1,2-диметоксиэтан/вода в соотношении 8/4. Затем последовательно в атмосфере аргона вводят 0,106 г (0,58 ммоль) 3,4-диметоксифенилбороновой кислоты, 0,08 г (0,58 ммоль) карбоната калия и 0,024 г (0,03 ммоль) дихлорбис(трифенилфосфин)палладия(II). Смесь нагревают при температуре 110 С в течение 2 ч, охлаждают до комнатной температуры и выливают в 300 мл насыщенного водного раствора карбоната натрия. Водную фазу экстрагируют два раза с помощью 100 мл хлороформа, объединенные органические фазы сушат над сульфатом натрия и концентрируют их при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле, элюируя смесью хлороформа, метанола и гидроксида аммония в пропорциях 90/10/1. Полученное в форме основания соединение (5-[6-(3,4-диметоксифенил)пиридин-3-ил]-1 азабицикло[3.3.1]нонан)превращают в гидрохлорид путем добавления двух эквивалентов хлористого водорода в виде 5-6 н. раствора в изопропиловом спирте. После растирания с помощью диэтилового эфи-7 017802 ра получают 0,035 г ожидаемого продукта в виде порошка желтого цвета. Температура плавления: 235-236 С. 1H-ЯМР (d6-ДМСО)(м.д.): 8,57 (с, 1 Н); 7,84-7,50 (м, 4 Н); 7,01 (д, 1 Н); 3,82 (с, 3H); 3,77 (с, 3H); 3,30 (шир.с, 2 Н); 3,13-2,83 (м, 4 Н); 2,31-1,95 (м, 4 Н); 1,88-1,61 (м, 2 Н); 1,55-1,33 (м, 2 Н). Пример 4 (соединение 15). 5-(1-Азабицикло[2.2.1]гепт-4-ил)пиридин-2-ол. 4.1. Диэтил-3-циано-3-(6-метоксипиридин-3-ил)пентандиоат. В трехгорлую колбу емкостью 100 мл в атмосфере аргона и при температуре -78 С вводят 10,12 мл(20,25 ммоль)диизопропиламида лития в 22 мл безводного тетрагидрофурана. Добавляют 1,00 г (6,75 ммоль) (6-метоксипиридин-3-ил)ацетонитрила (WO2004/111031) в виде раствора в 5 мл безводного тетрагидрофурана. Реакционную смесь затем осторожно доводят до температуры 0 С и перемешивают при этой температуре в течение одного часа. После этого реакционную смесь охлаждают до температуры-78 С и добавляют по каплям 2,25 мл (20,25 ммоль) этилбромацетата. Полученную смесь затем медленно приводят обратно к комнатной температуре, потом выдерживают при перемешивании в течение 12 ч. Реакционную среду после этого выливают в насыщенный водный раствор хлорида аммония, экстрагируют два раза диэтиловым эфиром. Органические фазы объединяют, сушат над сульфатом натрия,фильтруют и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, элюируя смесью циклогексана и этилацетата в пропорциях 90/10. Получают 1,758 г продукта в виде масла каштанового цвета. 1 Н-ЯМР (CDCl3; 200 МГц):(м.д.): 8,08 (д, 1 Н); 7,49 (дд, 1 Н); 6,55 (д, 1 Н); 3,90 (кв, 4 Н); 3,72 (с,3H); 3,11-2,79 (АВ, 4 Н); 0.97 (т, 6 Н). 4. 2. Этил-[3-(6-метоксипиридин-3-ил)-5-оксопирролидин-3-ил]ацетат. В колбу для гидрирования вводят 2,990 г (9,33 ммоль) диэтил-3-циано-3-(6-метоксипиридин-3 ил)пентандиоата, такого, как полученный на стадии 4.1, в виде раствора в 186 мл этилового спирта, в присутствии 50% в воде никеля Ренея (0,1 экв.). Среду перемешивают при давлении водорода около 5 атмосфер при температуре 60 С в течение 6 ч, затем фильтруют через диатомовую землю, и растворитель удаляют путем выпаривания при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, элюируя смесью хлороформа, метанола и гидроксида аммония в пропорциях 90/1/1, с получением 1,5 г желательного соединения в виде воскообразного вещества желтого цвета. 1 Н-ЯМР (CDCl3; 200 МГц):(м.д.): 7,93 (д, 1 Н); 7,37 (дд, 1 Н); 6,66 (д, 1 Н); 6,52 (шир.с, 1 Н); 3,91(кв, 2 Н); 3,85 (с, 3H); 3,84-3,57 (АВ, 2 Н); 2,71 (т, 4 Н); 1,04 (т, 3H). 4.3. 2-[3-(6-Метоксипиридин-3-ил)пирролидин-3-ил]этанол. В колбу емкостью 250 мл вводят при комнатной температуре 1,50 г (5,39 ммоль) этил-[3-(6 метоксипиридин-3-ил)-5-оксопирролидин-3-ил]ацетата, полученного на стадии 4.2, в виде раствора в 90 мл безводного тетрагидрофурана. Добавляют порциями 2,046 г (53,90 ммоль) литийалюминийгидрида, полученную смесь затем перемешивают при комнатной температуре в течение 3 ч. Эту смесь затем гидролизуют с помощью насыщенного водного раствора сульфата натрия, фильтруют через целит и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, элюируя смесью хлороформа, метанола и гидроксида аммония в пропорциях 90/1/1, с получением 0,41 г желательного соединения в виде воскообразного вещества желтого цвета. 1 Н-ЯМР (CDCl3; 200 МГц):(м.д.): 7,95 (д, 1 Н); 7,39 (дд, 1 Н); 6,64 (д, 1 Н); 3,83 (с, 3H); 3,60-2,91 (м,8 Н); 2,09 (т, 2 Н); 1,92-1,64 (м, 2 Н). 4.4. Гидробромид (1:1) 5-[3-(2-бромэтил)пирролидин-3-ил]пиридин-2-ола. В герметически закрываемую пробирку вводят 0,32 г (1,44 ммоль) 2-[3-(6-метоксипиридин-3-ил) пирролидин-3-ил]этанола, полученного на стадии 4.3, в виде раствора в 7,2 мл водного раствора бромистого водорода (48 мас.% раствор). Реакционную смесь перемешивают при температуре 160 С в течение 5 ч. После этого этот раствор приводят обратно к комнатной температуре, концентрируют при пониженном давлении. Получающийся остаток два раза растворяют в метаноле и выпаривают при пониженном давлении,растирают в диэтиловом эфире, получая после фильтрации 0,5 г желательного соединения в виде смолоподобного вещества каштанового цвета. 1(м, 4 Н). 4.5. 5-(1-Азабицикло[2.2.1]гепт-4-ил)пиридин-2-ол (соединение 15). В колбу емкостью 250 мл вводят 1,5 г (4,26 ммоль) гидробромида (1:1) 5-[3-(2-бромэтил) пирролидин-3-ил]пиридин-2-ола, полученного на стадии 4.4, в виде раствора в 85 мл хлороформа и 10 мл воды. Добавляют 2,944 г (21,3 ммоль) карбоната натрия и реакционную смесь перемешивают при температуре 60 С в течение 3 ч. Эту смесь затем приводят обратно к комнатной температуре, выливают в делительную воронку и экстрагируют два раза хлороформом. Органические фазы объединяют, сушат над сульфатом натрия, фильтруют и концентрируют при пониженном давлении. Таким образом полученный остаток растирают в диэтиловом эфире, получая после фильтрации и высушивания 0,265 г желательного соединения в виде порошка каштанового цвета. Температура плавления: 170-172 С. Н-ЯМР (d6-ДМСО; 200 МГц):(м.д.): 7,48 (дд, 1 Н); 7,08 (д, 1 Н); 6,27 (д, 1 Н); 2,94-2,74 (м, 2 Н); 2,65-2,42 (м, 2 Н); 2,35 (с, 2 Н); 1,75-1,50 (м, 2 Н); 1,50-1,33 (м, 2 Н). Пример 5 (соединение 1). Гидрохлорид (2:1) 4-[6-(1-метил-1 Н-пиразол-4-ил)пиридин-3-ил] -1 азабицикло[2.2.1]гептана/ 5.1. 4-(6-Хлорпиридин-3-ил)-1-азабицикло[2.2.1]гептан. В герметически закрываемую пробирку вводят 0,37 г (1,94 ммоль) 5-(1-азабицикло[2.2.1]гепт-4 ил)пиридин-2-ола, полученного в примере 4, в виде раствора в 5,44 мл (58,35 ммоль) оксихлорида фосфора, и затем перемешивают при температуре 140 С в течение 45 минут. Реакционную смесь после этого приводят обратно к комнатной температуре, выливают на 200 г измельченного льда и перемешивают в течение 15 мин. Затем среду очень медленно доводят до значения рН 10 с помощью концентрированного раствора гидроксида натрия. Реакционную смесь затем экстрагируют два раза хлороформом, органические фазы объединяют, сушат над сульфатом натрия, фильтруют и концентрируют при пониженном давлении, получая 370 мг желательного соединения в виде порошка каштанового цвета. Температура плавления: 70-72 С. 1 Н-ЯМР (ДМСО; 200 МГц):(м.д.): 8,36 (д, 1 Н); 7,80 (дд, 1 Н); 7,41 (д, 1 Н); 3,00-2,79 (м, 2 Н); 2,782,49 (м, 2 Н); 2,58 (с, 2 Н); 1,82-1,51 (м, 4 Н). 5.2. Гидрохлорид (2:1) 4-[6-(1-метил-1 Н-пиразол-4-ил)пиридин-3-ил]-1-азабицикло[2.2.1]гептана(соединение 1). В колбу емкостью 100 мл вводят 0,055 г (0,26 ммоль) 4-(6-хлорпиридин-3-ил)-1-азабицикло[2.2.1] гептана, полученного на стадии 5.1, в виде раствора в 12 мл смеси 1,2-диметоксиэтан/вода в соотношении 8/4. Затем последовательно в атмосфере аргона вводят 0,137 г (0,66 ммоль) 1-метил-4-(4,4,5,5 тетраметил-1,3,2-диоксаборолан-2-ил)-1 Н-пиразола, 0,091 г (0,66 ммоль) карбоната калия и 0,028 г (0,04 ммоль) дихлорбис(трифенилфосфин)палладия(II). Смесь нагревают при температуре 110 С в течение 2 часов, охлаждают ее до комнатной температуры и выливают ее в 300 мл насыщенного водного раствора карбоната натрия. Водную фазу экстрагируют два раза с помощью 100 мл хлороформа, объединенные органические фазы сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле, элюируя смесью хлороформа, метанола и гидроксида аммония в пропорциях 90/10/1. Полученное в форме основания соединение (4-[6-(1 метил-1 Н-пиразол-4-ил)пиридин-3-ил]-1-азабицикло[2.2.1]гептан) превращают в гидрохлорид путем добавления двух эквивалентов хлористого водорода в виде 5-6 н. раствора в изопропиловом спирте. После растирания при использовании диэтилового эфира получают 0,053 г (62%) ожидаемого продукта в виде порошка белого цвета. Температура плавления: 281-283 С. 1H-ЯМР (d6-ДМСО)(м.д.): 8,67 (с, 1 Н); 8,55 (д, 1 Н); 8,35 (с, 1 Н); 8,22 (д, 1 Н); 8,04 (д, 1 Н); 3,90 (с,3H); 3,60 (с, 2 Н); 3,55-3,31 (м, 4 Н); 2,31-2,07 (м, 4 Н). Пример 6 (соединение 13). 4-[6-(4-Бензилпиперазин-1-ил)пиридин-3-ил]-1-азабицикло[2.2.1]гептан. В атмосфере аргона в колбу емкостью 50 мл, содержащую 0,036 г (0,37 ммоль) трет-бутилата натрия в виде раствора в 5 мл толуола, предварительно продутых аргоном, вводят 0,055 г (0,32 ммоль) 1 бензилпиперазина. Затем последовательно добавляют в атмосфере аргона 0,06 г (0,29 ммоль) 4-(6 хлорпиридин-3-ил)-1-азабицикло[2.2.1]гептана, полученного на стадии 5.1 примера 5, 0,003 г (0,01 моль) ацетата палладия(II) и 0,011 г (0,03 ммоль) 2-дициклогексилфосфино-2'-(N,N-диметиламино)бифенила. Смесь нагревают при температуре 100 С в течение 3 ч, охлаждают ее до комнатной температуры, разбавляют с помощью 40 мл дихлорметана и выливают в 300 мл насыщенного водного раствора карбоната натрия. Водную фазу экстрагируют два раза с помощью 100 мл дихлорметана, объединенные органические фазы сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле, элюируя смесью хлороформа, метанола и гидроксида аммония в пропорциях 90/10/1. Получают 0,04 г ожидаемого продукта в виде порошка бежевого цвета. Температура плавления: 109-111 С. 1 Н-ЯМР (d6-ДМСО)(м.д.): 8,05 (д, 1 Н); 7,49 (дд, 1 Н); 7,38-7,15 (м, 5 Н); 6,73 (д, 1 Н); 3,50 (с, 2 Н); 3,40 (шир.т, 4 Н); 3,01-2,79 (м, 2 Н); 2,69-2,35 (м, 8 Н); 1,78-1,42 (м, 4 Н). Пример 7 (соединение 29). 4-(6-Пирролидин-1-илпиридин-3-ил)-1-азабицикло[2.2.1]гептан. В герметически закрываемую пробирку, содержащую 0,060 г (0,29 ммоль) 4-(6-хлорпиридин-3-ил)1-азабицикло[2.2.1]гептана, полученного на стадии 5.1 примера 5, добавляют 0,852 г (11,98 ммоль) пирролидина. Смесь нагревают при температуре 130 С в течение 3 ч, охлаждают ее до комнатной температуры, разбавляют с помощью 40 мл толуола и концентрируют при пониженном давлении. Таким образом полученный остаток разбавляют с помощью 50 мл дихлорметана и выливают его в 300 мл насыщенного водного раствора карбоната натрия. Водную фазу экстрагируют два раза с помощью 100 мл дихлорметана, объединенные органические фазы сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле, элюируя смесью хлороформа,1 метанола и гидроксида аммония в пропорциях 85/15/1,5. Получают 0,029 г ожидаемого продукта в виде порошка коричневого цвета. Температура плавления: 119-121 С. 1 Н-ЯМР (d6-ДМСО)(м.д.): 7,99 (д, 1 Н); 7,42 (дд, 1 Н); 6,35 (д, 1 Н); 3,43-3,18 (м, 6 Н); 2,96-2,78 (м,2 Н); 2,62-2,44 (м, 2 Н); 2,00-1,82 (м, 4 Н); 1,75-1,41 (м, 4 Н). Пример 8 (соединение 62). 4-[6-(Тиазол-2-ил)пиридин-3-ил]-1-азабицикло[2.2.1]гептан. В атмосфере аргона в колбу емкостью 50 мл, содержащую 0,055 г (0,26 ммоль) 4-(6-хлорпиридин-3 ил)-1-азабицикло[2.2.1]гептана, полученного на стадии 5.1 примера 5, в виде раствора в 10 мл тетрагидрофурана, последовательно вводят 0,246 г (0,66 ммоль) 2-трибутилстаннилтиазола и 0,055 г (0,08 ммоль) хлорида бис(трифенилфосфин)палладия(II). Смесь кипятят с обратным холодильником в течение 12 ч,охлаждают до комнатной температуры, разбавляют с помощью 40 мл дихлорметана и выливают в 300 мл насыщенного водного раствора хлорида аммония. Водную фазу доводят до значения рН 5 с помощью 1 н. раствора соляной кислоты. Органическую фазу отделяют, затем водную фазу доводят до значения рН 10 с помощью порошкообразного карбоната натрия. Водную фазу экстрагируют два раза с помощью 100 мл дихлорметана, объединенные органические фазы сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле, элюируя смесью хлороформа, метанола и гидроксида аммония в пропорциях 95/5/0,5. Получают 0,038 г ожидаемого продукта в виде порошка белого цвета. Температура плавления: 127-129 С. 1H-ЯМР (d6-ДМСО)(м.д.): 8,60 (д, 1 Н); 8,04 (д, 1 Н); 7,98-7,82 (м, 2 Н); 7,77 (д, 1 Н); 3,02-2,76 (м,2 Н); 2,70-2,33 (м, 4 Н); 1, 90-1, 51 (м, 4 Н). В нижеприводимой табл. 1 представлены химические структуры и физические свойства некоторых примеров соединений согласно изобретению. В колонке "Соль" этой таблицы знак "-" означает соединение в состоянии основания, "HBr" означает гидробромид и "HCl" означает гидрохлорид. Молярные соотношения кислота:основание указываются рядом. "ВОС" означает трет-бутоксикарбонил. Таблица 1 Соединения согласно изобретению составляли объект фармакологических испытаний, которые подчеркнули интерес к ним в качестве активных веществ лекарственных средств. Так, их исследовали в отношении их аффинности к никотиновым рецепторам, содержащим субъединицу 7, согласно методам, описанным Mark и Collins в J. Pharmacol. Exp. Ther., 22, 564 (1982), и Mark и др. в Mol. Pharmacol., 30, 427 (1986). Обезглавливают самцов крыс OFA массой от 150 до 200 г, быстро извлекают весь головной мозг,гомогенизируют его с помощью измельчителя Polytron в 15 объемах 0,32 М раствора сахарозы при температуре 4 С, затем центрифугируют при ускорении 1000 g в течение 10 мин. Осадок после центрифугирования удаляют и супернатант центрифугируют при ускорении 8000 g в течение 20 мин при температуре 4 С. Осадок после центрифугирования рекуперируют и гомогенизируют с помощью измельчителя Polytron в 15 объемах бидистиллированной воды при температуре 4 С, затем центрифугируют его при ускорении 8000 g в течение 20 мин. Осадок после центрифугирования удаляют, и супернатант и слой кожи ("лейкоцитная пленка") центрифугируют при ускорении 40000 g в течение 20 мин. Осадок после центрифугирования рекуперируют, суспендируют в 15 объемах бидистиллированной воды при температуре 4 С и еще раз центрифугируют при ускорении 40000 g в течение 20 мин перед его консервацией при температуре -80 С. В день эксперимента ткань медленно размораживают и суспендируют в 5 объемах буфера. 150 мкл этой мембранной суспензии предварительно инкубируют при температуре 37 С в течение 30 мин, в темноте, в присутствии или в отсутствие тестируемого соединения. Затем мембраны инкубируют в течение 60 мин при температуре 37 С, в темноте, в присутствии 50 мкл 1 нМ [3 Н]бунгаротоксина в конечном объеме 250 мкл буфера 20 мМ HEPES, 0,05% полиэтиленимина. Реакцию прекращают путем фильтрации через фильтры Whatman GF/C, предварительно обработанные в течение 3 часов с помощью 0,05% полиэтиленимина. Фильтры промывают два раза по 5 мл буфера при температуре 4 С и измеряют радиоактивность, удержанную на каждом фильтре, с помощью жидкостной сцинтиграфии. Определяют неспецифическое связывание в присутствии конечного 1 мкМ -бунгаротоксина; неспецифическое связывание составляет около 60% всего связывания, рекуперируемого на фильтре. Для каждой концентрации исследуемого соединения определяют процент ингибирования специфического связывания [3 Н]-бунгаротоксина, затем рассчитывают CI50, концентрацию соединения, которая ингибирует 50% специфического связывания.CI50 наиболее аффинных соединений согласно изобретению составляют от 0,001 мкМ до 1 мкМ. Экспериментальные данные некоторых конкретных соединений представлены в нижеприводимой табл. 2. Таблица 2 Соединения согласно изобретению также исследовали в отношении их аффинности к никотиновым рецепторам, содержащим субъединицу 42, согласно методам, описанным Anderson и Arneric в Eur. J.Pharmacol., 253, 261 (1994), и Hall и др. в Brain Res., 600, 127 (1993). Обезглавливают самцов крыс Sprague Dawley массой от 150 до 200 г, быстро извлекают весь головной мозг, гомогенизируют его в 15 объемах 0,32 М раствора сахарозы при температуре 4 С, затем центрифугируют при ускорении 1000 g в течение 10 минут. Осадок после центрифугирования удаляют и супернатант центрифугируют при ускорении 20000 g в течение 20 мин при температуре 4 С. Осадок после центрифугирования рекуперируют и гомогенизируют с помощью измельчителя Polytron в 15 объемах бидистиллированной воды при температуре 4 С, затем центрифугируют при ускорении 8000 g в течение 20 мин. Осадок после центрифугирования удаляют, и супернатант и слой кожи (лейкоцитная пленка) центрифугируют при ускорении 40000 g в течение 20 мин, осадок после центрифугирования рекуперируют, суспендируют его в 15 объемах бидистиллированной воды и еще раз центрифугируют при ускорении 40000 g перед консервацией при температуре -80 С. В день эксперимента ткань медленно размораживают и суспендируют в 3 объемах буфера. 150 мкл этой мембранной суспензии инкубируют при температуре 4 С в течение 120 мин в присутствии 100 мкл 1 нМ [3 Н]-цитизина в конечном объеме 500 мкл буфера, в присутствии или в отсутствие тестируемого соединения. Реакцию прекращают путем фильтрации через фильтры Whatman GF/B, предварительно обработанные с помощью полиэтиленимина, фильтры промывают два раза по 5 мл буфера при температуре 4 С и измеряют радиоактивность, удержанную на фильтре, с помощью жидкостной сцинтиграфии. Определяют неспецифическое связывание в присутствии 10 мкМ (-)-никотина; неспецифическое связывание составляет 75-85% всего связывания, рекуперируемого на фильтре. Для каждой концентрации исследуемого соединения определяют процент ингибирования специфического связывания [3 Н]-цитизина при дозах 1 мкМ и 10 мкМ. Для наиболее аффинных соединений согласно изобретению рассчитываютCI50 наиболее аффинных соединений согласно изобретению составляют от 0,001 мкМ до 1 мкМ. Соединения согласно изобретению также исследовали в отношении их аффинности к периферическим никотиновым рецепторам ганглионарного типа согласно методу, описанному Houghtling и др. вMol. Pharmacol., 48, 280 (1995). Размораживают бычьи надпочечники, консервированные при температуре -80 С, и гомогенизируют их с помощью измельчителя Polytron в 20 объемах буфера 50 мМ Tris-HCl с рН 7,4 и при температуре 4 С, затем центрифугируют при ускорении 35000 g в течение 10 мин. Супернатант удаляют, и осадок после центрифугирования суспендируют в 30 объемах буфера 50 мМ Tris-HCl при температуре 4 С и повторно гомогенизируют перед повторным центрифугированием при ускорении 35000 g в течение 10 мин. Последний осадок после центрифугирования обрабатывают с помощью 10 объемов буфера Tris-HCl при температуре 4 С. 100 мкл мембраны или 10 мг свежей ткани инкубируют при температуре 24 С в течение 3 ч в присутствии 50 мкл конечного 0,66 нМ [3 Н]-эпибатидина в конечном объеме 250 мкл буфера, в присутствии или в отсутствие тестируемого соединения. Реакцию прекращают путем разбавления образцов буфером 50 мкМ Tris-HCl, рН 7,4, при температуре 4 С, затем фильтруют через фильтрыWhatman GF/C, предварительно обработанные с помощью 0,5% полиэтиленимина в течение 3 ч. Фильтры промывают два раза по 5 мл буфера и измеряют радиоактивность, удержанную на фильтре, с помощью жидкостной сцинтиграфии. Определяют неспецифическое связывание в присутствии конечного 2 мМ (-)-никотина; неспецифическое связывание составляет 30-40% всего связывания, рекуперируемого на фильтре. Для каждой концентрации исследуемого продукта определяют процент ингибирования специфического связывания [3 Н]-эпибатидина, затем рассчитывают CI50, концентрацию соединения, которая ингибирует 50% специфического связывания.CI50 соединений согласно изобретению составляют от 0,001 мкМ до 1 мкМ. Полученные результаты показывают, что некоторые соединения согласно изобретению являются селективными лигандами в отношении субъединицы 7 никотинового рецептора и что другие -в отношении смешанных типов 42 и 7. Эти результаты наводят на мысль об использовании соединений в случае лечения или предотвращения нарушений, связанных с дисфункцией никотиновых рецепторов, особенно на уровне центральной нервной системы, однако, также на уровне периферической системы. Эти нарушения включают ухудшения познавательных способностей, более конкретно, относящиеся к памяти ухудшения (восприимчивость, закрепление и повторение), однако, также расстройства процессов в отношении внимания, и нарушения исполнительных функций, связанные с болезнью Альцгеймера,патологическим старением (Age Associated Memory Impairment, AAMI) или нормальным старениемinfarct dementia, MDI), черепно-мозговыми травмами. Соединения согласно изобретению также могут быть пригодны в случае лечения двигательных нарушений, наблюдаемых при болезни Паркинсона или других неврологических заболеваниях, таких, как хорея Гентингтона, синдром Туретта, поздняя дискинезия и гиперкинезия. Они также могут обладать нейрозащитной терапевтической активностью по отношению к анатомогистопатологическим расстройствам, связанным с вышеуказанными нейродегенеративными заболеваниями. Они также могут быть пригодны для лечения рассеянного склероза. Соединения согласно изобретению также можно назначать для лечебной или симптоматической терапии нарушений мозгового кровообращения и гипоксических церебральных кризов. Они могут быть использованы в случае психиатрических патологий: шизофрения (позитивные и/или негативные симптомы), биполярные расстройства, депрессия, беспокойство, приступы паники, PTSD, нарушения внимания с гиперактивностью (Attention Deficit Hyperactivity Disorder, ADHD), компульсивные и навязчивые поведения. Они могут предупреждать симптомы, возникающие вследствие лишения табака, алкоголя, различных веществ, вызывающих зависимость, таких как кокаин, ЛСД, индийская конопля, бензодиазепины. Они могут быть пригодны в случае лечения боли разного происхождения (включая хронические,невропатические или воспалительные боли). Кроме того, соединения согласно изобретению могут быть использованы для лечения ишемии нижних конечностей, облитерирующего артериита нижних конечностей (PAD: периферическое артериальное заболевание), ишемии сердца (стабильный ишемический синдром), инфаркта миокарда, сердечной недостаточности, дефицита заживления кожи больных диабетом пациентов, варикозных язв в случае венозной недостаточности, септических шоков. Соединения согласно изобретению также могут быть использованы для лечения воспалительных процессов различного происхождения, как, в частности, касающиеся центральной нервной системы воспаления, воспаление легких, связанное с аллергиями или астмой, пародонтит, саркоидоз, панкреатит,повреждения за счет реперфузии, ревматоидный полиартрит. Соединения согласно изобретению также могут быть пригодны в случае лечения дерматологических патологий, таких, как псориаз, и в случае лечения астмы. Соединения согласно изобретению также могут быть использованы для лечения язвенного неспецифического ректоколита. Соединения согласно изобретению, следовательно, могут быть использованы для получения лекарственных средств, в особенности, лекарственных средств, пригодных для лечения или предотвращения нарушений, связанных с дисфункцией никотиновых рецепторов, в частности, вышеуказанных нарушений. Таким образом, объектом данного изобретения, согласно другому из его аспектов, являются лекарственные средства, которые включают соединение формулы (I) или аддитивную соль данного соединения с фармацевтически приемлемой кислотой или гидрат или сольват соединения формулы (I). Эти лекарственные средства находят свое применение в терапии, в особенности, в случае лечения или предотвращения нарушений, связанных с дисфункцией никотиновых рецепторов, в частности, вышеуказанных нарушений. Согласно другому из его аспектов настоящее изобретение относится к фармацевтическим композициям, включающим, в качестве действующего начала, соединение согласно изобретению. Эти фармацевтические композиции содержат эффективную дозу по меньшей мере одного соединения согласно изобретению или фармацевтически приемлемой соли, гидрата или сольвата вышеуказанного соединения, а также по меньшей мере один фармацевтически приемлемый эксципиент. Вышеуказанные эксципиенты выбирают, в зависимости от фармацевтической формы и желательного способа введения, среди обычных эксципиентов, которые известны специалисту в данной области. В случае фармацевтических композиций согласно настоящему изобретению, для перорального,сублингвального, подкожного, внутримышечного, внутривенного, локального, топического, интратрахеального, интраназального, трансдермального или ректального введения, действующее начало вышеприведенной формулы (I) или его возможная(ный) соль, сольват или гидрат могут быть введены в разовой форме введения, в смеси с классическими фармацевтическими эксципиентами, животным и людям для профилактики или лечения вышеуказанных нарушений или заболеваний. Соответствующие разовые формы введения включают пероральные формы, такие, как таблетки,мягкие и твердые желатиновые капсулы, порошки,гранулы и пероральные растворы или суспензии, сублингвальные, буккальные, интратрахеальные, внутриглазные, интраназальные формы введения, формы введения путем ингаляции, локальные, трансдермальные, подкожные, внутримышечные или внутривенные формы введения, формы введения ректальным путем и имплантаты. Для локального применения можно использовать соединения согласно изобретению в кремах, гелях, мазях или лосьонах. В качестве примера, разовая форма введения соединения согласно изобретению в форме таблетки может включать следующие ингредиенты: Вышеуказанные разовые формы дозируются для возможности суточного введения от 0,01 мг до 20 мг действующего начала на кг массы тела, в зависимости от галеновой формы. Могут встречаться особые случаи, которые соответствуют более высоким или более незначительным дозировкам; такие дозировки не входят в рамки настоящего изобретения. Согласно обычной практике соответствующую каждому пациенту дозировку определяет врач в зависимости от способа введения, веса и ответной реакции вышеуказанного пациента. Настоящее изобретение согласно другому из его аспектов также относится к способу лечения вышеуказанных патологий, который включает введение пациенту эффективной дозы соединения согласно изобретению или одной (одного) из его фармацевтически приемлемых солей или гидратов или сольватов. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы (I)R означает либо атом водорода или галогена; либо гидроксил, (C1-C6) алкокси, (С 3-С 7) циклоалкил-О- или (С 3-С 7) циклоалкил-(C1-C3) алкилен-О-; либо гетероциклоалкильную, арильную или гетероарильную группу; причем эта группа необязательно может быть замещена одной или несколькими группами, выбираемыми из атомов галогенов, (C1-C6) алкила, (С 3-С 7) циклоалкила, (С 3-С 7) циклоалкил -(C1-C3) алкилена,(C1-C6) алкокси, (С 3-С 7) циклоалкил-О-, (С 3-С 7) циклоалкил-(C1-C3) алкилен-О-, (C1-C6) фторалкила, (C1 С 6) фторалкокси, нитрогруппы, цианогруппы, гидроксила, аминогруппы, (C1-C6) алкиламиногруппы или ди(C1-С 6) алкиламиногруппы, гетероциклоалкила, арила, арил-(C1-С 6) алкилена, гетероарила, гетероарил(C1-C6) алкилена, арил-О-, -С(О)-(C1-C6) алкила, причем гетероциклоалкил необязательно замещен С(О)О(СН 3)3;m означает 1 или 2; о означает 1 или 2; в виде основания или аддитивной соли кислоты, в виде гидрата или сольвата; причем случай, где n и о = 1 и m = 2 исключается; и причем исключаются следующие соединения: 4-(6-фторпиридин-3-ил)-1-азабицикло[2.2.1]гептан; 4-(6-хлорпиридин-3-ил)-1-азабицикло[2.2.1]гептан; 4-(6-бромпиридин-3-ил)-1-азабицикло[2.2.1]гептан; 4-(пиридин-3-ил)-1-азабицикло[2.2.1]гептан,где гетероциклоалкильная группа представляет собой 3-7-членную циклическую группу, содержащую 1-2 гетероатома, выбираемые из О, S или N; арильная группа представляет собой циклическую ароматическую группу, включающую от 6 до 10 атомов углерода; гетероарильная группа представляет собой 5-15-членную частично насыщенную или ароматическую циклическую группу, содержащую от 1 до 4 гетероатомов, выбираемых из О, S или N. 2. Соединение формулы (I) по п.1, отличающееся тем, что R означает либо атом водорода или галогена; либо гидроксил; либо гетероциклоалкильную, арильную или гетероарильную группу; причем эта группа необязательно может быть замещена одной или несколькими группами, выбираемыми из атомов галогенов, (C1C6) алкила, (C1-C6) алкокси, (C1-C6) фторалкила, (C1-С 6) фторалкокси, нитрогруппы, цианогруппы, гидроксила, аминогруппы, (C1-C6) алкиламиногруппы или ди(C1-С 6) алкиламиногруппы, гетероциклоалкила,арила, арил-(C1-С 6) алкилена, гетероарила, арил-О-, -С(О)-(C1-C6) алкила, причем гетероциклоалкил не- 17017802m означает 1 или 2; о означает 1 или 2; в виде основания или аддитивной соли кислоты, а также в виде гидрата или сольвата. 3. Соединение формулы (I) по п.1 или 2, отличающееся тем, чтоR означает либо атом галогена; либо гидроксил; либо гетероциклоалкильную группу, либо арильную группу, либо гетероарильную группу; причем эта группа необязательно может быть замещена одной или несколькими группами, выбираемыми из атомов галогенов, (C1-C6) алкила, (C1-C6) алкокси, (C1-C6) фторалкила, (C1-C6) фторалкокси,ди(C1-C6) алкиламиногруппы, гетероциклоалкила, арила, арил-(C1-C6) алкилена, гетероарила, арил-О-, С(О)-(C1-C6) алкила, причем гетероциклоалкил необязательно замещен -С(О)О(СН 3)3;m означает 1 или 2; о означает 1; в виде основания или аддитивной соли кислоты, а также в виде гидрата или сольвата. 4. Соединение формулы (I) по любому из пп.1-3, отличающееся тем, что n, m и о означают 1; в виде основания или аддитивной соли кислоты, а также в виде гидрата или сольвата. 5. Соединение формулы (I) по любому из пп.1-3, отличающееся тем, что n и m означают 2 и о означает 1; в виде основания или аддитивной соли кислоты, а также в виде гидрата или сольвата. 6. Лекарственное средство, отличающееся тем, что оно включает соединение формулы (I) по любому из пп.1-5 или аддитивную соль фармацевтически приемлемой кислоты этого соединения или его гидрат или сольват. 7. Фармацевтическая композиция, отличающаяся тем, что она включает соединение формулы (I) по любому из пп.1-5 или фармацевтически приемлемую соль, гидрат или сольват этого соединения, а также,по меньшей мере, фармацевтически приемлемый эксципиент. 8. Применение соединения формулы (I) по любому из пп.1-5 для получения лекарственного средства, предназначенного для лечения и предотвращения ухудшений познавательных способностей; расстройств внимания; нарушений исполнительных функций, связанных с болезнью Альцгеймера, патологическим или нормальным старением, болезнью Паркинсона, трисомией 21, психиатрическими патологиями, алкогольным синдромом Корсакова, васкулярными деменциями, черепно-мозговыми травмами; двигательных нарушений, наблюдаемых в случае болезни Паркинсона или других неврологических заболеваний или анатомогистопатологических расстройств, связанных с вышеуказанными нейродегенеративными заболеваниями; рассеянного склероза. 9. Применение соединения формулы (I) по любому из пп.1-5 для получения лекарственного средства, предназначенного для лечения и предотвращения нарушений мозгового кровообращения, гипоксических церебральных кризов, психиатрических патологий. 10. Применение соединения формулы (I) по любому из пп.1-5 для получения лекарственного средства, предназначенного для предотвращения симптомов, возникающих вследствие лишения табака, алкоголя, различных веществ, вызывающих зависимость. 11. Применение соединения формулы (I) по любому из пп.1-5 для получения лекарственного средства, предназначенного для лечения боли. 12. Применение соединения формулы (I) по любому из пп.1-5 для получения лекарственного средства, предназначенного для лечения ишемии нижних конечностей, облитерирующего артериита нижних конечностей, ишемии сердца, инфаркта миокарда, сердечной недостаточности, дефицита заживления кожи больных диабетом пациентов, варикозных язв в случае венозной недостаточности, септических шоков. 13. Применение соединения формулы (I) по любому из пп.1-5 для получения лекарственного средства, предназначенного для лечения воспалительных процессов. 14. Применение соединения формулы (I) по любому из пп.1-5 для получения лекарственного средства, предназначенного для лечения дерматологических патологий, астмы, язвенного неспецифического ректоколита.
МПК / Метки
МПК: A61K 31/4748, C07D 471/08, C07D 487/08, A61P 25/00, A61P 9/00, A61P 29/00
Метки: терапии, применение, азабициклоалкановые, производные, получение
Код ссылки
<a href="https://eas.patents.su/19-17802-azabicikloalkanovye-proizvodnye-ih-poluchenie-i-ih-primenenie-v-terapii.html" rel="bookmark" title="База патентов Евразийского Союза">Азабициклоалкановые производные, их получение и их применение в терапии</a>
Предыдущий патент: Пестицидная композиция, содержащая фосетил-алюминий, пропамокарб-hcl и инсектицидно активное вещество
Следующий патент: Система экспрессии
Случайный патент: Способ прямого непрерывного изготовления полых тел из полимерного расплава












