Производные плевромутилина и их применение в качестве антимикробных средств
Формула / Реферат
1. Соединение формулы (I)
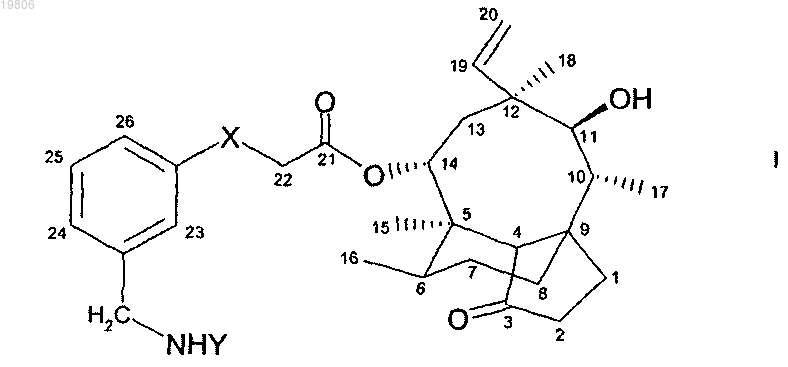
или соединение формулы (II)
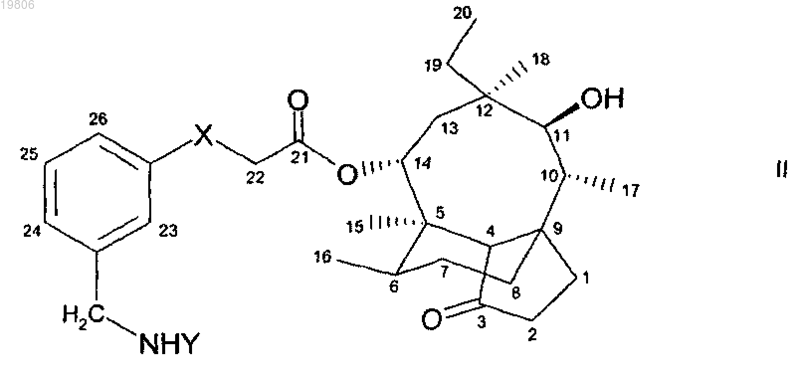
где X представляет собой кислород или серу и
Y представляет остаток пипеколиновой кислоты или остаток аминокислоты,
в свободной форме или в форме соли.
2. Соединение по п.1, где Y представляет остаток встречающейся в природе аминокислоты.
3. Соединение по п.1, выбранное из группы, состоящей из
14-O-[(3-{[((R)-пиперидин-2-карбонил)амино]метил}фенилсульфанил)ацетил]мутилина,
14-O-[(3-{[((R)-2-амино-3-метил)бутириламино]метил}фенилсульфанил)ацетил]мутилина,
14-O-[(3-{[((2R,4R)-4-гидроксипирролидин-2-карбонил)амино]метил}фенилсульфанил)ацетил]мутилина,
14-O-[(3-{[(S)-2-амино-3-(3Н-имидазол-4-ил)пропиониламино]метил}фенилсульфанил)ацетил]мутилина,
14-O-[(3-{[(R)-2-аминопропиониламино]метил}фенилсульфанил)ацетил]мутилина,
14-O-[(3-{[2-(2-аминоацетиламино)ацетиламино]метил}фенилсульфанил)ацетил]мутилина,
14-O-[(3-{[((R)-пирролидин-2-карбонил)амино]метил}фенилсульфанил)ацетил]мутилина,
14-O-[(3-{[(R)-2-амино-3-(4-гидроксифенил)пропиониламино]метил}фенилсульфанил)ацетил]мутилина,
14-O-[(3-{[2-аминоацетиламино]метил}фенилсульфанил)ацетил]мутилина,
14-O-[(3-{[(S)-2-((S)-2-аминопропиониламино)пропиониламино]метил}фенилсульфанил)ацетил]мутилина,
14-O-[(3-{[((S)-2-амино-3-метил)бутириламино]метил}фенилсульфанил)ацетил]мутилина,
14-O-[(3-{(2-[((R)-пирролидин-2-карбонил)амино]ацетиламино)метил}фенилсульфанил)ацетил]мутилина,
14-O-[(3-{[((2R,3S)-2-амино-3-гидрокси)бутириламино]метил}фенилсульфанил)ацетил]мутилина,
14-O-[(3-{[(R)-2,6-диаминогексаноиламино]метил}фенилсульфанил)ацетил]мутилина,
14-O-[(3-{[(R)-2-амино-3-(1Н-индол-3-ил)пропиламино]метил}фенилсульфанил)ацетил]мутилина,
14-O-[(3-{[(R)-2-амино-3-фенилпропиониламино]метил}фенилсульфанил)ацетил]мутилина,
14-O-[(3-{[(R)-2-амино-3-карбамоилпропиониламино]метил}фенилсульфанил)ацетил]мутилина,
14-O-[(3-{[(S)-2,6-диаминогексаноиламино]метил}фенилсульфанил)ацетил]мутилина,
14-O-[(3-{[(S)-2-((S)-2-амино-4-метилпентаноиламино)-4-метилпентаноиламино]метил}фенилсульфанил)ацетил]мутилина,
14-O-[(3-{[((R)-2-амино-3-гидрокси)пропиониламино]метил}фенилсульфанил)ацетил]мутилина,
14-O-[(3-{[(S)-2-аминопропиламино]метил}фенилсульфанил)ацетил]мутилина,
14-O-[(3-{[(R)-2-амино-4-карбамоилбутириламино]метил}фенилсульфанил)ацетил]мутилина,
14-O-[(3-{[((S)-1-(2-аминоацетил)пирролидин-2-карбонил)амино]метил}фенилсульфанил)ацетил]мутилина,
14-O-[(3-{[(R)-2-амино-3-(3Н-имидазол-4-ил)пропиониламино]метил}фенилсульфанил)ацетил]мутилина,
14-O-[(3-{[((2S,4R)-4-гидроксипирролидин-2-карбонил)амино]метил}фенилсульфанил)ацетил]мутилина,
14-O-[(3-{[((S)-пиперидин-2-карбонил)амино]метил}фенилсульфанил)ацетил]мутилина,
14-O-[(3-{[((S)-пирролидин-2-карбонил)амино]метил}фенилсульфанил)ацетил]мутилина,
14-O-[(3-{[(S)-2-амино-3-(4-гидроксифенил)пропиониламино]метил}фенилсульфанил)ацетил]мутилина,
14-O-[(3-{[(S)-2-амино-3-фенилпропиониламино]метил}фенилсульфанил)ацетил]мутилина,
14-O-[(3-{[((S)-2-амино-3-гидрокси)пропиониламино]метил}фенилсульфанил)ацетил]мутилина,
14-O-[(3-{[((2S,3R)-2-амино-3-гидрокси)бутириламино]метил}фенилсульфанил)ацетил]мутилина,
14-O-[(3-{[((R)-2-амино-3-гидрокси)пропиониламино]метил}фенокси)ацетил]мутилина,
14-O-[(3-{[((R)-пирролидин-2-карбонил)амино]метил}фенокси)ацетил]мутилина,
14-O-[(3-{[(S)-2-амино-3-(4-гидроксифенил)пропиониламино]метил}фенокси)ацетил]мутилина,
14-O-[(3-{[(R)-2-амино-3-(4-гидроксифенил)пропиониламино]метил}фенокси)ацетил]мутилина,
14-O-[(3-{[((R)-пирролидин-2-карбонил)амино]метил}фенокси)ацетил]-19,20-дигидромутилина,
14-O-[(3-{[((R)-2-амино-3-гидрокси)пропиониламино]метил}фенокси)ацетил]-19,20-дигидромутилина,
14-O-[(3-{[(S)-2-амино-3-(4-гидроксифенил)пропиониламино]метил}фенокси)ацетил]-19,20-дигидромутилина, находящихся в свободной форме или в форме соли.
4. Соединение по пп.1-3 в форме соли.
5. Применение соединения по любому из пп.1-4 в качестве фармацевтического средства для лечения заболеваний, вызванных микробами.
6. Способ лечения заболеваний, вызванных микробами, включающий введение субъекту, нуждающемуся в таком лечении, эффективного количества соединения по любому из пп.1-4.
7. Применение соединения по любому из пп.1-4 для получения лекарственного средства для лечения заболеваний, вызванных микробами.
8. Применение по п.7, при котором заболеванием является заболевание кожи или мягких тканей.
9. Фармацевтическая композиция для лечения заболеваний, вызванных микробами, включающая соединение по любому из пп.1-4, в сочетании по меньшей мере с одним фармацевтическим эксципиентом.
Текст
Описано соединение формулы (I) или формулы (II), где X представляет собой кислород или серу и Y представляет остаток пипеколиновой кислоты или остаток аминокислоты, предпочтительно встречающейся в природе аминокислоты.(71)(73) Заявитель и патентовладелец: НАБРИВА ТЕРАПЬЮТИКС АГ (AT)mutilus и Р. passeckerianus, см., например, The Merck Index, 12th edition, item 7694. Разработан ряд дополнительных плевромутилинов, содержащих кольцевую структурную основу плевромутилина и замещенных по гидрокси группе, например, в качестве антимикробных средств. В настоящее время авторами настоящего изобретения были обнаружены плевромутилины с интересной активностью. Согласно одному аспекту изобретения описаны соединения формулы (I) где X представляет кислород или серу, иY представляет остаток пипеколиновой кислоты или остаток аминокислоты, предпочтительно аминокислоты природного происхождения. Аминокислота может присутствовать в D или L форме и присоединена через СО группу ее карбоновой группы к азоту. В другом аспекте изобретения предоставляются соединения, выбранные из группы, состоящей из 14-O-[(3-[R)-пиперидин-2-карбонил)амино]метилфенилсульфанил)ацетил]мутилина,14-O-[(3-[R)-2-амино-3-метил)бутириламино]метилфенилсульфанил)ацетил]мутилина,14-O-[(3-[2R,4R)-4-гидроксипирролидин-2-карбонил)амино]метилфенилсульфанил)ацетил]мутилина,14-O-[(3-[(S)-2-амино-3-(3 Н-имидазол-4-ил)пропиониламино]метилфенилсульфанил)ацетил]мутилина,14-O-[(3-[(R)-2-аминопропиониламино]метилфенилсульфанил)ацетил]мутилина,14-O-[(3-[2-(2-аминоацетиламино)ацетиламино]метилфенилсульфанил)ацетил]мутилина,14-O-[(3-[R)пирролидин-2-карбонил)амино]метилфенилсульфанил)ацетил]мутилина,14-O-[(3-[(R)-2-амино-3-(4-гидроксифенил)пропиониламино]метилфенилсульфанил)ацетил]мутилина,14-O-[(3-[2-аминоацетиламино]метилфенилсульфанил)ацетил]мутилина,14-O-[(3-[(S)-2-S)-2-аминопропиониламино)пропиониламино]метилфенилсульфанил)ацетил]мутилина,14-O-[(3-[S)-2-амино-3-метил)бутириламино]метилфенилсульфанил)ацетил]мутилина,14-O-[(3-(2-[R)-пирролидин-2-карбонил)амино]ацетиламино)метилфенилсульфанил)ацетил]мутилина,14-O-[(3-[2R,3S)-2-амино-3-гидрокси)бутириламино]метилфенилсульфанил)ацетил]мутилина,14-O-[(3-[(R)-2,6-диаминогексаноиламино]метилфенилсульфанил)ацетил]мутилина,14-O-[(3-[(R)-2-амино-3-(1 Н-индол-3-ил)пропиламино]метилфенилсульфанил)ацетил]мутилина,14-O-[(3-[(R)-2-амино-3-фенилпропиониламино]метилфенилсульфанил)ацетил]мутилина,14-O-[(3-[(R)-2-амино-3-карбамоилпропиониламино]метилфенилсульфанил)ацетил]мутилина,14-O-[(3-[(S)-2,6-диаминогексаноиламино]метилфенилсульфанил)ацетил]мутилина,14-O-[(3-[(S)-2-S)-2-амино-4-метилпентаноиламино)-4-метилпентаноиламино]метилфенилсульфанил)ацетил]мутилина,14-O-[(3-[R)-2-амино-3-гидрокси)пропиониламино]метилфенилсульфанил)ацетил]мутилина,-1 019806 14-O-[(3-[(S)-2-аминопропиламино]метилфенилсульфанил)ацетил]мутилина,14-O-[(3-[(R)-2-амино-4-карбамоилбутириламино]метилфенилсульфанил)ацетил]мутилина,14-O-[(3-[S)-1-(2-аминоацетил)пирролидин-2-карбонил)амино]метилфенилсульфанил)ацетил] мутилина,14-О-[(3-[(R)-2-амино-3-(3 Н-имидазол-4-ил)пропиониламино]метилфенилсульфанил)ацетил]мутилина,14-O-[(3-[2S,4R)-4-гидроксипирролидин-2-карбонил)амино]метилфенилсульфанил)ацетил]мутилина,14-O-[(3-[S)-пиперидин-2-карбонил)амино]метилфенилсульфанил)ацетил]мутилина,14-O-[(3-[S)-пирролидин-2-карбонил)амино]метилфенилсульфанил)ацетил]мутилина,14-O-[(3-[(S)-2-амино-3-(4-гидроксифенил)пропиониламино]метилфенилсульфанил)ацетил]мутилина,14-O-[(3-[(S)-2-амино-3-фенилпропиониламино]метилфенилсульфанил)ацетил]мутилина,14-O-[(3-[S)-2-амино-3-гидрокси)пропиониламино]метилфенилсульфанил)ацетил]мутилина,14-O-[(3-[2S,3R)-2-амино-3-гидрокси)бутириламино]метилфенилсульфанил)ацетил]мутилина,14-O-[(3-[R)-2-амино-3-гидрокси)пропиониламино]метилфенокси)ацетил]мутилина,14-O-[(3-[R)-пирролидин-2-карбонил)амино]метилфенокси)ацетил]мутилина,14-O-[(3-[(S)-2-амино-3-(4-гидроксифенил)пропиониламино]метилфенокси)ацетил]мутилина,14-O-[(3-[(R)-2-амино-3-(4-гидроксифенил)пропиониламино]метилфенокси)ацетил]мутилина,14-O-[(3-[R)-пирролидин-2-карбонил)амино]метилфенокси)ацетил]-19,20-дигидромутилина,14-O-[(3-[R)-2-амино-3-гидрокси)пропиониламино]метилфенокси)цетил]-19,20-дигидромутилина,14-O-[(3-[(S)-2-амино-3-(4-гидроксифенил)пропиониламино]метилфенокси)цетил]-19,20-дигидромутилина. Оказалось, что антимикробная активность в отношении клинических релевантных бактериальных патогенов (Staphylococcus aureus, Enterococcus faecalis, Streptococcus pneumoniae, Moraxella catarrhalis иEscherichia coli, см. табл. 1 здесь ниже) указанных плевромутилиновых производных особенно усиливается, когда фенильное кольцо имеет насыщенный атом углерода, несущий остаток пипеколиновой кислоты или остаток аминокислоты, предпочтительно, природной аминокислоты в мета-положении (относительно кислорода/серы, связанного(ой) с фенильным кольцом). Соединение, предоставляемое настоящим изобретением, обозначено в настоящем описании также как "соединение(я) настоящего изобретения (или согласно настоящему изобретению)". Соединения по настоящему изобретению включают эфиры мутилин-14-ил-уксусной кислоты, например, ясно определенные выше, и соединения формул I и II. Соединение по настоящему изобретению включает соединение в любой форме, например, в свободной форме, в форме солей, в форме сольватов и в форме соли и сольвата. Соединения по настоящему изобретению могут быть в кристаллической или некристаллической форме и, если они являются кристаллическими, могут необязательно гидратироваться или сольватироваться. Когда некоторым из соединений по настоящему изобретению дают возможность кристаллизоваться или они перекристаллизовываются из органических растворителей, в кристаллическом продукте может присутствовать растворитель кристаллизации. Такие сольваты включены в объем настоящего изобретения. Аналогичным образом, некоторые из соединений по настоящему изобретению могут кристаллизоваться или перекристаллизовываться из растворителей, содержащих воду. В таких случаях в кристаллическом продукте может присутствовать гидратационная вода. В объем настоящего изобретения включены стехиометрические гидраты, а также соединения, содержащие различные количества воды, которые можно получать с помощью таких процессов, как лиофилизация. Согласно еще одному аспекту, настоящее изобретение предоставляет соединение по настоящему изобретению в форме соли. Такие соли включают предпочтительно фармацевтически приемлемые соли, несмотря на то, что включены и фармацевтически неприемлемые соли, например, для целей получения/выделения/очистки. Соль соединения по настоящему изобретению включает соль металла или кислотно-аддитивную соль. Соли металлов включают, например, соли щелочных или щелочно-земельных металлов; кислотноаддитивные соли включают соли соединения по настоящему изобретению с кислотой, например, с кислой фумаровой кислотой, фумаровой кислотой, нафталин-1,5-сульфоновой кислотой, хлористоводородной кислотой, дейтерохлористой кислотой; предпочтительно хлористо-водородной кислотой. Соединение по настоящему изобретению в свободной форме может превращаться в соответствующее соединение в форме соли; и наоборот. Соединение по настоящему изобретению в свободной форме или в форме соли и в форме сольвата может превращаться в соответствующее соединение в свободной форме или в форме соли в несольватированной форме; и наоборот. Соединение по настоящему изобретению, если оно является соответствующим образом замещенным, может существовать в форме изомеров и их смесей; например, оптических изомеров, диастереои-2 019806 зомеров, цис/транс конформеров. Соединение по настоящему изобретению может, например, содержать асимметрические атомы углерода и, таким образом, может существовать в форме энантиомеров или диастереоизомеров и их смесей, например, рацематов. Заместители любого асимметрического атома углерода могут присутствовать в (R)-, (S)- или (R,S)-конфигурации, предпочтительно, в (R)- или (S)конфигурации. Изомерные смеси можно соответствующим образом разделять, например, в соответствии или по аналогии со способом, общепринятым для получения чистых изомеров. Настоящее изобретение охватывает соединение по настоящему изобретению в любой изомерной форме и в любой изомерной смеси. Настоящее изобретение охватывает также таутомеры соединения по настоящему изобретению, когда таутомеры могут существовать. Любое описываемое здесь соединение, например, соединение по настоящему изобретению и промежуточные соединения при их получении могут быть получены соответствующим образом, например,согласно или аналогично общепринятым способам, или, например, как конкретно описано здесь. Описываемое здесь соединение, например, соединение по настоящему изобретению и промежуточные соединения при их получении могут быть превращены в соответствующую соль согласно или по аналогии с общепринятым способом, например, с помощью обработки кислотой или металлическим основанием, соответственно, с получением кислотно-аддитивной соли или металлической соли, соответственно, или наоборот, соединение, получаемое с помощью процесса, предоставляемого настоящим изобретением, в форме соли, может превращаться в соответствующее соединение в форме свободного основания, в соответствии или по аналогии с общепринятыми способами, например, путем обработки кислотой, если получают металлическую соль, и путем обработки металлическим основанием, например, гидроокисью металла, если получают кислотно-аддитивную соль. Например, соединения по настоящему изобретению показывают антимикробную, например, антибактериальную активность в отношении граммположительных бактерий, таких как коагулазаположительных и коагулаза-отрицательных стафилококков, например, Staphylococcus aureus, Styphylococcus epidermis, Staphylococcus haemolyticus, стрептококков, например, Streptococcus pyogenes, Streptococcus pneumoniae, Strepococcus agalacticae, энтерококков, например, Enterococcus faecium и Moraxellaceae, например, Moraxella catarrhalis, Pasteurellaceae, например, Haemophillus influenzae, а также противMycoplasmactaceae, Chlamydiaceae, например, Chlamydia trachomatis, Chlamydia pneumoniae и обязательных анаэробных бактерий, например, Bacteroides fragilis, Clostridium difficile; in vitro в испытании с разведением агара или испытании с микроразведением согласно методу Clinical and Laboratory StandardsInstitute (CLSI, прежний National Committee for Clinical Laboratory Standards (NCCLS) 2006, Document N7A7 Vol. 26, No. 2: "Methods for dilution Antimicrobial Susceptibility Tests for Bacteria that Grow AerobicallySeventh Edition, Approved Standard"; и in vitro определении антимикробной активности в отношении анаэробных бактерий согласно методу National Committee for Clinical Laboratory Standards (NCCLS) Vol. 24,No. 2, M11-A5, Methods for Antimicrobal Susceptibility Testing of Anaerobic Bacteria; approved Standard;Sixth Edition (2004) и in vivo на модели септических мышей в отношении Staphylococcus aureus. Соединения по настоящему изобретению поэтому являются подходящими для лечения и профилактики заболеваний, которые опосредуются микробами, например, бактериями. Заболевания, которые также могут подвергаться лечению, включают болезни, опосредуемые Helicobacter, такими как Helicobacterpylori, и болезни, опосредуемые Mycobacterium tuberculosis, болезни, опосредуемые Legionella pneuraophila или Neisseriaceae, болезни, которые также могут подвергаться лечению, включают в основном воспалительные заболевания, при которых микробы опосредуют указанное воспаление, например, включающие акне. Соединения по настоящему изобретению предпочтительно полезны для лечения кожи и инфекций мягких тканей, например, эпидермальных инфекций, как импетиго, буллезная импетиго или эктима,дермальных инфекций, как рожа, целлюлиты, эритразма или некротизирующий фасцит, фолликулярных инфекций, как фолликулит, фурункулез или карбункулез, других инфекций, как паронихия, дактилит,ботриомикоз, мастит, вторичные инфицированные кожные повреждения, вторичные инфицированные дерматозы, для деколонизации бактериальных носителей, например, деколонизации назальных носителей Staphylococcus aureus, и акне с помощью местного применения. Соответственно, согласно дополнительному аспекту настоящее изобретение предоставляет применение соединения по настоящему изобретению или его фармацевтически приемлемой соли, или производного или сольвата в получении лекарственного средства, пригодного для местного введения для применения при лечении кожных инфекций и инфекций мягких тканей, а также при лечении акне у людей. Настоящее изобретение предоставляет также применение соединения по настоящему изобретению или его фармацевтически приемлемого производного в получении лекарственного средства для применения при лечении кожной инфекции или инфекции мягких тканей. Согласно еще одному аспекту настоящее изобретение предоставляет соединение по настоящему изобретению для применения в качестве фармацевтического средства, предпочтительно в качестве антимикробного, такого как антибиотик, например, и антианаэробного средства. Согласно дополнительному аспекту настоящее изобретение предоставляет соединение по настоя-3 019806 щему изобретению для применения в получении лекарственного средства для лечения болезней, опосредуемых микробами, такими как бактерии, например, болезней, опосредуемых бактериями, например,выбранными из стафилококков, стрептококков, энтерококков; болезней, опосредуемых Helicobacter болезней, опосредуемых Legionella, Neisseriaceae, Moraxellaceae, Pasteurellaceae, Corynebacteria, болезней,опосредуемых Mycobacterium tuberculosis, например, болезней, опосредуемых Mycoplasmataceae, Chlamydiaceae и обязательными анаэробами для лечения акне, и/или для деколонизации индивидуумов, колонизируемых бактериями. Согласно дополнительному аспекту настоящее изобретение предоставляет способ лечения заболеваний, опосредуемых микробами, который включает введение субъекту, нуждающемуся в таком лечении, эффективного количества соединения по настоящему изобретению, например, в форме фармацевтической композиции. Согласно дополнительному аспекту настоящее изобретение предоставляет способ лечения акне, который включает введение субъекту, нуждающемуся в таком лечении, эффективного количества соединения по настоящему изобретению, например, в форме фармацевтической композиции. Лечение включает собственно лечение и профилактику. Для антимикробного лечения и лечения акне соответствующая дозировка будет, конечно, варьировать в зависимости, например, от химической природы и фармакокинетических данных применяемого соединения по настоящему изобретению, отдельного хозяина, способа введения и характера и тяжести подвергаемых лечению состояний. Однако, в основном, для удовлетворительных результатов на большем количестве млекопитающих, например, людей, указанная суточная дозировка составляет в пределах примерно от 0,01 до 3 г соединения по настоящему изобретению, удобно вводимого, например, в виде раздельных доз вплоть до четырех раз в день. Соединение по настоящему изобретению можно вводить с помощью любого общепринятого способа, например, энтерально, например, включая назальное, щечное, ректальное, оральное введение; парентерально, включая, например, внутривенное, внутримышечное, подкожное введение; или местно, например, включая эпикожное, интраназальное, внутритрахеальное введение, например, в форме таблеток с покрытием или без покрытия, капсул, инъецируемые растворы или суспензии, например, в виде ампул,пузырьков или пробирок, в виде полутвердых рецептур, например, мазей, кремов, гелей, паст, в виде ингаляционного порошка, пен, тинктур, губных помад, маскирующих или гигиенических помад, капель,спреев, или в виде медицинских свечей, например, аналогично макролидам, таким как эритромицины,например, кларитромицин или азитромицин. Соединение по настоящему изобретению можно вводить в форме фармацевтически приемлемой соли, например, кислотно-аддитивной соли или металлической соли; или в свободной форме; необязательно в виде сольвата. Соединение по настоящему изобретению в форме соли проявляет тот же порядок активности, что и соединение в свободном виде; необязательно в виде сольвата. Соединение по настоящему изобретению можно использовать для фармацевтического лечения согласно настоящему изобретению одно или в сочетании с одним или более другими фармацевтически активными агентами. Такие другие фармацевтически активные агенты включают, например, другие антибиотики и противовоспалительные агенты, и, если соединение по настоящему изобретению используется при лечении акне, другие фармацетические агенты включают дополнительно агенты, которые являются активными против акне, или используются для деколонизации/стерилизации бактериальных носителей. Сочетания включают фиксированные сочетания, в которых два или более фармацевтически активных агента находятся в той же самой рецептурной форме; в наборах, в которых два или более фармацевтически активных агента в раздельных рецептурах продаются в одной и той же упаковке, например, вместе с инструкцией по раздельному введению; и в свободных сочетаниях, в которых фармацевтически активные агенты упакованы отдельно, но даются инструкции по раздельному или последовательному введению. Согласно еще одному аспекту настоящее изобретение предоставляет фармацевтическую композицию, включающую соединение по настоящему изобретению, например, включающую соединение формулы I, в свободном виде или в виде фармацевтически приемлемой соли; например, и/или в виде сольвата; в сочетании по меньшей мере с одним фармацевтическим эксципиентом, например, носителем или разбавителем, например, включая наполнители, связующие, дезинтеграторы, кондиционеры текучести,смазочные агенты, сахара и подсластители, ароматизаторы, консервирующие агенты, стабилизаторы,смачивающие агенты и/или эмульгаторы, солюбилизаторы, соли для регулирования осмотического давления и/или буферы. Согласно еще одному аспекту настоящее изобретение предоставляет фармацевтическую композицию согласно настоящему изобретению, дополнительно включающую еще один фармацевтически активный агент. Такие фармацевтические композиции можно получать, например, по аналогии с общепринятым способом, например, с помощью способов смешения, гранулирования, нанесения покрытия, растворения или лиофилизации. Единичная лекарственная форма может содержать, например, приблизительно от 0,01 мг до при-4 019806 близительно 3000 мг, такое количество, как 1 мг до приблизительно 1000 мг. Соединения по настоящему изобретению дополнительно являются подходящими в качестве ветеринарных агентов, например, ветеринарно-активных соединений, например, в профилактике и в лечении микробных, например, бактериальных заболеваний, у животных, таких как домашняя птица, свиньи и детеныши домашних животных; например, и для разбавления жидкостей для искусственного осеменения и для приемов макания яиц. Согласно еще одному аспекту настоящее изобретение представляет соединение по настоящему изобретению для применения в качестве ветеринарного агента. Согласно еще одному аспекту настоящее изобретение представляет соединение по настоящему изобретению для получения ветеринарной композиции, которая полезна в качестве ветеринарного агента. Согласно еще одному аспекту настоящее изобретение представляет ветеринарный способ профилактики и лечения микробных, например, бактериальных заболеваний, который включает введение субъекту, нуждающемуся в таком лечении, эффективного количества соединения по настоящему изобретению, например, в форме ветеринарной композиции. Для использования активных соединений по настоящему изобретению в качестве ветеринарного агента дозировка, конечно, варьирует в зависимости от размера и возраста животного и желаемого эффекта; например, для профилактического лечения обычно вводят относительно низкие дозы на протяжении более длительного периода времени, например, в течение 1-4 недель. Предпочтительные дозы в питьевой воде составляют от 0,0125 до 0,05 весового объема, особенно 0,0125-0,025; а в кормах от 20 до 400 г/метрическую тонну, предпочтительно 20-200 г/метрическую тонну. Предпочтительно вводить активные соединения по настоящему изобретению в качестве ветеринарного агента курам в питьевой воде,свиньям - в корме и детенышам орально илипарентерально, например, в виде оральных или парентеральных препаратов. Изобретение описано далее со ссылкой на нижеследующие примеры. Данные примеры предоставлены только для целей иллюстрации и не предназначены никоим образом для ограничения настоящего изобретения. Используются следующие сокращения: ВОС - трет-бутокси-карбонил;THF (ТГФ) - тетрагидрофуран. Примеры Пример 1. 14-O-[(3-[R)-Пиперидин-2-карбонил)амино]метилфенилсульфанил)ацетил]мутилин. Стадия 1. Плевромутилинтозилат. К раствору 18,63 г (49,2 ммол) плевромутилина и 9,39 г (49,2 ммол) толуолсульфонилхлорида в 1400 мл метилэтилкетона при температуре окружающей среды медленно добавляют раствор 4,98 г (49,2 ммол) триэтиламина в 300 мл метилэтилкетона. Реакционную смесь перемешивают в течение 24 ч при температуре окружающей среды, образующийся осадок отфильтровывают, и к раствору добавляют 2800 мл воды. Раствор экстрагируют три раза этилацетатом, органическую фазу сушат с помощью Na2SO4 и выпаривают досуха при пониженном давлении. Сырой продукт используют в следующей стадии без дальнейшей очистки. 1 Н-ЯМР (400 МГц, ДМСО-Д 6,, м.д., характеристика сигналов): 0,49 (д, 3 Н, J=7 Гц, СН 3-16); 0,8 (д,3 Н, J=7 Гц, СН 3-17); 1,02 (с, 3 Н, СН 3-18); 1,29 (с, 3 Н, СН 3-15); 2,38 (ушир.с, 1 Н, Н-4); АВ-система Стадия 2. 14-O-[(3-Гидроксиметилфенилсульфанил)ацетил]мутилин. К 1,96 г (14 ммол) (3-Меркаптофенил)метанола [полученного из 3-Меркаптобензойной кислоты, согласно публикации: Chemistry Express, Vol 7, No.11, pp.865-868 (1992)] в 90 мл абсолютного этанола добавляют 322 мг (14 ммол) натрия. После перемешивания реакционной смеси в течение 30 мин при температуре окружающей среды добавляют раствор 7,45 г (14 ммол) Плевромутилинтозилата в 130 мл ме-5 019806 тилэтилкетона, и реакционную смесь перемешивают при температуре окружающей среды в течение 16 ч. Реакционную смесь выпаривают досуха при пониженном давлении, растворяют в этилацетате и три раза экстрагируют водой. Органическую фазу сушат Na2SO4, выпаривают досуха при пониженном давлении,и остаток подвергают хроматографии на силикагеле с использованием в качестве подвижной фазы дихлорметан/метанола 100:1,5. Полученный материал был кристаллическим (Т.пл. 139-141 С). 1 Н-ЯМР (500 МГц, CDCl3, , м.д., характеристика сигналов): 0,68 (д, 3 Н, J=7 Гц, СН 3-16); 0,88 (д,3 Н, J=7 Гц, СН 3-17); 1,12 (с, 3 Н, СН 3-18); 1,42 (с, 3 Н, СН 3-15); 2,06 (ушир.с, 1 Н, Н-4); 3,32 (т, 1 Н, J=6 Гц,Н-11); 3,59 (с, 2 Н, СН 2-22); 4,66 (с, 2 Н, СН 2-27); 5,15 и 5,30 (2 хм, 2 Н, Н-20); 5,72 (д, 1 Н, J=8 Гц, Н-14); 6,41 (дд, 1 Н, J=11 и 17 Гц, Н-19); 7,19 и 7,28 (2 хм, 3 Н, Н-24, 25 и 26); 7,38 (с, 1 Н, Н-23). 1 Н-ЯМР (400 МГц, ДМСО-д 6, , м.д., характеристика сигналов): 0,56 (д, 3 Н, J=7 Гц, СН 3-16); 0,79 Стадия 3. 14-O-[(3-Метансульфонилоксиметилфенилсульфанил)ацетил]мутилин. К 6 г (12 ммол) 14-O-[(3-Гидроксиметилфенилсульфанил)ацетил]мутилина в 250 мл сухого ТГФ добавляют 2,17 мл (20 ммол).N-метилморфолина и 3,06 г (18 ммол) метансульфонового ангидрида вместе с каталитическим количеством 4-диметиламинопиридина. Реакционную смесь оставляют стоять в течение 2 ч при температуре окружающей среды. После добавления воды смесь экстрагируют этилацетатом, а затем органическую фазу промывают несколько раз водой и солевым раствором. Органическую фазу сушат безводным сульфатом натрия и концентрируют при пониженном давлении. Органическую фазу сушат безводным сульфатом натрия, концентрируют при пониженном давлении и подвергают хроматографии на силикагеле с использованием в качестве подвижной фазы дихлорметан/метанола 100:1. 1 Н-ЯМР (400 МГц, CDCl3, , м.д., характеристика сигналов): 0,68 (д, 3 Н, J=7 Гц, СН 3-16); 0,87 (д,3 Н, J=7 Гц, СН 3-17); 1,12 (с, 3 Н, СН 3-18); 1,40 (с, 3 Н, СН 3-15); 2,08 (ушир.с, 1 Н, Н-4); 2,96 (с, 3 Н, СН 328); 3,34 (д, 1 Н, J=6 Гц, Н-11); 3,59 (с, 2 Н, СН 2-22); 5,15 и 5,30 (2 хм, 2 Н, Н-20); 5,72 (д, 1 Н, J=8 Гц, Н-14); 6,40 (дд, 1 Н, J=11 и 17 Гц, Н-19); 7,23-7,43 (м, 4 Н, Н-23, 24, 25 и 26). Стадия 4. 14-O-[(3-Азидометилфенилсульфанил)ацетил]мутилин. К 1 г (1,73 ммол) 14-O-[(3-Метансульфонилоксиметил-фенилсульфанил)ацетил]мутилина в 10 мл ДМФ (диметилформамид) добавляют 449 мг (6,9 ммол) NaN3. Полученную суспензию перемешивают в течение 4,5 ч при 50 С и оставляют на ночь при температуре окружающей среды. Добавляют воду и этилацетат, и органическую фазу промывают несколько раз водой и солевым раствором. После концентрирования при пониженном давлении остаток подвергают хроматографии на силикагеле с использованием в качестве подвижной фазы CH2Cl2/МеОН 100:1. 1 Н-ЯМР (400 МГц, ДМСО-д 6, , м.д., характеристика сигналов): 0,56 (д, 3 Н, J=7 Гц, СН 3-16); 0,79 (д,3 Н, J=7 Гц, СН 3-17); 1,00 (с, 3 Н, СН 3-18); 1,30 (с, 3 Н, СН 3-15); 2,34 (ушир.с, 1 Н, Н-4); 3,37 (т, 1 Н, J=6 Гц,Н-11); АВ-система (uA=3,85, uB=3,78, J=16 Гц, СН 2-22); 4,39 (с, 2 Н, СН 2-27); 4,95 (м, 2 Н, Н-20); 5,49 (д,1 Н, J=8 Гц, Н-14); 6,04 (дд, 1 Н, J=11 и 18 Гц, Н-19); 7,18 (м, 1 Н, Н-25); 7,32 (м, 2 Н, Н-24 и 26); 7,34 1 г (1,9 ммол) 14-O-[(3-Азидометилфенилсульфанил)ацетил]мутилина растворяют в 30 мл ТГФ, добавляют 900 мг Lindlar-катализатора, и реакционную смесь гидрируют в течение 6 ч. Реакционную смесь фильтруют через целит, концентрируют при пониженном давлении, и остаток подвергают хроматографии на силикагеле с использованием в качестве подвижной фазы CH2Cl2/МеОН 10:1. Гидрохлорид получали путем растворения 125 мг 14-O-[(3-Аминометил)фенилсульфанилацетил]мутилина в 3 мл CH2Cl2 и добавления HCl-насыщенной Et2O. Через 45 мин реакционную смесь выпаривали досуха при пониженном давлении. 1 Н-ЯМР (400 МГц, ДМСО-д 6, , м.д., характеристика сигналов): 0,57 (д, 3 Н, J=7 Гц, СН 3-16); 0,79 (д,3 Н, J=7 Гц, СН 3-17); 1,00 (с, 3 Н, СН 3-18), 1,31 (с, 3 Н, СН 3-15); 2,38 (ушир.с, 1 Н, Н-4); 3,38 (т, 1 Н, J=6 Гц,Н-11); АВ-система (uA=3,89, uB=3,82, J=16 Гц, СН 2-22); 3,95 (с, 2 Н, СН 2-27); 4,98 (м, 2 Н, Н-20); 5,51 (д,1 Н, J=8 Гц, Н-14); 6,05 (дд, 1 Н, J=11 и 18 Гц, Н-19); 7,30 (м, 3 Н, Н-24,25 и 26); 7,48 (с, 1 Н, Н-23). Стадия 6. 14-O-[(3-[R)-трет-Бутоксикарбонилпиперидин-2-карбонил)амино]метилфенилсульфанил)ацетил]мутилин. К 200 мг (0,4 ммол) 14-O-[(3-Аминометилфенилсульфанил)ацетил]мутилина в 2,5 мл ТГФ добавляют 180 мг (0,6 ммол) BOC-D-гомопролина вместе со 124 мг (0,6 ммол) DCC и 49 мг (0,4 ммол) DMAP. Реакционную смесь перемешивают в течение 3 ч при температуре окружающей среды, образованный осадок отфильтровывают, и фильтрат выпаривают досуха при пониженном давлении. Остаток подвергают хроматографии на силикагеле с использованием в качестве подвижной фазы дихлорметан/метанола 100 : 2. 1 Н-ЯМР (400 МГц, ДМСО-д 6, , м.д., характеристика сигналов): 0,56 (д, 3 Н, J=7 Гц, СН 3-16); 0,79 (д,3 Н, J=7 Гц, СН 3-17); 0,99 (с, 3 Н, СН 3-18), 1,31 (с, 3 Н, СН 3-15); 1,34 (ушир.с, 9 Н, СН 3-33); 2,36 (ушир.с,1 Н, Н-4); 3,03 и 4,56 (2 х ушир.м, 2 Н, СН 2-32); 3,38 (т, 1 Н, J=6 Гц, Н-11); АВ-система (uA=3,81, uB=3,74,J=16 Гц, СН 2-22); 3,81 (ушир.м, 1 Н, Н-28); 4,23 (ушир.м, 2 Н, СН 2-27); 4,98 (м, 2 Н, Н-20); 5,50 (д, 1 Н, J=8 Гц, Н-14); 6,04 (м, 1 Н, Н-19); 7,05 (д, 1 Н, J=7 Гц, Н-23); 7,20 (м, 3 Н, Н-24, 25 и 26). Пример 1. Гидрохлорид 14-O-[(3-[R)-пиперидин-2-карбонил)амино]метилфенилсульфанил) ацетил]мутилина. 208 мг 14-O-[(3-[R)-ВОС-Пиперидин-2-карбонил)амино]метилфенилсульфанил)ацетил]мутилина растворяют в 3 мл дихлорметана и добавляют 4 мл HCl-насыщенной Et2O. Реакционную смесь оставляют при температуре окружающей среды на 4 ч и выпаривают досуха при пониженном давлении. 1 Н-ЯМР (400 МГц, ДМСО-д 6, , м.д., характеристика сигналов): 0,58 (д, 3 Н, J=7 Гц, СН 3-16); 0,79 (д,3 Н, J=7 Гц, СН 3-17); 0,99 (с, 3 Н, СН 3-18), 1,31 (с, 3 Н, СН 3-15); 2,36 (ушир.с, 1 Н, Н-4); 2,90 и 3,21 (2 хм,2 Н, СН 2-32); 3,38 (т, 1 Н, J=6 Гц, Н-11); АВ-система (uA=3,84, uB=3,77, J=16 Гц, СН 2-22); 3,78 (ушир.м, 1 Н,Н-28); 4,29 (д, 2 Н, J=6 Гц, СН 2-27); 4,96 (м, 2 Н, Н-20); 5,50 (д, 1 Н, J=8 Гц, Н-14); 6,04 (дд, 1 Н, J=11 и 18 Гц, Н-19); 7,07 (м, 1 Н, Н-23); 7,22 (м, 3 Н, Н-24, 25 и 26). Следующие соединения получают аналогичным образом. Пример 32. Гидрохлорид 14-O-[(3-[R)-2-амино-3-гидрокси)пропиониламино]метилфенокси) ацетил]мутилина. Стадия 1. 14-O-[3-Гидроксиметилфеноксиацетил]мутилин. К 1,42 г (56,4 ммол) гидрида натрия в 150 мл ДМФ при комнатной температуре добавляют 7 г (56,4 ммол) 3-Гидроксиметил-фенола в 80 мл ДМФ. После перемешивания реакционной смеси в течение 30 минут при 30 С добавляют 30 г (56,4 ммол) Плевромутилинтозилата в 130 мл ацетона, и реакционную смесь перемешивают при температуре окружающей среды в течение 2 ч. Реакционную смесь выпаривают досуха при пониженном давлении, растворяют в этилацетате и экстрагируют три раза водой. Органическую фазу сушат с помощью Na2SO4, выпаривают досуха при пониженном давлении, и остаток подвергают хроматографии на силикагеле с использованием в качестве подвижной фазы дихлорметан/метанола 100:2. 1 Н-ЯМР (400 МГц, ДМСО-д 6, , м.д., характеристика сигналов): 0,64 (д, 3 Н, J=7 Гц, СН 3-16); 0,81 (д,3 Н, J=7 Гц, СН 3-17); 1,04 (с, 3 Н, СН 3-18); 1,34 (с, 3 Н, СН 3-15); 2,40 (с, 1 Н, Н-4); 3,41 (т, 1 Н, J=6 Гц, Н-11); 4,40 (м, 2 Н, СН 2-27); АВ-система (uA=4,74, uB=4,62, J=17 Гц, СН 2-22); 5,04 (м, 2 Н, Н-20); 5,08 (м, 1 Н, Н 14); 6,11 (дд, 1 Н, J=11 и 18 Гц, Н-19), 6,73 (дд, 1 Н, J=2 и 8 Гц, Н-26); 6,80 (ушир.с, 1 Н, Н-23); 6,92 (д, 1 Н,J=8 Гц, Н-24 и 26); 7,19 (м, 1 Н, Н-25). Стадия 2. 14-O-[(3-Метансульфонилоксиметилфенокси)ацетил]мутилин. К 23 г (47,5 ммол) 14-O-[3-Гидроксиметилфеноксиацетил]мутилина в 400 мл сухого ТГФ и 8,88 мл+4 С добавляют 14,42 г (82,8 ммол) метансульфонового ангидрида в 80 мл сухого ТГФ. Реакционной смеси дают возможность перемешиваться в течение 1 ч при температуре окружающей среды. После добавления воды смесь экстрагируют этилацетатом, и затем органическую фазу промывают несколько раз водой и солевым раствором. Органическую фазу сушат безводным сульфатом натрия, концентрируют при пониженном давлении и подвергают хроматографии на силикагеле с использованием в качестве подвижной фазы дихлорметан/метанола 100:1. Стадия 3. 14-O-[(3-Азидометилфенокси)ацетил]мутилин. К 8,14 г (14,5 ммол) 14-O-[(3-Метансульфонилоксиметилфенокси)ацетил]мутилина в 80 мл ДМФ добавляют 3,77 г (58 ммол) NaN3. Полученную суспензию перемешивают в течение 4,5 ч при 50 С и оставляют на ночь при температуре окружающей среды. Добавляют воду и этилацетат, и органическую фазу промывают несколько раз водой и солевым раствором. После концентрации при пониженном давлении остаток подвергают хроматографии на силикагеле с использованием в качестве подвижной фазы Стадия 4. Гидрохлорид 14-O-[(3-Аминометилфенокси)ацетил]мутилина. 5,6 г (11 ммол) 14-O-[(3-Азидометилфенокси)ацетил]мутилина растворяют в 170 мл ТТФ, добавляют 5,1 г Lindlar-катализатора, и реакционную смесь гидрируют в течение 30 мин. Реакционную смесь фильтруют через целит, концентрируют при пониженном давлении, и остаток подвергают хроматографии на силикагеле с использованием в качестве подвижной фазы CH2Cl2/МеОН 10:1. 1 Н-ЯМР (400 МГц, ДМСО-д 6, , м.д., характеристика сигналов): 0,64 (д, 3 Н, J=7 Гц, СН 3-16); 0,81 (д,3 Н, J=7 Гц, СН 3-17); 1,04 (с, 3 Н, СН 3-18), 1,34 (с, 3 Н, СН 3-15); 2,40 (ушир.с, 1 Н, Н-4); 3,42 (т, 1 Н, J=6 Гц,Н-11); 3,64 (с, 2 Н, СН 2-27); АВ-система (uA=4,69, uB=4,62, J=17 Гц, СН 2-22); 5,01 и 5,07 (2 хдд, 2 Н, J=2 и 11 Гц; J=2 и 18 Гц, Н-20); 5,60 (д, 1 Н, J=8 Гц, Н-14); 6,11 (дд, 1 Н, J=11 и 18 Гц, Н-19); 6,70 (дд, 1 Н, J=2 и 8 Гц; Н-26); 6,86 (д, 1 Н, J=2 Гц, Н-23); 6,89 (д, 1 Н, J=8 Гц, Н-24); 7,16 (т, 1 Н, J=8 Гц, Н-25). Гидрохлорид получали путем растворения 125 мг 14-O-[(3-Аминометил)фенилсульфанил)ацетил] мутилина в 3 мл CH2Cl2 и добавления 2 мл HCl-насыщенного Et2O. Через 45 мин реакционную смесь выпаривали досуха при пониженном давлении. Стадия 5. 14-O-[(3-[R)-2-трет-Бутоксикарбониламино-3-гидрокси)пропиониламино]метилфенокси)ацетил]мутилин. К 300 мг (0,62 ммол) 14-O-[(3-Аминометил-фенокси)-ацетил]-мутилина в 6 мл ТГФ добавляют 207 мг (0,96 ммол) BOC-D-Пролина вместе со 198 мг (0,96 ммол) DCC и 75 мг (0,62 ммол) DMAP. Реакционную смесь перемешивают в течение 3 ч при температуре окружающей среды, образующийся осадок отфильтровывают, и фильтрат выпаривают досуха при пониженном давлении. Остаток подвергают хроматографии на силикагеле с использованием в качестве подвижной фазы дихлорметан/метанола 100:4. 1Et2O. Реакционную смесь оставляли при температуре окружающей среды в течение 3 ч и выпаривали досуха при пониженном давлении. 1 Н-ЯМР (400 МГц, ДМСО-д 6, , м.д., характеристика сигналов): 0,64 (д, 3 Н, J=7 Гц, СН 3-16); 0,81 (д,3 Н, J=7 Гц, СН 3-17); 1,05 (с, 3 Н, СН 3-18), 1,35 (с, 3 Н, СН 3-15); 2,40 (ушир.с, 1 Н, Н-4); 3,41 (т, 1 Н, J=6 Гц,Н-11); 3,76 (м, 2 Н, СН 2-29); 3,84 (дд, 1 Н, J=4 и б Гц, Н-28); АВХ-система (uA=4,32, uB=4,26, JAB=16 Гц,JAX=6 Гц, JBX=6 ГЦ, СН 2-27); АВ-система (uA=4,71, uB=4,62, J=17 Гц, CH2-22); 5,01 и 5,07 (2 хдд, 2 Н, J=2 и 11 Гц; J=2 и 18 Гц, Н-20); 5,60 (д, 1 Н, J=8 Гц, Н-14); 6,11 (дд, 1 Н, J=11 и 18 Гц, Н-19); 6,76 (дд, 1 Н, J=2 и 8 Гц, Н-26); 6,84 (ушир.с, 1 Н, Н-23); 6,87 (д, 1 Н, J=8 Гц, Н-24); 7,21 (т, 1 Н, J=8 Гц, Н-25). Следующие соединения получают аналогичным образом. Пример 33. Гидрохлорид 14-O-[(3-[R)-пирролидин-2-карбонил)амино]метилфенокси)ацетил] мутилина. 1 Н-ЯМР (400 МГц, ДМСО-д 6, , м.д., характеристика сигналов): 0,63 (д, 3 Н, J=7 Гц, СН 3-16); 0,81 (д,3 Н, J=7 Гц, СН 3-17); 1,05 (с, 3 Н, СН 3-18), 1,34 (с, 3 Н, СН 3-15); 2,40 (ушир.с, 1 Н, Н-4); 3,18 (м, 2 Н, СН 231); 3,41 (д, 1 Н, J=6 Гц, Н-11); 4,18 (м, 1 Н, Н-28); 4,28 (м, 2 Н, СН 2-27); АВ-система (uA=4,72, uB=4,63,J=17 Гц, СН 2-22); 5,01 и 5,07 (2 хдд, 2 Н, J=2 и 11 Гц; J=2 и 18 Гц, Н-20); 5,60 (д, 1 Н, J=8 Гц, Н-14); 6,11 Пример 36. Гидрохлорид 14-O-[(3-[R)-пирролидин-2-карбонил)амино]метилфенокси)ацетил]19,20-дигидромутилина. Стадия 1. 14-O-[(3-Аминометилфенокси)ацетил]-19,20-дигидромутилин. 5,3 г (10,4 ммол) 14-O-[(3-Азидометилфенокси)ацетил]мутилина растворяют в 160 мл ТГФ, добавляют 4,8 г Lindlar-катализатора, и реакционную смесь гидрируют в течение 65 ч при температуре окружающей среды. Реакционную смесь фильтруют через целит, концентрируют при пониженном давлении,и остаток подвергают хроматографии на силикагеле с использованием в качестве подвижной фазы Стадия 2. 14-O-[(3-[R)-трет-Бутоксикарбонилпирролидин-2-карбонил)амино]метилфенокси) ацетил]-19,20-дигидромутилин. К 300 мг (0,62 ммол) 14-O-[(3-аминометилфенокси)ацетил]мутилина в 6 мл ТГФ добавляют 212 мг(0,99 ммол) BOC-D-Пролина вместе с 204 мг (0,99 ммол) DCC и 75 мг (0,62 ммол) DMAP. Реакционную смесь перемешивают в течение 12 ч при температуре окружающей среды, образующийся осадок отфильтровывают, и фильтрат выпаривают досуха при пониженном давлении. Остаток подвергают хроматографии на силикагеле с использованием в качестве подвижной фазы дихлорметан/метанола 100:2. 1 Н-ЯМР (400 МГц, ДМСО-д 6, , м.д., характеристика сигналов): 0,61 (т, 3 Н, J=7 Гц, СН 3-20); 0,64 (д,3 Н, J=7 Гц, СН 3-16); 0,80 (д, 3 Н, J=7 Гц, СН 3-17); 0,84 (с, 3 Н, СН 3-18), 1,27 (ушир.с, 9 Н, СН 3-32); 1,39 (с,3 Н, СН 3-15); 2,36 (ушир.с, 1 Н, Н-4); 3,35 (2 хм, 3 Н, СН 2-31 и Н-11); 4,10 и 4,26 (2 хм, 3 Н, СН 2-27 и Н-28); АВ-система (uA=4,70, uB=4,60, J=17 Гц, СН 2-22); 5,58 (д, 1 Н, J=8 Гц, Н-14); 6,72 (м, 1 Н, Н-26); 6,80 Стадия 3. Гидрохлорид 14-O-[(3-[R)-пирролидин-2-карбонил)амино]метилфенокси)ацетил]19,20-дигидромутилина. 337 мг 14-O-[(3-[R)-ВОС-пиперидин-2-карбонил)амино]метилфенилсульфанил)ацетил]мутилина растворяли в 2 мл дихлорметана и добавляли 5 мл HCl-насыщенного Et2O. Реакционную смесь оставляли при температуре окружающей среды в течение 4 ч и выпаривали досуха при пониженном давлении. 1 Н-ЯМР (400 МГц, ДМСО-д 6, , м.д., характеристика сигналов): 0,61 (т, 3 Н, J=7 Гц, СН 3-20); 0,63 (д,3 Н, J=7 Гц, СН 3-16); 0,79 (д, 3 Н, J=7 Гц, СН 3-17); 0,84 (с, 3 Н, СН 3-18), 1,33 (с, 3 Н, СН 3-15); 2,36 (ушир.с,1 Н, Н-4); 3,18 (м, 2 Н, СН 2-31); 3,32 (т, 1 Н, J=6 Гц, Н-11); 4,18 (т, 1 Н, J=7 Гц, Н-28); 4,29 (д, 2 Н, J=6 Гц,СН 2-27); АВ-система (uA=4,74, uB=4,63, J=17 Гц, СН 2-22); 5,58 (д, 1 Н, J=8 Гц, Н-14); 6,78 (дд, 1 Н, J=2 и 8 Гц; Н-26); 6,83 (д, 1 Н, J=2 Гц, Н-23); 6,85 (д, 1 Н, J=8 Гц, Н-24); 7,22 (т, 1 Н, J=8 Гц, Н-25). Следующие соединения получают аналогичным образом. Пример 37. Гидрохлорид 14-O-[(3-[R)-2-амино-3-гидрокси)пропиониламино]метил фенокси)ацетил]-19,20-дигидромутилина. 1 Н-ЯМР (400 МГц, ДМСО-д 6, , м.д., характеристика сигналов): 0,61 (т, 3 Н, J=7 Гц, СН 3-20); 0,63 (д,3 Н, J=7 Гц, СН 3-1 б); 0,79 (д, 3 Н, J=7 Гц, СН 3-17); 0,84 (с, 3 Н, СН 3-18); 1,34 (с, 3 Н, СН 3-15); 2,36 (ушир.с,1 Н, Н-4); 3,38 (т, 1 Н, J=6 Гц, Н-11); 3,77 (м, 2 Н, СН 2-29); 3,86 (м, 1 Н, Н-28); 4,29 (т, 2 Н, J=6 Гц, СН 2-27); АВ-система (uA=4,73, uB=4,62, J=17 Гц, СН 2-22); 5,59 (д, 1 Н, J=8 Гц, Н-14); 6,77 (дд, 1 Н, J=2 и 8 Гц, Н-26); 6,84 (ушир.с, 1 Н, Н-23); 6,87 (д, 1 Н, J=8 Гц, Н-24); 7,20 (т, 1 Н, J=8 Гц, Н-25). Пример 39 (сравнение). 14-O-[(3-Метилфенилсульфанил)ацетил]мутилин. Соединение примера 39 получали по аналогии со стадией 2, примера 1. 1 Пример 40 (сравнение). 14-O-[(3-Метилфенокси)ацетил]мутилин. Соединение примера 40 получали по аналогии со стадией 1, примера 32. 1 Н-ЯМР (400 МГц, ДМСО-д 6, , м.д., характеристика сигналов): 0,64 (д, 3 Н, J=7 Гц, СН 3-16); 0,81 (д,3 Н, J=7 Гц, СН 3-17); 1,04 (с, 3 Н, СН 3-18); 1,33 (с, 3 Н, СН 3-15); 2,23 (с, 3 Н, СН 3-27); 2,40 (ушир.с, 1 Н, Н 4); 3,41 (ушир.с, 1 Н, Н-11); АВ-s система (uA=4,68, uB=4,62, J=17 Гц, СН 2-22); 5,01 и 5,06 (2 хд, 2 Н, J=11 Гц и 18 Гц, Н-20); 5,60 (д, 1 Н, J=8 Гц, Н-14); 6,11 (дд, 1 Н, J=11, и 18 Гц, Н-19); 6,67 и 6,77 (2 хд, 2 Н, J=7 Гц, Н-24 и 26); 6,68 (с, 1 Н, Н-23); 7,12 (т, 1 Н, J=8 Гц, Н-25). Пример 41 (сравнение). 14-O-[(3-Метилфенокси)ацетил]-19,20-дигидромутилин. Соединение примера 41 получали путем гидрирования продукта примера 40 с помощью Pd/C. 1 Н-ЯМР (400 МГц, ДМСО-д 6, , м.д., характеристика сигналов): 0,64 (д, 3 Н, J=7 Гц, СН 3-16); 0,81 (д,3 Н, J=7 Гц, СН 3-17); 1,04 (с, 3 Н, СН 3-18); 1,33 (с, 3 Н, СН 3-15); 2,23 (с, 3 Н, СН 3-27); 2,40 (ушир.с, 1 Н, Н 4); 3,41 (ушир.с, 1 Н, Н-11); АВ-система (uA=4,68, uB=4,62, J=17 Гц, СН 2-22); 5,01 и 5,06 (2 хд, 2 Н, J=11 Гц и 18 Гц, Н-20); 5,60 (д, 1 Н, J=8 Гц, Н-14); 6,11 (дд, 1 Н, J=11, и 18 Гц, Н-19); 6,67 и 6,77 (2 хд, 2 Н, J=7 Гц,Н-24 и 26); 6,68 (с, 1 Н, Н-23); 7,12 (т, 1 Н, J=8 Гц, Н-25). Антимикробная активность новых производных плевромутилина с ароматической боковой цепью Антибактериальную активность, выраженную как минимальная ингибирующая концентрация(MIC), определяли в соответствии с одобренными стандартными рекомендациями CLSI (прежняяNCCLS). Соединение примера 1 и другие заявленные соединения показали очень хорошую активность в отношении клинически пригодных бактериальных патогенных видов Staphylococcus aureus, Enterococcusfaecalis, Streptococcus pneumoniae, Moraxella catarrhalis и Escherichia coli (см. табл. 1). Данная in vitro активность была значительно лучше, чем активность сравниваемых соединений из примеров 39-41, так какMICs соединения по примеру 1 были по меньшей мере в 2 раза ниже в отношении по меньшей мере одного из штаммов, показанных в табл.1, чем MICs соединений из примеров 39-41 (см. табл. 1). Таблица 1. Антимикробная активность соединения по примеру 1 и сравниваемых соединений из примеров 39-41 в отношении выбранных бактериальных патогенных видов, показанная в виде минимальной ингибирующей концентрации (MIC, [мкг/мл]). или соединение формулы (II) где X представляет собой кислород или серу иY представляет остаток пипеколиновой кислоты или остаток аминокислоты,в свободной форме или в форме соли. 2. Соединение по п.1, где Y представляет остаток встречающейся в природе аминокислоты. 3. Соединение по п.1, выбранное из группы, состоящей из 14-O-[(3-[R)-пиперидин-2-карбонил)амино]метилфенилсульфанил)ацетил]мутилина,14-O-[(3-[R)-2-амино-3-метил)бутириламино]метилфенилсульфанил)ацетил]мутилина,14-O-[(3-[2R,4R)-4-гидроксипирролидин-2-карбонил)амино]метилфенилсульфанил)ацетил]мутилина,14-O-[(3-[(S)-2-амино-3-(3 Н-имидазол-4-ил)пропиониламино]метилфенилсульфанил)ацетил]мутилина,14-O-[(3-[(R)-2-аминопропиониламино]метилфенилсульфанил)ацетил]мутилина,14-O-[(3-[2-(2-аминоацетиламино)ацетиламино]метилфенилсульфанил)ацетил]мутилина,14-O-[(3-[R)-пирролидин-2-карбонил)амино]метилфенилсульфанил)ацетил]мутилина,14-O-[(3-[(R)-2-амино-3-(4-гидроксифенил)пропиониламино]метилфенилсульфанил)ацетил]мутилина,14-O-[(3-[2-аминоацетиламино]метилфенилсульфанил)ацетил]мутилина,14-O-[(3-[(S)-2-S)-2-аминопропиониламино)пропиониламино]метилфенилсульфанил)ацетил]мутилина,14-O-[(3-[S)-2-амино-3-метил)бутириламино]метилфенилсульфанил)ацетил]мутилина,14-O-[(3-(2-[R)-пирролидин-2-карбонил)амино]ацетиламино)метилфенилсульфанил)ацетил]мутилина,14-O-[(3-[2R,3S)-2-амино-3-гидрокси)бутириламино]метилфенилсульфанил)ацетил]мутилина,14-O-[(3-[(R)-2,6-диаминогексаноиламино]метилфенилсульфанил)ацетил]мутилина,14-O-[(3-[(R)-2-амино-3-(1 Н-индол-3-ил)пропиламино]метилфенилсульфанил)ацетил]мутилина,14-O-[(3-[(R)-2-амино-3-фенилпропиониламино]метилфенилсульфанил)ацетил]мутилина,14-O-[(3-[(R)-2-амино-3-карбамоилпропиониламино]метилфенилсульфанил)ацетил]мутилина,14-O-[(3-[(S)-2,6-диаминогексаноиламино]метилфенилсульфанил)ацетил]мутилина,14-O-[(3-[(S)-2-S)-2-амино-4-метилпентаноиламино)-4-метилпентаноиламино]метилфенилсуль- 21019806 фанил)ацетил]мутилина,14-O-[(3-[R)-2-амино-3-гидрокси)пропиониламино]метилфенилсульфанил)ацетил]мутилина,14-O-[(3-[(S)-2-аминопропиламино]метилфенилсульфанил)ацетил]мутилина,14-O-[(3-[(R)-2-амино-4-карбамоилбутириламино]метилфенилсульфанил)ацетил]мутилина,14-O-[(3-[S)-1-(2-аминоацетил)пирролидин-2-карбонил)амино]метилфенилсульфанил)ацетил] мутилина,14-O-[(3-[(R)-2-амино-3-(3 Н-имидазол-4-ил)пропиониламино]метилфенилсульфанил)ацетил]мутилина,14-O-[(3-[2S,4R)-4-гидроксипирролидин-2-карбонил)амино]метилфенилсульфанил)ацетил]мутилина,14-O-[(3-[S)-пиперидин-2-карбонил)амино]метилфенилсульфанил)ацетил]мутилина,14-O-[(3-[S)-пирролидин-2-карбонил)амино]метилфенилсульфанил)ацетил]мутилина,14-O-[(3-[(S)-2-амино-3-(4-гидроксифенил)пропиониламино]метилфенилсульфанил)ацетил]мутилина,14-O-[(3-[(S)-2-амино-3-фенилпропиониламино]метилфенилсульфанил)ацетил]мутилина,14-O-[(3-[S)-2-амино-3-гидрокси)пропиониламино]метилфенилсульфанил)ацетил]мутилина,14-O-[(3-[2S,3R)-2-амино-3-гидрокси)бутириламино]метилфенилсульфанил)ацетил]мутилина,14-O-[(3-[R)-2-амино-3-гидрокси)пропиониламино]метилфенокси)ацетил]мутилина,14-O-[(3-[R)-пирролидин-2-карбонил)амино]метилфенокси)ацетил]мутилина,14-O-[(3-[(S)-2-амино-3-(4-гидроксифенил)пропиониламино]метилфенокси)ацетил]мутилина,14-O-[(3-[(R)-2-амино-3-(4-гидроксифенил)пропиониламино]метилфенокси)ацетил]мутилина,14-O-[(3-[R)-пирролидин-2-карбонил)амино]метилфенокси)ацетил]-19,20-дигидромутилина,14-O-[(3-[R)-2-амино-3-гидрокси)пропиониламино]метилфенокси)ацетил]-19,20-дигидромутилина,14-O-[(3-[(S)-2-амино-3-(4-гидроксифенил)пропиониламино]метилфенокси)ацетил]-19,20 дигидромутилина, находящихся в свободной форме или в форме соли. 4. Соединение по пп.1-3 в форме соли. 5. Применение соединения по любому из пп.1-4 в качестве фармацевтического средства для лечения заболеваний, вызванных микробами. 6. Способ лечения заболеваний, вызванных микробами, включающий введение субъекту, нуждающемуся в таком лечении, эффективного количества соединения по любому из пп.1-4. 7. Применение соединения по любому из пп.1-4 для получения лекарственного средства для лечения заболеваний, вызванных микробами. 8. Применение по п.7, при котором заболеванием является заболевание кожи или мягких тканей. 9. Фармацевтическая композиция для лечения заболеваний, вызванных микробами, включающая соединение по любому из пп.1-4, в сочетании по меньшей мере с одним фармацевтическим эксципиентом.
МПК / Метки
МПК: C07C 237/20, A61K 31/16, A61K 31/404, C07D 209/08, C07D 207/46, A61K 31/435, C07C 323/32, C07D 211/32
Метки: качестве, производные, антимикробных, применение, средств, плевромутилина
Код ссылки
<a href="https://eas.patents.su/23-19806-proizvodnye-plevromutilina-i-ih-primenenie-v-kachestve-antimikrobnyh-sredstv.html" rel="bookmark" title="База патентов Евразийского Союза">Производные плевромутилина и их применение в качестве антимикробных средств</a>
Предыдущий патент: Комбинированный анальгетик на основе парацетамола
Следующий патент: Системы обработки геофизических данных
Случайный патент: Получение функционально эффективных органических соединений расщеплением лигнита












