Производные хинолилпропилпиперидина и их применение в качестве антимикробных средств
Номер патента: 9769
Опубликовано: 28.04.2008
Авторы: Миньяни Серж, Табар Мишель, Маллерон Жан-Люк, Эль Амад Юссеф, Биго Антони, Бак Эрик, Ронан Батист, Вивьяни Фабрис
Формула / Реферат
1. Производное хинолилпропилпиперидина, отличающееся тем, что оно отвечает общей формуле (I)

в которой R1a означает гидроксил и R1b означает атом водорода или R1a и R1b образуют оксогруппу;
R2 означает карбоксил;
R3 означает алкил, включающий 1-6 атомов углерода, замещенный фенилтиогруппой, которая сама может содержать от 1 до 4 заместителей, выбираемых из группы, состоящей из атома галогена, гидроксила, алкила, алкилоксигруппы, трифторметила, трифторметоксигруппы, карбоксила, алкилоксикарбонила, цианогруппы и аминогруппы; циклоалкилтиогруппой, циклическая часть которой является
3-7-членной, которая сама может содержать один или несколько заместителей, выбираемых среди атома галогена и трифторметила; или 5-6-членной гетероарилтиогруппой, содержащей от 1 до 4 гетероатомов, выбираемых среди атома азота, атома кислорода и атома серы, которая сама может содержать один или несколько заместителей, выбираемых из группы, состоящей из атома галогена, гидроксила, алкила, алкилоксигруппы, трифторметила, трифторметоксигруппы, карбоксила, алкилоксикарбонила, цианогруппы и аминогруппы; и
R4 означает алкил, содержащий 1-6 атомов углерода;
в его различных изомерных, энантиомерных и диастереоизомерных, отдельных или в виде смесей, формах, а также его соли.
2. Производное формулы (I) по п.1, в которой R3 означает этил, замещенный тиенилтиогруппой, фенилтиогруппой, замещенной галогеном, циклогексилтиогруппой или циклопентилтиогруппой.
3. Любое из производных общей формулы (I) по п.1, имеющих следующие названия:
4-[3-гидрокси-3-(3-хлор-6-метоксихинолин-4-ил)пропил]-1-[2-(2,5-дифторфенилсульфанил)этил]пиперидин-3-карбоновая кислота;
4-[3-гидрокси-3-(3-хлор-6-метоксихинолин-4-ил)пропил]-1-[2-(2-тиенилсульфанил)этил]пиперидин-3-карбоновая кислота;
в его различных изомерных, отдельных или в виде смесей, формах, а также его соли.
4. Способ получения производного хинолилпропилпиперидина по п.1, отличающийся тем, что цепь R3, определенную в п.1, вводят в реакцию конденсации с производным хинолилпропилпиперидина общей формулы (II)

в которой R4 имеет указанное в п.1 значение; либо R1a означает гидроксил и R1b означает атом водорода, либо R'1a и R1b образуют оксогруппу; и R'2 означает защищенный карбоксил или карбоксиметил, с получением производного хинолилпропилпиперидина общей формулы (III)
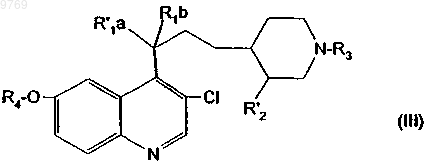
в которой R'1a, R1b, R'2, R3 и R4 имеют вышеуказанные значения;
в случае необходимости, гидроксил, обозначаемый радикалом R'1a, путем окисления превращают в оксогруппу, затем R'2 превращают в карбоксил, затем, в случае необходимости, изомеры разделяют, в случае необходимости, удаляют защитный радикал кислотной группы и/или, в случае необходимости, превращают полученный продукт в соль.
5. Способ по п.4, отличающийся тем, что производное хинолилпропилпиперидина общей формулы (II), в котором R'1a означает гидроксил, получают путем окисления в основной среде соответствующего производного, в котором R'1a и R1b означают атомы водорода, аминогруппа пиперидина промежуточно защищена и R'2 имеет вышеуказанное значение или означает карбоксил или карбоксиметил, и, в случае необходимости, путем повторной защиты карбоксила или карбоксиметила.
6. Способ по п.4, отличающийся тем, что производное хинолилпропилпиперидина общей формулы (II), в которой R'1a и R1b образуют оксогруппу, получают путем окисления известными способами производного общей формулы (II), в которой R'1a означает гидроксил, получаемого как описано в п.10.
7. Способ по п.4, отличающийся тем, что производное хинолилпропилпиперидина общей формулы (II), в котором R'2 означает защищенный карбоксиметил и R'1a и R1b означают атомы водорода, получают по способу, согласно которому конденсируют по реакции Виттига соответствующий илид фосфора с производным пиперидина общей формулы (IX)
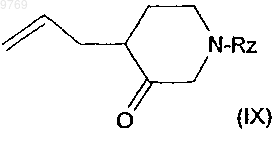
в которой Rz означает аминозащитную группу, с получением производного формулы (VIII)

в которой Rz имеет вышеуказанное значение и R"2 означает защищенный карбоксил, которое конденсируют с производным хинолина общей формулы (VII)
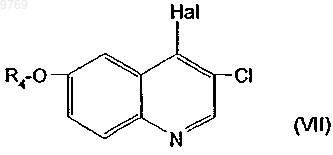
в которой R4 имеет указанное в п.1 значение и Hal означает атом йода или брома, с получением производного хинолилпропилпиперидина общей формулы (VI)
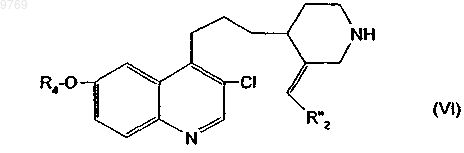
в которой R"2 и Rz имеют вышеуказанные значения, которое подвергают селективному гидрированию и, в случае необходимости, реакции удаления защиты аминогруппы.
8. Способ по п.7, отличающийся тем, что соединение формулы (II) подвергают реакции
восстановления защищенного карбоксиметила до гидроксиэтила, превращению его в
п-толуолсульфонилоксиэтильное производное, затем превращению этого производного в винильное производное путем реакции элиминирования с последующим окислением полученного производного и введением защитной группы для таким образом полученного карбоксила.
9. Способ по п.4, отличающийся тем, что производное хинолилпропилпиперидина общей формулы (II), в котором R'1a и R1b означают атомы водорода, получают путем реакции аллилирования сложного кетоэфира общей формулы (XIV)
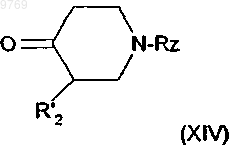
в которой R'2 имеет указанное в п.8 значение и Rz имеет указанное в п.7 значение, с образованием производного общей формулы (XIII)
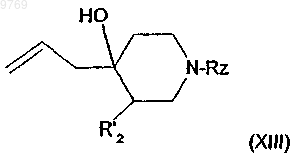
в которой R'2 и Rz имеют вышеуказанные значения, которое вводят во взаимодействие с алкилоксалилгалогенидом с получением производного общей формулы (XII)
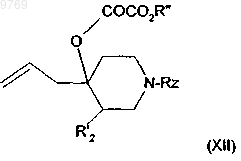
в которой R" означает алкил и R'2 и Rz имеют вышеуказанные значения, которое подвергают реакции радикального дезоксигенирования с получением производного общей формулы (X)
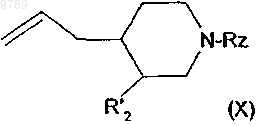
в которой R'2 и Rz имеют вышеуказанные значения, которое конденсируют с производным хинолина общей формулы (VII) по п.7 с получением производного общей формулы (XI)
затем удаляют аминозащитную группу Rz.
10. Применение производных хинолилпропилпиперидина по п.1, а также их фармацевтически приемлемых солей в качестве лекарственных средств.
11. Применение производных хинолилпропилпиперидина по любому из пп.2 или 3, а также их фармацевтически приемлемых солей в качестве лекарственных средств.
12. Фармацевтические композиции, содержащие в качестве действующего начала по меньшей мере одно лекарственное средство по любому из пп.10 и 11.
13. Производное хинолилпиперидина, отличающееся тем, что оно отвечает общей формуле (II)
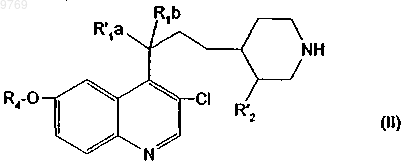
в которой R4 имеет указанное в п.1 значение, либо R'1a означает атом водорода или гидроксил и R1b означает атом водорода, либо R'1a и R1b образуют оксогруппу;
R'2 имеет указанное в п.4 значение.
14. Производэюх хинолилпропилпиперидина, отличающееся тем, что оно отвечает общей формуле (А)
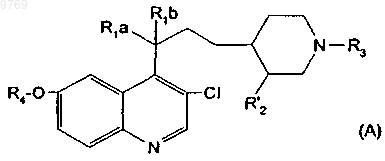
в которой R1a, R1b, R3 и R4 имеют указанные в п.1 значения;
R'2 имеет указанное в п.4 значение.
15. Производное хинолилпропилпиперидина, отличающееся тем, что оно отвечает общей формуле (VI)
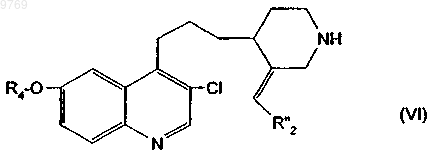
в которой R4 имеет указанное в п.1 значение;
R"2 и Rz имеют указанные в п.7 значения.
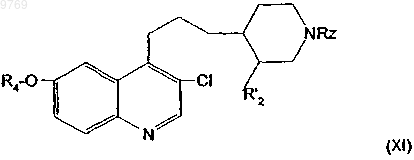
16. Производное хинолилпропилпиперидина, отличающееся тем, что оно отвечает общей формуле (XI)

в которой R4 имеет указанное в п.1 значение;
R'2 имеет указанное в п.4 значение;
Rz имеет указанное в п.7 значение.
Текст
009769 Настоящее изобретение относится к производным хинолилпропилпиперидина общей формулы которые активны в качестве антимикробных средств. Изобретение также относится к способу получения их и промежуточных продуктов и содержащим их фармацевтическим композициям. В международных заявках на патенты WO-99/37635 и WO-00/43383 описываются антимикробные производные хинолилпропилпиперидина общей формулы в которой радикал R1 означает, в частности, (C1-C6)алкоксил; радикал R2 означает водород; радикал R3 находится в положении 2 или 3 и означает (C1-C6)алкил, который может быть незамещен или замещен 1-3 заместителями, выбираемыми среди тиола, галогена, алкилтиогруппы, трифторметила,карбоксила, алкилоксикарбонила, алкилкарбонила, алкенилоксикарбонила, алкенилкарбонила, гидроксила, возможно замещенного алкилом, ;Z1-Z5 означают N или CR1a,Кроме того, в международных заявках на патенты WO-A-0125227 и WO-A-0240474 описываются,соответственно, производные типа 3-карбокси- или 3-гидроксиметилхинолилпропилпиперидина, но не включающие никакого заместителя в положении 3 хинолина, и производные типа 4-карбокси- или 4 гидроксиметилхинолилпропилпиперидина, включающие различные возможности замещения в положении 3 хинолина. Наконец, в заявке на европейский патент ЕР-30044 описываются производные хинолина, пригодные в качестве сердечно-сосудистых средств и отвечающие общей формулеR2 означает этил или винил;R3 означает, в частности, алкил, гидроксиалкил, циклоалкил, гидроксил, алкенил, алкинил, тетрагидрофурил, фенилалкил, возможно замещенный дифенилалкил, возможно замещенный бензоил или бензоилалкил, возможно замещенный гетероарил или гетероарилалкил;Z означает атом водорода или алкил или вместе с R3 образует циклоалкил. В настоящее время найдено, и это составляет объект настоящего изобретения, что продукты общей формулы (I), в которыхR1a означает гидроксил и R1b означает атом водорода или R1a и R1b образуют оксогруппу;R3 означает алкил, включающий 1-6 атомов углерода, замещенный фенилтиогруппой которая сама может содержать от 1 до 4 заместителей, выбираемых из группы,состоящей из атома галогена, гидроксила, алкила, алкилоксигруппы, трифторметила, трифторметоксигруппы, карбоксила, алкилоксикарбонила, цианогруппы и аминогруппы; циклоалкилтиогруппой, циклическая часть которой является 3-7-членной, которая сама может содержать один или несколько заместителей, выбираемых среди атома галогена и трифторметила; или 5-6-членной гетероарилтиогруппой, содержащей от 1 до 4 гетероатомов, выбираемых среди атома-1 009769 азота, атома кислорода и атома серы, которая сама может содержать один или несколько заместителей,выбираемых из группы, состоящей из атома галогена, гидроксила, алкила, алкилоксигруппы, трифторметила, трифторметоксигруппы, карбоксила, алкилоксикарбонила, цианогруппы и аминогруппы; иR4 означает алкил, содержащий 1-6 атомов углерода; в их изомерных, энантиомерных и диастереоизомерных, отдельных или в виде смесей формах, а также их соли являются сильнодействующими антибактериальными средствами. Подразумевают, что алкильные радикалы и части имеют линейную или разветвленную цепь и содержат, за исключением специального указания, от 1 до 4 атомов углерода и что в альтернативе, где R3 содержит атом галогена в качестве заместителя, могут быть выбраны среди атомов фтора, хлора, брома и йода, причем предпочтительным является атом фтора. В вышеприведенной общей формуле, когда R3 содержит гетероарильный заместитель, этот последний может быть выбран в качестве не исчерпывающего перечня, среди тиенила, фурила, пирролила,имидазолила, тиазолила, оксазолила, тиадиазолила, оксадиазолила, тетразолила, пиридила, пиридазинила, пиразинила и пиримидинила. Более конкретно, объектом изобретения являются производные общей формулы (I), имеющие следующие названия: 4-[3-гидрокси-3-(3-хлор-6-метоксихинолин-4-ил)пропил]-1-[2-(2,5-дифторфенилсульфанил)этил]пиперидин-3-карбоновая кислота; 4-[3-гидрокси-3-(3-хлор-6-метоксихинолин-4-ил)пропил]-1-[2-(2-тиенилсульфанил)этил]пиперидин-3-карбоновая кислота; в их различных изомерных, отдельных или в виде смесей, формах, а также их соли. Согласно изобретению продукты общей формулы (I) могут быть получены путем реакции конденсации цепи R3 с производным хинолилпропилпиперидина общей формулыR'1a означает гидроксил и R1b означает атом водорода либо R'1a и R1b образуют оксогруппу;R'2 означает защищенный карбоксил или карбоксиметил с образованием производного хинолилпропилпиперидина общей формулы в которой R'1a, R1b, R'2 и R4 и R3 имеют вышеуказанные значения; затем, в случае необходимости, путем превращения гидроксила, обозначаемого радикалом R'1a, в оксогруппу; затем путем превращения R'2 в карбоксил; затем, в случае необходимости, путем разделения изомеров, в случае необходимости, удаления защитного радикала кислотной группы и/или, в случае необходимости, превращения полученного продукта в соль. Реакцию конденсации цепи R3 с пиперидином преимущественно осуществляют путем воздействия производного общей формулыR3-X,(V) в которой R3 имеет вышеуказанное значение и X означает атом галогена, метилсульфонилоксигруппу,трифторметилсульфонилоксигруппу или п-толуолсульфонилоксигруппу, работая в безводной, предпочтительно, инертной среде (например, в атмосфере азота или аргона), в органическом растворителе, таком как амид (например, диметилформамид), кетон (например, ацетон) или нитрил (например, ацетонитрил),в присутствии основания, такого как органическое азотсодержащее основание (например, триэтиламин) или неорганическое основание (карбонат щелочного металла, например, карбонат калия), при температуре от 20C до температуры кипения с обратным холодильником растворителя. Предпочтительно воздействуют производным, в котором X означает атом брома или йода. Производные формулы (V) описаны или могут быть получены, как описывается, например, в международных заявках на патенты WO-200125227 или WO-200240474. Когда R3 означает пропаргил, замещенный фенилом, циклоалкилом или гетероарилом, можно также предпочтительно вводить в реакцию конденсации пропаргилгалогенид, затем замещать цепь фенилом,циклоалкилом или гетероарилом. В случае этой альтернативы конденсацию пропаргильной цепи осуще-2 009769 ствляют при использовании пропаргилбромида в вышеуказанных условиях, в случае необходимости, в присутствии йодида щелочного металла, как, например, йодид калия или натрия. Когда речь идет о замещении фенилом или гетероарилом, реакцию проводят путем воздействия галогенидного производного замещаемого циклического радикала в присутствии триэтиламина, в безводной среде, возможно без растворителя или в растворителе, таком как амид (например, диметилформамид) или нитрила (например, ацетонитрил) и в присутствии соли палладия, как, например, тетракис(трифенилфосфин)палладий, и йодида одновалентной меди при температуре от 20C до температуры кипения с обратным холодильником растворителя. Когда речь идет о замещении циклоалкилом, реакцию проводят путем воздействия литийорганического соединения, как н-бутиллитий или трет-бутиллитий, на вышеполученное пропаргильное производное в безводной среде, в простом эфире, как, например, тетрагидрофуран, при температуре от -78 до 0C,затем воздействия циклоалканона с последующим дезоксигенированием промежуточного спирта согласно классическим способам. Подразумевают, что, когда обозначаемые радикалом R3 алкильные радикалы содержат карбоксил или аминогруппу в качестве заместителей, эти последние предварительно защищают, затем после реакции высвобождают. Работают согласно обычным способам, которые не затрагивают остальной части молекулы, в частности согласно способам, описанным в руководстве T.W. Greene и P.G.M. Wuts"Protective Groups in Organic Synthesis" (2-е изд.), A. Wiley - Interscience Publication (1991) или в руководстве Me Omie "Protective Groups in Organic Chemistry", Plenum Press (1973). Защищенный карбоксил или карбоксиметил, обозначаемый радикалом R'2, может быть выбран среди легко гидролизующихся сложных эфиров. В качестве примера могут быть выбраны сложные метиловые, бензиловые, трет-бутиловые эфиры или еще сложные аллиловые или фенилпропиловые эфиры. В случае необходимости защиту карбоксила осуществляют одновременно с реакцией. В этом случае используют продукт общей формулы (II), содержащий радикал R'2 = карбоксил или карбоксиметил. Галогенирование, приводящее к производному, в котором R1a означает атом галогена, может быть осуществлено в присутствии трифторида аминосеры (как, например, трифторид диэтиламиносеры,трифторид бис-(2-метоксиэтил)аминосеры (Deoxofluor), трифторид морфолиносеры) или, альтернативно, в присутствии тетрафторида серы. Реакция фторирования также может быть осуществлена путем воздействия фторирующего агента, как фторид серы [например, трифторид морфолиносеры,тетрафторид серы (J. Org. Chem., 40, 3808 (1975, трифторид диэтиламиносеры (Tetrahedron, 44, 2875(1988, трифторид бис-(2-метоксиэтил)аминосеры (Deoxofluor)]. Альтернативно, реакцию фторирования также можно осуществлять с помощью фторирующего агента, как гексафторпропилдиэтиламин(патент Японии 2039546) или N-(2-хлор-1,1,2-трифторэтил)диэтиламин. Реакцию галогенирования также можно осуществлять с помощью такого реагента, как тетраалкиламмонийгалогенид,триалкилбензиламмонийгалогенид или триалкилфениламмонийгалогенид, или с помощью галогенида щелочного металла, в случае необходимости, с добавленным краун-эфиром. Когда используют тетраалкиламмонийгалогенид, то этот последний может быть выбран в качестве примера среди тетраметиламмонийгалогенида, тетраэтиламмонийгалогенида, тетрапропиламмонийгалогенида, тетрабутиламмонийгалогенида (например, тетра-н-бутиламмонийгалогенид), тетрапентиламмонийгалогенида, тетрациклогексиламмонийгалогенида, триэтилметиламмонийгалогенида,трибутилметиламмонийгалогенида или триметилпропиламмонийгалогенида. Работают в органическом растворителе, таком как хлорированный растворитель (например,дихлорметан, дихлорэтан, хлороформ), или в простом эфире (например, тетрагидрофуран, диоксан) при температуре от -78 до 40C (предпочтительно от 0 до 30C). Предпочтительно работают в инертной среде (в частности, в атмосфере аргона или азота). Также можно работать путем воздействия галогенирующего агента, как тионилхлорид или трихлорид фосфора, в органическом растворителе, таком как хлорированный растворитель (например,дихлорметан, хлороформ), при температуре от 0C до температуры кипения с обратным холодильником реакционной смеси. Превращение гидроксила в оксогруппу осуществляют классическими способами окисления, описанными в литературе, например путем окисления согласно D. Swern, J.O.C., 44, 41-48 (1979), в частности, в присутствии оксалилхлорида и диметилсульфоксида, в случае необходимости, в растворителе, как,например, дихлорметан, при температуре от -60 до 20C. Превращение оксогруппы в гидроксииминогруппу или алкилоксииминогруппу осуществляют путем воздействия гидроксиламина или алкилоксиамина, в случае необходимости, в форме гидрохлорида, в растворителе, таком как пиридин или спирт (такой, как метанол или этанол), и в присутствии азотсодержащего основания, такого как триэтиламин или пиридин, при температуре от 0 до 60C. Восстановление производного общей формулы (IV), в которой R5 означает атом водорода, до амина осуществляют обычными способами, которые не затрагивают остальной части молекулы, в частности путем воздействия восстановителя, как, например, гидрид (например, боргидрид щелочного металла, как боргидрид натрия или боргидрид калия, или литийалюминийгидрид), в присутствии или в отсутствие-3 009769 оксида молибдена, работая предпочтительно в инертной атмосфере (например, в атмосфере азота или аргона), в органическом растворителе, как спирт (например, метанол, этанол, изопропанол) или хлорированный растворитель (например, дихлорметан), при температуре от -10 до 40C. Восстановление производного общей формулы (IV) до гидроксиламина или алкилоксиамина осуществляют, в частности, в присутствии органической кислоты (карбоновая кислота, как, например, уксусная кислота), путем воздействия восстановителя, как, например, гидрид, выбираемый среди триацетоксиборгидрида натрия (в случае необходимости, получаемого in situ) и цианоборгидрида натрия, предпочтительно, в инертной атмосфере (например, в атмосфере азота или аргона), в органическом растворителе, как спирт (например, метанол, этанол, изопропанол) или хлорированный растворитель (например,дихлорметан), при температуре от -30 до 40C. Превращение аминогруппы, обозначаемой радикалом R1a, в алкиламиногруппу или диалкиламиногруппу осуществляют обычными способами, в частности путем воздействия алкилгалогенида, в случае необходимости, в основной среде, в присутствии азотсодержащего основания, как триалкиламин(триэтиламин, диизопропилэтиламин, ), пиридин, или в присутствии гидрида щелочного металла(гидрид натрия), в инертном растворителе, как амид (например, диметилформамид) или оксид (например, диметилсульфоксид), при температуре от 20C до температуры кипения с обратным холодильником реакционной смеси. Превращение алкилоксиаминогруппы, обозначаемой радикалом R1a, в алкилалкилоксиаминогруппу осуществляют способом, описанным выше для алкилирования амина. Превращение R'2 в карбоксил или карбоксиметил осуществляют обычными способами, в частности путем кислотного гидролиза или омыления сложного эфира R'2. В частности, используют гидроксид натрия в водно-органической среде, например, в спирте, как метанол, или в простом эфире, как диоксан,при температуре от 20C до температуры кипения с обратным холодильником реакционной смеси. Также можно осуществлять гидролиз в водной соляно-кислой среде при температуре от 20 до 100C. Восстановление до гидроксиметила в случае производного, в котором R'2 означает защищенный карбоксил, может быть осуществлено обычными способами, известными специалисту, которые не затрагивают остальной части молекулы, в особенности, путем воздействия гидрида (как, например,литийалюминийгидрид или диизобутилалюминийгидрид), в растворителе, таком как простой эфир (например, тетрагидрофуран), при температуре от 20 до 60C. Восстановление свободной кислоты может быть осуществлено также известными специалисту способами, например путем гидрирования в присутствии катализатора на основе родия или рутения, путем воздействия боргидрида натрия в присутствии кислоты Льюиса или литийалюминийгидрида в простом эфире. Превращение гидроксиметила в положении 3 пиперидина в карбоксиметил осуществляют обычными способами, которые не затрагивают остальной части молекулы, в частности путем воздействия галогенирующего агента, как, например, тионилхлорид или трихлорид фосфора или трибромид фосфора, или тозилирующего агента, затем цианида щелочного металла, например, цианида калия или цианида натрия,для получения соответствующего цианометильного производного с последующим гидролизом нитрила. Когда радикал R1 означает аминогруппу, этот радикал предпочтительно предварительно защищают известными и вышеуказанными в случае R3 способами. Галогенирование можно осуществлять в хлорированном растворителе (как, например, дихлорметан или хлороформ) при температуре от 0C до температуры кипения с обратным холодильником растворителя. Производное хинолилпропилпиперидина общей формулы (II), в которой R'1a означает гидроксил иR1b означает атом водорода, может быть получено путем окисления в основной среде соответствующего производного, в котором R'1a и R1b означают атомы водорода, аминогруппа пиперидина промежуточно защищена и R'2 имеет вышеуказанное значение или означает карбоксил или карбоксиметил, и, в случае необходимости, повторной защиты карбоксила или карбоксиметила. Окисление осуществляют путем воздействия кислорода, предпочтительно в инертном растворителе, таком как диметилсульфоксид, в присутствии трет-бутанола и основания, такого как трет-бутилат калия или натрия, при температуре от 0 до 100C. Производное хинолилпропилпиперидина общей формулы (II), в которой R'1a и R1b образуют оксогруппу, может быть получено способом, аналогичным указанному выше, путем классических способов окисления, исходя из производного общей формулы (II), в которой R'1a означает гидроксил, защищая промежуточно атом азота пиперидина. Производное хинолилпропилпиперидина общей формулы (II), в которой R'2 означает защищенный карбоксиметил, и R'1a и R1b означают атомы водорода, может быть получено путем селективного гидрирования производного хинолилпропилпиперидина общей формулыR"2 означает защищенный карбоксил, соответствующий R'2, и где аминогруппа пиперидина предварительно защищена, при давлении 1-100 бар и при температуре от 20 до 80C в растворителе, как, в частности, спирт (например, этанол) или амид (например, диметилформамид), в присутствии катализатора,например палладия-на-угле или палладия-на-сульфате бария. Защиту аминогруппы пиперидина осуществляют обычными способами, которые не затрагивают остальной части молекулы и совместимы с реакцией, в частности, согласно рекомендациям, относящимся к вышеуказанным защитным группам. Защитной группой предпочтительно является бензилоксикарбонил. В этом случае реакция гидрирования приводит прямо к удалению защитной группы амина. Производное хинолилпропилпиперидина общей формулы (VI) может быть получено путем реакции конденсации производного хинолина общей формулы в которой R4 имеет вышеуказанное значение и Hal означает атом йода или брома, с производным пиперидина общей формулы в которой R"2 имеет вышеуказанное значение и Rz означает аминозащитную группу. Реакцию осуществляют путем последовательного воздействия борорганического соединения (например 9-борабицикло[3,3,1]нонан), в растворителе, таком как простой эфир (например, тетрагидрофуран, диоксан), при температуре от -20 до 20C, затем производного хинолина общей формулы (VII) по аналогии со способами, описанными Suzuki et al., Pure and Appl. Chem., 57, 1749 (1985), и путем удаления защитного для аминогруппы радикала Rz. Реакцию обычно проводят в присутствии соли палладия (как,например, дифенилфосфинферроценпалладийхлорид) и основания, как фосфат калия, при температуре от 20C до температуры кипения с обратным холодильником растворителя. Удаление радикала Rz осуществляют известными и указанными выше, представленными в примерах способами или способами, описанными в руководстве T.W. Greene и P.G.M. Wuts "Protective Groups"Protective Groups in Organic Chemistry", Plenum Press (1973). Производное пиперидина общей формулы (VIII) может быть получено путем реакции Виттига, путем конденсации илида фосфора с производным пиперидина общей формулы в которой Rz имеет вышеуказанное значение. Работают преимущественно при использовании метил(трифенилфосфоранилиден)ацетата в растворителе, таком как, например, толуол, при температуре от 20 до 110C. Производное 3-оксопиперидина общей формулы (IX) может быть получено согласно или по аналогии со способом, описанным Y. Takeuchi et al., Synthesis, 10, 1814 (1999). Производные хинолина общей формулы (VII) могут быть получены по способу, описанному в международной заявке на патент WO-200240474-A2. Производное хинолилпропилпиперидина общей формулы (II), в которой R'2 означает защищенный карбоксил и R'1a и R1b означают атомы водорода, может быть получено из соответствующего производного, в котором R'2 означает защищенный карбоксиметил, путем восстановления этого радикала до гидроксиэтила, превращения в п-толуолсульфонилоксиэтильное производное, затем превращения этого производного в винильное производное путем реакции элиминирования с последующим окислением-5 009769 полученного производного до карбоксильного производного и введением защитной группы для полученного таким образом карбоксила. Восстановление защищенной кислотной группы до гидроксиэтила осуществляют обычными способами, которые не затрагивают остальной части молекулы, в частности воздействуют гидридом (как, например, литийалюминийгидрид или диизобутилалюминийгидрид) в растворителе, таком как простой эфир (например, тетрагидрофуран), при температуре от 20 до 60C. Превращение гидроксиэтильного производного в п-толуолсульфонилоксиэтильное производное осуществляют, в частности, согласно способу, описанному L.F. Fieser и М. Fieser, "Reagents for OrganicSynthesis", том 1, 1179 (1967), исходя из п-толуолсульфонилхлорида в присутствии основания, как третичный амин (например, триэтиламин) или ароматический амин (как, например, пиридин), в галогенсодержащем растворителе (как, например, дихлорметан) или без растворителя, при температуре от 0 до 50C. Превращение п-толуолсульфонилоксиэтильного производного в винильное производное осуществляют путем реакции элиминирования, в частности, согласно способу, описанному A. Sharma et al., Org.Prep. Proced. Int., 25(3), 330-333 (1993), в присутствии основания, как, например, трет-бутилат калия, в растворителе, таком как, например, диметилсульфоксид, при температуре от 20 до 100C. Превращение винильного производного в карбоксильное производное осуществляют способами окисления, описанными в литературе, в частности, с помощью метаперйодата натрия в присутствии гидрата трихлорида рутения, в смеси растворителей, как, например, смесь вода/ацетонитрил, при температуре от 20 до 60C. Согласно альтернативе производное хинолилпропилпиперидина общей формулы (II), в которой R'1a и R1b означают атомы водорода, может быть получено путем реакции конденсации производного хинолина общей формулы (VII), такой, как приведенная выше, с производным пиперидина общей формулы в которой Rz и R'2 имеют вышеуказанные значения, с образованием производного общей формулы затем удаляют аминозащитную группу Rz. Реакцию проводят в условиях, аналогичных условиям, описанным для реакции производного хинолина общей формулы (VII) и производного пиперидина общей формулы (VIII). Удаление группы Rz осуществляют согласно известным и указанным выше способам. Согласно изобретению производные, соответствующие таковым вышеприведенной общей формулы(XI), в которой R'2 означает защищенный карбоксил, могут быть превращены в производные, в которыхR'2 означает карбоксиметил, в условиях, аналогичных таковым, описанным выше, т.е. путем восстановления защищенного карбоксила до гидроксиметила и превращения его в карбоксиметил. Производное пиперидина общей формулы (X) может быть получено путем радикального дезоксигенирования с помощью трибутилоловогидрида в присутствии 2,2'-азо-бис-изобутиронитрилаR'2 и Rz имеют вышеуказанные значения. Реакцию радикального дезоксигенирования осуществляют с помощью трибутилоловогидрида в присутствии АИБН в инертном растворителе, как толуол или бензол, при температуре от 20C до температуры кипения с обратным холодильником, по аналогии со способом, описанным в J. Org. Chem., 61,7189 (1996). Производное пиперидина общей формулы (XII) может быть получено путем воздействия алкилоксалилгалогенида, такого как метилоксалилхлорид, на производное общей формулы в которой R'2 и Rz имеют вышеуказанные значения. Эту реакцию проводят в присутствии основания, как 4-диметиламинопиридин, в инертном растворителе, как ацетонитрил или дихлорметан, при температуре от 0 до 50C по аналогии со способом, описанным в J. Org. Chem., 61, 7189 (1996). Производное пиперидина общей формулы (XIII), в которой R'2 означает защищенный карбоксил иRz имеет вышеуказанное значение, может быть получено путем реакции аллилирования сложного кетоэфира общей формулы в которой R'2 и Rz имеют вышеуказанные значения. Когда R'2 означает защищенный карбоксил, эту реакцию аллилирования осуществляют либо с помощью аллилбромида, цинка и хлорида аммония в инертном растворителе, как тетрагидрофуран или диоксан, при температуре от 20C до температуры кипения с обратным холодильником растворителя по аналогии со способом, описанным в J. Chem. Soc. Comm., 1217 (1994), либо с помощью аллилбромида в присутствии индия в смеси из спирта, как метанол или этанол, и воды, при температуре от 20 до 70C по аналогии со способом, описанным в Tetrahedron Letters, 54, 2347 (1998). Когда R'2 означает защищенный карбоксиметил, алкилирование можно осуществлять путем реакции типа Гриньяра, используя соответствующий металлоорганический реагент. Соединения общей формулы (XIV) известны или их можно получать известными способами,например,исходя из алкил-4-оксо-3-пиперидинкарбоксилата,предпочтительно,метил-4-оксо-3-пиперидинкарбоксилата, за счет применения или адаптации к способу, описанному вTetrahedron Letters, 32, 3643 (1991), или исходя из алкил-4-оксо-3-пиперидинацетата или 4-оксо-3-пиперидинуксусной кислоты, атом азота которой защищен. Такие производные описываются,например, в Chem. Pharm. Bull., 31 (11), 4135-4138 (1983) или в заявках на патенты Японии 54098771 или 56038147. Различные промежуточные продукты типа хинолилпропилпиперидина, в которых R4 означает алкенил-CH2-, алкинил-CH2-, циклоалкил или циклоалкилалкил, могут быть получены по аналогии с получением промежуточных продуктов, в которых R4 означает алкил, путем воздействия соответствующего галогенированного производного на производное хинолина, гидроксилированное в положении 6. Подразумевают, что производные общей формулы (I), а также промежуточные продукты формул(II)-(IV), также как промежуточные продукты для их получения, обладают "цис/транс" изомерией на уровне заместителей в положении 3 и 4 пиперидина. Производные конфигурации "транс" могут быть получены из производных конфигурации "цис" согласно или по аналогии со способом, описанным в международной заявке на патент WO-99/37635, или из промежуточных продуктов, существующих в виде смесей, после разделения известными способами. Производные хинолилпропилпиперидина общей формулы (I) могут быть очищены, в случае необходимости, физическими методами, такими как кристаллизация или хроматография. Кроме того, также подразумевают, что, с одной стороны, в случае соединений общей формулы (I),когда R1b означает атом водорода и R1a является другим, чем атом водорода, и, с другой стороны, в случае соединений общей формулы (XII) и (XIII) также существуют энантиомерные и диастереоизомерные формы, которые, также как их смеси, входят в рамки настоящего изобретения. Эти последние, в случае необходимости, могут быть разделены хроматографией на диоксиде кремния или высокоэффективной жидкостной хроматографией (ВЭЖХ). Точно также, цис- и транс-производные могут быть разделены хроматографией на диоксиде кремния или высокоэффективной жидкостной хроматографией (ВЭЖХ). Производные хинолилпропилпиперидина общей формулы (I) могут быть превращены в аддитивные соли кислот известными способами. Подразумевают, что эти соли также входят в рамки настоящего изобретения. В качестве примеров аддитивных солей фармацевтически приемлемых кислот могут быть указаны соли, образуемые с неорганическими кислотами (гидрохлориды, гидробромиды, сульфаты, нитраты,фосфаты), или с органическими кислотами (сукцинаты, фумараты, тартраты, ацетаты, пропионаты,малеаты, цитраты, метансульфонаты, этансульфонаты, фенилсульфонаты, п-толуолсульфонаты,изетионаты, нафтилсульфонаты или камфорсульфонаты), или с замещенными производными этих соединений.-7 009769 Некоторые производные хинолилпропилпиперидина общей формулы (I), содержащие карбоксил,сами по себе известными способами могут быть превращены в соли металлов или в аддитивные соли азотсодержащих оснований. Эти соли также входят в рамки настоящего изобретения. Соли могут быть получены путем воздействия металлического основания (например, основания щелочного или щелочноземельного металла), гидроксида аммония или амина на продукт согласно изобретению в соответствующем растворителе, таком как спирт, простой эфир или вода, или путем реакции обмена с солью органической кислоты. Образовавшаяся соль осаждается после возможного концентрирования раствора,ее отделяют путем отфильтровывания, декантации или лиофилизации. В качестве примеров фармацевтически приемлемых солей можно указать соли со щелочными металлами (натрий, калий, литий) или со щелочно-земельными металлами (магний, кальций), аммониевую соль, соли азотсодержащих оснований (этаноламин, диэтаноламин, триметиламин, триэтиламин, метиламин, пропиламин, диизопропиламин,N,N-диметилэтаноламин,бензиламин,дициклогексиламин,N-бензилфенетиламин,N,N'-дибензилэтилендиамин, дифенилендиамин, бензгидриламин, хинин, холин, аргинин, лизин, лейцин,дибензиламин). Производные хинолилпропилпиперидина согласно изобретению являются особенно представляющими интерес антибактериальными средствами.In vitro, в случае грамположительных бактерий производные хинолилпропилпиперидина согласно изобретению оказались активными в концентрациях от 0,03 до 4 мкг/мл в отношении StaphylococcusStreptococcus pneumoniae 6254-01 и в концентрациях от 0,06 до 64 мкг/мл в отношении Enterococcus faecium Н 983401, и в случае грамотрицательных бактерий они оказались активными в концентрациях от 0,12 до 32 мкг/мл в отношении Moraxella catharrhalis IPA152; in vivo, они оказались активными в отношении экспериментальных инфекций мыши с помощью Staphylococcus aureus IP8203 в дозах от 12 до 150 мг/кг подкожно (DC50) и в случае некоторых из них в дозах от 26 до 150 мг/кг перорально. Кроме того, продукты согласно изобретению особенно представляют интерес из-за их незначительной токсичности. Ни один из продуктов не проявил токсичности в дозе 100 мг/кг подкожно в случае мыши. Эти свойства делают вышеуказанные продукты, а также их фармацевтически приемлемые соли кислот и оснований пригодными для использования в качестве лекарственных средств при лечении чувствительных к микробам заболеваний, провоцируемых грамположительными бактериями, и особенно при лечении стафилококковых инфекций, таких как стафилококковые сепсисы, злокачественные стафилококковые инфекции лица или кожи, пиодермиты, септические или гноящиеся раны, карбункулы, флегмоны, рожи, острые простейшие или постгриппозные стафилококковые инфекции, бронхопневмонии,легочные нагноения. Эти продукты также могут быть использованы в качестве лекарственных средств в случае лечения колибациллезов и ассоциированных инфекций, в случае инфекций за счет протеоз, клебсиеллы и сальмонеллы и в случае других заболеваний, провоцируемых грамотрицательными бактериями. Следовательно, объектом настоящего изобретения также, в качестве лекарственных средств и, в особенности, лекарственных средств, предназначенных для лечения бактериальных инфекций в случае человека или животного, являются соединения формулы (I), такие как указанные выше, а также их фармацевтически приемлемые соли, и, в частности, предпочтительные соединения, указанные выше. Настоящее изобретение также относится к фармацевтическим композициям, содержащим по меньшей мере одно производное хинолилпропилпиперидина согласно изобретению, в случае необходимости,в виде соли, в чистом состоянии или в виде ассоциации с одним или несколькими совместимыми и фармацевтически приемлемыми разбавителями или адъювантами. Композиции согласно изобретению могут быть использованы для введения перорально, парентерально, локально, ректально или в виде аэрозолей. В качестве твердых композиций для введения перорально могут быть использованы таблетки, пилюли, желатиновые капсулы, порошки или гранулы. В этих композициях активный продукт согласно изобретению смешан с одним или несколькими инертными разбавителями или адъювантами, такими, как сахароза, лактоза или крахмал. Эти композиции могут включать вещества, другие, чем разбавители, например смазку, такую как стеарат магния, или покрытие, предназначенное для контролируемого высвобождения. В качестве жидких композиций для введения перорально можно использовать фармацевтически приемлемые растворы, суспензии, эмульсии, сиропы и эликсиры, содержащие инертные разбавители,такие как вода или парафиновое масло. Эти композиции также могут включать вещества, другие, чем разбавители, например смачиватели, подсластители или ароматизаторы. Композиции для парентерального введения могут представлять собой стерильные растворы или эмульсии. В качестве растворителя или эксципиента можно использовать воду, пропиленгликоль, полиэтиленгликоль, растительные масла, в особенности оливковое масло, сложные органические эфиры для инъекций, например этилолеат. Эти композиции также могут содержать адъюванты, в особенности смачиватели, изотонизирующие агенты, эмульгаторы, диспергаторы и стабилизаторы.-8 009769 Стерилизацию можно осуществлять несколькими способами, например с помощью бактериологического фильтра, путем облучения или путем нагревания. Они также могут быть приготовлены в форме твердых стерильных композиций, которые могут быть растворены в момент употребления в стерильной воде или любой другой стерильной среде для инъекций. Композициями для локального применения могут быть, например, кремы, помады, лосьоны или аэрозоли. Композиции для ректального введения представляют собой суппозитории или ректальные капсулы,которые содержат, кроме действующего начала, эксципиенты, такие как масло какао, полусинтетические глицериды или полиэтиленгликоли. Композиции также могут представлять собой аэрозоли. Для использования в виде жидких аэрозолей композиции могут представлять собой стерильные стабильные растворы или твердые композиции,растворяемые в момент употребления в стерильной апирогенной воде, в сыворотке или любом другом фармацевтически приемлемом эксципиенте. В случае применения в форме сухих аэрозолей, предназначенных непосредственно для ингаляции, действующее начало тонко измельчают и ассоциируют с разбавителем или водорастворимым эксципиентом с гранулометрией от 30 до 80 мкм, как, например,декстран, маннит или лактоза. В терапии человека новые производные хинолилпропилпиперидина согласно изобретению особенно пригодны в случае лечения инфекций бактериального происхождения. Дозы зависят от искомого эффекта и продолжительности лечения. Врач определяет дозировку, которую он считает наиболее соответствующей с точки зрения лечения, в зависимости от возраста, массы, степени инфекции и других факторов, присущих подвергаемому лечению субъекту. Обычно дозы составляют от 750 мг до 3 г активного продукта 2 или 3 раза в сутки перорально или от 400 мг до 1,2 г внутривенно для взрослого. Следующий пример иллюстрирует композицию согласно изобретению. Обычным способом приготовляют жидкую композицию, предназначенную для использования парентерально, содержащую Наконец, объектами изобретения в качестве новых промышленных продуктов и, в частности, в качестве промежуточных продуктов, необходимых для получения продуктов формулы (I), являются следующие: продукты формулы (II), приведенной выше; продукты формулы (А)(III) или получаемым промежуточно в результате различных обработок, осуществляемых в отношении продуктов формулы (III); продукты формулы (IV), приведенной выше; продукты формулы (VI), приведенной выше; продукты формулы (XI), приведенной выше. Из продуктов согласно изобретению в высшей степени представляющими интерес являются производные хинолилпропилпиперидина, указываемые ниже, и, в частности, таковые, описанные в примерах,в качестве не исчерпывающего перечня(3S,4S)-4-[3-(R)-гидрокси-3-(3-хлор-6-метоксихинолин-4-ил)пропил]-1-[2-(2,5-дифторфенилсульфанил)этил]пиперидин-3-карбоновая кислота. Четыре стереоизомера ниже называют как A, B, C и D. Их абсолютная стереохимия неизвестна. Стереоизомер A. К раствору 390 мг метил-4-[3-гидрокси-3-(3-хлор-6-метоксихинолин-4-ил)пропил]-1-[2-(2,5 дифторфенилсульфанил)этил]пиперидин-3-карбоксилата (сложный эфир, изомер A) в 10 см 3 диоксана добавляют 2 см 3 1 н. водного раствора гидроксида натрия. Реакционную среду затем нагревают при температуре 70C в течение 5 ч, выдерживают в течение 18 ч при возврате к температуре 20C, затем снова нагревают при температуре 70C в течение 2 ч. После возврата к температуре 20C реакционную среду выпаривают при пониженном давлении (2 кПа; 45C). Остаток обрабатывают с помощью 25 см 3 дистиллированной воды и экстрагируют с помощью 25 см 3 диэтилового эфира. Водную фазу подкисляют с помощью 1,9 см 3 1 н. соляной кислоты и экстрагируют 3 раза по 70 см 3 этилацетата. Органическую фазу сушат над сульфатом магния, фильтруют через стеклянный пористый фильтр, затем концентрируют при пониженном давлении (2 кПа; 45C). Остаток обрабатывают с помощью 25 см 3 ацетона, затем снова концентрируют при пониженном давлении (2 кПа; 45C). После высушивания в сушильном шкафу при пониженном давлении (10 кПа; 20C) получают 340 мг 4-[3-гидрокси-3-(3-хлор-6-метоксихинолин-4 ил)пропил]-1-[2-(2,5-дифторфенилсульфанил)этил]пиперидин-3-карбоновой кислоты (изомер A) в виде твердого вещества бежевого цвета. 1 Н-ЯМР-спектр (400 МГц, (CD3)2SO-d6;м.д.): 1,34 (м, 1 Н); 1,50-1,85 (м, 5 Н); 2,10 (м, 1 Н); 2,28 (м,1 Н); 2,43 (д, очень ушир., J=11,55 Гц, 1H); 2,45-2,60 (м, 1 Н); 2,65 (т, J=7 Гц, 2 Н); 2,73 (массив, 1 Н); 2,86D20 = 52,31,1 (0,5% в метаноле). Стереоизомер B. К раствору 460 мг метил-4-[3-гидрокси-3-(3-хлор-6-метоксихинолин-4-ил)пропил]-1-[2-(2,5 дифторфенилсульфанил)этил]пиперидин-3-карбоксилата (сложный эфир, изомер B) в 10 см 3 диоксана добавляют 2,4 см 3 1 н. водного раствора гидроксида натрия. Реакционную среду затем нагревают при температуре 70C в течение 5 ч, выдерживают в течение 18 ч при возврате к температуре 20C, затем снова нагревают при температуре 70C в течение 2 ч. После возврата к температуре 20C реакционную среду выпаривают при пониженном давлении (2 кПа; 45C). Остаток обрабатывают с помощью 25 см 3 дистиллированной воды и экстрагируют с помощью 25 см 3 диэтилового эфира. Водную фазу подкисляют(рН 6) с помощью 2,3 см 3 1 н. соляной кислоты и экстрагируют 3 раза по 70 см 3 этилацетата. Органическую фазу сушат над сульфатом магния, фильтруют через стеклянный пористый фильтр, затем концентрируют при пониженном давлении (2 кПа; 45C). Остаток обрабатывают с помощью 25 см 3 ацетона,затем снова концентрируют при пониженном давлении (2 кПа; 45C). После высушивания в сушильном- 19009769 шкафу при пониженном давлении (10 кПа; 20C) получают 310 мг 4-[3-гидрокси-3-(3-хлор-6 метоксихинолин-4-ил)пропил]-1-[2-(2,5-дифторфенилсульфанил)этил]пиперидин-3-карбоновой кислоты(изомер B) в виде твердого вещества бледно-желтого цвета. 1 Н-ЯМР-спектр (400 МГц, (CD3)2SO-d6, при температуре 303 K;м.д.): 1,20-1,40 (м, 1 Н); 1,50-1,85D20=-53,11,1 (0,5% в метаноле). Стереоизомер C. К раствору 270 мг метил-4-[3-гидрокси-3-(3-хлор-6-метоксихинолин-4-ил)пропил]-1-[2-(2,5 дифторфенилсульфанил)этил]пиперидин-3-карбоксилата (сложный эфир, изомер C) в 10 см 3 диоксана добавляют 1,4 см 3 1 н. водного раствора гидроксида натрия. Реакционную среду затем нагревают при температуре 70C в течение 5 ч, выдерживают в течение 18 ч при возврате к температуре 20C, затем снова нагревают при температуре 70C в течение 4 ч. После возврата к температуре 20C реакционную среду выпаривают при пониженном давлении (2 кПа; 45C). Остаток обрабатывают с помощью 25 см 3 дистиллированной воды и экстрагируют с помощью 25 см 3 диэтилового эфира. Водную фазу подкисляют(рН=6) с помощью 1,3 см 3 1 н. соляной кислоты и экстрагируют 3 раза по 70 см 3 этилацетата. Органическую фазу сушат над сульфатом магния, фильтруют через стеклянный пористый фильтр, затем концентрируют при пониженном давлении (2 кПа; 45C). Остаток обрабатывают с помощью 25 см 3 ацетона,затем снова концентрируют при пониженном давлении (2 кПа; 45C). После высушивания в сушильном шкафу при пониженном давлении (10 кПа; 20C) получают 310 мг 4-[3-гидрокси-3-(3-хлор-6 метоксихинолин-4-ил)пропил]-1-[2-(2,5-дифторфенилсульфанил)этил]пиперидин-3-карбоновой кислоты(изомер C) в виде твердого вещества бежевого цвета. 1D20=60,11,2 (0,5% в метаноле). Стереоизомер D. К раствору 270 мг метил-4-[3-гидрокси-3-(3-хлор-6-метоксихинолин-4-ил)пропил]-1-[2-(2,5 дифторфенилсульфанил)этил]пиперидин-3-карбоксилата (сложный эфир, изомер D) в 10 см 3 диоксана добавляют 1,4 см 3 1 н. водного раствора гидроксида натрия. Реакционную среду затем нагревают при температуре 70C в течение 5 ч, выдерживают в течение 18 ч при возврате к температуре 20C, затем снова нагревают при температуре 70C в течение 4 ч. После возврата к температуре 20C реакционную среду выпаривают при пониженном давлении (2 кПа; 45C). Остаток обрабатывают с помощью 25 см 3 дистиллированной воды и экстрагируют с помощью 25 см 3 диэтилового эфира. Водную фазу подкисляют(рН 6) с помощью 1,3 см 3 1 н. соляной кислоты и экстрагируют 3 раза по 70 см 3 этилацетата. Органическую фазу сушат над сульфатом магния, фильтруют через стеклянный пористый фильтр, затем концентрируют при пониженном давлении (2 кПа; 45C). Остаток обрабатывают с помощью 25 см 3 ацетона,затем снова концентрируют при пониженном давлении (2 кПа; 45C). После высушивания в сушильном шкафу при пониженном давлении (10 кПа; 20C) получают 200 мг 4-[3-гидрокси-3-(3-хлор-6 метоксихинолин-4-ил)пропил]-1-[2-(2,5-дифторфенилсульфанил)этил]пиперидин-3-карбоновой кислоты(изомер D) в виде твердого вещества белого цвета. 1 Н-ЯМР-спектр (300 МГц, (CD3)2SO-d6;м.д.): 1,20-1,40 (м, 1 Н); 1,45-1,85 (м, 5 Н); 2,05-2,30 (м, 2 Н); 2,39 (д, очень ушир., J=10,5 Гц, 1 Н); 2,56 (м, 1 Н); 2,60-2,80 (массив, 1 Н); 2,64 (т, J=7 Гц, 2 Н); 2,91 (м, 1 Н); 3,17 (м, 2 Н); 3,90 (с, 3 Н); 5,45 (дд, J=8,5 и 5 Гц, 1 Н); 6,01 (массив, 1 Н); 7,08 (м, 1 Н); 7,20-7,40 (м, 2 Н); 7,43D20=-60,11,2 (0,5% в метаноле). Метил-(3RS,4RS)-4-[3-(R,S)-гидрокси-3-(3-хлор-6-метоксихинолин-4-ил)пропил]-1-[2-(2,5-дифторфенилсульфанил)этил]пиперидин-3-карбоксилат; метил-(3R,4R)-4-[3-(R)-гидрокси-3-(3-хлор-6-метоксихинолин-4-ил)пропил]-1-[2-(2,5-дифторфенилсульфанил)этил]пиперидин-3-карбоксилат; метил-(3S,4S)-4-[3-(S)-гидрокси-3-(3-хлор-6-метоксихинолин-4-ил)пропил]-1-[2-(2,5-дифторфенилсульфанил)этил]пиперидин-3-карбоксилат; метил-(3S,4S)-4-[3-(R)-гидрокси-3-(3-хлор-6-метоксихинолин-4-ил)пропил]-1-[2-(2,5-дифторфенилсульфанил)этил]пиперидин-3-карбоксилат; метил-(3S,4S)-4-[3-(S)-гидрокси-3-(3-хлор-6-метоксихинолин-4-ил)пропил]-1-[2-(2,5-дифторфенилсульфанил)этил]пиперидин-3-карбоксилат. Четыре стереоизомера ниже называют как A, B, C и D. Их абсолютная стереохимия неизвестна. К 2,35 г раствора гидрохлорида метил-(3RS,4RS)-4-[3-(R,S)-гидрокси-(3-хлор-6-метоксихинолин-4 ил)пропил]пиперидин-3-карбоксилата в 110 см 3 ацетонитрила добавляют 1,5 см 3 триэтиламина, 2,15 г- 20009769 карбоната калия и 0,85 г йодида калия. После этого добавляют 1,3 г 1-(2-бромэтилсульфанил)-(2,5 дифтор)бензола. Реакционную среду затем нагревают при температуре 60C в течение 16 ч. После этого среду выдерживают для возврата к температуре 20C, затем фильтруют через стеклянный пористый фильтр 3, потом промывают 2 раза по 20 см 3 ацетонитрила, затем выпаривают при пониженном давлении (45C; 5 кПа). Остаток очищают хроматографией под давлением аргона 150 кПа на колонке с силикагелем (гранулометрия 0,065-0,2 мкм; диаметр 2,5 см; высота 40 см), элюируя смесью циклогексан-этилацетат (в соотношении 60:40 по объемам) и собирая фракции по 50 см 3. Фракции 8-16 объединяют, затем концентрируют при пониженном давлении (45C; 5 кПа). Получают 2,15 г метил-(3RS,4RS)-4-[3-(R,S)-гидрокси-3-(3-хлор-6-метоксихинолин-4-ил)пропил]-1-[2-(2,5-дифторфенилсульфанил)этил]пиперидин-3-карбоксилата (смесь изомеров A, B, C, D) в виде бесцветного масла. 1-(2-Бромэтилсульфанил)-(2,5-дифтор)бензол получают согласно международной заявке на патентH-ЯМР-спектр (300 МГц, (CD3)2SO-d6;м.д.) (наблюдают смесь диастереоизомеров в соотношениях 50:50): 1,10-1,90 (м, 6 Н); 1,90-2,90 (м, 7 Н); 2,37 (д, ушир., J=10,5 Гц, 1 Н); 3,10 (т, J=7 Гц, 2 Н); 3,40 и 3,55 (2 с, 3 Н полностью); 3,88 и 3,89 (2 с, 3 Н полностью); 5,44 (м, 1 Н); 6,01 (с, ушир., 1 Н); 7,05 (м, 1 Н); 7,20-7,35 (м, 2 Н); 7,44 (дд, J=9 и 3 Гц, 1 Н); 7,95 (д, J=9 Гц, 1 Н); 8,19 (м, 1 Н); 8,65 и 8,66 (2 с, 1 Н полностью). Исходя из полученной выше смеси стереоизомеров A, B, C, D, осуществляют выделение каждого стереоизомера путем ВЭЖХ. Разделение двух пар стереоизомеров (A+B) и (C+D) осуществляют исходя из 2,7 г смеси A, B, C, D,описанной выше, при использовании неподвижной фазы Symmetry C18 (гранулометрия 7 мкм; диаметр 60 мм; масса неподвижной фазы 700 г), под давлением 500 кПа; подвижная фаза образована смесью метанол-водный раствор буфера (рН 4,9) ацетонитрил (в соотношении 10:30:60 по объемам), расход которой составляет 120 см 3/мин, и длина волны УФ-детектора фиксирована при 280 нм. Фракции, содержащие первую пару энантиомеров, обозначаемую (A+B), объединяют и выпаривают при пониженном давлении (2 кПа) при температуре около 40C. Полученный остаток обрабатывают водой, затем экстрагируют 2 раза дихлорметаном. Органическую фазу сушат над сульфатом магния,фильтруют, затем выпаривают при пониженном давлении (2 кПа; 45C). Получают 850 мг продукта(смесь A+B). Фракции, содержащие вторую пару энантиомеров, обозначаемую (C+D), объединяют и выпаривают при пониженном давлении (2 кПа) при температуре около 40C. Полученный остаток обрабатывают водой, затем экстрагируют 2 раза дихлорметаном. Органическую фазу сушат над сульфатом магния,фильтруют, затем выпаривают при пониженном давлении (2 кПа; 45C). Получают 540 мг продукта(смесь C+D). Затем продукты пары энантиомеров (A, B) разделяют на колонке с Chiralcel OD (гранулометрия 20 мкм; диаметр 80 мм; масса неподвижной фазы 1250 г) под давлением 1000 кПа; подвижная фаза образована смесью гептан-изопропанол-метанол-триэтиламин (в соотношении 90:5:5:0,1 по объемам), расход которой составляет 150 см 3/мин, и длина волны УФ-детектора фиксирована при 280 нм. Фракции, содержащие каждый продукт, выделяют, затем концентрируют при пониженном давлении (3 кПа) при температуре около 40C; получают 0,391 г энантиомера A и 0,459 г энантиомера B. Так же продукты пары энантиомеров (C, D) разделяют на колонке с Chiralpak AD (гранулометрия 20 мкмм; диаметр 80 мм; масса неподвижной фазы 750 г) под давлением 1000 кПа; подвижная фаза образована смесью гептан-изопропанол-метанол-триэтиламин (в соотношении 80:10:10:0,1 по объемам), расход которой составляет 100 см 3/мин, и длина волны УФ-детектора фиксирована при 280 нм. Фракции,содержащие каждый продукт, выделяют, затем концентрируют при пониженном давлении (3 кПа) при температуре около 40C; получают 0,27 г энантиомера C и 0,27 г энантиомера D. Стереоизомер A. 1(3RS,4RS)-4-[3-(R,S)-гидрокси-(3-хлор-6-метоксихинолин-4-ил)пропил]-1-(третбутилоксикарбонил)пиперидин-3-карбоновой кислоты в 110 см 3 метанола, после охлаждения до температуры около -25C с помощью бани с ацетоном и сухим льдом, по каплям в течение 45 мин добавляют 3,1 см 3 тионилхлорида, затем выдерживают в течение 16 ч при возврате к температуре 20C. Реакционную среду после этого выпаривают при пониженном давлении (45C; 5 кПа). Остаток обрабатывают с помощью 100 см 3 диизопропилового эфира и порошкуют вплоть до получения тонкого порошка. Затем концентрируют при пониженном давлении (45C; 5 кПа). Полученный продукт растворяют в 100 см 3 метанола. После охлаждения до температуры около -20C добавляют еще 3,4 см 3 тионилхлорида. Выдерживают снова при перемешивании в течение 16 ч, затем концентрируют досуха при пониженном давлении (45C; 5 кПа). Остаток обрабатывают с помощью 60 см 3 диизопропилового эфира, концентрируют досуха при пониженном давлении (45C; 5 кПа). Получают 4,75 г метил-(3RS,4RS)-4-[3-(RS)-гидрокси-3(3-хлор-6-метоксихинолин-4-ил)пропил]-1 Н-пиперидин-3-карбоксилата в виде гидрохлорида; твердое вещество бежевого цвета. 1(3RS,4RS)-4-[3-(R,S)-Гидрокси-3-(3-хлор-6-метоксихинолин-4-ил)пропил]-1-(трет-бутилоксикарбонил)пиперидин-3-карбоновая кислота. К 5,55 г (3RS,4RS)-4-[3-(3-хлор-6-метоксихинолин-4-ил)пропил]-1-(трет-бутилоксикарбонил)пиперидин-3-карбоновой кислоты в 450 см 3 диметилсульфоксида добавляют 100 см 3 трет-бутанола, затем реакционную среду в течение 30 мин насыщают кислородом. После этого в течение 40 мин добавляют раствор 3,36 г трет-бутилата калия в 40 см 3 трет-бутанола. Выдерживают при перемешивании в течение 2 ч, поддерживая расход кислорода, затем среду охлаждают до температуры около 0C для добавления 1,8 см 3 уксусной кислоты в 30 см 3 дистиллированной воды. Затем к реакционной среде добавляют 1000 см 3 дистиллированной воды и 1000 см 3 метилацетата. Органическую фазу после этого промывают 8 раз по 250 см 3 дистиллированной воды, затем 2 раза по 100 см 3 раствора хлорида натрия. Объединенные водные фазы снова экстрагируют с помощью 500 см 3 этилацетата. Обе органические фазы объединяют, затем сушат над сульфатом магния в течение 1 ч. Фильтруют через стеклянный пористый фильтр,затем концентрируют при пониженном давлении (2 кПа; 45C). Остаток обрабатывают с помощью 250 см 3 этилацетата и 100 см 3 дистиллированной воды. Органическую фазу промывают 3 раза по 50 см 3 дистиллированной воды, затем с помощью 50 см 3 водного насыщенного раствора хлорида натрия. Сушат над сульфатом магния в течение 1 ч, фильтруют через стеклянный пористый фильтр, затем выпаривают- 22009769 досуха при пониженном давлении (2 кПа; 45C). Получают 5,08 г (3RS,4RS)-4-[3-(R,S)-гидрокси-3-(3 хлор-6-метоксихинолин-4-ил)пропил]-1-(трет-бутилоксикарбонил)пиперидин-3-карбоновой кислоты. 1 Н-ЯМР-спектр (300 МГц, (CD3)2SO-d6;м.д.) (наблюдают смесь диастереоизомеров): 1,20-1,90 (м,6 Н); 1,38 (с, ушир., 9 Н); 2,00-2,20 (м, 1 Н); 2,45 (м, 1 Н); 2,65-4,00 (массив, ушир., 4 Н); 3,89 (с, 3 Н); 5,46 (м,1 Н); 5,90-6,15 (массив, ушир., 1 Н); 7,43 (дд, J=9 и 3 Гц, 1 Н); 7,95 (д, J=9 Гц, 1 Н); 8,20 (м, 1 Н); 8,64 и 8,65(3RS,4RS)-4-[3-(3-хлор-6-метоксихинолин-4-ил)пропил]-1-(трет-бутилоксикарбонил)пиперидин-3 карбоновая кислота. К 7,05 г метил-(3RS,4RS)-4-[3-(3-хлор-6-метоксихинолин-4-ил)пропил]-1-(трет-бутилоксикарбонил)пиперидин-3-карбоксилата в 100 см 3 диоксана добавляют 60 см 3 1 н. водного раствора гидроксида натрия. Реакционную среду затем нагревают при температуре 60C в течение 2 ч, потом концентрируют досуха при пониженном давлении (45C; 5 кПа). Полученный остаток обрабатывают с помощью 300 см 3 диэтилового эфира и 500 см 3 дистиллированной воды. Водную фазу затем промывают с помощью 200 см 3 диэтилового эфира, после чего подкисляют с помощью 55 см 3 1 н. соляной кислоты. Затем снова экстрагируют 2 раза по 250 см 3 этилацетата. Объединенные органические фазы сушат над сульфатом магния в течение 1 ч, после чего фильтруют через стеклянный пористый фильтр и выпаривают при пониженном давлении (45C; 5 кПа). Получают 5,5 г (3RS,4RS)-4-[3-(3-хлор-6-метоксихинолин-4 ил)пропил]-1-(трет-бутилоксикарбонил)пиперидин-3-карбоновой кислоты в виде твердого вещества белого цвета. 1(дд, J=9 и 3 Гц, 1 Н); 7,96 (д, J=9 Гц, 1 Н); 8,67 (с, 1 Н); 11,90-12,50 (массив, очень ушир., 1 Н). МС (IC): m/z=463 (М+Н)+. Метил-(3RS,4RS)-4-[3-(3-хлор-6-метоксихинолин-4-ил)пропил]-1-(трет-бутилоксикарбонил)пиперидин-3-карбоксилат. К 72 см 3 0,5 M раствора 9-борабицикло[3,3,1]нонана в тетрагидрофуране, при перемешивании,в инертной атмосфере и после охлаждения до температуры 0C, добавляют 5,85 г метил-(3RS,4RS)-1-(трет-бутилоксикарбонил)-4-аллилпиперидин-3-карбоксилата (изомер A), растворенные в 60 см 3 тетрагидрофурана. Смесь затем доводят до температуры около 20C, тогда как перемешивание продолжают в течение еще 4 ч. В течение 45 мин добавляют раствор 6,03 г 4-бром-3-хлор-6 метоксихинолина в 200 см 3 тетрагидрофурана, затем добавляют 440 мг дифенилфосфинферроценпалладийхлорида и, наконец, 12,8 г фосфата калия. Реакционную смесь в течение 15 ч кипятят с обратным холодильником, затем фильтруют в горячем состоянии через стеклянный пористый фильтр. Фильтрат обрабатывают 4 раза по 20 см 3 этилацетата и концентрируют досуха при пониженном давлении (45C; 5 кПа). Остаток обрабатывают с помощью 250 см 3 этилацетата и 200 см 3 воды. Органическую фазу декантируют, промывают 3 раза по 50 см 3 дистиллированной воды и 2 раза по 100 см 3 водного насыщенного раствора хлорида натрия, сушат над сульфатом магния, фильтруют, затем концентрируют при пониженном давлении (45C; 5 кПа). Остаток очищают хроматографией под давлением аргона 150 кПа на колонке с силикагелем (гранулометрия 20-45 мкм; диаметр 8 см; высота 35 см), элюируя смесью циклогексан-этилацетат (в соотношении 73:27 по объемам) и собирая фракции по 200 см 3. Фракции 8-16 объединяют, затем концентрируют при пониженном давлении (45C; 5 кПа). Получают 9,5 г метил(3RS,4RS)-4-[3-(3-хлор-6-метоксихинолин-4-ил)пропил]-1-(трет-бутилоксикарбонил)пиперидин-3 карбоксилата в виде бесцветного масла. 1(массив, 2 Н); 3,18 (т, ушир., J=7,5 Гц, 2 Н); 3,51 (с, ушир., 3 Н); 3,60-4,00 (массив, 2 Н); 3,97 (с, 3 Н); 7,38 (д,J=3 Гц, 1 Н); 7,45 (дд, J=9 и 3 Гц, 1 Н); 7,96 (д, J=9 Гц, 1 Н); 8,67 (с, 1 Н). МС (EI): m/z=476 (M)+; m/z=375, 207, 194, 170, 58 (пик молекулярного иона). 4-Бром-3-хлор-6-метоксихинолин описан в международной заявке на патент WO-20024074. Синтезы 2 пар стереоизомеров метил-1-(трет-бутилоксикарбонил)-4-аллилпиперидин-3 карбоксилата. Метил-(3RS,4RS)-1-(трет-бутилоксикарбонил)-4-аллилпиперидин-3-карбоксилат (изомер A, рацемат). Метил-(3RS,4SR)-1-(трет-бутилоксикарбонил)-4-аллилпиперидин-3-карбоксилат (изомер B, рацемат). Раствор 32,43 г метил-1-(трет-бутилоксикарбонил)-4-аллил-4-(метоксиоксалилокси)гидроксипиперидин-3-карбоксилата (рацемат А) в 600 см 3 толуола в инертной атмосфере нагревают до температуры 110C. Затем быстро добавляют 200 мг АИБН, потом 35,06 см 3 трибутилоловогидрида, затем снова 200 мг АИБН. Среду выдерживают при температуре 110C в течение 4 ч. Смесь затем охлаждают до температуры около 20C в течение 12 ч, после чего добавляют 300 см 3 дистиллированной воды. Органи- 23009769 ческую фазу повторно промывают 3 раза по 300 см 3 дистиллированной воды, затем сушат над сульфатом магния, фильтруют через стеклянный пористый фильтр и концентрируют досуха при пониженном давлении (45C; 5 кПа). Остаток очищают хроматографией под давлением азота 50 кПа на колонке с силикагелем (гранулометрия 0,06-0,2 мм; диаметр 12 см; высота 75 см), элюируя смесью циклогексанэтилацетат (в соотношении 80:20 по объемам) и собирая фракции по 100 см 3. Фракции 45-103 объединяют, затем концентрируют. Получают 16,05 г смеси изомеров (A+B) метил-1-(трет-бутилоксикарбонил)-4 аллилпиперидин-3-карбоксилата в виде масла светло-желтого цвета. 1 Н-ЯМР-спектр (300 МГц, (CD3)2SO-d6;м.д.): 1,38 (с, 9 Н); 1,43 (м, 1 Н); 1,75 (м, 1 Н); 1,66 (м, 1 Н); 2,06 (м, 2 Н); 2,61 (кв, J=5,5 Гц, 1 Н); 2,75-3,15 (массив, ушир., 1 Н); 3,20 (дд, J=13,5 и 5,5 Гц, 1 Н); 3,59 (с,ушир., 3 Н); 3,60-4,10 (массив, ушир., 2 Н); 5,01 (м, 2 Н); 5,75 (м, 1 Н). МС (IC): m/z=284 (М+Н)+. Исходя из полученной выше смеси изомеров (A+B), осуществляют разделение 2 пар изомеров путем ВЭЖХ. Разделение А (рацемат) и В (рацемат) осуществляют, исходя из 16,08 г вышеописанной смеси A+B,при использовании неподвижной фазы Kromasil C8 (гранулометрия 10 мкм; диаметр 80 мм; масса неподвижной фазы 1,25 кг), под давлением 600 кПа; подвижная фаза образована смесью ацетондистиллированная вода (в соотношении 60:40 по объемам), расход которой составляет 126 см 3/мин, и длина волны УФ-детектора фиксирована при 215 нм. Фракции, содержащие первый изомер, обозначаемый А (рацемат), объединяют и выпаривают при пониженном давлении (2 кПа) при температуре около 40C. Получают 6,55 г метил-(3RS,4RS)-1-(третбутилоксикарбонил)-4-аллилпиперидин-3-карбоксилата. Фракции, содержащие второй изомер, обозначаемый В (рацемат), объединяют и выпаривают при пониженном давлении (2 кПа) при температуре около 40C. Получают 2,35 г метил-(3RS,4SR)-1-(третбутилоксикарбонил)-4-аллилпиперидин-3-карбоксилата. Изомер А (рацемат). 1 Н-ЯМР-спектр (300 МГц, (CD3)2SO-d6;м.д.): 1,38 (с, 9 Н); 1,43 (м, 1 Н); 1,75 (м, 1 Н); 1,66 (м, 1 Н); 2,06 (м, 2 Н); 2,61 (кв, J=5,5 Гц, 1 Н); 2,75-3,15 (массив, ушир., 1 Н); 3,20 (дд, J=13,5 и 5,5 Гц, 1 Н); 3,59 (с,ушир., 3 Н); 3,60-4,10 (массив, ушир., 2 Н); 5,01 (м, 2 Н); 5,75 (м, 1 Н). МС (IC): m/z=284 (М+Н)+. Условие ВЭЖХ: препаративная колонка, Kromasil C8, расход 1 см 3/мин; условие элюирования: 0-16 мин; смесь ацетонитрил-дистиллированная вода (в соотношении 60:40). Время удерживания: 13,18 мин. Изомер В (рацемат). 1 Н-ЯМР-спектр (400 МГц, (CD3)2SO-d6;м.д.): 1,13 (м, 1 Н); 1,43 (с, 9 Н); 1,73 (дкв, J=14 и 4 Гц, 1 Н); 1,87 (м, 1 Н); 1,97 (м, 1 Н); 2,15 (м, 1 Н); 2,21 (тд, J=10 и 4 Гц, 1 Н); 2,83 (ддд, J=13,5-12 и 3 Гц, 1 Н); 2,89 (дд,J=13 и 11 Гц, 1 Н); 3,67 (с, 3 Н); 3,89 (дм, J=13,5 Гц, 1 Н); 4,02 (ддд, J=13-4 и 2 Гц, 1 Н); 5,04 (м, 2 Н); 5,76 (м, 1 Н). МС (IC): m/z = 284 (М+Н)+. Условие ВЭЖХ: препаративная колонка, Kromasil C8, расход 1 см 3/мин; условие элюирования: 0-16 мин; смесь ацетонитрил-дистиллированная вода (в соотношении 60:40). Время удерживания: 11,37 мин. Метил-1-(трет-бутилоксикарбонил)-4-аллил-4-(метоксиоксалилокси)гидроксипиперидин-3 карбоксилат. В инертной атмосфере, 45,5 г диметиламинопиридина добавляют к раствору 36,8 г метил-1-(третбутилоксикарбонил)-4-аллил-4-гидроксипиперидин-3-карбоксилата в 400 см 3 ацетонитрила, затем в течение 30 мин добавляют 35,32 см 3 оксалилхлорида. После перемешивания в течение 20 ч при температуре около 20C реакционную среду обрабатывают с помощью 300 см 3 этилацетата и 500 см 3 водного насыщенного раствора гидрокарбоната натрия. Органическую фазу декантируют, промывают 6 раз по 300 см 3 дистиллированной воды, затем 2 раза по 300 см 3 насыщенного водного раствора хлорида натрия. Так же водную фазу промывают 3 раза по 300 см 3 метилацетата. Объединенные органические фазы сушат над сульфатом магния, фильтруют через стеклянный пористый фильтр. Остаток очищают хроматографией под давлением азота 50 кПа на колонке с силикагелем (гранулометрия 40-60 мкм; диаметр 8 см; высота 60 см), элюируя смесью циклогексан-этилацетат (70:30 по объемам) и собирая фракции по 250 см 3. Фракции 19-37 объединяют, затем концентрируют при пониженном давлении. Получают 23,31 г смеси изомеров (A+B) метил-1-(трет-бутилоксикарбонил)-4-аллил-4-(метоксиоксалилокси)гидроксипиперидин 3-карбоксилата в виде масла светло-желтого цвета. 1- 24009769 Исходя из 196,59 г полученной выше смеси изомеров A+B, осуществляют разделение двух пар изомеров путем ВЭЖХ при использовании неподвижной фазы Kromasil C8 (препаративная колонка; гранулометрия 10 мкм; диаметр 80 мм; масса неподвижной фазы 1,2 кг), под давлением 600 кПа; подвижная фаза образована смесью ацетон-дистиллированная вода-метанол (в соотношении 60:30:10 по объемам),расход которой составляет 126 см 3/мин, и длина волны УФ-детектора фиксирована при 215 нм. Фракции,содержащие первый изомер A (рацемат), объединяют и выпаривают при пониженном давлении (2 кПа) при температуре около 40C; получают 32,43 г изомера А в виде масла. Фракции, содержащие второй изомер B (рацемат), объединяют и выпаривают при пониженном давлении (2 кПа) при температуре около 40C; получают 35,25 г изомера В в виде масла. Изомер А (рацемат). 1 Н-ЯМР-спектр (300 МГц, (CD3)2SO-d6;м.д.): 1,41 (с, 9 Н); 1,86 (м, 1 Н); 2,33 (м, 1 Н); 2,87 (дд,ушир., J=14,5 и 7,5 Гц, 1 Н); 2,95-3,10 (м, 2 Н); 3,25-3,75 (массив, ушир., 4 Н); 3,62 (с, ушир., 3 Н); 3,81 (с,3 Н); 5,10-5,25 (м, 2 Н); 5,80 (м, 1 Н). МС (IC): m/z=386 (М+Н)+; m/z=403 (M+NH4)+. Условие ВЭЖХ: препаративная колонка, Kromasil C8, расход 1 см 3/мин; условие элюирования: 0-10 мин; смесь ацетонитрил-дистиллированная вода (в соотношении 60:40). Время удерживания: 7,39 мин. Изомер В (рацемат). 1 Н-ЯМР-спектр (300 МГц, (CD3)2SO-d6;м.д.): 1,39 (с, 9 Н); 2,18 (м, 2 Н); 2,66 (дд, J=15 и 7,5 Гц,1 Н); 2,83 (дд, J=15 и 7 Гц, 1 Н); 2,85-3,10 (м, 1 Н); 3,18 (м, 1 Н); 3,30-3,55 (массив, 1 Н); 3,66 (с, очень ушир.,3 Н); 3,75-3,95 (массив, 1 Н); 3,83 (с, 3 Н); 4,00 (д, очень ушир., J=13,5 Гц, 1 Н); 5,07 (дд, J=18 и 1,5 Гц, 1 Н); 5,15 (дд, J=10,5 и 1,5 Гц, 1 Н); 5,75 (м, 1 Н). МС (IC): m/z=386 (М+Н)+ (пик молекулярного иона); m/z=403 (M+NH4)+. Условие ВЭЖХ: препаративная колонка, Kromasil C8, расход 1 см 3/мин; условие элюирования: 0-10 мин; смесь ацетонитрил-дистиллированная вода (в соотношении 60:40). Время удерживания: 7,98 мин. Пример 2. Синтез 4 стереоизомеров (3RS,4RS)-4-[3-(R,S)-гидрокси-3-(3-хлор-6-метоксихинолин-4 ил)пропил]-1-[2-(2-тиенилсульфанил)этил]пиперидин-3-карбоновой кислоты.(3S,4S)-4-[3-(R)-гидрокси-3-(3-хлор-6-метоксихинолин-4-ил)пропил]-1-[2-(2-тиенилсульфанил)этил]пиперидин-3-карбоновая кислота. Четыре стереоизомера ниже называют как A, B, C и D. Их абсолютная стереохимия неизвестна. Стереоизомер A. К раствору 480 мг метил-4-[3-гидрокси-3-(3-хлор-6-метоксихинолин-4-ил)пропил]-1-[2-(2 тиенилсульфанил)этил]пиперидин-3-карбоксилата (сложный эфир, изомер A) в 10 см 3 диоксана добавляют 2,7 см 3 1 н. водного раствора гидроксида натрия. Реакционную среду затем нагревают при температуре 70C в течение 5 ч 30 мин. Затем выдерживают в течение 12 ч при возврате к температуре 19C. Выпаривают при пониженном давлении (20 кПа; 45C). Остаток обрабатывают с помощью 25 см 3 дистиллированной воды, затем экстрагируют с помощью 25 см 3 диэтилового эфира. Водную фазу подкисляют с помощью 2,6 см 3 1 н. соляной кислоты (рН 6), после чего эту фазу экстрагируют 3 раза по 70 см 3 этилацетата. Органическую фазу сушат над сульфатом магния, фильтруют через стеклянный пористый фильтр, затем выпаривают при пониженном давлении (20 кПа; 45C). После высушивания в вакууме(50 кПа) в течение 4 ч получают 360 мг 4-[3-гидрокси-3-(3-хлор-6-метоксихинолин-4-ил)пропил]-1-[2-(2 тиенилсульфанил)этил]пиперидин-3-карбоновой кислоты в виде твердого вещества бледно-желтого цвета (изомер A). 1D20=28,20,9 (0,5% в метаноле). Стереоизомер B. К раствору 478 мг метил-4-[3-гидрокси-3-(3-хлор-6-метоксихинолин-4-ил)пропил]-1-[2-(2 тиенилсульфанил)этил]пиперидин-3-карбоксилата (сложный эфир, изомер B) в 10 см 3 диоксана добав- 25009769 ляют 2,7 см 3 1 н. водного раствора гидроксида натрия. Реакционную среду затем нагревают при температуре 70C в течение 5 ч 30 мин. Затем выдерживают в течение 12 ч при возврате к температуре 19C. Выпаривают при пониженном давлении (20 кПа; 45C). Остаток обрабатывают с помощью 25 см 3 дистиллированной воды и экстрагируют с помощью 25 см 3 диэтилового эфира. Водную фазу подкисляют с помощью 2,6 см 3 1 н. соляной кислоты (рН 6), затем эту фазу экстрагируют 3 раза по 70 см 3 этилацетата. Органическую фазу сушат над сульфатом магния, фильтруют через стеклянный пористый фильтр, затем выпаривают при пониженном давлении (20 кПа; 45C). После высушивания в вакууме (50 кПа) остаток обрабатывают с помощью 25 см 3 ацетона, затем снова концентрируют при пониженном давлении(20 кПа; 45C). Высушивают при пониженном давлении (50 кПа; 20C) в течение 4 ч и получают 350 мг 4-[3-гидрокси-3-(3-хлор-6-метоксихинолин-4-ил)пропил]-1-[2-(2-тиенилсульфанил)этил]пиперидин-3 карбоновой кислоты в виде твердого вещества бледно-желтого цвета (изомер B). 1D20=-25,21,5 (0,5% в метаноле). Стереоизомер C. К раствору 300 мг метил-4-[3-гидрокси-3-(3-хлор-6-метоксихинолин-4-ил)пропил]-1-[2-(2 тиенилсульфанил)этил]пиперидин-3-карбоксилата (сложный эфир, изомер C) в 10 см 3 диоксана добавляют 1,7 см 3 1 н. водного раствора гидроксида натрия. Реакционную среду затем нагревают при температуре 70C в течение 5 ч 30 мин. Выдерживают в течение 12 ч при возврате к температуре 19C, затем снова нагревают при температуре 70C в течение 2 ч. После этого выпаривают при пониженном давлении (20 кПа; 45C). Остаток обрабатывают с помощью 25 см 3 дистиллированной воды, затем экстрагируют с помощью 25 см 3 диэтилового эфира. Водную фазу подкисляют с помощью 1,6 см 3 1 н. соляной кислоты (рН 6), затем эту фазу экстрагируют 3 раза по 70 см 3 этилацетата. Органическую фазу сушат над сульфатом магния, фильтруют через стеклянный пористый фильтр,затем выпаривают при пониженном давлении (20 кПа; 45C). После высушивания в вакууме (50 кПа),остаток обрабатывают с помощью 20 см 3 ацетона, затем снова концентрируют при пониженном давлении (20 кПа; 45C). Высушивают при пониженном давлении (50 кПа; 20C) в течение 12 ч и получают 250 мг 4-[3-гидрокси-3-(3-хлор-6-метоксихинолин-4-ил)пропил]-1-[2-(2-тиенилсульфанил)этил]пиперидин-3-карбоновой кислоты в виде твердого вещества бледно-желтого цвета (изомер C). 1D20=88,11,5 (0,5% в метаноле). Стереоизомер D. К раствору 325 мг метил-4-[3-гидрокси-3-(3-хлор-6-метоксихинолин-4-ил)пропил]-1-[2-(2 тиенилсульфанил)этил]пиперидин-3-карбоксилата (сложный эфир, изомер D) в 10 см 3 диоксана добавляют 1,8 см 3 1 н. водного раствора гидроксида натрия. Реакционную среду затем нагревают при температуре 70C в течение 5 ч 30 мин. Выдерживают в течение 12 ч при возврате к температуре 19C, затем снова нагревают при температуре 70C в течение 2 ч. Затем выпаривают при пониженном давлении(20 кПа; 45C). Остаток обрабатывают с помощью 25 см 3 дистиллированной воды, после чего экстрагируют с помощью 25 см 3 диэтилового эфира. Водную фазу подкисляют с помощью 1,6 см 3 1 н. соляной кислоты (рН 6), затем экстрагируют 3 раза по 70 см 3 этилацетата. Органическую фазу сушат над сульфатом магния, фильтруют через стеклянный пористый фильтр, затем выпаривают при пониженном давлении (20 кПа; 45C). После высушивания в вакууме (50 кПа) остаток обрабатывают с помощью 20 см 3 ацетона, затем снова концентрируют при пониженном давлении (20 кПа; 45C). Высушивают при пониженном давлении (50 кПа; 20C) в течение 12 ч и получают 260 мг 4-[3-гидрокси-3-(3-хлор-6 метоксихинолин-4-ил)пропил]-1-[2-(2-тиенилсульфанил)этил]пиперидин-3-карбоновой кислоты в виде твердого вещества бледно-желтого цвета (изомер D). 1 Н-ЯМР-спектр (300 МГц, (CD3)2SO-d6;м.д.): 1,30 (м, 1 Н); 1,40-1,85 (м, 5 Н); 2,19 (м, 2 Н); 2,37 (д,очень ушир., J=10,5 Гц, 1 Н); 2,58 (т, J=7,5 Гц, 2 Н); 2,60-2,75 (м, 1 Н); 2,80-3,05 (м, 1 Н); 2,96 (м, 2 Н); 3,90- 26009769 метил-(3R,4R)-4-[3-(S)-гидрокси-3-(3-хлор-6-метоксихинолин-4-ил)пропил]-1-[2-(2-тиенилсульфанил)этил]пиперидин-3-карбоксилат; метил-(3S,4S)-4-[3-(R)-гидрокси-3-(3-хлор-6-метоксихинолин-4-ил)пропил]-1-[2-(2-тиенилсульфанил)этил]пиперидин-3-карбоксилат; метил-(3S,4S)-4-[3-(S)-гидрокси-3-(3-хлор-6-метоксихинолин-4-ил)пропил]-1-[2-(2-тиенилсульфанил)этил]пиперидин-3-карбоксилат. Четыре стереоизомера ниже называют как A, B, C и D. Их абсолютная стереохимия неизвестна. К 2,5 г гидрохлорида метил-(3RS,4RS)-4-[3-(R,S)-гидрокси-3-(3-хлор-6-метоксихинолин-4 ил)пропил]-1 Н-пиперидин-3-карбоксилата, растворенным в 110 см 3 ацетонитрила, добавляют 1,5 см 3 триэтиламина, 2,15 г карбоната калия и 0,85 г йодида калия. По-прежнему при температуре 20C добавляют 1,15 г 2-(бромэтилсульфанил)тиофена. Реакционную среду затем нагревают при температуре 60C в течение 16 ч. После этого среду выдерживают до возврата к температуре 20C, затем выпаривают при пониженном давлении (45C; 5 кПа). Остаток обрабатывают с помощью 200 см 3 этилацетата и 100 см 3 дистиллированной воды. Органическую фазу повторно промывают 2 раза по 100 см 3 водного насыщенного раствора хлорида натрия, сушат над сульфатом магния в течение 1 ч, фильтруют через стеклянный пористый фильтр, затем выпаривают при пониженном давлении (45C; 5 кПа). Остаток очищают хроматографией под давлением азота 50 кПа на колонке с силикагелем (гранулометрия 0,065-0,2 мкм; диаметр 2,5 см; высота 35 см), элюируя смесью циклогексан-этилацетат (в соотношении 60:40 по объемам) и собирая фракции по 50 см 3. Фракции 6-9 объединяют, затем концентрируют при пониженном давлении(45C; 5 кПа). Получают 1,95 г метил-(3RS,4RS)-4-[3-(R,S)-гидрокси-3-(3-хлор-6-метоксихинолин-4 ил)пропил]-1-[2-(2-тиенилсульфанил)этил]пиперидин-3-карбоксилата (смесь изомеров А, В, C, D) в виде бесцветного масла. 2-(Бромэтилсульфанил)тиофен получают согласно международной заявке на патент WO-200125227. 1 Н-ЯМР-спектр (300 МГц, (CD3)2SO-d6;м.д.) (наблюдают смесь 2 диастереоизомеров в соотношениях 60:40): 1,10-1,85 (м, 7H); 1,85-2,85 (м, 7H); 2,89 (т, ушир., J=7, 5 Гц, 2 Н); 3,42 и 3,56 (2 с, 3 Н полностью); 3,89 и 3,90 (2 с, 3 Н полностью); 5,45 (м, 1 Н); 6,01 (с, ушир., 1 Н); 7,05 (дд, J=5,5 и 3,5 Гц, 1 Н); 7,18(м, 1 Н); 8,65 и 8,66 (2 с, 1 Н полностью). МС (EI): m/z=534 (М+); m/z=504 (пик молекулярного иона). Исходя из полученной выше смеси стереоизомеров A, B, C, D, осуществляют выделение каждого стереоизомера путем ВЭЖХ. Разделение двух пар стереоизомеров (A+B) и (C+D) осуществляют, исходя из 1,95 г смеси A, B, C,D, описанной выше, при использовании неподвижной фазы Symmetry C18 (гранулометрия 7 мкм; диаметр 60 мм; масса неподвижной фазы 700 г), под давлением 500 кПа; подвижная фаза образована смесью метанол-водный раствор буфера (рН 4,9) ацетонитрил (в соотношении 10:55:35 по объемам), расход которой составляет 120 см 3/мин, и длина волны УФ-детектора фиксирована при 280 нм. Фракции, содержащие первую пару энантиомеров, обозначаемую (A+B), объединяют и выпаривают при пониженном давлении (2 кПа) при температуре около 40C. Полученный остаток обрабатывают водой, затем экстрагируют 2 раза дихлорметаном. Органическую фазу сушат над сульфатом магния,фильтруют, затем выпаривают при пониженном давлении (2 кПа; 45C). Получают 640 мг метил-4-[3 гидрокси-3-(3-хлор-6-метоксихинолин-4-ил)пропил]-1-[2-(2-тиенилсульфанил)этил]пиперидин-3 карбоксилата (смесь A+B). Фракции, содержащие вторую пару энантиомеров, обозначаемую (C+D), объединяют и выпаривают при пониженном давлении (2 кПа) при температуре около 40C. Полученный остаток обрабатывают водой, затем экстрагируют 2 раза дихлорметаном. Органическую фазу сушат над сульфатом магния,фильтруют, затем выпаривают при пониженном давлении (2 кПа; 45C). Получают 620 мг метил-4-[3 гидрокси-3-(3-хлор-6-метоксихинолин-4-ил)пропил]-1-[2-(2-тиенилсульфанил)этил]пиперидин-3 карбоксилата (смесь C+D). Затем продукты пары энантиомеров (А, B) разделяют на колонке с Chiralcel OJ (гранулометрия 20 мкм; диаметр 35 мм; масса неподвижной фазы 700 г), под давлением 1510 кПа; подвижная фаза образована смесью гептан-этанол-триэтиламин (в соотношении 90:10:0,1 по объемам), расход которой составляет 120 см 3/мин, и длина волны УФ-детектора фиксирована при 254 нм. Фракции, содержащие каждый продукт, выделяют, затем концентрируют при пониженном давлении (2 кПа) при температуре около 40C; получают 0,48 г стереоизомера А и 0,478 г стереоизомера В. Так же продукты пары энантиомеров (C, D) разделяют на колонке с Chiralcel OD (гранулометрия 20 мкм; диаметр 80 мм; масса неподвижной фазы 1250 г), под давлением 1510 кПа; подвижная фаза образована смесью гептан-изопропанол-метанол-триэтиламин (в соотношении 93:4:3:0,1 по объемам), расход которой составляет 150 см 3/мин, и длина волны УФ-детектора фиксирована при 265 нм. Фракции,содержащие каждый продукт, выделяют, затем концентрируют при пониженном давлении (2 кПа) при температуре около 40C; получают 0,30 г стереоизомера C в виде беловатого твердого вещества и 0,325 г стереоизомера D в виде беловатого твердого вещества. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Производное хинолилпропилпиперидина, отличающееся тем, что оно отвечает общей формуле (I) в которой R1a означает гидроксил и R1b означает атом водорода или R1a и R1b образуют оксогруппу;R3 означает алкил, включающий 1-6 атомов углерода, замещенный фенилтиогруппой, которая сама может содержать от 1 до 4 заместителей, выбираемых из группы, состоящей из атома галогена, гидроксила, алкила, алкилоксигруппы, трифторметила, трифторметоксигруппы, карбоксила, алкилоксикарбонила, цианогруппы и аминогруппы; циклоалкилтиогруппой, циклическая часть которой является 3-7-членной, которая сама может содержать один или несколько заместителей, выбираемых среди атома галогена и трифторметила; или 5-6-членной гетероарилтиогруппой, содержащей от 1 до 4 гетероатомов,- 28009769 выбираемых среди атома азота, атома кислорода и атома серы, которая сама может содержать один или несколько заместителей, выбираемых из группы, состоящей из атома галогена, гидроксила, алкила, алкилоксигруппы, трифторметила, трифторметоксигруппы, карбоксила, алкилоксикарбонила, цианогруппы и аминогруппы; иR4 означает алкил, содержащий 1-6 атомов углерода; в его различных изомерных, энантиомерных и диастереоизомерных, отдельных или в виде смесей, формах, а также его соли. 2. Производное формулы (I) по п.1, в которой R3 означает этил, замещенный тиенилтиогруппой,фенилтиогруппой, замещенной галогеном, циклогексилтиогруппой или циклопентилтиогруппой. 3. Любое из производных общей формулы (I) по п.1, имеющих следующие названия: 4-[3-гидрокси-3-(3-хлор-6-метоксихинолин-4-ил)пропил]-1-[2-(2,5-дифторфенилсульфанил)этил]пиперидин-3-карбоновая кислота; 4-[3-гидрокси-3-(3-хлор-6-метоксихинолин-4-ил)пропил]-1-[2-(2-тиенилсульфанил)этил]пиперидин-3-карбоновая кислота; в его различных изомерных, отдельных или в виде смесей, формах, а также его соли. 4. Способ получения производного хинолилпропилпиперидина по п.1, отличающийся тем, что цепьR3, определенную в п.1, вводят в реакцию конденсации с производным хинолилпропилпиперидина общей формулы (II) в которой R4 имеет указанное в п.1 значение; либо R1a означает гидроксил и R1b означает атом водорода,либо R'1a и R1b образуют оксогруппу; и R'2 означает защищенный карбоксил или карбоксиметил, с получением производного хинолилпропилпиперидина общей формулы (III) в которой R'1a, R1b, R'2, R3 и R4 имеют вышеуказанные значения; в случае необходимости, гидроксил, обозначаемый радикалом R'1a, путем окисления превращают в оксогруппу, затем R'2 превращают в карбоксил, затем, в случае необходимости, изомеры разделяют, в случае необходимости, удаляют защитный радикал кислотной группы и/или, в случае необходимости,превращают полученный продукт в соль. 5. Способ по п.4, отличающийся тем, что производное хинолилпропилпиперидина общей формулы(II), в котором R'1a означает гидроксил, получают путем окисления в основной среде соответствующего производного, в котором R'1a и R1b означают атомы водорода, аминогруппа пиперидина промежуточно защищена и R'2 имеет вышеуказанное значение или означает карбоксил или карбоксиметил, и, в случае необходимости, путем повторной защиты карбоксила или карбоксиметила. 6. Способ по п.4, отличающийся тем, что производное хинолилпропилпиперидина общей формулы(II), в которой R'1a и R1b образуют оксогруппу, получают путем окисления известными способами производного общей формулы (II), в которой R'1a означает гидроксил, получаемого как описано в п.10. 7. Способ по п.4, отличающийся тем, что производное хинолилпропилпиперидина общей формулы(II), в котором R'2 означает защищенный карбоксиметил и R'1a и R1b означают атомы водорода, получают по способу, согласно которому конденсируют по реакции Виттига соответствующий илид фосфора с производным пиперидина общей формулы (IX) в которой Rz означает аминозащитную группу, с получением производного формулы (VIII)- 29009769 в которой Rz имеет вышеуказанное значение и R"2 означает защищенный карбоксил, которое конденсируют с производным хинолина общей формулы (VII) в которой R4 имеет указанное в п.1 значение и Hal означает атом йода или брома, с получением производного хинолилпропилпиперидина общей формулы (VI) в которой R"2 и Rz имеют вышеуказанные значения, которое подвергают селективному гидрированию и,в случае необходимости, реакции удаления защиты аминогруппы. 8. Способ по п.7, отличающийся тем, что соединение формулы (II) подвергают реакции восстановления защищенного карбоксиметила до гидроксиэтила,превращению его в п-толуолсульфонилоксиэтильное производное, затем превращению этого производного в винильное производное путем реакции элиминирования с последующим окислением полученного производного и введением защитной группы для таким образом полученного карбоксила. 9. Способ по п.4, отличающийся тем, что производное хинолилпропилпиперидина общей формулы(II), в котором R'1a и R1b означают атомы водорода, получают путем реакции аллилирования сложного кетоэфира общей формулы (XIV) в которой R'2 имеет указанное в п.8 значение и Rz имеет указанное в п.7 значение, с образованием производного общей формулы (XIII) в которой R'2 и Rz имеют вышеуказанные значения, которое вводят во взаимодействие с алкилоксалилгалогенидом с получением производного общей формулы (XII) в которой R" означает алкил и R'2 и Rz имеют вышеуказанные значения, которое подвергают реакции радикального дезоксигенирования с получением производного общей формулы (X) в которой R'2 и Rz имеют вышеуказанные значения, которое конденсируют с производным хинолина общей формулы (VII) по п.7 с получением производного общей формулы (XI) затем удаляют аминозащитную группу Rz. 10. Применение производных хинолилпропилпиперидина по п.1, а также их фармацевтически приемлемых солей в качестве лекарственных средств. 11. Применение производных хинолилпропилпиперидина по любому из пп.2 или 3, а также их фар- 30
МПК / Метки
МПК: A61K 31/4709, C07D 409/14, C07D 211/60, A61P 31/04, C07D 401/06
Метки: качестве, хинолилпропилпиперидина, производные, применение, средств, антимикробных
Код ссылки
<a href="https://eas.patents.su/30-9769-proizvodnye-hinolilpropilpiperidina-i-ih-primenenie-v-kachestve-antimikrobnyh-sredstv.html" rel="bookmark" title="База патентов Евразийского Союза">Производные хинолилпропилпиперидина и их применение в качестве антимикробных средств</a>
Предыдущий патент: Замещенные конденсированные гетероциклические с-гликозиды
Следующий патент: Антитела против каспазы-8 и способы их получения и применения
Случайный патент: Комбинация производных триазина и агонистов pparα












