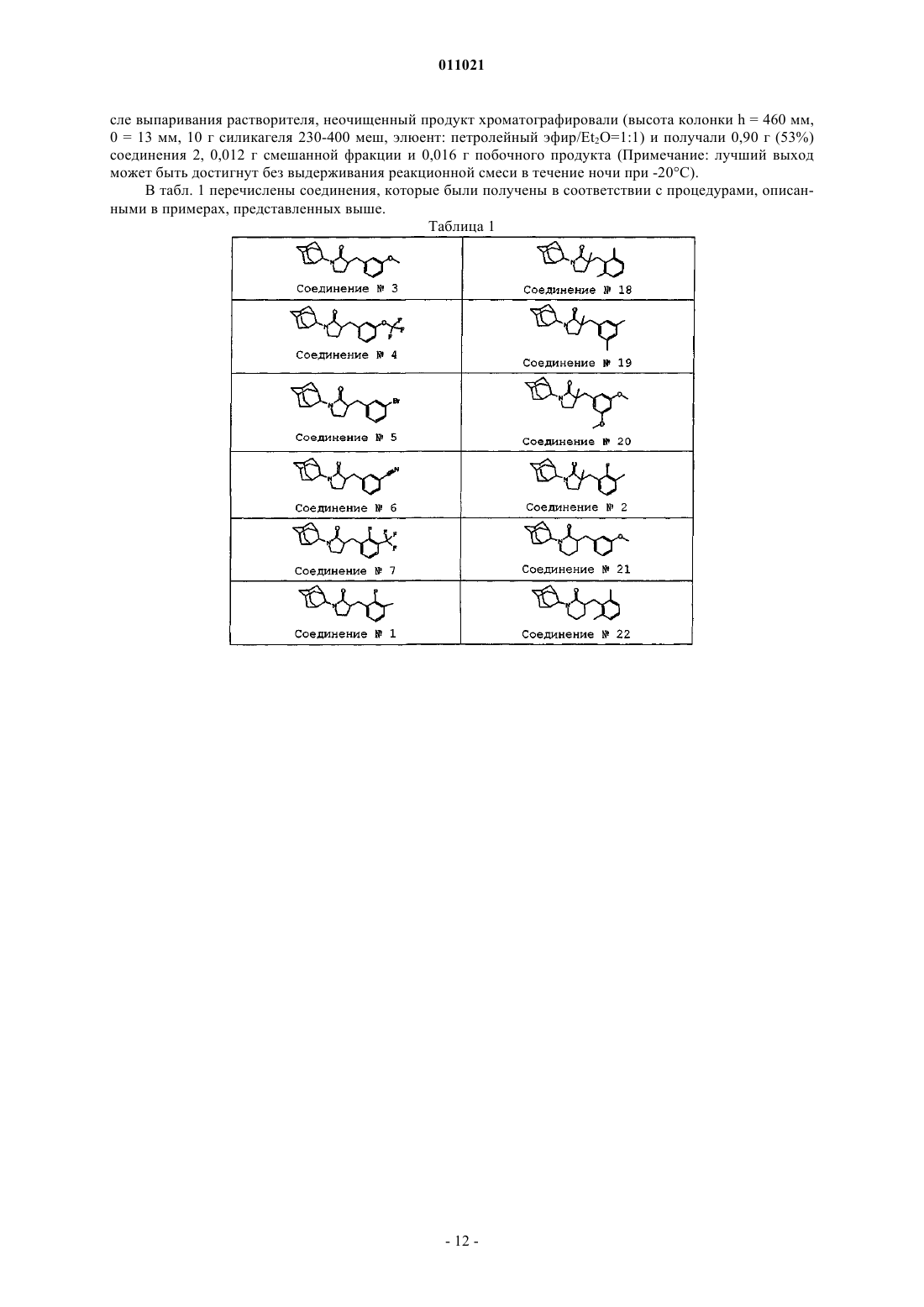
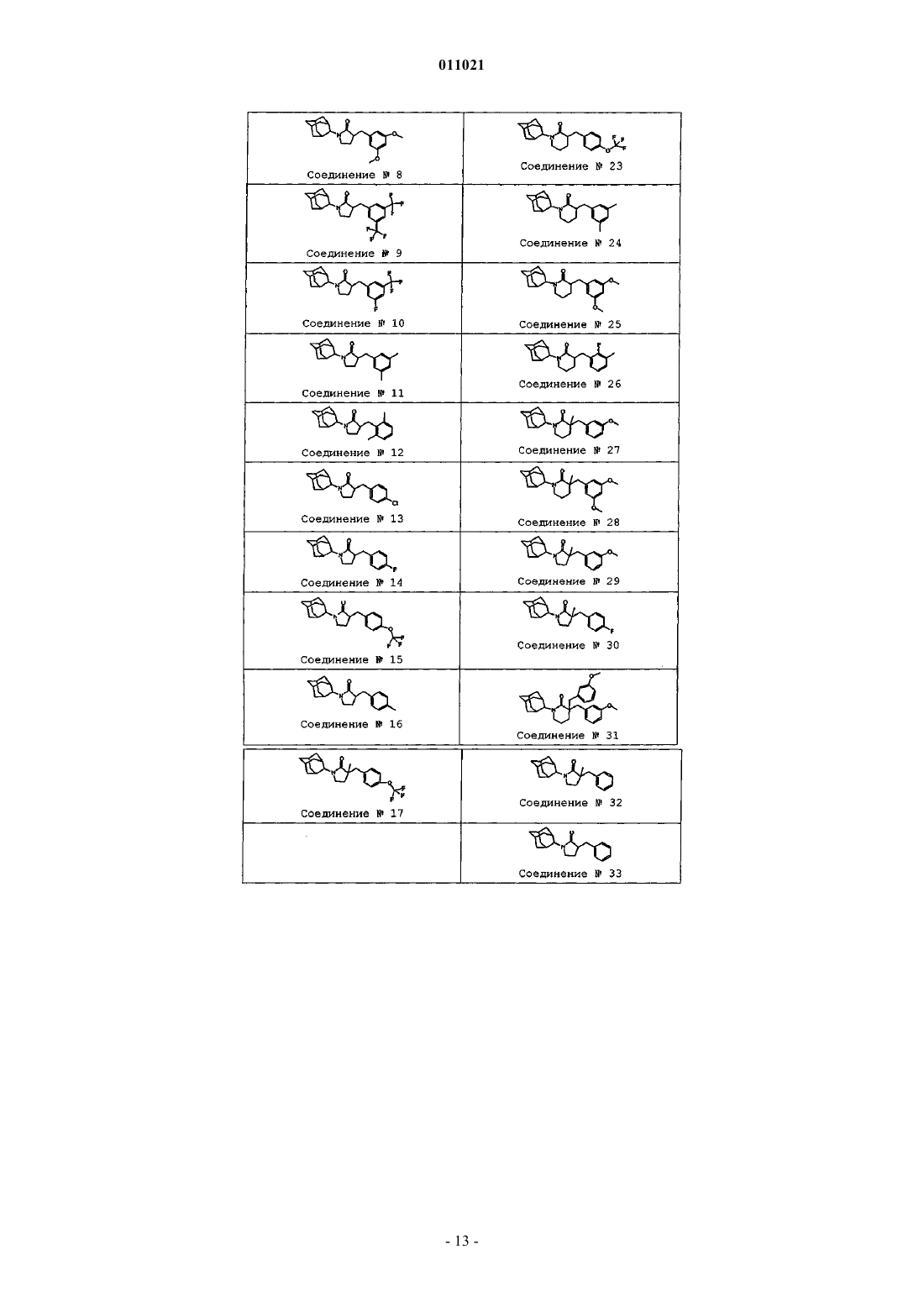
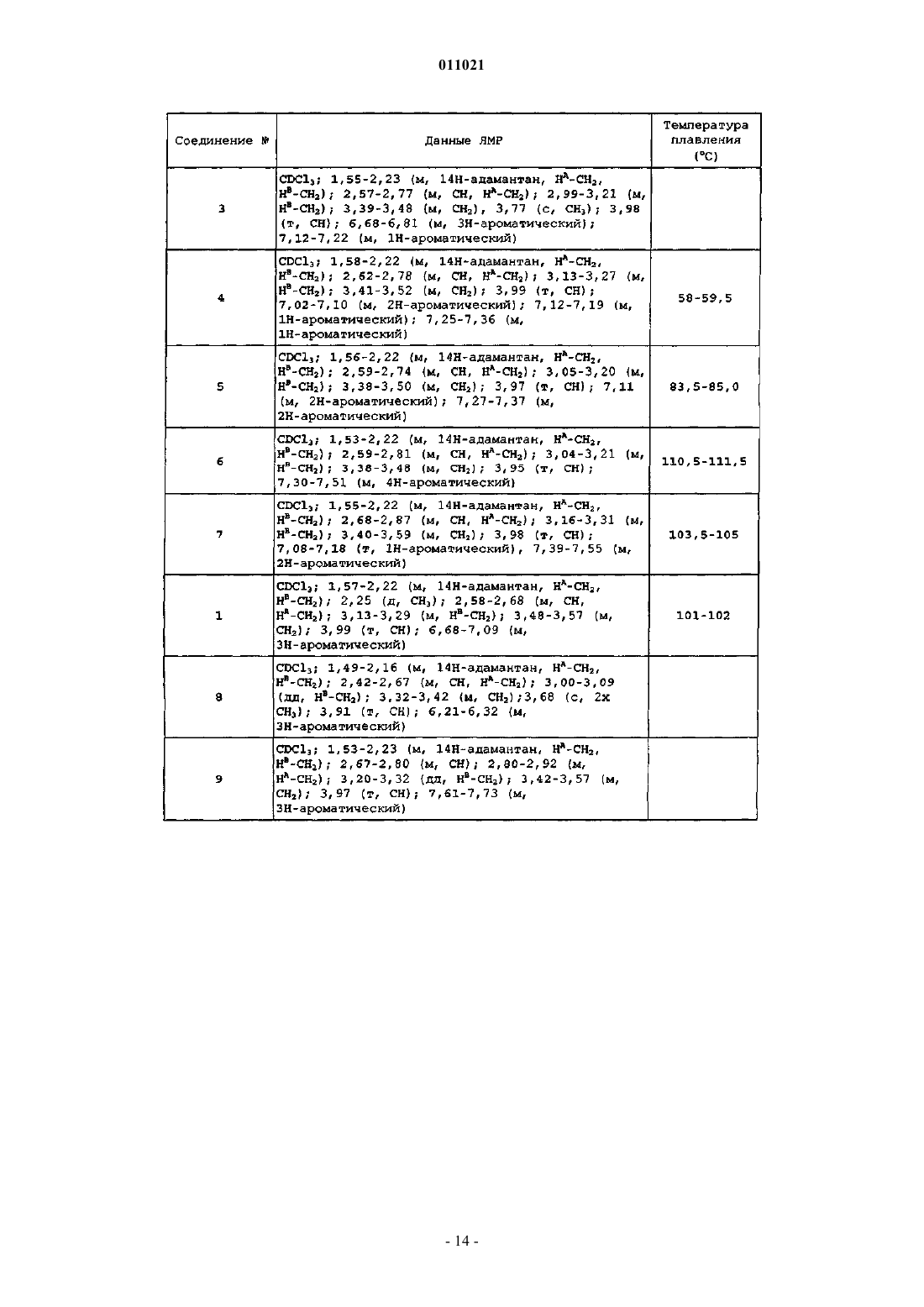
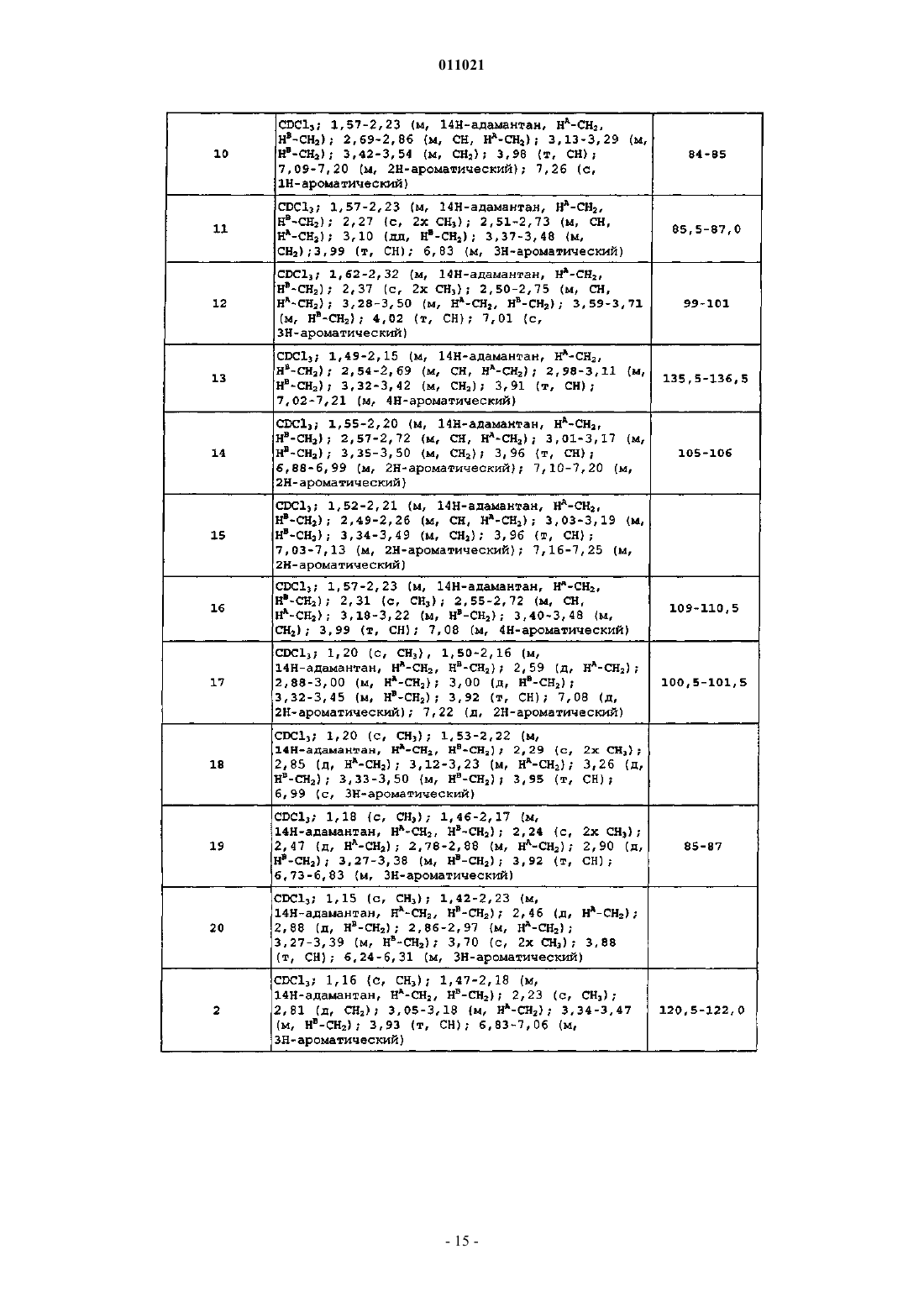
Производные адамантилпирролидин-2-она в качестве ингибиторов 11-бета-гидроксистероид-дегидрогеназы
Номер патента: 11021
Опубликовано: 30.12.2008
Авторы: Ван Дер Векен Луи Йозеф Элизабет, Линдерс Йоаннес Теодорус Мария, Яроскова Либуше, Бюйк Кристоф Франсис Роберт Нестор
Формула / Реферат
1. Соединение, имеющее формулу
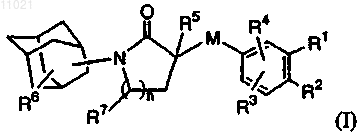
его N-оксидные формы, фармацевтически приемлемые аддитивные соли и стереохимически изомерные формы, где
n равно 1 или 2;
М представляет собой прямую связь или C1-3алкильный линкер, необязательно замещенный одним или двумя заместителями, выбранными из С1-4алкила, C1-3алкилокси-С1-4алкила, гидрокси-С1-4алкила, гидрокси, C1-3алкилокси- или фенил-С1-4алкила;
каждый из R1 и R2 независимо представляет собой водород, галоген, циано, гидрокси, С1-4алкил, необязательно замещенный галогеном, С1-4алкилокси, необязательно замещенный одним или, где возможно, двумя или тремя заместителями, выбранными из гидрокси, Ar1 и галогена;
R3 представляет собой водород, галоген, С1-4алкил, С1-4-алкилокси, циано или гидрокси;
R4 представляет собой водород, галоген, С1-4алкил, гидрокси, циано или C1-4-алкилокси, необязательно замещенный одним или, где возможно, двумя или тремя заместителями, выбранными из гидрокси и галогена;
R5 представляет собой водород, С1-4алкил или Ar2-С1-4алкил;
R6 представляет собой водород, гидрокси, галоген, С1-4алкил или C1-4-алкилокси;
R7 представляет собой водород, или R7 и R5, взятые вместе с атомом углерода, к которому они присоединены, образуют C2-алкильный линкер;
каждый из Ar1 и Ar2 независимо представляет собой фенил или нафтил, где указанные фенил и нафтил необязательно замещены С1-4алкилом, С1-4алкилокси или фенил-С1-4алкилом.
2. Соединение, имеющее формулу

его N-оксидные формы, фармацевтически приемлемые аддитивные соли и стереохимически изомерные формы, где
n равно 1 или 2;
М представляет собой C1-3алкильный линкер, необязательно замещенный одним или двумя заместителями, выбранными из С1-4алкила, C1-3алкилокси-С1-4алкила, гидрокси-С1-4алкила, гидрокси, C1-3алкилокси или фенил-С1-4алкила;
каждый из R1 и R2 независимо представляет собой водород, галоген, циано, гидрокси, С1-4алкил, необязательно замещенный галогеном, С1-4алкилокси, необязательно замещенный одним или, где возможно, двумя или тремя заместителями, выбранными из гидрокси, Ar1 и галогена;
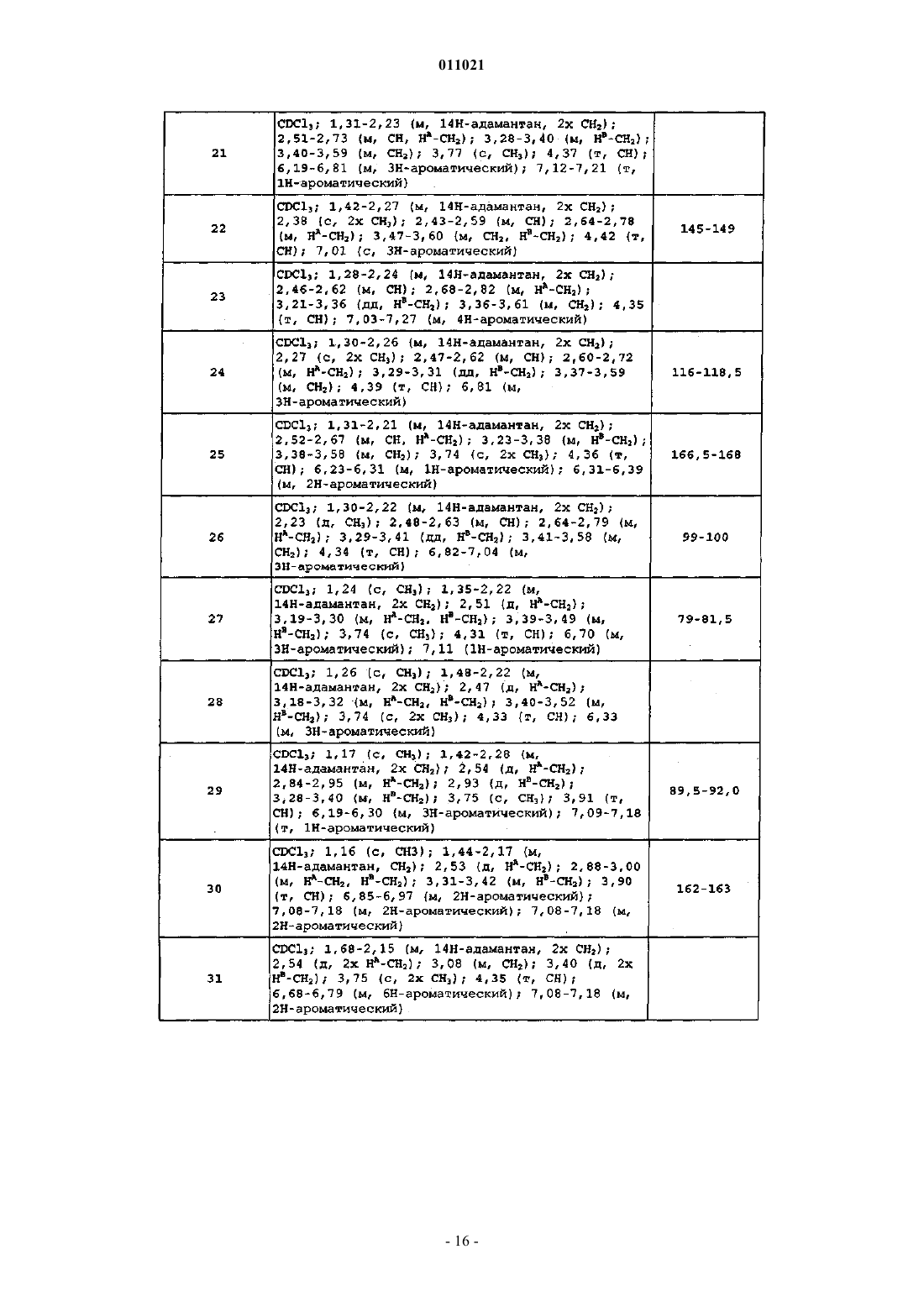
R3 представляет собой водород, галоген, С1-4алкил, C1-4-алкилокси, циано или гидрокси;
R4 представляет собой водород, галоген, С1-4алкил, гидрокси, циано или С1-4алкилокси, необязательно замещенный одним или, где возможно, двумя или тремя заместителями, выбранными из гидрокси и галогена;
R5 представляет собой водород, С1-4алкил или Ar2-С1-4алкил;
R6 представляет собой водород, гидрокси, галоген, С1-4алкил или C1-4-алкилокси;
каждый из Ar1 и Ar2 независимо представляет собой фенил или нафтил, где указанные фенил и нафтил необязательно замещены С1-4алкилом, С1-4алкилокси или фенил-С1-4алкилом.
3. Соединение по п.1 или 2, где
n равно 1 или 2;
М представляет собой C1-линкер, необязательно замещенный С1-4алкилом, гидрокси или гидрокси-С1-4алкилом, в частности, М представляет собой C1-линкер;
R1 представляет собой водород, гидрокси, циано, галоген, С1-4алкил, С1-4алкилокси, С1-4алкил, замещенный одним или, где возможно, двумя или тремя галогенами, или R1 представляет собой С1-4алкилокси, замещенный галогеном;
R2 представляет собой водород, галоген, С1-4алкил или С1-4алкилокси, необязательно замещенный одним или, где возможно, двумя или тремя галогенами;
R3 представляет собой водород, галоген, С1-4алкил, С1-4алкилокси или С1-4алкил, замещенный одним или, где возможно, двумя или тремя галогенами;
R4 представляет собой водород, галоген или С1-4алкил;
R5 представляет собой водород, С1-4алкил или Ar2-С1-4алкил, в частности, водород или метил;
R6 представляет собой водород или гидрокси, в частности, водород;
Ar2 представляет собой фенил, необязательно замещенный С1-4алкилокси.
4. Соединение по п.1 или 2, где n равно 1 или 2;
М представляет собой C1-линкер;
R1 и R2 представляют собой водород, С1-4алкил или С1-4алкилокси, в частности, метил или метокси;
R3 представляет собой водород или С1-4алкилокси, в частности, водород или метокси;
R4 представляет собой водород или галоген;
R5 представляет собой водород или С1-4алкил, в частности, водород или метил;
R6 представляет собой водород или гидрокси.
5. Соединение по п.1, где указанное соединение выбрано из группы, состоящей из
3-[(3,5-диметоксифенил)метил]-1-трицикло[3.3.1.13,7]дек-2-ил-2-пирролидинона;
3-[(4-метилфенил)метил]-1-трицикло [3.3.1.13,7]дек-2-ил-2-пирролидинона;
3-[(2-фтор-3-метилфенил)метил]-3-метил-1-трицикло[3.3.1.13,7]дек-2-ил-2-пирролидинона;
3-[(3-метоксифенил)метил] -3-метил-1-трицикло[3.3.1.13,7]дек-2-ил-2-пирролидинона;
3-бензил-1-(5-гидрокситрицикло [3.3.1.13,7]дек-2-ил)пирролидин-2-она;
3-бензил-1-(5-гидрокситрицикло[3.3.1.13,7]дек-2-ил)-3-метилпирролидин-2-она;
3-(2-фтор-3-метилбензил)-1-(5-гидрокситрицикло[3.3.1.13,7]дек-2-ил)пирролидин-2-она;
3-(2-фтор-3-метилбензил)-1-(5-гидрокситрицикло[3.3.1.13,7]дек-2-ил)-3-метилпирролидин-2-она;
их N-оксидов, фармацевтически приемлемых аддитивных солей или стереохимически изомерных форм.
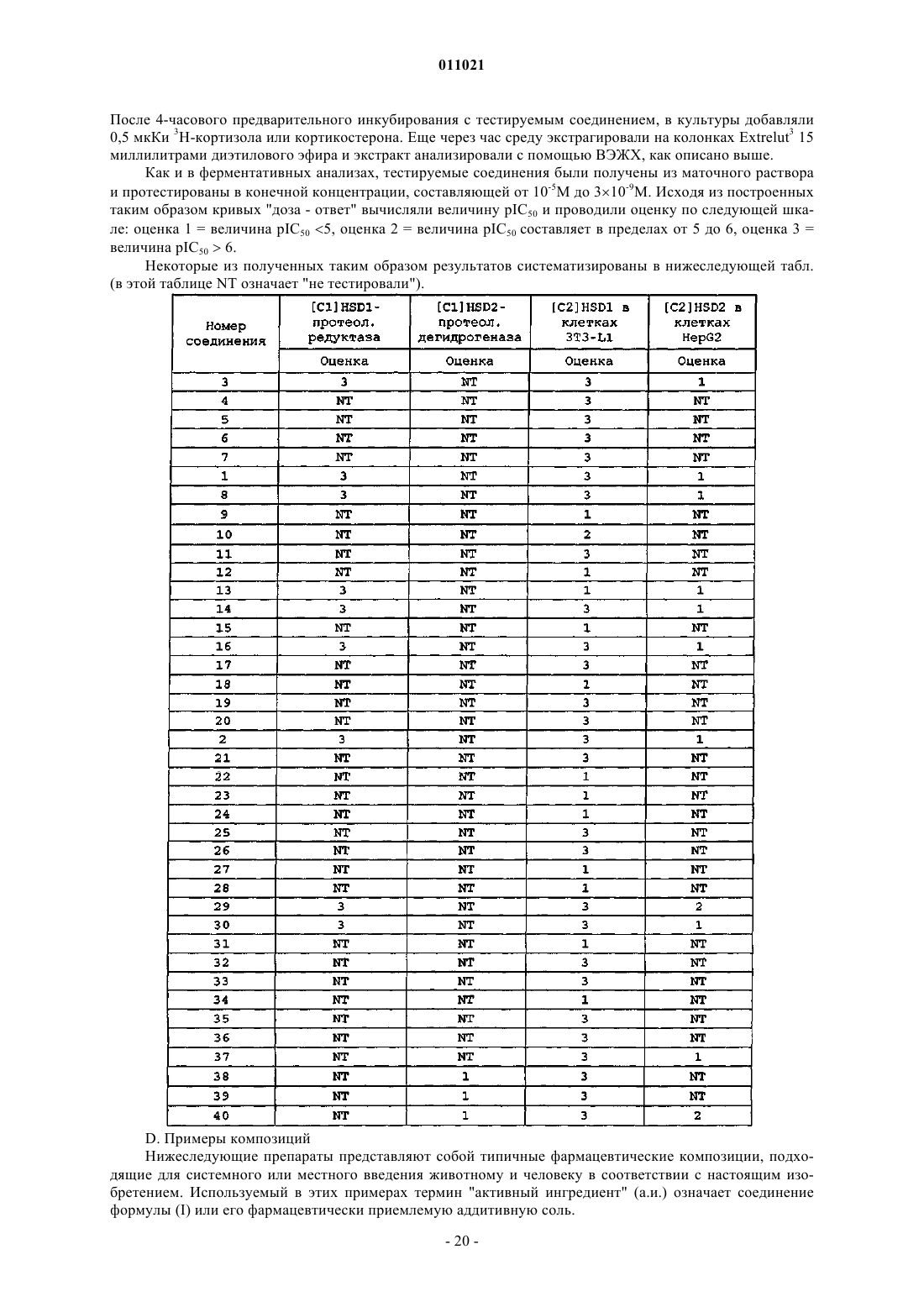
6. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и в качестве активного ингредиента эффективное 11bHSD1-ингибирующее количество соединения по любому из пп.1-5.
7. Способ получения фармацевтической композиции по п.6, отличающийся тем, что включает тщательное смешивание фармацевтически приемлемого носителя с эффективным 11bHSD1-ингибирующим количеством соединения по любому из пп.1-5.
8. Применение соединения по любому из пп.1-5 для получения лекарственного средства для лечения патологий, ассоциированных с избыточным образованием кортизола, таких как, например, ожирение, диабет, ассоциированные с ожирением сердечно-сосудистые заболевания, деменция, нарушение познавательной способности, остеопороз и глаукома.
Текст
011021 Метаболический синдром представляет собой заболевание, которое все чаще поражает людей не только в Западных странах, но также в странах Азии и в развивающихся странах. Оно характеризуется ожирением, а в частности, висцеральным ожирением, диабетом типа 2, гиперлипидемией, гипертензией,артериосклерозом, ишемической болезнью сердца и, наконец, хронической почечной недостаточностью.(СТ. Montague et al. (2000), Diabetes, 49, 883-888). Известно, что глюкокортикоиды и 11HSD1 являются важными факторами дифференцировки жировых стромальных клеток в зрелые адипоциты. У пациентов,страдающих ожирением, уровень мРНК 11HSD1 в висцеральных стромальных клетках является более высоким, чем в подкожной ткани. Кроме того, сверхэкспрессия 11HSD1 в жировой ткани трансгенных мышей ассоциируется с повышенными уровнями кортикостерона в жировой ткани, с висцеральным ожирением, чувствительностью к инсулину, диабетом типа 2, гиперлипидемией и с гиперфагией(H.Masuzaki et al. (2001), Science, 294, 2166-2170). Следовательно, 11HSD1, по всей вероятности, участвует в развитии висцерального ожирения и метаболического синдрома. Ингибирование 11HSD1 приводит к снижению уровня дифференцировки и к повышению уровня пролиферации жировых стромальных клеток. Кроме того, дефицит глюкокортикоидов (адренэктомия) приводит к усилению способности инсулина и лептина стимулировать анорексию и потерю веса, но при введении глюкокортикоидов эта способность инсулина и лептина снижается до исходного уровня (P.M.Stewart et al. (2002), Trends Endocrin. Metabol, 13, 94-96). Указанные данные позволяют предположить,что усиленная реактивация кортизона под действием 11HSD1 может стимулировать ожирение, а поэтому ингибирование этого фермента в жировой ткани пациентов, страдающих ожирением, может давать благоприятный эффект. Ожирение также ассоциируется с риском развития сердечно-сосудистых заболеваний. Существует четкая взаимосвязь между уровнем экскреции кортизола и уровнем холестерина липопротеина высокой плотности (ЛВП) как у мужчин, так и у женщин, что позволяет предположить, что глюкокортикоиды регулируют ключевые факторы риска развития сердечно-сосудистых заболеваний. Аналогичным образом, жесткость аорты также ассоциируется с висцеральным ожирением у пожилых людей. Глюкокортикоиды и глаукома Глюкокортикоиды, при их экзогенном введении и при некоторых состояниях, приводящих к увеличению уровня их продуцирования, таких как синдром Кушинга, способствуют повышению внутриглазного давления, и, тем самым, увеличивают риск развития глаукомы. Индуцированное кортикостероидами повышение внутриглазного давления вызывается резистентностью к оттоку воды, обусловленной индуцированными глюкокортикоидами изменениями в трабекулярной сети и в ее внутриклеточном матриксе. В работе Zhou et al. (Int. J. Mol. Med. (1998) 1, 339-346) также сообщалось, что кортикостероиды повышают количество фибронектина, а также коллагена типа I и типа IV в культивированных передних сегментах трабекулярной сети коровьих органов. 11HSD1 экспрессируется в базальных клетках эпителия роговицы и в непигментированных эпителиальных клетках. мРНК глюкокортикоидного рецептора детектируется только в трабекулярной сети, а мРНК глюкокортикоидного, минералокортикоидного рецептора и 11HSD1 присутствует в непигментированных эпителиальных клетках. Введение пациентам карбеноксолона приводит к значительному повышению внутриглазного давления (S. Rauz et al. (2001) Invest. Ophthalmol. Vis. Science, 42, 2037-2042),что позволяет предположить, что ингибиторы HSD1 могут быть использованы для лечения глаукомы. Проблема, связанная с вышеуказанным действием кортикостероидов, может быть решена с помощью настоящего изобретения путем идентификации сильных ингибиторов 11HSD1, подавляющих 11HSD1 с высокой селективностью, и их использования для лечения патологий, ассоциированных с избыточным образованием кортизола, таких как ожирение, диабет, ассоциированные с диабетом сердечно-сосудистые заболевания и глаукома. Как указано ниже, было обнаружено, что 3-замещенные 2 пирролидиноновые производные формулы (I) могут быть использованы в качестве лекарственного средства, а в частности, в целях приготовления лекарственного средства для лечения патологий, ассоциированных с избыточным образованием кортизола. В публикации Bloiranaert A. et al. (Heterocycles (2001),55(12), 2273-2278) описано получение пиперидин- и пирролидин-подобного полимера, присоединенного к (R)-фенилглициноловому каркасу, а в частности, описаны 1-[(1R)-2-гидрокси-1-фенилэтил]-3-метил-3(фенилметил)-2-пирролидинон и (3R)-1-[(1R)-2-гидрокси-1-фенилэтил]-3-(фенилметил)-2-пирролидинон. В публикации Bausanne I. et al. (Tetrahedron: Assymetry (1998), 9(5), 797-804) описано получение 3 замещенных пирролидинонов посредством -алкилирования хирального нерацемического -лактона, а в частности, описан 1-(2-гидрокси-1-фенилэтил)-3-бензилпирролидин-2-он. Заявки на патенты США 2001/034343, 6211199, 6194406, а также заявки WO 97/22604 и WO 97/19074 представляют собой патентные заявки, поданные фирмой Aventis Pharmaceuticals Inc., где описаны 4-(1 Н-бензимидазол-2-ил)-[1,4]диазепаны, которые могут быть использованы для лечения аллергических заболеваний. В этих заявках, 3-замещенные пирролидиноны согласно изобретению описаны как промежуточные соединения в синтезе указанных 4-(1 Н-бензимидазол-2-ил)-[1,4]диазепанов. В этих заявках, в частности, описаны: 3-[(4-фторфенил)метил]-1-[(1S)-1-фенилэтил]-2-пирролидинон и 3-[(4-1 011021 фторфенил)метил]-1-[(1R)-1-фенилэтил]-2-пирролидинон. Однако ни в одном из перечисленных документов не описано терапевтическое применение производных 3-замещенных 2-пирролидинонов согласно изобретению. В соответствии с этим, в своем первом аспекте, настоящее изобретение относится к соединениям формулы (I) к их N-оксидным формам, фармацевтически приемлемым аддитивным солям и стереохимически изомерным формам, гдеn равно 1 или 2; М представляет собой прямую связь или C1-3 алкильный линкер, необязательно замещенный одним или двумя заместителями, выбранными из C1-4 алкила, C1-3 алкилокси-С 1-4 алкила, гидрокси-С 1-4 алкила,гидрокси, C1-3 алкилокси или фенил-C1-4 алкила; каждый из R1 и R2 независимо представляет собой водород, галоген, циано, гидрокси, C1-4 алкил, необязательно замещенный галогеном, C1-4 алкилокси, необязательно замещенный одним или, где возможно, двумя или тремя заместителями, выбранными из гидрокси, Ar1 и галогена;R4 представляет собой водород, галоген, C1-4 алкил, гидрокси, циано или C1-4-алкилокси, необязательно замещенный одним или, где возможно, двумя или тремя заместителями, выбранными из гидрокси и галогена;R7 представляет собой водород, или R7 и R5, взятые вместе с атомом углерода, к которому они присоединены, образуют С 2-алкильный линкер; каждый из Ar1 и Ar2 независимо представляет собой фенил или нафтил, где указанные фенил и нафтил необязательно замещены C1-4-алкилом, C1-4 алкилокси или фенил-C1-4 алкилом. Ниже приводятся определения вышеупомянутых терминов, а именно "галоген" означает общее название фтора, хлора, брома и иода; "C1-3 алкил" означает насыщенные углеводородные радикалы с прямой и разветвленной цепью, имеющие от 1 до 3 атомов углерода, такие как, например, метил, этил, пропил, 1-метилэтил и т.п.;"С 1-4 алкил" означает насыщенные углеводородные радикалы с прямой или разветвленной цепью,имеющие от 1 до 4 атомов углерода, такие как, например, метил, этил, пропил, бутил, 1-метилэтил, 2 метилпропил, 2,2-диметилэтил и т.п.;"C1-3 алкилокси" означает насыщенные углеводородные радикалы с прямой или разветвленной цепью, имеющие от 1 до 3 атомов углерода, такие как метокси, этокси, пропилокси, 1-метилэтилокси и т.п.;"С 1-4 алкилокси" означает насыщенные углеводородные радикалы с прямой или разветвленной цепью, имеющие от 1 до 4 атомов углерода, такие как метокси, этокси, пропилокси, бутилокси, 1 метилэтилокси, 2-метилпропилокси и т.п. Вышеупомянутый термин "фармацевтически приемлемые аддитивные соли" означает терапевтически активные нетоксичные кислотно-аддитивные солевые формы, которые могут быть образованы соединениями формулы (I). Указанные кислотно-аддитивные соли могут быть получены путем обработки основной формы соответствующей кислотой. Подходящими кислотами являются, например, неорганические кислоты, такие как галогенводородные кислоты, например, хлористо-водородная или бромистоводородная кислота; серная кислота, азотная кислота; фосфорная кислота и т.п.; или органические кислоты, такие как, например, уксусная кислота, пропановая кислота, гидроксиуксусная кислота, молочная кислота, пировиноградная кислота, щавелевая кислота, малоновая кислота, янтарная кислота (то есть,бутандионовая кислота), малеиновая кислота, фумаровая кислота, яблочная кислота, винная кислота,лимонная кислота, метансульфоновая кислота, этансульфоновая кислота, бензолсульфоновая кислота, птолуолсульфоновая кислота, цикламиновая кислота, салициловая кислота, п-аминосалициловая кислота,памовая кислота и т.п. Вышеупомянутый термин "фармацевтически приемлемые аддитивные соли" означает терапевтически активные нетоксичные основно-аддитивные солевые формы, которые могут быть образованы соединениями формулы (I). Примерами таких основно-аддитивных солевых форм являются, например, соли натрия, калия и кальция, а также соли, образованные фармацевтически приемлемыми аминами, такими как аммиак, алкиламины, бензатин, N-метил-D-глюкамин, гидрабамин, и аминокислотами, например аргинином, лизином. И наоборот, указанные солевые формы могут быть превращены в свободную кислоту или свободное основание путем их обработки соответствующим основанием или соответствующей кислотой. Используемый выше термин "аддитивная соль" также включает сольваты, которые могут быть образованы соединениями формулы (I), а также их солями. Такими сольватами являются, например, гидра-2 011021 ты, алкоголяты и т.п. Используемый выше термин "стереохимически изомерные формы" означает все возможные различные изомерные формы, а также конформационные формы, которые могут иметь соединения формулы (I). Если это не оговорено или не указано особо, химические названия соединений обозначают смесь всех возможных стереохимически и конформационно изомерных форм; причем, указанные смеси содержат все диастереомеры, энантиомеры и/или конформеры основной молекулярной структуры. Все стереохимически изомерные формы соединений формулы (I) в чистой форме или в смеси друг с другом также входят в объем настоящего изобретения.N-оксидные формы соединений формулы (I) представляют собой соединения формулы (I), в которых один или несколько атомов азота окислены до так называемого N-оксида. Представляющая интерес группа соединений состоит из соединений формулы (I), которые имеют одно или несколько из нижеследующих ограничений:(ii) М представляет собой прямую связь или C1-линкер, необязательно замещенный C1-4 алкилом,гидрокси или гидрокси-C1-4 алкилом; а предпочтительно, М представляет собой C1-линкер, необязательно замещенный C1-4 алкилом, гидрокси или гидрокси-С 1-4 алкилом; в частности, М представляет собой C1 линкер;(iii) R1 представляет собой водород, гидрокси, циано, галоген, C1-4 алкил, C1-4 алкилокси, C1-4 алкил,замещенный одним или, где возможно, двумя или тремя галогеновыми заместителями; либо R1 представляет собой C1-4 алкилокси, замещенный галогеном;(iv) R2 представляет собой водород, галоген, C1-4 алкил или C1-4 алкилокси, необязательно замещенный одним или, где возможно, двумя или тремя галогенами;(v) R3 представляет собой водород, галоген, C1-4 алкил, C1-4 алкилокси или C1-4 алкил, замещенный одним или, где возможно, двумя или тремя галогенами;(viii) R6 представляет собой водород или гидрокси, в частности, водород;(х) Ar2 представляет собой фенил, необязательно замещенный C1-4 алкилокси. Другая группа представляющих интерес соединений состоит из соединений формулы (I), которые имеют одно или несколько из нижеследующих ограничений:(iv) R3 представляет собой водород или C1-4 алкилокси, в частности, водород или метокси;(v) R4 представляет собой водород или галоген;(vi) R5 представляет собой водород или C1-4 алкил, в частности, водород или метил;(vii) R6 представляет собой водород или гидрокси;(viii) R7 представляет собой водород. Другими представляющими интерес соединениями являются соединения формулы (I), которые имеют одно или несколько из нижеследующих ограничений:(v) R3 представляет собой водород или C1-4 алкилокси, в частности, водород или метокси;(vi) R4 представляет собой водород или галоген;(vii) R5 представляет собой водород или C1-4 алкил, в частности, водород или метил;(viii) R6 представляет собой водород или гидрокси;-3 011021 3-[(4-фторфенил)метил]-3-метил-1-трицикло [3.3.1.13,7]дек-2-ил-2-пирролидинона; 3-бензил-1-(5-гидрокситрицикло[3.3.1.13,7]дек-2-ил)пирролидин-2-она; 3-бензил-1-(5-гидрокситрицикло[3.3.1.13,7]дек-2-ил)-3-метилпирролидин-2-она; 3-(2-фтор-3-метилбензил)-1-(5-гидрокситрицикло[3.3.1.13,7]дек-2-ил)пирролидин-2-она; 3-(2-фтор-3-метилбензил)-1-(5-гидрокситрицикло[3.3.1.13,7]дек-2-ил)-3-метилпирролидин-2-она; их N-оксидов, фармацевтически приемлемых аддитивных солей или стереохимически изомерных форм. В более предпочтительном варианте изобретения, соединения формулы (I) выбраны из группы, состоящей из 3-[(3,5-диметоксифенил)метил]-1-трицикло[3.3.1.13,7]дек-2-ил-2-пирролидинона; 3-[(4-метилфенил)метил]-1-трицикло[3.3.1.13,7]дек-2-ил-2-пирролидинона; 3-[(2-фтор-3-метилфенил)метил]-3-метил-1-трицикло[3.3.1.13,7]дек-2-ил-2-пирролидинона; 3-[(3-метоксифенил)метил]-3-метил-1-трицикло[3.3.1.13,7]дек-2-ил-2-пирролидинона; 3-бензил-1-(5-гидрокситрицикло[3.3.1.13,7]дек-2-ил)пирролидин-2-она; 3-бензил-1-(5-гидрокситрицикло[3.3.1.13,7]дек-2-ил)-3-метилпирролидин-2-она; 3-(2-фтор-3-метилбензил)-1-(5-гидрокситрицикло[3.3.1.13,7]дек-2-ил)пирролидин-2-она; 3-(2-фтор-3-метилбензил)-1-(5-гидрокситрицикло [3.3.1.13,7]дек-2-ил)-3-метилпирролидин-2-она; их N-оксидов, фармацевтически приемлемых аддитивных солей или стереохимически изомерных форм. В соответствии с другим своим аспектом настоящее изобретение относится к соединениям формулы: к их N-оксидным формам, фармацевтически приемлемым аддитивным солям и стереохимически изомерным формам, гдеn равно 1 или 2; М представляет собой прямую связь или C1-3 алкильный линкер, необязательно замещенный одним или двумя заместителями, выбранными из C1-4 алкила, C1-3 алкилокси-C1-4 алкила, гидрокси-C1-4 алкила,гидрокси, C1-3 алкилокси или фенил-С 1-4 алкила; каждый из R1 и R2 независимо представляет собой водород, галоген, циано, гидрокси, C1-4 алкил, необязательно замещенный галогеном, C1-4 алкилокси, необязательно замещенный одним или, где возможно, двумя или тремя заместителями, выбранными из гидрокси, Ar1 и галогена;R4 представляет собой водород, галоген, C1-4 алкил, гидрокси, циано или C1-4-алкилокси, необязательно замещенный одним или, где возможно, двумя или тремя заместителями, выбранными из гидрокси и галогена;R6 представляет собой водород, гидрокси, галоген, C1-4 алкил или C1-4-алкилокси; каждый из Ar1 и Ar2 независимо представляет собой фенил или нафтил, где указанные фенил и нафтил необязательно замещены C1-4 алкилом, C1-4 алкилокси или фенил-C1-4 алкилом. Другая группа представляющих интерес соединений состоит из соединений формулы (I'), которые имеют одно или несколько из нижеследующих ограничений:iv. R3 представляет собой водород или C1-4 алкилокси, в частности, водород или метокси;v. R4 представляет собой водород или галоген;vi. R5 представляет собой водород или C1-4 алкил, в частности, водород или метил;vii. R6 представляет собой водород или гидрокси. Другими представляющими интерес соединениями также являются, соединения формулы (I'), которые имеют одно или несколько из нижеследующих ограничений:v. R3 представляет собой водород или C1-4 алкилокси, в частности, водород или метокси;vi. R4 представляет собой водород или галоген;vii. R5 представляет собой водород или C1-4 алкил, в частности, водород или метил;viii. R6 представляет собой водород или гидрокси. Другими конкретными группами соединений являются: соединения формулы (I), где n равно 1; соединения формулы (I), где адамантильный заместитель присоединен к остальной части молекулы в положении 2; соединения формулы (I), где R1 или R2 представляют собой водород; соединения формулы (I), где R3 присутствует в мета-положении по отношению к М; соединения формулы (I), где заместитель R6 присутствует в положении 4 напротив положения, в котором адамантил присоединен к остальной части молекулы. В другом своем аспекте, настоящее изобретение относится к любой из вышеупомянутых групп соединений, которые могут быть использованы в качестве лекарственного средства. В частности, эти соединения могут быть использованы для лечения или предупреждения патологий, ассоциированных с избыточным образованием кортизола, таких как ожирение, диабет, ассоциированные с ожирением сердечно-сосудистые заболевания и глаукома. 1,3-пирролидининовые производные согласно изобретению обычно получают путем алкилирования соответствующего лактама (II) соответствующим алкилгалогенидом (III) в присутствии основания, такого как, например, (диизопропиламино)литий (LDA) или втор-бутиллитий, необязательно, в присутствии сорастворителя, такого как, например, N,N',N"-гексаметилфосфорамид (НМРА), или в присутствии соли,такой как, например, LiBr (схема 1). Эту реакцию обычно проводят в инертном растворителе, таком как,например, диизопропиловый эфир, тетрагидрофуран или метиленхлорид. Температура реакции и время реакции могут варьироваться в зависимости от используемых исходных веществ или реагентов, но,обычно, такую реакцию проводят в течение двух часов при низких температурах (от -50 до -90 С). В некоторых случаях, такая реакция сочетания протекает медленно, и реакционную смесь оставляют до полного прекращения реакции. В этих случаях, температура должна быть увеличена (до температуры от -10 до -30 С). Схема 1 Соответствующий лактам формулы (II), описанный выше, обычно получают посредством реакции взаимодействия адамантан-2-она (IV) с соответствующей аминоалкилкарбоновой кислотой в присутствии кислоты, такой как, например, муравьиная кислота (схема 2). Такую реакцию обычно проводят при повышенной температуре, например, в пределах от 100 до 200 С, до тех пор, пока адамантанон не будет израсходован. После завершения реакции реакционную смесь охлаждают, подщелачивают, например,карбонатом натрия и экстрагируют эфиром, в результате чего получают лактам формулы (II). Другие примеры синтеза соединений формулы (I), проводимого любым из вышеупомянутых методов синтеза, приводятся ниже в экспериментальной части. Если это необходимо или желательно, то могут быть проведены одна или несколько из нижеследующих дополнительных стадий в любом порядке:(ii) превращение соединения формулы (I) или его защищенной формы в другое соединение формулы (I) или в его защищенную форму;(iii) превращение соединения формулы (I) или его защищенной формы в N-оксид, соль, четвертичный амин или сольват соединения формулы (I) или в его защищенную форму;(iv) превращение N-оксида, соли, четвертичного амина или сольвата соединения формулы (I) или его защищенной формы в соединение формулы (I) или в его защищенную форму;(v) превращение N-оксида, соли, четвертичного амина или сольвата соединения формулы (I) или его защищенной формы в другой N-оксид, фармацевтически приемлемую аддитивную соль, четвертичный амин или сольват соединения формулы (I) или в его защищенную форму;(vi) разделение смеси, в случае, если соединение формулы (I) получено в виде смеси (R)- и (S)энантиомеров, с получением нужного энантиомера. Следует отметить, что в описанных выше способах, функциональные группы промежуточных соединений могут быть, но необязательно, блокированы защитными группами. Функциональными группами, требующими защиты, являются гидрокси, амино и карбоновая кислота. Подходящими защитными группами для гидрокси являются триалкилсилильные группы (например,трет-бутилдиметилсилил, трет-бутилдифенилсилил или триметилсилил), бензил и тетрагидропиранил. Подходящими защитными группами для аминогруппы являются трет-бутилоксикарбонил или бензилоксикарбонил. Подходящими защитными группами для карбоновой кислоты являются С 1-6 алкиловый или бензиловый эфиры. Защита функциональных групп и снятие защиты с этих функциональных групп могут быть осуществлены до или после проведения стадии реакции. Использование защитных групп подробно описано в публикации "Protective Groups in Organic Synthesis", 2nd edition., T.W. GreeneP.G.M. Wuts, Wiley Interscience (1991). Кроме того, атомы N в соединениях формулы (I) могут быть метилированы известными методами с использованием СН 3-I в подходящем растворителе, таком как, например, 2-пропанон, тетрагидрофуран или диметилформамид. Соединения формулы (I) могут быть также превращены в другие соединения в соответствии с известными процедурами превращения функциональных групп, некоторые примеры которых упомянуты выше. Соединения формулы (I) могут быть также превращены в соответствующие N-оксидные формы в соответствии с известными процедурами превращения трехвалентного азота в его N-оксидную форму. Такую реакцию N-окисления обычно проводят посредством взаимодействия исходного соединения формулы (I) с 3-фенил-2-(фенилсульфонил)оксазиридином или с соответствующим органическим или неорганическим пероксидом. Соответствующими неорганическими пероксидами являются, например, пероксид водорода, пероксид щелочного металла или пероксид щелочно-земельного металла, например, пероксид натрия, пероксид калия; соответствующими органическими пероксидами могут быть пероксикислоты, такие как, например, бензолкарбопероксокислота или галогензамещенная бензолкарбопероксокислота, например, 3-хлорбензолкарбопероксокислота, пероксоалкановые кислоты, например пероксоуксусная кислота, алкилгидропероксиды, например трет-бутилгидропероксид. Подходящими растворителями являются, например, вода; низшие алканолы, например этанол и т.п.; углеводороды, например толуол; кетоны, например 2-бутанон; галогенированные углеводороды, например дихлорметан; и смеси таких растворителей. Чистые стереохимически изомерные формы соединений формулы (I) могут быть получены в соответствии с хорошо известными процедурами. Диастереомеры могут быть разделены физическими методами, такими как селективная кристаллизация и хроматография, например противоточная распределительная хроматография, жидкостная хроматография и т.п. Некоторые из соединений формулы (I) и некоторые из промежуточных соединений согласно изобретению могут содержать ассиметрический атом углерода. Чистые стереохимически изомерные формы указанных соединений и указанных промежуточных соединений могут быть получены в соответствии с-6 011021 хорошо известными процедурами. Так, например, диастереоизомеры могут быть разделены физическими методами, такими как селективная кристаллизация и хроматография, например, противоточная распределительная хроматография, жидкостная хроматография и другими методами. Энантиомеры могут быть получены из рацемических смесей, сначала путем превращения указанных рацемических смесей с использованием подходящих расщепляющих агентов, таких как например, хиральные кислоты, в смеси диастереомерных солей или соединений, а затем путем физического разделения указанных смесей диастереомерных солей или соединений, например, посредством селективной кристаллизации и хроматографии, например жидкостной хроматографии и другими методами; и наконец, путем превращения указанных разделенных диастереомерных солей или соединений в соответствующие энантиомеры. Чистые стереохимически изомерные формы могут быть также получены из чистых стереохимически изомерных форм соответствующих промежуточных соединений и исходных соединений, при условии, что промежуточные реакции протекают стереоспецифически. Альтернативным способом разделения энантиомерных форм соединений формулы (I) и промежуточных соединений является жидкостная хроматография, а в частности, жидкостная хроматография с использованием хиральной стационарной фазы. Некоторые промежуточные соединения и исходные соединения, используемые в процедурах реакций, упомянутых выше, представляют собой известные соединения и являются коммерчески доступными, либо они могут быть получены известными методами. Соединения согласно изобретению являются ценными соединениями, поскольку они обладают фармакологическими свойствами. Поэтому они могут быть использованы в качестве лекарственных средств, а в частности, для лечения патологий, ассоциированных с избыточным образованием кортизола,таких как, например, ожирение; диабет; ассоциированные с ожирением сердечно-сосудистые заболевания и глаукома. Как описано ниже в экспериментальной части, ингибирующее действие соединений согласно изобретению на 11HSD1-редуктазную активность (превращение кортизона в кортизол) было продемонстрированы in vitro в ферментативном анализе с использованием рекомбинантного фермента 11HSD1,проводимом путем детекции превращения кортизона в кортизол методами ВЭЖХ-очистки и количественными методами. Ингибирование 11HSD1-редуктазы было также продемонстрировано in vitro в клеточном анализе, включающем контактирование 11HSD1-экспрессирующих клеток с тестируемыми соединениями и оценку влияния указанных соединений на образование кортизола в культуральной среде данных клеток. Предпочтительными клетками, используемыми в анализе согласно изобретению, являются клетки, выбранные из группы, состоящей из мышиных фибробластов 3T3-L1, клеток HepG2, клеток почек свиньи, а в частности, клеток LCC-PK1 и крысиных гепатоцитов. В соответствии с этим, настоящее изобретение относится к соединениям формулы (I) и к их фармацевтически приемлемым N-оксидам, аддитивным солям, четвертичным аминам и стереохимически изомерным формам, используемым в терапии, а более конкретно, для лечения или предупреждения патологий, ассоциированных с избыточным образованием кортизола, таких как ожирение; диабет; ассоциированные с ожирением сердечно-сосудистые заболевания и глаукома. Соединения формулы (I) и их фармацевтически приемлемые N-оксиды, аддитивные соли, четвертичные амины, и стереохимически изомерные формы будут далее называться соединениями согласно изобретению. Соединения согласно изобретению являются ценными фармацевтическими средствами, а поэтому,настоящее изобретение относится к способу лечения животного, например млекопитающего, включая человека, страдающего патологией, ассоциированной с избыточным образованием кортизола, где указанный способ включает введение данному млекопитающему эффективного количества соединения согласно изобретению. Указанный способ включает системное или местное введение эффективного количества соединения согласно изобретению теплокровным животным, включая человека. Поэтому объектом настоящего изобретения является соединение настоящего изобретения, которое может быть использовано в качестве лекарственного средства. В частности, настоящее изобретение относится к использованию соединения согласно изобретению в целях изготовления лекарственного средства для лечения патологий, ассоциированных с избыточным образованием кортизола, таких как ожирение; диабет, ассоциированныес ожирением сердечно-сосудистые заболевания и глаукома. Очевидно, что количество соединения согласно изобретению, также называемого здесь активным ингредиентом, которое требуется для достижения терапевтического эффекта, может варьироваться в зависимости от конкретного соединения, способа введения, возраста и состояния реципиента, а также от конкретного расстройства или заболевания, подвергаемого лечению. Подходящая суточная доза должна составлять от 0,001 до 500 мг/кг массы тела, а в частности, от 0,005 до 100 мг/кг массы тела. Способ лечения может также включать введение активного ингредиента в режиме от одного до четырех раз в день. Хотя активный ингредиент может быть введен отдельно, однако, предпочтительно, чтобы он был введен в виде фармацевтической композиции. В соответствии с этим, настоящее изобретение также относится к фармацевтической композиции, содержащей соединение настоящего изобретения в комбинации с фармацевтически приемлемым носителем или разбавителем. Такой носитель или разбавитель дол-7 011021 жен быть "приемлемым", то есть, совместимым с другими ингредиентами такой композиции, и не должен оказывать негативного воздействия на состояние реципиента. Фармацевтические композиции согласно изобретению могут быть получены любыми методами,хорошо известными специалистам-фармацевтам, например, методами, описанными в руководстве Gennaro et al., Remington's Pharmaceutical Sciences (18th ed., Mack Publishing. Company, 1990, see especially Part 8: Pharmaceutical preparations and their Manufacture). Терапевтически эффективное количество конкретного соединения в виде основания или аддитивной соли, используемых в качестве активного ингредиента, объединяют с фармацевтически приемлемым носителем с получением однородной смеси, которая может быть приготовлена в различных формах широкого ряда, в зависимости от формы препарата, предпочтительной для введения. Такие фармацевтические композиции, предпочтительно, представляют собой унифицированную лекарственную форму, подходящую для системного введения, такого как пероральное, чрезкожное или парентеральное введение; или для местного введения, например, в виде аэрозоля для ингаляции, спрея для интраназального введения, глазных капель, крема, геля, шампуня или т.п. Так, например, для получения композиций в виде лекарственной формы для перорального введения могут быть использованы любые подходящие фармацевтические среды, такие как, например, вода, гликоли, масла, спирты и т.п., в случае приготовления жидких препаратов для перорального введения, таких как суспензии, сиропы, эликсиры и растворы; либо могут быть использованы твердые носители, такие как крахмалы, сахара, каолин, замасливатели, связывающие вещества, дезинтеграторы и т.п., в случае приготовления порошков, драже, капсул и таблеток. Таблетки и капсулы, благодаря простоте их введения, являются наиболее предпочтительными унифицированными лекарственными формами для перорального введения, в которых обычно используются твердые фармацевтические носители. В композиции для парентерального введения, для облегчения ее растворимости, обычно включают носитель, который, в основном, содержит, по крайней мере, в значительной степени, стерильную воду, хотя он может включать и другие ингредиенты. Так, например, могут быть получены растворы для инъекций, в которых носитель содержит физиологический раствор, раствор глюкозы или смесь физиологического раствора и раствора глюкозы. Могут быть также получены суспензии для инъекций, в которых могут быть использованы соответствующие жидкие носители, суспендирующие агенты и т.п. В указанных композициях, предназначенных для чрезкожного введения, носитель содержит, но необязательно, агент, усиливающий пенетрацию, и/или подходящий смачивающий агент,необязательно, объединенный с подходящими любыми добавками в небольших количествах, которые не оказывают какого-либо негативного воздействия на кожу. Такие добавки могут облегчать нанесение препарата на кожу и/или приготовление нужных композиций. Указанные композиции могут введены различными способами, например, в виде чрезкожного пластыря, капель типа "spot on" или мази. Подходящими композициями для местного применения могут быть все описанные композиции, обычно используемые для местного введения лекарственных средств, например, кремы, гели, повязки, шампуни,настойки, пасты, твердые мази, жидкие мази, порошки и т.п. Указанные композиции могут быть введены в виде аэрозоля, например, с использованием пропеллента, такого как азот, двуокись углерода и фреон,или без использования пропеллента, например в виде спрея, распыляемого насосом, капель, лосьона или полутвердых препаратов, таких как композиции густой консистенции, которые могут быть нанесены тампоном. В частности, обычно используются полутвердые композиции, такие как жидкие мази, кремы,гели, твердые мази и т.п. Для облегчения введения дозы и придания ей однородности, особенно предпочтительно, чтобы вышеупомянутые фармацевтические композиции были приготовлены в виде унифицированной лекарственной формы. Термин "унифицированная лекарственная форма", используемый в описании и в формуле изобретения, означает физически дискретные единицы, подходящие для однократного приема, где каждая такая единица содержит предварительно определенное количество активного ингредиента, рассчитанное на продуцирование нужного терапевтического эффекта, в комбинации с требуемым фармацевтическим носителем. Примерами таких унифицированных лекарственных форм являются таблетки (включая таблетки с насечками или таблетки с покрытиями), капсулы, драже, пакеты с порошком, облатки,суппозитории, растворы для инъекций или суспензии, препараты объемом, соответствующим чайной ложке, препараты объемом, соответствующим столовой ложке и т.п., и их дробные формы. Для повышения растворимости и/или стабильности соединений формулы (I) в фармацевтических композициях, желательно использовать -, - или -циклодекстрины или их производные. Для повышения растворимости и/или стабильности соединений формулы (I) в фармацевтических композициях могут быть также использованы со-растворители. Очевидно, что для получения водных композиций, более подходящими являются аддитивные соли рассматриваемых соединений, поскольку они имеют повышенную растворимость в воде. Экспериментальная часть Используемые ниже сокращения означают: "ДХМ" дихлорметан, "DIPE" - диизопропиловый эфир,"ДМФ" N,N-диметилформамид, "Et2O" - диэтиловый эфир, "EtOAc" - этилацетат, "LDA" - (диизопропиламино)литий, "ТГФ" - тетрагидрофуран.-8 011021 А. Получение промежуточных соединений Пример А 1. Получение промежуточного соединения 1 В круглодонную колбу загружали адамантан-2-он (5,00 г, 33,28 ммоль), -аминомасляную кислоту(6,86 г, 66,56 ммоль) и 8,3 мл муравьиной кислоты. Смесь нагревали при 140-160 С в течение 17 ч до тех пор, пока не был израсходован весь адамантанон. ТСХ промежуточного соединения 1: Rf=0,24 в Et2O + 1 капля СН 3 СООН, элюировали 2 раза. Смесь выливали на измельченный лед, а затем подщелачивали (NaHCO3), экстрагировали Et2O (370 мл) и сушили (MgSO4). После выпаривания растворителя получали 4,95 г неочищенного промежуточного соединения 1. Полученный продукт очищали хроматографией(59%) чистого промежуточного соединения 1 (бесцветные кристаллы). Пример А 2. а) Получение промежуточного соединения 2[3.3.1.13,7]декан-2-амина (0,025 моль) и калиевой соли уксусной кислоты (5 г) в метаноле (150 мл) гидрировали в течение ночи при 50 С в присутствии палладия на активированном угле (10%) (2 г), используемого в качестве катализатора, и раствора тиофена (1 мл). После израсходования водорода (1 экв.) катализатор отфильтровывали и фильтрат упаривали. Остаток растворяли в ДХМ и промывали водой. Органический слой отделяли, сушили и фильтровали, растворитель выпаривали, и получали 8 г промежуточного соединения 2.b) Получение промежуточного соединения 3 Смесь промежуточного соединения 2 (0,0029 моль) и гидроксида калия (0,0145 моль) в 1,2 этандиоле (15 мл) перемешивали и кипятили с обратным холодильником во время выходных дней. Реакционную смесь охлаждали, выливали в воду и экстрагировали ДХМ. Водный слой подкисляли лимонной кислотой (рН 5) и экстрагировали ДХМ. Органический слой отделяли, сушили, фильтровали и растворитель выпаривали, в результате чего получали 1,8 г промежуточного соединения 3. Пример A3. а) Получение промежуточного соединения 4 Гидрид натрия (0,08 моль) добавляли в атмосфере N2 к смеси -метилбензолацетонитрила (0,076 моль) в ДМФ (100 мл). Смесь перемешивали в течение 2,5 ч, а затем по каплям добавляли 2-бром-1,1 диметоксиэтан (0,1 моль) и реакционную смесь перемешивали в течение 3 ч. Смесь выливали на лед и экстрагировали ДХМ. Органический слой отделяли, промывали, сушили, фильтровали и растворитель выпаривали, в результате чего получали 15 г (90%) промежуточного соединения 4.b) Получение промежуточного соединения 5 Смесь промежуточного соединения 4 (0,022 моль) в муравьиной кислоте (25 мл) перемешивали в течение 10 мин при 50 С, а затем охлаждали. Реакционную смесь выливали на лед и экстрагировалиDIPE. Органический слой отделяли, промывали раствором Na2CO3 и водой, а затем сушили (MgSO4),фильтровали и растворитель выпаривали, в результате чего получали 3 г (79%) промежуточного соединения 5.-9 011021 с) Получение промежуточного соединения 6 Смесь промежуточного соединения 5 (0,017 моль), гидрохлорид трицикло [3.3.1.13,7]декан-2-амина(0,017 моль) и калиевой соли уксусной кислоты (3 г) в метаноле (50 мл) гидрировали в течение ночи в присутствии палладия на активированном угле (0,5 г), используемого в качестве катализатора, и раствора тиофена (0,5 мл). После израсходования водорода (1 экв.), катализатор отфильтровывали и фильтрат упаривали. Полученный остаток перемешивали в DIPE, фильтровали и фильтрат выпаривали, в результате чего получали 3,7 г (71%) промежуточного соединения 6.d) Получение промежуточного соединения 7 Смесь промежуточного соединения 6 (0,0094 моль) в серной кислоте (25 мл) перемешивали в течение ночи при комнатной температуре, и реакционную смесь выливали на лед, а затем смесь нейтрализовали раствором NaOH и экстрагировали EtOAc. Органический слой отделяли, промывали, сушили,фильтровали и фильтрат выпаривали, в результате чего получали 3,7 г промежуточного соединения 7. е) Получение промежуточного соединения 8 Смесь промежуточного соединения 7 (0,01 моль) в бромисто-водородной кислоте (48%) (50 мл) перемешивали и кипятили с обратным холодильником в течение 2 ч, а затем реакционную смесь охлаждали и фильтровали. Остаток на фильтре промывали водой и сушили, в результате чего получали 2,3 г(57%) промежуточного соединения 8. Пример А 4. а) Получение промежуточного соединения 9 Смесь N-(1-метилэтил)-2-пропанамина (0,016 моль) в ТТФ (15 мл) перемешивали в атмосфере N2 на льду с метанолом (-15 С), а затем по каплям добавляли раствор н-бутиллития, 2,5 М в гексане (0,016 моль) (-10 С), и полученную смесь перемешивали в течение 10 мин. Затем по каплям при -10 С добавляли этиловый эфир 1,4-диоксаспиро[4.5]декан-8-карбоновой кислоты (0,016 моль) в ТГФ (15 мл) и смесь перемешивали в течение 30 мин, после чего по каплям при -10 С, добавляли смесь (бромметил)бензола(0,016 моль) в ТГФ (15 мл). Реакционную смесь перемешивали в течение 1 ч, а затем перемешивали в течение ночи при комнатной температуре. Смесь выливали в насыщенный раствор NH4Cl и экстрагировали DIPE. Органический слой отделяли, промывали, сушили, отфильтровывали и растворитель выпаривали. Остаток очищали колоночной флеш-хроматографией. Фракции продукта собирали и растворитель выпаривали, в результате чего получали 2,2 г (46%) промежуточного соединения 9.b) Получение промежуточного соединения 10 Смесь промежуточного соединения 9 (0,0072 моль) в 2-пропаноне (50 мл) и в хлористо-водородной кислоте (2,5 н) (50 мл) перемешивали в течение ночи, а затем реакционную смесь выливали в ДХМ. Органический слой отделяли, промывали, сушили, фильтровали, растворитель выпаривали и получали 1,9 г промежуточного соединения 10. с) Получение промежуточного соединения 11 Смесь промежуточного соединения 10 (0,0073 моль), гидрохлорида трицикло[3.3.1.13,7]декан-2- 10011021 амина (0,009 моль) и калиевой соли уксусной кислоты (1 г) в этаноле (50 мл) гидрировали в течение ночи при 50 С в присутствии палладия на активированном угле (0,5 г), используемого в качестве катализатора, и раствора тиофена (0,5 мл). После израсходования водорода (1 экв.) катализатор отфильтровывали и фильтрат упаривали, в результате чего получали 2,9 г промежуточного соединения 11.d) Получение промежуточного соединения 12 Смесь промежуточного соединения 11 (0,0043 моль) и гидроксида калия (5 г) в этаноле (80 мл) и воде (20 мл) перемешивали и кипятили с обратным холодильником в течение 1 недели, а затем растворитель выпаривали. Остаток растворяли в воде и промывали ДХМ. Водный слой подкисляли HCl и экстрагировали ДХМ. Органический слой отделяли, сушили, фильтровали и растворитель выпаривали, в результате чего получали 0,774 г промежуточного соединения 12. Пример А 5. а) Получение промежуточного соединения 13[3.3.1.13,7]декан-1-ола (0,01 моль) в воде (50 мл) перемешивали при комнатной температуре. Затем добавляли концентрированную соляную кислоту (2 мл) и реакционную смесь перемешивали в течение ночи. Подкисленную смесь нейтрализовали водным раствором NaHCO3. Эту смесь экстрагировали ДХМ (3). Объединенные органические слои сушили, фильтровали и растворитель выпаривали, в результате чего получали 1,5 г промежуточного соединения 13.b) Получение промежуточного соединения 14: Смесь промежуточного соединения 13 (0,0064 моль) в метаноле (150 мл) перемешивали и гидрировали в течение ночи в присутствии палладия на активированном угле (10%) (0,5 г) в качестве катализатора. После израсходования водорода (1 экв.) катализатор отфильтровывали и фильтрат упаривали, в результате чего получали 1,2 г промежуточного соединения 14. В. Получение соединений Пример В 1. Получение соединения 1 В осушенной пламенем колбе Шленка 0,20 г (0,92 ммоль) промежуточного соединения 1 в 10 мл ТГФ охлаждали до -80 С. Затем шприцем вводили LDA (1,3 эквивалента, 0,59 мл, примерно 2 М коммерчески доступного раствора в ТГФ/гептане/этилбензоле) и полученную смесь перемешивали в течение 30 мин при -80 С. Затем вводили 2-фтор-3-метилбензилбромид (0,19 г, 0,96 ммоль) и реакционную смесь перемешивали в течение 1 ч при -80 С. Температуру медленно повышали до -50 С и смесь выдерживали в течение 4 ч. Реакцию гасили 2 н HCl, а затем смесь экстрагировали Et2O и органический слой промывали NaHCO3 (5% водным раствором), H2O и сушили Na2SO4. После выпаривания растворителя, неочищенный продукт хроматографировали (высота колонки h = 380 мм, 0 = 17 мм, 30 г силикагеля 230-400 меш, элюент: петролейный эфир/Et2O=1:1) и получали 0,22 г (71%) соединения 1 (бесцветные кристаллы). Пример В 2. Получение соединения 2 В осушенной пламенем колбе Шленка, 0,16 г (0,47 ммоль) соединения 1 в 10 мл ТГФ охлаждали до-80 С. Затем шприцем вводили LDA (1,3 эквивалента, 0,31 мл, примерно 2 М коммерчески доступного раствора в ТГФ/гептане/этилбензоле) и полученную смесь перемешивали в течение 1 ч при -80 С. Затем вводили метилиодид (0,09 г, 0,66 ммоль) и реакционную смесь перемешивали в течение 3 ч при -80 С. Затем смесь выдерживали в течение ночи при -20 С. Реакцию гасили 2 н HCl, а затем смесь экстрагировали Et2O и органический слой промывали NaHCO3 (5% водным раствором), H2O и сушили Na2SO4. По- 11011021 сле выпаривания растворителя, неочищенный продукт хроматографировали (высота колонки h = 460 мм,0 = 13 мм, 10 г силикагеля 230-400 меш, элюент: петролейный эфир/Et2O=1:1) и получали 0,90 г (53%) соединения 2, 0,012 г смешанной фракции и 0,016 г побочного продукта (Примечание: лучший выход может быть достигнут без выдерживания реакционной смеси в течение ночи при -20 С). В табл. 1 перечислены соединения, которые были получены в соответствии с процедурами, описанными в примерах, представленных выше. Таблица 1 Смесь промежуточного соединения (3) (0,00028 моль) и пентахлорида фосфора (0,1 г) в оксихлориде фосфора (1 мл) перемешивали при 100 С в течение 45 мин, а затем реакционную смесь охлаждали,выливали на лед, нейтрализовали раствором Na2CO3 и экстрагировали ДХМ. Органический слой фильтровали через фильтр Extrelut и растворитель выпаривали. Остаток очищали колоночной флешхроматографией во флеш-пробирках Triconex (элюент: ДХМ). Затем фракции продукта собирали и растворитель выпаривали с получением 0,051 г (54%) соединения 34. Пример В 4. Получение соединения 35 Смесь промежуточного соединения 8 (0,00024 моль) в тионилхлориде (2 мл) перемешивали и кипятили с обратным холодильником в течение 2 ч, а затем перемешивали в течение ночи при комнатной температуре. Растворитель выпаривали и остаток очищали колоночной флеш-хроматографией во флешпробирках Triconex (элюент: CH2Cl2/EtOAc, 95/5). Затем фракции продукта собирали и растворитель выпаривали с получением 0,0183 г (7,5%) соединения 35. Смесь промежуточного соединения 12 (0,00027 моль) и пентахлорида фосфора (0,1 г) в оксихлориде фосфора (1 мл) перемешивали в течение 1 ч при 100 С и после охлаждения реакционную смесь выливали на лед и экстрагировали дихлорметаном. Органический слой промывали раствором Na2CO3, сушили и фильтровали и растворитель выпаривали. Остаток очищали колоночной флеш-хроматографией во флеш-пробирках Triconex (элюент: CH2Cl2/EtOAc, 90/10). Затем фракции продукта собирали и растворитель выпаривали с получением 0,027 г соединения 36. Пример В 6. Получение соединения 37 Реакцию проводили в атмосфере N2. Смесь промежуточного соединения 14 (0,005 моль) в сухом ТГФ (25 мл) и 1,4-диоксане (10 мл) перемешивали при обработке ультразвуком до полного растворения. Смесь охлаждали до -78 С. После этого добавляли втор-бутиллитий (1,3 М/гексан) (0,013 моль), смесь перемешивали в течение 12 ч при -30 С, а затем охлаждали до -78 С. После этого по каплям добавляли(бромметил)бензол (0,01 моль) и реакционную смесь перемешивали в течение одного часа при -78 С, а затем - в течение ночи при комнатной температуре. Смесь выливали в насыщенный водный растворNH4Cl, а затем экстрагировали ДХМ. Отделенный органический слой сушили, фильтровали и растворитель выпаривали. Остаток очищали колоночной хроматографией на силикагеле (Biotage; элюент: ДХМ/CH3OH, 99/1). Фракции продукта собирали и растворитель выпаривали, в результате чего получали 0,8 г (50%) соединения 37. Пример В 7. Получение соединения 38 Реакцию проводили в атмосфере N2. Смесь промежуточного соединения 37 (0,0006 моль) в ТГФ (10 мл) перемешивали при -78 С. Затем добавляли втор-бутиллитий (1,3 М/гексан) (0,0026 моль) и смесь перемешивали в течение 2 ч при -78 С. После этого по каплям добавляли иодметан (0,0012 моль) при -78 С и полученную реакционную смесь перемешивали во время выходных дней, в течение которых температура от -78 С медленно повышалась до комнатной температуры. Смесь выливали в раствор NH4Cl (4 мл). Полученную смесь экстрагировали ДХМ. Отделенный органический слой сушили через фильтр Extrelut. Фильтрат выпаривали. Остаток очищали колоночной хроматографией на силикагеле (Supelco; элюент: ДХМ/СН 3 ОН, 99/2). Фракции продукта собирали, и растворитель выпаривали, в результате чего получали 0,153 г соединения 38. Пример В 8. Получение соединения 39 Реакцию проводили в атмосфере N2. Смесь промежуточного соединения 14 (0,005 моль) в ТГФ (50 мл) перемешивали при -78 С. Затем по каплям добавляли втор-бутиллитий (1,3 М/гексан (0,013 моль), и смесь перемешивали в течение 3 ч при -78 С. Затем, при -78 С, по каплям добавляли 1-(бромметил)-2 фтор-3-метилбензол (0,01 моль) и полученную реакционную смесь перемешивали в течение одного часа при -78 С, а затем перемешивали в течение ночи при комнатной температуре. Смесь выливали в насыщенный водный раствор NH4Cl. Полученную смесь экстрагировали ДХМ. Отделенный органический слой сушили, фильтровали и растворитель выпаривали. Остаток очищали колоночной хроматографией на силикагеле (Biotage; элюент: ДХМ/СН 3 ОН, 99/1). Фракции продукта собирали и растворитель выпаривали. Остаток (0,4 г) растворяли в ТГФ. Растворитель выпаривали и получали 0,4 г соединения 39. Пример В 9. Получение соединения 40 Смесь соединения 39 (0,0011 моль) в ТГФ (25 мл) перемешивали в атмосфере N2 при -78 С, а затем по каплям добавляли втор-бутиллитий (1,3 М/гексан) (0,0022 моль) и смесь перемешивали в течение 2 ч- 18011021 при -78 С, после чего по каплям добавляли иодметан (0,005 моль). Реакционную смесь перемешивали в течение 1 ч при -78 С, а затем в течение ночи при комнатной температуре. После этого по каплям добавляли насыщенный раствор NH4Cl (5 мл) и полученную смесь перемешивали в течение 10 мин, а затем экстрагировали ДХМ. Органический слой промывали, сушили, фильтровали и растворитель выпаривали. Остаток очищали колоночной хроматографией на силикагеле (элюент: ДХМ/СН 3 ОН, 98/2). Фракции продукта собирали и растворитель выпаривали. Остаток (0,242 г) растворяли в диэтиловом эфире, после чего растворитель выпаривали (в вакууме) при 80 С и получали 0,221 г соединения 40. С. Фармакологические примеры Пример С 1. Ферментативные анализы для оценки влияния соединений на 11-гидроксистероиддегидрогеназу типа 1 и типа 2. Влияние соединений на 11HSD1-зависимое превращение кортизона в кортизол (редуктазная активность) исследовали в реакционной смеси, содержащей 30 мМ буфера Трис-HCl, рН 7,2, 180 мкМNADPH, 1 мМ EDTA, 2 мкМ кортизона, 1 мкл лекарственного средства и/или растворителя и 11 мкг рекомбинантного белка в конечном объеме 100 мкл. Влияние соединений на 11HSD1-дегидрогеназную активность (превращение кортизола в кортизон) оценивали в реакционной смеси, содержащей 0,1 М натрийфосфатоного буфера, рН 9,0, 300 мкМNADP, 25 мкМ кортизола, 1 мкл лекарственного средства и/или растворителя и 3,5 мкг рекомбинантного белка в конечном объеме 100 мкл. Влияние соединений на 11-HSD2-зависимую дегидрогеназную активность исследовали в реакционной смеси, содержащей 0,1 М натрийфосфатоного буфера, рН 7,5, 300 мкМ NAD, 100 нМ кортизола (2 нМ которого было 3 Н-меченным), 1 мкл лекарственного средства и/или растворителя и 2,5 мкг рекомбинантного белка в конечном объеме 100 мкл. Все процедуры инкубирования проводили в течение 45 мин при 37 С в водяной бане. Реакцию прекращали добавлением 100 мкл ацетонитрила, содержащего 20 мкг кортикостерона в качестве внутреннего стандарта. После центрифугирования, образование продукта анализировали в супернатанте с помощью ВЭЖХ на колонке с Hypersyl BDS-C18 с использованием 0,05 мМ ацетата аммония/метанола(50/50) в качестве растворителя. Во всех вышеупомянутых анализах, тестируемые лекарственные средства были получены из маточного раствора и протестированы в конечной концентрации, составляющей от 10-5 М до 310-9 М. Исходя из построенных таким образом кривых "доза - ответ" вычисляли величинуpIС 50 и проводили оценку по следующей шкале: оценка 1 = величина pIC50 5, оценка 2 = величинаpIC50 составляет в пределах от 5 до 6, оценка 3 = величина pIC506. Некоторые из полученных таким образом результатов систематизированы в нижеследующей таблице (в этой таблице NT означает "не тестировали"). Пример С 2. Клеточные анализы для оценки влияния соединений на 11-гидроксистероиддегидрогеназу типа 1 и типа 2. Влияние соединений на 11HSD1-активность определяли в дифференцированных клетках 3T3-L1 и в крысиных гепатоцитах. Мышиные фибробласты 3T3-L1 (ATCC-CL-173) высевали при плотности 16500 клеток/мл в 12-луночные планшеты и культивировали в течение 7 дней в среде DMEM (в которую были добавлены 10% термоинактивированная фетальная телячья сыворотка, 2 мМ глутамина и 25 мг гентамицина) при 37 С в атмосфере 5% CO2 повышенной влажности. Среду заменяли свежей средой 2 раза в неделю. Фибробласты подвергали дифференцировке в адипоциты при 37 С в атмосфере 5% CO2 повышенной влажности в культуральной среде, содержащей 2 мкг/мл инсулина, 55 мкг/мл IBMX и 39,2 мкг/мл дексаметазона. Первичные гепатоциты, взятые у самцов крыс, высевали в многолуночные планшеты с матриксом BD-Biocoat Matrigel при плотности 250000 клеток/лунку и инкубировали в течение 10 дней при 37 С в атмосфере 5% CO2 повышенной влажности в смеси среды DMEM и среды Хэмса F12, содержащей 5% Nu-сыворотку, 100 мкг/мл пенициллина, 100 мкг/мл стрептомицина, 0,25 мкг/мл амфотерицина В, 50 мкг/мл сульфата гентамицина, 5 мкг/мл инсулина и 292 нг/мл дексаметазона. Среду заменяли свежей средой 3 раза в неделю. После 4-часового предварительного инкубирования с тестируемым соединением, в культуры добавляли 0,5 мкКи 3 Н-кортизона или дегидрокортикостерона. Еще через час среду экстрагировали на колонках Extrelut3 15 мл диэтилового эфира и экстракт анализировали с помощью ВЭЖХ, как описано выше. Влияние соединений на 11-HSD2-активность исследовали в клетках HepG2 и в клетках LCC-PK1. Клетки HepG2 (АТСС НВ-8065) высевали в 12-луночные планшеты при плотности 100000 клеток/мл и культивировали при 37 С в атмосфере 5% CO2 повышенной влажности в среде MEM-Rega-3 (в которую были добавлены 10% термоинактивированная фетальная телячья сыворотка, 2 мМ L-глутамина и бикарбоната натрия). Среду заменяли свежей средой 2 раза в неделю. Клетки почек свиньи (LCC-PK1, АТССCRL-1392) высевали при плотности 150000 клеток/мл в 12-луночные планшеты и культивировали при 37 С в атмосфере 5% CO2 повышенной влажности в среде 199, в которую были добавлены солевой раствор, модифицированный средой Эрла; 100 мкг/мл пенициллина; 100 мкг/мл стрептомицина; и 10% фетальная телячья сыворотка. Среду заменяли свежей средой 2 раза в неделю. За 24 ч до начала эксперимента, среду заменяли средой, содержащей фетальную телячью сыворотку, обработанную 10% углем.- 19011021 После 4-часового предварительного инкубирования с тестируемым соединением, в культуры добавляли 0,5 мкКи 3 Н-кортизола или кортикостерона. Еще через час среду экстрагировали на колонках Extrelut3 15 миллилитрами диэтилового эфира и экстракт анализировали с помощью ВЭЖХ, как описано выше. Как и в ферментативных анализах, тестируемые соединения были получены из маточного раствора и протестированы в конечной концентрации, составляющей от 10-5 М до 310-9 М. Исходя из построенных таким образом кривых "доза - ответ" вычисляли величину pIC50 и проводили оценку по следующей шкале: оценка 1 = величина pIC50 5, оценка 2 = величина pIC50 составляет в пределах от 5 до 6, оценка 3 = величина pIC506. Некоторые из полученных таким образом результатов систематизированы в нижеследующей табл.D. Примеры композиций Нижеследующие препараты представляют собой типичные фармацевтические композиции, подходящие для системного или местного введения животному и человеку в соответствии с настоящим изобретением. Используемый в этих примерах термин "активный ингредиент" (а.и.) означает соединение формулы (I) или его фармацевтически приемлемую аддитивную соль.- 20011021 Пример D.1. Таблетки, покрытые оболочкой Получение сердцевины таблеток Смесь активного ингредиента (а.и.) (100 г), лактозы (570 г) и крахмала (200 г) тщательно перемешивали, а затем смачивали раствором додецилсульфата натрия (5 г) и поливинилпирролидона (10 г) примерно в 200 мл воды. Влажную порошкообразную смесь просеивали, сушили и снова просеивали. Затем добавляли микрокристаллическую целлюлозу (100 г) и гидрогенизированное растительное масло(15 г). Всю смесь тщательно перемешивали и спрессовывали в таблетки, в результате чего получали 10000 таблеток, каждая их которых содержала 10 мг активного ингредиента. Покрытие К раствору метилцеллюлозы (10 г) в денатурированном этаноле (75 мл) добавляли раствор этилцеллюлозы (5 г) в CH2Cl2 (150 мл). Затем добавляли CH2Cl2 (75 мл) и 1,2,3-пропантриол (2,5 мл). После этого полиэтиленгликоль (10 г) расплавляли и растворяли в дихлорметане (75 мл). Полученный второй раствор добавляли к первому раствору, а затем добавляли октадеканоат магния (2,5 г), поливинилпирролидон (5 г) и концентрированную суспензию красителя (30 мл), и всю смесь гомогенизировали. Сердцевины таблеток покрывали полученной таким образом смесью в аппарате для нанесения покрытий. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение, имеющее формулу его N-оксидные формы, фармацевтически приемлемые аддитивные соли и стереохимически изомерные формы, гдеn равно 1 или 2; М представляет собой прямую связь или C1-3 алкильный линкер, необязательно замещенный одним или двумя заместителями, выбранными из С 1-4 алкила, C1-3 алкилокси-С 1-4 алкила, гидрокси-С 1-4 алкила,гидрокси, C1-3 алкилокси- или фенил-С 1-4 алкила; каждый из R1 и R2 независимо представляет собой водород, галоген, циано, гидрокси, С 1-4 алкил, необязательно замещенный галогеном, С 1-4 алкилокси, необязательно замещенный одним или, где возможно, двумя или тремя заместителями, выбранными из гидрокси, Ar1 и галогена;R4 представляет собой водород, галоген, С 1-4 алкил, гидрокси, циано или C1-4-алкилокси, необязательно замещенный одним или, где возможно, двумя или тремя заместителями, выбранными из гидрокси и галогена;R7 представляет собой водород, или R7 и R5, взятые вместе с атомом углерода, к которому они присоединены, образуют C2-алкильный линкер; каждый из Ar1 и Ar2 независимо представляет собой фенил или нафтил, где указанные фенил и нафтил необязательно замещены С 1-4 алкилом, С 1-4 алкилокси или фенил-С 1-4 алкилом. 2. Соединение, имеющее формулу его N-оксидные формы, фармацевтически приемлемые аддитивные соли и стереохимически изомерные формы, гдеn равно 1 или 2; М представляет собой C1-3 алкильный линкер, необязательно замещенный одним или двумя заместителями,выбранными из С 1-4 алкила, C1-3 алкилокси-С 1-4 алкила, гидрокси-С 1-4 алкила, гидрокси, C1-3 алкилокси или фенилС 1-4 алкила; каждый из R1 и R2 независимо представляет собой водород, галоген, циано, гидрокси, С 1-4 алкил, необязательно замещенный галогеном, С 1-4 алкилокси, необязательно замещенный одним или, где возможно, двумя или тремя заместителями, выбранными из гидрокси, Ar1 и галогена;R4 представляет собой водород, галоген, С 1-4 алкил, гидрокси, циано или С 1-4 алкилокси, необязательно замещенный одним или, где возможно, двумя или тремя заместителями, выбранными из гидрокси и галогена;R6 представляет собой водород, гидрокси, галоген, С 1-4 алкил или C1-4-алкилокси; каждый из Ar1 и Ar2 независимо представляет собой фенил или нафтил, где указанные фенил и нафтил необязательно замещены С 1-4 алкилом, С 1-4 алкилокси или фенил-С 1-4 алкилом. 3. Соединение по п.1 или 2, гдеn равно 1 или 2; М представляет собой C1-линкер, необязательно замещенный С 1-4 алкилом, гидрокси или гидроксиС 1-4 алкилом, в частности, М представляет собой C1-линкер;R1 представляет собой водород, гидрокси, циано, галоген, С 1-4 алкил, С 1-4 алкилокси, С 1-4 алкил, замещенный одним или, где возможно, двумя или тремя галогенами, или R1 представляет собой С 1-4 алкилокси, замещенный галогеном;R2 представляет собой водород, галоген, С 1-4 алкил или С 1-4 алкилокси, необязательно замещенный одним или, где возможно, двумя или тремя галогенами;R3 представляет собой водород, галоген, С 1-4 алкил, С 1-4 алкилокси или С 1-4 алкил, замещенный одним или, где возможно, двумя или тремя галогенами;R6 представляет собой водород или гидрокси, в частности, водород;R3 представляет собой водород или С 1-4 алкилокси, в частности, водород или метокси;R4 представляет собой водород или галоген;R5 представляет собой водород или С 1-4 алкил, в частности, водород или метил;R6 представляет собой водород или гидрокси. 5. Соединение по п.1, где указанное соединение выбрано из группы, состоящей из 3-[(3,5-диметоксифенил)метил]-1-трицикло[3.3.1.13,7]дек-2-ил-2-пирролидинона; 3-[(4-метилфенил)метил]-1-трицикло [3.3.1.13,7]дек-2-ил-2-пирролидинона; 3-[(2-фтор-3-метилфенил)метил]-3-метил-1-трицикло[3.3.1.13,7]дек-2-ил-2-пирролидинона; 3-[(3-метоксифенил)метил] -3-метил-1-трицикло[3.3.1.13,7]дек-2-ил-2-пирролидинона; 3-бензил-1-(5-гидрокситрицикло [3.3.1.13,7]дек-2-ил)пирролидин-2-она; 3-бензил-1-(5-гидрокситрицикло[3.3.1.13,7]дек-2-ил)-3-метилпирролидин-2-она; 3-(2-фтор-3-метилбензил)-1-(5-гидрокситрицикло[3.3.1.13,7]дек-2-ил)пирролидин-2-она; 3-(2-фтор-3-метилбензил)-1-(5-гидрокситрицикло[3.3.1.13,7]дек-2-ил)-3-метилпирролидин-2-она; их N-оксидов, фармацевтически приемлемых аддитивных солей или стереохимически изомерных форм. 6. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и в качестве активного ингредиента эффективное 11HSD1-ингибирующее количество соединения по любому из пп.1-5. 7. Способ получения фармацевтической композиции по п.6, отличающийся тем, что включает тщательное смешивание фармацевтически приемлемого носителя с эффективным 11HSD1-ингибирующим количеством соединения по любому из пп.1-5. 8. Применение соединения по любому из пп.1-5 для получения лекарственного средства для лечения патологий, ассоциированных с избыточным образованием кортизола, таких как, например, ожирение, диабет, ассоциированные с ожирением сердечно-сосудистые заболевания, деменция, нарушение познавательной способности, остеопороз и глаукома.
МПК / Метки
МПК: A61K 31/402, C07D 211/76, C07D 207/26
Метки: адамантилпирролидин-2-она, производные, ингибиторов, 11-бета-гидроксистероид-дегидрогеназы, качестве
Код ссылки
<a href="https://eas.patents.su/23-11021-proizvodnye-adamantilpirrolidin-2-ona-v-kachestve-ingibitorov-11-beta-gidroksisteroid-degidrogenazy.html" rel="bookmark" title="База патентов Евразийского Союза">Производные адамантилпирролидин-2-она в качестве ингибиторов 11-бета-гидроксистероид-дегидрогеназы</a>
Предыдущий патент: Антисептическое лекарственное средство
Следующий патент: Способ алкилирования с использованием катализатора, содержащего твердую кислоту и гидрирующий металл
Случайный патент: Адаптер видеокамеры изолирующий (варианты)