Производные мочевины и их применение в качестве ингибиторов инозин-5`-монофосфат- дегидрогеназы
Номер патента: 4771
Опубликовано: 26.08.2004
Авторы: Новак Перри М., Бетил Рэнди С., Армистед Дэвид М., Фрэнк Катарин А., Сондерс Джеффри О., Бадия Майкл К., Ронкин Стивен М., Бемис Гай В.
Формула / Реферат
1. Соединение общей формулы
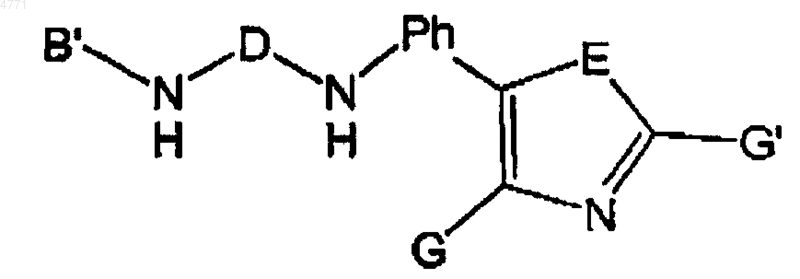
в которой
E обозначает O или S;
G и G' независимо выбраны из R1 или H;
Ph обозначает фенилен;
D выбирают из C(O), C(S) и S(O)2;
B' обозначает насыщенную, ненасыщенную или частично насыщенную моноциклическую или бициклическую кольцевую систему, возможно имеющую до 4 гетероатомов, выбираемых из N, O или S, которую выбирают из формул
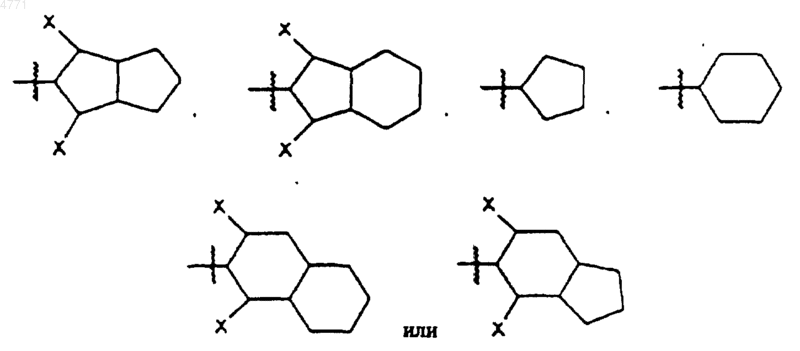
при этом каждый из Ph и B' может иметь до 3 заместителей, причем
первый из указанных заместителей, если он имеется, выбирают из R1, R2, R4 или R5,
второй из указанных заместителей, если он имеется, выбирают из R1 или R4 и
третьим из указанных заместителей, если он имеется, является R1;
причем каждый из R1 независимо выбирают из 1,2-метилендиокси, 1,2-этилендиокси, R6 или (CH2)n-Y; где n обозначает 0, 1 или 2 и Y выбирают из галогена, CN, NO2, CF3, OCF3, OH, SR6, S(O)R6, SO2R6, NH2, NHR6, N(R6)2, NR6R8, COOH, COOR6 или OR6;
каждый R2, независимо от других, выбирают из (C1-C4)алкила с прямой или разветвленной цепью или (C2-C4)алкенила или алкинила с прямой или разветвленной цепью, при этом каждый R2 может иметь до 2 заместителей, причем
первый из указанных заместителей, если он имеется, выбирают из R1, R4 и R5 и
вторым из указанных заместителей, если он имеется, является R1;
R3 выбирают из моноциклической или бициклической кольцевой системы с 5-6 членами в кольце, которая может иметь до 4 гетероатомов, выбираемых из N, O или S, и где группа CH2, смежная с любым из указанных гетероатомов N, O или S, может быть замещена C(O), при этом каждый R3 может иметь до 3 заместителей, причем
первый из указанных заместителей, если он имеется, выбирают из R1, R2, R4 или R5,
второй из указанных заместителей, если он имеется, выбирают из R1 или R4 и
третьим из указанных заместителей, если он имеется, является R1;
каждый R4, независимо от других, выбирают из OR5, OC(O)R6, OC(O)R5, OC(O)OR6, OC(O)OR5, OC(O)N(R6)2, OP(O)(OR6)2, SR6, SR5, S(O)R6, S(O)R5, SO2R6, SO2R5; SO2N(R6)2, SO2NR5R6, SO3R6, C(O)R5, C(O)OR5, C(O)R6, C(O)OR6, NC(O)C(O)R6, NC(O)C(O)R5, NC(O)C(O)OR6, NC(O)C(O)N(R6)2, C(O)N(R6)2, C(O)N(OR6)R6, C(O)N(OR6)R5, C(NOR6)R6, C(NOR6)R5, N(R6)2, NR6C(O)R1, NR6C(O)R6, NR6C(O)R5, NR6C(O)OR6, NR6C(O)OR5, NR6C(O)N(R6)2, NR6C(O)NR5R6, NR6SO2R6, NR6SO2R5, NR6SO2N(R6)2, NR6SO2NR5R6, N(OR6)R6, N(OR6)R5, P(O)(OR6)N(R6)2 и P(O)(OR6)2;
каждый R5 обозначает моноциклическую или бициклическую кольцевую систему с 5-6 членами в кольце, которая может иметь до 4 гетероатомов, выбираемых из N, O или S, и где группа CH2, смежная с указанными гетероатомами N, O или S, может быть замещена C(O), при этом каждый R5 может иметь до 3 заместителей, каждый из которых, если он имеется, является R1;
каждый R6 независимо от других выбирают из H, (C1-C4)алкила с прямой или разветвленной цепью или (C2-C4)алкенила с прямой или разветвленной цепью, при этом каждый R6 может иметь заместитель, который является R7;
R7 обозначает моноциклическую или бициклическую кольцевую систему с 5-6 членами в кольце, которая может иметь до 4 гетероатомов, выбираемых из N, O или S, и где группа CH2, смежная с указанными гетероатомами N, O или S, может быть замещена C(O), при этом каждый R7 может иметь до 2 заместителей, которые независимо друг от друга выбирают из H, (C1-C4)алкила с прямой или разветвленной цепью, (C2-C4)алкенила с прямой или разветвленной цепью, 1,2-метилендиокси, 1,2-этилендиокси или (CH2)n-Z,
где n равен 0, 1 или 2 и
Z выбирают из галогена, CN, NO2, CF3, OCF3, OH, S(C1-C4)алкила, SO(C1-C4)алкила, SO2(C1-C4)алкила, NH2, NH(C1-C4)алкила,N((C1-C4)алкила)2, N((C1-C4)алкила)R8, COOH, C(O)O(C1-C4)алкила или O(C1-C4)алкила; и
R8 обозначает аминозащитную группу; и
где любой атом углерода в любом R2 или R6 может быть заменен O, S, SO, SO2, NH или N(C1-C4)алкилом;
если Ph не имеет дополнительных заместителей, а все имеющиеся у B' указанные заместители являются R1, тогда по меньшей мере один из указанных заместителей R1 отличен от хлора, брома или иода; причем B и B' не могут одновременно обозначать незамещенный фенил.
2. Соединение по п.1, формулы
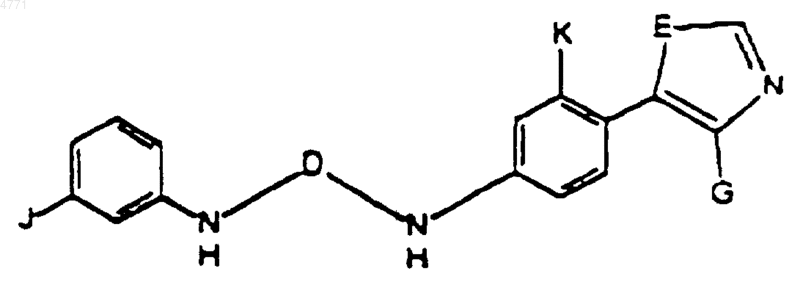
в которой
K выбирают из R1 и R4 и
J выбирают из R1, R2 и R4.
3. Соединение по п.2, в котором D обозначает -C(O)-.
4. Соединение по п.2, в котором E обозначает кислород.
5. Соединение по п.2, в котором J обозначает NR6C(O)R5 или NR6C(O)R6.
6. Соединение по п.5, в котором J обозначает NR6C(O)R6.
7. Соединение по п.6, в котором J обозначает N(CH3)C(O)R6.
8. Соединение по п.2, в котором K обозначает (CH2)n-Y.
9. Соединение по п.8, в котором K обозначает OCH3.
10. Соединение по п.2, в котором G обозначает водород.
11. Соединение по п.2, в котором
D обозначает -C(O)-;
E обозначает кислород;
K обозначает OCH3 и
G обозначает водород.
12. Соединение по п.2, в котором J обозначает R2.
13. Соединение по п.12, в котором E обозначает кислород.
14. Соединение по п.12, в котором J обозначает R2, замещенный R4.
15. Соединение по п.14, в котором R4 обозначает NR6C(O)OR5 или NR6C(O)OR6.
16. Соединение по п.12, в котором K обозначает (CH2)n-Y.
17. Соединение по п.16, в котором K обозначает OCH3.
18. Соединение по п.12, в котором D обозначает -C(O)-;
E обозначает кислород;
K обозначает OCH3 и
G обозначает водород.
19. Соединение по п.1, которое выбирают из группы, включающей соединеэшя 2-27, 29-31, 39-51, 53-69, 71-86, 88-89, 91-102 и 104-162, как показано ниже в табл. IB и IC:
Таблица IB
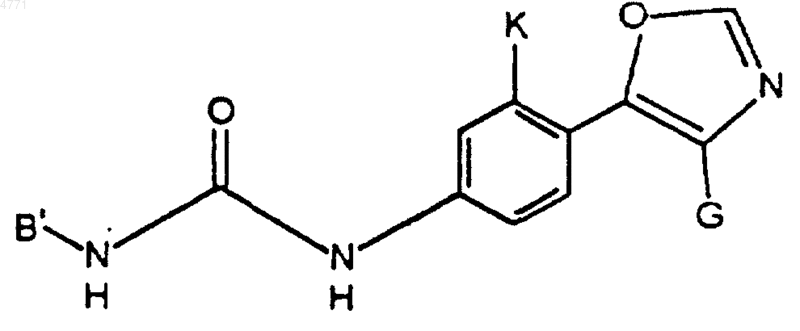
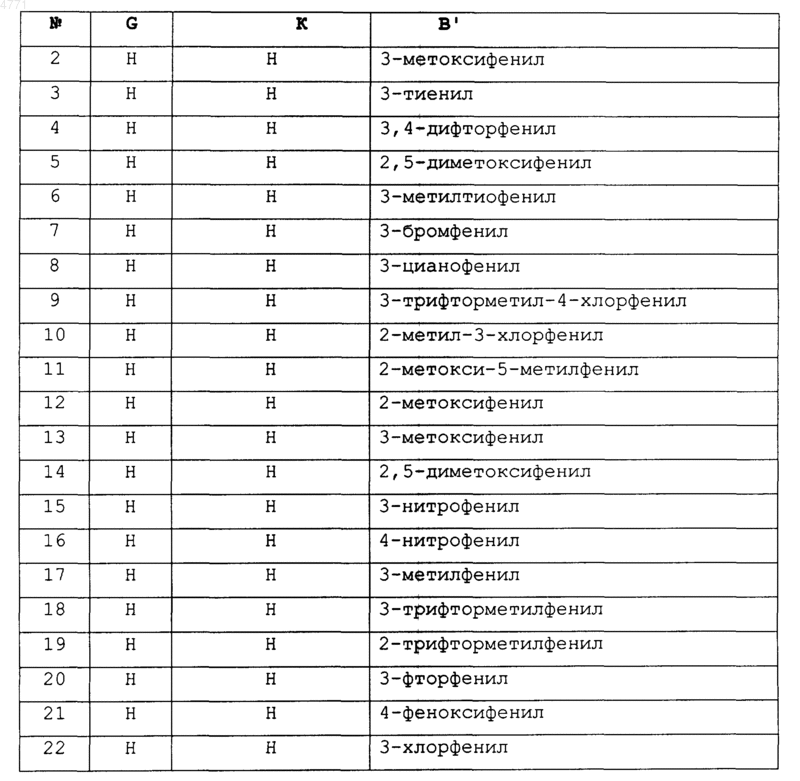
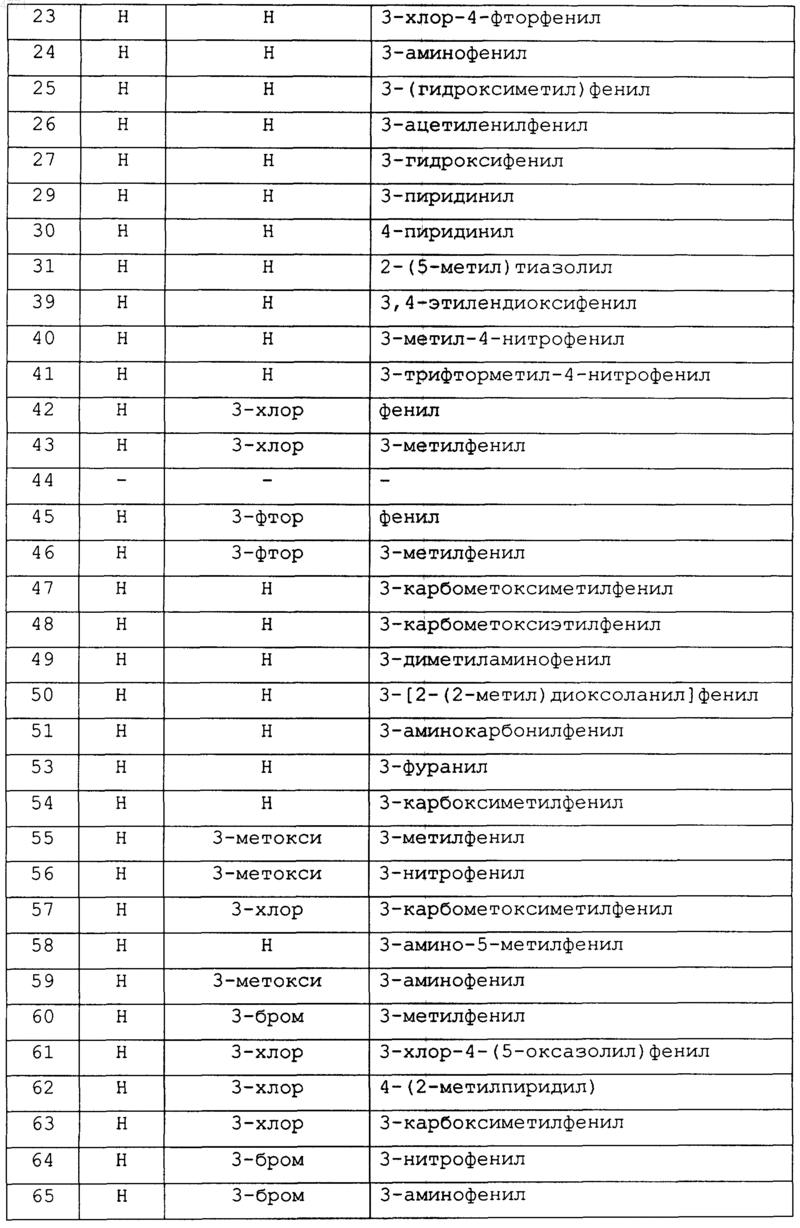
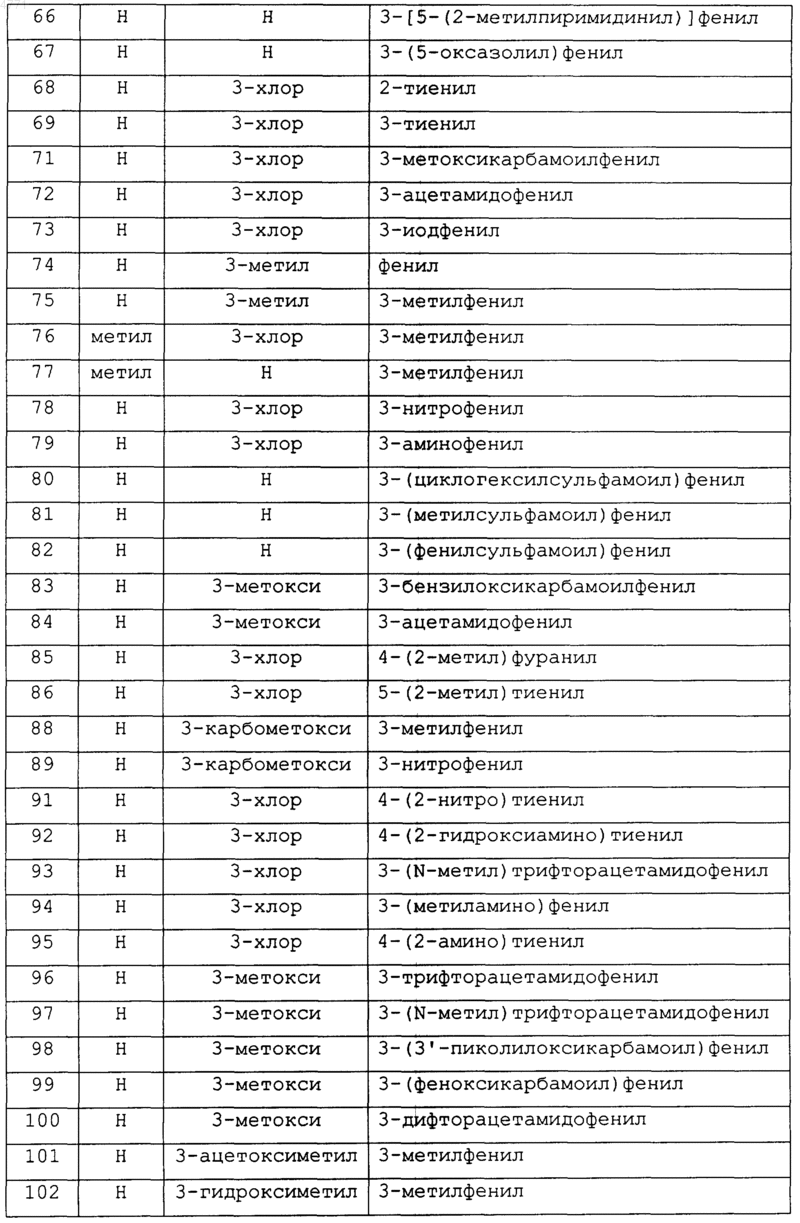
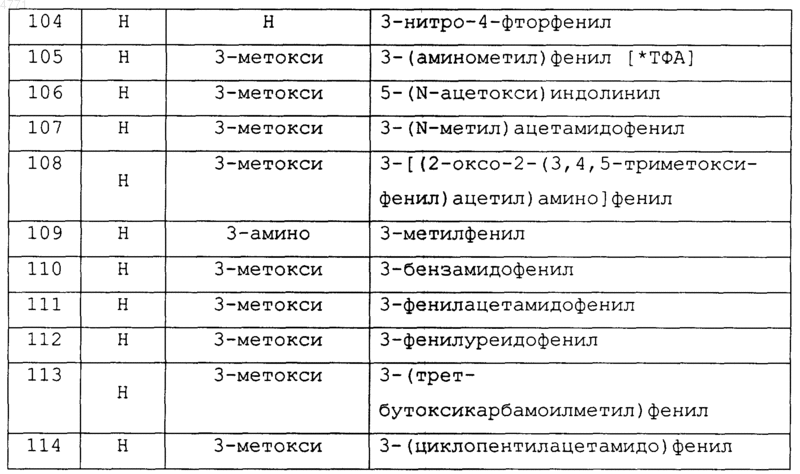
Таблица 1C
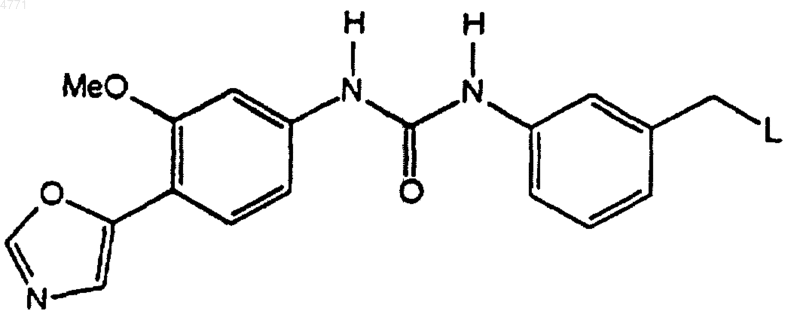


![]()
20. Фармацевтическая композиция, содержащая
a. соединение формулы
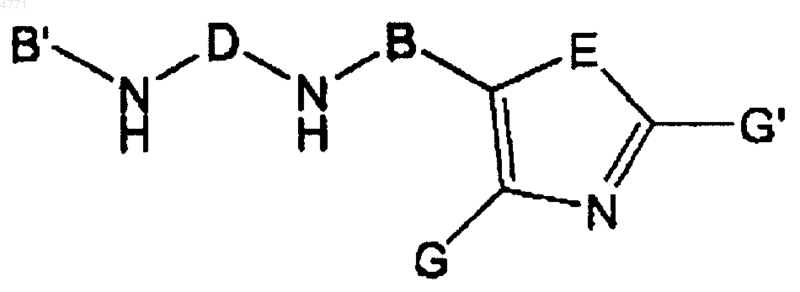
где B, B', G, G', D и E имеют значения, указанные в п.1, в количестве, эффективном для ингибирования активности IMPDH;
b. дополнительное лекарственное средство, которое выбирают из иммуносупрессоров, противораковых средств, антивирусных средств, противовоспалительных средств, противогрибковых средств, антибиотиков или средств, препятствующих гиперпролиферации сосудов;
c. фармацевтически приемлемый адъювант.
21. Композиция по п.20, в которой по крайней мере один B в указанном соединении имеет по крайней мере первый заместитель, представляющий собой R5.
22. Соединение по п.2, представленное формулой
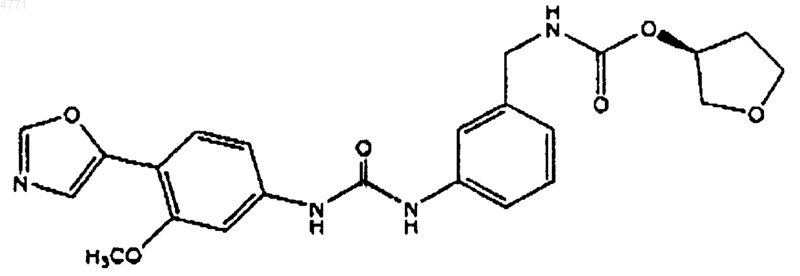
23. Фармацевтическая композиция, содержащая
a. соединение по любому из пп.1-19 в количестве, эффективном для ингибирования активности IMPDH; и
b. фармацевтически приемлемый адъювант.
24. Фармацевтическая композиция по п.23, дополнительно содержащая средство, которое выбирают из иммуносупрессоров, противораковых средств, антивирусных средств, противовоспалительных средств, противогрибковых средств, антибиотиков или средств, препятствующих гиперпролиферации сосудов.
25. Способ лечения или профилактики IMPDH-опосредованных заболеваний у млекопитающих, который включает стадию введения указанным млекопитающим композиции по п.20.
26. Способ лечения или профилактики IMPDH-опосредованных заболеваний у млекопитающих, который включает стадию введения указанным млекопитающим композиции по п.23.
27. Способ по п.26, где указанная композиция дополнительно содержит лекарственное средство, выбираемое из иммуносупрессоров, противораковых средств, антивирусных средств, противовоспалительных средств, противогрибковых средств, антибиотиков или средств, препятствующих гиперпролиферации сосудов.
28. Способ по любому из п.25-27, который применяют для подавления иммунной реакции и где указанное дополнительное лекарственное средство, если оно используется, является иммуносупрессором.
29. Способ по п.28, где указанное IMPDH-опосредованное заболевание является аутоиммунным заболеванием.
30. Способ по любому из пп.25-27, где IMPDH-опосредованное заболевание является вирусным заболеванием и указанное дополнительное лекарственное средство, если оно используется, является антивирусным средством.
31. Способ по любому из пп.25-27, где IMPDH-опосредованное заболевание является сосудистым заболеванием и указанное дополнительное лекарственное средство, если оно используется, является средством, препятствующим гиперпролиферации сосудов.
32. Способ по любому из пп.25-27, где IMPDH-опосредованное заболевание является раком и указанное дополнительное лекарственное средство, если оно используется, является противораковым средством.
33. Способ по любому из пп.25-27, где IMPDH-опосредованное заболевание является воспалительным заболеванием и указанное дополнительное лекарственное средство, если оно используется, является противовоспалительным средством.
Текст
1 Настоящее изобретение относится к новому классу соединений, которые ингибируют инозин-5'-монофосфатдегидрогеназу (IMPDH). Данное изобретение относится также к фармацевтическим композициям, содержащим эти соединения. Соединения и фармацевтические композиции по данному изобретению эффективно ингибируют активность ферментаIMPDH, поэтому их можно успешно использовать в качестве лекарственных средств для лечения болезней, опосредованных ферментомIMPDH. Настоящее изобретение относится также к способам ингибирования активностиIMPDH с помощью соединений по данному изобретений и родственных соединений. Предпосылки изобретения Синтез нуклеотидов в организме необходим для деления и репликации клеток. Синтез нуклеотидов у млекопитающих происходит в соответствии с одним из двух способов: синтезde novo и использование имеющихся нуклеотидов, причем для клеток разных типов эти способы характерны в разной степени. Инозим 5'-монофосфатдегидрогеназа(IMPDH; EC 1.1.1.205) является ферментом,который имеет непосредственное отношение к синтезу de novo гуанозиннуклеотидов.[Y.NatsumedaS.F.Carr, Ann. N.Y. Acad., 696,pp.88-93 (1993)]. Аминокислотные последовательности прокариотных форм на 30-40% идентичны ферменту человека. Независимо от вида этот фермент действует в соответствии с заданной последовательностью реакций по связыванию субстрата и кофактора и выделению продукта. Сначала IMP связывается с ферментомIMPDH, после чего происходит связывание кофактора NAD. Вслед за этим из продукта высвобождается восстановленный кофактор,NADH с последующим высвобождением продукта ХМР [S.F.Carr et al., J. Biol. Chem., 268,pp.27286-90 (1993); E.W.Holmes et al., Biochim.Biophys. Acta, 364, pp.209-217 (1974)]. Этот механизм отличается от механизма синтеза большинства других известных NAD-зависимых дегидрогеназ, которые или характеризуются произвольным порядком присоединения субстрата, или требуют связывания NAD перед связыванием субстрата. Идентифицированы и исследованы две изоформы IMPDH человека, которые известны как тип I и тип II [F.R.Collart and E.Huberman,J.Biol. Chem., 263, pp.15769-15772, (1988);Y.Natsumeda et al., J.Biol. Chem., 265, pp.52925295, (1990]. Каждая изоформа состоит из 514 аминокислот, последовательности которых идентичны на 84%. Как изоформа типа I, так и 2 изоформа типа II фермента IMPDH образуют активные тетрамеры в растворе с молекулярной массой субъединицы 56 кДа [Y.Yamada et al.,Biochemistry, 27, pp.2727-2745 (1988)]. Синтез de novo гуанозиннуклеотидов, а следовательно и активность фермента IMPDH имеют Особенно важное значение для В и Тлифтоцитов. Эти клетки в гораздо большей степени зависят от синтеза de novo, чем от использования имеющихся нуклеотидов для получения нуклеотидов в достаточном количестве для инициирования пролиферативной реакции на митоген или антиген [A.C. Allison et al., LancetIMPDH кажется весьма привлекательным с точки зрения избирательного ингирирования иммунной системы, не влекущего за собой подавления пролиферации других клеток. Иммуноподавление достигается путем ингибирования целого ряда ферментов, включая,например, кальцинеуринфосфатазу (ингибируется циклоспорином и FK-506); дигидрооротатдегидрогеназу, фермент, участвующий в биосинтезе пиримидинов (ингибируется лефлуномидом и бреквинаром); FRAP-киназу (ингибируется рапамицином); белок теплового шокаLung Transplantation, 12(6), pp.S275-S286(1993)]. Ингибиторы IMPDH также известны. В патентах США 5380879 и 5444072 и в публикациях РСТ WO 94/01105 и WO 94/12184 описывается микофенольная кислота (МРА),некоторые ее производные и их применение в качестве сильнодействующих, не имеющих аналогов, обратимых ингибиторов фермента(Ki=9 нМ) . Установлено, что микофенольная кислота блокирует реакцию В и Т-клеток на митоген или антиген [A.C. Allison et al., Ann. Иммуносупрессоры, такие как микофенольная кислота, являются эффективными лекарственными средствами, которые препятствуют отторжению трансплантата и позволяют лечить аутоиммунные нарушения. [R.E.Morris,Kidney Intl., 49, Suppl. 53, S-26, (1996)]. Однако микофенольная кислота обладает нежелательными фармакологическими свойствами, такими как желудочно-кишечная токсичность и плохая биологическая доступность. [L.M.Shaw, et al.,Therapeutic Drug Monitoring, 17, pp.690-699,(1995)].IMPDH [L.Hedstrom, et al., Biochemistry, 29,pp.849-854 (1990)]. Эти соединения, которые являются конкурентными ингибиторамиIMPDH, характеризуются недостаточной специфичностью в отношении этого фермента. Установлено, что микофенолят-мофетил,пролекарство, которое быстро высвобождает свободную микофенольную кислоту in vivo,предотвращает острое отторжение почечного аллотрансплантата после трансплантации почки. [L.M.Shaw, et al., Therapeutic Drug Monitoring, 17, pp.690-699, (1995); H.M.Sollinger, Transplantation, 60, pp.225-232, (1995)]. Однако некоторые клинические исследования указывают на ограниченный терапевтический потенциал этого лекарственного средства. [L.M. Shaw, et al.,Therapeutic Drug Monitoring, 17, pp.690-699,(1995)]. Микофенольная кислота быстро превращается в ходе обмена вещества in vivo в глюкуронид. [A.C. Allison and E.M. Euqui, Immunological Reviews, 136, pp.5-28 (1993)]. Затем происходит рециркуляция этого глюкуронида в печени, вызывающая накопление микофенольной кислоты в желудочно-кишечном тракте, где она не способна оказывать ингибирующее действие на иммунную систему. Это значительно ослабляет действие этого лекарственного средства in vivo и в то же время увеличивает нежелательные желудочно-кишечные побочные эффекты. Кроме того, известно, что фермент IMPDH участвует в других обменных процессах. Повышенная активность IMPDH проявляется в быстрой пролиферации линии лейкозных клеток и других линий опухолевых клеток, что указывает на необходимость воздействия на IMPDH в процессе противораковой и иммуносуппрессивной химиотерапии [M.Nagai et al., CancerRes., 51, pp.3886-3890, (1991)]. Как известно,IMPDH принимает участие в пролиферации клеток гладких мышц, из чего следует, что ингибиторы IMPDH, такие как микофенольная кислота или рапамицин, могут эффективно препятствовать возникновению рестеноза или других гиперпролиферативных сосудистых заболеваний [C.R. Gregory et al., Transplantation, 59,pp.655-61 (1995); публикация PCT WO 94/12184 и публикация РСТ WO 94/01105]. Помимо этого, фермент IMPDH участвует в репликации вирусов некоторых линий вирусных клеток. [S.F.Carr, J.Biol. Chem., 268,pp.27286-27290 (1993)]. Аналогично линиям лимфоцитов и опухолевых клеток в процессе репликации вирусов гораздо важнее синтез denovo, чем использование имеющихся нуклеотидов. В настоящее время исследована возможность использования такого ингибитора IMPDH,как рибавирин, для лечения инфекционных заболеваний, вызываемых вирусом гепатита-С(HCV) и вирусом гепатита-В (HBV). Рибавирин усиливает продолжительное действие интерферона при лечении болезней, вызываемых вирусами HBV и HCV. Однако лечебный потенциал рибавирина ограничен недостаточно продолжительным действием в процессе монотерапии и высокой клеточной токсичностью. Таким образом, существует необходимость в сильнодействующих ингибиторах IMPDH с улучшенными фармакологическими свойствами. Такие ингибиторы должны обладать высоким лечебным потенциалом в качестве иммуносупрессоров, противораковых средств, лекарственных средств, препятствующих гиперпролиферации клеток сосудов, противовоспалительных средств, противогрибковых средств, антипсориатичфских и антивирусных средств. Краткое изложение существа изобретения Настоящее изобретение относится к соединениям и их фармацевтически приемлемым производным, которые являются эффективными ингибиторами IMPDH. Эти соединения можно использовать отдельно или в сочетании с другими терапевтическими или профилактическими средствами, такими как антивирусные средства, противовоспалительные средства, антибиотики и иммуносупрессоры, для лечения или профилактики отторжения трансплантата и аутоиммунных нарушений. Кроме того, эти соединения, используемые отдельно или в сочетании с другими лекарственными средствами, являются эффективными терапевтическими и профилактическими антивирусными, противоопухолевыми, противораковыми и противовоспалительными средствами, противогрибковыми средствами и средствами для антипсориатической иммунопрессивной химиотерапии и лечения рестеноза. Настоящее изобретение относится также к фармацевтическим композициям, содержащим соединения по данному изобретению, а также к многокомпонентным композициям, содержащим наряду с иммуносупрессором дополнительные соединения, ингибирующие IMPDH. Объектом настоящего изобретения являются методы применения соединений по данному изобретению, а также других родственных соединений для ингибирования IMPDH. Соединения по настоящему изобретению,а также соединения, используемые при осуществлении методов по данному изобретению,характеризуются другими особенностями обмена веществ по сравнению с микофенольной кислотой и ее производными. Благодаря этим отличиям способы по настоящему изобретению и соединения, используемые при их осуществлении, обладают преимуществами в качестве лекарственных средств для лечения IMPDHопосредованных болезней. К таким преимуществам относятся общее благоприятное лечебное воздействие и уменьшение вредных побочных эффектов. 5 Подробное описание изобретения Приводимое ниже подробное описание изобретения дает более глубокое понимание этого изобретения. В этом описании изобретения используются следующие аббревиатуры: Обозначение: Реагент или фрагмент: Ас ацетилTHF тетрагидрофуран В описании изобретения использованы следующие термины. За исключением особо оговоренных случаев термины "-SO2-" и "S(O)2-" означают сульфон или производное сульфона (то есть боковые группы, присоединенные к S), а не сложный эфир сульфиновой кислоты. Термин "галоген" означает радикал фтора,хлора, брома или иода. Термин "иммуносупрессор" означает соединение или лекарственное средство, которое подавляет иммунную реакцию. Примерами таких средств являются циклоспорин A, FK506,рапамицин, лефлуномид, деоксиспергуалин,преднизон, азатиоприн, микофенолятмофетил,ОКТЗ, ATAG, интерферон и мизорибин. Термин "интерферон" означает все формы интерферонов, включая альфа-, бета- и гаммаформы, но не ограничивается ими.IMPDH-опосредованными заболеваниями являются любые болезни, в процессе которых фермент IMPDH регулирует метаболический путь. Примерами IMPDH-опосредованных заболеваний являются отторжение трансплантата и аутоиммунные нарушения, такие как ревматоидный артрит, рассеянный склероз, юношеский диабет, астма, воспаление кишечника, воспалительные заболевания, рак, вирусные и сосудистые заболевания. Соединения, композиции и методы их применения по данному изобретению, например, можно использовать для лечения отторжения трансплантата (например, почки, печени,сердца, легкого, поджелудочной железы (инсулоциты), костного мозга, роговицы, аллотрансплантатов тонкой кишки и кожи, а также ксенотрансплантатов клапанов сердца) и аутоиммунных нарушений, таких как ревматоидный артрит, рассеянный склероз, юношеский диабет,астма, воспаление кишечника (болезнь Крона,неспецифический язвенный колит), волчанка,диабет, миастения, псориаз, дерматит, экзема, 004771 6 себорея, воспаление легких, увеит, гепатит, базедова болезнь, тиреоидит, синдром Бехчета или Шегрена (сухость глаз и рта), пернициозная или иммуногемолитическая анемия, идиопатическая недостаточность надпочечников, плюригландулярный аутоиммунный синдром, гломерулонефрит, склеродермия, красный плоский лишай,витилиго (депигментация кожи), аутоиммунный тиреоидит, альвеолит; воспалительных заболеваний, таких как остеоартрит, острый панкреатит, хронический панкреатит, астма и респираторный дистресс-синдром взрослых, а также для лечения злокачественных и доброкачественных опухолей, таких как твердые опухоли, лимфомы и лейкоз; сосудистых заболеваний, таких как рестеноз, стеноз и артериосклероз; и заболеваний, связанных с репликацией ДНК и РНК вирусов, таких как ретровирусные заболевания и герпес. Кроме того, известно, что ферментыIMPDH присутствуют в бактериях и могут регулировать их рост. В связи с этим соединения и композиции,являющиеся ингибиторамиIMPDH, а также методы их применения могут быть полезны для лечения или профилактики бактериальных инфекций при использовании отдельно или в сочетании с другими антибиотиками. Термин "лечение" означает снятие симптомов определенного заболевания у нуждающегося субъекта или улучшение состояния, вызываемого определенным заболеванием. Термин"нуждающийся субъект" означает любого млекопитающего, включая человека. Термин "тиокарбаматы" означает соединения, содержащие функциональную группу NSO2-O. Термины "HBV", "HCV" и "HGV" означают соответственно вирус гепатита-В, вирус гепатита-С и вирус гепатита-G. В соответствии с одним вариантом осуществления данное изобретение предусматривает методы подавления активности IMPDH у млекопитающих, которые включают стадию введения указанному млекопитающему соединения формулы I. В соответствии с основным аспектом данного изобретения, предлагается соединение, подавляющее IMPDH активность у млекопитающих, общей формулы:G и G' независимо выбраны из R1 или Н;D выбирают из С (О), C(S) и S(О)2; В' обозначает насыщенную, ненасыщенную или частично насыщенную моноциклическую или бициклическую кольцевую систему,возможно имеющую до 4 гетероатомов, выби 7 раемых из N, О или S, которую выбирают из формул при этом каждый из Ph и В' может иметь до 3 заместителей, причем первый из указанных заместителей, если он имеется, выбирают из R1, R2, R4 или R5,второй из указанных заместителей, если он имеется, выбирают из R1 или R4, и третий из указанных заместителей, если он имеется, является R1; причем каждый из R1 независимо выбирают из 1,2-метилендиокси, 1,2-этилендиокси, R6 или (СН 2)n-Y; где n обозначает 0, 1 или 2 и Y выбирают из галогена, CN, NO2, CF3, OCF3, ОН,SR6, S(O)R6, SO2R6, NH2, NHR6, N(R6)2, NR6R8,COOH, COOR6 или OR6; каждый R2, независимо от других выбирают из (С 1-С 4)алкила с прямой или разветвленной цепью или (С 2-С 4)алкенила или алкинила с прямой или разветвленной цепью, при этом каждыйR2 может иметь до 2 заместителей, причем первый из указанных заместителей, если он имеется, выбирают из R1, R4 и R5 и второй из указанных заместителей, если он имеется, является R1;R3 выбирают из моноциклической или бициклической кольцевой системы с 5-6 членами в кольце, которая может иметь до 4 гетероатомов,выбираемых из N, О или S, и где группа СН 2,смежная с любым из указанных гетероатомов N, О или S, может быть замещена С(О), при этом каждый R3 может иметь до 3 заместителей,причем первый из указанных заместителей, если он имеется, выбирают из R1, R2, R4 или R5,второй из указанных заместителей, если он имеется, выбирают из R1 или R4, и третий из указанных заместителей, если он имеется, является R1; каждый R4 независимо от других выбирают из OR5, OC(O)R6, OC(O)R5, ОС(О)OR6,ОС(О)OR5, OC(O)N(R6)2, OP(O)(OR6)2, SR6, SR5,S(O)R6, S(O)R5, SO2R6, SO2R5; SO2N(R6)2,SO2NR5R6, SO3R6, C(O)R5, C(O)OR5, C(O)R6,C(O)OR6, NC(O)C(O)R6, NC(O)C(O)R5, NC(О)СN(OR )R , P(O)(OR )N(R )2 и P(O)(OR )2; каждый R5 обозначает моноциклическую или бициклическую кольцевую систему с 5-6 членами в кольце, которая может иметь до 4 8 гетероатомов, выбираемых из N, О или S, и где группа СН 2, смежная с указанными гетероатомами N, О или S, может быть замещена С(О),при этом каждый R5 может иметь до 3 заместителей, каждый из которых, если он имеется, является R1; каждый R6 независимо от других выбирают из Н, (С 1-С 4) алкила с прямой или разветвленной цепью или (C2-C4)алкенила с прямой или разветвленной цепью, при этом каждый R6 может иметь заместитель, который является R7;R7 обозначает моноциклическую или бициклическую кольцевую систему с 5-6 членами в кольце, которая может иметь до 4 гетероатомов, выбираемых из N, О или S, и где группа СН 2, смежная с указанными гетероатомами N, О или S, может быть замещена С(О), при этом каждый R7 может иметь до 2 заместителей, которые независимо друг от друга выбирают из Н,(C1-C4)алкила с прямой или разветвленной цепью, (С 2-С 4)алкенила с прямой или разветвленной цепью, 1,2-метилендиокси, 1,2-этилендиокси или (CH2)n-Z, где n равен 0, 1 или 2 иR8 обозначает аминозащитную группу; и где любой атом углерода в любом R2 или 6R может быть заменен О, S, SO, SO2, NH илиN(C1-C4)алкилом; если Ph не имеет дополнительных заместителей, а все имеющиеся у В' указанные заместители, являются R1, тогда по меньшей мере один из указанных заместителей R1 отличен от хлора,брома или иода; причем В и В' не могут одновременно обозначать незамещенный фенил. Из указанной группы предпочтительны соединения, формулыD обозначает -С(О)-,Е обозначает кислород,G обозначает водород,Особенно предпочтительны соединения включающие соединения 2-27, 29-31, 39-51, 5369, 71-86, 88-89, 91-102 и 104-162, показанные ниже в табл. IB и IС: Таблица IB 12 циональная группа присоединена к приемлемой химической группе (защитная группа). Примеры приемлемых аминозащитных групп и других защитных групп приведены в книгах(1995), и указаны в примерах конкретных соединений, используемых в этом изобретении. Еще одним аспектом изобретения является фармацевтическая композиция, содержащая: а. соединение формулы: Термин "замещенный" означает замену одного или нескольких водородных радикалов в данной формуле радикалом, выбираемым из указанной группы. В тех случаях, когда несколько водородных радикалов могут быть заменены заместителем, выбираемым из одной и той же указанной группы, указанные заместители могут быть одинаковыми или разными в любом положении. Термин "моноциклическая или бициклическая кольцевая система с 5-6 членами в кольце" означает 5- или 6-членные моноциклические кольца и 8, 9- и 10-членные бициклические кольцевые структуры, в которых каждая связь в кольце может иметь любую степень насыщенности, то есть является химически конденсируемой. При наличии заместителей в таких структурах эти заместители могут находиться в любом положении кольцевой системы, за исключением особо оговоренных случаев. Как указано, такие кольцевые системы могут иметь до 4 гетероатомов, выбираемых из N,O или S. Эти гетероатомы могут заменять любые атомы углерода в этих кольцевых системах до тех пор, пока полученное соединение остается химически стабильным. Термин "где каждый X обозначает количество атомов водорода, необходимых для достижения нужной валентности" означает, что X может обозначать 0, 1 или 2 атома водорода, в зависимости от атома в кольце, к которому присоединен X (С, N, О или S), значения двух смежных атомов в кольце и характера связей между атомом в кольце, к которому присоединен X, и двумя смежными атомами в кольце(простая, двойная или тройная связь). Как правило, это определение исключает из значений X все заместители, не являющиеся водородом. Термин "аминозащитная группа" означает приемлемую химическую группу, которая может быть присоединена к атому азота. Термин"защищенный" означает, что указанная функ где В, В', G, G', D и Е имеют значения, указанные в п.1, в количестве, эффективном для ингибир'ования активности IMPDH;c. фармацевтически приемлемый адъювант. В предпочтительном варианте указанная композиция включает соединение в котором по крайней мере один В имеет по крайней мере первый заместитель, представляющий собой R5,особенно предпочтительно соединение представленное формулой: Следующим аспектом изобретения является фармацевтическая композиция, содержащая:a. соединение по изобретению в количестве, эффективном для ингибирования активностиb. фармацевтически приемлемый адъювант и необязательно дополнительно содержащая средство, которое выбирают из иммуносупрессоров, противораковых средств, антивирусных средств, противовоспалительных средств, противогрибковых средств, антибиотиков или средств, препятствующих гиперпролиферации сосудов. Следующим аспектом изобретения является способ лечения или профилактики IMPDHопосредованных заболеваний у млекопитающих, который включает стадию введения млекопитающим композиции по изобретению. Способ лечения или профилактикиIMPDH-опосредованных заболеваний у млекопитающих, который включает стадию введения млекопитающим композиции по изобретению, 13 может быть применен для подавления иммунной реакции, причем дополнительное лекарственное средство, если оно используется, является иммуносупрессором. Вариантами применения указанного способа являются лечение IMPDH-опосредованного заболевания которое является аутоиммунным заболеванием, причем дополнительное лекарственное средство, если оно используется,является иммуносупрессором; вирусным заболеванием, причем указанное дополнительное лекарственное средство, если оно используется,является антивирусным средством; сосудистым заболеванием, причем указанное дополнительное лекарственное средство, если оно используется, является средством, препятствующим гиперпролиферации сосудов; раком, причем указанное дополнительное лекарственное средство,если оно используется, является противораковым средством; воспалительным заболеванием,причем указанное дополнительное лекарственное средство, если оно используется, является противовоспалительным средством. Соединения по данному изобретению могут иметь один или несколько асимметричных атомов углерода, образуя рацематы и рацемические смеси, отдельные энантиомеры, смеси диастереомеров и отдельные диастереомеры. Все изомерные формы этих соединений входят в объем настоящего изобретения. Каждый стереогенный атом углерода может иметь R или Sконфигурацию. В объем настоящего изобретения входят только такие сочетания заместителей и переменных элементов, которые позволяют получить стабильные соединения. Термин "стабильный" относится к соединениям, которые обладают достаточной стабильностью, необходимой для изготовления лекарственных средств, и сохраняют целостность в течение длительного периода времени в соответствии с описанными здесь целями данного изобретения (например,лечебное или профилактическое введение млекопитающему или применение в афинной хроматографии). Такие соединения обычно сохраняют стабильность при температуре 40 С или ниже при отсутствии влаги или в других химически активных условиях в течение по крайней мере одной недели. К соединениям по данному изобретению, в том числе к соединениям формул I-IX, относятся их фармацевтически приемлемые производные или пролекарства. "Фармацевтически приемлемое производное или пролекарство" означает любую фармацевтически приемлемую соль, сложный эфир, соль сложного эфира или другое производное соединение по данному изобретению, которое при введении реципиенту дает (прямо или косвенно) соединение по настоящему изобретению. Особенно предпочтительными производными и пролекарствами являются те, которые увеличивают биологиче 004771 14 скую доступность соединений по данному изобретению при их введении млекопитающему(например, облегчая всасывание в кровь перорально вводимых соединений) или усиливают поступление исходного соединения в биологические системы (например, в мозг или лимфатическую систему) по сравнению с исходными видами. Предпочтительными пролекарствами являются производные, у которых к соединениям формул I-IХ присоединена группа, увеличивающая растворимость в воде или активный перенос через стенки кишечника. Фармацевтически приемлемые соли соединений по данному изобретению получают из фармацевтически приемлемых неорганических или органических кислот и оснований. Примерами приемлемых кислых солей являются ацетат, адипат, альгинат, аспартат, бензоат, бензолсульфонат, бисульфат, бутират, цитрат, камфорат, камфорсульфонат, циклопентанпропионат,диглюконат, додецилсульфат, этансульфонат,формиат, фумарат, глюкогептаноат, глицерофосфат, гликолят, гемисульфат, гептаноат, гекса-ноат, гидрохлорид, гидробромид, гидроиодид, 2-гидроксиэтансульфонат, лактат, малеат,малонат, метансульфонат, 2-нафталинсульфонат, никотинат, нитрат, оксалат, пальмоат, пектинат, персульфат, 3-фенилпропионат, фосфат,пикрат, пивалат, пропионат, салицилат, сукцинат, сульфат, тартрат, тиоцианат, тозилат и ундеканоат. Для получения соединений по настоящему изобретению и их фармацевтически приемлемых солей присоединения кислоты можно использовать соли, получаемые из других кислот, таких как щавелевая кислота, которые полезны в качестве промежуточных соединений, хотя сами по себе не являются фармацевтически приемлемыми. Солями, получаемыми из приемлемых оснований, являются соли щелочных металловN-(C1-4 алкильного)4+ соединения. Настоящее изобретение предусматривает также кватернизацию любых основных азотсодержащих групп рассматриваемых здесь соединений. Посредством кватернизации можно получить водорастворимые, маслорастворимые или диспергируемые продукты. Соединения по данному изобретению можно синтезировать известными методами. Эти соединения синтезируют из легко получаемых исходных веществ. Соединения формул (I)-(IХ), как правило,получают с помощью методов, проиллюстрированных на общих схемах синтеза 1-3. В соответствии с общей схемой синтеза 1(см. ниже) X-замещенный анилин подвергают взаимодействию с Y-замещенным фенилизоцианатом в стандартных условиях, что дает требуемую мочевину. X и Y могут обозначать один или несколько независимых заместителей (или 15 их должным образом защищенных вариантов),которые показаны как заместители в кольце,приведенные выше для соединений формул IIX, в любом положении ароматического кольца. Общая схема синтеза 1 Общая схема синтеза 2 Общая схема синтеза 3 В соответствии с общей схемой синтеза 2(см. выше) замещенный бензальдегид (в данном случае 2-метокси-4-нитрозамещенный бензальдегид) обрабатывают тозилметилизоцианидом с получением оксазола, который восстанавливают каталитической гидрогенизацией с получением требуемого аналина. Взаимодействие указанного анилина с изоцианатом (в данном случае с мета-толилизоцианатом) в стандартных условиях дает требуемую мочевину. Альтернативный метод синтеза изображен на общей схеме синтеза 3 (см. выше). Замещенный бензальдегид (в данном случае 4 нитрозамещенный бензальдегид) превращают в соответствующий оксазолиланилин, как это показано на общей схеме синтеза 2. Указанный анилин обрабатывают замещенной бензойной кислотой (в данном случае 3 метилзамещенной бензойной кислотой) и активатором карбоновой кислоты, таким как дифенилфосфорилазид, в стандартных условиях реакции, что дает требуемую мочевину. Специалистам в этой области должно быть понятно, что приведенные выше схемы синтеза не охватывают все возможные методы синтеза соединений, рассмотренных в данном описании изобретения и определенных в формуле изобретения. Вполне очевидно, что существуют другие методы синтеза этих соединений. Кроме того,описанные выше стадии синтеза могут быть 16 выполнены в другой последовательности или порядке, что тем не менее позволяет получить требуемые соединения. Соединения по данному изобретению могут быть изменены путем присоединения соответствующих функциональных групп с целью усиления отдельных биологических свойств. Такие модификации хорошо известны и включают изменения, позволяющие увеличить биологическое проникновение в какую-либо биологическую систему (например, кровь, лимфатическую систему, центральную нервную систему), доступность при пероральном введении,растворимость при введении этих соединений в виде инъекций и изменить обмен веществ и скорость экскреции. Новые соединения по настоящему изобретению являются великолепными лигандами дляIMPDH, поэтому они способны обнаруживать и ингибировать указанный фермент. Степень ингибирова-ния можно измерить различными методами, в том числе, например, посредством жидкостной хроматографии высокого давления инозин-5'-монофосфатдегидрогеназы(путем измерения выработки ферментом ксантозин-5'монофосфата (ХМР) и восстановленного никотинамидадениндинуклеотида (NADH) из инозин-5'-монофосфата (IMP) и никотинамидадениндинуклеотида (NAD и спектрофотометрических анализов инозин-5'-монофосфатдегидрогеназы (путем измерения выработки ферментом восстановленного никотинамидаденин-динуклеотида (NADH) из никотинамидаденин-динуклеотида (NAD. [ cм. C.Montero etal., Clinica Chimica Acta, 238, pp.169-178 (1995)]. Фармацевтические композиции по данному изобретению содержат соединения формул(I), (II) или (VII) либо их фармацевтически приемлемые соли; дополнительные лекарственные средства, выбираемые из иммуносупрессоров,противораковых, антивирусных, противовоспалительных и противогрибковых средств, антибиотиков или средств, препятствующих гиперпролиферации сосудов; и фармацевтически приемлемые носители, наполнители или разбавители. Другие композиции по данному изобретению содержат соединения формул (III)-(IX) или их фармацевтически приемлемые соли и фармацевтически приемлемые носители, наполнители или разбавители. Такие композиции могут также содержать дополнительные лекарственные средства, выбираемые из иммуносупрессоров, противораковых, антивирусных,противовоспалительных и противогрибковых средств, антибиотиков или средств, препятствующих гиперпролиферации сосудов. Термин "фармацевтически приемлемый носитель или наполнитель" означает носитель или наполнитель, который можно вводить нуждающемуся субъекту вместе с соединением по данному изобретению, при этом он не нарушает фармакологическое действие указанного соеди 17 нения и являемся нетоксичным при введении в дозах, достаточных для достижения лечебного эффекта данного соединения. Фармацевтически приемлемыми носителями, наполнителями и разбавителями, которые можно использовать в фармацевтических композициях по данному изобретению, являются,но не ограничиваются ими, ионообменники,оксид алюминия, стеарат алюминия, лецитин,самоэмульгируемые системы доставки лекарственного вещества к участку действия (SEDDS),такие как сукцинат d-токоферолполиэтиленгликоль 1000, поверхностно-активные вещества,используемые в фармацевтических лекарственных формах, такие как твины или другие подобные полимерные матрицы доставки лекарственного вещества, сывороточные белки, такие как сывороточный альбумин человека, буферные вещества, такие как фосфаты, глицин, сорбитовая кислота, сорбат калия, частичные глицеридные смеси насыщенных растительных жирных кислот, вода, соли или электролиты, такие как сульфат протамина, динатрийфосфат, дикалийфосфат, хлорид натрия, соли цинка, коллоидный кремнезем, трисиликат магния, поливинилпирролидон, вещества на целлюлозной основе, полиэтиленгликоль,натрийкарбоксиметилцеллюлоза, полиакрилаты, воски,блок-полимеры полиэтилена с полиоксипропиленом, полиэтиленгликоль и ланолин. Для более эффективной доставки соединений формул I-IX к участку действия можно использовать циклодекстрины, такие как -, - и -циклодекстрины,или их химически модифицированные производные, такие как гидроксиалкшщиклодекстрины, включая 2- и 3-гидроксипропилциклодекстрины, или другие солюбилизованные производные. Фармацевтические композиции по данному изобретению можно вводить перорально,парентерально, посредством ингаляции, местно, ректально, назально, трансбуккально, вагинально или из имплантированного источника. Предпочтение отдается пероральному введению или посредством инъекций. Фармацевтические композиции по данному изобретению могут содержать любые известные нетоксичные фармацевтически приемлемые носители, наполнители или разбавители. В некоторых случаях рН композиции можно отрегулировать с помощью фармацевтически приемлемых кислот, оснований или буферов, чтобы увеличить стабильность полученного соединения или содержащей его лекарственной формы. Термин "парентеральный" означает подкожные, внутрикожные,внутривенные, внутримышечные, внутрисуставные, внутриартериальные, внутригрудинные,подоболочечные, внутриопухолевые и внутричерепные инъекции или вливания. Фармацевтические композиции могут представлять собой стерильные инъецируемые 18 препараты, например, стериальные водные или масляные суспензии для инъекций. Эти суспензии можно получить известными методами, используя приемлемые диспергирующие или смачивающие агенты (такие как, например, твин 80) и суспендирующие агенты. Стериальные инъецируемые препараты могут также быть стериальными растворами или суспензиями для инъекций в нетоксичном приемлемом для парентерального введения разбавителе или растворителе, например, в виде раствора в 1,3 бутандиоле. К приемлемым наполнителям и растворителям относятся маннит, вода, раствор Рингера и изотонический раствор хлорида натрия. Кроме того, в качестве растворителей и суспендирующих сред обычно используют стерильные нелетучие масла. Для этой цели можно использовать любое мягкое нелетучее масло,включая синтетические моно- или диглицериды. Для получения инъецируемых составов можно использовать жирные кислоты, такие как олеиновая кислота и ее глицеридные производные, а также оливковое или касторовое масло, предпочтительно в их полиоксиэтилированных формах. Эти масляные растворы или суспензии могут также содержать спиртовые разбавители и диспергирующие агенты с длинными цепями,аналогичные описанным в PharmacopeiaHelvetica, Ph. Helv., или аналогичный спирт,карбоксиметилцеллюлозу или аналогичные диспергирующие агенты, которые обычно используют в процессе приготовления фармацевтически приемлемых лекарственных форм, таких как эмульсии или суспензии. Для получения указанных композиций можно использовать другие известные поверхностно-активные вещества, такие как твины или спаны и/или другие подобные эмульгаторы или вещества, усиливающие биологическую доступность, которые обычно применяют для изготовления фармацевтически приемлемых твердых, жидких или других лекарственных форм. Фармацевтические композиции по данному изобретению можно вводить перорально в виде любой приемлемой для перорального введения лекарственной формы, включая, но не ограничиваясь ими, капсулы, таблетки, эмульсии и водные суспензии, дисперсии и растворы. В случае таблеток для перорального введения обычно используемыми наполнителями являются лактоза и кукурузный крахмал. Обычно также добавляют смазывающие вещества, такие как стеарат магния. Для перорального введения в виде капсул используют такие разбавители, как лактоза и сухой кукурузный крахмал. При пероральном введении водных суспензий и/или эмульсий активный ингредиент может быть суспендирован или растворен в масляной фазе и соединен с эмульгирующими и/или суспендирующими агентами. При желании могут быть добавлены подсластители, ароматизаторы и/или красители. 19 Фармацевтические композиции по данному изобретению можно также использовать в виде суппозиториев для ректального введения. Эти композиции можно получить путем смешивания соединения по данному изобретению с приемлемым нераздражающим наполнителем,который находится в твердом состоянии при комнатной температуре и становится жидким при температуре в прямой кишке, где он плавится и высвобождает активные компоненты. Такими веществами являются, но не ограничиваются ими, масло какао, пчелиный воск или полиэтиленгликоли. Фармацевтические композиции для местного применения особенно полезны при лечении легко доступных участков или органов. Фармацевтические композиции, предназначенные для нанесения на кожу, должны представлять собой приемлемые мази, содержащие активные компоненты, суспендированные или растворенные в носителе. Носителями для местного применения соединений по данному изобретению являются, но не ограничиваются ими,минеральное масло, вазелиновое масло, белый вазелин, пропиленгликоль, полиоксиэтиленполиоксипропилен, эмульгируемый воск и вода. Альтернативно указанные фармацевтические композиции можно получить, используя приемлемый лосьон или крем, содержащий активное соединение, суспендированное или растворенное в носителе вместе с приемлемыми эмульгаторами. Приемлемыми носителями являются, но не ограничиваются ими, минеральное масло,сорбит-моностеарат, полисорбат 60, воск на основе цетиловых эфиров, цетеариловый спирт, 2 октилдодеканол, бензиловый спирт и вода. Фармацевтические композиции по данному изобретению можно также использовать местно для лечения нижнего отдела желудочнокишечного тракта в виде ректальных суппозиториев или клизмы. В объем данного изобретения входит также чрескожный лейкопластырь для местного применения. Фармацевтические композиции по данному изобретению можно вводить в виде назальных аэрозолей или ингаляций. Такие композиции получают хорошо известными методами в виде растворов в физиологическом растворе с использованием бензилового спирта или других приемлемых консервантов, стимуляторов абсорбции, усиливающих биологическую доступность, и/или других известных солюбилизирующих или диспергирующих агентов. Дозы от около 0,01 до около 100 мг/кг массы тела в день, предпочтительно от около 0,5 до около 75 мг/кг массы тела в день описанных здесь ингибиторов IMPDH, оказывают эффективное действие при монотерапии и/или комбинированной терапии для профилактики и лечения IMPDH-опосредованных болезней. Фармацевтические композиции по данному изобретению обычно вводят примерно 1-5 раз в день или 20 в виде непрерывного вливания. Такую схему введения можно использовать для лечения хронических или острых заболеваний. Количество активного ингредиента, смешиваемого с носителями для получения отдельной лекарственной формы, можно изменять в зависимости от нуждающегося субъекта, подвергаемого лечению, и конкретного способа введения. Типичные препараты должны содержать от около 5% до около 95% активного соединения (в весовом отношении). Такие препараты предпочтительно содержат от около 20% до около 80% активного соединения. Когда композиции по данному изобретению содержат ингибитор IMPDH формул (I)(IХ) в сочетании с одним или несколькими дополнительными лечебными или профилактическими средствами, ингибитор IMPDH и дополнительное лекарственное средство должны составлять от около 10 до 100%, более предпочтительно от около 10 до 80% дозы, обычно вводимой в режиме монотерапии. Дополнительные лекарственные средства можно вводить отдельно от соединений по данному изобретению, как часть лечебного режима в виде нескольких лекарственных форм. Альтернативно эти лекарственные средства могут входить в состав одной лекарственной формы, которая представляет собой смесь указанного средства с соединениями по данному изобретению в одной композиции. В соответствии с одним вариантом осуществления изобретения фармацевтические композиции по данному изобретению содержат дополнительный иммуносупрессор. Примерами дополнительных иммуносупрессоров являются,но не ограничиваются ими, циклоспорин A,FK506, рапамицин, лефлуномид, деоксиспергуалин, преднизон, азатиоприн, микофенолятмофетил, ОКТЗ, ATAG, интерферон и мизорибин. В соответствии с другим вариантом осуществления изобретения фармацевтические композиции по данному изобретению могут дополнительно содержать противораковые средства. Примерами противораковых средств являются, но не ограничиваются ими, цисплатин, актиномицин D, доксорубицин, винкристин, винбластин, этопозид, амсакрин, митоксантрон, тенипазид, таксол, колхицин, циклоспорин А, фенотиазины, интерферон и тиоксантеры. В соответствии с другим вариантом осуществления изобретения фармацевтические композиции по данному изобретению могут дополнительно содержать антивирусные средства. Примерами антивирусных средств являются, но не ограничиваются ими, цитовин, ганцикловир, тринатрийфосфоноформиат, рибавирин,d4T, ddI, AZT и ацикловир. В соответствии с еще одним вариантом осуществления изобретения фармацевтические 21 композиции по данному изобретению могут дополнительно содержать средства, препятствующие гиперпролиферации сосудов. Примерами таких средств являются, но не ограничиваются ими, ингибиторы рeдуктазы HMG Со-А,такие как ловастатин, ингибиторы тромбоксанА 2-синтетазы, эйкозапентановая кислота, ципростин, трапидил, ингибиторы АСЕ, низкомолекулярный гепарин, микофенольная кислота,рапамицин и 5-(3'-пиридинилметил)бензофуран 2-карбоксилат. После того, как состояние нуждающегося субъекта станет лучше, при необходимости он может получать поддерживающую дозу соединения, композиции или комбинированного препарата по данному изобретению. Впоследствии в зависимости от симптомов болезни можно сократить дозу или частоту введения либо то и другое вместе до уровня, при котором состояние нуждающегося субъекта остается стабильным, а когда симптомы болезни уменьшатся до желаемого уровня, лечение следует прекратить. Однако нуждающемуся субъекту может потребоваться периодическое лечение на долговременной основе при любом появлении симптомов болезни. Специалистам в этой области должно быть ясно, что может потребоваться введение более низких или более высоких доз по сравнению с указанными выше. Конкретные дозы и режим лечения для конкретного нуждающегося субъекта зависят от ряда факторов, включая активность применяемого соединения, возраст, массу тела, общее состояние здоровья и пол субъекта,режим питания, время введения, скорость экскреции, сочетание лекарственных средств, тяжесть и течение инфекционного заболевания,предрасположение нуждающегося субъекта к инфекции, а также от решения лечащего врача. В соответствии с другим вариантом осуществления данное изобретение предусматривает методы лечения или профилактики IMPDHопосредованных заболеваний у млекопитающих, включающие стадию введения указанному млекопитающему любых вышеописанных фармацевтических композиций и комбинированных препаратов. Если фармацевтическая композиция содержит только ингибитор IMPDH по данному изобретению в качестве активного компонента,такие методы могут дополнительно включать стадию введения указанному млекопитающему лекарственного средства, выбираемого из противовоспалительных средств, иммуносупрессоров, противораковых средств, антивирусных средств или средств, препятствующих гиперпролиферации сосудов. Указанные дополнительные средства можно вводить млекопитающему до введения ингибитора IMPDH, одновременно с ним или после него. В соответствии с предпочтительным вариантом осуществления изобретенияэти методы позволяют эффективно подавлять иммунную 22 реакцию у млекопитающих. Такие методы полезны для лечения или профилактики различных заболеваний, включая отторжение трансплантата (например, почки, печени, сердца, легкого, поджелудочной железы (инсулоциты),костного мозга, роговицы, аллотрансплантатов тонкой кишки и кожи, а также ксенотрансплантатов клапанов сердца), реакцию"трансплантат против хозяина" и аутоиммунные нарушения, такие как ревматоидный артрит,рассеянный склероз, юношеский диабет, астма,воспаление кишечника (болезнь Крона, неспецифический язвенный колит), волчанка, диабет,миастения, псориаз, дерматит, экзема, себорея,воспаление легких, увеит, гепатит, базедова болезнь, тиреоидит Хашимото, синдром Бехчета или Шегрена (сухость глаз и рта), пернициозная или иммуногемолитическая анемия, идиопатическая недостаточность надпочечников, плюригландулярный аутоиммунный синдром, гломерулонефрит, склеродермия, красный плоский лишай, витилиго (депигментация кожи), аутоиммунный тиреоидит и альвеолит. Эти методы включают стадию введения млекопитающему композиции, содержащей соединение любой из формул I-IX и фармацевтически приемлемый наполнитель. В соответствии с предпочтительным вариантом осуществления изобретения этот метод включает дополнительную стадию введения указанному млекопитающему композиции, содержащей дополнительный иммуносуспрессор и фармацевтически приемлемый наполнитель. Альтернативно этот метод включает стадию введения указанному млекопитающему композиции, содержащей соединение формул IIX, дополнительный иммуносупрессор и фармацевтически приемлемый наполнитель. В соответствии с другим предпочтительным вариантом осуществления изобретения эти методы позволяют эффективно подавлять репликацию вируса у млекопитающих. Такие методы полезны для лечения или профилактики вирусных болезней ДНК и РНК, вызываемых, например, вирусами HTLV-1 и HTLV-2, HIV-1 иHIV-2, вирусом носоглоточной карциномы,HBV, HCV, HGV, вирусом желтой лихорадки,вирусом лихорадки денге, вирусом японского энцефалита, вирусом папилломы человека, риновирусами и вирусами герпеса, такими как вирус Эпштейна-Варра, цитомигаловирусами иHerpes Simplex, типов 1 и 2 или типа 6 [cм. патент США 5380879]. Эти методы включают стадию введения млекопитающему композиции, содержащей соединение любой из формул I-IX и фармацевтически приемлемый наполнитель. В соответствии с предпочтительным вариантом осуществления изобретения этот метод включает дополнительную стадию введения указанному млекопитающему композиции, содержащей дополнительное 23 антивирусное средство и фармацевтически приемлемый наполнитель. Альтернативно этот метод включает стадию введения указанному млекопитающему композиции, содержащей соединение формул IIX, дополнительное антивирусное средство и фармацевтический приемлемый наполнитель. В соответствии с другим предпочтительным вариантом осуществления изобретения эти методы позволяют эффективно ингибировать гиперпролиферацию сосудистых клеток у млекопитающих. Такие методы полезны для лечения или профилактики разных болезней, включая рестеноз, стеноз, артериосклероз и другие гиперпролиферативные сосудистые заболевания. Эти методы включают стадию введения млекопитающему композиции, содержащей соединение любой из формул I-IX и фармацевтически приемлемый наполнитель. В соответствии с предпочтительным вариантом осуществления изобретения этот метод включает дополнительную стадию введения указанному млекопитающему композиции, содержащей дополнительное лекарственное средство, препятствующее гиперпролиферации сосудов, и фармацевтически приемлемый наполнитель. Альтернативно этот метод включает стадию введения указанному млекопитающему композиции, содержащей соединение формул IIX, дополнительное средство, препятствующее гиперпролиферации сосудов, и фармацевтически приемлемый наполнитель. В соответствии с другим предпочтительным вариантом осуществления изобретения эти методы позволяют эффективно подавлять рост доброкачественных и злокачественных опухолей у млекопитающего. Такие методы полезны для лечения или профилактики разных болезней, включая доброкачественные и злокачественные опухоли, такие как лимфома, лейкоз и другие формы рака. Эти методы включают стадию введения млекопитающему композиции, содержащей соединение любой из формул I-IX и фармацевтически приемлемый наполнитель. В соответствии с предпочтительным вариантом осуществления изобретения этот метод включает дополнительную стадию введения указанному млекопитающему композиции, содержащей дополнительное противоопухолевое или противораковое средство и фармацевтически приемлемый наполнитель. Альтернативно этот метод включает стадию введения указанному млекопитающему композиции, содержащей соединение формул IIX, дополнительное противоопухолевое или противораковое средство и фармацевтически приемлемый наполнитель. В соответствии с другим предпочтительным вариантом осуществления изобретения эти методы позволяют эффективно инги-бировать 24 воспаления и воспалительные заболевания у млекопитающих. Такие методы полезны для лечения или профилактики разных болезней,включая остеоартрит, острый панкреатит, хронический панкреатит, астму и респираторный дистресс-синдром взрослых. Эти методы включают стадию введения млекопитающему композиции, содержащей соединение любой из формул I-IX и фармацевтически приемлемый наполнитель. В соответствии с предпочтительным вариантом осуществления изобретения этот метод включает дополнительную стадию введения указанному млекопитающему композиции, содержащей противовоспалительное средство и фармацевтически приемлемый наполнитель. Более полному пониманию данного изобретения способствуют приводимые ниже примеры. Эти примеры имеют часто иллюстративный характер и никоим образом не ограничивают объем данного изобретения. Вещества и методы Все температуры даны в градусах Цельсия. Тонкослойную хроматографию (TLC) выполняют на силикагельных пластинках 60 F254E.Merck толщиной 0,25 мм, производя элюирование указанной системой растворителей. Для выявления требуемого соединения пластинку обрабатывают соответствующим визуализирующим агентом, таким как 10% раствор фосфомолибденовой кислоты в этаноле или 0,1% раствор нингидрина в этаноле, после чего ее нагревают и/или при необходимости подвергают воздействию ультрафиолетового света или паров иода. Аналитическую жидкостную хроматографию высокого давления осуществляют на колонке для хроматографии с обращенной фазой размером 3,0 мм х 150 мм с цианосодержащим наполнителем 5 мкм Rainin MycrosorbMV, со скоростью перемещения фронта растворителя 1,0 мл/мин и градиентом растворителя,равным 5-100% ацетонитрила (0,1% ТФА) в воде (0,1% ТФА). Время удерживания жидкостной хроматографии высокого давления дано в минутах. Данные спектроскопии ЯМР получены с помощью спектрометра Bruker AMX500 в указанном растворителе. Анализ инозин-5'-монофосфатдегидрогеназы посредством жидкостной хроматографии высокого давления выполняют в стандартных условиях с целью измерения выработки ферментом ксантозин-5'-монофосфата (ХМР) и восстановленного никотинамидадениндинуклеотида (NADH) из инозин-5'-монофосфата (IMP) и никотинамидадениндинуклеотида (NAD). Для разделения всех четырех компонентов используют жидкостную хроматографию высокого давления, выполняемую на колонке С 18 с использованием реагентов для образования ионных пар. Степень взаимодействия определяют на основании площади пиков полученного продукта. Этот анализ эффективен для определения 25 профилей ингибирования соединений, которые обладают значительной абсорбцией в ультрафиолетовой области в интервале между 290 и 340 нм. Реакционная смесь обычно содержит 0,1 моль KPi; pH 8,0, 0,1 моль KСl, 0,5 ммоль этилендиаминтетрауксусной кислоты, 2 ммоль DTT и 0,2 ммоль инозин-5'-монофосфата (IMP) и никотинамидадениндинуклеотида (NAD). Этот раствор инкубируют при температуре 37 С в течение 10 мин. Реакцию инициируют путем добавления фермента до конечной концентрации, равной 20-100 нмоль, после чего реакционную смесь оставляют для взаимодействия на 10 мин. По истечении указанного времени реакционную смесь гасят, добавляя микофенольную кислоту до конечной концентрации, равной 0,01 ммоль. Степень превращения определяют посредством жидкостной хроматографии высокого давления на колонке С 18-2000 Rainin MicrosorbODS размером 4,6x10 мм, используя систему растворителей, содержащую сульфат тетрабутиламмония (5 ммоль) в 0,1 М растворе Kpi, pH 6,0, с градиентом метанола 0-30%, в течение 15 мин. Аналогичную систему растворителей используют для очистки производных галогенинозин-5'-монофосфата.J.C.Wu, Biochemistry, 33, 1753-1759 (1994)]. Для обнаружения четырех компонентов используют ультрафиолетовый монитор с длинной волны 254 нм, и степень превращения субстратов определяют, интегрируя пики продукта. Для анализа ингибирующей активности исследуемое соединение растворяют в ДМСО до конечной концентрации 20 ммоль и добавляют к исходной анализируемой смеси при требуемой концентрации в объеме 2-5% (в объемном отношении). Реакцию инициируют, добавляя фермент, и через 10 мин реакционную смесь гасят так, как описано выше. После выполнения жидкостной хроматографии высокого давления определяют степень превращения продукта на основании площади пиков по сравнению с результатами контрольного анализа, выполняемого при использовании только ДМСО без испытуемого соединения. Значения IС 50 или Ki определяют путем подбора кривых превращения в зависимости от концентрации по методу нелинейных наименьших квадратов в соответствии с уравнения Хендерсона. [P.J.F.Henderson, Biochem. J., 127, 321 (1972)]. Концентраты ингибирования каждого соединения измерены в отношении инозин-5'монофосфат-дегидрогеназы (IMPDH) при помощи модифицированного метода, впервые предложенного Магазаником. [B.Magasanik,H.S.Moyed and L.B.Gehring, J.Biol. Chem., 226,p.339 (1957)]. Поскольку соединения формул I-IX эффективно ингибируют IMPDH, их можно использовать в клинических условиях для леченияIMPDH-опосредованных заболеваний. Эти испытания позволяют прогнозировать способность данных соединений ингибировать IMPDH- дублет, (t) - триплет, (q) - квартет, (m) - мультиплет, (dd) - дублет дублетов, (dt) - дублет триплетов, (br) - широкий, (br s) - широкий синглет; ТГФ - тетрагидрофуран; ДМФ - диметилформамид. Экспериментальный раздел Синтез типичных соединений. Пример 1. Синтез соединения 1. К раствору 25 мг (156 мкмоль) 4-(5 оксазолил)анилина в 250 мкл СН 2 Сl2 при комнатной температуре добавляют 50 мкл (400 мкмоль)бензилизоцианата. Реакционную смесь перемешивают в течение ночи, полученный продукт фильтруют и промывают смесью гексанов и СН 2 Сl2 (3:1), что дает соединение 1 в чистом виде с выходом 21 мг (46%). 1 Н ЯМР (500 МГц, CDCl3)7,86 (с), 7,55 К раствору ледяной уксусной кислоты (46 мл), уксусного ангидрида (46 мл, 4 85 ммоль) и 2-хлор-4-нитротолуола (5 г, 29,1 ммоль) при 0 С по каплям добавляют концентрированнуюH2SO4 (6,9 мл). Затем в течение 60 мин порциями добавляют СrО 3 (8,08 г, 80,8 ммоль). Реакционную смесь перемешивают в течение 15 мин при 0 С и выливают на лед, полученный осадок отделяют фильтрованием и промывают холодной водой. Очистка флэш-хроматографией с элюированием градиентом 15-50% EtOAc в гексанах дает 2,02 г (24%, 40% в расчете на выделенное исходное вещество) соединения В 1 в виде белого твердого вещества. Спектр 1H ЯМР соответствует требуемой структуре. Соединение В 1 растворяют в смеси этанола и воды (1:1) (20 мл), обрабатывают концентрированной H2SO4 (2 мл) и нагревают с обратным холодильником в течение 1 ч. Реакционную смесь охлаждают до комнатной температуры и трижды экстрагируют диэтиловым эфиром. Эфирный раcтвор дважды промывают водой, 27 сушат над Nа 2SO4 и концентрируют в вакууме с получением желтого твердого вещества. Две перекристаллизации из горячей смеси диэтилового эфира и гексанов дают очищенный продукт В 2 с выходом 620 мг (47,6%) в виде светложелтого кристаллического твердого вещества. Спектр 1 Н ЯМР соответствует требуемой структуре. Смесь соединения В 2 (200 мг, 1,2 ммоль),тозилметилизоцианида (236 мг, 1,2 ммоль) и порошкообразного К 2 СO3 (172 мг, 1,2 ммоль) в метаноле (13 мл) нагревают с обратным холодильником в течение 90 мин и перемешивают в течение ночи при комнатной температуре. Смесь концентрируют до сухого состояния и распределяют между CH2Cl2 и водой. Органические слои отделяют, промывают 0,5 н. раствором НСl, водой и насыщенным раствором соли и сушат над Nа 2SO4. Растворитель удаляют в вакууме с получением сырого желтого вещества. Флэш-хроматография с элюированием градиентом 0-2,5% СН 3 ОН в СН 2 С 12 и перекристаллизация (смесь CH2Cl2 и гексанов) дают очищенный продукт В 3 с выходом 3,3 г (68%) в виде светло-желтого кристаллического твердого вещества. Спектр 1 Н ЯМР соответствует требуемой структуре.SnCl22H2O (избыток; примерно 5 эквивалентов) и нагревают с обратным холодильником в течение 30 мин. Смесь охлаждают до комнатной температуры, разбавляют диэтиловым эфиром и распределяют с помощью 2 н. раствора NaOH. Органические слои отделяют, промывают водой и насыщенным раствором соли, сушат надNa2SO4 и концентрируют в вакууме. Флэшхроматография с элюированием градиентом 0-0,5% СН 3 ОН в CH2Cl2 дает очищенный продукт В 4 с выходом 54 мг (41,5%) в виде светложелтого масла. Спектр 1 Н ЯМР соответствует требуемой структуре. К раствору 20 мг (103 мкмоль) соединения В 4 в 1 мл CH2Cl2 при комнатной температуре добавляют 20 мкл метатолилизоцианата. Реакционную смесь перемешивают в течение ночи,полученный продукт фильтруют и промывают 28 смесью этилацетата и гексанов, что дает соединение 43 в чистом виде с выходом 25 мг (74%). 1 Н ЯМР (500 МГц, d6-ДМСО)9,06 (с),8,73 (с), 8,50 (с), 7,89 (с), 7,73 (д), 7,67 (c), 7,42 Соединение Cl (8,14 г, 51%) получают из 2-метил-5-нитроанизола (10,0 г, 60 ммоль) аналогично описанному выше способу получения соединения В 1. Спектр 1 Н ЯМР соответствует требуемой структуре. Перемешанную суспензию соединения С 1(81,94 г, 307 ммоль) в диоксане (100 мл) обрабатывают концентрированной НСl (20 мл) и нагревают с обратным холодильником в течение ночи. Реакционную смесь охлаждают до комнатной температуры, при этом происходит осаждение продукта С 2 в виде светло-желтого кристаллического твердого вещества с выходом 40,65 г (73,1%). Фильтрат концентрируют до объема, примерно равного 80 мл, добавляют гексаны и выделяют из раствора вторую порцию кристаллического продукта с выходом 8,91 г (16,0%). Спектр 1 Н ЯМР и результаты тонкослойной хроматографии одинаковы для обеих порций и соответствуют требуемому веществу. Общий выход соединения С 2 составляет 49,56 г Раствор соединения С 2 (456 мг, 2,51 ммоль), тозилметилизоцианида (4 90 мг, 2,51 ммоль) и K2 СО 3 (347 мг, 251 ммоль) растворяют в метаноле и нагревают с обратным холодильником в течение 1,5 ч. Смесь продуктов концентрируют в вакууме, вновь растворяют в CH2Cl2,промывают водой и насыщенным раствором соли, сушат над Na2SO4 и еще раз концентрируют в вакууме. Перекристаллизация (смесь диэтилового эфира и гексанов) дает очищенный продукт С 3 с выходом 375 мг (68%). Спектр 1 Н ЯМР соответствует требуемой структуре. 29 течение ночи выдерживают в атмосфере водорода под давлением 2,8 атм (аппарат для гидрогенизации Парра). Реакционную смесь фильтруют и концентрируют в вакууме. Флэшхроматография с элюированием градиентом смеси 30-40% этилацетата и гексанов дает чистый продукт С 4 с выходом 3,4 г (93%). Спектр 1 Н ЯМР соответствует требуемой структуре. К раствору соединения С 4 (25 мг, 0,131 ммоль) в CH2Cl2 при комнатной температуре добавляют толилизоцианат (25 мкл, 0,197 ммоль). Реакционную смесь перемешивают в течение ночи, полученный продукт фильтруют и промывают CH2Cl2, что дает чистое соединение 55 с выходом 42 мг (74%). 1 Н ЯМР (500 МГц, d6-ДМСО)8,87 (с),8,64 (с), 8,37 (с), 7,60 (д), 7,46 (д), 7,42 (с), 7,33 К раствору соединения С 4 (75 мг, 0,394 ммоль) в дихлорэтане (5 мл) при комнатной температуре добавляют 3-нитрофенилизоцианат(97 мг, 0,591 ммоль). Реакционную смесь перемешивают в течение ночи, полученный продукт фильтруют и промывают СН 2 Сl2, что дает чистое соединение D1 с выходом 110,3 мг (79%). Спектр 1HЯМР соответствует требуемой структуре.D1 (95 мг, 0,268 ммоль) в этаноле (20 мл) добавляют SnCl22H2O (302 мг, 1,34 ммоль). Реакционную смесь доводят до температуры кипения с обратным холодильником в течение 1,5 ч, в результате чего она растворяется. Раствор охлаждают до комнатной температуры, разбавляютEtOAc, промывают 2 н. раствором NaOH и насыщенным раствором соли, сушат (Na2SO4) и концентрируют в вакууме. Флэш-хроматография (элюирование градиентом 2,5-5% метанола в СН 2 Сl2) и последующая избирательная кристаллизация требуемого вещества из слегка загрязненных фракций дают чистый продукт с выходом 15,7 мг (18%). 1 Н-ЯМР (500 МГц, d6-ДМСО)8,83 (с),8,44 (с), 8,35 (с), 7,59 (д), 7,48 (д), 7,40 (с), 6,97 004771 Раствор 3-аминобензиламина (826 мг, 6,87 ммоль) и триэтиламина (2,39 мл, 17,18 ммоль) обрабатывают ди-трет-бутилдикарбонатом (1,50 г, 6,87 ммоль) и перемешивают смесь при комнатной температуре в течение 2 ч. Реакционную смесь разбавляют CH2Cl2, промывают NаНСО 3(водный раствор), водой и насыщенным раствором соли, сушат (Na2SO4) и концентрируют в вакууме. Флэш-хроматография с элюированием смесью 25% этилацетата в гексанах дает чистое соединение Е 1 с выходом 200 мг (46%). Спектр 1 Н ЯМР соответствует требуемой структуре. Раствор соединения С 4 (150 мг, 0,789 ммоль) и 1,1-дикарбонилимидазола (160 мг,0,986 ммоль) смешивают с ТГФ (5 мл) и перемешивают в течение 6 ч при комнатной температуре. Происходит осаждение имидазола. К этому осадку добавляют соединение Е 1 (351 мг,1,58 ммоль) и N,N-диметиламинопиридин (97 мг, 0,789 ммоль) и нагревают смесь с обратным холодильником в течение ночи, что дает однородный раствор. Реакционную смесь охлаждают до комнатной температуры, разбавляют EtOAc(MgSO4) и концентрируют. Флэш-хроматография с элюированием градиентом смеси 2030-35% ацетона в гексанах дает чистое соединение 113 с выходом 164 мг (47%). 1 Н ЯМР (500 МГц, d6-ДМСО)8,90 (с),8,75 (с), 8,38 (с), 7,60 (д), 7,51 (с), 7,3-7,46 (м) ,7,21-7,27 (т) , 7,05 (дд), 6,87 (д), 4,12 (д), 3,93 (с),1,44 (с). Rf 0,21 (5% МеOН/СН 2 С 12). Пример 6. Синтез соединения 70 (ссылочный). Раствор 3-хлор-4-цианоанилина (500 мг,7,7 6 ммоль) и метатолилизоцианата (1,0 мл,3,17 ммоль) в СН 2 Сl2 (3 мл) перемешивают в течение ночи при комнатной температуре. Реакционную смесь концентрируют и выполняют жидкостную хроматографию среднего давления,производя элюирование смесью 1% метанола в 31 СН 2 Сl2, что дает чистое соединение 70 с выходом 285 мг (31%). 1 Н ЯМР (500 МГц, d6-ДМСО)9,36 (с),8,88 (с), 7,94 (с), 7,83 (д), 7,44 (д), 7,30 (с), 7,24(9,2 г, 43,4 ммоль) в пиридине (35 мл) добавляют диоксид селена (6,3 г, 56,7 ммоль) и полученный раствор нагревают с обратным холодильником в течение ночи. Реакционную смесь охлаждают до комнатной температуры, фильтруют через целит и концентрируют с получением темно-коричневого масла, которое растворяют в этилацетате и промывают 1,0 н. раствором НСl, а затем насыщенным раствором NaHCO3. Основный видный слой разбавляют эфиром и подкисляют концентрированной НСl. Слои разделяют, органическую фазу промывают насыщенным раствором соли и сушат (Na2SC4) с получением 8,4 г темно-желтого твердого вещества. Перекристаллизация этого вещества из смеси этилацетата и гексана дает соединение G1(6,8 г) в виде бледно-желтого твердого вещества. Спектр 1 Н ЯМР соответствует требуемой структуре. Смесь соединения 59 (64 мг, 0,20 ммоль),соединения G1 (300 мг, 1,20 ммоль) и гидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида (EDC) в ТГФ (5 мл) перемешивают в течение ночи при комнатной температуре. Реакционную смесь разбавляют EtOAc (150 мл),промывают водой, сушат (MgSO4) и концентрируют в вакууме. Жидкостная хроматография среднего давления с элюированием системой градиентов смеси 0-1% метанола в СН 2 Сl2 дает чистое соединение 108 с выходом 37,4 мг (35%). 1 Н ЯМР (500 МГц, d6-ДМСО)9,83 (с),8,23 (с), 8,18 (с), 7,65 (с), 7,61 (с), 7,35 (д), 7,33 Раствор соединения 59 (300 мг, 1,58 ммоль) и метатолилизотиоцианата (2,0 мл, 14,7 ммоль) в CH2Cl2 (5 мл) перемешивают при ком 004771 32 натной температуре в течение ночи. Чтобы завершить реакцию, добавляют дополнительное количество метатолил-изотиоцианата (1,0 мл,7,4 ммоль) и в течение 3 ч нагревают смесь до температуры кипения с обратным холодильником. Реакционную смесь концентрируют в вакууме. Жидкостная хроматография среднего давления с элюированием смесью 0-5% этилацетата в СН 2 Сl2 дает чистое соединение 115 с выходом 210 мг (39%). 1 Н ЯМР (500 МГц, d6-ДМСО)7,90 (с),7,89 (с), 7,82 (с), 7,75 (д), 7,64 (c), 7,44 (с), 7,327,37 (т), 7,27 (с), 7,13-7,21 (с), 6,91 (дд), 3,98 (с),2,40 (с). Rf 0,36 (5% МеОН/СН 2 Сl2) . Пример 9. Синтез соединения 97.(5 мл, 36 ммоль) и перемешивают при комнатной температуре в течение 3 ч. Реакционную смесь разбавляют СН 2 Сl2, промывают 1 н. раствором НСl и насыщенным раствором соли, сушат (МgSО 4) и концентрируют в вакууме с получением соединения I1 (1,61 г, 95%) в виде белого твердого вещества. Спектр 1 Н ЯМР соответствует требуемой структуре. К суспензии NaH (60% дисперсия в масле; 34 мг, 1,42 ммоль) в ТГФ (10 мл) при 0 С добавляют раствор соединения 1 (200 мг, 0,85 ммоль) в ТГФ (10 мл) и перемешивают смесь в течение 1 ч. К реакционной смеси добавляют метилиодид (100 мкл, 1,7 ммоль) и перемешивают в течение ночи при комнатной температуре. Реакционную смесь выливают в воду и экстрагируют этилацетатом. Органические слои отделяют, сушат (MgSO4) и концентрируют в вакууме. Флэш-хроматография с элюированием смесью 5% этилацетата в гексанах дает чистое соединение 12 с выходом 163 мг (66%) в виде желтого твердого вещества. Спектр 1 Н ЯМР соответствует требуемой структуре. Раствор соединения 12 (163 мг, 0,66 ммоль) в этаноле (5 мл) обрабатывают палладием на угле (20 мг) и помещают в атмосферу Н 2(1 атм.) на 3 ч. Реакционную смесь фильтруют и концентрируют в вакууме с получением соединения I3 (120 мг, 84%) в виде воскообразного твердого вещества. Спектр 1 Н ЯМР соответствует требуемой структуре. 34 белого твердого вещества. Спектр 1 Н ЯМР соответствует требуемой структуре. К раствору трифосгена (31 мг, 0,104 ммоль) в дихлорэтане (1 мл) по каплям добавляют раствор соединения В 4 (50 мг, 0,260 ммоль) и диизопропилэтиламина (67 мг, 518 ммоль) в дихлорэтане (5 мл). Реакционную смесь перемешивают еще 1 ч при комнатной температуре, обрабатывают соединением 13 (50 мг, 0,230 ммоль) и перемешивают в течение ночи. Флэш-хроматография всей реакционной смеси с элюированием смесью 1% метанола в СН 2 Сl2 дает чистое соединение 97 с выходом 8 мг (7%) . 1 Н ЯМР (500 МГц, d6-ДМСО)9,20 (с),8,98 (с), 8,39 (с), 7,67 (с), 7,63 (д), 7,48 (С), 7,387,45 (м) , 7,04-7,10 (т), 3,95 (с), 3,31 (с). Rf 0,37 К раствору соединения 59 (50 мг, 0,154 ммоль) и триэтиламина (31 мг, 0,30 ммоль) в ДМФ (0,5 мл) по каплям добавляют фенилацетилхлорид (25 мг, 0,169 ммоль) и перемешивают реакционную смесь в течение ночи при комнатной температуре. Полученную смесь разбавляют СН 2 Сl2 промывают NаНСО 3 (водный раствор) и водой, сушат над MgSO4 и концентрируют в вакууме. Флэш-хроматография с элюированием смесью 2% метанола в СН 2 Сl2 дает чистое соединение 111 с выходом 42 мг (62%). 1 Н ЯМР (500 МГц, d6-ДМСО)10,20 (с),8,90 (с), 8,79 (с), 8,39 (с), 7,88 (с), 7,63 (д), 7,53(сильное экзотермическое соединение) и полученную суспензию перемешивают в течение ночи при комнатной температуре. Реакционную смесь распределяют между EtOac и водой, органические слои отделяют, промывают водой и насыщенным раствором соли, сушат (Na2SO4) и концентрируют в вакууме с получением чистого соединения K1 (15,8 г, 98%) в виде серовато Соединение K2 (4,09 г, 16,2%) получают из соединения K1 (15,86 г, 81,3 ммоль) аналогично описанному выше способу получения соединения В 1. Спектр 1 Н ЯМР соответствует требуемой структуре. Раствор соединения K2 (2,5 г, 8,03 ммоль) в диоксане (10 мл) обрабатывают концентрированной НСl (0,5 мл) и в течение 2 ч нагревают смесь до температуры кипения с обратным холодильником. Добавляют дополнительное количество концентрированной НСl (0,5 мл) и продолжают нагревать смесь с обратным холодильником еще 3 ч. Полученную смесь разбавляют этилацетатом, промывают водой и насыщенным раствором соли, сушат (Na2SO4) и концентрируют в вакууме. Флэш-хроматография с элюированием градиентом смеси 20-30-50% диэтилового эфира в гексанах дает чистое соединениеK3 с выходом 1,14 г (68%). При этом также выделяют 215 мг (11,8%) гидратированного альдегида. Спектр 1 Н ЯМР соответствует требуемой структуре. Раствор соединения K3 (300 мг, 1,43 ммоль) в бензоле (5 мл) обрабатывают 1,3 пропандиолом (114 мкл, 1,573 ммоль) и рTsOHH2O (27 мг, 0,14 ммоль) и в течение 4,5 ч нагревают смесь с обратным холодильником,удаляя воду в аппарате Дина-Старка. Реакционную смесь охлаждают до комнатной температуры и распределяют между этилацетатом и разбавленным раствором NаНСО 3. Органические слои отделяют, промывают насыщенным раствором соли, сушат (Na2SO4) и концентрируют в вакууме. Флэш-хроматография с элюированием градиентом смеси 20-25% диэтилового эфира в гексанах дает чистое соединение K4 с выходом 324 мг (84,5%) в виде серовато-белого кристаллического твердого вещества. Спектр 1 Н ЯМР соответствует требуемой структуре. К раствору соединения К 4 (289 мг, 1,08 ммоль) в ТГФ (5 мл) при 0 С по каплям добав 35 ляют раствор DIBAL (1,0 М раствор в СН 2 Сl2; 2,7 мл, 2,7 ммоль) и перемешивают в течение 40 мин. Реакционную смесь гасят, добавляя насыщенный раствор сегнетовой соли (10 мл), разбавляют этилацетатом и перемешивают в течение 30 мин. Органические вещества собирают,промывают насыщенным раствором соли, сушат(Na2SO4) и концентрируют в вакууме с получением 250 мг (97%) соединения К 5 в виде белого кристаллического твердого вещества. Спектр 1 Н ЯМР соответствует требуемой структуре.NаНСО 3). Выполняют обратную экстракцию водной части посредством СН 2 С 12, органические слои объединяют, промывают водой и насыщенным раствором соли, сушат (Na2SO4) и концентрируют а вакууме. Флэш-хроматография с элюированием градиентом смеси 1050% ацетона в гексанах дает чистое соединение К 8 с выходом 70 мг (44%). Спектр 1 Н ЯМР соответствует требуемой структуре. Раствор соединения К 5 (250 мг, 1,05 ммоль) в СН 2 Сl2 (4 мл) при 0 С обрабатывают пиридином (110 мкл, 1,37 ммоль), бензоилхлоридом (146 мкл, 1,26 ммоль) и 4-диметиламинопиридином (каталитическое количество) и перемешивают при комнатной температуре в течение ночи. Реакционную смесь разбавляютCH2Cl2, промывают 0,5 н. раствором НСl, водой и насыщенным раствором соли, сушат (Na2SO4) и концентрируют в вакууме. Флэшхроматография с элюированием смесью 10% этилацетата в гексанах дает чистое соединение К 6 с выходом 340 мг (99%) в виде белого твердого вещества. Спектр 1 Н ЯМР соответствует требуемой структуре. Раствор соединения К 8 (70 мг, 0,318 ммоль) в уксусном ангидриде (1,5 мл) и пиридине (1,0 мл) обрабатывают 4-диметиламинопиридином (каталитическое количество) и перемешивают при комнатной температуре в течение 3 ч. Смесь разбавляют CH2Cl2, промывают 1,0 н. раствором НСl, водой и насыщенным раствором соли, сушат (Na2SO4) и концентрируют в вакууме с получением соединения К 9 с выходом 82 мг (98%) в виде бледно-желтого твердого вещества. Спектр 1 Н ЯМР соответствует требуемой структуре. Раствор соединения К 6 (326 мг, 0,99 ммоль) в диоксане (7 мл) обрабатывают 2,0 н. раствором НСl (5 мл) и полученную смесь нагревают при температуре 80 С в течение ночи. Реакционную смесь разбавляют EtOAc и промывают насыщенным раствором NаНСО 3 (водный раствор), водой и насыщенным раствором соли, сушат (Na2SO4) и концентрируют в вакууме. Флэш-хроматография с элюированием смесью 30% диэтилового эфира в гексанах дает чистое соединение К 7 с выходом 208 мг (77,5%) в виде белого твердого вещества. Спектр 1 Н ЯМР соответствует требуемой структуре.(101 мг, 0,765 ммоль) и TosMIC (149 мг, 0,765 ммоль) и нагревают при температуре 60 С в течение одного часа. Реакционную смесь концентрируют в вакууме, вновь растворяют вSnCl22H2O (241 мг, 1,07 ммоль) и нагревают смесь при температуре 60 С в течение 50 мин. Реакционную смесь разбавляют EtOAc, промывают насыщенным раствором NaHCO3, водой и насыщенным раствором соли, сушат (Na2SO4) и концентрируют в вакууме. Флэш-хроматография с элюированием градиентом смеси 2030% ацетона в гексанах дает чистое соединение К 10 с выходом 52 мг (73,4%) в виде бледножелтого масла. Спектр 1 Н ЯМР соответствует требуемой структуре. Раствор соединения К 10 (52 мг, 0,224 ммоль) в дихлорэтане (2 мл) обрабатывают метатолилизоцианатом (43 мкл, 0,336 ммоль) и перемешивают в течение ночи при комнатной температуре. Смесь разбавляют смесью CH2Cl2 и гексанов (2:1), фильтруют и промывают той же системой растворителей, что дает соединение К 11 (67 мг, 82%) в виде белого твердого 37 вещества. Спектр 1 Н ЯМР соответствует требуемой структуре. Раствор соединения К 11 (33 мг, 0,09 ммоль) в метаноле (2 мл) обрабатывают 1,0 н. раствором NaOH (135 мкл, 0,135 ммоль) и перемешивают при комнатной температуре в течение 1,5 ч. Реакционную смесь нейтрализуют,добавляя 1,0 н. раствор НСl (135 мкл), и концентрируют в вакууме. Белое твердое вещество промывают водой и смесью CH2Cl2 c гексанами(2:1) и сушат в вакууме, что дает соединение 102 (20 мг, 68%) в виде белого твердого вещества. 1 Н ЯМР (500 МГц, d6-ДМС 0)9,29 (с),9,00 (с), 8,42 (с), 7,69 (с), 7,55 (м), 7,37 (с), 7,33 Раствор соединения С 4 (50 мг, 0,263 ммоль) в ТГФ (2 мл) обрабатывают карбонилдиимидазолом (CDI) (53 мг, 0,33 ммоль) и перемешивают при комнатной температуре в течение 4 ч. К реакционной смеси добавляют 1 ацетил-6-аминоиндол (93 мг, 0,526 ммоль,Sigma Chemical Co.) и 4-диметиламинопиридин(35 мг, 0,28 9 ммоль) и нагревают с обратным холодильником в течение ночи. Полученную смесь разбавляют EtOAc (100 мл), промывают 5% раствором KHSO4, водой и насыщенным раствором соли, сушат (Na2SO4) и концентрируют в вакууме. Реакционную смесь вновь растворяют в EtOAc и фильтруют, чтобы удалить нерастворимые вещества, и еще раз концентрируют в вакууме. Флэш-хроматография с элюированием градиентом смеси 50-60% ацетона в гексанах дает чистое соединение 106 с выходом 37 мг (36%) в виде белого твердого вещества. 1 Н ЯМР (500 МГц, d6-ДМСО)8,79 (с),8,74 (с), 8,37 (с), 8,11 (с), 7,62 (д), 7,47 (с), 7,43 38 натной температуре по каплям добавляют несколько эквивалентов трифторуксусной кислоты и перемешивают в течение 90 мин. Полученный раствор упаривают в вакууме и растирают в порошок с СН 2 С 12 и метанолом. Полученную смесь фильтруют с получением чистого продукта 169 с выходом 258 мг (99%). Спектр 1 Н ЯМР соответствует требуемой структуре. Суспензию соединения 169 (250 мг, 0,55 ммоль) в 21 мл смеси СН 2 Сl2 и ДМФ (20:1 в объемном отношении) обрабатывают триэтиламином (193 мкл, 1,38 ммоль) и перемешивают при комнатной температуре до однородного состояния. Раствор охлаждают до 0 С, обрабатывают (S) 3-тетрагидрофуранил-N-оксисукцинимидилкарбонатом (635 мг, 0,608 ммоль) и продолжают перемешивать в течение ночи, позволяя раствору нагреться до комнатной температуры. Смесь выливают в этилацетат (500 мл),промывают NаНСО 3 (водный раствор) (дважды), водой (дважды) и насыщенным раствором соли (один раз), сушат над Na2SO4 и упаривают в вакууме. Полученный продукт растирают в порошок (30 мл СН 2 Сl2 100 мл эфира), что дает чистое соединение 120 с выходом 212 мг (85%). Спектр 1 Н ЯМР соответствует требуемой структуре. Пример 14. Анализ ингибирования активности инозин-5'-монофосфатдегидрогеназы. Константы ингибирования соединений,приведенных в таблице III, измеряли в соответствии со следующим протоколом. Активность инозин-5'-монофосфатдегидрогеназы (IMPDH) знализировали с помощью модифицированного метода, впервые вписанного Магазаником.[Magasanik, B.Moyed, H.S.and Gehring L.B. (1957) J.Biol. Chem, 226, 339]. Ферментативную активность измеряли спектрофотометрическим методом, контролируя увеличение оптической плотности при длине волны 340 нм вследствие образования восстановленного никотинамидадениндинуклеотида(NADH) (340 равно 6220 М-1 см-1). Реакционную смесь, содержащую 0,1 моль трис-буфера,рН 8,0, 0,1 моль KСl, 3 ммоль этилендиаминтетрауксусной кислоты (EDTA) 0,1 моль ино-зин 5'-монофосфата и фермент (IMPDH человеческого типа II) с концентрацией от 15 до 50 нмоль. Этот раствор инкубировали при температуре 37 С в течение 10 мин. Реакцию инициировали, добавляя никотинамидадениндинуклеотид (NAD) до конечной концентрации, равной 0,1 моль, и начальную скорость измеряли в соответствии с линейным увеличением оптической плотности при длине волны 340 нм в течение 10 мин. Для получения данных в стандарт 39 ном спектрофотометре (длина пути 1 см) конечный объем в кювете доводили до 1,0 мл. Этот анализ выполняли также с использованием 96 луночного титрационного микропланшета; в этом случае все реагенты имели такие же концентрации, при этом конечный объем уменьшали до 200 мкл. Для анализа ингибирующей активности любое испытуемое соединение растворяли в ДМСО до конечной концентрации, равной 20 нмоль, и добавляли к исходной анализируемой смеси для предварительной инкубации с ферментом в конечном объеме, равном 2-5% (в объемном отношении). Реакцию инициировали,добавляя никотинамидадениндинуклеотид(NAD), и измеряли начальные скорости в соответствии с вышеописанной процедурой. Значения константы ингибирования (Ki) определяли,измеряя начальные скорости в присутствии разных количеств ингибитора и осуществляя подбор данных с помощью уравнений Хендерсона[Henderson, P.J.F. (1972) Biochem. J. 127, 321]. Эти результаты приведены в табл. III. Значения Ki выражены в нмолях (нМ). В категории"А" указана активность от 0,01 до 50 нмоль, в категории "В" указана активность, равная 511000 нм, в категории "С" указана активность от 1001 до 10000 нм и в категории "D" указана активность свыше 10000 нм. Обозначение "ND" Пример 15. Анализы антивирусной активности. Антивирусную эффективность соединений можно определить с помощью разных анализов,выполняемых in vitro и in vivo. Например, соединения могут быть испытаны в соответствии с анализами репликации вируса in vitro. При выполнении анализов in vitro можно использовать целые клетки или выделенные клеточные компоненты. При выполнении анализов in vivo используют животные модели для вирусных заболеваний. Примерами таких животных моделей являются, но не ограничиваются ими, модель заражения грызунов вирусами гепатита-В(HBV) и гепатита-С (HCV), модель заражения сурков вирусом гепатита-В (HBV) и модель заражения шимпанзе вирусом гепатита-В (HBV). Несмотря на то, что в этом описании изобретения приведен ряд вариантов осуществления данного изобретения, очевидно, что на их основе могут быть разработаны другие варианты, которые позволят эффективно использовать продукты и методы по данному изобретению. Поэтому объем данного изобретения ограничивается лишь предлагаемой формулой изобретения, а не конкретными вариантами осуществления изобретения, приведенными в качестве примеров. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение общей формулыG и G' независимо выбраны из R1 или Н;D выбирают из С(О), C(S) и S(O)2; В' обозначает насыщенную, ненасыщенную или частично насыщенную моноциклическую или бициклическую кольцевую систему,возможно имеющую до 4 гетероатомов, выбираемых из N, О или S, которую выбирают из формул при этом каждый из Ph и В' может иметь до 3 заместителей, причем первый из указанных заместителей, если он имеется, выбирают из R1, R2, R4 или R5,второй из указанных заместителей, если он имеется, выбирают из R1 или R4 и третьим из указанных заместителей, если он имеется, является R1; причем каждый из R1 независимо выбирают из 1,2-метилендиокси, 1,2-этилендиокси, R6 или (СН 2)n-Y; где n обозначает 0, 1 или 2 и Y выбирают из галогена, CN, NO2, CF3, OCF3, ОН,SR6, S(O)R6, SO2R6, NH2, NHR6, N(R6)2, NR6R8,COOH, COOR6 или OR6; каждый R2, независимо от других, выбирают из (C1-C4)алкила с прямой или разветвленной цепью или (С 2-С 4)алкенила или алкинила с прямой или разветвленной цепью, при этом каждый R2 может иметь до 2 заместителей, причем первый из указанных заместителей, если он имеется, выбирают из R1, R4 и R5 и вторым из указанных заместителей, если он имеется, является R1;R3 выбирают из моноциклической или бициклической кольцевой системы с 5-6 членами в кольце, которая может иметь до 4 гетероатомов,выбираемых из N, О или S, и где группа СН 2,смежная с любым из указанных гетероатомов N,О или S, может быть замещена С(О), при этом каждый R3 может иметь до 3 заместителей, причем первый из указанных заместителей, если он имеется, выбирают из R1, R2, R4 или R5,второй из указанных заместителей, если он имеется, выбирают из R1 или R4 и третьим из указанных заместителей, если он имеется, является R1; каждый R4, независимо от других, выбирают из OR5, OC(O)R6, OC(O)R5, OC(O)OR6,OC(O)OR5, OC(O)N(R6)2, OP(O)(OR6)2, SR6, SR5,S(O)R6, S(O)R5, SO2R6, SO2R5; SO2N(R6)2,SO2NR5R6, SO3R6, C(O)R5, C(O)OR5, C(O)R6,C(O)OR6,NC(O)C(O)R6,NC(O)C(O)R5,6 6P(O)(OR )2; каждый R5 обозначает моноциклическую или бициклическую кольцевую систему с 5-6 42 членами в кольце, которая может иметь до 4 гетероатомов, выбираемых из N, О или S, и где группа СН 2, смежная с указанными гетероатомами N, О или S, может быть замещена С(О),при этом каждый R5 может иметь до 3 заместителей, каждый из которых, если он имеется, является R1; каждый R6 независимо от других выбирают из Н, (С 1-С 4)алкила с прямой или разветвленной цепью или (С 2-С 4)алкенила с прямой или разветвленной цепью, при этом каждый R6 может иметь заместитель, который является R7;R7 обозначает моноциклическую или бициклическую кольцевую систему с 5-6 членами в кольце, которая может иметь до 4 гетероатомов, выбираемых из N, О или S, и где группа СН 2, смежная с указанными гетероатомами N, О или S, может быть замещена С(О), при этом каждый R7 может иметь до 2 заместителей, которые независимо друг от друга выбирают из Н,(С 1-С 4)алкила с прямой или разветвленной цепью, (С 2-С 4)алкенила с прямой или разветвленной цепью, 1,2-метилендиокси, 1,2-этилендиокси или (СН 2)n-Z,где n равен 0, 1 или 2 иR8 обозначает аминозащитную группу; и где любой атом углерода в любом R2 или 6R может быть заменен О, S, SO, SO2, NH илиN(C1-C4)алкилом; если Ph не имеет дополнительных заместителей, а все имеющиеся у В' указанные заместители являются R1, тогда по меньшей мере один из указанных заместителей R1 отличен от хлора,брома или иода; причем В и В' не могут одновременно обозначать незамещенный фенил. 2. Соединение по п.1, формулыG обозначает водород. 19. Соединение по п.1, которое выбирают из группы, включающей соединения 2-27, 29-31,39-51, 53-69, 71-86, 88-89, 91-102 и 104-162, как показано ниже в табл. IB и IС: Таблица IB где В, В', G, G', D и Е имеют значения, указанные в п.1, в количестве, эффективном для ингибирования активности IMPDH;c. фармацевтически приемлемый адъювант. 21. Композиция по п.20, в которой по крайней мере один В в указанном соединении имеет по крайней мере первый заместитель,представляющий собой R5. 22. Соединение по п.2, представленное формулойa. соединение по любому из пп.1-19 в количестве, эффективном для ингибирования активности IMPDH; иb. фармацевтически приемлемый адъювант. 24. Фармацевтическая композиция по п.23,дополнительно содержащая средство, которое выбирают из иммуносупрессоров, противораковых средств, антивирусных средств, противовоспалительных средств, противогрибковых средств, антибиотиков или средств, препятствующих гиперпролиферации сосудов. 25. Способ лечения или профилактикиIMPDH-опосредованных заболеваний у млекопитающих, который включает стадию введения указанным млекопитающим композиции по п.20. 26. Способ лечения или профилактикиIMPDH-опосредованных заболеваний у млекопитающих, который включает стадию введения указанным млекопитающим композиции по п.23. 27. Способ по п.26, где указанная композиция дополнительно содержит лекарственное средство, выбираемое из иммуносупрессоров,противораковых средств,антивирусных средств, противовоспалительных средств, противогрибковых средств, антибиотиков или средств, препятствующих гиперпролиферации сосудов. 28. Способ по любому из п.25-27, который применяют для подавления иммунной реакции и где указанное дополнительное лекарственное средство, если оно используется, является иммуносупрессором. 29. Способ по п.28, где указанное IMPDHопосредованное заболевание является аутоиммунным заболеванием. 30. Способ по любому из пп.25-27, гдеIMPDH-опосредованное заболевание является вирусным заболеванием и указанное дополнительное лекарственное средство, если оно используется, является антивирусным средством. 31. Способ по любому из пп.25-27, гдеIMPDH-опосредованное заболевание является сосудистым заболеванием и указанное дополни 48 тельное лекарственное средство, если оно используется, является средством, препятствующим гиперпролиферации сосудов. 32. Способ по любому из пп.25-27, гдеIMPDH-опосредованное заболевание является раком и указанное дополнительное лекарственное средство, если оно используется, является противораковым средством. 33. Способ по любому из пп.25-27, гдеIMPDH-опосредованное заболевание является воспалительным заболеванием и указанное дополнительное лекарственное средство, если оно используется, является противовоспалительным средством.
МПК / Метки
МПК: C07D 263/32, A61K 31/422, A61P 31/12
Метки: производные, мочевины, дегидрогеназы, инозин-5`-монофосфат, ингибиторов, применение, качестве
Код ссылки
<a href="https://eas.patents.su/25-4771-proizvodnye-mocheviny-i-ih-primenenie-v-kachestve-ingibitorov-inozin-5-monofosfat-degidrogenazy.html" rel="bookmark" title="База патентов Евразийского Союза">Производные мочевины и их применение в качестве ингибиторов инозин-5`-монофосфат- дегидрогеназы</a>
Предыдущий патент: Новые сложные эфиры, производные (rr, ss)-3-(2-диметиламинометил -1-гидроксициклогексил)фенил 2-гидроксибензоата
Следующий патент: Применение 5-[4-[2-(n-метил-n-(2-пиридил)амино) этокси] бензил]тиазолидин – 2,4 – диона для уменьшения постишемического повреждения сердца
Случайный патент: Способ разработки наклонных рудных залежей












