Пиридо[2,3-d]пиримидин-2,4-диамины в качестве ингибиторов pde 2
Номер патента: 10424
Опубликовано: 29.08.2008
Авторы: Лэм Келвин, Чамберс Роберт Джеймс, Моррелл Эндрю Ян, Томпсон Дэвид Дьюэйн, Ли Мей, Бейер Томас Артур
Формула / Реферат
1. Соединения формулы (I)
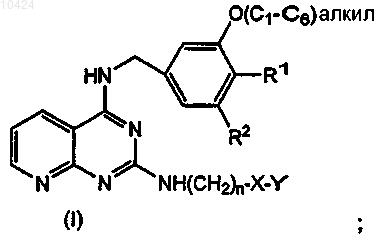
или их фармацевтически приемлемые соли, в которых
R1 и R2 представляют собой водород или метоксигруппу при условии, что R1 и R2 одновременно не являются водородом или метоксигруппой;
n представляет собой 1, 2, 3 или 4;
X представляет собой связь; О; С=O; -N(R)-, где R представляет -(C1-С3)алкил;
Y представляет собой бензоксазолил, бензотиазолил, пиридил, фенил или тиенил, причем Y необязательно замещен заместителями в количестве от 1 до 3, независимо выбранными из галогена, трифторметила, метокси, -С(=О)СН3, циано, -С(СН3)2ОН, -СН(СН3)ОН, -CH(CF3)OH, -C(C=O)CF3, 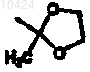 или оксадиазолила.
или оксадиазолила.
2. Соединение по п.1, в котором X представляет собой связь и Y представляет собой тиенил, пиридил или фенил, причем фенил необязательно замещен 1 или 2 заместителями, независимо выбранными из галогена, трифторметила, метокси, -С(=O)СН3, циано, -С(СН3)2ОН, -СН(СН3)ОН, -CH(CF3)OH,
-(C=O)CF3 или оксадиазолила.
3. Соединение по п.1 или 2, в котором X представляет собой связь, n представляет собой 2 или 3 и Y представляет собой тиенил, пиридил или фенил, причем фенил необязательно замещен 1 или 2 заместителями, независимо выбранными из метокси, галогена, -С(СН3)2ОН, -CH(CF3)OH или -(C=O)CF3.
4. N2,N4-бис-(3,5-Диметоксибензил)пиридо[2,3-d]пиримидин-2,4-диамин;
N4-(3,5-диметоксибензил)-N2-(2-пиридин-4-илэтил)пиридо[2,3-d]пиримидин-2,4-диамин;
N4-(3,5-диметоксибензил)-N2-(2-тиен-2-илэтил)пиридо[2,3-d]пиримидин-2,4-диамин;
N4-(3,5-диметоксибензил)-N2-2-фенетилпиридо[2,3-d]пиримидин-2,4-диамин;
N4-(3,5-диметоксибензил)-N2-[2-(3,5-диметоксифенил)этил]пиридо[2,3-d]пиримидин-2,4-диамин;
2-(3-{3-[4-(3,4-диметоксибензиламино)пиридо[2,3-d]пиримидин-2-иламино]пропил}фенил)пропан-2-ол;
N4-(3,4-диметоксибензил)-N2-[2-(4-фторфенил)этил]пиридо[2,3-d]пиримидин-2,4-диамин;
N4-(3,4-диметоксибензил)-N2-фенетилпиридо[2,3-d]пиримидин-2,4-диамин или
N4-(3,4-диметоксибензил)-N2-(3-фенилпропил)пиридо[2,3-d]пиримидин-2,4-диамин
или их фармацевтически приемлемые соли.
5. Фармацевтическая композиция, содержащая соединение формулы (I) по любому из пп.1-4 или фармацевтически приемлемую соль упомянутого соединения, а также фармацевтически приемлемую основу, носитель или разбавитель.
6. Способ лечения опосредованных PDE 2 состояний, заболеваний или симптомов у млекопитающих, нуждающихся в таком лечении, где указанный способ включает введение упомянутому млекопитающему терапевтически эффективного количества соединения формулы (I) по любому из пп.1-4, или фармацевтически приемлемой соли упомянутого соединения; или фармацевтической композиции, включающей упомянутое соединение формулы (I), или фармацевтически приемлемую соль упомянутого соединения, а также фармацевтически приемлемую основу, носитель или разбавитель.
7. Способ по п.6, в котором упомянутое состояние, заболевание или симптом представляет собой остеопороз, легочную гипертензию, расстройство полового влечения у женщин, ухудшение памяти или познавательной способности, агрегацию тромбоцитов, сосудистый ангиогенез, деменцию, рак, аритмию, тромбоз, перелом и/или дефект костей, медленно срастающийся или несросшийся перелом, сподилодез, врастание костей, реконструкцию лицевой части черепа или гипоксию, где способ включает введение млекопитающему, нуждающемуся в таком лечении, терапевтически эффективного количества соединения формулы (I) по п.1, или фармацевтически приемлемой соли упомянутого соединения, или фармацевтической композиции, включающей упомянутое соединение, или упомянутую фармацевтически приемлемую соль упомянутого соединения.
8. Способ по п.6, в котором упомянутое состояние представляет собой перелом и/или дефект костей.
9. Фармацевтическая композиция, содержащая соединение формулы (I) по п.1 в качестве ингибитора PDE 2, селективный агонист рецептора ЕР2 и фармацевтически приемлемую основу, носитель или разбавитель.
10. Композиция по п.9, в которой упомянутый ингибитор PDE 2 представляет собой N4-(3,5-диметоксибензил)-N2-(2-пиридин-4-илэтил)пиридо[2,3-d]пиримидин-2,4-диамин; 2-(3-{3-[4-(3,4-диметоксибензиламино)пиридо[2,3-d]пиримидин-2-иламино]пропил}фенил)пропан-2-ол; N4-(3,4-диметоксибензил)-N2-(3-фенилпропил)пиридо[2,3-d]пиримидин-2,4-диамин или фармацевтически приемлемые соли упомянутых соединений.
11. Композиция по п.9 или 10, в которой упомянутый селективный агонист рецептора ЕР2 представляет собой (3-(((4-трет-бутилбензил)(пиридин-3-сульфонил)амино)метил)фенокси)уксусную кислоту или ее фармацевтически приемлемую соль.
12. Способ по любому из пп.6-8, дополнительно включающий введение упомянутому млекопитающему терапевтически эффективного количества селективного агониста рецептора ЕР2 или фармацевтической композиции, включающей комбинацию упомянутого соединения формулы (I) по п.1 и упомянутого селективного агониста рецептора ЕР2.
13. Способ по п.12, в котором упомянутый ингибитор PDE 2 представляет собой N4-(3,5-диметоксибензил)-N2-(2-пиридин-4-илэтил)пиридо[2,3-d]пиримидин-2,4-диамин; 2-(3-{3-[4-(3,4-диметоксибензиламино)пиридо[2,3-d]пиримидин-2-иламино]пропил}фенил)пропан-2-ол; N4-(3,4-диметоксибензил)-N2-(3-фенилпропил)пиридо[2,3-d]пиримидин-2,4-диамин или фармацевтически приемлемые соли упомянутых соединений.
14. Способ по п.12 или 13, в котором упомянутый селективный агонист рецептора ЕР2 представляет собой (3-(((4-трет-бутилбензил)(пиридин-3-сульфонил)амино)метил)фенокси)уксусную кислоту или ее фармацевтически приемлемую соль.
15. Способ лечения перелома и/или дефекта костей у млекопитающего, нуждающегося в таком лечении, где способ включает введение упомянутому млекопитающему терапевтически эффективного количества соединения формулы (I) по п.1 в качестве ингибитора PDE 2 или фармацевтически приемлемой соли упомянутого ингибитора.
Текст
010424 Область техники, к которой относится изобретение Изобретение относится к некоторым пиридо[2,3-d]пиримидин-2,4-диаминам, применимым в качестве ингибиторов PDE 2; их фармацевтическим композициям, их комбинациям, а также их применениям. Уровень техники Семейство ферментов фосфодиэстераз (PDE) регулирует внутриклеточное содержание вторичных мессенджеров сАМР или cGMP путем гидролитического регулирования. Фосфодиэстераза типа II (PDE 2) обладает каталитическим доменом низкой аффинности и аллостерическим доменом, специфичным для cGMP. Каталитический сайт низкой аффиности может гидролизовать как сАМР, так и cGMP с более низкой кажущейся KM в случае cGMP по сравнению с сАМР. Однако, когда cGMP связывается с аллостерическим сайтом, каталитический сайт претерпевает конформационное изменение, демонстрируя высокую аффиность к сАМР. Наивысшая экспрессия PDE 2 наблюдается в мозге, но он обнаружен также и во многих других тканях и, следовательно, имеет широкий спектр функций и потенциальную терапевтическую применимость (J.A. Beavo, Rev. Phisio. Biochem. Pharm., 135, 67, (1999. Примеры функций и терапевтического потенциала PDE 2 встречаются в таких областях, как развитие нейронов, обучение и память (W.C.G. van Staveren, et al., Brain Res., 888, 275 (2001) и J. O'Donnell, et al., J. Pharm. Exp. Ther.,302, 249 (2002; секреция пролактина и альдостерона (M.O. Velardez, et al., Eur. J. Endo., 143, 279 (2000) и N. Gallo-Payet et al., Endo., 140, 3594 (1999; дифференцировка костных клеток, рост и ресорбция костей (С. Allardt-Lamberg, et al., Biochem. Pharm., 59, 1133 (2000) и S. Wakabayashi, et al., J. Bone. Miner.Res., 17, 249 (2002; иммунологический ответ (M.D. Houslay, et al., Cell Signal., 8, 97 (1996; сосудистый ангиогенез (Т. Keravis, et al., J. Vasc. Res., 37, 235 (2000; перенос воспалительных клеток (S.L. Wolda, etal., J. Histochem.Cytochem., 47, 895 (1999; сердечные сокращения (R. Fischmeister, et al., J. Clin. Invest.,99, 2710 (1997), P. Donzeau-Gouge, et al., J. Physiol., 533, 329 (2001) и D.J. Paterson, et al., Card. Res., 52,446 (2001; агрегация тромбоцитов (R.J. Haslam, et al., Biochem. J., 323, 371 (1997; расстройство женского полового возбуждения (FSAD) (C.P. Wayman, et al., European Patent Application PublicationEP 10977707 и 1097706); и гипоксическое сужение легочных сосудов (J. Haynes, et al., J. Pharm. Exp. Ther.,276, 752 (1996. Было показано, что EHNA (эритро-9-(2-гидрокси-3-нонил)аденин), т.е. мощный ингибитор аденозиндезаминазы, селективно ингибирует PDE 2, однако, применение EHNA в качестве основного терапевтического средства в отношении PDE 2 ограничено из-за низкой эффективности ингибирования PDE 2 и высокой эффективности ингибирования аденозиндезаминазы (R. Fischmeister, et al., Mol.Pharm., 48, 121 (1995. В настоящее время обнаружено, что некоторые производные пиридо[2,3-d]пиримидин-2,4-диаминов формулы (I), приведенной далее в настоящей заявке, ингибируют PDE 2 и, следовательно, применимы в лечении физиологических расстройств, опосредованных клеточными сигнальными путями сАМР или cGMP. Патенты США 5547954 и 5710157 раскрывают некоторые 2,4-диамино-5,6-дизамещенные и 5,6,7-тризамещенные-5-деазаптеридины, их композиции, а также их применения для регулирования численности насекомых на сельскохозяйственных культурах. Сущность изобретения Изобретение относится к соединениям формулы (I) их фармацевтически приемлемым солям, причем символы n, X и Y определены далее в настоящей заявке; к их фармацевтическим композициям, их комбинациям, а также их применениям в способах лечения опосредованных PDE 2 состояний, заболеваний или симптомов. Подробное описание изобретения Настоящее изобретение относится к соединениям формулы (I) их фармацевтически приемлемым солям, гдеR1 и R2 представляют собой водород или метоксигруппу, при условии, что R1 и R2 одновременно не являются водородом или метоксигруппой;Y представляет собой бензоксазолил, бензотиазолил, пиридил, фенил или тиенил, причем Y необязательно замещен заместителями в количестве от 1 до 3, независимо выбранными из галогена, трифторметила, метокси, -С(=О)СН 3, циано, -С(СН 3)2 ОН, -СН(СН 3)ОН, -CH(CF3)OH, -C(C=O)CF3,или оксадиазолила. Предпочтительная подгруппа соединений формулы (I), в основном, включает такие соединения, в которых X представляет собой связь и Y представляет собой тиенил, пиридил или фенил, причем фенил необязательно замещен одним или двумя заместителями, независимо выбранными из галогена, трифторметила, метокси, -С(=О)СН 3, циано, -С(СН 3)2 ОН, -СН(СН 3)ОН, -CH(CF3)OH, -C(C=O)CF3 или оксадиазолила. Особенно предпочтительная подгруппа соединений формулы (I) включает такие соединения, в которых X представляет собой связь, n представляет собой 2 или 3 и Y представляет собой тиенил, пиридил или фенил, причем фенил необязательно замещен 1 или 2 заместителями, независимо выбранными из метокси, галогена, -С(СН 3)2 ОН, -CH(CF3)OH или -C(C=O)CF3. Особенно предпочтительными соединениями настоящего изобретния являются следующие: N2,N4 бис-(3,5-диметоксибензил)пиридо[2,3-d]пиримидин-2,4-диамин; N4-(3,5-диметоксибензил)-N2-(2-пиридин 4-илэтил)пиридо[2,3-d]пиримидин-2,4-диамин; N4-(3,5-диметоксибензил)-N2-(2-тиен-2-илэтил)пиридо[2,3-d] пиримидин-2,4-диамин; N4-(3,5-диметоксибензил)-N2-2-фенетилпиридо[2,3-d]пиримидин-2,4-диамин; N4(3,5-диметоксибензил)-N2-[2-(3,5-диметоксифенил)этил]пиридо[2,3-d]пиримидин-2,4-диамин; 2-(3-3-[4(3,4-диметоксибензиламино)пиридо[2,3-d]пиримидин-2-иламино]пропилфенил)пропан-2-ол; N4-(3,4-диметоксибензил)-N2-[2-(4-фторфенил)этил]пиридо[2,3-d]пиримидин-2,4-диамин; N4-(3,4-диметоксибензил)N2-фенетилпиридо[2,3-d]пиримидин-2,4-диамин; или N4-(3,4-диметоксибензил)-N2-(3-фенилпропил)пиридо[2,3-d]пиримидин-2,4-диамин; или их фармацевтически приемлемые соли. Циклическая группа может быть связана с другой группой больше чем одним способом. Если не определен конкретный порядок связывания, подразумеваются все возможные расположения групп. Например, термин "пиридил" включает 2-, 3- или 4-пиридил и термин "тиенил" включает 2- или 3-тиенил. В настоящем изобретении соединения и промежуточные соединения могут быть названы в соответствии с номенклатурной системой IUPAC (Международный союз теоретической и прикладной химии) или CAS (Служба рефератов по химии, Columbus, ОН). Количество атомов углерода различных углеводородсодержащих фрагментов может быть показано с помощью префикса, обозначающего минимальное и максимальное число атомов углерода во фрагменте, т.е. префикс "-(Ca-Cb)алкил" обозначает алкильный фрагмент, содержащий атомы углерода в количестве от целого числа "а" до целого числа "b", включительно. Термин "алкил" означает прямые или разветвленные одновалентные цепи атомов углерода. Примеры алкильных групп включают метил, этил, пропил, изопропил, бутил, изобутил и т.п. Термин "галоген" означает хлор, фтор, бром и йод. Термин "пролекарство" относится к соединению, являющемуся предшественником лекарства, которое после введения высвобождает лекарство in vivo за счет химических или физиологических процессов(например, при попадании в среду с физиологическим рН или благодаря действию ферментов). Обсуждение получения и применения пролекарств можно найти в T. Higuchi и W. Stella, "Prodrugs as NovelRoche, American Pharmaceutical Association и Pergamon Press (1987). Термин "млекопитающее" означает животных, включая, например, собак, кошек, коров, овец, лошадей и людей. Предпочтительные млекопитающие включают людей обоих полов. Термин "соли" относится к органическим или неорганическим солям соединений формулы (I) или их пролекарств. Эти соли могут быть получены in situ в ходе окончательного выделения и очистки соединения или отдельно, взаимодействием соединения формулы (I) или его пролекарства с подходящими органическими или неорганическими кислотами или основаниями, с последующим выделением полученной таким образом соли. Типовые соли включают гидробромиды, гидрохлориды, сульфаты, бисульфаты, нитраты, ацетаты, оксалаты, безилаты, пальмитаты, стеараты, лаураты, бораты, бензоаты, лактаты, фосфаты,тозилаты, цитраты, малеаты, фумараты, сукцинаты, тартраты, нафтилаты, мезилаты, глюкогептонаты,лактобионаты и лаурилсульфонаты и т.п. Кроме этого они могут включать катионы щелочных или щелочно-земельных металлов, таких как натрий, литий, калий, кальций, магний и т.п., а также нетоксичные аммониевые, четвертичные аммониевые катионы и катионы аминов, включая, но не ограничиваясь перечисленным, аммоний, тетраметиламмоний, тетраэтиламмоний, метиламин, диметиламин, триметиламин,триэтиламин, этиламин и т.п. Другие примеры см., например, в Berge, et al., J. Pharm. Sci., 66, 1-19 (1977). Термин "замещенный" означает, что атом водорода в молекуле заменен другим атомом или молекулой. Атом или молекулу, заменяющие водород, именуют "заместителем". В рамках настоящей заявки термин "терапевтически эффективное количество" означает количество соединения, которое способно воздействовать на описанное патологическое состояние.-2 010424 Термины "лечить" и "лечение" включают предупреждающее (например, профилактическое) и паллиативное (например, восстанавливающее или корректирующее) лечение или действие, направленное на обеспечение предупреждающего или паллиативного лечения. Соединения формулы (I) могут содержать ассиметрические или хиральные центры и, следовательно,существовать в виде различных стереоизомерных форм. Имеется в виду, что все стереоизомерные формы соединений и пролекарств формулы (I), a также их смеси, включая рацемические смеси, составляют часть настоящего изобретения. Кроме этого, настоящее изобретение охватывает все геометрические изомеры и изомеры положения. Например, если соединение или пролекарство формулы (I) включает двойную связь (связи), его цис- и транс-формы, а также их смесь входят в объем настоящего изобретения. Смеси диастереомеров могут быть разделены на индивидуальные диастереомеры на основе их физико-химических различий способами, хорошо известными обычному специалисту в данной области техники, такими как хроматография и/или фракционированная кристаллизация. Энантиомеры могут быть разделены превращением смеси энантиомеров в смесь диастереомеров реакцией с подходящим оптически активным соединением (например, спиртом), разделением диастереомеров и превращением (например, гидролизом) отдельных диастереомеров в соответствующие чистые энантиомеры. Соединения и пролекарства соединений формулы (I) могут существовать в несольватированных формах, а также в формах, сольватированных фармацевтически приемлемыми растворителями, такими как вода, этанол и т.п., и имеется в виду, что настоящее изобретение охватывает как сольватированные,так и несольватированные формы. Кроме этого имеется возможность того, что соединения и пролекарства формулы (I) могут существовать в виде таутомеров, находящихся в равновесии, причем все такие формы включены в объем изобретения. Помимо этого в объем настоящего изобретения входят соединения формулы (I), меченные изотопами, которые идентичны перечисленным в настоящей заявке соединениям, за исключением того, что 1 или несколько атомов заменены атомами, имеющими атомную массу или массовое число, отличное от атомной массы или массового числа, которые обычно встречаются в природе. Примеры изотопов, которые могут входить в соединения формулы (I), включают изотопы водорода, углерода, азота, кислорода,фосфора, фтора и хлора, как, например, 2 Н, 3 Н, 13 С, 14 С, 15N, 18O, 17O, 31 Р, 32 Р, 35S, 18F и 36Cl, соответственно. Подразумевается, что соединения формулы (I) и их пролекарства, а также фармацевтически приемлемые соли соединений и пролекарств, которые содержат вышеупомянутые изотопы и/или другие изотопы других атомов, входят в объем данного изобретения. Некоторые соединения формулы (I), меченные изотопами, например те соединения, в состав которых входят такие радиоизотопы, как 3 Н и 14 С, применимы при анализе соединений и/или исследовании распределения в тканях. Соединения, меченные тритием, т.е. изотопом 3 Н, и углеродом-14, т.е. изотопом 14 С, являются особенно предпочтительными благодаря относительной легкости их получения и несложному детектированию. Кроме того, замещение тяжелыми изотопами, такими как дейтерий, т.е. 2 Н, может предоставить определенные терапевтические преимущества, являющиеся следствием большей устойчивости к метаболизму, например увеличение времени полужизни in vivo или уменьшение требуемой дозировки, и, следовательно, в некоторых обстоятельствах может оказаться предпочтительным. Соединения формулы (I), меченные изотопами, в основном, могут быть получены с помощью методик, аналогичных тем, которые раскрыты в схемах и/или примерах, приведенных далее в настоящей заявке, путем замены реагента, не меченного изотопами, на реагент, меченный изотопами. В другом аспекте настоящее изобретение относится к способам лечения опосредованных PDE 2 состояний, заболеваний или симптомов у млекопитающих, нуждающихся в таком лечении, причем упомянутые способы включают введение млекопитающему терапевтически эффективного количества соединения формулы (I), его пролекарства или фармацевтически приемлемой соли соединения или пролекарства; или фармацевтической композиции, содержащей соединение формулы (I), его пролекарство или фармацевтически приемлемую соль соединения или пролекарства, а также фармацевтически приемлемую основу, носитель или разбавитель. Предпочтительные состояния, заболевания или симптомы, которые могут подвергаться лечению в соответствии со способами настоящего изобретения, включают остеопороз, легочную гипертензию, расстройство полового влечения у женщин, ухудшение памяти или познавательной способности, агрегацию тромбоцитов, сосудистый ангиогенез, деменцию, рак, аритмию, тромбоз, перелом и/или дефект костей, медленно срастающийся или несросшийся перелом, сподилодез, врастание костей, реконструкцию лицевой части черепа или гипоксию. Особенно предпочтительным состоянием является перелом и/или дефект костей. В другом аспекте изобретение относится к способам ингибирования активности PDE 2 у млекопитающих, нуждающихся в таком ингибировании, причем упомянутые способы включают введение млекопитающему ингибирующего PDE 2 количества соединения формулы (I), его пролекарства или фармацевтически приемлемой соли соединения или пролекарства; или фармацевтической композиции, содержащей соединение формулы (I), его пролекарство или фармацевтически приемлемую соль соединения или пролекарства, а также фармацевтически приемлемую основу, носитель или разбавитель. Соединения формулы (I), их пролекарства и фармацевтически приемлемые соли соединений или пролекарств могут вводиться млекопитающим в дозе в диапазоне от примерно 0,001 до примерно 200 мг-3 010424 в день. В случае обычного взрослого человека, имеющего массу тела около 70 кг, как правило, предпочтительна дозировка от 0,01 до примерно 100 мг на кг массы тела, однако, могут потребоваться некоторые изменения в основном диапазоне доз, в зависимости от возраста и массы подвергаемого лечению пациента, планируемого пути введения, конкретного вводимого соединения и т.п. факторов. Определение диапазонов доз и оптимальных доз для конкретного субъекта из числа млекопитающих доступно обычному специалисту в области техники, к которой принадлежит описываемое изобретение. Еще в одном аспекте изобретение относится к фармацевтическим композициям, содержащим комбинацию ингибитора PDE 2, селективного агониста ЕР 2 и фармацевтически приемлемой основы, носителя или разбавителя; а также к способам лечения остеопороза, легочной гипертензии, расстройств полового влечения у женщин, ухудшения памяти или познавательной способности, агрегации тромбоцитов,сосудистого ангиогенеза, деменции, рака, аритмии, тромбоза, переломов и/или дефектов костей, медленно срастающегося или несросшегося перелома, сподилодеза, врастания костей, реконструкции лицевой части черепа или гипоксии с применением таких композиций. Особенно предпочтительным состоянием является перелом и/или дефект костей. Еще в одном аспекте изобретение относится к способам лечения переломов и/или дефектов костей у млекопитающих, нуждающихся в таком лечении, причем упомянутые способы включают введение млекопитающему терапевтически эффективного количества ингибитора PDE 2, его пролекарства или фармацевтически приемлемой соли упомянутого ингибитора или пролекарства. В способах и комбинациях по настоящему изобретению может быть применен любой ингибиторPDE 2, включая соединения формулы (I) настоящей заявки. Примеры известных ингибиторов PDE 2 включают EHNA, 6-(3,4-диметоксибензил)-1-[(1-гидроксиэтил)-4-фенилбутил]-3-метил-1,5-дигидропиразоло[3,4-d]пиримидин-4-он (BAY-60-7550; патент США 6174884) и 9-(1-ацетил-4-фенилбутил)-2-(3,4 диметоксибензил)-1,9-дигидропурин-6-он (патент США 5861396). Дополнительные примеры ингибиторов PDE 2 раскрыты в патентах США 5861396; 5401774; 6458796 и 6555547, а также в публикации международной заявки РСТ 98/32755. В аспектах настоящего изобретения, относящихся к комбинациям, может быть применен любой селективный агонист рецептора ЕР 2, однако, в основном, предпочтительный класс селективных агонистов рецептора ЕР 2, раскрытый в переуступленном патенте США 6498172, включает соединения формулы АА их пролекарства и их фармацевтически приемлемые соли,причем значения символов G, A, B, K, M, Q и Z соответствуют определениям, приведенным в патенте. В основном, предпочтительными соединениями формулы АА являются (3-пиридин-3-сульфонил)(4-пиримидин-5-илбензил)амино)метил)фенил)уксусная кислота; (3-5-фенилфуран-2-илметил)-(пиридин 3-сульфонил)амино)метил)фенил)уксусная кислота; (3-пиридин-3-сульфонил)-(4-пиримидин-2-илбензил) амино)метил)фенил)уксусная кислота; (3-пиридин-3-сульфонил)-(4-тиазол-2-илбензил)амино)метил) фенил)уксусная кислота; (3-4-пиразин-2-илбензил)-(пиридин-3-сульфонил)амино)метил)фенил)уксусная кислота; (3-4-циклогексилбензил)-(пиридин-3-сульфонил)амино)метил)фенокси)уксусная кислота;(3-пиридин-3-сульфонил)-(4-пиридин-2-илбензил)амино)метил)фенокси)уксусная кислота; (3-пиридин 3-сульфонил)-(4-пиридин-3-илбензил)амино)метил)фенокси)уксусная кислота; (3-пиридин-3-сульфонил)(4-пиридин-4-илбензил)амино)метил)фенокси)уксусная кислота; (3-пиридин-3-сульфонил)-(4-тиазол 2-илбензил)амино)метил)фенокси)уксусная кислота; 5-(3-пиридин-3-сульфонил)-(4-тиазол-2-илбензил) амино)пропил)тиофен-2-карбоновая кислота; (3-2,3-дигидробензо[1,4]диоксин-6-илметил)-(пиридин-3 сульфонил)амино)метил)фенил)уксусная кислота; и (3-бензофуран-2-илметил-(пиридин-3-сульфонил) амино)метил)фенил)уксусная кислота; (3-4-бутилбензил)-(пиридин-3-сульфонил)амино)метил)фенил) уксусная кислота; (3-бензолсульфонил(4-бутилбензил)амино)метил)фенил)уксусная кислота; (3-4-бутилбензил)-(1-метил-1 Н-имидазол-4-сульфонил)амино)метил)фенил)уксусная кислота; и (3-4-диметиламинобензил)-(пиридин-3-сульфонил)амино)метил)фенил)уксусная кислота; (3-4-диметиламинобензил)(пиридин-3-сульфонил)амино)метил)фенокси)уксусная кислота; и (3-4-трет-бутилбензил)-(пиридин-3 сульфонил)амино)метил)фенокси)уксусная кислота; транс-(3-3-(3,5-дихлорфенил)аллил)-(пиридин-3 сульфонил)амино)метил)фенил)уксусная кислота; (3-2-(3,5-дихлорфенокси)этил)-(пиридин-3-сульфонил) амино)метил)фенокси)уксусная кислота; пролекарства перечисленных соединений, а также фармацевтически приемлемые соли соединений и пролекарств. Особенно предпочтительным соединением формулы АА является (3-4-трет-бутилбензил)-(пиридин-3-сульфонил)амино)метил)фенокси)уксусная кислота, ее пролекарства, или фармацевтически приемлемые соли соединения или пролекарств. Особенно предпочтительной солью является натриевая соль. Другой, в основном, предпочтительный класс селективных агонистов рецептора ЕР 2, применимый в аспекте настоящего изобретения, связанном с комбинациями, включает соединения, пролекарства и фармацевтически приемлемые соли приведенной ниже формулы ВВ, которые описаны в переуступлен-4 010424 ном патенте США 6288120, причем определения символов A, B, K, M, Q и Z приведены в патенте. В основном, предпочтительными соединениями формулы ВВ являются 7-[(2'-гидроксиметилбифенил 4-илметил)метансульфониламино]гептановая кислота; 7[4-(3-гидроксиметилтиофен-2-ил)бензил]метансульфониламиногептановая кислота; 7-[(2'-хлорбифенил-4-илметил)метансульфониламино]гептановая кислота; 7-[4-(1-гидроксигексил)бензил]метансульфониламиногептановая кислота; 7-[(4-бутилбензил) метансульфониламино]гептановая кислота; 7-[5-(1-гидроксигексил)тиофен-2-илметил]метансульфониламиногептановая кислота; (3-[(4-бутилбензил)метансульфониламино]метилфенил)уксусная кислота; 7-[3-(3-хлорфенил)пропил]метансульфониламиногептановая кислота; 7-[3-(3,5-дихлорфенил)пропил] метансульфониламиногептановая кислота; 5-(3-[3-(3-хлорфенил)пропил]метансульфониламинопропил) тиофен-2-карбоновая кислота; 7-[2-(3,5-дихлорфенокси)этил]метансульфониламиногептановая кислота; 5-(3-[2-(3,5-дихлорфенокси)этил]метансульфониламинопропил)тиофен-2-карбоновая кислота; N-[2-(3,5 дихлорфенокси)этил]-N-[6-(1 Н-тетразол-5-ил)гексил]метансульфонамид; транс-(4-[3-(3,5-дихлорфенил) аллил]метансульфониламинобутокси)уксусная кислота; транс-N-[3-(3,5-дихлорфенил)аллил]-N-[6-(1 Нтетразолил-5-ил)гексил]метансульфонамид; транс-5-(3-[3-(3,5-дихлорфенил)аллил]метансульфониламинопропил)тиофен-2-карбоновая кислота; транс-[3-([3-(3,5-дихлорфенил)аллил]метансульфониламино метил)фенил]уксусная кислота, пролекарства перечисленных соединений, а также фармацевтически приемлемые соли соединений и пролекарств. Особенно предпочтительным соединением формулы ВВ является 7-[(4-бутилбензил)метансульфониламино]гептановая кислота, ее пролекарства или фармацевтически приемлемые соли соединения и пролекарств. Предпочтительной солью является мононатриевая соль. Другие селективные агонисты рецептора ЕР 2, применимые в аспекте данного изобретения, имеющем отношение к комбинациям, включают агонисты рецептора простагландина, раскрытые в патентах США 6531485, 6376533, 6124314, 5877211, 5716835, 5698598 и 5462968, опубликованной заявке на патент США 2002/187961; N. Duckworth, et al., Journal of Endocrinology, 172 (2), 263-269 (2002); K.and Therapeutics, 11 (3), 447-54 (1995); A.T. Nials, et al., Cardiovascular Drug Reviews, 11 (2), 165-79 (1993); и D.F. Woodward, et al., Prostaglandins, 46 (4), 371-83 (1993). В аспекте данного изобретения, относящемся к комбинациям, агонисты селективного рецептора ЕР 2 могут вводиться млекопитающим в дозах, находящихся в диапазоне от примерно 0,001 до примерно 100 мг/кг массы тела в день. Для нормального взрослого человека, имеющего массу тела примерно 70 кг,как правило, предпочтительна доза в пределах от примерно 0,01 до примерно 50 мг/кг массы тела, однако, может потребоваться некоторое изменение основного диапазона доз, в зависимости от возраста и массы подвергаемого лечению пациента, намеченного пути введения, конкретного вводимого соединения и т.п. Определение диапазонов доз комбинаций и оптимальной дозировки для конкретного субъекта из числа млекопитающих доступно обычному специалисту в той области техники, к которой относится данное описание. Фармацевтические композиции, пригодные для парентеральной инъекции, могут содержать фармацевтически приемлемые стерильные водные или неводные растворы, дисперсии, суспензии или эмульсии, а также стерильные порошки для немедленного восстановления стерильных растворов или дисперсий, пригодных для инъекций. Примеры подходящих водных и неводных носителей, основ и разбавителей включают воду, этанол, полиолы (как, например, пропиленгликоль, полиэтиленгликоль, глицерин и т.п.), их подходящие смеси, растительные масла (как, например, оливковое масло), а также пригодные для инъекций органические сложные эфиры, такие как этилолеат. Надлежащая текучесть может поддерживаться, например, применением покрытий, таких как лецитин, поддержанием требуемого размера частиц в случае дисперсий, а также применением ПАВ. Фармацевтические композиции по настоящему изобретению могут дополнительно содержать вспомогательные средства, такие как консервирующие, смачивающие, эмульгирующие и диспергирующие средства. Предотвращение загрязнения растворимых композиций микроорганизмами может быть осуществлено с помощью различных антибактериальных и противогрибковых средств, например парабенов,хлорбутанола, фенола, сорбиновой кислоты и т.п. Кроме этого может быть желательно включить изотонические средства, например сахара, хлорид натрия и т.п. Пролонгированная абсорбция пригодных для-5 010424 инъекций фармацевтических композиций может быть достигнута применением средств, допускающих замедленную абсорбцию, например моностеарата алюминия или желатина. Твердые дозированные формы для перорального введения включают капсулы, таблетки, порошки и гранулы. В таких твердых дозированных формах активное соединение смешано по крайней мере с одним инертным общепринятым фармацевтическим эксципиентом (или носителем), таким как цитрат натрия или дикальцийфосфат или (а) наполнителями или разбавителями, например крахмалами, лактозой, сахарозой, маннитом и кремниевой кислотой; (b) связующими веществами, например карбоксиметилцеллюлозой, альгинатами, желатином, поливинилпирролидоном, сахарозой и гуммиарабиком; (с) увлажнителями, например глицерином; (d) дезинтегрирующими средствами, например агар-агаром, карбонатом кальция, картофельным крахмалом или крахмалом из маниоки, некоторыми сложными силикатами альгиновой кислоты и карбонатом натрия; (е) замедлителями растворения, например парафином; (f) ускорителями абсорбции, например четвертичными аммониевыми соединениями; (g) смачивающими средствами, например цетиловым спиртом или моностеаратом глицерина; (h) адсорбентами, например каолином и бентонитом; и/или (i) лубрикантами, например тальком, стеаратом кальция, стеаратом магния, твердыми полиэтиленгликолями, лаурилсульфатом натрия или их смесями. В случае капсул и таблеток дозированные формы могут дополнительно содержать буферные средства. Твердые композиции подобного типа также могут применяться в качестве наполнителей в случае мягких или твердых наполненных желатиновых капсул, с применением таких эксципиентов, как лактоза или молочный сахар, а также полиэтиленгликоли высокой молекулярной массы и т.п. Твердые дозированные формы, такие как таблетки, драже, капсулы и гранулы, могут быть получены с покрытиями и оболочками, такими как энтеропокрытия и другие виды покрытий, хорошо известные обычному специалисту в данной области техники. Они также могут включать средства для придания непрозрачности и, кроме этого, принадлежать к числу таких композиций, которые высвобождают активное соединение (соединения) с задержкой, в течение продолжительного времени или контролируемым образом. Примерами относящихся сюда композиций, которые могут быть применены, являются полимерные вещества и воски. Активное соединение (соединения) также может быть представлено в форме микрокапсул, если это уместно, с одним или несколькими из перечисленных выше эксципиентов. Жидкие дозированные формы для перорального введения включают фармацевтически приемлемые эмульсии, растворы, суспензии, сиропы и эликсиры. Помимо активных соединений жидкие дозированные формы могут содержать инертные разбавители, обычно применяемые в технике, например воду или другие растворители, солюбилизирующие средства и эмульгаторы, например этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, диметилформамид, масла, в частности масло хлопчатника, арахисовое масло, масло зародышей пшеницы, оливковое масло, касторовое масло и масло кунжута, глицерин, тетрагидрофурфуриловый спирт, полиэтиленгликоли, а также сложные эфиры жирных кислот и сорбитана или смеси перечисленных веществ и т.п. Кроме названных инертных разбавителей фармацевтическая композиция также может содержать вспомогательные средства, такие как смачивающие средства, эмульгирующие и суспендирующие средства, подсластители, флаворанты и отдушки. Суспензии, помимо активного соединения (соединений), могут дополнительно включать суспендирующие средства, например этоксипроизводные изостеариловых спиртов, сложные эфиры полиоксиэтиленсорбита и сорбитана, микрокристаллическую целлюлозу, метагидроксид алюминия, бентонит, агарагар и трагакант или смеси перечисленных выше веществ и т.п. Композиции для ректального или вагинального введения предпочтительно включают суппозитории, которые могут быть получены смешиванием активного соединения (соединений) с подходящими не раздражающими эксципиентами или носителями, такими как масло какао, полиэтиленгликоль или воск для суппозиториев, которые являются твердыми при обычной комнатной температуре, но жидкими при температуре тела, и, следовательно, плавятся в прямой кишке или вагинальной полости, высвобождая,таким образом, активное соединение. Дозированные формы для местного введения могут включать мази, порошки, аэрозоли и средства для ингаляции. Активное соединение (соединения) в стерильных условиях смешивают с фармацевтически приемлемым носителем, основой или разбавителем, а также любыми консервантами, буферами или пропеллентами, которые могут потребоваться. В основном, предпочтительные композиции для введения ингибиторов PDE 2, содержащие соединения формулы (I), а также комбинации, включающие ингибиторы PDE 2 и селективные агонисты рецептора ЕР 2, при лечении переломов костей содержат пригодные для инъекции текучие композиции, которые обеспечивают продолжительное высвобождение действующего начала непосредственно в месте инъекции, за счет образования биоразлагаемого депо в виде твердого вещества или геля, а также матрицы или имплантата. Примеры подобной системы введения включают систему доставки с медленным высвобождением на основе биоразлагаемого полимера. См., например, опубликованную заявку на патент США 2003-0104031 А 1. Подобная система доставки на основе полимеров обычно содержит терапевтически полезное сред-6 010424 ство (средства), растворенное или диспергированное в текучем, биоразлагаемом, термопластичном растворе или дисперсии полимера в органическом растворителе. При введении композиции органический растворитель диффундирует от места инъекции, вызывая превращение полимера в осадок или гель, что приводит к захвату молекул лекарственного средства (средств) в депо длительного высвобождения. Впоследствии лекарственное средство (средства) высвобождается за счет диффузии из полимерной матрицы и ее разрушения. Матрица медленно разрушается в результате гидролиза и, в конце концов, исчезает с места введения. Высвобождение лекарственного средства (средств) in vivo, а также скорость разрушения матрицы можно контролировать за счет изменения молекулярной массы и концентрации полимера. Системы доставки на основе полимеров обеспечивают пациенту в случае необходимости непрерывное высвобождение действующего средства (средств) in vivo в течение длительного периода времени с минимальным или незначительным всплеском выделения. Значительный всплеск выделения действующего лекарственного средства (средств) мог бы привести к плохой местной переносимости из-за локальных воздействий (например, раздражения) и мог бы уменьшить количество лекарственного средства(средств), доступного для целевого воздействия. Преимущество, которое предоставляет такой способ введения, заключается в том, что он минимизирует или сокращает исходный всплеск, но по-прежнему доставляет лекарственное средство (средства) в эффективных количествах в течение продолжительного периода времени после одной местной инъекции. Полимерную систему получают контактированием текучей композиции и гелеобразующей среды для коагуляции или образования геля, с превращением композиции в твердую микропористую полимерную матрицу или гелевую полимерную матрицу. Текучая композиция содержит термопластичный полимер или сополимер в сочетании с подходящим растворителем. Полимеры или сополимеры, которые образуют тело матрицы, являются, по существу, нерастворимыми, предпочтительно, по существу, полностью нерастворимыми в воде и жидких средах организма. Нерастворимость тела матрицы позволяет ей действовать в качестве единого центра контролируемого высвобождения лекарственного средства(средств). Кроме этого полимеры или сополимеры являются биосовместимыми и биоразлагаемыми и/или биоразрушаемыми в теле животного, например млекопитающего. Разрушение под действием биологической среды делает возможным усвоение и выведение полимерной матрицы пациентом, так что отсутствует необходимость ее хирургического удаления. Благодаря тому, что текучая композиция и полимерная система являются биосовместимыми, процесс введения полимерной системы и ее присутствие в организме не вызывают существенного раздражения или некроза тканей в месте нахождения имплантата. Композицию по настоящему изобретению вводят в виде текучей композиции непосредственно в ткани тела. Термопластичные полимеры, которые подходят для включения в твердые матрицы систем с контролируемым высвобождением, являются твердыми, фармацевтически совместимыми и биоразрушаемыми под действием клеток и/или под действием жидких сред организма. Примеры подходящих термопластичных полимеров включают сложные полиэфиры диолов и дикарбоновых кислот или гидроксикарбоновых кислот, такие как полилактиды, полигликолиды и их сополимеры. Более предпочтительно полимеры включают сополимеры полимолочная-согликолевая кислота (сокращенно PLGH), которые при гидролизе образуют молочную и гликолевую кислоты. Всплеск высвобождения из этого сополимера может быть дополнительно уменьшен добавлением полиэтиленгликоля (PEG) для образования молекулPLGH с включением PEG в концевую часть. Предпочтительные вещества включают полилактиды, полигликолиды и их сополимеры. Данные полимеры могут применяться для улучшения действия полимерной системы, в частности, благодаря тому, что они демонстрируют прекрасную биосовместимость. Они вызывают незначительные, если вообще вызывают, воспаление, раздражение, некроз или токсическое поражение тканей. В присутствии воды эти полимеры выделяют, соответственно, молочную или гликолевую кислоты, которые легко усваиваются. Полилактиды также могут включать мономеры гликолидов для улучшения итогового распада полимеров. Кроме этого данные полимеры являются предпочтительными благодаря тому, что с их помощью можно эффективно контролировать скорость высвобождения лекарственного средства (средств) из полимерной системы, и благодаря тому, что они приводят к локальному удерживанию лекарственного средства (средств) в месте введения. Растворимость и смешиваемость термопластичных полимеров с органическим растворителем композиции будет меняться в соответствии с такими факторами, как кристалличность, гидрофильность, способность к образованию водородных связей, а также молекулярная масса полимера. Следовательно, для достижения желаемой смешиваемости, а также желаемой скорости высвобождения включенного в состав лекарственного средства (средств) регулируют молекулярную массу полимера и его концентрацию в растворителе. Текучие композиции термопластичного полимера, растворителя и лекарственного средства(средств) включают стабильные текучие вещества. Предпочтительно образуется гомогенный раствор лекарственного средства (средств) в органическом растворителе. Термопластичный полимер в значительной степени растворим в органическом растворителе. При помещении текучей композиции в организм растворитель удаляется и полимер твердеет или превращается в гель с образованием полимерной системы, содержащей лекарственное средство (средства) в твердой или гелеобразной полимерной матрице.-7 010424 В случае некоторых предпочтительных полимеров для эффективного продолжительного высвобождения соединения, способствующего росту костей, молекулярную массу полимера или сополимера подбирают таким образом, чтобы собственная вязкость находилась в пределах примерно от 0,2 до 0,4 I.V.(собственная вязкость, выражена в дл/г). Стандартная скорость высвобождения входящего в состав лекарственного средства (средств) наблюдается при I.V. примерно 0,2 (при молекулярных массах от примерно 8000 до примерно 16000) или примерно 0,3 (при молекулярных массах от примерно 23000 до примерно 45000), но она может изменяться в зависимости от конкретных компонентов композиции. Для большинства систем предпочтительно подобрать молекулярную массу полимера, соответствующую I.V. примерно 0,2, для эффективного продолжительного высвобождения лекарственного средства (средств). Для поли(DL-лактида) или полимерной системы лактид-согликолид желательный диапазон молекулярных масс составляет от примерно 0,2 до примерно 0,4 I.V., причем предпочтительным является I.V. приблизительно 0,2. Молекулярная масса полимера может быть изменена стандартными способами. Особенно предпочтительные коммерчески доступные термопластичные полимеры включают следующие: сополимер PLGH с соотношением молочной и гликолевой кислот 1:1 и собственной вязкостью примерно 0,2 дл/г (коммерчески доступный от Boehringer Ingelheim как Copolymer RESOMER RG 502 H)(молекулярная масса около 12000); сополимер PLGH с соотношением молочной и гликолевой кислот 1:1 и собственной вязкостью примерно 0,3 дл/г (коммерчески доступный от Boehringer Ingelheim как CopolymerRESOMER RG 503 H) (молекулярная масса около 37000); сополимер PLGH с соотношением молочной и гликолевой кислот 1:1 и собственной вязкостью примерно 0,4 дл/г (коммерчески доступный от BoehringerIngelheim как Copolymer RESOMER RG 504 H) (молекулярная масса около 47000); и сополимер PLGH с присоединенным к концу молекулы полиэтиленгликолем (PEG), соотношением молочной и гликолевой кислот 1:1 и собственной вязкостью примерно 0,79 дл/г (коммерчески доступный от Boehringer Ingelheim как PLG-PEG) (молекулярная масса около 52000). Растворители, применяемые в термопластичных композициях, предпочтительно являются фармацевтически приемлемыми, биосовместимыми и способными рассеиваться в жидких средах организма insitu, так что они могут быть классифицированы как имеющие растворимость в воде от высокой до нерастворимых. Предпочтительно они вызывают относительно небольшое, если вообще наблюдаемое, раздражение или некроз тканей в месте инъекции и имплантации. Предпочтительно растворитель имеет, по крайней мере, минимальный уровень растворимости в воде. Если органический растворитель нерастворим или минимально растворим в воде, он будет медленно вымываться из текучей полимерной композиции. В результате этого имплантат в процессе своего существования может содержать различные количества остаточного растворителя. Предпочтительно органический растворитель имеет уровень растворимости в воде от умеренного до высокого, так что он будет легко вымываться из полимерной композиции в жидкие среды организма. Наиболее предпочтительно, если растворитель быстро удаляется из полимерной композиции, для быстрого образования твердого имплантата. По ходу удаления растворителя, термопластичный полимер коагулирует или образует гель, превращаясь в твердую полимерную систему. Предпочтительно, т.к. термопластичный полимер коагулирует, удаление растворителя вызывает образование пор внутри полимерной системы. В результате текучая композиция, содержащая термопластичный полимер, растворитель и лекарственное средство (средства), образует пористую твердую полимерную систему. Кроме этого, если растворитель слабо растворим или нерастворим в воде, вымывание растворителя может вести к образованию твердого пористого имплантата или, если часть растворителя остается в имплантате, результат может заключаться в образовании гелевого имплантата, содержащего незначительное количество или не содержащего пор. Подходящие растворители включают такие жидкие органические соединения, которые удовлетворяют приведенным выше критериям. В основном, предпочтительные растворители включают N-метил-2 пирролидон (NMP). Растворители для текучих композиций термопластичных полимеров выбирают с точки зрения совместимости и надлежащей растворимости полимера и растворителя. Термопластичные полимеры с более низкой молекулярной массой, как правило, легче растворяются в растворителях, чем полимеры с высокой молекулярной массой. В результате концентрация термопластичного полимера, растворенного в различных растворителях, различается в зависимости от типа полимера и его молекулярной массы. Наоборот, термопластичные полимеры с более высокой молекулярной массой склонны быстрее коагулировать, образовывать гели или затвердевать по сравнению с термопластичными полимерами с очень низкой молекулярной массой. Кроме того, полимеры с более высокой молекулярной массой склонны образовывать растворы с более высокими вязкостями по сравнению с веществами низкой молекулярной массы. Таким образом, для высокой эффективности инъекции, кроме оптимальной скорости высвобождения,контролируют молекулярную массу и концентрацию полимера в растворителе. При образовании полимерной системы из текучей композиции лекарственное средство (средства) оказывается заключенным в полимерную матрицу. После введения текучей композиции для образования полимерной системы лекарственное средство (средства) высвобождается из матрицы в близлежащие ткани или жидкие среды за счет механизмов диффузии и распада. Управление этими механизмами также-8 010424 может влиять на высвобождение лекарственного средства (средств) в окружающую среду с контролируемой скоростью. Например, можно выбрать такой состав полимерной матрицы, чтобы она распадалась после того, как эффективное и/или значительное количество лекарственного средства (средств) высвобождено из матрицы. Таким образом, высвобождение лекарственного средства (средств) из матрицы можно изменять за счет, например, растворимости лекарственного средства (средств) в воде, распределения соединений, стимулирующих рост костей в матрице, или, среди прочих факторов, за счет размера,формы, пористости, растворимости и биоразрушаемости полимерной матрицы. Высвобождение лекарственного средства (средств) из матрицы контролируется относительно естественной скорости за счет изменения молекулярной массы полимера для обеспечения желательной продолжительности и скорости высвобождения. Например, предпочтительные дозированные формы лекарственного средства (средств) включают лиофилизованное соединение, предназначенное для восстановления перед введением раствором PLGH вNMP. Дозированная форма, состоящая из лиофилизованного соединения в одном шприце (шприц А) и раствора PLGH в NMP во втором шприце (шприц В), известна как система восстановления А/В. Содержимое обоих шприцов смешивают непосредственно перед введением дозы в необходимое место или рядом с ним. После восстановления содержимое переносят в градуированный дозирующий шприц для введения. Введенные дозированные формы будут представлять собой раствор, и в результате будет получена дисперсия соединения с PLGH в NMP в желаемых концентрациях, например 5 и 50 мгА/мл (мгА/мл относится к эквиваленту свободной кислоты в форме натриевой соли лекарственного средства (средств. Дозированная форма представляет собой состав для парентеральной (например, подкожной, внутримышечной или внутрикостной) инъекции с продолжительным высвобождением для местного введения. Данное соединение в составе полимерной матрицы с медленным высвобождением (депо-инъекция) предназначена для введения в требуемое место или рядом с ним, и не предназначена для внутривенного введения. Для обеспечения достаточной устойчивости подобной дозированной формы при хранении может быть использована описанная выше система двух шприцев, предпочтительно с использованием соединения в форме натриевой соли. Композиция в виде одной фазы, предпочтительно содержащая соединение в форме свободной кислоты, представляет собой предпочтительную альтернативную композицию. Основанное на устойчивости лекарственного средства (средств) и полимера, стерильное фильтрование лекарственного средства (средств) и облучение раствора полимера может быть предпочтительным для производства стабильного стерильного продукта. В одном из вариантов осуществления дозированная форма может быть произведена и доставлена потребителю в виде отдельных алюминиевых пакетов, содержащих шприцы, заполненные лиофильной формой лекарственного средства (средств), в одном пакете и раствор полимера в другом пакете. Емкости для доставки, системы и способы лиофилизации соединений, стимулирующих рост костей, описаны в опубликованной международной патентной заявке WO 01/73363. Другие способы введения включают местное введение путем инъекции в конкретное место или доставки в конкретное место с помощью катетера. Дополнительные примеры можно найти в предварительной заявке США 60/335156, поданной 30 ноября 2001 г. Содержание всех патентов США, номера которых указаны в настоящей заявке, включено в заявку во всей полноте с помощью ссылок. Соединения формулы (I), их пролекарства, а также фармацевтически приемлемые соли соединений и пролекарств могут быть получены в соответствии с типовыми путями синтеза, раскрытыми ниже на схемах и в примерах, а также с помощью других общепринятых препаративных органических методик,известных или очевидных специалисту в данной области техники в свете настоящего описания. Раскрытые в данных схемах способы предназначены служить примерами, иллюстрирующими настоящее изобретение, и никоим образом не должны истолковываться как ограничения объема изобретения. Схема 1 На стадии 1 схемы 1, 2,4-дихлорпиридо[2,3-d]пиримидин (IV) вводят во взаимодействие с соответствующим образом замещенным бензиламином (V) в присутствии в качестве основания третичного амина, например триэтиламина (TEA) или диизопропилэтиламина (DIPEA), или ароматического основания,-9 010424 например пиридина. Реакцию, как правило, проводят в полярном спиртовом растворителе, таком как метанол (МеОН), этанол (EtOH) или изопропанол (IPA), при температуре, находящейся в пределах от примерно 0 до примерно 100 С. Предпочтительно реакцию проводят в присутствии DIPEA в этаноле при температуре, приблизительно равной комнатной (RT). Затем на стадии 2 для получения соединения (I) итоговый продукт конденсации (VI) вводят во взаимодействие с соответствующим образом замещенным амином (VII) в присутствии в качестве основания третичного амина, такого как TEA или DIPEA, или ароматического основания, такого как пиридин. Реакцию, как правило, проводят в апротонном полярном растворителе, таком как диметилформамид (ДМФА), диметилсульфоксид (ДМСО), N-метилпирролидинон или сульфолан при повышенной температуре, находящейся в пределах от примерно 60 до примерно 250 С. Предпочтительно реакцию проводят в ДМСО в присутствии DIPEA при температуре от примерно 90 до примерно 120 С. Хотя схема 1 изображена в виде дискретного двухстадийного процесса, в котором промежуточное соединение (VI) выделяют и затем вводят во взаимодействие с амином (VII), также было найдено, что удобно получать и осуществлять реакцию соединения (IV) с амином (VII) in situ в одну стадию. В таком способе применяют апротонный растворитель, предпочтительно ДМСО. Реакцию также проводят в присутствии DIPEA в ДМСО при температуре от примерно 90 до примерно 120 С. Экспериментальная часть Если не указано иначе, все использованные реактивы были получены на коммерческой основе. Если не указано иначе, используемые далее в описании экспериментов сокращения имеют приведенные ниже значения: АсОН - уксусная кислотаLAH - литийалюминийгидрид м - минута (минуты) МС - масс-спектрометрия ЯМР - ядерный магнитный резонанс ТГФ - тетрагидрофуранp-TsOH - п-толуолсульфоновая кислота Синтез 1. (2-Хлорпиридо[2,3-d]пиримидин-4-ил)-(3,5-диметоксибензил)амин. К перемешиваемому раствору 2,4-дихлорпиридо[2,3-d]пиримидина (1,3 г, 6,7 ммоль) и 3,5-диметоксибензиламина (1,1 г, 6,7 ммоль) в 30 мл EtOH при комнатной температуре добавляют TEA (4 мл, 28,7 ммоль). Образовавшийся осадок отфильтровывают и промывают холодным этанолом и затем гексаном, получая 1,8 г соединения, указанного в заглавии (82%) в виде твердого вещества. Т.пл. 185 С (с разложением). 1 Н ЯМР (ДМСО-d6) : 9,5 (т, 1 Н), 8,9 (дд, 1 Н), 8,7 (дд, 1 Н), 7,5 (м, 1 Н), 6,5 (д, 2 Н), 6,4 (т, 1 Н), 4,6 (д, 2 Н), 3,7(с, 6 Н). МС (m/z, %): 331 (100). Синтез 2. (2-Хлорпиридо[2,3-d]пиримидин-4-ил)-(3,4-диметоксибензил)амин. Данное соединение получают способом, аналогичным описанному в синтезе 1, используя соответствующие исходные вещества. 1 Н ЯМР (ДМСО-d6) : 9,5 (т, 1 Н), 8,9 (дд, 1 Н), 8,7 (дд, 1 Н), 7,0 (с, 1 Н), 6,9(д, 2 Н), 4,6 (д, 2 Н), 3,7 (с, 3 Н). МС (m/z, %): 331 (100). Синтез 3. 2-(4-Аминометилфенил)пропан-2-ол. К перемешиваемому раствору 4-(1-гидрокси-1-метилэтил)бензонитрила (2,0 г, 12,4 ммоль) в 30 мл ТГФ при 0 С добавляют по каплям 1,0 н. литийалюминийгидрид в ТГФ (26 мл, 26,1 ммоль). Смесь оставляют нагреваться до комнатной температуры и затем кипятят с обратным холодильником в течение 20 мин. Затем смесь охлаждают до 0 С и гасят 5 мл МеОН, добавляя его по каплям. Смесь разбавляют 300 мл хлороформа, промывают водой (180 мл), высушивают над сульфатом магния и концентрируют, получая 1,9 г (95%) указанного в заглавии соединения в виде твердого вещества. 1 Н ЯМР (CDCl3) : 7,45 (д, 2 Н),7,26 (д, 2 Н), 3,83 (с, 2 Н), 1,57 (с, 6 Н). ГХ-МС (m/е, %): 164 (М+, 15), 150 (80), 132 (75), 106 (100). Синтез 4. 3-(4-Ацетилфенил)пропионитрил. Смесь 4-(2-бромэтил)ацетофенона (2,0 г, 8,8 ммоль) и KCN (0,6 г, 8,8 ммоль) нагревают в 30 мл ДМСО при 75 С в течение 4 ч. Реакционную смесь разбавляют водой и экстрагируют EtOAc. Органический экстракт последовательно промывают водой и насыщенным раствором соли, высушивают и концентрируют, получая масло. Хроматография на силикагеле с использованием в качестве элюента 40%(т, 2 Н), 2,6 (с, 3 Н). ГХ-МС (m/е, %): 173 (М+, 20), 158 (100). Синтез 5. 3-[4-(1-Гидрокси-1-метилэтил)фенил]пропионитрил. К перемешиваемому 3 М раствору метилмагнийхлорида в ТГФ (3,3 мл, 9,8 ммоль), дополнительно разбавленному 10 мл ТГФ, по каплям при -40 С добавляют раствор 3-(4-ацетилфенил)пропионитрила(0,7 г, 3,9 ммоль) в 10 мл ТГФ. Реакционную смесь оставляют медленно нагреваться до комнатной температуры в течение ночи, охлаждают до 0 С, затем гасят, добавляя по каплям водный раствор АсОН. Реакционную смесь разбавляют водой и экстрагируют EtOAc. Органический экстракт последовательно промывают водой и насыщенным раствором соли, высушивают и концентрируют, получая 0,8 г масла. 1 Н ЯМР (CD3OD) : 7,4 (д, 2 Н), 7,2 (д, 2 Н), 2,9 (т, 2 Н), 2,7 (т, 2 Н), 1,5 (с, 6 Н). ГХ-МС (m/е, %): 189 (М+,5), 174 (100). Синтез 6. 2-[4-(3-Аминопропил)фенил]пропан-2-ол. К перемешиваемому 1 М раствору литийалюминийгидрида в ТГФ, дополнительно разбавленному 20 мл ТГФ, при 0 С по каплям добавляют раствор 3-[4-(1-гидрокси-1-метилэтил)фенил]пропионитрила (0,8 г,4,0 ммоль) в 10 мл ТГФ. Реакционную смесь оставляют медленно нагреваться до комнатной температуры, затем 4 ч кипятят с обратным холодильником. После этого реакционную смесь охлаждают до 0 С и гасят, медленно по каплям добавляя МеОН. Смесь разбавляют хлороформом и промывают водой. Органический экстракт фильтруют через диатомовую землю, фильтрат концентрируют, затем разбавляют этилацетатом, высушивают и концентрируют, получая 0,5 г масла. 1 Н ЯМР (CD3OD) : 7,4 (д, 2 Н), 7,1 (д, 2 Н), 2,6 (м, 2 Н), 1,7 (м, 2 Н), 1,5 (с, 6 Н). МС (m/е, %): 194(М +1, 100), 176 (90). Синтез 7. 3-[4-(2-Метил[1,3]диоксолан-2-ил)фенил]пропионитрил. Смесь 3-(4-ацетилфенил)пропионитрила (2,2 г, 13 ммоль), этиленгликоля (2,8 мл, 51 ммоль) и каталитического количества p-TsOH (200 мг) кипятят в 100 мл толуола с обратным холодильником и ловушкой Дина-Старка в течение 18 ч. Смесь разбавляют EtOAc и последовательно промывают 5% раствором бикарбоната, водой и насыщенным раствором соли, высушивают (MgSO4) и концентрируют, получая масло. Хроматография на силикагеле при элюировании смесью EtOAc/гексан дает 2,5 г масла. 1 Н ЯМР (CDCl3) : 7,4 (д, 2 Н), 7,2 (д, 2 Н), 4,0 (м, 2 Н), 3,8 (м, 2 Н), 2,9 (т, 2 Н), 2,6 (т, 2 Н), 1,6 (с, 3 Н). МС (m/е,%): 216 (М+-1, 1), 202 (100). Синтез 8. 3-[4-(2-Метил[1,3]диоксолан-2-ил)фенил]пропиламин. К перемешиваемому раствору 3-[4-(2-метил[1,3]диоксолан-2-ил)фенил]пропионитрила (2,4 г, 11 ммоль) в 30 мл ТГФ по каплям добавляют 1 М раствор литийалюминийгидрида в ТГФ. Смесь оставляют нагреваться до комнатной температуры, затем кипятят с обратным холодильником в течение 1 ч. Смесь охлаждают до 0 С, затем гасят добавляемым по каплям МеОН. Смесь разбавляют хлороформом и промывают водой. Полученную суспензию фильтруют через диатомовую землю и собирают слои фильтрата. Органический экстракт высушивают над MgSO4 и концентрируют, получая 2,4 г масла. 1 Н ЯМР (CDCl3) : 7,4(м, 2 Н), 7,1 (д, 2 Н), 4,0 (м, 2 Н), 3,8 (м, 2 Н), 2,7 (м, 2 Н), 2,6 (м, 2 Н), 1,7 (м, 2 Н), 1,6 (с, 3 Н). МС (m/е, %): 221 (М+, 10), 206 (60), 189 (100). Синтез 9. 2,2,2-Трифтор-1-(4-йодфенил)этанол. К перемешиваемому раствору 4-йодбензальдегида (2,0 г, 8,6 ммоль) в 20 мл ТГФ при комнатной температуре добавляют 0,5 М раствор триметил(трифторметил)силана в ТГФ (19 мл, 9,5 ммоль) и затем тетрабутиламмонийфторид (112 мг, 0,4 ммоль). Смесь перемешивают в течение ночи при комнатной температуре, выливают в 0,1 н. раствор соляной кислоты и экстрагируют EtOAc. Органический экстракт по очереди промывают водой и насыщенным раствором соли, высушивают (MgSO4) и концентрируют,получая 2,6 г масла. 1 Н ЯМР (CDCl3) : 7,7 (д, 2 Н), 7,2 (д, 2 Н), 5,0 (м, 1 Н), 2,7 (д, 1 Н). МС (m/е, %): 302(М+, 100), 233 (100). Синтез 10. 2-3-[4-(2,2,2-Трифтор-1-гидроксиэтил)фенил]проп-2-инилизоиндол-1,3-дион. К перемешиваемой суспензии 2,2,2-трифтор-1-(4-йодфенил)этанола (2,6 г, 8,5 ммоль), N-пропаргилфталимида (1,6 г, 8,5 ммоль), дихлор-бис-(трифенилфосфин)палладия (298 мг, 0,43 ммоль) и йодида меди(I) (82 мг, 0,43 ммоль) в 20 мл ТГФ при комнатной температуре добавляют 5 мл TEA. Из смеси быстро удаляют воздух, пропуская ток азота, и затем кипятят в течение 6 ч. Смесь разбавляют хлороформом,промывают водой, высушивают над MgSO4 и концентрируют, получая твердое вещество. Затем его растирают с EtOAc, что позволяет получить 2,2 г твердого вещества. 1 Н ЯМР (CDCl3) : 7,9 (м, 2 Н), 7,7 (м,2 Н), 7,5 (д, 2 Н), 7,4 (д, 2 Н), 5,0 (м, 1 Н), 4,7 (с, 2 Н). МС (m/е, %): 359 (М+, 100). Синтез 11. 2-3-[4-(2,2,2-Трифтор-1-гидроксиэтил)фенил]пропилизоиндол-1,3-дион. Смесь 2-3-[4-(2,2,2-трифтор-1-гидроксиэтил)фенил]проп-2-инилизоиндол-1,3-диона (2,2 г, 6,1 ммоль) и 10% Pd/C (220 мг) в 150 мл EtOH и 150 мл ТГФ встряхивают в аппарате Парра при давлении водорода 50 фунт/кв.дюйм и комнатной температуре в течение 2 ч. Добавляют еще 220 мг 10% Pd/C и смесь встряхивают при давлении водорода 50 фунт/кв.дюйм и комнатной температуре в течение еще 2 ч. Затем добавляют еще 220 мг 10% Pd/C и смесь встряхивают при давлении водорода 50 фунт/кв.дюйм и комнатной температуре в течение ночи. Смесь фильтруют через диатомовую землю и фильтрат концентрируют, получая масло. Хроматография на силикагеле при элюировании смесью EtOAc/гексан дает 1,8 г масла. 1 Н ЯМР (CDCl3) : 7,8 (м, 2 Н), 7,7 (м, 2 Н), 7,3 (д, 2 Н), 7,2 (д, 2 Н), 4,9 (м, 1 Н), 3,7 (т, 2 Н), 2,7 (т,2 Н), 2,0 (м, 2 Н). МС (m/е, %): 363 (М+, 15), 345 (35), 325 (50), 161 (100). Синтез 12. 1-[4-(3-Аминопропил)фенил]-2,2,2-трифторэтанол. К перемешиваемой суспензии 2-3-[4-(2,2,2-трифтор-1-гидроксиэтил)фенил]пропилизоиндол-1,3- 11010424 диона (1,8 г, 5,0 ммоль) в 50 мл МеОН при комнатной температуре добавляют гидразингидрат (0,46 мл,15,0 ммоль). Смесь перемешивают при комнатной температуре в течение 18 ч. Затем реакционную смесь фильтруют и фильтрат концентрируют, получая масло. Масло растирают с хлороформом, фильтруют и фильтрат концентрируют, получая 1,0 г масла. 1 Н ЯМР (CDCl3) : 7,3 (д, 2 Н), 7,2 (д, 2 Н), 5,0 (м, 1 Н), 2,6(м, 2 Н), 2,5 (м, 2 Н), 1,6 (м, 2 Н). МС (m/е, %): 363 (М+, 10), 216 (100). Синтез 13. Бензо[1,2,5]оксадиазол-5-иловый эфир трифторметансульфоновой кислоты. К перемешиваемому раствору 5-гидроксибензофуразана (1,8 г, 13,0 ммоль), TEA (2,4 мл, 33,0 ммоль) и DMAP (79 мг, 7,0 ммоль) в 40 мл дихлорметана при -78 С по каплям добавляют раствор ангидрида трифторметансульфоновой кислоты (2,8 мл, 17,0 ммоль) в 10 мл дихлорметана. Смеси дают медленно нагреться до комнатной температуры в течение 3 ч, разбавляют дихлорметаном и промывают водой. Органический экстракт высушивают и концентрируют, получая масло. Хроматография на силикагеле при элюировании дихлорметаном дает 3,1 г масла. 1 Н ЯМР (CDCl3) : 8,0 (дд, 1 Н), 7,8 (дд, 1 Н), 7,3 (дд, 1 Н). МС (m/е, %): 268 (М+, 60), 146 (60), 69 (100). Синтез 14. 2-(Бензо[1,2,5]оксадиазол-5-илпроп-2-инил)изоиндол-1,3-дион. Данное соединение получают способом, аналогичным способу синтеза 10, используя соответствующие исходные вещества. 1 Н ЯМР (CDCl3) : 8,2 (с, 1 Н), 8,0 (дд, 1 Н), 7,9 (м, 2 Н), 7,8 (м, 2 Н), 7,5 (дд,2 Н), 4,7 (с, 2 Н). МС (m/е, %): 303 (М+, 100). Синтез 15. 2-(3-Бензо[1,2,5]оксадиазол-5-илпропил)изоиндол-1,3-дион. Данное соединение получают способом, аналогичным способу синтеза 11, используя соответствующие исходные вещества. 1 Н ЯМР (CDCl3) : 7,8 (м, 2 Н), 7,7 (м, 3 Н), 7,6 (с, 1 Н), 7,2 (м, 1 Н), 3,8 (т, 3 Н),2,8 (т, 2 Н), 2,1 (м, 2 Н). МС (m/е, %): 307 (М+, 40), 290 (30), 272 (20), 160 (100). Синтез 16. 3-Бензо[1,2,5]оксадиазол-5-илпропиламин. Данное соединение получают способом, аналогичным способу синтеза 12, используя соответствующие исходные вещества. 1 Н ЯМР (ДМСО-d6) : 7,9 (м, 2 Н), 7,7 (м, 1 Н), 7,5 (м, 1 Н), 2,7 (м, 2 Н), 2,5 (м,2 Н), 1,7 (м, 2 Н). МС (m/е, %): 177 (М+, 40), 160 (100). Синтез 17. Бензотиазол-6-иловый эфир трифторметансульфоновой кислоты. Данное соединение получают способом, аналогичным способу синтеза 13, используя соответствующие исходные вещества. 1 Н ЯМР (CDCl3) : 9,1 (с, 1 Н), 8,2 (д, 1 Н), 7,9 (д, 1 Н), 7,4 (дд, 1 Н). МС (m/е,%): 283 (М+, 80), 150 (100). Синтез 18. 2-(3-Бензотиазол-6-илпроп-2-инил)изоиндол-1,3-дион. Данное соединение получают способом, аналогичным способу синтеза 10, используя бензотиазол 6-иловый эфир трифторметансульфоновой кислоты (синтез 17) вместо 2,2,2-трифтор-1-(4-йодфенил)этанола. 1 Н ЯМР (ДМСО-d6) : 9,4 (с, 1 Н), 8,3 (д, 1 Н), 8,0 (д, 2 Н), 7,9 (м, 1 Н), 7,8 (м, 2 Н), 7,5 (дд, 1 Н), 4,6 (с,2 Н). МС (m/е, %): 318 (М+, 100). Синтез 19. 2-(3-Бензотиазол-6-илпропил)изоиндол-1,3-дион. Данное соединение получают способом, аналогичным способу синтеза 11, используя 2-(3-бензотиазол-6-илпроп-2-инил)изоиндол-1,3-дион (синтез 19) вместо 2-3-[4-(2,2,2-трифтор-1-гидроксиэтил)фенил]проп-2-инилизоиндол-1,3-диона (синтез 10). 1 Н ЯМР (CDCl3) : 8,9 (с, 1 Н), 8,0 (д, 1 Н), 7,8 (м, 2 Н),7,7 (м, 2 Н), 7,3 (дд, 1 Н), 3,8 (т, 2 Н), 2,8 (т, 2 Н), 2,1 (м, 2 Н). МС (m/е, %): 322 (М+, 80), 174 (40), 162 (100). Синтез 20. 3-Бензотиазол-6-илпропиламин. Данное соединение получают способом, аналогичным способу синтеза 12, используя 2-(3-бензотиазол-6-илпропил)изоиндол-1,3-дион (синтез 20) вместо 2-3-[4-(2,2,2-трифтор-1-гидроксиэтил)фенил]пропилизоиндол-1,3-диона (синтез 11). МС (m/е, %): 192 (М+, 20), 175 (100). Синтез 21. 2-(3-Йодфенил)-2-метил[1,3]диоксолан. Смесь 3-йодацетофенона (3,0 г, 12 ммоль), этиленгликоля (2,7 мл, 48 ммоль) и п-толуолсульфоновой кислоты (30 мг) кипятят с обратным холодильником и ловушкой Дина-Старка в 50 мл толуола в течение 18 ч. Смесь разбавляют EtOAc и последовательно промывают 5% раствором бикарбоната натрия,водой и насыщенным раствором соли, высушивают над MgSO4 и концентрируют, получая масло. Хроматография на силикагеле с элюированием смесью EtOAc/гексан дает 3,1 г масла. 1 Н ЯМР (CDCl3) : 7,8 (м,1 Н), 7,6 (дд, 1 Н), 7,4 (дд, 1 Н), 7,0 (м, 1 Н), 4,0 (м, 2 Н), 3,7 (м, 2 Н), 1,6 (с, 3 Н). МС (m/е, %): 290 (М+, 20),275 (100). Синтез 22. 2-3-[3-(2-Метил[1,3]диоксолан-2-ил)фенил]проп-2-инилизоиндол-1,3-дион. Данное соединение получают способом, аналогичным способу синтеза 10, используя 2-(3 йодфенил)-2-метил[1,3]диоксолан (синтез 21) вместо 2,2,2-трифтор-1-(4-йодфенил)этанола. 1H ЯМР(CDCl3) : 7,9 (м, 2 Н), 7,7 (м, 2 Н), 7,5 (с, 2 Н), 7,4 (м, 1 Н), 7,3 (м, 1 Н), 7,2 (м, 1 Н), 4,7 (с, 2 Н), 4,0 (м, 2 Н),3,7 (м, 2 Н), 1,6 (с, 6 Н). МС (m/е, %): 347 (М+, 15), 332 (100). Синтез 23. 2-3-[3-(2-Метил[1,3]диоксолан-2-ил)фенил]пропилизоиндол-1,3-дион. Данное соединение получают способом, аналогичным способу синтеза 11, используя 2-3-[3-(2 метил[1,3]диоксолан-2-ил)фенил]проп-2-инилизоиндол-1,3-дион (синтез 22) вместо 2-3-[4-(2,2,2-трифтор-1-гидроксиэтил)фенил]проп-2-инилизоиндол-1,3-диона (синтез 10). 1 Н ЯМР (CDCl3) : 7,8 (м, 2 Н),7,7 (м, 2 Н), 7,2 (м, 4 Н), 7,1 (д, 1 Н), 4,0 (м, 2 Н), 3,7 (м,4 Н), 2,6 (т, 2 Н), 2,0 (м, 2 Н), 1,6 (с, 3 Н). МС (m/е, %):- 12010424 351 (М+, 5), 336 (100). Синтез 24. 3-[3-(2-Метил[1,3]диоксолан-2-ил)фенил]пропиламин. Данное соединение получают способом, аналогичным способу синтеза 12, используя 2-3-[3-(2 метил[1,3]диоксолан-2-ил)фенил]пропилизоиндол-1,3-дион (синтез 23) вместо 2-3-[4-(2,2,2-трифтор-1 гидроксиэтил)фенил]пропилизоиндол-1,3-диона. 1 Н ЯМР (CDCl3) : 7,3 (м, 3 Н), 7,1 (дд, 1 Н), 4,0 (м, 2 Н),3,8 (м, 2 Н), 2,7 (т, 2 Н), 2,6 (т, 2 Н), 1,8 (м, 2 Н), 1,6 (с, 3 Н). МС (m/е, %): 221 (М+, 20), 206 (60), 189 (100). Синтез 25. 2-(3-Йодфенил)пропан-2-ол. К перемешиваемому раствору метилмагнийхлорида (65 ммоль) в 100 мл ТГФ при 0 С по каплям добавляют 3-йодацетофенон (4,0 г, 16,3 ммоль). Реакционной смеси дают нагреться до комнатной температуры, затем охлаждают до 0 С и добавляют еще 1 экв. метилмагнийхлорида. Смеси дают нагреться до комнатной температуры и перемешивают в течение 5 ч. Реакционную смесь гасят МеОН, разбавляют водой, подкисляют ледяной АсОН и экстрагируют дихлорметаном. Органический экстракт промывают 5% раствором бикарбоната натрия и затем концентрируют. Хроматографическая очистка на силикагеле с элюированием дихлорметаном дает масло, которое затвердевает при стоянии. МС (m/е, %): 262 (М+, 80),247 (100). Синтез 26. 2-3-[3-(1-Гидрокси-1-метилэтил)фенил]проп-2-инилизоиндол-1,3-дион. Данное соединение получают способом, аналогичным способу синтеза 10, используя 2-(3-йодфенил)пропан-2-ол (синтез 25) вместо 2,2,2-трифтор-1-(4-йодфенил)этанола. МС (m/е, %): 319 (М+, 90), 301(80), 160 (100). Синтез 27. 2-3-[3-(1-Гидрокси-1-метилэтил)фенил]пропилизоиндол-1,2-дион. Данное соединение получают способом, аналогичным способу синтеза 11, используя 2-3-[3-(1-гидрокси-1-метилэтил)фенил]проп-2-инилизоиндол-1,3-дион (синтез 26) вместо 2-3-[4-(2,2,2-трифтор-1-гидроксиэтил)фенил]проп-2-инилизоиндол-1,3-диона (синтез 10). МС (m/е, %): 305 (М+-Н 2 О, 80), 145 (100). Синтез 28. 2-[3-(3-Аминопропил)фенил]пропан-2-ол. Данное соединение получают способом, аналогичным способу синтеза 12, используя 2-3-[3-(1-гидрокси-1-метилэтил)фенил]пропилизоиндол-1,3-дион (синтез 27) вместо 2-3-[4-(2,2,2-трифтор-1-гидроксиэтил)фенил]пропилизоиндол-1,3-диона. МС (m/е, %): 193 (М+, 30), 162 (60), 145 (100). Синтез 29. 4-[3-(1,3-Диоксо-1,3-дигидроизоиндол-2-ил)проп-1-инил]бензонитрил. Данное соединение получают способом, аналогичным способу синтеза 10, используя соответствующие исходные вещества. 1 Н ЯМР (CDCl3) : 7,8 (м, 6 Н), 7,6 (д, 2 Н), 4,6 (с, 2 Н). МС (m/е, %): 286 (М+, 100). Синтез 30. 4-[3-(1,3-Диоксо-1,3-дигидроизоиндол-2-ил)пропил]бензонитрил. Данное соединение получают способом, аналогичным способу синтеза 11, используя 4-[3-(1,3-диоксо-1,3-дигидроизоиндол-2-ил)проп-1-инил]бензонитрил (синтез 29) вместо 2-3-[4-(2,2,2-трифтор-1-гидроксиэтил)фенил]проп-2-инилизоиндол-1,3-диона (синтез 10). 1 Н ЯМР (CDCl3) : 7,8 (дд, 2 Н), 7,7 (дд,2 Н), 7,5 (д, 2 Н), 7,3 (д, 2 Н), 3,7 (т, 2 Н), 2,7 (т, 2 Н), 2,0 (м, 2 Н). МС (m/е, %): 290 (М+, 60), 161 (100). Синтез 31. 4-(3-Аминопропил)бензонитрил. Данное соединение получают способом, аналогичным способу синтеза 12, используя 4-[3-(1,3-диоксо-1,3-дигидроизоиндол-2-ил)пропил]бензонитрил (синтез 30) вместо 2-3-[4-(2,2,2-трифтор-1-гидроксиэтил)фенил]пропилизоиндол-1,3-диона. 1 Н ЯМР (CDCl3) : 7,5 (д, 2 Н), 7,3 (д, 2 Н), 2,7 (м, 4 Н), 1,8 (м,2 Н). МС (m/е, %): 160 (М+, 20), 143 (100). Синтез 32. Оксим 2-хлор-3,4-диметоксибензальдегида. Смесь 2-хлор-3,4-диметоксибензальдегида (1,5 г, 7,5 ммоль), гидрохлорида гидроксиламина (650 мг,9,4 ммоль) и ацетата натрия (1,5 г, 18,8 ммоль) в 30 мл МеОН и 15 мл воды нагревают до 65 С в течение 18 ч. Смесь разбавляют водой и экстрагируют EtOAc. Органический экстракт последовательно промывают водой и насыщенным раствором соли, высушивают над MgSO4 и концентрируют, получая 1,7 г твердого вещества. 1 Н ЯМР (CDCl3) : 8,5 (с, 1 Н), 7,6 (д, 1 Н), 6,8 (д, 1 Н), 3,9 (с, 3 Н), 3,8 (с, 3 Н). МС (m/е,%): 215 (М+, 40), 199 (100). Синтез 33. 2-Хлор-3,4-диметоксибензиламин. К перемешиваемому раствору продукта синтеза 32 (1,7 г, 7,8 ммоль) в 40 мл ТГФ при 0 С медленно по каплям добавляют 1 М раствор литийалюминийгидрида в ТГФ (17 мл, 17 ммоль). Температуре смеси дают медленно подняться до комнатной и затем кипятят с обратным холодильником в течение 2 ч. Смесь охлаждают до 0 С и гасят, медленно по каплям добавляя МеОН. Смесь разбавляют водой и экстрагируют хлороформом. Полученную эмульсию фильтруют через диатомовую землю и разделяют слои фильтрата. Органический экстракт промывают водой, высушивают (MgSO4) и концентрируют, получая 1,1 г масла. МС (m/е, %): 202 (М+, 100). Синтез 34. Оксим 3-этокси-4-метоксибензальдегида. Данное соединение получают способом, аналогичным способу синтеза 32, используя соответствующие исходные вещества. 1 Н ЯМР (CDCl3) : 8,1 (с, 1 Н), 7,2 (д, 1 Н), 7,0 (м, 1 Н), 6,8 (д, 1 Н), 4,1 (кв,2H), 3,9 (с, 3 Н), 1,5 (т, 3 Н). МС (m/е, %) : 195 (М+, 100). Синтез 35. 3-Этокси-4-метоксибензиламин. Данное соединение получают способом, аналогичным способу синтеза 33, используя соответствую- 13010424 щие исходные вещества. 1 Н ЯМР (CDCl3) : 6,9 (с, 1 Н), 6,8 (с, 2 Н), 4,1 (кв, 2 Н), 3,8 (с, 2 Н), 1,5 (т, 3 Н). МС(m/е, %): 181 (М+, 100). Синтез 36. 2-(3-Пиридин-4-илпропил)изоиндол-1,3-дион. К перемешиваемому раствору 4-пиридинпропанола (2,0 г, 14,5 ммоль), фталимида (2,1 г, 14,5 ммоль) и трифенилфосфина (4,9 г, 15,2 ммоль) в 50 мл ТГФ при 0 С по каплям добавляют диэтилазодикарбоксилат (2,5 мл, 16,0 ммоль). Смеси дают медленно нагреться до комнатной температуры, затем перемешивают в течение ночи. Смесь разбавляют 0,1 н. раствором соляной кислоты и промывают диэтиловым эфиром. Водный экстракт подщелачивают 6 н. гидроксидом натрия и экстрагируют EtOAc. Органический экстракт промывают 1 н. гидроксидом натрия и водой, высушивают над MgSO4 и концентрируют, получая 1,8 г твердого вещества. 1 Н ЯМР (CDCl3) : 8,5 (с, 2 Н), 7,8 (м, 2 Н), 7,7 (м, 2 Н), 7,2 (м, 2 Н), 3,7 (т, 2 Н),2,7 (т, 2 Н), 2,0 (м, 2 Н). Синтез 37. 3-Пиридин-4-илпропиламин. Данное соединение получают способом, аналогичным способу синтеза 12, используя соединение,указанное в заглавии синтеза 36. 1 Н ЯМР (CDCl3) : 8,4 (м, 2 Н), 7,1 (м, 2 Н), 2,7 (т, 2 Н), 2,6 (т, 2 Н), 1,8 (м,2 Н). МС (m/е, %): 136 (М+, 30), 119 (35), 107 (100). Соединения формулы (I) получают, как описано в следующих примерах. Пример 1. N4-(3,5-Диметоксибензил)-N2-(2-пиридин-2-илэтил)пиридо[2,3-d]пиримидин-2,4-диамин. Смесь соединения, указанного в заглавии синтеза 1 (174 мг, 0,5 ммоль), 2-(2-аминоэтил)пиридина(386 мг, 3,2 ммоль) и DIPEA (0,2 мл, 1,1 ммоль) в 1 мл ДМСО нагревают при 90 С в течение 18 ч. Смесь выливают в воду и экстрагируют метиленхлоридом. Органический экстракт промывают насыщенным раствором соли, высушивают над MgSO4 и концентрируют. Полученный остаток растирают с EtOAc,получая 83 мг (40%) соединения, указанного в заглавии примера. Т.пл. 157-158 С. 1H ЯМР (ДМСО-d6) : 8,6 (дд, 1 Н), 8,5 (д, 1 Н), 8,4 (дд, 1 Н), 7,7 (м, 1 Н), 7,2 (м, 1 Н), 7,0 (м, 2 Н), 6,5 (м, 2 Н), 6,3 (м, 1 Н), 4,6 (м,2 Н), 3,7 (с, 6 Н), 3,6 (м, 2 Н), 3,0 (м, 2 Н). МС (m/z, %): 417 (100). Данные элементного анализа: вычислено для C23H24N6O2: С 66,3; Н 5,8; N 20,2; найдено: С 65,3; Н 6,3; N 18,3. Соединения примеров 2-5 получают способом, аналогичным описанному в примере 1, используя соответствующие исходные соединения. Пример 2. N4-(3,5-Диметоксибензил)-N2-(2-пиридин-3-илэтил)пиридо[2,3-d]пиримидин-2,4-диамин. Т.пл. 185-186 С. Данные элементного анализа: вычислено для C23H24N6O2: С 66,3; Н 5,8; N 20,2; найдено: С 64,5; Н 5,6; N 19,6. Пример 3. N4-(3,5-Диметоксибензил)-N2-(2-пиридин-4-илэтил)пиридо[2,3-d]пиримидин-2,4-диамин. Т.пл. 234-235 С. Данные элементного анализа: вычислено для C23H24N6O2: С 66,3; Н 5,8; N 20,2; найдено: С 66,0; Н 5,6; N 20,0. Пример 4. N4-(3,5-Диметоксибензил)-N2-2-пиридин-3-илметилпиридо[2,3-d]пиримидин-2,4-диамин. Т.пл. 222-223 С. Данные элементного анализа: вычислено для C22H22N6O2: С 65,7; Н 5,5; N 20,9; найдено: С 65,5; Н 5,5; N 20,8. Пример 5. N2-N4-бис-(3,5-Диметоксибензил)пиридо[2,3-d]пиримидин-2,4-диамин. Т.пл. 159-160 С. Данные элементного анализа: вычислено для C25H27N5O4: С 65,1; Н 5,9; N 15,2; найдено: С 65,3; Н 5,9; N 15,1. Пример 6. N4-(3,5-Диметоксибензил)-N2-[2-(4-метоксифенил)этил]пиридо[2,3-d]пиримидин-2,4-диамин. Смесь соединения, указанного в заглавии синтеза 1 (100 мг, 0,5 ммоль), п-метоксифенетиламина (89 мкл,0,61 ммоль) и DIPEA (105 мкл, 0,61 ммоль) в 0,8 мл ДМСО нагревают при 90 С в течение 18 ч. Соединение выделяют из полученной реакционной смеси и очищают, непосредственно впрыскивая его в прибор для обращенно-фазовой препаративной ВЭЖХ (Shimadzu Corp.; Kyoto, Japan), используя в качестве элюента ступенчатый градиент ацетонитрил/вода, содержащий 0,1% гидроксида аммония. Фракции, содержащие желаемый продукт, объединяют, концентрируют и остаток перекристаллизовывают из изопропанола, получая 80 мг (60%) соединения, указанного в заглавии примера. Т.пл. 88-89 С. Данные элементного анализа: вычислено для C25H27N5O3: С 67,4; Н 6,1; N 15,7; найдено: С 67,0; Н 6,3; N 15,2. Соединения примеров 7-31 получают способом, аналогичным описанному в примере 6, используя соответствующие исходные вещества. Отмечены конкретные отклонения от стандартных условий проведения реакции и/или использованные условия очистки. Пример 7. N4-(3,5-Диметоксибензил)-N2-(3-фенилпропил)пиридо[2,3-d]пиримидин-2,4-диамин. 1 Н ЯМР (ДМСО-d6) : 8,6 (дд, 1 Н), 8,4 (д, 1 Н), 7,2 (м, уш, 3 Н), 7,1 (м, уш, 2 Н), 7,0 (м, уш, 1 Н), 6,5 (с,уш, 2 Н), 6,3 (с, уш, 1 Н), 4,6 (м, уш, 2 Н), 3,7 (с, уш, 6 Н), 2,6 (м, уш, 2 Н), 1,8 (м, уш, 2 Н), 1,7 (м, уш, 2 Н). МС (m/z, %): 417 (100). МС (m/z, %): 430 (100). Пример 8. N2-[2-(4-Хлорфенил)этил]-N4-(3,5-диметоксибензил)пиридо[2,3-d]пиримидин-2,4-диамин. Т.пл. 85-90 С. Данные элементного анализа: вычислено для C24H24N5O2Cl: С 64,1; Н 5,4; N 15,6; найдено: С 63,6; Н 5,7; N 15,3. Пример 9. N2-Бензил-N4-(3,5-диметоксибензил)пиридо[2,3-d]пиримидин-2,4-диамин. Т.пл. 84-85 С. Данные элементного анализа: вычислено для C23H23N5O2: С 68,8; Н 5,8; N 17,4; найдено: С 68,5; Н 6,0; N 17,4.- 14010424 Пример 10. N4-(3,5-Диметоксибензил)-N2-(2-тиофен-2-илэтил)пиридо[2,3-d]пиримидин-2,4-диамин. Т.пл. 120-121 С. Данные элементного анализа: вычислено для C22H23N5O2S: С 62,7; Н 5,5; N 16,6; найдено: С 62,2; Н 6,0; N 15,6. Пример 11. 2-(4-[4-(3,5-Диметоксибензиламино)пиридо[2,3-d]пиримидин-2-иламино]метилфенил) пропан-2-ол. Т.пл. 105-109 С. Данные элементного анализа: вычислено для C26H29N5O3: С 68,0; Н 6,4; N 15,2; найдено: С 67,7; Н 6,6; N 14,4. Пример 12. N4-(3,5-Диметоксибензил)-N2-2-фенетилпиридо[2,3-d]пиримидин-2,4-диамин. Т.пл. 112-114 С. Данные элементного анализа: вычислено для C24H25N5O2: С 69,4; Н 6,1; N 16,9; найдено: С 68,5; Н 6,9; N 15,3. Пример 13. N4-(3,5-Диметоксибензил)-N2-[2-(3,5-диметоксифенил)этил]пиридо[2,3-d]пиримидин-2,4 диамин. Т.пл. 95-100 С. Данные элементного анализа: вычислено для C26H29N5O4: С 65,7; Н 6,2; N 14,7; найдено: С 65,5; Н 6,6; N 14,5. Пример 14. N4-(3,4-Диметоксибензил)-N2-[2-(3-фторфенил)этил]пиридо[2,3-d]пиримидин-2,4-диамин. Т.пл. 227-228 С. Данные элементного анализа: вычислено для C24H24N5O2F: С 66,5; Н 5,6; N 16,2; найдено: С 66,6; Н 5,6; N 16,2. Пример 15. N4-(3,4-Диметоксибензил)-N2-[2-(2-фторфенил)этил]пиридо[2,3-d]пиримидин-2,4-диамин. Т.пл. 220-222 С. Данные элементного анализа: вычислено для C24H24N5O2F: С 66,5; Н 5,6; N 16,2; найдено: С 66,4; Н 5,5; N 16,1. Пример 16. N4-(3,4-Диметоксибензил)-N2-[2-(4-фторфенил)этил]пиридо[2,3-d]пиримидин-2,4-диамин. Т.пл. 225-226 С. Данные элементного анализа: вычислено для C24H24N5O2F: С 66,5; Н 5,6; N 16,2; найдено: С 66,4; Н 5,6; N 16,2. Пример 17. N4-(3,4-Диметоксибензил)-N-фенетилпиридо[2,3-d]пиримидин-2,4-диамин. Т.пл. 217-218 С. Данные элементного анализа: вычислено для C24H25N5O2: С 69,4; Н 6,1; N 16,9; найдено: С 69,4; Н 6,0; N 16,8. Пример 18. N4-(3,4-Диметоксибензил)-N2-(4-фенилбутил)пиридо[2,3-d]пиримидин-2,4-диамин. Т.пл. 194-195 С. Данные элементного анализа: вычислено для C26H29N5O2: С 70,4; Н 6,6; N 15,8; найдено: С 70,5; Н 6,6; N 15,9. Пример 19. N4-(3,4-Диметоксибензил)-N2-(4-феноксиэтил)пиридо[2,3-d]пиримидин-2,4-диамин. Т.пл. 227-228 С. Данные элементного анализа: вычислено для C24H25N5O3: С 66,8; Н 5,8; N 16,2; найдено: С 66,7; Н 5,7; N 16,2. Пример 20. N4-(3,4-Диметоксибензил)-N2-(2-трифторметилбензил)пиридо[2,3-d]пиримидин-2,4-диамин. Т.пл. 227-228 С. Данные элементного анализа: вычислено для C24H22N5O2F3: С 61,4; Н 4,7; N 14,9; найдено: С 60,6; Н 4,9; N 14,8. Пример 21. 2-(4-3-[4-(3,4-Диметоксибензиламино)пиридо[2,3-d]пиримидин-2-иламино]пропилфенил)пропан-2-ол. Полученные при осуществлении обращенно-фазовой препаративной ВЭЖХ фракции, содержащие неочищенный желаемый продукт, концентрируют и остаток перекристаллизовывают из EtOAc. Т.пл. 198-199 С. Данные элементного анализа: вычислено для C28H33N5O3: С 69,0; Н 6,8; N 14,4; найдено: С 68,7; Н 6,9; N 14,3. Пример 22. 2-(4-3-[4-(3,5-Диметоксибензиламино)пиридо[2,3-d]пиримидин-2-иламино]пропилфенил)пропан-2-ол. Аморфное твердое вещество. Т.пл. 70-75 С. 1 Н ЯМР (ДМСО-d6) : 8,6 (дд, 1 Н), 8,4 (д, 1 Н), 7,3 (м,уш, 2 Н), 7,1 (м, уш, 2 Н), 7,0 (м, уш, 2 Н), 6,5 (с, уш, 2 Н), 6,3 (с, уш, 1 Н), 4,6 (м, уш, 2 Н), 3,7 (с, уш, 6 Н), 2,6(м, уш, 2 Н), 1,8 (м, уш, 2 Н), 1,7 (м, уш, 2 Н), 1,4 (с, 6 Н). МС (m/z, %): 430 (100). МС (m/z, %): 488 (М 1,100), 470 (50). Данные элементного анализа: вычислено для C28H33N5O3: С 69,0; Н 6,8; N 14,4; найдено: С 67,1; Н 7,0; N 12,1. Пример 23. 1-(4-[4-(3,4-Диметоксибензиламино)пиридо[2,3-d]пиримидин-2-иламино]метилфенил)2,2,2-трифторэтанол. Полученные при осуществлении обращенно-фазовой препаративной ВЭЖХ фракции, содержащие неочищенный желаемый продукт, концентрируют и остаток перекристаллизовывают из смеси ацетонитрил/вода. Т.пл. 121-122 С. Данные элементного анализа: вычислено для C25H24N5O3F3: С 60,1; Н 4,8; N 14,0; найдено: С 58,0; Н 5,0; N 13,4. Пример 24. 1-(4-3-[4-(3,4-Диметоксибензиламино)пиридо[2,3-d]пиримидин-2-иламино]пропилфенил)этанон. Реакционную смесь, содержащую неочищенный продукт, выливают в воду и образовавшийся осадок удаляют фильтрованием. Остаток растворяют в 30 мл МеОН и добавляют 10 мл 1 н. соляной кислоты. Смесь перемешивают 4 ч при комнатной температуре, концентрируют, нейтрализуют 5% раствором бикарбоната натрия и экстрагируют дихлорметаном. Органические экстракты объединяют, промывают насыщенным раствором соли, высушивают над MgSO4 и концентрируют. Неочищенный продукт очищают- 15010424 обращенно-фазовой ВЭЖХ, как описано в примере 6. Фракции, содержащие желаемый продукт, объединяют, концентрируют и остаток перекристаллизовывают из смеси ацетонитрил/вода, получая твердое вещество. Т.пл. 184-185 С. Данные элементного анализа: вычислено для C27H29N5O3: С 68,8; Н 6,2; N 14,9; найдено: С 68,7; Н 6,0; N 14,6. Пример 25. 1-(4-3-[4-(3,4-Диметоксибензиламино)пиридо[2,3-d]пиримидин-2-иламино]пропилфенил)-2,2,2-трифторэтанол. Т.пл. 222-224 С. 1 Н ЯМР (ДМСО-d6):8,6 (дд, 1 Н), 8,4 (дд, 1 Н), 7,4 (м, уш, 2 Н), 7,3 (м, 1 Н), 7,0 (м,уш, 2 Н), 6,8 (с, уш, 2 Н), 6,7 (д, 1 Н), 5,0 (м, уш, 1 Н), 4,6 (с, уш, 2 Н), 3,7 (м, 6 Н), 2,6 (м, уш, 2 Н), 1,8 (м, уш,2 Н). МС (m/z, %): 528 (М+, 100). Пример 26. N2-3-(Бензо[1,2,5]оксадиазол-5-илпропил)-N4-(3,4-диметоксибензил)пиридо[2,3-d]пиримидин-2,4-диамин. Продукт выделяют хроматографией на силикагеле, элюируя 2,5% МеОН в смеси 2 н. аммиак/дихлорметан, получая неочищенное твердое вещество. Растирание с EtOAc дает твердое вещество. Т.пл. 191-193 С. 1 Н ЯМР (ДМСО-d6):8,6 (дд, 1 Н), 8,4 (дд, 1 Н), 7,9 (м, уш, 1 Н), 7,7 (м, 1 Н), 7,5 (м, уш, 1 Н), 7,0(м, уш, 2 Н), 6,8 (м, 2 Н), 4,6 (м, уш, 2 Н), 3,7 (м, 6 Н), 3,4 (м, 2 Н), 2,7 (м, уш, 2 Н), 1,9 (м, уш, 2 Н). МС (m/z,%): 472 (М+, 100). Пример 27. N2-3-(Бензотиазол-6-илпропил)-N4-(3,4-диметоксибензил)пиридо[2,3-d]пиримидин-2,4 диамин. Продукт выделяют хроматографией на силикагеле, элюируя 2,5% МеОН в смеси 2 н. раствор аммиака/дихлорметан, получая твердое вещество. Т.пл. 191-193 С. МС (m/z, %): 487 (М+, 100). Данные элементного анализа: вычислено для C26H26N6O2S: С 64,2; Н 5,4; N 17,3; найдено: С 64,5; Н 5,5; N 16,8. Пример 28. N4-(3,4-Диметоксибензил)-N2-3-[3-(2-метил[1,3]диоксолан-2-ил)фенил]пропилпиридо(с, уш, 1 Н), 6,9 (д, 1 Н), 6,6 (д, 1 Н), 4,8 (д, 2 Н), 3,7 (с, 3 Н), 3,7 (с, 3 Н), 3,6 (м, 2 Н), 2,7 (м, 2 Н), 2,0 (м, 2 Н). МС (m/z, %): 432 (M1, 20), 256 (15), 237 (30), 216 (100). Соединения примеров 32-35 получают в соответствии со следующей обобщенной методикой. Отмечены конкретные исключения, относящиеся к использованным условиям реакций и/или очистки. К перемешиваемому раствору 2,4-дихлорпиридо[2,3-d]пиримидина (0,75 ммоль) и DIPEA (1,5 ммоль) в 3 мл ДМСО при комнатной температуре добавляют 0,75 ммоль амина, соответствующего формуле (V) на стадии 1 схемы 1. Смесь перемешивают при комнатной температуре в течение 1 ч, затем добавляют 2,25 ммоль амина, соответствующего формуле (VII) стадии 2 схемы 1, и добавочное количество DIPEA(2,25 ммоль) и смесь нагревают при 90 С в течение 2 ч. Пример 32. N4-(3,4-Диметоксибензил)-N2-(3-фенилпропил)пиридо[2,3-d]пиримидин-2,4-диамин. Соединение выделяют и очищают из полученной реакционной смеси непосредственным впрыскиванием в прибор для обращенно-фазовой препаративной ВЭЖХ, используя в качестве элюента ступенчатый градиент смеси ацетонитрил/вода, содержащей 0,1% гидроксид аммония. Фракции, содержащие соединение, объединяют и концентрируют, получая твердое вещество. Т.пл. 190-192 С. 1 Н ЯМР (ДМСО-d6):8,6 (дд, 1 Н), 8,4 (дд, 1 Н), 7,2 (м, уш, 3 Н), 7,1 (м, уш, 2 Н), 7,0 (м, уш, 2 Н), 6,8 (м, уш, 2 Н), 4,6 (м, уш, 2 Н),3,7 (д, уш, 6 Н), 3,3 (м, уш, 2 Н), 2,6 (м, уш, 2 Н), 1,8 (м, 2 Н). МС (m/е, %): 431 (М 1,50), 430 (М+, 100). Пример 33. N4-(3,5-Диметоксибензил)-N2-(3-феноксиэтил)пиридо[2,3-d]пиримидин-2,4-диамин. Соединение выделяют и очищают из полученной реакционной смеси непосредственным впрыскиванием в прибор для обращенно-фазовой препаративной ВЭЖХ, используя в качестве элюента ступенчатый градиент смеси ацетонитрил/вода, содержащей 0,1% гидроксид аммония. Фракции, содержащие соединение, объединяют, концентрируют и остаток перекристаллизовывают из смеси изопропанол/вода. Т.пл. 165-167 С. 1 Н ЯМР (ДМСО-d6):8,6 (дд, 1 Н), 8,4 (д, 1 Н), 7,2 (м, уш, 3 Н), 7,1 (м, уш, 2 Н), 7,0 (м,1 Н), 6,9 (м, уш, 2 Н), 6,8 (м, уш, 1 Н), 6,5 (д, 2 Н), 6,4 (с, 1 Н), 4,6 (м, уш, 2 Н), 4,0 (м, уш, 2 Н), 3,7 (м, уш,- 16010424 8 Н). МС (m/е, %): 433 (М 1,50), 432 (М+, 100). Пример 34. N4-(3-Этокси-4-метоксибензил)-N2-(3-фенилпропил)пиридо[2,3-d]пиримидин-2,4-диамин. Соединение выделяют и очищают из полученной реакционной смеси непосредственным впрыскиванием в прибор для обращенно-фазовой препаративной ВЭЖХ, используя в качестве элюента ступенчатый градиент смеси ацетонитрил/вода, содержащей 0,1% гидроксид аммония. Фракции, содержащие соединение, объединяют, концентрируют и перекристаллизовывают из смеси ацетонитрил/вода. Т.пл. 181182 С. Данные элементного анализа: вычислено для C26H29N5O2: С 70,4; Н 6,6; N 15,8; найдено: С 70,7; Н 6,9; N 15,9. Пример 35. 2-(4-3-[4-(3-Этокси-4-метоксибензиламино)пиридо[2,3-d]пиримидин-2-иламино]пропил фенил)пропан-2-ол. Соединение выделяют и очищают из полученной реакционной смеси непосредственным впрыскиванием в прибор для обращенно-фазовой препаративной ВЭЖХ, используя в качестве элюента ступенчатый градиент смеси ацетонитрил/вода, содержащей 0,1% гидроксид аммония. Фракции, содержащие желаемое соединение, объединяют, концентрируют и перекристаллизовывают из смеси ацетонитрил/вода. Т.пл. 150-152 С. Данные элементного анализа: вычислено для C29H35N5O3: С 69,4; Н 7,0; N 13,7; найдено: С 69,1; Н 6,9; N 13,7. Пример 36. 1-(4-3-[4-(3,4-Диметоксибензиламино)пиридо[2,3-d]пиримидин-2-иламино]пропилфенил)-2,2,2-трифторэтанон. К перемешиваемому раствору соединения, указанного в заглавии примера 25 (150 мг, 0,28 ммоль), в 15 мл дихлорметана при комнатной температуре добавляют 1,1,1-триацетокси-1,1-дигидро-1,2-бензйодоксол-3(1 Н)-она (180 мг, 0,43 ммоль). Смесь перемешивают при комнатной температуре в течение 6 ч,затем добавляют дополнительную порцию 1,1,1-триацетокси-1,1-дигидро-1,2-бензйодоксол-3(1 Н)-она(180 мг, 0,43 ммоль) и смесь перемешивают в течение ночи при комнатной температуре. Смесь разбавляют хлороформом, промывают водой, высушивают над MgSO4 и концентрируют, получая масло. Хроматография на силикагеле с элюированием 5% МеОН в смеси 2 н. аммиак/дихлорметан позволяет получить масло. Растирание с EtOAc дает 45 мг твердого вещества. Т.пл. 198-200 С. 1 Н ЯМР (ДМСО-d6):8,6 (дд, 1 Н), 8,4 (дд, 1 Н), 7,9 (м, уш, 2 Н), 7,5 (м, уш, 2 Н), 7,0 (м, уш, 2 Н), 6,8 (м, уш, 2 Н), 4,6 (м, 2 Н), 3,7(м, 6 Н), 3,3 (м, 2 Н), 2,7 (м, уш, 2 Н), 1,9 (м, уш, 2 Н). МС (m/е, %): 526 (М+, 100). Пример 37. 1-(3-3-[4-(3,4-Диметоксибензиламино)пиридо[2,3-d]пиримидин-2-иламино]пропилфенил)этанон. Смесь соединения, указанного в заглавии синтеза 27 (419 мг, 0,81 ммоль), в 8 мл ТГФ, содержащего 10 мл 6 н. соляной кислоты, перемешивают при комнатной температуре в течение 6 ч. Реакционную смесь экстрагируют EtOAc, органический экстракт промывают 5% раствором бикарбоната натрия, затем концентрируют, получая твердое вещество. Т.пл. 152-155 С. 1 Н ЯМР (ДМСО-d6):8,8 (д, 1 Н), 8,7 (д,1 Н), 7,7 (м, 2 Н), 7,4 (м, 3 Н), 7,0 (с, 1 Н), 6,8 (м, 2 Н), 4,6 (д, 2 Н), 3,7 (с, 3 Н), 3,6 (с, 3 Н), 3,5 (м, 2 Н), 2,7 (м,2 Н), 2,5 (с, 3 Н), 1,9 (м, 2 Н). МС (m/е, %): 471 (М+, 30), 470 (100). Биологические методики Выделение фермента PDE 2 Фермент PDE 2 выделяют из тромбоцитов человека, используя примерно 1,4 л крови многих доноров для получения осадка тромбоцитов. Тромбоциты повторно суспендируют примерно в 75 мл буферного раствора для лизиса [20 мМ Tris pH 7,2, 5 мМ MgCl2, 250 мМ сахарозы, 1 мМ DTT, 1 мкл ингибитора протеазы Sigma 8340, Sigma-Aldrich, St.Louis, МО] и подвергают лизису обработкой ультразвуком при 4 С, 3 цикла импульсов по 1 мин, затем в течение ночи при 4 С вращают в центрифуге при 100000g. Просветленные лизаты загружают в прибор AKTA Explorer FPLC (Amersham Biosciences;Piscataway, NJ) в виде трех последовательных хроматографических разделений со средним объемом загрузки 25 мл. Применяют 5 мл анионообменную колонку HiTrap Q (Amersham Biosciences). Буферный раствор А [20 мМ Tris рН 7,2, 5 мМ MgCl2, 1 мкл/2 мл ингибитора протеазы Sigma 8340] смешивают с градиентом буфера В [20 мМ Tris pH 7,2, 500 мМ NaCl, 5 мМ MgCl2, 1 мкл/2 мл ингибитора протеазыSigma 8340], так что при пропускании объема, равного 20 объемам колонки от первоначальной концентрации буфера В 0%, конечная концентрация повышается до 100%. Наблюдают пики гидролиза cGMP со средним разрешением при низком содержании соли - 125 мМ NaCl (PDE 5) - и высоком содержании соли 325 мМ NaCl (PDE 2). Выделяют и собирают отдельно две основные фракции, демонстрирующие активность в отношении cGMP (PDE 5 и PDE 2). Суммарный объем собранных фракций PDE 2 составляет приблизительно 40 мл, причем их распределяют по криопробиркам, 200 мкл/пробирка, и помещают на хранение при -80 С. Исследование связывания фермента PDE 2 Ингибирующую активность соединений формулы (I) по отношению к рекомбинантному или выделенному ферменту PDE 2, а также другим ферментам семейства PDE определяют, используя наборы[3 Н]сАМР для сцинтилляционного анализа близости (SPA) фирмы Amersham International (Little Charlfont,England). Анализы SPA проводят с использованием 96-луночных планшетов. Шарики силиката иттрия для SPA PDE (Amersham Biosciences) предпочтительно связываются с линейным нуклеотидом, т.е. GMP,- 17010424 по сравнению с циклическим нуклеотидом, т.е. cGMP. 3H-cGMP добавляют в реакцию, и когда продукт,т.е. 3H-GMP, находится в близком соседстве с шариками, в шариках возбуждается сцинтиллятор, который определяют с использованием счетчика сцинтилляции Packard (Perkin-Elmer Life Sciences; Boston,MA). Так как использованная концентрация фермента находится в линейной области, определяют Km фермента (15 мкМ). Итоговая концентрация субстрата составляет 1/3 Km (1 мкМ), поэтому величиныIC50 могли бы аппроксимировать величины Kl. Описанный анализ показывает удовлетворительные результаты при использовании в качестве контрольных образцов известных в литературе соединений перед исследованием соединений по настоящему изобретению. Затем сравнивают измерения каталитической активности PDE, полученные в присутствии тестируемых соединений, и измерения, полученные в отсутствие тестируемых соединений, и определяют значения IC50. Радиоактивные субстраты и продукты реакций PDE количественно определяют с использованием счетчика сцинтилляции жидкостей RACK-BETA 1219 (LKB Wallac, Freiburg, FRG). Значения IC50 (концентрации, соответствующие 50% ингибированию) определяют с использованием 1 мкМ сАМР илиcGMP, используя пиковые фракции. Данные аппроксимируют по четырем параметрам с помощью сигмоидальной логистической функции. Используя описанные ранее ферменты PDE, выделенные из тромбоцитов человека, и способы исследования тестируемых соединений, предназначенных для ингибирования данного фермента, определяют IC50 для EHNA, равную 1,7 мкМ. Кроме этого, с использованием упомянутой выше методики дополнительно определяют IC50 для 9-(1-ацетил-4-фенилбутил)-2-(3,4-диметоксибензил)-1,9-дигидропурин-6 она, составляющую 3 нМ. Соединения формулы (I), в основном, демонстрируют ингибирующую активность в отношенииPDE 2, выраженную через IC50, которая составляет 1000 нм. Диапазоны ингибирующей активности в отношении PDE 2 для соединений формулы (I) примеров 1-37 показаны в нижеследующей таблице. Ингибирование PDE 2:(IC5050 нМ),(IC50 50-250 нМ), + (IC50 250-1000 нМ). Способность ингибиторов PDE 2, включая соединения формулы (I), воздействовать на переломы и/или дефекты костей или содействовать срастанию костей может быть продемонстрирована в соответствии со следующими протоколами. Модель поперечного перелома бедра у крысы Используют мужских особей крыс Sprague-Dawley в возрасте от 3 до 4 месяцев. Животным проводят анестезию кетамином и ксилазином в дозировке 100 и 10 мг/кг, соответственно. Правую заднюю конечность каждой крысы бреют и очищают. Выполняют 1 см разрез сбоку от коленной чашки и раскрывают бедренный мыщелок. В костно-мозговой канал через межмыщелковую часть вводят проволоку Киршнера (диаметром 0,045"), предназначенную для внутренней стабилизации. Разрез в мышце зашивают викрилом и разрез на коже стягивают скобками для ран из нержавеющей стали. Осуществляют перелом диафиза скрепленной бедренной кости с помощью трехточечного устройства для изгибания, приводимого в движение падающим грузом. После пробуждения от анестезии допускают полную нагрузку на лапу крысы и неограниченную активность. Тестируемые соединения вводят в различные сроки после хирургического вмешательства с помощью чрескожной инъекции в место перелома. После воздействия- 18010424 тестируемых соединений животных умерщвляют и собирают для исследования бедренные кости. Степень излечения перелома определяют с использованием рентгенографии, гистологического и биомеханического тестов (F. Bonnarens, et al., Journal of Orthopaedic Research, 2, 97-101 (1984. Протокол и результаты исследований модели поперечного перелома бедренной кости у крысы Мужских особей крыс трехмесячного возраста под общим наркозом подвергают поперечному перелому правой бедренной кости. Осуществляют чрескожную инъекцию 1 дозы (5 мг) N4-(3,4-диметоксибензил)-N2-(3-фенилпропил)пиридо[2,3-d]пиримидин-2,4-диамина в места переломов после завершения формирования переломов. Через 3 недели после инъекций крыс умерщвляют и их правые бедренные кости собирают и анализируют. Усилие разрушения и жесткость (параметры, показывающие прочность кости) возрастают на 19 и 62%, соответственно, в случае воздействия на бедренную кость N4-(3,4-диметоксибензил)-N2-(3-фенилпропил)пиридо[2,3-d]пиримидин-2,4-диамина по сравнению с теми же параметрами бедренной кости, на которую воздействуют плацебо. Модель инъекции в надкостницу крысы Крыс анестезируют изофлураном (2-3 мин) в камере, расположенной в вытяжном шкафу. Правую заднюю конечность каждой крысы бреют и очищают. К шприцу, предварительно заполненному композицией тестируемого соединения для местной инъекции, присоединяют иглу 25 размера. Композицию вводят в поднадкостничную область бедренной кости в объеме 5-15 мкл в течение 14 дней. После окончания введения доз крыс умерщвляют, собирают бедренные кости и затем исследуют с помощью рентгенографии и рентгеновской абсорбциометрии с двойной энергией (DEXA). Протокол и результаты исследований модели инъекции в надкостницу крыс 5 раз в неделю в течение 2 недель осуществляют ежедневные инъекции носителя или тестируемого соединения в правую бедренную кость мужских особей крыс Sprague-Dawley трехнедельного возраста. На 15 день всех крыс умерщвляют и собирают правые бедренные кости для исследования. Индукцию костной ткани надкостницей определяют с использованием рентгенографии и DEXA. Рентгенография показывает образование новой костной ткани, расположенной в месте инъекции во всех бедренных костях, подвергшихся воздействию тестируемых соединений. Содержание минералов в костной ткани(ВМС) бедренной кости в области инъекции (область между малым вертелом и средней третью бедренной кости) измеряют с помощью DEXA, сравнивая крыс, подвергшихся воздействию тестируемого соединения, и крыс, подвергшихся только воздействию носителя. В данной модели N4-(3,5-диметоксибензил)-N2(2-пиридин-4-илэтил)пиридо[2,3-d]пиримидин-2,4-диамин, 2-(3-3-[4-(3,4-диметоксибензиламино)пиридо[2,3-d]пиримидин-2-иламино]пропилфенил)пропан-2-ол и N4-(3,4-диметоксибензил)-N2-(3-фенилпропил)пиридо[2,3-d]пиримидин-2,4-диамин увеличивают ВМС на 34, 49 и 33%, соответственно. Кроме этого, 9-(1-ацетил-4-фенилбутил)-2-(3,4-диметоксибензил)-1,9-дигидропурин-6-он в вышеупомянутой модели увеличивает ВМС на 20%. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединения формулы (I) или их фармацевтически приемлемые соли, в которыхR1 и R2 представляют собой водород или метоксигруппу при условии, что R1 и R2 одновременно не являются водородом или метоксигруппой;Y представляет собой бензоксазолил, бензотиазолил, пиридил, фенил или тиенил, причем Y необязательно замещен заместителями в количестве от 1 до 3, независимо выбранными из галогена, трифторметила, метокси, -С(=О)СН 3, циано, -С(СН 3)2 ОН, -СН(СН 3)ОН, -CH(CF3)OH, -C(C=O)CF3,или оксадиазолила. 2. Соединение по п.1, в котором X представляет собой связь и Y представляет собой тиенил, пиридил или фенил, причем фенил необязательно замещен 1 или 2 заместителями, независимо выбранными из галогена, трифторметила, метокси, -С(=O)СН 3, циано, -С(СН 3)2 ОН, -СН(СН 3)ОН, -CH(CF3)OH,-(C=O)CF3 или оксадиазолила. 3. Соединение по п.1 или 2, в котором X представляет собой связь, n представляет собой 2 или 3 и Y представляет собой тиенил, пиридил или фенил, причем фенил необязательно замещен 1 или 2 замести- 19010424 телями, независимо выбранными из метокси, галогена, -С(СН 3)2 ОН, -CH(CF3)OH или -(C=O)CF3. 4. N2,N4-бис-(3,5-Диметоксибензил)пиридо[2,3-d]пиримидин-2,4-диамин;N4-(3,4-диметоксибензил)-N2-(3-фенилпропил)пиридо[2,3-d]пиримидин-2,4-диамин или их фармацевтически приемлемые соли. 5. Фармацевтическая композиция, содержащая соединение формулы (I) по любому из пп.1-4 или фармацевтически приемлемую соль упомянутого соединения, а также фармацевтически приемлемую основу, носитель или разбавитель. 6. Способ лечения опосредованных PDE 2 состояний, заболеваний или симптомов у млекопитающих, нуждающихся в таком лечении, где указанный способ включает введение упомянутому млекопитающему терапевтически эффективного количества соединения формулы (I) по любому из пп.1-4, или фармацевтически приемлемой соли упомянутого соединения; или фармацевтической композиции, включающей упомянутое соединение формулы (I), или фармацевтически приемлемую соль упомянутого соединения, а также фармацевтически приемлемую основу, носитель или разбавитель. 7. Способ по п.6, в котором упомянутое состояние, заболевание или симптом представляет собой остеопороз, легочную гипертензию, расстройство полового влечения у женщин, ухудшение памяти или познавательной способности, агрегацию тромбоцитов, сосудистый ангиогенез, деменцию, рак, аритмию,тромбоз, перелом и/или дефект костей, медленно срастающийся или несросшийся перелом, сподилодез,врастание костей, реконструкцию лицевой части черепа или гипоксию, где способ включает введение млекопитающему, нуждающемуся в таком лечении, терапевтически эффективного количества соединения формулы (I) по п.1, или фармацевтически приемлемой соли упомянутого соединения, или фармацевтической композиции, включающей упомянутое соединение, или упомянутую фармацевтически приемлемую соль упомянутого соединения. 8. Способ по п.6, в котором упомянутое состояние представляет собой перелом и/или дефект костей. 9. Фармацевтическая композиция, содержащая соединение формулы (I) по п.1 в качестве ингибитора PDE 2, селективный агонист рецептора ЕР 2 и фармацевтически приемлемую основу, носитель или разбавитель. 10. Композиция по п.9, в которой упомянутый ингибитор PDE 2 представляет собой N4-(3,5 диметоксибензил)-N2-(2-пиридин-4-илэтил)пиридо[2,3-d]пиримидин-2,4-диамин; 2-(3-3-[4-(3,4-диметоксибензиламино)пиридо[2,3-d]пиримидин-2-иламино]пропилфенил)пропан-2-ол;N4-(3,4-диметокси 2 бензил)-N -(3-фенилпропил)пиридо[2,3-d]пиримидин-2,4-диамин или фармацевтически приемлемые соли упомянутых соединений. 11. Композиция по п.9 или 10, в которой упомянутый селективный агонист рецептора ЕР 2 представляет собой (3-4-трет-бутилбензил)(пиридин-3-сульфонил)амино)метил)фенокси)уксусную кислоту или ее фармацевтически приемлемую соль. 12. Способ по любому из пп.6-8, дополнительно включающий введение упомянутому млекопитающему терапевтически эффективного количества селективного агониста рецептора ЕР 2 или фармацевтической композиции, включающей комбинацию упомянутого соединения формулы (I) по п.1 и упомянутого селективного агониста рецептора ЕР 2. 13. Способ по п.12, в котором упомянутый ингибитор PDE 2 представляет собой N4-(3,5 диметоксибензил)-N2-(2-пиридин-4-илэтил)пиридо[2,3-d]пиримидин-2,4-диамин; 2-(3-3-[4-(3,4-диметоксибензиламино)пиридо[2,3-d]пиримидин-2-иламино]пропилфенил)пропан-2-ол; N4-(3,4-диметоксибензил)-N2-(3-фенилпропил)пиридо[2,3-d]пиримидин-2,4-диамин или фармацевтически приемлемые соли упомянутых соединений. 14. Способ по п.12 или 13, в котором упомянутый селективный агонист рецептора ЕР 2 представляет собой (3-4-трет-бутилбензил)(пиридин-3-сульфонил)амино)метил)фенокси)уксусную кислоту или ее фармацевтически приемлемую соль. 15. Способ лечения перелома и/или дефекта костей у млекопитающего, нуждающегося в таком лечении, где способ включает введение упомянутому млекопитающему терапевтически эффективного количества соединения формулы (I) по п.1 в качестве ингибитора PDE 2 или фармацевтически приемлемой соли упомянутого ингибитора. Евразийская патентная организация, ЕАПВ Россия, 109012, Москва, Малый Черкасский пер., 2/6
МПК / Метки
МПК: A61P 9/06, A61P 15/00, C07D 471/04, A61K 31/519, A61P 35/00, A61P 19/10
Метки: ингибиторов, качестве, пиридо[2,3-d]пиримидин-2,4-диамины
Код ссылки
<a href="https://eas.patents.su/21-10424-pirido23-dpirimidin-24-diaminy-v-kachestve-ingibitorov-pde-2.html" rel="bookmark" title="База патентов Евразийского Союза">Пиридо[2,3-d]пиримидин-2,4-диамины в качестве ингибиторов pde 2</a>
Предыдущий патент: Инданзамещенные пиримидины, ингибирующие репликацию вич
Следующий патент: Способ получения диарилкарбоната высокой чистоты
Случайный патент: Циклические замещенные конденсированные пирролкарбазолы и изоиндолоны












