Циклические замещенные конденсированные пирролкарбазолы и изоиндолоны
Номер патента: 5273
Опубликовано: 30.12.2004
Авторы: Сингх Джасбир, Трипатхи Рабиндранатх, Андерайнер Теодор Л., Хадкинс Роберт Л., Редди Данду
Формула / Реферат
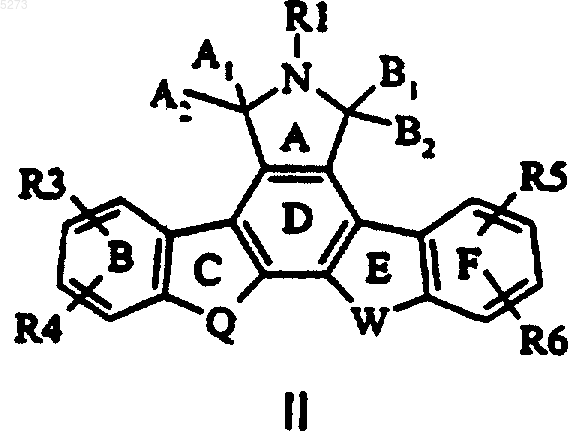
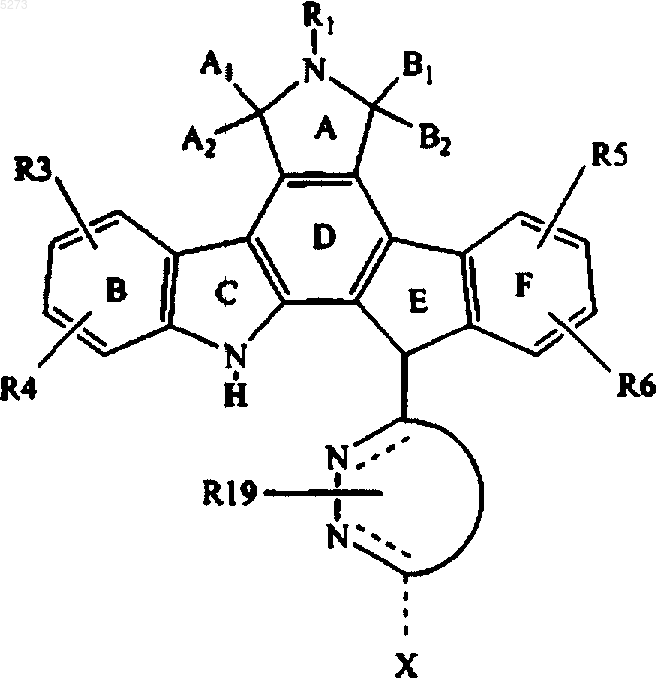
1. Соединение формулы I
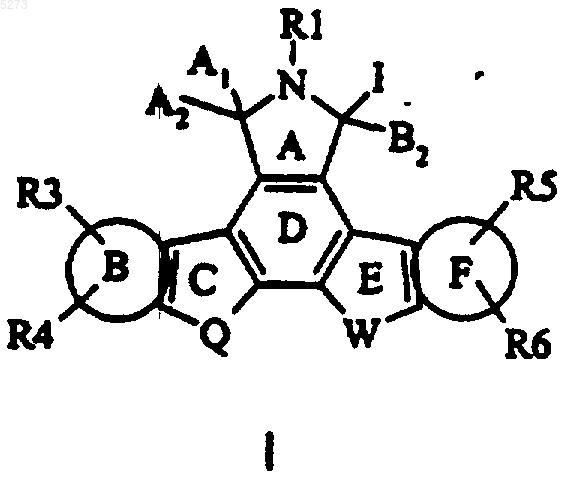
в которой кольцо B и кольцо F, каждое, вместе с атомами углерода, к которым они присоединены, представляет фенил;
R1, R4, R6 представляют водород;
R2 выбирают из группы, состоящей из H, алкила, содержащего от 1 до 4 атомов углерода и -O(CH2)pOR10;
R3 выбирают из группы, состоящей из
H, F, Cl, Br, I, -OR9, где R9 представляет алкил, содержащий от 1 до 8 атомов углерода;
-CH2OR10, -C(=O)R2, где R2 представляет -O(CH2)pOR10, где R10 выбирают из группы, состоящей из H и алкила, содержащего от 1 до 4 атомов углерода;
алкила, содержащего от 1 до 8 атомов углерода, замещенного C1-C8алкилоксиC1-C8алкоксигруппой;
R5 означает H или -OR9;
R7 означает
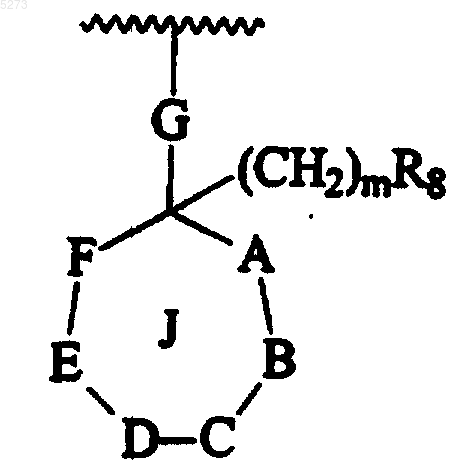
в которой m равно 0-4;
G соответствует связи или алкилену, содержащему от 1 до 4 углеродов, причем группа алкилена незамещена или замещена OH;
R8 выбирают из группы, состоящей из H, замещенного галогеном фенила, -O(C=O)NR11R12, -CN, ацилокси, где ацил представляет алканоил с прямой или разветвленной цепью, содержащий 1-6 атомов углерода, C2-C8алкенила, -O-CH2-O-(CH2)2-O-CH3, галогена, -OR10, где R10 выбирают из группы, состоящей из H и алкила, содержащего от 1 до 4 атомов углерода, тиенила, алкила, содержащего от 1 до 4 атомов углерода, замещенного 2 гидроксигруппами;
R11 и R12, каждый независимо, выбирают из группы, состоящей из H и алкила, содержащего от 1 до 4 углеродов;
A выбирают из группы, состоящей из O, CHR17 и C(=O);
B выбирают из группы, состоящей из O, NR17, S, CHR17, C(OH)R17 и C(=O);
или A и B вместе могут образовывать -CH=CH-;
C выбирают из группы, состоящей из связи, O, NR17, S, CHR17, C(=O) и CH2=C-;
D выбирают из группы, состоящей из связи, O, CHR17 и C(OH)R17;
E выбирают из группы, состоящей из связи, N и CH(R17);
F выбирают из группы, состоящей из связи, N, S и CH(R17);
R17 выбирают из группы, состоящей из H, необязательно замещенного N-морфолинметилом или гидроксигруппой C1-C8алкила, -C(=O)-CH3, C1-C8алкоксикарбонила и C1-C8алкокси;
где
1) кольцо J содержит 0-2 кольцевых гетероатома;
2) любые две соседние гидроксильные группы кольца J могут быть объединены в кольцо диоксолана;
3) любые два соседних кольцевых атома углерода кольца J могут быть объединены с образованием конденсированного фенильного кольца;
4) любые два соседних кольцевых атома азота кольца J могут быть объединены с образованием конденсированного гетероциклического кольца, которое может быть замещено 1-2 группами C1-C4алкила или фенила;
при условии, что
1) один из A, B, C, D, E или F представляет по крайней мере один атом углерода, который является насыщенным;
2) кольцо J не содержит два соседних кольцевых атома O;
3) кольцо J содержит максимально две кольцевых группы C(=O);
Q выбирают из группы, состоящей из NR13, NR7A, где R7A является таким же, как R7;
W выбирают из группы, состоящей из CR18R7 и CHR2, где R2 представляет H или C1-C4алкил с прямой, циклической или разветвленной цепью;
R13 выбирают из группы, состоящей из H, -C (=O)NR11R12, алкила с 1-8 углеродами;
R18 представляет H или C1-C4алкил;
A1A2 и B1B2 представляют H,H или вместе образуют =O; при условии, что по крайней мере одна из пар A1 и A2 или B1 и B2 образует =O;
при условии, что когда Q означает NH или NR7A и в любой группе R7 или R7A m равно 0 и G соответствует связи, R8 означает H, а R7 или R7A содержат один кольцевой гетероатом кислорода в положении A в 5- или 6-членном кольце, тогда B не может быть CHR17, где R17 является замещенным или незамещенным C1-C8алкилом; и
при другом условии, что соединение формулы I содержит одну группу R7 или R7A или как группу R7, так и группу R7A.
2. Соединение по п.1, в котором
A выбирают из группы, состоящей из O, CHR17 и C(=O);
B выбирают из группы, состоящей из O, NR17, S, CHR17, C(OH)R17 и C(=O);
R17 выбирают из группы, состоящей из H, необязательно замещенного N-морфолинометилом или гидроксигруппой C1-C8алкила, и C1-C4алкокси, где
1) кольцо J содержит 0-2 кольцевых гетероатома;
2) любые две соседние гидроксильные группы кольца J могут быть объединены в кольцо диоксолана;
3) любые два соседних кольцевых атома углерода кольца J могут быть объединены с образованием конденсированного фенильного кольца;
при условии, что
1) один из A, B, C, D, E или F представляет по крайней мере один атом углерода, который является насыщенным;
2) кольцо J не содержит два соседних кольцевых атома O;
3) кольцо J содержит максимально две кольцевых группы C(=O); и
R8 выбирают из группы, состоящей из H, O(C=O)NR11R12, ацилокси, где ацил представляет алканоил с прямой или разветвленной цепью, содержащий 1-6 атомов углерода, C2-C4алкенила, -O-CH2-O-(CH2)2-O-CH3, галогена, замещенного галогеном фенила, -OR10, тиенила; алкила, содержащего от 1 до 4 атомов углерода, замещенного 2 гидроксигруппами.
3. Соединение по п.2, в котором A1,A2 означает H,H, а B1,B2 означает =O.
4. Соединение по п.2, в котором Q означает NR13.
5. Соединение по п.2, в котором Q означает NR7A.
6. Соединение по п.2, в котором W означает CR18R7.
7. Соединение по п.2, в котором R7 представляет собой 3-, 4-, 5- или 6-членное карбоциклическое кольцо или 5- или 6-членное гетероциклическое кольцо, которое содержит один или два кольцевых атома O, N или S.
8. Соединение по п.7, в котором R7 представляет собой гетероциклическое кольцо, содержащее один кольцевой гетероатом O, N или S.
9. Соединение по п.2, в котором G соответствует связи или CH2.
10. Соединение по п.2, в котором R8 представляет собой H, OH, галоген, этенил, ацилокси, где ацил представляет алканоил, содержащий 1-6 атомов углерода, C1-C4алкокси, замещенный галогеном фенил, тиенил или гидроксиC1-C4алкил.
11. Соединение по п.10, в котором G соответствует связи или CH2.
12. Соединение по п.2, в котором W означает CH2 или CR18R7.
13. Соединение по п.2, в котором A1,A2 означает H,H, и B1,B2 означает =O; R3 выбирают из группы, состоящей из H, C1-C8алкокси, F, Cl, Br, I, C1-C4алкоксиметила, C1-C4алкокси-C1-C4алкоксиметилр ш C1-C4алкоксиC1-C4алкоксикарбонила; R5 означает H или C1-C4алкокси, G соответствует связи или CH2; W означает CH2 или CR18R7; R8 выбирают из группы, состоящей из H, OH, галогена, этенила, ацилокси, где ацил представляет алканоил, содержащий 1-6 атомов углерода, C1-C4алкокси, замещенного галогеном фенила, тиенила или гидроксиC1-C4алкила; и Q означает NR13 или NR7A.
14. Соединение по п.2, в котором Q означает NR13, где R13 означает H, G соответствует связи; W означает CR18R7, где R18 означает H или C1-C4алкил; и R3 выбирают из группы, состоящей из H, C1-C4алкокси и C1-C4алкоксиC1-C4алкоксикарбонила; и R5 означает H или C1-C4алкокси.
15. Соединение по п.14, в котором R7 представляет собой гетероциклическое кольцо, содержащее один кольцевой гетероатом O, N или S.
16. Соединение по п.1, в котором переменные составляющие соединений формулы I выбирают в соответствии со следующей таблицей:
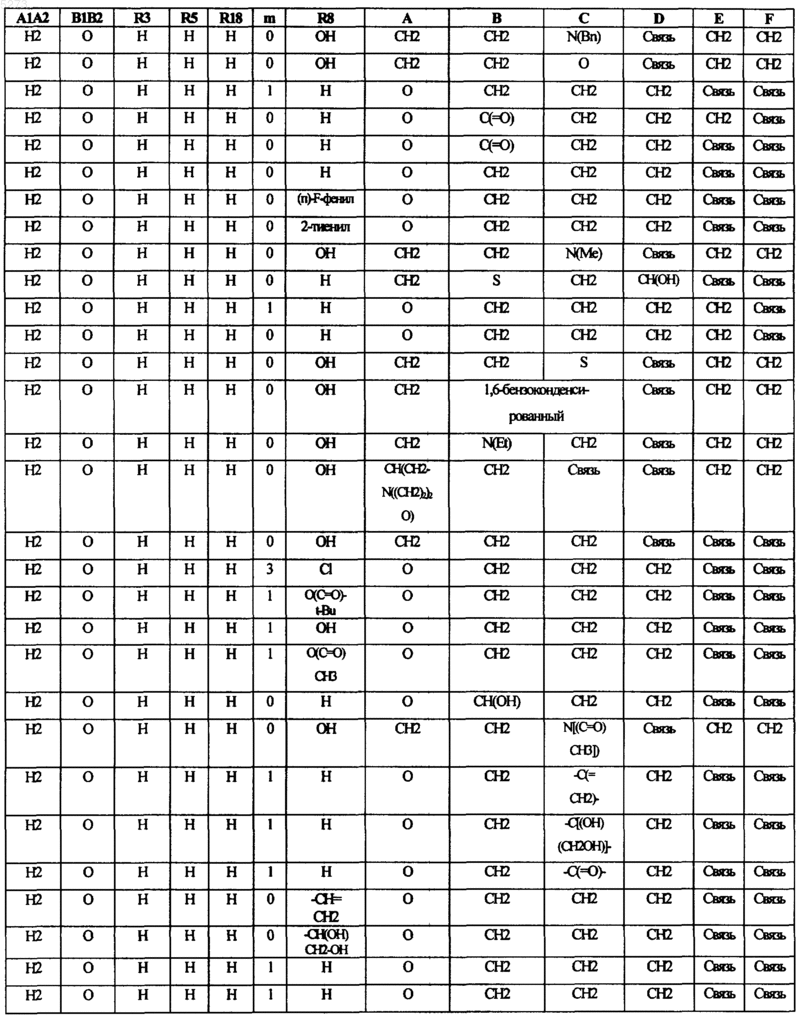
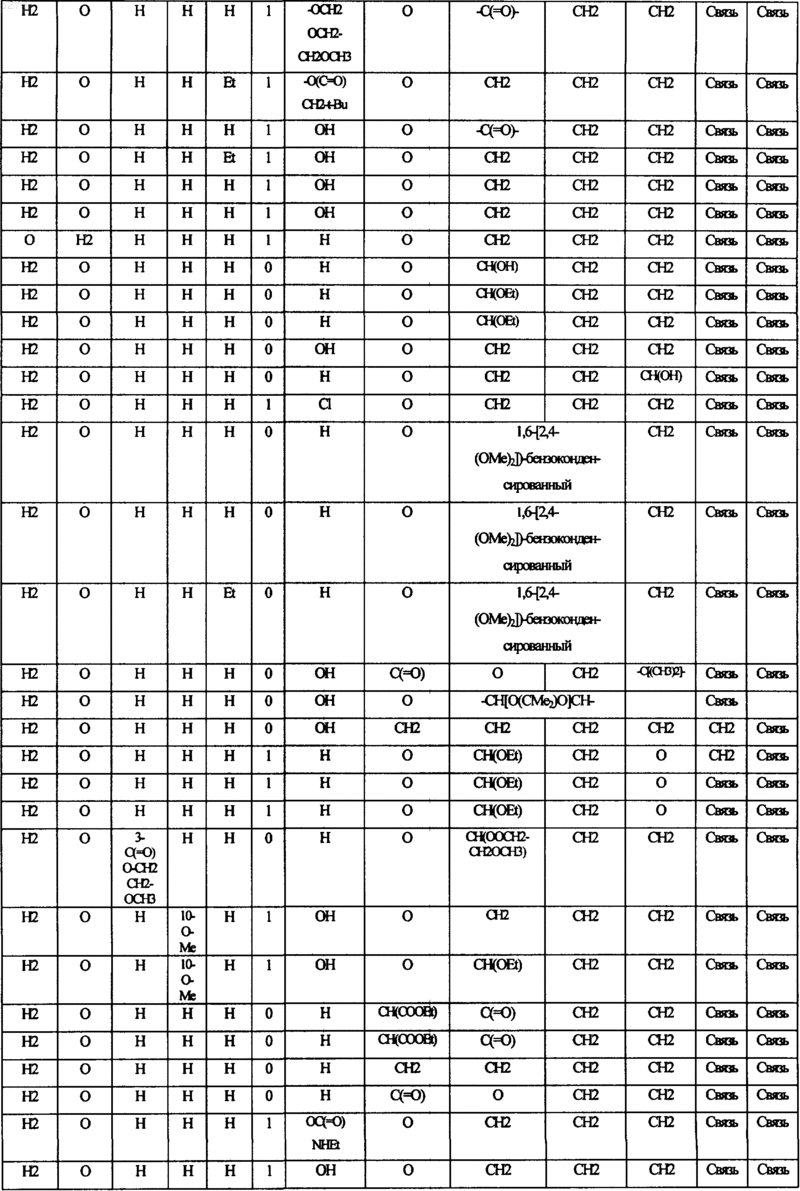
17. Соединение по п.2, в котором Q означает NR7A; R5 и R8 означает H; W является CH2; m равно 0; G соответствует связи или CH2; и R3 выбирают из группы, состоящей из H, F, Cl, Br, I, C1-C4алкоксиметила и C1-C4алкоксиC1-C4алкоксикарбонила.
18. Соединение по п.17, в котором R7A представляет собой 3-, 4-, 5- или 6-членное карбоциклическое кольцо или 5- или 6-членное гетероциклическое кольцо, которое содержит один или два кольцевых атома O, N или S.
19. Соединение по п.17, в котором R7A представляет собой 3-, 4-, 5- или 6-членное гетероциклическое кольцо, которое содержит один кольцевой атом O.
20. Соединение по п.1, в котором переменные составляющие соединений формулы I выбирают в соответствии со следующей таблицей:
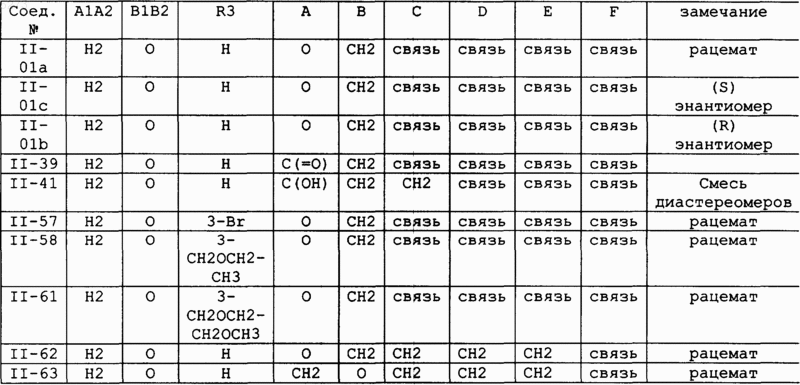
21. Соединение по п.2, в котором R1, R3, R4 и R6, каждый, означает H; A1,A2 означает H,H; B1,B2 означает =O; Q является NH; R5 означает H или C1-C4алкокси; W соответствует CR18R7, где R18 означает H; G соответствует связи; m равно 1; R8 означает OH или -OC(=O)R9, где R9 означает C1-C8алкил; A является O; B, C и D, каждый, соответствует CHR17, где R17 означает H; и E и F, каждый, соответствует связи [соединения II-53, II-36 и II-22].
22. Соединение по п.1, в котором R1, R3, R4, R5 и R6, каждый, означает H; A1,A2 означает H,H; B1,B2 означает =O, W является CH2 и Q означает NR7A.
23. Соединение по п.1, в котором R1, R3, R4, R5 и R6, каждый, означает H; A1,A2 означает H,H; B1,B2 означает =O, Q является NH, а W является CR18R7, где R18 означает H.
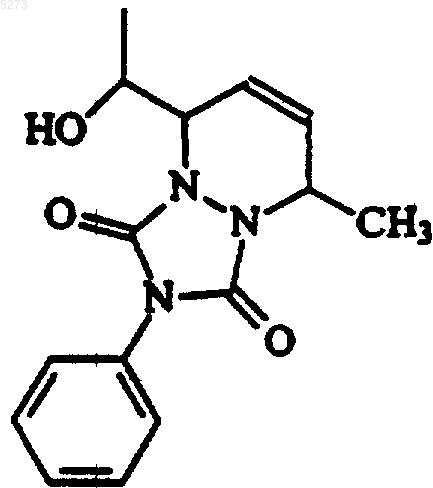
24. Соединение по п.23, в котором G означает CHOH, m равно 0, R8 является H, A и B образуют -CH=CH-, C означает CHR17, в котором R17 является -CH3, D соответствует связи, E и F, каждый, означает N.
25. Соединение по п.24, в котором R7 имеет формулу
26. Соединение по п.22, в котором G является этиленом, m равно 0, R8 означает H, A означает NH, B означает CHR17, C и D, каждый, соответствует связи, E означает CH2 и F означает S.
27. Соединение формулы
где R1, R2, R3, R4, R5, R6, каждый, представляет H; A1A2 означает H,H; B1B2 означает =O;
Q является NH и
W представляет
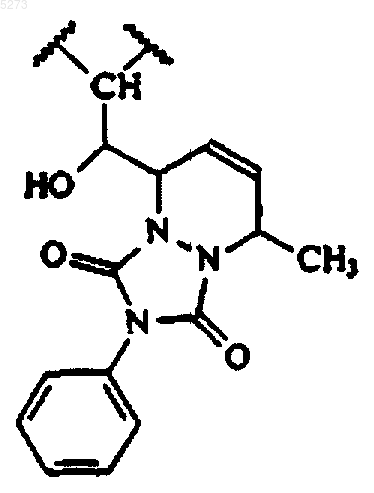
или
Q является N-CH2-циклопропил и W представляет CH-CH2-циклопропил; или
W представляет CH2 и Q является
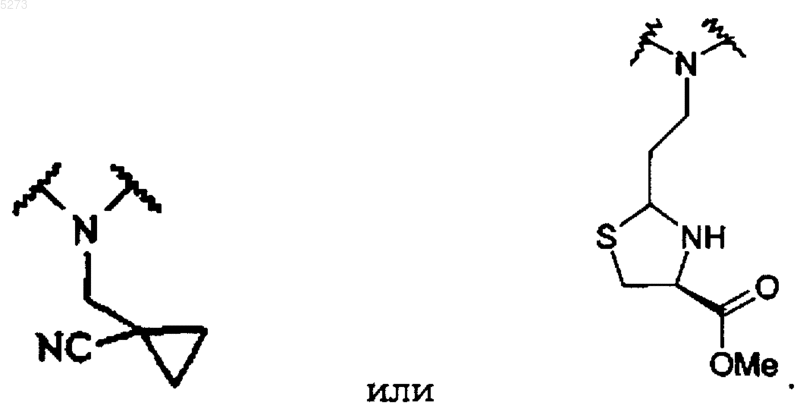
28. Соединение формулы
где переменные составляющие A1, A2, B1, B2 и R3-R6 имеют значения, указанные в п.1, R19 выбирают из группы, состоящей из H, C1-C8алкила, C1-C6ацила и C(=O)NR11R12, где R11 и R12 имеют значения, указанные в п.1, где R1 имеет значения, указанные в п.1, и дополнительно может представлять защитную группу или полимерный носитель, X означает H или O.
29. Соединение по п.28 формулы

30. Фармацевтическая композиция, содержащая соединение по п.1 или 27 и фармацевтически приемлемый носитель.
31. Фармацевтическая композиция для лечения или предупреждения расстройств простаты, содержащая соединение по п.1 или 27 и фармацевтически приемлемый носитель.
32. Фармацевтическая композиция по п.31, где расстройства простаты представляют собой рак простаты или доброкачественную гиперплазию простаты.
33. Фармацевтическая композиция для лечения или предупреждения неоплазии, ревматоидного артрита, фиброза легких, миелофиброза, аномального заживления ран, атеросклероза или рестеноза, содержащая соединение по п.1 или 27 и фармацевтически приемлемый носитель.
34. Фармацевтическая композиция для лечения или предупреждения болезни Альцгеймера, амиотрофического латерального склероза, болезни Паркинсона, удара, ишемии, болезни Гентингтона, СПИД-деменция, эпилепсии, рассеянного склероза, периферической невропатии или повреждений головного или спинного мозга, содержащая соединение по п.1 или 27 и фармацевтически приемлемый носитель.
35. Способ ингибирования киназы, которую выбирают из киназы trk, VEGFR, MLK и FGFR, включающий использование соединения по п.1 или 27 в количестве, достаточном, чтобы привести к эффективному ингибированию.
36. Способ по п.35, в котором соединение по п.1 или 27 используют для лечения воспаления.
37. Способ лечения или предупреждения расстройств простаты, который включает введение пациенту, нуждающемуся в таком лечении или предупреждении, терапевтически эффективного количества соединения по п.1 или 27.
38. Способ по п.37, в котором расстройство простаты представляет собой рак простаты или доброкачественную гиперплазию простаты.
39. Способ лечения или предупреждения нарушений, при которых активность VEGFR способствует развитию патологических состояний, таких как рак, эндометриоз, псориаз, гемангиобластома или заболевание глаз, включающий использование соединения по п.1 или 27 в количестве, достаточном, чтобы происходило контактирование рецептора тромбоцитарного фактора роста с эффективно ингибирующим количеством соединения.
40. Способ по п.39, в котором нарушением является рак.
41. Способ по п.40, в котором нарушение представляет собой солидные опухоли или злокачественные заболевания гемопоэтической или лимфатической системы.
42. Способ по п.39, в котором нарушением является заболевание глаз.
43. Способ по п.42, в котором заболевание глаз представляет собой диабетическую ретинопатию.
44. Способ лечения или предупреждения болезни Альцгеймера, амиотрофического латерального склероза, болезни Паркинсона, удара, ишемии, болезни Гентингтона, СПИД-деменция, эпилепсии, рассеянного склероза, периферической невропатии или повреждений головного или спинного мозга, рака, рестеноза, остеопороза, воспаления, ангиогенеза, вирусных инфекций, костных и гемопоэтических заболеваний, аутоиммунных заболеваний или отторжения трансплантата, который включает введение пациенту, нуждающемуся в таком лечении или предупреждении, терапевтически эффективного количества соединения по п.1 или 27.
Текст
1 Перекрестная ссылка на родственные заявки Данная заявка подтверждает приоритетное содержание предварительной заявки на патент США серии 60/119834, поданной 12 февраля 1999 г., содержание которой включено в описание ссылкой в полном объеме. Область изобретения Данное изобретение направлено на циклические замещенные арил- и гетероарилконденсированные пирролкарбазолы и изоиндолоны,которые в описании упоминают как "циклические замещенные конденсированные пирролкарбазолы и изоиндолоны". Изобретение также направлено на способы создания и применения циклических замещенных конденсированных пирролкарбазолов и изоиндолонов. Предпосылки создания изобретения Протеинкиназы играют существенную роль в контроле роста и дифференцировки клеток. Показано, что аномальная экспрессия или мутации в протеинкиназах приводят к неконтролируемой пролиферации клеток, такой как рост злокачественных опухолей, и различным дефектам в процессах развития, включающим миграцию и инвазию клеток, и ангиогенезу. Поэтому протеинкиназы являются ключевыми факторами в контроле, регуляции и модуляции пролиферации клеток при заболеваниях и нарушениях, связанных с аномальной клеточной пролиферацией. Протеинкиназы также вовлечены в качестве мишеней в нарушения центральной нервной системы, такие как болезнь Альцгеймера, воспалительные нарушения, такие как псориаз, костные заболевания, такие как остеопороз, атеросклероз, рестеноз, тромбоз, метаболические нарушения, такие как диабет, и инфекционные заболевания, такие как вирусные и грибковые инфекции. Одним из наиболее изучаемых путей метаболизма, включающих киназную регуляцию,является клеточная передача сигнала от рецепторов на поверхности клетки к ядру. Обычно функцию каждого рецептора определяют по характеру его экспрессии, доступности лиганда и ряду путей передачи сигнала в прямом направлении, которые активируются особым рецептором. Примером такого пути является каскад киназ, в котором представители тирозинкиназ рецептора фактора роста передают сигналы через фосфорилирование к другим киназам, таким как Src тирозинкиназа и представителям семейства Raf, Mek и Erk-серин/треонинкиназ. Каждая из этих киназ представлена несколькими членами семейства, которые играют близкие,но функционально различные роли. Потеря регуляции пути передачи сигнала фактора роста представляет частое явление при раке, а также других патологических состояниях. Fearon, Genetic Lesions in Human Cancer, Molecular Oncology, 1996, 143-178.Rafl серин/треонинкиназа может быть активирована известным онкогенным продуктомras. Raf-киназный фермент позитивно регулирует клеточное деление через Raf/MEK/ERK протеинкиназный каскад. Такая активация является результатом cRafl-катализируемого фосфорилирования протеинкиназы, МЕK1, которая фосфорилирует и активирует протеинкиназу. ERK фосфорилирует и регулирует факторы транскрипции, необходимые для деления клеток.Avruch et al., TIBS, 1994 (19) 279-283. crafl негативно регулирует гибель клеток, модифицируя активность Всl-2, важного регулятора апоптоза. Такая регуляция включает прямое фосфорилирование членов семейства Всl-2. Gajewski andThompson, Cell, 1996 (87) 619-628. Для описанных аспектов cRafl-опосредованной регуляции пролиферации клеток необходима киназная активность cRafl. Также описано, что снижение уровней белка Raf коррелирует со снижением скорости роста опухолей in vivo на мышиных моделях опухолей. Monia, Johnston, Geiger, Muller, and Fubro, NatureMedicine, Vol. 2,6, June 1996, 668-674. Поэтому ингибиторы киназной активности cRafl должны обеспечить эффективное лечение большого разнообразия раков человека. Активация путей передачи сигналов МАРкиназы представляет собой привлекательную мишень в отношении терапии опухолей ингибированием одной или более вовлеченных киназ. Дополнительным представителем белков семейства MAP-киназ является р 38-киназа, альтернативно известная как цитокин-супрессивное лекарственное средство, связывающее белок или реактивирующее киназу, RK. Активация данной киназы вовлечена в продуцирование провоспалительных цитокинов, таких как IL-1 и TNF. Поэтому ингибирование данной киназы может быть предложено как лечение патологических состояний, при которых имеет место нарушение образования цитокинов. Также показано, что опосредованные киназами сигналы контролируют рост клеток, клеточную гибель и дифференцировку в клетке регулированием процессов клеточного цикла. Прогрессивное развитие на протяжении эукариотического клеточного цикла контролируется семейством киназ,названных циклинзависимыми киназами (CDKs). Нарушение контроля регуляции CDK представляет частое явление при гиперпролиферативных заболеваниях и раке. Ингибиторы киназ, вовлеченные в опосредование или поддержание определенных болезненных состояний, представляют собой новые виды терапии для таких нарушений. Примеры таких киназ включают ингибирование Src, raf и циклинзависимых киназ (CDK) 1, 2 и 4 при раке, CDK2 или киназы PDGF-R при рестенозе,киназ CDK5 и GSK3 при болезни Альцгеймера,c-Src-киназы при остеопорозе, GSK-3-киназы при диабете типа-2, р 38-киназы при воспалении,киназ VEGE-R 1-3 и TIE-1 и TIE-2 при ангиоге 3 незе, UL97-киназы при вирусных инфекциях,CSF-1R-киназы при костных и гемопоэтических заболеваниях и Lck-киназы при аутоиммунных заболеваниях и отторжении трансплантата. Вещество микробного происхождения,упоминаемое как "К-252 а", является необычным соединением, которое привлекает большое внимание в течение последних нескольких лет, благодаря целому ряду функциональных активностей, которыми оно обладает. К-252 а представляет собой индолкарбазольный алкалоид, который первоначально был выделен из культурыNocardiosis sp. (Kase, H. et al., 39 J. Antibiotics 1059, 1986). K-252a является ингибитором нескольких ферментов, включая протеинкиназу С(РКС), которая играет центральную роль в регуляции клеточных функций, и trk-тирозинкиназу. Описанные функциональные активности К-252 а и его производных многочисленны и разнообразны: ингибирование опухолей (cм. патенты США 4877776, 4923986 и 5063330; европейская публикация 238011 от имени Nomato); антиII-инсектицидная активность (см. патент США 4735939); ингибирование воспаленияCephalon, Inc. and Kyowa Hakko Kogyo Co.,Ltd.); и лечение заболевания простаты (см. патенты США 5516771 и 5654427). Также описано, что К-252 а ингибирует продуцирование IL-2 (см. Grove, D.S. et al., Experimental CellResearch 193: 175-182, 1991). Описанные индолкарбазолы обладают некоторыми общими характерными свойствами. В частности, каждый содержит три пятичленных кольца, все из которых включают фрагмент азота, к тому же стауроспорин (происходящий изStreptomyces sp.) и К-252 а, каждый, содержит сахаросодержащий фрагмент, соединенный посредством двух N-гликозидных связей. Как К 252 а, так и стауроспорин хорошо изучены в отношении их применения в качестве терапевтических средств. Индолкарбазолы в общем являются липофильными, что позволяет им сравнительно легко проходить через биологические мембраны и в отличие от белокподобных веществ они характеризуются более длительным периодом полураспада in vivo. Хотя К-252 а обычно получают из культуральной среды способом ферментации, осуществлен общий синтез природного (+) изомера и неприродного (-) изомера, в котором три хиральных углерода сахара имеют противоположную конфигурацию (см. Wood et al., J. Am.Chem. Soc. 117: 10413, 1995, и WIPO международная заявка WO 97/07081). Однако такой синтез не пригоден для коммерческих целей. В дополнение к индолкарбазольным алкалоидам, представленным К-252 а и стауроспори 005273 4 ном, получены синтетические небольшие органические молекулы, которые являются биологически активными и известны как конденсированные пирролкарбазолы (см. патенты США 5475110; 5591855; 5594009; 5705511 и 5616724). Также известны конденсированные изоиндолоны, которые являются не содержащими индол молекулами, которые могут быть синтезированы химически de novo (см. патент США 5808060 и WIPO международная заявка WO 97/21677). Также описаны некоторые макроциклические производные бис-индолилмалеимида (см. для примера патенты США 5710145; 5672618; 5552396 и 5545636). Сахаросодержащие производные индолпирролкарбазолов описаны также (см. WIPO международная заявка WO 98/07433). Таким образом, существует потребность в новых классах соединений, которые проявляют активность в отношении протеинкиназ рецепторного и нерецепторного типа. Установлено,что класс соединений, упоминаемых в описании как циклические замещенные конденсированные пирролкарбазолы и изоиндолоны, полезны в качестве агентов для регуляции протеинкиназы. Поэтому данное изобретение, к тому же,направлено на их применение в качестве терапевтических средств для лечения вышеперечисленных нарушений, а также для других важных целей. Краткое изложение изобретения Данное изобретение направлено на циклические замещенные арил- и гетероарилконденсированные пирролкарбазолы и изоиндолоны. Примерами соединений изобретения являются соединения общей формулы IG соответствует связи; или алкилену, содержащему от 1 до 4 углеродов, причем группа алкилена незамещена или замещена ОН;-O(C=O)NR11R12; -CN; ацилокси, где ацил представляет алканоил с прямой или разветвленной цепью, содержащий 1-6 атомов углерода; С 2 С 8 алкенила; -О-СН 2-О-(СН 2)2-О-СН 3; галогена;R17 выбирают из группы, состоящей из Н,необязательно замещенного N-морфолинметилом или гидроксигруппой C1-С 8 алкила, -С(=О)СН 3, C1-С 8 алкоксикарбонила и C1-С 8 алкокси; где 1) кольцо J содержит 0-2 кольцевых гетероатома; 2) любые две соседние гидроксильные группы кольца J могут быть объединены в кольцо диоксолана; 3) любые два соседних кольцевых атома углерода кольца J могут быть объединены с образованием конденсированного фенильного кольца; 4) любые два соседних кольцевых атома азота кольца J могут быть объединены с образованием конденсированного гетероциклического кольца, которое может быть замещено 1-2 группами С 1-С 4 алкила или фенила; при условии, что 6 1) один из А, В, С, D, Е или F представляет по крайней мере один атом углерода, который является насыщенным; 2) кольцо J не содержит два соседних кольцевых атома О; 3) кольцо J содержит максимально две кольцевых группы С(=O);CR18R7 и CHR2, где R2 представляет Н или С 1 С 4 алкил с прямой, циклической или разветвленной цепью;R18 представляет Н или С 1-С 4 алкил; А 1 А 2 и В 1 В 2 представляют Н,Н; или вместе образуют =O; при условии, что по крайней мере одна из пар А 1 и А 2, или В 1 и В 2 образует =O; при условии, что когда Q означает NH илиR7A содержат один кольцевой гетероатом кислорода в положении А в 5- или 6-членном кольце,тогда В не может быть CHR17, где R17 является замещенным или незамещенным С 1-С 8 алкилом; и при другом условии, что соединение формулы I содержит одну группу R7 или R7A или как группу R7, так и группу R7A. В некоторых предпочтительных вариантах осуществления соединений формулы I, А выбирают из группы, состоящей из О, CHR17 и С(=O); В выбирают из группы, состоящей из О,NR17, S, CHR17, C(OH)R17 и С(=O);R17 выбирают из группы, состоящей из Н,необязательно замещенного N-морфолинометилом или гидроксигруппой C1-С 8 алкила, и С 1-С 4 алкокси; где 1) кольцо J содержит 0-2 кольцевых гетероатома; 2) любые две соседние гидроксильные группы кольца J могут быть объединены в кольцо диоксолана; 3) любые два соседних кольцевых атома углерода кольца J могут быть объединены с образованием конденсированного фенильного кольца; при условии, что 1) один из А, В, С, D, Е или F представляет по крайней мере один атом углерода, который является насыщенным; 2) кольцо J не содержит два соседних кольцевых атома О; 3) кольцо J содержит максимально две кольцевых группы С(=O); и(C=O)NR11R12, ацилокси, где ацил представляет алканоил с прямой или разветвленной цепью,содержащий 1-6 атомов углерода; С 2 С 4 алкенила, -O-СН 2-О-(СН 2)2-О-СН 3, галогена, 7 замещенного галогеном фенила, -OR10, тиенила; алкила, содержащего от 1 до 4 атомов углерода,замещенного 2 гидроксигруппами. В некоторых предпочтительных вариантах осуществления соединений изобретения A1,A2 означает Н,Н, aB1,B2 означает =O. Предпочтительно R1, R4 и R6 соответствуют Н, и один из A1,A2 или B1,B2 соответствует Н,Н, а другой соответствует =O. В следующих предпочтительных вариантах осуществления Q означает NR13. В некоторых предпочтительных вариантах осуществления Q означает NR7A. В других предпочтительных вариантах осуществления Q означает NR13. В следующих предпочтительных вариантах осуществления соединений изобретения W означает CR18R7. В некоторых предпочтительных вариантах осуществления, R7 представляет собой 3-, 4-, 5 или 6-членное карбоциклическое кольцо, или 5 или 6-членное гетероциклическое кольцо, которые содержат один или два кольцевых атома О,N или S. Более предпочтительно R7 представляет собой гетероциклическое кольцо, содержащее один кольцевой гетероатом O, N или S. В других предпочтительных вариантах осуществления G соответствует связи или СН 2. В некоторых предпочтительных вариантах осуществления R8 представляет собой Н, ОН,галоген, этенил, ацилокси, где ацил представляет алканоил, содержащий 1-6 атомов углерода,C1-С 4 алкокси, замещенный галогеном фенил,тиенил или гидроксиС 1-С 4 алкил. При этом предпочтительно, чтобы в таком предпочтительном варианте осуществления G соответствовал связи или СН 2. В некоторых предпочтительных вариантах осуществления соединений формулы I, A1,A2 означает Н,Н, и B1,B2 означает =O; R3 выбирают из группы, состоящей из Н, С 1-С 8 алкокси, F, Cl,Вr, I, С 1-С 4 алкоксиметила, С 1-С 4 алкокси-С 1 С 4 алкоксиметила и C1-С 4 алкоксиС 1-С 4 алкоксикарбонила; R5 означает Н или С 1-С 4 алкокси, G соответствует связи или СН 2; W означает СН 2 или CR18R7; R8 выбирают из группы, состоящей из Н, ОН, галогена, этенила, ацилокси, где ацил представляет алканоил, содержащий 1-6 атомов углерода, С 1-С 4 алкокси, замещенного галогеном фенила, тиенила или гидроксиС 1-С 4 алкила; и Q означает NR13 или NR7A. В следующих предпочтительных вариантах осуществления соединений формулы I Q означает NR13, где R13 означает Н, G соответствует связи; W означает CR18R7, где R18 означает Н или С 1-С 4 алкил; и R3 выбирают из группы,состоящей из Н, C1-С 4 алкокси и С 1-С 4 алкоксиС 1-С 4 алкоксикарбонила, и R5 означает Н или С 1-С 4 алкокси. В более предпочтительных вариантах осуществления соединений формулы I R7 представ 005273 8 ляет собой гетероциклическое кольцо, содержащее один кольцевой гетероатом О, N или S. В некоторых особенно предпочтительных вариантах осуществления переменные составляющие соединений формулы I выбирают в соответствии с табл. 7 ниже. В других более предпочтительных вариантах осуществления соединений формулы I Q означает NR7A; R5 и R8 означает Н; W является СН 2; m равно 0; G соответствует связи или СН 2; и R3 выбирают из группы, состоящей из Н, F, Cl,Br, I, C1-С 4 алкоксиметила и С 1-С 4 алкоксиС 1 С 4 алкоксикарбонила. Предпочтительно R7A представляет собой 3-, 4-, 5- или 6-членное карбоциклическое кольцо, или 5- или 6-членное гетероциклическое кольцо, которое содержит один или два кольцевых атома О, N или S. Также предпаочтительными являются варианты осуществления, в которых R7A представляет собой 3-, 4-, 5- или 6 членное гетероциклическое кольцо, которое содержит один кольцевой атом О. В некоторых особенно предпочтительных вариантах осуществления переменные составляющие соединений формулы I выбирают в соответствии с табл. 8 ниже. В некоторых предпочтительных вариантах осуществления соединений формулы I R1, R3, R4 и R6, каждый, означает Н; A1,A2 означает Н,Н;B1,B2 означает =O; Q является NH; R5 означает Н или С 1-С 4 алкокси; W соответствует CR18R7,где R18 означает Н; G соответствует связи; m равно 1; R8 означает ОН или -OC(=O)R9, где R9 означает C1-С 8 алкил; А является О; В, С и D,каждый соответствует CHR17, где R17 означает Н; и Е и F, каждый, соответствует связи [соединения II-53, II-36 и II-22]. В других предпочтительных вариантах осуществления соединений формулы I R1, R3,R4, R5 и R6, каждый, означает Н; A1,A2 означает Н,Н; B1,B2 означает =O, W является СН 2 и Q означает NR7A. В следующих предпочтительных вариантах осуществления соединений формулы I R1,R3, R4, R5 и R6, каждый, означает Н; A1,A2 означает Н,Н; В 1,В 2 означает =O, Q является NH, a 9 В других предпочтительных вариантах осуществления соединений формулы I R1, R3,R4, R5 и R6, каждый, означает Н; A1,A2 означает Н,Н; B1,B2 означает =O, W является СН 2 и Q означает NR7A, G является этиленом, m равно О,R8 означает Н, А означает NH, В означаетCHR17, С и D, каждый, соответствует связи, Е означает СН 2 и F означает S. Данное изобретение также предоставляет циклические замещенные арил- и гетероарилконденсированные пирролкарбазолы и изоиндолоны формулы II Изобретение направлено также на соединения формулы где переменные составляющие A1, А 2, B1, B2 иR3-R6 имеют значения, указанные выше для соединений формулы I, R19 выбирают из группы,состоящей из Н, C1-С 8 алкила, C1-С 6 ацила и С(=O)NR11R12, где R11 и R12 имеют значения,указанные для соединений формулы I; где R1 10 имеет значения, указанные для соединений формулы I и дополнительно может представлять защитную группу или полимерный носитель, X означает Н или О. Предпочтительно указанное соединение имеет структуру Соединения изобретения, в числе прочего,полезны для повышения индуцированной трофическим фактором активности клеток, чувствительных к трофическому фактору, например,холинэргических нейронов, а также соединения могут действовать как агенты, способствующие выживанию для других типов нейронных клеток, например, допаминэргических и глутаматэргических, и, таким образом, являются благоприятными фармакологическими и терапевтическими веществами. Данные соединения также используют при лечении нарушений, связанных со сниженной активностью ChAT или гибелью или повреждением мотонейронов спинного мозга, а также применяют при заболеваниях, связанных с апоптотической гибелью клеток центральной и периферической нервной системы,иммунной системы и при воспалительных заболеваниях. Представленные в описании соединения циклических замещенных конденсированных пирролкарбазолов и изоиндолонов также могут найти применение для лечения патологических состояний, включающих злокачественную пролиферацию клеток, таких как рак. Таким образом, в соответствии с данным изобретением предлагается способ ингибирования киназы, включающей использование соединения по п.1 в количестве, достаточном, чтобы в результате происходило эффективное ингибирование. Предпочтительно киназы выбирают изFGFR. В некоторых предпочтительных вариантах осуществления способы изобретения предназначены для лечения воспаления. В других предпочтительных вариантах осуществления способы предназначены для лечения или предупреждения заболеваний простаты, которые включают введение пациенту, нуждающемуся в таком лечении или предупреждении, терапевтически эффективного количества соединения изобретения. В некоторых предпочтительных вариантах осуществления заболеванием простаты является рак простаты или доброкачественноя гиперплазия простаты. 11 В других предпочтительных вариантах осуществления способов изобретения способ предусматривает лечение или предупреждение нарушений, при которых активность VEGFR способствует развитию патологических состояний, включающий обеспечение соединением изобретения в количестве, достаточном, чтобы происходило контактирование рецептора тромбоцитарного фактора роста с эффективно ингибирующим количеством соединения, причем предпочтительным нарушением является рак,эндометриоз, псориаз, гемангиобластома или заболевание глаз и более предпочтительно, когда нарушением является солидная опухоль,злокачественные заболевания гемопоэтической или лимфатической системы или заболевание глаз, которое предпочтительно является диабетической ретинопатией. В некоторых предпочтительных вариантах осуществления способов изобретения способы предназначены для лечения или предупреждения нарушений, при которых активностьPDGFR способствует развитию патологических состояний, заключающиеся в использовании соединения изобретения в количестве, достаточном, чтобы происходило контактирование тромбоцитарного фактора роста с эффективно ингибирующим количеством соединения. В других предпочтительных вариантах осуществления способов изобретения способ предназначен для лечения или предупреждения неоплазии, ревматоидного артрита, фиброза легких, миелофиброза, аномального заживления раны, атеросклероза или рестеноза, который заключается во введении пациенту, нуждающемуся в таком лечении или предупреждении, терапевтически эффективного количества соединения изобретения. В следующих предпочтительных вариантах осуществления способов изобретения способ предназначен для лечения или предупреждения нарушений, характеризующихся аномальной активностью клеток, чувствительных к трофическому фактору, заключающийся в использовании соединения изобретения в количестве, достаточном для контактирования клеточного рецептора трофического фактора с количеством соединения, индуцирующим эффективную активность. В других предпочтительных вариантах осуществления способов изобретения способ предназначен для лечения или предупреждения болезни Альцгеймера, амиотрофического латерального склероза, болезни Паркинсона, удара,ишемии,болезни Гентингтона,СПИДдеменция, эпилепсии, рассеянного склероза,периферической невропатии или повреждений головного или спинного мозга, который включает введение пациенту, нуждающемуся в таком лечении или предупреждении, терапевтически эффективного количества соединения изобретения. 12 В других предпочтительных вариантах осуществления способов изобретения способ предназначен для лечения или предупреждения нарушений, характеризующихся аномальной активностью протеинкиназы, который включает введение пациенту, нуждающемуся в таком лечении или предупреждении, терапевтически эффективного количества соединения изобретения. В еще некоторых предпочтительных вариантах осуществления способов изобретения способ предназначен для лечения или предупреждения нарушений, при которых или киназа рецептора фактора роста сосудистого эндотелия(VEGFR), trkA-тирозинкиназа (trkA), киназа смешанных линий (MLK) или киназа фактора роста фибробластов (FGFR) участвуют в развитии патологических состояний, причем способ включает использование соединения изобретения в количестве, эффективном, чтобы происходил контакт рецептора с эффективно ингибирующим количеством соединения. В некоторых предпочтительных вариантах осуществления способов изобретения способы предназначены для лечения или предупреждения заболеваний опосредованных киназой, выбранной из аb1, АKТ, bcr-ab1, Blk, Brk, Btk, ckit, c-met, c-src, CDK1, CDK2, CDK4, CDK6,chk1, chk2, cRafl, CSF1R, CSK, EGFR, ErbB2,ЕrbВ 3, ErbB4, ERK(Eph), ERK2, Fak, fes,FGFR1, FGFR2, FGFR3, FGFR4, FGFR5, Fgr,FLK-4, flt-1, Fps, Frk, Fyn, GSK, Hck, IGF-1R,INS-R, Jak, JNK, tau, VEGFR1, VEGFR2,VEGFR3, Lck, Lyn, MEK, p38, PDGFR, PIK,PKC, PYK2, ros, tie1, tie2, TRK, UL97, Yes иZap70, причем способ включает введение пациенту, нуждающемуся в таком лечении или предупреждении, фармацевтически эффективного количества соединения изобретения. В других предпочтительных вариантах осуществления способы предназначены для лечения или предупреждения нарушений, при которых киназа, выбранная из аb1, АKТ, bcr-ab1,Blk, Brk, Btk, c-kit, c-met, c-src, CDK1, CDK2,CDK4, CDK6, chkl, chk2, cRafl, CSF1R, CSK,EGFR, ErbB2, ЕrbВ 3, ErbB4, ERK(Eph), ERK2,Fak, fes, FGFR1, FGFR2, FGFR3, FGFR4,FGFR5, Fgr, FLK-4, flt-1, Fps, Frk, Fyn, GSK,Hck, IGF-1R, INS-R, Jak, JNK, tau, VEGFR1,VEGFR2, VEGFR3, Lck, Lyn, MEK, p38,PDGFR, PIK, PKC, PYK2, ros, tie1, tie2, TRK,UL97, Yes и Zap70, способствует развитию патологических состояний, причем способ включает использование соединения изобретения в количестве, достаточном, чтобы осуществлялось контактирование рецептора с эффективно ингибирующим количеством соединения. Также в соответствии с предпочтительными вариантами осуществления изобретения предусмотрены способы для лечения или предупреждения симптомов нарушений, при которых киназа, выбранная из ab1, АKТ, bcr-ab1, 13Blk, Brk, Btk, c-kit, c-met, c-src, CDK1, CDK2,CDK4, CDK6, chkl, chk2, cRafl, CSF1R, CSK,EGFR, ErbB2, ЕrbВ 3, ErbB4, ERK(Eph), ERK2,Fak, fes, FGFR1, FGFR2, FGFR3, FGFR4,FGFR5, Fgr, FLK-4, flt-1, Fps, Frk, Fyn, GSK,Hck, IGF-1R, INS-R, Jak, JNK, tau, VEGFR1,VEGFR2, VEGFR3, Lck, Lyn, MEK, p38,PDGFR, PIK, PKC, PYK2, ros, tie1, tie2, TRK,UL97, Yes и Zap70, способствует развитию таких симптомов, при этом способ включает использование соединения изобретения в количестве, достаточном, чтобы происходило контактирование рецептора с эффективно ингибирующим количеством соединения. Кроме того, данное изобретение обеспечивает способы лечения или предупреждения болезни Альцгеймера, амиотрофического латерального склероза, болезни Паркинсона, удара,ишемии,болезни Гентингтона,СПИДдеменция, эпилепсии, рассеянного склероза,периферической невропатии, повреждений головного или спинного мозга, рака, рестеноза,остеопороза, воспаления, ангиогенеза, вирусных инфекций, костных и гемопоэтических заболеваний, аутоиммунных заболеваний или отторжения трансплантата, которые включают введение пациенту, нуждающемуся в таком лечении или предупреждении, терапевтически эффективного количества соединения изобретения. Также в соответствии с данным изобретением предусмотрены способы лечения рака,заключающиеся в ингибировании одной или более киназ из Src, raf или киназы клеточного цикла. Предпочтительно киназой клеточного цикла является циклинзависимая киназа или"киназа точки контроля". Предпочтительно циклинзависимой киназой является CDK 1, 2, 4 или 6, а киназой "точки контроля" является chk 1 или chk 2. Описаны композиции, содержащие заявленные соединения и способы применения заявленных соединений. Также описана методология создания циклических замещенных арил- и гетероарилконденсированных пирролкарбазолов и изоиндолонов. Другие полезные способы станут очевидными специалистам в данной области, если только они будут располагать данным описанием. Описанные и другие особенности соединений данного изобретения рассмотрены более подробно ниже. Краткое описание чертежей Фиг. 1 является схематическим изображением, демонстрирующим получение R1 защищенных конденсированных пиррокарбазолов и изоиндолонов; фиг. 2 является схематическим изображением, демонстрирующим общее получение циклического соединения изобретения из ациклического реагента; фиг. 3 представляет собой схематическое изображение, демонстрирующее общее получение циклического соединения изобретения по 005273 14 средством внутримолекулярного биполярного циклоприсоединения; фиг. 4 представляет собой схематическое изображение, демонстрирующее другое общее получение циклического соединения изобретения через межмолекулярное биполярное циклоприсоединение; фиг. 5 представляет собой схематическое изображение, демонстрирующее общее получение циклического соединения изобретения в результате реакции карбанионного промежуточного соединения с циклическим кетоном,эпоксидом, оксираном или азиридином и присоединения Михаэля (Michael); фиг. 6 представляет собой схематическое изображение, демонстрирующее общее получение циклического соединения изобретения введением предпочтительного соответственно замещенного циклического промежуточного соединения в качестве нуклеофила; фиг. 7 представляет собой схематическое изображение, демонстрирующее общее получение циклического соединения изобретения в результате реакции карбанионного промежуточного соединения с сильно электрофильными реагентами; фиг. 8 представляет собой схематическое изображение, демонстрирующее общее получение циклического соединения изобретения с использованием предпочтительного соответственно замещенного циклического промежуточного соединения в качестве электрофила; фиг. 9 представляет собой схематическое изображение, демонстрирующее общее получение циклического соединения изобретения, в котором циклические заместители образуются из олефинной группы; фиг. 10 представляет собой схематическое изображение, демонстрирующее получение R1 защищенных конденсированных пирролкарбазолов и изоиндолонов; фиг. 11 представляет собой схематическое изображение получения растворимых и связанных с полимером N-лактамзащищенных конденсированных пирролкарбазолов; фиг. 12 представляет собой схематическое изображение, демонстрирующее общее получение циклического соединения изобретения в результате реакции карбанионного промежуточного соединения с ациклическим реагентом,содержащим электрофильную связь C=Y, чтобы непосредственно обеспечить циклический заместитель; фиг. 13 представляет собой схематическое изображение, демонстрирующее общее получение циклического соединения изобретения внутримолекулярным биполярным циклоприсоединением; фиг. 14 представляет собой схематическое изображение, демонстрирующее общее получение циклического соединения изобретения 15 межмолекулярным биполярным циклоприсоединением; фиг. 15 представляет собой другое схематическое изображение, демонстрирующее общее получение циклического соединения изобретения в результате реакции карбанионного промежуточного соединения с циклическим кетоном, эпоксидом, оксираном или азиридином и присоединения Михаэля; фиг. 16 представляет собой схематическое изображение, демонстрирующее общее получение циклического соединения изобретения введением предпочтительного соответственно замещенного циклического промежуточного соединения в качестве нуклеофила; фиг. 17 представляет собой другое схематическое изображение, демонстрирующее общее получение циклического соединения изобретения в результате реакции карбанионного промежуточного соединения с сильно электрофильным реагентом; фиг. 18 представляет собой другое схематическое изображение, демонстрирующее общее получение циклического соединения изобретения с использованием предпочтительного соответственно замещенного циклического промежуточного соединения в качестве электрофила; фиг. 19 представляет собой другое схематическое изображение, демонстрирующее общее получение циклического соединения изобретения, в котором циклические заместители образуются из олефинной группы; фиг. 20 представляет собой схематическое изображение, демонстрирующее общее получение циклического соединения изобретения, в котором циклический заместитель образуется из альдегидного промежуточного соединения; фиг. 21 представляет собой другое схематическое изображение, демонстрирующее общее получение циклического соединения изобретения, в котором циклический заместитель образуется из альдегидного промежуточного соединения. Подробное описание изобретения Раскрытые в настоящем описании соединения представляют собой циклические замещенные конденсированные пирролкарбазолы и изоиндолоны, представленные следующей формулой I:G соответствует связи; или алкилену, содержащему от 1 до 4 углеродов, причем группа алкилена незамещена или замещена ОН;NR11R12; -CN; ацилокси, где ацил представляет алканоил с прямой или разветвленной цепью,содержащий 1-6 атомов углерода; С 2 С 8 алкенила; -О-СН 2-О-(СН 2)2-О-СН 3; галогена;R11 и R12, каждый, независимо выбирают из группы, состоящей из Н и алкила, содержащего от 1 до 4 углеродов; А выбирают из группы, состоящей из О,CHR17 и С(=О); В выбирают из группы, состоящей из О,NR17, S, CHR17, C(OH)R17 и С(=О); или А и В вместе могут образовывать 17 2) любые две соседние гидроксильные группы кольца J могут быть объединены в кольцо диоксолана; 3) любые два соседних кольцевых атома углерода кольца J могут быть объединены с образованием конденсированного фенильного кольца; 4) любые два соседних кольцевых атома азота кольца J могут быть объединены с образованием конденсированного гетероциклического кольца, которое может быть замещено 1-2 группами С 1-С 4 алкила или фенила; при условии, что 1) один из А, В, С, D, Е или F представляет по крайней мере один атом углерода, который является насыщенным; 2) кольцо J не содержит два соседних кольцевых атома О; 3) кольцо J содержит максимально две кольцевых группы С(=O);CR18R7 и CHR2, где R2 представляет Н или С 1 С 4 алкил с прямой, циклической или разветвленной цепью;R18 представляет Н или С 1-С 4 алкил; А 1 А 2 и В 1 В 2 представляют Н,Н; или вместе образуют =O; при условии, что по крайней мере одна из пар А 1 и А 2, или В 1 и В 2 образует =O; при условии, что когда Q означает NH илиR7A содержат один кольцевой гетероатом кислорода в положении А в 5- или 6-членном кольце,тогда В не может быть CHR17, где R17 является замещенным или незамещенным C1-С 8 алкилом; и при другом условии, что соединение формулы I содержит одну группу R7 или R7A или как группу R7, так и группу R7A. Соединения изобретения включают как диастереомеры, так и энантиомеры. Так как в соединениях изобретения как кольцо В, так и кольцо F вместе с атомами углерода, к которым они присоединены, представляет фенил, циклические замещенные конденсированные пирролкарбазолы и изоиндолоны фактически представлены следующей формулой:(I) и (II), в дальнейшем упоминаются как соединение (I) или (II) и тоже самое применяется в 18 отношении соединений с другими номерами формул. Используемый в настоящем описании термин "карбоциклический" относится к циклическим группам, в которых кольцевая часть составлена исключительно из атомов углерода. Термины "гетероцикло" и "гетероциклический" относится к циклическим группам, в которых кольцевая часть включает по крайней мере один гетероатом, такой как О, N или S. Используемый в настоящем описании термин "алкил" означает группу алкила с прямой,циклической или разветвленной цепью, содержащую от 1 до 8 атомов углерода, такую как метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, изоамил,неопентил, 1-этилпропил, гексил, октил, циклопропил и циклопентил. Алкильный фрагмент алкилсодержащих групп, таких как группы алкокси, алкоксикарбонила и алкиламинокарбонила, имеют такое же значение, как определенный выше алкил. Группы низшего алкила, которые являются предпочтительными, представляют собой вышеопределенные группы алкила, которые содержат от 1 до 4 углеродов. Подразумевается, что термин"алкенил" означает углеводородные цепи с прямой или разветвленной цепью, содержащие по крайней мере одну двойную связь углеродуглерод. Примеры алкенильных групп включают группы этенила и пропенила. Используемый в данном описании термин "алкинил" предполагает наличие углеводородных цепей с прямой или разветвленной цепью, содержащих по крайней мере одну тройную связь углерод-углерод. Примеры алкинильных групп включают группы этинила и пропинила. Подразумевается, что ацильный фрагмент ацилсодержащих групп, таких как группы ацилокси, включает группу алканоила с прямой или разветвленной цепью, содержащую 1-6 атомов углерода, таких как формил, ацетил, пропаноил,бутирил, валерил, пивалоил или гексаноил. Используемый в описании термин "арил" означает группу, содержащую 6-12 атомов углерода, такую как фенил, бифенил и нафтил. Предпочтительные арильные группы включают незамещенные и замещенные группы фенила и нафтила. Используемый в описании термин "гетероарил" указывает на арильную группу, в которой один или более кольцевых атомов углерода заменены на гетеро (т.е. неуглеродный) атом, такой как О, N или S. Предпочтительные гетероарильные группы включают группы пиридила, пиримидила, пирролила, фурила, тиенила, имидазолила, тиазолила, тетразолила, хинолила, изохинолила, бензимидазолила, тиазолила, пиразолила и бензотиазолила. Подразумевается, что термин "аралкил"(или "арилалкил") означает группу, содержащую от 7 до 15 углеродов, состоящую из алкильной группы, которая несет арильную груп 19 пу. Примеры аралкильных групп включают группы бензила, фенетила, бензгидрила и нафтилметила. Алкильные группы и алкильные фрагменты, содержащиеся в замещающих группах, таких как группы аралкила, алкокси, арилалкокси, гидроксиалкокси, алкокси-алкокси,гидрокси-алкилтио, алкокси-алкилтио, алкилкарбонилокси, гидроксиалкил и ацилокси, могут быть замещенными или незамещенными. Замещенная алкильная группа имеет от 1 до 3 независимо выбранных заместителей, предпочтительно гидрокси, низший алкокси, низший алкокси-алкокси, замещенный или незамещенный арилалкокси-низший алкокси, замещенный или незамещенный гетероарилалкокси-низший алкокси, замещенный или незамещенный арилалкокси, замещенный или незамещенный гетероциклоалкокси, галоген, карбоксил, низший алкоксикарбонил, нитро, амино, моно- или динизший алкиламино, диоксолан, диоксан, дитиолан, дитион, фуран, лактон или лактам. Группы замещенного арила, замещенного гетероарила и замещенного аралкила, каждая имеет от 1 до 3 независимо выбранных заместителей, которые предпочтительно представляют собой низший алкил, гидрокси, низший алкокси,карбокси, низший алкоксикарбонил, нитро,амино, моно- или ди-низший алкиламино и галоген. Гетероциклические группы, образованные с атомом азота, включают группы пирролидинила, пиперидинила, пиперидино, морфолинила,морфолино, тиоморфолино, N-метилпиперазинила, индолила, изоиндолила, имидазола, имидазолина, оксазолина, оксазола, триазола, тиазолина, тиазола, пиразола, пиразолона, оксадиазола, тиадиазола и триазола. Гетероциклические группы, образованные с атомом кислорода,включают группы фурана, тетрагидрофурана,пирана, 1,3-диоксолана, 1,3-диоксинана, 1,4 диоксинана, 1,3-оксатинана, 1,4-оксатинана, 1,3 оксатиолана и тетрагидропурана. Группы "гидроксиалкила" представляют собой алкильные группы, которые содержат присоединенную к ним гидроксильную группу. Группы "гидроксиалкокси" являются группами алкокси, к которым присоединена гидроксильная группа. Галогены включают фтор, хлор,бром и иод. Используемый в описании термин "гетероарилалкил" означает арилалкильную группу,которая содержит гетероатом. Термин "окси" указывает на присутствие атома кислорода. Таким образом, алкоксигруппы представляют собой алкильные группы, которые присоединены через атом кислорода, и группы карбонилокси представляют собой карбонильные группы, которые присоединены через атом кислорода. Термин "гетероциклоалкокси" означает группу алкокси, которая содержит гетероциклическую группу, присоединенную к ее алкильному фрагменту, а термин "арилалкокси" означает 20 алкоксигруппу, которая содержит арильную группу, присоединенную к ее алкильному фрагменту. Термин "алкилкарбонилокси" означает группу формулы -O-С(=O)-алкил. Используемый в описании термин "алкилокси-алкокси" означает алкоксигруппу, которая содержит алкоксизаместитель, присоединенный к алкильному фрагменту. Термин "алкоксиалкилтио" означает группу алкилтио (т.е. группу формулы -S-алкил), которая содержит алкоксизаместитель, присоединенный к ее алкильному фрагменту. Термин "гидроксиалкилтио" означает группу алкилтио (т.е. группу формулы -S-алкил), которая содержит гидроксизаместитель, присоединенный к алкильному фрагменту. Используемый в описании термин "моносахарид" имеет его обычное значение как простой сахар. Используемый в описании термин "аминокислота" означает молекулу, содержащую как аминогруппу, так и карбоксильную группу. Воплощения аминокислот включают -аминокислоты; т.е. карбоновые кислоты общей формулы НООС-СН(NH2)-(боковая цепь). Боковые цепи аминокислот включают природные и не встречающиеся в природе фрагменты. Не встречающиеся в природе (т.е. неприродные) аминокислотные боковые цепи являются фрагментами, которые используют вместо встречающихся в природе аминокислотных боковых цепей, например, в аналогах аминокислот. См., для примера, Lehninger, Biochemistry, Second Edition, Worth Publishers, Inc,1975, pages 73-75, включенную в описание в качестве ссылки. В некоторых предпочтительных вариантах осуществления группы заместителей для соединений формул I и II включают остаток аминокислоты после удаления гидроксильного фрагмента их карбоксильных групп; т.е. группы формулы -С(=O)-СН(NН 2)-(боковая цепь). Функциональные группы, имеющиеся в соединениях формулы I, могут содержать защитные группы. Например, заместители аминокислотной боковой цепи соединений формулы I могут быть замещены защитными группами,такими как группы бензилоксикарбонила или трет-бутоксикарбонила. Защитные группы известны, по существу, как химические функциональные группы, которые могут быть избирательно присоединены и удалены из функциональных групп, таких как гидроксильные группы и карбоксильные группы. Подобные группы присутствуют в химическом соединении, чтобы сделать такие функциональные группы инертными в условиях химической реакции, действию которой подвергают соединение. Любая из целого ряда защитных групп может быть использована в данном изобретении. Одной такой защитной группой является бензилоксикарбонильная (Cbz; Z)группа. Другие предпочтитель 21 ные защитные группы согласно изобретению можно найти у Greene, T.W. and Wuts, P.G.M.,"Protective Groups in Organic Synthesis" 2d. Ed.,WileySons, 1991. Циклические замещенные конденсированные пирролкарбазольные и изоиндолоновые соединения характеризуются очевидными важными функциональными фармакологическими активностями, которые находят применение в целом ряде областей, включая как научные исследования, так и область терапии. Эти производные полезны в качестве терапевтических агентов. Активности соединений оказывают положительное влияние на функцию и/или выживание чувствительных к трофическому фактору клеток. Влияние на функцию и/или выживание чувствительных к трофическому фактору клеток, например, клеток нейронного происхождения, продемонстрировано с использованием любого из следующих способов: (1) исследование ацетилхолинтрансферазы ("ChAT") культивированного спинного мозга или (2) исследование активности ChAT культивированных базальных нейронов переднего мозга. Термин "влияние", используемый, чтобы видоизменить термины "функция" и "выживание", означает положительную или негативную перемену или изменение. Влияние, которое является позитивным, может упоминаться в описании как "увеличение" или "увеличивающий",а влияние, которое является негативным, может упоминаться в описании как "ингибирование" или "ингибирующий". Используемые в описании термины "усиление" или "увеличение", когда используются для видоизменения терминов "функция" или"выживание", означают, что присутствие циклического замещенного конденсированного пирролкарбазольного или изоиндолонового соединения оказывают позитивное влияние на функцию и/или выживание чувствительной к трофическому фактору клетки по сравнению с клеткой в отсутствие соединения. Не с целью ограничения, а для примера выживания, например холинэргического нейрона, соединение демонстрирует увеличение выживания холинэргической нейронной популяции при риске умирания (вследствие, например повреждения, патологического состояния, дегенеративного состояния или естественного развития), при сравнении с холинэргической популяцией в отсутствие такого соединения, если обработанная популяция проявляет сравнительно более длительный период функционирования, чем необработанная популяция. Используемые в описании термины "ингибирует" и "ингибирование" означают, что специфический ответ определенного материала(например, энзиматической активности) сравнительно снижался в присутствии циклического замещенного конденсированного пирролкарбазольного или изоиндолонового соединения. 22 Используемый термин "trk" относится к семейству рецепторов с высоким сродством к нейротропину, в настоящее время включающему trk A, trk В и trk С и другие ассоциированные с мембраной белки, с которыми может связываться нейротропин. Используемое выражение "ингибированиеVEGFR" означает полезность, например, при заболеваниях, в развитии которых играет важную роль ангиогенез, таких как раковые солидные опухоли, эндометриоз, диабетическая ретинопатия, псориаз, гемангиобластома, а также другие заболевания глаз и другие злокачественные заболевания. Ингибирование trk означает полезность,например, при заболеваниях простаты, таких как рак простаты и доброкачественная гиперплазия простаты, и для лечения боли при воспалении. Ингибирование рецептора тромбоцитарного фактора роста (PDGFR) означает полезность,например, при различных формах неоплазии,ревматоидном артрите, фиброзе легких, миелофиброзе, аномальном заживлении раны, заболеваниях с сердечно-сосудистыми осложнениями таких как атеросклероз, рестеноз, рестеноз после ангиопластики и так далее. Используемые термины "рак" и "злокачественный" означает любую злокачественную пролиферацию клеток у млекопитающих. Примеры включают рак простаты, доброкачественную гиперплазию простаты, рак яичников, молочной железы, мозга, легких, поджелудочной железы, колоректальный рак, рак желудка, солидные опухоли, рак головы и шеи, нейробластому, карциному почечных клеток, лимфому,лейкоз, другие распознаваемые злокачественные заболевания гемопоэтической системы и другие распознаваемые раки. Используемые в описании термины "нейрон", "клетка нейронного происхождения" и"нейронная клетка", не ограничиваясь указанным, включают гетерогенную популяцию нейронных типов, имеющую единственный или многочисленные медиаторы, и/или единственную или многочисленные функции; предпочтительно, они представляют холинэргические или сенсорные нейроны. Используемое выражение"холинэргический нейрон" означает нейроны центральной нервной системы (CNS) и периферической нервной системы (PNS), нейротрансмиттером которых является ацетилхолин; примерами являются базальный передний мозг,стриарные нейроны и нейроны спинного мозга. Используемое выражение "сенсорный нейрон" включает в себя нейроны, чувствительные к раздражителям окружающей среды (например,температуре, движению), от, например, кожи,мышц и суставов; примером является нейрон ганглия заднего корешка. Используемое в описании выражение"клетка, чувствительная к трофическому факто 23 ру", относится к клетке, которая содержит рецептор, с которым специфически может связываться трофический фактор; примеры включают нейроны (например, холинэргические и сенсорные нейроны) и ненейронные клетки (например,моноциты и неопластические клетки). Представленные в описании соединения циклических замещенных конденсированных пирролкарбазола и изоиндолона находят применение как для исследовательских, так и терапевтических целей, например, для ингибирования активности ферментов. Например, для исследований, соединения можно использовать при разработке способов и моделей для дальнейшего понимания роли, которую играет ингибирование серин/треонинпротеинкиназы или тирозинпротеинкиназы (например, РКС, тирозинкиназа trk) в механизмах, связанных с нарушениями и заболеваниями. В терапевтических целях соединения, которые ингибируют активность таких ферментов, можно использовать, чтобы ингибировать вредные последствия активности этих ферментов в отношении нарушений, таких как рак. На примерах ниже показано, что ингибирование ферментативной активности с применением соединений циклических замещенных конденсированных пирролкарбазола и изоиндолона, можно определять, используя, например,следующие испытания: 1. Исследование ингибирования активности тирозинкиназы trkA. 2. Ингибирование trk фосфорилирования,стимулированного NGF, в препарате целых клеток. 3. Исследование ингибирования киназы рецептора фактора роста сосудистого эндотелия(VEGFR). 4. Исследование ингибирования активности РКС. 5. Исследование ингибирования PDGFR. 6. Усиление активности ChAT спинного мозга. Описанные соединения циклических замещенных конденсированных пирролкарбазола и изоиндолона можно использовать для усиления функции и/или выживания клеток нейронного происхождения у млекопитающих, например, человека. В данном контексте соединения могут быть использованы индивидуально или с другими конденсированными пирролкарбазолами и/или индолокарбазолами, или в комбинации с другими полезными молекулами, которые также проявляют способность влиять на функцию и/или выживание указанной клетки. Циклические замещенные конденсированные пирролкарбазолы и изоиндолоны данного изобретения используют, среди прочего, в качестве терапевтических агентов. В частности, соединения используют для ингибирования протеинкиназы. Циклические замещенные конденсированные пирролкарбазолы и изоиндолоны 24 могут ингибировать, например, киназы, выбранные из abl, АKТ, bcr-abl, Blk, Brk, Btk, c-kit,c-met, c-src, CDK1, CDK2, CDK4, CDK6, chk1,chk2, cRafl, CSF1R, CSK, EGFR, ErbB2, ЕrbВ 3,ErbB4, ERK (Eph), ERK2, Fak, fes, FGFR1,FGFR2, FGFR3, FGFR4, FGFR5, MLK1, MLK2,MLK3, DLK, trkA, trkB, trkC, Fgr, FLK-4, flt-1,Fps, Frk, Fyn, GSK, Hck, IGF-1R, INS-R, Jak,JNK, tau, VEGFR1, VEGFR2, VEGFR3, Lck, Lyn,MEK, p38, PDGFR, PIK, PKC, PYK2, ros, tie1,tie2, UL97, Yes и Zap70. Таким образом, свойства соединений данного изобретения являются благоприятными для терапевтических целей. Активности циклических замещенных конденсированных пирролкарбазолов и изоиндолонов в отношении определенных ферментов могут быть использованы для борьбы с вредными последствиями действия таких ферментов. Например, ингибирование рецептора фактора роста сосудистого эндотелия(VEGFR) оказывается полезным, например, при заболеваниях, при которых играет важную роль ангиогенез, таких как рак (например солидные опухоли и злокачественные заболевания гемопоэтической и лимфатической систем), эндометриоз, диабетическая ретинопатия, псориаз,гемангиобластома, а также другие глазные заболевания и другие злокачественные новообразования. Ингибирование trk оказывается полезным, например, при заболеваниях простаты,таких как рак простаты и доброкачественная гиперплазия простаты и при лечении боли при воспалении. Ингибирование рецептора тромбоцитарного фактора роста (PDGFR) оказывается полезным, например, при различных формах неоплазии, ревматоидном артрите, фиброзе легких, миелофиброзе, аномальном заживлении раны, заболеваниях с сердечно-сосудистыми осложнениями, таких как атеросклероз, рестеноз, рестеноз после ангиопластики и тому подобное. Ингибирование киназы смешанных линий (MLK) оказывается полезным, например,при болезни Альцгеймера, расстройствах мотонейрона (например, амиотрофический латеральный склероз); болезни Паркинсона; цереброваскулярных нарушениях (например, удар, ишемия); болезни Гентингтона; СПИД-деменция; эпилепсии; рассеянном склерозе; периферической невропатии (например, повреждения DRG нейронов при периферической невропатии, связанной с химиотерапией), включая диабетическую невропатию; расстройствах, вызванных раздражающими аминокислотами; и нарушениях, связанных с сотрясением головного или спинного мозга или проникающими повреждениями головного или спинного мозга. Ингибирование киназы рецептора фактора роста фибробластов (FGFR) оказывается полезным, например, при рестенозе, рестенозе после ангиопластики, атеросклерозе, фиброзе легких,различных злокачественных новообразованиях,не ограничиваясь указанным, включающих рак 25 простаты, рак молочной железы; аномальном заживлении раны и доброкачественной гиперплазии простаты. Активности циклических замещенных конденсированных пирролкарбазолов и изоиндолонов также могут оказывать позитивное влияние на функцию и выживание чувствительных к трофическому фактору клеток, стимулируя выживание нейронов. Что касается, например выживания холинэргических нейронов, соединение может способствовать выживанию холинэргической нейронной популяции при риске гибели (вследствие, например, повреждения, патологического состояния, дегенеративного состояния или естественного развития), по сравнению с холинэргической нейрональной популяцией, находящейся без такого соединения, если обработанная популяция имеет сравнительно больший период функционирования, чем необработанная популяция. Целый ряд неврологических нарушений характеризуют по состоянию нейронных клеток,которые оказываются умирающими, поврежденными, подорваны функционально, претерпевающими аксональную дегенерацию, при риске гибели, и так далее. Такие нарушения включают: болезнь Альцгеймера, мотонейронные нарушения (например, амиотрофический латеральный склероз); болезнь Паркинсона; цереброваскулярные нарушения (например, удар,ишемия); болезнь Гентингтона; СПИДдеменция; эпилепсию; рассеянный склероз; периферические невропатии (например, повреждения DRG нейронов при периферической невропатии, связанной с химиотерапией), включая диабетическую невропатию; расстройства, вызванные возбуждающими аминокислотами; и нарушения, связанные с сотрясением головного или спинного мозга или проникающими повреждениями головного или спинного мозга, не ограничиваясь перечисленным. Кроме того, ингибирование Src, raf киназ и киназ клеточного цикла, таких как циклинзависимые киназы (CDK) 1, 2, 4 и 6, и киназ"точки контроля" (таких как chk 1 и chk 2) может быть полезно для лечения рака. Регуляция киназы CDK2 может быть полезна для лечения рестеноза. Регуляция одной или более из киназCDK5 или GSK3 может быть полезна при лечении болезни Альцгеймера. Регуляция одной или более из c-Src-киназ может оказаться полезной при лечении остеопороза. Регуляция одной или более из GSK-3-киназ может быть полезна для лечения диабета 2 типа. Регуляция одной или более р 38-киназ может быть полезна для лечения воспаления. Регуляция одной или болееTIE-1- или TIE-2-киназ может быть полезной при лечении ангиогенеза. Регуляция одной или более UL97-киназ может быть полезна для лечения вирусных инфекций. Регуляция одной или более CSF-1R-киназ может быть полезна 26 при лечении костных и гемопоэтических заболеваний. Регуляция одной или более из Lckкиназ может быть полезна для лечения аутоиммунных заболеваний и отторжения трансплантата. Регуляция топоизомераз Торо-I и Торо-II может оказаться полезной при лечении рака. СhАТ катализирует синтез нейротрансмиттера ацетилхолина, и СhАТ рассматривают как ферментативный маркер функционального холинэргического нейрона. Функциональный нейрон характеризуется также способностью к выживанию. Выживание нейрона исследуют с помощью количественного определения специфического поглощения и ферментативного превращения красителя (например, кальцеина AM) живыми нейронами. Благодаря своим различным свойствам представленные в описании циклические замещенные конденсированные пирролкарбазольные и изоиндолоновые соединения оказываются полезными при целом ряде применений, например, в научном исследовании. Соединения можно использовать при разработке моделей выживания, функционирования, идентификации нейронных клеток in vitro или для скрининга других синтетических соединений, которые характеризуются активностью, подобной активности циклических замещенных конденсированных пирролкарбазольных и изоиндолоновых соединений. Таким образом, соединения, представленные данным изобретением, полезны в качестве стандартных или ссылочных соединений для применения в испытаниях или исследованиях для определения активности агента в фармацевтических исследовательских программах и/или могут применяться в других случаях в исследованиях окружающей среды, чтобы изучить, определить и установить молекулярные мишени, связанные с функциональным ответом. Например, введением радиоактивной метки в циклическое замещенное конденсированное пирролкарбазольное или изоиндолоновое соединение, связанное со специфической клеточной функцией (например, митогенезом), реальная мишень, с которой связывается производное, может быть идентифицирована, выделена и очищена для характеристики. Соединения оказываются полезными не только для увеличения индуцированной трофическим фактором активности клеток, чувствительных к трофическому фактору, например,холинэргических нейронов, но они также могут действовать как агенты, способствующие выживанию, для других типов нейронных клеток,например допаминэргических или глутаматэргических клеток. Фактор роста может регулировать выживание нейронов с помощью каскадов передачи сигналов в прямом направлении небольших GTP-связывающих белков ras, rас и 27 активируемой рецептором киназы (ERK), которая связана с биологическими процессами роста и дифференцировки. Стимуляция rac/cdc42 приводит к усилению активации JNK и р 38, ответным реакциям, которые связаны со стрессом,апоптозом и воспалением. Хотя ответные реакции фактора роста осуществляются сначала через ERK путь, повреждение указанных последних процессов может приводить к альтернативным механизмам выживания нейронов, которые могут имитировать увеличивающие выживание свойства фактора роста (Xia et al., Science, 1995,270, 1326). Соединения также могут действовать как способствующие выживанию агенты для нейронных и ненейронных клеток посредством механизмов, связанных с выживанием, опосредованным фактором роста, а также отличающимся от него, например, ингибированием JNK и р 38 МАРK путей, что может привести к выживанию посредством ингибирования процессов апоптической гибели клеток. Данные соединения полезны для лечения нарушений, связанных со сниженной активностью СhАТ или гибелью, повреждением мотонейронов спинного мозга, а также применяются,например, при заболеваниях, связанных с апоптической гибелью клеток центральной и периферической нервной системы, иммунной системы, и при воспалительных заболеваниях. Представленные в описании циклические замещенные конденсированные пирролкарбазольные и изоиндолоновые соединения также могут находить применение при лечении болезненных состояний, включающих злокачественную пролиферацию клеток, таких как многие виды раков. С целью дальнейшей иллюстрации соединения могут быть использованы при разработке способов и моделей для лучшего понимания роли, которую ингибирование играет в механизмах связанных нарушений и заболеваний. Таким образом, соединения данного изобретения полезны как диагностические реагенты при диагностических исследованиях, таких как описанные выше исследования. Фармацевтически приемлемые соли соединений (I) включают фармацевтически приемлемые аддитивные соли кислот, соли металлов, соли аммония, аддитивные соли органического амина и аддитивные соли аминокислот. Примерами аддитивных солей кислот являются аддитивные соли неорганических кислот, такие как гидрохлорид, сульфат и фосфат, аддитивные соли органических кислот, такие как ацетат,малеат, фумарат, тартрат, цитрат и лактат; примерами солей металлов являются соли щелочных металлов, такие как соль лития, соль натрия и соль калия, соли щелочно-земельных металлов, такие как соль магния и соль кальция, соль алюминия и соль цинка; примерами солей аммония являются соль аммония и соль тетраметиламмония; примерами аддитивных солей ор 005273 28 ганических аминов являются соли морфолина и пиперидина; и примерами аддитивных солей аминокислот являются соли глицина, фенилаланина, глутаминовой кислоты и лизина. Представленные в описании соединения могут быть составлены в фармацевтические композиции смешиванием с фармацевтически приемлемыми нетоксичными эксципиентами и носителями. Такие композиции можно приготовить для применения для парентерального введения, в частности, в форме жидких растворов или суспензий; или для перорального введения,в частности, в форме таблеток или капсул; или для интраназального введения, в частности, в форме порошков, назальных капель или аэрозолей; или для кожного введения, например, посредством трансдермальных пластырей. Композиции можно удобно вводить в стандартной дозированной форме и можно приготовить с помощью любого из способов, хорошо известных в фармацевтической области, например как описано в Remington's PharmactuticalSciences (Mack Pub. Co., Easton, PA, 1980). Композиции для парентерального введения могут содержать в качестве обычных эксципиентов стерильную воду или физиологический раствор,полиалкиленгликоли, такие как полиэтиленгликоль, масла растительного происхождения, гидрированные нафталины и тому подобное. В частности, биосовместимые, биодеградируемые лактидный полимер, сополимер лактид/гликолид или сополимеры полиоксиэтилен-полиоксипропилена могут быть подходящими эксципиентами для регулирования высвобождения активных соединений. Другие возможные подходящие системы парентеральной доставки для таких активных соединений включают частицы сополимера этилен-винилацетат, осмотические насосы, имплантируемые системы инфузии и липосомы. Композиции для ингаляционного введения содержат в качестве эксципиентов,например, лактозу, или могут быть водными растворами, содержащими, например, полиоксиэтилен-9-лауриловый простой эфир, гликохолат и дезоксихолат, или масляными растворами для введения в форме назальных капель, или в виде геля для интраназального применения. Композиции для парентерального введения также могут включать гликохолат для щечного введения, салицилат для ректального введения,или лимонную кислоту для вагинального введения. Композиции для трансдермальных пластырей предпочтительно представляют липофильные эмульсии. Соединения данного изобретения можно применять в виде единственного активного агента в фармацевтической композиции. Альтернативно, они могут быть использованы в комбинации с другими активными ингредиентами, например, другими факторами роста, которые способствуют нейронному выживанию 29 или регенерации аксонов при заболеваниях или расстройствах. Соединения формулы I и их фармацевтически приемлемые соли можно вводить перорально или неперорально, например, в виде мазей или инъекций. Концентрации соединений данного изобретения в терапевтической композиции можно изменять. Концентрации зависят от факторов, таких как общая доза лекарственного средства, которая должна быть введена,химических характеристик (например, гидрофобности) применяемых соединений, способа введения, возраста, массы тела и симптомов у пациента и так далее. Соединения данного изобретения обычно используют в водном физиологическом буферном растворе, содержащем приблизительно от 0,1 до 10% маc./об. соединения для парентерального введения. Типичный диапазон доз составляет приблизительно от 1 мг до 1 мкм кг/кг массы тела в день; предпочтительный диапазон доз составляет приблизительно от 0,01 до 100 мг/кг массы тела в день и предпочтительно приблизительно от 0,1 до 20 мг/кг от одного до четырех раз в день. Предпочтительная доза лекарственного средства, которая должна быть введена, будет зависеть также от таких переменных величин, как тип и степень прогрессирования заболевания или расстройства, общего состояния здоровья определенного пациента, соответствующей биологической эффективности выбранного соединения, состава эксципиентов соединения и способа его введения. Соединения формулы I и их фармацевтически приемлемые соли можно вводить одни или в форме различных фармацевтических композиций в соответствии с фармакологической активностью и целью введения. В соответствии с данным изобретением, фармацевтические композиции можно приготовить равномерным смешением эффективного количества соединения формулы I или его фармацевтически приемлемой соли в качестве активного ингредиента с фармацевтически приемлемым носителем. Можно использовать разнообразные формы носителя в соответствии с формами композиции,подходящими для введения. Желательно, чтобы такие фармацевтические композиции были получены в стандартной дозированной форме для перорального или неперорального введения. Формы для неперорального введения включают мази и инъекции. Таблетки можно получать общепринятым способом, используя эксципиенты, такие как лактоза, глюкоза, сахароза, маннит и метилцеллюлоза, дезинтегрирующие агенты, такие как крахмал, альгинат натрия, кальцийкарбоксиметилцеллюлоза и кристаллическая целлюлоза,смазки, такие как стеарат магния и тальк, связующие вещества, такие как желатин, поливиниловый спирт, поливинилпирролидон, гидроксипропилцеллюлоза и метилцеллюлоза, по 005273 30 верхностно-активные вещества, такие как сложный эфир жирной кислоты сахарозы и сложный эфир жирной кислоты сорбита и тому подобное. Предпочтительно каждая таблетка содержит 15300 мг активного ингредиента. Гранулы можно получать общепринятым способом, используя эксципиенты, такие как лактоза и сахароза, дезинтегрирующие агенты,такие как крахмал, связующие вещества, такие как желатин и тому подобное. Порошки можно получать согласно общепринятому способу,используя эксципиенты, такие как лактоза и маннит и тому подобное. Капсулы можно получать согласно общепринятому способу, используя желатин, воду, сахарозу, аравийскую камедь, сорбит, глицерин, кристаллическую целлюлозу, стеарат магния, тальк и тому подобное. Предпочтительно каждая капсула содержит 15300 мг активного ингредиента. Препараты сиропов можно получать общепринятым способом, используя сахара, такие как сахароза, воду, этанол и тому подобное. Мази можно получать общепринятым способом, используя мазевые основы, такие как вазелин, жидкий парафин, ланолин и макрогол,эмульгаторы, такие как лаурилластат натрия,хлорид бензалкония, моносложный эфир жирной кислоты сорбитана, натрийкарбоксиметилцеллюлоза и аравийская камедь и тому подобное. Инъецируемые препараты можно получать общепринятым способом, используя растворители, такие как вода, физиологический раствор,растительные масла (например, оливковое масло и арахисовое масло), этилолеат и пропиленгликоль, солюбилизирующие агенты, такие как бензойно-кислый натрий, салицилово-кислый натрий и уретан, вещества, поддерживающие изотоничность, такие как хлорид натрия и глюкоза, консерванты, такие как фенол, крезол,сложный п-гидроксибензойный эфир и хлорбутанол, антиоксиданты, такие как аскорбиновая кислота и пиросульфит натрия, и тому подобное. Изобретение далее иллюстрируется следующими примерами, которые предназначены для объяснения изобретения. Данные примеры не предназначены для ограничения объема изобретения и не должны быть истолкованы, как огрничивающие его. Примеры Пример 1. Ингибирование активности тирозинкиназы trkA. Исследовали способность выбранных циклических замещенных конденсированных пирролкарбозольных и изоиндолоновых соединений ингибировать киназную активность цитоплазматического домена trkA человека, экспрессированного в бакуловирусе, используя способ,основанный на твердофазном иммуноферментном анализе (ELISA), как описано ранее (Angeles et al., Anal. Biochem. 236: 49-55, 1996). Вкратце, 96-луночный титрационный микропланшет покрывали раствором субстрата (рекомбинантный фосфолипаза С-1/глутатион Sтрансфераза белок слияния человека) (Rotin etal., EMBO J., 11: 559-567, 1992). Изучение ингибирования проводили в анализируемых смесях,объемом 100 мкл, содержащих 50 мМ Hepes, рН 7,4, 40 мкМ АТР, 10 мМ МnСl2, 0,1% BSA, 2%DMSO, и различные концентрации ингибитора. Реакцию инициировали добавлением киназыtrkA и оставляли для протекания реакции в течение 15 мин при 37 С. Затем добавляли антитело к фосфотирозину (UBI) с последующим добавлением вторичного, конъюгированного с ферментом, антитела, меченного щелочной фосфатазы IgG козы против антII-мыши (BioRad). Активность связанного фермента измеряли с помощью индикаторной системы определения (Gibco-BRL). Результаты ингибирования анализировали,используя уравнение сигмовидного графика доза-ответ (переменный угол наклона), в GraphPad Prism. Концентрации, которые приводили к 50% ингибированию киназной активности, выражали как IC50. Результаты суммированы в табл. 1. Таблица 1 Ингибирующее действие циклических замещенных конденсированных пирролкарбазолов и изоиндолонов на активность кинааы trkA Пример 2. Ингибирование фосфорилирования trk, стимулированного NGF, в препарате целых клеток. Ингибирование фосфорилирования trk,стимулированного NGF, выбранными соединениями циклических замещенных конденсированных пирролкарбазолов и изоиндолонов проводили, используя описываемый ниже способ, 33 представляющий модификацию способа, описанного ранее (см. патент США 5516771). Клетки NIH3T3, трансфицированные trkA, выращивали в 100 мм чашках. Субконфлуентные клетки выращивали в бессывороточной среде,заменив среду бессывороточной 0,05% BSADMEM, содержащей соединение (100 нМ и 1 мкМ) или DMSO (добавленный в контроли), в течение одного часа при 37 С. Затем к клеткам добавляли NGF (Harlan/Bioproducts for Science) в концентрации 10 нг/мл в течение 5 мин. Клетки лизировали буфером, содержащим детергент и ингибиторы протеаз. Осветленные клеточные лизаты нормализовали, используя ВСА-способ,и иммунопреципитировали антителами против антII-trk. Поликлональные антитела к антII-trk получали против пептида, соответствующего 14 аминокислотам на карбоксильном конце trk(Martin-Zanca et al., Mol. Cell. Biol. 9: 24-33,1989). Иммунный комплекс собирали на гранулах протеин А сефарозы (Sigma Chem.Co., St.Lois, МО), разделяли электрофорезом в полиакриламидном геле в присутствии SDS (SDSPAGE) и переносили на мембраны из дифторидполивинилидена (PVDF). Мембраны подвергали иммуноблоттингу с антителами к антIIфосфотирозину (UBI) с последующей инкубацией с пероксидазой хрена, конъюгированной сtrk измеряли и сравнивали с контролем, стимулированным NGF. Использованная система подсчета ингибирования, основанная на процентном снижении зоны белка trk, заключается в следующем: 0 = нет снижения; 1 = 1-25%; 2 = 26-49%; 3 = 50-75%; 4 = 76-100%. Результаты представлены в табл. 2 ниже. Таблица 2 Влияние циклических замещенных конденсированных пирролкарбазолов и изоиндолонов на 34 Пример 3. Ингибирование активности киназы рецептора фактора роста сосудистого эндотелия. Исследовали ингибирующее действие циклических замещенных конденсированных пирролкарбазольных и изоиндолоновых соединений на киназную активность домена киназ (flk1, KDR, VEGFR2 человека) рецептора VEGF,экспрессированного в бакуловирусе, используя способ ELISA-анализа, описанный для trkA киназы выше. Киназную реакционную смесь, содержащую 50 мМ Hepes, рН 7,4, 40 мкМ АТР,10 мМ МnСl2, 0,1% BSA, 2% DMSO и различные концентрации ингибитора, переносили в планшеты, покрытые PLC-/GST. Добавляли киназу VEGFR, и реакция протекала в течение 15 мин при 37 С. Определение фосфорилированного продукта осуществляли добавлением антител к антII-фосфотирозину (UBI). Вторичные антитела, конъюгированные с ферментом,добавляли, чтобы захватить комплекс антителофосфорилированные PLC-/GST. Активность связанного фермента измеряли, используя индикаторную систему определения (Gibco-BRL). Результаты ингибирования анализировали, используя уравнение сигмовидного графика дозаответ (переменный угол наклона) в GraphPadPrism. Результаты суммированы в табл. 3. Таблица 3 Ингибирующее действие циклических замещенных конденсированных пирролкарбазолов и изоиндолонов на активность киназы рецептора 36 Таблица 4 Ингибирующее действие циклических замещенных конденсированных пирролкарбазолов и изоиндолонов на активность протеинкиназы С Пример 4. Ингибирование активности протеинкиназы С. Активность протеинкиназы С оценивали,используя анализ миллипор-мультискрин ТСА в планшете (Millipore Multiscreen ТСА), описанный Pitt, A.M. and Lee, C. (J. Biomol. Screening, 1: 47-51, 1996). Исследования проводили в 96-луночных планшетах мультискрин-DP (Millipore). Каждая 40-мл опытная смесь содержала 20 мМ Hepes, pH 7,4, 10 мМ МgСl2, 2,5 мМ(Fluka), 5 мМ [-32 Р]АТР, 1,5 нг протеинкиназы С (UBI; смешанных изомеров a, b, g), 0,1% BSA,2% DMSO и исследуемое циклическое замещенное конденсированное пирролкарбазольное соединение. Реакция протекала в течение 10 мин при 37 С, затем реакцию останавливали добавлением охлажденной льдом 50% трихлоруксусной кислоты. Планшеты оставляли для уравновешивания в течение 30 мин при 4 С,потом промывали 25% ТСА, охлажденной льдом. Сцинтилляционный коктейль добавляли в планшеты и определяли радиоактивность, используя -сцинтилляционный счетчик WallacMicroBeta 1450 PLUS. Значения IC50 рассчитывали нанесением данных на сигмовидный график доза-ответ (переменный угол наклона) в Пример 5. Ингибирование активности киназы рецептора тромбоцитарного фактора роста. Исследовали ингибирующее действие соединений циклических замещенных конденсированных пирролкарбазолов и изоиндолонов на киназную активность домена киназы рецептораDMSO и различные концентрации ингибитора. Реакцию инициировали добавлением предварительно фосфорилированного рекомбинантного фермента человека (10 нг/мл PDGFR) и реакция протекала в течение 15 мин при 37 С. Предварительно фосфорилированный фермент получали перед использованием инкубацией киназы в буфере, содержащем 20 мкМ АТР и 10 мМ МnСl2 в течение 1 ч при 4 С. Определение фосфорилированного продукта производили добавлением пероксидазы хрена 37 комнатной температуре. Реакцию останавливали кислотой и оптическую плотность продукта измеряли при 450 нм, используя планшет-ридер модель Microplate Bio-kinetics Reader (Bio-TekInstrument EL 312e). Результаты ингибирования анализировали, используя сигмовидный график доза-ответ (переменный угол наклона) в GraphPad Prism. Результаты суммированы в табл. 5. Таблица 5 Ингибирующее действие циклических замещенных конденсированных пирролкарбазолов и изоиндолонов на PDGFR Пример 6. Увеличение активности ChAT спинного мозга. Как отмечено выше, ChAT является специфическим биохимическим маркером функциональных холинэргических нейронов. Холинэргические нейроны представляют основной холинэргический вклад в образование гиппокампа, обонятельное ядро, межножковое ядро,кору, миндалевидное тело и отделы таламуса. В спинном мозге, мотонейроны являются холинэргическими нейронами, которые содержатChAT (Phelps et al., J. Соmр. Neurol. 273: 459472 (1988. Активность ChAT использовали для изучения влияния нейротропинов (например,NGF или NT-3) на выживание и/или функцию холинэргических нейронов. Анализ ChAT также служит показателем регуляции уровней ChAT в холинэргических нейронах. Циклические замещенные конденсированные пирролкарбазольные и изоиндолоновые соединения увеличивали активность ChAT при анализе культуры диссоциированного эмбрионального спинного мозга крысы (табл. 6). В таком исследовании, например, соединение непосредственно добавляли в диссоциированную культуру спинного мозга. Соединения, которые увеличивали активность ChAT по крайней мере на 120% от контрольной активности, рассматривали как активные. Результаты суммированы в табл. 6. 38 Таблица 6 Увеличение активности ChAT спинного мозга циклическими замещенными конденсированными пирролкарбазолами и изоиндолонами Способы. Эмбриональные клетки спинного мозга крысы диссоциировали, а эксперименты проводили как описано (Smith et al., J. Cell Biology 101: 1608-1621 (1985); Glicksman et al., J.Neurochem. 61: 210-221 (1993. Диссоциированные клетки получали из спинного мозга, вырезанного у крыс, (эмбрионы 14-15 дней) стандартным способом диссоциации трипсином(Smith et al., выше). Клетки помещали при 6105 клеток/см 2 в пластиковые лунки для культуры ткани, покрытые поли-1-орнитином, в бессывороточной среде 2, дополненной 0,05% бычьим сывороточным альбумином (BSA)(1979.Культуры инкубировали при 37 С в увлажненной атмосфере 5% СО 2/95% воздуха в течение 48 ч. Активность ChAT измеряли через 2 дня in vitro, используя модификацию способа Фоннума (Fonnum) (Fonnum, J. Neurochem. 24: 407-409 (1975 согласно McManaman et al., andal., J. Neurochem., выше). Описанные в примерах соединения формулы II перечислены в табл. 7 и 8. В табл. 7 значением R1, R4 и R6 является Н; Q означает NH 40 Общее описание способов синтеза и примеры Общий способ синтеза, примененный для получения циклических замещенных конденсированных пирролкарбазолов данного изобретения, представлен на фиг. с 2 по 12. Общие способы синтеза конденсированных пирролкарбазолов (3)/(47) могут быть осуществлены как описано в патенте США 5705511 и патенте США 4923986, описание каждого из которых включено в данную заявку путем ссылки в полном объеме. Когда R1 соответствует Н, азот лактама конденсированных пирролкарбазолов(3)/(47) защищают подходящей защитной группой, приводящей к (4)/(48). Защищенные соединения обрабатывают подходящим основанием в безводном органическом растворителе(ях), что приводило к образованию тмно-красного раствора, который, как полагают, является карбанионом. Реакция карбаниона с реагентом, содержащим электрофильную связь C=Y, дает или непосредственно циклический заместитель (как показано на фиг. 2, 5, 7, 12, 15 и 17), или первоначально образованное нециклическое производное (6), (14), (53) или (60), которое впоследствии превращается в циклический заместитель(как показано на фиг. 3, 4, 13 и 14). Предварительно полученное, соответственно замещенное циклическое производное можно использовать или как нуклеофил (как показано на фиг. 6 и 16), или как электрофил (как показано на фиг. 8 и 18). Циклические заместители могут быть образованы из олеофинной группы, как показано на фиг. 9 и 19. Способ, катализируемый или кислотой,или основанием, использовали для проведения защиты азота лактама (показано на фиг. 1, 10 и 11). Катализируемую кислотой реакцию можно проводить с реагентом, связанным с полимером,допускающим иммобилизацию конденсированного пирролкарбазола (47) на полимерном носителе, таком как кислотная смола Ринка (Rink) на основе полистирола, (фиг. 11), получая (50). Альтернативно, реакцию, катализируемую кислотой, можно осуществлять с растворимым реагентом, например, 4,4'-диметоксибензгидролом, чтобы получить соединение (49) (фиг. 11). Защищенное силилом соединение (51) получали основным катализатором (фиг. 11). Реакция карбаниона, полученного из(4)/(48), с кетон/альдегидом с -функцонализированной группой (5), [фиг. 2/12] давала ациклическое промежуточное соединение (6)/(53). Замыкание кольца, чтобы получить (7)/(54),происходит обычно in-situ, если циклизация приводит к 5-членному (и случайно к 6 членному) продукту, и если Z группа является сложным эфиром или галогеном, таким как хлор или бром. В случаях, когда замыкание кольца приводит к шестичленному или с большим количеством элементов циклическому продукту,выделенное на начальной стадии ациклическое производное (6)/(53) впоследствии обрабатыва 41 ют основанием, получая циклический продукт(7)/(54). Ациклические промежуточные продукты (6)/(53), полученные в реакции с альдегидом,при окислении дают кетонный промежуточный продукт (9)/(56). Когда Z группа является другой, содержащей карбонил, группой (например,третичный амид), реакция с гидразином (или мочевиной) приводит к образованию гетероциклических производных, таких как дигидропиразол, пиразол, пиридазинон, пиридазиндион или фталазиндион и так далее (или дигидропиримидон/дион, примидон/дион и/или гомологи, и так далее). Однако когда Z группа является олефином (или ацетиленовой группой), реакция кетопромежуточного соединения (9)/(56) с Nалкилгидроксиламином дает нитрон, что впоследствии приводит к циклическому продукту,полученному в реакции внутримолекулярного биполярного циклоприсоединения (фиг. 3/13). Вторичный спирт (14)/(60), полученный из реакции с альдегидом (13), окисляют до кетона(15)/(61), который в свою очередь превращают в соответствующий нитрон (16)/(62) (фиг. 4/14). Реакция полученного нитрона с олефиновым или ацетиленовым соединением дает циклическое производное (17)/(63). Моно- или диалкилирование аниона(ов), полученных из (4)/(48),дает олефин, содержащий конденсированный пирролкарбазол (41)/(79) или (44)/(82), соответственно (фиг. 9/19). Группа С=С (олефин) впоследствии превращают в циклическое производное через аналогичную реакцию межмолекулярного биполярного циклоприсоединения с нитрилоксидом, нитроном или азометинилидом. Циклическую группу, непосредственно связанную с ядром карбазола, получают (фиг. 7/17) в результате реакции карбаниона, полученного из (4)/(48), с сильно электрофильными реагентами, такими как соединения Nацилпиридиния (30) [или пиридин N-оксид]. Дигидропроизводные (31)/(71) или (32)/(72) превращают или в соответствующие насыщенные циклические аналоги (35) или (26)/(75) или(76), или ароматизируют до соответствующих гетероциклических производных (33) или (34)/(4)/(48) с циклическим нитроном (37) дает насыщенные гетероциклические производные(38)/(77). Циклические заместители получают в результате реакции карбаниона, происходящего из(4)/(48), с циклическим кетоном (18) (фиг. 5/15),который может необязательно содержать широкий ряд функциональных групп (см. раздел примеров). Иначе говоря, реакция карбаниона,полученного из (4)/(48) с эпоксидом, оксираном или азиридином (фиг. 5/15) дает циклические заместители, представленные (21)/(65). Карбанион, происходящий из (4)/(48), также вступает в реакцию с сильно активированными акрилатными производными (22) (фиг. 5/15), чтобы получить циклические производные (23)/(66). Ес 005273 42 ли EWG в полученных продуктах (23)/(66) представляет собой эфирную функцию, дальнейшая реакция с гидразином (или мочевиной) приводит к образованию гетероциклических производных, таких как дигидропиразол, пиразол, пиридазинон, пиридазиндион, фталазиндион и так далее (или дигидропиримидон, дигидропиримидондион, пиримидон/дион, или гомологи и так далее). Циклические заместители получают в результате дальнейшего образования производных из ключевого альдегидного промежуточного продукта (90)/(99) или с (i) бифункциональными реагентами (91), такими как аминоспирт, аминотиолдиол, дитиолы или диамины [(путь (а) на фиг. (20/21)], или (ii) через реакцию ДильсаАльдера с диеном (93), как показано через путь(b) на фиг. (20/21). Полученные циклические заместители могут необязательно содержать широкий ряд функциональных групп, или имеющихся в бифункциональном реагенте (91) или диене; или альтернативно, в результате дальнейшей функцонализации олефиновой группы, имеющейся в (94)/(101) для получения(95)/(102). Наконец, циклический заместитель вводят посредством взаимодействия алкилирующего агента, несущего соответственно замещенную циклическую группу (фиг. 8/18), с карбанионом,полученным из (4)/(48). Если Q = NH, осуществлению данной реакции способствует присутствие основания третичного амина, неорганического основания, такого как карбонат щелочного металла, алкоксид щелочного металла, гидрид щелочного металла или использование алкиллития или основания Гриньяра. В большинстве описанных выше способов получения конденсированного пирролкарбазола, содержащего циклические заместители, использовали карбанион, образованный из (4)/(48). Как представлено на фиг. 20 и 21, он является азотным нуклеофилом, который использовали для функционализации, чтобы получить конденсированный пирролкарбазол, содержащий циклические заместители. Однако путь,когда конденсированный пирролкарбазол (4)/(48) служит в качестве электрофила, изображен на фиг. 6/16. Метиленовую группу конденсированного пирролкарбазола (4)/(48) окисляют,чтобы получить электрофильный кетон(25)/(68). Присоединение аниона (27), полученного из циклического реагента (26), к С=O соединения (25)/(68) дает циклический замещенный продукт (29)/(69), который также содержит гидроксильную группу в положении бензила,как показано. Данную гидроксильную группу заменяют на Н, F, SR, OR или NRR'. Кроме того, если Q = NH и W является циклическим заместителем, как описано выше,полученные аналоги можно обработать соответственно функционализированным изоцианатом,чтобы получить конденсированные пирролкар 43 базолы, содержащие циклические заместители,в которых Q = NC(=O)NHR'. Ниже примеры представляют синтез характерной серии конкретных соединений с применением общих способов, описанных выше. Пример 7. Получение промежуточных продуктов, связанных с полимером Ринка(Rink), (50 а), (50b) и (50 с) (фиг. 11). Пример 7 А. В круглодонную трехгорлую колбу, снабженную подвесной механической мешалкой и ловушкой Дина-Старка, последовательно загружают кислотный полимер Ринка(Rink) (51b, R'=OMe, R=полимер) (10,00 г, 0,64 ммоль/г), 1-метил-2-пирролидинон (80 мл), бензол (350 мл), (47 а) [А 1,А 2=Н 2, В 1,В 2=О,R3=R4=R5=R6=H, Q=NH] (3,00 г) и птолуолсульфоновую кислоту (1,00 г). Реакционную смесь нагревают при температуре кипения с обратным холодильником в течение 20 ч, охлаждают, а затем фильтруют. Полимер промывают THF (5175 мл), и фильтрат отбрасывают. Потом полимер последовательно промывают DMSO (4100 мл), 2% водным NaHCO3 (4100 мл), водой (4100 мл), DMSO (2200 мл),THF (4100 мл) и этилацетатом (4100 мл). Полимер сушат в вакууме (24 ч), чтобы получить (0,47 ммоль/г) полимера (50 а) [А 1,А 2=Н 2,В 1,В 2=О, R3=R4=R5=R6=H)]. Первоначальные промывки THF упаривают, остаток разбавляют водой (750 мл) и полученный осадок фильтруют и последовательно промывают водой, 2% водным NаНСО 3 (4100 мл) и водой (4100 мл). После высушивания в вакууме, получают 1,28 г (47 а). Пример 7 В. Аналогичным способом, (47b)[А 1,А 2=Н 2, В 1,В 2=О, R3=R4=R5=H, R6=10OMe, Q=NH], (1,02 г) присоединяют к кислотному полимеру Ринка (51b) (3,12 г), чтобы получить 3,70 г (0,46 ммоль/г) соединения, связанного с полимером, (50b) вместе с регенерированным исходным материалом (47b) (0,44 г). Пример 7 С. Аналогичным способом, (47 с)[А 1,А 2=О,В 1,В 2=Н 2,R3=R4=R5=R6=H,Q=NH], (0,5 г) присоединяют к кислотному полимеру Ринка (51b) (1,52 г), чтобы получить связанное с полимером соединение (50 с), (1,58 г). Пример 7D. Получение промежуточного соединения (49 а) (фиг. 11). В трехгорлую круглодонную колбу, снабженную подвесной механической мешалкой и ловушкой Дина-Старка,последовательно загружают DMB-ОН (51 а)(2,44 г, 10 ммоль), 1-метил-2-пирролидинон (30 мл), бензол (270 мл), (47 а) (3,10 г, 10 ммоль) и п-толуолсульфоновую кислоту (1,90 г, 10 ммоль). Реакционную смесь нагревают при температуре кипения с обратным холодильником. Через 2 ч реакционная смесь становится гомогенной, а нагревание продолжают еще в течение 2 ч. Реакционную смесь охлаждают до комнатной температуры, разбавляют EtOAc (200 мл), 005273 44 промывают насыщенным водным растворомNaHCO3 (4100 мл), водой (4100 мл) и органический слой сушат над безводным MgSO4,фильтруют и концентрируют в вакууме. Остаток растирают со смесью EtOAc/гексан, и полученное твердое вещество фильтруют и сушат в глубоком вакууме до получения (49 а)[А 1,А 2=Н 2, В 1,В 2=О, R3=R4=R5=R6=H, Q=NH,R'=R"=H], (5,2 г, 98%). Пример 8. Общий синтез циклических производных посредством синтеза в твердой фазе (SPS). К суспензии (50 а), или (50b), или (50 с) (50 мг) в THF (2 мл) добавляют 1,0 М растворEtMgBr (1,0 мл в THF) и реакционную смесь перемешивают в течение 1 ч перед добавлением НМРА (0,5 мл). После перемешивания в течение 10 мин, добавляют электрофил (например, альдегид, кетон, эпоксид и так далее) (10-15 ммоль) и реакционную смесь перемешивают в течение 20 ч. Реакцию гасят 10% водным NH4Cl(5 мл) и фильтруют. Полимер последовательно промывают 10% водным NH4Cl (310 мл), водой (310 мл), THF (310 мл), DMF (310 мл), водой (310 мл), THF (310 мл) и простым эфиром (310 мл). Полимер сушат под вакуумом, добавляют к хлористому метилену(15 мл) и обрабатывают трифторуксусной кислотой (0,15 мл). После перемешивания в течение 1 ч, реакционную смесь фильтруют, а фильтрат упаривают. Полученный остаток анализируют с помощью аналитической HPLC(ВЭЖХ) (см. описание способа ниже) и полученные образцы с чистотой менее 80% очищают способом препаративной ВЭЖХ (Zorbax RX-8, 425 см, элюируют смесью MeCN/вода, содержащей 0,1% трифторуксусной кислоты, градиент). Соответствующие фракции нейтрализуют(350 мл) и сушат над MgSO4. После фильтрования и упаривания растворителя получают требуемые соединения. Способы аналитической ВЭЖХ. Способ А: Колонка: аналитическая Zorbax RX-C8,4,6 мм 250 мм. Условия: 10% MeCN100% MeCN(200 мл) нагревают (155 С, масляная баня) в вакууме и объем растворителя уменьшают отгонкой (70 мл). После охлаждения до комнатной температуры впускают в систему азот и верхнюю часть дистиллятора заменяют мембраной и барботируют азот. Гидрид натрия (274 мг,8,15 ммоль 60% дисперсии в минеральном масле) добавляют в одной порции и затем реакционную смесь нагревают до 55 С и перемешивают в течение 1 ч. Затем добавляют (+/-) глицидилмезилат (1,69 г, 8,15 ммоль) и реакционную смесь перемешивают дополнительные 15 ч при 55 С. Масляную баню удаляют и реакционную смесь перемешивают при комнатной температуре в течение 24 ч. Неочищенную смесь фильтруют и маточную жидкость концентрируют и растирают со смесью диэтиловый эфир/метанол. Твердое вещество собирают фильтрованием, промывают водой и сушат,чтобы получить требуемый продукт II-01 а в виде бледно-зеленого твердого вещества (1,7 г,4,62 ммоль, 71%), который характеризуется следующими спектральными свойствами: 300 МГц 1 Н ЯМР (DMSO d6):9,50 (дублет, 1), 8,58 (синглет, 1) 8,01 (дублет, 1), 7,74(35 мл) нагревают (155 С, масляная баня) под вакуумом и объем растворителя уменьшают отгонкой (15 мл). После охлаждения до комнатной температуры впускают в систему азот и верхнюю часть дистиллятора заменяют мембраной и барботируют N2. Гидрид натрия (49 мг,1,1 ммоль 60% дисперсии в минеральном масле) добавляют в одной порции и реакционную смесь перемешивают в течение 1 ч при комнатной температуре. Затем добавляют 2-R(-) глицидилтозилат (283 мг, 1,24 ммоль), и реакционную смесь перемешивают дополнительные 18 ч при 60 С. Масляную баню удаляют и реакционную смесь перемешивают при комнатной температуре в течение 4 ч. Неочищенную смесь сушат, растирают со смесью диэтиловый эфир/метанол, а затем присоединяют к THF и фильтруют. Фильтрат THF концентрируют и полученное твердое вещество растирают со смесью диэтиловый эфир/метанол и сушат, чтобы получить требуемый продукт II-01b (155 мг,0,42 ммоль, 37%) в виде зеленоватого твердого вещества. Дальнейшее концентрирование и рас 005273 46 тирание маточной жидкости обеспечивает дополнительное количество продукта II-01b (90 мг). Продукт II-01b имеет следующие спектральные свойства: 300 МГц 1 Н ЯМР (DMSO d6):9,50 (дублет, 1), 8,58 (синглет, 1), 8,01 (дублет, 1), 7,74(триплет, 1), 2,48 (мультиплет, 1). Пример 11. Получение соединения II-01 с. Данное соединение получают, применяя такой же способ, как для II-01b, используя (47 а)DMF (10 мл). Получен требуемый продукт (277 мг, 0,76 ммоль, 78%), который имеет следующие спектральные свойства: 300 МГц 1 Н ЯМР (DMSO d6):9,50 (дублет, 1), 8,60 (синглет, 1), 8,02 (дублет, 1), 7,78(синглет, 2), 3,53 (мультиплет, 1), 2,8 (триплет,1), 2,48 (мультиплет, 1). Пример 12. Получение соединения II-02. Следуя общей процедуре SPS, описанной в примере 8, (50 а) (50 мг) вводят в реакцию с 1 бензил-4-пиперидоном, чтобы получить 9 мг требуемого соединения, которое характеризуется следующими физическими свойствами: ВЭЖХ: Rt (время удерживания) = 21,36 мин.(синглет, 1 Н), 4,49 (широкий синглет, 2 Н), 3,661,03 (серия мультиплетов, 8 Н). Пример 13. Получение соединения II-03. Следуя общей процедуре SPS, описанной в примере 8, (50 а) (50 мг) вводят в реакцию с тетрагидро-4 Н-пираноном, чтобы получить 11 мг требуемого соединения, которое имеет следующие физические свойства: ВЭЖХ: Rt = 23,85 мин. (Способ D). МС: 411 (М+Н). 1 Н ЯМР (DMSO d6):11,07 (синглет, 1 Н),9,42 (дублет, J=7,59 Гц, 1 Н), 8,52 (синглет, 1 Н),7,9-7,22 (серия мультиплетов, 7 Н), 4,89 (синглет, 2 Н), 4,39 (синглет, 1 Н), 3,6-0,83 (серия мультиплетов, 8 Н). Пример 14. Получение соединения II-04. Следуя общей процедуре SPS, описанной в примере 8, (50 а) (50 мг) вводят в реакцию с 5 хлорпентан-2-оном, чтобы получить 10 мг требуемого соединения в виде смеси диастереомеров, которое имеет следующие физические свойства: ВЭЖХ: Rt = 32,1 мин и 33,0 мин. 47 Следуя общей процедуре SPS, описанной в примере 8, (50 а) (50 мг) вводят в реакцию с метил 2-кетогексаноатом [который получают в соответствии с описанным в литературе способом E.J. Corey, et al., Tetr. Letters, 1985, 3919-22],чтобы получить 6 мг требуемого соединения в виде смеси диастереомеров, которое имеет следующие физические свойства: ВЭЖХ: Rt = 25,5 мин и 26,0 мин. (Способ А). МС: 409 (М+Н),431 (M+Na). Пример 16. Получение соединения II-06. Следуя общей процедуре SPS, описанной в примере 8, (50 а) (50 мг) вводят в реакцию с метил 2-кетопентаноатом [который получают в соответствии с описанным в литературе способом С. Hershburg, Org. Syn., 1955, 627], чтобы получить 6 мг требуемого соединения в виде смеси диастереомеров, которое имеет следующие физические свойства: ВЭЖХ: Rt = 24,1 мин и 25,6 мин. (Способ А). МС: 395 (М+Н). Пример 17. Получение соединения II-07. Следуя общей процедуре SPS, описанной в примере 8, (50 а) (50 мг) вводят в реакцию с 4 хлорбутиральдегидом [который получают в соответствии с описанным в литературе способом М.Е. Kuehene et al., J. Org. Chem. 1981, 46, 200209], чтобы получить 6,9 мг требуемого соединения в виде смеси диастереомеров, которое имеет следующие физические свойства: ВЭЖХ: Rt = 28,6 мин и 30,0 мин. (Способ А). МС: 381(М+Н). Пример 18. Получение соединения II-08. Следуя общей процедуре SPS, описанной в примере 8, (50 а) (50 мг) вводят в реакцию с 4 хлор-4'-фторбутирфеноном для получения 10,1 мг требуемого соединения в виде смеси диастереомеров, которое имеет следующие физические свойства: ВЭЖХ: Rt = 32,8 мин и 35,0 мин.(Способ А). МС: 475 (М+Н). Пример 19. Получение соединения II-09. Следуя общей процедуре SPS, описанной в примере 8, (50 а) (50 мг) вводят в реакцию с 4 хлор-(2-тиофенил)бутирононом для получения 7,6 мг требуемого соединения в виде смеси диастереомеров, которое имеет следующие физические свойства: ВЭЖХ: Rt = 31,5 мин и 34,8 мин.(Способ А). МС: 463 (М+Н). Пример 20. Получение соединения II-10. Следуя общей процедуре SPS, описанной в примере 8, (50 а) (50 мг) вводят в реакцию с 1 метил-4-пиперидоном для получения 6 мг требуемого соединения, которое имеет следующие физические и спектральные свойства: ВЭЖХ: Rt 48 Следуя общей процедуре SPS, описанной в примере 8, (50 а) (50 мг) вводят в реакцию с 3,4 эпокситетрагидротиофеном для получения 7 мг требуемого соединения в виде смеси диастереомеров, которое имеет следующие физические и спектральные свойства: ВЭЖХ: Rt (основной диастереомер) = 27,19 мин, Rt (минорный диастереомер) = 27,34 мин. (Способ D). Диастереомерное соотношение: 60:40. МС: 413 (М+Н). 1 Н ЯМР (DMSO d6):11,21 и 11,1 (2 синглета, 1 Н), 9,43 (мультиплет, 1 Н), 8,55 (2 синглета, 1 Н), 7,96-7,11 (серия мультиплетов, 7 Н), 4,89(синглет, 2 Н), 4,67 (синглет, 1 Н), 3,00-1,3 (серия мультиплетов, 6 Н). Пример 22. Получение соединения 11-12. Следуя общей процедуре SPS, описанной в примере 8, (50 а) (50 мг) вводят в реакцию с 6 бромгексан-2-оном [который получают в соответствии с описанным в литературе способомFlannery et al., J. Org. Chem. 1972, 37, 2803] и неочищенный продукт очищают с помощью препаративной TLC, чтобы получить 2,5 мг требуемого продукта в виде смеси диастереомеров,который имеет следующие физические свойства: ВЭЖХ: Rt = 33,9 мин и 34,1 мин. (Способ А). МС: 409 (М+Н). Пример 23. Получение соединения 11-13. Следуя общей процедуре SPS, описанной в примере 8, (50 а) (50 мг) вводят в реакцию с бромпентан-1-алом [который получают в соответствии с описанным в литературе способом М.Е. Kuehene et al., J. Org. Chem. 1981, 46, 200209], чтобы получить 8,8 мг требуемого соединения в виде смеси диастереомеров, которое имеет следующие физические свойства: ВЭЖХ: Rt = 31,3 мин и 35,4 мин. (Способ А). МС: 395(М+Н). Пример 24. Получение соединения 11-14. Следуя общей процедуре SPS, описанной в примере 8, (50 а) (50 мг) вводят в реакцию с тетрагидротиопиран-4-оном, чтобы получить 8,8 мг требуемого соединения, которое имеет следующие физические свойства: ВЭЖХ: Rt = 28,21 мин. (Способ D). МС: 427 (М+Н). Пример 25. Получение соединения II-15. Следуя общей процедуре SPS, описанной в примере 8, (50 а) (50 мг) вводят в реакцию с ртетралоном, чтобы получить 8 мг требуемого соединения в виде смеси диастереомеров, которое имеет следующие физические свойства: ВЭЖХ: Rt (основной диастереомер) = 32,83 мин,Rt (минорный диастереомер) = 32,38 мин. (Способ D). Диастереомерное соотношение 55:45. МС: 457 (М+Н). Пример 26. Получение соединения II-16. Следуя общей процедуре SPS, описанной в примере 8, (50 а) (50 мг) вводят в реакцию с 1 этил-3-пиперидоном, чтобы получить 8 мг требуемого соединения в виде смеси диастереомеров, которое имеет следующие физические и спектральные свойства: ВЭЖХ: Rt (основной(серия мультиплетов, 13 Н). Пример 27. Получение соединения II-17. Следуя общей процедуре SPS, описанной в примере 8, (50 а) (50 мг) вводят в реакцию с 2(N-морфолинметил)циклопентаноном для получения 8 мг требуемого соединения в виде смеси диастереомеров, которое имеет следующие физические и спектральные свойства: ВЭЖХ: Rt(синглет, 1 Н), 7,99-7,09 (серия мультиплетов,7 Н), 4,93 (синглет, 2 Н), 4,68 (синглет, 1 Н), 4,01,1 (серия мультиплетов, 17 Н). Пример 28. Получение соединения 11-18. Следуя общей процедуре SPS, описанной в примере 8, (50 а) (50 мг) вводят в реакцию с циклобутаноном для получения 6 мг требуемого соединения, которое имеет следующие физические и спектральные свойства: ВЭЖХ: Rt = 27,42 мин. (Способ D). МС: 381 (М+Н). 1 Н ЯМР (DMSO d6):11,07 (синглет, 1 Н),9,43 (дублет, J=7,68 Гц, 1 Н), 8,52 (синглет, 1 Н),7,93 (дублет, J=7,78 Гц, 1 Н), 7,79 (дублет, J=7,44 Гц, 1 Н), 7,67 (дублет, J=8,08 Гц, 1 Н), 7,4-7,14(мультиплет, 4 Н), 4,89 (синглет, 2 Н), 4,36 (синглет, 1 Н), 2,7-0,8 (серия мультиплетов, 6 Н). Пример 29. Получение соединения II-19. Следуя общей процедуре SPS, описанной в примере 8, (50 а) (50 мг) вводят в реакцию с 1,7 дихлоргептан-4-оном для получения 7,6 мг требуемого соединения в виде смеси диастереомеров, которое имеет следующие физические свойства: ВЭЖХ: Rt = 34,0 мин и 35,3 мин.II-32. Следуя общей процедуре SPS, описанной в примере 8, (50 а) (50 мг) вводят в реакцию с 5 хлор-(1-пивалил)-пентан-2-оном [который получают в соответствии с описанным в литературе способом P. Knochel et al., J.Org. Chem. 1993,58, 588-99] и неочищенный продукт растирают с ацетонитрилом для получения 5,3 мг требуемого соединения в виде смеси диастереомеров,которое имеет следующие физические свойства: ВЭЖХ: Rt = 34,4 мин и 35,9 мин. (Способ А). МС: 495 (М+Н). Ацетонитрильную маточную жидкость очищают хроматографией (обращенная фаза С-8(М+Н). Пример 31. Получение соединения II-21. Раствор продукта II-20 (20 мг) в THF (2 мл) обрабатывают раствором LiBH4 в THF (0,5 мл, 2 М раствор) при комнатной температуре в течение 30 мин. Реакционную смесь гасят 1 н. НСl (2 мл), добавляют EtoAc и реакционную смесь перемешивают в течение 1,5 ч. Реакционную смесь нейтрализуют водным растворомNаНСО 3 и органическую фазу отделяют, промывают насыщенным раствором соли, сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток вносят в толуол с минимальным количеством THF, чтобы получить прозрачный раствор, который фильтруют через слой кремнезема и элюируют смесью 50% THF-толуол и выпаривают, чтобы получить II-21 в виде смеси диастереомеров, которое имеет следующие физические свойства: ВЭЖХ: Rt = 24,9 мин и 26,7 мин. (Способ А). МС: 411 (М+Н). Пример 32. Получение соединения II-22. К раствору спирта II-21 (5 мг) в СН 2 Сl2 (2 мл) добавляют Et3N (15 мкл), уксусный ангидрид (10 мкл) и кристаллический N,Nдиметиламинопиридин. Реакционную смесь перемешивают при комнатной температуре в течение 30 мин, гасят водным растворомNаНСО 3 и экстрагируют в EtOAc. Органический слой промывают 1 н. раствором НСl, насыщенным солевым раствором и затем сушат над безводным MgSO4. Концентрирование в вакууме дает II-22 в виде смеси диастереомеров, которое характеризуется следующими физическими свойствами: ВЭЖХ: Rt = 29,2 мин и 30 мин.(Способ А). МС: 453 (М+Н) и 475 (M+Na). Пример 33. Получение соединения II-23. В соответствии с общим способом SPS,описанным в примере 8, (50 а) (50 мг) вводят в реакцию с диэтоксибутиральдегидом [который получают согласно описанному в литературе способу L.A. Paquette et al., J. Am. Chem. Soc. 1997, 119, 9662], чтобы получить требуемое соединение, которое характеризуется следующими физическими свойствами: ВЭЖХ: Rt = 23,2 мин. (Способ А). МС: 397 (М+Н). Пример 34. Получение соединения II-24. В соответствии с общим способом SPS,описанным в примере 8, (50 а) (50 мг) вводят в реакцию с 1-ацетил-4-пиперидоном, чтобы получить 6 мг требуемого соединения, которое характеризуется следующими физическими свойствами: ВЭЖХ: Rt = 21,06 мин. (Способ D). МС: 452 (М+Н). 1 Н ЯМР (DMSO d6):11,06 (2 синглета,1 Н), 9,41 (дублет, J=7,53 Гц, 1 Н), 8,53 (синглет,1 Н), 7,94 (дублет, J=7,59 Гц, 1 Н), 7,7-7,1 (серия мультиплетов, 7 Н), 4,89 (синглет, 2 Н), 4,5-0,5 51 К раствору этилвинилового простого эфира (3,0 мл) в THF (14 мл) при -78 С в атмосфере аргона добавляют трет-BuLi (12,0 мл, 1,7 М в пентане). Реакционную смесь нагревают до-40 С в течение 10 мин, затем до комнатной температуры в течение 5 мин, повторно охлаждают до -78 С и добавляют к суспензии-40 С. Через 30 мин, быстро добавляют 1,3 дихлоризобутен (3,0 мл) и реакционную смесь оставляют для постепенного нагревания до комнатной температуры и перемешивают в течение 4 ч. Реакционную смесь гасят 10% раствором NH4Cl. Полученную смесь фильтруют и твердое вещество промывают простым эфиром. Органический слой промывают водным раствором NаНСО 3, насыщенным раствором соли и сушат над MgSO4, и концентрируют в вакууме. Остаток вносят в метанол (15 мл) и обрабатывают НСl (0,4 мл). Если никакого исходного материала не выявляют с помощью TLC, растворитель удаляют в вакууме, остаток обрабатывают водным NаНСО 3 и смесь экстрагируют эфиром (330 мл). Эфирный слой промывают насыщенным раствором соли и сушат над безводным MgSO4 и концентрируют в вакууме. Остаточный материал очищают через силикагель и элюируют с 20% EtOAc в гексане, чтобы получить 3-ацетил-4-хлоризобутен. Следуя общей процедуре SPS, описанной в примере 8, (50 а) (50 мг) вводят в реакцию с 3 ацетил-4-хлоризобутеном (который описан выше) для получения 2,15 мг требуемого соединения, которое характеризуется следующими физическими свойствами: ВЭЖХ: Rt = 34,0 мин и 34,9 мин. (Способ А). МС: 407 (М+Н). Пример 36. Получение соединения 11-26. Суспензию соединения 11-25, связанного с полимером (до расщепления продукта 11-25OsO4 (100 мкл 0,1 М раствора в ССl4), нметилморфолин N-оксидом (50 мг) и водой (100 мкл). После перемешивания в течение ночи реакционную смесь гасят 10% раствором NH4Cl,полимер промывают и продукт отделяют от полимера, как описано в примере 8, для получения соединения II-26 в виде смеси диастереомеров,которое имеет следующие физические свойства: ВЭЖХ: Rt = 20,0 мин и 21,2 мин. (Способ А). МС: 441 (М+Н). Пример 37. Получение соединения 11-27. Порцию продукта 11-26 (2 мг) вносят вNaIO4 (50 мг) при комнатной температуре в течение 16 ч. Реакцию гасят водным растворомNаНСО 3 и экстрагируют EtOAc. Органический слой сушат над МgSO4, фильтруют и концентрируют в вакууме для получения II-27 в виде смеси диастереомеров, которая имеет следующие физические свойства: ВЭЖХ: Rt = 27,3 мин и 28,2 мин. (Способ А). МС: 431 (M+Na). Пример 38. Получение соединения II-28. 52 К смеси гидрохлорида N,O-диметилгидроксиламина (13,0 г) в СН 2 Сl2 (500 мл) при 0 С добавляют Et3N (36 мл) и 5-хлорвалерилхлорид. Реакционную смесь нагревают до комнатной температуры и перемешивают в течение 2 ч. Реакцию гасят водным раствором NаНСО 3,промывают 1 н. раствором НСl и насыщенным раствором соли. Органический слой сушат над безводным MgSO4, фильтруют, концентрируют в вакууме и остаток перегоняют при 0,1 мм Нg(78-81 С). К раствору амида (2,0 г) в THF (15 мл) при -78 С добавляют раствор бромида винилмагния (17 мл, 1 М раствор), смесь нагревают до 0 С в течение 1 ч, а затем перемешивают при комнатной температуре в течение 30 мин. Реакционную смесь повторно охлаждают до 0 С и гасят охлажденной льдом 1 н. НСl. Продукт экстрагируют простым эфиром, сушат надMgSO4, фильтруют и концентрируют до объема 8 мл. Следуя общей процедуре SPS, описанной в примере 8, (50 а) (50 мг) вводят в реакцию с эфирным раствором 6-хлор-3-гекс-1-еноном(как описано выше) для получения 5,2 мг требуемого соединения II-28 в виде смеси диастереомеров, которое характеризуется следующими физическими свойствами: ВЭЖХ: Rt = 32,4 мин и 35, 6 мин. (Способ А). МС: 407 (М+Н). Пример 39. Получение соединения II-29. Суспензию соединения II-28, связанного с полимером (до расщепления продукта II-27OsO4 (100 мкл 0,1 М раствора в ССl4) нметилморфолин N-оксидом (50 мг) и водой (100 мкл). Реакционную смесь защищают от света алюминиевой фольгой и перемешивают в течение ночи. Реакционную смесь гасят раствором 10% NH4Cl и полимер промывают, а продукт отделяют от полимера, как описано в примере 8. Неочищенный диол очищают препаративной тонкослойной хроматографией (60% THF в толуоле) для получения продукта II-29, который характеризуется следующими физическими свойствами: ВЭЖХ: Rt = 21,6 мин. (Способ А). МС: 441 (М+Н) и 463 (M+Na). Пример 40. Получение соединений II-30 а иII-30b. Соединение (II-04) (два диастереомера) очищают, как описано ранее, и каждый диастереомер выделяют препаративной ВЭЖХ, как описано в общем синтезе. Один диастереомер имеет ВЭЖХ Rt = 32,1 мин. (Способ А) и МС = 395 (М+Н); другой имеет ВЭЖХ Rt = 33,0 мин.(Способ А) и МС = 395 (М+Н). Пример 41. Получение соединения II-31. Следуя общей процедуре SPS, описанной в примере 8, (50 а) (50 мг) вводят в реакцию с этил 5,7,9-триокса-3-оксодеканоатом [который получают в соответствии с описанным в литературе способом О. Kalinnkovick et al., Tett. Lett., 1996,10956] для получения 16 мг лактонов II-31 в виде смеси диастереомеров, которые характери 53 зуются следующими физическими свойствами: ВЭЖХ: Rt = 24,1 мин и 25,2 мин. (Способ А). МС: 469 (М+Н) и 491 (M+Na). Пример 42. Получение соединения II-33. Порцию (10 мг) МОМ-эфира (II-31) вносят в метанол (4 мл), обрабатывают несколькими каплями 6 н. раствора НСl и нагревают до 55 С в течение 2 ч. Растворитель удаляют выпариванием на роторном испарителе и неочищенный продукт очищают препаративной TLC со смесью 50% THF/толуол для получения 1 мг гидроксилактонов (II-33) в виде смеси диастереомеров, которые характеризуются следующими физическими свойствами: ВЭЖХ: Rt = 19,6 мин и 19,8 мин. (Способ А). МС: 425 (М+Н) и 447(M+Na). Пример 43. Получение соединения II-34. К раствору пивалата II-32 (5 мг) в THF (5 мл) добавляют раствор LiВН 4 в THF (1 мл, 2 М раствора) и реакционную смесь перемешивают при комнатной температуре в течение 5 ч, гасят 1 н. НСl (2 мл) и вносят в EtOAc. Реакционную смесь нейтрализуют водным растворомNаНСО 3, органическую фазу отделяют, промывают насыщенным раствором соли, сушат над безводным NaSO4, фильтруют и концентрируют в вакууме. Остаток вносят в толуол с минимальным количеством THF, чтобы получить прозрачный раствор, и очищают колоночной хроматографией на силикагеле (элюируют 55%THF в толуоле) для получения II-34 (3,34 мг),который характеризуется следующими физическими свойствами: ВЭЖХ: Rt = 25,3 мин. (Способ А). МС: 439 (М+Н). Пример 44. Получение соединения II-35 иII-36. Следуя общей процедуре SPS, описанной в примере 8, (50 а) (500 мг) вводят в реакцию с 5 хлор-(1-пивалил)пентан-2-оном [см. получениеII-20, выше] и неочищенный продукт очищают и выделяют индивидуальные диастереомеры полупрепаративной ВЭЖХ (С-8 колонка с обращенной фазой, элюируют 60% MeCN в воде,содержащей 0,1% TFA). Минорный изомер(М+Н). Также выделяют небольшое количество аналога II-32 R18=Et (ВЭЖХ: Rt = 37,0 мин). Минорный изомер (3,7 мг) в THF (1 мл) обрабатывают раствором LiВН 4 (0,5 мл, 2 М) и перемешивают при комнатной температуре в течение ночи. Реакционную смесь экстрагируютEtOAc, органический слой промывают 1 н. раствором NaOH, насыщенным раствором соли и сушат над безводным MgSO4. После фильтрования и удаления растворителя выпариванием на роторном испарителе, выделяют спирт II-35 (2,4 мг), который характеризовался следующими физическими свойствами: ВЭЖХ: Rt = 25,2 мин. 54 перемешивают при комнатной температуре в течение ночи. Реакционную смесь экстрагируютEtOAc, органический слой промывают 1 н. раствором NaOH, насыщенным раствором соли и сушат над безводным MgSO4. После фильтрования и удаления растворителя выпариванием на роторном испарителе, выделяют спирт II-36(27,3 мг), который характеризуется следующими физическими свойствами: ВЭЖХ: Rt = 23,7 мин. (Способ А). МС: 411 (М+Н). Пример 45. Получение соединения II-37. Следуя общей процедуре SPS, описанной в примере 8, (50 а) (25 мг) вводят в реакцию с 5 хлорпентан-2-оном для получения 2,3 мг требуемого продукта в виде смеси диастереомеров,который имеет следующие физические свойства: ВЭЖХ: Rt = 32,2 мин и 33,2 мин. (Способ А). МС: 395 (М+Н). Пример 46. Получение соединения II-38. Следуя общей процедуре SPS, описанной в примере 8, (50 а) (50 мг) вводят в реакцию с диэтоксибутиральдегидом [аналогично способу,описанному для II-23]. После обработки TFA,неочищенный продукт очищают хроматографией на колонке С-8 с обращенной фазой и подвергают гидролизу при внесении в растворитель ВЭЖХ [55% MeCN-45% вода маc./0,1% TFA]. Растворитель удаляют выпариванием на роторном испарителе для получения продукта, который характеризуется ВЭЖХ: Rt = 22,3 мин.(Способ А). МС: 397 (М+Н). Пример 47. Получение соединения II-39. К перемешиваемой суспензии (47 а) (87 мг,0,280 ммоль) в ацетонитриле (20 мл) при комнатной температуре в атмосфере азота добавляют 2-хлорметилциклобутанон (39,9 мг, 0,336 ммоль) с последующим добавлением DBU (46,1 мл, 0,308 ммоль). Реакционную смесь нагревают при температуре кипения с обратным холодильником в течение 42 ч. Добавляют DMF для солюбилизации реакционной смеси и 2 хлорметилциклобутанон (1 экв.) добавляют и смесь нагревают при температуре кипения с обратным холодильником в течение 30 мин. Добавляют дополнительный 1 экв. 2-хлорметилциклобутанона и реакционную смесь нагревают при температуре кипения с обратным холодильником в течение ночи, охлаждают до комнатной температуры, разбавляют этилацетатом (50 мл),затем промывают водой (425 мл). Органический слой сушат (MgSO4), фильтруют и концентрируют в вакууме для получения тонкой пленки, которая при дальнейшем высушивании затвердевает (90 мг, 82% выход). МС (ES+): m/e 415 (M+Na)+. 1 Н ЯМР (CDCl3, 300 МГц):1,93 (мультиплет, 1 Н), 2,28 (мультиплет, 1 Н), 3,09 (двойной дублет, 2 Н), 3,74 (мультиплет, 4 Н), 3,88 (мультиплет, 1 Н), 4,46 (дублет, 1 Н, J=17,1), 4,68 (дублет, 1 Н, J=17,1), 7,21-7,48 (мультиплет, 6 Н), 7,63II-40b. Реакцию проводят, как описано для II-38,за исключением того, что неочищенный продукт (после отщепления от полимера) очищают колоночной хроматографией на силикагеле (2:1 толуол/EtOAc). Выделяют два изомерных этилацеталя, II-40 а и II-40b, которые характеризуются следующими физическими свойствами: ВЭЖХ: Rt = 32,3 мин и 30,4 мин соответственно. (Способ А). МС: 425 (М+Н). Пример 49. Получение соединения II-41. К перемешиваемому раствору II-39 (63 мг,0,161 ммоль) в THF (8 мл) в атмосфере азота при 0 С добавляют по каплям боргидрид лития(96 мл, 0,193 ммоль). Реакционную смесь перемешивают при 0 С в течение 30 мин, затем нагревают до комнатной температуры в течение 2 ч. Реакционную смесь охлаждают до 0 С и гасят метанолом. Смесь перемешивают в течение 30 мин при комнатной температуре. Растворитель удаляют в вакууме, получая не совсем белое твердое вещество. Продукт выделяют флэшхроматографией на силикагеле, используяEtOAc (100%) для получения белого остатка (5 мг, 8% выход). МС (ES+): m/e 394 (М+Н). 1 Н ЯМР (CDCl3, 300 МГц):2,34 (мультиплет, 2 Н), 3,43 (мультиплет, 1 Н), 3,60 (двойной дублет, 1 Н), 3,83 (двойной дублет, 1 Н), 3,89(мультиплет, 6 Н), 7,72 (дублет, 1 Н), 8,54 (синглет, 1 Н), 9,38 (двойной дублет, 1 Н). Пример 50. Получение соединения II-42. Следуя общей процедуре SPS, описанной в примере 8, (50 а) (50 мг) вводят в реакцию с лактоном для получения 4,5 мг требуемого соединения, которое характеризуется следующими физическими свойствами: ВЭЖХ: Rt = 14,1 мин (смесь диастереомеров). (Способ С). МС: 379 (М-ОН)+. Пример 51. Получение соединения II-43. Следуя общей процедуре SPS, описанной в примере 8, (50 а) (50 мг) вводят в реакцию с 3,4 оксотетрагидрофураном [который получают в соответствии с описанным в литературе способом Hawkins et al., J. Chem. Soc. 1959, 248] и неочищенный продукт очищают полупрепаративной ВЭЖХ для получения 1 мг требуемого соединения, которое характеризуется следующими физическими свойствами: ВЭЖХ:Rt = 14,7 мин (смесь диастереомеров). (Способ С). МС: 395 (М+Н). Пример 52. Получение соединения II-44. Следуя общей процедуре SPS, описанной в примере 8, (50 а) (50 мг) вводят в реакцию с 1,5 дихлорпентан-2-оном [который получают в соответствии с описанным в литературе способом 56 получения 6,5 мг хлорметилтетрагидрофуранового производного II-44 в виде смеси диастереомеров, которое характеризуется следующими физическими свойствами: ВЭЖХ: Rt = 15,3 мин(М+Н). Пример 53. Получение соединения II-45a,II-45b и II-46. Следуя общей процедуре SPS, описанной в примере 8, (50 а) (50 мг) вводят в реакцию с 2 формил-3,5-диметоксибензилхлоридом [который получают в соответствии с описанным в литературе способом G.M. Makara et al., J. Org.Chem. 1995, 60, 717] для получения неочищенного продукта, который очищают (и разделяют диастереомеры) полупрепаративной ВЭЖХ,чтобы получить индивидуальные диастереомеры II-45 а (6,8 мг) и II-45b (5,9 мг) соответственно. Полученный продукт характеризуется следующими физическими свойствами: ВЭЖХ: Rt= 13,8 мин (II-45 а) и 15,9 мин (II-45b). (Способ С). МС: 511 (M+Na). Кроме того, также выделяют этилпереносящий продукт II-46 (R18 = Et аналог), который характеризуется следующими физическими свойствами: ВЭЖХ: Rt = 15,0 мин. (Способ С). МС: 539 (M+Na). Пример 54. Получение соединения II-47. Следуя общей процедуре SPS, описанной в примере 8, (50 а) (50 мг) вводят в реакцию с 3,3 диметил-4-оксолактоном для получения 10,1 мг требуемого продукта в виде смеси диастереомеров, который характеризуется следующими физическими свойствами: ВЭЖХ: Rt = 13,2 мин и 14,3 мин. (Способ С). МС: 439 (М+Н)+. Пример 55. Получение соединения II-48. Следуя общей процедуре SPS, описанной в примере 8, (50 а) (50 мг) вводят в реакцию с 2,3 О-изопропилиден-D-эритронолактоном для получения 4,1 мг требуемого продукта в виде смеси диастереомеров, который характеризуется следующими физическими свойствами: ВЭЖХ:(М+Н)+. Пример 56. Получение соединения II-49. Следуя общей процедуре SPS, описанной в примере 8, (50 а) (125 мг) вводят в реакцию с 3 формил-N,N-диметилпропионамидом и 20 мг гидроксиамидного промежуточного соединения выделяют обычным способом из реакции в твердой фазе. Полученный спирт (10 мг) окисляют периодинаном Десс-Мартина (Dess-Martin)(105 мл) в дихлорметане (5 мл) при 0 С в течение 30 мин. Реакционную смесь промывают водным Nа 2S2 О 3, водным NаНСО 3 и насыщенным раствором соли, и сушат над безводнымMgSO4 перед фильтрованием и концентрированием в вакууме. Полученный кетоамид вносят в метанол (5 мл) и добавляют гидрат гидразина (1 мл), а смесь нагревают при температуре кипения с обратным холодильником в течение 2 ч. После удаления растворителя в вакууме, оста 57 ток вносят в СН 2 Сl2 и промывают водой, насыщенным раствором соли и сушат над безводнымMgSO4. После фильтрования и удаления растворителя выпариванием на роторном испарителе,получают 4,9 мг требуемого продукта, II-49,который характеризуется следующими физическими свойствами: ВЭЖХ: Rt = 10,3 мин. (Способ С). МС: 407 (М+Н)+. Пример 57. Получение соединения II-50. Следуя общей процедуре SPS, описанной в примере 8, (50 а) (50 мг) вводят в реакцию с 1,4 диоксаспиро[4,5]деканоном для получения 4,1 мг требуемого продукта в виде смеси диастереомеров, который характеризуется следующими физическими свойствами: ВЭЖХ: Rt = 14,0 мин.(Получение (1,1-диэтоксиэтокси)ацетона). К охлажденной (0 С) суспензии NaH (2,68 г, 60%) в THF (150 мл) добавляют раствор 1,1 диэтоксиэтанола [который получают согласно описанному в литературе способу Zirkle, C.L. etTHF (20 мл) и реакционную смесь перемешивают при комнатной температуре в течение 1 ч перед добавлением металлилхлорида (8,0 мл). Реакционную смесь нагревают при температуре кипения с обратным холодильником в течение ночи, охлаждают и фильтруют через слой из целита. Растворитель удаляют выпариванием на роторном испарителе, а остаток очищают хроматографией на колонке (кремнезем, 20% простой эфир/гексан) для получения простого 1,1 диэтоксиэтилметаллилового эфира (11,5 г, 90%). Озонолиз охлажденного (-30 С) раствора полученного эфира (6,00 г) в EtOAc (80 мл) проводят до тех пор, пока не перестает выявляться с помощью TLC исходный материал (1 ч). В это время реакционную смесь продувают кислородом, обрабатывают Pd(OH)2 (150 мг) и перемешивают в атмосфере водорода в течение ночи. Катализатор отфильтровывают, а фильтрат концентрируют упариванием на роторном испарителе. Полученный остаток очищают колоночной хроматографией (кремнезем, 20% EtOAc/ гексан), чтобы получить (1,1-диэтоксиэтокси) ацетон (4,53 г, 82%). Следуя общей процедуре SPS, описанной в примере 8, (50 а) (50 мг) вводят в реакцию с (1,1 диэтоксиэтокси)ацетоном [который описан выше]. Порцию продукта (6,5 мг) фракционируют с помощью полупрепаративной ВЭЖХ (С-8 обращенная фаза, элюируют смесью 65% MeCNвода, содержащей 0,1% TFA). Выделенные изомерные продукты разделяли: 11-51 а (0,53 мг,ВЭЖХ: Rt = 15,0 мин), МС: 455 (М+Н), II-51bc 58 Неочищенные продукты реакции (10,5 мг),полученные согласно способу получения II-40 а и II-40b, вносят в хлористый метилен (20 мл) и обрабатывают эфиратом BF3 (20 мкл). После перемешивания в течение 2,5 ч, раствор промывают насыщенным водным NаНСО 3 и насыщенным раствором соли перед высушиванием надMgSO4. После фильтрования и удаления растворителя на роторном испарителе остаток переносят в THF (2 мл) и обрабатывают NBS (4,5 мг). После перемешивания в течение ночи добавляют дополнительный NBS (4,5 мг) и реакционную смесь перемешивают в течение следующих 2,5 ч. Неочищенный продукт фильтруют через короткую колонку С-18 (SEP-PAK картридж) и элюируют ступенчатым градиентом с 5% возрастанием смеси 65-75% MeCN-вода, содержащей 0,1% TFA. Соответствующие фракции объединяют, нейтрализуют водным NaHCO3, экстрагируют CH2Cl2 и сушат над безводнымMgSO4. После фильтрования и удаления растворителя на роторном испарителе, получают смесь бромидов (5 мг). К смеси бромидов (5 мг) в метоксиэтаноле (2 мл) добавляют Et3N (37 мкл) иPdCl2 (Рh3 Р)2 (1,5 мг) и смесь нагревают в атмосфере моноокиси углерода в течение 30 мин. Реакционную смесь охлаждают и экстрагируютEtOAc, и органический слой промывают водой. Водный слой экстрагируют несколько разEtOAc, а объединенные органические слои промывают насыщенным раствором соли, воднымNaHCO3, 1 н. НСl и насыщенным раствором соли и сушат над MgSO4. Фильтрование и концентрирование в вакууме дает выход = 1,1 мг II-52 в виде смеси диастереомеров. ВЭЖХ: Rt = 13,97 мин и 14,12 мин. (Способ С). МС: 557 (М+Н),579 (M+Na). Пример 60. Получение соединения II-53. Следуя общей процедуре SPS, описанной в примере 8, (50 а) (50 мг) вводят в реакцию с 5 хлор-(1-пивалил)пентан-2-оном [как описано выше для II-20] и основной продукт, единственный диастереомер, выделяют полупрепаративной ВЭЖХ (колонка С-8 с обращенной фазой,элюируют 75% MeCN в воде, содержащей 0,1%TFA). ВЭЖХ: Rt = 17,2 мин. (Способ А). Пивалат (5 мг) в THF (2 мл) обрабатывают раствором LiВН 4 (2 мл, 2 М) и реакционную смесь перемешивают при комнатной температуре в течение ночи. Реакционную смесь гасят 1 н. НСl и экстрагируют EtOAc. Органический слой промывают 1 н. раствором NaOH, насыщенным раствором соли и сушат над безводным MgSO4. Фильтрование и концентрирование в вакууме обеспечивает спирт II-53 (3,2 мг). ВЭЖХ: Rt = 12,0 мин. (Способ А). МС: 441 (М+Н). Пример 61. Получение соединения II-54. Следуя общей процедуре SPS, описанной в примере 8, (50 а) (50 мг) вводят в реакцию с диэтоксибутиральдегидом. Данный экспериментальный протокол подобен протоколу, примененному для получения соединений II-23, II-40 а 59 и II-40b, который описан выше. Неочищенный продукт (после обработки TFA) очищают колоночной хроматографией с обращенной фазой,соответствующие фракции объединяют и нейтрализуют твердым NаНСО 3 перед экстрагированием в EtOAc. Органический слой промывают насыщенным раствором соли и сушат надII-55b. Следуя общей процедуре SPS, описанной в примере 8, (50 а) (145 мг) вводят в реакцию с 2 этоксикарбонил-2-циклопентеноном [который получают в соответствии с описанным в литературе способом H.J. Reich et al., J. Am. Chem. 1975, 97, 5434-47]. Неочищенный продукт очищают полупрепаративной ВЭЖХ (С 8, 65%CH3CN - 35% воды, содержащей 0,1% TFA) для получения II-55 а (1,98 мг). ВЭЖХ: Rt = 12,1 мин. (Способ С). МС: 465 (М+Н) и II-55b (7,35 мг) ВЭЖХ: Rt = 14,1 мин и 15,6 мин. (Способ С). МС: 465 (М+Н). Пример 63. Получение соединения II-56. Образец из примера II-55 а (7 мг) обрабатывают цианидом натрия в DMSO при 145 С в течение 1 ч, чтобы получить II-56, имидное производное. Выход: (4,93 мг). ВЭЖХ: Rt = 13,6 мин. (Способ С). МС: 519. Пример 64. Получение соединения II-57. К раствору II-01 а (200 мг, 0,54 ммоль) вTHF (10 мл) добавляют NBS (116 мг, 0,65 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 24 ч. Растворитель удаляют выпариванием на роторном испарителе и оставшееся коричневое твердое вещество перемешивают с метанолом (5 мл) в течение 0,5 ч. Суспензию фильтруют и промывают метанолом, получая 215 мг (0,48 ммоль,89%) требуемого продукта, который характеризуется следующими спектральными свойствами: 300 МГц 1 Н ЯМР (DMSO d6):9,52 (дублет, 1), 8,65 (синглет, 1), 8,621 (синглет, 1), 8,15(40 мл) добавляют NBS (632 мг, 3,5 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 18 ч. Растворитель удаляют в вакууме и полученное желто-оранжевое твердое вещество суспендируют в метаноле (50 мл). Суспензию фильтруют, а твердое вещество промывают дополнительным метанолом. После высушивания получают соединение брома (R3=Br) (1,09 г, 2,8 ммоль, 88% выход) в виде твердого веществаm/е). К раствору вышеописанного бромида (1,09 г, 2,8 ммоль) добавляют 4,4'-диметоксибензгидрол (818 мг, 3,4 ммоль) и п-толуолсульфоновую кислоту (532 мг, 2,8 ммоль) в бензоле (60 мл) и N-метилпирролидинон (6 мл) и нагревают при температуре кипения с обратным холодильником. Через 24 ч реакционную смесь оставляют для охлаждения до комнатной температуры и разбавляют этилацетатом (200 мл). Органический слой промывают NаНСО 3 (2 x), Н 2 О (2 x) и насыщенным раствором соли (2 x), сушат над безводным MgSO4, фильтруют, а растворитель удаляют в вакууме. Неочищенный материал очищают колоночной хроматографией (10%EtOAc-гексан) для получения требуемого DMBзащищенного 3-броминдольного производного(1,5 г, 2,4 ммоль, выход 87%) в виде оранжевого твердого вещества: (ESII-MC (М+Н) 616,5 m/е). В закрываемую герметически пробирку,объемом 250 мл, загружают DMB-защищенное 3-бромсоединение (1,5 г, 2,4 ммоль), дихлорид бис(трифенилфосфинил)палладия (100 мг, 0,14 ммоль), безводный ацетат натрия (3,9 г, 4,8 ммоль) и метоксиэтанол (50 мл). Пробирку попеременно откачивают и заполняют СО, оставляя ее в атмосфере СО. Затем ее погружают в масляную баню при 150 С. Через 4 ч пробирку охлаждают до комнатной температуры и повторно загружают СО. Такую процедуру повторяют еще раз во время реакции, продолжающейся в целом 10 ч. Реакционную смесь разбавляют этилацетатом (250 мл), промывают водой,сушат над безводным MgSO4, фильтруют и сушат в вакууме. Остаток растирают с метанолом,чтобы получить 3-карбоксипроизводное (1,29 г,2,02 ммоль, выход 84%) в виде желтого твердого вещества: ESII-MC (М+Н) 639,6 m/е. К раствору вышеописанного сложного эфира (1,2 г, 1,9 ммоль) в хлористом метиленеTFA (4 мл). После перемешивания в течение 1 ч при комнатной температуре, реакционную смесь упаривают до сухого состояния, а остаток суспендируют в диэтиловом эфире. Суспензию фильтруют и твердое вещество промывают диэтиловым эфиром до тех пор пока фильтрат не становится бесцветным. Сложный эфир со снятой защитной группой (636 мг, 1,54 ммоль) выделяют в виде не совсем белого твердого вещества: ESII-MC (М+Н) 413,4 m/е. Вышеописанный сложный эфир (500 мг,1,2 ммоль) суспендируют в хлористом метилене(15 мл) и добавляют раствор гидрида диизобутилалюминия в хлористом метилене (5,5 мл, 5,5 ммоль, 1,0 М). Через 2 ч при комнатной температуре реакцию гасят метанолом. Растворитель удаляют выпариванием на роторном испарителе и к остатку добавляют воду. Суспензию фильтруют и тведое вещество оставляют для высыхания. Получают требуемый продукт [A1,A2=H2,
МПК / Метки
МПК: A61P 13/08, C07D 487/04, A61K 31/40
Метки: пирролкарбазолы, конденсированные, изоиндолоны, циклические, замещенные
Код ссылки
<a href="https://eas.patents.su/30-5273-ciklicheskie-zameshhennye-kondensirovannye-pirrolkarbazoly-i-izoindolony.html" rel="bookmark" title="База патентов Евразийского Союза">Циклические замещенные конденсированные пирролкарбазолы и изоиндолоны</a>
Предыдущий патент: Жидкий концентрат минеральных наполнителей, содержащий привитые сополимеры, и его применение для приготовления красок на водной и/ или органической основе
Следующий патент: Ингибиторы 11-бета-гидроксистероиддегидрогеназы типа 1
Случайный патент: Дейтерированные производные катехоламина, а также лекарственные средства, содержащие эти соединения












