Замещенные фенильные производные в качестве антагонистов эндотелина
Номер патента: 61
Опубликовано: 30.04.1998
Авторы: Астлис Петер Чарльз, Хэлли Фрэнк, Уолш Роджер Джон Айчисон, Ван Сикли Эндрю Пол, Смит Кристофер, Бридж Эндрю Уильям, Портер Барри, Харрис Нейл Виктор, Маккарти Клив, Маклей Ян Макфарлейн, Морли Эндрю Дэвид, Маджид Тахир Надим
Формула / Реферат
1. Соединение формулы (I):

где R1 представляет CN, CH2CN, CH=CHCN, СНО или СН=СНСО2Н;
R2 представляет арил низший алкокси, гетероарил низший алкокси, арил низший алкилтио или гетероарил низший алкилтио, в которых каждый арильный и гетероарильный остатки необязательно замешены;
R3 представляет галоген;
R4 представляет необязательно замещенный арил или необязательно замещенный гетероарил;
R5 представляет карбокси или биоизостер кислоты;
Х представляет кислород или серу; и
n равно 0 или 1;
и его N-оксиды и пролекарства, и их фармацевтически приемлемые соли.
2. Соединение по п.1, в котором R1 присоединен к кольцу в положении 2.
3. Соединение по пп.1 или 2, в котором R2 присоединен к кольцу в положении 5.
4. Соединение по любому из предшествующих пунктов, в которых R3 присоединен к кольцу в положении 3.
5. Соединение по п.1, имеющее формулу (Iа):
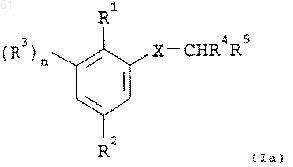
где R1 представляет CN, CH2CN, CH=CHCN, СНО или СН=СНСО2Н;
R2 представляет арил низший алкокси, гетероарил низший алкокси, арил низший алкилтио или гетероарил низший алкилтио, в которых каждый арильный и гетероарильный остатки необязательно замещены;
R3 представляет галоген;
R4 представляет необязательно замещенный арил или необязательно замещенный гетероарил;
R5 представляет карбокси или изостер кислоты;
Х представляет кислород или серу; и
n равно 0 или 1,
и его N-оксиды и пролекарства, и их фармацевтически приемлемые соли.
6. Соединение по любому из предшествующих пунктов, в котором R1 является CN.
7. Соединение по любому из предшествующих пунктов, в котором R2 является гетероарил низший алкокси.
8. Соединение по п.7, в котором R2 является гетероарилметокси.
9. Соединение по любому из предшествующих пунктов, в котором R4 является арилом, замещенным арилом.
10. Соединение по любому из предшествующих пунктов, в котором R5 является карбокси.
11. Соединение по любому из предшествующих пунктов, в котором Х является кислородом.
12. Соединение по п.1, имеющее формулу (Ib):

где R2 представляет арил низший алкокси, гетероарил низший алкокси, арил низший алкилтио или гетероарил низший алкилтио, в которых каждый арильный и гетероарильный остатки необязательно замещены;
R3 представляет галоген;
R4 представляет необязательно замещенный арил или необязательно замещенный гетероарил; и
n равно 0 или 1,
и их N-оксиды и пролекарства, и их фармацевтически приемлемые соли.
13. Соединение по любому из предшествующих пунктов, в котором R2 является пиридилметокси, пиридазинилметокси, тиенилметокси, изотиазолилметокси или 1,3-бензодиоксолилметокси.
14. Соединение по любому из предшествующих пунктов, в котором R3 является атомом фтора.
15. Соединение по любому из предшествующих пунктов, в котором R4 является фенилом, замещенным в орто-положении по отношению к месту присоединения фенильной группы к оставшейся части радикала R4 с помощью низшего алкила, СF3 или хлора, и может быть, кроме того, замещен одним или несколькими заместителями, выбранными из галогена, низшего алкила, CN или низшего алкокси.
16. Соединение по любому из предшествующих пунктов, в котором хиральный центр, связанный с атомом углерода в a-положении по отношению к радикалу Х в группе -X-CHR4R5, или с атомом углерода в a-положении по отношению к атому кислорода в группе -O-CHR4CO2H, имеет (S)конфигурацию.
17. Соединение по п.1, выбранное из следующих соединений:
(RS)-(2-хлорфенил)-[2-циано-5-(4-пиридилметокси)фенокси]-уксусная кислота;
(RS)-2-циано-5-(3-тиенилметокси)фенокси] фенилуксусная кислота;
(RS)-(2-хлорфенил)-[2-циано-5-(3-тиенилметокси)фенокси]-уксусная кислота;
(RS)-[5-(1,3-бензодиоксол-5-илметокси)-2-цианофенокси]-фенилуксусная кислота;
(RS)-[5-(1,3-бензодиоксол-5-илметокси)-2-цианофенокси]-(2-трифторметилфенил) уксусная кислота;
(RS)-[2-циано-5-(3-тиенилметокси)фенокси]-(2-метилфенил) уксусная кислота;
(RS)-[5-(1,3-бензодиоксол-5-илметокси)-2-цианофенокси]-(2-хлорфенил) уксусная кислота;
(RS)-(2-бромфенил)-[2-циано-5-(3-тиенилметокси) фенокси]-уксусная кислота;
(RS)-(3-хлорфенил)-[2-циано-5-(3-тиенилметокси)фенокси]-уксусная кислота;
(R)-(2-хлорфенил)-[2-циано-5-(3-тиенилметокси)фенокси]-уксусная кислота;
(S)-(2-хлорфенил)-[2-циано-5-(3-тиенилметокси)фенокси]-уксусная кислота;
(RS)-[2-циано-5-(4-пиридилметокси)фенокси]фенилуксусная кислота;
(RS)-[2-циано-5-(3-тиенилметокси)фенокси]-(2-фторфенил)-уксусная кислота;
(RS)-[2-циано-5-(4-пиридилметокси)фенокси]-(2-метилфенил)-уксусная кислота;
(RS)-[2-циано-5-(3-тиенилметокси)фенокси]-(2-трифторметилфенил) уксусная кислота;
(RS)-(2-бромфенил)-[2-циано-5-(4-пиридилметокси)фенокси]-уксусная кислота;
(RS)-[2-циано-5-(4-пиридилметокси)фенокси]-(2-трифторметилфенил) уксусная кислота;
(S)-[2-циано-5-(4-пиридилметокси)фенокси]-(2-метилфенил)-уксусная кислота;
(RS)-(2-хлорфенил)-[2-циано-5-(пиридазин-4-илметокси)-фенокси] уксусная кислота;
(RS)-[5-(1,3-бензодиоксол-5-илметокси)-2-цианофенокси]-(2-метилфенил) уксусная кислота;
(RS)-(2-хлорфенил)-[2-циано-5-(изотиазол-4-илметокси)-фенокси] уксусная кислота;
(RS)-[2-циано-5-(3-пиридилметокси)фенокси] фенилуксусная кислота;
(RS)-[2-формил-5-(3-тиенилметокси)фенокси] фенилуксусная кислота;
(RS)-N-{[2-циано-5-(3-тиенилметокси)фенокси]фенилацетил}-4-изопропилбензолсульфонамид;
ацетоксиметиловый эфир (RS)-[2-циано-5-(4-пиридилметокси)фенокси]-(2-метилфенил) уксусной кислоты;
(RS)-(2-хлорфенил)-[2-циано-3-фтор-5-(3-тиенилметокси)-фенокси] уксусная кислота;
(RS)-[5-(бензоксазол-6-илметокси)-2-цианофенокси]-(2-хлорфенил) уксусная кислота;
(RS)-[2-циано-5-(4-пиридилметокси)фенокси]-[2-(3-метил)-тиенил] уксусная кислота;
(RS)-[(2-циано-5-(тиазол-5-илметокси)фенокси]-(2-метилфенил)-уксусная кислота;
(RS)-(2-хлорфенил)-[2-циано-3-фтор-5-(4-пиридилметокси)-фенокси] уксусная кислота;
(RS)-2-[(2-хлорфенил)-(1Н-тетразол-5-ил) метокси)-4-(4-пиридилметокси) бензонитрил;
(RS)-[3-хлор-2-циано-5-(4-пиридилметокси)фенокси]-(2-хлорфенил) уксусная кислота;
(RS)-[5-(бензоксазол-6-илметокси)-2-цианофенокси]-(2-метилфенил) уксусная кислота;
(S)-[5-(1,3-бензодиоксол-5-илметокси)-2-цианофенокси]-(2-метилфенил) уксусная кислота;
(S)-[5-(1,3-бензодиоксол-5-илметокси)-2-циано-3-фторфенокси]-(2-метилфенил) уксусная кислота;
(RS)-[2-циано-5-(4-(3-фторпиридил)метокси)фенокси]-(2-метилфенил) уксусная кислота;
(RS)-2-[(2-метилфенил)-(1Н-тетразол-5-ил)метокси]-4-(4-пиридилметокси) бензонитрил;
(RS)-4-(1,3-бензодиоксол-5-илметокси)-2-[(2-метилфенил)-(1Н-тетразол-5-ил)метокси]бензонитрил;
(RS)-[2-циано-3-фтор-5-(4-пиридилметокси)фенокси]-(2-метилфенил) уксусная кислота;
(RS)-[5-(бензоксазол-6-илметокси)-2-циано-3-фторфенокси]-(2-метилфенил) уксусная кислота;
(RS)-[5-(1,3-бензодиоксол-5-илметокси)-2-циано-3-фторфенокси]-(2-метилфенил) уксусная кислота;
(RS)-[5-(бензоксазол-5-ил)метокси-2-цианофенокси]-(2-метилфенил) уксусная кислота;
(RS)-(5-бензилокси-2-цианофенокси)-(2-метилфенил)уксусная кислота;
(RS)-[2-циано-5-(фуран-3-илметокси)фенокси]-(2-метилфенил) уксусная кислота;
(RS)-N-метокси-[2-циано-5-(3-тиенилметокси)фенокси]-(2-метилфенил)ацетамид;
и их сольваты (например, гидраты); и их фармацевтически приемлемые соли.
18. Соединение по п.1, выбранное из следующих соединений:
(RS)-(2-хлорфенил)-[2-циано-5-(4-пиридилметокси)фенокси]-уксусная кислота;
(S)-[5-(1,3-бензодиоксол-5-илметокси)-2-цианофенокси]-(2-метилфенил) уксусная кислота;
(RS)-[5-(1,3-бензодиоксол-5-илметокси)-2-цианофенокси]-(2-метилфенил) уксусная кислота;
(RS)-[2-циано-5-(4-пиридилметокси)фенокси]-(2-метилфенил)-уксусная кислота;
(S)-[2-циано-5-(4-пиридилметокси)фенокси]-(2-метилфенил) уксусная кислота;
(RS)-[5-(1,3-бензодиоксол-5-илметокси)-2-циано-3-фторфенокси]-(2-метилфенил) уксусная кислота;
(S)-[5-(1,3-бензодиоксол-5-илметокси)-2-циано-3-фторфенокси]-(2-метилфенил) уксусная кислота;
и их сольваты (например, гидраты); и их фармацевтически приемлемые соли.
19. Соединение по п.1, являющееся (S)-[5-(1,3-бензодиоксол-5-илметокси)-2-цианофенокси]-(2-метилфенил)уксусной кислотой, и его сольваты (например, гидраты) и их фармацевтически приемлемые соли.
20. Фармацевтическая композиция, содержащая эффективное количество соединения по п.1 и фармацевтически приемлемый носитель или наполнитель.
21. Фармацевтическая композиция по п.20 для лечения болезненного состояния, связанного с физиологически вредным избытком эндотелина, или с болезненным состоянием, связанным с патологическими симптомами, которые могут быть ослаблены путем ингибирования эндотелина.
22. Использование соединения по п.1 для получения лекарственного средства для лечения болезненного состояния, связанного с физиологически вредным избытком эндотелина, или с болезненным состоянием, связанным с патологическими симптомами, которые могут быть ослаблены путем ингибирования эндотелина.
23. Использование соединения по п.1 в качестве ингибитора эндотелина в сочетании в комбинированной терапии с одним или несколькими ингибиторами ферментов, преобразующих эндотелин, с антагонистами рецепторов ангиотензина II, с ингибиторами ренина, с ингибиторами фермента, преобразующего ангиотензин, с агонистами и антагонистами a- и b-адреноцепторов, с диуретиками, с активаторами калиевых каналов, с антагонистами кальциевых каналов, с нитратами, с противоаритмическими агентами, с положительными инотропическими агентами, с агонистами и антагонистами рецепторов серотонина, с антагонистами фактора активации тромбоцитов, с антагонистами рецепторов гистамина, ингибиторами протонного насоса, с антитромботическими и тромболитическими агентами, с агентами, понижающими уровень липидов, с антибиотическими агентами и с ингибиторами фосфодиэстеразы для лечения болезненного состояния, связанного с физиологически вредным избытком эндотелина или с болезненным состоянием, связанным с патологическими симптомами, которые могут быть ослаблены путем ингибирования эндотелина.
24. Способ получения соединения формулы (I), указанного в п.1, который включает взаимодействие соединения формулы (II)
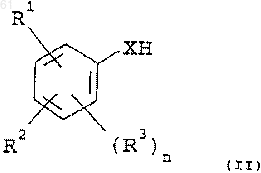
где R1 представляет CN, CH2CN, CH=CHCN, СНО или СН=СНСO2Н;
R2 представляет арил низший алкокси, гетероарил низший алкокси, арил низший алкилтио или гетероарил низший алкилтио, в которых каждый арильный и гетероарильный остатки необязательно замещены;
R3 представляет галоген;
Х представляет кислород или серу; и
n равно 0 или 1
с соединением формулы (III)
Y-CHR4R5a (III)
где Y является удаляемой группой, такой как атом галогена или арил- или алкилсульфонилоксигруппа (например, метан- или n-толуолсульфонилокси), и R5a является защищенным производным R5, включая аммонийные соли карбоновой кислоты, с последующим удалением любых имеющихся защитных групп, если это необходимо; с образованием соли и пролекарства и с преобразованием R5 в биоизостер карбоновой кислоты, если это необходимо.
25. Способ получения соединения формулы (I), указанного в п.1, где R1 обозначает CN, присоединенный к кольцу в положении 2;
R2 представляет арил низший алкокси, гетероарил низший алкокси, арил низший алкилтио или гетероарил низший алкилтио, в которых каждый арильный и гетероарильный остатки необязательно замещены;
R3 представляет галоген; и
n равно 0 или 1,
который включает взаимодействие соединения формулы (IV)
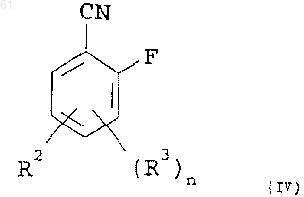
с соединением формулы (V)
HOCHR4R5 (V)
где R4 представляет необязательно замещенный арил или необязательно замещенный гетероарил; и
R5 представляет карбокси или изостер кислоты;
или соответствующим тиолом, с последующим удалением любых имеющихся защитных групп, если это необходимо; с образованием соли и пролекарства и с преобразованием R5 в биоизостер карбоновой кислоты, если это необходимо.
26. Способ получения соединения формулы (I), указанного в п.1, где Х представляет кислород, и R2 представляет арил низший алкокси или гетероарил низший алкокси, R1 представляет CN, CH2CN, CH=CHCN, СНО или СН=НСО2Н; R3 представляет галоген; R4 представляет необязательно замещенный арил или необязательно замещенный гетероарил; n равно 0 или 1, который включает обработку соединения формулы (VI)
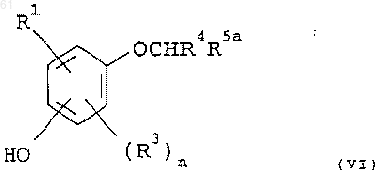
где R5a является защищенным производным R5, арилалкил- или гетероарилалкилгалогенидом в присутствии соответствующего основания, с последующим удалением любых имеющихся защитных групп, если это необходимо; с образованием соли и пролекарства и с преобразованием R5 в биоизостер карбоновой кислоты, если это необходимо.
27. Способ лечения болезненного состояния, которое может быть облегчено путем введения ингибитора эндотелина, включающий введение пациенту, страдающему указанным болезненным состоянием, эффективного количества соединения по п.1.
Текст
1 Данное изобретение относится к замещенным фенильным производным, их получению,фармацевтическим композициям, содержащим эти соединения, и к их фармацевтическому применению при лечении болезненных состояний, связанных с эндотелиновыми пептидами. Эндотелины являются семейством пептидов, в основном синтезируемых или высвобождаемых эндотелиальными клетками. Термин эндотелин (ЕТ) относится к семейству гомологических 21 аминокислотных пептидов, находящихся в трех различных изоформах: ЕТ-1,ЕТ-2 и ЕТ-3, и в настоящем описании термин эндотелин предназначен для указания любой или всех изоформ эндотелина. Каждый эндотелиновый изопептид кодирован отдельным геном с отдельным хромосомальным локусом для каждого гена человека. Были идентифицированы подтипы рецепторов ЕТА и ЕТв, специфичные к эндотелину (Н.al., Nature 348, 732 (1990. ЕТ-1 и ЕТ-2 связываются с ЕТА сильнее, чем ЕТ-3, и стимуляция этого подтипа рецептора вызывает сужение сосудов. ЕТ-1, ЕТ-2 и ЕТ-3 связываются с одинаковым сродством с рецепторами ЕТВ, и стимуляция этого подтипа рецептора может устранить расширение сосудов или вызвать сужение сосудов. Таким образом, эндотелин является важным сильнодействующим сосудосуживающим средством, которое оказывает продолжительное воздействие на артерии и вены. Вследствие этого эндотелин оказывает глубокое действие на сердечно-сосудистую систему, в частности на систему коронарного, почечного, мезентериального и церебрального кровообращения. Также наблюдались другие виды биологической активности эндотелина. Внутривенное вливание ЕТ-1 крысам вызывает преходящий гипотонический эффект с последующим медленным повышением кровяного давления. Даже низкие дозы эндотелина,которые сами по себе не имеют прессорного действия, усиливают эффекты других сосудосуживающих агентов. Сообщалось о значительно повышенных уровнях иммунореактивного ЕТ-1 в плазме крови у пациентов с такими расстройствами, как инфаркт миокарда, включая острый инфаркт миокарда, ишемическая болезнь сердца, приступы стенокардии, включая вазоспастическую стенокардию, преэклампсия,эссенциальная и легочная гипертензия и застойная сердечная недостаточность. Кровеносные сосуды почек являются особенно чувствительными к сосудосуживающему действию ЕТ. Он вызывает заметное уменьшение кровотока в почках, сопровождающееся уменьшениями скорости клубочковой фильтрации, объема мочи и экскреции натрия и калия с мочой. Эндотелин является также митогенным 2 для мезангиальных клеток. Таким образом, эндотелин играет роль в ряде почечных расстройств, таких как острая почечная недостаточность и хроническая почечная недостаточность, и нефротоксический эффект циклоспорина. Кроме того, эритропоэтин вызывает высвобождение эндотелина, и это высвобождение играет роль при почечных осложнениях и гипертонии, проявляющихся в качестве побочных эффектов у диализных пациентов. Эндотелин вызывает пролиферативный ответ клеток гладких мышц сосудов, и это, в сочетании с наблюдениями повышенных уровней циркулирующего ЕТ-1 при атеросклерозе, указывает на то, что эндотелин вносит вклад в патогенез данного и связанных с ним заболеваний. Уровни эндотелина также повышаются после операций на сосудах и определяют высокий уровень рестенозирования после операций с полным поперечным пересечением сосуда. Мышцы церебральных сосудов очень чувствительны к сосудосуживающему действию эндотелинов. Разовая интратекальная инъекция собакам ведет к длительному сужению базилярной артерии. Гипоксия и ишемия являются сильнодействующими стимулами для усиленного высвобождения эндотелина эндотелиальными клетками, в то время как секреция эндогенных вазодилятаторов, таких как PGI2 и эндотелиальный фактор релаксации, является пониженной. Следовательно, эндотелин играет важную роль в развитии церебральной ишемии,такой как инсульт, удар и субарахноидальное кровоизлияние. Эндотелин является сильнодействующим фактором, вызывающим сокращение изолированной ткани дыхательных путей, включая бронхи человека. Кроме того, показано, что эндотелин вызывает высвобождение эйкозаноида,обладает митогенными свойствами по отношению к гладким мышцам дыхательных путей и имеет выраженное провоспалительное воздействие. Все эти эффекты подтверждают важную роль эндотелина в патофизиологии легких и в развитии астмы и связанных с ней состояниях. Уровни эндотелина повышаются во время септического шока и при других эндотоксининдуцированных состояниях, таких как синдром диссеминированного внутрисосудистого свертывания крови, мигрень, желудочно-кишечные расстройства, такие как язвы и синдром раздраженного кишечника, болезнь Рейно, гемангиоэндотелиома. Нормальное восстановление костной ткани включает соединение функций остеокластов и остеобластов, дисбаланс этих условий ведет к патофизиологической потере костной ткани. Оба типа клеток продуцируют эндотелин и обладают эндотелиновыми рецепторами. По этой причине антагонисты отдельных эффектов эндотелина могли бы использоваться при лечении 3 клинических состояний, сопровождающихся потерей костной ткани, таких как остеопороз. Эндотелин-1 продуцируется в простате человека, и рецепторы эндотелина были идентифицированы в этой ткани. Поскольку эндотелин является паракринным контрактильным и пролиферативным фактором предстательной железы, роль эндотелина отмечена в доброкачественной гиперплазии. Эндотелин продуцируется опухолевыми клетками, и в свете их митогенных свойств антагонисты рецепторов эндотелина могли бы использоваться в химиотерапии рака. Также наблюдалось дополнительное воздействие эндотелина на высвобождение нейротрансмиттеров, свидетельствующее о роли в некоторых расстройствах центральной нервной системы. В настоящее время заявители обнаружили новую группу соединений, которые действуют как антагонисты эндотелина и поэтому могут использоваться в терапии, более конкретно, в лечении болезненного состояния, связанного с физиологически вредным избытком эндотелина или с болезненным состоянием, связанным с патологическими состояниями, которые модулируют с помощью ингибирования действия эндотелина. Таким образом, в соответствии с первым аспектом настоящего изобретения авторы указывают соединение формулы (1):R2 представляет арил низший алкокси, гетероарил низший алкокси, арил низший алкилтио или гетероарил низший алкилтио, в которых каждый арильный и гетероарильный радикал необязательно замещены;R4 представляет необязательно замещенный арил или необязательно замещенный гетероарил;R5 представляет карбокси или биоизостер кислоты; Х представляет кислород или серу; иn равно 0 или 1; и их N-оксиды и пролекарства и их фармацевтически приемлемые соли. Как использовано выше и по всему описанию изобретения, следующие термины в кавычках, если не указано иного, должны пониматься в качестве имеющих следующие значения: Биоизостер кислоты обозначает группу,которая значительно ионизована при физиологических рН. Примеры соответствующих изо 000061 4 стеров кислот включают сульфо, фосфоно, алкилсульфонилкарбамоил, тетразолил, арилсульфонилкарбамоил,гетероарилсульфонилкарбамоил или N-метоксикарбамоил."Алкокси" обозначает алкил-О-группу, в которой алкильная группа является такой, как здесь описана. Предпочтительными алкоксигруппами являются низшие алкоксигруппы,имеющие от 1 до около 3 атомов углерода. Типичные алкоксигруппы включают метокси,этокси и н-пропокси."Алкил" обозначает алифатическую углеводородную группу, которая может быть прямой или разветвленной, имеющей от около 1 до около 6 атомов углерода в цепи. Предпочтительные алкильные группы имеют от 1 до около 4 атомов углерода в цепи, главным образом, от 1 до 2 атомов углерода."Разветвленный" обозначает, что одна или несколько низших алкильных групп, таких как метил, этил или пропил, присоединены к линейной алкильной цепи."Низший алкил" обозначает от 1 до 4 атомов углерода в цепи, которая может быть прямой или разветвленной. Типичные алкильные группы включают метил, этил, п-пропил, изопропил, н-бутил, трет-бутил и н-пентил."Арил" обозначает ароматический карбоциклический радикал, содержащий от около 6 до около 10 атомов углерода. Типичный арил включает фенил или нафтил, или фенил или нафтил, замещенные одним или несколькими заместителями для арильных групп, причем заместители могут быть одинаковыми или различными, где "заместитель для арильной группы" включает алкил, предпочтительно низший алкил, галоген, например хлор, бром или фтор,СF3, амино, нитро, циано, алкокси, предпочтительно низший алкокси, и гидрокси, где алкокси и алкил являются такими, как здесь определены."Арил низший алкокси" обозначает арилнизший алкил-О-, в котором арил и низший алкил являются такими, как указаны ранее."Арил низший алкилтио" обозначает арилнизший алкил-S-, в котором арил и низший алкил являются такими, как указаны ранее."Гетероарил" обозначает от около 5- до около 10-членную) ароматическую монокольцевую или мультикольцевую углеводородную кольцевую систему, в которой один или несколько атомов углерода в кольцевой системе является(являются) элементом (и) иным(и), чем углерод, например азот, кислород или сера."Гетероарил" также может быть замещен одним или несколькими заместителями для арильной группы. Типичные гетероарильные группы включают пиридазинил, пиразолил, 1,3 бензодиоксолил, 1,3-бензоксазолил, фуранил,тиенил, пиридил, пиримидинил, изоксазолил,тиазолил, изотиазолил, хинолинил, индолил, 5 изохинолинил, оксазолил и 1,2,4-оксадиазолил. Предпочтительные гетероарильные группы включают (2-, 3- или 4-) пиридил, 4 изотиазолил, 1,3-бензодиоксол-3-ил, пиридазин 4-ил и 3-тиенил."Гетероарил низший алкокси" обозначает гетероарил-низший алкил-О-, в котором гетероарил и низший алкил являются такими, как указаны выше."Гетероарил низший алкилтио" обозначает гетероарил-низший алкил-S-, в котором гетероарил и низший алкил являются такими, как предварительно описаны."Фармацевтически приемлемая соль" обозначает солевую форму соединения формулы(I), которая является относительно безвредной для пациента при использовании в терапевтических дозах, так что полезные фармацевтические свойства исходного соединения формулы (I) не ослабляются побочными эффектами, приписываемыми противоиону этой солевой формы. Фармацевтически приемлемая соль также включает цвиттерион или внутреннюю соль соединения формулы (I)."Пролекарство" обозначает соединение,например сложный эфир, который может быть преобразован in vivo (например с помощью гидролиза) в соединение формулы (I). Соединения формулы (I) и их N-оксиды и пролекарства могут использоваться в виде свободного основания или кислоты или в виде их фармацевтически приемлемой соли. Все формы входят в объем настоящего изобретения, и отсылка здесь к соединению по настоящему изобретению включают соединение формулы (I),или N-оксид, или их пролекарства вместе с фармацевтически приемлемой солью такого соединения. Когда соединение по настоящему изобретению замещено основным радикалом, образуют соли добавления кислот, и они являются просто более удобной формой при использовании; и на практике применение солевой формы изначально равнозначно применению формы свободного основания. Кислоты, которые могут быть использованы для получения солей добавления кислот, предпочтительно включают такие кислоты, которые при соединении со свободным основанием дают фармацевтически приемлемые соли, то есть соли, анионы которых являются нетоксичными для пациента в фармацевтических дозах солей, так что полезные ингибиторные эффекты на эндотелин, присущие изначально свободному основанию, не ослабляются побочными эффектами, приписываемыми анионам. Хотя фармацевтически приемлемые соли указанных основных соединений являются предпочтительными, все соли добавления кислот могут использоваться в качестве источников формы свободного основания, даже 6 если конкретная соль сама по себе является желательной только в качестве промежуточного продукта, как, например, тогда, когда соль получают для целей очистки и идентификации,или когда она используется в качестве промежуточного продукта при получении фармацевтически приемлемой соли путем ионообменных методов. Фармацевтически приемлемые соли в рамках настоящего изобретения включают соли,производные следующих кислот: неорганические кислоты, такие как хлористоводородная кислота, серная кислота, фосфорная кислота и сульфаминовая кислота; и органические кислоты, такие как уксусная кислота, лимонная кислота, молочная кислота, винная кислота, малоновая кислота, метансульфоновая кислота, этансульфоновая кислота, бензолсульфоновая кислота, п-толуолсульфоновая кислота, циклогексилсульфаминовая кислота, хинная кислота и тому подобное. Соответствующие соли добавления кислот включают следующие: гидрогалогениды, такие как гидрохлорид и гидробромид,сульфат, фосфат, нитрат, сульфамат, ацетат,цитрат, лактат, тартрат, малонат, оксалат, салицилат, пропионат, сукцинат, фумарат, малеат,метилен-бисгидроксинафтоаты,гентизаты,мезилаты, изотионаты и ди-п-толуолтартраты,метансульфонат, этансульфонат, бензолсульфонат, п-толуолсульфонат, циклогексилсульфамат и хиноат, соответственно. Когда соединение по настоящему изобретению замещено кислотным радикалом, могут быть образованы соли добавления оснований, и они являются просто более удобной формой при использовании; и на практике применение солевой формы изначально равнозначно применению формы свободной кислоты. Основания,которые могут быть использованы для получения солей добавления оснований, предпочтительно включают такие основания, которые дают при соединении со свободной кислотой фармацевтически приемлемые соли, то есть соли,катионы которых являются нетоксичными для организма животного в фармацевтических дозах солей, так что полезные ингибиторные эффекты на эндотелин, присущие свободной кислоте, не ослабляются побочными эффектами, приписываемыми этим катионам. Фармацевтически приемлемые соли,включая, например, соли щелочных и щелочноземельных металлов, в рамках настоящего изобретения включают соли, производные следующих оснований: гидрид натрия, гидроксид натрия, гидроксид калия, гидроксид кальция,гидроксид алюминия, гидроксид лития, гидроксид магния, гидроксид цинка, аммиака, этилендиамин, N-метилглюкамин, лизин, аргинин,орнитин, холин, N,N'-дибензилэтилендиамин,хлорпрокаин, диэтаноламин, прокаин, Nбензилфенетиламин, диэтиламин, пиперазин, 7 трис(гидроксиметил) аминометан, гидроксид тетраметиламмония и тому подобное. Специалисту в данной области понятно,что некоторые соединения формулы (I) могут проявлять изомерию, например геометрическую изомерию и оптическую изомерию. Геометрические изомеры включают цис- и транс-формы соединений по настоящему изобретению,имеющих алкенильный радикал. Оптические изомеры содержат асимметрические центры. Эти асимметрические центры могут независимо быть либо в R, либо в S-конфигурации. Все изомеры в объеме формулы (I) и их смеси в рамках настоящего изобретения. Такие изомеры могут быть выделены из их смесей путем применения или адаптации известных способов, например хроматографических методик, таких как хроматография на хиральных фазах или разрешение с помощью солей хиральных аминов (например соли метилбензиламина или эфедрина), или они отдельно получаются из соответствующих изомеров их промежуточных соединений, например,путем применения или адаптации описанных здесь способов. Понятно, что в формуле (I), указанной выше, группы R1, R2 и R3 могут быть присоединены по любому доступному положению бензольного кольца. R1 может быть предпочтительно присоединен в орто-положении к группеR3 может быть предпочтительно присоединен в положении 3 кольца. R2 может быть предпочтительно присоединен в положении 5 кольца (то есть в пара-положении по отношению к предпочтительному положению R1). Конкретные и предпочтительные соединения формулы (I) включают соединения, в которых индивидуальные радикалы R1 - R5, X и n,независимо, имеют следующие значения:R2 представляет, предпочтительно, гетероарил низший алкокси, более предпочтительно, гетероарилметокси. Типичные гетероарилметоксигруппы включают пиридилметокси (например 3-пиридилметокси или, главным образом, 4-пиридилметокси), пиридазинилметокси(например пиридазин-4-илметокси), тиенилметокси (например, 3-тиенилметокси), изотиазолилметокси,(например 4-изотиазолилметокси) и 1,3-бензодиоксолилметокси (например 1,3-бензодиоксол-5-илметокси). Когда присутствует R3, галогеновым заместителем предпочтительно может быть фтор.R4 представляет необязательно замещенный арил; более предпочтительно, фенил или,главным образом, фенил, замещенный в ортоположении по отношению к присоединению фенильной группы к оставшейся части молекулы и необязательно замещенный дополнительно. Предпочтительные заместители для фенильной группы включают один или несколько (на 000061 8 пример, 1, 2 или 3) заместителей, выбранных из низшего алкила (например метил), галогена (например хлор или бром), CN, низшего алкоксиR5 может, в частности, представляет карбокси. Х может, в частности, представляет кислород. Необходимо учесть, что настоящее изобретение направлено на перекрывание всех сочетаний конкретных и предпочтительных комбинаций, определенных здесь. Конкретная группа соединений по настоящему изобретению представляет соединения формулы (Iа) где R1, R2, R3, R4, R5, n и X являются такими, как определены ранее, и их N-оксиды и пролекарства и их фармацевтически приемлемые соли. Соединения формулы (Iа), в которых R1 представляет CN, являются особенно предпочтительными. Соединения формулы (Iа), в которых R2 представляет гетероарил низший алкокси, более конкретно, гетероарилметоксигруппу, такую как пиридилметокси (например 3-пиридилметокси или, главным образом, 4-пиридилметокси), пиридазинилметокси (например пиридазин-4 илметокси), тиенилметокси (например 3 тиенилметокси), изотиазолилметокси (например 4-изотиазолилметокси) и 1,3-бензодиоксолилметокси (например 1,3-бензодиоксол-5-илметокси) также являются предпочтительными. Соединения формулы (Iа), в которых-X-CHR4R5 представляет -O-CHR4R5, более конкретно, когда R4 представляет необязательно замещенный арил и R5 представляет карбокси,также являются предпочтительными. В-O-CHR4R5 R4 предпочтительно представляет фенил, замещенный в орто-положении относительно присоединения фенильной группы к оставшейся части радикала R4 с помощью низшего алкила (например метила), СF3 или хлора, и является необязательно дополнительно замещенным одним или несколькими галогенами, низшими алкилами, CN или низшими алкоксигруппами. Предпочтительной группой соединений по настоящему изобретению являются соединения формулы (Ib) 9 где R2, R3, R4 и n являются такими, как указаны ранее, и их N-оксиды и пролекарства, и их фармацевтически приемлемые соли. Особенно предпочтительными являются соединения формулы (Ib), где R2 представляет гетероарилметокси и R4 представляет необязательно замещенный арил (например, фенил,замещенный в орто-положении низшим алкилом, таким как метил, СF3 или хлором, и необязательно далее замещенный одним или несколькими, например 1, 2 или 3 заместителями, выбранными из галогена, низшего алкила, CN и низшего алкокси). Конкретными соединениями по настоящему изобретению являются соединения, где хиральный центр, связанный с атомом углерода в положениипо отношению к остатку Х в группе -X-CHR4R5 или с атомом углерода в положениипо отношению к атому кислорода в группе -O-CHR4CO2H, имеет (S) конфигурацию. В (Iа) и (Ib), когда присутствует R3, он, в частности, представляет атом фтора. Соединения формулы (Ib), где R2 представляет пиридилметокси (например 3-пиридилметокси или, главным образом, 4-пиридилметокси), пиридазинилметокси (например пиридазин-4-илметокси), тиенилметокси (например 3-тиенилметокси), изотиазолилметокси(например 4-изотиазолилметокси) и 1,3-бензодиоксолилметокси (например 1,3-бензодиоксол 5-илметокси), являются особенно предпочтительными. Следует учесть, что терминология, описывающая некоторые из изомеров соединений,заявляемых здесь и получаемых далее, модифицирована по терминологии, используемой в приоритетных заявках на патент Великобритании GB9504061.4 и GB9509604.6 [где индивидуально полученные энантиомеры подразделяют на правовращающие (приставка +) в соответствии с направлением, в котором при определенных условиях они вращают плоскость поляризации света], в соответствии с рентгенографическим определением абсолютной стереохимии, связанной с хиральным центром атома углерода в положениипо отношению к атому кислорода в группе -O-СН(2-метилфенил)СO2 Н,описанной в ссылочном примере как (S)-[5-(1,3 бензодиоксол-5-илметокси)-2-цианофенокси](2-метилфенил)уксусная кислота, соль (-) эфедрина. Конкретные соединения для использования по настоящему изобретению выбраны из следующих соединений:(RS)-N-метокси-[2-циано-5-(3-тиенилметокси)фенокси]-(2-метилфенил)ацетамид; и их сольваты (например, гидраты); и их фармацевтически приемлемые соли. Особенно предпочтительные соединения по настоящему изобретению: 12 кислота; и сольваты (например гидраты); и их фармацевтически приемлемые соли. Особенно предпочтительными соединениями по настоящему изобретению являются:(S)-[5-(1,3-бензодиоксол-5-илметокси)-2 цианофенокси]-(2-метилфенил)уксусная кислота; и сольваты (например гидраты); и их фармацевтически приемлемые соли. Соединения формулы (I) и их N-оксиды, и пролекарства и их фармацевтически приемлемые соли (далее указываемые как "соединения по настоящему изобретению") проявляют фармакологическую активность и, соответственно,могут использоваться в терапии. Более конкретно, они являются ингибиторами эндотелина, в частности ингибиторами эндотелина А. Соединения по настоящему изобретению соответственно вводят в состав фармацевтических композиций и используют при лечении пациентов,страдающих от некоторых медицинских заболеваний. Настоящее изобретение, таким образом,относится к соединениям по настоящему изобретению и композиции, содержащей соединения по настоящему изобретению, для использования при лечении пациента, страдающего от симптомов или подверженного симптомам, которые могут быть ослаблены путем введения ингибитора эндотелина. Например, соединения по настоящему изобретению могут использоваться при лечении заболеваний и состояний,характеризуемых или имеющих этиологию,включающую патогенные уровни эндотелина. Примеры болезненных состояний и симптомов,которые могут быть ослаблены с помощью введения ингибиторов эндотелина, таких как соединения по настоящему изобретению, включают сосудистую ишемию, например заболевание сосудов мозга, включая церебральную ишемию, такую как апоплексический удар и субарахноидальное кровоизлияние, коронарные заболевания, такие как инфаркт миокарда,включая острый инфаркт миокарда, заболевание коронарных сосудов сердца, стенокардию,включая проходящую и вазоспастическую стенокардию, преэклампсию, специфическую и легочную гипертонию и застойные явления в сердце, почечные расстройства, такие как острая почечная недостаточность и хроническая почечная недостаточность, нефротоксичность,вызванная циклоспорином, вызванные эритропоэтином почечные осложнения и гипертонию,желудочно-кишечные расстройства, такие как язвы и синдром раздражения кишечника, болезнь Крона, болезни ослабления периферических скелетных мышц, такие как заболевание периферических сосудов, перемежающаяся хромота и критическая ишемия конечностей,глаукому, атеросклероз и родственные заболевания, гипертонию, астму, легочный фиброз,хроническое заболевание закупорки легких, 13 шок, вызванный эндотоксином и кровоизлиянием, болезнь Рейно, доброкачественное разрастание простаты, метастатический рак простаты,потерю костной ткани, такую как остеопороз,рестеноз после операций на сосудах, диабетические невропатии, а также для лечения гипофункции органов, в частности гипофункции,вызванной хирургическим вмешательством или трансплантации органов, таких как печень. Соединения по настоящему изобретению могут также использоваться при терапии по заживлению ран и в качестве вспомогательных средств при лечении рака. В соответствии с еще одним аспектом настоящего изобретения предложен способ лечения пациента - человека или животного, страдающего от симптомов или подверженного симптомам, которые могут быть ослаблены путем введения ингибитора эндотелина, особенно ЕТА, например симптомам, описанным выше,который включает введение пациенту эффективного количества соединения по настоящему изобретению или композиции, содержащей соединение по настоящему изобретению. Термин"эффективное количество" используется для описания количества соединения по настоящему изобретению, эффективного при ингибировании эндотелина и таким образом производящего желаемое терапевтическое действие. Настоящее изобретение также включает в свой объем фармацевтические препараты, которые содержат, по крайней мере, одно из соединений по настоящему изобретению в сочетании с фармацевтически приемлемым носителем или покрытием. На практике соединения по настоящему изобретению могут обычно вводиться парентерально, ректально или перорально. Соединения по настоящему изобретению также могут наноситься местно при лечении заболеваний периферических сосудов. Композиции по настоящему изобретению могут быть получены в соответствии с обычными способами при использовании одного или нескольких фармацевтически приемлемых вспомогательных веществ или наполнителей. Вспомогательные вещества включают,среди прочих, разбавители, стерильные водные среды и различные нетоксичные органические растворители. Композиции могут быть представлены в виде таблеток, капсул, пилюль, гранул, порошков, водных растворов или суспензий, растворов для инъекций, эликсиров, кремов, мазей или сиропов и могут содержать один или несколько агентов, выбранных из группы,включающей подсластители, ароматизаторы,красители или стабилизаторы, для получения фармацевтически приемлемых препаратов. Выбор разбавителя и содержание активного вещества в разбавителе обычно определяются с учетом растворимости и химических свойств продукта, конкретного способа введения и тре 000061 14 бованиями, соблюдаемыми в фармацевтической практике. Например, для приготовления таблеток могут использовать наполнители, такие как лактоза, цитрат натрия, карбонат кальция, дикальций фосфат, и разрыхляющие агенты, такие как крахмал, альгиновые кислоты и некоторые комплексные силикаты, соединенные со смазывающими веществами, такими как стеарат магния, лаурилсульфат натрия и тальк. Для получения капсул удобным является использование лактозы и полиэтиленгликолей с высокими молекулярными массами. Когда используют суспензии или растворы, они могут содержать эмульсифицирующие агенты или агенты, которые способствуют суспендированию или солюбилизации. Также могут быть использованы разбавители, такие как сахароза, этанол, полиэтиленгликоль, пропиленгликоль, глицерин и хлороформ, или их смеси. Для парентерального введения используют эмульсии, суспензии или растворы продуктов согласно настоящему изобретению в растительном масле, например в кунжутном масле, арахисовом масле или оливковом масле, или в водноорганических растворах, таких как вода и пропиленгликоль, в сложных органических эфирах для инъекций, таких как этилолеат, а также в стерильных водных растворах фармацевтически приемлемых солей. Растворы солей продуктов по настоящему изобретению являются особенно полезными для введения путем внутримышечной или подкожной инъекций. Водные растворы, содержащие растворы солей в чистой дистиллированной воде, также могут быть использованы для внутривенного введения при условии, что их рН установлен соответствующим образом, что они содержат соответствующий буфер, что они приготовлены изотоническими с помощью достаточного количества глюкозы или хлорида натрия и что они стерилизованы путем нагревания, облучения или микрофильтрования. Соответствующие композиции для ингаляции, содержащие соединения по настоящему изобретению, могут быть получены с помощью обычных средств. Например, соединения по настоящему изобретению могут быть растворены или суспендированы в соответствующем носителе для использования в распылителе или в аэрозоле с суспензией или раствором, или они могут быть абсорбированы или адсорбированы на соответствующем твердом носителе для использования в ингаляторе с твердым порошком. Твердые композиции для ректального введения включают суппозитории, приготовленные в соответствии с известными способами и содержащие, по меньшей мере, одно соединение по настоящему изобретению. Композиции для местного нанесения включают кремы и мази, приготовленные в соответствии с известными способами с использованием такого носителя для использования на 15 ружно, как Plastibase (минеральное масло, желатинированное полиэтиленом), и содержащие,по меньшей мере, одно соединение по настоящему изобретению. Процентное содержание активного ингредиента в композициях по настоящему изобретению может изменяться, при этом необходимо,чтобы оно присутствовало в пропорции, такой,чтобы получалась соответствующая дозировка. Разумеется, могут вводиться несколько стандартных лекарственных форм примерно в одно и тоже время. Используемая доза будет устанавливаться врачом и зависит от желаемого терапевтического действия, способа введения и длительности лечения и от состояния пациента. Для взрослых доза обычно составляет от около 0,01 до около 100 мг/кг, предпочтительно от около 0,02 до около 50 мг/кг, а более предпочтительно от около 0,1 до около 25 мг/кг массы тела (или от около 1 до около 5000 мг, предпочтительно от около 5 до около 2000 мг) в каждой из от 2 до 4 разделенных доз ежедневно. В каждом конкретном случае дозы будут определяться в соответствии с факторами, характерными для субъекта лечения, такими как возраст, вес,общее состояние здоровья и другими характеристиками, которые могут влиять на эффективность лекарственного продукта. Соединения по настоящему изобретению могут вводиться так часто, как это необходимо,с целью достижения желаемого терапевтического действия. Некоторые пациенты могут сразу реагировать на более высокие или более низкие дозы, но при постоянном введении могут быть адекватными намного более слабые дозировки. Для других пациентов может быть необходимым долговременное лечение с введением от 1 до 4 доз ежедневно в соответствии с физиологическими требованиями каждого конкретного пациента. Как правило, активный продукт может вводиться перорально от 1 до 4 раз в день. Можно не говорить о том, что для других пациентов может оказаться необходимым назначать не более одной или двух доз ежедневно. Соединения по настоящему изобретению также могут вводиться в сочетании с ингибиторами ферментов, преобразующих эндотелин,антагонистами рецепторов ангиотензина II, ингибиторами ренина, ингибиторами фермента,преобразующего ангиотензин, агонистами и антагонистами - и -адреноцепторов, диуретиками, активаторами калиевых каналов, антагонистами кальциевых каналов, нитратами, противоаритмическими агентами, с положительными инотропическими агентами, с агонистами и антагонистами рецепторов серотонина, с антагонистами фактора активации тромбоцитов, с антагонистами рецепторов гистамина, ингибиторами протонного насоса, с антитромботическими и тромболитическими агентами, с агентами, понижающими уровень липидов, с антибиотическими агентами и с ингибиторами фос 000061 16 фодиэстеразы. При приготовлении в виде стандартной лечебной дозы в таких объединенных продуктах используют соединения по настоящему изобретению в диапазоне дозировок, описанном ниже, а все другие фармацевтически активные агенты в опробованном диапазоне их дозировок. Соединения по настоящему изобретению также могут быть приготовлены с противогрибковыми и иммуносуппрессивными агентами, такими как амфотерицин В, циклоспосрины и им подобными, или использоваться в сочетании с ними для противодействия гипертонии и нефротоксичности побочных для таких соединений. Соединения по настоящему изобретению также могут быть использованы в сочетании с гемодиализом. Соединения в объеме настоящего изобретения проявляют выраженную фармакологическую активность, согласно с испытаниями, описанными в литературе и изложенными подробно здесь в разделе примеров, эти результаты испытаний, как полагают авторы, коррелируют с фармакологической активностью на людях и других млекопитающих. Таким образом, в соответствии с еще одним воплощением, заявителями предложено соединение по настоящему изобретению для применения при лечении пациента - человека или животного, страдающего от или подверженного симптомам, которые могут быть ослаблены путем введения ингибитора эндотелина,особенно ЕТА. В другом воплощении авторы предлагают использование соединения по настоящему изобретению при получении лекарственного средства для лечения пациента - человека или животного, страдающего от симптомов или подверженного симптомам, которые могут быть ослаблены путем введения ингибитора эндотелина, особенно ЕТА. Соединения формулы (I) могут быть получены путем использования или модификации известных способов, которые означают способы, использованные здесь или описанные в литературе. В последующих способах R1 - R5, Х иn являются такими, как определены для формулы (I), если не указано иного. Таким образом, в соответствии с первым способом (А) соединение формулы (I) может быть получено путем взаимодействия соединения формулы (II)Y-CHR4R5 (Ш) где Y является уходящей группой, такой как атом галогена или арил- или алкилсульфонилоксигруппаna толуолсульфонилокси), и R5 является защищенным производным R5, включая аммонийные соли карбоновых кислот, с последующим удалением защитной группы. Соединения формулы (Ib) могут, таким образом, быть получены путем взаимодействия соединения формулы (IIа) в которой катионом является производное классического хирального основания (например эфедрина). Конкретные соединения формулы(Ib), в которых хиральный центр, связанный с группой O-CHR4CO2H имеет (S)-конфигурацию,получают путем взаимодействия соединения формулы (IIа) с соединением формулы (IIIa), в котором катион N+H2R6R7 является производным (-)-эфедрина. Реакция замещения протекает в присутствии подходящего основания, такого как карбонат щелочного металла (например карбонат калия, карбонат цезия), алкоксид щелочного металла (например трет-бутоксид калия), фосфат щелочного металла (например фосфат калия),который является особенно подходящим основанием для взаимодействия (IIа) с (IIIa), или гидрид щелочного металла (например гидрид натрия), с последующим, где необходимо, удалением любых имеющихся защитных групп. Взаимодействие предпочтительно проходит в инертном растворителе, таком как простой эфир(например тетрагидрофуран), необязательно смешанный с кетоном (например третичный бутилметилкетон), кетон (например ацетон или метилэтилкетон) или диполярный апротонный растворитель (например диметилформамид). Взаимодействие удобно проводить при температурах от около 10 С до температуры кипения.a Когда R5 является алкоксикарбонильной группой, такой как метоксикарбонильная, преобразование в карбоксильную группу может быть произведено путем гидролиза, используя основание, такое как гидроксид щелочного металла или карбонат (например гидроксид натрия, гидроксид лития, гидроксид калия или карбонат калия) в присутствии органического растворителя, такого как простой эфир (например диоксан или тетрагидрофуран), преимущественно, смешанное с водой. Взаимодействие 18 может быть преимущественно осуществлено при температурах в пределах от около температуры окружающей среды до температуры кипения. Альтернативно, может быть использован кислотный гидролиз, например, используя неорганическую кислоту, такую как хлористоводородную кислоту в органическом растворителе,таком как простой эфир (например диоксан или тетрагидрофуран), преимущественно смешанный с водой. Взаимодействие может быть преимущественно осуществлено при температурах в пределах от около температуры окружающейa среды до около 80 С. Когда R5 представляет трет-бутоксикарбонильную группу, гидролиз может быть преимущественно осуществлен с использованием трифторуксусной кислоты при температуре около температуры окружающей среды. Следуя другому способу (В), соединение формулы (I), в котором R1 представляет CN,который присоединен к кольцу в положении 2,может быть получено путем взаимодействия соединения формулы (IV) или соответствующим тиолом. Соединение формулы (V) первоначально обрабатывают соответствующим основанием, таким как гидрид натрия, с образованием соли щелочного металла, которая взаимодействует с (IV), предпочтительно, в инертном растворителе, таком как диметилсульфоксид, и, преимущественно, при температуре в пределах от около комнатной температуры и до около 100 С. Тиольное производное может быть преимущественно обработано подходящим основанием, таким как алкоксид щелочного металла (например метоксид натрия или трет-бутоксид калия), и подвергнуто взаимодействию с (IV) в присутствии подходящего растворителя (например спирта, такого как метанол, или простого эфира, такого как тетрагидрофуран) при температуре от около температуры окружающей среды до температуры кипения. Другой способ (С) получения соединения формулы (I), в котором Х представляет кислород и R2 представляет арил низший алкокси или гетероарил низший алкокси, включает обработку соединения формулы (VI) где R5 является таким, как определено ранее, с арилалкилом или гетероарилалкилгалогенидом в присутствии соответствующего основания,такого как карбонат щелочного металла (например карбонат калия) или гидрид щелочного металла (например гидрид натрия), с последующим, если это необходимо, удалением любых из присутствующих защитных групп. Реакция замещения предпочтительно протекает в инертном растворителе, таком как кетон (например ацетон или метилэтилкетон) или диполярный апротонный растворитель, такой как диметилформамид, преимущественно, при температуре от комнатной температуры до температуры кипения. Альтернативно, соединение формулы(VI) может быть обработано арилалкильным или гетероарилалкильным спиртом в присутствии триарилфосфина, такого как трифенилфосфин, и диалкилового сложного эфира, такого как диизопропил или диэтиловый эфир азодикарбоновой кислоты, с последующим, если это необходимо, удалением любой из имеющихся защитных групп. Взаимодействие предпочтительно имеет место в инертном растворителе,таком как тетрагидрофуран, предпочтительно,при температуре от около 0 С до около комнатной температуры. Соединения общей формулы (I), в которыхR5 представляет изостер карбоновой кислоты,могут быть получены методами, описанными здесь, или преимущественно из соответствующей кислоты. Например, соединения формулы(I), в которых R5 представляет алкилсульфонилкарбамоил, арилсульфонилкарбамоил или гетероарилсульфонилкарбамоил, Х представляет кислород и R2 представляет арил низший алкокси или гетероарил низший алкокси, получают путем обработки соединения формулы (I), гдеR5 представляет карбокси, активирующим агентом, таким как N,N-карбонилдиимидазол, в инертном растворителе, таком как дихлорметан,с последующим взаимодействием с натриевой солью алкилсульфонамида, арилсульфонамида или гетероарилсульфонамида и удалением любых имеющихся защитных групп. Взаимодействие предпочтительно проходит в диполярном апротонном растворителе, таком как диметилформамид, при температуре около комнатной температуры."Пролекарства" соединений общей формулы (I), в которых R5 представляет карбоновую кислоту, такие как алкиловые эфиры карбоновых кислот, включая ацилоксиалкиловые эфиры, преимущественно могут быть получены из соответствующей кислоты, например, путем взаимодействия с подходящим алкилгалогени 000061 20 дом, включая ацилоксиалкилгалогениды, в присутствии подходящего основания, такого как карбонат щелочного металла (например карбонат калия) или гидрид щелочного металла (например гидрид натрия). Взаимодействие предпочтительно протекает в диполярном апротонном растворителе, таком как диметилформамид,при температуре около комнатной температуры. Промежуточные соединения формулы (II),где R2 представляет арил низший алкокси или гетероарил низший алкокси и Х представляет атом кислорода, могут быть получены преимущественно путем обработки соединений формулы (VII) где R1a представляет СНО, с целью введения групп R2 и R1, преимущественно, в этой последовательности. Группа R2 может быть преимущественно введена путем взаимодействия с арилом или гетероарилгалогенидом или с арилом или гетероарилметанолом согласно способу (С). Когда R1 представляет CN, эта группа может быть введена с помощью обычных средств,например, путем обработки соответствующего альдегида гидроксиламином или его солью (например гидрохлоридной солью) с получением оксима, который может быть затем дегидратирован, например, с использованием уксусного ангидрида. Альтернативно, альдегид может взаимодействовать с нитроалканом в уксусной кислоте, предпочтительно в присутствии ацетата натрия или гидрофосфата аммония, согласно способу, описанному в JACS 1961, 83, 2203. Альтернативно, альдегид может взаимодействовать с гидроксиламин-О-сульфоновой кислотой,предпочтительно, в спиртовом растворителе(например водном этаноле) и преимущественно при температуре около комнатной температуры,с последующей обработкой гидроксидом щелочного металла, такого как гидроксид натрия. Когда R1 представляет CH2CN, эта группа может быть введена путем восстановления альдегида до CH2OH с последующим стандартным преобразованием гидроксигруппы в соответствующую уходящую группу, такую как галоген,алкилсульфонилокси или арилсульфонилокси,которую затем преобразуют в CH2CN путем стандартной реакции замещения, используя неорганический нитрил. Когда R1 представляет CH=CHCN или СН=СНСО 2 Н, эти группы могут быть введены путем стандартных реакций Виттига или Хорнер-Эммонса с соответствующим альдегидом, с последующим удалением любых защитных групп, если это необходимо. 21 Следует учесть, что указанные выше преобразования также могут быть применены к соединению, у которого одна или обе гидроксильные группы формулы (VII) является/являются замещенными SH, с получением соединения, в котором Х является серой и/илиR2 представляет арил низший алкилтио или гетероарил низший алкилтио. Соединения формулы (III), где Y является атомом брома, могут быть преимущественно получены путем взаимодействия соответствующего соединения, в котором Y является водородом, с N-бромсукцинимидом и азобисизобутиронитрилом в инертном растворителе, таком как хлороформ, при температуре около температуры кипения. Соединения формулы (III), где Y является атомом брома, могут быть также получены путем взаимодействия соответствующего соединения, в котором Y является гидроксилом, с четырехбромистым углеродом и трифенилфосфином в инертном растворителе, таком как дихлорметан, при температуре около температуры окружающей среды. Соединения формулы (III), где Y является атомом брома или хлором, могут быть также получены путем взаимодействия соответствующего соединения, в котором Y является гидроксилом, с тионилбромидом или тионилхлоридом в инертном растворителе, таком как толуол, при температуре около температуры окружающей среды. Соединения формулы (III), где Y является алкилсульфонилокси, таким как метансульфонилокси или арилсульфонилокси, таким как птолуолсульфонилокси, могут быть преимущественно получены путем взаимодействия соответствующего соединения, в котором Y является гидроксилом, с алкил- или арилсульфонилгалогенидом,таким как метанили птолуолсульфонилхлорид, в присутствии основания, такого как пиридин. Взаимодействие может быть проведено в инертном растворителе, таком как галогенированный углеводород (например дихлорметан) при температуре от около температуры окружающей среды до температуры кипения. Соединения формулы (IIIa), где Y является атомом брома и катион N+H2R6R7 является производным классического хирального основания(например (-)-эфедрина), могут быть получены путем взаимодействия соединений формулы(III), где Y является атомом брома и R5 представляет карбокси, с соответствующим хиральным основанием (например (-)-эфедрином), в присутствии агента, усиливающего рацемизацию (например тетра-н-бутиламмонийбромида). Взаимодействие осуществляют в инертном растворителе, таком как этилацетат, при температуре около температуры окружающей среды. Соединения формулы (IV), в которых R2 представляет арил низший алкокси или гетероа 000061 22 рил низший алкокси, могут быть преимущественно получены из соответствующих соединений, в которых R2 представляет гидроксил, по способу, описанному выше в способе (С). Предшественники фенола представляют собой либо известные соединения, описанные, например, S.M. Kelly, Helv. Chim. Acta 1984, vol. 67, p. 1572-1579, либо могут быть получены способом, подобным тому, что здесь описан. Также могут быть использованы соответствующие тиолы для получения соединений формулы (IV),в которых R2 представляет арил низший алкилтио или гетероарил низший алкилтио. Соединения формулы (IV) могут быть преимущественно получены из соединенийa формулы (VII), в которых R1 представляет СНО, путем обработки указанного соединения формулы (VII) сначала аллилгалогенидом (например аллилбромидом) в присутствии соответствующего основания, такого как карбонат (например карбонат калия), с получением соединения формулы (VIII) Взаимодействие облегчается путем добавления йодида калия и бромида тетрабутиламмония. Предпочтительно, взаимодействие проходит в инертном растворителе, таком как кетон(например ацетон или метилэтилкетон), при температурах от около комнатной температуры до температуры кипения. Альтернативно, взаимодействие может быть осуществлено в присутствии гидрида щелочного металла, такого как гидрид натрия, в диполярном апротонном растворителе, таком как диметилформамид, при температуре от около комнатной температуры до около 100 С. Группа СНО в соединении формулы (VIII) далее может быть преобразована в желаемую R1 группу, используя способы, описанные выше. Указанное соединение затем может быть преобразовано в соединение формулы (IX) путем обработки соединением формулы (III) по процедуре способа (А). В заключение соединение формулы (IX) может быть преобразовано в соединение формулы (IV) путем взаимодействия 1,4-диазабицикло [2,2,2] октана и хлорида трис(трифенилфосфин)-родия(I),предпочтительно в спиртовом растворителе (например водном этаноле) и преимущественно при температуре от около комнатной температуры до температуры кипения. 23 Промежуточные соединения формулы (V),их тиоловые производные и соединения формулы (III), в которых Y является водородом или гидроксилом, представляют собой либо хорошо известные соединения, описанные, например, вVol. I, p. 336, Ark. Kemi, 24B(15), 1947, EP-A0617001 and Tetrahedron Letters, 36, 1759, (1995),либо могут быть получены способами аналогичными тем, которые там описаны. Промежуточные соединения формулы (V) могут быть также получены из соответствующих кето-эфиров путем восстановления боргидридом натрия в инертном растворителе, таком как тетрагидрофуран, при температуре около 0 С с последующим гидролизом, используя основание, такое как гидроксид щелочного металла (например гидроксид натрия), в присутствии органического растворителя, такого как простой эфир (например диоксан), преимущественно смешанного с водой. Взаимодействие может быть произведено при температуре от около температуры окружающей среды до температуры кипения. Соединения формулы (VII) являются известными соединениями, которые легко доступны из коммерческих источников. Соответствующие меркаптаны являются либо известными в данной области, либо могут быть получены из соединений формулы (VII), используя обычные способы. Согласно дальнейшим особенностям изобретения, соли добавления кислот соединений по настоящему изобретению получают путем взаимодействия свободного основания с соответствующей кислотой путем использования или модификации известных способов. Например, соли добавления кислот соединений по настоящему изобретению получают либо растворением свободного основания в водном или водно-спиртовом растворе или в других соответствующих растворителях, содержащих подходящую кислоту, и выделением соли путем выпаривания раствора, либо путем взаимодействия свободного основания и кислоты в органическом растворителе, в этом случае соль отделяют непосредственно или она может быть получена при концентрировании раствора. Исходные соединения по настоящему изобретению могут быть выделены из солей добавления кислот путем использования или модификации известных способов. Например, исходные соединения изобретения могут быть выделены из их солей добавления кислот обработкой щелочью, такой как водный раствор бикарбоната натрия или водный раствор аммиака. Металлические соли соединения по настоящему изобретению могут быть получены путем взаимодействия гидрида, гидроксида,карбоната или подобного реакционноспособного соединения выбранного металла в водном или органическом растворителе с со 000061 24 единением в виде свободной кислоты. Используемым водным растворителем может быть вода или смесь воды с органическим растворителем,предпочтительно спиртом, таким как метанол или этанол, кетоном, таким как ацетон, алифатическим сложным эфиром, таким как тетрагидрофуран, или сложным эфиром, таким как этилацетат. Такие реакции обычно проводят при температуре окружающей среды, но, если желательно, они могут быть проведены при нагревании. Соли аминов соединения по настоящему изобретению могут быть получены путем взаимодействия амина в водном или органическом растворителе с соединением в виде свободной кислоты. Соответствующие водные растворители включают воду или смеси воды и спирта,такого как метанол или этанол, простого эфира,такого как тетрагидрофуран, нитрилов, таких как ацетонитрил, или кетонов, таких как ацетон. Соли аминокислот могут быть получены подобным образом. Исходные соединения по настоящему изобретению могут быть восстановлены из соли добавления основания путем использования или модификации известных способов. Например,исходные соединения по изобретению могут быть восстановлены из их солей добавления основания обработкой кислотой, такой как хлористоводородная кислота. Ясно специалисту в данной области, некоторые из соединений по настоящему изобретению не образуют стабильных солей добавления кислот. Однако соли добавления кислот, наиболее вероятно, могут быть образованы с помощью соединений по настоящему изобретению,имеющих азотсодержащую гетероарильную группу. Настолько, насколько они сами по себе могут использоваться в качестве активных соединений, соли соединений по настоящему изобретению могут использоваться для очистки соединений, например, путем использования различий в растворимости между солями и исходными соединениями, побочными продуктами и/или исходными продуктами, с помощью методик, хорошо известных специалистам в данной области. Понятно, что может быть необходимо защитить любую из подвижных групп, таких как гидроксильные группы, при проведении некоторых из реакций, описанных выше. Могут быть использованы обычные способы защиты и последующего снятия защиты. Так, например,гидроксильная группа может быть преимущественно защищена в виде ацилоксигруппы (например ацетокси) ; гидроксильная группа может быть восстановлена путем гидролиза с основным катализом. Могут быть также использованы другие обычные гидроксилзащитные группы, как например, описано в Protective Groups inWileySons Inc. 1991). Последующие примеры иллюстрируют получение соединений по настоящему изобретению, а ссылочные примеры иллюстрируют получение промежуточных соединений. Понятно,что примеры являются чисто иллюстративными и не предназначены для ограничения изобретения каким-либо образом. В спектрах ядерного магнитного резонанса(ЯМР) химические сдвиги выражены в миллионных долях по отношению к тетраметилсилану. Сокращения имеют следующие значения: с=синглет, д=дублет, т=триплет, кв=квадруплет,м=мультиплет, дд=дублет дублетов. Определение с помощью ВЭЖХ для установления энантиомерной чистоты индивидуальных изомеров в виде свободных кислот проводят с использованием колонки Chiralpak AD(Diacel) и подвижную фазу из гептана/изопропанола/трифторуксусной кислоты (400/100/1, по объему) с УФ детектированием на длине волны 254 нм. Пример 1. (RS)-(2-хлорфенил)-[2-циано-5(4-пиридилметокси)фенокси]-уксусная кислота. Раствор из ссылочного примера 7 (0,35 г) в диоксане (25 мл) обрабатывают 1 н. гидроксидом натрия (5 мл) и перемешивают при температуре окружающей среды в течение 6 ч. Добавляют воду (50 мл) и раствор подкисляют до рН 2 2 н. соляной кислотой. Смесь экстрагируют три раза этилацетатом (25 мл) и объединенные экстракты промывают солевым раствором (25 мл), сушат над сульфатом магния и упаривают. Остаток растворяют в 1 н. гидроксиде натрия (10 мл) и раствор подкисляют до рН 2 путем добавления концентрированной соляной кислоты. Полученный твердый продукт фильтруют и промывают водой с получением бледно-желтого твердого продукта, который перекристаллизовывают из изопропанола с получением указанного в заголовке соединения (100 мг), т. пл. 225-226 С[Элементный анализ: - С 63,98; Н 3,80; N 7,07%. Рассчитано: - С 63,88; Н 3,83; N 7,10%]. Пример 2. (RS)-[2-циано-5-(3-тиенилметокси)фенокси]фенил уксусная кислота. Раствор из ссылочного примера 8 (600 мг) в диоксане (17 мл) обрабатывают 1 н. гидроксидом натрия (4,74 мл) и перемешивают при комнатной температуре в течение 1 ч. рН раствора доводят до 7 путем добавления 2 н. соляной кислоты и упаривают с удалением диоксана. Остаток разбавляют водой и устанавливают рН раствора 1. Смесь экстрагируют этилацетатом,промывают водой, сушат и упаривают. Остаток растирают в пентане с получением указанного в заголовке соединения в виде желтого твердого продукта (440 мг).(1 Н, с), 6,6 (1 Н, д), 7,05 (1 Н, д), 7,2-7,4 (5 Н, м),7,45 (1 Н, д), 7,6 (2 Н, д). Пример 3. (RS)-(2-хлорфенил)-[2-циано-5(3-тиенилметокси)фенокси]-уксусная кислота. Раствор из ссылочного примера 11 (1/5 г) в диоксане (20 мл) обрабатывают 1 н. гидроксидом натрия (13 мл) и перемешивают при температуре окружающей среды в течение 1 ч. Добавляют воду (30 мл) и раствор подкисляют до рН 1 путем добавления 2 н. соляной кислоты. Смесь экстрагируют четыре раза этилацетатом (100 мл). Объединенные экстракты промывают четыре раза водой (50 мл), четыре раза солевым раствором (50 мл), сушат над сульфатом магния и упаривают. Добавляют пентан (50 мл) к масляному остатку с последующим выпариванием,получая твердый продукт кремового цвета, который растворяют в эфире (20 мл) и повторно осаждают путем добавления пентана (20 мл) с получением указанного в заголовке соединения(1,5 г) в виде твердого продукта кремового цвета, т. пл. 68-70 С.[Элементный анализ: - С 60,29; Н 4,47; N 3,26%. Рассчитано для C20H14ClNO4S0,5Et2O: - С 60,07; Н 3,52; N 3,50%]. Пример 4. (RS)-[5-(1,3-бензодиоксол-5 илметокси)-2-цианофенокси]-уксусная кислота. Раствор из ссылочного примера 16 (0,75 г) в диоксане (10 мл) обрабатывают 1 н. гидроксидом натрия (5,4 мл) и перемешивают при температуре окружающей среды в течение 1,5 ч. Добавляют воду (10 мл) и раствор подкисляют до рН 2 путем добавления 2 н. соляной кислоты. Смесь экстрагируют три раза этилацетатом (25 мл). Объединенные экстракты промывают солевым раствором (25 мл), сушат над сульфатом магния и упаривают. Оставшееся желтое масло очищают с помощью флэш-хроматографии на силикагеле, элюируя смесью этилацетата и фракцией легких углеводородов нефти (т. кип. 40-60 С) (1:1, объем/объем). Фракции, гомогенные по требуемому продукту, объединяют и упаривают. Этот продукт затем очищают с помощью флэш-хроматографии на силикагеле,элюируя сначала смесью фракции легких углеводородов нефти (т. кип. 40-60 С) и этилацетата(5:5, объем/объем), затем смесью фракции легких углеводородов нефти (т. кип. 40-60 С) и этилацетата (10:3, объем/объем). Фракции, содержащие требуемый продукт, объединяют и упаривают с получением указанного в заголовке соединения (1,5 г) в виде твердого продукта кремового цвета, т. пл. 68-70 С.[Элементный анализ:-С 66,36; Н 4,95; N 2,85%. Рассчитано для C23H17NO60,6H2O:- С, 66,63; Н,4,44; N, 3,38%]. Пример 5. (RS)-[5-(1,3-бензодиоксол-5 илметокси)-2-цианофенокси]-(2-трифторметилфенил)уксусная кислота. Раствор из ссылочного примера 19 (0,35 г) в диоксане (5 мл) обрабатывают 1 н. гидрокси 27 дом натрия (2,16 мл) и перемешивают при температуре окружающей среды в течение 2 ч. Добавляют воду (10 мл) и раствор подкисляют до рН 1 путем добавления 2 н. соляной кислоты. Смесь экстрагируют три раза этилацетатом (20 мл) и объединенные экстракты промывают солевым раствором (20 мл), сушат над сульфатом магния и упаривают. Оставшееся желтое масло очищают с помощью флэш-хроматографии на силикагеле, элюируя смесью дихлорметана и метанола (95:5, объем/объем). Фракции, гомогенные по требуемому продукту, объединяют и упаривают. Остаток растирают в смеси диизопропилового эфира и пентана с получением указанного в заголовке соединения (0,25 г) в виде белого твердого продукта, т. пл. 137-138 С.[Элементный анализ: - С 61,08; Н 3,48; N 3,11%. Рассчитано: - С 61,15; Н 3,42; N 2,97%]. Пример 6. (RS)-[2-циано-5-(3-тиенилметокси)фенокси]-(2-метилфенил) уксусная кислота; Раствор из ссылочного примера 22 (0,55 г) в диоксане (10 мл) обрабатывают 1 н. гидроксидом натрия (4,5 мл) и перемешивают при температуре окружающей среды в течение 2 ч. Добавляют воду (10 мл) и раствор подкисляют до рН 1 2 н. соляной кислотой. Смесь экстрагируют четыре раза этилацетатом (100 мл). Объединенные экстракты промывают два раза водой (10 мл), два раза солевым раствором (10 мл), сушат над сульфатом магния и упаривают. Оставшийся розовый твердый продукт растирают в пентане (30 мл). Твердый продукт растворяют в этилацетате и раствор фильтруют через пад из силикагеля. Выпаривание фильтрата и растирание полученного твердого продукта в эфире (10 мл) дает указанное в заголовке соединение (0,28 г) в виде бесцветного твердого продукта, т. пл. 146148 С.[Элементный анализ: - С 66,80; Н 4,49; N 3,69; S 8,45%. Рассчитано: - С 66,50; Н 4,52; N 3,69; S 8,47%]. Пример 7. (RS)-[5-(1,3-бензодиоксол-5 илметокси)-2-цианофенокси]-(2-хлорфенил) уксусная кислота. Раствор из ссылочного примера 23 (0,35 г) в диоксане (5 мл) обрабатывают 1 н. гидроксидом натрия (2 мл) и перемешивают при температуре окружающей среды в течение 1 ч. Добавляют воду (10 мл) и раствор подкисляют до рН 1 2 н. соляной кислотой. Смесь экстрагируют три раза этилацетатом (20 мл). Объединенные экстракты промывают солевым раствором (20 мл), сушат над сульфатом магния и упаривают. Оставшееся желтое масло очищают с помощью флэш-хроматографии на силикагеле, элюируя смесью этилацетата и метанола (4:1, объем/объем). Фракции, гомогенные по требуемому продукту, объединяют и упаривают. Остаток растирают в смеси диизопропилового эфира и пентана с получением указанного в заголовке 28 соединения (0,25 г) в виде белого твердого продукта, т. пл. 144-145 С.[Элементный анализ: - С 61,08; Н 3,48; N 3,11%. Рассчитано: -С 61,15; Н 3,42; N 2,97%]. Пример 8. (RS)-(2-бромфенил)-[2-циано-5(3-тиенилметокси)фенокси]-уксусная кислота. Раствор из ссылочного примера 28 (0,48 г) в диоксане (5 мл) обрабатывают 1 н. гидроксидом натрия (3,14 мл) и перемешивают при температуре окружающей среды в течение 1,5 ч. Добавляют воду (30 мл) и раствор подкисляют до рН 2 2 н. соляной кислотой. Смесь экстрагируют три раза этилацетатом (50 мл). Объединенные экстракты промывают водой, сушат над сульфатом магния и упаривают. Оставшийся светло-коричневый полутвердый продукт растирают в пентане с получением указанного в заголовке соединения (0,39 г) в виде белого твердого продукта, т. пл. 89-98 С. Пример 9. (RS)-(3-хлорфенил)-[2-циано-5(3-тиенилметокси)фенокси]-уксусная кислота. Раствор из ссылочного примера 31 (1 г) в диоксане (20 мл) обрабатывают 1 н. гидроксидом натрия (9 мл) и перемешивают при температуре окружающей среды в течение 1 ч. Добавляют воду (10 мл), смесь фильтруют и фильтрат подкисляют до рН 1 2 н. соляной кислотой. Смесь экстрагируют четыре раза этилацетатом (50 мл). Объединенные экстракты промывают солевым раствором (50 мл), сушат над сульфатом магния и упаривают. К оставшемуся маслу добавляют эфир (10 мл) и полученный твердый продукт кремового цвета очищают с помощью флэшхроматографии на силикагеле, элюируя этилацетатом. Фракции, гомогенные по требуемому продукту, объединяют и упаривают. Остаток растворяют в эфире (10 мл) и добавляют пентан(10 мл) с получением указанного в заголовке соединения (0,3 г) в виде бесцветного твердого продукта, т. пл. 134-136 С.(S)-(2-хлорфенил)-[2-циано-5-(3-тиенилметокси) фенокси] -уксусная кислота Продукт из примера 3 разделяют на его (R) и (S) энантиомеры с помощью ВЖЭХ с хиральной фазой, используя следующие условия: - колонка Chiracel OD; подвижная фаза изопропанол/трифторуксусная кислота/гептан(10:0,25:90, объем/объем); скорость потока 1 мл/минута; температура окружающей среды; УФ детектирование на длине волны 270 нм. Пример 11.(0,16 г, 60%-ная дисперсия в минеральном мас 29 ле) при комнатной температуре. Через 15 мин добавляют вещество из ссылочного примера 32(0,457 г) и перемешивание продолжают в течение 1,25 ч при температуре окружающей среды,затем при 50 С в течение 30 мин. Добавляют воду (20 мл) и раствор подкисляют до рН 2,5 2 н. соляной кислотой. Добавляют небольшое количество хлорида натрия и смесь экстрагируют три раза этилацетатом (50 мл). Объединенные экстракты промывают солевым раствором, сушат над сульфатом магния и упаривают. Остаток растирают в пентане, твердый продукт промывают эфиром и перекристаллизовывают из этанола с получением указанного в заголовке соединения (0,08 г) в виде светло-желтого твердого продукта, т. пл. 218-220 С.[Элементный анализ: - С 69,77; Н 4,43; N 7,74%. Рассчитано: - С 69,99; Н 4,48; N 7,78%]. Пример 12. (RS)-[2-циано-5-(3-тиенилметокси)фенокси]-(2-фторфенил)-уксусная кислота. Раствор из ссылочного примера 33 (0,66 г) в диоксане (6 мл) обрабатывают 1 н. гидроксидом натрия (4,98 мл) и перемешивают при температуре окружающей среды в течение 1,5 ч. Добавляют воду (50 мл) и раствор подкисляют до рН 2 2 н. соляной кислотой. Смесь экстрагируют три раза этилацетатом (30 мл). Объединенные экстракты промывают два раза водой(10 мл), сушат над сульфатом магния и упаривают. Оставшееся масло зеленого цвета (0,9 г) растирают два раза в пентане (30 мл), получая указанное в заголовке соединение в виде светложелтого твердого продукта, т. пл. 159-161 С.Lipkin and A. V. Ljubimowa Zh. Obschch. Khim 1948, 18, 701 (С.A. 1949, 43, 188)] и продукта из ссылочного примера 32 (9,5 г) в сухом диметилсульфоксиде обрабатывают по частям гидридом натрия (4,0 г 60%-ная маc/маc дисперсия в минеральном масле, 100 ммоль) в течение 1 ч. Реакционную смесь перемешивают затем 3 ч при температуре окружающей среды перед тем, как начинают концентрировать при пониженном давлении. Остаток распределяют между водой(500 мл) и тремя частями дихлорметана (200 мл). Водный слой подкисляют до рН 2-3 концентрированной соляной кислотой и экстрагируют этилацетатом (1000 мл). Органический слой сушат над сульфатом магния и нагревают на паровой бане до тех пор, пока общий объем не уменьшится до 100 мл. При стоянии осаждается белый твердый продукт. Перекристаллизация из изопропанола дает указанное в заголовке 30 соединение (10,0 г) в виде белого твердого продукта, т. пл. 198-201 С.[Элементный анализ: - С 70,42; Н 4,79; N 7,56%. Рассчитано: - С 70,58; Н 4,85; N 7,48%]. Пример 14. (RS)-[2-циано-5-(3-тиенилметокси)фенокси]-(2-трифторметилфенил) уксусная кислота. Раствор из ссылочного примера 34 (0,8 г) в диоксане (40 мл) обрабатывают 1 н. гидроксидом натрия (5 мл) и перемешивают при температуре окружающей среды в течение 1 ч. Добавляют воду (40 мл) и раствор подкисляют до рН 1 2 н. соляной кислотой. Смесь экстрагируют четыре раза этилацетатом (80 мл). Объединенные экстракты промывают водой (10 мл), затем солевым раствором (10 мл), сушат над сульфатом магния и упаривают. Оставшуюся смолу растирают в смеси диэтилового эфира (20 мл) и пентана (5 мл) и полученный твердый продукт (0,38 г) растворяют в этилацетате. Этот раствор фильтруют через пад силикагеля. Выпаривание фильтрата дает указанное в заголовке соединение (0,18 г) в виде бесцветного твердого продукта, т. пл. 38-40 С.(0,46 г) в сухом диметилсульфоксиде (15 мл) обрабатывают гидридом натрия (0,16 г, 60%-ная дисперсия в минеральном масле) при комнатной температуре. Через 1 ч добавляют вещество из ссылочного примера 32 (0,46 г) и перемешивание продолжают в течение 24 ч при температуре окружающей среды. Добавляют воду (50 мл) и рН раствора устанавливают 3-4 2 н. соляной кислотой, смесь экстрагируют два раза этилацетатом (75 мл). Объединенные экстракты сушат над сульфатом магния, упаривают и остаток очищают с помощью флэш-хроматографии на силикагеле, элюируя сначала этилацетатом, затем смесью этилацетата и метанола (4:1, объем/объем). Фракции, гомогенные по требуемому продукту, объединяют и упаривают. Оставшееся желтое масло растворяют в 1 н. гидроксиде натрия (10 мл), раствор фильтруют и фильтрат подкисляют до рН 3. Полученный желтый твердый продукт (0,22 г) тщательно промывают водой и перекристаллизовывают из изопропанола,получая указанное в заголовке соединение (0,1 г) в виде бледно-желтого твердого продукта, т. пл. 171-172 С.(40 мл) при комнатной температуре обрабатывают по частям гидридом натрия (0,4 г, 60%-ная дисперсия в минеральном масле). После перемешивания в течение 0,75 ч при температуре окружающей среды добавляют вещество из ссылочного примера 32 (1,14 г) и перемешивание продолжают в течение 8 ч. Реакционную смесь выдерживают при комнатной температуре в течение 3 дней, затем упаривают. Остаток распределяют между водой и дихлорметаном. Водную фазу подкисляют до рН 3 концентрированной соляной кислотой и экстрагируют три раза этилацетатом. Объединенные экстракты сушат над сульфатом магния, упаривают и остаток растирают в диэтиловом эфире с получением желтого твердого продукта. Перекристаллизация из изопропанола дает указанное в заголовке соединение (0,1 г) в виде белого твердого продукта, т. пл. 200 С (разл.).(3,0 г) растворяют в этаноле (50 мл) и оставляют стоять при температуре окружающей среды в течение 18 ч. Полученный твердый продукт собирают и перекристаллизовывают из этанола с получением белого твердого продукта (3,3 г). Образец этого твердого продукта (0,5 г) перемешивают в воде (50 мл) и обрабатывают 1 н. соляной кислотой до тех пор, пока рН не станет равным 2-3. После перемешивания в течение еще 15 мин, смесь экстрагируют два раза дихлорметаном (50 мл). Объединенные экстракты сушат над сульфатом магния и упаривают. Остаток перекристаллизовывают из этилацетата с получением указанного в заголовке соединения(0,2 г) в виде белого пушистого твердого продукта, т. пл. 215 С (разл.); []D20+125 (с=0,005,диметилсульфоксид).[Элементный анализ: - С 70,34; Н 4,89; N 7,53%. Рассчитано: С 70,58; Н 4,85; N 7,48%]. Пример 18. (RS)-(2-хлорфенил)-[2-циано 5-(пиридазин-4-илметокси)-фенокси] уксусная кислота. Раствор из ссылочного примера 35 (0,2 г) в диоксане (6 мл) обрабатывают 1 н. гидроксидом натрия (1,47 мл) и перемешивают при температуре окружающей среды в течение 1 ч. Реакционную смесь упаривают при 40 С, остаток разбавляют водой (6 мл) и раствор подкисляют до рН 3 2 н. соляной кислотой. Полученный твердый продукт фильтруют, перемешивают с водой 32 сушат в вакууме при 40 С, получая указанное в заголовке соединение (0,048 г) в виде не вполне белого аморфного твердого продукта, т. пл. 203205 С.(RS)-гидрокси-(2-метилфенил)-уксусной кислоты (11 г) и продукта из ссылочного примера 36 (14,4 г) в сухом диметилсульфоксиде (100 мл) при комнатной температуре обрабатывают по частям гидридом натрия (5,94 г, 60%-ная дисперсия в минеральном масле) в течение 1 ч. После перемешивания в течение 18 ч при температуре окружающей среды реакционную смесь упаривают и остаток растворяют в воде (500 мл). Раствор промывают три раза этилацетатом (100 мл) и водную фазу подкисляют до рН 1,5 и экстрагируют три раза этилацетатом (300 мл). Объединенные экстракты сушат над сульфатом магния, упаривают и оставшуюся коричневую смолу очищают с помощью флэш-хроматографии на силикагеле, элюируя смесью этилацетата и пентана (3:2, объем/объем). Три фракции, содержащие требуемый продукт, объединяют и упаривают. Оставшийся светло-желтый твердый продукт растирают в смеси диизопропилового эфира и пентана, получая указанное в заголовке соединение (6,85 г) в виде твердого продукта кремового цвета, т. пл. 125-126 С.[Элементный анализ: - С 68,65; Н 4,59; N 3,36%. Рассчитано: -С 68,65; Н 4,66; N 3,28%]. Две последние фракции, содержащие требуемый продукт, объединяют и упаривают. Оставшийся светло-желтый твердый продукт растирают в смеси диизопропилового эфира и пентана, получая еще 3,8 г указанного в заголовке соединения в виде кремового твердого продукта, т. пл. 124-125 С.[Элементный анализ: - С 68,47; Н 4,80; N 3,27%. Рассчитано для C24H19NO6 0,1H2O:- С 68,71; Н 4,62; N 3,34%]. Пример 20. (RS)-(2-хлорфенил)-[2-циано 5-(изотиазол-4-илметокси)-фенокси] уксусная кислота. Раствор из ссылочного примера 37 (0,43 г) в диоксане (30 мл) обрабатывают 1 н. гидроксидом натрия (3 мл) и перемешивают при температуре окружающей среды в течение 2 ч. Реакционную смесь упаривают, добавляют к остатку воду (10 мл) и раствор промывают эфиром (15 мл), затем подкисляют до рН 1 2 н. соляной кислотой. Смесь экстрагируют два раза этилацетатом (40 мл). Объединенные экстракты промывают два раза водой (15 мл), затем солевым раствором (15 мл), сушат над сульфатом магния и упаривают. Оставшуюся смолу растирают в смеси пентана и эфира (20 мл, 2:1, объем/объем), получая указанное в заголовке со 33 единение (0,34 г) в виде белого твердого продукта, т. пл. 194-197 С. Пример 21. (RS)-[2-циано-5-(3-пиридилметокси)фенокси] фенилуксусная кислота. Раствор из ссылочного примера 38 (0,2 г) в диоксане (10 мл) обрабатывают 1 н. гидроксидом натрия (1,2 мл) и перемешивают при температуре окружающей среды в течение 2 ч. Реакционную смесь подкисляют до рН 5 2 н. соляной кислотой и экстрагируют этилацетатом. Органические экстракты промывают солевым раствором,сушат над сульфатом магния, упаривают и остаток очищают с помощью флэш-хроматографии на силикагеле, элюируя смесью пентана и этилацетата (3:1, объем/объем). Фракции, гомогенные по требуемому продукту, объединяют и упаривают, получая указанное в заголовке соединение (0,39 г) в виде желтого твердого продукта, т. пл. 201-202 С. Пример 22.(RS)-[2-формил-5-(3 тиенилметокси)фенокси] фенилуксусная кислота. Раствор из ссылочного примера 42 (0,50 г) в диоксане (10 мл) обрабатывают 1 н. гидроксидом натрия (3,63 мл) и перемешивают при 25 С в течение 2 ч. Раствор обрабатывают водой (40 мл), подкисляют до рН 2 3 н. соляной кислотой и экстрагируют три раза этилацетатом (75 мл). Объединенные экстракты промывают солевым раствором (70 мл), сушат над сульфатом магния и упаривают. Остаток растирают в эфире с получением указанного в заголовке соединения(0,17 г) в виде твердого продукта кремового цвета, т. пл. 172-174 С.[Элементный анализ: - С 64,2; Н 4,34%. Рассчитано для C20H16O533H2O:- С 64,2; Н 4,49%] Пример 23. (RS)-N-[2-циано-5-(3-тиенилметокси)фенокси]фенилацетил-4-изопропилбензолсульфонамид. Раствор из примера 2 (0,73 г) в сухом дихлорметане (50 мл) обрабатывают N,N'карбонилдиимидазолом (0,36 г) и перемешивают при 25 С в течение 2 ч, пока выделение двуокиси углерода не закончится. Раствор 4 изопропилбензолсульфонамида (0,60 г) в сухом диметилформамиде (20 мл) обрабатывают гидридом натрия (0,13 г, 60%-ная дисперсия в минеральном масле) и перемешивают при 25 С в течение 2 ч. Этот раствор затем обрабатывают по каплям раствором ацилимидазола, полученным выше, и перемешивание продолжают при 25 С в течение 8 ч. Реакционную смесь упаривают, остаток разбавляют водой (50 мл) и экстрагируют два раза этилацетатом. Экстракты промывают водой, сушат и упаривают с получением оранжевого масла, которое очищают с помощью флэш-хроматографии на силикагеле,элюируя эфиром. Фракции, гомогенные по требуемому продукту, объединяют и упаривают. Оставшийся светло-желтый твердый продукт(0,35 г) перекристаллизовывают из смеси этил 000061(RS)-[2-циано-5-(4-пиридилметокси)фенокси](2-метилфенил) уксусной кислоты. Смесь из примера 13 (0,6 г) в диметилформамиде (50 мл) обрабатывают при комнатной температуре в атмосфере аргона гидридом натрия (0,072 г, 60%-ная дисперсия в масле) и перемешивают 30 мин. Добавляют бромметилацетат (0,24 мл) и смесь перемешивают 2 ч. Реакционную смесь упаривают и остаток очищают с помощью флэш-хроматографии на силикагеле,элюируя смесью дихлорметана и метанола (99:1,объем/объем). Фракции, гомогенные по требуемому продукту, объединяют и упаривают. Остаток растирают в пентане, получая указанное в заголовке соединение (0,34 г) в виде белого твердого продукта, т. пл. 127-130 С.[Элементный анализ: - С 67,13; Н 4,83; N 6,24%. Рассчитано: С 67,26; Н 4,97; N 6,27%]. Пример 25. (S)-[2-циано-5-(4-пиридилметокси)фенокси]-(2-метилфенил)-ацетат натрия. Суспензию из примера 17 (19,5 г) в воде(195 мл) обрабатывают 0,1 н гидроксидом натрия (510 мл) и перемешивают при 25 С в течение 15 мин. Смесь фильтруют от следов нерастворимого твердого продукта и фильтрат сушат вымораживанием. Остаток растирают в эфире,сушат при 50 С/0,1 мм рт.ст./2 ч и приводят в равновесие 25 С/760 мм рт.ст./2 дня, получая указанное в заголовке соединение (15,0 г) в виде бесцветного твердого продукта, т. пл. 191-193 С Пример 26. (S)-[5-(1,3-бензодиоксол-5 илметокси)-2-цианофенокси]-(2-метилфенил) ацетат натрия. Способ А: Суспензию из примера 35 (а)(13,5 г) в воде (50 мл) обрабатывают 0,1 н. гидроксидом натрия (320 мл) и перемешивают при 25 С в течение 30 мин. Смесь фильтруют от следов нерастворимого твердого продукта,фильтрат сушат вымораживанием и твердый продукт перекристаллизовывают из бутанола,получая указанное в заголовке соединение (8,15 г) в виде белого твердого продукта, т. пл. 218222 С.[Элементный анализ: - С 65,5; Н 4,15; N 3,38%. Рассчитано:- С 65,6; Н 4,20; N 3,19%]. Способ В: Суспензию из ссылочного примера 72 (а) (8,0 г) в этилацетате (80 мл) перемешивают в течение 10 мин с серной кислотой(1 н.; 21 мл) при около 20 С. Два слоя отделяют; раствор этилацетата промывают два раза водой(20 мл), фильтруют и фильтрат разбавляют метанолом (24 мл). Водный гидроксид натрия (9 н.; около 1,5 мл) добавляют до тех пор, пока рН раствора не достигнет 8,5-9 по рНиндикаторной бумаге. Раствор концентрируют путем отгонки около 85 мл летучего растворителя. Добавляют этилацетат (80 мл) и смесь еще концентрируют до тех пор, пока не начнется кристаллизация (отгоняют около 55 мл). Смесь перемешивают при около 20 С, затем охлаждают на ледяной бане до тех пор, пока не закончится кристаллизация. Продукт фильтруют,промывают трет-бутилметиловым эфиром и сушат путем отсасывания, а затем при около 50 С/300 мбар, с получением указанного в заголовке соединения (4,63 г; чистота 98%). Способ С: Суспензию из ссылочного примера 72(а) (220,0 г) в этилацетате (1100 мл) перемешивают в течение 30 мин с серной кислотой (1 н.; 282 мл) при около 20 С. Через примерно 5 мин весь твердый продукт растворяется. Два слоя отфильтровывают. Органическую фазу отделяют и раствор этилацетата промывают водой (220 мл), а затем водным хлоридом натрия (220 мл). Органический раствор перемешивают с древесным углем (11,0 г), затем фильтруют и концентрируют при пониженном давлении. Остаток обрабатывают толуолом (300 мл) и концентрируют при пониженном давлении, оставляя (S)-[5-(l,3-бензодиоксол-5-илметокси)-2 цианофенокси]-(2-метилфенил)-уксусную кислоту (157,0 г) в виде твердого продукта. Продукт растворяют в этаноле (785 мл) с нагревом. Водный гидроксид натрия (9 н.; около 42 мл) добавляют до тех пор, пока рН раствора не достигает 8,5-9 по рН-индикаторной бумаге, затем добавляют бутанол (1570 мл) и воду (40 мл). Этот раствор объединяют с раствором, полученным подобным образом из (415,3 г) продукта из ссылочного примера 72(а), перемешивают при нагревании до около 80 С и концентрируют путем понижения давления по мере необходимости при примерно этой же температуре до тех пор, пока не начнется кристаллизация. Смеси дают охладиться до около 20 С, затем фильтруют и промывают бутанолом (350 мл), а затем трет-бутилметиловым эфиром (650 мл). Продукт сушат путем отсасывания, а затем при около 70 С/300 мбар с получением указанного в заголовке соединения (395,5 г; чистота 99%). Пример 27. (RS)-(2-хлорфенил)-[2-циано 3-фтор-5-(3-тиенилметокси)-фенокси] уксусная кислота. Раствор из ссылочного примера 43 (0,95 г) в диоксане (30 мл) обрабатывают 1 н. гидроксидом натрия (25 мл) и перемешивают при температуре окружающей среды в течение 4 ч. Реакционную смесь обрабатывают дополнительным количеством 1 н. раствора гидроксида натрия (5 мл) и перемешивание продолжают в течение 30 мин, к этому времени ТСХ (дихлорме 000061 36 тан:метанол, 19:1 объем/объем) показывает завершение реакции. Добавляют воду (100 мл),раствор промывают диэтиловым эфиром (50 мл), затем подкисляют до рН 1 путем добавления 1 н. соляной кислоты. Смесь экстрагируют три раза диэтиловым эфиром (50 мл). Объединенные органические экстракты промывают солевым раствором (50 мл), сушат над сульфатом магния и упаривают. Оставшееся вязкое желтое масло кристаллизуют из смеси этилацетата и циклогексана с получением указанного в заголовке соединения (0,55 г) в виде твердого продукта кремового цвета, т. пл. 152-153 С.(RS)-[5-(бензоксазол-6 илметокси)-2-цианофенокси]-(2-хлорфенил) уксусная кислота. Раствор продукта из ссылочного примера 47 (0,9 г) в диоксане (10 мл) обрабатывают 1 н. гидроксидом натрия (5 мл) и перемешивают при температуре окружающей среды в течение 1,25 ч. Путем добавления 2 н. соляной кислоты устанавливают рН полученного темно-оранжевого раствора 8 и реакционную смесь концентрируют при пониженном давлении при 35 С. Оставшуюся смолу растворяют в воде (10 мл), раствор подкисляют до рН 2,5 путем добавления 2 н. соляной кислоты и экстрагируют этилацетатом. Объединенные экстракты промывают водой, солевым раствором, сушат над сульфатом магния и упаривают. Оставшееся темнокоричневое масло (1,4 г) растирают в пентане(0,75 г), который очищают с помощью флэшхроматографии на силикагеле, элюируя смесью дихлорметана и метанола (14:1, объем/объем). Фракции, гомогенные по требуемому продукту,объединяют и упаривают с получением указанного в заголовке соединения (0,08 г) в виде твердого продукта темно-желтого цвета, т. пл. 172-178 С.(RS)-[2-циано-5-(4 пиридилметокси) фенокси]-[2-(3-метил)-тиенил] уксусная кислота. Смесь продукта из ссылочного примера 49(1,14 г) и 1 н. гидроксида натрия (5,7 мл) в диоксане (50 мл) перемешивают при комнатной температуре в течение ночи. Затем добавляют еще(5 мл) гидроксида натрия и перемешивание продолжают в течение еще 3 ч при комнатной температуре. Прозрачный раствор упаривают досуха и остаток несколько раз подвергают азеотропной отгонке с толуолом. Полученный белый порошок растворяют в водном диметилсульфоксиде (20 мл) в атмосфере азота (0,37 г, 37 60%-ная дисперсия в минеральном масле) и раствор обрабатывают гидридом натрия (0,37 г,60%-ная дисперсия в минеральном масле). Смесь перемешивают при комнатной температуре в течение 30 мин, затем добавляют за один раз продукт из ссылочного примера 32 (1,25 г). После перемешивания в течение 1 ч при комнатной температуре реакционную смесь распределяют между этилацетатом (100 мл) и 5%-ным водным раствором бикарбоната натрия (100 мл). Водную фазу подкисляют до рН 5 путем добавления уксусной кислоты и экстрагируют этилацетатом (100 мл). Этилацетатный экстракт промывают водой (50 мл), сушат над сульфатом магния и упаривают. Остаток перекристаллизовывают из этилацетата, получая указанное в заголовке соединение (0,26 г) в виде белого твердого продукта; т. пл. 153-154 С.(RS)Гидрокси-(2-метилфенил) уксусную кислоту (0,44 г) по частям добавляют к перемешиваемой суспензии гидрида натрия (0,32 г 60%-ная суспензия в минеральном масле) в водном диметилсульфоксиде (10 мл). Добавляют за один раз продукт из ссылочного примера 50(0,62 г) и смесь перемешивают при комнатной температуре в течение 1 ч. Реакционную смесь распределяют между этилацетатом (100 мл) и 5%-ным водным раствором гидрокарбоната натрия (100 мл). Водный слой промывают этилацетатом (20 мл), подкисляют до рН 5 путем добавления уксусной кислоты и экстрагируют этилацетатом. Экстракт промывают водой (10 мл), сушат над сульфатом магния и упаривают. Остаток перекристаллизовывают из смеси этилацетата и циклогексана, получая указанное в заголовке соединение (0,25 г), т. пл. 226-227 С.[Элементный анализ: -С 60,5; Н 4,28; N 6,85; S 7,35%. Рассчитано для C20H16N2O4SH2O: - С 60,3; Н 4,52; N 7,04; S 8,04%]. Пример 31. (RS)-(2-[хлорфенил)-[2-циано 3-фтор-5-(4-пиридилметокси)-фенокси] уксусная кислота. Раствор продукта из ссылочного примера 51 (0,72 г) в диоксане (20 мл) и 1 н. гидроксид натрия (2 мл) перемешивают при комнатной температуре в течение 30 мин. Раствор разбавляют водой (50 мл) и промывают диэтиловым эфиром (40 мл). Водный слой подкисляют до рН 4 путем добавления 1 н. соляной кислоты и экстрагируют три раза диэтиловым эфиром (40 мл). Объединенные органические экстракты промывают насыщенным солевым раствором (50 мл),сушат над сульфатом магния и упаривают. Оставшуюся желтую смолу растирают в смеси 38 диэтилового эфира и этилацетата (1:1, объем/объем), получая указанное в заголовке соединение (0,7 г) в виде кремового твердого продукта, т. пл. 135-139 С.[Элементный анализ: - С 60,93; Н 3,70; N 6,64%. Рассчитано: - С 61,09; Н 3,39; N 6,79%]. Пример 32. (RS)-2-[(2-хлорфенил)-(1 Нтетразол-5-ил)метокси)-4-(4-пиридилметокси) бензонитрил. Раствор продукта из ссылочного примера 58 (0,6 г) в сухом диметилсульфоксиде (20 мл) в атмосфере азота обрабатывают гидридом натрия(0,23 г, 60%-ная дисперсия в минеральном масле). После перемешивания при температуре окружающей среды в течение 5 мин добавляют продукт из ссылочного примера 32 (0,65 г) и перемешивание продолжают в течение 45 мин. Добавляют воду (100 мл), смесь подкисляют до рН 4 путем добавления 1 н. соляной кислоты и экстрагируют три раза смесью этилацетата и метанола (60 мл, 9:1, объем/объем). Воронка с фильтром на этой стадии должна быть промыта метанолом для растворения некоторых нерастворимых продуктов. Объединенные экстракты и промывочный метанол концентрируют и остаток разбавляют водой (100 мл), а рН этого раствора доводят до 4 путем добавления 1 н. соляной кислоты. Полученный твердый продукт фильтруют и сушат, получая указанное в заголовке соединение (0,91 г) в виде не совсем белого твердого продукта, т. пл. 108-110 С.[Элементный анализ: - С 55,58; Н 3,81; N 18,6%. Рассчитано для С 21 Н 15 СlN6O21,5 Н 2 О: - С, 56,0; Н, 4,10; N, 18,6%]. Пример 33. (RS)-[3-хлор-2-циано-5-(4 пиридилметокси) фенокси]-(2-хлорфенил) уксусная кислота. Раствор продукта из ссылочного примера 60 (0,3 г) в диоксане (20 мл) обрабатывают 1 н. гидроксидом натрия (5 мл) и перемешивают при комнатной температуре в течение 1 ч. После отстаивания при комнатной температуре в течение 48 ч раствор разбавляют водой (30 мл) и промывают диэтиловым эфиром (30 мл). Водный слой подкисляют до рН 4 путем добавления 1 н. соляной кислоты и экстрагируют три раза смесью метанола и этилацетата (40 мл, 1:9, объем/объем). Объединенные органические экстракты промывают насыщенным солевым раствором (40 мл), сушат над сульфатом магния и упаривают, получая указанное в заголовке соединение (0,15 г) в виде кремового твердого продукта, т. пл. 165-167 С.(RS)-[5-(Бензоксазол-6 илметокси)-2-цианофенокси]-(2-метилфенил) уксусная кислота. Раствор продукта из ссылочного примера 69 (0,9 г) в диоксане (10 мл) обрабатывают 1 н. гидроксидом натрия (5 мл) и перемешивают при 39 температуре окружающей среды в течение 1,25 ч. рН получившегося темно-оранжевого раствора доводят до 8 путем добавления 2 н. соляной кислоты и реакционную смесь концентрируют при пониженном давлении при 35 С. Оставшуюся смолу растворяют в воде (10 мл), раствор подкисляют до рН 2,5 путем добавления 2 н. соляной кислоты и экстрагируют этилацетатом. Объединенные экстракты промывают водой, солевым раствором, сушат над сульфатом магния и упаривают. Оставшееся темнокоричневое масло (1,4 г) растирают в пентане(0,75 г), который очищают с помощью флэшхроматографии на силикагеле, элюируя смесью дихлорметана и метанола (14:1, объем/объем). Фракции, гомогенные по требуемому продукту,объединяют и упаривают с получением указанного в заголовке соединения в виде твердого продукта темно-желтого цвета, т. пл. 172-178 С.[Элементный анализ: - С 62,70; Н 3,63; N 6,25%. Рассчитано для C23H15ClN2O50,32H2O: - С 62,7; Н 3,58; N 6,36%]. Пример 35. (a) (S)-[5-(1,3-бензодиоксол-5 илметокси)-2-цианофенокси]-(2-метилфенил) уксусная кислота. Перемешиваемую суспензию продукта из ссылочного примера 72 (а) (0,58 г) в этилацетате(50 мл) обрабатывают 2 н. соляной кислотой (20 мл). После перемешивания при температуре окружающей среды в течение 40 мин органический слой отделяют, промывают 2 н. соляной кислотой (20 мл), затем солевым раствором (20 мл), сушат над сульфатом магния и упаривают. Остаток растирают в смеси эфира и пентана,получая указанное в заголовке соединение (0,24 г) в виде стеклообразного твердого продукта, т. пл. 52-56 С. []D20+118 (с=0,005, метанол).(b) по способу из примера 35(а), но используя продукт из из ссылочного примера 72(S)-[5-(1,3 бензодиоксол-5-илметокси)-2-циано-3-фторфенокси]-(2-метилфенил) уксусная кислота. Пример 36. (RS)-[5-(1,3-бензодиоксол-5 илметокси)-2-цианофенокси]-(2-метилфенил) уксусная кислота. Суспензию продукта из ссылочного примера 73 (123 г) в диоксане (1000 мл) обрабатывают 1 н. гидроксидом натрия (600 мл). После перемешивания при комнатной температуре в течение 2 ч реакционную смесь упаривают, остаток разбавляют водой (750 мл) и смесь промывают этилацетатом (200 мл). Водную фазу подкисляют до рН 1 путем добавления концентрированной соляной кислоты и экстрагируют два раза этилацетатом (250 мл). Объединенные экстракты упаривают и остаток растирают в смеси этилацетата и циклогексана, получая ука 000061 40 занное в заголовке соединение (99,6 г) в виде бежевого твердого продукта, т. пл. 124-126 С. Пример 37.(RS)-2-Циано-[5-(4-(3 фторпиридил)метокси) фенокси]-(2-метилфенил) уксусная кислота. Раствор продукта из ссылочного примера 74 (0,15 г) в диоксане (10 мл) обрабатывают 1 н. гидроксидом натрия (0,5 мл) и перемешивают при температуре окружающей среды в течение 3,5 ч. Добавляют дополнительное количество 1 н. гидроксида натрия (0,5 мл) и перемешивание продолжают в течение 1 ч. Реакционную смесь разбавляют водой (50 мл), устанавливают рН 3 путем добавления 2 н. соляной кислоты и смесь экстрагируют три раза этилацетатом (25 мл). Объединенные экстракты промывают солевым раствором (25 мл), сушат над сульфатом магния и упаривают. Остаток растирают в диизопропиловом эфире и полученный светло-желтый твердый продукт промывают пентаном. Перекристаллизация из смеси этилацетата и пентана дает указанное в заголовке соединение (0,75 г) в виде белого кристаллического твердого продукта, т. пл. 178-179 С.[Элементный анализ: - С 67,31; Н 4,44; N 7,12%. Рассчитано: - С 66,34; Н 4,37; N 3,14%]. Пример 38. (RS)-2-[(2-метилфенил)-(1 Нтетразол-5-ил)метокси]-4-(4-пиридилметокси) бензонитрил. Перемешиваемый раствор продукта из ссылочного примера 76 (0,42 г) в сухом диметилсульфоксиде (10 мл) в атмосфере азота при комнатной температуре обрабатывают гидридом натрия (0,19 г, 60%-ная дисперсия в минеральном масле). После перемешивания при температуре окружающей среды в течение 30 мин добавляют продукт из ссылочного примера 32(0,5 г) и перемешивание продолжают в течение 5 ч. Добавляют воду (50 мл), смесь промывают диэтиловым эфиром (50 мл) и рН водной фазы устанавливают 4 с помощью 1 н. соляной кислоты. Полученный твердый продукт промывают два раза водой (10 мл), получая указанное в заголовке соединение (0,34 г) в виде кремового твердого продукта,т. пл. 132-133 С.(дд, 1 Н), 7,0 (д, 1 Н), 7,25 (м, 4 Н), 7,4 (дд, 2 Н),7,5 (дд, 1 Н), 7,7 (д, 1 Н), 8,6 (дд, 2 Н)]. Пример 39. (RS)-4-(1,3-бензодиоксол-5 илметокси)-2-[(2-метилфенил)-(1H-тетразол-5 ил)метокси] бензонитрил. Перемешиваемый раствор продукта из ссылочного примера 76 (0,34 г) в сухом диметилсульфоксиде (10 мл) в атмосфере азота при комнатной температуре обрабатывают гидридом натрия (0,16 г, 60%-ная дисперсия в минеральном масле). После перемешивания при комнатной температуре в течение 30 мин добавляют раствор продукта из ссылочного примера 36 (0,5 г) в сухом диметилсульфоксиде (5 мл) и перемешивание продолжают в течение 18 ч. Добавляют воду (50 мл), смесь промывают ди 41 этиловым эфиром (50 мл) и устанавливают рН водной фазы 2 путем добавления 1 н. соляной кислоты. Смесь экстрагируют четыре раза диэтиловым эфиром (50 мл) и один раз этилацетатом (10 мл). Объединенные органические экстракты промывают три раза водой (50 мл), сушат над сульфатом магния и упаривают. Перекристаллизация из смеси циклогексана и этилацетата дает указанное в заголовке соединение(0,49 г) в виде белого твердого продукта, т. пл. 106-109 С.[Элементный анализ: - С 66,04; Н 4,64; N 15,47%. Рассчитано: - С 65,30; Н 4,34; N 15,86%]. Пример 40. (RS)-[2-циано-3-фтор-5-(4 пиридилметокси)фенокси]-(2-метилфенил) уксусная кислота. Раствор продукта из ссылочного примера 78 (0,64 г) в диоксане (20 мл) и 1 н. гидроксид натрия (5 мл) перемешивают при комнатной температуре в течение 30 мин. Раствор разбавляют водой (50 мл) и промывают диэтиловым эфиром (50 мл). Водную фазу подкисляют до рН 4 путем добавления 1 н. соляной кислоты и экстрагируют два раза диэтиловым эфиром (50 мл). Объединенные органические экстракты промывают насыщенным солевым раствором (50 мл),сушат над сульфатом магния и упаривают. Оставшуюся желтую смолу растирают в диэтиловом эфире, получая указанное в заголовке соединение (0,10 г) в виде кремового твердого продукта, т. пл. 163-165 С. [ЯМР (CD3)2SO: 2,4 (с, 3 Н), 5,3 (с, 2 Н), 6,3 (с, 1 Н), 6,9 (м, 2 Н), 7,3(м, 3 Н), 7,5 (м, 3 Н), 8,6 (дд, 2 Н)]. Пример 41. (RS)-[5- (Бензоксазол-6 илметокси)-2-циано-3-фторфенокси]-(2-метилфенил) уксусная кислота. Раствор продукта из ссылочного примера 81 (0,35 г) в диоксане (20 мл) и 1 н. гидроксид натрия (3 мл) перемешивают при комнатной температуре в течение 1 ч, затем оставляют стоять при температуре окружающей среды на 18 ч. Реакционную смесь упаривают до небольшого объема, разбавляют водой (50 мл) и промывают диэтиловым эфиром (50 мл). Водную фазу подкисляют до рН 6 путем добавления 1 н. соляной кислоты и экстрагируют три раза этилацетатом (50 мл). Объединенные органические экстракты промывают насыщенным солевым раствором (50 мл), сушат над сульфатом магния и упаривают. Оставшийся оранжевый твердый продукт растирают в метаноле, получая указанное в заголовке соединение (0,24 г) в виде оранжевого твердого продукта, т. пл. 193-194 С.[Элементный анализ: - С 65,93; Н 4,0; N 5,9%. Рассчитано для С 24 Н 17N2O5F0,5 СН 3 ОН: - С 66,63; Н 4,24; N 6,25%]. Пример 42. (RS)-[5-(1,3-бензодиоксол-5 илметокси)-2-циано-3-фторфенокси]-(2-метилфенил) уксусная кислота. Раствор продукта из ссылочного примера 82 (1,42 г) в диоксане (20 мл) и 1 н. гидроксид 42 натрия (5 мл) перемешивают при комнатной температуре в течение 5 ч. Реакционную смесь упаривают до небольшого объема, разбавляют водой (50 мл) и промывают диэтиловым эфиром(50 мл). Водную фазу подкисляют до рН 6 путем добавления 1 н. соляной кислоты и экстрагируют один раз диэтиловым эфиром (50 мл) и два раза этилацетатом (50 мл). Объединенные органические экстракты промывают насыщенным солевым раствором (50 мл), сушат над сульфатом магния и упаривают. Оставшееся бесцветное масло растирают в пентане, получая указанное в заголовке соединение (0,65 г) в виде кремового твердого продукта, т. пл. 110-117 С.(RS)-[5-(бензоксазол-5 ил)метокси-2-цианофенокси]-(2-метилфенил) уксусная кислота. Раствор продукта из ссылочного примера 83 (0,12 г) в диоксане (10 мл) обрабатывают 1 н. водным гидроксидом натрия (1 мл) при комнатной температуре. Через 3 ч добавляют воду (20 мл) и смесь экстрагируют этилацетатом (20 мл). Полученный водный слой подкисляют до рН 1 путем добавления концентрированной соляной кислоты и экстрагируют три раза этилацетатом(25 мл). Объединенные экстракты промывают солевым раствором (25 мл), сушат над сульфатом магния и упаривают. Полученный остаток перекристаллизовывают из этилацетата с получением указанного в заголовке соединения (80 мг) в виде белого твердого продукта, т. пл. 189191 С.(RS)-(5-бензилокси-2 цианофенокси)-(2-метилфенил)уксусная кислота. Раствор продукта из ссылочного примера 85 (0,49 г) в диоксане (10 мл) обрабатывают 1 н. водным гидроксидом натрия (3 мл) при комнатной температуре. Через 30 мин добавляют воду(20 мл) и смесь экстрагируют этилацетатом (20 мл). Полученный водный слой подкисляют до рН 1 путем добавления концентрированной соляной кислоты и экстрагируют три раза этилацетатом (25 мл). Объединенные экстракты промывают солевым раствором (25 мл), сушат над сульфатом магния и упаривают. Полученный остаток очищают с помощью флэшхроматографии на силикагеле, элюируя смесью метанола и дихлорметана (1:19, объем/объем). Фракции, гомогенные по требуемому продукту,объединяют и упаривают. Полученный остаток растирают в диэтиловом эфире и пентане с получением указанного в заголовке соединения(80 мг) в виде белого твердого продукта, т. пл. 128-130 С.[Элементный анализ: - С 73,91; Н 5,26; N 3,69%. Рассчитано: - С 73,98; Н 5,13; N 3,75%]. Пример 45. (RS)-[2-циано-5-(фуран-3 илметокси)фенокси]-(2-метилфенил)-уксусная кислота. Раствор продукта из ссылочного примера 86 (1,01 г) в диоксане (20 мл) обрабатывают 1 н. водным гидроксидом натрия (8 мл) при комнатной температуре. Через 1 ч полученный раствор упаривают, остаток разбавляют водой (10 мл) и устанавливают рН 2 путем добавления 2 н. водной соляной кислоты. Полученную смесь экстрагируют два раза этилацетатом (20 мл). Объединенные экстракты промывают водой, сушат над сульфатом магния, упаривают и остаток растворяют в 1 н. водном гидроксиде натрия (30 мл). Раствор два раза промывают эфиром (40 мл), устанавливают рН 1 путем добавления 2 н. водной соляной кислоты и экстрагируют три раза этилацетатом (30 мл). Объединенные экстракты сушат над сульфатом магния и упаривают с получением бесцветного твердого продукта (0,29 г). Перекристаллизация из диизопропилового эфира дает указанное в заголовке соединение (0,18 г) в виде бесцветных кристаллов, т. пл. 141-143 С.[Элементный анализ: - С 69,5; Н 4,81; N 4,12%. Рассчитано :- С 69,4; Н 4,72; N 3,86%]. Пример 46. (RS)-N-метокси-[2-циано-5-(3 тиенилметокси)фенокси]-(2-метилфенил) уксусная кислота. Раствор продукта из примера 6 (0,37 г) в дихлорметане (10 мл) обрабатывают оксалилхлоридом (0,28 г) и нагревают с обратным холодильником в течение 3 ч. После того, как ей дают остыть до комнатной температуры, реакционную смесь концентрируют. Полученный остаток повторно растворяют в дихлорметане (15 мл), обрабатывают триэтиламином (0,15 мл) и метоксиламингидрохлоридом (0,09 г). После перемешивания при комнатной температуре в течение 2 ч реакционную смесь упаривают досуха, разбавляют водой (50 мл) и смесь экстрагируют два раза этилацетатом (50 мл). Объединенные органические экстракты промывают солевым раствором (30 мл), сушат над сульфатом магния и упаривают. Полученный остаток очищают с помощью флэш-хроматографии на силикагеле, элюируя смесью этилацетата и пентана (1:1, объем/объем). Фракции, гомогенные по требуемому продукту, объединяют и упаривают. Полученный остаток растирают в диэтиловом эфире с получением указанного в заголовке соединения (0,1 г) в виде белого твердого продукта, т. пл. 155-156 С. 44 бутиламмония (3,59 г) в метилэтилкетоне (200 мл) нагревают с обратным холодильником в течение 1 ч. Реакционную смесь фильтруют и упаривают. Остаток распределяют между этилацетатом (100 мл) и водой (100 мл). Органическую фазу упаривают и оставшееся масло (20 г) очищают с помощью флэш-хроматографии на силикагеле, элюируя смесью пентана и этилацетата (95:5, объем/объем). Фракции, гомогенные по требуемому продукту, объединяют и упаривают с получением указанного в заголовке соединения (13,8 г) в виде масла. Ссылочный пример 2. Оксим 4-аллилокси 2-гидроксибензальдегида. Смесь продукта из ссылочного примера 1(7,48 г), гидроксиламингидрохлорида (3,32 г) и пиридина (3,12 мл) в этаноле (100 мл) нагревают с обратным холодильником в течение 1 ч. Реакционную смесь упаривают и распределяют между этилацетатом (100 мл) и водой (100 мл). Органическую фазу сушат над сульфатом магния и упаривают до небольшого объема, затем добавляют пентан (80 мл) с получением указанного в заголовке соединения (5,5 г) в виде бесцветного твердого продукта, т. пл. 74-76 С. Ссылочный пример 3. 2-Ацетокси-4-аллилоксибензонитрил. Смесь продукта из ссылочного примера 2(11,75 г), ацетата натрия (0,2 г) и уксусного ангидрида (100 мл) нагревают с обратным холодильником в течение 3 ч, охлаждают, при перемешивании осторожно разбавляют водой (600 мл) и экстрагируют три раза этилацетатом (200 мл). Объединенные экстракты промывают водой (150 мл), затем солевым раствором (150 мл),сушат над сульфатом магния и упаривают. Оставшееся светло-оранжевое масло очищают с помощью флэш-хроматографии на силикагеле,элюируя сначала смесью этилацетата и пентана(1:9, объем/объем), затем смесью этилацетата и пентана (15:85, объем/объем). Фракции, гомогенные по требуемому продукту, объединяют и упаривают с получением указанного в заголовке соединения (13,7 г) в виде светло-желтого масла. Ссылочный пример 4. 2-Аллилокси-2-гидроксибензонитрил. Раствор продукта из ссылочного примера 3(13,7 г) в смеси метанола (15 мл) и тетрагидрофурана (50 мл) обрабатывают при комнатной температуре раствором карбоната калия (8,72 г) в воде (100 мл). Через 2 ч реакционную смесь разбавляют водой (100 мл), подкисляют до рН 1 путем добавления 2 н. соляной кислоты и экстрагируют три раза этилацетатом (200 мл). Объединенные органические экстракты промывают солевым раствором (200 мл), сушат над сульфатом магния и упаривают. Полученный не вполне белый твердый продукт перекристаллизовывают из диизопропилового эфира с получением указанного в заголовке соединения (4,7 г) в виде не 45 вполне белого твердого продукта, т. пл. 134136 С. Ссылочный пример 5. Метил (RS)-(5 аллилокси-2-цианофенокси)-(2-хлорфенил) ацетат. Смесь продукта из ссылочного примера 4(3,31 г), продукта из ссылочного примера 10(3,31 г) и карбоната калия (2,37 г) в диметилформамиде (20 мл) перемешивают при температуре окружающей среды в течение 2 ч. Реакционную смесь разбавляют водой (30 мл), подкисляют до рН 2 путем добавления концентрированной соляной кислоты и экстрагируют три раза этилацетатом (40 мл). Объединенные экстракты промывают солевым раствором (30 мл),сушат над сульфатом магния и упаривают. Остаток очищают с помощью флэшхроматографии на силикагеле, элюируя смесью этилацетата и пентана (1:4, объем/объем). Фракции, гомогенные по требуемому продукту,объединяют и упаривают с получением указанного в заголовке соединения (1,15 г). Ссылочный пример 6. Метил (RS)-(2-хлорфенил)-[2-циано-5-гидроксифенокси] ацетат. Перемешиваемый раствор продукта из ссылочного примера 5 (1,15 г) в смеси воды (5 мл) и этанола (50 мл) обрабатывают 1,4 диазабицикло [2,2,2] октаном (0,75 г) и хлоридом трис(три-фенилфосфин) родия (I) (0,3 г). Реакционную смесь нагревают с обратным холодильником в течение 5 ч, упаривают досуха и остаток распределяют между этилацетатом (50 мл) и 2 н. соляной кислотой (50 мл). Водную фазу экстрагируют этилацетатом (25 мл) и объединенные органические фазы промывают солевым раствором, сушат над сульфатом магния и упаривают. Остаток очищают с помощью флэшхроматографии на силикагеле, элюируя смесью этилацетата и пентана (1:2, объем/объем). Фракции, гомогенные по требуемому продукту,объединяют и упаривают с получением указанного в заголовке соединения (0,62 г) в виде желтого масла. Ссылочный пример 7. Метил (RS)-(2-хлорфенил)-[2-циано-5-(4-пиридилметокси)-фенокси] ацетат. Раствор продукта из ссылочного примера 6(0,63 г) в ацетоне (25 мл) обрабатывают карбонатом калия (0,28 г) и гидрохлоридом 4 пиколилхлорида (0,36 г), а затем перемешивают при температуре кипения в течение 24 ч. Реакционную смесь упаривают и остаток распределяют между этилацетатом (100 мл) и водой (75 мл). Органическую фазу промывают два раза 0,1 н. гидроксидом натрия (20 мл), затем солевым раствором (50 мл), сушат над сульфатом магния и упаривают. Оставшееся масло медленно отвердевает при стоянии. Твердый продукт перемешивают с этилацетатом (30 мл), фильтруют и фильтрат упаривают с получением указанного в заголовке соединения (0,35 г) в виде 46 воскообразного твердого продукта темнофиолетового цвета. Ссылочный пример 8. Метил (RS)-[2 циано-5-(3-тиенилметокси)фенокси] фенилацетат. Раствор продукта из ссылочного примера 25 (1,0 г) в диметилформамиде (14 мл) обрабатывают гидридом натрия (60%-ная дисперсия в минеральном масле) и перемешивают при комнатной температуре в течение 10 мин. Раствор обрабатывают метил(RS)-бромфенилацетатом (1,02 г) и перемешивают при 25 С в течение 1 ч. Раствор разбавляют водой и экстрагируют этилацетатом. Экстракт промывают солевым раствором, сушат и упаривают. Остаток промывают эфиром и перекристаллизовывают из смеси этилацетата и циклогексана с получением указанного в заголовке соединения в виде бесцветного твердого продукта (0,91 г), т. пл. 112-114 С. Ссылочный пример 9. Метил 2-хлорфенилацетат. Раствор 2-хлорфенилуксусной кислоты(10,0 г) в метаноле (100 мл), содержащий 1 каплю концентрированной серной кислоты, нагревают с обратным холодильником в течение 2 ч. Реакционную смесь упаривают до половины объема и распределяют между этилацетатом(100 мл) и водой (100 мл). Органическую фазу сушат над сульфатом магния и упаривают с получением указанного в заголовке соединения(10,0 г) в виде бесцветного масла. Ссылочный пример 10. Метил (RS)-бром-(2-хлорфенил) ацетат. Смесь продукта из ссылочного примера 9(5,0 г), N-бромсукцинимида (5,3 г) и азобисизобутиронитрила (0,38 г) в сухом хлороформе (50 мл) нагревают с обратным холодильником в течение 6 ч. Реакционную смесь промывают три раза водой (30 мл) и органическую фазу сушат над сульфатом магния и упаривают. Оставшееся масло очищают с помощью флэшхроматографии на силикагеле, элюируя смесью этилацетата и пентана (5:95, объем/объем). Фракции, гомогенные по требуемому продукту,объединяют и упаривают с получением указанного в заголовке соединения (4,0 г) в виде масла. Ссылочный пример 11. Метил (RS)-(2 хлорфенил)-[2-циано-5-(3-тиенилметокси)фенокси] ацетат. Раствор продукта из ссылочного примера 25 (2,0 г) в диметилформамиде (80 мл) обрабатывают гидридом натрия (0,22 г, 60%-ная дисперсия в минеральном масле) и перемешивают при температуре окружающей среды в течение 10 мин. Раствор обрабатывают продуктом из ссылочного примера 10 (1,7 г) и перемешивают при 25 С в течение 1 ч. Реакционную смесь распределяют между этилацетатом (100 мл) и водой (100 мл). Органическую фазу промывают 47 два раза солевым раствором (100 мл), сушат над сульфатом магния и упаривают. Оставшееся масло растирают в пентане (50 мл) с получением указанного в заголовке соединения (1,75 г) в виде бесцветного твердого продукта, т. пл. 102104 С.[Элементный анализ: - С 60,97; Н 3,88; N 3,31; S 7,16%. Рассчитано: - С 60,94; Н 3,89; N 3,38; S 7,74%]. Ссылочный пример 12. 4-(1,3-бензодиоксол-5-илметокси)-2-гидроксибензальдегид. Смесь 2,4-гидроксибензальдегида (22,94 г),3,4-метилендиоксибензилхлорида (34 г), карбоната калия (34,43 г), йодида калия (41,33 г) и бромида тетра-н-бутиламмония (6 г) в метилэтилкетоне нагревают с обратным холодильником в течение 3 ч. Реакционную смесь фильтруют и упаривают. Остаток распределяют между этилацетатом (400 мл) и водой (400 мл) и водную фазу экстрагируют два раза этилацетатом (200 мл). Объединенные органические фазы сушат над сульфатом магния и упаривают. Оставшийся твердый продукт бежевого цвета очищают с помощью флэш-хроматографии на силикагеле, элюируя сначала смесью пентана и этилацетата (95:5, объем/объем), затем смесью пентана и этилацетата (9:1, объем/объем) и в конце смесью пентана и этилацетата (85:15,объем/объем). Фракции, гомогенные по требуемому продукту, объединяют и упаривают с получением указанного в заголовке соединения(14,2 г) в виде белого твердого продукта. Ссылочный пример 13. 4-(1,3-бензодиоксол-5-илметокси)-2-гидроксибензальдегид оксим. Смесь продукта из ссылочного примера 12(3,9 г), гидроксиламингидрохлорида (0,99 г) и пиридина (1,25 мл) в этаноле (100 мл) нагревают с обратным холодильником в течение 1,5 ч. Реакционную смесь распределяют между этилацетатом (100 мл) и водой (100 мл) и водную фазу экстрагируют два раза этилацетатом (100 мл). Объединенные органические фазы промывают 1 н. соляной кислотой (100 мл), солевым раствором (100 мл), сушат над сульфатом магния и упаривают с получением указанного в заголовке соединения (2,6 г) в виде белого твердого продукта. Ссылочный пример 14. 2-Ацетокси-4-(1,3 бензодиоксол-5-илметокси) бензонитрил. Смесь продукта из ссылочного примера 13(2,6 г), ацетата натрия (0,03 г) и уксусного ангидрида (15 мл) нагревают с обратным холодильником в течение 3,5 ч, ей позволяют охладиться до комнатной температуры и оставляют стоять на 3 дня. Реакционную смесь при перемешивании осторожно разбавляют водой (250 мл) и фильтруют. Нерастворимый продукт перекристаллизовывают из смеси диизопропилового эфира и этилацетата с получением указанного в заголовке соединения (1,52 г) в виде твердого продукта кремового цвета. 48 Ссылочный пример 15. 4-(1,3-бензодиоксол-5-илметокси)-2-гидроксибензонитрил. Способ А. Раствор продукта из ссылочного примера 14 (1,5 г) в смеси метанола (15 мл) и тетрагидрофурана (7 мл) обрабатывают при комнатной температуре раствором карбоната калия (0,66 г) в воде (10 мл). Раствор медленно приобретает красновато-коричневый цвет и через 1 ч реакционную смесь разбавляют водой(30 мл) и экстрагируют три раза этилацетатом(75 мл). Объединенные органические экстракты промывают солевым раствором (30 мл), сушат над сульфатом магния и упаривают с получением указанного в заголовке соединения (1,34 г) в виде твердого продукта песочного цвета. Способ В. Перемешиваемую суспензию продукта из ссылочного примера 12 (845,0 г) в этаноле (7770 мл) обрабатывают раствором гидроксиламин-О-сульфоновой кислоты (470,7 г) в деминерализованной воде (1110 мл). Реакционную смесь перемешивают при 25-30 С в течение примерно 1 ч, получая прозрачный раствор. Раствор охлаждают до около 5 С, затем добавляют водный гидроксид натрия (1550 мл; 9,1 н) в течение около 3 ч, поддерживая температуру между 5 и 15 С. Затем смесь перемешивают при 5-15 С до тех пор, пока реакция не завершится,что определяется путем тонкослойной хроматографии (около 1-1,5 ч). Поддерживая температуру ниже 30 С, рН смеси устанавливают 1-2 путем добавления концентрированной соляной кислоты. Смесь разбавляют деминерализованной водой (3900 мл) и перемешивают 30 мин при 25-30 С. Продукт собирают, промывают деминерализованной водой (3900 мл) и сушат путем отсасывания, а затем при 45-50 С/от 500 до 750 тор с получением указанного в заголовке соединения (760,0 г). Ссылочный пример 16. Метил (RS)-[5-(1,3 бензодиоксол-5-илметокси)-2-цианофенокси]фенилацетат. Смесь продукта из ссылочного примера 15(10 мл) перемешивают при температуре окружающей среды в течение 2 ч. Добавляют воду(30 мл) и раствор подкисляют до рН 2 путем добавления концентрированной соляной кислоты. Смесь экстрагируют три раза этилацетатом(30 мл) и объединенные экстракты промывают солевым раствором (30 мл), сушат над сульфатом магния и упаривают. При стоянии указанное в заголовке соединение (0,77 г) медленно осаждается в виде белого твердого продукта. Ссылочный пример 17. Метил 2-трифторметилфенилацетат. Раствор 2-трифторметилфенилуксусной кислоты (5,0 г) в метаноле (30 мл), содержащий 5 капель концентрированной серной кислоты,нагревают с обратным холодильником в течение 2 ч. Реакционную смесь концентрируют, разбавляют этилацетатом (100 мл), промывают 1 н. 49 гидроксидом натрия (25 мл), затем солевым раствором (25 мл), сушат над сульфатом магния и упаривают с получением указанного в заголовке соединения (5,04 г) в виде бесцветного масла. Ссылочный пример 18. Метил (RS)-бром-(2-трифторметилфенил) ацетат. Смесь продукта из ссылочного примера 17(40 мл) нагревают с обратным холодильником в течение 18 ч. Реакционную смесь промывают три раза водой (25 мл) и органическую фазу сушат над сульфатом магния и упаривают. Оставшееся желтое масло очищают с помощью флэш-хроматографии на силикагеле, элюируя смесью этилацетата и пентана (1:3, объем/объем). Фракции, гомогенные по требуемому продукту, объединяют и упаривают с получением указанного в заголовке соединения (5,8 г) в виде желтого масла. Ссылочный пример 19. Метил (RS)-[5-(1,3 бензодиоксол-5-илметокси)-2-цианофенокси](2-трифторметилфенил) ацетат. Смесь продукта из ссылочного примера 15(0,5 г), продукта из ссылочного примера 18 (0,58 г) и карбоната калия (0,38 г) в диметилформамиде (5 мл) перемешивают при температуре окружающей среды в течение 1,5 ч. Реакционную смесь разбавляют водой (20 мл), подкисляют до рН 1 путем добавления концентрированной соляной кислоты и экстрагируют три раза этилацетатом (20 мл). Объединенные экстракты промывают солевым раствором (20 мл), сушат над сульфатом магния и упаривают. Оставшийся желтый полутвердый продукт растирают в эфире с получением указанного в заголовке соединения (0,36 г) в виде светло-бежевого твердого продукта. Ссылочный пример 20. Метил (RS)-гидрокси-(2-метилфенил) ацетат. Раствор (RS )гидрокси-(2-метилфенил) уксусной кислоты (3,6 г) в метаноле (80 мл),содержащий 2 капли концентрированной серной кислоты, нагревают с обратным холодильником в течение 2 ч. Реакционную смесь концентрируют и оставшееся масло распределяют между этилацетатом и водой. Органическую фазу промывают водой, сушат над сульфатом магния и упаривают с получением указанного в заголовке соединения (2,5 г) в виде бесцветного масла. Ссылочный пример 21. Метил (RS)-бром-(2-метилфенил)ацетат. Способ А. К перемешиваемому раствору продукта из ссылочного примера 20 (2,0 г) в сухом дихлорметане (30 мл) при 0 С добавляют трифенилфосфин (0,727 г) и четырехбромистый углерод (0,92 г). Реакционную смесь перемешивают при температуре окружающей среды в течение 3 ч и упаривают. Полученное масло растворяют в эфире и раствор фильтруют через пад из силикагеля, промывая силикагель эфи 000061 50 ром. Объединенный фильтрат и промывочные жидкости упаривают и оставшееся масло очищают с помощью флэш-хроматографии на силикагеле, элюируя смесью этилацетата и пентана (1:4, объем/объем). Фракции, гомогенные по требуемому продукту, объединяют и упаривают с получением указанного в заголовке соединения (1,8 г) в виде бесцветного масла. Способ В. Перемешиваемый раствор продукта из ссылочного примера 20 (63,2 г) в сухом толуоле (250 мл) при температуре окружающей среды обрабатывают тионилбромидом (27 мл) и смесь оставляют стоять при температуре окружающей среды в течение 3 дней. Реакционную смесь промывают раствором бикарбоната натрия до тех пор, пока промывочные жидкости не станут нейтральными, промывают два раза солевым раствором (100 мл), сушат над сульфатом магния и упаривают, получая указанное в заголовке соединение (74,5 г) в виде светло-желтого масла. Ссылочный пример 22. Метил (RS)-[2 циано-5-(3-тиенилметокси)фенокси]-(2-метилфенил) ацетат. Раствор продукта из ссылочного примера 25 (0,7 г) в диметилформамиде (80 мл) обрабатывают гидридом натрия (0,11 г, 60%-ная дисперсия в минеральном масле) и перемешивают при температуре окружающей среды в течение 40 мин. Раствор обрабатывают продуктом из ссылочного примера 21 (0,726 г) и перемешивают при температуре окружающей среды в течение 2 ч. Реакционную смесь концентрируют и распределяют между этилацетатом и водой. Органическую фазу промывают солевым раствором, сушат над сульфатом магния и упаривают. Оставшееся масло очищают с помощью флэш-хроматографии на силикагеле, элюируя смесью этилацетата и пентана (1:4, объем/объем). Фракции, гомогенные по требуемому продукту, объединяют и упаривают и оставшийся твердый продукт растирают в смеси пентана и эфира с получением указанного в заголовке соединения (0,6 г) в виде бесцветного твердого продукта, т. пл. 102-104 С. Ссылочный пример 23. Метил (RS)-[5-(1,3 бензодиоксол-5-илметокси)-2-цианофенокси](2-хлорфенил) ацетат. Смесь продукта из ссылочного примера 15(1,5 г), продукта из ссылочного примера 10 (1,62 г) и карбоната калия (1,16 г) в диметилформамиде (15 мл) перемешивают при температуре окружающей среды в течение 1,5 ч. Реакционную смесь разбавляют водой (30 мл), подкисляют до рН 2 путем добавления концентрированной соляной кислоты и экстрагируют три раза этилацетатом (40 мл). Объединенные экстракты промывают солевым раствором (30 мл), сушат над сульфатом магния и упаривают. Оставшийся желтый полутвердый продукт очищают с помощью флэш-хроматографии на силикагеле,элюируя сначала смесью этилацетата и пентана(1:4, объем/объем), затем смесью этилацетата и пентана (3:10, объем/объем). Фракции, гомогенные по требуемому продукту, объединяют и упаривают с получением указанного в заголовке соединения (0,36 г) в виде бесцветного масла,которое медленно отвердевает при стоянии. Ссылочный пример 24. 2-Гидрокси-4-(3 тиенилметокси) бензальдегид. Перемешиваемый раствор 2,4 дигидроксибензальдегида (31,8 г) в сухом диметилформамиде (150 мл) при температуре окружающей среды обрабатывают по частям гидридом натрия (11,96 г, 60%-ная дисперсия в минеральном масле) в течение 30 мин. Через дополнительный период в 15 мин смесь обрабатывают по каплям раствором 3-хлорметилтиофена (35 г) в диметилформамиде (50 мл). Смесь перемешивают при 70 С в течение 2 ч, охлаждают и упаривают растворитель. Остаток распределяют между этилацетатом (200 мл) и 0,5 н. соляной кислотой (200 мл) и водный слой экстрагируют два раза этилацетатом (100 мл). Объединенные органические фазы промывают солевым раствором (100 мл), сушат над сульфатом магния и упаривают. Остаток подвергают флэшхроматографии на силикагеле, элюируя смесью этилацетата и пентана (1:4, объем/объем) с получением бесцветного масла, которое кристаллизуется при стоянии. Этот твердый продукт перекристаллизовывают из диизопропилового эфира с получением указанного в заголовке соединения (8 г) в виде белого твердого продукта. Ссылочный пример 25. 2-Гидрокси-4-(3 тиенилметокси) бензонитрил. Смесь продукта из ссылочного примера 24(7,7 г), нитроэтана (4,74 г), ацетата натрия (5,4 г) и ледяной уксусной кислоты (6,6 мл) нагревают с обратным холодильником в течение 14 ч. Смесь затем охлаждают, разбавляют водой (50 мл) и экстрагируют три раза этилацетатом (50 мл). Объединенные экстракты промывают насыщенным водным раствором бикарбоната натрия (50 мл), сушат над сульфатом магния и упаривают. Остаток подвергают флэшхроматографии на силикагеле, элюируя смесью этилацетата и пентана (3:7, объем/объем) с получением указанного в заголовке соединения(5,6 г) в метаноле (80 мл), содержащий 6 капель концентрированной серной кислоты, нагревают с обратным холодильником в течение 12 ч. Реакционную смесь концентрируют, растворяют в эфире (100 мл) и промывают водой. Эфирный раствор сушат над сульфатом магния и упаривают с получением указанного в заголовке соединения (5,8 г) в виде бледно-оранжевого масла. Ссылочный пример 27. Метил (RS)-бром-(2-бромфенил) ацетат. 52 Смесь продукта из ссылочного примера 26(25 мл) нагревают с обратным холодильником в течение 6 ч. Реакционную смесь промывают солевым раствором и концентрируют с получением указанного в заголовке соединения (2,9 г) в виде оранжевого масла. Ссылочный пример 28. Метил (RS)-(2 бромфенил)-[2-циано-5-(3-тиенилметокси)фенокси] ацетат. Раствор продукта из ссылочного примера 25 (0,693 г) в диметилформамиде (10 мл) обрабатывают гидридом натрия (0,12 г, 60%-ная дисперсия в минеральном масле) и перемешивают при температуре окружающей среды в течение 15 мин. Раствор обрабатывают продуктом из ссылочного примера 27 (1,7 г) и перемешивают при 25 С в течение 1 ч. Реакционную смесь разбавляют водой (60 мл) и экстрагируют этилацетатом Органические экстракты промывают водой, затем солевым раствором, сушат над сульфатом магния и упаривают. Оставшееся масло очищают с помощью флэшхроматографии на силикагеле, элюируя смесью пентана и эфира (3:2, объем/объем). Фракции,гомогенные по требуемому продукту, объединяют и упаривают. Остаток растирают в эфире с получением указанного в заголовке соединения(0,52 г) в виде белого твердого продукта, т. пл. 92-95 С.(10,0 г) в метаноле (80 мл), содержащий 2 капли концентрированной серной кислоты, нагревают с обратным холодильником в течение 3 ч. Реакционную смесь концентрируют и распределяют между этилацетатом (100 мл) и водой (100 мл). Органическую фазу сушат над сульфатом магния и упаривают с получением указанного в заголовке соединения (9,8 г) в виде бесцветного масла. Ссылочный пример 30. Метил (RS)-бром-(3-хлорфенил) ацетат. Смесь продукта из ссылочного примера 29(5,0 г), N-бромсукцинимида (5,3 г) и азобисизобутиронитрила (0,38 г) в сухом хлороформе (50 мл) нагревают с обратным холодильником в течение 6 ч. Реакционную смесь промывают четыре раза водой (50 мл) и органическую фазу сушат над сульфатом магния и упаривают. Оставшееся масло очищают с помощью флэшхроматографии на силикагеле, элюируя смесью этилацетата и пентана (5:95, объем/объем). Фракции, гомогенные по требуемому продукту,объединяют и упаривают с получением указанного в заголовке соединения (4,3 г) в виде масла. 53 Ссылочный пример 31. Метил (RS)-(3 хлорфенил)-[2-циано-5-(3-тиенилметокси)-фенокси] ацетат. Раствор продукта из ссылочного примера 25 (2,0 г) в диметилформамиде (80 мл) обрабатывают гидридом натрия (0,22 г, 60%-ная дисперсия в минеральном масле) и перемешивают при температуре окружающей среды в течение 1 ч. Раствор обрабатывают продуктом из ссылочного примера 30 (1,7 г) и перемешивают при 25 С в течение 2 ч. Реакционную смесь концентрируют и распределяют между этилацетатом(200 мл) и водой (200 мл). Органическую фазу промывают два раза водой (50 мл), затем солевым раствором (50 мл), сушат над сульфатом магния и упаривают. Оставшееся масло очищают с помощью флэш-хроматографии на силикагеле, элюируя смесью этилацетата и пентана(1:4, объем/объем). Фракции, гомогенные по требуемому продукту, объединяют и упаривают с получением указанного в заголовке соединения (1,0 г). Ссылочный пример 32. 2-Фтор-4-(4-пиридилметокси) бензонитрил. Смесь 2-фтор-4-гидроксибензонитрила(10,96 г; S.M. Kelly, Helv. Chim. Acta 1984, vol. 67, p. 1572-1579), карбоната калия (53,2 г), йодида калия (6,64 г), тетра-н-бутиламмоний бромида (0,4 г) и 4-пиколилхлорида (14,4 г) в метилэтилкетоне (600 мл) перемешивают при нагревании с обратным холодильником в течение 3 ч. Реакционную смесь фильтруют и нерастворимый продукт промывают метилацетат-кетоном. Объединенный фильтрат плюс промывочные жидкости упаривают и остаток распределяют между этилацетатом (300 мл) и водой (150 мл). Водную фазу экстрагируют два раза этилацетатом (100 мл) и объединенные этилацетатные растворы промывают солевым раствором (100 мл), сушат над сульфатом магния и упаривают. Остаток перекристаллизовывают из смеси этилацетата и пентана с получением указанного в заголовке соединения (11,5 г) в виде твердого продукта темно-фиолетового цвета, т. пл. 132133 С. Ссылочный пример 33. Метил (RS)-[2 циано-5-(3-тиенилметокси)фенокси]-(2-фторфенил) ацетат. Раствор продукта из ссылочного примера 25 (0,693 г) в диметилформамиде (10 мл) обрабатывают гидридом натрия (0,12 г, 60%-ная дисперсия в минеральном масле) и перемешивают при температуре окружающей среды в течение 30 мин. Раствор обрабатывают метил(RS)бром-(3-фторфенил) ацетатом (1,8 г) и перемешивают при температуре окружающей среды в течение 2 ч. Реакционную смесь концентрируют и распределяют между этилацетатом и водой. Органическую фазу промывают солевым раствором, сушат над сульфатом магния и упаривают. Оставшееся коричневое масло 54 хроматографии на силикагеле, элюируя дихлорметаном. Фракции, гомогенные по требуемому продукту, объединяют и упаривают. Оставшийся твердый продукт растирают в смеси пентана и эфира, получая указанное в заголовке соединение (0,75 г), т. пл. 104-106 С.[Элементный анализ: - С 63,71; Н 4,09; N 3,8; S 7,8%. Рассчитано: - С 63,47; Н 4,06; N 3,53; S 8,07%]. Ссылочный пример 34. Метил (RS)-[2 циано-5-(3-тиенилметокси)фенокси]-(2-трифторметилфенил) ацетат. Раствор продукта из ссылочного примера 25 (1,5 г) в диметилформамиде (100 мл) обрабатывают гидридом натрия (0,24 г, 60%-ная дисперсия в минеральном масле) и перемешивают при температуре окружающей среды в течение 30 мин. Раствор обрабатывают продуктом из ссылочного примера 18 (1,8 г) и перемешивают при температуре окружающей среды в течение 2 ч. Реакционную смесь концентрируют и распределяют между этилацетатом (100 мл) и водой(100 мл). Органическую фазу промывают солевым раствором, сушат над сульфатом магния и упаривают. Оставшееся масло (0,98 г) очищают с помощью флэш-хроматографии на силикагеле,элюируя смесью этилацетата и пентана (1:4,объем/объем). Фракции, гомогенные по требуемому продукту, объединяют, упаривают и оставшийся твердый продукт растирают в смеси пентана и эфира, получая указанное в заголовке соединение (0,8 г) в виде бесцветного твердого продукта, т. пл. 104-108 С. Ссылочный пример 35. Метил (RS)-(2 хлорфенил)-[2-циано-5-(пиридазин-4-илметокси)-фенокси] ацетат. Перемешиваемую смесь продукта из ссылочного примера 6 (0,481 г) и 4-хлорметилпиридазин гидрохлорида (0,25 г) в диметилформамиде (6 мл) при 5 С обрабатывают гидридом натрия (0,121 г; 60%-ная дисперсия в минеральном масле). После перемешивания при 5 С в течение 1 ч реакционной смеси позволяют нагреться до комнатной температуры, перемешивание продолжают в течение еще 2 ч при комнатной температуре, затем при 60 С в течение 4 ч. Реакционную смесь упаривают и оставшееся масло распределяют между этилацетатом (50 мл) и водой (20 мл). Водную фазу экстрагируют три раза этилацетатом. Объединенные органические фазы промывают солевым раствором (5 мл), сушат над сульфатом магния и упаривают. Оставшееся масло (700 мг) очищают с помощью флэш-хроматографии на силикагеле,элюируя смесью дихлорметана и метанола (99:1,объем/объем). Фракции, гомогенные по требуемому продукту, объединяют и упаривают, получая указанное в заголовке соединение (0,2 г) в виде белого твердого продукта, т. пл. 136-138 С.l572-1579) (30 г), карбоната калия (45,36 г) и 3,4-метилендиоксибензилхлорида (42,65 г) в диметилформамиде (500 мл) перемешивают при 90 С в течение 2 ч. Реакционную смесь фильтруют и фильтрат упаривают. Остаток перемешивают с этилацетатом (500 мл) и фильтруют,получая указанное в заголовке соединение (32,1 г) в виде твердого продукта кремового цвета, т. пл. 139-140 С. Ссылочный пример 37. Метил (RS)-(2 хлорфенил)-[2-циано-5-(изотиазол-4-ил-метокси)фенокси] ацетат. Перемешиваемый раствор трифенилфосфина (2,2 г) в тетрагидрофуране при -5 С обрабатывают по каплям диизопропилазодикарбоксилатом (1,65 мл). После перемешивания при -5 С в течение 30 мин добавляют раствор продукта из ссылочного примера 6 (1,5 г) в сухом тетрагидрофуране (5 мл), затем раствор 4 гидроксиметилизотиазола (0,5 г), в результате чего образуется красный раствор. Реакционной смеси дают нагреться до комнатной температуры, затем оставляют стоять при комнатной температуре на 18 ч и упаривают. Остаток обрабатывают этилацетатом (40 мл) и органическую фазу промывают два раза водой (20 мл), затем солевым раствором (20 мл), сушат над сульфатом магния и упаривают. Оставшееся масло янтарного цвета (7 г) очищают с помощью флэшхроматографии на силикагеле, элюируя смесью эфира и пентана (1:1, объем/объем). Фракции,гомогенные по требуемому продукту, объединяют и упаривают. Оставшуюся желтую смолу(1,44 г) растирают в эфире (25 мл), получая указанное в заголовке соединение (0,44 г) в виде белого твердого продукта. Ссылочный пример 38. Метил (RS)-[2 циано-5-(3-пиридилметокси)фенокси]фенилацетат. Смесь продукта из ссылочного примера 41(25 мл) перемешивают при температуре окружающей среды в течение 1,5 ч. Реакционную смесь разбавляют водой, устанавливают рН раствора 4-5 путем добавления 2 н. соляной кислоты и смесь экстрагируют этилацетатом. Органические экстракты промывают солевым раствором (30 мл), сушат над сульфатом магния и упаривают. Оставшееся масло очищают с помощью флэш-хроматографии на силикагеле, элюируя смесью пентана и этилацетата (3:1, объем/объем). Фракции, гомогенные по требуемому продукту, объединяют и упаривают, получая указанное в заголовке соединение (0,52 г) в виде белого твердого продукта. Ссылочный пример 39. 2-Гидрокси-4-(3 пиридилметокси) бензальдегид. 56 Смесь 2,4-дигидробензальдегида (25 г),гидрохлорида 3-пиколилхлорида (38,2 г), карбоната калия (91 г), йодида калия (0,5 г) и тетра-нбутиламмоний бромида (0,5 г) в метилэтилкетоне (1000 мл) нагревают с обратным холодильником в течение 4 ч. Реакционную смесь фильтруют и упаривают. Остаток распределяют между этилацетатом и разбавленной уксусной кислотой. Органическую фазу промывают водой, сушат над сульфатом магния и упаривают. Остаток очищают с помощью флэшхроматографии на силикагеле, элюируя сначала смесью пентана и этилацетата (3:1, объем/объем), затем смесью пентана и этилацетата(1:1, объем/объем) и в конце смесью пентана и этилацетата (85:15, объем/объем). Фракции, гомогенные по требуемому продукту, объединяют и упаривают, получая указанное в заголовке соединение (5 г) в виде бесцветного твердого продукта. Ссылочный пример 40. Оксим 2-гидрокси 4-(3-пиридилметокси) бензальдегида. Смесь продукта из ссылочного примера 39(5 г), гидроксиламин гидрохлорида (1,72 г) и пиридина (2 мл) в этаноле (100 мл) нагревают с обратным холодильником в течение 1,5 ч. Реакционную смесь упаривают и оставшийся твердый продукт растирают в диэтиловом эфире,получая указанное в заголовке соединение (2,7 г). Ссылочный пример 41. 2-Гидрокси-4-(3 пиридилметокси) бензонитрил. Смесь продукта из ссылочного примера 40(2,5 г), ацетата натрия (0,03 г) и уксусного ангидрида (10 мл) нагревают с обратным холодильником в течение 1,5 ч. Охлажденную реакционную смесь при перемешивании осторожно разбавляют водой (250 мл) и фильтруют. Полученное коричневое масло экстрагируют этилацетатом. Упаривание органических экстрактов и кристаллизация из изопропанола дает 2 ацетокси-4-(3-придилметокси)бензонитрил (2,15 г), который растворяют в смеси метанола (10 мл) и тетрагидрофурана (7,5 мл) и обрабатывают при комнатной температуре раствором карбоната калия (1 г) в воде (10 мл). Через 2 ч реакционную смесь разбавляют водой (50 мл) и устанавливают рН смеси 4 путем добавления 2 н. соляной кислоты. Смесь экстрагируют этилацетатом. Органические экстракты промывают солевым раствором, сушат над сульфатом магния и упаривают, получая указанное в заголовке соединение (1,12 г) в виде белого твердого продукта. Ссылочный пример 42. Метил (RS)-[2 формил-5-(3-тиенилметокси)фенокси]фенилацетат. Смесь продукта из ссылочного примера 24(50 мл) перемешивают при температуре 25 С в течение 1,5 ч. Реакционную смесь обрабатыва 57 ют водой (50 мл), подкисляют до рН 3 путем добавления концентрированной соляной кислоты и экстрагируют пять раз этилацетатом (100 мл). Объединенные экстракты промывают солевым раствором (100 мл), сушат над сульфатом магния и упаривают. Оставшийся кремовый твердый продукт промывают диэтиловым эфиром, получая указанное в заголовке соединение(2,80 г) в виде белого твердого продукта. Ссылочный пример 43. Метил (RS)-(2 хлорфенил)-[2-циано-3-фтор-5-(3-тиенилметокси)-фенокси] ацетат. Раствор продукта из ссылочного примера 44 (0,97 г) в сухом тетрагидрофуране (40 мл) обрабатывают гидридом натрия (0,17 г, 60%-ная дисперсия в минеральном масле). После перемешивания при комнатной температуре в течение 30 мин реакционную смесь обрабатывают раствором продукта из ссылочного примера 10(1,12 г) в сухом диметилформамиде (10 мл) и перемешивание продолжают при температуре окружающей среды в течение 2 ч. Реакционную смесь разбавляют водой (100 мл), устанавливают рН раствора 3 путем добавления 1 н. соляной кислоты и экстрагируют четыре раза этилацетатом (50 мл). Объединенные органические экстракты промывают солевым раствором (50 мл),сушат над сульфатом магния и упаривают. Оставшееся темно-желтое масло очищают с помощью флэш-хроматографии на силикагеле,элюируя смесью фракции легких углеводородов нефти и этилацетата (4:1, объем/объем). Фракции, гомогенные по требуемому продукту, объединяют и упаривают, получая указанное в заголовке соединение (0,95 г) в виде белого твердого продукта, т. пл. 143-144 С. Ссылочный пример 44. 2-Фтор-6-гидрокси-4-(3-тиенилметокси) бензонитрил. Смесь продукта из ссылочного примера 45(1 г), нитроэтана (0,6 г), ацетата натрия (0,66 г) и ледяной уксусной кислоты (1 мл) нагревают с обратным холодильником в течение 2 ч. Реакционную смесь охлаждают до температуры окружающей среды, добавляют воду (50 мл) и смесь экстрагируют три раза этилацетатом (50 мл). Объединенные органические экстракты промывают насыщенным солевым раствором(50 мл), сушат над сульфатом магния и упаривают. Оставшееся коричневое масло очищают с помощью флэш-хроматографии на силикагеле,элюируя смесью этилацетата и пентана (1:2,объем/объем). Фракции, гомогенные по требуемому продукту, объединяют и упаривают, получая указанное в заголовке соединение (250 мг) в виде желтого твердого продукта. Ссылочный пример 45. 2-Фтор-6 гидрокси-4-(3-тиенилметокси) бензальдегид. Гидрид натрия (0,52 г, 60%-ная дисперсия в минеральном масле) добавляют по каплям в течение 30 мин к раствору продукта из ссылочного примера 46 (2 г) в диметилформамиде (50 мл) при 0 С. После перемешивания при 0 С в 58 течение 30 мин добавляют раствор 3 хлорметилтиофена (1,72 г) в диметилформамиде(50 мл) и смесь перемешивают при 60 С в течение 16 ч. Реакционную смесь концентрируют и остаток распределяют между диэтиловым эфиром (50 мл) и водой (50 мл). Водную фазу экстрагируют четыре раза диэтиловым эфиром (50 мл) и объединенные органические экстракты промывают солевым раствором (50 мл), сушат над сульфатом магния и упаривают. Остаток очищают с помощью флэш-хроматографии на силикагеле, элюируя смесью этилацетата и пентана (1:4, объем/объем). Фракции, гомогенные по требуемому продукту, объединяют и упаривают с получением светло-желтого твердого продукта, который растирают в диизопропиловом эфире с получением указанного в заголовке соединения (1,1 г) в виде желтого твердого продукта. Ссылочный пример 46. 2,4-Дигидрокси-6 фторбензальдегид. Диметилформамид (12,7 г) добавляют к энергично перемешиваемому фосфороксихлориду (14,4 г) при 0 С. Реакционную смесь перемешивают при этой температуре в течение 30 мин,затем добавляют 3,5-дигидроксифторбензол (6 г). Вязкому красному сиропу дают нагреться до комнатной температуры и перемешивают в течение 2 ч, затем оставляют стоять в течение 14 ч. Добавляют воду (100 мл) и экстрагируют смесь четыре раза этилацетатом(100 мл). Объединенные органические экстракты промывают солевым раствором (100 мл),сушат над сульфатом магния и упаривают. Остаток очищают с помощью флэшхроматографии на силикагеле, элюируя смесью этилацетата и пентана (1:2, объем/объем). Фракции, гомогенные по требуемому продукту,объединяют и упаривают с получением оранжевого твердого продукта, который растирают в этилацетате с получением указанного в заголовке соединения (2 г) в виде желтого твердого продукта. Ссылочный пример 47. Метил (RS)-[5-(бензоксазол-6-илметокси)2-цианофенокси]-(2-хлорфенил) ацетат. Смесь продукта из ссылочного примера 6(3,24 г), продукта из ссылочного примера 48(2,17 г) и карбоната калия (1,41 г) в сухом диметилформамиде (60 мл) перемешивают при комнатной температуре в атмосфере азота в течение 18 ч. Реакционную смесь упаривают, добавляют воду (60 мл) и экстрагируют раствор три раза этилацетатом (40 мл). Объединенные экстракты промывают два раза водой (40 мл), солевым раствором (50 мл), сушат над сульфатом магния и упаривают. Оставшийся продукт очищают с помощью флэш-хроматографии на силикагеле,элюируя смесью диэтилового эфира и пентана(1:1, объем/объем). Фракции, гомогенные по требуемому продукту, объединяют и упаривают. Остаток растирают два раза в пентане (10(1,49 г) в виде белого твердого продукта,т.пл.157-159 С. Ссылочный пример 48. 6-Бромметилбензоксазол. Смесь 6-метилбензоксазола (5,0 г; J.T.Communications,1986,16,365),Nбромсукцинимида (7,0 г) и азобисизобутиронитрила (0,55 г) в сухом хлороформе (100 мл) нагревают с обратным холодильником в течение 1 ч. Охлажденную реакционную смесь промывают три раза водой (40 мл), сушат над сульфатом магния и упаривают. Оставшийся оранжевый вязкий твердый продукт дважды растирают в пентане (50 мл), получая указанное в заголовке соединение (6,20 г) в виде твердого продукта темно-желтого цвета, т. пл. 52-56 С. Ссылочный пример 49. Этил (RS)-гидрокси-[2-(3-метил) тиенил] ацетат. Перемешиваемый раствор 2-[2-(3-метил) тиенил]-2-оксоацетата (5,5 г) в тетрагидрофуране (50 мл) и воде (2 мл), охлаждают на ацетоновой/ледяной бане и обрабатывают боргидридом натрия (0,45 г). После перемешивания на ледяной бане в течение около 1 ч добавляют немного ацетона для разложения избытка боргидрида и смесь упаривают до небольшого объема. Остаток распределяют между этилацетатом и 0,1 н. соляной кислотой. Органическую фазу промывают 5%-ным водным раствором бикарбоната натрия, затем водой, сушат над сульфатом магния и упаривают. Остаток очищают путем пропускания через тонкий слой силикагеля, элюируя сначала смесью дихлорметана и циклогексана (1:1, объем/объем), затем дихлорметаном. Фракции, гомогенные по требуемому продукту,объединяют и упаривают, получая указанное в заголовке соединение (1,14 г) в виде бесцветного текучего масла. Ссылочный пример 50. 2-Фтор-4-(триазол 5-илметокси) бензонитрил. Диизопропилазодикарбоксилат (4,0 г) растворяют в небольшом количестве безводного тетрагидрофурана (около 10 мл) и по каплям добавляют к перемешиваемому раствору трифенилфосфин (5,2 г) в безводном тетрагидрофуране (150 мл) при 0 С в атмосфере азота. После перемешивания при 0 С в течение 15 мин, в течение которых образуется белый осадок, добавляют смесь 2-фтор-4-гидроксибензонитрила(S.M. Kelly, Helv. Chim. Acta 1984, volume 67,p.1572-1579) (2,0 г) и триазол-5-метанола (2,3 г) в безводном тетрагидрофуране (20 мл) по каплям, при этом температуру поддерживают при 5 С или ниже. Реакционную смесь перемешивают на охлаждающей бане в течение еще 2 ч,затем дают медленно нагреться до комнатной температуры. После выдерживания при комнатной температуре в течение ночи реакционную смесь распределяют между этилацетатом (200 мл) и насыщенным водным раствором хлорида 60 аммония (200 мл). Слои разделяют и органическую фазу промывают водой (100 мл), сушат над сульфатом магния и упаривают. Остаток очищают с помощью флэш-хроматографии на силикагеле, элюируя смесью этилацетата и циклогексана (1:1, объем/объем). Фракции, гомогенные по требуемому продукту, объединяют и упаривают, получая указанное в заголовке соединение в виде светло-желтого твердого продукта (2,0 г). Ссылочный пример 51. Метил (RS)-(2 хлорфенил)-[2-циано-3-фтор-5-(4-пиридилметокси)фенокси] ацетат. Смесь продукта из ссылочного примера 52(0,6 г), гидрохлорида 4-пиколилхлорида (0,32 г),карбоната калия (1,24 г), йодида калия (0,15 г) и тетра-н-бутиламмоний бромида (20 мг) в метилэтилкетоне (30 мл) нагревают с обратным холодильником в течение 1 ч. Смесь упаривают досуха и распределяют между 10%-ной уксусной кислотой (50 мл) и этилацетатом (50 мл). Органический слой отделяют и водный слой экстрагируют два раза этилацетатом (250 мл). Объединенные органические экстракты промывают насыщенным солевым раствором (50 мл), сушат над сульфатом магния и упаривают, получая указанное в заголовке соединение (0,72 г) в виде коричневого масла, которое используют без дополнительной очистки. Ссылочный пример 52. Метил (RS)-(2 хлорфенил)-[2-циано-3-фтор-5-гидрокси-фенокси] ацетат. Азот барботируют через раствор продукта из ссылочного примера 53 (0,66 т) в этаноле (60 мл) и воде (6 мл) в течение 20 мин. Добавляют диазабицикло[2,2,2]октан (0,04 г) и трис(трифенилфосфин) родий (I) хлорид (0,125 г) и смесь нагревают с обратным холодильником. После нагревания с обратным холодильником в течение 4,5 ч реакционную смесь охлаждают до комнатной температуры и распределяют между 1 н. соляной кислотой (50 мл) и этилацетатом (50 мл). Органический слой отделяют и водный слой экстрагируют два раза этилацетатом (50 мл). Объединенные органические экстракты промывают насыщенным солевым раствором(50 мл), сушат над сульфатом магния и упаривают. Оставшееся желтое масло очищают с помощью флэш-хроматографии на силикагеле,элюируя смесью этилацетата и петролейного эфира (33:67, объем/объем). Фракции, гомогенные по требуемому продукту, объединяют и упаривают, получая указанное в заголовке соединение (0,6 г) в виде желтого масла. Ссылочный пример 53. Метил (RS)-[5 аллилокси-2-циано-3-фторфенокси]-(2-хлорфенил)-ацетат. Раствор продукта из ссылочного примера 54 (0,52 г) в сухом диметилформамиде (30 мл) в атмосфере азота обрабатывают гидридом натрия(0,12 г, 60%-ная дисперсия в минеральном масле). Смесь перемешивают при комнатной тем
МПК / Метки
МПК: C07D 213/30, C07C 59/70, A61K 31/19
Метки: качестве, фенильные, эндотелина, замещенные, антагонистов, производные
Код ссылки
<a href="https://eas.patents.su/30-61-zameshhennye-fenilnye-proizvodnye-v-kachestve-antagonistov-endotelina.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенные фенильные производные в качестве антагонистов эндотелина</a>
Предыдущий патент: Способ и устройство для обработки табачных листьев при изготовлении резанного табака.
Следующий патент: Гербицидные композиции, содержащие 4-бензоилизоксазол или 2-циан-1,3-дион и антидоты для них, и их применение.
Случайный патент: Пьезохромный защитный элемент











