Производные 5н, 10н-имидазо{1,2-а}индено {1,2-е} пиразин-4-она, способы их получения, содержащее их лекарственное средство и производные инданона в качестве промежуточных продуктов
Номер патента: 218
Опубликовано: 24.12.1998
Авторы: Манфр Франко, Женевуа-Борелла Ариель, Миньяни Серж, Арди Жан-Клод, Алу Жан-Клод, Жимоне Патрик, Немесе Патрик, Барро Мишель, Одьо Франсуа, Дамур Доминик, Рибей Ив
Формула / Реферат
1. Производные 5Н,10H-имидазо[1,2-а] индено[1,2-е]пиразин-4-она формулы (I)
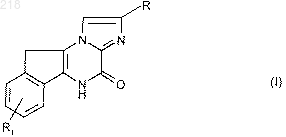
в которой R означает атом водорода или карбоксил, алкоксикарбонил, -CO-NR4R5,
-РО3H2 или -СН2ОН;
R1 означает радикалы -aлк-NH2, -алк-NН-СО-R3, -алк-СООR4, -aлк-CO-NR5R6 или -CO-NH-R7;
R3 означает алкил, фенил, фенилалкил, циклоалкил или -NR6R8;
R4 означает атом водорода или алкильный радикал;
R5 означает атом водорода, алкил, фенил, циклоалкил или фенилалкил;
R6 означает атом водорода или алкил;
или R5 и R6 вместе с атомом азота, с которым они связаны, образуют моно- или полициклический, насыщенный или ненасыщенный, гетероцикл, содержащий 1-6 атомов углерода и, возможно, один или несколько других гетероатомов, выбираемых среди кислорода, серы и азота;
R7 означает фенил, фенилалкил или -алк-СООR4;
R8 означает атом водорода, алкил, циклоалкил или фенилалкил;
причем "алк" означает алкиленовый радикал при условии, что алкоксильные, алкильные и алкиленовые радикалы и части содержат 1-6 атомов углерода и имеют линейную или разветвленную цепь, а циклоалкильные радикалы содержат 3-6 атомов углерода;
их соли, энантионеры и диастереоизомеры.
2. Производные формулы (I) по п.1, в которых, когда R5, и R6 с атомом азота, с которым они связаны, образуют гетероцикл, то этот гетероцикл означает азетидиновый, пирролидиновый, пиперидиновый, пиперазиновый или морфолиновый цикл.
3. Производные формулы (I) по п.1 или 2, в которых заместитель R1 находится в положении 8 или 9.
4. Производные формулы (I) по п.1, в которых R означает атом водорода или карбоксильный радикал, R1 означает радикал -алк-NН-СО-R3, -алк-СООR4, -aлк-CO-NR5R6 или -CO-NH-R7;
R3 означает алкильный радикал или -NR6R8; R4 означает атом водорода; R5 означает атом водорода; R6 означает алкильный радикал; R7 означает фенилалкильный радикал или -алк-СООR4;
их соли, энантиомеры и диастереоизомеры.
5. Производные формулы (I) по п.1, представляющие собой следующие соединения:
- (4,5-дигидро-4-оксо-10Н-имидазо[1,2-а]индено[1,2-е]пиразин-9-ил)уксусная кислота;
- N-метил-2-(4,5-дигидро-4-оксо-10Н-имидазо[1,2-а]индено-[1,2-е]пиразин-9-ил)ацетамид;
- N-[(4,5-дигидро-4-оксо-10Н-имидазо[1,2-а]индено[1,2-е]пиразин-9-ил)метил]ацетамид;
- 9-[(3-метилуреидо)метил]-5Н,10H-имидазо[1,2-а]индено[1,2-е]пиразин-4-он;
- N-метил-(4,5-дигидро-4-оксо-10H-имидазо[1,2-а]индено[1,2-е]пиразин-8-ил)ацетамид;
- 8-N-метилкарбоксамидометил-4,5-дигидро-4-оксо-10Н-имидазо-[1,2-а]индено[1,2-е]пиразин-2-карбоновая кислота;
- 8-карбоксиметил-4,5-дигидро-4-оксо-10Н-имидазо[1,2-а]индено[1,2-е]пиразин-2-карбоновая кислота;
- 8-(3-метилуреидо) метил-5Н, 10H-имидазо[-1,2-а]индено[1,2-е]пиразин-4-он;
- 9-карбоксиметил-4,5-дигидро-4-оксо-10H-имидазо[1,2-а]индено[1,2-е]пиразин-2-карбоновая кислота;
- N-бензил-(4,5-дигидро-4-оксо-10Н-имидазо[1,2-а]индено[1,2-е]пиразин-9-ил)карбоксамид;
- N-[(4,5-дигидро-4-оксо-10H-имидазо[1,2-а]индено[1,2-е]пиразин-9-ил)карбонил]глицин;
- N-бензил-(4,5-дигидро-4-оксо-10H-имидазо[1,2-а]индено[1,2-е]пиразин-8-ил)карбоксамид;
- 8-(N-этиламинокарбонилметил)-4,5-дигидро-4-оксо-10H-имидазо[1,2-а]индено[1,2-е]пиразин-2-карбоновая кислота;
- 8-(N-этиламинокарбонилметил)-4,5-дигидро-4-оксо-10Н-имидазо[1,2-а]индено[1,2-е]пиразин-2-этилкарбоксилат;
- 9-N-бензилкарбамоил-4,5-дигидро-4-оксо-10Н-имидазо[1,2-а]индено[1,2-е]пиразин-2-карбоновая кислота;
- 8-(2-карбоксиэтил)-4,5-дигидро-4-оксо-10H-имидазо[1,2-а]индено[1,2-е]пиразин-2-карбоновая кислота;
- 9-[(3-метилуреидо)метил]-4,5-дигидро-4-оксо-10Н-имидазо-[1,2-а]индено[1,2-е]пиразин-2-карбоновая кислота;
- 9-карбоксиметил-4,5-дигидро-4-оксо-10H-имидазо[1,2-а]индено[1,2-е]пиразин-2-фосфиновая кислота;
- 9-N-метиламинокарбонилметил-4,5-дигидро-4-оксо-10Н-имидазо[1,2-а]индено[1,2-е]пиразин-2-карбоновая кислота;
- 9-(1-карбоксиэтил)-4,5-дигидро-4-оксо-10Н-имидазо[1,2-а]индено[1,2-е]пиразин-2-карбоновая кислота;
их соли, энантиомеры и диастереоизомеры.
6. Способ получения производных 5Н, 10H-имидазо[1,2-а]-индено[1,2-е]пиразин-4-она формулы (I) по п.1, отличающийся тем, что в присутствии ацетата аммония циклизуют производное формулы (II):
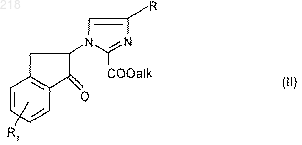
в которой R и R1 имеют указанные в п.1 значения и "алк" означает алкильный радикал, продукт выделяют и в случае необходимости превращают его в соль.
7. Способ получения соединений формулы (I) по п.1, в которых R означает карбоксил и/или R1 означает радикал -алк-СООR4, где R4 означает атом водорода, или -CO-NH-R7, в котором R7 означает радикал -алк-СООR4, в котором R4 означает атом водорода, отличающийся тем, что гидролизуют соответствующее соединение формулы (I), в котором R означает алкоксикарбонил и/или R1 означает радикал -алк-СООR4, где R4 означает алкильный радикал, или радикал -CO-NH-R7, в котором R7 означает радикал -алк-СООR4, где R4 означает алкиленовый радикал, продукт выделяют и в случае необходимости превращают его в соль.
8. Способ получения соединений формулы (I) по п.1, в которых R означает радикал -РО3Н2, отличающийся тем, что гидролизуют производное формулы (V):
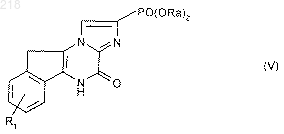
в которой R1 имеет указанные в п.1 значения и Rа означает метил, этил или бензил, продукт выделяют и в случае необходимости превращают его в соль.
9. Способ получения соединений формулы (I) по п.1, в которых R означает радикал -СН2ОН, отличающийся тем, что восстанавливают соответствующее соединение формулы (I), в котором R означает алкоксикарбонил, продукт выделяют и в случае необходимости превращают его в соль.
10. Способ получения соединений формулы (I) по п.1, в которых R означает радикал -CO-NR4R5, отличающийся тем, что комплексное соединение алюминия, образованное триалкилалюминием и хлоргидратом амина HNR4R5, вводят во взаимодействие с соответствующим соединением формулы (I), в котором R означает алкоксикарбонил, продукт выделяют и в случае необходимости превращают его в соль.
11. Способ получения соединений формулы (I) по п.1, в которых R1 означает радикал -алк-NH-СО-R3, в котором R3 означает алкильный радикал (1 атом углерода), отличающийся тем, что соответствующее соединение формулы (I), в котором R1 означает радикал -алк-NH2, вводят во взаимодействие с уксусным ангидридом, продукт выделяют и в случае необходимости превращают его в соль.
12. Способ получения соединений формулы (I) по п.1, в которых R1 означает радикал -алк-NН-СО-R3, в котором R3 означает радикал -NR6R8, где R6 означает атом водорода и R8 означает атом водорода или алкильный радикал, циклоалкильный радикал или фенилалкильный радикал, отличающийся тем, что соответствующее соединение формулы (I), в котором R1 означает радикал -алк-NH2, вводят во взаимодействие с изоцианатом Rb-NCO, в котором Rb означает триметилсилил, алкил,циклоалкил или фенилалкил, в случае необходимости с последующим гидролизом силилированного производного, продукт выделяют и в случае необходимости превращают его в соль.
13. Способ получения соединений формулы (I) по п.1, в которых R1 означает радикал -алк-NН-СО-R3, в котором R3 означает радикал -NR6R8, где R6 означает атом водорода и R8 означает алкил, циклоалкил или фенилалкил, отличающийся тем, что соответствующее соединение формулы (I), в котором R1 означает радикал -алк-NH2, вводят во взаимодействие с производным формулы (VI)
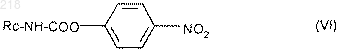
в которой Rc означает алкил, циклоалкил или фенилалкил, продукт выделяют и в случае необходимости превращают его в соль.
14. Способ получения соединений формулы (I) по п.1, в которых R1 означает радикал -алк-NН-СО-R3, в котором R3 означает алкил, фенил, фенилалкил, циклоалкил или радикал -NR6R8, где R6 означает алкильный радикал и R8 означает алкил, циклоалкил или фенилалкил, отличающийся тем, что соответствующее соединение формулы (I), в котором R1 означает радикал -алк-NH2, вводят во взаимодействие с производным Гал-СО-R3, в котором Гал означает атом галогена и R3 имеет вышеуказанные значения, продукт выделяют и в случае необходимости превращают его в соль.
15. Способ получения соединений формулы (I) по п.1, в которых R1 означает радикал -алк-CO-NR5R6, отличающийся тем, что соответствующее соединение формулы (I), в котором R1 означает радикал -алк-СООR4, или, когда R4 означает атом водорода, реакционно-способное производное этой кислоты вводят во взаимодействие с амином HNR5R6, продукт выделяют и в случае необходимости превращают его в соль.
16. Способ получения соединений формулы (I) по п.1, в которых R1 означает радикал -алк(1C)-NH2, отличающийся тем, что гидрируют производное формулы (VII):
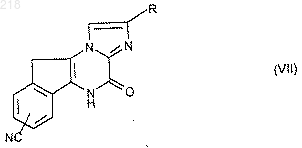
в которой R имеет указанные в формуле (I) значения, продукт выделяют и в случае необходимости превращают его в соль.
17. Лекарственное средство, являющееся антагонистом к АМРА и NMDA, содержащее в качестве действующего начала, по крайней мере, одно соединение формулы (I) по любому из пп.1-5 или соль такого соединения.
18. Соединение формулы (II):
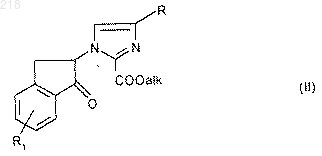
в которой R и R1 имеют указанные в п.1 значения и "алк" обозначает линейный или разветвленный C1-6 алкил.
Текст
Настоящее изобретение относится к производным 5 Н, 10 Н-имидазо[1,2-а]индено[1,2 е]пиразин-4-она формулы (I): их солям, энантиомерам и диастереоизомерам, к способу их получения и лекарственным средствам на их основе. В формуле (I) R означает атом водорода или карбоксил, алкоксикарбонил, -CO-NR4R5,-PO3 Н 2 или -СН 2 ОН;R4 означает атом водорода или алкильный радикал;R6 означает атом водорода или алкил; или R5 и R6 вместе с атомом азота, с которым они связаны, образуют моно- или полициклический, насыщенный или ненасыщенный гетероцикл, содержащий 1-6 атомов углерода и,возможно, один или несколько других гетероатомов, выбираемых среди кислорода, серы и азота;"алк" означает алкиленовый радикал. Если нет других указаний, алкоксильные,алкильные и алкиленовые части и радикалы содержат 1-6 атомов углерода и являются линейными или разветвленными; циклоалкильные радикалы содержат 3-6 атомов углерода. Предпочтительно, когда R5 и R6 вместе с атомом азота, с которым они связаны, образуют гетероцикл, то он означает азетидиновый, пирролидиновый, пиперидиновый, пиперазиновый или морфолиновый цикл. Предпочтительно, заместитель R1 находится в положении 8 или 9. Соединения формулы (I) могут быть получены путем циклизации в присутствии ацетата аммония, производного формулы (II) : в которой R и R1 имеют указанные в формуле (I) значения и "алк" означает алкильный радикал. Эту циклизацию проводят в органической кислоте, такой как уксусная кислота, при температуре кипения реакционной смеси. Производные формулы (II) являются новыми и составляют часть изобретения. Их можно получать путем взаимодействия инданона формулы (III) в которой R имеет указанные в формуле (I) значения и "алк" означает алкильный радикал. Эту реакцию обычно осуществляют в инертном растворителе, таком как спирт (например метанол, этанол), кетон (например ацетон), ароматический углеводород (например толуол), диметилформамид, или в отсутствие растворителя, в случае необходимости в присутствии основания, такого как гидрид натрия или карбонат калия, в случае необходимости, с краун-эфиром, таким как 18 С 6, при температуре от 20 С до температуры кипения реакционной среды или температуры плавления реакционной среды. Производные формулы (III) могут быть получены путем применения или адаптации методов, описанных OLIVIER и сотр., Bull. Soc.Chim. France, 3092 (1973), в патенте ФРГ 2640358 и в примерах. Производные формулы (IV) могут быть получены путем применения или адаптации методов, описанных P.S. BRANCO и сотр., Tetrahedron, 48(30), 6335 (1992); J.E. OLIVIER и сотр., J. Org. Chem., 38 (7), 1437 (1973); в патенте США 3600399 и в примерах. Соединения формулы (I), в которых R означает карбоксильный радикал и/или R1 означает радикал -алк-СООН 4, где R4 означает атом водорода, или -CO-NH-R7, где R7 означает радикал -алк-СООR4 и R4 означает атом водорода,также могут быть получены путем гидролиза 3 соответствующего соединения формулы (I), в котором R означает алкоксикарбонильный радикал и/или R1 означает радикал -алк-СООR4, в котором R4 означает алкильный радикал, или радикал -CO-NH-R7, в котором R7 означает радикал -алк-СООR4 и R4 означает алкильный радикал. Эту реакцию обычно проводят с помощью основания, такого как гидроксид щелочного металла (например гидроксид натрия, гидроксид калия), в смеси инертного растворителя (например диоксана) и воды, при температуре от 20 С до температуры кипения реакционной среды; или с помощью неорганической кислоты, такой как соляная кислота, в инертном растворителе,таком как диоксан и уксусная кислота, при температуре кипения реакционной среды. Соединения формулы (I), в которых R означает радикал -РО 3 Н 2, также могут быть получены путем гидролиза производного формулы в которой R1 имеет указанные в формуле (I) значения и Ra означает метил, этил или бензил. Эту реакцию обычно проводят с помощью бромтриметилсилана в хлорированном растворителе (например дихлорметан, хлороформ),при температуре около 20 С. Производные формулы (V) могут быть получены путем циклизации, аналогично таковой, описанной выше для получения соединений формулы (I), и по способу, описанному ниже в примерах. Соединения формулы (I), в которых R означает радикал -СН 2 ОН, могут быть получены также путем восстановления соответствующего соединения формулы (I), в котором R означает алкоксикарбонильный радикал. Это восстановление обычно проводят с помощью литийборгидрида или литийалюминийгидрида, в инертном растворителе, таком как тетрагидрофуран, диоксан, при температуре от 20 С до температуры кипения реакционной среды. Соединения формулы (I), в которых R означает радикал -CO-NR4R5, также могут быть получены путем взаимодействия комплексного соединения алюминия, полученного из триалкилалюминия (например триметилалюминий) и хлоргидрата амина HNR4R5, с соответствующим соединением формулы (I), в котором R означает алкоксикарбонильный радикал. Эту реакцию обычно осуществляют в инертном растворителе, таком как углеводород 4 20 С до температуры кипения реакционной среды. Амины HNR4R5 имеются в продаже или могут быть получены путем взаимодействия первичного амина H2NR5 с производным ГалР 4,в котором Гал означает атом галогена (как, например, хлор, бром) и R4 имеет указанные в формуле (I) значения за исключением водорода. Эту реакцию обычно проводят в инертном растворителе, таком как диметилформамид, в присутствии триалкиламина (например триэтиламина) при температуре около 20 С. Соединения формулы (I), в которых R1 означает радикал -алк-NН-СО-R3, в котором R3 означает алкильный радикал (1 атом углерода),также могут быть получены путем взаимодействия соответствующего соединения формулы (I),в котором R1 означает радикал -алк-NH2, с уксусным ангидридом. Эту реакцию обычно проводят без растворителя или в среде инертного растворителя, такого, как уксусная кислота, диметилформамид,при температуре около 20 С, в случае необходимости в присутствии основания, такого как триалкиламин (например триэтиламин) или ацетат натрия. Соединения формулы (I), в которых R1 означает радикал -алк-NН-СО-R3, где R3 означает радикал -NR6R8, причем R6 означает атом водорода, a R8 означает атом водорода или алкил,циклоалкил или фенилалкил, также могут быть получены путем взаимодействия соответствующего соединения формулы (I), в котором R1 означает радикал -алк-NH2, с изоцианатомRb-NCO, в котором Rb означает триметилсилильный, алкильный, циклоалкильный или фенилалкильный радикал, в случае необходимости с последующим гидролизом силилированного производного. Эту реакцию обычно проводят в инертном растворителе, таком как диметилформамид, тетрагидрофуран, диоксан, при температуре от 20 С до температуры кипения реакционной среды. Гидролиз силилированного производного осуществляют при температуре от 20 до 50 С. Соединения формулы (I), в которых R1 означает радикал -алк-NH-СО-R3, где R3 означает радикал -NR6R8, причем R6 означает атом водорода, a R8 означает алкил, циклоалкил или фенилалкил, также могут быть получены путем взаимодействия соответствующего соединения формулы (I), в котором R1 означает радикал aлк-NH2, с производным формулы (VI): в которой RC означает алкил, циклоалкил или фенилалкил. Эту реакцию обычно проводят в инертном растворителе, таком как диметилформамид, тетрагидрофуран, диоксан, при температуре от 5 20 С до температуры кипения реакционной среды. Производные формулы (VI) могут быть получены путем применения или адаптации способов, описанных J. IZDEBSKI et coll., Synthesis, 423 (1989), T. KONAKAHARA et coll.,Synthesis, 103 (1993). Соединения формулы I), в которых R1 означает радикал -алк-NН-СО-R3, в котором R3 означает алкил, фенил, фенилалкил, циклоалкил или -NR6R8, причем R6 означает алкил, а R8 означает алкил, циклоалкил или фенилалкил, также могут быть получены путем взаимодействия соответствующего соединения формулы (I), в котором R1 означает радикал -алк-NH2, с производным Гал-СО-R3, в котором Гал означает атом галогена и предпочтительно атом хлора, а R3 имеет вышеуказанные значения. Эту реакцию предпочтительно проводят в инертном растворителе, таком как диметилформамид, в присутствии акцептора кислоты, такого как триалкиламин (например триэтиламин),при температуре от 20 С до температуры кипения реакционной среды. Производные Гал-СО-R3 имеются в продаже или производные, в которых R3 означает радикал -NR6R8, могут быть получены путем взаимодействия амина HNR6R8 с фосгеном при применении или адаптации способа, описанногоH.TILLES, J.Am. Chem. Soc., 81, 714 (1959). Амины HNR6R8 имеются в продаже или могут быть получены путем взаимодействия первичного амина H2NR8 с производным ГалR6, в котором Гал означает атом галогена (например, как хлор, бром) и R6 имеет указанные в формуле (I) значения за исключением водорода. Эту реакцию обычно осуществляют в инертном растворителе, таком как диметилформамид, в присутствии триалкиламина (например, как триэтиламин), при температуре около 20 С. Соединения формулы (I), в которых R1 означает радикал -алк-CO-NR5R6, также могут быть получены путем взаимодействия соответствующего соединения формулы (I), в которомR1 означает радикал -алк-СООR4, или, когда R4 означает атом водорода, путем взаимодействия реакционно-способного производного этой кислоты с амином HNR5R6. Когда используют кислоту, то работают в присутствии агента конденсации, используемого в химии пептидов, такого как карбодиимид(например N,N'-дициклогексилкарбодиимид, 1(3-диметиламинопропил)-3-этилкарбодиимид) или N,N'-димидазолкарбонил, в инертном растворителе, таком как простой эфир (например тетрагидрофуран, диоксан), амид (диметилформамид) или хлорированный растворитель (например дихлорметан, 1,2-дихлорэтан, хлороформ), в случае необходимости в присутствии гидроксибензотриазола, при температуре от 0 С до температуры кипения с обратным холодильником реакционной смеси. Когда используют 6 сложный эфир, тогда работают либо в органической среде, в случае необходимости в присутствии акцептора кислоты, такого как органическое азотистое основание (например триалкиламин,пиридин, 1,8-диазабицикло/5.4.0/ундец-7-ен или 1,5-диазабицикло 4.3.0/нон-5-ен), в растворителе, таком как вышеуказанный, или в смеси этих растворителей или в низшем алифатическом спирте, при температуре от 0 С до температуры кипения с обратным холодильником реакционной смеси; либо в двухфазной водноорганической среде в присутствии гидроксида щелочного или щелочно-земельного металла в качестве основания (гидроксид натрия, гидроксид калия) или карбоната или гидрокарбоната щелочного или щелочно-земельного металла,при температуре от 0 до 40 С. Амины HNR5R6 имеются в продаже или могут быть получены путем взаимодействия первичного амина H2NR5 с производным ГалR6,в котором Гал означает атом галогена (например как хлор, бром), a R6 имеет указанные в формуле (I) значения за исключением водорода. Эту реакцию обычно проводят в инертном растворителе, таком как диметилформамид, в присутствии триалкиламина (например, как триэтиламин), при температуре около 20 С. Соединения формулы (I), в которых R1 означает радикал -алк(1 С)-NH2, также могут быть получены путем гидрирования производного формулы (VII): в которой R имеет указанные в формуле (I) значения. Это гидрирование обычно осуществляют с помощью водорода в инертном растворителе,таком как уксусная кислота, трифторуксусная кислота или смесь этих растворителей, в присутствии катализатора гидрирования, такого как палладий-на-угле, под давлением (около 50 бар), при температуре около 20 С. Производные формулы (VII) могут быть получены путем циклизации производного формулы (VIII): 7 Эту циклизацию обычно проводят в уксусной кислоте, при температуре кипения реакционной среды. Производные формулы (VIII) могут быть получены путем взаимодействия аммиака со сложным эфиром формулы (IX): в которой R имеет указанные в формуле (I) значения и "алк" означает алкильный радикал. Эту реакцию обычно проводят в инертном растворителе, таком как низший алифатический спирт (как, например, метанол, этанол), при температуре около 20 С. Производные формулы (IX) могут быть получены путем применения или адаптации метода, описанного в примерах. Специалисту понятно, что для осуществления способов согласно изобретению, которые описаны выше, может оказаться необходимым введение защитных групп для амино-, карбоксильной и спиртовой функций, чтобы избежать вторичных реакций. Эти группы представляют собой такие, которые могут быть удалены без затрагивания остальной части молекулы. В качестве примеров защитных групп для аминофункции можно назвать трет.-бутилкарбамат или метилкарбамат, которые могут быть регенерированы с помощью иодтриметилсилана, фталимидогруппы, которые могут быть регенерированы с помощью гидразина или метилгидразина или в кислой среде (например, в бромисто-водородной кислоте). В качестве защитных групп для карбоксильных функций можно назвать сложные эфиры (например, метоксиметиловый эфир, тетрагидропираниловый эфир, бензиловый эфир, трет.-бутиловый эфир), оксазолы и 2-алкил-1,3-оксазолины. В качестве защитных групп для спиртовых функций можно назвать сложные эфиры (например, бензиловый эфир),простые эфиры (метоксиэтоксиметил, тритил,тетрагидропиранил), которые могут быть регенерированы в кислой среде. Другие используемые защитные группы описываются W.Sons. Соединения формулы (I) можно очищать обычными известными методами, как например кристаллизация, хроматография или экстракция. Энантиомеры соединений формулы (I) могут быть получены путем разделения рацематов,например, путем хроматографии на колонке с хиральной фазой согласно W.H. PIRCKLE et(1983), или путем синтеза из хиральных предшественников. Диастереоизомеры соединений формулы(I) могут быть разделены обычными известными методами, например путем кристаллизации или хроматографии. Соединения формулы (I), содержащие основный остаток, в случае необходимости можно превращать в соли присоединения неорганической или органической кислоты путем воздействия такой кислоты в органическом растворителе, таком как спирт, кетон, простой эфир или хлорированный растворитель. Соединения формулы (I), содержащие кислотный остаток, в случае необходимости можно превращать в их соли металлов или в соли присоединения азотистых оснований известным способом. Эти соли можно получать путем взаимодействия металлического основания (например основания щелочного или щелочноземельного металла), аммиака, амина или соли амина с соединением формулы (I) в растворителе. Образовавшуюся соль отделяют обычными способами. Эти соли также составляют часть изобретения. В качестве примеров фармацевтически приемлемых солей можно назвать соли присоединения неорганических или органических кислот (такие как ацетат, пропионат, сукцинат,бензоат, фумарат, малеат, оксалат, метансульфонат, изотионат, теофиллинацетат, салицилат,метилен-бисоксинафтоат, хлоргидрат, сульфат, нитрат и фосфат), соли щелочных металлов(таких как натрия, калия, лития) или соли щелочно-земельных металлов (таких как кальция,магния), соль аммония, соли азотистых оснований (таких как этаноламин, триметиламин, метиламин, бензиламин, N-бензилфенетиламин,холин,аргинин,лейцин,лизин,Nметилглюкамин). Соединения формулы (I) обладают интересными фармакологическими свойствами. Эти соединения являются антагонистами рецептора-амино-3-гидрокси-5-метил-5-изоксазолпропионовой кислоты (АМПК), известного также под названием рецептора квисквалата. Кроме того, соединения формулы (I) являются неконкурентными антагонистами рецептора N-метил-D-аспартата (NMDA) и более предпочтительно являются лигандами модуляторных сайтов глицина рецептора NMDA. Эти соединения, следовательно, пригодны для лечения или профилактики всех видов ишемий (таких как очаговая или общая ишемия),являющихся результатом травм сосудов головного мозга, таких как тромбоэмболический приступ и геморрагический приступ, остановка сердца, артериальная гипотензия, хирургическое вмешательство в сердце, сосуды или легкие или тяжелая гипогликемия. Они также пригод 9 ны для лечения эффектов, возникающих вследствие аноксии, которая является перинатальной или результатом утопления, высокого давления или спинномозговых поражений. Эти соединения также могут быть использованы для лечения или предотвращения развития нейродегенеративных заболеваний, хореи Гентингтона, болезни Альцгеймера и других деменций,бокового амиотрофического склероза и других мотонейронных заболеваний,оливопонтоцеребеллярной атрофии и болезни Паркинсона. Эти соединения также могут быть использованы против эпилептогенных симптомов и/или конвульсивных симптомов, для лечения повреждений головного или спинного мозга, травм, связанных с дегенерацией внутреннего ухаPharmacol., 185, 1 (1990, шизофрении (REYNOLDS, TIPS, 13, 116 (1992, синдрома Туретта, гепатических энцефалопатий, расстройств сна, нарушений дефицита внимания, расстройств гормональных состояний (избыток выделения HG или HL, выделение кортикостерона); в качестве анальгетиков (DICKENSON и сотр., Neurosc. Letters, 121, 263. (1991, противовоспалительных средств (SLUTA и сотр.,Neurosci. Letters, 149, 99-102 (1993, антианорексических средств (SORRELS и сотр., Brain.Res. 572, 265 (1992, средств против мигреней,противорвотных средств; и для лечения отравлений нейротоксинами или другими агонистами рецептора NMDA или АМПК, также как неврологических расстройств, связанных с вирусными заболеваниями, такими как вирусные менингиты и энцефалиты, СПИД (LIPTON и сотр.,Neuron. 7, 111 (1991, бешенство, корь и столбняк (BAGETTA и сотр., Br. J. Pharmacol., 101,776 (1990. Эти соединения также пригодны для профилактики, устойчивости и зависимости при симптомах абстиненции к лекарствам (наркотикам), спирту, они ингибируют привыкание и зависимость от наркотиков, барбитуратов,амфетамина и бензодиазепинов. Их можно также использовать при лечении дефицитов, связанных с митохондриальными аномалиями, такими, как митохондриальная миопатия, синдром Лебера, геморрагический полиэнцефалит Вернике, синдром Ретта, гомоцистеинемия, гиперпролинемия,гидроксибутироаминоацидурия,свинцовая энцефалопатия (хроническая интоксикация свинцом) и при дефиците сульфитоксидазы. Сродство соединений формулы (I) по отношению к рецептору АМПК определяют путем изучения антагонизма специфической фиксации/3 Н/-АМПК на мембранах коры головного мозга крысы (HONORE и сотр., Neurscience Letters,54, 27 (1985. /3H/-АМПК инкубируют в при 000218 10 сутствии 0,2 мг протеинов в течение 30 мин при температуре 4 С в буфере, содержащем 10 ммоль КН 2 РO4, 100 ммоль KSCN, рН = 7,5. Неспецифическую фиксацию определяют в присутствии 1 ммоль L-глутамата. Часть со связанной радиоактивностью отделяют путем фильтрации на фильтрах PHARMACIA (штампованный фильтрующий материал А). Ингибирующая активность этих продуктов ниже или равна 100 мкмоль. Сродство соединений формулы (I) к глициновому сайту, связанному с рецепторомNMDA, определяют путем изучения антагонизма специфической фиксации /3H/-DCKA на мембранах коры головного мозга крысы по методу, описанному Т.CANTON и сотр., J. Pharm.Pharmacol., 44, 812 (1992). /3H/-DCKA (20 нмоль) инкубируют в присутствии 0,1 мг протеинов в течение 30 мин при температуре 4 С в буфере 50 мМ ГЕПЕС, рН = 7,5. Неспецифическую фиксацию определяют в присутствии 1 ммоль глицина. Часть со связанной радиоактивностью отделяют путем фильтрации через фильтры Ватман GF/B. Ингибирующая активность этих продуктов ниже или равна 100 мкмоль. Соединения формулы (I) обладают слабой токсичностью. Их ЛД 50 выше 50 мг/кг при введении интраперитонеально в случае мыши. Предпочтительными соединениями формулы (I) являются такие, в которых R означает атом водорода или карбоксильный радикал; R1 означает радикал -алк-NН-СО-R3, -алк-СООR4,-aлк-CO-NR5R6 или -CO-NH-R7, причем R3 означает алкильный радикал или радикал -NR6R8,R4 означает атом водорода, R5 означает атом водорода, R6 означает алкильный радикал, R7 означает фенилалкильный радикал или радикал-алк-СООR4. Из этих соединений предпочтительными являются следующие:- 9-(1-карбоксиэтил)-4,5-дигидро-4-оксо 10H-имидазо[1,2-а]-индено[1,2-е]пиразин-2 карбоновая кислота; их соли, их энантиомеры и диастереоизомеры. Следующие примеры иллюстрируют изобретение. Пример 1. К суспензии, находящейся в атмосфере аргона, из 3,09 г этилового эфира (4,5 дигидро-4-оксо-10 Н-имидазо[1,2-а]индено[1,2 е]пиразин-9-ил)уксусной кислоты в 150 мл диоксана, нагретой до 40 С, добавляют 37,5 мл 8 н соляной кислоты, затем смесь нагревают в течение 90 ч. Реакционную среду концентрируют досуха при пониженном давлении (15 мм рт.ст.; 2 кПа) при 40 С. Остаток после выпаривания обрабатывают с помощью 200 мл дистиллированной воды, перемешивают, отфильтровывают,промывают водой, затем два раза по 40 мл диизопропиловым эфиром и высушивают при пониженном давлении (1 мм рт.ст.; 0,13 кПа). Таким образом, полученный продукт (3,8 г) растворяют в 125 мл 0,1 н раствора гидроксида натрия с помощью ультразвука. Органическую фазу экстрагируют с помощью 25 мл этилацетата. Водную фазу обрабатывают 0,3 г растительной сажи, отфильтровывают, подкисляют с помощью 1,3 мл 1 н соляной кислоты. Выпавший осадок отфильтровывают, промывают водой,сушат при пониженном давлении (1 мм рт.ст.; 0,13 кПа) при 60 С. Продукт растворяют в 40 мл 12 0,1 н раствора гидроксида натрия, водную фазу отфильтровывают, затем разбавляют с помощью 60 мл дистиллированной воды и лиофилизируют. Таким образом получают 1,2 г (4,5-дигидро 4-оксо-10 Н-имидазо[1,2-а]-индено[1,2-е]пиразин-9-ил)-ацетата натрия в виде лиофилизата светло-бежевого цвета, т.пл. которого выше 260 С. Анализ для С 15H10N3NaO3: Рассчитано, %: С 59,41 Н 3,32 N 13,86 Найдено, %: 59,6 3,4 13,50 Пример 2. 10,15 г Этилового эфира 1-(4 этоксикарбонилметил-1-оксо-индан-2-ил)имидазол-2-карбоновой кислоты и 22 г ацетата аммония в 100 мл уксусной кислоты кипятят с обратным холодильником в течение 18 ч. После охлаждения до температуры около 20 С реакционную среду концентрируют досуха при пониженном давлении (15 мм рт.ст.; 2 кПа) при 40 С. Полученный продукт обрабатывают с помощью 200 мл дистиллированной воды, затем отфильтровывают и промывают 40 мл диизопропилового эфира. После высушивания при пониженном давлении (1 мм рт.ст.; 0,13 кПа) при 40 С получают 8,9 г твердого вещества светло-бежевого цвета. 1 г продукта суспендируют в 7 мл 0,1 н раствора гидроксида натрия .и 13 мл дистиллированной воды и перемешивают в течение 15 мин, после чего отфильтровывают,промывают водой, затем диизопропиловым эфиром и высушивают при пониженном давлении (15 мм рт.ст.; 2 кПа) при 20 С. Получают 0,95 г твердого вещества светло-бежевого цвета,которое очищают путем флэш-хроматографии на колонке с диоксидом кремния, используя смесь дихлорметана с метанолом в соотношении 90:10 по объему в качестве элюирующего средства. Получают 0,85 г твердого вещества бежевого цвета, которое суспендируют в 50 мл диэтилового эфира, затем отфильтровывают и высушивают при пониженном давлении (15 мм рт.ст.; 2 кПа) при 60 С. Таким образом получают 0,58 г этилового эфира (4,5-дигидро-4-оксо 10H-имидазо[1,2-а]индено[1,2-е]пиразин-9-ил) уксусной кислоты в виде твердого вещества бежевого цвета, т.пл. которого выше 260 С. Анализ для С 17 Н 15N3O3: Рассчитано, %: С 66,01 Н 4,89 N 13,58 Найдено, %: С 65,89 Н 4,80 N 13,20 Этиловый эфир 1-(4-этоксикарбонилметил-1-оксо-инден-2-ил)-имидазол-2-карбоновой кислоты может быть получен следующим образом. 12,7 г Этилового эфира (2-бром-1-оксоиндан-4-ил) уксусной кислоты, 6 г этил-1 Нимидазол-2-карбоксилата и 28,5 г карбоната калия в 250 мл ацетона кипятят с обратным холодильником в течение 3,5 ч в атмосфере аргона. После охлаждения до температуры около 20 С выпавший осадок отфильтровывают, затем промывают ацетоном. Фильтрат концентрируют досуха при пониженном давлении (15 мм рт.ст.; 13 2 кПа) при 40 С. Сырой продукт очищают путем флэш-хроматографии на колонке с диоксидом кремния, используя смесь этилацетата с дихлорметаном в объемном соотношении 50:50 в качестве элюирующего средства. Выделяют 10,15 г целевого продукта в виде коричневого масла, используемого как таковое на следующих синтезах. Этиловый эфир (2-бром-1-оксо-индан-4 ил) уксусной кислоты может быть получен следующим образом. К 10,45 г этилового эфира (1-оксо-индан-4 ил) уксусной кислоты в 130 мл дихлорметана в течение 10 мин добавляют 2,15 мл раствора брома в 20 мл дихлорметана при температуре около 5 С и в атмосфере аргона. Реакционную смесь оставляют стоять до повышения ее температуры примерно до 20 С и продолжают реакцию в течение 2 ч. Реакционную смесь выливают в 100 мл насыщенного раствора хлорида натрия. Органическую фазу промывают два раза по 100 мл дистиллированной водой перед высушиванием и затем концентрируют с получением 12,7 г целевого продукта в виде коричневого масла, используемого таким в последующих синтезах. Этиловый эфир (1-оксо-индан-4-ил) уксусной кислоты может быть получен следующим образом. К 9,4 г (1-оксо-индан-4-ил) уксусной кислоты в 200 мл дихлорметана при комнатной температуре и в атмосфере аргона добавляют 4,7 мл оксалилхлорида. После перемешивания в течение 4 ч при температуре около 20 С добавляют 40 мл этанола к реакционной среде и продолжают перемешивание в течение 1 ч. Органическую фазу промывают 2 раза по 25 мл насыщенным раствором гидрокарбоната натрия, затем 2 раза по 100 мл дистиллированной водой,после чего сушат и концентрируют с получением 10,45 г целевого продукта в виде коричневого масла, используемого таким в последующих синтезах.(1-0 ксо-индан-4-ил) уксусная кислота может быть получена следующим образом. 43 г 3-(2-Карбоксиметил-фенил) пропионовой кислоты в 250 мл 95%-ной серной кислоты нагревают при 100 С в течение 18 ч. После охлаждения до температуры около 20 С реакционную смесь выливают в 1000 мл воды со льдом. Среду экстрагируют три раза по 400 мл этилацетатом и органическую фазу промывают водой, сушат, концентрируют с получением 9,56 г твердого вещества оранжевого цвета. Таким образом полученный продукт суспендируют в 50 мл петролейного эфира, отфильтровывают,затем промывают с помощью 25 мл диизопропилового эфира, сушат при пониженном давлении (1 мм рт.ст.; 0,13 кПа) при 60 С с получением 6,7 г твердого вещества оранжево-желтого цвета, плавящегося при 160 С. 14 3-(2-Карбоксиметилфенил) пропионовая кислота может быть получена следующим образом. 39,6 г 3-(2-Карбоксиметилфенил) акриловой кислоты в присутствии 3 г 10%-ного палладия-на-угле в 400 мл уксусной кислоты гидрируют при температуре около 20 С при давлении 1,2 бар в течение 4 ч. После отфильтровывания реакционной среды органическую фазу концентрируют при пониженном давлении (15 мм рт.ст.; 2 кПа) при 40 С. Полученное твердое вещество белого цвета суспендируют в 100 мл петролейного эфира, затем отфильтровывают и высушивают при пониженном давлении (1 мм рт.ст.; 0,13 кПа) при 20 С с получением 39,3 г твердого вещества белого цвета с т.пл. 138 С. 3-(2-Карбоксиметилфенил) акриловая кислота может быть получена следующим образом. 63,8 г 2-Бромфенилуксусной кислоты, 25,5 мл акриловой кислоты, 3,6 г три(2-толил) фосфина, 0,67 г ацетата палладия в 211 мл трибутиламина нагревают в течение 6 ч при температуре 100 С. После охлаждения до температуры вблизи 20 С реакционную среду выливают в 420 мл воды и 80 мл концентрированной соляной кислоты. Среду экстрагируют 3 раза по 500 мл этилацетатом; ограническую фазу отфильтровывают, промывают 3 раза по 500 мл водой,затем в течение 15 мин при температуре около 20 С перемешивают в присутствии 800 мл воды и 35 г карбоната натрия. Водную фазу затем подкисляют с помощью 700 мл 1 н соляной кислоты. Выпавший осадок отфильтровывают,промывают водой, затем высушивают при пониженном давлении (1 мм рт.ст.; 0,13 кПа) при 60 С с получением 39,6 г твердого вещества белого цвета, плавящегося при 190 С. Пример 3. Раствор 0,93 г этилового эфира[1,2-е]пиразин-9-ил)уксусной кислоты, 20 мл метиламина в виде 33%-ного раствора в этаноле и 20 мл метанола в атмосфере аргона перемешивают в течение 18 ч при температуре около 20 С. Реакционную среду отфильтровывают. Полученный осадок промывают последовательно три раза по 40 мл этанолом, три раза по 40 мл метил-трет.-бутиловым эфиром и высушивают при пониженном давлении (15 мм рт.ст.; 2 кПа) при 20 С. Полученное твердое вещество суспендируют в смеси ацетона (25 мл) с метанолом (5 мл) и перемешивают в течение 15 мин, затем отфильтровывают, промывают с помощью 10 мл ацетона и высушивают при пониженном давлении (1 мм рт.ст.; 0,13 кПа) при 60 С. Получают 0,32 г N-метил-2-(4,5-дигидро-4-оксо 10 Н-имидазо[1,2-а]индено[1,2-е]пиразин-9-ил) ацетамида в виде твердого вещества белого цвета, т.пл. которого выше 260 С. Анализ для C16H14N4O2: Рассчитано, %: С 65,30 Н 4,79 N 19,04 Найдено, %: 65,00 4,50 18,80 15 Пример 4. Раствор 0,56 г (4,5-дигидро-4 оксо-10 Н-имидазо[1,2-а]-индено[1,2-е]пиразин 9-ил)уксусной кислоты, 0,38 г 1-(3-диметиламинопропил)-3-этилкарбодиимид-гидрохлорида, 0,27 г гидроксибензотриазола и 1,1 мл анилина в 20 мл диметилформамида перемешивают в течение 20 ч при температуре около 20 С в атмосфере аргона. К реакционной смеси добавляют 20 мл соляной кислоты. Выпавший осадок отфильтровывают , промывают водой и диизопропиловым эфиром, затем высушивают при пониженном давлении (15 мм рт.ст.; 2 кПа) при 20 С. Полученное твердое вещество бежевого цвета суспендируют в растворе из 20 мл воды и 84 мг гидрокарбоната натрия, затем отфильтровывают, промывают водой. Полученное твердое вещество снова суспендируют в 10 мл 0,1 н соляной кислоты, после чего отфильтровывают, промывают водой и высушивают при пониженном давлении (1 мм рт.ст.; 0,13 кПа) при 60 С. Получают 0,2 г N-фенил-2-(4,5-дигидро-4 оксо-10 Н-имидазо[1,2-а]индено[1,2-е]-пиразин 9-ил)ацетамида в виде твердого вещества белого цвета, плавящегося при температуре выше 260 С. Анализ для C21H16N4O2: Рассчитано, %: С 70,77 Н 4,53 N 15,72 Найдено, %: 70,74 4,39 15,64 Пример 5. Смесь из 0,25 г 9-циано-5 Н,10Hимидазо[1,2-а]индено-[1,2-е]пиразин-4-она, 10 мл уксусной кислоты, 10 мл трифторуксусной кислоты и 20 мг 10%-ного палладия-на-угле гидрируют в автоклаве под давлением 50 бар в течение 20 ч. Суспензию отфильтровывают,промывают уксусной кислотой. Фильтрат концентрируют досуха при пониженном давлении(15 мм рт.ст.; 2 кПа) при 40 С. Полученное твердое вещество растворяют в смеси из 50 мл уксусной кислоты и 10 мл концентрированной соляной кислоты, затем снова концентрируют досуха при пониженном давлении (15 мм рт.ст.; 2 кПа) при 40 С. Полученный остаток обрабатывают с помощью 25 мл метанола, отфильтровывают, затем промывают два раза по 25 мл диизопропиловым эфиром и высушивают при пониженном давлении (1 мм рт.ст.; 0,13 кПа) при 20 С. Получают 0,24 г 9-аминометил 5 Н,10H-имидазо-[1,2-а]индено[1,2-е]пиразин-4 он-дигидрохлорида в виде твердого вещества белого цвета, плавящегося выше 260 С. Анализ для С 14 Н 14Cl2N4O: Рассчитано, %: С 51,71 Н 4,34 N 17,23 Найдено, %: 52,11 4,53 17,04 9-Циано-5 Н,10H-имидазо[1,2-а]индено[1,2-е]пиразин-4-он может быть получен следующим образом. 1 г 1-(4-Циано-1-оксо-индан-2-ил)имидазол-2-карбоксамида растворяют в 10 мл уксусной кислоты и раствор кипятят с обратным холодильником в течение 22 ч. После охлаждения реакционной среды суспензию отфильтровывают, промывают с помощью 5 мл уксусной 16 кислоты, дистиллированной воды и диэтилового эфира. Твердое вещество высушивают при пониженном давлении (15 мм рт.ст.; 2 кПа) при 30 С; таким образом получают 0,4 г 9-циано 5 Н,10H-имидазо[1,2-а]индено[1,2-е]пиразин-4 она с т.пл. выше 260 С. Анализ для C14H8N4O0,21 Н 2 О: Рассчитано,%: С 67,74 Н 3,25 N 22,57 О 6,45 68,1 3,3 22,6 6,7 1-(4-Циано-1-оксо-индан-2-ил)имидазол-2 карбоксамид может быть получен следующим образом. Раствор 1,5 г этил-1-(4-циано-1-оксоиндан-2-ил)имидазол-2-карбоксилата в 130 мл метанола насыщают в течение часа при температуре около 20 С током газообразного аммиака. Реакционную смесь затем концентрируют досуха при пониженном давлении (15 мм рт.ст.; 2 кПа) при 50 С. Таким образом получают 1,2 г 1-(4-циано-1-оксо-индан-2-ил)имидазол-2 карбоксамида с т.пл. 216 С. Этил-1-(4-циано-1-оксо-индан-2-ил)имидазол-2-карбоксилат может быть получен следующим образом. Смесь из 3,92 г этил-имидазол-2 карбоксилата и 3,4 г 2-бром-4-циано-1-инданона нагревают в течение 20 мин при 130 С, охлаждают до 20 С и растворяют в 20 мл дихлорметана. Среду затем концентрируют досуха при пониженном давлении (15 мм рт.ст.; 2 кПа) при 40 С. Таким образом полученный остаток очищают путем флэш-хроматографии на колонке с диоксидом кремния, в токе азота со средним давлением (0,5 бара), с помощью смеси дихлорметана с метанолом в объемном соотношении 95:5 в качестве элюирующего средства. Таким образом получают 1,5 г этил-1-(4-циано-1-оксоиндан-2-ил)имидазол-2-карбоксилата с т.пл. 159 С. 2-Бром-4-циано-1-инданон может быть получен следующим образом. Раствор 6,9 г 4-циано-1-инданона в 95 мл хлороформа охлаждают до 5 С. Затем в течение 2 ч и при температуре 0-5 С прикапывают раствор 7,04 г брома в 20 мл хлороформа. После перемешивания реакционной среды в течение часа при поддерживании вышеуказанной температуры раствор оставляют стоять для повышения его температуры до комнатной и перемешивают еще в течение ночи. Реакционную среду затем концентрируют досуха при пониженном давлении (15 мм рт.ст.; 2 кПа) при 40 С. Таким образом полученный остаток очищают путем флэш-хроматографии на колонке с диоксидом кремния, в токе азота при среднем давлении (0,5 бар), с помощью смеси диэтилового эфира с циклогексаном в объемном соотношении 20:80 в качестве элюирующего средства. Таким образом, получают 3,43 г 2-бром-4-циано-1 инданона с т.пл. 124 С. 4-Циано-1-инданон может быть получен следующим образом. 17 К раствору 10 г 4-бром-1-инданона в 94 мл диметилформамида добавляют 12,61 г цианида меди, затем реакционную среду кипятят с обратным холодильником в течение 6 ч и перемешивают при температуре около 20 С в течение ночи. Раствор затем выливают в водный раствор цианида натрия (5%-ный), перемешивают в течение 15 мин и экстрагируют три раза по 500 мл этилацетата. Органические фазы сушат над сульфатом натрия и концентрируют при пониженном давлении (15 мм рт.ст.; 2 кПа) при 40 С. Таким образом полученный остаток очищают путем флэш-хроматографии на колонке с диоксидом кремния, в токе азота со средним давлением (0,5 бара), с помощью смеси этилацетата с циклогексаном в соотношении по объему 20:80 в качестве элюирующего средства. Таким образом, получают 5,9 г 4-циано-1-инданона с т.пл. 122 С. 4-Бром-1-инданон может быть получен как описано F.G.HOLLIMAN, F.G.MANNE иD.A.THORNTON, J. Chem, Soc. 9 (1960). Пример 6. Смесь из 1 г 9-аминометил 5 Н,10 Н-имидазо[1,2-а]индено-[1,2-е]пиразин-4 она и 20 мл уксусного ангидрида перемешивают в атмосфере аргона в течение 2 ч при температуре около 20 С. Реакционную смесь отфильтровывают, нерастворимую часть промывают последовательно 10 мл уксусного ангидрида,два раза по 40 мл метил-трет.-бутиловым эфиром, затем сушат при пониженном давлении (15 мм рт.ст.; 2 кПа) при 20 С. Твердое вещество белого цвета суспендируют в смеси из 30 мл ацетона и 5 мл метанола, затем отфильтровывают и высушивают при пониженном давлении (1 мм рт.ст.; 0,13 кПа) при 60 С. Получают 1,03 гN-[(4,5-дигидро-4-оксо-10 Н-имидазо[1,2-а]индено[1,2-е]пиразин-9-ил)ме-тил]ацетамида в виде твердого вещества белого цвета, температура плавления которого выше 260 С. Анализ для С 16H14N4O2: Рассчитано, %: С 65,30 Н 4,79 N 19,04 Найдено, %: 65,20 5,10 19,30 Пример 7. Суспензию из 0,25 г 9 аминометил-5 Н,10H-имидазо[1,2-а]-индено[1,2 е]пиразин-4-она, 0,49 г 4-нитрофенил-Nметилкарбамата и 10 мл диметилформамида перемешивают в течение 4 ч при температуре около 20 С в атмосфере аргона. Реакционную среду отфильтровывают, промывают последовательно с помощью 5 мл диметилформамида, два раза по 20 мл метил-трет.-бутилового эфира,затем высушивают при пониженном давлении(1 мм рт.ст.; 0,13 кПа) при 60 С. Получают 0,2 г 9-[(3-метилуреидо)метил]-5 Н, 10H-имидазо[1,2 а]индено[1,2-е]-пиразин-4-она в виде твердого вещества белого цвета с температурой плавления выше 260 С. Анализ для С 16 Н 15N5O2: Рассчитано, %: С 62,13 Н 4,89 N 22,64 Найдено, %: 62,03 4,90 22,26 18 Пример 8. Смесь 24,5 г этил-1-(5 этоксикарбонилметил)-1-оксо-индан-2-ил)имидазол-2-карбоксилата и 236,5 г ацетата аммония в 1 л уксусной кислоты в течение 8 ч кипятят с обратным холодильником. После выпаривания уксусной кислоты при пониженном давлении к остатку добавляют 1 л дистиллированной воды. Нерастворимую часть отфильтровывают, промывают водой, затем высушивают на воздухе. Таким образом получают 10,6 г твердого вещества серого цвета. После перекристаллизации из 175 мл этанола образца этого твердого вещества массой 0,8 г и высушивания при 60 С при пониженном давлении (1 мбар) получают 0,65 г этил-(4,5-дигидро-4-оксо-10 Н-имидазо[1,2 а]индено[1,2-е]пиразин-8-ил)ацетата в виде твердого вещества каштанового цвета, т.пл. которого выше 260 С. Анализ: Рассчитано,%: С 66,01 Н 4,89 N 13,58 О 15,52 Найдено, %: 65,8 5,1 13,20 15,5 Этил-1-(5-этоксикарбонилметил-1-оксоиндан-2-ил)имидазол-2-карбоксилат может быть синтезирован следующим образом. Суспензию из 47 г этил-имидазол-2 карбоксилата и 50 г смеси в молярном соотношении 60:40 2-бром-5-этоксикарбонилметилиндан-1-она и 2,2-дибром-5-этоксикарбонилметилиндан-1-она в 1,5 л толуола кипятят с обратным холодильником в течение 26 ч в токе азота. Растворитель выпаривают при пониженном давлении и сырую реакционную смесь обрабатывают смесью 1,5 л дихлорметана с 500 мл дистиллированной воды. Водную фазу удаляют, а органическую фазу промывают последовательно три раза по 500 мл дистиллированной водой, один раз 500 мл насыщенного раствора карбоната калия и один раз 500 мл дистиллированной воды, затем ее сушат над сульфатом магния и растворитель выпаривают при пониженном давлении. После очистки остатка с помощью флэш-хроматографии на колонке с диоксидом кремния (элюирующее средство: смесь дихлорметана с этилацетатом в объемном соотношении 1:1) получают 21,3 г этил 1-(5-этоксикарбонилметил-1-оксо-индан-2 ил)имидазол-2-карбоксилата в виде твердого вещества каштанового цвета с чистотой 70% и используют таким, какой есть, в последующих стадиях.Rf = 0,35; тонкослойная хроматография на силикагеле; элюирующее средство: смесь этилацетата с дихлорметаном в объемном соотношении 1:1; 1 Н-ЯМР-спектр (дейтерохлороформ; температура 27 С;в м.д. (миллионные доли): 1,20(3 Н, т, J =6 Гц, СН 3); 1,28 (3 Н, т, J= 6 Гц, CH3); 3,20 и 3,76 (1 Н каждый, соответственно дд, J = 6 и 16 Гц, и дд, J= 8 и 16 Гц, СН 2); 3,67 (2 Н, с,СН 2); 4,10 (2 Н, к, J=6 Гц, ОСН 2); 4,23 (2 Н, к, J=6 Гц, ОСН 2); 5,81 (1 Н, т, J=6 Гц, СН); 6,99 (1 Н, с, 19 СН); 7,13 (1 Н, с, СН); 7,32 (1 Н, д, J =7 Гц, СН); 7,37 (1 Н, с, СН); 7,71 (1 Н, д, J= 7 Гц, СН). Этил-имидазол-2-карбоксилат может быть получен как описано в патенте США 3600399. 2-Бром-5-этоксикарбонилметилиндан-1-он может быть получен следующим образом. К раствору 38 г 5-этоксикарбонилметилиндан-1-она в смеси из 175 мл дихлорметана и 350 мл абсолютированного этанола, поддерживаемому при температуре 5-10 С, прикапывают 8,9 мл брома в виде раствора в 87 мл дихлорметана. Реакцию продолжают в течение 1,5 ч при температуре 5-10 С, затем в течение 15 мин при температуре около 20 С. Реакционную среду затем выпаривают и остаток обрабатывают с помощью 500 мл дихлорметана. Органическую фазу промывают последовательно три раза по 200 мл дистиллированной водой, один раз с помощью 200 мл насыщенного раствора гидрокарбоната натрия и два раза по 200 мл дистиллированной водой, затем сушат над сульфатом магния и выпаривают. Таким образом получают 50,1 г смеси 2-бром-5 этоксикарбонилметилиндан-1-она (Rf = 0,41; тонкослойная хроматография на силикагеле,элюирующее средство: дихлорметан) и 2,5 дибром-5-этоксикарбонилметилиндан-1-она (Rf= 0,59; тонкослойная хроматография на силикагеле, элюирующее средство: дихлорметан), используемой такой, какая есть, для последующего синтеза (молярное соотношение монобромированного соединения к дибромированному соединению составляет 60:40). 1 Н-ЯМР-спектр 2-бром-5-этоксикарбонилметилиндан-1-она(1 Н, дд, J = 4 и 7 Гц, СН); 7,30-7,45 (2 Н, м, Н ароматические); 7,79 (1 Н, д, J=7 Гц, Н ароматический). 5-Этоксикарбонилметилиндан-1-он может быть получен следующим образом. Раствор 39,9 г (1-оксо-индан-5-ил) уксусной кислоты и 79,8 мл метансульфокислоты в 720 мл абсолютированного этанола кипятят с обратным холодильником в течение 2 ч. Этанол выпаривают и остаток обрабатывают с помощью 500 мл дихлорметана. Таким образом полученную органическую фазу промывают последовательно 4 раза по 200 мл дистиллированной водой, один раз с помощью 200 мл водного насыщенного раствора гидрокарбоната натрия и один раз с помощью 200 мл дистиллированной воды, сушат над сульфатом магния и выпаривают. Таким образом получают 41,5 г этил-(1 оксо-индан-5-ил)ацетата в виде твердого вещества кремового цвета. 1 Н-ЯМР-спектр (дейтерохлороформ, температура 27 С)в м.д. = 1,25(1-Оксо-индан-5-ил) уксусная кислота может быть получена следующим образом. Раствор 50,9 г этил-[4-(3-хлор-1-оксопропил)фенил]ацетата в 950 мл 95%-ной серной кислоты нагревают в течение 1 ч при 100 С. Реакционную среду охлаждают до температуры около 20 С, после чего выливают в 4 л воды со льдом. Смесь экстрагируют три раза по 1,5 л дихлорметаном. Органическую фазу промывают три раза по 1 л воды, затем сушат над сульфатом магния и выпаривают при пониженном давлении. Таким образом получают 22,2 г (1-оксоиндан-5-ил) уксусной кислоты в виде твердого вещества кремового цвета с т.пл. = 141 С. 1 Н-ЯМР-спектр (дейтерохлороформ, температура 27 С)в м.д. = 2,70 (2 Н, м, СОСН 2); 3,12 (2 Н, т, J = 5 Гц, СН 2); 3,68 (2 Н, с, СН 2) ; 7,27 (1 Н, д, J = 7 Гц, СН ароматический); 7,45(1 Н, с, СН ароматический); 7,76 (1 Н, д, J = 7 Гц,СН ароматический). Этил-[4-(3-хлор-1-оксопропил)фенил] ацетат может быть получен следующим образом. К суспензии из 1,5 кг хлорида алюминия в 3,5 л дихлорметана прикапывают, так чтобы температура реакционной среды не превышала 25 С, раствор 600 г этилфенилацетата и 384 мл 3-хлорпропионилхлорида в 1 л дихлорметана. После протекания реакции в течение 24 ч при температуре около 20 С реакционную смесь выливают в 8 л воды со льдом. Органическую фазу декантируют, а водную фазу экстрагируют два раза 2 л дихлорметана. Органические фазы объединяют, промывают 4 раза по 2 л дистиллированной водой, сушат над сульфатом магния и выпаривают. После фильтрации остатка через колонку с диоксидом кремния (элюирующее средство: дихлорметан) получают 605 г масла,которое кристаллизуется. После промывки абсолютированным этанолом и высушивания получают 82 г этил[4-(3-хлор-1 оксопропил)фенил]ацетата в виде твердого вещества белого цвета с т.пл. 69 С. 1 Н-ЯМР-спектр (дейтерохлороформ, температура 27 С)в м.д.= 1,26 (3 Н, т, J = 6 Гц,CH3); 3,43 (2 Н, т, J = 6 Гц, СН 2 О); 3,68 (2 Н, с,СН 2); 3,92 (2 Н, T, J = 6 Гц, СН 2); 4,16 (2 Н, к, J= 6 Гц, ОСН 2); 7,40 (2 Н, д, J = 7 Гц, СН ароматические); 7,92 (2 Н, J = 7 Гц, СН ароматические). Пример 9. Суспензию 0,5 г этил-[4,5 дигидро-4-оксо-10 Н-имидазо-[1,2-а]индено[1,2 е]пиразин-8-ил]ацетата в 50 мл 6 н соляной кислоты кипятят с обратным холодильником в течение 2 ч. Смесь разбавляют с помощью 25 мл 1,4-диоксана и продолжают кипятить с обратным холодильником в течение 4 ч. После возвращения к температуре около 20 С образовавшееся твердое вещество отфильтровывают, 21 промывают с помощью 5 мл 1,4-диоксана, после чего сушат при пониженном давлении (1 мбар) при 60 С. Таким образом получают 0,47 г [4,5 дигидро-4-оксо-10H-имидазо[1,2-а]индено[1,2 е]пиразин-8-ил]уксусной кислоты в виде гидрохлорида-моногидрата, температура плавления которого выше 260 С. Анализ: Рассчитано, % С: 56,7 Н 3,81 Сl 11,16 N 13,23 Найдено, %: 56,7 3,9 10,9 12,9 Пример 10. Смесь из 0,618 г этил-(4,5 дигидро-4-оксо-10 Н-имидазо-[1,2-а]индено[1,2 е]пиразин-8-ил)ацетата и 10 мл бензиламина нагревают при 140 С в течение 17 ч в атмосфере азота. После возвращения к комнатной температуре реакционную среду разбавляют 50 мл дихлорметана. Выпавшее в осадок твердое вещество отфильтровывают, промывают дихлорметаном, затем перекристаллизуют из 25 мл диметилформамида. Таким образом, после высушивания при пониженном давлении (1 мбар) при 60 С, получают 0,65 г N-бензил-2-(4,5-дигидро 4-оксо-10 Н-имидазо-[1,2-а]индено [1,2-е]пиразин-8-ил)ацетамида с т.пл. выше 260 С. Анализ: Рассчитано, %: С 71,34 Н 4,90 N 15,13 О 8,64 Найдено, %: 71,1 5,0 15,2 9,1 Пример 11. Суспензию из 2,9 г гидрохлорида (4,5-дигидро-4-оксо-10H-имидазо [1,2 а]индено[1,2-е]пиразин-8-ил)уксусной кислоты и 108 мл диметилформамида смешивают в атмосфере азота с 1,21 мл триэтиламина. После перемешивания в течение 30 мин при температуре около 20 С к реакционной смеси добавляют 3,5 г 1,1'-карбонилдиимидазола и продолжают перемешивание в течение 2 ч при температуре около 20 С. Затем реакционную смесь охлаждают до -10 С и в течение 15 мин в смесь пропускают ток газообразного аммиака. После возвращения температуры к величине около 20 С реакционную среду концентрируют досуха при пониженном давлении. Остаток после выпаривания обрабатывают с помощью 100 мл дистиллированной воды и находящееся в виде суспензии твердое вещество отфильтровывают,промывают водой, затем растворяют в 125 мл диметилсульфоксида. Добавление 250 мл ацетона к раствору вызывает выпадение осадка, который собирают путем отфильтровывания, промывают ацетоном и высушивают при пониженном давлении (1 мбар) при 60 С. Таким образом получают 1,1 г (4,5-дигидро-4-оксо-10Hимидазо[1,2-а]индено[1,2-е]пиразин-8-ил)ацетамида в виде твердого вещества бежевого цвета, температура плавления которого выше 260 С. Анализ: Рассчитано,%: С 64,28 Н 4,32 N 19,99 О 11,42 Найдено, %: 63,9 4,3 19,8 10,9 Пример 12. Смесь из 1,8 г этил-1-(5-Nметилкарбоксамидометил-1-оксо-индан-2-ил) имидазол-2-карбоксилата и 20,9 г ацетата аммо 000218 22 ния в 88 мл уксусной кислоты в течение 2 ч кипятят с обратным холодильником. Реакционную смесь концентрируют досуха при пониженном давлении. Остаток после выпаривания обрабатывают с помощью 100 мл дистиллированной воды. Суспендированное твердое вещество отфильтровывают, промывают дистиллированной водой, затем перекристаллизуют из 25 мл уксусной кислоты. После высушивания при пониженном давлении (1 мбар) при 60 С получают 0,75 гN-метил-(4,5-дигидро-4-оксо-10Hимидазо[1,2-а]индено[1,2-е]пиразин-8-ил)ацетамида в виде твердого вещества бежевого цвета с т.пл. выше 260 С. Анализ: Рассчитано, %: С 65,30 Н 4,79 N 19,04 О 10,87 Найдено, %: 65,5 4,8 18,9 11,2 Этил-1-(5-N-метилкарбоксамидометил-1 оксо-индан-2-ил)имидазол-2-карбоксилат может быть получен следующим образом. Смесь 1,44 г этил-имидазол-2 карбоксилата, 3,55 г карбоната калия и 68 мг краун-эфира 18 С-6 в 130 мл диметилформамида нагревают в течение 2 ч при температуре 85 С, затем охлаждают до 20 С. В реакционную среду затем добавляют раствор 2,9 г N-метил-(2 бром-1-оксо-индан-5-ил)ацетамида. Реакцию продолжают в течение 16 ч при температуре около 20 С, затем в течение 1 ч при 80 С. Диметилформамид удаляют при пониженном давлении и остаток обрабатывают с помощью 100 мл дистиллированной воды и 200 мл этилацетата. Водную фазу экстрагируют 4 раза по 200 мл этилацетатом. Органические фазы объединяют,промывают 4 раза по 100 мл водой, сушат над сульфатом магния и выпаривают. Таким образом получают 1,4 г этил-1-(5-Nметилкарбоксамидометил-1-оксо-индан-2-ил) имидазол-2-карбоксамида в виде коричневого цвета твердого вещества. (Rf = 0,39, тонкослойная хроматография на силикагеле; элюирующее средство: смесь этилацетата с метанолом в объемном соотношении 8:2).N-Метил-(2-бром-1-оксо-индан-5-ил)ацетамид может быть синтезирован следующим образом. Раствор 9 г N-метил-(1-оксо-индан-5 ил)ацетамида в 200 мл дихлорметана и 500 мл абсолютированного этанола охлаждают до температуры в пределах 0-5 С. К реакционной среде прикапывают так, чтобы температура не превышала 5 С, 7,1 г брома, разбавленного в 100 мл дихлорметана. После перемешивания в течение полутора часов при температуре около 20 С растворитель выпаривают при пониженном давлении. Сырой остаток очищают путем флэшхроматографии на диоксиде кремния (элюирующее средство: смесь дихлорметана с метанолом в объемном соотношении 96:4). Таким образом получают 7,8 г N-метил(2-бром-1-оксоиндан-5-ил)ацетамида в виде твердого вещества белого цвета с т.пл. 184 С.N-Метил(1-оксо-индан-5-ил)ацетамид может быть получен следующим образом. В раствор 12,5 г (1-оксоиндан-5-ил)уксусной кислоты в 250 мл тетрагидрофурана,поддерживаемый при температуре 0 С, порциями добавляют 16 г N,N'-карбонилдиимидазола. После протекания реакции в течение 1 ч при температуре около 20 С раствор охлаждают до-10 С и в смесь в течение 5 мин пропускают ток монометиламина. После возвращения к температуре около 20 С реакционную среду выпаривают при пониженном давлении. Остаток обрабатывают с помощью 1 л дихлорметана. Органическую фазу промывают три раза по 500 мл дистиллированной водой, сушат над сульфатом магния, затем выпаривают. Полученное твердое вещество коричневого цвета очищают путем флэш-хроматографии на диоксиде кремния(элюирующее средство: смесь дихлорметана с метанолом в объемном соотношении 96:4). Таким образом получают 9 г N-метил-(1 оксоиндан-5-ил)ацетамида в виде твердого вещества белого цвета с т.пл. 169 С. 1 Н-ЯМР-спектр (дейтерохлороформ, температура 27 С)в м.д. = 2,69 (2 Н, м, СОСН 2); 2,80 (3 Н, д, NCH3); 3,14 (2 Н, т, J= 5 Гц, СН 2); 3,65 (2 Н, с, СН 2); 5,47 (1 Н, уш.с, NH); 7,26 (1 Н,д, J = 7 Гц, СН аром.); 7,42 (1 Н, с, СН аром.); 7,74 (1H, д, J = 7 Гц, СН аром.). Пример 13. Суспензию из 1 г этил-8-Nметилкарбоксамидометил-4,5-дигидро-4-оксо 10H-имидазо[1,2-а]индено[1,2-е]пиразин-2 карбоксилата, 97 мл 1,4-диоксана и 24 мл дистиллированной воды в атмосфере азота солюбилизируют путем добавления 7,26 мл 1 н раствора гидроксида натрия. Смесь перемешивают в течение 18 ч при температуре около 20 С. Реакционную среду подкисляют 1 н соляной кислотой до рН = 1. Полученное твердое вещество отфильтровывают, промывают последовательно 1,4-диоксаном, дистиллированной водой и диэтиловым эфиром. После высушивания при пониженном давлении (1 мбар) при 60 С получают 0,75 г 8-N-метилкарбоксамидометил-4,5 дигидро-4-оксо-10H-имидазо[1,2-а]индено[1,2 е]пиразин-2-карбоновой кислоты в виде твердого вещества желтого цвета с т.пл. выше 260 С. Анализ: Рассчитано, %: С 60,35 Н 4,17 N 16,56 Найдено, %: 60,4 4,1 16,6 Этил-8-N-метилкарбоксамидометил-4,5 дигидро-4-оксо-10 Н-имидазо[1,2-а]индено[1,2 000218 24 е]пиразин-2-карбоксилат может быть синтезирован следующим образом. Смесь 3,4 г диэтил-1-[5-(Nметилкарбоксамидометил)-1-оксоиндан-2-ил] имидазол-2,4-дикарбоксилата и 33,2 г ацетата аммония в 137 мл ледяной уксусной кислоты кипятят с обратным холодильником в течение 16 ч. После удаления растворителя путем выпаривания при пониженном давлении к остатку добавляют 100 мл дистиллированной воды. Выпавший осадок собирают путем отфильтровывания, затем промывают с помощью 50 мл дистиллированной воды и 50 мл ацетона. Таким образом получают 2 г этил-4,5-дигидро-8-Nметилкарбоксамидометил-4-оксо-10H-имидазо[1,2-а]индено[1,2-е]пиразин-2-карбоксилата в виде твердого вещества бежевого цвета с т.пл. выше 260 С. Диэтил-1-[5-(N-метилкарбоксамидометил)1-оксоиндан-2-ил]имидазол-2,4-дикарбоксилат может быть получен следующим образом. Смесь из 2,6 г диэтил-имидазол-2,4 дикарбоксилата, 4,2 г карбоната калия и 79 мг краун эфира 18 С-6 в 150 мл диметилформамида нагревают 2 ч при 85 С, затем охлаждают до температуры около 20 С. Затем к реакционной среде добавляют раствор 3,4 г N-метил(2-бром 1-оксо-индан-5-ил)ацетамида в 75 мл диметилформамида. Реакцию продолжают в течение 16 ч при температуре около 20 С. Диметилформамид удаляют при пониженном давлении и остаток обрабатывают 150 мл дистиллированной воды и 200 мл этилацетата. Органическую фазу декантируют, а водную фазу экстрагируют 4 раза по 200 мл этилацетатом. Органические фазы объединяют, промывают три раза по 100 мл дистиллированной водой, сушат над сульфатом магния и выпаривают. Таким образом получают 2,9 г диэтил-1-[5-(N-метилкарбоксамидометил)1-оксо-индан-2-ил]имидазол-2,4-дикарбоксилата в виде твердого вещества кремового цвета. 1 Н-ЯМР-спектр (дейтерированный диметилсульфоксид, температура 27 С)в м.д. = 1,25 (3 Н, т, J = 6 Гц, CH3); 1,37 (3 Н, т, J = 6 Гц,CH3); 2,66 (3 Н, д, J = 4 Гц, NCH3); 3,49 и 3,80(2 Н, к, J= 6 Гц, ОСН 2); 4,37 (2 Н, к, J = 6 Гц,ОСН 2); 5,90 (1 Н, дд, J = 6 и 8 Гц, СН); 7,47 (1 Н,д, J = 7 Гц, СН); 7,55 (1 Н, с, СН); 7,76 (1 Н, д, J = 7 Гц, СН) ; 8,17 (1H, с, NH); 8,40 (1H, с, СН) . Диэтил-имидазол-2,4-дикарбоксилат может быть синтезирован как описано P.S.(1992). Пример 14. Смесь 0,5 г этил-8-(Nметилкарбоксамидометил)-4,5-дигидро-4-оксо 10H-имидазо[1,2-а]индено[1,2-е]пиразин-2 карбоксилата, 25 мл диоксана и 50 мл 6 н соляной кислоты кипятят с обратным холодильником в течение 5 ч. После охлаждения реакционной среды выпавший осадок отфильтровывают, 25 промывают с помощью 50 мл дистиллированной воды и 10 мл диоксана. Таким образом получают 320 мг гидрохлорида 8-карбоксиметил 4,5-дигидро-4-оксо-10 Н-имидазо[1,2-а]индено(1H, д, J = 7 Гц, СН аром.); 8,48 (1H, с, СН аром.); 12,5 (1H, с, NH). Пример 15. Смесь из 1 г 8-аминометил 5 Н,10H-имидазо[1,2-а]индено-[1,2-е] пиразин-4 она и 1,8 г 4-нитрофенил-N-метилкарбамата в 40 мл диметилформамида перемешивают в течение 18 ч при температуре около 20 С. Реакционную среду отфильтровывают и остаток промывают 5 мл диметилформамида. Твердое вещество обрабатывают с помощью 25 мл диметилформамида и суспензию нагревают при 100 С в течение 30 мин. Нерастворимую часть отфильтровывают, промывают с помощью 5 мл диметилформамида, затем с помощью 20 мл ацетона. После высушивания при пониженном давлении (1 мбар) при 60 С получают 1,2 г 8-(3 метилуреидо)метил-5 Н,10H-имидазо[1,2-а]индено[1,2-е]пиразин-4-она в виде твердого вещества желтого цвета, температура плавления которого выше 260 С. Анализ: Рассчитано, %: С 62,13 Н 4,89 N 22,64 Найдено, %: 62,0 4,5 22,6 4-Нитрофенил-N-метилкарбамат может быть получен как описано T.KONAKAHARA и сотр., Synthesis, 103 (1993). 8-Аминометил-5 Н,10H-имидазо[1,2-а]индено[1,2-е]пиразин-4-он может быть получен следующим образом. Смесь из 1 г 8-фталимидометил-5 Н,10Hимидазо[1,2-а]индено[1,2-е]пиразин-4-она,50 мл абсолютированного этанола, 20 мл дистиллированной воды и 1,3 мл гидразингидрата кипятят с обратным холодильником в течение 18 ч. Твердое вещество отфильтровывают, промывают дистиллированной водой. Затем его в 15 мл 2 н соляной кислоты перемешивают в течение 1,5 ч при температуре около 20 С, отфильтровывают, промывают водой, затем ацетоном. Продукт обрабатывают с помощью 50 мл диметилформамида, перемешивают в течение полутора часов при температуре 120 С и суспензию отфильтровывают в горячем состоянии. Нерастворимую часть промывают диметилформамидом, затем ацетоном и высушивают при 60 С при пониженном давлении (1 мбар). Таким образом получают 0,58 г гидрохлорида 8 аминометил-5 Н,10H-имидазо[1,2-а]индено[1,2 е]пиразин-4-она в виде твердого вещества бежевого цвета с т.пл. выше 260 С. Анализ: Рассчитано,%: С 58,24 Н 4,54 Сl 12,28 N 19,40 Найдено, %: 58,3 4,8 12,2 19,2 26 8-Фталимидометил-5 Н,10H-имидазо[1,2-а] индено[1,2-е] пиразин-4-он может быть получен следующим образом. Смесь из 17 г этил-1-(5-фталимидометил 1-оксоиндан-2-ил)-имидазол-2-карбоксилата и 153 г ацетата аммония в 355 мл ледяной уксусной кислоты кипятят с обратным холодильником в течение 16 ч. Реакционную среду охлаждают до температуры около 20 С. Осадок отфильтровывают на стеклянной фритте, промывают дистиллированной водой до нейтрального значения рН, затем промывают ацетоном. После высушивания в вакууме (1 мбар) при 80 С получают 10 г 8-фталимидометил-5 Н,10H-имидазо[1,2-а]индено[1,2-е]пиразин-4-она в виде твердого вещества каштанового цвета. 1 Н-ЯМР-спектр (дейтерированный диметилсульфоксид, температура 27 С)в м.д. = 4,00 (2 Н, с, СН 2); 4,83 (2 Н, с, NCH2); 7,47 (1 Н, д,J = 1 Гц, СН аром.); 7,55 (2 Н, д, J = 1 Гц, СН аром.); 7,80 (1 Н, д, J = 7 Гц, СН аром.); 7,85-8,00(4 Н, м, Н фтал.); 12,30 (1 Н, уш.с, NH). Этил-1-(5-фталимидометил-1-оксоиндан-2 ил)имидазол-2-карбоксилат может быть синтезирован следующим образом. Суспензию из 28,3 г 2-бром-5 фталимидометилиндан-1-она и 21,4 г этилимидазол-2-карбоксилата в 700 мл толуола кипятят с обратным холодильником в течение 24 ч. Раствор выпаривают при пониженном давлении и остаток обрабатывают с помощью 800 мл насыщенного раствора карбоната калия и 800 мл дихлорметана. Органическую фазу декантируют, а водную фазу экстрагируют два раза по 500 мл дихлорметаном. Органические фазы объединяют, промывают 6 раз по 800 мл дистиллированной водой, сушат над сульфатом магния и выпаривают при пониженном давлении. После очистки остатка путем флэш-хроматографии на колонке с диоксидом кремния(элюирующее средство: смесь дихлорметана с метанолом в объемном соотношении 99:1) получают 17,5 г этил-1-(5-фталимидометил-1 оксо-индан-2-ил)имидазол-2-карбоксилата в виде твердого вещества бежевого цвета. 1H-ЯМР-спектр (дейтерированный диметилсульфоксид и несколько капель CD3CO2D; температура 27 С)в м.д. = 1,15 (3 Н, т, J = 7 Гц, CH3); 3,35 и 3,70 (1 Н каждый, соответственно дд, J = 6 и 16 Гц, и дд, J = 9 и 16 Гц, СН 2); 4,10 (2 Н, к, J = 7 Гц, ОСН 2); 4,93 (2 Н, с, NCH2); 5,79 (1 Н, дд, J = 6 и 9 Гц, NCH); 7,20 (1 Н, с, СН); 7,48 (1 Н, д, J = 7 Гц, СН аром.); 7,53 (1 Н, с, СН аром.); 7,56 (1 Н, с, СН аром.); 7,72 (1 Н, д, J = 7 Гц, СН аром.); 7,80-7,95 (4 Н, м, Н фтал.). 2-Бром-5-фталимидометилиндан-1-он может быть получен следующим образом. В раствор из 22,6 г 5-фталимидометилиндан-1-она в 150 мл дихлорметана, поддерживаемый при температуре 0-5 С, добавляют 15,5 г брома, разбавленного в 75 мл дихлор 27 метана. После выдерживания в течение 16 ч при температуре около 20 С реакционную среду выливают в 300 мл дистиллированной воды. Органическую фазу декантируют, а водную фазу экстрагируют три раза по 100 мл дихлорметаном. Органические фазы объединяют, промывают два раза по 100 мл дистиллированной водой, сушат над сульфатом магния и выпаривают при пониженном давлении. Таким образом получают 28,3 г 2-бром-5-фталимидометил-индан 1-она в виде твердого вещества бежевого цвета. 1 Н-ЯМР-спектр (дейтерированный диметилсульфоксид, температура 27 С)в м.д. = 3,30 и 3,87 (1 Н каждый, соответственно, дд, J = 4 и 16 Гц и дд, J = 7 и 16 Гц, СН 2); 4,90 (2 Н, с,NCH2); 4,99 (1 Н, дд, J = 4 и 7 Гц, СНВr); 7,46(4 Н, м, Н фтал.). 5-Фталимидометилиндан-1-он может быть получен следующим образом. К суспензии из 43,1 г 3-[3-(фталимидометил)фенил]пропановой кислоты в 900 мл дихлорметана добавляют 20,4 мл тионилхлорида и несколько капель диметилформамида. Смесь перемешивают в течение 2 ч при 30 С,затем в течение 16 ч при температуре около 20 С. Выпаривание растворителя приводит к получению 46,3 г желтого масла. Это масло растворяют в 400 мл 1,2-дихлорэтана и прикапывают к суспензии из 56 г хлорида алюминия в атмосфере азота и при температуре около 20 С. После протекания реакции в течение 24 ч при температуре около 20 С, реакционную среду выливают на 400 г льда. Смесь экстрагируют три раза с помощью 300 мл диэтилового эфира. Органические фазы объединяют, промывают с помощью 100 мл насыщенного раствора карбоната натрия и 200 мл дистиллированной воды,затем сушат над сульфатом магния и выпаривают. После очистки полученного твердого вещества путем флэш-хроматографии на колонке с диоксидом кремния (элюирующее средство: смесь дихлорметана с этилацетатом в объемном соотношении 98:2) получают 20,4 г 5 фталимидометилиндан-1-она в виде твердого вещества бежевого цвета. 1H-ЯМР-спектр (дейтерированный диметилсульфоксид, температуpa 27C)в м.д. = 2,61 (2 Н, м, СОCH2); 3,08 (2 Н, т, J = 5 Гц, СН 2); 4,90 (2 Н, с, СН 2); 7,38 (1 Н, д, J = 7 Гц, СН аром.); 7,51 (1 Н, с, СН аром.); 7,61 (1 Н, д, J = 7 Гц, СН аром.); 7,85-8,00 (4 Н, м, Н фтал.). 3-[3-(Фталимидометил)фенил]пропановая кислота может быть синтезирована следующим образом. В раствор из 48,7 г 3-(фталимидометил) коричной кислоты в 730 мл диметилформамида и 230 мл абсолютированного этанола добавляют 4,9 г 10 %-ного палладия-на-угле и помещают в атмосферу водорода под давлением около 1 ба 000218 28 ра и при температуре около 20 С. После протекания реакции в течение 4 ч, реакционную среду фильтруют через целит и фильтрат выпаривают при пониженном давлении. Таким образом получают 43,1 г 3-[3-(фталимидометил)фенил]пропановой кислоты в виде твердого вещества белого цвета. 1 Н-ЯМР-спектр (дейтерированный диметилсульфоксид, температура 27 С)в м.д.: 2,52(2 Н, с, NCH2); 7,10-7,35 (4 Н, м, Н аром.); 7,858,00 (4 Н, м, Н фтал.); 12,20 (1 Н, с, СООН). 3-(Фталимидометил)коричная кислота может быть получена следующим образом. В колбу под током азота вводят последовательно 114,4 г 1-бром-3-(фталимидометил) фенила, 7,5 г три-о-толилфосфина, 0,8 г ацетата палладия, 200 мл трибутиламина, затем прикапывают 30 мл акриловой кислоты. Смесь нагревают при 110 С в течение 2,5 ч. В течение этого промежутка времени наблюдают повышение температуры реакционной среды, которая достигает 140 С, с последующей стабилизацией при 110 С. После возвращения температуры примерно к 20 С в реакционную среду добавляют 300 мл диметилформамида, 300 мл метанола и 11 г животного угля. Суспензию нагревают в течение 5 мин при 80 С, отфильтровывают через целит и фильтрат выпаривают при пониженном давлении. Остаток обрабатывают с помощью 900 мл метанола. Смесь кипятят с обратным холодильником в течение 15 мин,затем охлаждают до температуры около 20 С и отфильтровывают. Таким образом получают 88,6 г 3-(фталимидометил)-коричной кислоты в виде твердого вещества белого цвета. 1H-ЯМР-спектр (дейтерированный диметилсульфоксид, температура 27 С)в м.д. = 4,80 (2 Н, с, NCH2); 6,55 (1 Н, д, J = 15 Гц, =СН); 7,4 (2 Н, м, СН аром.); 7,60 (1 Н, д, J = 15 Гц,=СН); 7,65 (2 Н, м, СН аром,); 7,85-8,00 (4 Н, м, Н фтал.). 1-Бром-3-(фталимидометил)фенил может быть получен следующим образом. Раствор 150 г 3-бромбензилбромида в 1,5 л диметилформамида, к которому добавлено 155,6 г фталимидата калия, нагревают в течение 16 ч при температуре 60 С. После возвращения температуры к значению около 20 С, реакционную смесь отфильтровывают через стеклянный фильтр из фриттированного стекла и фильтрат выпаривают. Остаток обрабатывают 400 мл метанола и полученную суспензию перемешивают в течение 1 ч при температуре около 20 С. Путем отфильтровывания выделяют 163,9 г 1 бром-3-(фталимидометил)фенила в виде твердого вещества белого цвета. 1 Н-ЯМР-спектр (дейтирированный диметилсульфоксид, температура 27 С)в м.д. = 4,80 (2 Н, с, NCH2); 7,25-7,35 (2 Н, м, 2 Н аром.); 29 7,49 (1 Н, м, СН аром.); 7,55 (1 Н, с, СН аром.); 7,85-8,00 (4 Н, м, Н фтал.). Пример 16. К суспензии 0,8 г гидрохлорида 8-аминометил-5 Н,10H-имидазо[1,2-а] индено[1,2-е]пиразин-4-она в 20 мл диметилформамида добавляют 1,1 мл триэтиламина,затем 0,52 мл уксусного ангидрида. После протекания реакции в течение 18 ч при температуре около 20 С реакционную среду отфильтровывают и твердое вещество промывают последовательно с помощью диметилформамида, дистиллированной воды и ацетона, затем высушивают при пониженном давлении (1 мбар) при 50 С. Таким образом получают 0,81 г N-[(4,5-дигидро 4-оксо-10 Н-имидазо[1,2-а]-индено[1,2-е] пиразин-8-ил)метил]ацетамида в виде твердого вещества белого цвета с т.пл. выше 260 С. Анализ: Рассчитано, %: С 65,30 Н 4,79 N 19,04 Найдено, %: 65,3 4,8 18,7 Пример 17. К суспензии 1 г гидрохлорида 8-аминометил-5 Н,10H-имидазо[1,2-а]индено[1,2-е]пиразин-4-она в 40 мл диметилформамида добавляют 1,4 мл триэтиламина и 0,9 мл фенилацетилхлорида. После протекания реакции в течение 16 ч при температуре около 20 С реакционную среду отфильтровывают и фильтрат выпаривают при пониженном давлении. Остаток суспендируют в 50 мл ацетона. После отфильтровывания и высушивания при пониженном давлении (1 мбар) при 60 С, получают 100 мг N-[(4,5-дигидро-4-оксо-10 Н-имидазо[1,2-а] индено[1,2-е]пиразин-9-ил)метил]фенилацетамида в виде твердого вещества бежевого цвета с т.пл. выше 260 С. 1 Н-ЯМР-спектр (дейтерированный диметилсульфоксид, температуpa 27C)в м.д. = 3,51 (2 Н, с, СН 2-фенил); 3,97 (2 Н, с, СН 2); 4,35(2 Н, д, J = 4 Гц, NCH2); 7,20-7,40 (6 Н, м, Н аром.); 7,43(1 Н, с, СН аром.); 7,60 (1 Н, с, СН аром.); 7,78 (1 Н, д, J = 7 Гц, СН аром.); 7,98 (1 Н,с, СН аром.); 8,63 (1 Н, уш.т, NH); 12,3 (1 Н, с,NH). Пример 18. К суспензии 1,5 г этил-9 этоксикарбонилметил-4,5-дигидро-4-оксо-10Hимидазо[1,2-а]индено[1,2-е]пиразин-2-карбоксилата в смеси из 150 мл диоксана и 40 мл дистиллированной воды при температуре около 20 С прикапывают 11,8 мл 1 н раствора гидроксида натрия. Таким образом полученный раствор коричневого цвета перемешивают в течение 4 ч при той же самой температуре. Выпавший осадок отфильтровывают, промывают диоксаном,затем диэтиловым эфиром. Таким образом получают тринатриевую соль 9-карбоксиметил-4 оксо-4,5-дигидро-10H-имидазо(в расчете на сухое вещество) 30 Эту соль поглощают дистиллированной водой и таким образом полученный водный раствор подкисляют с помощью 0,5 н соляной кислоты. Вновь выпавший осадок отфильтровывают, промывают водой, затем метанолом и высушивают при пониженном давлении (1 мм рт.ст.; 0,13 кПа) при 45 С с получением 0,91 г дигидрата 9-карбоксиметил-4,5-дигидро-4-оксо 10 Н-имидазо[1,2-а]-индено[1,2-е]пиразин-2 карбоновой кислоты в виде белого порошка,температура плавления которого выше 260 С. Анализ для С 16 Н 15N3O70,35 Н 2 О: Рассчитано, %:С 53,19 Н 4,18 N 11,63 О 31,00 Найдено, %: 53,2 4,0 11,4 31,0 1 Н-ЯМР-спектр ( 250 мГц, дейтерированный диметилсульфоксид, температура 27 С)в м.д. = 3,78 (2 Н, с, СОСН 2); 4,03 (2 Н, с, СН 2); 7,28 (1 Н, д, J = 7 Гц, СH аром.); 7,42 (1 Н, т, J = 7 Гц, СН аром.); 7,85 (1 Н, д, J = 7 Гц, СН аром.); 8,55 (1 Н, с, СН аром.); 12,5 (1 Н, с, NH). Путем высушивания дигидрата при 60 С получают моногидрат. Анализ: Рассчитано, %: С 55,98 Н 3,82 N 12,24 Найдено, %: 55,2 3,6 12,0 Путем обработки кислоты с помощью двух эквивалентов 1 Н раствора гидроксида натрия можно также получать динатриевую соль 9 карбоксиметил-4-оксо-4,5-дигидро-10H-имидазо[1,2-а]индено-[1,2-е]пиразин-2-карбоновой кислоты. Анализ для С 16H9N3O5Na23 Н 2 О: Рассчитано,%:С 52,04 Н 2,46 N 11,38 Na 12,45 Найдено, %: 51,7 1,8 11,4 12,6 Пример 18 А. Этил-9-этоксикарбонилметил-4,5-дигидро-4-оксо-10 Н-имидазо[1,2-а] индено[1,2-е]пиразин-2-карбоксилат может быть получен следующим образом. 7,1 г Диэтил-1-(4-этоксикарбонилметил-1 оксоиндан-2-ил)имидазол-2,4-карбоксилата и 83 г ацетата аммония в виде суспензии в 140 мл уксусной кислоты кипятят с обратным холодильником в течение 3 ч. После охлаждения до температуры около 20 С нерастворимую часть отфильтровывают, промывают дистиллированной водой, затем ацетоном и высушивают. Получают 4,7 г целевого соединения в виде твердого вещества светло-серого цвета, температура плавления которого выше 260 С. 1 Н-ЯМР-спектр (200 мГц, дейтерированный диметилсульфоксид, температура 27 С)в м.д. = 1,21 (3 Н, т, J = 6 Гц, CH3); 1,37 (3 Н, т, J = 6 Гц, CH3); 3,82 (2 Н, с, СОСН 2); 4,01 (2 Н, с,СН 2); 4,37 (2 Н, к, J = 6 Гц, ОСН 2); 7,28 (1 Н, д, J= 7 Гц, СН аром.); 7,42 (1 Н, т, J = 7 Гц, СН аром.); 7,83 (1 Н, д, J = 7 Гц, СН аром.); 8,06 (1 Н,с, СН аром.). Диэтил-1-(4-этоксикарбонилметил-1-оксоиндан-2-ил)имидазол-2,4-дикарбоксилат может быть получен следующим образом. 31 К суспензии из 6,99 г диэтил-имидазол-2,4 дикарбоксилата и 22 г карбоната калия в 100 мл ацетона при температуре кипения с обратным холодильником прикапывают раствор 9,8 г сложного этилового эфира(2-бром-1 оксоиндан-4-ил)уксусной кислоты в 100 мл ацетона. Реакционную среду кипятят с обратным холодильником в течение 3,5 ч, затем охлаждают до температуры около 20 С и нерастворимую часть отфильтровывают и промывают ацетоном. Фильтрат затем концентрируют досуха при пониженном давлении и таким образом полученный сырой продукт очищают путем флэшхроматографии на колонке с диоксидом кремния, используя смесь этилацетата с дихлорметаном в объемном соотношении 20:80 в качестве элюирующего средства. Получают 7,1 г целевого продукта в виде коричневого масла. 1 Н-ЯМР-спектр (250 мГц, дейтерированный диметилсульфоксид, температура 27 С)в м.д. = 1,18 (3 Н, т, J = 6 Гц, CH3); 1,20 (3 Н, т, J = 6 Гц, CH3); 1,35 (3 Н, т, J = 6 Гц, CH3); 3,38 и 3,80(4 Н, м, 2 раза ОСН 2); 4,32 (2 Н, к, J = 6 Гц,ОСН 2); 5,91 (1 Н, т, J = 6 и 8 Гц, СН); 7,55 (1 Н, т,J = 7 Гц, СН аром.); 7,73 (2 Н, д, J = 7 Гц, СН аром.); 8,37 (1 Н, с, СН). Пример 19. Смесь из 0,9 г 4-бензилкарбамоил-2-(2-этоксикарбонилимидазолил)-индан-1-она, 30 мл уксусной кислоты и 17,2 г ацетата аммония кипятят с обратным холодильником в течение 1,5 ч. В реакционную смесь добавляют 30 мл дистиллированной воды и все охлаждают на бане со льдом в течение 30 мин. Осадок отфильтровывают, промывают 3 раза по 10 мл дистиллированной водой, 10 мл этанола и,наконец, 3 раза по 10 мл ацетоном. После высушивания при 50 С в вакууме (1 мм рт.ст.; 0,13 кПа) получают 0,63 г N-бензил-(4,5-дигидро-4 оксо-10H-имидазо[1,2-а]индено[1,2-е]пиразин 9-ил)карбоксамида в виде твердого вещества бежевого цвета с т.пл. выше 260 С. Анализ: Рассчитано, %: С 70,77 Н 4,53 N 15,72 О 8,98 Найдено, %: 70,8 4,5 9,0 4-Бензилкарбамоил-2-(2-этоксикарбонилимидазолил)-индан-1-он может быть получен следующим образом. Смесь 0,5 г 4-бензилкарбамоил-2-броминдан-1-она, 0,37 г 2-этоксикарбонилимидазола и 10 мл толуола кипятят с обратным холодильником в течение 12 ч. Реакционную смесь концентрируют в роторном испарителе. К остатку после выпаривания добавляют дихлорметан,отфильтровывают и фильтрат промывают дистиллированной водой, сушат над сульфатом натрия и выпаривают в роторном испарителе. Полученное масло коричневого цвета (0,26 г) очищают путем хроматографии на колонке с диоксидом кремния (диаметр 1,5 см, высота 30 см), элюируя смесью дихлорметана с метанолом 32 в объемном соотношении 95:5. Полученный продукт в виде воздушной массы растирают до порошка с помощью 5 мл этилацетата, отфильтровывают и твердое вещество промывают этилацетатом (2 раза по 5 мл) и высушивают при 50 С в вакууме (1 мм рт.ст.; 0,13 кПа). Получают 0,07 г 4-бензилкарбамоил-2-(2 этоксикарбонилимидазолил)-индан-1-она в виде твердого вещества оранжевого цвета с т.пл. 218 С. 4-Бензилкарбамоил-2-бром-индан-1-он может быть получен следующим образом. К смеси 4,5 г 4-бензилкарбамоил-индан-1 она, 40 мл уксусной кислоты и 0,55 мл концентрированной бромисто-водородной кислоты при перемешивании прикапывают раствор 2,72 г брома в 10 мл уксусной кислоты, поддерживая температуру реакционной среды около 16 С. Перемешивание продолжают в течение 30 мин при температуре около 16 С, затем в течение 2 ч при температуре около 20 С. После этого реакционную смесь обрабатывают с помощью 100 мл воды и экстрагируют этилацетатом. Органическую фазу промывают дистиллированной водой, сушат над сульфатом натрия и выпаривают в роторном испарителе. После высушивания при 65 С при пониженном давлении (10 мм рт.ст.) получают 5,7 г 4-бензилкарбамоил-2 бром-индан-1-она в виде желтого масла, которое вскоре кристаллизуется, и используется в таком виде в последующих синтезах. 4-Бензилкарбамоил-индан-1-он может быть получен следующим образом. В атмосфере азота к перемешиваемому раствору 5 г 1-оксо-индан-4-карбоновой кислоты в 270 мл диметилформамида прикапывают раствор 3,34 мл бензиламина в 30 мл диметилформамида. Перемешивание продолжают в течение 10 мин, после чего добавляют 4 г 1 гидроксибензотриазола и 5,68 г 1-(3 диметиламинопропил)-3-этилкарбодиимидгидрохлорида. Перемешивание продолжают в течение ночи, затем реакционную смесь обрабатывают с помощью 250 мл воды и экстрагируют 3 раза по 250 мл этилацетатом. Органическую фазу промывают дистиллированной водой (2 раза по 250 мл), сушат над сульфатом натрия и выпаривают в роторном испарителе. Остаток после выпаривания очищают путем хроматографии на колонке с диоксидом кремния (диаметр 2,5 см, высота 50 см), элюируя смесью циклогексана с этилацетатом в объемном соотношении 50:50. Получают 4,5 г 4 бензилкарбамоил-индан-1-она в виде твердого вещества желто-оранжевого цвета с т.пл. 124 С. 1-Оксо-индан-4-карбоновая кислота может быть получена следующим образом. К раствору из 190,3 г перманганата калия в 2000 мл дистиллированной воды и 20 г тетрабутиламмонийбромида, охлаждаемому на бане со льдом и водой, добавляют 1500 мл толуола, затем порциями 90 г 3-(1-оксо-индан-4-ил) акри 33 ловой кислоты. Реакционную смесь перемешивают в течение ночи при температуре около 20 С, затем добавляют 200 мл воды и бисульфита натрия до обесцвечивания реакционной среды. После подкисления до рН = 1 с помощью 6 н соляной кислоты полученную суспензию отфильтровывают и фильтрат декантируют. Водную фазу экстрагируют этилацетатом и полученную органическую фазу добавляют к толуольной фазе. После выпаривания в роторном испарителе получают 35 г 1-оксо-индан-4 карбоновой кислоты в виде оранжевого твердого вещества с т.пл. 215 С. 3-(1-Оксо-индан-4-ил)акриловая кислота может быть получена следующим образом. К смеси из 59,1 г 4-бром-индан-1-она,107,9 г трибутиламина, 6,1 г три-отолилфосфина и 0,63 г ацетата палладия добавляют 20,26 г акриловой кислоты и нагревают при 100 С в течение 2 ч. Реакционную среду охлаждают до температуры около 20 С и обрабатывают с помощью 400 мл воды и 50 г гидрокарбоната натрия. Смесь затем отфильтровывают и водную фазу промывают 2 раза по 250 мл диэтиловым эфиром и подкисляют с помощью 100 мл 6 н соляной кислоты. Выпавший осадок отфильтровывают, промывают 1 н соляной кислотой и высушивают сначала на воздухе, затем при 50 С в вакууме (1 мм рт.ст.; 0,13 кПа). Получают 48,7 г 3-(1-оксо-индан-4-ил)акриловой кислоты в виде твердого вещества бледножелтого цвета, плавящегося при 190 С. 4-Бром-индан-1-он может быть получен по способу, описанному M. ADAMCZYK и сотр., J.Org. Chem., 49 (22), 4226 (1984). Пример 20. Следуют методике примера 19,но исходят из 0,9 г 4-фенил-карбамоил-2-(2 этоксикарбонилимидазолил)-индан-1-она, 30 мл уксусной кислоты и 17,8 г ацетата аммония. Получают 0,55 г N-фенил-(4,5-дигидро-4-оксо 10 Н-имидазо[1,2-а]индено[1,2-е]пиразин-9-ил) карбоксамида в виде твердого вещества бледнорозового цвета с т.пл. выше 260 С. Анализ: Рассчитано, %: С 70,17 Н 4,12 N 16,36 О 9,35 Найдено, %: 70,1 3,8 16,2 4-Фенилкарбамоил-2-(2-этоксикарбонилимидазолил)-индан-1-он может быть получен следующим образом. Следуют методике примера 19 для получения 4-бензилкарбамоил-2-(2-этоксикарбонилимидазолил)-индан-1-она, но исходят из 3 г 4 фенилкарбамоил-2-бром-индан-1-она, 80 мл толуола и 2,55 г 2-этоксикарбонилимидазола. Сырой продукт очищают с помощью двукратной хроматографии на колонке с диоксидом кремния (диаметр 2,5 см, высота 30 см), элюируя этилацетатом. Получают 0,81 г 4 фенилкарбамоил-2-(2-этоксикарбонилимидазолил) индан-1-она в виде твердого вещества бледно-желтого цвета с т.пл. 246 С. 34 4-Фенилкарбамоил-2-бром-индан-1-он может быть получен следующим образом. Следуют методике примера 19 для получения 4-бензилкарбамоил-2-бром-индан-1-она, но исходят из 4,9 г 4-фенилкарбамоил-индан-1-она,60 мл уксусной кислоты, 0,6 мл концентрированной бромисто-водородной кислоты и 2,97 г брома. Получают 4 г 4-фенилкарбамоил-2-броминдан-1-она в виде бледно-желтого твердого вещества с т.пл. 212 С. 4-Фенилкарбамоил-индан-1-он можетбыть получен следующим образом. Следуют методике примера 19 для получения 4-бензилкарбамоил-индан-1-она, но исходят из 5 г 1-оксо-индан-4-карбоновой кислоты, 300 мл диметилформамида, 2,85 г анилина, 4 г 1 гидроксибензотриазола и 5,68 г 1-(3 диметиламинопропил)-3-этилкарбодиимидгидрохлорида. Получают 4,9 г 4-фенилкарбамоил-индан-1-она в виде твердого вещества каштанового цвета с т.пл. 150 С. Пример 21. Следуют методике примера 19,но исходят из 3 г 4-(метоксикарбонилметилкарбамоил)-2-(2-этоксикарбонилимидазолил)индан-1-она, 100 мл уксусной кислоты и 60 г ацетата аммония. Осадок после промывки водой высушивают на воздухе и кристаллизуют из 48 мл диметилформамида. Кристаллы промывают диизопропиловым эфиром и высушивают при 60 С в вакууме (1 мм рт.ст.; 0,13 кПа). Получают 0,96 г метил-N[(4,5-дигидро-4-оксо-10 Н-имидазо[1,2-а]индено[1,2-е]пиразин-9-ил)карбонил]глицината в виде твердого вещества розового цвета с т.пл. выше 260 С. Анализ: Рассчитано, %: С 60,35 Н 4,17 N 16,56 О 18,92 Найдено, %: 4,2 16,2 18,3 1H-ЯМР-спектр (250 мГц, дейтерированный диметилсульфоксид)в м.д. = 3,7 (с, 3 Н, метил); 4,10 (д, J = 6 Гц, 2 Н: CH2N); 4,30 (с, 1 Н,СН 2); 7,52 (т, J = 7 Гц, 2 Н: Н ароматические); 7,55 (с, 1 Н: Н гетероциклический); 7,70 (д, J = 7 Гц, 1 Н: Н ароматический); 8,05 (д, J = 7 Гц, 1 Н: Н ароматический); 8,10 (с, 1 Н: Н гетероциклический); 9,05 (т, J = 6 Гц, 1 Н: CONH); 12,45 (уш.с, 1 Н: NH). 4-(Метоксикарбонилметилкарбамоил)-2(2-этоксикарбонилимидазолил)индан-1-он может быть получен следующим образом. Следуют методике примера 19 для получения 4-бензилкарбамоил-2-(2-этоксикарбонилимидазолил)индан-1-она, но исходят из 10,2 г 4(метоксикарбонилметилкарбамоил)-2-бром-индан-1-она, 200 мл толуола и 7 г 2-этоксикарбонилимидазола. Сырой продукт, растворенный в смеси метанола с дихлорметаном, очищают путем хроматографии на колонке с диоксидом кремния (диаметр 4,5 см, высота 47 см),элюируя смесью этилацетата с дихлорметаном в объемном соотношении 80:20. Получают 3 г 4(метоксикарбонилметилкарбамоил)-2-(2 35 этоксикарбонилимидазолил) индан-1-она в виде твердого вещества оранжевого цвета с т.пл. 143 С. 4-(Метоксикарбонилметилкарбамоил)-2 бром-индан-1-он может быть получен следующим образом. Следуют методике примера 19 для получения 4-бензилкарбамоил-2-бром-индан-1-она, но исходят из 9,04 г 4-(метоксикарбонилметилкарбамоил)индан-1-она, 120 мл уксусной кислоты, 1,7 мл концентрированной бромистоводородной кислоты и 6,6 г брома. Получают 11 г 4-(метоксикарбонилметилкарбамоил)-2-броминдан-1-она в виде оранжевого масла, которое затем кристаллизуется и которое используют таким, какое есть, в последующих синтезах. 4-Метоксикарбонилметилкарбамоил) индан-1-она может быть получен следующим образом. Следуют методике примера 19 для получения 4-бензилкарбамоил-индан-1-она, но исходят из 10 г 1-оксо-индан-4-карбоновой кислоты, 400 мл дихлорметана, 7,4 г метилглицинат-гидрохлорида, 6 г триэтиламина, 7,9 г 1-гидроксибензотриазола и 11,25 г 1-(3-диметиламинопропил)-3-этилкарбодиимид-гидрохлорида. Сырой продукт очищают путем хроматографии на колонке с диоксидом кремния (диаметр 2,5 см,высота 38 см), элюируя смесью дихлорметана с этилацетатом в объемном соотношении 60:40. Получают 8,7 г 4-(метоксикарбонилметилкарбамоил)индан-1-она в виде твердого вещества бледно-желтого цвета с т.пл. 122 С. Пример 22. Смесь 1 г 9-(метоксикарбонилметилкарбамоил)-5 Н,10H-имидазо[1,2-а] индено[1,2-е]пиразин-4-она, 50 мл диоксана и 15 мл концентрированной соляной кислоты кипятят с обратным холодильником в течение 24 ч. Реакционную смесь концентрируют в роторном испарителе и в остаток после выпаривания добавляют диэтиловый эфир и фильтруют. Полученное твердое вещество растирают до порошкового состояния в 20 мл дистиллированной воды, отфильтровывают, промывают 20 мл дистиллированной воды, затем диэтиловым эфиром и высушивают при 60 С в вакууме (1 мм рт.ст.; 0,13 кПа). Получают 0,8 г N-[(4,5-дигидро-4 оксо-10H-имидазо[1,2-а]индено[1,2-е]пиразин 9-ил)карбонил]глицина в виде твердого вещества желтого цвета, содержащего 0,66 моль хлороводорода и плавящегося выше 260 С. Анализ: Рассчитано,%: С 55,13 Н 3,66 С 1 6,78 N 16,07 О 18,36 Найдено, %: 55,1 3,6 6,2 15,8 18,3 Пример 23. Следуют методике примера 19,но исходят из 0,9 г 5-фенил-карбамоил-2-(2 этоксикарбонилимидазолил)индан-1-она, 32 мл уксусной кислоты и 17,7 г ацетата аммония. Получают 0,5 г N-фенил-(4,5-дигидро-4-оксо 10 Н-имидазо[1,2-а]индено[1,2-е]-пиразин-8-ил) карбоксамида в виде твердого вещества каштанового цвета, плавящегося выше 260 С. 36 Анализ: Рассчитано, %: С 70,16 Н 4,12 N 16,37 О 9,35 Найдено, %: 70,1 3,6 15,8 5-Фенилкарбамоил-2-(2-этоксикарбонилимидазолил) индан-1-он может быть получен следующим образом. Следуют методике примера 19 для получения 4-бензилкарбамоил-2-(2-этоксикарбонилимидазолил)индан-1-она, но исходят из 3,65 г 5 фенилкарбамоил-2-бром-индан-1-она, 73 мл толуола и 3,1 г 2-этоксикарбонилимидазола. Сырой продукт очищают путем хроматографии на колонке с диоксидом кремния, элюируя сначала смесью дихлорметана с метанолом в объемном соотношении 99,5:0,5, затем смесью дихлорметана с метанолом в объемном соотношении 98:2. Получают 0,9 г 5-фенилкарбамоил-2(2-этоксикарбонилимидазолил)индан-1-она в виде твердого вещества каштанового цвета с т.пл. 122 С. 5-Фенилкарбамоил-2-бром-индан-1-он может быть получен следующим образом. Следуют методике примера 19 для получения 4-бензилкарбамоил-2-бром-индан-1-она, но исходят из 3,1 г 5-фенилкарбамоилиндан-1-она,37 мл уксусной кислоты, 0,4 мл концентрированной бромисто-водородной кислоты и 1,96 г брома. Получают 3,7 г 5-фенилкарбамоил-2 бром-индан-1-она в виде твердого вещества зеленовато-серого цвета с т.пл. 144 С. 5-Фенилкарбамоил-индан-1-он может быть получен следующим образом. Следуют методике примера 19 для получения 4-бензилкарбамоил-индан-1-она, но исходят из 4,4 г 1-оксо-индан-5-карбоновой кислоты,2,86 г анилина, 100 мл дихлорметана, 3,5 г 1 гидроксибензотриазола и 5 г 1-(3-диметиламинопропил)-3-этил-карбодиимидгидрохлорида. Сырой продукт очищают путем хроматографии на колонке с диоксидом кремния, элюируя смесью дихлорметана с метанолом в объемном соотношении 99:1. Получают 3,1 г 5 фенилкарбамоил-индан-1-она в виде твердого вещества каштанового цвета с т.пл. 174 С. 1-Оксо-индан-5-карбоновая кислота может быть получена следующим образом. Следуют методике примера 19 для получения 1-оксо-индан-4-карбоновой кислоты, но исходят из 22,3 г 3-(1-оксо-индан-5 ил)акриловой кислоты, 560 мл дистиллированной воды, 370 мл толуола, 4,95 г тетрабутиламмонийбромида и 47,4 г перманганата калия. Получают 14,4 г 1-оксо-индан-5-карбоновой кислоты в виде твердого вещества кремового цвета с т.пл. 270 С. 3-(1-Оксо-индан-5-ил)акриловая кислота может быть получена следующим образом. Следуют методике примера 19 для получения 3-(1-оксо-индан-4-ил)акриловой кислоты,но исходят из 106,9 г 5-бром-индан-1-она, 250 мл трибутиламина, 10,9 г три-о-толилфосфина,1,1 г ацетата палладия и 36,6 г акриловой кисло 37 ты. Выпадающий за счет подкисления 6 н соляной кислотой осадок очищают путем хроматографии на колонке с диоксидом кремния, элюируя смесью дихлорметана с метанолом в объемном соотношении 97,5:2,5. Получают 22,3 г 3(1-оксо-индан-5-ил)акриловой кислоты в виде твердого вещества цвета охры, плавящегося при 234 С. 5-Бром-индан-1-он может быть получен по способу,описанному(1971) . Пример 24. Следуют методике примера 19,но исходят из 0,8 г 5-бензилкарбамоил-2-(2 этоксикарбонилимидазолил)индан-1-она, 28 мл уксусной кислоты и 15,2 г ацетата аммония. Получают 0,5 г N-бензил-(4,5-дигидро-4-оксо 10 Н-имидазо[1,2-а]индено[1,2-е]пиразин-8-ил) карбоксамида в виде твердого вещества серого цвета, плавящегося выше 260 С. Анализ: Рассчитано, %: С 70,77 Н 4,53 N 15,72 О 8,98 Найдено, %: 70,8 4,8 8,6 5-Бензилкарбамоил-2-(2-этоксикарбонилимидазолил)индан-1-он может быть получен следующим образом. Следуют методике примера 19 для получения 4-бензилкарбамоил-2-(2-этоксикарбонилимидазолил)индан-1-она, но исходят из 4,1 г 5 бензилкарбамоил-2-бром-индан-1-она, 82 мл толуола и 3,3 г 2-этоксикарбонилимидазола. Сырой продукт очищают путем хроматографии на колонке с диоксидом кремния, элюируя смесью дихлорметана с этилацетатом в объемном соотношении 50:50. Получают 0,9 г 5-бензилкарбамоил-2-(2-этоксикарбонилимидазолил) индан-1-она в виде твердого вещества цвета охры, плавящегося при 72 С. 5-Бензилкарбамоил-2-бром-индан-1-он может быть получен следующим образом. Следуют методике примера 19 для получения 4-бензилкарбамоил-2-бром-индан-1-она, но исходят из 3,9 г 5-бензилкарбамоил-индан-1 она, 45 мл уксусной кислоты, 0,47 мл концентрированной бромисто-водородной кислоты и 2,35 г брома. Получают 5,1 г 5 бензилкарбамоил-2-бром-индан-1-она в виде пастообразной массы оранжевого цвета, используемой такой, какая есть в последующих синтезах. 5-Бензилкарбамоил-индан-1-он может быть получен следующим образом. Следуют методике примера 19 для получения 4-бензилкарбамоил-индан-1-она, но исходят из 4,4 г 1-оксо-индан-5-карбоновой кислоты, 88 мл диметилформамида, 3 мл бензиламина, 3,5 г 1-гидроксибензотриазола и 5 г 1-(3-диметиламинопропил)-3-этилкарбодиимид-гидрохлорида. Сырой продукт очищают путем хроматографии на колонке с диоксидом кремния, элюируя смесью дихлорметана с метанолом в объемном соотношении 99:1. Получают 3,9 г 5 000218 38 бензилкарбамоил-индан-1-она в виде твердого вещества желтого цвета, плавящегося при 133 С. Пример 25. Смесь 850 г этил-8-(Nэтиламинокарбонилметил)-4,5-дигидро-4-оксо 10H-имидазо[1,2-а]индено[1,2-е]пиразин-2-карбоксилата, 10 мл диоксана, 40 мл дистиллированной воды и 5,8 мл 1 н раствора гидроксида натрия перемешивают в течение ночи при температуре около 20 С в токе аргона. Реакционную смесь охлаждают до температуры около 0 С и нейтрализуют с помощью 5,8 мл 1 н соляной кислоты. Выпавший осадок отфильтровывают, промывают несколько раз дистиллированной водой и высушивают в сушильном шкафу. Получают 695 мг 8-(N-этиламинокарбонилметил)-4,5-дигидро-4-оксо-10 Нимидазо[1,2-а]индено[1,2-е]пиразин-2-карбоновой кислоты в виде твердого вещества каштанового цвета с т.пл. выше 300 С. 1 Н-ЯМР-спектр (300 мГц, дейтерированный диметилсульфоксид, температура 27 С)в м.д. = 1,05 (3 Н, т, J = 6 Гц, CH3); 3,10 (2 Н, м,NCH2); 3,47 (2 Н, с, СН 2 СО); 4,02 (2 Н, с, СН 2); 7,30 (1 Н, д, J = 8 Гц, СН аром.); 7,48 (1 Н, с, СН аром.); 7,82 (1 Н, д, J = 8 Гц, СН аром.); 8,08 (1 Н,т, J = 5 Гц, NH); 8,52 (1 Н, с, Н имидазола). Пример 26. Смесь из 3,9 г диэтил-1-[5-(Nэтиламинокарбонилметил)-1-оксо-индан-2-ил] имидазол-2,4-дикарбоксилата, 33,4 г ацетата аммония и 200 мл уксусной кислоты кипятят с обратным холодильником в течение 3 ч. Реакционную смесь выпаривают в роторном испарителе и в остаток после выпаривания добавляют 250 мл дистиллированной воды и отфильтровывают. Полученное твердое вещество промывают дистиллированной водой несколько раз и высушивают в сушильном шкафу. Получают 2,2 г этил-8-(N-этиламинокарбонилметил)-4,5-дигидро-4-оксо-10 Н-имидазо-[1,2-а]индено[1,2-е] пиразин-2-карбоксилата в виде твердого вещества светло-каштанового цвета, плавящегося выше 300 С. 1H-ЯМР-спектр (300 мГц, дейтерированный диметилсульфоксид, температура 27 С)в м.д. = 1,05 (3 Н, т, J = 6 Гц, CH3); 1,40 (3 Н, т, J = 6 Гц, CH3); 3,12 (2 Н, м, NCH2); 3,48 (2 Н, с,СН 2 СО); 4,05 (2 Н, с, СН 2); 4,40 (2 Н, к, J = 6 Гц,СН 2 О); 7,32 (1 Н, д, J = 8 Гц, СН аром.); 7,42 (1 Н,с, СН аром.); 7,83 (1 Н, д, J = 8 Гц, СН аром.); 8,10 (1 Н, т, J = 5 Гц, NH); 8,60 (1 Н, с, Н имидазола). Диэтил-1-[5-(N-этиламинокарбонилметил)1-оксо-индан-2-ил]имидазол-2,4-дикарбоксилат может быть получен следующим образом. Смесь 1,84 г диэтил-имидазол-2,4 дикарбоксилата, 150 мл диметилформамида и 3,6 г карбоната калия нагревают в течение 2 ч при температуре около 85 С. Реакционную смесь оставляют стоять для снижения температуры до примерно 20 С и при перемешивании 39 добавляют раствор 3,3 г 2-бром-5-(Nэтиламинокарбонилметил)индан-1-она в 50 мл диметилформамида. Продолжают перемешивание в течение ночи. Реакционную смесь выпаривают в роторном испарителе и к остатку после выпаривания добавляют 200 мл дистиллированной воды и экстрагируют 5 раз по 200 мл этилацетатом. Органическую фазу сушат над сульфатом магния, отфильтровывают и фильтрат выпаривают в роторном испарителе. Полученный остаток очищают путем хроматографии на колонке с диоксидом кремния, элюируя сначала этилацетатом, затем смесью этилацетата с метанолом в объемном соотношении 95:5. Получают 3,9 г диэтил-1-[5-(Nэтиламинокарбонилметил)-1-оксо-индан-2-ил] имидазол-2,4-дикарбоксилата в виде твердого вещества белого цвета. 1 Н-ЯМР-спектр (300 мГц, дейтерированный диметилсульфоксид, температура 27 С)в м.д. = 1,05 (3 Н, т, J = 6 Гц, CH3); 1,18 (3 Н, т, J = 6 Гц, CH3); 1,32 (3 Н, т, J = 6 Гц, CH3); 3,10 (2 Н,м, NCH2); 3,43 и 3,72 (1 Н каждый, соответственно, дд, J = 5 и 13 Гц, и дд, J = 7 и 13 Гц, СН); 3,55 (2 Н, с, СОСН 2); 4,15 (2 Н, к, J = 6 Гц, СН 2 О); 4,30 (2 Н, к, J = 6 Гц, СН 2 О); 5,88 (1 Н, дд, J = 7 и 5 Гц, NCH); 7,42 (1 Н, д, J = 8 Гц, СН аром.); 7,50(1 Н, с, СН аром.); 7,70 (1 Н, д, J = 8 Гц, СН аром.); 8,20 (1 Н, т, J = 5 Гц, NH); 8,30 (1 Н, с, Н имидазола). 2-Бром-5-(N-этиламинокарбонилметил) индан-1-он может быть получен следующим образом. Раствор 3,2 г 5-(N-этиламинокарбонилметил)индан-1-она в 237 мл дихлорметана и 183 мл этанола в атмосфере аргона охлаждают до температуры 0-3 С и при перемешивании прикапывают раствор 0,75 мл брома в 36 мл дихлорметана, поддерживая температуру реакционной среды ниже 5 С. Перемешивание продолжают в течение 90 мин при температуре около 20 С, затем реакционную смесь выпаривают в роторном испарителе. Остаток после выпаривания (7,3 г) хроматографируют на колонке с диоксидом кремния, элюируя сначала этилацетатом, затем смесью этилацетата с метанолом в объемном соотношении 95:5. Получают 3,3 г 2-бром-5-(N-этиламинокарбонилметил) индан-1-она в виде твердого вещества белого цвета (Rf = 0,64, тонкослойная хроматография на диоксиде кремния, элюирующее средство: смесь этилацетата с метанолом в объемном соотношении 95:5). 5-(N-Этиламинокарбонилметил)индан-1 он может быть получен следующим образом. Раствор 3 г (1-оксо-индан-5-ил) уксусной кислоты в 75 мл тетрагидрофурана в токе аргона охлаждают до температуры около 0 С и при перемешивании добавляют 3,84 г карбонилдиимидазола. Продолжают перемешивание при температуре 20 С в течение часа, затем реакционную среду охлаждают до температуры около 000218 40 10 С и добавляют 10,3 мл триэтиламина. Оставляют температуру реакционной смеси повышаться до значения около 20 С и перемешивание продолжают в течение двух часов. Реакционную смесь концентрируют в роторном испарителе и добавляют к остатку 150 мл дихлорметана. Органическую фазу промывают с помощью 75 мл дистиллированной воды, сушат над сульфатом магния, отфильтровывают и выпаривают в роторном испарителе. Остаток после выпаривания (4,1 г) очищают путем хроматографии на колонке с диоксидом кремния, элюируя сначала дихлорметаном, затем смесью дихлорметана с метанолом в объемном соотношении 96:4. Получают 3,3 г 5-(N-этиламинокарбонилметил)индан-1-она в виде твердого вещества бледно-розового цвета (Rf = 0,50; тонкослойная хроматография на диоксиде кремния; элюирующее средство: смесь этилацетата с метанолом в объемном соотношении 95:5). 1 Н-ЯМР-спектр (300 мГц, дейтерированный диметилсульфоксид, температура 27 С)в м.д. = 1,03 (3 Н, т, J = 6 Гц, CH3); 2,62 (2 Н, т, J = 6 Гц, СН 2 СО); 2,90-3,15 (4 Н, м, СН 2 и NCH2); 3,50 (2 Н, с, СН 2 СО); 7,30 (1 Н, д, J = 8 Гц, СН аром.); 7,45 (1 Н, с, СН аром.); 7,60 (1 Н, д, J = 8 Гц, СН аром.); 8,12 (1 Н, т, J = 5 Гц, NH). Пример 27. Следуют методике примера 25,но исходят из 0,3 г этил-8-(N,N-диметиламинокарбонилметил)-4,5-дигидро-4-оксо-10 Нимидазо[1,2-а]индено[1,2-е]пиразин-2-карбоксилата, 15 мл диоксана, 15 мл воды и 2,3 мл 1 н раствора гидроксида натрия. Получают 0,2 г 8(N,N-диметиламинокарбонилметил)-4,5-дигидро-4-оксо-10H-имидазо[1,2-а]индено[1,2-е]пиразин-2-карбоновой кислоты в виде твердого вещества цвета охры, плавящегося выше 260 С. Анализ для C18H16N4O4: Рассчитано, %:С 61,36 Н 4,58 N 15,90 О 18,16 Найдено, %: 61,1 4,5 15,6 18,0 Этил-8-(N,N-диметиламинокарбонилметил)-4,5-дигидро-4-оксо-10H-имидазо[1,2-а] индено[1,2-е]пиразин-2-карбоксилат может быть получен следующим образом. Следуют методике примера 26, но исходят из 0,5 г диэтил-1-[5-(N,N-диметиламинокарбонилметил)-1-оксо-индан-2-ил]имидазол 2,4-дикарбоксилата, 4,7 г ацетата аммония и 25 мл уксусной кислоты. Получают 0,3 г этил-8(N,N-диметиламинокарбонилметил)-4,5-дигидро-4-оксо-10 Н-имидазо[1,2-а]индено[1,2-е]пиразин-2-карбоксилата в виде твердого вещества коричневого цвета, плавящегося выше 260 С, используемого таким, какое есть, в последующих стадиях. Диэтил-1-[5-(N,N-диметиламинокарбонилметил)-1-оксо-индан-2-ил]имидазол-2,4-дикарбоксилат может быть получен следующим образом. Следуют методике примера 26 для получения диэтил-1-[5-(N-этиламинокарбонилметил) 41 1-оксо-индан-2-ил]имидазол-2,4-дикарбоксилата, но исходят из 1,2 г диэтил-имидазол-2,4 дикарбоксилата, 150 мл диметилформамида,2,37 г карбоната калия и 2,2 г 2-бром-5-(N,Nдиметиламинокарбонилметил)индан-1-она. Сырой продукт очищают путем хроматографии на колонке с диоксидом кремния, элюируя смесью этилацетата с метанолом в объемном соотношении 90:10. Получают 0,56 г диэтил-[1-[5-(N,Nдиметиламинокарбонилметил)-1-оксо-индан-2 ил]имидазол-2,4-дикарбоксилата в виде воздушной массы кремового цвета. Rf = 0,36 (тонкослойная хроматография на диоксиде кремния,элюирующее средство: смесь этилацетата с метанолом в объемном соотношении 90:10). 2-Бром-5-(N,N-диметиламинокарбонилметил)индан-1-он может быть получен следующим образом. Следуют методике примера 26 для получения 2-бром-5-(N-этиламинокарбонилметил) индан-1-она, но исходят из 2,2 г 5-(N,Nдиметиламинокарбонилметил) индан-1-она, 185 мл дихлорметана, 60 млэтанола и 0,5 мл брома. Сырой продукт хроматографируют на колонке с диоксидом кремния, элюируя смесью этилацетата с метанолом в объемном соотношении 90:10. Получают 2,2 г 2-бром-5-(N,Nдиметиламинокарбонилметил)индан-1-она в виде твердого пастообразного вещества оранжевого цвета Rf = 0,53 (тонкослойная хроматография на диоксиде кремния, элюирующее средство: смесь этилацетата с метанолом в объемном соотношении 90:10) . 5-(N,N-Диметиламинокарбонилметил) индан-1-он может быть получен следующим образом. К смеси 1,9 г (1-оксо-индан-5-ил)уксусной кислоты, 50 мл дихлорметана и 5 капель диметилформамида при перемешивании добавляют 0,86 мл оксалилхлорида и перемешивание продолжают в течение 3 ч при температуре около 20 С. Затем добавляют 1,4 мл триэтиламина,затем 7 мл 2 М раствора диметиламина в толуоле. Перемешивание продолжают в течение ночи. Реакционную смесь обрабатывают с помощью 100 мл дихлорметана и 30 мл дистиллированной воды. Органическую фазу сушат над сульфатом магния, отфильтровывают и выпаривают в роторном испарителе. Получают 2,2 г 5-(N,Nдиметиламинокарбонилметил)-индан-1-она в виде пастообразного твердого вещества коричневого цвета. Rf = 0,44 (тонкослойная хроматография на диоксиде кремния, элюирующее средство: смесь этилацетата с метанолом в объемном соотношении 90:10). Пример 28. К суспензии 0,65 г этил-9 бензилкарбамоил-4,5-дигидро-4-оксо-10Hимидазо[1,2-а]индено[1,2-е]пиразин-2-карбоксилата в 26 мл диоксана добавляют 6,5 мл 6 н соляной кислоты и реакционную среду выдерживают при температуре около 100 С в течение 7 ч. После охлаждения и перемешивания в тече 000218 42 ние часа при температуре около 20 С таким образом полученный осадок отфильтровывают на стеклянном фильтре из фриттированного стекла, промывают 2 раза по 10 мл диоксаном, затем высушивают при 60 С и пониженном давлении. После перекристаллизации из 60 мл смеси диметилформамида с водой в объемном соотношении 2:1 полученного твердого вещества, и после высушивания при 60 С при пониженном давлении получают 0,4 г 9-бензилкарбамоил 4,5-дигидро-4-оксо-10 Н-имидазо[1,2-а]индено[1,2-е]-пиразин-2-карбоновой кислоты в виде твердого вещества белого цвета, температура плавления которого выше 260 С. Анализ для С 22H16N4O41,82 Н 2 О 0,57 C3H7NO: Рассчитано, %: С 66,00 Н 4,03 N 13,99 О 15,98 Найдено, %: 59,8 4,0 13,9 Этил-9-бензилкарбамоил-4,5-дигидро-4 оксо-10 Н-имидазо-[1,2-а]индено[1,2-е]пиразин 2-карбоксилат может быть получен следующим образом. 0,75 г Диэтил-1-(4-бензилкарбамоил-1 оксо-индан-2-ил)имидазол-2,4-дикарбоксилата и 6 г ацетата аммония в виде суспензии в 20 мл уксусной кислоты кипятят с обратным холодильником в течение 1 ч. После охлаждения до температуры вблизи 20 С в реакционную среду добавляют 20 мл воды, выдерживают при перемешивании в течение 30 мин и полученную нерастворимую часть отфильтровывают на стеклянном фильтре из фриттированного стекла,промывают водой, затем сушат при пониженном давлении при 60 С. Таким образом получают 0,65 г этил-9-бензилкарбамоил-4,5 дигидро-4-оксо-10 Н-имидазо[1,2-а]индено-[1,2 е]пиразин-2-карбоксилата в виде твердого вещества серого цвета, температура плавления которого выше 260 С, используемого в таком виде в последующих синтезах. Диэтил-1-(4-бензилкарбамоил-1-оксоиндан-2-ил)имидазол-2,4-дикарбоксилат может быть получен следующим образом. К суспензии 0,31 г диэтил-имидазол-2,4 дикарбоксилата и 1 г карбоната калия в 7 мл ацетона при температуре кипения с обратным холодильником прикапывают раствор 0,5 г 4 бензил-карбамоил-2-бром-индан-1-она в 8 мл ацетона и кипятят с обратным холодильником в течение 15 мин. После охлаждения реакционной среды до температуры около 20 С нерастворимую часть отфильтровывают на стеклянном фильтре из фриттированного стекла и промывают ацетоном. Фильтрат концентрируют досуха при пониженном давлении и сырой продукт,полученный таким образом, очищают путем флэш-хроматографии на колонке с диоксидом кремния, используя смесь этилацетата с дихлорметаном в объемном соотношении 30:70 в качестве элюирующего средства. Таким образом получают 0,35 г диэтил-1-(4-бензилкарбамоил 1-оксо-индан-2-ил)имидазол-2,4-дикарбокси 43 лата в виде масла, используемого в таком виде в последующих синтезах. Пример 29. В атмосфере аргона и при температуре около 20 С к перемешиваемой смеси из 1,75 г этил-8-(2-этоксикарбонилэтил)-4,5 дигидро-4-оксо-10 Н-имидазо[1,2-а]индено[1,2 е]пиразин-2-карбоксилата, 220 мл диоксана и 60 мл воды добавляют 18 мл 1 н раствора гидроксида натрия и перемешивание продолжают в течение 6 ч. Реакционную смесь фильтруют и твердое вещество промывают 2 раза по 20 мл диоксаном и добавляют 30 мл воды. Полученный раствор подкисляют до рН=1 с помощью 1 н соляной кислоты и осадок отфильтровывают,промывают 2 раза по 30 мл дистиллированной водой, затем 2 раза по 30 мл ацетоном и высушивают в вакууме (1 мм рт.ст.; 0,13 кПа) около 50 С. Получают 0,9 г 8-(2-карбоксиэтил)-4,5 дигидро-4-оксо-10H-имидазо[1,2-а]индено[1,2 е]пиразин-2-карбоновой кислоты в виде твердого вещества бежевого цвета с т.пл. выше 290 С. 1 Н-ЯМР-спектр (200 мГц, дейтерированный диметилсульфоксид, температура 27 С)в м.д. = 2,60 (2 Н, т, J = 6 Гц, СН 2 СО 2H); 2,90 (2 Н,т, J = 6 Гц, СН 2); 4,00 (2 Н, с, СН 2); 7,25 (1 Н, д, J(1 Н, д, J = 8 Гц, СН аром.); 8,50 (1 Н, с, Н имидазола); 12,5 (3 Н, с, NHCO и 2 СО 2H). Этил-8-(2-этоксикарбонилэтил)-4,5 дигидро-4-оксо-10 Н-имидазо[1,2-а]индено[1,2 е]пиразин-2-карбоксилат может быть получен следующим образом. Смесь 6,4 г диэтил-1-[5-(2-этоксикарбонилэтил)-1-оксо-индан-2-ил]имидазол-2,4-дикарбоксилата, 158 мл уксусной кислоты и 110 г ацетата аммония кипятят с обратным холодильником в течение 45 мин. К реакционной смеси добавляют 160 мл воды и выпавший осадок отфильтровывают, промывают 2 раза по 20 мл дистиллированной водой, затем 2 раза по 20 мл ацетоном и высушивают на воздухе. Сырой продукт (3 г) кристаллизуют из 300 мл смеси диметилформамида с дистиллированной водой в объемном соотношении 80:20 и кристаллы промывают 2 раза по 30 мл дистиллированной водой и 2 раза по 30 мл ацетоном. После высушивания в вакууме (1 мм рт.ст.; 0,13 кПа) при температуре около 50 С получают 1,8 г этил-8-(2 этоксикарбонилэтил)-4,5-дигидро-4-оксо-10 Нимидазо[1,2-а]-индено[1,2-е]пиразин-2-карбоксилата в виде твердого вещества светло-серого цвета с т.пл. выше 290 С. 1 Н-ЯМР-спектр (200 мГц, дейтерированный диметилсульфоксид, температура 27 С)в м.д. = 1,20 (3 Н, т, J = 6 Гц, CH3); 1,37 (3 Н, т, J = 6 Гц, CH3); 2,68 (2 Н, т, J = 6 Гц, СН 2 СО); 2,90 44 Диэтил-1-[5-(2-этоксикарбонилэтил)-1 оксо-индан-2-ил]-имидазол-2,4-дикарбоксилат может быть получен следующим образом. Смесь 4,6 г диэтил-имидазол-2,4 дикарбоксилата, 94 мл ацетона и 15 г карбоната калия в инертной атмосфере доводят до температуры кипения с обратным холодильником. Затем прикапывают раствор 6,8 г этил-3-(2 бром-1-оксо-индан-5-ил)пропионата в 135 мл ацетона и продолжают кипятить с обратным холодильником в течение 1 ч. Реакционную смесь отфильтровывают при температуре около 20 С и полученное твердое вещество промывают 2 раза по 30 мл ацетоном. Фильтрат выпаривают в роторном испарителе и остаток после выпаривания хроматографируют на колонке с диоксидом кремния, элюируя смесью циклогексана с этилацетатом в объемном соотношении 75:25. Получают 6,4 г диэтил-1-[5-(2 этоксикарбонилэтил)-1-оксо-индан-2-ил] имидазол-2,4-дикарбоксилата в виде твердого вещества светло-оранжевого цвета с т.пл. 106 С. 1(2 Н, т, J = 6 Гц, СН 2) ; 3,40 и 3,88 (1 Н каждый,соответственно, дд, J = 5 и 12 Гц, и дд, J = 8 и 12 Гц, СН 2); 3,90-4,30 (6 Н, м, 3 СН 2 О); 5,85 (1 Н, дд,J = 8 и 5 Гц, NCH); 7,42 (1 Н, д, J = 8 Гц, СН аром.); 7,48 (1 Н, с, СН аром.); 7,65 (1 Н, д, J = 8 Гц, СН аром.); 8,30 (1 Н, с, Н имидазола). Этил-3-(2-бром-1-оксо-индан-5-ил)пропионат может быть получен следующим образом. Смесь 5,8 г этил-3-(1-оксо-индан-5 ил)пропионата, 100 мл тетрагидрофурана и 9,4 г фенилтриметиламмонийбромида перемешивают в течение 1 ч при температуре около 20 С и в инертной атмосфере. Реакционную смесь обрабатывают с помощью 250 мл водного 5%-ного раствора гидрокарбоната натрия и экстрагируют с помощью в целом 375 мл этилацетата. Органический экстракт сушат над сульфатом магния,отфильтровывают и выпаривают в роторном испарителе. Остаток после выпаривания (10,6 г) хроматографируют на колонке с диоксидом кремния, элюируя смесью циклогексана с этилацетатом в объемном соотношении 85:15. Получают 7,3 г этил-3-(2-бром-1-оксо-индан-5 ил)пропионата в виде светло-желтого масла. 1 Н-ЯМР-спектр (300 мГц, дейтерированный диметилсульфоксид, температура 27 С)в м.д. = 1,15 (3 Н, т, J = 6 Гц, CH3); 2,70 (2 Н, т, J = 6 Гц, СН 2 СО); 3,00 (2 Н, т, J = 6 Гц, СН 2); 3,35 и 3,87 (1 Н каждый, соответственно, дд, J = 2 и 12 Гц, и дд, J = 6 и 12 Гц, СН 2); 4,05 (2 Н, к, J = 6 Гц, СН 2 О); 5,02(1 Н, дд, J = 6 и 2 Гц, СНВr); 7,40 45 Этил-3-(1-оксо-индан-5-ил)пропионат может быть получен следующим образом. Смесь 1,15 г этил-3-(1-оксо-индан-5 ил)акрилата, 23 мл этилацетата и 0,11 г 10 %ного палладия-на-угле гидрируют при температуре около 20 С под давлением 2 бара. Реакционную смесь отфильтровывают в инертной атмосфере и фильтрат выпаривают в роторном испарителе. Остаток после выпаривания хроматографируют на колонке с диоксидом кремния,элюируя смесью циклогексана с этилацетатом в объемном соотношении 87,5:12,5. Получают 0,6 г этил-3-(1-оксо-индан-5-ил)-пропионата в виде очень светло-желтого твердого вещества с т.пл. 53 С. 1 Н-ЯМР-спектр (300 мГц, дейтерированный диметилсульфокисд, температура 27 С)в м.д. = 1,12 (3 Н, т, J = 6 Гц, CH3); 2,57 (2 Н, т, J = 6 Гц, CH3); 2,57 (2 Н, т, J = 6 Гц, СН 2 СО); 2,65(2 Н, т, J = 6 Гц, СН 2); 2,98 (2 Н, т, J = 6 Гц,СН 2 СО); 3,05 (2 Н, т, J = 6 Гц, СН 2) ; 4,05 (2 Н, к,J = 6 Гц, СН 2 О); 7,30 (1 Н, д, J = 8 Гц, СН аром.); 7,42 (1 Н, с, СН аром.); 7,58 (1 Н, д, J = 8 Гц, СН аром.). Этил-3-(1-оксо-индан-5-ил)акрилат может быть получен следующим образом. Смесь 63 г 5-бром-индан-1-она, 90 мл трибутиламина, 40,8 мл этилакрилата, 3,65 г три-отолилфосфина и 0,67 г ацетата палладия нагревают до температуры около 100 С. Нагревающую баню при температуре около 105 С убирают и температура реакционной смеси быстро достигает 170 С, затем постепенно снижается. Реакционную среду выдерживают при температуре около 100 С в течение 3 ч. К реакционной смеси добавляют 300 мл 1 н соляной кислоты и экстрагируют с помощью в целом 750 мл этилацетата. Органическую фазу сушат над сульфатом магния, отфильтровывают и выпаривают в роторном испарителе. Остаток после выпаривания (150 г) хроматографируют на колонке с диоксидом кремния, элюируя смесью циклогексана с дихлорметаном в объемном соотношении 50:50. Получают 49,5 г этил-3-(1-оксо-индан-5 ил)акрилата в виде твердого вещества желтого цвета с т.пл. 110 С. 1 Н-ЯМР-спектр (300 мГц, дейтерированный диметилсульфоксид, температура 27 С)в м.д. = 1,30 (3 Н, т, J = 6 Гц, CH3); 2,70 (2 Н, т, J = 6 Гц, СН 2 СО); 3,15 (2 Н, т, J = 6 Гц, СН 2); 4,22= 8 Гц, СН аром.); 7,95 (1 Н, с, СН аром.). 5-Бром-индан-1-он может быть синтезирован как описано J.P. QUERE и Е. MARECHAL,Bull. Soc. Chim. Fr., 8, 2983 (1971). Пример 30. К суспензии 0,56 г этил-9-[(3 метилуреидо)метил]-4,5-дигидро-4-оксо-10Hимидазо[1,2-а]индено[1,2-е]пиразин-2-карбоксилата в смеси диоксана с водой в объемном 46 соотношении 4:1, при перемешивании и при температуре около 20 С, прикапывают 4,4 мл 1 н раствора гидроксида натрия. Таким образом полученный раствор перемешивают в течение 5 ч при той же температуре. Затем реакционную смесь концентрируют досуха при пониженном давлении и полученный остаток обрабатывают 0,5 н соляной кислотой. Образовавшийся осадок отфильтровывают, затем промывают диэтиловым эфиром и ацетоном с получением 0,23 г 9[(3-метилуреидо)метил]-4,5-дигидро-4-оксо 10H-имидазо[1,2-а]индено[1,2-е]пиразин-2 карбоновой кислоты в виде твердого вещества бежевого цвета, температура плавления которого выше 260 С. 1 Н-ЯМР-спектр (250 мГц, дейтерированный диметилсульфоксид, температура 27 С)в м.д. = 2,60 (3 Н, с, NCH3); 4,05 (2 Н, с, СН 2); 4,35(2 Н, с, NCH2); 6,00 (1 Н, с, NH); 6,60 (1 Н, с, NH); 7,25 (1 Н, д, J = 8 Гц, СН аром.); 7,40 (1 Н, т, J = 8 Гц, СН аром.); 7,80 (1 Н, д, J = 8 Гц, СН аром.); 8,55 (1 Н, с, Н имидазола); 12,50 (1 Н, с, NHCO). Этил-9-[(3-метилуреидо)метил]-4,5-дигидро-4-оксо-10 Н-имидазо[1,2-а]индено[1,2-е] пиразин-2-карбоксилат может быть получен согласно следующей методике. К суспензии 0,8 г этил-9-аминометил-4,5 дигидро-4-оксо-10H-имидазо[1,2-а]индено[1,2 е]пиразин-2-карбоксилата в 60 мл диметилформамида при температуре около 20 С прикапывают 0,58 мл метилизоцианата. Реакция продолжается в течение ночи при той же температуре. Нерастворимую часть отфильтровывают,промывают диметилформамидом, затем диэтиловым эфиром. Таким образом получают 0,56 г целевого продукта в виде твердого вещества светло-серого цвета, температура плавления которого выше 260 С. 1 Н-ЯМР-спектр (300 мГц, дейтерированный диметилсульфоксид, температура 27 С)в м.д. = (спектр очень плохо разрешен) 1,4 (3 Н,CH3); 2,6 (3 Н, NCH3); 4,1 (2 Н, СН 2); 4,4 (4 Н,NCH2 и ОСН 2); 7,2-8,6 (4 Н, 3 СН аром. и 1 СН имидазола). Масс-спектр (электронный удар, 70 эв) м/е: 381 (М+), 350, 336, 307, 278, 261, 57. Этил-9-аминометил-4,5-дигидро-4-оксо 10 Н-имидазо[1,2-а]индено[1,2-е]пиразин-2 карбоксилат может быть получен по следующей методике. 1,65 мл гидразингидрата добавляют к суспензии 1,5 г этил-9-фталимидометил-4,5 дигидро-4-оксо-10 Н-имидазо[1,2-а]индено[1,2 е]пиразин-2-карбоксилата в 80 мл этанола и реакционную среду кипятят с обратным холодильником в течение 24 ч. После охлаждения до температуры около 20 С нерастворимую часть отфильтровывают, затем промывают этанолом и диэтиловым эфиром. Таким образом получают 1 г целевого продукта в виде твердого вещества светло-серого цвета.H-ЯМР-спектр (400 мГц, дейтерированный диметилсульфоксид, температура 27 С)в м.д. = 1,35 (3 Н, т, J = 6 Гц, CH3); 3,85 (2 Н, с,NCH2); 4,05 (2 Н, с, CH2); 4,38 (2 Н, к, J = 6 Гц,СН 2 О); 7,40-8,10 (3 Н, м, 3 СН аром.); 8.60 (1 Н, с,Н имидазола). Этил-9-фталимидометил-4,5-дигидро-4 оксо-10 Н-имидазо-[1,2-а]индено[1,2-е]пиразин 2-карбоксилат может быть получен следующим образом. Смесь из 4,35 г этил-1-(4-фталимидометил 1-оксо-индан-2-ил)имидазол-2,4-дикарбоксилата, 40,9 г ацетата аммония и 70 мл уксусной кислоты кипятят с обратным холодильником в течение 7 ч. После охлаждения до температуры около 20 С нерастворимую часть отфильтровывают, промывают водой, затем ацетоном, получая 2 г целевого продукта в виде твердого вещества бежевого цвета, используемого без дальнейшей очистки в последующих синтезах. Масс-спектр (электронный удар, 70 эв) м/е: 454 (М+) , 408, 307, 261, 160. Этил-1-(4-фталимидометил-1-оксо-индан 2-ил)имидазол-2,4-дикарбоксилат может быть синтезирован следующим образом. К суспензии 6,27 г этил-имидазол-2,4 дикарбоксилата и 20,4 г карбоната калия в 180 мл ацетона при температуре кипения с обратным холодильником добавляют 15,2 г 2-бром-4 фталимидометилиндан-1-она в 220 мл ацетона. Реакцию продолжают в течение 3,5 ч при той же температуре. Затем реакционную среду охлаждают до температуры около 20 С и нерастворимую часть отфильтровывают, затем промывают ацетоном. Фильтрат концентрируют досуха при пониженном давлении, после чего обрабатывают этилацетатом и нерастворимую часть отфильтровывают. Таким образом получают этил 1-(4-фталимидометил-1-оксо-индан-2-ил)имидазол-2,4-дикарбоксилат (3,6 г) в виде воздушной массы бежевого цвета. 1 Н-ЯМР-спектр (250 мГц, дейтерированный диметилсульфоксид, температура 27 С)в м.д. = 1,18 (3 Н, т, J = 6 Гц, CH3); 1,33 (3 Н, т, J = 6 Гц, CH3); 3,50 и 4,00 (1 Н каждый, соответственно, дд, J = 16 и 5 Гц, и дд, J = 16 и 8 Гц, СН 2); 4,15 (2 Н, к, J = 6 Гц, СН 2 О); 4,30 (2 Н, к, J = 6 Гц,СН 2 О); 4,90 (2 Н, с, NCH2); 5,91 (1 Н, дд, J = 8 и 5 Гц, NCH); 7,53 (1H, т, J = 8 Гц, СН аром.); 7,72(2 Н, д, J =8 Гц, 2 СН аром.); 7,80-8,00 (4 Н, м, СН фталимида); 8,40 (1H, с, Н имидазола). 2-Бром-4-фталимидометилиндан-1-он может быть получен по следующей методике. В атмосфере азота и при температуре около 0 С к суспензии 15 г 4-фталимидометилиндан-1-она в 100 мл дихлорметана прикапывают в течение примерно 45 мин раствор 2,64 мл брома в 50 мл дихлорметана. Реакцию продолжают в течение 6 ч при температуре около 20 С. После добавления 100 мл дистиллированной воды фазы разделяют путем декантации 48 и органическую фазу промывают водой, сушат над сульфатом магния, отфильтровывают и концентрируют досуха при пониженном давлении, получая 17 г целевого бромсодержащего соединения в виде твердого вещества белого цвета с т.пл. 173 С. 1 Н-ЯМР-спектр (250 мГц, дейтерированный диметилсульфоксид, температура 27 С)в м.д. = 3,50 и 4,05 (1H каждый, соответственно,дд, J = 16 и 2 Гц, и дд, J = 16 и 8 Гц, СН 2); 4,90(2 Н, с, NCH2); 5,10 (1H, дд, J = 8 и 2 Гц, ВrСН); 7,50 (1H, т, J = 8 Гц, СН аром.); 7,70 (2 Н, д, J = 8 Гц, 2 СН аром.); 7,80-8,00 (4 Н, м, СН фталимида). 4-Фталимидометилиндан-1-он может быть получен следующим образом. Раствор хлорангидрида 3-[2-(фталимидометил)фенил]пропионовой кислоты (получают путем взаимодействия 83,39 г 3-[2(фталимидометил)фенил]пропионовой кислоты с 39,3 мл тионилхлорида в 330 мл дихлорметана при температуре 30 С в течение 4,5 ч) в 500 мл 1,2-дихлорэтана прикапывают к суспензии 107,9 г хлорида алюминия в 800 мл 1,2-дихлорэтана при температуре ниже 20 С. Реакцию продолжают в течение ночи при температуре 20 С,затем реакционную среду выливают на лед. Таким образом полученную нерастворимую часть отфильтровывают, промывают водным насыщенным раствором карбоната натрия, затем дистиллированной водой. После высушивания получают 41,1 г 4-фталимидометилиндан-1-она в виде порошка белого цвета с т.пл. 199 С. Экстракция органической фазы и концентрирование досуха приводят к получению дополнительных 30 г целевого продукта. 1 Н-ЯМР-спектр (250 мГц, дейтерированный диметилсульфоксид, температура 27 С)в м.д. = 2,70 (2 Н, т, J = 6 Гц, СН 2 СО); 3,20 (2 Н, т, J= 6 Гц, СН 2); 4,90 (2 Н, с, NCH2); 7,40 (1 Н, т, J = 8 Гц, СН аром.); 7,60 (2 Н, д, J = 8 Гц, 2 СН аром.); 7,80-8,00 (4 Н, м, СН фталимида). 3-[2-(Фталимидометил)фенил]пропионовая кислота может быть получена по следующей методике. К раствору 95 г о-(фталимидометил) коричной кислоты в 900 мл диметилформамида добавляют 4 г 10%-ного палладия-на-угле и помещают в атмосферу водорода под давлением около 1 бара и при температуре около 20 С. После протекания реакции в течение 15 ч реакционную среду фильтруют через целит, нерастворимую часть промывают диметилформамидом,а фильтрат концентрируют досуха при пониженном давлении. Остаток обрабатывают диэтиловым эфиром и нерастворимую часть отфильтровывают и высушивают, получая 88,39 г целевого продукта в виде порошка белого цвета с т.пл. 180 С. 1 Н-ЯМР-спектр (200 мГц, дейтерированный диметилсульфоксид, температура 27 С)в= 6 Гц, СН 2); 4,83 (2 Н, с, NCH2); 7,00-7,40 (4 Н,м, 4 СН аром.); 7,80-8,00 (4 Н, м, СН фталимида); 12,20 (1 Н, с, СООН). о-(Фталимидометил)коричная кислота может быть получена по следующей методике. В колбу в токе азота вводят последовательно 149 г 1-бром-2-фталимидометилбензола,337 мл трибутиламина, 5,7 г три-отолилфосфина, 1 г ацетата палладия и 40 мл акриловой кислоты. Суспензию нагревают в течение 2 ч при 100 С, затем оставляют стоять в течение ночи при температуре около 20 С. Масляную фазу черного цвета декантируют, затем выливают в водный раствор соляной кислоты(170 мл 12 н соляной кислоты в 1 л дистиллированной воды). Выпавший осадок отфильтровывают, промывают водой и высушивают. Полученный сероватый порошок обрабатывают с помощью 500 мл диметилформамида при 60 С и животным углем. Фильтрация через целит и концентрирование досуха фильтрата приводят к желтого цвета пасте, которую обрабатывают диэтиловым эфиром, после чего нерастворимую часть отфильтровывают и высушивают. Получают 95,8 г целевой коричной кислоты в виде белого цвета порошка с т.пл. 234 С. Массспектр (электронный удар, 70 эв) м/е: 307 (М+) ,261, 160, 147, 115. 1-Бром-2-фталимидометилбензол может быть получен следующим образом. Раствор 150 г о-бромбензилбромида в 1,2 л диметилформамида обрабатывают с помощью 155,5 г фталимидата калия и нагревают при 60 С в течение 5 ч. После охлаждения до температуры около 20 С реакционную смесь фильтруют и нерастворимую часть промывают метанолом и высушивают. Таким образом получают 59 г целевого продукта в виде белого цвета порошка с т.пл. 170 С. Фильтрат концентрируют досуха при пониженном давлении и остаток обрабатывают с помощью 200 мл метанола; нерастворимую часть отфильтровывают, промывают метанолом и высушивают, получая дополнительные 88,2 г целевого продукта в виде порошка белого цвета с т.пл. 165 С. 1(4 Н, м, СН фталимида). Пример 31. Раствор 0,4 г диэтил-9 этоксикарбонилметил-4,5-дигидро-4-оксо-10Hимидаза[1,2-а]индено[1,2-е]пиразин-2-фосфоната в 10 мл 6 н соляной кислоты нагревают при 100 С в течение 24 ч. Образовавшуюся нерастворимую часть отфильтровывают, промывают водой, затем ацетоном, получая после высушивания 0,18 г гидрохлорида 9-карбоксиметил-4,5 дигидро-4-оксо-10H-имидазо [1,2-а]индено[1,2 е]пиразин-2-фосфоновой кислоты в виде порошка белого цвета с т.пл. выше 260 С.(1 Н, с, Н имидазола); 12,50 (1 Н, с, NHCO). Диэтил-9-этоксикарбонилметил-4,5-дигидро-4-оксо-10 Н-имидазо[1,2-а]индено[1,2-е]пиразин-2-фосфонат может быть получен по следующей методике. Смесь из 0,995 г диэтил-2-этоксикарбонил 1-(4-этоксикарбонилметил-1-оксо-индан-2-ил) имидазол-4-фосфоната, 7 г ацетата аммония и 20 мл уксусной кислоты кипятят с обратным холодильником в течение 4 ч. После охлаждения до температуры около 20 С реакционную среду выливают в смесь воды с колотым льдом и органическую фазу экстрагируют этилацетатом, экстракт промывают водой, сушат над сульфатом натрия, отфильтровывают и концентрируют досуха при пониженном давлении. Таким образом полученное масло коричневого цвета очищают путем хроматографии при среднем давлении на диоксиде кремния, используя смесь дихлорметана с метанолом в объемном соотношении 98:2 в качестве элюирующего средства. Выделяют 0,4 г целевого продукта в виде сероватого кристаллического порошка. 1 Н-ЯМР-спектр (300 мГц, дейтерированный диметилсульфоксид, температура 27 С)в м.д. = 1,10-1,40 (9 Н, м, 3 CH3); 3,80 (2 Н, с,СОСН 2); 4,00 (2 Н, с, СН 2); 4,05-4,20 (6 Н, м, 3 СН 2 О); 7,22 (1 Н, д, J = 8 Гц, СН аром.); 7,40 (1 Н,т, J = 8 Гц, СН аром.); 7,80 (1H, д, J = 8 Гц, СН аром.); 8,45 (1 Н, с, Н имидазола); 12,50 (1H, с,NHCO). Диэтил-2-этоксикарбонил-1-(4-этоксикарбонилметил-1-оксо-индан-2-ил)имидазол-4 фосфонат может быть получен следующим образом. К суспензии 2,1 г диэтил-2-этоксикарбонилимидазол-4-фосфоната и 7 г карбоната калия в 45 мл ацетона при температуре кипения с обратным холодильником добавляют 3,15 г этил-(2-бром-1-оксо-индан-4-ил)ацетата в 20 мл ацетона. Реакция продолжается 2 ч при той же температуре. Затем реакционную среду охлаждают до температуры около 20 С и нерастворимую часть отфильтровывают, затем промывают ацетоном. Фильтрат концентрируют досуха при пониженном давлении и остаток черного цвета очищают путем флэш-хроматографии на диоксиде кремния, используя этилацетат в качестве элюирующего средства. Таким образом получают 0,995 г целевого продукта в виде желтого масла. 1 51 м.д. = 1,00-1,40 (12 Н, м, 4 CH3); 3,35 и 3,95 (1H каждый, соответственно, дд, J = 16 и 5 Гц, и дд,J = 16 и 8 Гц, СН 2); 3,85 (2 Н, с, СОСН 2); 4,004,20 (8 Н, м, 4 СН 2 О); 5,90 (1H, дд, J = 8 и 5 Гц,NCH); 7,51 (1H, т, J = 8 Гц, СН аром.); 7,70 (2 Н,д, J = 8 Гц, 2 СН аром.); 8,25 (1H, с, Н имидазола). Диэтил-2-этоксикарбонилимидазол-4 фосфонат может быть получен следующим образом. Раствор 1,2 г этил-(гидроксиамино) иминоацетата в 20 мл хлороформа и 1,4 мл триэтиламина охлаждают до температуры около 10 С и прикапывают раствор 1,54 г диэтилэтинилфосфоната в 5 мл хлороформа. Реакционную среду перемешивают в течение ночи при температуре около 20 С, добавляют 0,15 г диэтил-этинилфосфоната и нагревают в течение 1 ч при температуре около 50 С. К реакционной смеси добавляют 50 мл дихлорметана и промывают 3 раза по 40 мл насыщенным раствором хлорида натрия. Органическую фазу выпаривают в роторном испарителе и к остатку после выпаривания добавляют 40 мл диэтилового эфира и отфильтровывают. Фильтрат выпаривают в роторном испарителе с получением желтого масла (2,4 г). К этому маслу добавляют 20 мл ксилола и кипятят с обратным холодильником в течение 20 ч. Жидкую фазу декантируют и выпаривают в роторном испарителе. Остаток после выпаривания очищают путем хроматографии на колонке с диоксидом кремния, элюируя этилацетатом. Получают 0,5 г диэтил-2 этоксикарбонилимидазол-4-фосфоната в виде желтого масла. Масс-спектр (электронный удар) м/е: 276 (М+) ; 247 (276-С 2H5)+; 231 (276 С 2 Н 5O)+; 204 (C6H9N2O4P)+; 157 (С 4H2N2 О 3 Р)+. Этил-(гидроксиамино)иминоацетат может быть синтезирован как описано W.K. WARBURTON, J. Chem. Soc., (С), 1522 (1966). Диэтил-этинилфосфонат может быть синтезирован как описано D.T.MONAGHAN и сотр., Brain Res., 278, 138 (1983). Пример 32. К суспензии 1 г этил-9-(Nметиламинокарбонилметил)-4,5-дигидро-4 оксо-10H-имидазо[1,2-а]индено[1,2-е]пиразин 2-карбоксилата в смеси диоксана с дистиллированной водой в объемном соотношении 100:27 в атмосфере азота и при температуре около 20 С прикапывают 8,2 мл 1 н раствора гидроксида натрия. Реакция продолжается в течение 2 ч при той же температуре. Нерастворимую часть светло-серого цвета отфильтровывают, промывают ацетоном, затем обрабатывают с помощью 15 мл дистиллированной воды. Этот водный раствор отфильтровывают, затем подкисляют до рН 52 слоты в виде порошка белого цвета, температура плавления которого выше 260 С. Анализ для С 17H14N4O43 Н 2 О: Рассчитано, %: С 60,35 Н 4,17 N 16,56 Найдено, %: 60,0 4,1 16,3 1 Н-ЯМР-спектр (300 мГц, дейтерированная уксусная кислота, температура 27 С)в м.д. = 2,7 (3 Н, с, NCH3); 3,9 (2 Н, с, СН 2 СО); 4,1 (2 Н, с,СН 2); 7,2 (1 Н, д, J = 8 Гц, СН аром.); 7,4 (1 Н, т, J[1,2-е]пиразин-2-карбоксилат может быть получен по следующей методике. Смесь из 1,5 г этил-1-[4-(N-метиламинокарбонилметил)-1-оксо-индан-2-ил]имидазол 2,4-дикарбоксилата, 14,2 г ацетата аммония и 60 мл уксусной кислоты в течение 6 ч кипятят с обратным холодильником. После охлаждения до температуры около 20 С нерастворимую часть отфильтровывают, промывают водой, затем ацетоном. Таким образом выделяют 1 г целевого продукта в виде сероватого твердого вещества, температура плавления которого выше 260 С. 1 Н-ЯМР-спектр (300 мГц, дейтерированный диметилсульфоксид, температура 27 С)в м.д. = 1,35 (3 Н, т, J = 6 Гц, CH3); 2,60 (3 Н, д, J = 5 Гц, NCH3); 3,60 (2 Н, с, СН 2 СО); 4,05 (2 Н, с,СН 2); 4,35 (2 Н, к, J = 6 Гц, СН 2 О); 7,20 (1 Н, д, J= 8 Гц, СН аром.); 7,40 (1 Н, т, J = 8 Гц, СН аром.); 7,75 (1 Н, д, J = 8 Гц, СН аром.); 8,60 (1 Н,с, Н имидазола). Этил-2-[4-(N-метиламинокарбонилметил)1-оксо-индан-2-ил]имидазол-2,4-дикарбоксилат может быть получен следующим образом: Раствор из 3,77 г этил-имидазол-2,4 дикарбоксилата, 6,14 г карбоната калия и 0,117 г краун-эфира-18 С-6 в 225 мл диметилформамида в атмосфере азота нагревают в течение 2 ч при температуре 85 С. После охлаждения до температуры около 20 С к реакционной среде прикапывают раствор 5 г N-метил-(2 бром-1-оксо-индан-4-ил)ацетамида в 75 мл диметилформамида. Реакция продолжается в течение ночи при той же температуре. Реакционную среду концентрируют досуха при пониженном давлении, затем остаток обрабатывают дистиллированной водой и органическую фазу экстрагируют дихлорметаном, промывают водой, сушат над сульфатом магния, обрабатывают древесным углем 3S, отфильтровывают и концентрируют досуха при пониженном давлении. Таким образом полученное коричневого цвета масло обрабатывают ацетонитрилом и образовавшийся осадок отфильтровывают и высушивают. Получают 1,5 г целевого продукта в виде твердого вещества белого цвета, который разлагается при 166 С.N-Метил-(2-бром-1-оксо-индан-4-ил) ацетамид может быть получен по следующей методике. В атмосфере азота и при температуре около 0 С к раствору 4,18 г N-метил-(1-оксо-индан 4-ил)ацетамида в смеси дихлорметана (100 мл) с этанолом (150 мл) в течение примерно 30 мин прикапывают 1,05 мл брома в виде раствора в 25 мл дихлорметана. Реакция продолжается в течение 5 ч при температуре около 20 С. Реакционную среду затем концентрируют досуха при пониженном давлении, после чего полученный остаток обрабатывают дихлорметаном. Нерастворимую часть отфильтровывают, промывают этилацетатом и высушивают. Получают 5 г целевого бромсодержащего соединения в виде твердого вещества желтого цвета, используемого без дополнительной очистки в последующих стадиях. 1N-Метил-(1-оксо-индан-4-ил)ацетамид может быть синтезирован следующим образом. В атмосфере азота и при температуре 0 С,раствор 4,5 г (1-оксо-индан-4-ил)уксусной кислоты в 100 мл тетрагидрофурана обрабатывают с помощью 5,7 г N,N'-карбонилдиимидазола. Реакция продолжается в течение полутора часов при температуре около 20 С. После охлаждения до -5 С к реакционной среде добавляют 2,67 г метиламингидрохлорида и продолжают перемешивание в течение ночи при температуре около 20 С. Концентрированно при пониженном давлении реакционной среды приводит к остатку, который обрабатывают дихлорметаном и эту органическую фазу промывают водой,сушат над сульфатом магния, отфильтровывают и концентрируют досуха при пониженном давлении. Таким образом получают 3,9 г целевого амида в виде желтого масла, которое кристаллизуется. Масс-спектр (электронный удар, 70 эв) м/е: 203 (М+) , 146, 117, 58. Пример 33. В атмосфере азота и при температуре около 20 С к суспензии 1,9 г этил-9-(1 этоксикарбонилэтил)-4,5-дигидро-4-оксо-10H 000218 54 имидазо[1,2-а]индено[1,2-е]пиразин-2 карбоксилата в смеси из 245 мл диоксана и 65 мл дистиллированной воды прикапывают 19 мл 1 н раствора гидроксида натрия. Реакция продолжается в течение 4,5 ч при той же температуре. Образующуюся после частичного выпаривания растворителей нерастворимую часть отфильтровывают, промывают водой, затем смесью из 10 мл диметилформамида и 80 мл метанола и высушивают. Твердое вещество растворяют в 20 мл 1 н раствора гидроксида натрия и перемешивают в течение 4 ч при температуре около 20 С. Реакционную среду затем обрабатывают 1 н соляной кислотой до достижения рН=1 и выпавший осадок отфильтровывают,промывают водой, затем ацетоном и высушивают,получая 0,62 г гидрата 9-(1 карбоксиэтил)-4,5-дигидро-4-оксо-10 Н-имидазо[1,2-а]индено[1,2-е]пиразин-2-карбоновой кислоты в виде розового порошка, температура плавления которого выше 260 С. Анализ для С 17 Н 13N3O51,4 Н 2 О: Рассчитано, %: С 60,18 Н 3,86 N 12,38 Найдено, %: 60,1 3,2 12,5 1 Н-ЯМР-спектр (300 мГц, дейтерированный диметилсульфоксид, температура 27 С)в м.д. = 1,5 (3 Н, CH3); 3,9 (1 Н, СН); 4,1 (2 Н, СН 2); 7,3, 7,5, 7,9 (1H каждый, 3 СН аром.); 8,6 (1H,СН имидазола); 12-13,5 (3 Н, 2 СООН и NHCO). Этил-9-(1-этоксикарбонилэтил)-4,5-дигидро-4-оксо-10 Н-имидазо[1,2-а]индено[1,2-е] пиразин-2-карбоксилат может быть получен следующим образом. Смесь из 3,67 г этил-1-[4-(1 этоксикарбонилэтил)-1-оксо-индан-2-ил]имидазол-2,4-дикарбоксилата, 40 г ацетата аммония и 80 мл уксусной кислоты кипятят с обратным холодильником в течение 3 ч. После охлаждения до температуры около 20 С нерастворимую часть отфильтровывают и промывают водой. Таким образом выделяют 1,9 г целевого продукта в виде розового порошка, температура плавления которого выше 260 С и который используют без дополнительной очистки в последующих синтезах. Этил-1-[4-(1-этоксикарбонилэтил)-1-оксоиндан-2-ил]имидазол-2,4-дикарбоксилат может быть получен по следующей методике. Раствор 5,24 г этил-имидазол-2,4 дикарбоксилата и 16 г карбоната калия в 100 мл ацетона в атмосфере азота нагревают до температуры кипения с обратным холодильником. Затем прикапывают раствор 7,7 г этил-2-(2 бром-1-оксо-индан-4-ил)пропионата в 50 мл ацетона и продолжают кипячение с обратным холодильником в течение 3 ч. После охлаждения до температуры около 20 С нерастворимую часть отфильтровывают, промывают ацетоном и фильтрат концентрируют досуха при пониженном давлении. Полученный сырой продукт очищают путем флэш-хроматографии на колонке с диоксидом кремния, используя дихлорме 55 тан, затем смесь дихлорметана с метанолом в объемном соотношении 98:2 в качестве элюирующих средств. Вторая флэш-хроматография на колонке с диоксидом кремния при использовании смеси этилацетата с циклогексаном в объемном соотношении 60:50 в качестве элюирующего средства приводит к 3,67 г целевого продукта в виде оранжевого масла. Этил-2-(2-бром-1-оксо-индан-4-ил)пропионат может быть получен следующим образом. К раствору 5,64 г этилметил-(1-оксоиндан-4-ил)ацетата в 50 мл дихлорметана, в атмосфере азота и при температуре около 15 С,прикапывают 1,2 мл брома в виде раствора в 10 мл дихлорметана. Реакция продолжается в течение 2 ч при температуре около 20 С. После этого к реакционной среде добавляют 40 мл дистиллированной воды и фазу оранжевого цвета отделяют, промывают водой, сушат и концентрируют досуха при пониженном давлении. Получают 7,7 г целевого бромсодержащего соединения в виде масла красновато-коричневого цвета, используемого без дополнительной очистки в последующих стадиях. Этилметил-(1-оксо-индан-4-ил)ацетат может быть синтезирован по следующей методике. К раствору 8,6 г -метил-(1-оксо-индан-4 ил)уксусной кислоты в смеси из 140 мл дихлорметана и 32 мл абсолютированного этанола прикапывают 4 мл оксалилхлорида, поддерживая температуру ниже 25 С. После перемешивания в течение 4 ч при температуре около 20 С,реакционную среду концентрируют досуха при пониженном давлении и остаток обрабатывают дистиллированной водой и дихлорметаном. Органическую фазу отделяют, промывают водой,сушат и концентрируют досуха при пониженном давлении. Полученное масло коричневого цвета очищают путем флэш-хроматографии на диоксиде кремния, используя дихлорметан в качестве элюирующего средства. Таким образом получают 5,64 г целевого сложного эфира в виде красновато-коричневого масла.-Метил-(1-оксо-индан-4-ил)уксусная кислота может быть получена по следующей методике. К 40 г фосфорной кислоты добавляют 50 г пентоксида фосфора и смесь нагревают при 130 С в течение 3 ч. Затем смесь охлаждают до 90 С и при этой температуре вводят 10,4 г 3-[о(1-карбоксиэтил)фенил]пропионовой кислоты. Реакцию продолжают в течение 30 мин при 90 С. После охлаждения до температуры около 20 С, реакционную среду выливают на колотый лед. Органическую фазу экстрагируют этилацетатом, промывают водой, сушат над сульфатом натрия, отфильтровывают и концентрируют досуха при пониженном давлении. Таким образом получают 8,6 г целевого инданона в виде воздушной массы желтого цвета.= 6 Гц, СН); 7,40-7,75 (3 Н, м, 3 СН аром.). 3-[о-(1-Карбоксиэтил)фенил]пропионовая кислота может быть получена следующим образом. 13 г о-(1-Карбоксиэтил)коричной кислоты в виде раствора в 130 мл диметилформамида гидрируют в присутствии 0,9 г 10%-ного палладия-на-угле при температуре около 20 С и под давлением 1,2 бара в течение 3 ч. После отфильтровывания реакционной смеси через целит и промывки нерастворимой части диметилформамидом фильтрат концентрируют досуха при пониженном давлении. Таким образом получают 10,4 г целевой пропионовой кислоты в виде порошка бледно-желтого цвета с т.пл. 154 С. 1H-ЯМР-спектр (200 мГц, дейтерированный диметилсульфоксид, температура 27 С)в м.д. = 1,30 (3 Н, д, J = 6 Гц, CH3); 2,50 (2 Н, м,СОСН 2); 2,90 (2 Н, м, СН 2); 3,90 (1 Н, к, J = 6 Гц,СН); 7,10-7,40 (4 Н, м, 4 СН аром.); 12,30 (2 Н, с,2 СООН). о-(1-Карбоксиэтил)коричная кислота может быть синтезирована следующим образом. В токе азота в колбу вводят последовательно 23,34 г 2-(о-бромфенил)пропионовой кислоты, 400 мл дистиллированной воды, 185 мл водного 1,6 М раствора карбоната натрия,2,24 г ацетата палладия и 10,35 мл акриловой кислоты. Суспензию кипятят с обратным холодильником в течение 17 ч. Затем еще добавляют 5 мл акриловой кислоты и 1 г ацетата палладия и снова кипятят с обратным холодильником в течение 18 ч. После охлаждения до температуры около 20 С, реакционную смесь отфильтровывают, промывают водой, затем подкисляют с помощью 6 н соляной кислоты. Выпавший осадок отфильтровывают, промывают водой, затем дихлорметаном и высушивают. Получают 13 г целевой коричной кислоты в виде коричневого цвета порошка с т.пл. 176 С. 1= 8 Гц, СН аром.); 8,00 (1 Н, д, J = 16 Гц, СН этиленовый); 12,50 (2 Н, с, 2 СООН). 2-(о-Бромфенил)пропионовая кислота может быть получена следующим образом. 17 г Метил-2-(о-бромфенил)пропионата вместе со 100 мл 1 н раствора гидроксида натрия в 100 мл тетрагидрофурана перемешивают в течение 4 ч при температуре около 20 С. Потом реакционную среду подкисляют с помощью 1 н соляной кислоты и органическую фазу экстрагируют дихлорметаном, промывают водой, су 57 шат и концентрируют досуха при пониженном давлении, получая 16,4 г целевой кислоты в виде меренги, используемой без дополнительной очистки в последующих синтезах. Метил-2-(о-бромфенил)пропионат может быть получен по следующей методике. К раствору 15 г о-бромфенилуксусной кислоты в 150 мл дихлорметана при температуре около 20 С добавляют 54 г диметилсульфата. К этому раствору, охлажденному до 5 С, добавляют 37 г измельченного гидроксида калия, затем 4,98 г триэтилбензиламмонийхлорида. Реакция продолжается в течение ночи при температуре около 20 С. Потом реакционную смесь выливают в 100 мл воды и органическую фазу декантируют, промывают с помощью 1 н соляной кислоты, затем водой, сушат и концентрируют досуха при пониженном давлении. Таким образом получают 17 г целевого продукта в виде масла желтого цвета. 1 Н-ЯМР-спектр (250 мГц, дейтерированный диметилсульфоксид, температура 27 С)в м. д. = 1,45 (3 Н, д, J = 6 Гц, CH3); 3,65 (3 Н, с,ОCH3); 4,20 (1 Н, к, J = 6 Гц, СН); 7,20-7,50 (3 Н,м, 3 СН аром.); 7,67 (1 Н, д, J = 8 Гц, СН аром.). Лекарственные средства согласно изобретению состоят из соединения формулы (I) или его соли в чистом виде или в форме композиции, в которой это соединение находится вместе с любым другим фармацевтически приемлемым продуктом, который может быть инертным или физиологически активным. Лекарственные средства согласно изобретению можно вводить орально, парентерально, ректально или топически в эффективном количестве. В качестве твердых композиций для введения орально можно использовать таблетки,пилюли, порошки (желатиновые капсулы, облатки) или гранулы. В этих композициях действующее начало согласно изобретению смешано с одним или несколькими инертными разбавителями, такими как крахмал, целлюлоза, сахароза, лактоза или диоксид кремния, в токе аргона. Эти композиции также могут включать иные,чем разбавители вещества, как например, одну или несколько смазок, таких как стеарат магния или тальк, краситель, защитное покрытие (драже) или лак. В качестве жидких композиций для введения орально можно использовать фармацевтически приемлемые растворы, суспензии, эмульсии, сиропы и эликсиры, содержащие инертные разбавители, такие как вода, этанол, глицерин,растительные масла или парафиновое масло. Помимо разбавителя эти композиции могут содержать другие вещества, как, например, смачиватели, подслащивающие вещества, загустители, ароматизирующие вещества или стабилизаторы. Стерильные композиции для парентерального введения могут представлять собой предпочтительно водные или неводные растворы, 000218 58 суспензии или эмульсии. В качестве растворителя или эксципиента можно использовать воду,пропиленгликоль, полиэтиленгликоль, растительные масла, в особенности оливковое масло,инъецируемые сложные органические эфиры,например как этилолеат, или другие приемлемые органические растворители. Эти композиции также могут содержать добавки, в особенности смачиватели, изотонические агенты,эмульгаторы, диспергаторы и стабилизаторы. Стерилизацию можно осуществлять несколькими путями, например путем асептизирующей фильтрации, включения в композицию стерилизующих агентов, путем облучения или нагревания. Их также можно приготовлять в виде твердых стерильных композиций, которые могут быть растворены в стерильной воде или любой стерильной среде для инъекции в момент употребления. Композиции для ректального введения представляют собой суппозитории или реактальные капсулы, которые содержат, кроме активного продукта, эксципиенты, такие как масло какао, полусинтетические глицериды или полиэтиленгликоли. Композициями для топического применения могут быть, например, кремы, лосьоны,примочки для глаз, жидкости для полоскания полости рта и аппликации на десны, капли в нос или аэрозоли. В терапии человека соединения согласно изобретению особенно пригодны для лечения и/или профилактики состояний, которые требуют введения антагониста рецептора АМПК или антагониста рецептора NMDA. Эти соединения особенно пригодны для лечения или профилактики всех видов ишемий и, в частности церебральной ишемии, эффектов, возникающих вследствие аноксии, развития нейродегенеративных заболеваний, хореи Гентингтона, болезни Альцгеймера и других деменций, бокового амиотрофического склероза или других мотонейронных заболеваний,олевопонтоцеребеллярной атрофии, болезни Паркинсона,против эпилептогенных и/или конвульсивных симптомов, повреждений головного или спинного мозга, травм, связанных с дегенерацией внутреннего уха или сетчатки, шума в ушах,страха, депрессии, шизофрении, синдрома Туретта, гепатических энцефалопатий, расстройств сна, нарушений дефицита вниманий расстройств гормональных состояний (избыток выделения HG или HL, выделение кортикостерона); в качестве анальгетиков, противовоспалительных средств, антианорексических средств против мигреней, противорвотных средств; и для лечения отравлений нейротоксинами или другими агонистами рецептора NMDA или АМПК, также как неврологических расстройств,связанных с вирусными заболеваниями, такими,как вирусные менингиты и энцефалиты, СПИД,бешенство, корь и столбняк; для профилактики, 59 устойчивости и зависимости при симптомах абстаненции к лекарствам (наркотикам), спирту,ингибирует привыкание и зависимость от наркотиков, барбитуратов, амфетамина и бензодиазепинов; для лечения дефицитов, связанных с митохондриальными аномалиями, такими,как митохондриальная миопатия, синдром Лебера, геморрагический полиэнцефалит Вернике,синдром Ретта, гомоцистеинемия, гиперпролинемия, гидроксибутироаминоацидурия, свинцовая энцефалопатия (хроническая интоксикация свинцом) и при дефиците сульфитоксидазы. Дозы зависят от желаемого эффекта, продолжительности лечения и используемого пути введения; обычно они составляют от 10 до 100 мг в день перорально для взрослого человека с разовыми дозами до 5-50 мг активного вещества. Вообще, врач определяет соответствующую дозировку в зависимости от возраста, массы и всех других факторов, присущих излечиваемому субъекту. Следующие примеры иллюстрируют композиции согласно изобретению. Пример А. Обычным способом готовят желатиновые капсулы с дозами по 50 мг активного продукта,имеющие следующий состав, мг: Соединение формулы 1 50 Целлюлоза 18 Лактоза 55 Коллоидальный диоксид кремния 1 Натриевая соль карбоксиметилкрахмала 10 Тальк 10 Стеарат магния 1 Пример Б. Обычным способом готовят таблетки с дозами до 50 мг активного продукта, имеющие следующий состав, мг: Соединение формулы (1) 50 Лактоза 104 Целлюлоза 40 Поливидон 10 Натриевая соль карбоксиметилкрахмала 22 Тальк 10 Стеарат магния 2 Коллоидальный диоксид кремния 2 Смесь гидроксиметилцеллюлозы, глицерина, диоксида титана (72:3,5:24,5) - достаточное количество для одной, покрытой тонкой пленкой, таблетки общей массой 245 мг. Пример В. Готовят раствор для инъекции, содержащий 10 мг активного продукта и имеющий следующий состав, мг: Соединение формулы (1) 10 Бензойная кислота 80 Бензиловый спирт 0,06 мл 60 Бензоат натрия 95%-ный этанол Гидроксид натрия Пропиленгликоль Вода 80 0,4 мл 24 1,6 мл До общего количества 4 мл в которой R означает атом водорода или карбоксил, алкоксикарбонил, -CO-NR4R5, -РО 3H2 или -СН 2 ОН;R4 означает атом водорода или алкильный радикал;R6 означает атом водорода или алкил; или R5 и R6 вместе с атомом азота, с которым они связаны, образуют моно- или полициклический, насыщенный или ненасыщенный, гетероцикл, содержащий 1-6 атомов углерода и, возможно, один или несколько других гетероатомов, выбираемых среди кислорода, серы и азота;R8 означает атом водорода, алкил, циклоалкил или фенилалкил; причем алк означает алкиленовый радикал при условии, что алкоксильные, алкильные и алкиленовые радикалы и части содержат 1-6 атомов углерода и имеют линейную или разветвленную цепь, а циклоалкильные радикалы содержат 3-6 атомов углерода; их соли, энантионеры и диастереоизомеры. 2. Производные формулы (I) по п.1, в которых, когда R5 и R6 с атомом азота, с которым они связаны, образуют гетероцикл, то этот гетероцикл означает азетидиновый, пирролидиновый, пиперидиновый, пиперазиновый или морфолиновый цикл. 3. Производные формулы (I) по п.1 или 2, в которых заместитель R1 находится в положении 8 или 9. 4. Производные формулы (I) по п.1, в которых R означает атом водорода или карбоксильный радикал, R1 означает радикал -алк-NН
МПК / Метки
МПК: A61K 31/495, C07D 487/04, C07F 9/6561
Метки: способы, лекарственное, 1,2-е, получения, 10н-имидазо{1,2-а}индено, промежуточных, продуктов, средство, содержащее, производные, качестве, пиразин-4-она, инданона
Код ссылки
<a href="https://eas.patents.su/30-218-proizvodnye-5n-10n-imidazo12-aindeno-12-e-pirazin-4-ona-sposoby-ih-polucheniya-soderzhashhee-ih-lekarstvennoe-sredstvo-i-proizvodnye-indanona-v-kachestve-promezhutochnyh-produktov.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 5н, 10н-имидазо{1,2-а}индено {1,2-е} пиразин-4-она, способы их получения, содержащее их лекарственное средство и производные инданона в качестве промежуточных продуктов</a>












