Производные пиперазина с антагонистической активностью к рецептору ccr1
Номер патента: 6243
Опубликовано: 27.10.2005
Авторы: Лундквист Грегори Дин Мл., Хэйворд Мэттью Меррилл, Посс Кристофер Стенли, Шавня Андре, Браун Мэттью Фрэнк, Блюмберг Лаура Кук
Формула / Реферат
1. Соединение формулы I
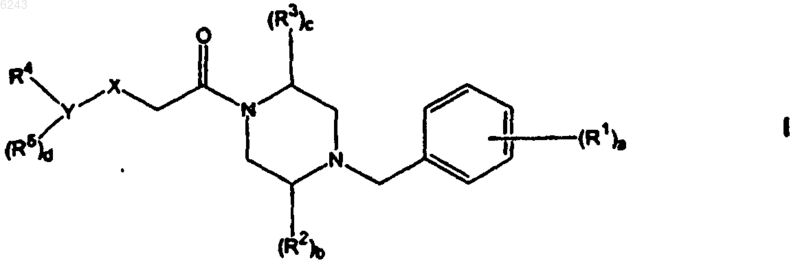
или его фармацевтически приемлемая форма;
где a равно 0, 1, 2, 3, 4 или 5;
b равно 0, 1 или 2;
c равно 0, 1 или 2;
d равно 0, 1, 2, 3 или 4;
X представляет собой -O-, -S-, -CH2- или -NR6-;
Y представляет собой (C6-C10)арил или (C2-C9)гетероарил;
каждый R1 независимо представляет собой H-, HO-, галоген-, (C1-C8)алкил-, (C1-C8)алкил-O-, HO-(C1-C8)алкил-, NC-, H2N-, H2N-(C1-C8)алкил-, HO-(C=O)-, (C1-C8)алкил-(C=O)-, (C1-C8)алкил-(C=O)-(C1-C8)алкил-, H2N-(C=O)- или H2N-(C=O)-(C1-C8)алкил-;
каждый R2 и R3 независимо представляет собой H-, оксо, (C1-C8)алкил-, (C3-C8)циклоалкил-(C1-C8)алкил-, (C6-C10)арил-, (C6-C10)арил-(C1-C8)алкил-, HO-(C1-C8)алкил-, (C1-C8)алкил-O-(C1-C8)алкил-, H2N-(C1-C8)алкил-, (C1-C8)алкил-NH-(C1-C8)алкил-, [(C1-C8)алкил]2N-(C1-C8)алкил-, (C2-C9)гетероциклил-(C1-C8)алкил-, (C3-C8)циклоалкил-NH-(C1-C8)алкил-, (C1-C8)алкил-(C=O)-NH-(C1-C8)алкил-, (C1-C8)алкил-O-(C=O)-NH-(C1-C8)алкил-, H2N-(C=O)-NH-(C1-C8)алкил-, (C1-C8)алкил-SO2-NH-(C1-C8)алкил-, (C2-C9)гетероарил-(C1-C8)алкил-, H2N-(C=O)- или H2N-(C=O)-(C1-C8)алкил-;
R4 представляет собой [HO-(C=O)-][H2N-](C1-C8)алкил-, [HO-(C=O)-][((C1-C8)алкил)2N-](C1-C8)алкил-, HO-(C=O)-(C1-C8)алкил-NH-, HO-(C=O)-(C1-C8)алкил-NH-(C1-C8)алкил-, [HO-(C=O)-(C1-C8)алкил][(C1-C8)алкил]N-, [HO-(C=O)-(C1-C8)алкил][(C1-C8)алкил]N-(C1-C8)алкил-, [HO-(C=O)-(C1-C8)алкил][(C1-C8)алкил-SO2]N-, [HO-(C=O)-(C1-C8)алкил][(C1-C8)алкил-SO2]N-(C1-C8)алкил-, [HO-(C=O)-(C1-C8)алкил][(C1-C8)алкил-(C=O)-]N-, [HO-(C=O)-(C1-C8)алкил][(C1-C8)алкил-(C=O)]N-(C1-C8)алкил-, [HO-(C=O)-(C1-C8)алкил][(C1-C8)алкил-O-(C=O)-]N-, [HO-(C=O)-(C1-C8)алкил][(C1-C8)алкил-O-(C=O)-]N-(C1-C8)алкил-, [HO-(C=O)-(C1-C8)алкил][(C1-C8)алкил-N-(C=O)-]N-, [HO-(C=O)-(C1-C8)алкил][(C1-C8)алкил-NH-(C=O)-]N-(C1-C8)алкил-, HO-(C=O)-(C1-C8)алкил-O-N=(C1-C8)алкил-, HO-(C=O)-(C1-C8)алкил-SO2-, HO-(C=O)-(C1-C8)алкил-SO2-(C1-C8)алкил-, HO-(C=O)-(C1-C8)алкил-SO2-NH-, HO-(C=O)-(C1-C8)алкил-SO2-NH-(C1-C8)алкил-, HO-(C=O)-(C1-C8)алкил-NH-SO2-, HO-(C=O)-(C1-C8)алкил-NH-SO2-(C1-C8)алкил-, HO-(C=O)-(C=O)-NH-SO2-, HO-(C=O)-(C=O)-NH-SO2-(C1-C8)алкил-, HO-(C=O)-(C1-C8)алкил-NH-(C=O)-NH-, HO-(C=O)-(C1-C8)алкил-O-, HO-(C=O)-(C1-C8)алкил-O-(C1-C8)алкил-, HO-(C=O)-(C1-C8)алкил, замещенный гидроксигруппой, HO-(C=O)-(C2-C8)алкенил-, (C1-C9)гетероциклил-(C1-C8)алкил-O-, (C1-C9)гетероциклил-(C1-C8)алкил-O-(C1-C8)алкил-, (C1-C9)гетероарил-(C1-C8)алкил-O-, (C1-C9)гетероарил-(C1-C8)алкил-O-(C1-C8)алкил-, (C1-C9)гетероциклил-O-, (C1-C9)гетероциклил-O-(C1-C8)алкил-, (C1-C9)гетероарил-O-, (C1-C9)гетероарил-O-(C1-C8)алкил-, HO-(C=O)-(C1-C8)алкил-S-, HO-(C=O)-(C1-C8)алкил-S-(C1-C8)алкил-, (C1-C9)гетероциклил-(C1-C8)алкил-S-, (C1-C9)гетероциклил-(C1-C8)алкил-S-(C1-C8)алкил-, (C1-C9)гетероарил-(C1-C8)алкил-S-, (C1-C9)гетероарил-(C1-C8)алкил-S-(C1-C8)алкил-, (C1-C9)гетероциклил-S-, (C1-C9)гетероциклил-S-(C1-C8)алкил-, (C1-C9)гетероарил-S-, (C1-C9)гетероарил-S-(C1-C8)алкил-, HO-(C=O)-(C1-C8)алкил-NH-SO2-NH-, HO-(C=O)-(C1-C8)алкил-NH-SO2-NH-(C1-C8)алкил-, HO-(C=O)-(C1-C8)алкил-SO2-NH-(C=O)-, HO-(C=O)-(C1-C8)алкил-SO2-NH-(C=O)-(C1-C8)алкил-, HO-(C=O)-(C1-C8)алкил-(C=O)-NH-SO2-, HO-(C=O)-(C1-C8)алкил-(C=O)-NH-SO2-(C1-C8)алкил-, HO-(C=O)-(C=O)-, HO-(C=O)-(C=O)-(C1-C8)алкил-, HO-(C=O)-(C1-C8)алкил-(C=O)-, HO-(C=O)-(C1-C8)алкил-(C=O)-(C1-C8)алкил-, HO-(C=O)-(C1-C9)гетероциклил-(C=O)-, HO-(C=O)-(C1-C9)гетероарил-(C=O)-, NC-NH-(C=O)-, NC-NH-(C=O)-(C1-C8)алкил-, [(C1-C8)алкил-SO2-NH-(C=O)-][H2N-](C1-C8)алкил-, (C1-C8)алкил-SO2-NH-(C=O)-, (C1-C8)алкил-SO2-NH-(C=O)-(C1-C8)алкил-, (C1-C8)алкил-SO2-NH-(C=O)-(C1-C8)алкил-NH-, (C1-C8)алкил-SO2-NH-(C=O)-(C1-C8)алкил-NH-(C1-C8)алкил-, [(C1-C8)алкил-SO2-NH-(C=O)-(C1-C8)алкил-][(C1-C8)алкил-]N-, [(C1-C8)алкил-SO2-NH-(C=O)-(C1-C8)алкил][(C1-C8)алкил-]N-(C1-C8)алкил-, (C1-C8)алкил-SO2-NH-(C=O)-(C1-C8)алкил-NH-SO2-, (C1-C8)алкил-SO2-NH-(C=O)-(C1-C8)алкил-NH-SO2-(C1-C8)алкил-, (C1-C8)алкил-SO2-NH-(C=O)-(C1-C8)алкил-SO2-NH-, (C1-C8)алкил-SO2-NH-(C=O)-(C1-C8)алкил-SO2-NH-(C1-C8)алкил-, (C1-C8)алкил-SO2-NH-(C=O)-(C1-C8)алкил-SO2-, (C1-C8)алкил-SO2-NH-(C=O)-(C1-C8)алкил-SO2-(C1-C8)алкил-, (C1-C8)алкил-SO2-NH-(C=O)-(C=O)-, (C1-C8)алкил-SO2-NH-(C=O)-(C=O)-(C1-C8)алкил-, (C1-C8)алкил-SO2-NH-(C=O)-(C1-C8)алкил-(C=O)-, (C1-C8)алкил-SO2-NH-(C=O)-(C1-C8)алкил-(C=O)-(C1-C8)алкил-, NC-(C1-C8)алкил-SO2-NH-(C=O)-, NC-(C1-C8)алкил-SO2-NH-(C=O)-(C1-C8)алкил-, HO-(C1-C8)алкил-SO2-NH-(C=O)-, HO-(C1-C8)алкил-SO2-NH-(C=O)-(C1-C8)алкил-, (C1-C8)алкил-SO2-NH-(C=O)-(C2-C8)алкенил-, (C1-C9)гетероциклил-SO2-NH-(C=O)-, (C1-C9)гетероциклил-SO2-NH-(C=O)-(C1-C8)алкил-, (C1-C9)гетероциклил-(C1-C8)алкил-SO2-NH-(C=O)-, (C1-C9)гетероциклил-(C1-C8)алкил-SO2-NH-(C=O)-(C1-C8)алкил-, (C6-C10)арил-SO2-NH-(C=O)-, (C6-C10)арил-SO2-NH-(C=O)-(C1-C8)алкил-, (C1-C9)гетероарил-SO2-NH-(C=O)-, (C1-C9)гетероарил-SO2-NH-(C=O)-(C1-C8)алкил-, H2N-SO2-NH-(C=O)-, H2N-SO2-NH-(C=O)-(C1-C8)алкил-, (C1-C8)алкил-NH-SO2-NH-(C=O)-, (C1-C8)алкил-HN-SO2-NH-(C=O)-(C1-C8)алкил-, [(C1-C8)алкил]2N-SO2-NH-(C=O)-, [(C1-C8)алкил]2N-SO2-NH-(C=O)-(C1-C8)алкил-, (C1-C8)алкил-SO2-NH-(C=O)-(C1-C8)алкил-O-, (C1-C8)алкил-SO2-NH-(C=O)-(C1-C8)алкил-O-(C1-C8)алкил-, (C1-C8)алкил-(C=O)-NH-SO2-, H2N-SO2-(C1-C8)алкил-, (C1-C8)алкил-(C=O)-NH-SO2-(C1-C8)алкил-, NC-(C1-C8)алкил-(C=O)-NH-SO2-(C1-C8)алкил-, HO-(C1-C8)алкил-(C=O)-NH-SO2-(C1-C8)алкил-, (C6-C10)арил-(C=O)-NH-SO2-, (C6-C10)арил-(C=O)-NH-SO2-(C1-C8)алкил-, (C1-C9)гетероарил-(C=O)-NH-SO2-, (C1-C9)гетероарил-(C=O)-NH-SO2-(C1-C8)алкил-, (C1-C9)гетероциклил-(C=O)-NH-SO2-, (C1-C9)гетероциклил-(C=O)-NH-SO2-(C1-C8)алкил-, H2N-(C=O)-NH-SO2-, H2N-(C=O)-NH-SO2-(C1-C8)алкил-, (C1-C8)алкил-NH-(C=O)-NH-SO2-, (C1-C8)алкил-NH-(C=O)-NH-SO2-(C1-C8)алкил-, [(C1-C8)алкил]2N-(C=O)-NH-SO2-, [(C1-C8)алкил]2N-(C=O)-NH-SO2-(C1-C8)алкил-, (C6-C10)арил-NH-(C=O)-NH-SO2-, (C6-C10)арил-NH-(C=O)-NH-SO2-(C1-C8)алкил-, (C1-C9)гетероарил-NH-(C=O)-NH-SO2-, (C1-C9)гетероарил-NH-(C=O)-NH-SO2-(C1-C8)алкил-, (C1-C8)алкил-O-(C=O)-NH-SO2-, (C1-C8)алкил-O-(C=O)-NH-SO2-(C1-C8)алкил-, (C6-C10)арилокси-(C=O)-NH-SO2-, (C6-C10)арилокси-(C=O)-NH-SO2-(C1-C8)алкил-, (C1-C8)алкил-SO2-NH-(C=O)-O-, (C1-C8)алкил-SO2-NH-(C=O)-O-(C1-C8)алкил-, (C1-C8)алкил-SO2-NH-(C=O)-NH-, (C1-C8)алкил-SO2-NH-(C=O)-NH-(C1-C8)алкил-, (C6-C10)арил-SO2-NH-(C=O)-O-, (C6-C10)арил-SO2-NH-(C=O)-O-(C1-C8)алкил-, (C6-C10)арил-SO2-NH-(C=O)-NH-, (C6-C10)арил-SO2-NH-(C=O)-NH-(C1-C8)алкил-, (C1-C9)гетероарил-SO2-NH-(C=O)-O-, (C1-C9)гетероарил-SO2-NH-(C=O)-O-(C1-C8)алкил-, NH2-SO2-NH-(C=O)-O-, NH2-SO2-NH-(C=O)-O-(C1-C8)алкил-, (C1-C9)гетероарил-SO2-NH-(C=O)-NH-, (C1-C9)гетероарил-SO2-NH-(C=O)-NH-(C1-C8)алкил-, NH2-SO2-NH-(C=O)-NH-, NH2-SO2-NH-(C=O)-NH-(C1-C8)алкил-, HO-(C=O)-(C1-C8)алкил-NH-(C=O)-O-, HO-(C=O)-(C1-C8)алкил-NH-(C=O)-O-(C1-C8)алкил-, HO-(C=O)-(C1-C8)алкил-O-(C=O)-NH-, HO-(C=O)-(C1-C8)алкил-O-(C=O)-NH-(C1-C8)алкил-, (C1-C8)алкил-(C=O)-NH-SO2-NH-, (C1-C8)алкил-(C=O)-NH-SO2-NH-(C1-C8)алкил-, (C6-C10)арил-(C=O)-NH-SO2-NH-, (C6-C10)арил-(C=O)-NH-SO2-NH-(C1-C8)алкил-, (C1-C9)гетероарил-(C=O)-NH-SO2-NH-, (C1-C9)гетероарил-(C=O)-NH-SO2-NH-(C1-C8)алкил-, NH2-(C=O)-NH-SO2-NH-, NH2-(C=O)-NH-SO2-NH-(C1-C8)алкил-, (C1-C9)гетероарил-(C1-C8)алкил-(C=O)-, (C1-C9)гетероциклил-(C1-C8)алкил-(C=O)-, (C1-C9)гетероарил-(C1-C8)алкил-(C=O)-(C1-C8)алкил-, (C1-C9)гетероциклил-(C1-C8)алкил-(C=O)-(C1-C8)алкил-, (C1-C9)гетероарил-(C=O)-(C1-C8)алкил- или (C1-C9)гетероциклил-(C=O)-(C1-C8)алкил-;
или, если Y представляет собой (C2-C9)гетероарильную группу, тогда R4 также может представлять собой HO-(C=O)-(C1-C8)алкил-, (C1-C9)гетероарил-, (C1-C9)гетероциклил-, (C1-C9)гетероарил-(C1-C8)алкил- или (C1-C9)гетероциклил-(C1-C8)алкил-;
каждый R5 независимо представляет собой H-, HO-, галоген-, NC-, HO-(C=O)-, H2N-, (C1-C8)алкил-NH-, [(C1-C8)алкил]2N-, (C1-C8)алкил-, (C1-C8)алкил-O-, HO-(C1-C8)алкил-, (C1-C8)алкил-O-(C1-C8)алкил-, H2N-(C1-C8)алкил-, (C1-C8)алкил-NH-(C1-C8)алкил-, [(C1-C8)алкил]2N-(C1-C8)алкил-, (C1-C8)алкил-(C=O)-, (C1-C8)алкил-(C=O)-(C1-C8)алкил-, (C6-C10)арил-, (C2-C9)гетероарил-, (C6-C10)арилокси-, H2N-(C=O)-, H2N-(C=O)-(C1-C8)алкил-, (C1-C8)алкил-NH-(C=O)-, (C1-C8)алкил-NH-(C=O)-(C1-C8)алкил-, [(C1-C8)алкил]2N-(C=O)-, [(C1-C8)алкил]2N-(C=O)-(C1-C8)алкил-, (C3-C8)циклоалкил-, (C1-C8)алкил-SO2-, NC-(C1-C8)алкил-, (C1-C8)алкил-(C=O)-NH-, H2N-(C=O)-NH- или H2N-(C=O)-NH-(C1-C8)алкил- и R6 представляет собой H, (C1-C8)алкил-, (C1-C8)алкил-(C=O)-, (C6-C10)арил-(C=O)-, (C2-C9)гетероарил-(C=O)-, H2N-(C=O)-, (C1-C8)алкил-NH-(C=O)-, [(C1-C8)алкил]2N-(C=O)-, (C1-C8)алкил-O-(C=O)- или (C1-C8)алкил-SO2-.
2. Соединение по п.1, где R4 представляет собой [HO-(C=O)-][H2N-](C1-C8)алкил-, [HO-(C=O)-][((C1-C8)алкил)2N-](C1-C8)алкил-, HO-(C=O)-(C1-C8)алкил-NH-, HO-(C=O)-(C1-C8)алкил-NH-(C1-C8)алкил-, [HO-(C=O)-(C1-C8)алкил][(C1-C8)алкил]N-, [HO-(C=O)-(C1-C8)алкил][(C1-C8)алкил]N-(C1-C8)алкил, [HO-(C=O)-(C1-C8)алкил][(C1-C8)алкил-SO2]N-, [HO-(C=O)-(C1-C8)алкил][(C1-C8)алкил-SO2]N-(C1-C8)алкил-, [HO-(C=O)-(C1-C8)алкил][(C1-C8)алкил-(C=O)-]N-, [HO-(C=O)-(C1-C8)алкил][(C1-C8)алкил-(C=O)-]N-(C1-C8)алкил-, [HO-(C=O)-(C1-C8)алкил][(C1-C8)алкил-O-(C=O)-]N-, [HO-(C=O)-(C1-C8)алкил][(C1-C8)алкил-O-(C=O)-]N-(C1-C8)алкил-, [HO-(C=O)-(C1-C8)алкил][(C1-C8)алкил-N-(C=O)-]N-, [HO-(C=O)-(C1-C8)алкил][(C1-C8)алкил-NH-(C=O)-]N-(C1-C8)алкил-, HO-(C=O)-(C1-C8)алкил-O-N=(C1-C8)алкил-, HO-(C=O)-(C1-C8)алкил-SO2-, HO-(C=O)-(C1-C8)алкил-SO2-(C1-C8)алкил-, HO-(C=O)-(C1-C8)алкил-SO2-NH-, HO-(C=O)-(C1-C8)алкил-SO2-NH-(C1-C8)алкил-, HO-(C=O)-(C1-C8)алкил-NH-SO2-, HO-(C=O)-(C1-C8)алкил-NH-SO2-(C1-C8)алкил-, HO-(C=O)-(C=O)-NH-SO2-, HO-(C=O)-(C=O)-NH-SO2-(C1-C8)алкил-, HO-(C=O)-(C1-C8)алкил-NH-(C=O)-NH-, HO-(C=O)-(C1-C8)алкил-O-, HO-(C=O)-(C1-C8)алкил-O-(C1-C8)алкил-, HO-(C=O)-(C2-C8)алкенил-, (C2-C9)гетероциклил-(C1-C8)алкил-O-, (C2-C9)гетероциклил-(C1-C8)алкил-O-(C1-C8)алкил-, (C2-C9)гетероарил-(C1-C8)алкил-O-, (C2-C9)гетероарил-(C1-C8)алкил-O-(C1-C8)алкил-, (C2-C9)гетероциклил-O-, (C2-C9)гетероциклил-O-(C1-C8)алкил-, (C2-C9)гетероарил-O-, (C2-C9)гетероарил-O-(C1-C8)алкил-, HO-(C=O)-(C1-C8)алкил-S-, HO-(C=O)-(C1-C8)алкил-S-(C1-C8)алкил-, (C2-C9)гетероциклил-(C1-C8)алкил-S-, (C2-C9)гетероциклил-(C1-C8)алкил-S-(C1-C8)алкил-, (C2-C9)гетероарил-(C1-C8)алкил-S-, (C2-C9)гетероарил-(C1-C8)алкил-S-(C1-C8)алкил-, (C2-C9)гетероциклил-S-, (C2-C9)гетероциклил-S-(C1-C8)алкил-, (C2-C9)гетероарил-S-, (C2-C9)гетероарил-S-(C1-C8)алкил-, HO-(C=O)-(C1-C8)алкил-NH-SO2-NH-, HO-(C=O)-(C1-C8)алкил-NH-SO2-NH-(C1-C8)алкил-, HO-(C=O)-(C1-C8)алкил-SO2-NH-(C=O)-, HO-(C=O)-(C1-C8)алкил-SO2-NH-(C=O)-(C1-C8)алкил-, HO-(C=O)-(C1-C8)алкил-(C=O)-NH-SO2-, HO-(C=O)-(C1-C8)алкил-(C=O)-NH-SO2-(C1-C8)алкил-, HO-(C=O)-(C=O)-, HO-(C=O)-(C=O)-(C1-C8)алкил-, HO-(C=O)-(C1-C8)алкил-(C=O)-, HO-(C=O)-(C1-C8)алкил-(C=O)-(C1-C8)алкил-, HO-(C=O)-(C2-C9)гетероциклил-(C=O)-, HO-(C=O)-(C2-C9)гетероарил-(C=O)-, NC-NH-(C=O)-, NC-NH-(C=O)-(C1-C8)алкил-, [(C1-C8)алкил-SO2-NH-(C=O)-][H2N-](C1-C8)алкил-, (C1-C8)алкил-SO2-NH-(C=O)-, (C1-C8)алкил-SO2-NH-(C=O)-(C1-C8)алкил-, (C1-C8)алкил-SO2-NH-(C=O)-(C1-C8)алкил-NH-, (C1-C8)алкил-SO2-NH-(C=O)-(C1-C8)алкил-NH-(C1-C8)алкил-, [(C1-C8)алкил-SO2-NH-(C=O)-(C1-C8)алкил-][(C1-C8)алкил-]N-, [(C1-C8)алкил-SO2-NH-(C=O)-(C1-C8)алкил-][(C1-C8)алкил-]N-(C1-C8)алкил-, (C1-C8)алкил-SO2-NH-(C=O)-(C1-C8)алкил-NH-SO2-, (C1-C8)алкил-SO2-NH-(C=O)-(C1-C8)алкил-NH-SO2-(C1-C8)алкил-, (C1-C8)алкил-SO2-NH-(C=O)-(C1-C8)алкил-SO2-NH-, (C1-C8)алкил-SO2-NH-(C=O)-(C1-C8)алкил-SO2-NH-(C1-C8)алкил-, (C1-C8)алкил-SO2-NH-(C=O)-(C1-C8)алкил-SO2-, (C1-C8)алкил-SO2-NH-(C=O)-(C1-C8)алкил-SO2-(C1-C8)алкил-, (C1-C8)алкил-SO2-NH-(C=O)-(C=O)-, (C1-C8)алкил-SO2-NH-(C=O)-(C=O)-(C1-C8)алкиы-, (C1-C8)алкил-SO2-NH-(C=O)-(C1-C8)алкил-(C=O)-, (C1-C8)алкил-SO2-NH-(C=O)-(C1-C8)алкил-(C=O)-(C1-C8)алкил-, NC-(C1-C8)алкил-SO2-NH-(C=O)-, NC-(C1-C8)алкил-SO2-NH-(C=O)-(C1-C8)алкил-, HO-(C1-C8)алкил-SO2-NH-(C=O)-, HO-(C1-C8)алкил-SO2-NH-(C=O)-(C1-C8)алкил-, (C1-C8)алкил-SO2-NH-(C=O)-(C2-C8)алкенил-, (C2-C9)гетероциклил-SO2-NH-(C=O)-, (C2-C9)гетероциклил-SO2-NH-(C=O)-(C1-C8)алкил-, (C2-C9)гетероциклил-(C1-C8)алкил-SO2-NH-(C=O)-, (C2-C9)гетероциклил-(C1-C8)алкил-SO2-NH-(C=O)-(C1-C8)алкил-, (C6-C10)арил-SO2-NH-(C=O)-, (C6-C10)арил-SO2-NH-(C=O)-(C1-C8)алкил-, (C2-C9)гетероарил-SO2-NH-(C=O)-, (C2-C9)гетероарил-SO2-NH-(C=O)-(C1-C8)алкил-, H2N-SO2-NH-(C=O)-, H2N-SO2-NH-(C=O)-(C1-C8)алкил-, (C1-C8)алкил-NH-SO2-NH-(C=O)-, (C1-C8)алкил-HN-SO2-NH-(C=O)-(C1-C8)алкил-, [(C1-C8)алкил]2N-SO2-NH-(C=O)-, [(C1-C8)алкил]2N-SO2-NH-(C=O)-(C1-C8)алкил-, (C1-C8)алкил-SO2-NH-(C=O)-(C1-C8)алкил-O-, (C1-C8)алкил-SO2-NH-(C=O)-(C1-C8)алкил-O-(C1-C8)алкил-, (C1-C8)алкил-(C=O)-NH-SO2-, H2N-SO2-(C1-C8)алкил-, (C1-C8)алкил-(C=O)-NH-SO2-(C1-C8)алкил-, NC-(C1-C8)алкил-(C=O)-NH-SO2-(C1-C8)алкил-, HO-(C1-C8)алкил-(C=O)-NH-SO2-(C1-C8)алкил-, (C6-C10)арил-(C=O)-NH-SO2-, (C6-C10)арил-(C=O)-NH-SO2-(C1-C8)алкил-, (C2-C9)гетероарил-(C=O)-NH-SO2-, (C2-C9)гетероарил-(C=O)-NH-SO2-(C1-C8)алкил-, (C2-C9)гетероциклил-(C=O)-NH-SO2-, (C2-C9)гетероциклил-(C=O)-NH-SO2-(C1-C8)алкил-, H2N-(C=O)-NH-SO2-, H2N-(C=O)-NH-SO2-(C1-C8)алкил-, (C1-C8)алкил-NH-(C=O)-NH-SO2-, (C1-C8)алкил-NH-(C=O)-NH-SO2-(C1-C8)алкил-, [(C1-C8)алкил]2N-(C=O)-NH-SO2-, [(C1-C8)алкил]2N-(C=O)-NH-SO2-(C1-C8)алкил-, (C6-C10)арил-NH-(C=O)-NH-SO2-, (C6-C10)арил-NH-(C=O)-NH-SO2-(C1-C8)алкил-, (C2-C9)гетероарил-NH-(C=O)-NH-SO2-, (C2-C9)гетероарил-NH-(C=O)-NH-SO2-(C1-C8)алкил-, (C1-C8)алкил-O-(C=O)-NH-SO2-, (C1-C8)алкил-O-(C=O)-NH-SO2-(C1-C8)алкил-, (C6-C10)арилокси-(C=O)-NH-SO2-, (C6-C10)арилокси-(C=O)-NH-SO2-(C1-C8)алкил-, (C1-C8)алкил-SO2-NH-(C=O)-O-, (C1-C8)алкил-SO2-NH-(C=O)-O-(C1-C8)алкил-, (C1-C8)алкил-SO2-NH-(C=O)-NH-, (C1-C8)алкил-SO2-NH-(C=O)-NH-(C1-C8)алкил-, (C6-C10)арил-SO2-NH-(C=O)-O-, (C6-C10)арил-SO2-NH-(C=O)-O-(C1-C8)алкил-, (C6-C10)арил-SO2-NH-(C=O)-NH-, (C6-C10)арил-SO2-NH-(C=O)-NH-(C1-C8)алкил-, (C2-C9)гетероарил-SO2-NH-(C=O)-O-, (C2-C9)гетероарил-SO2-NH-(C=O)-O-(C1-C8)алкил-, NH2-SO2-NH-(C=O)-O-, NH2-SO2-NH-(C=O)-O-(C1-C8)алкил-, (C2-C9)гетероарил-SO2-NH-(C=O)-NH-, (C2-C9)гетероарил-SO2-NH-(C=O)-NH-(C1-C8)алкил-, NH2-SO2-NH-(C=O)-NH-, NH2-SO2-NH-(C=O)-NH-(C1-C8)алкил-, HO-(C=O)-(C1-C8)алкил-NH-(C=O)-O-, HO-(C=O)-(C1-C8)алкил-NH-(C=O)-O-(C1-C8)алкил-, HO-(C=O)-(C1-C8)алкил-O-(C=O)-NH-, HO-(C=O)-(C1-C8)алкил-O-(C=O)-NH-(C1-C8)алкил-, (C1-C8)алкил-(C=O)-NH-SO2-NH-, (C1-C8)алкил-(C=O)-NH-SO2-NH-(C1-C8)алкил-, (C6-C10)арил-(C=O)-NH-SO2-NH-, (C6-C10)арил-(C=O)-NH-SO2-NH-(C1-C8)алкил-, (C2-C9)гетероарил-(C=O)-NH-SO2-NH-, (C2-C9)гетероарил-(C=O)-NH-SO2-NH-(C1-C8)алкил-, NH2-(C=O)-NH-SO2-NH- или NH2-(C=O)-NH-SO2-NH-(C1-C8)алкил-;
или, если Y представляет собой (C2-C9)гетероарильную группу, тогда R4 также может представлять собой HO-(C=O)-(C1-C8)алкил-, (C2-C9)гетероарил-, (C2-C9)гетероциклил-, (C2-C9)гетероарил-(C1-C8)алкил- или (C2-C9)гетероциклил-(C1-C8)алкил-.
3. Соединение по п.1 или 2, где фармацевтически приемлемая форма представляет собой его фармацевтически приемлемую соль или пролекарство.
4. Соединение по п.1, 2 или 3, в котором стереохимия является такой, как показано формулой Ia, b равно 0 или 1 и c равно 1
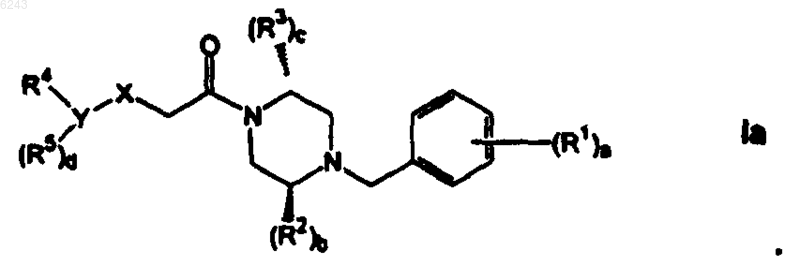
5. Соединение по п.4, где каждый R1 независимо представляет собой H-, HO-, галоген, NC-, (C1-C8)алкил- или (C1-C8)алкил-O-; и a равно 1 или 2.
6. Соединение по п.4, где каждый R2 и R3 независимо представляет собой H-, (C1-C8)алкил-, (C3-C8)циклоалкил-, (C3-C8)циклоалкил-(C1-C8)алкил-, (C6-C10)арил-, (C6-C10)арил-(C1-C8)алкил-, HO-(C1-C8)алкил-, H2N-(C1-C8)алкил-, (C1-C9)гетероциклил-(C1-C8)алкил-, (C1-C8)алкил-O-(C=O)-NH-(C1-C8)алкил-, H2N-(C=O)-NH-(C1-C8)алкил-, (C1-C8)алкил-SO2-NH-(C1-C8)алкил-, (C1-C9)гетероарил-(C1-C8)алкил-, H2N-(C=O)- шыш H2N-(C=O)-(C1-C8)алкил-.
7. Соединение по п.4, где R4 представляет собой [HO-(C=O)-][H2N-](C1-C8)алкил-, [HO-(C=O)-][((C1-C8)алкил)2N-](C1-C8)алкил-, HO-(C=O)-(C1-C8)алкил-NH-, HO-(C=O)-(C1-C8)алкил-NH-(C1-C8)алкил-, [HO-(C=O)-(C1-C8)алкил][(C1-C8)алкил]N-, [HO-(C=O)-(C1-C8)алкил][(C1-C8)алкил]N-(C1-C8)алкил-, (C1-C8)алкил-SO2-NH-(C=O)-(C1-C8)алкил-, NC-(C1-C8)алкил-SO2-NH-(C=O)-(C1-C8)алкил-, HO-(C1-C8)алкил-SO2-NH-(C=O)-(C1-C8)алкил-, (C1-C9)гетероциклил-SO2-NH-(C=O)-(C1-C8)алкил-, (C1-C9)гетероциклил-(C1-C8)алкил-SO2-NH-(C=O)-(C1-C8)алкил-, (C1-C9)гетероарил-SO2-NH-(C=O)-(C1-C8)алкил-, H2N-SO2-NH-(C=O)-(C1-C8)алкил-, (C1-C8)алкил-NH-SO2-NH-(C=O)-, (C1-C8)алкил-SO2-NH-(C=O)-(C1-C8)алкил-O-, (C1-C8)алкил-SO2-NH-(C=O)-(C1-C8)алкил-O-(C1-C8)алкил-, H2N-SO2-(C1-C8)алкил-, (C1-C8)алкил-(C=O)-NH-SO2-(C1-C8)алкил-, NC-(C1-C8)алкил-(C=O)-NH-SO2-(C1-C8)алкил-, HO-(C1-C8)алкил-(C=O)-NH-SO2-(C1-C8)алкил-, (C1-C9)гетероарил-(C=O)-NH-SO2-(C1-C8)алкил-, (C1-C9)гетероциклил-(C=O)-NH-SO2-(C1-C8)алкил-, H2N-(C=O)-NH-SO2-(C1-C8)алкил-, (C1-C8)алкил-NH-(C=O)-NH-SO2-(C1-C8)алкил-, (C1-C8)алкил-SO2-NH-(C=O)-NH-(C1-C8)алкил-, (C1-C8)алкил-(C=O)-NH-SO2-NH-(C1-C8)алкил-, HO-(C=O)-(C1-C8)алкил-O-, HO-(C=O)-(C1-C8)алкил-O-(C1-C8)алкил-, (C1-C8)алкил-SO2-NH-(C=O)-(C1-C8)алкил-O-, (C1-C9)гетероциклил-(C1-C8)алкил-O-, (C1-C9)гетероциклил-(C1-C8)алкил-O-(C1-C8)алкил-, (C1-C9)гетероарил-(C1-C8)алкил-O-, (C1-C9)гетероарил-(C1-C8)алкил-O-(C1-C8)алкил-, (C1-C9)гетероциклил-O-, (C1-C9)гетероциклил-O-(C1-C8)алкил-, (C1-C9)гетероарил-O-, (C1-C9)гетероарил-O-(C1-C8)алкил-, HO-(C=O)-(C1-C8)алкил-S-, HO-(C=O)-(C1-C8)алкил-S-(C1-C8)алкил-, (C1-C9)гетероциклил-(C1-C8)алкил-S-, (C1-C9)гетероциклил-(C1-C8)алкил-S-(C1-C8)алкил-, (C1-C9)гетероарил-(C1-C8)алкил-S-, (C1-C9)гетероарил-(C1-C8)алкил-S-(C1-C8)алкил-, (C1-C9)гетероциклил-S-, (C1-C9)гетероциклил-S-(C1-C8)алкил-, (C1-C9)гетероарил-S-, (C1-C9)гетероарил-S-(C1-C8)алкил-, HO-(CO)-(C1-C8)алкил-SO2-, HO-(C=O)-(C1-C8)алкил-SO2-(C1-C8)алкил-, HO-(C=O)-(C=O)-(C1-C8)алкил-, HO-(C=O)-(C1-C8)алкил-(C=O)-, HO-(C=O)-(C1-C8)алкил-(C=O)-(C1-C8)алкил-, (C1-C9)гетероарил-(C1-C8)алкил-(C=O)- или (C1-C9)гетероциклил-(C1-C8)алкил-(C=O)-.
8. Соединение по п.7, где a равно 1 или 2;
X представляет собой -O- или -NR6-;
Y представляет собой (C6-C10)арил или (C1-C9)гетероарил;
каждый R1 независимо представляет собой H-, HO-, галоген, NC-, (C1-C8)алкил- или (C1-C8)алкил-O-;
R2 и R3, каждый независимо, представляет собой H-, (C1-C8)алкил-, (C3-C8)циклоалкил-, (C3-C8)циклоалкил-(C1-C8)алкил-, (C6-C10)арил-, (C6-C10)арил-(C1-C8)алкил-, HO-(C1-C8)алкил-, H2N-(C1-C8)алкил-, (C1-C9)гетероциклил-(C1-C8)алкил-, (C1-C8)алкил-O-(C=O)-NH-(C1-C8)алкил-, H2N-(C=O)-NH-(C1-C8)алкил-, (C1-C8)алкил-SO2-NH-(C1-C8)алкил-, (C1-C9)гетероарил-(C1-C8)алкил-, H2N-(C=O)-или H2N-(C=O)-(C1-C8)алкил-;
Y представляет собой (C6-C10)арил или (C1-C9)гетероарил и
R5 представляет собой H-, HO-, NC-, (C1-C8)алкил-, (C1-C8)алкил-O-, (C1-C8)алкил-(C=O)- или галоген.
9. Соединение по п.7, где a равно 1 или 2;
d равно 1 или 2;
X представляет собой -O-;
Y представляет собой (C6-C10)арил;
R1 представляет собой галоген;
R2 представляет собой H- или (C1-C8)алкил-;
R3 представляет собой (C1-C8)алкил- и
R5 представляет собой H-, галоген, (C1-C8)алкил- или (C1-C8)алкил-O-.
10. Соединение, выбранное из группы, состоящей из
(2-{2-[4-(4-фторбензил)-(2R)-2-метилпиперазин-1-ил]-2-оксоэтокси}-5-трифторметилфенил)метансульфонамида;
(2-{3-[4-(4-фторбензил)-(2R,5S)-2,5-диметилпиперазин-1-ил]-3-оксопропил}-5-метилфенокси)уксусной кислоты;
(4-хлор-2-{2-[4-(4-фторбензил)-(2R)-2-метилпиперазин-1-ил]-2-оксоэтокси}фенил)уксусной кислоты;
(5-бром-2-{2-[(2R)-2-этил-4-(4-фторбензил)пиперазин-1-ил]-2-оксоэтокси}фенил)метансульфонамида;
(5-бром-2-{2-[4-(4-хлорбензил)-(2R)-2-метилпиперазин-1-ил]-2-оксоэтокси}фенил)метансульфонамида;
(5-хлор-2-{2-[(2R)-2-этил-4-(4-фторбензил)пиперазин-1-ил]-2-оксоэтокси}фенил)уксусной кислоты;
(5-хлор-2-{2-[4-(4-хлорбензил)-(2R,5S)-2,5-диметилпиперазин-1-ил]-2-оксоэтокси}фенил)уксусной кислоты;
(5-хлор-2-{2-[4-(4-фторбензил)-(2R,5S)-2,5-диметилпиперазин-1-ил]-2-оксоэтокси}бензилокси)ацетилметансульфонамида;
[(5-хлор-2-{2-[4-(4-фторбензил)-(2R,5S)-2,5-диметилпиперазин-1-ил]-2-оксоэтиламино}пиридин-3-карбонил)амино]уксусной кислоты;
2-(5-хлор-2-{2-[4-(4-фторбензил)-(2R,5S)-2,5-диметилпиперазин-1-ил]-2-оксоэтокси}фенокси)-4-метилтиазол-5-карбоновой кислоты;
3-(2-{2-[4-(4-фторбензил)-(2R,5S)-2,5-диметилпиперазин-1-ил]-2-оксоэтокси}-5-метилфенил)пропионовой кислоты;
3-(5-хлор-2-{2-[4-(4-фторбензил)-(2R)-2-метилпиперазин~1-ил]-2-оксоэтокси}фенил)акриловой кислоты;
3-[3-(5-хлор-2-{2-[4-(4-фторбензил)-(2R)-2-метилпиперазин-1-ил]-2-оксоэтокси}фенил)уреидо]пропионовой кислоты;
4-(5-хлор-2-{2-[4-(4-фторбензил)-(2R)-2-метилпиперазин-1-ил]-2-оксоэтокси}фенил)-4-оксомасляной кислоты;
5-(5-хлор-2-{2-[4-(4-фторбензил)-(2R,5S)-2,5-диметилпиперазин-1-ил]-2-оксоэтокси}фенокси)-5-метилпиримидин-2,4,6-триона;
6-(5-хлор-2-{2-[4-(4-фторбензил)-(2R,5S)-2,5-диметилпиперазин-1-ил]-2-оксоэтокси}феноксиметил)никотиновой кислоты;
C-(5-хлор-2-{2-[4-(4-фторбензил)-(2R)-2-метилпиперазин-1-ил]-2-оксоэтокси}фенил)-N-(3-гидрокси-3-метилбутирил)метансульфонамида;
C-(5-хлор-2-{2-[4-(4-фторбензил)-(2R,5S)-2,5-диметилпиперазин-1-ил]-2-оксоэтокси}фенил)-N-гидроксиацетилметансульфонамида;
N-[(2-{2-[4-(4-фторбензил)-(2R,5S)-2,5-диметилпиперазин-1-ил]-2-оксоэтокси}-4-метоксифенил)ацетил]метансульфонамида и
N-[(5-хлор-2-{2-[4-(4-фторбензил)-(2R,5S)-2,5-диметилпиперазин-1-ил]-2-оксоэтокси}фенил)ацетил]-4-фторбензолсульфонамида
или их фармацевтически приемлемой формы.
11. Соединение, выбранное из группы, состоящей из
(2S)-2-амино-4-(5-хлор-2-{2-[4-(4-фторбензил)-(2R,5S)-2,5-диметилпиперазин-1-ил]-2-оксоэтокси}фенокси)масляной кислоты;
(4S)-4-(5-хлор-2-{2-[4-(4-фторбензил)-(2R,5S)-2,5-диметилпиперазин-1-ил]-2-оксоэтокси}фенокси)пирролидин-(2S)-2-карбоновой кислоты;
(5-бром-2-{2-[4-(4-фторбензил)-(2R,5S)-2,5-диметилпиперазин-1-ил]-2-оксоэтокси}бензилиденаминоокси)уксусной кислоты;
(5-бром-2-{2-[4-(4-фторбензил)-(2R,5S)-2,5-диметилпиперазин-1-ил]-2-оксоэтокси}фенокси)уксусной кислоты;
(5-хлор-2-{2-[4-(4-фторбензил)-(2R,5S)-2,5-диметилпиперазин-1-ил]-2-оксоэтокси}бензиламино)уксусной кислоты;
(5-хлор-2-{2-[4-(4-фторбензил)-(2R,5S)-2,5-диметилпиперазин-1-ил]-2-оксоэтокси}бензилсульфамоил)уксусной кислоты;
1-(5-хлор-2-{2-[4-(4-фторбензил)-(2R,5S)-2,5-диметилпиперазин-1-ил]-2-оксоэтокси}фенил)-2-(1H-тетразол-5-ил)этанона;
3-(5-хлор-2-{2-[4-(4-фторбензил)-(2R,5S)-2,5-диметилпиперазин-1-ил]-2-оксоэтокси}фенил)акриловой кислоты;
3-[3-(5-хлор-2-{2-[4-(4-фторбензил)-(2R,5S)-2,5-диметилпиперазин-1-ил]-2-оксоэтокси}фенил)уреидо]пропионовой кислоты;
4-(5-хлор-2-{2-[4-(4-фторбензил)-(2R,5S)-2,5-диметилпиперазин-1-ил]-2-оксоэтокси}фенокси)пиридин-2-карбоновой кислоты;
4-(5-хлор-2-{2-[4-(4-фторбензил)-(2R,5S)-2,5-диметилпиперазин-1-ил]-2-оксоэтокси}фенил)-4-оксомасляной кислоты;
4-(5-хлор-2-{2-[4-(4-фторбензил)-(2R,5S)-2,5-диметилпиперазин-1-ил]-2-оксоэтокси}пиридин-3-иламино)масляной кислоты;
5-(5-хлор-2-{2-[4-(4-фторбензил)-(2R,5S)-2,5-диметилпиперазин-1-ил]-2-оксоэтокси}фенил)-5-оксопентановой кислоты;
5-(хлор-2-{2-[4-(4-фторбензил)-(2R,5S)-2,5-диметилпиперазин-1-ил]-2-оксоэтокси}бензилиденаминоокси)уксусной кислоты;
6-(5-хлор-2-{2-[4-(4-фторбензил)-(2R,5S)-2,5-диметилпиперазин-1-ил]-2-оксоэтокси}фенокси)никотиновой кислоты;
C-(5-хлор-2-{2-[4-(4-фторбензил)-(2R,5S)-2,5-диметилпиперазин-1-ил]-2-оксоэтокси}фенил)-N-гидроксиацетилметансульфонамида;
N-[(5-бром-2-{2-[4-(4-фторбензил)-(2R)-2-метилпиперазин-1-ил]-2-оксоэтокси}фенил)ацетил]метансульфонамида ;
N-[(5-хлор-2-{2-[4-(4-фторбензил)-(2R)-2-метилпиперазин-1-ил]-2-оксоэтокси}фенил)ацетил]метансульфонамида;
N-[(5-хлор-2-{2-[4-(4-фторбензил)-(2R,5S)-2,5-диметилпиперазин-1-ил]-2-оксоэтокси}фенил)ацетил]метансульфонамида и
N-[(5-хлор-2-{2-[4-(4-фторбензил)-(2R,5S)-2,5-диметилпиперазин-1-ил]-2-оксоэтокси}пиридин-3-ил)ацетил]метансульфонамида
или их фармацевтически приемлемой формы.
12. Соединение, выбранное из группы, состоящей из
(2R)-2-(5-хлор-2-{2-[4-(4-фторбензил)-(2R)-2-метилпиперазин-1-ил]-2-оксоэтокси}фенокси)пропионовой кислоты;
(4S)-4-(5-хлор-2-{2-[4-(4-фторбензил)-(2R,5S)-2,5-диметилпиперазин-1-ил]-2-оксоэтокси}фенокси)пирролидин-2-карбоновой кислоты;
(5-хлор-2-{2-[4-(4-фторбензил)-(2R)-2-метилпиперазин-1-ил]-2-оксоэтокси}фенил)уксусной кислоты;
(5-хлор-2-{2-[4-(4-фторбензил)-(2R,5S)-2,5-диметилпиперазин-1-ил]-2-оксоэтокси}фенилсульфамоил)уксусной кислоты;
4-(5-хлор-2-{2-[4-(4-фторбензил)-(2R,5S)-2,5-диметилпиперазин-1-ил]-2-оксоэтокси}фенил)-4-гидроксибут-3-еновой кислоты;
4-(5-хлор-2-{2-[4-(4-фторбензил)-(2R,5S)-2,5-диметилпиперазин-1-ил]-2-оксоэтокси}фенил)-4-гидроксимасляной кислоты;
4-(5-хлор-2-{2-[4-(4-фторбензил)-(2R,5S)-2,5-диметилпиперазин-1-ил]-2-оксоэтокси}фенил)бут-3-еновой кислоты;
4-[2-(5-хлор-2-{2-[4-(4-фторбензил)-(2R,5S)-2,5-диметилпиперазин-1-ил]-2-оксоэтокси}фенил)-2-оксоэтил]изоксазолидин-3,5-диона;
4-[2-(5-хлор-2-{2-[4-(4-фторбензил)-(2R,5S)-2,5-диметилпиперазин-1-ил]-2-оксоэтокси}фенил)-2-оксоэтил]-1,1-диоксо-[1,2,6]тиадиазинан-3,5-диона;
5-[2-(5-хлор-2-{2-[4-(4-фторбензил)-(2R,5S)-2,5-диметилпиперазин-1-ил]-2-оксоэтокси}фенил)-2-оксоэтил]-2-тиоксодигидропиримидин-4,6-диона;
5-[2-(5-хлор-2-{2-[4-(4-фторбензил)-(2R,5S)-2,5-диметилпиперазин-1-ил]-2-оксоэтокси}фенил)-2-оксоэтил]пиримидин-2,4,6-триона;
5-[2-(5-хлор-2-{2-[4-(4-фторбензил)-(2R,5S)-2,5-диметилпиперазин-1-ил]-2-оксоэтокси}фенил)-2-оксоэтил]-2-иминодигидропиримидин-4,6-диона;
6-[2-(5-хлор-2-{2-[4-(4-фторбензил)-(2R,5S)-2,5-диметилпиперазин-1-ил]-2-оксоэтокси}фенил)-2-оксоэтил]-[1,4]диазепан-2,5,7-триона;
N-(5-хлор-2-{2-[4-(4-фторбензил)-(2R,5S)-2,5-диметилпиперазин-1-ил]-2-оксоэтокси}пиридин-3-ил)полуамида янтарной кислоты;
N-[(5-бром-2-{2-[4-(4-фторбензил)-(2R,5S)-2,5-диметилпиперазин-1-ил]-2-оксоэтокси}фенил)ацетил]метансульфонамида;
N-[(5-хлор-2-{2-[4-(4-фторбензил)-(2R,5S)-2,5-диметилпиперазин-1-ил]-2-оксоэтокси}фенил)ацетил]сульфамида;
N-ацетил-C-(5-бром-2-{2-[4-(4-хлорбензил)-(2R)-2-метилпиперазин-1-ил]-2-оксоэтокси}фенил)метансульфонамида;
N-ацетил-C-(5-хлор-2-{2-[(2R)-2-этил-4-(4-фторбензил)пиперазин-1-ил]-2-оксоэтокси}фенил)метансульфонамида;
N-ацетил-C-(5-хлор-2-{2-[4-(4-хлорбензил)-(2R,5S)-2,5-диметилпиперазин-1-ил]-2-оксоэтокси}фенил)метансульфонамида и
[(5-хлор-2-{2-[4-(4-фторбензил)-(2R,5S)-2,5-диметилпиперазин-1-ил]-2-оксоэтокси}фенил)ацетил]амида пропан-1-сульфокислоты
или их фармацевтически приемлемой формы.
13. Фармацевтическая композиция, включающая фармацевтически эффективное количество соединения по любому из пп.1-12 или его фармацевтически приемлемой формы и фармацевтически приемлемый носитель.
14. Применение соединения по любому из пп.1-12 для лечения или профилактики расстройств или состояний, выбранных из аутоиммунных заболеваний, волчанки, острых и хронических воспалительных состояний, аллергических состояний, связанного с инфекцией воспаления, вирусных заболеваний, хронических бронхитов, ксенотрансплантации, отторжения трансплантированной ткани, атеросклероза, рестеноза, ВИЧ инфицирования и гранулематозного заболевания.
15. Применение соединения по любому из пп.1-12 для лечения или профилактики расстройств или состояний, которые можно лечить или предотвратить, ингибируя CCR1 рецептор млекопитающего.
Текст
006243 Данная заявка на изобретение заявляет приоритет на основании предварительной заявки на патент 60/338601, поданной 22 октября 2001 года, которая включается в данное описание во всей своей полноте для всех целей. Предпосылки изобретения Настоящее изобретение относится к новым производным пиперазина, способам использования и фармацевтическим композициям, которые их содержат. Соединения по изобретению являются сильными и селективными ингибиторами связывания MIP1 (CCL3) его рецептором CCR1, находящимся на клетках воспаления и иммуномодулирующих клетках(предпочтительно лейкоцитах и лимфоцитах). CCR1 рецептор также иногда называют CC-CKR1 рецептором. Данные соединения также ингибируют индуцируемый MIP-1 (и родственными хемокинами,которые, как показано, взаимодействуют с CCR1 (например, RANTES (CCL5), МСР-2 (CCL8), МСР-3(CCL7), НСС-1 (CCL14) и НСС-2 (CCL15 хемотаксис ТНР-1 клеток и лейкоцитов человека и являются потенциально полезными для лечения или профилактики аутоиммунных заболеваний (таких как ревматоидный артрит, диабеты типа I (недавно проявившиеся), волчанка, воспалительное заболевание кишечника, неврит зрительного нерва, псориаз, рассеянный склероз, ревматическая полимиалгия, увеит и васкулит), острых и хронических воспалительных заболеваний (таких как остеоартрит, респираторный дистресс-синдром взрослых, респираторный дистресс-синдром детей, ишемическое и реперфузионное повреждение и гломерулонефрит), аллергических состояний (таких как астма и диффузный нейродермит(атопический дерматит, связанных с инфекцией воспалений (таких как вирусное воспаление (включая грипп и гепатит) и синдром Гийена-Барре), хронических бронхитов, ксенотрансплантации, отторжения тканей трансплантата (хронического и острого), отторжения органов (хронического и острого), атеросклероза, рестеноза (включая, но не ограничиваясь этим, рестеноз, связанный с введением баллона и/или стента), ВИЧ-инфекции (использование корецептора) и гранулематозных заболеваний (включая саркоидоз, проказу и туберкулез) и осложнений, связанных с определенными типами рака, такими как множественная миелома. Соединения данного ряда также могут быть полезны для предотвращения метастазирования рака. Соединения данного ряда также могут ограничивать продуцирование цитокинов на участках воспаления, включая, но не ограничиваясь этим, TNF и IL-1, вследствие снижения клеточной инфильтрации, принося пользу при лечении заболеваний, связанных с TNF и IL-1, включая застойную сердечную недостаточность, эмфизему легких или связанную с ней отдышку, эмфизему; ВИЧ-1, ВИЧ-2,ВИЧ-3; вирус цитомегалии (CMV), аденовирусы, вирусы герпеса (Herpes zoster и Herpes simplex). Они также могут принести пользу при осложнениях, связанных с инфекцией, где такая инфекция вызывает продуцирование вредных цитокинов воспаления, таких как TNF, например, при грибковом менингите,повреждении ткани суставов, гиперплазии, образовании паннуса и резорбции кости, псориатическом артрите, печеночной недостаточности, бактериальном менингите, синдроме Кавасаки, инфаркте миокарда, острой печеночной недостаточности, болезни Лайма, септическом шоке, раке, травме, малярии и т.д.MIP-1 и RANTES являются растворимыми хемотаксическими пептидами (хемокинами), которые продуцируются множеством типов клеток, включая клетки воспаления, такие как CD8+ лимфоциты, полиморфно-ядерные лейкоциты (PMN) и макрофаги, J. Biol. Chem., 270 (30) 29671-29675 (1995). Данные хемокины действуют, вызывая миграцию и активацию ключевых клеток воспаления и иммуномодулирующих клеток. Повышенные уровни хемокинов были обнаружены в синовиальной жидкости пациентов с ревматоидным артритом, пациентов, страдающих хроническим заболеванием, больных с отторжением трансплантированной ткани и в назальных выделениях больных с аллергическим насморком после воздействия аллергена (Теran, et аl., J. Immunol., 1806-1812 (1996) и Kuna et al., J. Allergy Clin. Immunol. 321(1994. Антитела, которые препятствуют взаимодействию хемокин/рецептор, нейтрализуя MIP-1 илиRANTES, обеспечивают косвенное доказательство роли CCR1 в клеточной инфильтрации и в заболевании. (Smith et аl., J. Immunol., 153, 4704 (1994) и Cook et а 1., Science, 269, 1583 (1995), Belperio et al., J.Immunol., 165, 461 (2000. Более непосредственная роль CCR1 была продемонстрирована на трансгенных мышах, у которых данный рецептор отсутствует и которые показали сниженные воспалительные реакции, пролонгированное выживание трансплантатов аллогенных тканей (Gao et al., J. Clin. Invest. 105; 35 (2000 и ослабление заболевания в модели рассеянного склероза (Rottman et al., Eur. J. Imm., 30; 2372(2000). Совместно данные результаты демонстрируют, что антагонисты CCR1 рецептора были бы эффективными для лечения отдельных заболеваний иммунной системы. Описанные соединения являются сильными и селективными антагонистами CCR1 рецептора. Различные производные пиперазина недавно были описаны в качестве противовоспалительных средств в патенте США 6207665, который включается в данное описание в качестве ссылки во всей полноте и для всех целей. Данные средства также описываются в качестве средств, ингибирующих активность хемокинов, MIP-1 и RANTES. Краткое изложение изобретения В одном аспекте настоящее изобретение относится к соединениям формулы I и его фармацевтически приемлемым формам; где а равно 0, 1, 2, 3, 4 или 5;Y представляет собой (С 6-С 10)арил или (С 2-С 9)гетероарил; каждый R1 независимо представляет собой Н-, НО-, галоген-, (C1-C8)алкил-, (C1-C8)алкил-O-, НО(C1-C8)алкил-, NC-, H2N-, H2N-(C1-C8)алкил-, НО-(С=O)-, (С 1-С 8)алкил-(С=O)-, (C1-C8)алкил-(C=O)-(C1C8)алкил-, H2N-(С=O)- или H2N-(С=O)-(C1-C8)алкил-; каждый R2 и R3 независимо представляет собой Н-, оксо, (C1-C8)алкил-, (С 3-C8)циклоалкил-(C1-C8) алкил-, (С 6-С 10)арил-, (С 6-С 10)арил-(C1-C8)алкил-, НО-(C1-C8)алкил-, (C1-C8)алкил-O-(C1-С 8)алкил-, H2N(C1-C8)алкил-, (C1-С 8)алкил-NH-(C1-C8)алкил-, [(C1-С 8)алкил]2N-(C1-C8)алкил-, (С 2-С 9)гетероциклил-(C1C8)алкил-, (С 3-С 8)циклоалкил-NH-(C1-C8)алкил-, (C1-C8)алкил-(С=O)-NH-(C1-С 8)алкил-, (C1-C8)алкил-O(С=O)-NH-(C1-C8)алкил-,H2N-(С=O)-NH-(C1-C8)алкил-,(C1-C8)алкил-SO2-NH-(C1-C8)алкил-,(С 2 С 9)гетероарил-(C1-C8)алкил-, H2N-(C=O)- или H2N-(С=O)-(C1-C8)алкил-;C8)алкил-, (C1-C8)алкил-NH-SO2-NH-(С=O)-, (C1-С 8)алкил-NH-SO2-NH-(С=O)-(C1-C8)алкил-, [(C1C8)алкил]2N-SO2-NH-(С=O)-,[(C1-C8)алкил]2N-SO2-NH-(С=O)-(C1-C8)алкил-,(C1-C8)алкил-SO2-NH(С=O)-(C1-C8)алкил-O-, (C1-C8)алкил-SO2-NH-(С=O)-(C1-C8)алкил-O-(C1-C8)алкил-, (C1-C8)алкил-(С=O)NH-SO2-, H2N-SO2-(C1-С 8)алкил-, (C1-C8)алкил-(С=O)-NH-SO2-(C1-C8)алкил-, NC-(C1-С 8)алкил-(С=O)NH-SO2-(C1-C8)алкил-, НО-(C1-C8)алкил-(С=O)-NH-SO2-(C1-C8)алкил-, (С 6-С 10)арил-(С=O)-NH-SO2-, (С 6 С 10)арил-(С=O)-NH-SO2-(C1-C8)алкил-, (C1-C9)гетероарил-(С=O)-NH-SO2-, (C1-C9)гетероарил-(С=O)-NHSO2-(C1-C8)алкил-, (C1-C9)гетероциклил-(С=O)-NH-SO2-, (C1-C9)гетероциклил-(С=O)-NH-SO2-(C1-C8)алкил-, H2N-(С=O)-NH-SO2-, H2N-(С=O)-NH-SO2-(C1-C8)алкил-, (C1-C8)алкил-NH-(С=O)-NH-SO2-, (C1-C8) алкил-NH-(С=O)-NH-SO2-(C1-C8)алкил-, [(C1-C8)алкил]2N-(C=O)-NH-SO2-, [(C1-C8)алкил]2N-(С=O)-NHSO2-(C1-C8)алкил-, (С 6-С 10)арил-NH-(С=O)-NH-SO2-, (С 6-С 10)арил-NH-(С=O)-NH-SO2-(C1-C8)алкил-, (C1C9) гетероарил-NH-(С=O)-NH-SO2-, (C1-C9)гетероарил-NH-(С=O)-NH-SO2-(C1-C8)алкил-, (C1-C8)алкил-O(С=O)-NH-SO2-, (C1-C8)алкил-O-(С=O)-NH-SO2-(C1-C8)алкил-, (С 6-С 10)арилокси-(С=O)-NH-SO2-, (С 6-С 10) арилокси-(С=O)-NH-SO2-(C1-С 8)алкил-, (C1-C8)алкил-SO2-NH-(С=O)-О-, (C1-C8)алкил-SO2-NH-(С=O)-О(C1-C8)алкил-, (C1-C8)алкил-SO2-NH-(С=O)-NH-, (C1-C8)алкил-SO2-NH-(С=O)-NH-(C1-C8)алкил-, (С 6-С 10) арил-SO2-NH-(С=O)-О-, (С 6-С 10)арил-SO2-NH-(С=O)-О-(C1-C8)алкил-, (С 6-С 10)арил-SO2-NH-(C=O)-NH-,(С 6-С 10)арил-SO2-NH-(СО)-NH-(C1-C8)алкил-, (C1-C9)гетероарил-SO2-NH-(С=O)-О-, (C1-C9)гетероарилSO2-NH-(С=O)-O-(C1-С 8)алкил-, NH2-SO2-NH-(C=O)-O-, NH2-SO2-NH-(С=O)-О-(C1-C8)алкил-, (C1-C9) гетероарил-SO2-NH-(С=O)-NH-,(C1-C9)гетероарил-SO2-NH-(С=O)-NH-(C1-C8)алкил-,NH2-SO2-NH(С=O)-NH-, NH2-SO2-NH-(C=O)-NH-(C1-C8)алкил-, НО-(С=O)-(C1-C8)алкил-NH-(С=O)-О-, НО-(С=O)-(C1C8)алкил-NH-(С=O)-О-(C1-C8)алкил-, НО-(С=O)-(C1-С 8)алкил-O-(С=O)-NH-, НО-(С=O)-(C1-C8)алкил-O(С=O)-NH-(C1-C8)алкил-, (C1-C8)алкил-(С=O)-NH-SO2-NH-, (C1-C8)алкил-(С=O)-NH-SO2-NH-(C1-C8)алкил-, (С 6-С 10)арил-(С=O)-NH-SO2-NH-, (С 6-С 10)арил-(С=O)-NH-SO2-NH-(C1-C8)алкил-, (С 1-С 9)гетероарил(С=O)-NH-SO2-NH-, (C1-C9)гетероарил-(С=O)-NH-SO2-NH-(C1-C8)алкил-, NH2-(С=O)-NH-SO2-NH-, NH2(С=O)-NH-SO2-NH-(C1-C8)алкил-, (C1-C9)гетероарил-(C1-C8)алкил-(С=O)-, (C1-C9)гетероциклил-(C1-C8) алкил-(С=O)-, (C1-C9)гетероарил-(C1-C8)алкил-(С=O)-(C1-C8)алкил-, (C1-C9)гетероциклил-(C1-C8)алкил(С=O)-(C1-C8)алкил-, (C1-C9)гетероарил-(С=O)-(C1-C8)алкил- или (C1-C9)гетероциклил-(С=O)-(C1-C8)алкил-, НО-(С=O)-(C1-C8)алкил-, (C1-C9)гетероарил-, (C1-C9)гетероциклил-, (C1-C9)гетероарил-(C1-C8)алкилили (C1-C9)гетероциклил-(C1-C8)алкил-; каждый R5 независимо представляет собой Н-, НО-, галоген-, NC-, HO-(C=O)-, H2N-, (C1-C8)алкилNH-, [(C1-C8)алкил]2N-, (C1-С 8)алкил-, (C1-C8)алкил-O-, НО-(C1-C8)алкил-, (C1-C8)алкил-O-(C1-C8)алкил-,H2N-(C1-C8)алкил-, (C1-C8)алкил-NH-(C1-C8)алкил-, [(C1-C8)алкил]2N-(C1-C8)алкил-, (C1-C8)алкил-(С=O)-,(C1-C8)алкил-(С=O)-(C1-C8)алкил-, (С 6-С 10)арил-, (С 2-С 9)гетероарил-, (С 6-С 10)арилокси-, H2N-(C=O)-,H2N-(С=O)-(C1-C8)алкил-, (C1-C8)алкил-NH-(С=O)-, (C1-C8)алкил-NH-(С=O)-(C1-C8)алкил-, [(C1-C8)алкил]2N-(С=O)-, [(C1-C8)алкил]2N-(С=O)-(C1-C8)алкил-, (С 3-С 8)циклоалкил-, (C1-C8)алкил-SO2-, NC-(C1-C8) алкил-, (C1-C8)алкил-(С=O)-NH-, H2N-(C=O)-NH- или H2N-(C=O)-NH-(C1-C8)алкил- иR6 представляет собой Н, (C1-C8)алкил-, (C1-C8)алкил-(С=O)-, (С 6-С 10)арил-(С=O)-, (С 2 С 9)гетероарил-(С=O)-, H2N-(С=O)-, (C1-С 8)алкил-NH-(С=O)-, [(C1-C8)алкил]2N-(C=O)-, (C1-C8)алкил-O(С=O)- или (C1-C8)алкил-SO2-. В одном варианте осуществления R4 представляет собой [НО-(С=O)-][H2N-](C1-С 8)алкил-, [НО(С=O)-][C1-C8)алкил)NH-](C1-С 8)алкил-, [НО-(С=O)-][C1-C8)алкил)2N-](C1-C8)алкил-, НО-(С=O)-(C1C8)алкил-NH-, НО-(С=O)-(C1-C8)алкил-NH-(C1-C8)алкил-, [НО-(С=O)-(C1-C8)алкил][(C1-C8)алкил]N-,[НО-(С=O)-(C1-C8)алкил][(C1-С 8)алкил]N-(C1-C8)алкил, [НО-(С=O)-(C1-C8)алкил][(C1-C8)алкил-SO2]N-,[НО-(С=O)-(C1-C8)алкил][(C1-C8)алкил-SO2]N-(C1-C8)алкил-,[НО-(С=O)-(С 1-С 8)алкил][(C1-C8)алкил(С=O)-]N-, [HO-(C=O)-(C1-С 8)алкил][(C1-C8)алкил-(C=O)]N-(C1-C8)алкил-, [НО-(С=O)-(C1-C8)алкил][(C1C8)алкил-O-(C=O)-]N-, [НО-(С=O)-(C1-C8)алкил][(C1-С 8)алкил-O-(C=O)-]N-(C1-C8)алкил-, [НО-(С=O)(C1-C8)алкил][(C1-С 8)алкилN-(С=O)-]N-,[НО-(C=O)-(C1-C8)алкил][(C1-C8)алкил-NH-(С=O)-]N-(C1-C8) алкил-, НО-(С=O)-(C1-C8)алкил-O-N=(C1-C8)алкил-, НО-(С=O)-(C1-C8)алкил-SO2-, НО-(С=O)-(C1-С 8) алкил-SO2-(C1-С 8)алкил-, НО-(С=O)-(C1-C8)алкил-SO2-NH-, НО-(С=O)-(C1-C8)алкил-SO2-NH-(C1-C8)алкил-, НО-(С=O)-(С 1-С 8)алкил-NН-SO2-, НО-(С=O)-(С 1-С 8)алкил-NН-SO2-(С 1-С 8)алкил-, НО-(С=O)-(С=O)NH-SO2-, НО-(С=O)-(С=O)-NH-SO2-(C1-C8)алкил-, НО-(С=O)-(C1-C8)алкил-NH-(С=O)-NH-, НО-(C=O)(C1-C8)алкил-NH-(С=O)-NH-(C1-C8)алкил-, НО-(С=O)-(C1-C8)алкил-O-, НО-(С=O)-(C1-C8)алкил-O-(C1C8)алкил-, НО-(С=O)-(С 2-С 8)алкенил-, (С 2-С 9)гетероциклил-(C1-C8)алкил-O-, (С 2-С 9)гетероциклил-(C1C8)алкил-O-(C1-C8)алкил-, (С 2-С 9)гетероарил-(C1-С 8)алкил-O-, (С 2-С 9)гетероарил-(C1-C8)алкил-O-(C1C8)алкил-, (С 2-С 9)гетероциклил-O-, (C2-C9)гетероциклил-O-(C1-C8)алкил-, (С 2-С 9)гетероарил-O-, (С 2-С 9) гетероарил-O-(C1-C8)алкил-, НО-(С=O)-(C1-C8)алкил-S-, НО-(С=O)-(C1-C8)алкил-S-(C1-C8)алкил-, (С 2-С 9) гетероциклил-(C1-C8)алкил-S-, (С 2-С 9)гетероциклил-(C1-C8)алкил-S-(C1-C8)алкил-, (С 2-С 9)гетероарил-(C1C8)алкил-S-, (С 2-С 9)гетероарил-(C1-C8)алкил-S-(C1-C8)алкил-, (С 2-С 9)гетероциклил-S-, (C2-C9) гетероциклил-S-(C1-C8)алкил-, (С 2-С 9)гетероарил-S-, (С 2-С 9)гетероарил-S-(C1-C8)алкил-, НО-(С=O)-(C1-C8)алкил-NH-SO2-NH-, НО-(С=O)-(C1-C8)алкил-NH-SO2-NH-(C1-C8)алкил-, НО-(С=O)-(C1-C8)алкил-SO2-NH(C=O)-, НО-(С=O)-(C1-C8)алкил-SO2-NH-(С=O)-(C1-С 8)алкил-, НО-(С=O)-(C1-C8)алкил-(С=O)-NH-SO2-,НО-(С=O)-(C1-С 8)алкил-(С=O)-NH-SO2-(C1-C8)алкил-, НО-(С=O)-(С=O)-, НО-(С=O)-(С=O)-(C1-C8)алкил-,НО-(С=O)-(C1-C8)алкил-(С=O)-, НО-(С=O)-(C1-C8)алкил-(С=O)-(C1-C8)алкил-, НО-(С=O)-(C2-C9)гетеро-3 006243 циклил-(С=O)-, НО-(С=O)-(C2-C9)гетероарил-(С=O)-, NC-NH-(С=O)-, NC-NH-(C=O)-(C1-C8)алкил-, [(C1C8)алкил-SO2-NH-(C=O)-][H2N-](C1-С 8)алкил-,(C1-C8)алкил-SO2-NH-(C=O)-,(C1-C8)алкил-SO2-NH(C=O)-(C1-C8)алкил-, (C1-C8)алкил-SO2-NH-(C=O)-(C1-C8)алкил-NH-, (C1-C8)алкил-SO2-NH-(C=O)-(C1-C8) алкил-NH-(C1-C8)алкил-, [(C1-C8)алкил-SO2-NH-(C=O)-(C1-C8)алкил-][(C1-C8)алкил-]N-, [(C1-C8)алкилSO2-NH-(C=O)-(C1-C8)алкил-][(C1-C8)алкил-]N-(C1-C8)алкил-, (C1-C8)алкил-SO2-NH-(C=O)-(C1-C8)алкилNH-SO2-, (C1-C8)алкил-SO2-NH-(C=O)-(C1-C8)алкил-NН-SO2-(C1-C8)алкил-, (C1-C8)алкил-SO2-NH-(C=O)(C1-C8)алкил-SO2-NH-, (C1-C8)алкил-SO2-NH-(C=O)-(C1-C8)алкил-SO2-NH-(C1-C8)алкил-, (C1-C8)алкилSO2-NH-(C=O)-(C1-С 8)алкил-SO2-, (C1-C8)алкил-SO2-NH-(C=O)-(C1-С 8)алкил-SO2-(C1-C8)алкил-, (C1-С 8) алкил-SO2-NH-(C=O)-(С=O)-, (C1-C8)алкил-SO2-NH-(С=O)-(С=O)-(C1-C8)алкил-, (C1-C8)алкил-SO2-NH(С=O)-(C1-С 8)алкил-(С=O)-, (C1-C8)алкил-SO2-NH-(С=O)-(C1-C8)алкил-(С=O)-(C1-C8)алкил-, NC-(C1-C8) алкил-SO2-NH-(С=О)-, NC-(C1-C8)алкил-SO2-NH-(C=O)-(C1-C8)алкил-, НО-(C1-C8)алкил-SO2-NH-(С=O)-,HO-(C1-С 8)алкил-SO2-NH-(С=O)-(C1-C8)алкил-, (C1-C8)алкил-SO2-NH-(С=O)-(С 2-С 8)алкенил-, (С 2-С 9) гетероциклил-SO2-NH-(С=O)-, (С 2-С 9)гетероциклил-SO2-NH-(С=O)-(C1-C8)алкил-, (С 2-С 9)гетероциклил(C1-C8)алкил-SO2-NH-(С=O)-, (С 2-С 9)гетероциклил-(C1-C8)алкил-SO2-NH-(CO)-(C1-C8)алкил-, (С 6-С 10) арил-SO2-NH-(С=O)-, (С 6-С 10)арил-SO2-NH-(С=O)-(C1-C8)алкил-, (С 2-С 9)гетероарил-SO2-NH-(С=O)-, (С 2 С 9)гетероарил-SO2-NH-(С=O)-(C1-C8)алкил-, H2N-SO2-NH-(С=O)-, H2N-SO2-NH-(C=O)-(C1-C8)алкил-, (C1C8)алкил-NH-SO2-NH-(C=O)-, (C1-C8)алкил-NH-SO2-NH-(C=O)-(C1-C8)алкил-, [(C1-C8)алкил]2N-SO2-NH(C=O)-, [(C1-C8)алкил]2N-SO2-NH-(C=O)-(C1-C8)алкил-, (C1-C8)алкил-SO2-NH-(C=O)-(C1-C8)алкил-O-, (C1C8)алкил-SO2-NH-(C=O)-(C1-C8)алкил-O-(C1-C8)алкил-, (C1-C8)алкил-(C=O)-NH-SO2-, H2N-SO2-(C1-C8) алкил-, (C1-C8)алкил-(С=O)-NH-SO2-(C1-C8)алкил-, NC-(C1-C8)алкил-(C=O)-NH-SO2-(C1-C8)алкил-, НО(C1-C8)алкил-(С=O)-NH-SO2-(C1-C8)алкил-, (С 6-С 10)арил-(С=O)-NH-SO2-, (С 6-С 10)арил-(С=O)-NH-SO2(C1-C8)алкил-, (С 2-С 9)гетероарил-(С=O)-NH-SO2-, (C2-С 9)гетероарил-(С=O)-NH-SO2-(C1-C8)алкил-, (С 2 С 9)гетероциклил-(С=O)-NH-SO2-, (C2-C9)гетероциклил-(С=O)-NH-SO2-(C1-C8)алкил-, H2N-(С=O)-NHSO2-, H2N-(С=O)-NH-SO2-(C1-C8)алкил-, (C1-C8)алкил-NH-(С=O)-NH-SO2-, (C1-C8)алкил-NH-(С=O)-NHSO2-(C1-C8)алкил-, [(C1-C8)алкил]2N-(С=O)-NH-SO2-, [(C1-C8)алкил]2N-(С=O)-NH-SO2-(C1-C8)алкил-, (С 6 С 10)арил-NH-(С=O)-NH-SO2-, (С 6-С 10)арил-NH-(С=O)-NH-SO2-(C1-C8)алкил-, (C2-C9)гетероарил-NH(С=O)-NH-SO2-, (C2-C9)гетероарил-NH-(С=O)-NH-SO2-(C1-C8)алкил-, (C1-C8)алкил-O-(C=O)-NH-SO2-,(C1-C8)алкил-O-(C=O)-NH-SO2-(C1-C8)алкил-, (С 6-С 10)арилокси-(С=O)-NH-SO2-, (C6-C10)арилокси-(С=O)NH-SO2-(C1-C8)алкил-, (C1-C8)алкил-SO2-NH-(С=O)-О-, (C1-C8)алкил-SO2-NH-(С=O)-O-(С 1-С 8)алкил-,(C1-C8)алкил-SO2-NH-(С=O)-NH-, (C1-С 8)алкил-SO2-NH-(С=O)-NH-(C1-C8)алкил-, (С 6-С 10)арил-SO2-NH(С=O)-О-, (С 6-С 10)арил-SO2-NH-(С=O)-О-(C1-C8)алкил-, (С 6-С 10)арил-SO2-NH-(C=O)-NH-, (С 6-С 10)арилSO2-NH-(С=O)-NH-(C1-C8)алкил-,(С 2-С 9)гетероарил-SO2-NH-(С=O)-О-,(С 2-С 9)гетероарил-SO2-NH(С=O)-O-(C1-C8)алкил-, NH2-SO2-NH-(C=O)-O-, NH2-SO2-NH-(С=O)-О-(C1-C8)алкил-, (С 2-С 9)гетероарилSO2-NH-(С=O)-NH-, (C2-C9)гетероарил-SO2-NH-(С=O)-NH-(C1-C8)алкил-, NH2-SO2-NH-(С=O)-NH-, NH2SO2-NH-(C=O)-NH-(C1-C8)алкил-, НО-(С=O)-(C1-C8)алкил-NH-(С=O)-О-, НО-(С=O)-(C1-C8)алкил-NH(С=O)-О-(C1-C8)алкил-, НО-(С=O)-(C1-С 8)алкил-O-(С=O)-NH-, НО-(С=O)-(C1-C8)алкил-O-(С=O)-NH-(C1 С 8)алкил-, (C1-C8)алкил-(С=O)-NH-SO2-NH-, (C1-C8)алкил-(С=O)-NH-SO2-NH-(C1-C8)алкил-, (С 6-С 10) арил-(С=O)-NH-SO2-NH-, (С 6-С 10)арил-(С=O)-NH-SO2-NH-(C1-C8)алкил-, (C2-C9)гетероарил-(С=O)-NHSO2-NH-, (C2-C9)гетероарил-(С=O)-NH-SO2-NH-(C1-C8)алкил-, NH2-(С=O)-NH-SO2-NH- или NH2-(С=O)NH-SO2-NH-(C1-C8)алкил-; или, если Y представляет собой (С 2-С 9)гетероарильную группу, тогда R4 также может представлять собой НО-(С=O)-(C1-С 8)алкил-, (C2-C9)гетероарил-, (C2-C9)гетероциклил-, (C2-C9)гетероарил-(C1-C8)алкил- или (C2-C9)гетероциклил-(C1-C8)алкил-. В другом варианте осуществления настоящее изобретение включает соединения формулы I или их фармацевтически приемлемые соли или пролекарства. Предпочтительные соединения формулы I включают соединения, где каждый R1 независимо представляет собой Н-, НО-, галоген, NC-, (C1-C8)алкил- или (C1-C8)алкил-O-. Другие предпочтительные соединения формулы I включают соединения, где каждый R2 и R3 независимо представляет собой Н-, (C1-C8)алкил-, (С 3-С 8)циклоалкил-(C1-C8)алкил-, (С 6-С 10)арил-, (С 6-С 10) арил-(C1-C8)алкил-, НО-(C1-C8)алкил-, H2N-(C1-C8)алкил-, (C1-C9)гетероциклил-(C1-C8)алкил-, (C1-C8) алкил-O-(С=O)-NH-(C1-С 8)алкил-, H2N-(С=O)-NH-(C1-C8)алкил-, (C1-C8)алкил-SO2-NH-(C1-C8)алкил-,(C1-C9)гетероарил-(C1-C8)алкил-, H2N-(C=O)- или H2N-(С=O)-(C1-C8)алкил-. Другие предпочтительные соединения формулы I включают соединения, где Х представляет собой-О- и Y представляет собой фенильное кольцо. Другие предпочтительные соединения формулы I включают соединения, где Х представляет собой-О- и Y представляет собой пиридильное кольцо. Другие предпочтительные соединения формулы I включают соединения, где Х представляет собой-NR6- и Y представляет собой пиридильное кольцо. Другие предпочтительные соединения формулы I включают соединения, где R4 представляет собой[НО-(С=O)-] [H2N-](C1-С 8)алкил-, [НО-(С=O)-][C1-C8)алкил)NH-](C1-C8)алкил-, [НО-(С=O)-][C1-C8) алкил)2N-](C1-C8)алкил-, НО-(С=O)-(C1-C8)алкил-NH-, НО-(С=O)-(С 1-С 8)алкил-NН-(С 1-С 8)алкил-, [НО(С=O)-(C1-С 8)алкил][(C1-C8)алкил]N-, [НО-(С=O)-(C1-C8)алкил][(C1-C8)алкил]N-(C1-C8)алкил-, (C1-C8)ал-4 006243 кил-SO2-NH-(С=O)-(C1-C8)алкил-, NC-(C1-C8)алкил-SO2-NH-(С=O)-(C1-C8)алкил-, НО-(C1-C8)алкил-SO2NH-(С=O)-(C1-C8)алкил-, (C1-C9)гетероциклил-SO2-NH-(С=O)-(C1-С 8)алкил-, (C1-C9)гетероциклил-(C1-C8) алкил-SO2-NH-(С=O)-(C1-С 8)алкил-,(C1-C9)гетероарил-SO2-NH-(С=O)-(C1-C8)алкил-,H2N-SO2-NH(C=O)-(C1-C8)алкил-, (C1-C8)алкил-NH-SO2-NН-(С=O)-, (C1-С 8)алкил-SO2-NH-(С=O)-(C1-C8)алкил-O-,(C1-C8)алкил-SO2-NH-(С=O)-(C1-C8)алкил-O-(C1-C8)алкил-, H2N-SO2-(C1-C8)алкил-, (C1-C8)алкил-(С=O)NH-SO2-(C1-C8)алкил-, NC-(C1-C8)алкил-(С=O)-NH-SO2-(C1-С 8)алкил-, НО-(C1-C8)алкил-(С=O)-NH-SO2(C1-C8)алкил-, (C1-C9)гетероарил-(С=O)-NH-SO2-(C1-C8)алкил-, (C1-C9)гетероциклил-(С=O)-NH-SO2-(C1C8)алкил-, H2N-(С=O)-NH-SO2-(C1-C8)алкил-, (C1-C8)алкил-NH-(С=O)-NH-SO2-(C1-C8)алкил-, (C1-C8) алкил-SO2-NH-(С=O)-NH-(C1-C8)алкил-, (C1-C8)алкил-(С=O)-NH-SO2-NH-(C1-С 8)алкил-, НО-(С=O)-(C1C8)алкил-O-, НО-(С=O)-(C1-C8)алкил-O-(C1-С 8)алкил-, (C1-C8)алкил-SO2-NH-(С=O)-(C1-С 8)алкил-O-, (C1C9)гетероциклил-(C1-C8)алкил-O-, (C1-C9)гетероциклил-(C1-С 8)алкил-O-(C1-C8)алкил-, (C1-C9)гетероарил(C1-C8)алкил-O-, (C1-C9)гетероарил-(C1-C8)алкил-O-(C1-C8)алкил-, (C1-C9)гетероциклил-O-, (C1-C9)гетероциклил-O-(C1-C8)алкил-, (C1-C9)гетероарил-O-, (C1-C9)гетероарил-O-(C1-C8)алкил-, НО-(С=O)-(C1-C8) алкил-S-, НО-(С=O)-(C1-C8)алкил-S-(C1-C8)алкил-, (C1-C9)гетероциклил-(C1-С 8)алкил-S-, (C1-С 9)гетероциклил-(C1-C8)алкил-S-(C1-C8)алкил-, (C1-C9)гетероарил-(C1-C8)алкил-S-, (C1-C9)гетероарил-(C1-C8)алкил-S-(C1-C8)алкил-, (C1-С 9)гетероциклил-S-, (C1-C9)гетероциклил-S-(C1-C8)алкил-, (C1-C9)гетероарил-S-,(C1-C9)гетероарил-S-(C1-С 8)алкил-, НО-(С=O)-(C1-C8)алкил-SO2-, НО-(С=O)-(C1-C8)алкил-SO2-(C1-C8) алкил-, НО-(C=O)-(C=O)-(C1-C8)алкил-, НО-(С=O)-(C1-С 8)алкил-(С=O)-, НО-(С=O)-(C1-C8)алкил-(С=O)(C1-C8)алкил-, (C1-С 9)гетероарил-(C1-C8)алкил-(С=O)- или (C1-C9)гетероциклил-(C1-C8)алкил-(С=O)-. Другие предпочтительные соединения формулы I включают соединения, где каждый R5 независимо представляет собой Н-, НО-, NC-, (C1-C8)алкил-, (C1-C8)алкил-O-, (C1-C8)алкил-(С=O)- или галоген. Другие предпочтительные соединения формулы I включают соединения, где R6 представляет собой Н-, (C1-C8)алкил-, H2N-(С=O)- или (C1-C8)алкил-SO2-. Другие предпочтительные соединения формулы I включают соединения, где а равно 1; Х представляет собой -О-; Y представляет собой (С 6-С 10)арил; R1 представляет собой галоген;R2 и R3, каждый независимо, представляет собой Н- или (C1-C8)алкил- и R5 представляет собой галоген. Другие предпочтительные соединения формулы I включают соединения с абсолютной стереохимией, показанной формулой Iа, где каждый b и с равен 1. Примерами конкретных соединений формулы I являются следующие соединения:[(5-хлор-2-2-[4-(4-фторбензил)-(2R,5S)-2,5-диметилпиперазин-1-ил]-2-оксоэтоксифенил)ацетил] амид пропан-2-сульфокислоты. В одном варианте осуществления соединение формулы I представляет собойN-[(5-хлор-2-2-[4-(4-фторбензил)-(2R,5S)-2,5-диметилпиперазин-1-ил]-2-оксоэтоксифенил)ацетил]-4-фторбензолсульфонамид. В другом варианте осуществления соединение формулы I представляет собойN-[(5-хлор-2-2-[4-(4-фторбензил)-(2R,5S)-2,5-диметилпиперазин-1-ил]-2-оксоэтоксипиридин-3 ил)ацетил]метансульфонамид. В еще одном варианте осуществления соединение формулы I представляет собой[(5-хлор-2-2-[4-(4-фторбензил)-(2R,5S)-2,5-диметилпиперазин-1-ил]-2-оксоэтоксифенил)ацетил] амид пропан-1-сульфокислоты. В другом аспекте настоящее изобретение также относится к фармацевтическим композициям, содержащим соединение формулы I или его фармацевтически приемлемую форму и фармацевтически приемлемый носитель. Кроме того, другой аспект настоящего изобретения относится к применению вышеуказанных соединений формулы I, где применение включает введение млекопитающему фармацевтически эффективного количества соединения формулы I или его фармацевтически приемлемой формы для лечения или профилактики расстройств или состояний, выбранных из аутоиммунных заболеваний, волчанки, острых и хронических воспалительных состояний, аллергических состояний, связанного с инфекцией воспаления, вирусных, хронических бронхитов, ксенотрансплантации, отторжения трансплантированной ткани,атеросклероза, рестеноза, ВИЧ инфицирования и гранулематозного заболевания. В другом аспекте настоящее изобретение относится к применению соединений формулы I, где применение включает введение млекопитающему фармацевтически эффективного количества соединения формулы I или его фармацевтически приемлемой формы для лечения или профилактики расстройств или состояний, которые можно лечить или предотвратить, ингибируя CCR1 рецептор млекопитающего. Кроме того, другой аспект настоящего изобретения относится к применению композиций, содержащих соединения формулы I или их фармацевтически приемлемые формы, где применение включает введение млекопитающему фармацевтически эффективного количества композиции для лечения или профилактики расстройств или состояний, которые можно лечить или предотвратить, ингибируя CCR1 рецептор млекопитающего. Необходимо понимать, что как предшествующее общее описание, так и следующее далее подробное описание, являются иллюстративными и только поясняющими, но не ограничивают изобретение, как оно заявлено в формуле изобретения. Подробное описание изобретения Настоящее изобретение можно более легко понять, обращаясь к следующему ниже подробному описанию иллюстративных вариантов осуществления изобретения и включенным в него примерам. Прежде чем настоящие соединения, композиции и методы будут описаны, необходимо отметить,что данное изобретение не ограничивается конкретными методами синтеза, которые, конечно, могут различаться. Также необходимо понимать, что используемая здесь терминология имеет в качестве цели исключительно описание конкретных вариантов осуществления и не предназначена для их ограничения. Настоящее изобретение также относится к фармацевтически приемлемым кислотно-аддитивным солям соединений формулы I. Кислоты, которые используют для получения фармацевтически приемлемых кислотно-аддитивных солей вышеуказанных основных соединений по данному изобретению, представляют собой кислоты, которые образуют нетоксичные аддитивные соли, соли присоединения кислоты, т.е. соли, содержащие фармакологически приемлемые анионы, такие как гидрохлоридные, гидробромидные, гидройодидные, нитратные, сульфатные, бисульфатные, фосфатные, кислые фосфатные, ацетатные, лактатные, цитратные, кислые цитратные, тартратные, битартратные, сукцинатные, малеатные,фумаратные, глюконатные, сахаратные, бензоатные, метансульфонатные, этансульфонатные, бензолсульфонатные, п-толуолсульфонатные и памоатные (т.е. 1,1'-метилен-бис-(2-гидрокси-3-нафтоатные соли. Изобретение также относится к аддитивным солям, солям присоединения основания формулы I. Химические основания, которые можно использовать в качестве реагентов для получения фармацевтически приемлемых основных солей тех соединений формулы I, которые являются кислотными по природе,- 16006243 представляют собой основания, которые образуют нетоксичные основные соли с такими соединениями. Такие нетоксичные основные соли включают, но не ограничиваются ими, соли, полученные из таких фармакологически приемлемых катионов, как катионы щелочных металлов (например, калия и натрия) и катионы щелочно-земельных металлов (например, кальция и магния), соли аммония или водорастворимые аддитивные соли аминов, таких как N-метилглюкамин(меглюмин), соли низшего алканоламмония и другие основные соли фармацевтически приемлемых органических аминов. Соединения по данному изобретению могут содержать олефиноподобные двойные связи. Когда такие связи присутствуют, соединения по изобретению существуют в виде цис- и трансконфигураций и в виде их смесей. Данное изобретение также включает меченные изотопами соединения, которые идентичны соединениям, описываемым формулой I, за исключением того факта, что один или несколько атомов замещены одним или несколькими атомами, имеющими специфические атомные массы или массовые номера. Примеры изотопов, которые можно ввести в соединения по изобретению, включают изотопы водорода,углерода, азота, кислорода, серы и фтора, такие как 2H, 3R, 13 С, 14 С, 15N, 18 О, 17 О и 18F, соответственно. Соединения по настоящему изобретению, их пролекарства и фармацевтически приемлемые соли соединений или пролекарств, которые содержат вышеуказанные изотопы и/или другие изотопы других атомов, находятся внутри охвата данного изобретения. Определенные меченные изотопами соединения по настоящему изобретению, например, соединения, в которые введены радиоактивные изотопы, такие как 3H или 14 С, являются полезными для определения распределения лекарственных препаратов и/или тканей субстрата. Изотопы трития (т.е. 3H) и углерода-14 (т.е. 14 С) являются особенно предпочтительными благодаря простоте получения и определения. Далее, замещение более тяжелыми изотопами, такими как дейтерий (т.е. 2H), может принести определенные терапевтические преимущества в результате большей метаболической стабильности, например, увеличенного in vivo периода полувыведения или сниженных требований по дозе и, следовательно, может быть предпочтительным при некоторых обстоятельствах. Меченные изотопами соединения формулы I по данному изобретению и их пролекарства обычно можно получить с помощью методик, описанных на приведенных ниже схемах и/или примерах, заменяя реагенты без изотопного замещения легкодоступными изотопно меченными реагентами. В данном описании и формуле изобретения, которая следует далее, будут сделаны отсылки к ряду терминов, которые имеют следующие ниже значения. Если это не указано иначе, алкил, на который здесь ссылаются, может быть линейным или разветвленным, а также может быть циклическим (например, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил) или бициклическим (например, норборнанил, бицикло[3.2.1]октан), или содержать циклические группы. Алкил включает алкильные радикалы, обычно известные как алкилены,включая, но не ограничиваясь ими, метилен, этилен, пропилен и аналогичные. Они также могут содержать от нуля до двух уровней ненасыщенности и, необязательно, могут быть замещены 1, 2 или 3 заместителями, независимо выбранными из группы, состоящей, но не ограничивающейся ими, из: галогена-,НО-, NC-, H2N-, (C1-C8)алкил-NH-, [(С 1-С 8)алкил]N-, НО-(С=O)-, H2N-(C=O)-. Алкенил, на который здесь ссылаются, может быть линейным или разветвленным, а также может быть циклическим (например, циклобутенил, циклопентенил, циклогексенил) или бициклическим, или может содержать циклические группы. Они содержат 1-3 двойные связи углерод-углерод, которые могут быть цис- или транс-. Алкенил включает алкенильные радикалы, обычно известные как алкилидены,включая, но не ограничиваясь ими, этилиден, пропилиден и аналогичные. Алкенильные группы могут быть необязательно замещены 1, 2 или 3 заместителями, независимо выбранными из группы, состоящей,но не ограничивающейся ими, из: галогена-, НО-, NC-, H2N-, (C1-С 8)алкила-, (C1-C8)алкил-NH-, [(C1-C8) алкил]N-, HO-(C=O)-, H2N-(С=O)-. Арил относится к фенилу или нафтилу, которые могут быть необязательно замещены 1, 2 или 3 заместителями, независимо выбранными из группы, состоящей, но не ограничивающейся ими, из: Н-,НО-, галогена-, (C1-C8)алкила-, (C1-C8)алкил-O-, HO-(C1-С 8)алкила-, NC-, H2N-, (C1-C8)алкил-NH-, [(C1C8)алкил]N-, H2N-(C1-C8)алкила-, НО-(С=O)-, НО-(С=O)-(C1-C8)алкила-, (C1-C8)алкил-(С=O)-, (С 1-С 8) алкил-(С=O)-(С 1-С 8)алкила-, H2N-(C=O)-, H2N-(C=O)-(C1-C8)алкила-, H2NSO2- или (C1-C8)алкил-SO2-NH-. Если это не указано иначе, галоген включает фтор, хлор, бром или йод. Гетероциклил относится, но не ограничивается ими, к лактону, лактаму, диазепанилу, пирролидинилу, тетрагидрофуранилу, дигидрофуранилу, тетрагидропиранилу, пиранилу, тиопиранилу, азиридинилу, оксиранилу, метилендиоксилу, хроменилу, барбитурилу, изоксазолидинилу, 1,3-оксазолидин-3 илу, изотиазолидинилу, 1,3-тиазолидин-3-илу, 1,2-пиразолидин-2-илу, 1,3-пиразолидин-1-илу, пиперидинилу, тиоморфолинилу, 1,2-тетрагидротиазин-2-илу, 1,3-тетрагидротиазин-3-илу, тетрагидротиадиазинилу, морфолинилу, 1,2-тетрагидродиазин-2-илу, 1,3-тетрагидродиазин-1-илу, тетрагидроазепинилу, пиперазинилу и хроманилу. Указанная гетероциклильная группа содержит, по меньшей мере, один атом углерода, где гетероатомы могут представлять собой любую комбинацию N, О или S. Предпочтительно,гетероциклильная группа присоединена через атом углерода или азота и может быть, необязательно, замещена 1-4 заместителями, независимо выбранными из группы, состоящей, но не ограничивающейся ими, из: Н-, НО-, галогена-, оксо-, HN=, (C1-C8)алкила-, (C1-С 8)алкил-O-, НО-(C1-C8)алкила-, NC-, H2N-,- 17006243(C1-C8)алкил-NH-, [(C1-C8)алкил]N-, H2N-(C1-C8)алкила-, НО-(С=O)-, НО-(С=O)-(C1-С 8)алкила-, (C1-C8) алкил-(С=O)-, (C1-C8)алкил-(С=O)-(C1-С 8)алкила-, H2N-(C=O)-, H2N-(С=O)-(C1-C8)алкила-, H2NSO2-, (C1 С 8)алкил-SO2-NH-. Гетероарил относится, но не ограничивается ими, к фурилу, тиенилу, тиазолилу, пиразолилу,изотиазолилу, оксазолилу, изоксазолилу, пирролилу, триазолилу, тетразолилу, имидазолилу, 1,3,5 оксадиазолилу, 1,2,4-оксадиазолилу, 1,2,3-оксадиазолилу, 1,3,5-тиадиазолилу, 1,2,3-тиадиазолилу, 1,2,4 тиадиазолилу, пиридилу, пиримидилу, пиразинилу, пиридазинилу, 1,2,4-триазинилу, 1,2,3-триазинилу,1,3,5-триазинилу, пиразоло[3,4-b]пиридинилу, циннолинилу, птеридинилу, пуринилу, 6,7-дигидро-5 Н[1]пириндинилу, бензо[b]тиофенилу, 5,6,7,8-тетрагидрохинолин-3-илу, бензоксазолилу, бензотиазолилу,бензизотиазолилу, бензизоксазолилу, бензимидазолилу, тианафтенилу, изотианафтенилу, бензофуранилу, изобензофуранилу, изоиндолилу, индолилу, индолизинилу, индазолилу, изохинолилу, хинолилу,фталазинилу, хиноксалинилу, хиназолинилу и бензоксазинилу. Указанная гетероарильная группа содержит по меньшей мере один атом углерода, где гетероатомы могут представлять собой любую комбинацию N, О или S. Предпочтительно, гетероарильная группа присоединена через атом углерода или азота и может быть, необязательно, замещена 1-4 заместителями, независимо выбранными из группы, состоящей, но не ограничивающейся ими, из: Н-, НО-, галогена-, оксо-, HN=, (C1-C8)алкила-, (C1-C8)алкил-O-,НО-(C1-C8)алкила-, NC-, H2N-, (C1-C8)алкил-NH-, [(C1-C8)алкил]N-, H2N-(C1-C8)алкила-, НО-(С=O)-, НО(C=O)-(C1-C8)алкила-, (C1-C8)алкил-(С=O)-, (C1-C8)алкил-(С=O)-(C1-C8)алкила-, H2N-(C=O)-, H2N-(С=O)(C1-С 8)алкила-, H2NSO2- или (C1-С 8)алкил-SO2-NH-. Под фармацевтически приемлемым понимают вещество, которое не является биологически или иным образом нежелательным, т.е. вещество можно вводить пациенту без каких-либо существенных нежелательных биологических эффектов или вредного взаимодействия с любыми другими компонентами фармацевтической композиции, в которой оно может содержаться. Используемый здесь термин фармацевтически приемлемые формы относится к любым фармацевтически приемлемым производным или разновидностям, включая конформационные изомеры (например, цис- и транс-изомеры) и все оптические изомеры (например, энантиомеры и диастереомеры),рацемические, диастереомерные и другие смеси таких изомеров, а также сольваты, гидраты, изоморфы,полиморфы, таутомеры, сложные эфиры, солевые формы и пролекарства. Таутомерами называют химические соединения, которые могут существовать в двух или более формах различной структуры (изомеры) в равновесии, причем обычно формы различаются положением атома водорода. Могут существовать различные формы таутомерии, включая кето-енольную, цикл-цепь и цикл-цикл таутомерию. Следующие ниже схемы реакций иллюстрируют получение соединений по настоящему изобретению. Если это не указано иначе, а, b, с, d, R1-R6 и структурная формула I в схемах реакций и обсуждении,которые следуют далее, являются такими, как определено выше. R7 относится к аминорадикалу, который может быть незамещенным, монозамещенным, дизамещенным, циклическим или ациклическим. Реакции, приведенные в методах получения и схемах, описываются в обычной одновременно рассматриваемой заявке серийный номер USSN:09/821322, поданной 29 марта 2001 года, и предварительной одновременно рассматриваемой заявке серийный номер 60/241804, поданной 19 октября 2000 года, описание которых полностью включается в данное описание в качестве ссылки для всех целей.- 23006243 В реакции 1 метода получения А соединение формулы II, где b равно 0, 1 или 2, превращают в соответствующее соединение формулы III взаимодействием II с соединением бензальдегида формулы в присутствии основания, такого как триэтиламин, и восстановителя, такого как триацетоксиборгидрид натрия, в апротонном растворителе, таком как 1,2-дихлорэтан. Реакционную смесь перемешивают при комнатной температуре в течение периода времени примерно от 1 до 4 ч, предпочтительно в течение примерно 2 ч. В реакции 2 метода получения А соединение формулы III превращают в соответствующее соединение формулы IV вначале взаимодействием соединения формулы где с равно 0, 1 или 2, с 4-метилморфолином и изобутилхлорформиатом в присутствии полярного апротонного растворителя, такого как тетрагидрофуран, затем взаимодействием полученного таким образом промежуточного соединения с соединением формулы III. Полученную таким образом реакционную смесь перемешивают в течение ночи при комнатной температуре. В реакции 3 метода получения А соединение формулы IV преобразуют в соответствующее соединение пиперазин-2,5-диона формулы V обработкой IV трифторуксусной кислотой в присутствии полярного апротонного растворителя, такого как метиленхлорид. Реакционную смесь перемешивают при комнатной температуре в течение периода времени примерно от 1 до 4 ч, предпочтительно в течение 2 ч. В реакции 4 метода получения А соединение формулы V преобразуют в соответствующее соединение формулы VI, восстанавливая V восстановителем, таким как литий-алюминий гидрид. Реакцию проводят при температуре примерно от -10 до 10 С, предпочтительно примерно при 0 С, в течение периода времени примерно от 10 мин до 90 мин, предпочтительно в течение 40 мин. В реакции 5 метода получения А соединение формулы VI преобразуют в соответствующее соединение формулы VII взаимодействием VI с хлорацетилхлоридом в присутствии основания, такого как триэтиламин, в полярном апротонном растворителе, таком как метиленхлорид, при комнатной температуре в течение периода времени от 15 мин до 3 ч, предпочтительно в течение примерно 30 мин. В реакции 6 метода получения А соединение формулы VI превращают в соответствующее соединение формулы VIII взаимодействием VI с ацетоксиацетилхлоридом в присутствии основания, такого как триэтиламин, в полярном апротонном растворителе, таком как метиленхлорид, при комнатной температуре в течение периода времени примерно от 15 мин до 4 ч, предпочтительно в течение примерно 1 ч. Полученный в результате спирт с защитной ацетильной группой взаимодействует с гидратом гидроксида лития в смеси растворителей, включающей воду, тетрагидрофуран и метанол, при комнатной температуре в течение периода времени от 1 до 8 ч, предпочтительно в течение примерно 2 ч. В реакции 7 метода получения А соединение формулы VI превращают в соответствующее соединение формулы IX взаимодействием VI с N-(трет-бутоксикарбонил)глицином в присутствии основания,такого как диметиламинопиридин, и связующего агента, такого как 1-(3-диметиламинопропил)-3 этилкарбодиимин, в полярном апротонном растворителе, таком как метиленхлорид, при комнатной температуре в течение периода времени от 4 до 18 ч, предпочтительно в течение примерно 12 ч. Полученное в результате соединение, содержащее защитную N-(трет-бутоксикарбонильную) группу, взаимодействует с трифторуксусной кислотой в полярном апротонном растворителе, таком как метиленхлорид, при комнатной температуре в течение периода времени от 30 мин до 6 ч, предпочтительно в течение примерно 2 ч. Специалисту в данной области будет понятно, что метод получения А дает доступ ко всем разнообразным изомерам, диастереомерам и энантиомерам формулы VI. В частности, метод получения А можно использовать для получения соединений с предпочтительной стереохимией, как изображено на формуле В реакции 1 метода получения В соединение формулы Х превращают в соответствующее соединение формулы XI взаимодействием Х с соответствующим амином в присутствии полярного апротонного растворителя, такого как тетрагидрофуран. Реакционную смесь перемешивают при комнатной температуре в течение периода времени примерно от 1 до 24 ч, предпочтительно в течение примерно 12 ч. В реакции 2 метода получения В соединение формулы XI превращают в соответствующее соединение формулы XII взаимодействием XI с тиофенолом в присутствии основания, такого как гидрид натрия,и полярного апротонного растворителя, такого как диметилформамид. Реакционную смесь кипятят с об- 24006243 ратным холодильником в течение периода времени примерно от 1 до 10 ч, предпочтительно в течение примерно 4 ч. В реакции 1 метода получения С соединение формулы XIII, где е равно 1-4, превращают в соответствующее соединение формулы XIV, сначала превращая гидроксильную группу в C1-группу взаимодействием XIII с тионилхлоридом, в присутствии апротонного растворителя, такого как метиленхлорид. Реакционную смесь кипятят с обратным холодильником в течение периода времени примерно от 1 до 10 ч,предпочтительно в течение примерно 3 ч. Полученный в результате алкилхлорид затем обрабатывают тиоуксусной кислотой в присутствии основания, такого как карбонат цезия, в полярном апротонном растворителе, таком как диметилформамид, при комнатной температуре в течение периода времени от 6 до 24 ч, предпочтительно в течение примерно 12 ч. В реакции 2 метода получения С соединение формулы XIV превращают в соответствующее соединение формулы XV взаимодействием XIV с пероксидом водорода (водный раствор) в уксусной кислоте при комнатной температуре в течение периода времени от 6 до 24 ч, предпочтительно в течение примерно 12 ч. В реакции 3 метода получения С соединение формулы XV превращают в соответствующее соединение формулы XVI сначала взаимодействием XV с пентахлоридом фосфора в апротонном растворителе, таком как толуол, при температуре от комнатной до температуры флегмообразования, предпочтительно при температуре флегмообразования, в течение периода времени от 1 до 8 ч, предпочтительно в течение примерно 3 ч, получая соответствующий сульфонилхлорид. Сульфонилхлорид затем подвергают взаимодействию с соответствующим амином в полярном апротонном растворителе, таком как тетрагидрофуран, при комнатной температуре в течение периода времени от 3 до 24 ч, предпочтительно в течение 12 ч. В реакции 4 метода получения С соединение формулы XVI превращают в соответствующее соединение формулы XVII по методике, описанной в реакции 2 метода получения В. В реакции 1 метода получения D соединение формулы XVIII превращают в соответствующее соединение формулы XIX обработкой XVIII восстановителем, таким как литий-алюминий гидрид, в апротонном растворителе, таком как тетрагидрофуран. Реакционную смесь кипятят с обратным холодильником в течение периода времени от 1 до 6 ч, предпочтительно в течение примерно 2 ч. В реакции 2 метода получения D соединение формулы XIX превращают в соответствующее соединение формулы XX, сначала превращая гидроксильную группу в C1-группу взаимодействием XIX с тионилхлоридом, в присутствии апротонного растворителя, такого как метиленхлорид. Реакционную смесь кипятят с обратным холодильником в течение периода времени примерно от 1 до 10 ч, предпочтительно в течение примерно 3 ч. Затем полученный в результате алкилхлорид обрабатывают источником цианида, таким как цианид калия, в присутствии апротонного растворителя, такого как ацетонитрил и краунэфир, например, 18-краун-6. Реакционную смесь перемешивают при комнатной температуре в течение периода времени примерно от 1 до 10 ч, предпочтительно в течение примерно 3 ч. В реакции 3 метода получения D соединение формулы XX превращают в соединение формулы XXI обработкой XX источником гидроксида, таким как гидроксид калия, в смеси этанола и воды. Реакционную смесь кипятят с обратным холодильником в течение периода времени примерно от 1 до 10 ч, предпочтительно, в течение примерно 8 ч. В реакции 4 метода получения D соединение формулы XXI превращают в соединение формулыXXII, где f равно 1, сначала деметилируя метиловый эфир обработкой кислотой, такой как 47% водный раствор бромистого водорода. Реакционную смесь кипятят с обратным холодильником в течение периода времени примерно от 10 до 30 ч, предпочтительно в течение примерно 24 ч. В конечном счете фенольную кислоту превращают в соответствующее соединение формулы XXII, где f равно 1, обработкой этанолом в присутствии кислоты, такой как хлористоводородная кислота, при комнатной температуре в течение периода времени примерно от 8 до 16 ч, предпочтительно в течение примерно 12 ч. В реакции 5 метода получения D соединение формулы XIX превращают в соответствующее соединение формулы XXIII обработкой XIX окислителем, таким как реагент Десс-Мартина, в присутствии апротонного растворителя, такого как тетрагидрофуран, при комнатной температуре в течение периода времени примерно от 1 до 16 ч, предпочтительно, в течение примерно 4 ч. В реакции 6 метода получения D соединение формулы XXIII превращают в соответствующее соединение формулы XXII, где f равно 2-8, обработкой XXIII илидом фосфония, полученным из соли фосфония формулы где g равно 1-7, в присутствии апротонного растворителя, такого как тетрагидрофуран. Реакцию проводят при температуре от -78 С до температуры флегмообразования (кипения с обратным холодильником),причем предпочтительная температура зависит от того, какой илид фосфония используют, в течение периода времени примерно от 4 до 16 ч, предпочтительно в течение примерно 10 ч (для ознакомления с- 25006243 аналогичными превращениями см.: J. Am. Chem. Soc. 1985, 107, 217). Полученный в результате олефиновый сложный эфир затем гидрируют, встряхивая при избыточном давлении водорода в присутствии катализатора, такого как диоксид платины, в присутствии апротонного растворителя, такого как этилацетат. Затем снимают защиту с метилового эфира по методике, описанной в реакции 2 метода получения В. В реакции 1 схемы 1 соединение формулы VI превращают в соответствующее соединение формулыI взаимодействием VI с соединением формулы НО-(С=O)-CH2-X-Y[(R5)d](R4) в присутствии основания,такого как 4-диметиламинопиридин, и связующего агента, такого как 1-(3-диметиламинопропил)-3 этилкарбодиимин, в полярном апротонном растворителе, таком как метиленхлорид. Реакционную смесь перемешивают при комнатной температуре в течение периода времени от 4 до 24 ч, предпочтительно в течение примерно 12 ч. Альтернативно, соединение формулы VI превращают в соответствующее соединение формулы I сначала взаимодействием VI с соединением формулы в присутствии апротонного растворителя, такого как толуол, при температуре от комнатной до температуры флегмообразования, предпочтительно при температуре флегмообразования, в течение периода времени примерно от 4 до 18 ч, предпочтительно в течение примерно 12 ч. Полученный таким образом фенол затем можно превратить в соединения формулы I реакциями, известными специалисту в данной области. В реакции 1 схемы 2 соединение формулы VII превращают в соответствующее соединение формулы XXIV взаимодействием VII с соединением формулы H-X-Y[(R5)d](NO2), где Х представляет собой-О-, -S- или -NH-, в присутствии карбоната калия, йодида калия и апротонного растворителя, такого как бутанон. Реакционную смесь кипятят с обратным холодильником в течение периода времени примерно от 4 до 8 ч, предпочтительно в течение примерно 6 ч. В реакции 2 схемы 2 соединение формулы XXIV превращают в соответствующее соединение формулы XXV, гидрируя XXIV в присутствии катализатора, такого как платина на угле, и полярного протонного растворителя, такого как этанол. Реакцию осуществляют при давлении примерно oт 30 фунт./кв. дюйм до 40 фунт./кв. дюйм, предпочтительно при 35 фунт./кв. дюйм, в течение периода времени примерно от 5 мин до 1 ч, предпочтительно в течение примерно 30 мин. В реакции 3 схемы 2 соединение формулы XXV превращают в соответствующую мочевину формулы I сначала взаимодействием XXV с 4-нитрофенилхлорформиатом в присутствии основания, такого как пиридин, и полярного апротонного растворителя, такого как метиленхлорид, затем взаимодействием полученного таким образом промежуточного соединения с соответствующим амином или сульфонамидом. Полученную таким образом реакционную смесь перемешивают в течение ночи при комнатной температуре. Соединение формулы XXV взаимодействует с соответствующим сульфонилхлоридом с образованием соответствующих сульфонамидов формулы I в присутствии основания, такого как триэтиламин, и полярного апротонного растворителя, такого как метиленхлорид. Реакционную смесь перемешивают в течение ночи при комнатной температуре. Для получения вторичного амина формулы I соединение формулы XXV подвергают взаимодействию с соответствующим альдегидом в присутствии основания, такого как триэтиламин, и восстановителя, такого как триацетоксиборгидрид натрия, в апротонном растворителе, таком как 1,2-дихлорэтан. Реакционную смесь перемешивают при комнатной температуре в течение периода времени примерно от 1 до 12 ч, предпочтительно в течение примерно 10 ч. В реакции 1 схемы 3 соединение формулы VII превращают в соответствующее соединение формулы XXVI, где h равно 0-3, по методике, описанной выше в реакции 1 схемы 2. В реакции 2 схемы 3 соединение формулы XXVI превращают в соответствующий амин формулы I взаимодействием XXVI с соответствующим амином в присутствии раствора дихлорэтан/уксусная кислота с соотношением 10:1. Реакционную смесь перемешивают при комнатной температуре в течение периода времени примерно от 30 мин до 2 ч, предпочтительно в течение примерно 1 ч. Затем к смеси добавляют восстановитель, такой как цианоборгидрид натрия, и реакционную смесь перемешивают в течение ночи при комнатной температуре. Если полученный таким образом амин является первичным или вторичным, можно осуществить дальнейшую реакцию соединения формулы I по методике, описанной выше в реакции 3 схемы 2, с получением мочевины или сульфонамида. Соединение формулы XXVI превращают в соответствующий оксим формулы I взаимодействием XXVI с соответствующим алкоксиамином в присутствии основания, такого как триэтиламин, и полярного протонного растворителя, такого как метанол, при температуре от 0 С до температуры флегмообразования, предпочтительно при комнатной температуре, в течение периода времени от 1 до 8 ч, предпочтительно в течение примерно 3 ч. В реакции 1 схемы 4 соединение формулы VII превращают в соответствующее соединение формулы XXVII взаимодействием VII с соединением формулы H-X-Y[(R5)d](CH2)iCO2Et, где Х представляет собой -О-, -S- или -NH- и i равно 0-3, по методике, описанной в реакции 1 схемы 2. В реакции 2 схемы 4 соединение формулы XXVII превращают в соответствующее соединение формулы XXVIII взаимодействием XXVII с восстановителем, таким как боргидрид натрия, в полярном про- 26006243 тонном растворителе, таком как метанол, при комнатной температуре в течение периода времени примерно от 1 до 10 ч, предпочтительно в течение примерно 3 ч. В реакции 3 схемы 4 соединение формулы XXVIII превращают в соответствующий эфир формулыI, сначала превращая XXVIII в соответствующий алкилхлорид, как описано в реакции 2 метода получения D. Затем осуществляют взаимодействие алкилхлорида с соответствующим спиртом, который предварительно подвергали взаимодействию с сильным основанием, таким как NaH, в полярном апротонном растворителе, таком как диметилформамид, при температуре примерно от -10 до 10 С, предпочтительно примерно при 0 С, в течение периода времени примерно от 10 до 90 мин, предпочтительно в течение примерно 40 мин. Алкилхлорид перемешивают с полученным в результате алкоксидом при комнатной температуре в течение периода времени примерно от 3 до 24 ч, предпочтительно в течение примерно 12 ч. Соединение формулы XXVIII превращают в соответствующий карбамат формулы I взаимодействиемXXVIII с соответствующим изоцианатом в присутствии основания, такого как триэтиламин, в апротонном растворителе, таком как толуол, при комнатной температуре в течение периода времени от 4 до 24 ч,предпочтительно в течение примерно 12 ч. Соединение формулы XXVIII превращают в соответствующий ацилсульфамид формулы I сначала взаимодействием XXVIII с ВОС-защищенным сульфамидом,таким как трет-бутоксикарбонилсульфамид, в присутствии трифенилфосфина и диэтилазодикарбоксилата в полярном апротонном растворителе, таком как тетрагидрофуран. Вначале реакцию проводят при температуре от -100 до 0 С, предпочтительно примерно при -60 С, в течение периода времени примерно 15 мин, затем реакционную смесь медленно нагревают до температуры от 10 С до комнатной в течение периода времени от 1 до 8 ч, предпочтительно в течение примерно 2 ч. Полученный в результате ВОСзащищенный сульфамид подвергают взаимодействию с ацилхлоридом в присутствии основания, такого как триэтиламин и/или диметилпиридин, в полярном апротонном растворителе, таком как дихлорметан. Реакционную смесь перемешивают при температуре от 0 до 40 С, предпочтительно при комнатной температуре, в течение периода времени от 8 до 24 ч, предпочтительно в течение примерно 18 ч. Полученный таким образом ВОС-защищенный ацилсульфамид обрабатывают сильной кислотой, такой как трифторуксусная кислота, в полярном апротонном растворителе, таком как дихлорметан, при комнатной температуре в течение периода времени от 1 до 6 ч, предпочтительно в течение примерно 3 ч, получая, таким образом, соединение формулы I. В реакции 4 схемы 4 соединение формулы XXVII превращают в соответствующее соединение формулы I взаимодействием XXVII с моногидратом гидроксида лития в присутствии метанола, тетрагидрофурана и воды, получая соответствующую карбоновую кислоту. Реакционную смесь перемешивают при комнатной температуре в течение периода времени от 8 до 24 ч, предпочтительно в течение 12 ч. Карбоновую кислоту превращают в соответствующий ацилсульфонамид формулы I взаимодействием карбоновой кислоты с соответствующим сульфонамидом в присутствии основания, такого как 4-диметиламинопиридин, и связующего агента, такого как 1-(3-диметиламинопропил)-3-этилкарбодиимин, в полярном апротонном растворителе, таком как метиленхлорид. Реакционную смесь перемешивают при комнатной температуре в течение периода времени от 4 до 24 ч, предпочтительно в течение примерно 12 ч. Карбоновую кислоту превращают в соответствующий ацилсульфамид формулы I взаимодействием карбоновой кислоты с хлорсульфонилизоцианатом в полярном апротонном растворителе, таком как 1,2 дихлорэтан, при температуре от комнатной до температуры флегмообразования, предпочтительно при комнатной температуре, в течение периода времени от 8 до 24 ч, предпочтительно в течение примерно 12 ч, получая соединение формулы: которое затем подвергают взаимодействию с соответствующим амином в полярном апротонном растворителе, таком как тетрагидрофуран, при комнатной температуре в течение периода времени от 4 до 24 ч,предпочтительно, в течение примерно 12 ч. В реакции 1 схемы 5 соединение формулы VII превращают в соответствующее соединение формулы XXIX взаимодействием VII с соединением формулы H-X-Y[(R5)d](CH2)jSO2NH2, где Х представляет собой -О-, -S- или -NR6- и j равно 0-4, в соответствии с методикой, описанной в реакции 1 схемы 2. В реакции 2 схемы 5 соединение формулы XXIX превращают в соответствующий ацилсульфонамид формулы I взаимодействием XXIX с соответствующей карбоновой кислотой в присутствии основания, такого как 4-диметиламинопиридин, и связующего агента, такого как 1-(3-диметиламинопропил)-3 этилкарбодиимин, в полярном апротонном растворителе, таком как метиленхлорид. Реакционную смесь перемешивают при комнатной температуре в течение периода времени от 4 до 24 ч, предпочтительно в течение примерно 12 ч. Соединение формулы XXIX превращают в соответствующую сульфонилмочевину формулы I взаимодействием XXIX с соответствующим изоцианатом в присутствии основания, такого как 1,8-диазобицикло[5.4.0]ундец-7-ен, и полярного апротонного растворителя, такого как тетрагидрофуран. Реакционную смесь перемешивают при температуре от комнатной до температуры флегмообра- 27006243 зования, предпочтительно при температуре флегмообразования, в течение периода времени от 6 до 24 ч,предпочтительно, в течение примерно 12 ч. Соединение формулы XXIX превращают в соответствующий сульфонилкарбамат формулы I взаимодействием XXIX с соответствующим хлорформиатом в присутствии основания, такого как 1,8-диазобицикло[5.4.0]ундец-7-ен, и полярного апротонного растворителя,такого как тетрагидрофуран. Реакционную смесь перемешивают при температуре от комнатной до температуры флегмообразования, предпочтительно при температуре флегмообразования, в течение периода времени от 6 до 24 ч, предпочтительно в течение примерно 12 ч. Соединение формулы XXIX превращают в соответствующий алкилированный сульфонамид формулы I, сначала обрабатывая соединениеXXIX ди-трет-бутилдикарбонатом в присутствии основания, такого как триэтиламин и 4-диметиламинопиридин, в полярном апротонном растворителе, таком как дихлорметан. Полученный в результате сульфонамид, защищенный N-трет-бутоксикарбонильной группой, затем обрабатывают алкилгалогенидом в присутствии полярного апротонного растворителя, такого как диметилформамид. Затем кислотой,такой как трифторуксусная кислота, снимают защиту с вторичного сульфонамида, защищенного N-третбутоксикарбонильной группой, в присутствии полярного растворителя, такого как дихлорметан. В реакции 1 схемы 6 соединение формулы VIII превращают в соответствующее соединение формулы I взаимодействием VIII с сильным основанием, таким как гидрид натрия, в апротонном растворителе,таком как толуол, при температуре примерно от -10 С до комнатной, предпочтительно при 0 С, в течение периода времени от 15 до 90 мин, предпочтительно в течение примерно 30 мин. К данной смеси добавляют соединение формулы Cl-Y[(R5)d](R4), где Y представляет собой (C1-C9)гетероарил, где хлор присоединен к атому углерода, который является соседним к гетероатому (например, 2-пиридил). Реагенты перемешивают при температуре от комнатной до температуры флегмообразования, предпочтительно при комнатной температуре, в течение периода времени от 8 до 24 ч, предпочтительно в течение 12 ч. В реакции 1 схемы 7 соединение формулы IX превращают в соответствующее соединение формулыI, где R6 представляет собой Н-, взаимодействием IX с соединением формулы Cl-Y[(R5)d](R4), где Y представляет собой (C1-С 9)гетероарил, где хлор присоединен к атому углерода, который является соседним к гетероатому (например, 2-пиридил). Реагенты перемешивают в полярном апротонном растворителе, таком как ацетонитрил, в присутствии основания, такого как триэтиламин, при температуре флегмообразования в течение периода времени примерно от 4 до 24 ч, предпочтительно в течение примерно 12 ч. Соединение формулы I, где R6 представляет собой Н-, превращают в соединение формулы I, где R6 представляет собой алкильную группу, взаимодействием соединения формулы I, где R6 представляет собой Н-, с соответствующим алкилгалогенидом в присутствии основания, такого как триэтиламин, и полярного апротонного растворителя, такого как тетрагидрофуран, при температуре от комнатной до температуры флегмообразования, предпочтительно при комнатной температуре, в течение периода времени от 8 до 24 ч, предпочтительно в течение примерно 18 ч. Соединение формулы I, где R6 представляет собой Н-, превращают в соединение формулы I, где R6, взятый вместе с атомом азота, к которому он присоединен, образует амид, взаимодействием соединения формулы I, где R6 представляет собой Н-, с соответствующей карбоновой кислотой в присутствии основания, такого как 4-диметиламинопиридин, и связующего агента, такого как 1-(3-диметиламинопропил)-3-этилкарбодиимин, в полярном растворителе,таком как метиленхлорид. Реакционную смесь перемешивают при комнатной температуре в течение периода времени от 4 до 24 ч, предпочтительно в течение примерно 12 ч. Соединение формулы I, где R6 представляет собой Н-, превращают в соединение формулы I, где R6, взятый вместе с атомом азота, к которому он присоединен, образует мочевину, взаимодействием соединения формулы I, где R6 представляет собой Н-, с соответствующим изоцианатом в присутствии основания, такого как триэтиламин, и полярного апротонного растворителя, такого как тетрагидрофуран. Реакционную смесь перемешивают при температуре от комнатной до температуры флегмообразования, предпочтительно при температуре флегмообразования, в течение периода времени от 4 до 18 ч, предпочтительно в течение примерно 12 ч. Соединение формулы I, где R6 представляет собой Н-, превращают в соединение формулы I, где R6, взятый вместе с атомом азота, к которому он присоединен, образует карбамат, взаимодействием соединения формулы I, где R6 представляет собой Н-, с соответствующим хлорформиатом в присутствии основания,такого как триэтиламин, и полярного апротонного растворителя, такого как тетрагидрофуран. Реакционную смесь перемешивают при температуре от комнатной до температуры флегмообразования, предпочтительно при температуре флегмообразования, в течение периода времени от 4 до 18 ч, предпочтительно в течение примерно 12 ч. Соединение формулы I, где R6 представляет собой Н-, превращают в соединение формулы I, где R6, взятый вместе с атомом азота, к которому он присоединен, образует сульфонамид,взаимодействием соединения формулы I, где R6 представляет собой Н-, с соответствующим сульфонилхлоридом в присутствии основания, такого как триэтиламин, и полярного апротонного растворителя,такого как тетрагидрофуран. Реакционную смесь перемешивают при температуре от комнатной до температуры флегмообразования, предпочтительно при температуре флегмообразования, в течение периода времени от 4 до 18 ч, предпочтительно в течение примерно 12 ч. Если это не указано иначе, давление, при котором проводят вышеуказанные реакции, не является критичным. Как правило, реакции осуществляют при давлении примерно от 1 до трех атмосфер, предпочтительно при давлении окружающей среды (примерно одна атмосфера).- 28006243 Соединения формулы I, которые являются основными по природе, способны образовывать разнообразные соли с различными неорганическими и органическими кислотами. Хотя такие соли должны быть фармацевтически приемлемыми для введения животным, часто желательно при осуществлении на практике вначале выделить соединение формулы I из реакционной смеси в виде фармацевтически неприемлемой соли и затем просто преобразовать последнюю обратно в соединение в виде свободного основания обработкой щелочным реагентом, и впоследствии превратить свободное основание в фармацевтически приемлемую аддитивную соль кислоты. Кислотно-аддитивные соли основных соединений по изобретению легко получать обработкой основных соединений по существу эквивалентным количеством выбранной неорганической или органической кислоты в среде водного растворителя или в подходящем органическом растворителе, таком как метанол или этанол. После осторожного выпаривания растворителя получают соль в виде твердого вещества. Кислоты, которые используют для получения фармацевтически приемлемых кислотно-аддитивных солей основных соединений по изобретению, представляют собой кислоты, которые образуют нетоксичные аддитивные соли кислоты, т.е. соли, содержащие фармакологически приемлемые анионы, такие как гидрохлоридные, гидробромидные, гидройодидные, нитратные, сульфатные или бисульфатные, фосфатные или кислые фосфатные, ацетатные, лактатные, цитратные или кислые цитратные, тартратные или битартратные, сукцинатные, малеатные, фумаратные, глюконатные, сахаратные, бензоатные, метансульфонатные и памоатные (т.е. 1,1'-метилен-бис-(2-гидрокси-3-нафтоатные соли. Данные соединения формулы I, которые также являются кислыми по природе, способны образовывать основные соли с различными фармакологически приемлемыми катионами. Примеры таких солей включают соли щелочных металлов или соли щелочно-земельных металлов и, в частности, соли натрия и калия. Данные соли готовят традиционными методами. Химические основания, которые используют в качестве реагентов для получения фармацевтически приемлемых основных солей по изобретению, представляют собой основания, которые образуют нетоксичные соли основания с описываемыми здесь кислотными соединениями формулы I. Данные нетоксичные основные соли включают соли, полученные из таких фармакологически приемлемых катионов, как натрий, калий, кальций, магний и т.д. Данные соли можно легко получить обработкой соответствующих кислотных соединений водным раствором, содержащим желаемые фармакологически приемлемые катионы, и затем выпариванием полученного в результате раствора досуха, предпочтительно при пониженном давлении. Альтернативно, их можно также получить, смешивая вместе растворы кислотных соединений в низших спиртах и желаемые алкоксиды щелочных металлов и затем выпаривая полученный в результате раствор досуха таким же образом, как и ранее. В любом случае, предпочтительно используют стехиометрические количества реагентов, чтобы обеспечить завершенность реакции и максимальные выходы продуктов. Соединения формулы I и их фармацевтически приемлемые соли (в дальнейшем также вместе называемые активными соединениями) являются мощными антагонистами CCR1 рецептора. Активные соединения являются полезными для лечения или профилактики аутоиммунных заболеваний (таких как ревматоидный артрит, диабеты типа I (недавно проявившиеся), волчанка, воспалительное заболевание кишечника, неврит зрительного нерва, псориаз, рассеянный склероз, ревматическая полимиалгия, увеит и васкулит), острых и хронических воспалительных заболеваний (таких как остеоартрит, респираторный дистресс-синдром взрослых, респираторный дистресс-синдром детей, ишемическое и реперфузионное повреждение и гломерулонефрит), аллергических состояний (таких как астма и диффузный нейродермит), связанных с инфекцией воспалений (таких как вирусное воспаление (включая грипп и гепатит) и синдром Гийена-Барре), хронических бронхитов, ксенотрансплантации, отторжения тканей трансплантата (хронического и острого), отторжения органов (хронического и острого), атеросклероза, рестеноза(включая, но не ограничиваясь этим, рестеноз, связанный с введением баллона и/или стента), ВИЧинфицирования (использование корецептора) и гранулематозных заболеваний (включая саркоидоз, проказу и туберкулез) и осложнений, связанных с определенными типами рака, такими как множественная миелома. Соединения данного ряда также могут быть полезны для предотвращения метастазирования рака. Соединения данного ряда также могут ограничивать продуцирование цитокинов на участках воспаления, включая, но не ограничиваясь этим, TNF и IL-1, вследствие снижения клеточной инфильтрации,принося пользу при лечении заболеваний, связанных с TNF и IL-1, включая застойную сердечную недостаточность, эмфизему легких или связанную с ней отдышку, эмфизему; ВИЧ-1, ВИЧ-2, ВИЧ-3; вирус цитомегалии (CMV), аденовирусы, вирусы герпеса (Herpes zoster и Herpes simplex). Они также могут принести пользу при осложнениях, связанных с инфекцией, где такая инфекция вызывает продуцирование вредных цитокинов воспаления, таких как TNF, например, при грибковом менингите, повреждении ткани суставов, гиперплазии, образовании паннуса и резорбции кости, псориатическом артрите, печеночной недостаточности, бактериальном менингите, синдроме Кавасаки, инфаркте миокарда, острой печеночной недостаточности, болезни Лайма, септическом шоке, раке, травме, малярии и т.д. Активность соединений по изобретению можно оценить с помощью методик, известных специалисту в данной области. Примеры общепризнанных методов определения индуцированной CCR1 миграции можно найти в Coligan, J.E., Kruisbeek, A.M., Margulies, D.H., Shevach, E.M., Strober, W. editors.: CurrentProtocols In Immunology, 6.12.1-6.12.3 (John Wiley and Sons, NY, 1991). Один конкретный пример определения активности соединения для ингибирования миграции подробно описывается ниже. Анализ Хемотаксиса Способность соединений ингибировать хемотаксис по отношению к различным хемокинам можно оценить, используя стандартные 48- или 96-луночные камеры Бойдена с 5-микронным поликарбонатным фильтром. Все реагенты и клетки можно приготовить в стандартной RPMI (BioWhitikker Inc.) среде для выращивания тканевой культуры, в которую добавлен 1 мг/мл альбумина бычьей сыворотки. Коротко говоря, MIP-1 (Peprotech, Inc., P.O. Box 275, Rocky Hill NJ) или другие тестируемые агонисты помещают в нижний отдел камеры Бойдена. Затем помещают поликарбонатный фильтр и верхнюю камеру закрывают. Количество выбранного агониста представляет собой количество, которое дает максимальное значение хемотаксиса в данной системе (например, 1 нМ для MIP-1 должно быть достаточным). Затем в верхние камеры совместно с различными концентрациями тестируемого соединения в трех экземплярах можно добавить ТНР-1 клетки (АТСС TIB-202), первичные моноциты человека, или первичные лимфоциты, выделенные стандартным методом. Растворы соединений можно приготовить, используя стандартные серологические методы, и их смешивают с клетками перед добавлением в камеру. После подходящего периода инкубации при 37 С (например, 3,5 ч для ТНР-1 клеток, 90 мин для первичных моноцитов) камеру удаляют, клетки из верхней камеры удаляют, верхнюю часть фильтра протирают, и количество мигрирующих клеток определяют следующим методом. Для ТНР-1 клеток камеру (96-луночный вариант, изготовленный Neuroprobe) можно центрифугировать, чтобы удалить клетки из нижней камеры, и количество клеток можно оценить относительно стандартной кривой по изменению цвета красителя флуоресцеиндиацетата. Для первичных моноцитов человека, или лимфоцитов, фильтр можно окрасить красителем DifQuik (American Scientific Products), и количество мигрирующих клеток можно определить микроскопически. Количество мигрирующих клеток в присутствии соединения делят на количество мигрирующих клеток в контрольных лунках (без соединения). Доля представляет собой % ингибирования для соединения, который затем можно нанести на график, используя стандартные графические методы, в зависимости от концентрации используемого соединения. Затем определяют точку 50% ингибирования, используя линейный регрессионный анализ для всех тестируемых концентраций. Подгонка прямой линии для всех точек должна иметь коэффициент корреляции (R в квадрате) 90%, чтобы считаться надежным анализом. Все соединения по изобретению, иллюстрируемые в следующих ниже примерах, имеют ИК 50 менее 10 мкМ в анализе хемотаксиса. Из композиций по настоящему изобретению можно составить рецептуры (составы) обычным способом, используя один или несколько фармацевтически приемлемых носителей. Таким образом, из активных соединений по изобретению можно составить рецептуры для орального, трансбуккального, интраназального, парентерального (например, внутривенного, внутримышечного или подкожного) или ректального введения, или в форме, подходящей для введения ингаляцией или инсуффляцией. Из активных соединений по изобретению также можно составлять рецептуры пролонгированной доставки. Для орального введения фармацевтические композиции могут принимать, например, форму таблеток или капсул, приготовленных традиционными способами с фармацевтически приемлемыми наполнителями, такими как связующие вещества (например, желатинизированный кукурузный крахмал, поливинилпирролидон или гидроксипропилметилцеллюлоза), наполнители (например, лактоза, микрокристаллическая целлюлоза или фосфат кальция), смазывающие вещества (например, стеарат магния, тальк или диоксид кремния), вещества, способствующие распадаемости лекарственной формы, дезинтегрирующие агенты (например, картофельный крахмал или крахмал гликолят натрия) или увлажняющие средства(например, лаурилсульфат натрия). Таблетки можно покрыть оболочкой методами, известными из уровня техники. Жидкие препараты для орального введения могут принимать форму, например, растворов,сиропов или суспензий, или они могут быть представлены в виде сухого продукта для разведения водой или другим подходящим растворителем перед использованием. Такие жидкие препараты можно приготовить традиционными способами с фармацевтически приемлемыми добавками, такими как суспендирующие вещества (например, сироп сорбита, метилцеллюлоза или гидрогенизированные пищевые жиры), эмульгирующие вещества (например, лецитин или гуммиарабик), неводные растворители (например, миндальное масло, маслянистые сложные эфиры или этиловый спирт) и консерванты (например,метил- или пропил-п-гидроксибензоаты или сорбиновая кислота). Для трансбуккального введения композиция может находиться в форме таблеток или пастилок,сделанных традиционным способом. Из активных соединений по изобретению можно составить рецептуры для парентерального введения инъекцией, включая использование традиционного метода катетеризации или инфузии. Рецептуры для инъекций могут быть представлены в виде стандартной лекарственной формы, например, в ампулах или в многодозовых сосудах с добавленными консервантами. Композиции могут принимать форму сус- 30
МПК / Метки
МПК: A61K 31/495, C07D 241/04, A61P 29/00
Метки: антагонистической, активностью, пиперазина, рецептору, производные
Код ссылки
<a href="https://eas.patents.su/30-6243-proizvodnye-piperazina-s-antagonisticheskojj-aktivnostyu-k-receptoru-ccr1.html" rel="bookmark" title="База патентов Евразийского Союза">Производные пиперазина с антагонистической активностью к рецептору ccr1</a>












