Производные хиноксалин-2,3-диона и их фармацевтически приемлемые соли, фармацевтические композиции, обладающие антагонистической активностью в отношении рецептора глютамата и противосудорожной активностью, способы лечения пациентов, страдающих от удара или заболеваний, при помощи этих соединений.
Номер патента: 762
Опубликовано: 24.04.2000
Авторы: Рафферти Майкл Фрэнсис, Корнберг Брайэн Эдвард, Никам Шам
Формула / Реферат
1. Производные хиноксалин-2,3-диона общей формулы I
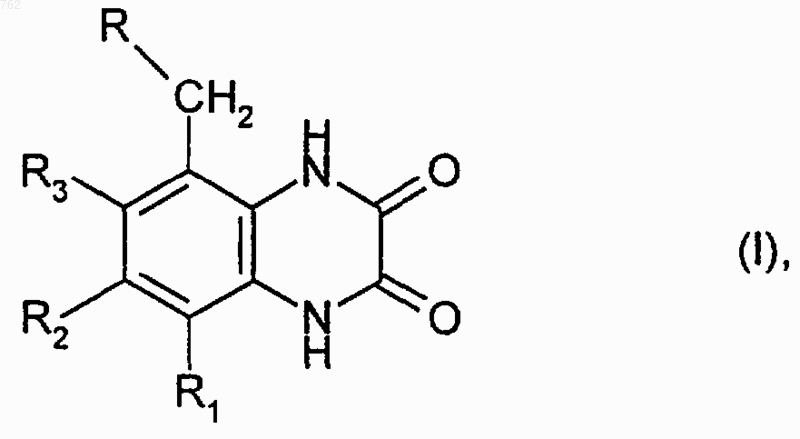
где R - группа - NR4R5, где R4 и R5 независимо друг от друга означают водород, низший алкил, незамещенный или замещенный низшим алкилом, низший циклоалкил, который может содержать 1 или 2 атома кислорода в качестве гетероатома,
R1 и R2 независимо друг от друга означают водород или нитрогруппу,
R3 - низший алкил,
при этом радикалы R3 и R-CH2- могут каждый находиться в положениях 5 или 6,
или их фармацевтически приемлемые соли.
2. Производные хиноксалин-2,3-диона общей формулы I по п.1, выбранные из группы, включающей:
5-диэтиламинометил-6-метил-7-нитро-1,4-дигидрохиноксалин-2,3-дион,
5-дипропиламинометил-6-метил-7-нитро-1,4-дигидрохиноксалин-2,3-дион,
5-дибутиламинометил-6-метил-7-нитро-1,4-дигидрохиноксалин-2,3-дион,
5-циклогексиламинометил-6-метил-7-нитро-1,4-дигидрохиноксалин-2,3-дион,
5-[(циклогексилметиламино)-метил]-6-метил-7-нитро-1,4-дигидрохиноксалин-2,3-дион,
5-диметиламинометил-6-метил-7-нитро-1,4-дигидрохиноксалин-2,3-дион.
3. Фармацевтическая композиция, обладающая антагонистической активностью в отношении рецептора глютамата, содержащая активное вещество на основе производных хиноксалиндиона и фармацевтически приемлемый носитель, отличающаяся тем, что в качестве производных хиноксалиндиона содержит соединения по п.1 в терапевтически эффективном количестве.
4. Фармацевтическая композиция, обладающая противосудорожной активностью, содержащая активное вещество на основе производных хиноксалиндиона и фармацевтически приемлемый носитель, отличающаяся тем, что в качестве производных хиноксалиндиона содержит соединения по п.1 в терапевтически эффективном количестве.
5. Способ лечения пациентов, страдающих от удара или заболеваний путем введения средства, обеспечивающего блокировку рецепторов глютамата, отличающийся тем, что вводят соединения по п.1 в терапевтически эффективном количестве.
6. Способ лечения пациентов, страдающих от заболеваний, путем введения противосудорожного средства, отличающийся тем, что вводят соединения по п.1 в терапевтически эффективном количестве.
Текст
1 Изобретение относится к новым производным хиноксалинона, обладающим биологической активностью, более конкретно к производным хиноксалин-2,3-диона и их фармацевтически приемлемым солям, которые можно использовать в качестве противосудорожного средства и антагониста рецептора глютамата. Известны производные хиноксалин-2,3 диона, которые можно использовать в качестве антагониста рецептора глютамата (см. заявкуWO 95/12 417, май 1995 г.). Задачей изобретения является расширение ассортимента производных хиноксалин-2,3 диона, обладающих биологической активностью, например, антагонистической активностью в отношении рецептора глютамата и противосудорожной активностью. Данная задача решается предлагаемыми производными хиноксалин-2,3-диона общей формулы (I) где R - группа - NR4R5, где R4 и R5 - независимо друг от друга означают водород, низший алкил,незамещенный или замещенный низшим алкилом, низший циклоалкил, который может содержать 1 или 2 атома кислорода в качестве гетероатома,R1 и R2 независимо друг от друга означают водород или нитрогруппу,R3-низший алкил,при этом радикалы R3 и R-CH2- могут менять свои положения,или их фармацевтически приемлемыми солями. Предпочтительными производными хиноксалин-2,3-диона формулы (I) являются соединения, выбранные из группы, включающей 5-диэтиламинометил-6-метил-7-нитро-1,4 дигидрохиноксалин-2,3-дион; 5-дипропиламинометил-6-метил-7-нитро 1,4-дигидрохиноксалин-2,3-дион; 5-дибутиламинометил-6-метил-7-нитро 1,4-дигидрохиноксалин-2,3-дион; 5-циклогексиламинометил-6-метил-7 нитро-1,4-дигидрохиноксалин-2,3-дион; 5-[(цикпогексилметиламино)-метил]-6 метил-7-нитро-1,4-дигидрохиноксалин-2,3-дион. Благодаря вышеупомянутой биологической активности соединений формулы (I), объектом изобретения является также фармацевтическая композиция, обладающая антагонистической активностью в отношении рецептора глютамата и противосудорожной активностью, которая помимо фармацевтически приемлемого носителя содержит соединения формулы (I) или их фармацевтически приемлемые соли в терапевтически эффективном количестве. 2 Дальнейшим объектом изобретения является способ лечения пациентов, страдающих от удара или заболеваний, лечимых введением противосудорожного средства или средства,обеспечивающего блокировку рецепторов глютамата, который заключается в том, что вводят соединения формулы (I) или их фармацевтически приемлемые соли в терапевтически эффективном количестве. К фармацевтически приемлемым солям соединений формулы (I) относятся соли с нетоксическими неорганическими кислотами, такими как хлористо-водородная кислота, азотная кислота, фосфорная кислота, серная кислота, бромисто-водородная кислота, иодисто-водородная кислота, фосфористая кислота и др., а также соли с нетоксическими органическими кислотами такими, как алифатические моно- и дикарбоновые кислоты, замещенные фенилом алкановые кислоты, оксиалкановые кислоты, алкандикарбоновые кислоты, ароматические кислоты,алифатические и ароматические сульфокислоты и др. К таким солям причисляют сульфат, пиросульфат, бисульфат, сульфит, бисульфит, нитрат, фосфат, кислый фосфат, первичный фосфат,метафосфат, пирофосфат, хлорид, бромид, иодид, ацетат, пропионат, каприлат, изобутират,оксалат, малонат, сукцинат, суберат, себацинат,фумарат, малеинат, манделат, бензоат, хлорбензоат, метилбензоат, динитробензоат, фталат,фенилсульфонат, толуолсульфонат, фенилацетат, цитрат, лактат, тартрат, метансульфонат и др. Возможны и соли с аминокислотами, как,например, аргинат и др. и глюконат, галактуронат. Кислотно-аддитивные соли указанных основных соединений получают обычным образом путем контактирования свободного основания с достаточным количеством желаемой кислоты. Свободное основание можно регенерировать путем контактирования соли с основанием и выделения свободного основания обычным образом. Свободные основания отличаются от соответствующих солей определенными физическими свойствами, как растворимостью в полярных растворителях, однако, для цели настоящего изобретения соли являются эквивалентами соответственных свободных оснований. Некоторые из соединений настоящего изобретения могут существовать в нерастворенной форме, а также в растворенной форме, включая гидратированную форму. Как правило, растворенные, в том числе и гидрированные, формы являются эквивалентами нерастворенных форм и входят в объем настоящего изобретения. Под термином "низший алкил" понимают неразветвленный или разветвленный углеводород с 1-6 атомами углерода, например метил,этил, н-пропил, изопропил, н-бутил, втор.бутил, изобутил, трет.-бутил, н-пентил, н-гексил и др. Под термином "низший циклоалкил" по 3 нимают циклический углеводород с 3-6 атомами углерода. Предлагаемые соединения обладают ценными биологическими свойствами благодаря их сильному антагонизирующему возбудительную аминокислоту действию в одном из некоторых связывающих сайтов рецепторов глютамата: в связывающем сайте АМПК (-амино 3 гидрокси-5-метил-4-изоксазолпропионовой кислоты) или соли 3-карбоксиметил-4 изопропенилпролина; КИПП),рецепторов АМПК (рецепторов, не связывающихся с Nметил-D-аспартатом; NMDA) или в сайте гликокола рецептора NMDA. Предлагаемые соединения проявляют сходство с рецепторами АМПК, измеряемое по способу, описанному Ноnоru Т. и др., Neuroscience Letters. 1985; 54: 27-32. В данном источнике предпочтительные соединения имеют данные по KT50 100 мкмол. Предлагаемые соединения имеют сходство со связывающим сайтом КИППCoyle J., Mol. Pharmacol., 1979, 15:492. Предлагаемые соединения имеют сходство со связывающим сайтом гликокола рецептора NMDA,измеряемое по способу, описанному Jones S.M. и др., Pharmacol. Methods. 1989; 21:161. Для определения активности функционального антагониста АМПК исследуют его действие на повреждение нейронов, вызываемое АМПК, в культурах первичных кортикальных нейронов по способам, похожим на те, описанные Koh J.-Y. и др., J. Neurosci, 1990; 10:693. Кроме того, повреждение нейронов, вызываемое долговременным воздействием 100 мкмол АМПК, можно определять освобождением цитозольного энзима, дегидрогеназы молочной кислоты. Выбранные соединения настоящего изобретения испытывают в одном или более из вышеописанных опытов. Достигнутые результаты приведены в нижеследующей табл. 1. Сведенные в табл. 1 данные по KT50 представляют собой измеряемую концентрацию (мкмоль) исследуемого соединения, ингибирующего активность рецепторов на 50%. Соединение примераKT50, мкмоль АМПК КИПП 1,501 4,483 0,689 6,647 1,631 24,93 4,643 20,50 1,264 5,128 3,226 5,331 1,15 8,23 1,14 8,22 1,56 8,15 Дополнительно, предварительным показателем исследуемой ин виво активности центральной нервной системы по отношению к ак 4 тивности противосудорожного средства и потенциальной нейрозащите является опыт максимального электрошока (далее: МЭШ) на мышах штамма CF-1 (20-25 г) при использовании роговых электродов по обычным способам,описанным недавно Krall и др., Epilepsia. 1988; 19:409-428. Соединения настоящего изобретения, как правило, обладают данными по ЭД 50 50 мг/кг. Для соединения 1 табл. 3 выявлены, в частности, сведенные в табл. 2 результаты. Время Из соединений настоящего изобретения можно вместе с обычным вспомогательным веществом, носителем или растворителем получать фармацевтические композиции и их содержащие лекарственные препараты, например, в виде твердых лекарственных форм, как таблеток или наполненных капсул, или жидких лекарственных форм, как растворов, суспензий, эмульсий, эликсиров или наполненных ими капсул,причем все формы применяют орально; фармацевтические композиции могут иметься и в виде суппозиториев для ректального применения,или в виде стерильных инъецируемых растворов для парентерального (в том числе, подкожного) применения. Такие фармацевтические композиции и их лекарственные препараты могут содержать обычные добавки в обычных количествах, дополнительные активные начала или вещества, а лекарственные препараты могут содержать любое эффективное количество активных начал в соответствии с намеченной суточной дозой. Таблетки, содержащие 10 мг активного начала или, более широко, по 0,1-100 мг на таблетку представляют собой пригодные лекарственные препараты. Предпочитают твердые лекарственные формы фармацевтических композиций для оральной дачи и инъецируемые растворы. Предлагаемые соединения весьма пригодны для лечения биологических заболеваний центральной нервной системы. Таким образом,предлагаемые соединения можно давать пациентам, людям и животным, которые нуждаются в лечении, облегчении и устранении, показания,связанного с биологической активностью соединений. К этому относятся, в частности, вызываемые возбудительной аминокислотой психоз, гипоксия, ишемия, паркинсонизм, судороги и мигрень. Пригодные суточные дозы колеблются от 0,1 до 1000 мг, от 10 до 50 мг и, в частности, 30-100 мг, в зависимости от точного способа дачи лекарственной формы, показания,пациента, веса тела пациента и предпочтения и 5 опыта соответствующего врача или ветеринарного врача. Нижеследующие реакционные схемы и примеры призваны пояснить изобретение. Общая схема I В указанной схеме I стадия (а) заключается в реакции производного нитроанилина формулы(1) с амином формулы (2) в присутствии триарилфосфина, предпочтительно трифенилфосфина и сложного диэфира диазодикарбоксилата,предпочтительно диэтилдиазодикарбоксилата, в среде углеводородного растворителя, как бензола, или эфирного растворителя, как тетрагидрофурана, предпочтительно бензола, при температурах приблизительно 5 С. Реакционную смесь смешивают в течение 2-16 ч и проверяют тонкослойной хроматографией на силикагеле с применением в качестве элюента смеси петролейного эфира и этилацетата в соотношении, равном 1:1. Растворитель испаряется при пониженном давлении, и продукт выделяют колоночной хроматографией на силикагеле с применением в качестве элюента смеси петролейного эфира и этилацетата. Стадия (б) заключается в восстановлении производного нитроанилина формулы (3) путем гидрогенолиза газообразным водородом при примерно 350 кПа в присутствии катализатора,как никеля Ренея или палладия на угле, предпочтительно никеля Ренея, в среде гидроксилированного растворителя, как метанола. Катализатор отфильтровывают и фильтрат испаряется с получением производного о-фенилендиамина,которое используют на следующем шаге без дополнительной очистки. Стадия (в) заключается в реакции производного о-фенилендиамина формулы (4) с производным щавелевой кислоты, как диметилоксалатом, в среде гидроксилированного растворителя, как метанола, при температурах флегмы в течение 12-24 ч. Реакционная смесь частично испаряется с получением неочищенного продукта, который очищают кристаллизацией. 6 Стадия (г) заключается в реакции производного хиноксалин-2,3-диона формулы (5) с нитрирующей смесью, предпочтительно нитрата калия и серной кислоты или трифторуксусной кислоты, при температурах от 0 С до комнатной температуры. Реакционную смесь подают на лед, получаемое твердое вещество очищают кристаллизацией или колоночной хроматографией на силикагеле с применением в качестве элюента смеси петролейного эфира и этилацетата. Схема II В указанной схеме II стадия (а) заключается в бромировании производного нитроанилина формулы (1) бромирующими средствами, как смесью тетрабромметана и трифенилфосфина или трибромида фосфора, в среде растворителя,как простого эфира. Летучие вещества испаряются при пониженном давлении и неочищенный продукт используют непосредственно на стадии(б) или очищают колоночной хроматографией на силикагеле с применением в качестве элюента смеси петролейного эфира и этилацетата. Стадия (б) заключается в реакции производного бензилбромида формулы (2) с соответственным аминосоединением формулы (3) в присутствии основания, как триэтиламина, в среде эфирного растворителя, как тетрагидрофурана, при температурах от 10 до 60 С. Реакционная смесь испаряется при пониженном давлении и охлаждается водой. Продукт экстрагируют с использованием растворителя, как этилацетата. Конечный продукт очищают колоночной хроматографией на силикагеле с применением в качестве элюента смеси петролейного эфира и этилацетата. Из формулы (3), указанной в схеме II,нельзя образовать производные формулы 4, 5 и 6, указанные в схеме I. В данных общих реакционных схемах указаны большинство конечных продуктов настоящего изобретения. Остальные описываются в нижепредставленных примерах. Схема 1(300 ммоль) 2-амино-6 метилбензойной кислоты суспендируют в простом эфире и порциями прибавляют 13,26 г (350 ммоль) гидрида литийалюминия. Реакционную смесь смешивают при комнатной температуре в течение 4 ч и охлаждают водным хлоридом аммония. Реакционную смесь фильтруют, фильтрат экстрагируют три раза, используя по 200 мл диэтилового эфира. Смачивающийся фильтрованный осадок также промывают 200 мл простого эфира, эфирные растворы объединяют,промывают 200 мл воды и сушат над сульфатом магния. Растворитель испаряется с получением 19,04 г (46%) кристаллического продукта. Температура плавления 78-81 С,массспектроскопия (химическая ионизация): М+1= 138.Ac - ацетил Получение сложного 2-ацетиламино-6 метилбензильного эфира уксусной кислоты Раствор 19,04 г (138,9 ммоль) 2-амино-6 метилфенилметанола в среде 100 мл уксусного ангидрида нагревают до 50 С в течение 2 ч. Избыточный уксусный ангидрид удаляют под вакуумом с получением 29,8 г (97%) светлокоричневого твердого вещества, кристаллизоAc - ацетил Получение сложного 2-ацетиламино-6-метил 3-нитробензильного эфира уксусной кислоты В раствор сложного 2-ацетиламино-6 метилбензильного эфира уксусной кислоты в среде 400 мл уксусной кислоты каплями добавляют 16 мл 60%-ной азотной кислоты при температуре ниже 5 С и одновременном смешивании. Реакционную смесь дополнительно смешивают в течение 2 ч при комнатной температуре,подают в ледяную воду и смешивают в течение 30 мин. Коричневое масло отделяют и обрабатывают 50 мл этилацетата с получением 7,65 гAc - ацетил Получение (2-амино-6-метил-3-нитрофенил)метанола 7 г (26,2 ммоль) сложного 2-ацетиламино 6-метил-3-нитробензильного эфира уксусной кислоты растворяют в 0,5-н. метанольной гидроокиси калия. Раствор испаряется после часа смешивания при комнатной температуре. Продукт экстрагируют в среде 150 мл этилацетата,промывают водой и рассолом и сушат над сульфатом магния. Испарением растворителя получают 4,45 г (93,4%) оранжевых игол, температура плавления 134-136 С (после повторного измерения: 135-136 С).Me - метил Общие указания о способе получения 2 дизамещенного аминометил-3-метил-6 нитрофениламина В суспензию 1 экв. (2-амино-6-метил-3 нитрофенил)-метанола и 1,5 экв. трифенилфосфина в среде 10 мл бензола подают 1,5 экв. диэтилазодикарбоксилата в атмосфере азота при 5 С. Реакционную смесь нагревают до комнатной температуры и смешивают в течение 2 ч. Темную реакционную смесь концентрируют под вакуумом, остаток хроматографируют на силикагеле с применением в качестве элюента смеси 9 гексана и этилацетата в соотношении, равном 95:5-75:25, с получением желаемого продукта. Различные синтезированные производные указаны ниже в табл. 3. Таблица 3 10 Общие указания о способе получения 3 диалкиламинометил-4-метилфенил-1,2 диамина Раствор 1 экв. (примерно 5 ммоль) 2 дизамещенного аминометил-3-метил-6 нитрофениламина в среде 75 мл метанола подвергают гидрированию при примерно 350 кПа в устройстве Парра. Реакцию контролируют тонкослойной хроматографией на силикагеле с применением в качестве элюента смеси простого эфира и этилацетата в соотношении, равном 1:1, и реакционную смесь полностью фильтруют. Фильтрат концентрируют и получаемый продукт используют дальше без дополнительной очистки. Общие указания о способе получения 5 диалкиламинометил-6-метил-1,4 дигидрохиноксалин-2,3-диона Раствор 1 экв. 3-диалкиламинометил-4 метилфенил-1,2-диамина и 1,5 экв. диметилоксалата в среде 35 мл метанола нагревают с обратным холодильником в течение 16 ч. Реакционная смесь частично испаряется с получением продукта в виде твердого вещества, которое используют дальше без дополнительной очистки. Синтезированные соединения ниже указаны в табл. 4. Таблица 4 Общие указания о способе получения 5 диалкиламинометил-6-метил-7-нитро-1,4 дигидрохиноксалин-2,3-диона В раствор 1 экв. (примерно 2-5 ммоль) 5 диалкиламинометил-6-метил-1,4-дигидрохиноксалин-2,3-диона в среде 5 мл концентрированной серной кислоты или 5 мл трифторуксусной кислоты при смешивании и 0 С подают нитрат калия. При использовании в качестве растворителя серной кислоты реакционную смесь подают на лед и получаемое твердое вещество кристаллизуют или подают в колонку на силикагеле или трихлорметане с применением в качестве элюента смеси трихлорметана и метанола в соотношении, равном 95:5, с получением чистого продукта. При использовании в качестве растворителя трифторуксусной кислоты избыточная трифторуксусная кислота испаряется при температуре ниже 35 С и получаемое твердое вещество очищают по вышеуказанному способу после нейтрализации аммиаком. Синтезированные соединения указаны ниже в табл. 5.Bu - бутил ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Производные хиноксалин-2,3-диона общей формулы I где R - группа - NR4R5, где R4 и R5 независимо друг от друга означают водород, низший алкил,незамещенный или замещенный низшим алкилом, низший циклоалкил, который может содержать 1 или 2 атома кислорода в качестве гетероатома,R1 и R2 независимо друг от друга означают водород или нитрогруппу,R3 - низший алкил,при этом радикалы R3 и R-CH2- могут каждый находиться в положениях 5 или 6,или их фармацевтически приемлемые соли. 2. Производные хиноксалин-2,3-диона общей формулы I по п.1, выбранные из группы,включающей: 5-диэтиламинометил-6-метил-7-нитро-1,4 дигидрохиноксалин-2,3-дион,5-дипропиламинометил-6-метил-7-нитро 1,4-дигидрохиноксалин-2,3-дион,5-дибутиламинометил-6-метил-7-нитро 1,4-дигидрохиноксалин-2,3-дион,5-циклогексиламинометил-6-метил-7 нитро-1,4-дигидрохиноксалин-2,3-дион,5-[(циклогексилметиламино)-метил]-6 метил-7-нитро-1,4-дигидрохиноксалин-2,3-дион,5-диметиламинометил-6-метил-7-нитро 1,4-дигидрохиноксалин-2,3-дион. 14 3. Фармацевтическая композиция, обладающая антагонистической активностью в отношении рецептора глютамата, содержащая активное вещество на основе производных хиноксалиндиона и фармацевтически приемлемый носитель, отличающаяся тем, что в качестве производных хиноксалиндиона содержит соединения по п.1 в терапевтически эффективном количестве. 4. Фармацевтическая композиция, обладающая противосудорожной активностью, содержащая активное вещество на основе производных хиноксалиндиона и фармацевтически приемлемый носитель, отличающаяся тем, что в качестве производных хиноксалиндиона содержит соединения по п.1 в терапевтически эффективном количестве. 5. Способ лечения пациентов, страдающих от удара или заболеваний путем введения средства, обеспечивающего блокировку рецепторов глютамата, отличающийся тем, что вводят соединения по п.1 в терапевтически эффективном количестве. 6. Способ лечения пациентов, страдающих от заболеваний, путем введения противосудорожного средства, отличающийся тем, что вводят соединения по п.1 в терапевтически эффективном количестве.
МПК / Метки
МПК: C07D 241/44
Метки: активностью, фармацевтически, этих, композиции, отношении, противосудорожной, фармацевтические, способы, лечения, обладающие, приемлемые, заболеваний, антагонистической, производные, соли, удара, соединений, пациентов, рецептора, помощи, хиноксалин-2,3-диона, страдающих, глютамата
Код ссылки
<a href="https://eas.patents.su/8-762-proizvodnye-hinoksalin-23-diona-i-ih-farmacevticheski-priemlemye-soli-farmacevticheskie-kompozicii-obladayushhie-antagonisticheskojj-aktivnostyu-v-otnoshenii-receptora-glyutamata-i.html" rel="bookmark" title="База патентов Евразийского Союза">Производные хиноксалин-2,3-диона и их фармацевтически приемлемые соли, фармацевтические композиции, обладающие антагонистической активностью в отношении рецептора глютамата и противосудорожной активностью, способы лечения пациентов, страдающих от удара или заболеваний, при помощи этих соединений.</a>
Предыдущий патент: Катализатор на носителе и способ гидрирования многократно ненасыщенных углеводородов с 2-8 атомами углерода.
Следующий патент: Способ минимизации остеопороза
Случайный патент: Способы и системы для осуществления операций с платежными картами












