Производные 3-азабицикло(3.1.0)гексана, обладающие сродством к опиодному рецептору
Номер патента: 5117
Опубликовано: 28.10.2004
Авторы: Гетин Дэвид Моррис, Бэнкс Бернард Джозеф, Критчер Дуглас Джеймс, Фенвик Эшли Эдвард, Ланн Грэхем, Гибсон Стефен Пол
Формула / Реферат
1. Соединение формулы I
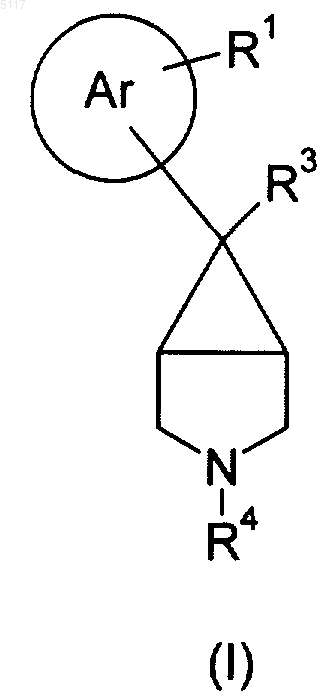
где кольцо Ar представляет собой фенильное кольцо;
R1 представляет собой NH2 или NHSO2Y1;
Y1 представляет собой C1-10алкил;
R3 представляет собой C1-6алкил (где алкильная группа необязательно замещена фенилом);
R4 представляет собой C1-10алкил, где группа присоединена к атому N через sp3 углерод и где группа замещена одним или несколькими заместителями, выбранными из следующих:
арил2,
циклоалкил1,
арил2окси,
гетероцикл, замещенный одним или несколькими заместителями, выбранными из CO2(C1-6алкила) и арила,
где арил2 представляет собой фенил, замещенный одним или несколькими заместителями, выбранными из CO(C1-6алкил), гетероциклил, арил(CH2)окси, CN и C3-7циклоалкил,
циклоалкил1 представляет собой C3-10карбоциклическую систему с одним или двумя кольцами и замещенную арилом,
при условии, что нет N-R4 групп, в которых гетероатом присоединен к другому гетероатому через один sp3 углерод;
гетероцикл представляет собой группу, состоящую из 1, 2 или 3 колец, содержащих до 4 кольцевых гетероатомов, выбранных из N, O и S, и до 18 кольцевых атомов углерода;
арил, относящийся к определению арилокси и тому подобное, обозначает группу, содержащую фенильное кольцо, и которая может содержать дополнительное карбоциклическое кольцо, конденсированное с указанным фенильным кольцом, и которая может быть присоединена к оставшейся части соединения через любой(ые) доступный(ые) атом(ы) (примеры таких групп включают в себя нафтил, инданил и тому подобное);
группы алкил, алкенил и алкинил могут быть линейными или разветвленными, если позволяет количество атомов углерода;
группы циклоалкил могут быть полициклическими, если позволяет количество атомов углерода;
или его фармацевтически приемлемая соль.
2. Соединение по п.1, где R3 представляет собой C1-6алкил.
3. Соединение по п.2, где R3 представляет собой H, CH3, C2H5, изо-C3H7, н-C3H7 или CH2OCH3.
4. Соединение по любому из пп.1-3, где R4 представляет собой C1-10алкил, замещенный циклоалкилом1.
5. Соединение по любому из пп.1-4, где R3 представляет собой CH3 или C2H5.
6. Соединение по любому из пп.1-5, где R1 представляет собой NHSO2CH3, NHSO2C2H5, NHSO2(н-C3H7), NHSO2(изо-C3H7), NHSO2(H-C4H7).
7. Соединение по п.6, где R1 представляет собой NHSO2CH3 или NHSO2C2H5.
8. Соединение по любому из пп.1-7, где R4 представляет собой C2-4алкил, замещенный циклоалкилом1.
9. Соединение по п.8, где R4 представляет собой пропил, замещенный циклоалкилом1.
10. Соединение по п.1, которое выбрано из группы, включающей следующие соединения:
N-(3-{3-[3-(4-ацетилфенил)пропил]-6-этил-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамид,
N-[3-(3-{2-[4-(4,5-дигидро-1,3-оксазол-2-ил)фенокси]этил}-6-этил-3-азабицикло[3.1.0]гекс-6-ил)фенил]метансульфонамид,
N-(3-{6-этил-3-[2-(4-феноксифенокси)этил]-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамид,
N-{3-[3-(4-цианобензил)-6-этил-3-азабицикло[3.1.0]гекс-6-ил]фенил}метансульфонамид,
N-(3-{3-[2-(4-циклопропилфенокси)этил]-6-этил-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамид,
N-{3-[6-этил-3-(октагидро-1H-инден-2-илметил)-3-азабицикло[3.1.0]гекс-6-ил]фенил}метансульфонамид,
N-(3-{3-[3-(4-ацетилфенил)пропил]-6-этил-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамид,
N-(3-{3-[2-(бензилокси)бензил]-6-этил-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамид,
N-{3-[3-(4-цианобензил)]-6-этил-3-азабицикло[3.1.0]гекс-6-илфенил}метансульфонамид,
N-(3-{3-[2-(4-циклопропилфенокси)этил]-6-этил-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамид,
N-(3-{6-этил-3-[(2-фенилциклопропил)метил]-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамид
и их фармацевтически приемлемые соли.
11. Фармацевтическая композиция, включающая соединение по любому из предыдущих пунктов, и фармацевтически приемлемый носитель.
12. Применение соединения по любому из пп.1-10 в медицине.
13. Применение соединения по любому из пп.1-10 в качестве лекарственного средства для лечения опиат-опосредованного заболевания или состояния.
14. Применение соединения по любому из пп.1-10 при получении лекарственного средства для лечения заболевания или состояния, опосредованного опиатными рецепторами.
15. Способлечения состояния, опосредованного опиатным рецептором или рецепторами, включающий введение терапевтически активного количества соединения по любому из пп.1-10.
16. Способ получения соединения формулы I по п.1, где R1 представляет собой NHSO2Y1, путем взаимодействия соединения формулы II
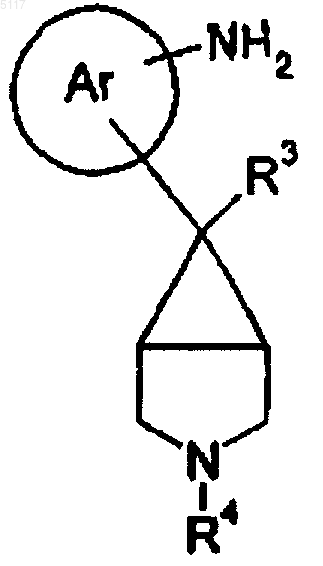
с соединением формулы III
Z1-SO2Y1 III,
где Z1 представляет собой подходящую удаляемую группу, такую как галоген или Y1SO2O-;
и, если желательно или необходимо, преобразования полученного соединения формулы I в фармацевтически приемлемую соль или наоборот.
17. Способ получения соединения формулы I по п.1 путем восстановления соединения формулы IV
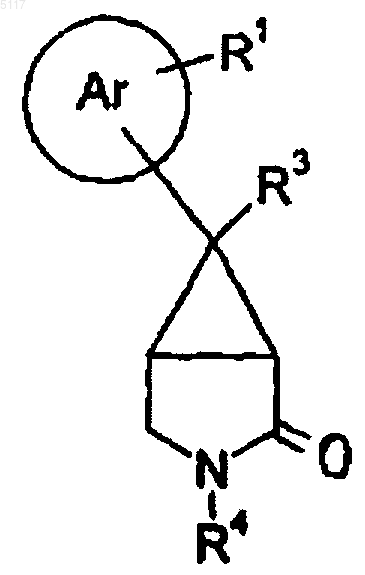
с использованием подходящего восстановителя;
и, если желательно или необходимо, преобразования полученного соединения формулы I в фармацевтически приемлемую соль или наоборот.
18. Способ получения соединения формулы I по п.1 путем взаимодействия соединения формулы VIII
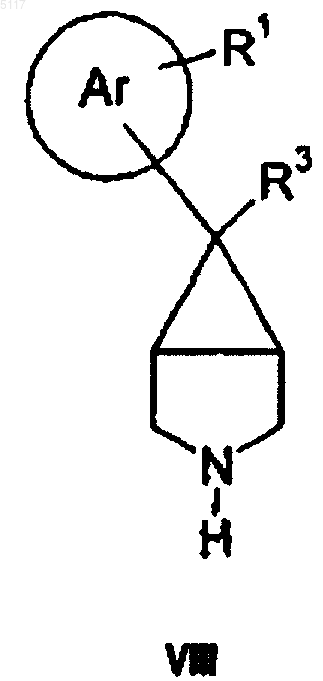
с соединением формулы IX
R4-Lq IX,
где Lg представляет собой удаляемую группу;
и, если желательно или необходимо, преобразования полученного соединения формулы I в фармацевтически приемлемую соль или наоборот.
19. Способ получения соединения формулы I по п.1 путем восстановления соединения формулы X
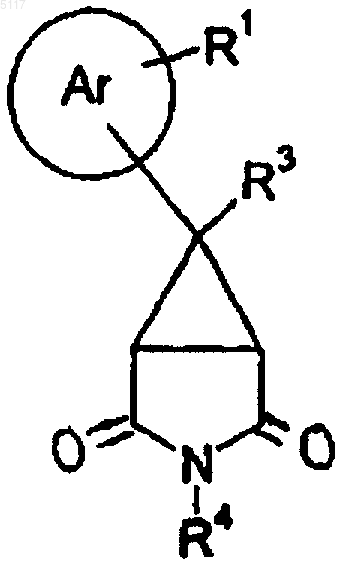
подходящим восстановителем;
и, если желательно или необходимо, преобразования полученного соединения формулы I в фармацевтически приемлемую соль или наоборот.
20. Способ получения соединения формулы I по п.1 путем восстановления соответствующего соединения формулы XXXI
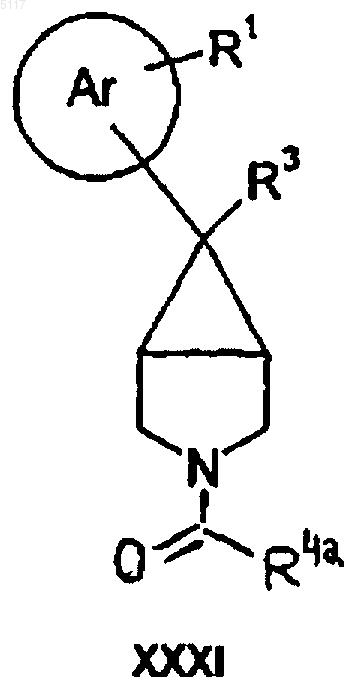
где R4aCH2 принимает те же значения, что и R4, описанное выше;
и, если желательно или необходимо, преобразования полученного соединения формулы I в фармацевтически приемлемую соль или наоборот.
21. Способ получения соединений формулы I по п.1 путем восстановительного аминирования амина формулы VIII, представленной выше, с альдегидом формулы R4a-CHO, где R4aCH2 принимает те же значения, что и R4, описанное выше,
и, если желательно или необходимо, преобразования полученного соединения формулы I в фармацевтически приемлемую соль или наоборот.
22. Соединение формулы II
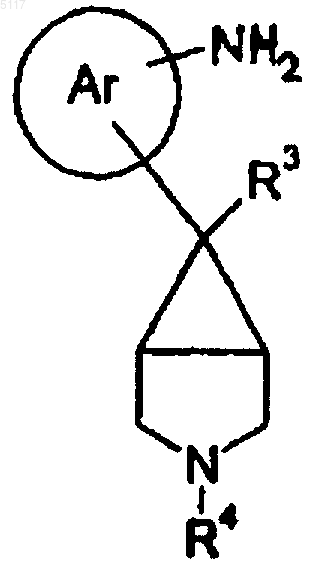
где R3 и R4 такие, как определено в п.1, или его соль.
23. Соединеэшх формулы IV
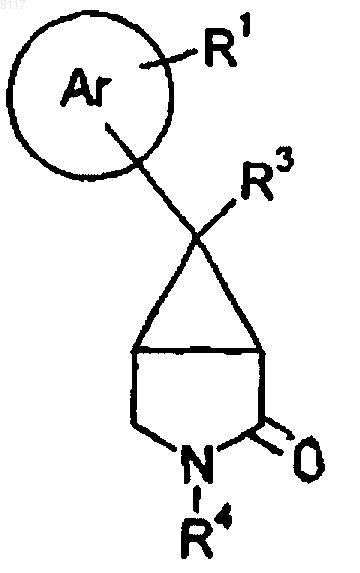
где R1, R3 и R4 такие, как определено в п.1, или его соль.
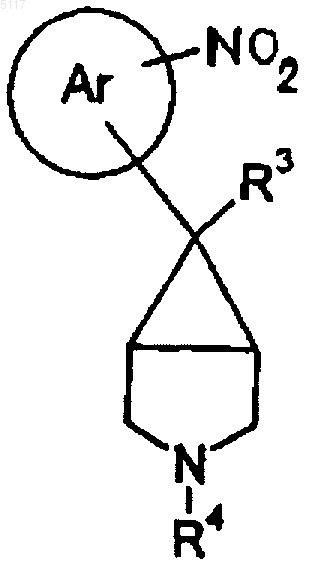
24. Соединение формулы X
где R1, R3 и R4 такие, как определено в п.1, или его соль.
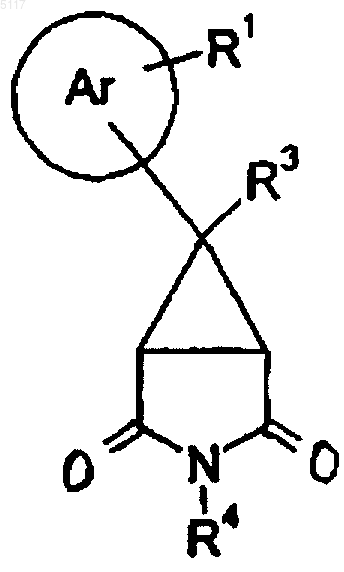
25. Соединение формулы XII
где R3 и R4 такие, как определено в п.1, или его соль.
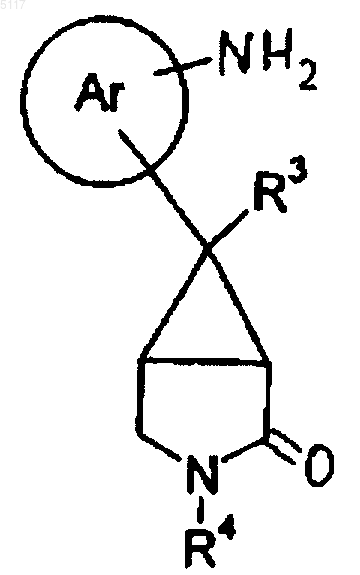
26. Соединение формулы XXX
где R3 и R4 такие, как определено в п.1, или его соль.
27. Соединение формулы XXXI
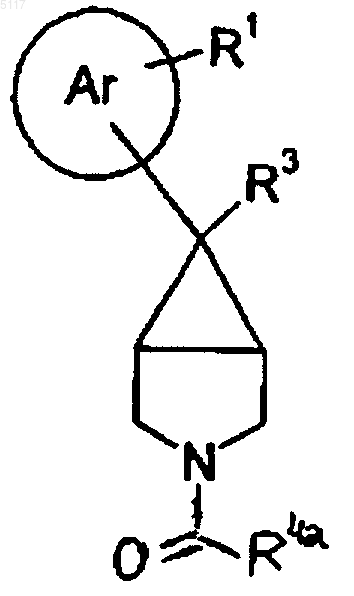
где R4a имеет то же значение, как указано выше, и R1 и R3 такие, как определено в п.1, или его соль.
Текст
1 Данное изобретение относится к фармацевтически полезным соединениям, в частности,к соединениям, которые связываются с опиатными рецепторами (например, мю-, каппа- и дельта-опиоидными рецепторами). Соединения,которые связываются с такими рецепторами,вероятно, могут использоваться при лечении заболеваний, модулируемых опиатными рецепторами, например, синдрома воспаленной толстой кишки, запора, тошноты, рвоты, и зудящих дерматозов, таких как аллергический дерматит и атопия, у животных и людей. Соединения,которые связываются с опиатными рецепторами, были рекомендованы для лечения расстройств аппетита, опиатной передозировки,депрессии, зависимости от табака и хронического алкоголизма, половой дисфункции, удара,приступа, повреждения спинного мозга и травмы головы. Они особенно требуются для эффективного лечения зуда. Зуд является обычным дерматологическим симптомом, который может приводить к усилению тяжелого патологического состояния как у людей, так и у животных. Зачастую зуд ассоциируется с воспалительными заболеваниями кожи, которые могут вызваться реакциями повышенной чувствительности,включая реакции на укусы насекомых, такие как укусы блох, и на аллергены окружающей среды,такие как клещ домашней пыли или пыльца,бактериальными и грибковыми инфекциями кожи или инфекциями эктопаразитов. Существующие методы лечения, используемые для лечения зуда, включают применение кортикостероидов и антигистаминов. Однако оба эти метода лечения, как известно, обладают нежелательными побочными эффектами. Другие терапевтические методы, которые использовались ранее, включают применение пищевых добавок незаменимых жирных кислот, хотя их недостатком является медленное действие и ограниченная эффективность в отношении аллергического дерматита. Применялись также различные смягчающие средства, такие как мягкий парафин, глицерин и ланолин, но с ограниченным успехом. Таким образом, необходимы альтернативные и/или более совершенные методы лечения зуда. Некоторые производные 4-арилпиперидина описаны среди прочих соединений в европейских заявках на патент ЕР 287339, ЕР 506468 и ЕР 506478 в качестве опиоидных антагонистов. Кроме того, в международной заявке на патент WO 95/15327 описаны азабициклоалканпроизводные, которые могут использоваться в качестве нейролептических средств. В международной заявке на патент WO 00/39089, поданной ранее даты приоритета по данному изобретению, но опубликованной позднее и введенной во всей полноте в данное изобретение в виде ссылки, описаны азабицик 005117 где кольцо Аr представляет собой бензоконденсированные фенил, или 5- или 6-членное гетероарильное кольцо;R1, взятый отдельно, представляет собой Н, галоген, NO2, NH2, NY2WY1, Het1, AD,CO2R7, C(O)R8, C(=NOH)R8 или ОЕ,Y2 представляет собой Н, C1-6 алкил, С 3-6 алкенил (каждый из указанных алкила и алкенила необязательно замещен арилом, арилоксигруппой или Het1),W представляет собой SO2, СО, С(О)О,P(Y1)=O, Р(Y1)=S,Y1 представляет собой C1-10 алкил (необязательно замещенный одним или несколькими заместителями, независимо выбранными из галогена, ОН, C1-4 алкокси-, C1-6 алканоилоксигруппы, CONH2, C1-6 алкоксикарбонила, NH2,арила, моно- или ди(С 1-4 алкил)аминогруппы,С 3-8 циклоалкила, фталимидила, Het1), Het1, арил(необязательно замещенный одним или несколькими заместителями, независимо выбранными из C1-4 алкила, C1-4 галогеналкила или галогена), NH2, N(C1-6 алкил)2 или NH(C1-6 алкил),Het1 представляет собой гетероциклическую группу, содержащую до 4 гетероатомов,выбранных из N, О и S, которая может включать до 3 колец (предпочтительно, гетероарильная группа, необязательно, бензо- или пиридинконденсированный гетероарил), необязательно замещенных одним или несколькими заместителями, независимо выбранными из C1-6 алкила,C1-6 алкоксигруппы, С 3-6 циклоалкила, C1-6 галогеналкоксигруппы, C1-6 галогеналкила, С 3-6 галогенциклоалкила, =O, ОН, галогена, NO2,SiR19aR19bR19c, CON20aR20b, NR20aR20b, SR21a,NR21bSO1R22a, NR21cC(O)OR22b, NR21dCOR22d иC1-6 алкоксикарбонила,и если атом S присутствует в кольце, он может быть представлен как часть группы -S-,S(O)- или S(O)2-,и атомы углерода в кольце могут быть представлены как часть карбонильного фрагмента;R19a, R19b, R19c, каждый независимо, представляют собой C1-6 алкил или арил,R20a и R20b, каждый независимо, представляют собой Н, C1-6 алкил, арил, (C1-4 алкил) фенил, и каждый из указанных алкила, арила и алкилфенила необязательно замещен одним или несколькими C1-4 алкилом, C1-4 алкоксигруппой, 3 ОН, NO2, NH2 и/или галогеном, или R20a и R20b вместе с атомом N, к которому они присоединены, могут образовывать 4-6-членное кольцо,необязательно замещенное одним или несколькими заместителями, независимо выбранными из одного или нескольких C1-4 алкила, C1-4 алкоксигруппы, ОН, =O, NO2, NH2 и/или галогена,R21a, b, с и d, каждый независимо, представляют собой Н, C1-6 алкил, арил или C1-4 алкилфенил, и каждый из указанных алкила, арила и алкилфенила необязательно замещен одним или несколькими C1-4 алкилом, C1-4 алкокси, ОН, NO2,галогеном, NH2,R22 а, b и с, каждый независимо, представляют собой C1-6 алкил, арил или C1-4 алкилфенил, и каждый из указанных алкила, арила и алкилфенила необязательно замещен одним или несколькими C1-4 алкилом, C1-4 алкокси-, ОН, NO2,галогеном, NH2,А представляет собой C1-4 алкилен, С 2-4 алкенилен или С 2-4 алкинилен, каждый из которых необязательно замещен одним или несколькимиC1-3 алкила, С 3-8 циклоалкила, арила и C1-4 алкилфенила необязательно замещен одним или несколькими NO2, галогеном, C1-4 алкилом и/илиC1-4 алкила и/или C1-4 алкокси- необязательно замещен одним или несколькими галогенами,или R25 и R26 вместе с атомом N, к которому они присоединены, могут образовывать 4-7-членное гетероциклическое кольцо, необязательно содержащее один или несколько дополнительных гетероатомов, выбранных из N, О и S, и указанное кольцо необязательно замещено одним или несколькими C1-4 алкилом, ОН, =O, NO2, NH2 и/или галогеном,R27 представляет собой COR30, CO2R31a,SO2R31b,R28 и R29, каждый независимо, представляют собой Н, C1-6 алкил, С 3-8 циклоалкил, арил или C1-4 алкилфенил, и каждый из указанных C1-6 алкила, С 3-8 циклоалкила, арила или C1-4 алкилфенила необязательно замещен одним или несколькими NO2, галогеном, C1-4 алкилом, C1-4 алкокси- (каждый из последних C1-4 алкила и C1-4 алкокси- необязательно замещен одним или несколькими галогенами),R30 представляет собой Н, C1-4 алкил, С 3-8 циклоалкил, C1-4 алкокси-, С 3-8 циклоалкоксигруппу, арил, арилоксигруппу, C1-4 алкилфенил,фенил (C1-4)алкоксигруппу (каждый из указанных C1-4 алкила, С 3-8 циклоалкила, C1-4 алкокси-,С 3-8 циклоалкокси-, арила, арилокси-, C1-4 алкилфенила, фенил(C1-4)алкокси- необязательно за 005117 4 мещен одним или несколькими NO2, галогеном,C1-4 алкилом, C1-4 алкокси (и последние алкил и алкокси необязательно замещены одним или несколькими галогенами,R31a и R31b, каждый независимо, представляют собой C1-4 алкил, С 3-8 циклоалкил, арил илиC1-4 алкилфенил, каждый из которых необязательно замещен одним или несколькими NO2,галогеном, C1-4 алкилом или C1-4 алкокси-, и каждый из последних алкила и алкокси- необязательно замещен одним или несколькими галогенами,Е представляет собой Н, CONR32R33,CSNR32R33, COR34, CO2R34, COCH(R34a)NH2, R35,CH2CO2R35a, CHR35bCO2R35a,CH2OCO2R35c,35d 35c 36 37CHR37NH2 или PO(OR38)2,R32 и R33, каждый независимо, представляют собой Н, С 3-10 алкилалкенил, С 3-7 циклоалкил (необязательно замещенный C1-4 алкилом),фенил (необязательно замещенный (Х)n), C1-10 алкил (необязательно замещенный С 4-7 циклоалкилом (необязательно замещенным C1-4 алкилом) или фенилом, необязательно замещенным (Х)n),или R32 и R33 вместе с атомом N, к которому присоединены, могут образовывать 5-8 членный гетероцикл, необязательно включающий дополнительные гетероатомы, выбранные из N, О и S, и указанный гетероцикл необязательно замещен C1-4 алкилом, необязательно замещенным одним или несколькими галогенами,R34 представляет собой Н, С 4-7 циклоалкил(необязательно замещенный одним или несколькими C1-4 алкилами), фенил (необязательно замещенный (Х)n, C1-4 алканоилоксигруппой,NR32R33, CONR32R33 и/или ОН) или C1-6 алкил(необязательно замещенный одним или несколькими галогеном, С 4-7 циклоалкилом (необязательно замещенным одним или несколькими(Х)n,C1-4 алканоилоксигруппой,NR32R33, CONR32R33 и/или ОН,R34a представляет собой Н, C1-6 алкил (необязательно замещенный одним или несколькими галогеном, С 4-7 циклоалкилом (необязательно замещенным одним или несколькимиC1-4 алкилами) или фенилом (необязательно замещенным (Х)n, C1-4 алканоилокси, NR32R33,CONR32R33 и/или ОН, С 4-7 циклоалкил (необязательно замещенный одним или несколькимиC1-4 алкилами), фенил (необязательно замещенный (Х)n, C1-4 алканоилокси, NR32R33, CONR32R33 и/или ОН) или природный аминокислотный заместитель,R35 представляет собой С 4-7 циклоалкил,необязательно замещенный одним или несколькими C1-4 алкилом, фенилом (необязательно замещенным одним или несколькими (Х)n, C1-4 алканоилом, NHR32, CON(R32)2 и/или ОН), C1-6 алкилом (необязательно замещенным С 4-7 циклоалкилом, необязательно замещенным одним или 5 несколькими C1-4 алкилом или фенилом (необязательно замещенным одним или несколькими(Х)n, C1-4 алканоилом, NHR32, CON(R32)2 и/или ОН, C1-4 алкокси(С 1-4 алкилом), фенил(C1-4)алкилокси(C1-4)алкилом,тетрагидропиранилом,тетрагидрофуранилом, циннамилом или триметилсилилом,R35 а, b, с и d, каждый независимо, представляют собой Н, C4-7 циклоалкил, необязательно замещенный одним или несколькими C1-4 алкилом, фенилом, необязательно замещенным одним или несколькими (Х)n или C1-6 алкилом(необязательно замещенным C4-7 циклоалкилом,необязательно замещенным одним или несколькими C1-4 алкилом или фенилом, необязательно замещенным одним или несколькими (Х)n),R36 и R37, каждый независимо, представляют собой Н, С 3-6 алкилалкенил, С 4-7 циклоалкил, фенил, необязательно замещенный одним или несколькими (Х)n или C1-6 алкилом (необязательно замещенным С 4-7 циклоалкилом,необязательно замещенным одним или несколькими C1-4 алкилом или фенилом, необязательно замещенным одним или несколькими (Х)n),R38 представляет собой С 4-7 циклоалкил,необязательно замещенный одним или несколькими C1-4 алкилом, фенилом, необязательно замещенным одним или несколькими (Х)n или C1-6 алкилом (необязательно замещенным С 4-7 циклоалкилом, необязательно замещенным одним или несколькими C1-4 алкилом или фенилом, необязательно замещенным одним или несколькими (Х)n),R2, взятый отдельно, представляет собой Н или галоген; или R1 и R2, присоединенные к соседним атомам углерода, могут вместе с атомами углерода, к которым присоединены, представлятьHet1a представляет собой гетероциклическую группу, содержащую до 4 гетероатомов,выбранных из N, О и S, которая может включать до 3 колец (и предпочтительно представляет собой 5-7-членное гетероциклическое кольцо,необязательно конденсированное с бензольным кольцом),и указанная группа является необязательно замещенной одним или несколькими заместителями, независимо выбранными из ОН, =O, галогена, C1-4 алкила, C1-4 галогеналкила, C1-4 алкоксии C1-4 галогеналкоксигруппы,и указанные C1-4 алкил, C1-4 галогеналкил,C1-4 алкокси- и C1-4 галогеналкоксигруппа могут быть необязательно замещены одним или несколькими С 3-6 циклоалкилом, арил(C1-6)алкилом,и арильная группа является необязательно замещенной одним или несколькими галогеном,C1-4 алкилом, C1-4 галогеналкилом, C1-4 алкокси- и 6 быть необязательно замещены одним или несколькими NR23R24, NR23S(O)nR24, NR23C(O)mR24,и если в кольце присутствует атом S, он может быть представлен как часть группы -S-,S(O)- или -S(O2)-,и R23 и R24, каждый в отдельности, независимо представляют собой Н, C1-4 алкил или C1-4 галогеналкил; или R23 и R24 вместе с атомом N, к которому они присоединены, могут образовывать 4-6 членное гетероциклическое кольцо, необязательно содержащее один или несколько дополнительных гетероатомов, выбранных из N, О или S, и указанное гетероциклическое кольцо является необязательно замещенным одним или несколькими галогеном, C1-4 алкилом, C1-4 галогеналкилом, C1-4 алкокси- и/или C1-4 галогеналкоксигруппами;R3 представляет собой Н, CN, галоген, C1-6 алкоксигруппу, C1-6 алкоксикарбонил, C2-6 алканоил, C2-6 алканоилокси, С 3-8 циклоалкил, С 3-8 циклоалкилокси, С 4-9 циклоалканоил, арил, арилоксигруппу, гетероарил, насыщенный гетероцикл, NR12R13, CONR12R13, NY2WY1, C1-6 алкил,С 2-10 алкенил, С 2-10 алкинил (каждая из указанных алкильной, алкенильной и алкинильной групп является необязательно замещенной одним или несколькими CN, галогеном, ОН, C1-6 алкоксигруппой, C1-6 алкоксикарбонилом, С 2-6 алкилоксикарбонилоксигруппой, C1-6 алканоилом, C1-6 алканоилоксигруппой, С 3-8 циклоалкилом, С 3-8 циклоалкилоксигруппой, C4-9 циклоалканоилом,арилом, арилоксигруппой, гетероарилом, насыщенным гетероциклом, NR12R13, CONR12R13 и/или NY2WY1),R4 представляет собой C1-10 алкил, С 3-10 алкенил или С 3-10 алкинил, и каждая из этих групп присоединена к атому N через sp3 углерод и замещена одним или несколькими заместителями,выбранными из следующих групп: С 2-6 алкоксигруппа [замещенная одной или несколькими группами, выбранными из ОН,NR25R26, CONR25R26, галогена, C1-6 алкоксигруппы, С 2-4 алкинила, С 2-4 алкенила, гетероарила 1,арила 1, COCH2CN, СО(гетероарила 1), СO(арила 1), СO2(гетероарила 1), СОСН 2(арила 1), СОСН 2(гетероарила 1), SO2NR25R26 и циклоалкила 1],S(O)nC1-6 алкил [необязательно замещенный одной или несколькими группами, выбранными из ОН, NR25R26, CONR25R26, галогена, C1-6 алкоксигруппы, С 2-4 алкинила, С 2-4 алкенила, гетероарила 1, арила 1, COCH2CN, СО(гетероарила 1), CO(арила 1), СO2(гетероарила 1), СОСН 2NR25R26,циклоалкил 1 окси,СОциклоалкил 1,гетероцикл, замещенный одним или несколькими заместителями, выбранными из C1-6 алкилаCH2CONR R , NR R , NHCONR R , CO(C1-6 алкила), SO2NR25R26, SO2(C1-6 алкила), CO2(C1-6 алкила), CH2CO2(C1-6 алкила), OCH2CO2(C1-6 алкила), арила, гетероциклила, арилоксигруппы,арил(СН 2)оксигруппы, арил(СН 2)-, CN и С 3-7 циклоалкила,гетероциклилоксигруппа, замещенная одним или несколькими заместителями, выбранными из C1-6 алкила (замещенного ОН),CONR25R26, CH2CONR25R26, NR25R26, NHCO 8 где арил 1 представляет собой фенил, необязательно конденсированный с С 5-7 карбоциклическим кольцом, и указанная группа является необязательно замещенной одним или несколькими заместителями, выбранными из C1-6 алкилаCO2(гетероарила), арила, гетероциклила, арилоксигруппы, арил(CH2)оксигруппы, арил(СН 2),CN, O(CH2)1-4-CONR25R26 и С 3-7 циклоалкила,арил 2 представляет собой фенил, необязательно конденсированный с C5-7 карбоциклическим кольцом, указанная группа является необязательно замещенной одним или несколькими заместителями, выбранными из C1-6 алкилаCONR25R26 и С 3-7 циклоалкила,гетероарил 1 представляет собой гетероарил, необязательно конденсированный с С 5-7 карбоциклическим кольцом, указанная группа является необязательно замещенной одним или несколькими заместителями, выбранными изR26, CO(C1-6 алкила), СО-арила, СО-гетероарила,SO2NR25R26, S(O)n(C1-6 алкила), S(О)n(арила),S(O)n(гетероарила), CO2(C1-6 алкила), СO2(арила), СO2(гетероарила), СО 2 Н, (СН 2)1-4CO2-(C1-6 алкила),(СН 2)1-4 СO2 Н,(СН 2)1-4CO2(арила),(CH2)1-4CO2-(гетероарила),О(СН 2)1-4CO2(C1-6 алкила), О(СН 2)1-4 СO2 Н, О(СН 2)1-4CO2-(арила),О(СН 2)1-4CO2(гетероарила), арила, гетероциклила, арилоксигруппы, арил(СН 2)оксигруппы,арил(СН 2), CN, O(CH2)1-4-CONR25R26 и С 3-7 циклоалкила,циклоалкил 1 представляет собой С 3-10 карбоциклическую систему с одним или тремя кольцами, которая замещена C1-6 алкилом, арилом, C1-6 алкоксигруппой, СН 2(арилом 1), C1-4 галогеналкилом, галогеном, ОН, CN или NR25R26, 9 при условии, что отсутствуют N-R4 группы, в которых гетероатом соединен с другим гетероатомом С через один SP3 углеродZ представляет собой одинарную связь,СО или S(O)n группу,В представляет собой (СН 2)p,R12 и R13, каждый независимо, представляют собой Н или C1-4 алкил,или R12 и R13 вместе с атомом N, к которому присоединены, могут образовывать 4-7 членный гетероцикл, необязательно включающий дополнительную гетерогруппу, выбранную из NR16, О и/или S, и указанный гетероцикл необязательно замещен одним или несколькимиC1-4 алкилами,R14 и R15, каждый, независимо, представляют собой Н, C1-10 алкил, С 3-10 алкенил, С 3-10 алкинил, С 3-8 циклоалкил, арил или гетероарил,или R14 и R15 вместе с атомом N, к которому присоединены, могут образовывать 4-7 членный гетероцикл, необязательно включающий дополнительную гетерогруппу, выбранную из NR16, О и/или S, и указанный гетероцикл необязательно замещен одним или несколькимиq равно 0 или 1; термин природный аминокислотный заместитель означает -заместитель, который встречается в любой из следующих природных аминокислот: глицин, аланин, валин, лейцин,изолейцин, фенилаланин, триптофан, тирозин,гистидин, серин, треонин, метионин, цистеин,аспаргиновая кислота, глутаминовая кислота,аспаргин, глутамин, лизин, аргинин или пролин; термин гетероарил означает ароматическое кольцо, содержащее до четырех гетероатомов, независимо выбранных из N, О и S, и, если атом S присутствует в кольце, он может быть представлен как часть групп -S-, S(O)- или-S(O)2-, указанная группа может соединяться с остатком соединения через любой(ые) доступный(е) атом(ы); 10 термин гетероцикл означает группу из 1,2 или 3 колец, которая содержит до 4 кольцевых гетероатомов, выбранных из N, О и S, и до 18 кольцевых атомов углерода; термин арил, входящий в определения арилокси и т.д., означает группу, которая включает фенильное кольцо, может содержать дополнительное карбоциклическое кольцо, конденсированное с указанным фенильным кольцом, и может соединяться с остатком соединения через любой(ые) доступный(е) атом(ы)(примерами таких групп являются нафтил, инданил и т.д.); алкильная, алкенильная и алкинильная группы могут быть линейными или, если количество атомов позволяет, разветвленными группами; циклоалкильные группы могут быть полициклическими, если количество атомов углерода позволяет; или его фармацевтически или ветеринарно приемлемое производного или пролекарство. В том случае, когда имеет место конденсированная гетероциклическая группа, она может присоединяться к остатку соединения через любой(ые) доступный(е) атом(ы). Галогеналкильные,галогеналкокси группы и т.п. могут содержать несколько атомов галогена и, например, могут быть пергалогенированными (исчерпывающе галогенированными). Некоторые соединения по данному изобретению могут существовать в виде одной или нескольких геометрических и/или стериометрических формах. Данное изобретение включает все такие отдельные изомеры и их соли и пролекарства. Некоторые соединения по данному изобретению могут существовать в виде нескольких таутомерных форм. Аналогично, некоторые соединения по изобретению могут быть в виде цвиттерионных форм. Следует учесть, что изобретение включает все такие таутомеры, цвиттерионы и их производные. Фармацевтически приемлемые соли соединений формулы (I) включают их кислотноаддитивные соли и соли с основаниями. Подходящие кислотно-аддитивные соли образуются при использовании кислот, которые дают нетоксичные соли, и примеры таких солей включают гидрохлориды, гидробромиды, гидройодиды,сульфаты, гидросульфаты, нитраты, фосфаты,гидрофосфаты, ацетаты, малеаты, фумараты,лактаты, тартраты, цитраты, глюконаты, сукцинаты, бензоаты, метансульфонаты, бензолсульфонаты и п-толуолсульфонаты. Подходящими солями с основаниями являются соли, полученные из оснований, которые дают нетоксичные соли, и примерами таких солей являются соли алюминия, кальция, лития, магния, калия, натрия, цинка и диэтаноламинные соли. Обзор 11 таких солей приведен в публикации Berge et al.,J. Pharm. Sci., 66, 1-19 (1977). Специалисту в данной области понятно,что некоторые защищенные производные соединений формулы (I), которые могут образовываться перед конечной стадией снятия защиты, сами по себе могут не обладать фармакологической активностью, но в некоторых случаях после введения в организм или нанесения на организм, например, под действием обмена веществ, могут превращаться в соединения формулы (I), которые являются фармакологически активными. Такие производные охватываются термином пролекарство. Квалифицированному в данной области техники специалисту будет также понятно, что некоторые фрагменты, известные как профрагменты, например описанные в публикации Design of Prodrugs (H.Bundgaard (Elsevier), 1985), могут вводиться в подходящие функциональные группы, когда такие функциональные группы присутствуют в соединениях формулы (I), также для получения пролекарства. Кроме того, некоторые соединения формулы I могут действовать как пролекарства других соединений формулы I. Все защищенные производные и пролекарства соединений формулы I включены в область по данному изобретению. Предпочтительно кольцо Аr представляет собой фенил или пиридил. Наиболее предпочтительно кольцо Аr представляет собой группу формулы Предпочтительно R1, взятый отдельно,представляет собой ОН, CN, галоген, NO2, NH2,NY2WY1 или Het1. Более предпочтительно R1,взятый отдельно, представляет собой ОН, CN, I,Cl, NH2, NO2, гетероарил, необязательно конденсированный с бензольным кольцом,NHSO2Y1, NHCOY1 или NHCO2Y1. Еще более предпочтительно R1, взятый отдельно, представляет собой ОН, CN, I, Cl, NH2, NO2, 1,2,3 триазолил, 1,2,4-триазолил, имидазол-2-ил, пиридин-2-ил, тиен-2-ил, имидазол-4-ил, бензимидазол-2-ил, NHSO2(C1-6 алкил), NHSO2(C1-6 алкил, замещенный метоксигруппой, CONH2, ОН,СO2(С 2-6 алкилом), фталимидогруппой, NH2 или галогеном), NHSO2NH2, NHSO2NH(C1-6 алкил),NHSO2N(C1-6 алкил)2, NHSO2Het1a, NHCO(C1-6 алкил) или NHCO2(C1-6 алкил). Еще более предпочтительно R1 представляет ОН, NНSO2 СН 3,NHSO2C2H5, NHSO2(n-С 3 Н 7), NHSO2(i-С 3 Н 7),NHSO2(n-С 4 Н 7), NНSO2NН(i-С 3 Н 7), NHSO2(Nмeтилимидaзoл-4-ил),NHSO2(СН 2)2OСН 3,NHSO2(СН 2)2OН, 1,2,4-триазолил или имидазол 2-ил. Наиболее предпочтительно R1 представляет собой ОН, NHSO2CH3, NHSO2C2H5 или имидазол-2-ил.R1 и R2 вместе с атомами углерода, к которым они присоединены, предпочтительно представляют собой бензо-конденсированное 5-7 членное гетероарильное кольцо, необязательно замещенноеC1-4 алкилом или C1-4 галогеналкилом. Еще более предпочтительно R1 и R2 вместе с атомами углерода, к которым присоединены, представляют собой имидазольную группу, необязательно замещенную во 2 положении группой СF3. Предпочтительно Х представляет собой Сl. Предпочтительно n равно 0. Предпочтительно q равно 0. Предпочтительно R3 представляет собой Н, CN, C1-6 алкил, необязательно замещенный одним или несколькими галогеном, ОН, C1-6 алкоксигруппой, C1-6 алкоксикарбонилом, С 2-6 алканоилом, С 2-6 алканоилоксигруппой, С 2-6 алкилоксикарбонилоксигруппой,NR12R13,12 13 2 1CONR R и/или NY WY . Более предпочтительно R3 представляет собой Н, СН 3, C2H5, iС 3 Н 7, n-С 3 Н 7 или СН 2OCН 3. Наиболее предпочтительно R3 представляет собой СН 3. Предпочтительно R4 представляет собойC1-10 алкил, замещенный одним или несколькими заместителями, выбранными из следующих групп: С 2-6 алкоксигруппа [замещенная одной или несколькими группами, выбранными из ОН,NR25R26, CONR25R26, галогена, C1-6 алкоксигруппы, С 2-4 алкинила, С 2-4 алкенила, гетероарила 1, арила 1, COCH2CN, СO(гетероарила 1),СO(арила 1), СO2(гетероарила 1), СОСН 2(арила 1),СОСН 2(гетероарила 1), CO2CH2(арила 1), СO2 СН 2(гетероарила 1), S(O)n(C1-6 алкила), S(О)n(арила 1),S(О)n(гетероарила 1), SO2NR25R26 и циклоалкила 1],S(O)nC1-6 алкил [необязательно замещенный одной или несколькими группами, выбранными из ОН, NR25R26, CONR25R26, галогена, C1-6 алкоксигруппы, C2-4 алкинила, С 2-4 алкенила, гетероарила 1, арила 1, COCH2CN, СО(гетероарила 1), СO(арила 1), CO2(гетероарила 1), СОСН 2NR25R26,циклоалкил 1 оксигруппа,СОциклоалкил 1,гетероцикл, замещенный одним или несколькими заместителями, выбранными из C1-6 алкилаCH2CONR R , NR R , NHCONR R , CO(C1-6 алкила), SO2NR25R26, SO2(C1-6 алкила), CO2(C1-6 алкила), CH2CO2(C1-6 алкила), OCH2CO2(C1-6 алкила), арила, гетероциклила, арилоксигруппы,арил(СН 2)оксигруппы, арил(СН 2), CN и С 3-7 циклоалкила,гетероциклилоксигруппа, замещенная одним или несколькими заместителями, выбранными из C1-6 алкила (замещенного ОН),CONR25R26, CH2CONR25R26, NR25R26, NHCON(СН 2), CN и С 3-7 циклоалкила. Более предпочтительно R4 представляет собой C1-10 алкил, замещенный циклоалкилом 1. Еще более предпочтительно R4 представляет собой С 2-4 алкил, замещенный циклоалкилом 1. 14 Еще более предпочтительно R4 представляет собой пропил, замещенный циклоалкилом 1. Еще более предпочтительно R4 представляет собой пропил, замещенный С 3-10 карбоциклической системой с одним или двумя кольцами, и которая замещена ОН. Еще более предпочтительно R4 представляет собой пропил, замещенный циклогексилом,замещенным ОН. Наиболее предпочтительно R4 представляет собой (1-гидроксициклогексил)проп-3-ил. Другой группой предпочтительных соединений являются соединения, в которых R4 принимает значения, которые указаны в примерах 145-203 ниже. Предпочтительно R5, R6, R7, R8, R9 и R10 присутствуют отдельно и представляют собой Н. Группой предпочтительных соединений являются соединения, в которых кольцо Аr,R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, q и (Х)n принимают значения, описанные в примерах ниже. Изобретение также относится к получению соединений и солей по данному изобретению,которые описаны ниже и в примерах и способах получения. Квалифицированному специалисту будет понятно, что соединения по данному изобретению могут быть получены и другими способами с использованием методов, известных в данной области техники или описанных в учебниках, таких как Comprehensive Organic Transformations - A Guide to Functional Group Transformations, RC Larock, VCH (1989 или более поздние редакции), Advanced Organic Chemistry - Reactions, Mechanisms and Structure, J.March, Wiley-Interscience (3rd edition или более поздние редакции), Organic Synthesis - The Disconnection Approach, S. Warren (Wiley), (1982 или более поздние редакции), Designing Organic Syntheses, S. Warren (Wiley)(1983 или более поздние редакции), Guidebook to OrganicSynthesis, R.K. Mackie and D.M. Smith (Longman) (1982 или более поздние редакции) и т.д., и в приведенных в них ссылках. Следует представлять, что способы синтетических преобразований, приведенные в данном описании, являются лишь примерами и могут реализовываться в различных последовательностях для эффективного получения целевых соединений. Квалифицированный химик будет принимать решение и осуществлять наиболее эффективную последовательность реакций синтеза данного целевого соединения. Например, заместители могут вводиться в различные промежуточные соединения и/или с ними могут проводиться химические превращения до получения промежуточных продуктов, указанных ниже, в сочетании с конкретной реакцией. Это будет зависеть, помимо прочего, от таких факторов, как природа других функциональных групп, присутствующих в конкретном соединении, доступности ключевых промежуточных продуктов и стратегии использования защитных групп (если они применяются). Понятно, что тип используемых химических превращений будет влиять на выбор реагента, который используется в указанных стадиях синтеза, необходимость применения и тип применяемых защитных групп и последовательность осуществляемого синтеза. Методики могут адаптироваться с учетом реагентов и других параметров реакций способом, который будет очевидным для квалифицированного специалиста при обращении к стандартным учебным пособиям и примерам, приведенным далее. Для квалифицированного специалиста будет очевидно, что в процессе синтеза соединения по данному изобретению реакционноспособным функциональным группам может потребоваться защита и удаление защиты. Это может достигаться традиционными способами,например, описанными в монографии T.W.Organic Synthesis, John WileySons Inc. (1999) и в ссылках, приведенных в ней. Функциональные группы, которым может потребоваться защита, включают окогруппу, гидроксильную группу, аминогруппу и группу карбоновой кислоты. Подходящие защитные группы для оксогруппы включают ацетали, кетали (например,этиленкетали) и дитианы. Подходящие защитные группы для гидроксильной группы включают триалкилсилильную и диарилалкилсилильную группы (например, трет-бутилдиметилсилил, трет-бутилдифенилсилил или триметилсилил) и тетрагидропиранил. Подходящие защитные группы для аминогруппы включают трет-бутоксикарбонил, 9-флуоренилметоксикарбонил или бензилоксикарбонил. Подходящие защитные группы для групп карбоновой кислоты включают сложные C1-6 алкиловые или бензиловые эфиры. Если не указано другое значение, то в способах, представленных далее, заместители принимают значения, которые определены выше со ссылкой на соединения формулы (I). Изобретение предоставляет способ получения соединений формулы I, определенной выше, или их фармацевтически или ветеринарно приемлемых производных, который включает:(а) для соединений формулы I, в которых q равно 0 и R1 представляет собой NY2WY1, взаимодействие соединения формулы II 16 где Z1 представляет собой подходящую удаляемую группу, такую как галоген или Y1SO2O-;(b) для соединений формулы I, в которых q равно 0 и R6 и R7 представляют собой Н, восстановление соединения формулы IV(с) для соединений формулы I, в которых q равно 0 и R9 и R10 представляют собой Н, восстановление соединения формулы V(d) для соединений формулы I, в которых q равно 0 и R1 и R2 присоединены к соседним атомам углерода и вместе с атомами углерода, к который присоединены, образуют Het1a, гдеHet1a представляет собой имидазольный фрагмент, взаимодействие соответствующего соединения формулы VIVII,где RY представляет собой Н или любые необязательные заместители на Het1a (которые определены выше), предпочтительно Н, С 1-4 алкил или C1-4 галогеналкил;(е) когда q равно 0, взаимодействие соединения формулы VIIIIX где Lg представляет собой удаляемую группу;(f) для соединений формулы I, в которых q равно 0 и R6, R7, R9 и R10 представляют собой Н,восстановление соединения формулы X, подходящим восстановителем;(g) для соединений формулы I, в которых q равно 0 и R1 представляет собой ОН, взаимодействие соединения формулы II, где Y2 представляет собой H, как определено выше, с фторборной кислотой и изоамилнитритом;(h) для соединений формулы I, в которых q равно 0 и R1 представляет собой Сl, взаимодействие соединения формулы II, где Y2 представляет собой H, как определено выше, с нитритом натрия в присутствии разбавленной кислоты с последующим взаимодействием с хлоридом меди(I) в присутствии концентрированной кислоты;(i) для соединений формулы I, в которых q равно 1, взаимодействие соединения формулы I,где q равно 0, с подходящим окислителем, таким как водный пероксид водорода;(j) для соединений формулы I, где q равно 0, восстановление соответствующего соединения формулы XXXI где R4aCH2 принимает такие же значения, что и(k) для соединений формулы (I), где q равно 0, восстановительное аминирование амина формулы VIII, представленной выше, с альдегидом формулы R4a-CHO, где R4aCH2 принимает такие же значения, что и R4, определенный выше,и где желательно или необходимо превращение полученного соединения формулы I в фармацевтически или ветеринарно приемлемое производное или наоборот. В способе (а) взаимодействие может проводиться при температуре в интервале от 0 С до комнатной температуры в присутствии подходящего основания (например, пиридина) и подходящего органического растворителя (например, дихлорметана). Соединения формулы II могут быть получены восстановлением соответствующего соединения формулы XI или формулы XII, в присутствии подходящего восстановителя,такого как алюмогидрид лития. Реакция может проводиться при температуре в интервале от комнатной до температуры кипения в присутствии подходящего растворителя (например, тетрагидрофурана). Соединения формулы XI и XII могут быть получены восстановлением соответствующих-NO2-производных в условиях, хорошо известных квалифицированному специалисту (например, с использованием H2/Ni Ренея или в присутствии CaCl2 и порошкообразного железа в присутствии подходящей системы растворителей (например, EtOH, EtOAc и/или воды. Для квалифицированного специалиста понятно, что при получении соединения формулы II, в котором Y2 представляет собой Н, из соответствующего -NO2 соединения две описанные выше стадии восстановления могут осуществляться в одну стадию или последовательно в любом порядке. Указанные соответствующие-NO2 соединения могут быть получены взаимодействием соединения формулы XII или формулы где L1 представляет собой подходящую удаляемую группу [такую как галоген (например, хлор или бром)], L2 представляет собой подходящую удаляемую группу (такую как C1-3 алкоксигруппа) и R3 принимает значения, определенные выше, с соединением формулы XV,R4NH2XV. Реакция может проводиться при температуре в интервале от комнатной до температуры кипения в присутствии подходящего основания(например, NaHCO3) и соответствующего органического растворителя (например, диметилформамида) или при более высокой температуре(в интервале от 50 до 200 С, предпочтительно в интервале от 100 до 160 С) в присутствии чистого соединения формулы XV. Соединения формулы XIII и XIV могут быть получены в соответствии со стандартными методами. Например, соединения формулы XIII и XIV могут быть получены взаимодействием 19 соответствующего соединения формулы XVI или XVIIXVIII,XIX,N2CHR8COL2 где L2 принимает значения, определенные выше. Реакция может проводиться при комнатной температуре в присутствии подходящего катализатора [например, Rh2(ОАс)4] и подходящего апротонного органического растворителя (например, дихлорметана). Соединения формулы XVI и формулыXVII доступны или могут быть получены известными методами. Соединения формулы XVI и формулы XVII могут быть получены, например, из соответствующих соединений формулы например, реакцией Виттига с использованием подходящего поставщика нуклеофильной группы RO2C-CR5H- или RO2C-CR8H- (где R представляет собой подходящий низший алкил (например, C1-3 алкил, в условиях, хорошо известных квалифицированному специалисту. ГруппаCO2R полученного соединения может подвергаться превращению в соответствующую -CH2L1 группу стандартными методами (например, восстановлением сложного эфира в первичный спирт и превращением последнего в алкилгалогенид) в условиях, хорошо известных квалифицированному специалисту. В способах (b) и (с) подходящие восстановители включают алюмогидрид лития. Реакция может проводиться при температуре в интервале от комнатной до температуры кипения в присутствии подходящего растворителя (например,тетрагидрофурана). Соединения формулы II могут быть получены восстановлением соответствующего соединения формулы XXX 20 Соединения формулы IV и V могут быть получены соответственно из соединений формулы XXI и XII где L3 представляет собой группу, которая способна подвергаться превращениям функциональных групп (например, цианогруппа) с использованием стандартного замещения функциональной группы или стандартных способов превращения. Например.(1) Соединения формулы IV и V, в которых R1 представляет собой 1,2,4-триазол-3-ил,могут быть получены взаимодействием соответствующего соединения формулы XXI или XXII,в котором L3 представляет собой -CN, с НСl(газ.) в присутствии подходящего низшего алкилового спирта (например, этанола), например,при температуре в интервале от 0 С до комнатной температуры с последующим взаимодействием полученного промежуточного продукта с гидразином муравьиной кислоты (например,при температуре кипения в присутствии органического растворителя (например, метанола) или без него с последующим удалением растворителя (если это необходимо) и нагревом полученного остатка до высокой температуры (например, до примерно 150 С.(2) Соединения формулы IV и V, в которых R1 представляет собой имидазол-2-ил, могут быть получены взаимодействием соответствующего соединения формулы XXI или XXII, в котором L3 представляет собой -CN, с НСl (газ.) в присутствии подходящего низшего алкилового спирта (например, этанола), например, при температуре в интервале от 0 до комнатной температуры с последующим взаимодействием полученного промежуточного продукта с аминоацетальдегидом диалкилацеталем (например,диметилацеталем) (например, при температуре кипения или близкой к этой температуре в присутствии подходящего растворителя, такого как метанол),(3) Соединения формулы IV и V, в которых R1 представляет собой 1,2,3-триазол-5-ил,могут быть получены взаимодействием подходящего соединения формулы XXI или XXII, в котором L3 представляет собой -CN, с диазометаном или его защищенного производного (например, триалкилсилилпроизводного), например, при температуре в интервале от 0 С до комнатной температуры в присутствии подходящего основания (например, n-BuLi) и, необязательно, подходящего органического раствори 21 теля (например, ТГФ) с последующим удалением защитной группы, как это необходимо.(4) Соединения формулы IV и V, в которых R1 представляет собой бензимидазол-2-ил,могут быть получены взаимодействием соответствующего соединения формулы XXI или XXII,в котором L3 представляет собой C=NH(OEt), с 1,2-диаминобензолом. Реакция может проводиться в растворителе, таком как метанол, при повышенной температуре (например, при температуре кипения растворителя). Примеры получения 81 и т.д. предоставляют более подробные описания. Соединения формулы IV и V, в которых R1 представляет собой Het1, могут быть получены из соединений формулы XI и XII, соответственно, в соответствии со следующей схемой синтеза: где Het1 принимает значения, определенные выше. Более подробное описание можно найти в Примерах получения 67, 68 и т.д. в публикацииWO00/39089, которая полностью введена в данное описание в виде ссылки. Соединения формулы XXI и XXII могут быть получены способами, аналогичными описанным в данной заявке, например, способами,представленными выше для получения соединений формулы II. Другие соединения формулы (IV) и (V) могут быть получены по аналогии со способами, описанными в данной заявке (например по аналогии со способами, описанными выше для получения соединений формулы XI и XII (в частности, соответствующего -NO2 соединения. В способе (d) реакция может проводиться при кипячении с обратным холодильником в присутствии подходящего органического растворителя или без него. Соединения формулы VI могут быть получены известными способами. Например, соединения формулы VI могут быть получены нитрованием (в 4-положение) соответствующего 3 аминобензольного соединения (соединение формулы II), последнее соединение может быть активировано превращением 3-аминогруппы в 3-амидогруппу с последующим гидролизом амида и восстановлением 4-нитробензольного 22 производного. Все эти реакции могут проводиться с использованием методов, которые известны квалифицированному специалисту и описаны в Примерах получения 45-48 и т.д.,приведенных ниже. В способе (е) подходящие удаляемые группы, которые может представлять Lg, включают галоген, такой как бром, или сульфонатную группу, такую как тозилат, мезилат или трифлат. Реакция может проводиться в полярном растворителе, который не оказывает неблагоприятного влияния на реакцию, при подходящей температуре, например 0-150 С, в присутствии основания. Необязательно может добавляться катализатор, такой как йодид натрия. Предпочтительными условиями являются легкий избыток R4-Lg, где Lg = Сl или Вr, избыток основания (2,0-4,0 экв.), такого как К 2 СО 3,NаНСО 3 или третичный амин, такой как триэтиламин или основания Ханигса (Hunigs base), в полярном растворителе, таком как ТГФ, ДМФА или MeCN, при температуре в интервале от 40 до 120 С, необязательно в присутствии катализатора, такого как NaI или KI, в течение 2-24 ч(см. R.C. Larrock, Comprehensive Organic Transformations - A Guide to Functional Group Preparations, VCH, (1989), p. 397 и ссылки, приведенные в этой монографии). Соединения формулы VIII могут быть получены из соединений формулы XXV где Рg представляет собой подходящую защитную группу. Подходящие защитные группы включают аллил, который может удаляться с использованием палладиевого (0) катализатора и N,N-диметилбарбитуровой кислоты (см. пример получения 53 и т.д. ниже). Соединения формулы XXV могут быть получены способами, аналогичными описанным для получения соединений формулы I. В способе (f) подходящие восстановители включают алюмогидрид лития. Реакция может проводиться в растворителе, который не оказывает вредного воздействия на реакцию (например, тетрагидрофуране), при повышенной температуре (например, при температуре кипения растворителя). Соединения формулы Х могут быть получены взаимодействием соединения формулыXXVI с соединением формулы XXVII в присутствии окислителя. Подходящие окислители включают диоксид магния. Реакция может проводиться в растворителе, который не оказывает вредного воздействия на реакцию (например, в 23 диоксане), при повышенной температуре, такой как температура кипения растворителя (см. пример получения 77, WO 00/39089). Промежуточные соединения XXIXa выделяются при использовании подходящих условий (см. пример получения 58, WO 00/39089). Соединения формулы XXVI могут быть получены из соединений формулы XXVIII взаимодействием соответствующего кетона с гидразином моногидратом известными методами (и как описано в примере получения 76 и т.д. в WO00/39089). Способ (f) особенно полезен, когда Аr представляет собой 5-или 6-членное гетероарильное кольцо, необязательно конденсированное с бензольным кольцом. Аналогичная методика может использоваться для получения соединений формулы II: исходное нитросоединение может быть получено из соединения формулы XX, как описано выше, с использованием стадий, описанных выше (см. примеры получения 57-61WO00/39089). В способе (g) реакция может проводиться в растворителе, который не оказывает вредного воздействия на реакцию (например, в этаноле),сначала при температуре ниже комнатной температуры, затем при повышенной температуре(в примере 79 и т.д. WO00/39089 приводится более подробное описание). В способе (h) подходящие кислоты включают водную соляную кислоту и концентрированную соляную кислоту, соответственно. Реакция может проводиться при комнатной температуре или температуре, близкой к комнатной, с завершением при повышенной температуре (например, при 90 С). В примере 51, приведенном в публикации WO00/39089, данный способ описывается более подробно. В способе (j) соединение формулы XXXI может быть получено ацилированием соединения формулы VIII, которое описано выше, ацилирующим агентом формулы R4aCOLg, где Lg 24 представляет собой подходящую удаляемую группу, описанную в способе (е), и включает галоген, (алкил, галогеналкил- или арил) сульфонат, OCOR4a (т.е. ангидрид кислоты) и т.д.,что хорошо известно специалисту-практику в данной области техники. См., например, условия, используемые в способе получения 47. Связывание может, необязательно, проводиться в присутствии катализатора, например, ДМАП, в подходящем растворителе (см. R.C. Larrock,Comprehensive Organic Transformations - Aedition, (1999), p. 1941-1949 и ссылки, приведенные в этой публикации). Предпочтительно карбоновую кислоту (0,9-1,1 экв.), 1-(3 диметиламинопропил)-3-этилкарбодиимид, НСl(1-1,5 экв.) и 1-гидроксибензотриазол (1,0 экв.) перемешивают в ДМФА или ДХМ при комнатной температуре в течение 5-15 мин, затем добавляют аминную соль (1 экв.) и основание(NаНСО 3, органическое основание, Еt3N или основания Ханигса (2-4 экв., реакция протекает в течение 2-24 ч при комнатной температуре. Амидная связь может восстанавливаться подходящим восстановителем, например, алюмогидридом лития или бораном, в эфирном растворителе, таком как ТГФ, при 0-100 С с получением желаемого третичного амина (см. R.C.(1,0-3 экв.) при температуре в интервале от 0 С до комнатной температуры в ТГФ в течение 124 ч. В способе (k) подходящий альдегид подвергается взаимодействию с амином, необязательно в присутствии кислотно-аддитивной соли в присутствии подходящего восстановителя(такого как цианоборгидрид натрия, триацетоксиборгидрид натрия, или каталитическое гидрирование с Pd, Pt или Ni катализаторами). Реакция приемлемо проводится в присутствии уксусной кислоты при 0-100 С в ТГФ, метаноле,ДХМ(1,2 дихлорэтане) в течение подходящего интервала времени, такого как 1-24 ч. Предпочтительно, аминную соль, такую как аминную соль трифторуксусной кислоты(ТФУК), обрабатывают органическим основание (1-3 моль-эквивалентами), таким как триэтиламин или основания Ханигса, затем альдегидом (1-1,5 моль-эквивалента) и далее триацетоксиборгидридом натрия (1-2,0 моль-экв.) в ДХМ или ДХЭ при комнатной температуре в течение 2-24 ч (см. R.C. Larrock, Comprehensive 25 Альдегиды, используемые в данном способе, могут быть получены из соответствующих спиртов с использованием подходящих окислителей (см. R.C. Larrock, Comprehensive OrganicPreparations, second edition, (1999), pp. 12341236 и 1238-1247 и ссылки, приведенные в этой публикации). Предпочтительными окислителями являются тетрапропиламмоний перрутенат(Ley et al., Synthesis, 1994, 639-666), окисление Сверна (Swern oxidation) и аналогичные способы (Tidwell, Organic Reactions, 1990, 39, 297572) и перйодированный реагент ДессаМартина (Dess-Martin Periodinane reagent) (Desset al., J. Org. Chem., 1983, 48, 4155-4156). Для получения различных соединений формулы (I) или их промежуточных продуктов могут осуществляться взаимопревращения различных функциональных групп соединений формулы (I) или их промежуточных продуктов. Некоторые из них описаны ниже. Анилины могут превращаться в мочевину с использованием цианата калия (избыток) в водном кислотном растворе (см. Cross et al., J.Med. Chem., 1985, 28, 1427-1432). Сложные эфиры могут превращаться в соответствующие спирты с использованием подходящего восстановителя (см. R.C. Larrock,Comprehensive Organic Transformations - Aedition, (1999), pp. 1117-1120 и ссылки, приведенные в этой публикации). Подходящие восстановители включают гидрид диизобутилалюминия (diisobutylaluminium hydride - DIBAL) Спирты могут быть получены из соответствующей кислоты с использованием подходящего восстановителя (см. R.C. Larrock, Comprehensive Organic Transformations - A Guide toFunctional Croup Preparations, second edition,(1999), pp. 1114-1116). Предпочтительно, восстановитель представляет собой либо боран(BН 3 (1-2 экв.), J. Org. Chem., 1973, 38, 2786),либо LiAlH4 (1-4 экв.) в эфирном растворителе,таком как ТГФ, при 0-80 С в течение 1-24 ч. Реакция имеет вид Способы прямого получения алкилгалогенидов и алкилсульфонатов из их спиртов описаны в публикации R.C. Larrock, ComprehensiveGroup Preparations, second edition, (1999), pp. 689-700 и ссылках, приведенных в ней. Бензилацетали могут подвергаться обработке подходящим восстановителем в присутствии кислоты Льюиса или органической кислоты 26 с получением бензилоксиспиртов. Типичные примеры приведены в публикациях Organic Для квалифицированного специалиста будет ясно, что соединения формулы I могут превращаться в другие соединения формулы I с использованием известных методов. Например,соединения формулы I, в которых Y1 представляет собой алкоксикарбонил, могут превращаться в соединения, в которых Y1 представляет собой алкил, замещенный ОН, восстановлением с помощью LiAlH4 (более подробное описание приводится в примере 57). Аналогично, промежуточные соединения могут подвергаться взаимопревращениям с использованием известных методов (см. пример получения 85). Промежуточные соединение, такие как соединения формул III, XV, XVIII, XIX, XX, VII,IX, XXVI, XXVII и XXVIII и их производные,когда не являются коммерчески доступными или не последовательно описаны, могут быть получены по аналогии со способами, описанными в данной заявке, или посредством общеизвестных методик синтеза в соответствии со стандартными способами из доступных исходных веществ при использовании подходящих реагентов и условий реакций. Изобретение, кроме того, относится к промежуточным соединениям формул II, IV, V, VI,X, Xa, XI, XII, XXI, XXII, XXIII, XXIV, XXIX,XXIXa, XXX и XXXI, которые определены выше. Когда желательно или необходимо, соединение формулы (I) может быть преобразовано в его фармацевтически приемлемую соль, обычно, смешением растворов соединения формулы(I) и нужной кислоты или нужного основания,как это подходит. Соль может быть высажена из раствора и собрана фильтрованием или может быть собрана другими способами, например испарением растворителя. Соли обоих типов также могут быть получены или подвергаться взаимному превращению с помощью способов,в которых применяются ионно-обменные смолы. Соединения по данному изобретению могут быть очищены обычными методами, например, разделение диастереомеров может достигаться такими традиционными способами, как фракционная кристаллизация, хроматография или ВЭЖХ стереоизомерной смеси соединения формулы (I) или его соли. Отдельный энантиомер соединения формулы (I) также может быть получен из соответствующего чистого проме 27 жуточного соединения или разделением, например ВЭЖХ соответствующего рацемата с использованием подходящей хиральной основы или фракционной кристаллизацией диастереомерных солей, полученных взаимодействием соответствующего рацемата с подходящим оптически активным основанием или кислотой. Соединения по данному изобретению являются полезными, поскольку обладают фармакологической активностью по отношению к животным, в частности млекопитающим, включая человека. Следовательно, они рекомендуются для применения в качестве фармацевтических средств и, в частности, для применения в качестве лекарственных средств для животных. В соответствии с дополнительным аспектом по данному изобретению, предложены соединения по данному изобретению для применения в качестве лекарственных средств, таких как фармацевтические средства и лекарственные средства для лечения животных, например,для лечения опиат-проводимых заболеваний и состояний. Термин лечение в данном описании включает как терапевтическое (лечебное), так и профилактическое применение. В частности, было установлено, что вещества по данному изобретению могут использоваться при лечении заболеваний и состояний,модулируемых посредством опиатных рецепторов, таких как синдром воспаленной толстой кишки, запор, тошнота, рвота, зуд, расстройство аппетита, опиатные передозировки, депрессия,зависимость от табака и хронический алкоголизм, половая дисфункция, удар, приступ, повреждение спинного мозга и/или травма головы; и состояний, характеризующихся наличием зуда как симптома. Следовательно, в соответствии с еще одним аспектом по данному изобретению, предложено применение соединений по данному изобретению при получении лекарственного средства для лечения заболеваний, модулируемых посредством опиатного рецептора. Кроме того, предложено применение соединений по данному изобретению при получении лекарственного средства для лечения синдрома воспаленной толстой кишки, запора, тошноты, рвоты,зуда, расстройств аппетита, опиатных передозировок, депрессии, зависимости от табака, хронического алкоголизма, половой дисфункции,удара, приступа, повреждения спинного мозга и/или травмы головы; и состояний, характеризующихся наличием зуда как симптома. Следовательно ожидается, что соединения по данному изобретению могут использоваться для лечения или профилактики зудящих дерматозов, включая аллергический дерматит и атопию, у животных и людей. Другие заболевания и состояния, которые могут упоминаться в этой связи, включают контактный дерматит, псориаз,экзему и укусы насекомых. 28 Таким образом, изобретение относится к способу лечения или профилактики заболевания, модулируемого посредством опиатного рецептора. Предложен также способ лечения синдрома воспаленной толстой кишки, запора,тошноты, рвоты, зуда, расстройств аппетита,опиатных передозировок, депрессии, зависимости от табака, хронического алкоголизма, половой дисфункции, удара, приступа, повреждения спинного мозга и/или травмы головы; и болезненного состояния у животного (например, млекопитающего), характеризующегося наличием зуда как симптома, который включает введение терапевтически эффективного количества соединения по данному изобретению животному,которое нуждается в таком лечении. Соединения по данному изобретению обычно могут вводиться перорально или любым парентеральным способом в форме фармацевтических препаратов, включающих активный ингредиент, необязательно в виде нетоксичной органической или неорганической кислотноили основно-аддитивной соли в фармацевтически приемлемой дозированной лекарственной форме. В зависимости от заболевания и пациента, которые подлежат лечению, а также от способа введения, композиции могут вводиться в различных дозах (см. ниже).Хотя можно вводить соединение по данному изобретению непосредственно без любой рецептуры, соединения предпочтительно применяются в виде фармацевтического или ветеринарного препарата, включающего фармацевтически или ветеринарно приемлемый носитель,разбавитель или наполнитель и соединение по данному изобретению. Носитель, разбавитель или наполнитель может выбираться с учетом предполагаемого способа введения и стандартной фармацевтической и/или ветеринарной практики. Фармацевтические композиции,включающие соединения по данному изобретению, могут содержать от 0,1 до 90,0 процентов активного ингредиента из расчета на массу. Способы, с помощью которых соединения могут вводиться для ветеринарного применения,включают пероральное введение в виде капсулы, болюса, таблетки или вливанием животному, местное применение в виде мази, препарата для смачивания, наложения на больное место,погружения, опрыскивания, в виде пенки, шампуня или в виде ошейника или порошка или,альтернативно, они могут вводиться инъекцией(например, подкожно, внутримышечно или внутривенно) или в виде имплантата. Такие препараты могут быть получены стандартным способом в соответствии со стандартной ветеринарной практикой. Препараты будут изменяться с учетом массы активного соединения, содержащегося в нем,в зависимости от вида животного, подлежащего лечению, тяжести и типа инфекции и массы тела животного. Для парентерального, местного и 29 перорального введения обычные интервалы доз активного ингредиента составляют от 0,01 до 100 мг на кг массы тела животного. Предпочтительно интервал доз составляет от 0,1 до 10 мг на кг. В любом случае, практикующий ветеринар или квалифицированный специалист будет способен определить действующую дозу, которая будет наиболее приемлемой для индивидуального пациента и которая может изменяться в зависимости от вида, возраста, массы и чувствительности конкретного пациента. Указанные выше дозировки являются общими примерами; конечно, могут иметь место отдельные случаи, в которых применимы более высокие или более низкие интервалы доз, и такие случаи охватываются областью по данному изобретению. При ветеринарном применении соединения по данному изобретению особенно важны для лечения зуда у домашних животных, таких как кошки и собаки, а также у лошадей. В качестве альтернативы для лечения животных соединения могут вводиться вместе с кормом для животных и для этой цели могут приготавливаться концентрированная пищевая добавка или заранее приготовленная смесь для смешения с обычным кормом для животных. При применении для людей соединения вводятся в виде фармацевтического препарата,содержащего активный ингредиент в сочетании с фармацевтически приемлемым разбавителем или носителем. Такие композиции включают стандартную таблетку, капсулу или препараты в виде мази, которые приготавливаются в соответствии со стандартной фармацевтической практикой. Соединения по данному изобретению могут вводиться сами по себе или в сочетании с одним или несколькими лекарственными средствами, используемыми для лечения или профилактики заболевания или для снижения или подавления симптомов. Примеры таких лекарственных средств (которые приводятся для иллюстрации и не должны рассматриваться как ограничение) включают противопаразитные средства, например, фипронил (fipronil), луфенурон (lufenuron), имидаклоприд (imidacloprid),авермектины (avermectins) (например, абамектин (abamectin), ивермектин (ivermectin), дорамектин (doramectin, милбемицины (milbemycins), фосфорорганические вещества, пиретроиды, антигистаминные вещества, например,хлорфенирамин (chlorpheniramine), тримепразинcillin); противовоспалительные средства, например, преднизолон (prednisolone), бетаметазон (betamethasone), дексаметазон (dexamethasone), капрофен (caprofen), кетопрофен (ketoprofen); пищевые добавки, например, гаммалинолевая кислота; и смягчающие средства. Следовательно, данное изобретение дополнительно предоставляет продукт, содержащий соединение по данному изобретению и одно или несколько соединений, выбранных из представленного выше перечня, в виде комбинированного препарата для одновременного, раздельного или последовательного применения при лечении заболеваний, модулируемых посредством опиатных рецепторов. Квалифицированному специалисту также понятно, что соединения по данному изобретению могут приниматься в виде единичной дозы или по требованию (например, как необходимо или желательно). Таким образом, в соответствии с еще одним аспектом, данное изобретение относится к фармацевтическому или ветеринарному препарату, включающему соединение по данному изобретению в смеси с фармацевтически или ветеринарно приемлемым адъювантом, разбавителем или носителем. Соединения по данному изобретению могут также обладать тем преимуществом при лечении человека и/или животных пациентов, что они могут быть более эффективными, менее токсичными, иметь более широкий спектр активности, оказывать более сильное действие и легче абсорбироваться, а также они могут обладать другими полезными фармакологическими свойствами по сравнению с соединениями, известными в данной области техники. Биологические активности соединений по данному изобретению определялись с помощью следующего метода. Биологическое испытание Соединения по данному изобретению, как установлено, проявляют активность в трех опытах связывания рецепторов, выбранных для мю-, каппа- и дельта-опиоидных рецепторов, в мозге собаки. Опыты проводились следующим образом. В качестве источника ткани мозга собаки используют лабораторных племенных гончих. Животных безболезненно умерщвляют, их мозг удаляют и отделяют мозжечок. Оставшуюся ткань мозга делят на небольшие кусочки массой примерно 3 г и гомогенизируют в 50 мМ Trisбуфера (рН 7,4) при 40 С, используя гомогенизатор ткани марки Kinematica Polytron. Полученный гомогенат центрифугируют при 48,400 хg в течение 10 мин и супернатант выгружают. Пеллет снова суспендируют в Trisбуфере и выдерживают при 37 С в течение 10 мин. Центрифугирование, повторное суспендирование и инкубирование повторяют еще дважды, конечный пеллет снова суспендируют вTris-буфере и хранят при -80C. Мембранный материал, приготовленный таким образом, может храниться до четырех недель до применения. Для проведения оценки на мю-, каппа- и дельта-опиоидных рецепторах экспериментальное вещество с возрастающими концентрациями[D-Ala2,N-Me-Phe4,Cly-ol5]-Enkephalin,DAMGO; каппа=U-69, 593; дельта= Enkephalin,[D-pen2,5]DPDPE), объединяют в полистирольных пробирках. Реакцию инициируют добавлением ткани, и смесь выдерживать при комнатной температуре в течение 90 мин. Реакцию заканчивают быстрым фильтрованием с использованием клеточного харвестера Brandel CellHarvester через фильтры стекловолокна BetaplateGF/A, предварительно смоченные в 50 мМ Tris-0,l% полиэтилениминном буфере (рН 7,4). Фильтры после этого промывают три раза 0,5 мл ледяного Tris-буфера (рН 7,4). Для мю- и дельта-опытов промытые фильтры помещают в мешки и добавляют Starscint сцинтиллянт, для каппа-опытов используют твердый сцинтиллянтMeltilex B/HS. Мешки, содержащие фильтры и сцинтиллянт, запаивают и обсчитывают с помощью бэта-счетчика Betaplate 1204. Для каждого экспериментального соединения изготавливают дублирующие образцы, и полученные данные анализируют с использованием программного обеспечения IС 50 анализаGraphpad Prism. Значение Ki вычисляют с использованием Graphpad Prism в соответствии со следующей формулой:Ki=IC50/1+[3Hлиганд]/KD,где IC50 - концентрация, при которой 50% 3H лиганда замещается испытываемым соединением, и КD - константа диссоциации для 3 Н лиганда на рецепторном сайте. Биологическая активность Значения Ki некоторых соединений по данному изобретению определяют в опытах связывания опиоидных рецепторов, и устанавливают, что соединения обладают значениямиKi 4000 нМ или менее для мю-рецептора. Полагают, что способы, используемые в приведенных далее примерах, приводят к получению соединений, обладающих стереохимической структурой, представленной ниже, и такие соединения являются предпочтительными где R1-4 и (Х)n принимают значения, определенные выше. Изобретение иллюстрируется представленными далее примерами и способами получе 005117 32 ния, в которых могут использоваться следующие аббревиатуры:APCI (atmospheric pressure chemical ionizaton) = химическая ионизация при атмосферном давлении; ДМФА - диметилформамид; ДМСО = диметилсульфоксид; д (применительно ко времени) = день; д (применительно к ЯМР) = дуплет;TSP = термораспыление. Температуры плавления определены с использованием аппарата определения температуры плавления Gallenkamp и не корректировались. Данные ядерного магнитного резонанса(ЯМР) относятся к 1H и получены с использованием спектрометра Varian Unity 300 или 400,причем наблюдаемые химические сдвигисовместимы с предполагаемыми структурами. Данные масс-спектроскопии (МС) получены наFisons Instruments Trio 1000, или на Fisons Instruments Trio 1000 APCI или на Finnigan Navigator MS или на Micromass Platform LC спектрометре. Вычисленные и наблюдаемые ионы,заключенные в кавычки, относятся к изотопной композиции самой низкой массы. Комнатной температурой называется температура 20 - 25 С. Масс-спектрометр, который используется в качестве детектора на аналитической ВЭЖХ-МСсистеме, представляет собой аппарат марки Micromass VG Platform II, работающий на программном обеспечении Masslynx/Openlynx. Система может определять положительный и отрицательный ион с электрораспылительными или с APCI-зондами и калибруется до 1972 Дальтон, она собирает полные данные диодной антенной решетки от 190 до 600 нм. ВЭЖХ означает высокоэффективную жидкостную хроматографию. Условия выполнения ВЭЖХ. Условие 1: колонка Rainin Dynamax, 8 мкм ODS, 24 х 300 мм, температура колонки 40 С, объемная скорость потока 45 мл/мин,элюирование: метанол:вода (70:30), УФ обнаружение продукта при 246 нм. Условие 2: колонка Rainin Dynamax, 5 мкм ODS, 21,6 х 250 мм, температура колонки 40 С, объемная скорость потока 5 мл/мин,элюирование: ацетонитрил:вода (50:50), УФ обнаружение продукта при 246 нм. Условие 3: колонка Rainin Dynamax, 8 мкм ODS, 41 х 250 мм, температура колонки 33 40 С, объемная скорость потока 45 мл/мин.,элюирование: ацетонитрил:0,1 М водный ацетатаммониевый буфер (50:50), УФ обнаружение продукта при 235 нм. Условие 4: колонка Phenomenex Magellan, 5 мкм C18 диоксид кремния, 21,2 х 150 мм,температура колонки 40 С, объемная скорость потока 20 мл/мин, элюирование с градиентом: ацетонитрил:0,1 М водный ацетатаммониевый буфер (от 30:70 до 95:5 в течение 10 мин), УФ обнаружение продукта при 220 нм. Условие 5: колонка Phenomenex Magellan, 5 мкм ODS, 21,2 х 150 мм, температура колонки 40 С, объемная скорость потока 20 мл/мин, элюирование с градиентом: ацетонитрил:0,1 М водный ацетатаммониевый буфер (от 5:95 до 95:5 в течение 20 мин), УФ обнаружение продукта при 215 нм. Условие 6: колонка Phenomenex Magellan, 5 мкм C18 диоксида кремния, 4,6 х 150 мм,температура колонки 40 С, объемная скорость потока 1 мл/мин, элюирование с градиентом: ацетонитрил:0,1 М водная гептансульфоновая кислота (от 10:90 до 90:10 в течение 10 мин),УФ обнаружение продукта при 220 нм. Условие 7: колонка Phenomenex Magellan, 5 мкм C18 диоксид кремния, 21,2 х 150 мм,температура колонки 40 С, объемная скорость потока 20 мл/мин, элюирование с градиентом: ацетонитрил:0,05 М водный ацетатаммониевый буфер (50:50 в течение 15 мин, затем от 50:50 до 90:10 в течение 5 мин), УФ обнаружение продукта при 220 нм. Условие 8: колонка Phenomenex Magellan, 5 мкм C18 диоксид кремния, 21,2 х 150 мм,температура колонки 40 С, объемная скорость потока 20 мл/мин, элюирование с градиентом: ацетонитрил:0,1 М водный ацетатаммониевый буфер (от 15:85 до 85:15), УФ обнаружение продукта при 220 нм. Условие 9: колонка Phenomenex Magellan, 5 мкм ODS, 10 х 150 мм, температура колонки 40 С, объемная скорость потока 5 мл/мин, элюирование с градиентом: ацетонитрил:0,1 М водный ацетатаммониевый буфер (от 5:95 до 30:70 в течение 5 мин, затем 30:70 в течение дополнительных 20 мин), УФ обнаружение продукта при 225 нм. Условие 10: колонка Phenomenex Magellan, 5 мкм C18 диоксид кремния, 21,2 х 150 мм,температура колонки 40 С, объемная скорость потока 20 мл/мин, элюирование с градиентом: ацетонитрил:0,1 М водный ацетат аммония (от 5:95 до 40:60 в течение 5 мин, затем 40:60 в течение дополнительных 25 мин), УФ обнаружение продукта при 210 нм. Условие 11: колонка Phenomenex Magellan, 5 мкм ODS, 10 х 150 мм, температура колонки 40 С, объемная скорость потока 5 мл/мин., элюирование с градиентом: ацетонитрил:вода (от 5:95 до 55:45 в течение 5 мин), УФ обнаружение продукта при 210 нм. 34 Форма свободного основания азабициклов может быть получена из гидрохлоридной или ацетатной солей, например, следующим способом. Соль (0,3 ммоль) растворяют в дихлорметане (20 мл) и промывают насыщенным водным раствором гидрокарбоната натрия (20 мл). Основную смесь отделяют и водный слой экстрагируют дихлорметаном (2 х 20 мл). Объединенные органические экстракты сушат (Na2SO4) и концентрируют в вакууме с получением свободного основания.SPE картридж относится к картриджу твердофазной экстракции (solid-phase extraction). Они могут быть коммерчески доступны отVarian (Mega Bond Elut) или Isolute. Обращаем внимание на то, что в примерах 1-144 приведены соединения, относящиеся к данному изобретению, но с другими R4 группами, и они заявлены в Международной заявке на патентWO 00/39089, которая введена в описание в виде ссылки. Ряд дополнительных примеров, например,примеры в таблице ниже, могут выполняться с использованием способов А-К, описанных ниже, и в условиях, описанных в приведенной далее таблице. Способ А. Алкилирование. Алкилирование амина формулы VIII или его соли с помощью R4Lg, где Lg представляет собой подходящую удаляемую группу, такую как галоген, трифлат, мезилат и т.д., в присутствии основания, необязательно в присутствии катализатора, в полярном растворителе при температуре в интервале от 0 до 150 С. Предпочтительно, алкилирование проводят с помощью R4Lg (небольшой избыток), гдеLg=Cl или Вr, с избытком основания (2,0 - 4,0 экв.), такого как К 2 СО 3, NaHCO3 или третичный амин, например триэтиламин или основания Ханигса, в полярном растворителе, таком как ТГФ, ДМФА или MeCN, при температуре в интервале от 40 до 120 С, необязательно в присутствии катализатора, такого как NaI или KI, в течение 2-24 ч. См. R.C. Larrock, Comprehensive OrganicR4aCHO амином формулы VIII в присутствии подходящего восстановителя (такого как цианоборгидрид натрия, триацетоксиборгидрид натрия или каталитическое гидрирование с применением Pd, Pt или Ni катализаторов). Реакцию часто проводят в присутствии уксусной кислоты при 0-100 С в ТГФ, МеОН, ДХМ или ДХЭ (1,2 дихлорэтане) в течение 1-24 ч. Предпочтительно аминную соль обрабатывают органическим основанием (1-3 экв.), таким как триэтиламин или основание Ханигса, и затем последовательно альдегидом (1-1,5 экв.),триацетоксиборгидридом натрия (1-2,0 экв.) в дихлорметане или ДХЭ при комнатной температуре в течение 2-24 ч (см. R.C. Larrock, Comprehensive Organic Transformations - A Guide toXXXI. Карбониламид может подвергаться восстановлению подходящим восстановителем,например, алюмогидридом лития или бораном,в эфирном растворителе, таком как ТГФ, при 0100 С с получением желаемого третичного амина (см. R.C. Larrock, Comprehensive OrganicPreparations, VCH, (1989), pp. 432-434 и ссылки, приведенные в этой публикации). Предпочтительно амид (1,0 экв.) обрабатывают алюмогидридом лития (1,0-3 экв.) при температуре в интервале от 0 С до комнатной температуры в ТГФ в течение 1-24 ч, например, Способ D. Окисление. Альдегиды, используемые в способе В, могут быть получены с помощью подходящих окислителей (см. R.C. Larrock, ComprehensiveGroup Preparations, second edition, (1999), pp. 1234-1236, 1238-1247, и ссылки, приведенные в данной публикации). Предпочтительными окислителями являются перрутенат тетрапропиламмония (Ley et Способ Е. Связывание соли кислота/амин приводит к получению амидов формулы XXXI либо при использовании смеси хлорангидрид кислоты + амин в подходящем растворителе или кислоты,активированной подходящим реагентом, необязательно в присутствии катализатора, например,ДМАП в подходящем растворителе (см. R.C.(1-1,5 экв.) и 1-гидроксибензотриазол (1,0 экв.) перемешивают в ДМФА или ДХМ при комнатной температуре в течение 5-15 мин. и затем добавляют аминную соль (1 экв.) и основание(NaHCO3 или органическое основание, Et3N или основание Ханигса (2-4 экв., реакцию проводят в течение 2-24 ч при комнатной температуре. Например, Способ F. Получение мочевины. Анилины могут превращаться в мочевину при использовании цианата калия (избыток) в водном растворе кислоты (см. Cross et al., J.Med. Chem., 1985, 28, 1427-1432), то есть в соответствии со следующей реакцией: Способ G. Превращение сложного эфира в спирт. Сложные эфиры могут превращаться в соответствующий спирт при использовании подходящего восстановителя (см. R.C. Larrock,Comprehensive Organic Transformations - Aedition, (1999), pp. 1117-1120 и ссылки, приведенные в этой публикации). Подходящие восстановители включают гидрид диизобутилалюминия (diisobutylaluminium hydride - DIBAL, см.Brown, Org. Reactions, 1951, 6, 469). Реакция имеет следующий вид: Способ Н. Получение спирта из кислоты. Следует представлять, что спирты, используемые в способе D, могут быть получены из соответствующей кислоты с использованием подходящего восстановителя (см. R.C. Larrock,Comprehensive Organic Transformations - Aedition, (1999), pp. 1114-1116). Предпочтительно, восстановитель представляет собой боран Способ I. Получение галогенида из спирта. Следует представлять, что R4Lg, используемый в способе А, может быть получен из соответствующего спирта R4aOH. Прямые способы получения алкилгалогенидов и алкилсульфонатов из их спиртов описаны в публикации R.C. Larrock, ComprehensiveGroup Preparations, second edition, (1999), pp. 689-700 и ссылках, приведенных в ней. Способ J. Получение бензилоксиспиртов из бензилгалогенидов. Бензилоксиспирты могут быть получены кипячением с обратным холодильником соответствующего бензилгалогенида с натрием или гидридом натрия и полиметиленгликолем в ксилоле (см. J. Am. Chem. Soc., 1951, 3159-3162). Реакция имеет следующий вид: Способ K. Получение бензилоксиспиртов из ацеталей. Ацетали могут обрабатываться подходящим восстановителем в присутствии кислоты Льюиса или органической кислоты с получением бензилоксиспиртов. Типичные примеры см. в публикациях: Organic Preparations and Procedures, Int., 1991, 23, 4, 427-431, ZrCl4/LiAlH4; 38 17(1), 11-16, NaBH4/TFA. Реакция имеет следующий вид:H ЯМР (300 МГц, СDСl3, данные для соли муравьиной кислоты) : 0,85 (т, 3H), 1,70 (кв.,2 Н), 2,05 (квинтет, 2 Н), 2,15 (с, 2 Н), 2,55 (с, 3H),2,70 (т, 2 Н), 2,80-2,85 (м, 4 Н), 2,95 (с,3H), 3,703,80 (м, 2 Н), 7,00 (д, 1 Н), 7,05-7,10 (м, 2 Н), 7,207,28 (м, 3H), 7,90 (д, 2 Н), 8,40 (с, 1 Н). МС (электрораспыление): M/Z (М-Н) 439; вычислено для С 25 Н 32N2O3S - Н 439,2. Пример 200. N-(3-3-[2-(бензилокси)бензил]-6-этил-3-азабицикло[3.1.0]гекс-6-илфенил)метансульфонамид. К раствору соли трифторуксусной кислотыN,N-диметилформамиде (4 мл) добавляют гидрокарбонат натрия (90 мг, 1,1 ммоль), 1-[4-(3 хлорпропил)фенил]этанон (58 мг, 0,29 ммоль) и йодид натрия (каталитическое количество), реакционную смесь нагревают до 70 С и выдерживают при этой температуре в течение 20 ч. После охлаждения растворитель удаляют в вакууме с получением неочищенного остатка. Остаток очищают на хроматографической колонке с силикагелем (14 г) (элюент: смесь этилацетат:гексан (75:25), затем чистый этилацетат). Объединение и выпаривание соответствующих фракций приводит к получению частично очищенного продукта. Полученный продукт дополнительно очищают препаративной ВЭЖХ (условие 1) с получением соли муравьиной кислоты указанного в заглавии соединения (16 мг,12%) в виде желтого масла. К раствору 2-бензилоксибензальдегида (27 мг, 0,13 ммоль) в дихлорметане (5 мл) при комнатной температуре добавляют соль трифторуксусной кислоты[3.1.0]гекс-6-ил)фенил]метансульфонамида (50 мг, 0,13 ммоль) и триэтиламин (0,05 мл, 0,38 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 2 ч. В это время добавляют триацетоксиборгидрид натрия(40,8 мг, 0,19 ммоль) и реакционную смесь перемешивают при комнатной температуре в течение 16 ч. После этого к реакционной смеси добавляют воду (5 мл) и два слоя разделяют,используя трубку Ватмана (Whatman) для фильтровального тигля (гидрофобная политетрафторэтиленовая мембрана). Затем органический слой раздувают досуха потоком азота. Остаток очищают колоночной хроматографией,используя Sep-Pak картридж с силикагелем(10 г) (элюирование: гексан:этилацетат 100:0,1:1, 1:3, 1:6, 1:9 и 0:100), в результате получают указанное в заголовке соединение (28 мг, 46%) в виде масла. 1 47 цианобензальдегид (33 мг, 0,25 ммоль) в качестве исходных веществ. Продукт очищают препаративной ВЭЖХ (условия 3) с получением указанного в заголовке соединения (28 мг, 28%) в виде твердого не совсем белого вещества. 1 К раствору соли трифторуксусной кислотыN,N-диметилформамиде (3 мл) добавляют гидрокарбонат натрия (64 мг, 0,8 ммоль), 1-(2 хлорэтокси)-4-циклопропилбензол (41 мг, 0,21 ммоль) и йодид натрия (3 мг, катализатор), реакционную смесь нагревают до 60 С и выдерживают при этой температуре в течение 20 ч. После охлаждения растворитель удаляют в вакууме с получением неочищенного остатка. Остаток очищают препаративной ВЭЖХ (условие 2), в результате получают соль муравьиной кислоты указанного в заголовке соединения (4 мг,5%) в виде коричневой смолы. 1 Н ЯМР (300 МГц, СDСl3, данные для соли муравьиной кислоты): 0,55-0,60 (м, 2 Н), 0,800,95 (м, 5 Н), 1,80-1,90 (м, 3H), 2,25 (ушир.с, 2 Н),2,95 (с, 3H), 3,15 (д, 2 Н), 3,45 (т, 2 Н), 3,80-3,90(30 мг, 0,2 ммоль) и соли трифторуксусной кислоты N-[3-(6-этил-3-азабицикло[3.1.0]гекс-6 ил)фенил]-метансульфонамида (50 мг, 0,13 ммоль) в сухом 1,2-дихлорэтане добавляют основание Ханигса (0,02 мл, 0,12 ммоль). Смесь 48 обрабатывают ультразвуком в течение 3 мин и затем перемешивают в течение дополнительных 30 мин с последующим добавлением триацетоксиборгидрида натрия (50 мг, 0,25 ммоль). После перемешивания в течение 72 ч реакционную смесь разбавляют этилацетатом (50 мл) и делят на части с помощью насыщенного раствора гидрокарбоната натрия (2 х 25 мл). Органический слой промывают насыщенным раствором соли(2 х 20 мл), сушат над безводным сульфатом натрия, фильтруют и растворитель удаляют под пониженным давлением с получением желтовато-коричневого масла. Это масло растворяют в минимальном количестве дихлорметана и очищают, используя Biotage картридж (6 г)(элюирование с градиентом: этилацетат:гексан от 30:70 до 100:0), в результате получают указанное в заголовке соединение (32 мг, 62%) в виде масла. 1NB Способы получения с 1 по 148 из международной заявки на патентWO 00/39089 введены в описание в виде ссылки, и эта же нумерация используется в настоящей заявке. Способ получения 149. 1-[4-(3-хлорпропил)фенил]этанон. Хлорид алюминия (15,0 г, 0,11 моль) и ацетилхлорид (16,0 г, 0,20 моль) растворяют в дихлорметане (50 мл) при комнатной температуре. Затем эту смесь по каплям в течение 15 мин при комнатной температуре добавляют к раствору 1-хлор-3-фенилпропана (15,5 г, 0,10 моль) в дихлорметане (25 мл). Смесь перемешивают в течение 1 ч и затем осторожно выливают в лед. Водный слой экстрагируют дихлорметаном (450 мл). Органическую часть промывают водой и насыщенным раствором соли, затем сушат (MgSO4) и концентрируют в вакууме,получая указанное в заголовке соединение (19,2 г, 98%) в виде масла. 1 49 4-Хлорпропилфенол (6,75 г, 50,3 ммоль,Horrom et al., Org. Prep. Proceed. Int., 1992, 24(6),696-698), 2-хлорэтил-п-толуолсульфонат (17,71 г, 75,5 ммоль) и карбонат калия (10,4 г, 75,4 ммоль) в безводном ацетонитриле (500 мл) кипятят с обратным холодильником при перемешивании под атмосферой азота в течение 30 ч. Реакционной смеси дают охладиться до комнатной температуры и разбавляют этилацетатом(1000 мл). Органическую часть промывают водой (3 х 250 мл), сушат (MgSO4), фильтруют и концентрируют в вакууме. Неочищенный продукт очищают колоночной хроматографией на силикагеле (элюирование: гексан:дихлорметан 4:1, затем гексан:дихлорметан 3:1), в результате получают указанное в заголовке соединение (8,7 г, 88%) в виде твердого вещества. Т. пл. 4748 С. 1 К раствору ангидрида малеиновой кислоты(98 г, 1,00 моль) в сухом толуоле (3000 мл) при комнатной температуре под атмосферой азота по каплям в течение 1 ч добавляют раствор аллиламина (57,1 г, 1,00 моль) в толуоле (1000 мл). Смесь перемешивают при комнатной температуре в течение 20 ч, затем добавляют хлорид цинка (136,3 г, 1,00 моль) и реакционную смесь нагревают до 80 С. К полученной смеси по каплям в течение часа добавляют 1,1,1,3,3,3 гексаметилдисилазан (242 г, 1,5 моль) в толуоле(1000 мл) и смесь перемешивают при 80 С в течение дополнительных 4 ч. Смесь охлаждают до комнатной температуры и затем выливают в 1N HCl (4000 мл). Два слоя разделяют и органический слой промывают водой (2000 мл), насыщенным раствором бикарбоната натрия (2000 мл) и насыщенным раствором соли (2000 мл). Органическую часть концентрируют в вакууме с получением указанного в заголовке соединения 50 К раствору 3-нитрофенона (168 г, 0,93 моль) в этаноле (830 мл) при комнатной температуре медленно с помощью капельной воронки добавляют гидразин моногидрат (96,8 г, 1,93 моль). Реакционную смесь кипятят с обратным холодильником в течение 4 ч, затем охлаждают до комнатной температуры. Растворитель удаляют в вакууме и остаток распределяют между дихлорметаном (750 мл) и водой (750 мл). Два слоя разделяют, органический слой промывают насыщенным раствором соли (250 мл), сушат(N2SO4), фильтруют и концентрируют в вакууме с получением оранжевого масла. Полученный остаток кристаллизуют из простого диизопропилового эфира при -20 С, получая указанное в заголовке соединение (110 г, 61%) в виде твердого кристаллического вещества желтого цвета. Т. пл. 32 С. 1(1000 мл) при комнатной температуре с перемешиванием быстро добавляют диоксид магния(сорт CMD-1 от Sumitromo, 175 г, 2,01 моль),затем насыщенный этанольный раствор гидроксида калия (40 мл). Смесь перемешивают при комнатной температуре в течение 18 мин, и в течение этого времени температура реакционной смеси возрастает от 19 до 25 С. Перемешивание прекращают и смеси дают отстояться. Смесь фильтруют через рыхлый слой целита(Celite) по каплям непосредственно в раствор 1-аллил-1 Н-пиррол-2,5-диона (57,3 г, 418 ммоль) в 1,4 диоксане (200 мл). Целит (Celite) промывают 1,4 диоксаном (100 мл) для обеспечения полного добавления реагентов. После перемешивания при комнатной температуре в течение одного часа смесь кипятят с обратным холодильником в течение 20 ч. Смесь охлаждают до комнатной температуры и растворитель удаляют в вакууме. Остаток кристаллизуют из простого диизопропилового эфира (100 мл) при 0 С с получением указанного в заголовке соединения (83 г, 66%) в виде твердого кристаллического вещества не совсем белого цвета. Т.пл. 128-129 С. 1 К суспензии 3-алил-6-этил-6-(3 нитрофенил)-3-азабицикло[3.1.0]гексан-2,4 диона (93 г, 310 ммоль) и порошкообразного железа (151 г, 2,70 моль) в этаноле (6,75 л) при перемешивании добавляют хлорид кальция(16,7 г, 0,15 моль) в воде (1,2 л). Смесь кипятят с обратным холодильником в течение трех часов, затем охлаждают до комнатной температуры и фильтруют через целит (Celite). Фильтрат концентрируют в вакууме с получением влажного твердого вещества. Этот продукт растворяют в дихлорметане (500 мл) и полученные два слоя разделяют. Органический слой сушат(МgSO4), фильтруют и концентрируют в вакууме с получением бледно-желтого твердого вещества (81 г). Полученное вещество кристаллизуют из этилацетата и гексана (1:1; 6 мл на грамм) при комнатной температуре с получением указанного в заголовке соединения (54 г,65%) в виде твердого кристаллического вещества бледно-желтого цвета. 1 К раствору алюмогидрида лития (1 М раствор в ТГФ; 400 мл, 400 ммоль) в тетрагидрофуране (400 мл) в атмосфере азота при -15 С по каплям с помощью капельной воронки в течение 0,5 ч добавляют 3-аллил-6-(3-аминофенил)6-этил-3-азабицикло[3.1.0]гексан-2,4-дион (44 г,163 ммоль) в тетрагидрофуране (250 мл). Смеси дают медленно нагреться до комнатной температуры в течение часа. Смесь нагревают до 50 С и выдерживают при этой температуре в течение 3 ч, затем охлаждают до 5 С. К охлажденной 52 реакционной смеси (5 С) осторожно добавляют воду (400 мл). Твердый осадок удаляют фильтрованием через слой целита (Celite), промывают этилацетатом (400 мл). Фильтрат сушат К раствору 3-(3-аллил-6-этил-3-азабицикло[3.1.0]гекс-6-ил)анилина (41 г, 169 ммоль) и триэтиламина (34 г, 337 ммоль) в дихлорметане (750 мл) при -40 С по каплям с помощью капельной воронки добавляют метансульфонидхлорид (23,7 г, 206 ммоль). Реакционной смеси дают медленно в течение 2 ч нагреться до комнатной температуры и перемешивают ее при комнатной температуре в течение 20 ч. Затем органическую часть промывают водой (4 х 500 мл), сушат (MgSO4), фильтруют и концентрируют в вакууме с получением указанного в заголовке соединения (59,0 г) в виде неочищенной смолы. 1 К дегазированному раствору N-[3-(3 аллил-6-этил-3-азабицикло[3.1.0]гекс-6-ил)фенил]метансульфонамида (54,0 г, 169 ммоль) и 1,3-диметилбарбитуровой кислоты (80,0 г, 512 ммоль) в дихлорметане (500 мл) в атмосфере азота добавляют тетракис(трифенилфосфин) 53 палладий (0) (2,0 г, 1,73 ммоль). Смесь кипятят с обратным холодильником в течение 8 ч, затем перемешивают при комнатной температуре в течение 20 ч. Органическую часть экстрагируют 2 М НСl (2 х 100 мл) и водой (100 мл). Объединенные водные слои промывают дихлорметаном(4 х 100 мл) и сушат вымораживанием с получением неочищенного твердого вещества. Этот продукт очищают препаративной ВЭЖХ (условие 4) с получением соли трифторуксусной кислоты указанного в заголовке соединения (25,2 г, 53%) в виде твердого серого вещества. 1C14H20N2O2S+H 281,1. Пример получения 158. 3-Бензил-6-метил 6-(3-нитрофенил)-3-азабицикло[3.1.0]гексан-2,4 дион. К раствору 1-(3-нитрофенил)-1-этанон гидразона (100 г, 0,56 моль) в диоксане (1 л) добавляют МnO2 (350 г, 2,3 моль) и реакционную смесь перемешивают при комнатной температуре в течение 30 мин. Суспензию фильтруют через целит и слой целита промывают диоксаном (200 мл). Фильтрат возвращают в реактор и в течение 20 мин небольшими порциями добавляют N-бензилмалеимид (110 г). Реакционную смесь перемешивают при комнатной температуре в течение 4 ч, затем кипятят с обратным холодильником в течение 16 ч. Реакционную смесь охлаждают до комнатной температуры и растворитель удаляют в вакууме. Остаток растирают в метаноле (500 мл) и фильтрованием выделяют продукт в виде твердого кристаллического вещества белого цвета (56%). ЯМР (СDСl3) d: 1,31 (с, 3H), 1,55 (с, 3H),2,80 (с, 2 Н), 4,63 (с, 2 Н), 7,28-7,34 (м, 3H), 7,437,45 (д, 2 Н), 7,52-7,56 (т, 1 Н), 7,63-7,65 (д, 1 Н),8,13-8,16 (д, 1 Н), 8,17 (с, 1 Н). МС (APCI): m/z [МН+] 337,5 +Н; вычислено для +Н 337,3. Пример получения 159. 6-(3-Аминофенил)3-бензил-6-метил-3-азабицикло[3.1.0]гексан-2,4 дион. К суспензии 3-бензил-6-метил-6-(3 нитрофенил)-3-азабицикло[3.1.0]гексан-2,4 диона (30 г, 89 ммоль) в этилацетате (600 мл) добавляют 5 % Pt/C (1,5 г, 5 маc.%). Смесь гидрируют при 4 атм. (=60 фунтов на кв.дюйм) и комнатной температуре в течение 18 ч. Суспензию фильтруют через arbacel и полученный раствор выпаривают в вакууме с получением продукта в виде твердого кристаллического вещества белого цвета (24 г, 88%). ЯМР (СDСl3) d: 1,26 (с, 3H), 2,74 (с, 2 Н),3,7 (2 Н, ушир.с), 4,60 (с, 2 Н), 6,56-6,58 (д, 1 Н),6,60 (с, 1 Н), 6,65-6,67 (д, 1 Н), 7,07-7,11 (т, 1 Н),7,26-7,33 (м, 3H), 7,42-7,44 (м, 2 Н). 54 МС (APCI): m/z [MH+] 307,5; вычислено для +Н 307,4. Пример получения 160. N-3-[3-Бензил-6 метил-2,4-диоксо-3-азабицикло[3.1.0]гекс-6-ил] фенилметансульфонамид. К раствору 6-(3-аминофенил)-3-бензил-6 метил-3-азабицикло[3.1.0]гексан-2,4-диона (24 г, 78 ммоль) в этилацетате (480 мл) добавляют пиридин (9,5 мл, 118 ммоль) и затем медленно добавляют метансульфонилхлорид (9,1 мл, 118 ммоль). Реакционную смесь перемешивают в течение 2,5 ч. Реакционную смесь промывают последовательно 1 М раствором НСl (120 мл) и водой (120 мл). Этилацетатную часть сушат над МgSO4 и выпаривают в вакууме с получением продукта в виде твердого вещества оранжевого цвета (30 г, 99%). ЯМР (СDСl3) d: 1,27 (с, 3H), 2,77 (с, 2 Н),3,02 (с, 3H), 4,61 (с, 2 Н), 7,08-7,14 (м, 3H), 7,267,32 (м, 4 Н), 7,41-7,42 (д, 2 Н). МС (APCI): m/z [MH+] 385,7; вычислено для +Н 385,5. Пример получения 161. N-3-Бензил-6 метил-3-азабицикло[3.1.0]гекс-6-ил]фенилметансульфонамид. К раствору N-3-[3-бензил-6-метил-2,4 диоксо-3-азабицикло[3.1.0]гекс-6-ил]фенилметансульфонамида (150 г, 391 ммоль) в атмосфере азота добавляют боргидрид натрия (31 г, 820 ммоль). Реакционную смесь охлаждают до 10 С и, поддерживая температуру 10 С, по каплям добавляют ВF3OEt2 (138 мл, 1094 ммоль). Реакционной смеси дают нагреться до комнатной температуры в течение 2 ч, затем кипятят с обратным холодильником в течение дополнительных 8,5 ч. Реакционную смесь охлаждают до температуры 0-5 С и добавляют водный раствор пиперазина (198,5 г, 2304 ммоль в 1,26 л воды) . После этого реакционную смесь кипятят с обратным холодильником в течение 18 ч. ТГФ удаляют в вакууме, добавляют этилацетат (900 мл) и фазы делят. Водную фазу экстрагируют второй порцией этилацетата (450 мл). Органические фазы объединяют и промывают водой (750 мл). Органическую часть сушатMgSO4 и выпаривают в вакууме с получение продукта в виде твердого кристаллического вещества белого цвета (129 г, 93%). ЯМР (CDCl3) d: 2,62 (с, 3H), 2,80-2,83 (д,2 Н), 2,99 (с, 3H), 3,03-3,07 (д, 2 Н), 3,68 (с, 2 Н),7,01-7,02 (с, 1 Н), 7,06-7,08 (м, 2 Н), 7,22-7,26 (м,3H), 7,30-7,32 (м, 3H). МС (APCI): m/z [MH+] 357,5, вычислено для +Н 357,5. Способ получения 162. N-3-[6-Метил-3 азабицикло[3.1.0]-гекс-6-ил]фенилметансульфонамид. К растворуN-3-бензил-6-метил-3 азабицикло[3.1.0]гекс-6-ил]фенилметансульфонамида (20 г, 56 ммоль) в метаноле добавляют формиат аммония (10,6 г, 168 ммоль) и реакционную смесь перемешивают в течение 5 мин. 55 Добавляют 10% Pd/C (8 г) и полученную смесь кипятят с обратным холодильником в течение 16 ч. Смеси дают охладиться и катализатор удаляют фильтрованием через целит. Растворитель удаляют в вакууме с получением продукта в виде бледно-желтого масла, которое затвердевает (15,2 г, 85%). ЯМР (СDСl3) d: 1,27 (с, 3H), 1,85-1,88 (д,2 Н), 2,93 (с, 3H), 3,07-3,10 (д, 2 Н), 3,39-3,44 (д,2 Н), 6,92-6,97 (м, 2 Н), 7,06 (с, 1 Н), 7,20-7,23 (м,1 Н). МС (APCI): m/z [MH+] 267,4; вычислено для +Н 267,3. Способ получения 163. 3-Бензил-6-этил-6(3-нитрофенил)-3-азабицикло[3.1.0]гексан-2,4 дион. К раствору 1-(3-нитрофенил)-1-пропанон гидразона (42,1 г, 217 ммоль) в диоксане (630 мл) добавляют МnO2 (126 г, 1440 ммоль) и реакционнную смесь перемешивают при комнатной температуре в течение 20 мин. Суспензию фильтруют через целит и целит промывают диоксаном (200 мл). Фильтрат возвращают в реакционную емкость и порциями в течение 20 мин добавляют N-бензилмалеимид (44,9 г, 239 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 60 ч, затем кипятят с обратным холодильником в течение 16 ч. Реакционную смесь охлаждают до комнатной температуры и растворитель удаляют в вакууме. Остаток кипятят с обратным холодильником в метаноле (1200 мл) в течение 3 ч и затем охлаждают до комнатной температуры. Продукт выделяют фильтрованием в виде твердого кристаллического вещества белого цвета(д, 2 Н), 8,17-8,18 (м, 3H). МС (APCI): m/z [MH+] 351,5; вычислено для +Н 351,3. Способ получения 164. 6-(3-Аминофенил)3-бензил-6-этил-3-азабицикло[3.1.0]гексан-2,4 дион. К суспензии 3-бензил-6-этил-6-(3 нитрофенил)-3-азабицикло[3.1.0]гексан-2,4 диона (42,1 г, 120 ммоль) в этилацетате (850 мл) добавляют 5% Pt/C (2,1 г, 5 маc.%). Смесь гидрируют при давлении 60 фунтов на кв.дюйм и комнатной температуре в течение 18 ч. Суспензию фильтруют через arbacel, полученный раствор выпаривают в вакууме с получением продукта в виде твердого кристаллического вещества белого цвета (34,1 г, 89%). ЯМР (СDСl3) d: 0,70-0,74 (т, 3H), 1,41-1,47 56 Способ получения 165. N-3-[3-Бензил-6 этил-2,4-диоксо-3-азабицикло[3.1.0]гекс-6-ил] фенилметансульфонамид. К раствору 6-(3-аминофенил)-3-бензил-6 этил-3-азабицикло[3.1.0]гексан-2,4-диона (31,5 г, 98 ммоль) в дихлорметане (250 мл) добавляют пиридин (9,5 мл, 118 ммоль) и затем медленно добавляют метансульфонилхлорид (9,1 мл, 118 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 16 ч. Реакционную смесь промывают последовательно 1 М раствором НСl (250 мл) и водой (120 мл). Дихлорметановый слой сушат над MgSO4 и выпаривают в вакууме с получением продукта в виде воскообразного твердого вещества розового цвета (38,2 г, 98%). ЯМР (СDСl3) d: 0,68-0,72 (т, 3H), 1,42-1,47(кв., 2 Н), 2,75 (с, 2 Н), 3,02 (с, 3H), 4,62 (с, 2 Н),7,13-7,18 (м, 3H), 7,29-7,42 (м, 4 Н), 7,41-7,43 (д,2 Н). МС (APCI): m/z [MH+] 399,6; вычислено для +Н 399,5. Способ получения 166. N-3-Бензил-6 этил-3-азабицикло-[3.1.0]гекс-6-ил]фенилметансульфонамид. К раствору N-3-[3-бензил-6-этил-2,4 диоксо-3-азабицикло[3.1.0]гекс-6-ил]фенилметансульфонамида (38,2 г, 95 ммоль) в ТГФ (200 мл) под атмосферой азота добавляют боргидрид натрия (7,46 г, 201 ммоль). Реакционную смесь охлаждают до 10 С и, поддерживая температуру 10 С, по каплям добавляют BF3OEt2 (38,1 мл, 268 ммоль). Реакционной смеси дают нагреться до комнатной температуры в течение 2 ч, после чего ее кипятят с обратным холодильником в течение 12 ч. Реакционную смесь охлаждают до температуры в интервале от 0 до 5 С и добавляют водный раствор пиперазина (48,7 г,565 ммоль в 320 мл воды). После этого реакционную смесь кипятят с обратным холодильником в течение 18 ч. ТГФ удаляют в вакууме,добавляют этилацетат (200 мл) и фазы разделяют. Водную фазу экстрагируют второй порцией этилацетата (200 мл). Органические фазы объединяют и промывают 3 отдельными порциями воды (3 х 400 мл). Органическую часть сушат надMgSO4 и упаривают в вакууме с получением продукта в виде твердого кристаллического вещества белого цвета (33,5 г, 94%). ЯМР (СDСl3) d: 0,84-0,88 (т, 3H), 1,76-1,77 57 добавляют формиат аммония (255 мг, 4,05 ммоль) и реакционную смесь перемешивают в течение 5 мин. К смеси добавляют 10% Pd/C(200 мг) и полученную смесь кипятят с обратным холодильником в течение 2 ч. Смеси дают охладиться и катализатор удаляют фильтрованием через целит. Растворитель удаляют в вакууме с получением продукта в виде бледножелтого масла, которое затвердевает (15,2 г,85%). 1H ЯМР (СDСl3) d: 0,80-0,84 (т, 3H), 1,641,69 (кв., 3H), 1,82-1,86 (д, 2 Н), 2,98 (с, 3H),3,12-3,18 (д, 2 Н), 3,21-3,26 (д, 2 Н), 7,01-7,06 (д,1 Н), 7,10-7,14 (м, 2 Н), 7,25-7,28 (м, 1 Н). МС (APCI): m/z [MH+] 281,7; вычислено для +Н 281,4. Другие вещества, полезные для синтеза соединений формулы (I) с различными R4 группами, доступны из источников, которые представлены в таблице ниже со способом их синтеза или синтеза аналогов. где кольцо Аr представляет собой фенильное кольцо;R3 представляет собой C1-6 алкил (где алкильная группа необязательно замещена фенилом);R4 представляет собой C1-10 алкил, где группа присоединена к атому N через sp3 углерод и где группа замещена одним или несколькими заместителями, выбранными из следующих: арил 2,циклоалкил 1,арил 2 окси,
МПК / Метки
МПК: A61K 31/403, C07D 209/52, A61P 1/00
Метки: опиодному, обладающие, сродством, производные, рецептору, 3-азабицикло[3.1.0]гексана
Код ссылки
<a href="https://eas.patents.su/30-5117-proizvodnye-3-azabiciklo310geksana-obladayushhie-srodstvom-k-opiodnomu-receptoru.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 3-азабицикло(3.1.0)гексана, обладающие сродством к опиодному рецептору</a>
Предыдущий патент: Новая кристаллическая форма гидрохлорида 6-гидрокси-3-(4-[2-(пиперидин-1-ил)этокси]фенокси)-2-(4-метоксифенил)бензо[b]тиофена
Следующий патент: Замещенный аналог тетрациклина (варианты) и способ его получения (варианты).
Случайный патент: Система для избирательной загрузки информации из сети интернет в пользовательские терминалы с использованием спутниковой системы радиовещания












