Производные пиперазина
Номер патента: 669
Опубликовано: 28.02.2000
Авторы: Мацуда Масааки, Мацуда Хироси, Кониси Нобукийо, Манабе Такаси, Мияке Хироси, Хагивара Дайдзиро, Мурано Кендзи, Сигенага Синдзи
Формула / Реферат
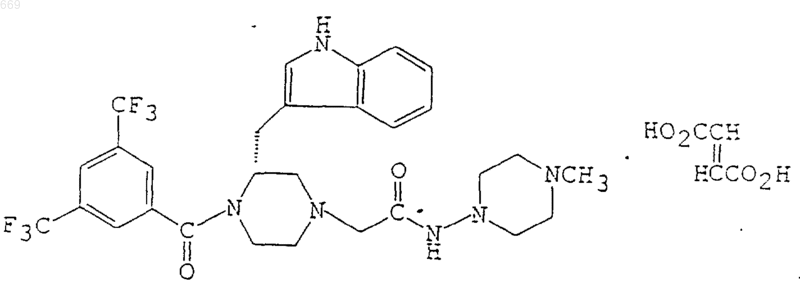
1. Соединение формулы
2. Способ получения соединения по п.1, включающий реакцию соединения формулы

или его соли, отличной от соли фумаровой кислоты, с фумаровой кислотой с получением соединения формулы

3. Фармацевтическая композиция, включающая в качестве активного ингредиента соединение по п.1 в сочетании с фармацевтически приемлемым нетоксичным носителем или разбавителем.
4. Способ лечения или профилактики заболеваний, опосредованных тахикинином, который включает введение человеку или животным эффективного количества соединения по п.1.
5. Применение соединения по п.1 для производства лекарственного препарата для лечения или профилактики заболеваний, опосредованных наличием тахикинина.
6. Соединение общей формулы

где R1 представляет тригалоген (C1-C6)алкил,
R2 представляет тригалоген (C1-C6)алкил,
R3 представляет индолил (C1-С6)алкил,
-А- является -СН2- или 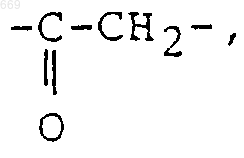 и
и
R4 представляет
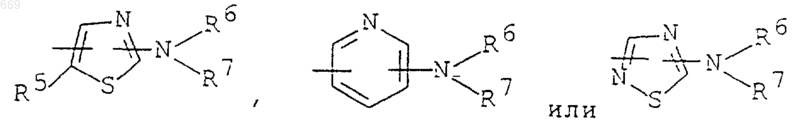
в которых R5 является водородом или C1-С6 алкоксикарбонилом,
R6 является водородом или С2-С6 алканоилом,
R7 является водородом, C1-С6 алкилом, С2-С6 алканоилом, С1-С6 алкоксикарбонилом, С1-C6 алкокси (С2-С6) алканоилом, цикло (С3-С6) алкилкарбонилом, С6-С10 ароил или С1-С6 алкилсульфонилом,
или его фармацевтически пригодная соль.
Текст
1 Область изобретения Данное изобретение касается новых производных пиперазина и их фармацевтически пригодных солей. Более подробно, оно касается новых производных пиперазина и их фармацевтически пригодных солей, обладающих такой фармацевтической активностью как антагонизм тахикинину, в особенности антагонизм Веществу Р,антагонизм нейрокинину А, антагонизм нейрокинину В и подобные, способа их получения,содержащих их фармацевтических композиций и их применения в качестве лекарственных препаратов. В соответствии с этим одним предметом настоящего изобретения является обеспечение новых и полезных производных пиперазина и их фармацевтически пригодных солей, обладающих такой фармацевтической активностью как антагонизм тахикинину, в особенности, антагонизм Веществу Р, антагонизм нейрокинину А, антагонизм нейрокинину В и подобные. Другим предметом данного изобретения является обеспечение способа получения указанных производных пиперазина и их солей. Еще одним предметом настоящего изобретения является обеспечение фармацевтической композиции, отличающейся тем, что включает в качестве активного ингредиента указанные производные пиперазина и их фармацевтически пригодные соли. Еще одним предметом настоящего изобретения является обеспечение применения указанных производных пиперазина или их фармацевтически пригодных солей в качестве антагонистов тахикинина, в особенности антагонистов Вещества Р, антагонистов нейрокинина А или антагонистов нейрокинина В, полезных для лечения или профилактики заболеваний человека или животных, опосредованных тахикинином,например респираторных заболеваний, таких как астма, бронхит, ринит, кашель, выделение мокроты и подобные, глазных заболеваний, таких как конъюктивит, весенний конъюктивит и подобные, кожных заболеваний, таких как контактный дерматит, атонический дерматит, крапивница и другие экземовидные дерматиты и подобное, воспалительных заболеваний, таких как ревматоидный артрит, остеоартрит и подобные, болей и страданий (например, мигрень,головная боль, зубная боль, страдания при раковых заболеваниях, боли в спине и др.) и подобных. Описание изобретения Соединение, рассматриваемое в настоящем изобретении, имеет следующую формулу (If): 2 и называется (2R)-1-[3,5-бис(трифторметил) бензоил]-2-(1 Н-индол-3-илметил)-4-[N-(4 метил-1-пиперазинил)карбамоилметил] пиперазинфумарат [здесь далее кратко обозначают как соединение (If)]. Другим рассматриваемым в настоящем изобретении соединением является соединение,которое можно представить следующей общей формулой (Ig): где R1 представляет собой тригалоген (низший)алкил, R2 представляет собой тригалоген в которых R5 является водородом или низшим алкоксикарбонилом,R6 является водородом или низшим алканоилом,R7 является водородом, низшим алкилом,низшим алканоилом, низшим алкоксикарбонилом, низшим алкокси(низшим) алканоилом,цикло(низший)алкилкарбонилом, ароилом или низшим алкилсульфонилом,или его фармацевтически пригодная соль. В соответствии с настоящим изобретением рассматриваемые соединения можно получить способом, который проиллюстрирован приведенной далее схемой. Способ 1 где R1, R2, R3 и R4 каждый является таким, как определено выше, -А- является -СН 2, и W является удаляемой группой. Подходящие соли и фармацевтически пригодные соли исходных соединений и соединений, рассматриваемых в данном изобретении,являются общепринятыми нетоксическими солями и включают такие соли присоединения кислот как соли органических кислот (например, ацетат, трифторацетат, фумарат, малеат,тартрат, метансульфонат, бензолсульфонат,формиат, толуолсульфонат и др.), соли неорганических кислот (например, гидрохлорид, гидробромид, гидроиодид, сульфат, нитрат, фосфат и др.), или соли с аминокислотами (например аргинином, аспарагиновой кислотой, глутаминовой кислотой и др.), или соли металлов, такие как соли щелочных металлов (например соль натрия, соль калия и др.) и соли щелочноземельных металлов (например соль кальция,соль магния и др.), соли аммония, соли органи 000669 4 ческих оснований (например соль триметиламина, соль триэтиламина, соль пиридина, соль пиколина, соль дициклогексиламина, соль N,N'дибензилэтилендиамина и др.) или подобные. Далее подробно объясняются различные определения, приведенные в предыдущем и последующем описаниях данного изобретения,подходящих примерах и иллюстрациях, которые включены в область данного изобретения. Термин "низший" подразумевает от 1 до 6 атомов углерода, предпочтительно от 1 до 4,если не указано по-другому. Подходящий "низший алкил" или "низшая алкильная часть" в определениях "индолил(низший)алкил" и "низший алкилсульфонил" является линейным или разветвленным алкилом с количеством атомов углерода от 1 до 6 и может включать метил, этил, пропил, изопропил,бутил, изобутил, пентил, гексил и подобное. Подходящий "тригалоген(низший)алкил" может включать трихлорметил, трибромметил,трифторметил и подобное. Подходящая "низшая алкоксигруппа" или"цикло(низшая)алкильная часть" в определении "цикло(низший)алкилкарбонил" может включать циклопропил, циклобутил, циклопентил, циклогексил и подобные. Подходящий "ароил" может включать бензоил, толуоил, нафтоил и подобные. Подходящая "удаляемая группа" может включать гидроксил, производную от гидроксила реакционноспособную группу и подобные. Подходящая "производная от гидроксила реакционноспособная группа" может включать кислотный остаток и подобное. Подходящий "кислотный остаток" может включать галоген (например, фтор, хлор, бром,иод), ацилоксигруппу (например, ацетокси-,тозилокси-, мезилоксигруппы и др.) и подобные. Далее подробно описаны способы 1-4 получения рассматриваемых соединений настоящего изобретения. Способ 1. Рассматриваемое соединение (1) или его соль можно получить по реакции соединения(11), или его реакционноспособного производного по карбоксильной группе, или его соли с соединением (111), или его реакционноспособным производным по аминогруппе, или его солью. 5 Подходящее реакционноспособное производное соединение (11) по карбоксильной группе может включать галогенангидрид кислоты,ангидрид кислоты, активированный амид, активированный сложный эфир и подобное. Подходящими примерами реакционноспособных производных могут быть хлорангидрид кислоты, азид кислоты, смесь ангидрида кислоты с кислотой, такой как замещенная фосфорная кислота (например диалкилфосфорная кислота,фенилфосфорная кислота, дифенилфосфорная кислота, дибензилфосфорная кислота, галогенированная фосфорная кислота и др.), диалкилфосфористая кислота, сернистая кислота, тиосерная кислота, серная кислота, сульфоновая кислота (например метансульфоновая кислота и др.), алифатическая карбоновая кислота (например уксусная кислота, пропионовая кислота,масляная кислота, изомасляная кислота, пивалиновая кислота, валериановая кислота, изовалериановая кислота, 2-этилмасляная кислота,трихлоруксусная кислота и др.) или ароматическая карбоновая кислота (например, бензойная кислота и др.), симметричный ангидрид кислоты, активированный амид с имидазолом, 4 замещенным имидазолом, диметилпиразолом,триазолом или тетразолом, или активированный сложный эфир (например цианометиловый эфир, метоксиметиловый эфир, диметилиминометиловый [(СН 3)2N+ =CH-] эфир, виниловый эфир,пропаргиловый эфир,паранитрофениловый эфир, 2,4-динитрофениловый эфир, трихлорфениловый эфир, пентахлорфениловый эфир, мезилфениловый эфир, фенилазофениловый эфир, фенилтиоэфир, паранитрофениловый тиоэфир, паракрезиловый тиоэфир,карбоксиметиловый тиоэфир, пираниловый эфир, пиридиловый эфир, пиперидиловый эфир,8-хинолиловый тиоэфир и др., или сложный эфир с N-гидроксисоединением (например, N,Nдиметилгидроксиламином, 1-гидрокси-2-(1 Н)пиридоном, N-гидроксисукцинимидом, N-гидроксифталимидом, 1-гидрокси-1H-бензотриазолом и др.) и подобные. Эти реакционноспособные соединения можно произвольно выбрать из указанных выше в соответствии с типом используемого соединения (11). Подходящие реакционноспособные производные соединения (111) по аминогруппе могут включать основания Шиффа иминотипа или их таутомеры енаминного типа, полученные по реакции соединения (111) с таким карбонильным соединением как альдегид, кетон или подобные, кремнийсодержащие производные, полученные по реакции соединения (111) с таким кремнийсодержащим соединением как бис(триметилсилил)ацетамид, моно (триметилсилил) ацетамид, бис(триметилсилил)мочевина или подобные, производные, полученные по реакции соединения (111) с фосфортрихлоридом или фосгеном и подобные. 6 Обычно реакцию проводят в общеизвестном растворителе, таком как вода, спирт (например метанол, этанол и др.), ацетон, 2 бутанон, диоксан, ацетонитрил, хлороформ, метиленхлорид, этиленхлорид, тетрагидрофуран,этилацетат, N,N-диметилформамид, пиридин или любой другой органический растворитель,который не оказывает нежелательного влияния на реакцию, или смесь растворителей. В этой реакции при использовании соединения (11) в виде свободной кислоты или ее соли реакцию предпочтительно проводить в присутствии обычных агентов конденсации,таких как N,Nдициклогексилкарбодиимид, Nциклогексил-Nморфолиноэтилкарбодиимид,N-циклогексил-N(4-диэтиламиноциклогексил) карбодиимид, N,Nдиэтилкарбодиимид, N,N-диизопропилкарбодиимид, N-этил-N(3-диметиламинопропил)карбодиимид, пентаметиленкетен-N-циклогексилимин,дифенилкетен-Nциклогексилимин, этоксиацетилен, 1-алкокси-1 хлорэтилен, триалкилфосфит, этилполифосфат,изопропилполифосфат, оксихлорид фосфора(хлористый фосфорил), трихлорид фосфора,дифенилфосфорилазид, тионилхлорид, оксалилхлорид, галогенформиат низшего алкила (например этиловый эфир хлормуравьиной кислоты, изопропиловый эфир хлормуравьиной кислоты и др.), трифенилфосфин, 2-этил-7 гидроксибензизоксазолиевая соль, внутримолекулярная соль гидроксида 2-этил-5-(метасульфофенил)изоксазолия, 1-(пара-хлорбензолсульфонилокси)-6-хлор-1H-бензотриазол, 1-гидроксибензотриазол, так называемый, реагент Мукаямы (Mukaiyama reagent), такой как 2 хлор-1-метилпиридинийиодид, гидрохлорид 1(3-диметиламинопропил)-3-этилкарбодиимида,сам по себе или в комбинации с 1 гидроксибензолтриазолом, так называемый реагент Вилсмейера (Vilsmeier reagent), полученный по реакции N,N-диметилформамида с тионилхлоридом, фосгеном, трихлорметиловым эфиром хлормуравьиной кислоты, оксихлоридом фосфора и др., или подобные, или их смеси. Реакцию также можно проводить в присутствии неорганического или органического основания, такого как бикарбонат щелочного металла, три(низший)алкиламина, пиридина, N(низший)алкилморфолина, N,N-ди(низший) алкилбензиламина или подобного. Температура реакции не является критичной, и обычно реакцию проводят в условиях от охлаждения до нагревания. Способ 2. Рассматриваемое соединение (If) можно получить по реакции соединения (1) или его соли, отличной от соли фумаровой кислоты, с фумаровой кислотой. Обычно реакцию проводят в обычном растворителе, таком как вода, спирт (например метанол, этанол и др.), ацетон, 2-бутанон, диоксан,ацетонитрил, хлороформ, метиленхлорид, эти 7 ленхлорид, тетрагидрофуран, этилацетат, N,Nдиметилформамид, пиридин, или в любом другом органическом растворителе, который не оказывает вредного влияния на реакцию, или в смеси растворителей. Температура реакции не является критичной, и обычно реакцию проводят в условиях от охлаждения до нагревания. Способ 3. Рассматриваемое соединение (Ig) или его соль можно получить по реакции соединения (1) или его реакционноспособного производного по иминогруппе, или его соли с соединением (V) или его солью. Подходящие реакционноспособные производные соединения (IV) по иминогруппе могут включать основания Шиффа имино типа или их таутомеры енаминного типа, полученные по реакции соединения (IV) с таким карбонильным соединением как альдегид, кетон или подобные,кремнийсодержащие производные, полученные по реакции соединения (IV) с таким кремнийсодержащим соединением как бис(триметилсилил)ацетамид,моно(триметилсилил)ацетамид, бис(триметилсилил)мочевина или подобные, производные, полученные по реакции соединения (IV) с фосфортрихлоридом или фосгеном и подобные. Обычно эту реакцию проводят в таком растворителе, как спирт (например метанол,этанол и др.), дихлорметан, бензол, N,Nдиметилформамид, тетрагидрофуран, диэтиловый эфир или в любом другом органическом растворителе, который не оказывает вредного влияния на реакцию. Эту реакцию можно проводить в присутствии неорганического или органического основания, такого как гидроксид щелочного металла(например гидроксид натрия, гидроксид калия и др.), карбонат щелочного металла (например карбонат натрия, карбонат калия и др.), бикарбонат щелочного металла (например бикарбонат натрия, бикарбонат калия и др.), гидрид щелочного металла (например гидрид натрия, гидрид калия и др.), три(низший)алкиламин (например,триметиламин, триэтиламин, диизопропилэтиламин и др.), пиридин или его производные (например, пиколин, лутидин, 4-диметиламинопиридин и др.) или подобного. В случае, когда применяемое основание является жидкостью,его также можно использовать в качестве растворителя. Температура данной реакции не является критичной, и реакцию можно проводить при охлаждении, при комнатной температуре или при небольшом или сильном нагревании. Способ 4. Соединение (Ig") или его соль можно получить по реакции соединения (IV) или его реакционноспособного производного по иминогруппе, или его соли с соединением (VI) или его 8 реакционноспособным производным по карбоксильной группе, или его солью. Реакцию можно осуществлять способом,раскрытым в получении 10 или аналогичными способами. Рассматриваемые соединения настоящего изобретения обладают фармакологической активностью, такой как антагонизм тахикинину, в особенности антагонизм Веществу Р, антагонизм нейрокинину А или антагонизм нейрокинину В и, следовательно, являются полезными для лечения или профилактики заболеваний,опосредованных тахикинином, в частности заболеваний, опосредованных веществом Р, например, респираторных заболеваний, таких как астма, бронхит (например хронический бронхит, острый бронхит и диффузный панбронхиолит и др.), ринит, кашель, выделение мокроты, и подобных; глазных заболеваний, таких как конъюктивит, весенний конъюктивит и подобные; кожных заболеваний, таких как контактный дерматит, атопический дерматит, крапивница и другие экземовидные дерматиты и подобное; воспалительных заболеваний, таких как ревматоидный артрит, остеоартрит и подобные; болей и страданий (например, мигрень, головная боль, "гистаминовая" головная боль,зубная боль, страдания при раковых заболеваниях, боли в спине, невралгия и др.) и подобных. Кроме того, ожидается, что рассматриваемые соединения настоящего изобретения полезны для лечения или профилактики глазных болезней, таких как глаукома, увевит и подобные,желудочно-кишечных заболеваний, таких как язва, язвенный колит, синдром раздраженной толстой кишки, пищевая аллергия и подобные,воспалительных заболеваний, таких как нефрит и подобные, болезней, связанных с кровообращением, таких как гипертония, стенокардия,сердечная недостаточность, тромбоз, болезнь Рейно и подобные, эпилепсии, спастического паралича, поллакиурии, цистита, гиперрефлексии выталкивающей мышцы мочевого пузыря,недержания мочи, болезни Паркинсона, слабоумия, слабоумия, связанного со СПИДом, болезни Альцгеймера, синдрома Дауна, хореи Хантингтона (Huntington), карциноидного синдрома, нарушений, касающихся повышения или ослабления иммунитета, нарушений, вызванныхHelicobacter pylori или другими спиральными уреазаположительными грамотрицательными бактериями, солнечных ожогов, развития кровеносных сосудов или заболеваний, вызванных развитием кровеносных сосудов, и подобных. Кроме того, ожидают, что рассматриваемые соединения настоящего изобретения являются полезными для лечения или профилактики хронических закупоривающих легочных заболеваний, в частности хронической эмфиземы 9 легких, ирита, пролиферативной витреоретинопатии, псориаза, воспалительных кишечных заболеваний, в частности болезни Крона, гепатита, поверхностной боли на замораживание,ожог, герпесный опоясывающий лишай или диабетическую невропатию, теналгин, сопутствующей гиперлипидемии, постоперативной невромы, в частности после мастэктомии, вестибулита вульвы, зуда, связанного с гемодиализом, красного плоского лишая, ларингофарингита, бронхоэктаза, кониоза, коклюша, туберкулеза легких, муковисцидоза, рвоты, психических заболеваний, в частности страха, депрессии,дистимин и шизофрении, заболеваний, разрушающих миелиновый слой нервных волокон,таких как рассеянный склероз и боковой амиотрофический склероз, ослабления абстиненции морфина, отеков таких как отек, вызванный термическим ожогом, карцином малых клеток, в частности рака малых клеток легких (small celllung cancer = SCLC), нарушений гиперчувствительности, такой как дерматит, вызванный контактом с сумахом укореняющимся (poison ivy),фиброзных и коллагеновых заболеваний, таких как склеродермия и эозинофильный фасциолез,рефлекторной симпатической дистрофии, такой как плечевой синдром, наркологических заболеваний, таких как алкоголизм, связанных со стрессом соматических нарушений, ревматических заболеваний, таких как фиброз, и подобных. Для терапевтических целей рассматриваемые соединения настоящего изобретения можно применять в виде фармацевтических препаратов, содержащих в качестве активного ингредиента одно из указанных соединений в смеси с фармацевтически пригодным носителем, таким как органический или неорганический, твердый или жидкий наполнитель, подходящий для орального, парентерального, наружного (включая локальное), кишечного, внутривенного,внутримышечного, ингаляционного, носового,внутрисуставного интраспинального, транстрахеального или глазного применения. Фармацевтические препаративные формы могут быть твердыми, полутвердыми или растворами, такими как капсулы, таблетки, пилюли, драже,порошки, гранулы, суппозитории, мази, кремы,лосьоны, ингаляции, инъекции, припарки, гели,лейкопластыри, глазные капли, растворы, сиропы, аэрозоли, суспензии, эмульсии или подобное. Если требуется, в эти препараты можно включить вспомогательные вещества, стабилизаторы, смачивающие или эмульгирующие агенты, буферы и другие обычно применяемые добавки. Дозировку рассматриваемых соединений варьируют в зависимости от возраста и симптомов пациента, для лечения опосредованных тахикинином заболеваний, эффективной может быть средняя разовая доза около 0,1 мг, 1 мг, 10 мг, 50 мг, 100 мг, 250 мг, 500 мг и 1000 мг рас 000669 10 сматриваемых соединений. В основном, ежедневно вводят количества от 0,1 до примерно 1000 мг пациенту. Для иллюстрации полезности рассматриваемых соединений далее приведены данные фармакологической проверки представителей соединений настоящего изобретения. Указанные далее исследованные соединения демонстрируют более чем 90% степень ингибирования присоединения 125I-ВН-Вещества Р к h-NK1 рецепторам при концентрации 0,1 мкг/мл. Исследованное соединение: соединение примера 2. Присоединение 125I-ВН-Вещества Р к hNK1 рецепторам. Метод исследования: Присоединение 125IВН-Вещества Р к h-NK1 рецепторам:(а) Получение неочищенной СНО клеточной мембраны. СНО клетки с постоянной экспрессией hNК 1 рецепторов собирают и гомогенизируют при помощи Dounce гомогенизатора при 4 С в буфере (0,25 М сахароза, 25 мМ Трис-НСl рН 7,4, 10 мМ MgCl2, 1 мМ Е DTA, 5 мкг/мл pAPMSF). Гомогенат центрифугируют (500xg, 10 мин) и осадок снова суспендируют в том же буфере, гомогенизируют и центрифугируют. Оба супернатанта объединяют и центрифугируют (100000 xg, 1 ч). Выделенные таким образом неочищенные клеточные мембраны повторно суспендируют в буфере (25 мМ Трис-НСl рН 7,4, 10 мМ MgCl2, 1 мМ ЕDТА, 5 мкг/мл pAPMSF) и хранят при -80 С до использования.(b) Присоединение 125I-ВН-Вещества Р к приготовленной мембране. Клеточные мембраны инкубируют с 125IВН-Веществом Р (0,1 нМ) с указанными исследуемыми соединениями или без них в 0,25 мл(bacitracin), 4 г/мл лейпептина (leupeptine), 5 г/мл р-АРМ SF, 200 г/мл BSA) при 22 С в течение 90 мин. В конце периода инкубации содержимое быстро фильтруют при отсасывании через стеклянный фильтр (Wahtman GF/Cglass filter), предварительно для использования обработанный 0,1% полиэтилен имином в течение 3 ч. Каждый фильтр затем промывают четыре раза 5 мл буфера (50 мМ Трис-НСl рН 7,4,5 мМ MnCl2). Радиоактивность определяют при помощи автоматического счетчика гаммаизлучения (Packerd RIASTAR 5420A). Все представленные данные соответствуют специфическому связыванию, определенному как связь,замещаемая посредством 3 М немеченного Вещества Р. Кроме того, рассматриваемое соединение настоящего изобретения, в особенности, соединение (If) имеет превосходную стабильность и др. 11 Примеры Следующие далее способы получения и примеры приведены с целью более подробной иллюстрации настоящего изобретения. Способ получения 1.N-бензилглицинбензилового эфира (3,50 г) в дихлорметане (70 мл) добавляют в атмосфере азота триэтиламин (5,85 мл). К смеси при комнатной температуре добавляют йодид 2-хлор-1 метилпиридиния (3,67 г) и полученную смесь перемешивают в течение 2 ч. После завершения реакции добавляют дихлорметан (30 мл) и воду(10 мл), водой (10 мл), водным раствором бикарбоната натрия (10 мл) и солевым раствором(20 мл) и сушат над сульфатом магния. После выпаривания растворителя остаток чистят на колонке с силикагелем (140 г), элюируя смесью толуол:этилацетат (4:1) и получая (2R)-Nбензил-N-бензилоксикарбонилметил-2-(третбутоксикарбониламино)-3-(N-формил-1 Ниндол-3-ил) пропанамид (6,41 г) в виде масла. ИК (СНСl3): 3300, 2970, 1740, 1700, 1644,1604 см-1. ЯМР (ДМСО-d6, ): 0,89, 1,22 и 1,29 (9 Н,3 с), 2,80-3,10 (2 Н, м), 3,95-4,25 (2 Н, м), 4,40-4,90 К охлаждаемому льдом раствору соединения способа получения 1 (6,39 г) в дихлорметане (50 мл) добавляют 4N раствор хлористого 12 водорода в диоксане (50 мл) . Смесь перемешивают при той же температуре в течение 30 мин и при комнатной температуре в течение 1 ч. После выпаривания растворителя остаток распределяют между дихлорметаном (50 мл) и водным раствором бикарбоната натрия (30 мл). Органический слой отделяют, сушат над сульфатом магния и фильтруют. К фильтрату добавляют при комнатной температуре триэтиламин (1,67 мл) и смесь перемешивают в течение 1,5 ч. После выпаривания остаток растирают с диизопропиловым эфиром, собирают посредством фильтрации и сушат, получая (3R)-1-бензил-3(N-формил-1H-индол-3-илметил) пиперазин-2,5 дион (3,93 г). Т.пл. 176-178 С. ИК (Nujol): 3250, 1709, 1648, 1630 см-1. ЯМР (ДМСО-d6, ): 2,95-3,30 и 3,35-3,70 К охлажденному льдом раствору соединения способа получения 2 (3,89 г) в смеси метанола (175 мл) и тетрагидрофурана (50 мл) добавляют водный 0,1N раствор гидроксида натрия (108 мл). Смесь перемешивают при той же температуре в течение 30 мин и при комнатной температуре в течение 1,5 ч. После выпаривания растворителя остаток экстрагируют дихлорметаном. Органический слой промывают водой и водным раствором хлорида натрия и сушат над сульфатом магния. Выпаривание растворителя дает (3R)-1-бензил-3-(1 Н-индол-3-илметил) пиперазхин-2,5-дион (3,68 г). Т.пл. 207-208 С ИК (Nujol): 3402, 1650 см-1. ЯМР (ДМСО-d6, ): 2,68 (1H, д, J= 17,2 Гц),3,04 (1H, дд, J = 14,4 и 4,4 Гц), 3,20-3,40 (2 Н, м),4,24 (1H, с), 4,10-4,40 (2 Н, м), 6,75-7,60 (10 Н, м),8,35 (1 Н,с), 10,94 (1 Н,с). МАСС: 334 (М+1) Способ получения 4. 13 капле раствор соединения способа получения 3(3,40 г) в тетрагидрофуране (40 мл) при 0 С в атмосфере азота. Смесь перемешивают при комнатной температуре в течение 50 мин и при температуре кипения с обратным холодильником в течение 1 ч. Полученную смесь разбавляют тетрагидрофураном (60 мл) и охлаждают до 0 С. Медленно добавляют воду (3,0 мл) и водный 15% раствор гидроксида натрия (0,8 мл). Из смеси удаляют посредством фильтрования получившийся нерастворимый неорганический материал и промывают тетрагидрофураном. Фильтрат и промывной раствор объединяют и выпаривают при пониженном давлении, получая (3R)-1-бензил-3-(1H-индол-3-илметил)пиперазин (3768 г) в виде масла. ИК (СНСl3): 3240, 3040, 2900 см-1. ЯМР (ДМСО-d6, ): 1,70-2,00 и 2,30-2,45 К смеси 3,5-бис(трифторметил)бензойной кислоты (1,15 г) и (3R)-1-бензил-3-(1H-индол-3 илметил)пиперазина (1,61 г) в дихлорметане (80 мл) добавляют при комнатной температуре в атмосфере азота триэтиламин (1,55 мл). Добавляют иодид 2-хлор-1-метилпиридиния (1,37 г) и смесь перемешивают в течение 2,5 ч при комнатной температуре. Полученную смесь выливают в воду (20 мл). Органический слой промывают последовательно 0,5 N соляной кислотой,водой, водным раствором бикарбоната натрия и солевым раствором и сушат над сульфатом магния. После выпаривания при пониженном давлении остаток хроматографируют на силикагеле, элюируя смесью толуол:этилацетат (4:1) и получая Смесь (2R)-4-бензил-1-[3,5-бис(трифторметил)бензоил] -2-(1H-индол-3-илметил) пиперазина (5,20 г), формиата аммония (1,50 г) и 10% Pd угля (0,52 г) в этаноле (50 мл) кипятят с обратным холодильником в течение 7,5 ч в атмосфере азота. Реакционную смесь охлаждают до комнатной температуры и фильтруют через набивку из броунмиллерита (Celite). Фильтрат концентрируют при пониженном давлении и остаток чистят на колонке с силикагелем, элюируя смесью дихлорметан:метанол (20:1) и получая (2R)-1-[3,5-бис(трифторметил)бензоил]-2(1H-индол-3-илметил)пиперазин (2,67 г) в виде сиропа. ИК (СНСl3): 3280, 2900, 1622 см-1. ЯМР (ДМСО-d6, ): 2,50-3,50 (9 Н, м), 3,64,8 (1H, м), 6,55-7,40 (5 Н, м), 7,50-8,22 (3 Н, м),10,84 (1H, с). МАСС: 456 (М+1). Способ получения 7. Смесь (2R)-1-[3,5-бис(трифторметил) бензоил]-2-(1 Н-индол-3-илметил)пиперазина (1,5 г), бензил-2-бромацетата (0,79 г), триэтиламина(0,55 мл) и тетрагидрофурана (15 мл) перемешивают в течение ночи при комнатной температуре. Получившийся нерастворимый материал удаляют посредством фильтрования, а фильтрат концентрируют при пониженном давлении. Остаток чистят способом колоночной хроматографии на силикагеле, элюируя смесью дихлорметан:метанол (30:1), получая (2R)-4-(бензилоксикарбонилметил)-1-[3,5-бис (трифторметил) бензоил]-2-(1H-индол-3-илметил) пиперазин(0.186 г) и тетрагидрофурана (93 мл) перемешивают в течение 17 ч в атмосфере газообразного водорода (1 атм.). Катализатор удаляют посредством фильтрования, а фильтрат концентрируют. Остаток растирают с этиловым эфиром, получая[]D19: -3,0 (C=0,5, DMF) Т.пл. 152-156 С ИК (Nujol): 3600-3100, 1654, 1630, 1277,1196, 1130 см-1. ЯМР (ДМСО-d6, ): 2,20-5,20 (11 Н, м),6,60-8,20 (8 Н, м), 10,85 (1H, ш.с.). МАСС: 514 (М+1) Способ получения 9. К охлаждаемой льдом смеси (2R)-2 бензил-1-[3,5-бис(трифторметил)бензоил] пиперазина (0,3 г) и триэтиламина (0,39 мл) в диметилформамиде (8 мл) добавляют гидрохлорид 3(хлорметил)пиридина (0,12 г). Реакционную смесь перемешивают при той же температуре в течение 30 мин и затем при комнатной температуре в течение 2 ч. Добавляют еще триэтиламин(0,12 г) и полученную смесь перемешивают в течение ночи. Реакционную смесь фильтруют, а фильтрат концентрируют и хроматографируют на силикагеле, элюируя смесью толуол:этилацетат (5:1). Элюент обрабатывают 4N раствором хлористого водорода в этилацетате,получая дигидрохлорид (2R)-2-бензил-1-[3,5 бис (трифторметил) бензоил]-4-(пиридин-3 илметил)пиперазина. Т.пл. 164-168 С. К перемешиваемой смеси (2R)-2-бензил-1[3,5-бис(трифторметил)бензоил]пиперазина (0,3 г) и 2-(1 Н-индол-3-ил)уксусной кислоты (0,13 г) в дихлорметане (8 мл), содержащей триэтиламин (0,25 мл), добавляют при комнатной температуре в атмосфере азота иодид 2-хлор-1 метилпиридиния (0,22 г). После перемешивания в течение 5 ч реакционную смесь разбавляют дихлорметаном и промывают 0,1N соляной кислотой, насыщенным водным раствором бикарбоната натрия и солевым раствором и сушат над сульфатом магния. После удаления растворителя остаток чистят способом колоночной хроматографии на силикагеле, элюируя смесью хлороформ/метанол (50:1) и получая (2R)-2-бензил 1-[3,5-бис(трифторметил)бензоил]-4-[2-(1H 000669(1 Н, м). МАСС: 574 (М+1) 417. Способ получения 11. К раствору (2R)-2-бензил-1-[3,5-бис (трифторметил)бензоил]-4-[2-(1H-индол-3-ил)ацетил] пиперазина (0,1 г) в дихлорметане (10 мл) добавляют 4N раствор хлористого водорода в диоксане (0,05 мл) при температуре 0 С. Полученную смесь перемешивают при той же температуре в течение 50 мин и затем концентрируют при пониженном давлении. Полученный порошок собирают посредством фильтрации и промывают этиловым эфиром, получая гидрохлорид (2R)-1-[3,5-бис(трифторметил)бензоил]-2(1H-индол-3-илметил)пиперазина (0,1 г). ИК (Nujol): 3340, 1648 см-1. ЯМР (ДМСО-d6, ): 2,9-3,9 (8 Н, м), 3,9-5,2(0,1 мл). После перемешивания в течение 1 ч реакционную смесь выливают в ледяную воду и экстрагируют этилацетатом. Экстракт промывают последовательно насыщенным водным раствором бикарбоната натрия и солевым раствором и сушат. После выпаривания растворителя в вакууме остаток чистят способом колоночной хроматографии на силикагеле, элюируя смесью дихлорметан: метанол (40:1), и обрабатывают 4N раствором хлористого водорода в этилацетате, получают гидрохлорид (2R)-1-[3,5 бис(трифторметил)бензоил]-2-(3,4-диметилбензил)-4-[2-(мезиламино)этил]пиперазина (50 мг). Т.пл.: 220 С.[]D22 +0,2 (С = 0,5, DMF) ИК (Nujol): 3350, 2700-2400, 1645, 1500,1450, 1380 см-1. ЯМР (ДMCO-d6, ): 2,10 и 2,18 (6 Н, 2 с),2,7-5,2 (17 Н, м), 6,6-7,7 (5 Н, м), 8,1-8,2 (1 Н, м),11,05-11,4 (1 Н, м). МАСС: 566 (М+1) (свободный). Пример 1. К перемешиваемому раствору (2R)-4(карбоксиметил)-1-[3,5-бис(трифторметил)бензоил]-2-(1-индол-3-илметил)пиперазина (1 г) в сухом диметилформамиде (10 мл) добавляют при комнатной температуре 1-гидроксибензотриазол (0,29 г) и гидрохлорид 1-(3-диме 17 гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (0,41 г). После перемешивания в течение 15 мин при комнатной температуре добавляют 1-амино-4 метилпиперазин (320 мг) и перемешивают еще в течение 5 ч при той же температуре. Реакционную смесь выливают в раствор гидрокарбоната натрия (1,8 г) в воде (100 мл) и трижды экстрагируют 20 мл порциями этилацетата. Органические слои объединяют и промывают солевым раствором (30 мл). Органический слой сушат над сульфатом магния, фильтруют и удаляют растворитель на роторном испарителе. Сырой продукт чистят хроматографически (силикагель,дихлорметан: метанол = 5:1), получая (2R)-1[3,5-бис(трифторметил)бензоил]-2-(1H-индол-3 илметил)-4-[N-(4-метил-1-пиперазинил) карбамоил-метил]пиперазин (0,94 г) в виде желтоватого порошка. ИК (Nujol): 3180, 1680, 1630, 1276, 1170,1130, 1005, 897 см-1. ЯМР (ДМСО-d6, ): 2,16 (3 Н, с), 2,0-5,0(2R)-1-[3,5-бис(трифторметил)бензоил]-2(1H-индол-3-илметил)-4-[N-(4-метил-1-пиперазинил)карбамоилметил]пиперазин (10,89 г) и фумаровую кислоту (2,07 г) растворяют в этаноле (50 мл) при 70 С. После охлаждения полученный раствор концентрируют при пониженном давлении, получая порошок (13,18 г). Этот порошок (9,68 г) растворяют в 2-бутаноле (194 мл) при температуре кипения с обратным холодильником и раствор перемешивают при комнатной температуре, получая кристаллы, которые собирают посредством фильтрации и сушат,получая фумарат (2R)-1-[3,5-бис(трифторметил) бензоил]-2-(1H-индол-3-илметил)-4-[N-(4 метил-1-пиперазинил)карбамоилметил]пиперазина (7,94 г). Т.пл.: 169,5-171 С. ИК (Nujol): 3220, 1700, 1653, 1630, 1275,1217, 1168, 1122, 979, 894, 730 см-1. ЯМР (ДМСО-d6, ): 2,23, 2,26 (3 Н, 2 с),2,10-4,93 (19 Н, м), 6,60 (2 Н, с), 6,54-8,23 (8 Н, м),8,50, 8,85 (1 Н, 2 с), 10,85 (1 Н, с). Пример 3. Соединение (If), которое называется фумарат (2R)-1-[3,5-бис(трифторметил)бензоил]-2(1H-индол-3-илметил)-4-[N-(4-метил-1-пиперазинил)карбамоилметил]пиперазина, можно также получить по следующей схеме. Пример 4. Смесь (2R)-1-[3,5-бис(трифторметил) бензоил]-2-(1H-индол-3-илметил)пиперазина (120 мг), 4-хлорметил-2-(2-метоксиэтилкарбониламино)тиазола (70 мл) и измельченного в порошок гидрокарбоната натрия (27 мг) в сухом диметилформамиде перемешивают в течение 5 ч и 20 мин при температуре 60 С. Реакционную смесь выливают в воду и полученный осадок собирают посредством фильтрации. Сырой продукт чистят способом колоночной хроматографии на силикагеле, элюируя смесью дихлорметан: метанол (30:1). Элюат выпаривают при пониженном давлении и обрабатывают 17,6% раствором хлористого водорода в этаноле (0,12 мл),получая гидрохлорид (2R)-1-[3,5-бис(трифторметил) бензоил]-2-(1H-индол-3-илметил)-4-2(3-метоксипропаноиламино)тиазол-4-ил]метил] пиперазина (140 мг).(табл.1) получают способом, аналогичным способу примера или способа получения, указанного в колонке "Способ". После таблицы приведены физические характеристики рассматриваемых соединений. Физические характеристики соединений примера 5. Пример 5-1. Т.пл.: 185-189 С. 3. Фармацевтическая композиция, включающая в качестве активного ингредиента соединение по п.1 в сочетании с фармацевтически приемлемым нетоксичным носителем или разбавителем. 4. Способ лечения или профилактики заболеваний, опосредованных тахикинином, который включает введение человеку или животным эффективного количества соединения по п.1. 5. Применение соединения по п.1 для производства лекарственного препарата для лечения или профилактики заболеваний, опосредованных наличием тахикинина. 6. Соединение общей формулы ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы где R1 представляет тригалоген (C1-C6)алкил,R2 представляет тригалоген (C1-C6)алкил,R3 представляет индолил (C1-С 6)алкил,2. Способ получения соединения по п.1,включающий реакцию соединения формулы или его соли, отличной от соли фумаровой кислоты, с фумаровой кислотой с получением соединения формулы в которых R5 является водородом или C1-С 6 алкоксикарбонилом,R6 является водородом или С 2-С 6 алканоилом,R7 является водородом, C1-С 6 алкилом, С 2 С 6 алканоилом, С 1-С 6 алкоксикарбонилом, С 1-C6 алкокси (С 2-С 6) алканоилом, цикло (С 3-С 6) алкилкарбонилом, С 6-С 10 ароил или С 1-С 6 алкилсульфонилом,или его фармацевтически пригодная соль.
МПК / Метки
МПК: A61K 31/50, C07D 403/06
Метки: производные, пиперазина
Код ссылки
<a href="https://eas.patents.su/13-669-proizvodnye-piperazina.html" rel="bookmark" title="База патентов Евразийского Союза">Производные пиперазина</a>
Следующий патент: Окно с усовершенствованной оконной рамой
Случайный патент: Система многосекционных топливных элементов












