Замещенные 8-арилхинолиновые ингибиторы фосфодиэстеразы-4
Номер патента: 4747
Опубликовано: 26.08.2004
Авторы: Дюб Дэниел, Галлан Мишель, Макдональд Дуайт, Лякомб Патрик, Жирар Ив, Мастраччо Энтони, Перье Элен, Дешен Дени
Формула / Реферат
1. Соединение, представленное формулой (I)
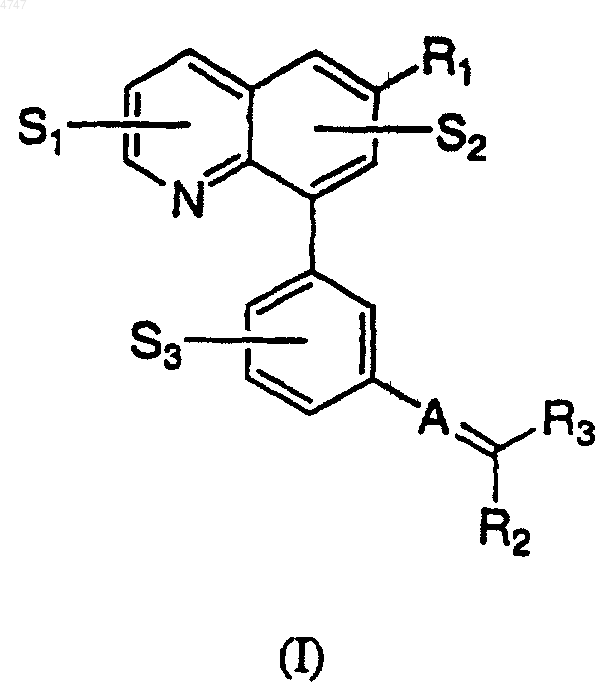
или его фармацевтически приемлемая соль, где
S1, S2 и S3 представляют собой H;
R1 представляет собой -C1-C6алкильную группу, необязательно замещенную группой -CN или -SO2-C1-C6алкилом;
A представляет собой CH;
R2 представляет собой фенил, замещенный галогеном или -SO2-C1-C6алкилом;
R3 представляет собой ди(C1-C6алкил) амино-C1-C6алкил; фенил, необязательно замещенный галогеном или -SO2-C1-C6алкилом; -C(O)OH; карбамоил, необязательно замещенный -C1-C6алкилом или C3-C6циклоалкилом; пирролидинокарбонил; или гетероарил, выбранный из группы, включающей имидазолил, тиазолил, оксадиазолил или пиридил, каждый из которых необязательно замещен C1-C6алкилом, гидрокси-C1-C6алкилом или C1-C6алкоксифенокси-C1-C6алкилом;
2. Соединение по п.1 или его фармацевтически приемлемая соль, где R3 представляет собой гетероарил, выбранный из группы, включающей имидазолил, тиазолил, оксадиазолил или пиридил, каждый из которых необязательно замещен C1-C6алкилом, гидрокси-C1-C6алкилом или C1-C6алкоксифенокси-C1-C6алкилом.
3. Соединение по п.2 или его фармацевтически приемлемая соль, где R3 представляет собой фенил, необязательно замещенный галогеном или -SO2-C1-C6алкилом.
4. Соединение по п.1, выбранное из группы, включающей
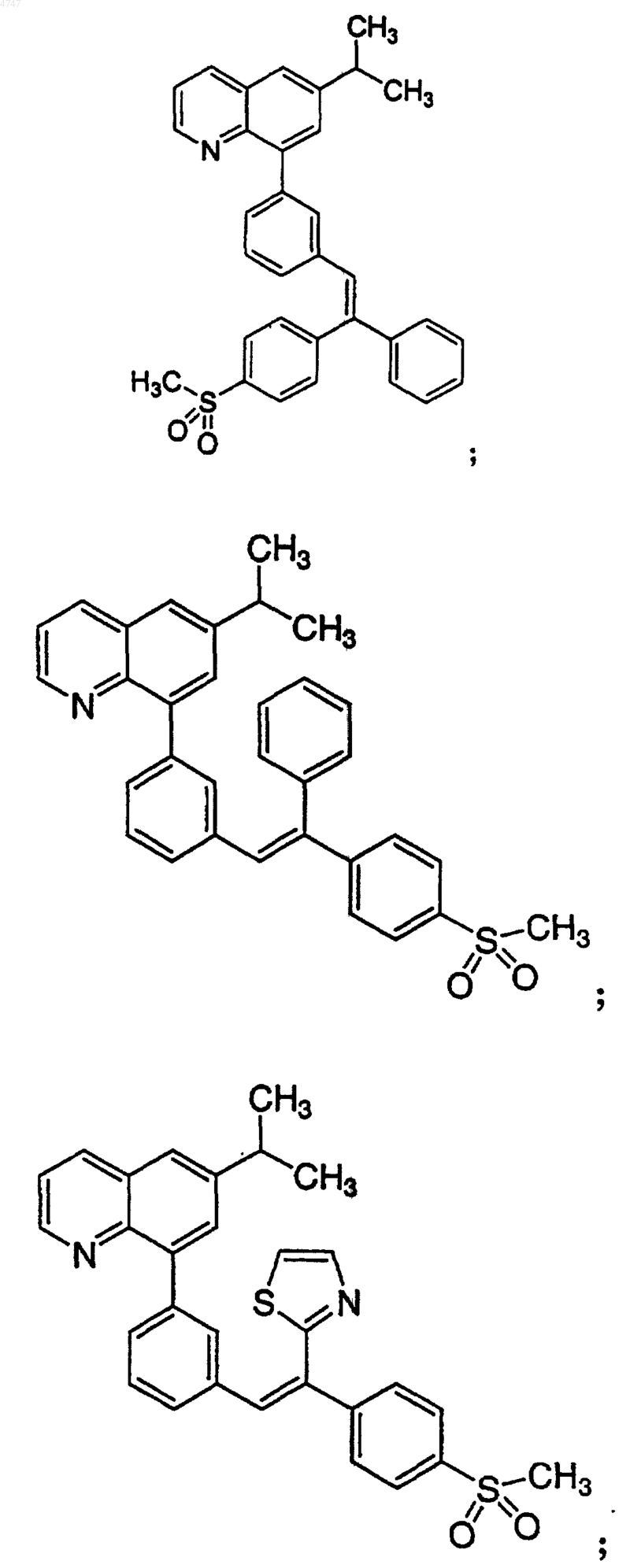
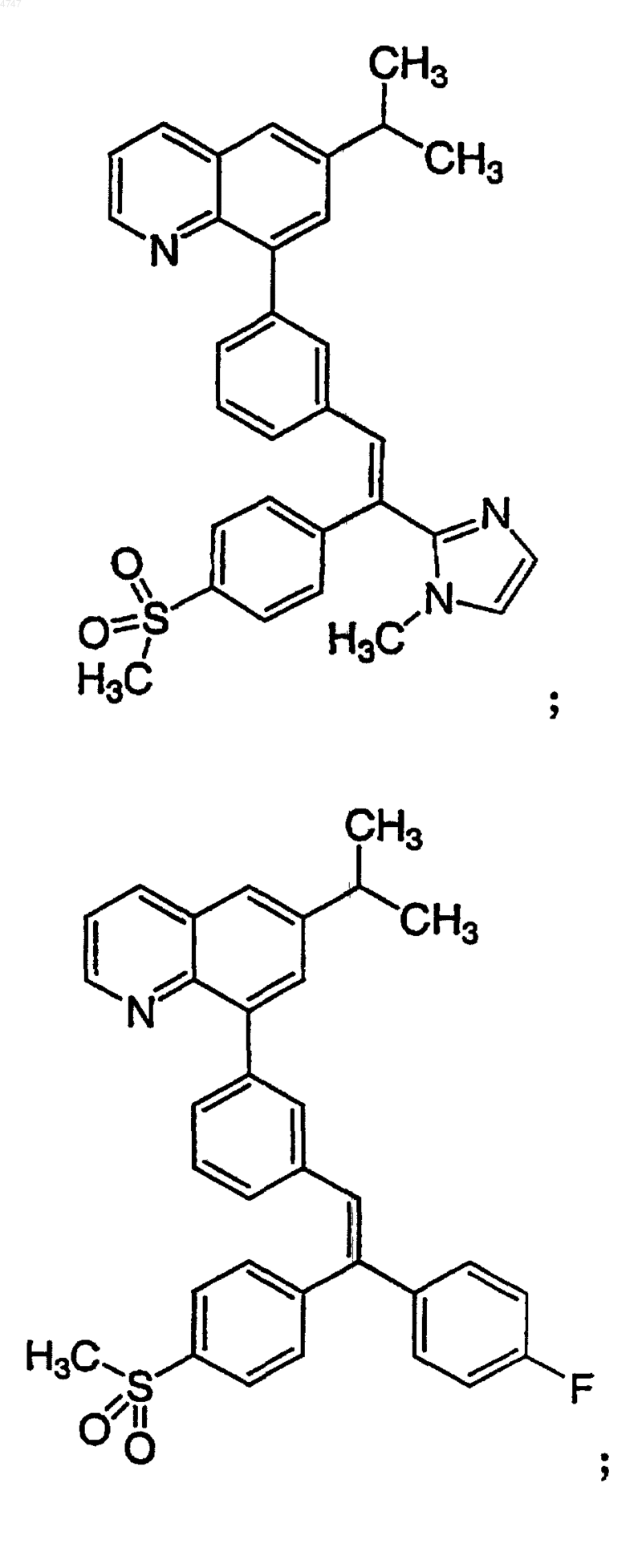
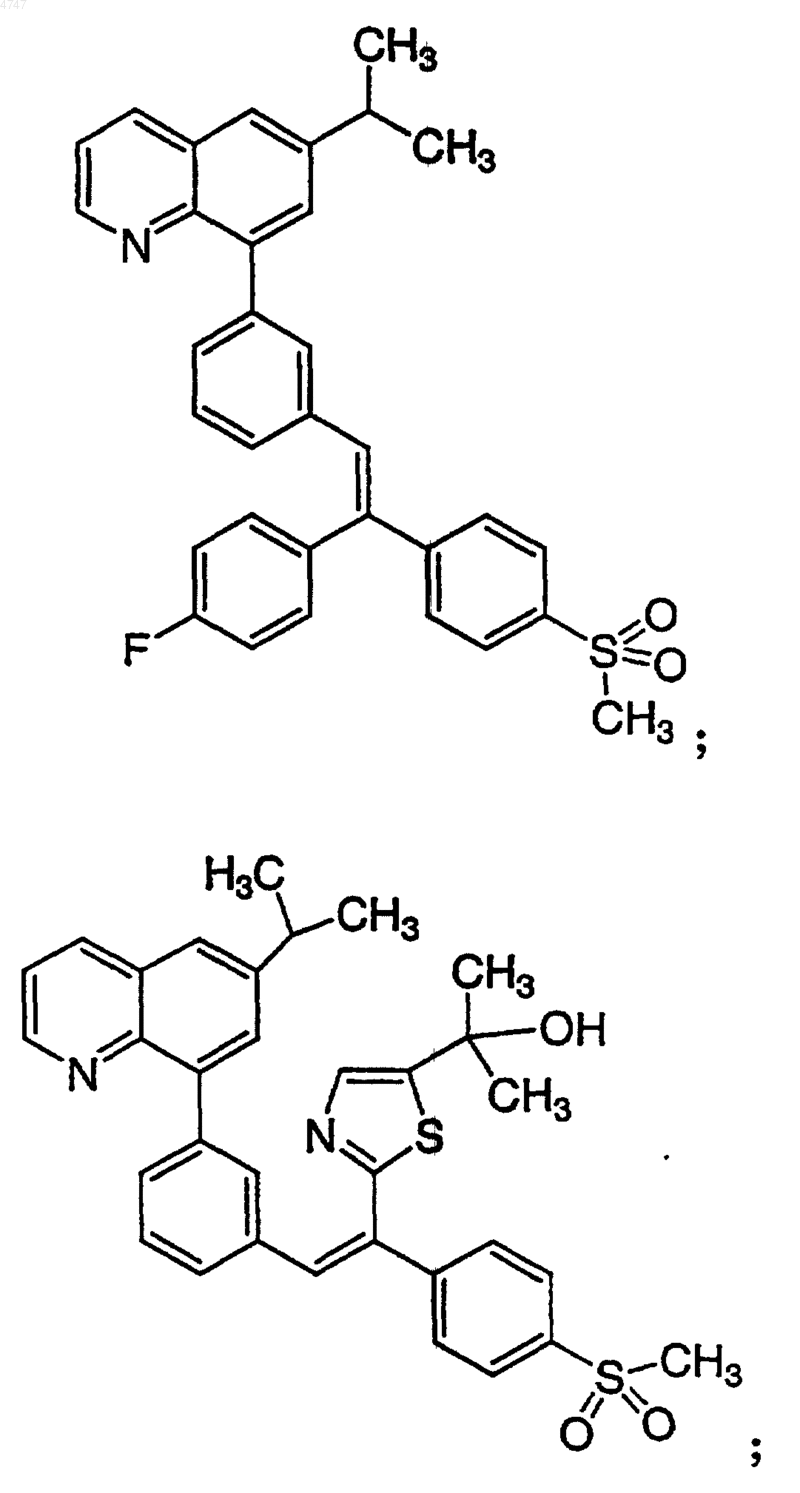
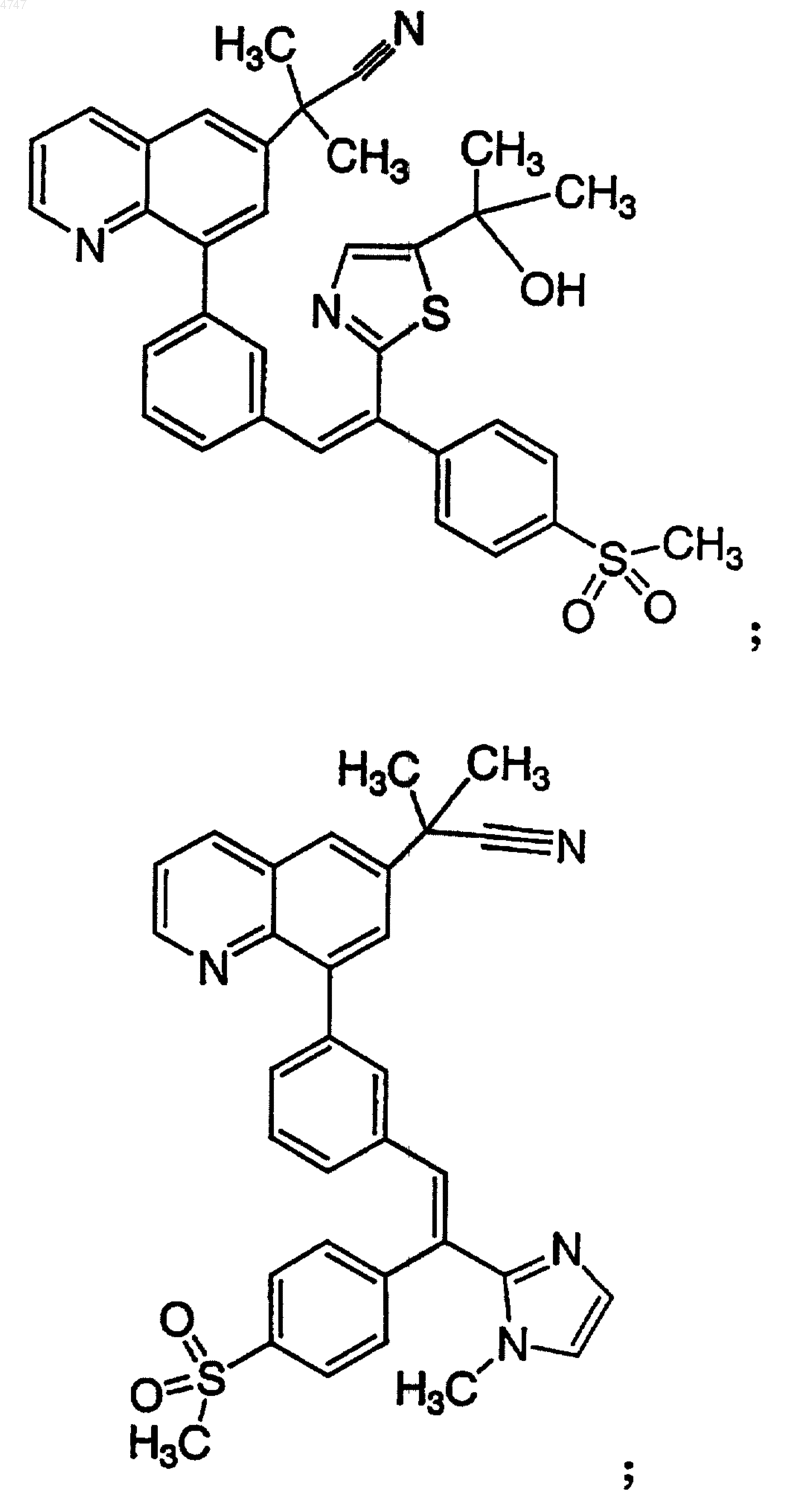


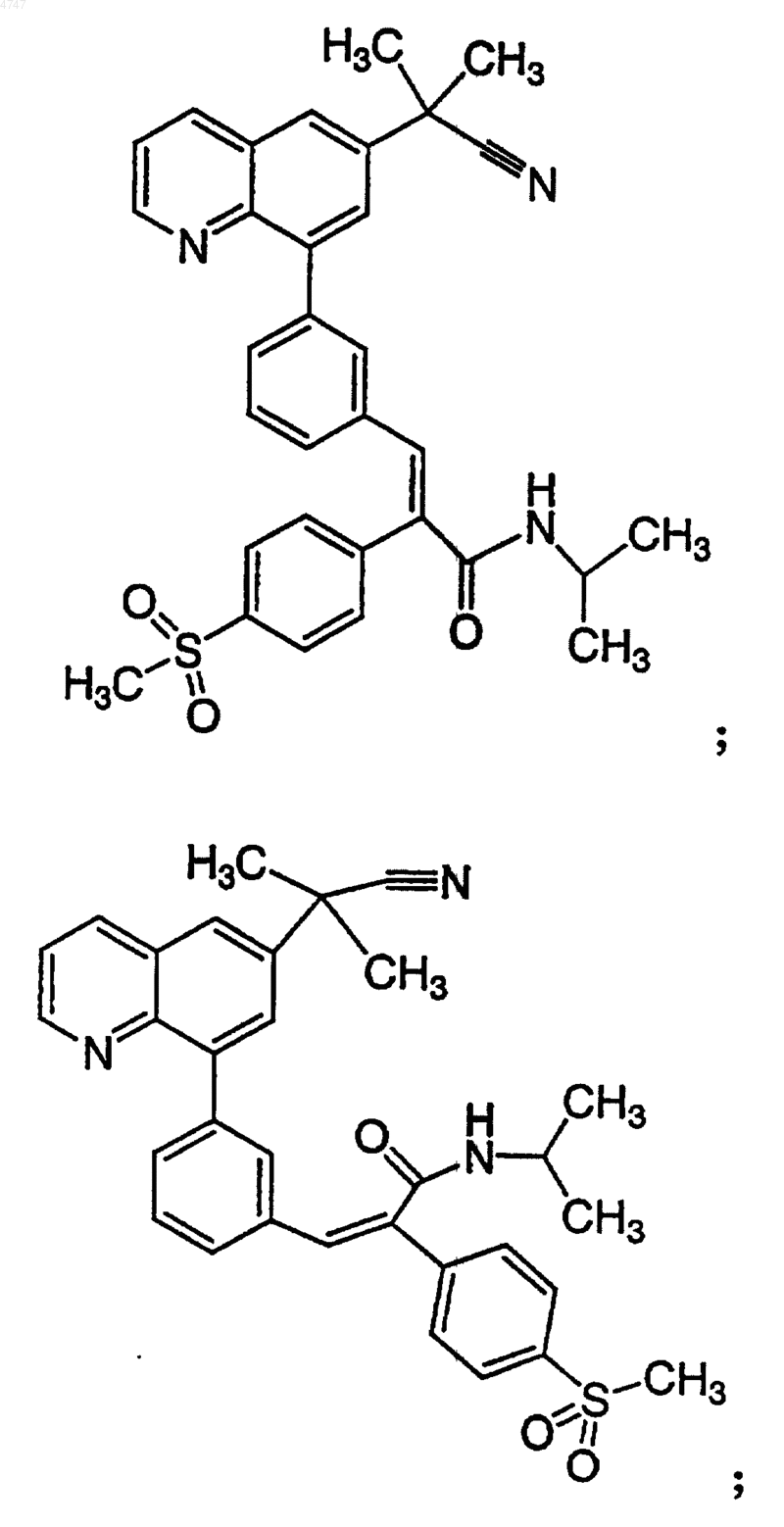
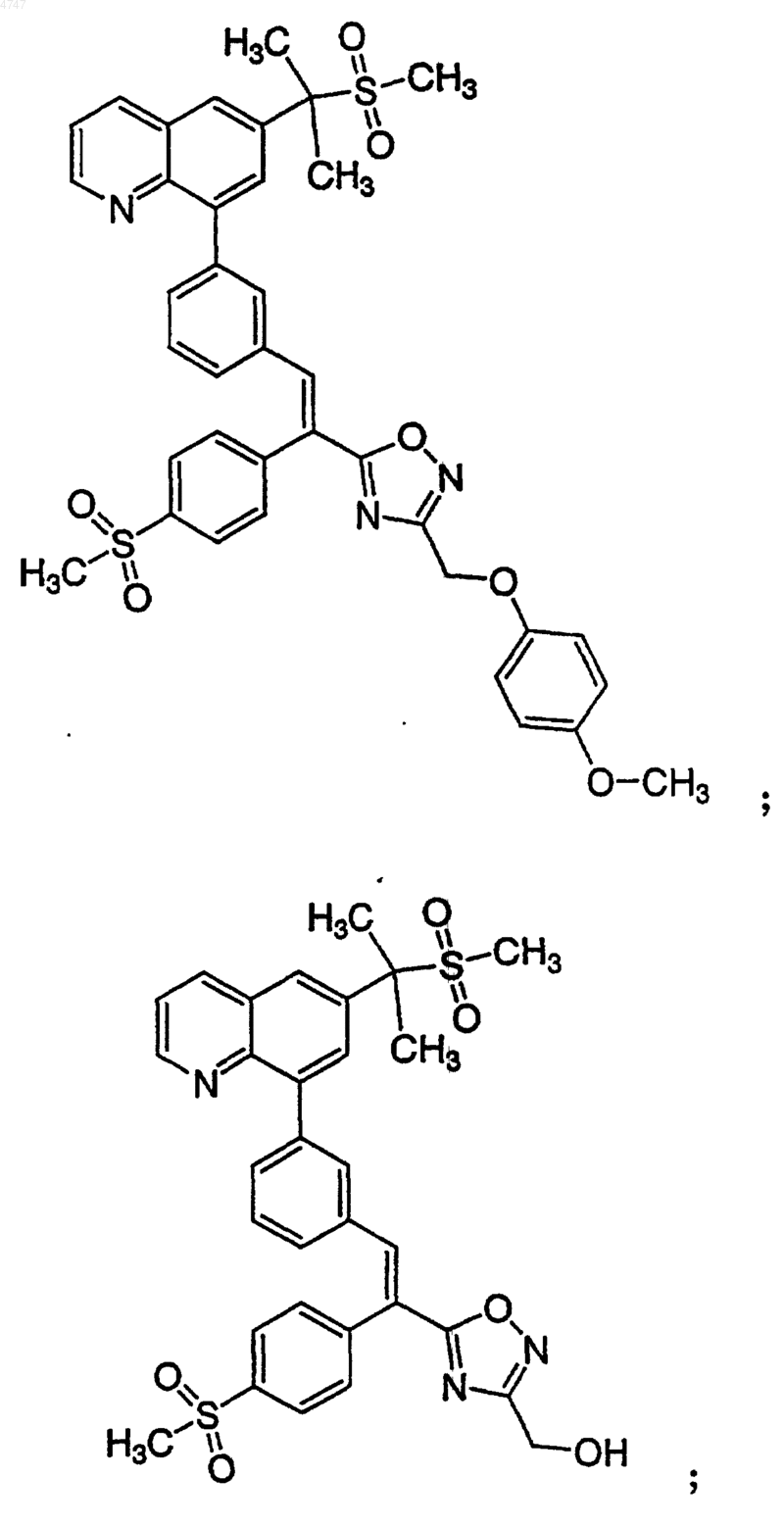
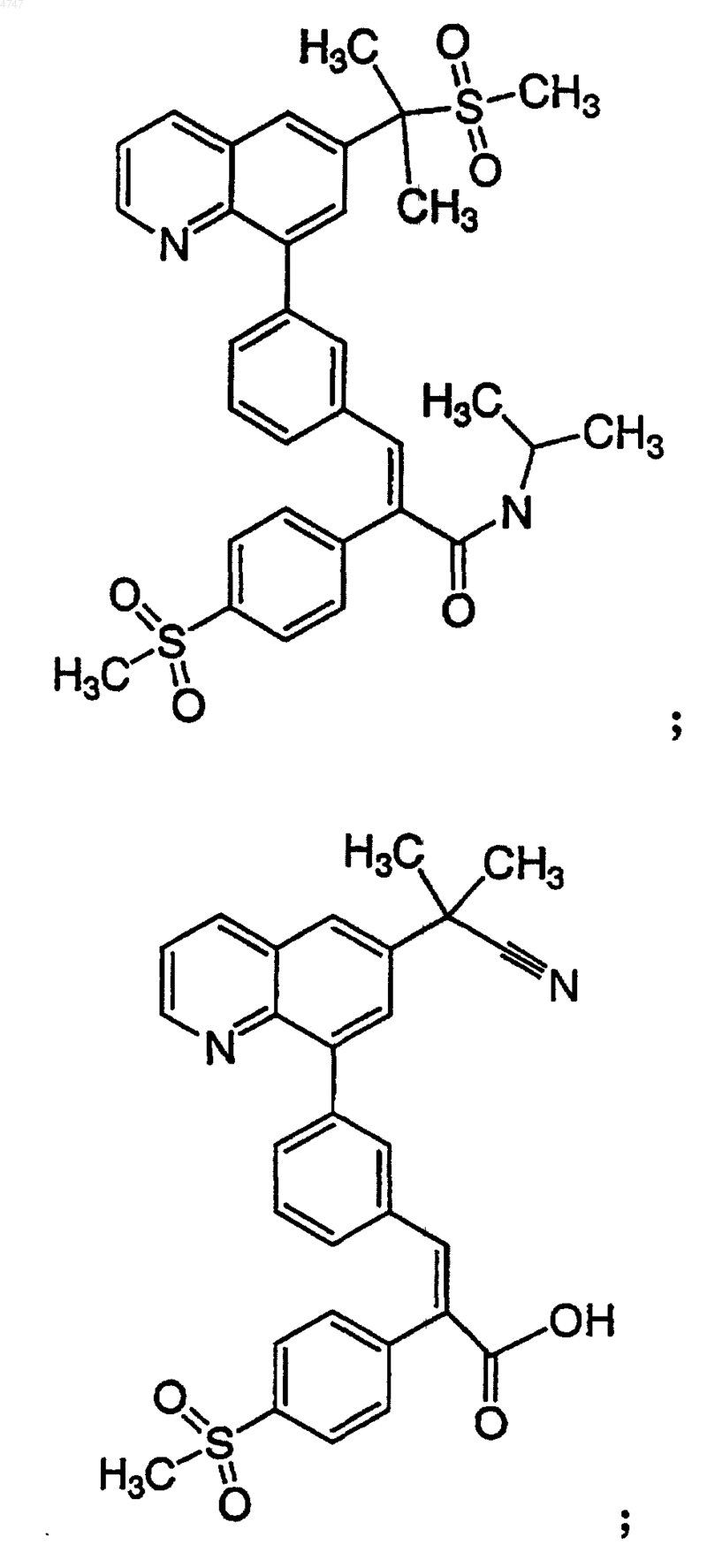
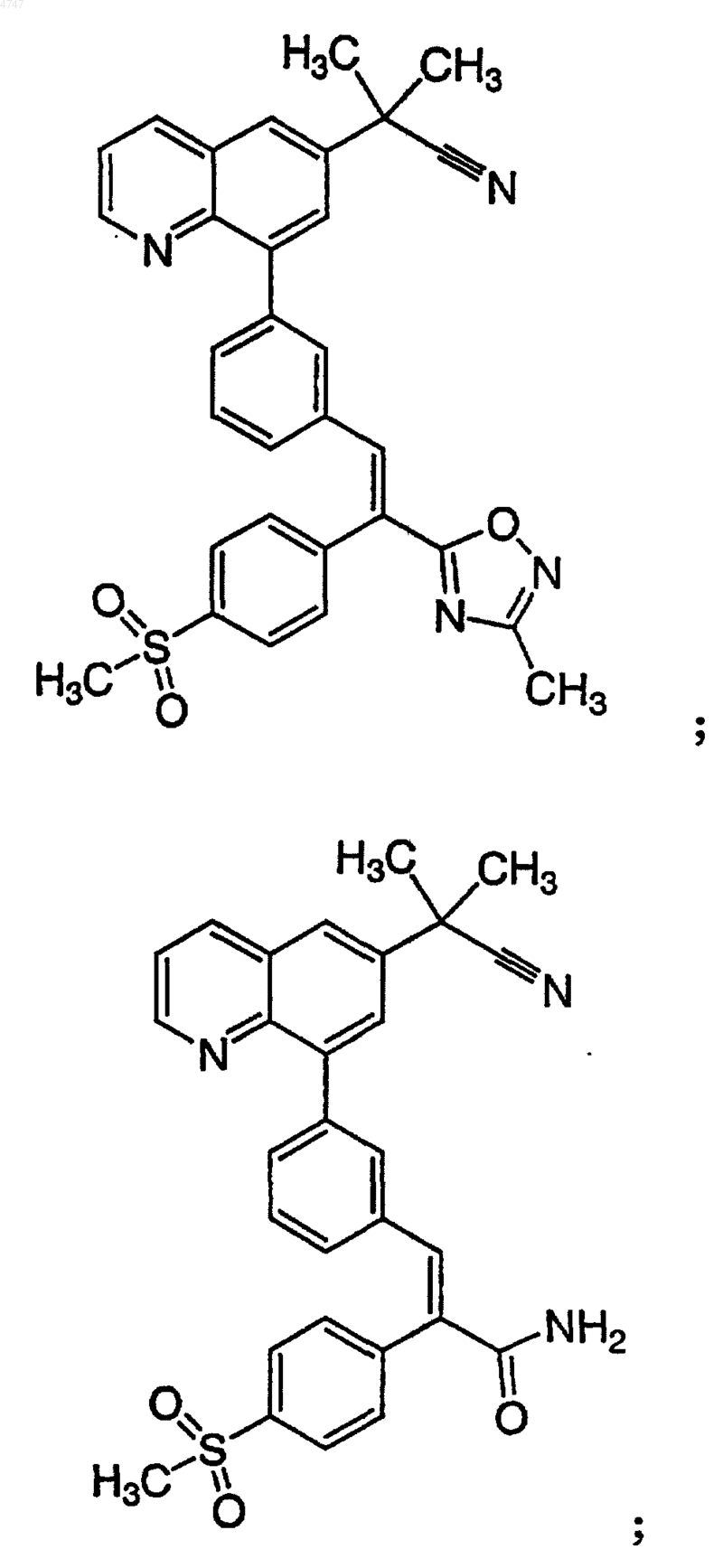
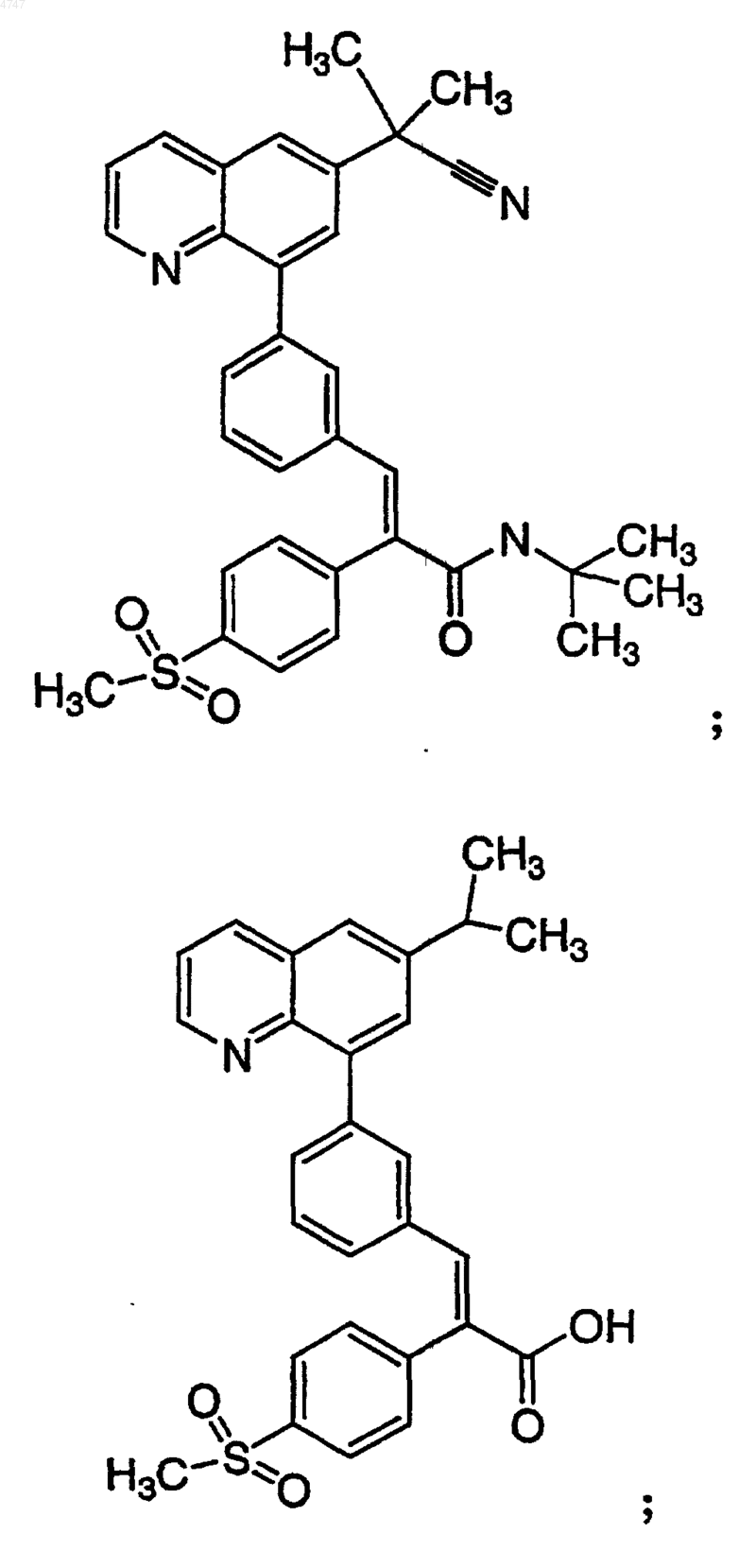
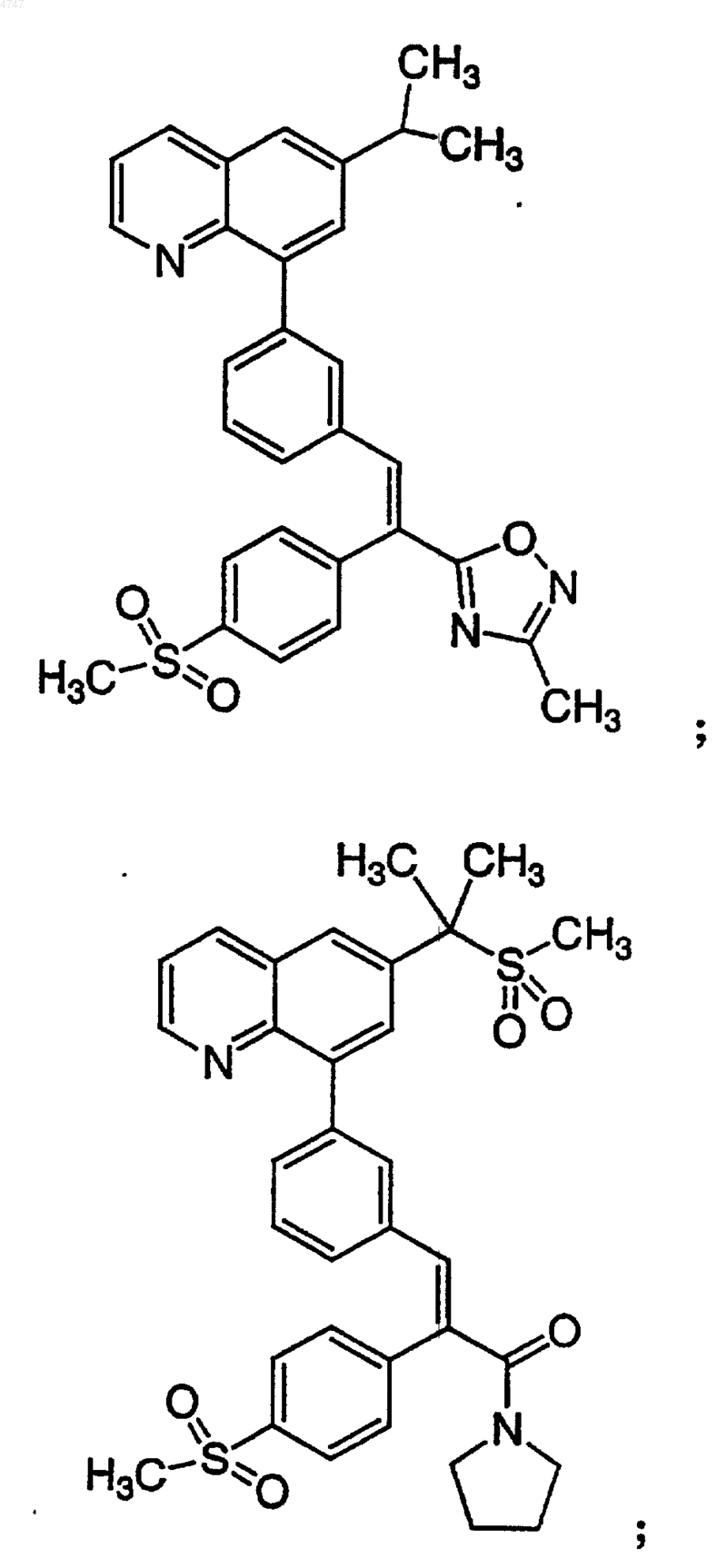
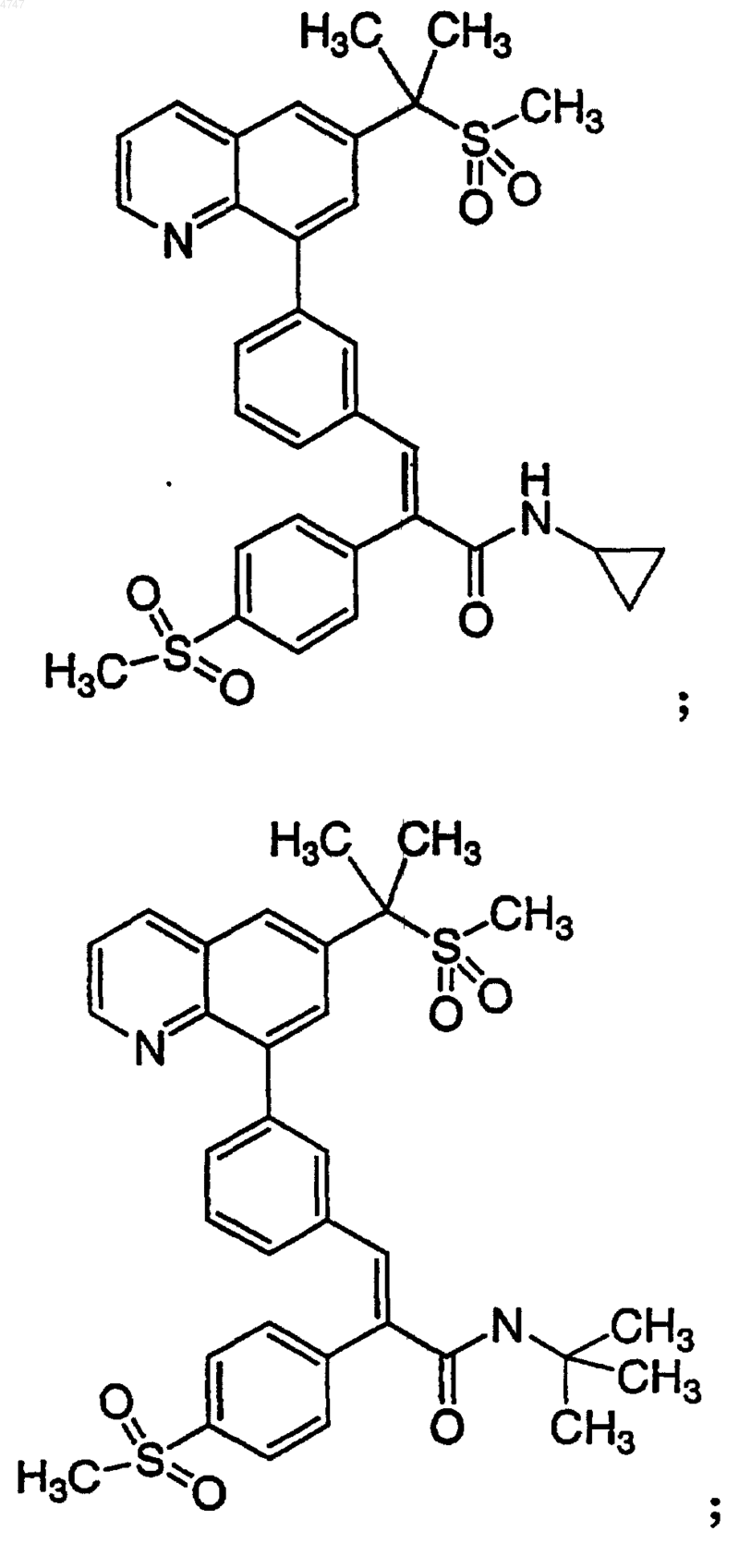
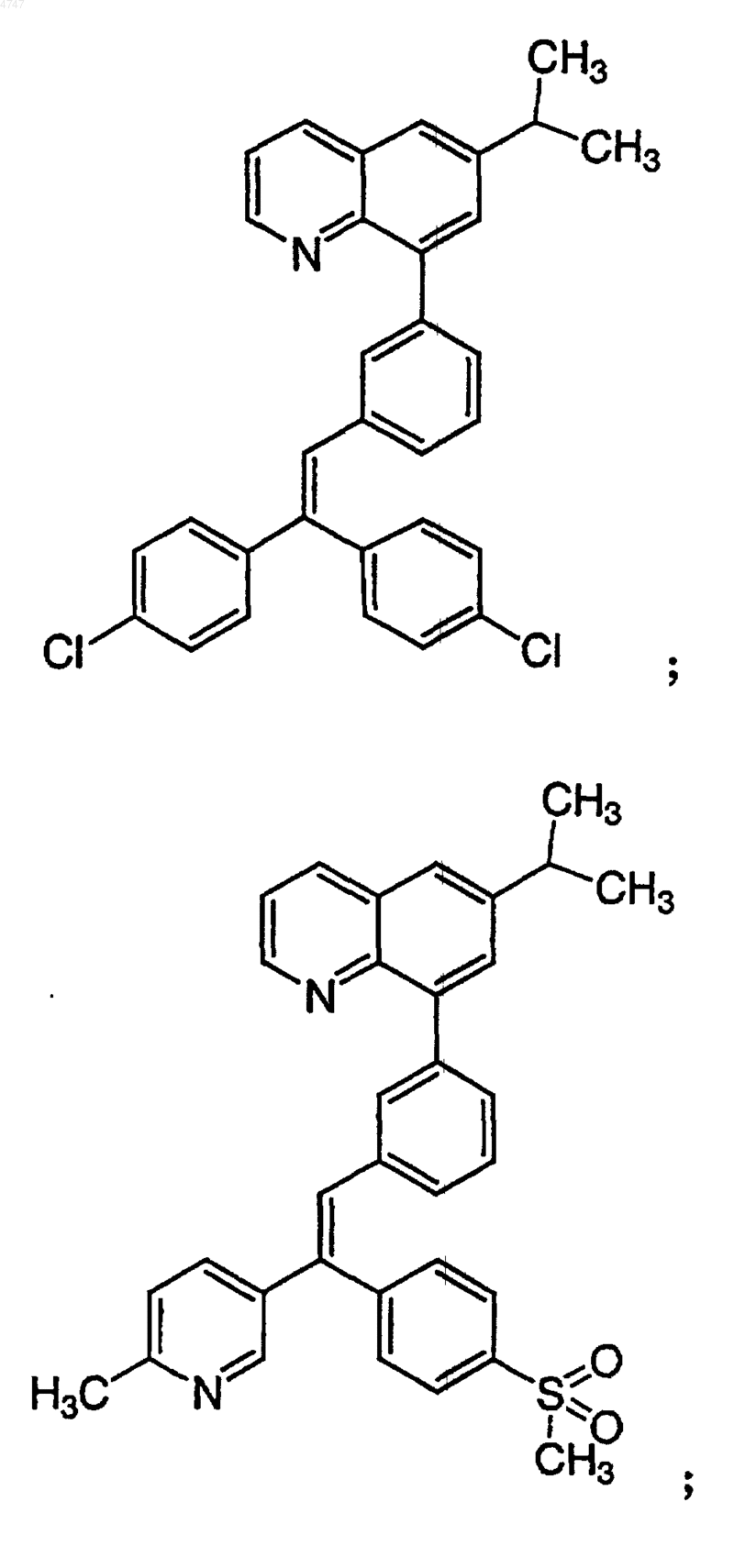
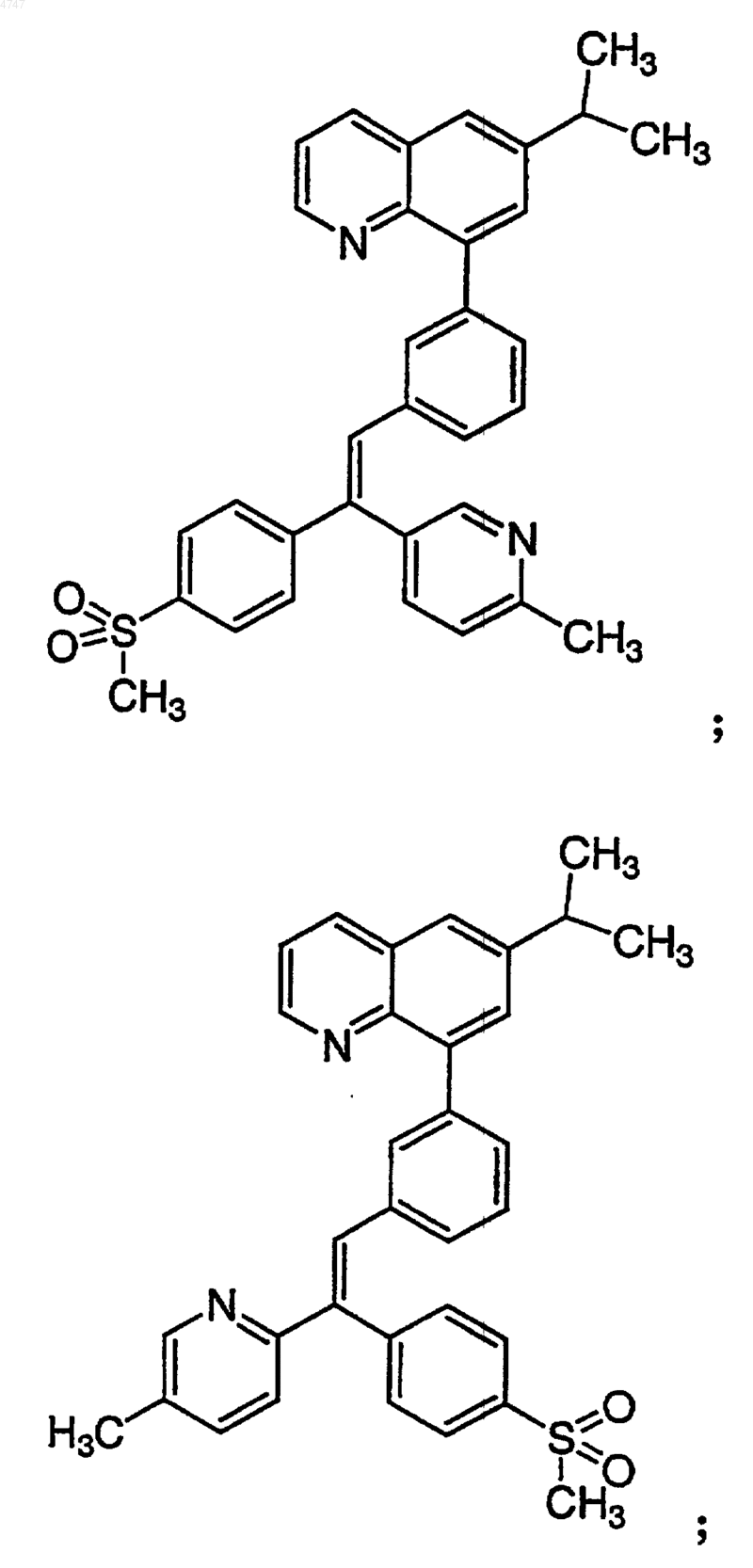
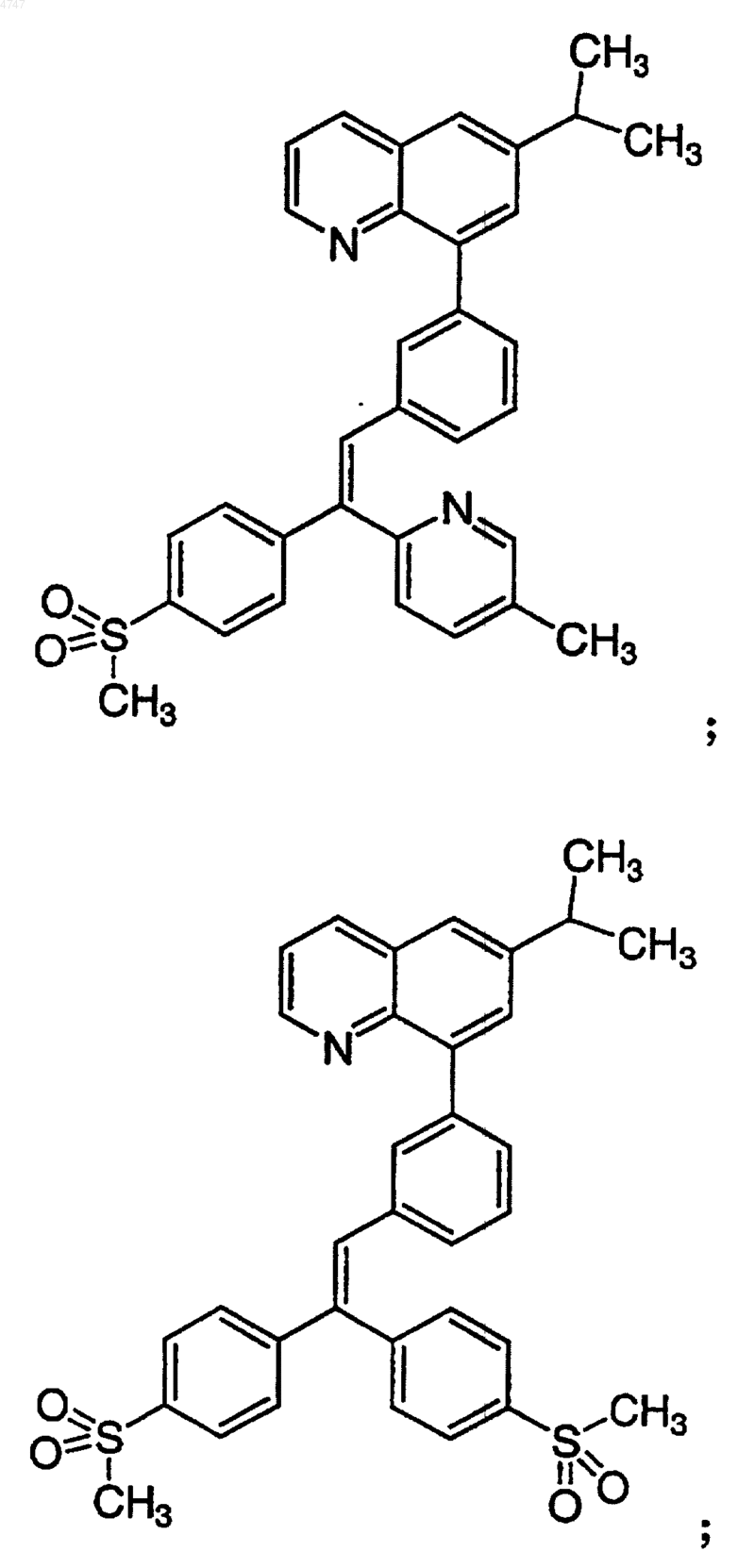
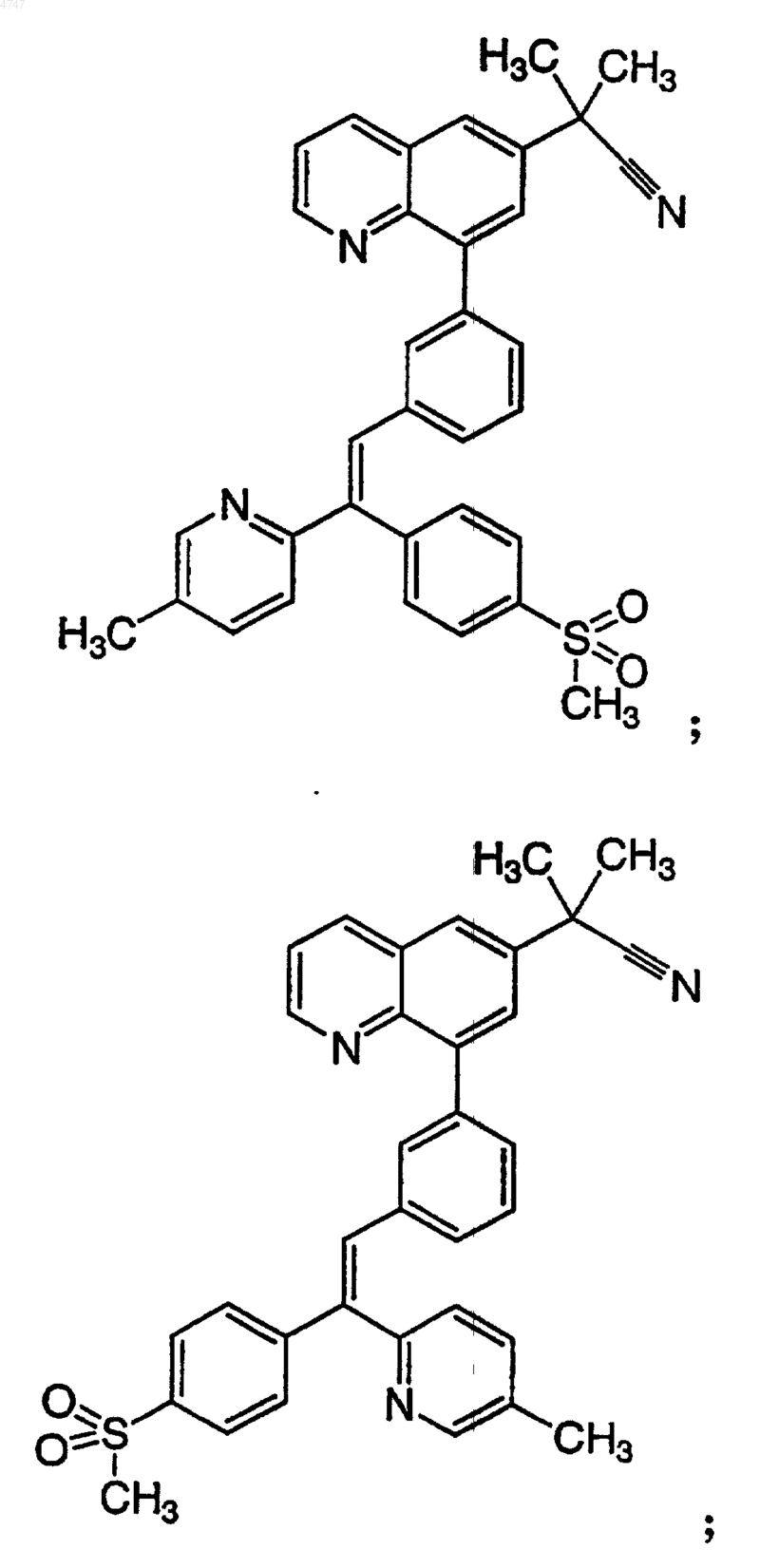
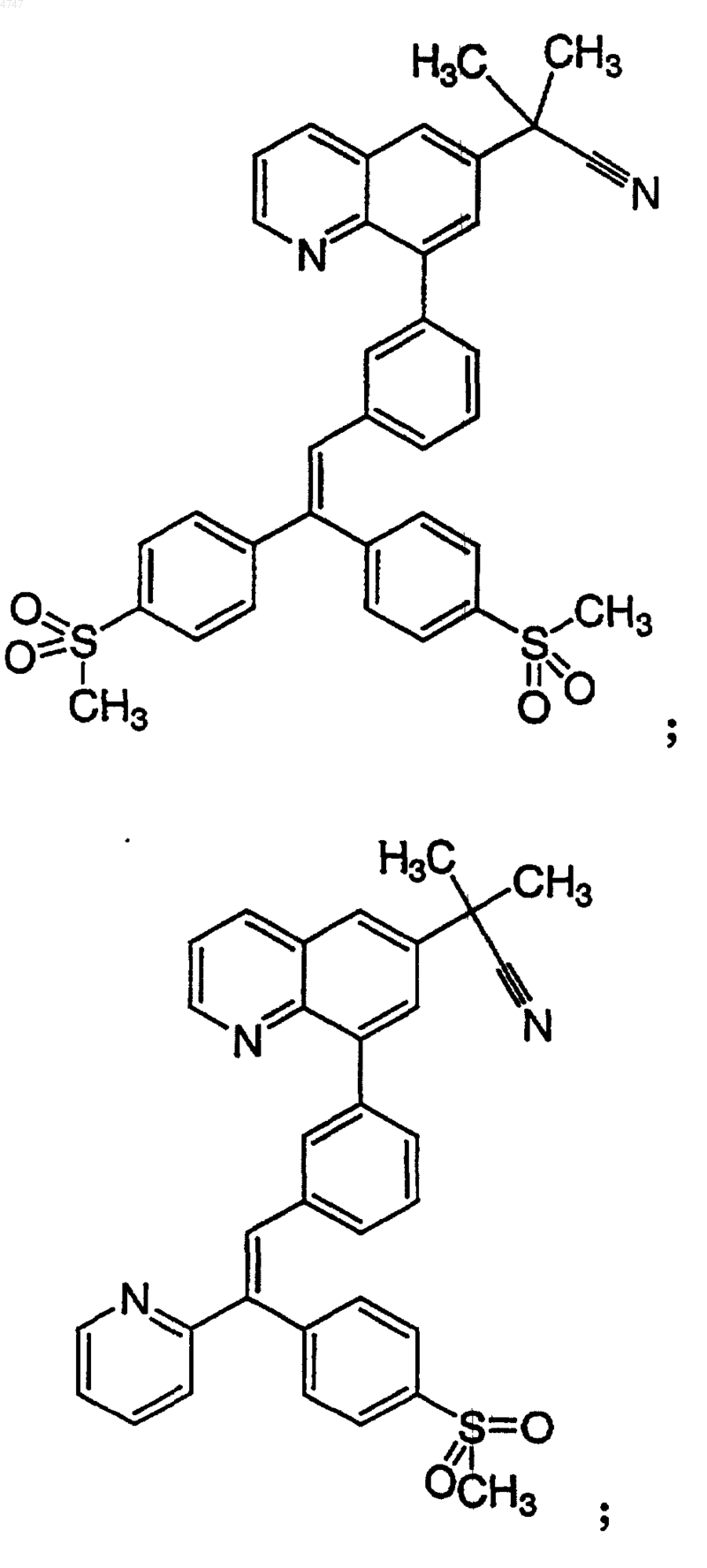

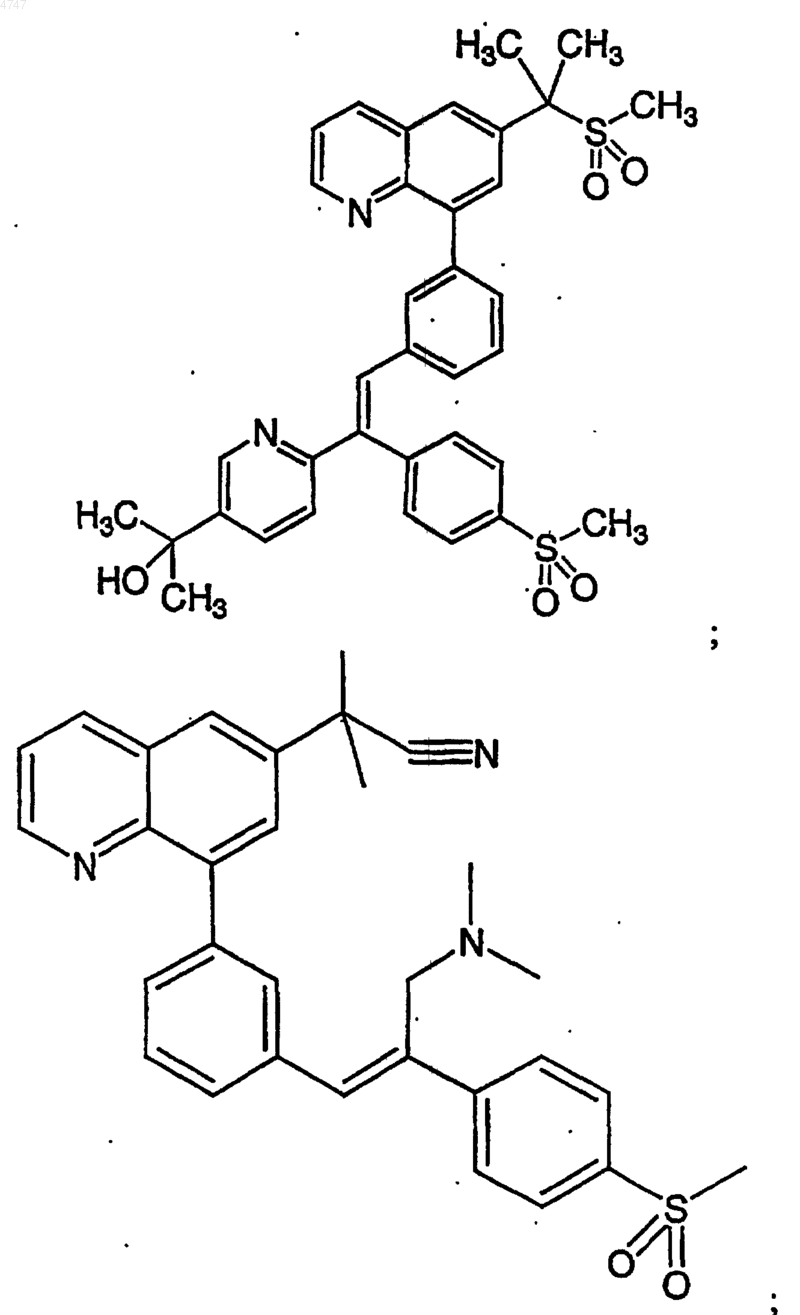
или его фармацевтически приемлемую соль.
5. 6-[1-Метил-1-(метилсульфонил)этил]-8-(3-{(E/Z)-2-(3-метил-1,2,4-оксадиазол-5-ил)-2-[4-(метилсульфонил)фенил]этенил}фенил)хинолин формулы
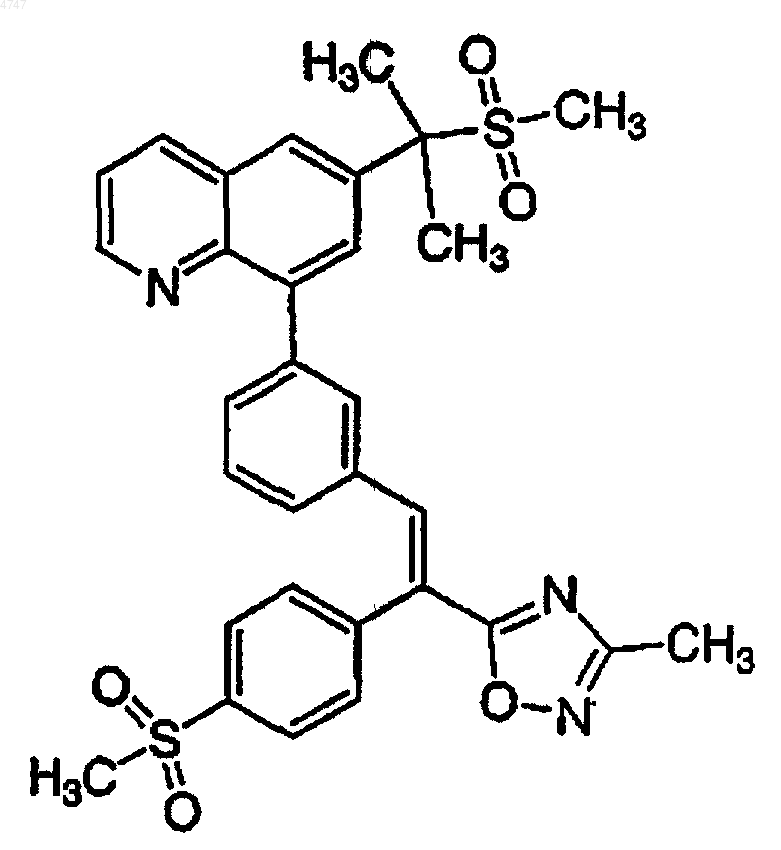
или его фармацевтически приемлемая соль.
6. Фармацевтическая композиция, содержащая терапевтически эффективное количество соединения формулы (I) по любому из пп.1-5 или его фармацевтически приемлемой соли; и фармацевтически приемлемый носитель.
7. Фармацевтическая композиция по п.6, дополнительно содержащая антагонист лейкотриеновых рецепторов, ингибитор биосинтеза лейкотриенов, антагонист M2/M3, кортикостероид, антагонист H1 рецептора или агонист бета 2 адренорецепторов.
8. Фармацевтическая композиция по п.6, дополнительно содержащая селективный ингибитор COX-2, статин или НСПВС.
9. Способ лечения или профилактики астмы, хронического бронхита, хронического обструктивного заболевания легких (ХОЗЛ), эозинофильной гранулемы, псориаза и других доброкачественных или злокачественных пролиферативных заболеваний кожи, эндотоксического шока (и связанных состояний, таких как ламинит и колики у лошадей), септического шока, язвенного колита, болезни Крона, повреждений миокарда и мозга, связанных с кровоснабжением, воспалительного артрита, остеопороза, хронического гломерулонефрита, атопического дерматита, крапивницы, респираторного дистресс-синдрома у взрослых, респираторного дистресс-синдрома у младенцев, хронического обструктивного легочного заболевания у животных, несахарного диабета, аллергического ринита, аллергического конъюнктивита, весеннего конъюнктивита, артериального рестеноза, атеросклероза, нейрогенного воспаления, боли, кашля, ревматоидного артрита, анкилозирующего спондилита, отторжения трансплантата и реакции "трансплантат против хозяина", гиперсекреции желудочного сока, сепсиса или септического шока, вызванного бактериальной, грибковой и вирусной инфекцией, воспаления и цитокин-связанной хронической дегенерации ткани, остеоартрита, рака, кахексии, мышечной слабости, депрессии, ухудшения памяти, монополярной депрессии, острых и хронических нейродегенеративных заболеваний с воспалительным компонентом, болезни Паркинсона, болезни Альцгеймера, травмы спинного мозга, ушиба головы, рассеянного склероза, опухолевого роста и раковой инвазии в нормальные ткани, включающий стадию введения терапевтически эффективного количества или профилактически эффективного количества соединения по п.1 или его фармацевтически приемлемой соли.
10. Способ лечения или профилактики астмы, хронического бронхита, хронического обструктивного заболевания легких (ХОЗЛ), эозинофильной гранулемы, псориаза и других доброкачественных или злокачественных пролиферативных заболеваний кожи, эндотоксического шока (и связанных состояний, таких как ламинит и колики у лошадей), септического шока, язвенного колита, болезни Крона, повреждений миокарда и мозга, связанных с кровоснабжением, воспалительного артрита, остеопороза, хронического гломерулонефрита, атопического дерматита, крапивницы, респираторного дистресс-синдрома у взрослых, респираторного дистресс-синдрома у младенцев, хронического обструктивного легочного заболевания у животных, несахарного диабета, аллергического ринита, аллергического конъюнктивита, весеннего конъюнктивита, артериального рестеноза, атеросклероза, нейрогенного воспаления, боли, кашля, ревматоидного артрита, анкилозирующего спондилита, отторжения трансплантата и реакции "трансплантат против хозяина", гиперсекреции желудочного сока, сепсиса или септического шока, вызванного бактериальной, грибковой и вирусной инфекцией, воспаления и цитокин-связанной хронической дегенерации ткани, остеоартрита, рака, кахексии, мышечной слабости, депрессии, ухудшения памяти, монополярной депрессии, острых и хронических нейродегенеративных заболеваний с воспалительным компонентом, болезни Паркинсона, болезни Альцгеймера, травмы спинного мозга, ушиба головы, рассеянного склероза, опухолевого роста и раковой инвазии в нормальные ткани, включающий в себя стадию формирования in vivo терапевтически эффективного количества или профилактически эффективного количества соединения по п.1.
11. Соединение формулы (I) по любому из пп.1-5 или его фармацевтически приемлемая соль для использования в качестве ингибиторов фосфодиэстеразы.
12. Применение соединения формулы (I) по любому из пп.1-5 или его фармацевтически приемлемой соли для использования в изготовлении лекарственного средства для лечения или профилактики астмы, хронического бронхита, хронического обструктивного заболеваэшя легких (ХОЗЛ), эозинофильной гранулемы, псориаза и других доброкачественных или злокачественных пролиферативных заболеваний кожи, эндотоксического шока (и связанных состояний, таких как ламинит и колики у лошадей), септического шока, язвенного колита, болезни Крона, повреждений миокарда и мозга, связанных с кровоснабжением, воспалительного артрита, остеопороза, хронического гломерулонефрита, атопического дерматита, крапивницы, респираторного дистресс-синдрома у взрослых, респираторного дистресс-синдрома у младенцев, хронического обструктивного легочного заболевания у животных, несахарного диабета, аллергического ринита, аллергического конъюнктивита, весеннего конъюнктивита, артериального рестеноза, атеросклероза, нейрогенного воспаления, боли, кашля, ревматоидного артрита, анкилозирующего спондилита, отторжения трансплантата и реакции "трансплантат против хозяина", гиперсекреции желудочного сока, сепсиса или септического шока, вызванного бактериальной, грибковой и вирусной инфекцией, воспаления и цитокин-связанной хронической дегенерации ткани, остеоартрита, рака, кахексии, мышечной слабости, депрессии, ухудшения памяти, монополярной депрессии, острых и хронических нейродегенеративных заболеваний своспалительным компонентом, болезни Паркинсона, болезни Альцгеймера, травмы спинного мозга, ушиба головы, рассеянного склероза, опухолевого роста и раковой инвазии в нормальные ткани, включающего в себя стадию введения терапевтически эффективного количества или профилактически эффективного количества соединения по п.1 или его фармацевтически приемлемой соли.
13. Фармацевтическая композиция, ингибирующая фосфодиэстеразу 4, включающая приемлемое ингибирующее фосфодиэстеразу 4 количество соединения формулы (I) по любому из пп.1-5 или его фармацевтически приемлемой соли в сочетании с фармацевтически приемлемым носителем.
Текст
1 Область изобретения Настоящее изобретение относится к соединениям, которые представляют собой замещенные 8-арилхинолины. В частности, данное изобретение относится к замещенным 8-арилхинолинам, которые являются ингибиторами фософодиэстеразы-4, где арильная группа в 8 положении содержит в качестве заместителя замещенную алкенильную группу. Предпосылки изобретения Гормоны представляют собой соединения,которые различным образом действуют на клеточную активность. Во многих отношениях гормоны действуют как мессенджеры специфических триггерных ответов и активности клетки. Однако множество эффектов, вызываемых гормонами, не являются результатом исключительного действия только гормона. Напротив, гормон сначала связывается с рецептором, таким образом, инициируя высвобождение вторичного соединения, которое затем действует на клеточную активность. По этой схеме гормон известен как первичный мессенджер, тогда как вторичное соединение называется вторичным мессенджером. Циклический аденозинмонофосфат (аденозин 3',5'-циклический монофосфат, цАМФ или циклический АМФ) известен как вторичный мессенджер гормонов, включая эпинефрин,глюкагон, кальцитонин, кортикотропин, липотропин, лютеинизирующий гормон, норэпинефрин, паратиреоидный гормон, тиреоидстимулирующий гормон и вазопрессин. Таким образом, цАМФ опосредует клеточные ответы на действие гормонов. Циклический АМФ также опосредует клеточные ответы на действие различных нейтромедиаторов. Фосфодиэстеразы (ФДЭ) относятся к семейству ферментов, которые метаболизируют 3',5'-циклические нуклеотиды до 5'-нуклеозидмонофосфатов, таким образом, ограничивая активность вторичного мессенджера цАМФ. Конкретная фосфодиэстераза, фосфодиэстераза-4(ФДЭ 4, также известная как ФДЭ-IV), которая является высокоаффинной, цАМФспецифичной ФДЭ типа IV, вызывает интерес в качестве возможного объекта для разработки новых противоастматических и противовоспалительных соединений. Известно, что ФДЭ 4 существует, по крайней мере, в виде четырех изоферментов, каждый из которых кодируется особым геном. Каждый из четырех известных генных продуктов ФДЭ 4, вероятно, играет различные роли в аллергических и/или воспалительных ответах. Таким образом, полагают, что ингибирование ФДЭ 4, в частности специфических изоформ ФДЭ 4, которые вызывают вредные реакции, может успешно влиять на симптомы аллергии и воспаления. Было бы желательно разаботать новые соединения и композиции,которые ингибировали бы активность ФДЭ 4. Главным моментом при использовании ингибиторов ФДЭ 4 является их побочный эффект(1998); и Burnouf описывают большое разнообразие серьезных нежелательных побочных эффектов, проявляемых некоторыми соединениями. Как описано М. D. Houslay et al., Adv. InPharmacol., 44:225-342 (1998) и D. Spina et al.,Adv. In Pharmacol., 44:33-89 (1998), существует огромный интерес к поиску терапевтических ингибиторов ФДЭ 4. В международной патентной публикацииWO 9422852 описаны хинолины в качестве ингибиторов ФДЭ 4. А. Н. Cook, et al., J. Chem. Soc, 413-417(1943) описали гамма-пиридилхинолины. Другие хинолиновые соединения описаны Kei Manabe et al., J. Org. Chem., 58(24) :6692-6700Am. Chem. Soc, 114 (17) :6940-6941 (1992). Соединения, которые включают в себя кольцевые системы, были описаны различными исследователями в качестве эффективных для различного лечебного и практического использования. Например, в международной патентной публикацииWO 98/25883 описаны кетобензамиды в качестве ингибиторов кальпаина, в европейской патентной публикацииЕР 811610 и в патентах США 5679712, 5693672 и 5747541 описаны замещенные бензоилгуанидины, блокирующие натриевые каналы, в патенте США 5736297 описана кольцевая система,используемая в качестве светочувствительной композиции. В патентах США 5491147, 5608070,5622977, 5739144, 5776958, 5780477, 5786354,5798373, 5849770, 5859034, 5866593, 5891896 и в международной патентной публикации WO 95/35283 описаны ингибиторы ФДЭ 4, которые являются тризамещенными арил или гетероарилфенилпроизводными. В патенте США 5580888 описаны ингибиторы ФДЭ 4, которые являются стирилпроизводными. В патенте США 5550137 описаны ингибиторы ФДЭ 4, которые являются фениламинокарбонилпроизводными. В патенте США 5340827 описаны ингибиторы ФДЭ 4, которые являются фенилкарбоксамидными соединениями. В патенте США 5780478 описаны ингибиторы ФДЭ 4, которые являются тетразамещенными фенилпроизводными. В международной патентной публикации WO 96/00215 описаны производные замещенного оксима, используемые в качестве ингибиторов ФДЭ 4. В патенте США 5633257 описаны ингибиторы ФДЭ 4, которые являются цикло(алкил и алкенил)фенилалкенил (арил и гетероарил) соединениями. 3 Однако остается потребность в новых соединениях и композициях, которые терапевтически ингибируют ФДЭ 4 с минимальными побочными эффектами. Сущность изобретения Настоящее изобретение относится к новым замещенным 8-арилхинолинам, которые являются ингибиторами ФДЭ 4, где арильная группа в 8-положении содержит в качестве заместителя замещенную алкенильную группу. Данное изобретение также относится к фармацевтической композиции, которая включает эффективное количество нового замещенного 8-арилхинолина и фармацевтически приемлемый носитель. Данное изобретение, кроме того, относится к способу лечения у млекопитающих, например,астмы, хронического бронхита, хронического обструктивного заболевания легких (ХОЗЛ),эозинофильной гранулемы, псориаза и других доброкачественных или злокачественных пролиферативных кожных заболеваний, эндотоксического шока (и связанных с ним состояний,таких как ламинит и колики у лошадей), септического шока, язвенного колита, болезни Крона,реперфузивных повреждений миокарда и мозга,воспалительного артрита, остеопороза, хронического гломерулонефрита, атопического дерматита, крапивницы, респираторного дистресссиндрома у взрослых, респираторного дистресссиндрома у младенцев, хронического обструктивного заболевания у животных, несахарного диабета, аллергического ринита, аллергического конъюнктивита, весеннего конъюнктивита, артериального рестеноза, атеросклероза, нейрогенного воспаления, боли, кашля, ревматоидного артрита, анкилозирующего спондилита, отторжения трансплантата и реакции трансплантат против хозяина, гиперсекреции желудочного сока, сепсиса или септического шока, вызванного бактериальной, грибковой и вирусной инфекцией, воспаления и цитокин-связанной хронической дегенерации ткани, остеоартрита,рака, кахексии, мышечной слабости, депрессии,ухудшения памяти, монополярной депрессии,острых и хронических нейродегенеративных заболеваний с воспалительным компонентом,болезни Паркинсона, болезни Альцгеймера,травмы спинного мозга, ушиба головы, рассеянного склероза, опухолевого роста и раковой инвазии в нормальные ткани путем введения эффективного количества нового замещенного 8-арилхинолина или соединения-предшественника, которое образует in vivo новый замещенный 8-арилхинолин. Краткое описание рисунков На фиг. 1 представлена схема химического изображения общей структуры соединений по настоящему изобретению. На фиг. 2 представлен график значения относительно Theta для порошковой дифракции рентгеновских лучей полиморфа формы А соли бензолсульфоновой кислоты 6-[1-метил-1 004747(метилсульфонил)этил]-8-[3-[(Е)-2-[3-метил-1,2,4-оксадиазол-5-ил]-2-[4-(метилсульфонил)фенил]этенил]фенил]хинолина. На фиг. 3 представлен график значения относительно Theta для порошковой дифракции рентгеновских лучей полиморфа формы В соли бензолсульфоновой кислоты 6-[1-метил-1(метилсульфонил)этил]-8-[3-[(Е)-2-[3-метил 1,2,4-оксадиазол-5-ил]-2-[4-(метилсульфонил) фенил]этенил]фенил]хинолина. На фиг. 4 представлено сравнение порошковой дифракции рентгеновских лучей полиморфа формы А (нижняя линия) и формы В(верхняя линия) соли бензолсульфоновой кислоты 6-[1-метил-1-(метилсульфонил)этил]-8[3-[(Е)-2-[3-метил-1,2,4-оксадиазол-5-ил]-2-[4(метилсульфонил)фенил]этенил]фенил]хинолина. На рис. 5 представлен график дифференциальных характерных пиков порошковой дифракции рентгеновских лучей полиморфа формы В соли бензолсульфоновой кислоты 6-[1 метил-1-(метилсульфонил)этил]-8-[3-[(Е)-2-[3 метил-1,2,4-оксадиазол-5-ил]-2-[4-(метилсульфонил)фенил]этенил]фенил]хинолина. На рис. 6 представлен график дифференциальных характерных пиков порошковой дифракции рентгеновских лучей полиморфа формы В соли бензолсульфоновой кислоты 6-[1 метил-1-(метилсульфонил)этил]-8-[3-[(Е)-2-[3 метил-1,2,4-оксадиазол-5-ил]-2-[4-(метилсульфонил)фенил]этенил]фенил]хинолина. Подробное оисание изобретения Соединение по данному изобретению представлено формулой (I) или его фармацевтически приемлемой солью,где S1, S2 и S3 независимо представляют собой Н, -ОН, галоген, -C1-С 6 алкил, -NO2, -CN или-C1-С 6 алкокси, где алкил и алкокси группы необязательно замещены 1-5 заместителями; где каждый заместитель независимо представляет собой галоген или ОН;(С 0-С 6 алкил)(С 0-С 6 алкил),-NH-SOn-(C1-С 6 алкил), -SOn-(C1-С 6 алкил), -(C1-С 6 алкил)-O-С(CN)диалкиламино или группу -(C1-С 6 алкил)-SOn(C1-С 6 алкил), где любая из групп необязательно 5 замещена 1-5 заместителями; где каждый заместитель независимо представляет собой галоген,-ОН, -CN, -C1-С 6 алкил, -циклоС 3-С 6 алкил,-С(О)(гетероциклоС 3-С 6 алкил), -С(О)-О-(С 0-С 6 алкил), -С(О)-арилокси, -C1-С 6 алкокси, -(С 0-С 6 алкил)(С 0-С 6 алкил)амино,циклоалкилокси,ацил, ацилокси, -циклоС 3-С 6 алкил, гетероциклоС 3-С 6 алкил, арил, гетероарил, карбонил, карбамоил или -SOn-(C1-С 6 алкил); А представляет собой СН, С-сложный эфир или C-R4;-C1-С 6 алкилациламиногруппу, где любая из групп необязательно замещена 1-5 заместителями, где каждый заместитель независимо представляет собой арил, гетероарил, галоген, -NO2,-С(О)ОН, карбонил, -CN, -C1-С 6 алкил, -SOn-(C1 С 6 алкил), -SOn-(арил), арилокси, -гетероарилокси, C1-С 6 алкокси, N-оксид, -С(О)-гетероцикло С 3-С 6 алкил, -NH-циклоС 3-С 6 алкил, амино, -ОН или -(С 0-С 6 алкил) (С 0-С 6 алкил)аминогруппу,группу заместителя -С(О)-N(С 0-С 6 алкил) (С 0 С 6 алкил), где каждый заместитель независимо необязательно замещен -ОН, C1-С 6 алкокси, -C1 С 6 алкилом, -циклоС 3-С 6 алкилом, арилокси,-С(О)ОН, -C(O)O(C1-С 6 алкил), галогеном, -NO2,-CN, -SOn-(C1-С 6 алкил) или -С(О)-N(С 0-С 6 алкил)(С 0-С 6 алкил); один из R2 и R3 должен быть арилом или гетероарилом, необязательно замещенными; когда R2 и R3 оба представляют собой арил или гетероарил, тогда R2 и R3 могут быть необязательно связаны с помощью тио, окси или (С 1 С 4 алкильного) мостика с образованием конденсированной трех-кольцевой системы;(С 0-С 6 алкил) или -C1-С 6 алкилациламиногруппу,где любая из групп необязательно замещена 1-5 заместителями, где каждый заместитель независимо представляет собой карбонил, -CN, галоген, -С(О)(С 0-С 6 алкил), -С(О)О(С 0-С 6 алкил),-C1-С 6 алкил, -SOn-(C1-С 6 алкил), -ОН, C1-С 6 алкокси или -(С 0-С 6 алкил) (С 0-С 6 алкил)аминогруппу;R2 или R3 могут быть необязательно присоединены связью к R4 с образованием кольца. В первом аспекте соединение по данному изобретению представлено формулой (I) или его фармацевтически приемлемой солью, гдеS1, S2 и S3 независимо представляют собой Н, -ОН, галоген, -C1-С 6 алкил, -NO2, -CN или-C1-С 6 алкокси, где алкил и алкокси группы необязательно замещены 1-5 заместителями; где каждый заместитель независимо представляет галоген или ОН;NH(гетероарил), -SOnNH(арил), -SOnNH(гетероарил),-SОnNH(C1-С 6 алкил),-С(О)N(С 0 С 6 алкил)(С 0-С 6 алкил),-NH-SOn-(C1-С 6 алкил),-SOn-(C1-С 6 алкил),-(C1-С 6 алкил)-О-С(CN)диалкиламино или группу -(C1-С 6 алкил)-SOn(C1-С 6 алкил), где любая из групп необязательно замещена 1-5 заместителями; где каждый заместитель независимо представляет галоген, -ОН,-CN, -C1-С 6 алкил, -циклоС 3-С 6 алкил, -С(О)(гетероциклоС 3-С 6 алкил),-С(О)-О-(С 0-С 6 алкил),-С(О)арилокси, -C1-С 6 алкокси, -(С 0-С 6 алкил)R2 и R3 независимо представляют арил, гетероарил, Н, галоген, -CN, -C1-С 6 алкил, гетероцикло-С 3-6 алкил, -С 1-С 6 алкокси, карбонил, карбамоил, -С(О)ОН, -(C1-С 6 алкил)-SOn-(C1-С 6 алкил),-С(О)N(C1-С 6 алкил)(C1-С 6 алкил) или группу -C1-С 6 алкилациламино, где любая из групп необязательно замещена 1-5 заместителями, где каждый заместитель независимо представляет арил, гетероарил, галоген, -NO2,-С(О)ОН, карбонил, -CN, -C1-С 6 алкил, -SOn-(C1 С 6 алкил), -SOn-(арил), -арилокси, -гетероарилокси, C1-С 6 алкокси, N-оксид, -С(О)-гетероциклоC1-С 6 алкил, -NН-циклоС 3-С 6 алкил, амино,-ОН или группу -(С 0-С 6 алкил)(С 0-С 6 алкил)амино, -С(О)-N(С 0-С 6 алкил)(С 0-С 6 алкил), где каждый заместитель независимо необязательно замещен -ОН, C1-С 6 алкокси, -C1-С 6 алкилом,-циклоС 3-С 6 алкилом,-арилокси,-С(О)ОН,-C(O)O(C1-С 6 алкил), галогеном, -NO2, -CN,-SOn-(C1-С 6 алкил) или -С(О)-N(С 0-С 6 алкил)(С 0 С 6 алкил); один из R2 и R3 должен быть арилом или гетероарилом, необязательно замещенным; когда R2 и R3 оба представляют собой арил или гетероарил, тогда R2 и R3 могут быть необязательно связаны с помощью тио, окси или(С 1-С 4 алкильного)мостика с образованием конденсированной трех-кольцевой системы; и n независимо равно 0, 1 или 2. В первом воплощении данного аспекта соединение по этому изобретению представлено формулой (I) или его фармацевтически приемлемой солью, гдеS1, S2, и S3 независимо представляют Н,-ОН, галоген, -C1-С 6 алкил, -NO2, -CN или -C1-С 6 алкокси, где алкил и алкокси группы необязательно замещены 1-5 заместителями; где каждый заместитель независимо представляет галоген или ОН;R1 представляет собой -C1-С 6 алкил, необязательно замещенный 1-5 заместителями; где каждый заместитель независимо представляет галоген, -ОН, -CN, -С(О)(гетероциклоС 3-С 6 алкил), -С(О)-О-(С 0-С 6 алкил), -С(О)-O-арил, алкокси, циклоалкилокси, ацил, ацилокси, -цикло С 3-С 6 алкил, гетероциклоС 3-С 6 алкил, арил, гетероарил, карбонил, карбамоил или -SOn-(C1 С 6 алкил), -(С 0-С 6 алкил)(С 0-С 6 алкил)амино; А представляет собой СН; R2 и R3 независимо представляют собой арил, гетероарил, Н, галоген, -CN, -C1-С 6 алкил, гетероциклоС 3-6 алкил,-C1-С 6 алкокси, карбонил, карбамоил, -С(О)ОН,-(C1-С 6 алкил)-SOn-(C1-С 6 алкил), -С(О)N(С 0-С 6 алкил)(С 0-С 6 алкил) или -C1-С 6 алкилациламиногруппу, где любая из групп необязательно замещена 1-5 заместителями, где каждый заместитель независимо представляет арил, гетероарил, галоген, -NO2, -С(О)ОН, карбонил, -CN,-C1-С 6 алкил, -SOn-(C1-С 6 алкил), -SOn-(арил), -Оарил, -О-гетероарил, C1-С 6 алкокси, N-оксид,-С(О)-гетероциклоС 3-С 6 алкил, -NH-циклоС 3-С 6 алкил, амино, -ОН или -(С 0-С 6 алкил)(С 0-С 6 алкил)амино,-С(О)-N(С 0-С 6 алкил)(С 0-С 6 алкил),где каждый заместитель независимо необязательно замещен -ОН, C1-С 6 алкокси, -C1-С 6 алкилом, -циклоС 3-С 6 алкилом, арилокси, -С(О) ОН, -С(О)О(C1-С 6 алкил), галогеном, -NO2, -CN,-SOn-(C1-С 6 алкил) или -С(О)-N(С 0-С 6 алкил)(С 0 С 6 алкил); один из R2 и R3 должен быть арилом или гетероарилом, необязательно замещенным; когда R2 и R3 оба представляют собой арил или гетероарил, тогда R2 и R3 могут быть необязательно связаны с помощью тио, окси или (С 1 С 4 алкильного) мостика с образованием конденсированной трех-кольцевой системы;n независимо равно 0, 1 или 2. В другом воплощении данного аспекта соединение по данному изобретению представлено формулой (I) или его фармацевтически приемлемой солью, гдеS1, S2 и S3 независимо представляют Н,-ОН, галоген, -C1-С 6 алкил, -NO2, -CN или -C1-С 6 алкокси, где указанные алкил и алкоксигруппы необязательно замещены 1-5 заместителями; где каждый заместитель независимо представляет собой галоген или ОН;R1 представляет собой -циклоС 3-С 6 алкил,необязательно замещенный 1-5 заместителями; где каждый заместитель независимо представляет собой галоген, -ОН, -CN, -С(О) (гетероциклоС 3-С 6 алкил), -С(О)-О-(С 0-С 6 алкил), -С(О)-Оарил, алкокси, циклоалкил окси, ацил, ацилокси,-циклоС 3-С 6 алкил,гетероциклоС 3-С 6 алкил,арил, гетероарил, карбонил, карбамоил или-C1-С 6 алкилациламиногруппу, где любая из групп необязательно замещена 1-5 заместителями, где каждый заместитель независимо представляет собой арил, гетероарил, галоген, -NO2,-С(О)ОН, карбонил, -CN, -C1-С 6 алкил, -SOn- (C1 С 6 алкил), -SOn-(арил), -O-арил, -О-гетероарил,C1-С 6 алкокси, N-оксид, -С(О)-гетероциклоС 3 С 6 алкил, -NH-циклоС 3-С 6 алкил, амино, -ОН или(С 0-С 6 алкил)(С 0-С 6 алкил), где каждый заместитель независимо необязательно замещен -ОН,C1-С 6 алкокси, -C1-С 6 алкилом, -циклоС 3-С 6 алкилом, арилокси, -С(О)ОН, -С(О)О(С 1-С 6 алкил),галогеном, -NO2, -CN, -SOn-(C1-С 6 алкил) или-С(О)-N(С 0-С 6 алкил)(С 0-С 6 алкил); один из R2 и R3 должен быть арилом или гетероарилом, необязательно замещенным; когда R2 и R3 оба представляют собой арил или гетероарил, тогда R2 и R3 могут быть необязательно связаны с помощью тио, окси или (С 1 С 4 алкильного) мостика с образованием конденсированной трех-кольцевой системы; и n независимо равно 0, 1 или 2. В следующем воплощении данного аспекта соединение по данному изобретению представлено формулой (I) или его фармацевтически приемлемой солью, гдеS1, S2 и S3 независимо представляют Н,-ОН, галоген, -C1-С 6 алкил, -NO2, -CN или -C1-С 6 алкокси, где указанные алкил и алкокси группы необязательно замещены 1-5 заместителями; где каждый заместитель независимо представляет галоген или ОН;R1 представляет собой -С 2-С 6 алкенил, необязательно замещенный 1-5 заместителями; где каждый заместитель независимо представляет галоген, -ОН, -CN, -С(О) (гетероциклоС 3 С 6 алкил), -С(О)-О-(С 0-С 6 алкил), -С(О)-O-арил,алкокси, циклоалкилокси, ацил, ацилокси,-циклоС 3-С 6 алкил,гетероциклоС 3-С 6 алкил,арил, гетероарил, карбонил, карбамоил или-C1-С 6 алкилациламиногруппу, где любая из групп необязательно замещена 1-5 заместителями, где каждый заместитель независимо представляет собой арил, гетероарил, галоген, -NO2,-С(О)ОН, карбонил, -CN, C1-С 6 алкил, -SOn-(C1 С 6)алкил, -SOn-(арил), -O-арил, -О-гетероарил,C1-С 6 алкокси, N-оксид, -С(О)-гетероциклоС 3 С 6 алкил, -NH-циклоС 3-С 6 алкил, амино, -ОН или группу -(С 0-С 6 алкил)(С 0-С 6 алкил)амино, -С(О)N(С 0-С 6 алкил)(С 0-С 6 алкил), где каждый заместитель независимо необязательно замещен -ОН,C1-С 6 алкокси, -C1-С 6 алкилом, -циклоС 3-С 6 алкилом, арилокси, -С(О)ОН, -С(O)O(С 1-С 6 алкил), 9 галогеном, -NO2, -CN, -SOn- (C1-С 6 алкил) или-С(О)-N(С 0-С 6 алкил)(С 0-С 6 алкил); один из R2 и R3 должен быть арилом или гетероарилом, необязательно замещенными; когда R2 и R3 оба представляют собой арил или гетероарил, тогда R2 и R3 могут быть необязательно связаны с помощью тио, окси или (С 1 С 4 алкильного) мостика с образованием конденсированной трех-кольцевой системы;n независимо равно 0, 1 или 2. В другом воплощении данного аспекта, соединение по данному изобретению представлено формулой (1) или его фармацевтически приемлемой солью, гдеS1, S2, и S3 независимо представляют Н,-ОН, галоген, -C1-С 6 алкил, -NO2, -CN или -C1-С 6 алкокси, где указанные алкил и алкокси группы необязательно замещены 1-5 заместителями; где каждый заместитель независимо представляет галоген или ОН;R1 представляет собой гетероарил, необязательно замещенный 1-5 заместителями; где каждый заместитель независимо представляет галоген, -ОН, -CN, -С(О)(гетероциклоС 3-С 6 алкил), -С(О)-О-(С 0-С 6 алкил), -С(О)-O-арил, алкокси, циклоалкилокси, ацил, ацилокси,-циклоС 3-С 6 алкил,гетероциклоС 3-С 6 алкил,арил, гетероарил, карбонил, карбамоил или-SOn-(C1-С 6 алкил); А представляет собой СН; R2 и R3 независимо представляют собой арил, гетероарил, Н, галоген, -CN, -C1-С 6 алкил, гетероциклоС 3-6 алкил, -C1-С 6 алкокси, карбонил, карбамоил, -С(О)ОН, -(C1-С 6 алкил) -SOn-(C1-С 6 алкил),-С(О)N(С 0-С 6 алкил)(С 0-С 6 алкил) или группу -C1-С 6 алкилациламино, где любая из групп необязательно замещена 1-5 заместителями, где каждый заместитель независимо представляет арил, гетероарил, галоген, -NO2,-С(О)ОН, карбонильную, -CN, -C1-С 6 алкильную, -SOn-(C1-С 6 алкил), -SОn-(арил), -арилокси,-О-гетероарильную, C1-С 6 алкокси, N-оксидную,-С(O)-гетероциклоС 3-С 6 алкильную, -NH-цикло С 3-С 6 алкильную, амино, -ОН или группу, -(С 0 С 6 алкил)(С 0-С 6 алкил) амино, -C(O)-N(C0-С 6 алкил)(С 0-С 6 алкил), где каждый заместитель независимо необязательно замещен -ОН, C1-С 6 алкокси, -C1-С 6 алкилом, -циклоС 3-С 6 алкилом,-арилокси, -С(О)ОН, -С(О)О(C1-С 6 алкил), галогеном, -NO2, -CN, -SOn-(C1-С 6 алкил) или -С(О)N(С 0-С 6 алкил)(С 0-С 6 алкил); один из R2 и R3 должен быть арилом или гетероарилом, необязательно замещенным; когда R2 и R3 оба представляют собой арил или гетероарил, тогда R2 и R3 могут быть необязательно связаны с помощью тио, окси или (С 1 С 4 алкильного) мостика с образованием конденсированной трех-кольцевой системы;n независимо представляет 0, 1 или 2. Еще в одном воплощении данного аспекта,соединение по данному изобретению представлено формулой (I) или его фармацевтически приемлемой солью, гдеS1, S2 и S3 независимо представляют Н,-ОН, галоген, -C1-С 6 алкил, -NO2, -CN или -C1-С 6 алкокси, где указанные алкил и алкокси группы необязательно замещены 1-5 заместителями; где каждый заместитель независимо представляет галоген или ОН;R1 представляет собой -амино, -C1-С 6 алкиламино или -(C1-С 6 алкил)(C1-С 6 алкил)аминогруппу, где любая из групп необязательно замещена 1-5 заместителями; где каждый заместитель независимо представляет галоген, -ОН,-CN, -С(О)(гетероциклоС 3-С 6 алкил), -С(О)-О(С 0-С 6 алкил), -С(О)-O-арил, алкокси, циклоалкилокси, ацил, ацилокси, -циклоС 3-С 6 алкил,гетероциклоС 3-С 6 алкил, арил, гетероарил, карбонил, карбамоил или -SOn-(С 1-С 6 алкил); А представляет собой СН;R2 и R3 независимо представляют собой арил, гетероарил, Н, галоген, -CN, -C1-С 6 алкил,гетероциклоС 3-6 алкил, -C1-С 6 алкокси, карбонил,карбамоил, -С(О)ОН, -(C1-С 6 алкил) -SOn-(C1-С 6 алкил), -С(О)N(С 0-С 6 алкил)(С 0-С 6 алкил) или-C1-С 6 алкилациламиногруппу, где любая из групп необязательно замещена 1-5 заместителями, где каждый заместитель независимо представляет собой арил, гетероарил, галоген, -NO2,-С(О)ОН, карбонил, -CN, -C1-С 6 алкил, SOn-(C1 С 6 алкил), -SOn-(арил), -арилокси, -О-гетероарил,C1-С 6 алкокси, N-оксид, -С(О)-гетероциклоС 3 С 6 алкил, -NH-циклоС 3-С 6 алкил, амино, -ОН или группу -(С 0-С 6 алкил)(С 0-С 6 алкил)амино, -С(О)N(С 0-С 6 алкил)(С 0-С 6 алкил), где каждый заместитель независимо необязательно замещен -ОН,C1-С 6 алкокси, -C1-С 6 алкилом, -циклоС 3-С 6 алкилом, -арилокси, -С(О)ОН, -C(O)O(C1-С 6 алкил),галогеном, -NO2, -CN, -SOn-(C1-С 6 алкил) или-С(О)-N(С 0-С 6 алкил) (С 0-С 6 алкил); один из R2 и R3 должен быть арилом или гетероарилом, необязательно замещенным; когда R2 и R3 оба представляют собой арил или гетероарил, то R2 и R3 могут быть необязательно связаны с помощью тио, окси или (С 1-С 4 алкильным) мостиком с образованием конденсированной трех-кольцевой системы;n независимо равно 0, 1 или 2. В воплощении данного аспекта соединение данного изобретения представлено формулой (I) или его фармацевтически приемлемой солью,гдеS1, S2 и S3 независимо представляют собой Н, -ОН, галоген, -C1-С 6 алкил, -NO2, -CN или C1 С 6 алкокси, где указанные алкил и алкокси группы необязательно замещены 1-5 заместителями; где каждый заместитель независимо представляет собой галоген или ОН;R1 представляет собой -C1-С 6 алкил, -цикло С 3-С 6 алкил, -С 1-С 6 алкенил, -C1-С 6 алкокси, арил,гетероарил,-CN,-гетероциклоС 3-С 6 алкил,-амино, -C1-С 6 алкиламино, -(C1-С 6 алкил)(C1-С 6 алкил)амино,-C1-С 6 алкил(окси)-C1-С 6 алкил,-С(О)NH(арил), -С(О)NH(гетероарил), -SOnNH(арил), -SOnNH (гетероарил), -SОnNH(C1-С 6 ал 11 кил), -С(О)N(С 0-С 6 алкил)(С 0-С 6 алкил), -NHSOn-(C1-С 6 алкил), -SOn-(C1-С 6 алкил), -карбамоил, -(C1-С 6 алкил)-O-С(CN)-диалкиламино или группу -(C1-С 6 алкил)-SOn-(C1-С 6 алкил), где любая из групп необязательно замещена 1-5 заместителями; где каждый заместитель независимо представляет собой галоген, -ОН, -CN, алкокси,циклоалкилокси, ацил, ацилокси, -циклоС 3-С 6 алкил, гетероциклоС 3-С 6 алкил, арил, гетероарил, карбонил, карбамоил или -SOn-(C1-С 6 алкил); А представляет собой СН;R2 представляет собой арил, необязательно замещенный 1-5 заместителями, где каждый заместитель независимо представляет арил, гетероарил, галоген, -NO2, -С(О)ОН, карбонил,-CN, -C1-С 6 алкил, -SOn-(C1-С 6 алкил), -SОn(арил), -арилокси, -O-гетероарил, C1-С 6 алкокси,N-оксид, -С(O)-гетероциклоС 3-С 6 алкил, -NHциклоС 3-С 6 алкил, амино, -ОН или - (С 0-С 6 алкил)(С 0-С 6 алкил), где каждый заместитель независимо необязательно замещен -ОН, C1-С 6 алкокси, -C1-С 6 алкилом, -циклоС 3-С 6 алкилом, -арилокси, -С(О)ОН, -C(O)O(C1-С 6 алкил), галогеном,-NO2, -CN, -SOn-(C1-С 6 алкил) или -C(O)-N-(С 0 С 6 алкил)(С 0-С 6 алкил);R3 представляет собой гетероарил, необязательно замещенный 1-5 заместителями, где каждый заместитель независимо представляет собой арил, гетероарил, галоген, -NO2, -С(О)ОН,карбонил, -CN, -C1-С 6 алкил, -SOn-(C1-С 6 алкил), SOn-(арил), -арилокси, -O-гетероарил, C1-С 6 алкокси, N-оксид, -С(O)-гетероциклоС 3-С 6 алкил, -NH-циклоС 3-С 6 алкил, амино, -ОН или группу -(С 0-С 6 алкил)(С 0-С 6 алкил)амино, -С(О)N(С 0-С 6 алкил)(С 0-С 6 алкил), где каждый заместитель независимо необязательно замещен -ОН,C1-С 6 алкокси, -C1-С 6 алкилом, -циклоС 3-С 6 алкилом, -арилокси, -С(О)ОН, -С(О)О(C1-С 6 алкил),галогеном, -NO2, -CN, -SOn-(C1-С 6 алкил) илиn независимо равно 0, 1 или 2. Еще в одном воплощении данного аспекта соединение по данному изобретению представлено формулой (I) или его фармацевтически приемлемой солью, гдеS1, S2 и S3 независимо представляют собой Н, -ОН, галоген, -C1-С 6 алкил, -NO2, -CN или-C1-С 6 алкокси, где указанные алкил и алкокси группы необязательно замещены 1-5 заместителями; где каждый заместитель независимо представляет галоген или ОН; 12 кил),-карбамоил,-(C1-С 6 алкил)-O-С(CN)диалкиламино или группу -(C1-С 6 алкил)-SOn(C1-С 6 алкил), где любая из групп необязательно замещена 1-5 заместителями; где каждый заместитель независимо представляет галоген, -ОН,-CN, -С(О)(гетероциклоС 3-С 6 алкил), -С(О)-О(С 0-С 6 алкил), -С(О)-O-арил, алкокси, циклоалкилокси, ацил, ацилокси, -циклоС 3-С 6 алкил,гетероциклоС 3-С 6 алкил, арил, гетероарил, карбонил, карбамоил или -SOn-(C1-С 6 алкил); А представляет собой СН;R2 представляет собой арил, необязательно замещенный 1-5 заместителями, где каждый заместитель независимо представляет арил, гетероарил, галоген, -NO2, -С(О)ОН, карбонильную, -CN, -C1-С 6 алкил, -SOn-(C1-С 6 алкил), -SOn(арил), -арилокси, -О-гетероарил, C1-С 6 алкокси,N-оксид, -С(О)-гетероциклоС 3-С 6 алкил, -NHциклоС 3-С 6 алкил, амино, -ОН или группу -(С 0 С 6 алкил)(С 0-С 6 алкил)амино, -С(О)-N(С 0-С 6 алкил)(С 0-С 6 алкил), где каждый заместитель независимо необязательно замещен -ОН, C1-С 6 алкокси, -C1-С 6 алкилом, -циклоС 3-С 6 алкилом,-арилокси, -С(О)ОН, -С(O)O(С 1-С 6 алкил), галогеном, -NO2, -CN, -SOn-(C1-С 6 алкил) или -С(О)N(С 0-С 6 алкил)(С 0-С 6 алкил);R3 представляет собой арил, необязательно замещенный 1-5 заместителями, где каждый заместитель независимо представляет собой арил, гетероарил, галоген, -NO2, -С(О)ОН, карбонил, -CN, -C1-С 6 алкил, -SOn-(C1-С 6 алкил),-SOn-(арил), -арилокси, -О-гетероарил, C1-С 6 алкокси, N-оксид, -С(О)-гетероциклоС 3-С 6 алкил, -NH-циклоC3-С 6 алкил, амино, -ОН или группу -(С 0-С 6 алкил)(С 0-С 6 алкил)амино, -С(О)N(C0-С 6 алкил)(С 0-С 6 алкил),где каждый заместитель независимо необязательно замещен -ОН, C1-С 6 алкокси, -C1-С 6 алкилом,-циклоС 3-С 6 алкилом,-арилокси,-С(О)ОН, -С(O)O(C1-С 6 алкил), галогеном, -NO2,-CN, -SOn-(C1-С 6 алкил) или -С(О)-N(С 0-С 6 алкил)(С 0-С 6 алкил); иn независимо равно 0, 1 или 2. И еще в одном воплощении данного аспекта соединение по данному изобретению представлено формулой (I) или его фармацевтически приемлемой солью, гдеS1, S2 и S3 независимо представляют Н,-ОН, галоген, -C1-С 6 алкил, -NO2, -CN или -C2 С 6 алкокси, где указанные алкил и алкокси группы необязательно замещены 1-5 заместителями; где каждый заместитель независимо представляет галоген или ОН;(С 0-С 6 алкил), -NH-SOn-(C1-С 6 алкил), -SOn-(C1 13 С 6 алкил), -карбамоил, -(C1-С 6 алкил)-O-С(CN)диалкиламино или группу -(С 1-С 6 алкил)-SOn(C1-С 6 алкил), где любая из групп необязательно замещена 1-5 заместителями; где каждый заместитель независимо представляет собой галоген,-ОН, -CN, -С(О) (гетероциклоC3-С 6 алкил),-С(O)-O-(С 0-С 6 алкил), -С(О)-O-арил, алкокси,циклоалкилокси, ацил, ацилокси, -циклоС 3-С 6 алкил, гетероциклоС 3-С 6 алкил, арил, гетероарил, карбонил, карбамоил или -SOn-(С 1-С 6 алкил); А представляет собой СН;R2 представляет собой карбонил, необязательно замещенный 1 заместителем, где замеситель представляет собой арил, гетероарил,-С(О)ОН, карбонил, -С 1-С 6 алкил, -O-арил, -Огетероарил, -О-(C1-С 6 алкил), -гетероциклоС 3-С 6 алкил, -NH-циклоС 3-С 6 алкил, амино, -ОН или-(С 0-С 6 алкил)(С 0-С 6 алкил)аминогруппу, где каждый заместитель независимо необязательно замещен -ОН, -О(C1-С 6 алкил), -C1-С 6 алкилом,-циклоС 3-С 6 алкилом, -О(арил), -С(О)ОН, -С(О) О(С 1-С 6 алкил), галогеном, -NO2, -CN, -SOn-(C1 С 6 алкил), -циклоС 3-С 6 алкилом или -С(О)-N(С 0 С 6 алкил)(С 0-С 6 алкил);R3 представляет собой арил, необязательно замещенный 1-5 заместителями, где каждый заместитель независимо представляет собой арил, гетероарил, галоген, -NO2, -С(О)ОН, карбонил, -CN, -С 1-С 6 алкил, -SOn-(C1-С 6 алкил),-SOn-(арил), -арилокси, -О-гетероарил, С 1-С 6 алкокси, N-оксид, -С(О)-гетероциклоС 3-С 6 алкил, -NH-циклоС 3-С 6 алкил, амино, -ОН или группу -(С 0-С 6 алкил)(С 0-С 6 алкил)амино, -С(О)N(С 0-С 6 алкил)(С 0-С 6 алкил), где каждый заместитель независимо необязательно замещен -ОН,С 1-С 6 алкокси, -С 1-С 6 алкилом, -циклоС 3-С 6 алкилом, -арилокси, -С(О)ОН, -С(O)O(С 1-С 6 алкил),галогеном, -NO2, -CN, -SOn-(С 1-С 6 алкил) илиn независимо равно 0, 1 или 2. В следующем воплощении данного аспекта соединение по данному изобретению представлено формулой (I) или его фармацевтически приемлемой солью, гдеS1, S2 и S3 независимо представляют собой Н, -ОН, галоген, -С 1-С 6 алкил, -NO2, -CN или-С 1-С 6 алкокси, где указанные алкил и алкокси группы необязательно замещены 1-5 заместителями; где каждый заместитель независимо представляет собой галоген или ОН; 14 С 6 алкил), где любая из групп необязательно замещена 1-5 заместителями; где каждый заместитель независимо представляет собой галоген,-ОН, -CN, -С(О)(гетероциклоС 3-С 6 алкил), -С(O)O-(С 0-С 6 алкил), -С(О)-O-арил, алкокси, циклоалкилокси, ацил, ацилокси, -циклоС 3-С 6 алкил,гетероциклоС 3-С 6 алкил, арил, гетероарил, карбонил, карбамоил или -SOn-(С 1-С 6 алкил); А представляет собой СН;R2 представляет собой карбамоил, необязательно замещенный 1-2 заместителями, где каждый заместитель независимо представляет собой карбонил, -CN, -С 1-С 6 алкил, -SOn-(С 1-С 6 алкил), -О-арил, -О-гетероарил, -С(О)-гетероциклоС 3-С 6 алкил, -NH-циклоС 3-С 6 алкил, амино,-ОН или группу -С 1-С 6 алкил(амино), где каждый заместитель независимо необязательно замещен -ОН, -О(С 1-С 6 алкил), -О(арил), -СООН,-СOO(С 1-С 6 алкил), галогеном, -NO2, -CN илиR3 представляет собой арил, необязательно замещенный 1-5 заместителями, где каждый заместитель независимо представляет собой арил, гетероарил, галоген, -NO2, -С(О)ОН, карбонил, -CN, -С 1-С 6 алкил, -SOn-(С 1-С 6 алкил),-SОn-(арил), -арилокси, -О-гетероарил, С 1-С 6 алкокси, N-оксид, -С(О)-гетероциклоС 3-С 6 алкил, -NH-циклоС 3-С 6 алкил, амино, -ОН или группу -(С 0-С 6 алкил)(С 0-С 6 алкил)амино, -С(О)N(С 0-С 6 алкил)(С 0-С 6 алкил), где каждый заместитель независимо необязательно замещен -ОН,С 1-С 6 алкокси, -С 1-С 6 алкилом, -циклоС 3-С 6 алкилом, -арилокси, -С(О)ОН, -С(О)О(С 1-С 6 алкил),галогеном, -NO2, -CN, -SOn-(С 1-С 6 алкил) илиn независимо представляет 0, 1 или 2. В другом воплощении данного аспекта соединение по данному изобретению представлено формулой (I) или его фармацевтически приемлемой солью, гдеS1, S2 и S3 независимо представляют собой Н, -ОН, галоген, -С 1-С 6 алкил, -NO2, -CN или-С 1-С 6 алкокси, где указанные алкил и алкокси группы необязательно замещены 1-5 заместителями; где каждый заместитель независимо представляет собой галоген или ОН;(CN)-диалкиламино или группу -(С 1-С 6 алкил)SOn-(С 1-С 6 алкил), где любая из групп необязательно замещена 1-5 заместителями; где каждый заместитель независимо представляет галоген, ОН,-CN,-С(О)(гетероциклоС 3-С 6 алкил),-С(O)-O-(С 0-С 6 алкил), -С(О)-О-арил, алкокси, 15 циклоалкилокси, ацил, ацилокси, -циклоС 3-С 6 алкил, гетероциклоС 3-С 6 алкил, арил, гетероарил, карбонил, карбамоил или -SOn-(С 1-С 6 алкил); А представляет собой СН;R2 и R3 каждый независимо представляют собой необязательно замещенный арил, связаны между собой тио, окси или (С 1-С 4 алкил)ьным мостиком с образованием конденсированной трех-кольцевой системы; иn независимо равно 0, 1 или 2. Еще в одном воплощении данного аспекта соединение по данному изобретению представлено формулой (I) или его фармацевтически приемлемой солью, где(С 0-С 6 алкил), -NH-SOn-(С 1-С 6 алкил), -SOn-(С 1-С 6 алкил), -карбамоил, -(С 1-С 6 алкил) -O-С(CN)диалкиламино или группу -(С 1-С 6 алкил)-SOn(С 1-С 6 алкил), где любая из групп необязательно замещена 1-5 заместителями; где каждый заместитель независимо представляет собой галоген,-ОН, -CN, -С(О)(гетероциклоС 3-С 6 алкил), -С(O)O-(С 0-С 6 алкил), -С(О)-О-арил, алкокси, циклоалкилокси, ацил, ацилокси, -циклоС 3-С 6 алкил,гетероциклоС 3-С 6 алкил, арил, гетероарил, карбонил, карбамоил или -SOn-(С 1-С 6 алкил); А представляет собой СН;R2 представляет собой -(С 1-С 6 алкил)-SOn(С 1-С 6 алкил), необязательно замещенный 1-5 заместителями, где каждый заместитель независимо представляет собой галоген, -NO2, -COOH,карбонил, -CN, -С 1-С 6 алкил, -SOn-(С 1-С 6 алкил), О-арил, -О-гетероарил, -С(О)-гетероциклоС 3 С 6 алкил, -NH-циклоС 3-С 6 алкил, амино, -ОН или группу -С 1-С 6 алкил(амино), где каждый заместитель независимо необязательно замещен -ОН,-О(С 1-С 6 алкил), -О(арил), -СООН, -СOO(С 1-С 6 алкил), галогеном, -NO2, -CN или C(O)-N(C0-С 6 алкил)(С 0-С 6 алкил);R3 представляет собой арил, необязательно замещенный 1-5 заместителями, где каждый заместитель независимо представляет собой арил, гетероарил, галоген, -NO2, -С(О)ОН, карбонил, -CN, -С 1-С 6 алкил, -SOn- (С 1-С 6 алкил),-SOn-(арил), -арилокси, -О-гетероарил, С 1-С 6 алкокси, N-оксид, -С(О)-гетероциклоС 3-С 6 алкил, -NH-циклоС 3-С 6 алкил, амино, -ОН или группу (С 0-С 6 алкил)(С 0-С 6 алкил)амино, -С(О)-N(С 0-С 6 алкил)(С 0-С 6 алкил), где каждый заместитель независимо необязательно замещен -ОН,С 1-С 6 алкокси, -С 1-С 6 алкилом, циклоС 3-С 6 алки 004747n независимо равно 0, 1 или 2. В еще одном воплощении данного аспекта соединение по данному изобретению представлено формулой (I) или его фармацевтически приемлемой солью, гдеS1, S2 и S3 независимо представляют собой Н, -ОН, галоген, -С 1-С 6 алкил, -NO2, -CN или С 1 С 6 алкокси, где указанные алкил и алкокси группы необязательно замещены 1-5 заместителями; где каждый заместитель независимо представляет галоген или ОН;(окси)С 1-С 6 алкил, -С(О)NH(арил), -С(О)NH(гетероарил), -SOnNH(арил), -SOnNH(гетероарил),-SOnNH(С 1-С 6 алкил), -С(О)N(С 0-С 6 алкил)(С 0-С 6 алкил), -NH-SOn-(С 1-С 6 алкил), -SOn-(С 1-С 6 алкил),-карбамоил,-(С 1-С 6 алкил)-O-С(CN)диалкиламино или группу -(С 1-С 6 алкил)-SOn(С 1-С 6 алкил), где любая из групп необязательно замещена 1-5 заместителями; где каждый заместитель независимо представляет собой галоген,-ОН, -CN, -С(О)(гетероциклоС 3-С 6 алкил), -С(O)O-(С 0-С 6 алкил), -С(О)-O-арил, алкокси, циклоалкилокси, ацил, ацилокси, -циклоС 3-С 6 алкил,гетероциклоС 3-С 6 алкил, арил, гетероарил, карбонил, карбамоил или SOn-(С 1-С 6 алкил); А представляет собой СН;R2 представляет собой -С(O)N-(С 0-С 6 алкил)(С 0-С 6 алкил), необязательно замещенный 15 заместителями, где каждый заместитель независимо представляет собой галоген, -NO2,-СООН, карбонил, -CN, -С 1-С 6 алкил, -SOn-(С 1 С 6 алкил), арилокси, -гетероарилокси, -С(О)гетероциклоС 3-С 6 алкил, -NH-циклоС 3-С 6 алкил,амино, -ОН или группу -С 1-С 6 алкил (амино), где каждый заместитель независимо необязательно замещен -ОН, -О(C1-С 6 алкил), -О(арил), -СООН,-СOO(С 1-С 6 алкил), галогеном, -NO2, -CN или С(О)-N(С 0-С 6 алкил) (С 0-С 6 алкил);R3 представляет собой арил, необязательно замещенный 1-5 заместителями, где каждый заместитель независимо представляет собой арил, гетероарил, галоген, -NO2, -С(О)ОН, карбонил, -CN, -С 1-С 6 алкил, -SOn-(С 1-С 6 алкил),-SOn-(арил), -арилокси, -О-гетероарил, С 1-С 6 алкокси, N-оксид, -С(О)-гетероциклоС 3-С 6 алкил, -NH-циклоС 3-С 6 алкил, амино, -ОН или группу (С 0-С 6 алкил)(С 0-С 6 алкил)амино, -С(О)N(С 0-С 6 алкил)(С 0-С 6 алкил), где каждый заместитель независимо необязательно замещен -ОН,С 1-С 6 алкокси, -С 1-С 6 алкилом, -циклоС 3-С 6 алкилом, -арилокси, -С(О)ОН, -С(O)O(С 1-С 6 алкил), галогеном, -NO2, -CN, -SOn-(С 1-С 6 алкил) или -С (О)-N(С 0-С 6 алкил)(С 0-С 6 алкил); и 17 Еще в одном воплощении данного аспекта соединение по данному изобретению представлено формулой (I) или его фармацевтически приемлемой солью, гдеS1, S2 и S3 независимо представляют собой Н, -ОН, галоген, -С 1-С 6 алкил, -NO2, -CN или С 1 С 6 алкокси, где указанные алкил и алкокси группы необязательно замещены 1-5 заместителями; где каждый заместитель независимо представляет собой галоген или ОН;(окси)С 1-С 6 алкил, -С(О)NH(арил), -С(О)NH(гетероарил), -SOnNH(арил), -SOnNH(гетероарил),-SOnNH(С 1-Сбалкил), -С(О)N(С 0-С 6 алкил)(С 0-С 6 алкил), -NH-SOn-(С 1-С 6 алкил), -SOn-(С 1-С 6 алкил),-карбамоил,-(С 1-С 6 алкил)-O-С(CN)диалкиламино или группу -(С 1-С 6 алкил)-SOn(С 1-С 6 алкил), где любая из групп необязательно замещена 1-5 заместителями; где каждый заместитель независимо представляет собой галоген,-ОН, -CN, -С(О)(гетероциклоС 3-С 6 алкил), -С(O)O-(С 0-С 6 алкил), -С(О)-О-арил, алкокси, циклоалкилокси, ацил, ацилокси, -циклоС 3-С 6 алкил,гетероциклоС 3-С 6 алкил, арил, гетероарил, карбонил, карбамоил или SOn-(С 1-С 6 алкил); А представляет собой СН;R3 представляет собой арил, необязательно замещенный 1-5 заместителями, где каждый заместитель независимо представляет собой арил, гетероарил, галоген, -NO2, -С(О)ОН, карбонил, -CN, -С 1-С 6 алкил, -SOn-(С 1-С 6 алкил),-SOn-(арил), -арилокси, -О-гетероарил, С 1-С 6 алкокси, N-оксид, -С(О)-гетероциклоС 3-С 6 алкил, -NH-циклоС 3-С 6 алкил, амино, -ОН или группу (С 0-С 6 алкил)(С 0-С 6 алкил)амино, -С(О)-N(С 0-С 6 алкил)(С 0-С 6 алкил), где каждый заместитель независимо необязательно замещен -ОН,С 1-С 6 алкокси, -С 1-С 6 алкилом, -циклоС 3-С 6 алкилом, -арилокси, -С(О)ОН, -С(O)O(С 1-С 6 алкил),галогеном, -NO2, -CN, -SOn-(С 1-С 6 алкил) илиn независимо равно 0, 1 или 2. Еще в одном воплощении данного аспекта соединение по данному изобретению представлено формулой (I) или его фармацевтически приемлемой солью, гдеS1, S2 и S3 независимо представляют Н,-ОН, галоген, -С 1-С 6 алкил, -NO2, -CN или С 1-С 6 алкокси, где указанные алкил и алкокси группы необязательно замещены 1-5 заместителями; где каждый заместитель независимо представляет галоген или ОН;R1 представляет собой -С 1-С 6 алкил, необязательно замещенный 1-5 заместителями; где каждый заместитель независимо представляет собой галоген, -ОН, -CN, -С 1-С 6 алкил, -циклоС 3 С 6 алкил, -С(О)(гетероциклоС 1-С 6 алкил), -С(О) 004747 18 О-(С 0-С 6 алкил), -С(О)-арилокси, -С 1-С 6 алкокси,-(С 0-С 6 алкил)(С 0-С 6 алкил)амино,циклоалкилокси, ацил, ацилокси, -цикло С 3-С 6 алкил, гетероциклоС 3-С 6 алкил, арил, гетероарил, карбонил, карбамоил или SOn-(С 1-С 6 алкил); А представляет собой СН,R2 и R3 каждый независимо представляет собой арил или гетероарил, где каждый необязательно замещен 1-5 заместителями, где каждый заместитель независимо представляет собой арил, гетероарил, галоген, -NO2, -С(О)ОН,карбонил, -CN, -С 1-С 6 алкил, -SOn-(С 1-С 6 алкил), SOn-(арил), арилокси, -гетероарилокси, С 1 С 6 алкокси, N-оксид, -С(О)-гетероциклоС 3-С 6 алкил, -NH-циклоС 3-С 6 алкил, амино, -ОН или группу -(С 0-С 6 алкил)(С 0-С 6 алкил)амино, -С(О)N(С 0-С 6 алкил)(С 0-С 6 алкил), где каждый заместитель независимо необязательно замещен -ОН,С 1-С 6 алкокси, -С 1-С 6 алкилом, -циклоС 3-С 6 алкилом, арилокси, -С(О)ОН, -С(О)О(С 1-С 6 алкил),галогеном, -NO2, -CN, -SOn-(С 1-Сбалкил) илиR2 и R3 необязательно могут быть соединены тио, окси или (С 1-С 4 алкильным)мостиком с образованием конденсированной трехкольцевой системы; иn независимо равно 0, 1 или 2; Еще в одном воплощении данного аспекта соединение по данному изобретению представлено формулой (I) или его фармацевтически приемлемой солью, гдеS1, S2 и S3 каждый представляют собой Н;R1 представляют собой -С 1-С 6 алкил, необязательно замещенный 1-5 заместителями; где каждый заместитель независимо представляет собой галоген, -ОН, -CN, -С 1-С 6 алкил,-циклоС 3-С 6 алкил, -С(О)(гетероциклоС 3-С 6 алкил), -С(О)-О-(С 0-С 6 алкил), -С(О)-арилокси,-С 1-С 6 алкокси, -(С 0-С 6 алкил)(С 0-С 6 алкил)амино,циклоалкилокси, ацил, ацилокси, -циклоС 3-С 6 алкил, гетероциклоС 3-С 6 алкил, арил, гетероарил, карбонил, карбамоил или SOn-(С 1-С 6 алкил); А представляет собой СН,R2 и R3 каждый независимо представляет собой арил или гетероарил, где каждый необязательно замещен 1-5 заместителями, где каждый заместитель независимо представляет арильную, гетероарил, галоген, -NO2, -С(О)ОН,карбонил, -CN, -С 1-С 6 алкил, -SOn-(С 1-С 6 алкил), SOn-(арил), арилокси, -гетероарилокси, С 1-С 6 алкокси, N-оксид, -С(О)-гетероциклоС 3-С 6 алкил, -NH-циклоС 3-С 6 алкил, амино, -ОН или группу -(С 0-С 6 алкил)(С 0-С 6 алкил)амино, -С(О)N(С 0-С 6 алкил)(С 0-С 6 алкил), где каждый заместитель независимо необязательно замещен -ОН,С 1-С 6 алкокси, -С 1-С 6 алкилом, -циклоС 3-С 6 алкилом, арилокси, -С(О)ОН, -C(O)O(С 1-С 6 алкил),галогеном, -NO2, -CN, -SOn-(С 1-С 6 алкил) илиR2 и R3 необязательно могут быть связаны с помощью тио, окси или (С 1-С 4 алкильного) мостика с образованием конденсированной трех-кольцевой системы; иn независимо равно 0, 1 или 2; Как используется здесь, алкил, а также другие группы, имеющие приставку алк, такие как, например, алкокси, алканоил, алкенил,алкинил и тому подобное, означают углеродные цепи, которые могут быть линейными или разветвленными или их сочетания. Примеры алкильных групп включают метил, этил, пропил,изопропил, бутил, втор- и трет-бутил, пентил,гексил, гептил и тому подобное. Алкенил,алкинил и другие подобные термины включают углеродные цепи, содержащие, по крайней мере, одну ненасыщенную С-С связь. Термин циклоалкил означает карбоциклы, не содержащие гетероатомы, и включает моно-, би- и трициклические насыщенные карбоциклы, а также конденсированные кольцевые системы. Такие конденсированные кольцевые системы могут включать в себя одно кольцо,которое частично или полностью ненанасыщено, такое как бензольное кольцо, с образованием конденсированных кольцевых систем, таких как бензоконденсированные карбоциклы. Циклоалкил включает в себя такие конденсированные кольцевые системы, как спироконденсированные кольцевые системы. Примеры циклоалкила включают циклопропил, циклобутил, циклопентил, циклогексил, декагидронафталин,адамантан, инданил, инденил, флуоренил,1,2,3,4-тетрагидронафталин и тому подобное. Подобным образом, циклоалкенил означает карбоциклы, не содержащие гетероатомов и содержащие, по крайней мере, одну неароматическую С-С двойную связь, и включают в себя моно-, би- и трициклические частично насыщенные карбоциклы, а также бензоконденсированные циклоалкены. Примеры циклоалкенила включают в себя циклогексенил, инденил и тому подобное. Термин циклоалкилокси, если специально не определено иного, включает циклоалкильную группу, присоединенную к окси связывающему атому. Термин алкокси, если специально не определено иного, включает алкильную группу,присоединенную к окси связывающему атому. Термин арил, если специально не определено иного, включает поликольцевые системы, а также монокольцевые системы, такие как,например, фенил или нафтил. Термин арилокси, если специально не определено иного, включает поликольцевые системы, а также монокольцевые системы, такие как, например, фенил или нафтил, присоединенные через окси связывающий атом к месту присоединения. Термин С 0-С 6 алкил включает алкилы,содержащие 6, 5, 4, 3, 2, 1 или не содержащие 20 углеродных атомов. Не содержащий углеродных атомов алкил представляет собой заместитель атом водорода или прямую связь в зависимости от того является ли алкил концевой или мостиковой группой. Термин гетеро, если специально не определено иного, включает один или несколько атомов О, S или N. Например, гетероциклоалкил и гетероарил включают в себя кольцевые системы, которые содержат один или несколько атомов О, S или N в кольце, включая смеси таких атомов. Гетероатомы заменяют углеродные атомы кольца. Таким образом, например, гетероцикло-С 5 алкил представляет собой пятичленное кольцо, содержащее от 5 до 0 углеродных атомов. Примеры гетероарила включают в себя,например, пиридинил, хинолинил, изохинолинил, пиридазинил, пиримидинил, пиразинил,хиноксалинил, фурил, бензофурил, дибензофурил, тиенил, бензтиенил, пирролил, индолил,пиразолил, индазолил, оксазолил, изоксазолил,тиазолил, изотиазолил, имидазолил, бензимидазолил, оксадиазолил, тиадиазолил, триазолил,тетразолил. Термин гетероарилокси, если специально не определено иного, описывает гетероарильную группу, присоединенную через окси связывающему атом к месту присоединения. Примеры гетероарил(С 1-С 6)алкила включают в себя, например, фурилметил, фурилэтил,тиенилметил, тиенилэтил, пиразолилметил, оксазолилметил, оксазолилэтил, изоксазолилметил, тиазолилметил, тиазолилэтил, имидазолилметил, имидазолилэтил, бензимидазолилметил,оксадиазолилметил, оксадиазолилэтил, тиадиазолилметил, тиадиазолилэтил, тризолилметил,триазолилэтил, тетразолилметил, тетразолилэтил, пиридинилметил, пиридинилэтил, пиридазинилметил, пиримидинилметил, пиразинилметил, хинолинилметил, изохинолинилметил и хиноксалинилметил. Примеры гетероциклоС 3-7 алкила включают в себя, например, азетидинил, пирролидинил, пиперидинил, пиперазинил, морфолинил,тетрагидрофуранил, имидазолинил, пиролидин 2-он, пиперидин-2-он и тиоморфолинил. Примеры арил(C1-6)алкила включают в себя, например, фенил (C1-6)алкил и нафтил (C1-6) алкил. Примеры гетероциклоС 3-7 алкилкарбонил(C1-6)алкила включают в себя, например, азетидинилкарбонил(C1-6)алкил, пирролидинилкарбонил(C1-6)алкил, пиперидинилкарбонил (C1-6) алкил, пиперазинилкарбонил(C1-6)алкил, морфолинилкарбонил(C1-6)алкил и тиоморфолинилкарбонил (C1-6)алкил. Термин амин, если специально не определено иного, включает первичные, вторичные и третичные амины. 21 Если не определено иного, термин карбамоил включает в себя -NHC(O)С 1-С 4 алкил и-ОС(О)NНС 1-С 4 алкил. Термин галоген включает атомы фтора,хлора, брома и йода. Термин необязательно замещенный предназначен для обозначения как замещенный,так и незамещенный. Таким образом, например,необязательно замещенный арил может представлять собой пентафторфенильное или фенильное кольцо. Кроме того, замещение может быть осуществлено в любой группе. Например,замещенный арил(C1-6) алкил включает замещение в арильной группе, а также замещение в алкильной группе. Описанные здесь соединения содержат одну или несколько двойных связей и это может быть причиной существования цис/транс изомеров, а также других конформационных изомеров. Настоящее изобретение включает все такие возможные изомеры, а также смеси таких изомеров. Описанные здесь соединения могут содержать один или несколько асимметричных центров и это может быть причиной существования диастереомеров и оптических изомеров. Настоящее изобретение включает все такие возможные диастереомеры, а также их рацемические смеси, их по существу чистые разделенные энантиомеры, все возможные геометрические изомеры и их фармацевтически приемлемые соли. Вышеуказанная формула I представлена без указания стерохимии у некоторых положений. Настоящее изобретение включает все стероизомеры формулы I и их фармацевтически приемлемые соли. Кроме того, включены также как смеси стереоизомеров, так и выделенные конкретные стереоизомеры. В процессе синтетических методов, используемых для получения таких соединений, или при использовании процессов рацемизации или эпимеризации, известных специалистам в данной области, продукты таких процессов могут быть в виде смеси стереоизомеров. Термин фармацевтически приемлемые соли относится к солям, полученным из фармацевтически приемлемых нетоксических оснований или кислот. Когда соединение по настоящему изобретению является кислым, то его соответствующая соль может подходящим образом быть получена из фармацевтически приемлемых нетоксичных оснований, включая неорганические основания и органические основания. Соли, полученные из таких неорганических оснований, включают соли алюминия, аммония,кальция, меди (I и II), железа (II), железа (III),лития, магния, марганца (II и IV), калия, натрия,цинка и тому подобное. Особенно предпочтительными являются соли аммония, кальция,магния, калия и натрия. Соли, полученные из фармацевтически приемлемых органических нетоксичных оснований, включают соли пер 004747 22 вичных, вторичных и третичных аминов, а также циклических аминов и замещенных аминов,таких как природные и синтезируемые замещенные амины. Другие фармацевтически приемлемые органические нетоксичные основания,из которых могут быть получены соли, включают ионнообменные смолы, такие как, например,аргинин, бетаин, кофеин, холин, N,N'-дибензилэтилендиамин, диэтиламин, 2-диэтиламиноэтанол, 2-диметиламиноэтанол, этаноламин, этилендиамин, N-этилморфолин, N-этилпиперидин, глюкамин, глюкозамин, гистидин,гидрабамин, изопропиламин, лизин, метилглюкамин, морфолин, пиперазин, пиперидин, полиаминовые смолы, прокаин, пурины, теобромин,триэтиламин, триметиламин, трипропиламин,трометамин и тому подобное. Когда соединение по настоящему изобретению является основанием, его соответствующая соль может подходящим образом быть получена из фармацевтически приемлемых нетоксичных кислот, включая неорганические и органические кислоты. Такие кислоты включают,например, уксусную, бензолсульфоновую, бензойную, камфорсульфоновую, лимонную, этансульфоновую, фумаровую, глюконовую, глутаминовую, бромисто-водородную, хлористоводородную, изетионовую, молочную, малеиновую, яблочную, миндальную, метансульфоновую, муконовую, азотную, памовую, пантотеновую, фосфорную, янтарную, серную, винную, птолуолсульфоновую кислоту и тому подобное. Особенно предпочтительными являются бензолсульфоновая, лимонная, бромисто-водородная, хлористо-водородная, малеиновая, фосфорная, серная и винная кислоты. Фармацевтические композиции по настоящему изобретению включают в качестве активного вещества соединение представленное формулой I (или его фармацевтически приемлемые соли), фармацевтически приемлемый носитель и необязательно другие терапевтические ингредиенты или адъюванты. Такие дополнительные терапевтические ингредиенты включают, например, i) антагонисты лейкотриеновых рецепторов, ii) ингибиторы биосинтеза лейкотриенов, iii) кортикостероиды, iv) антагонистыH1 рецепторов, v) агонисты бета 2 адренорецепторов, vi) селективные ингибиторы СОХ-2, vii) статины, viii) нестероидные противовоспалительные средства (НСПВС) и ix) антагонисты М 2/М 3. Композиции включают в себя композиции, подходящие для перорального, ректального, местного и парентерального (включая подкожное, внутримышечное и внутривенное) введения, хотя наиболее подходящий путь в любом данном случае будет зависеть от конкретного больного и природы и серьезности состояния болезни при которой вводят активное вещество. Фармацевтические композиции могут быть удобно представлены в виде стандартной лекарственной формы и получены каким-либо спосо 23 бом, хорошо известным в области фармацевтики. Для местного использования могут применяться кремы, мази, желе, растворы или суспензии, содержащие соединение формулы I. Полоскания для рта и горла включены в рамки местного использования по данному изобретению. Уровни доз от около 0,001 мг/кг до 140 мг/мг массы тела в день могут использоваться при лечении состояний, таких как астма, хронический бронхит, хроническое обструктивное заболевание легких (ХОЗЛ), эозинофильная гранулема, псориаз и другие доброкачественные или злокачественные пролиферативные заболевания кожи, эндотоксический шок (и связанных с ним состояний, таких как ламинит и колики у лошадей), септический шок, язвенный колит,болезнь Крона, повреждения миокарда и мозга,связанные с кровоснабжением, воспалительный артрит остеопороз, хронический гломерулонефрит, атопический дерматит, крапивница, респираторный дистресс синдром у взрослых, респираторный дистресс синдром у младенцев, хроническое обструктивного заболевание у животных, несахарный диабет, аллергический ринит,аллергический конъюнктивит, весенний конъюнктивит, артериальный рестеноз, атеросклероз, нейрогенное воспаление, боль, кашель,ревматоидный артрит, анкилозирующий спондилит, отторжение трансплантата и реакция трансплантат против хозяина, гиперсекреция желудочного сока, сепсис или септический шок,вызванный бактериальной, грибковой и вирусной инфекцией, воспаление и цитокинсвязанная хроническая дегенерация ткани, остеоартрит, рак, кахексия, мышечная слабость,депрессия, ухудшение памяти, монополярная депрессия, острые и хронические нейродегенеративные заболевания с воспалительным компонентом, болезнь Паркинсона, болезнь Альцгеймера, травма спинного мозга, ушиб головы,рассеянный склероз, рост опухоли и раковая инвазия нормальной ткани, которые чувствительны к ингибированию ФДЭ 4, или альтернативно, от около 0,05 мг до около 7 г на пациента в день. Например, воспаление может эффективно подвергнуто лечению путем введения от около 0,01 мг до 50 мг соединения на килограмм массы тела в день или, альтернативно, от около 0,5 мг до около 2,5 г на пациента в день. Кроме того, понятно, что соединения, ингибирующие ФДЭ 4, по данному изобретению могут вводиться в профилактиктически эффективных уровнях доз для профилактики вышеуказанных состояний. Количество активного вещества, которое может быть объединено с веществом носителя с получением единичной дозированной формы,может изменяться в зависимости от субъекта,который подвергается лечению, и конкретного пути введения. Например, состав, предназначенный для перорального введения человеку, 004747 24 может удобно содержать от около 0,5 мг до около 5 г активного вещества вместе с подходящим и удобным количеством вещества носителя,которое может изменяться от около 5 до около 95 процентов от всей композиции. Стандартные лекарственные формы обычно будут содержать от около 0,01 мг до около 1000 мг активного вещества, обычно 0,01 мг, 0,05 мг, 0,25 мг, 1 мг,5 мг, 25 мг, 50 мг, 100 мг, 200 мг, 300 мг, 400 мг,500 мг, 600 мг, 800 мг или 1000 мг. Однако понятно, что конкретный уровень дозы для отдельного пациента будет зависеть от различных факторов, включая возраст, массу тела, общее состояние, пол, питание, время введения, пути введения, скорость выведения, сочетание с другим лекарственным препаратом и серьезность данного заболевания, подвергающегося лечению. На практике соединения, представленные формулой I, или их фармацевтически приемлемые соли по данному изобретению в качестве активного ингредиента могут быть объединены в гомогенную смесь с фармацевтическим носителем в соответствии с обычными фармацевтическими способами получения составов. Носитель может быть выбран из широкого разнообразия форм, в зависимости от вида желаемого лекарственного препарата для введения, например, перорального или парентерального (включая внутривенный). Таким образом,фармацевтические композиции по настоящему изобретению могут быть представлены как дискретные единицы, подходящие для перорального введения, такие как капсулы, каше или таблетки, каждый содержит заранее определенное количество активного вещества. Кроме того,композиции могут быть представлены в виде порошков, в виде гранул, в виде раствора, в виде суспензии в водной жидкости, в виде неводной жидкости, в виде эмульсии масло в воде или в виде эмульсии вода в масле. Помимо обычных дозированных форм, указанных выше,соединение, представленное формулой I, или его фармацевтически приемлемые соли могут также вводиться способами, контролирующими высвобождение и/или доставку. Композиции могут быть получены любым из фармацевтических способов. Обычно такие способы включают в себя стадию вхождения в ассоциацию активного вещества и носителя, который состоит из одного или нескольких необходимых ингредиентов. Обычно композиции получают путем однородного и тщательного смешивания активного ингредиента с жидкими носителями или мелко измельченными твердыми носителями,или с теми и другими. Продукту затем можно подходящим образом придать желаемую форму. Таким образом, фармацевтические композиции по данному изобретению могут включать фармацевтически приемлемый носитель и соединение или фармацевтически приемлемую соль формулы I. Соединения формулы I или их фар 25 мацевтически приемлемые соли также могут входить в состав фармацевтических композиций в сочетании с одним или несколькими другими терапевтически активными соединениями. Используемый фармацевтический носитель может быть, например, твердым веществом, жидкостью или газом. Примеры твердых носителей включают лактозу, белую глину, сахарозу, тальк, желатин, агар, пектин, гуммиарабик, стеарат магния и стеариновую кислоту. Примерами жидких носителей являются сахарный сироп, арахисовое масло, оливковое масло и вода. Примеры газообразных носителей включают диоксид углерода и азот. При получении композиций для пероральной дозируемой формы может использоваться любая обычная фармацевтическая среда. Например, для пероральных жидких лекарственных препаратов, таких как суспензии, эликсиры и растворы, могут использоваться вода, гликоли, масла, спирты, вкусовые добавки, консерванты, красители и тому подобное; тогда как для получения твердых пероральных форм лекарственных препаратов, таких как порошки,капсулы и таблетки, могут использоваться носители, такие как крахмалы, сахара, микрокристаллическая целлюлоза, разбавители, гранулирующие агенты, смазывающие вещества, связывающие вещества, разрыхлители и тому подобное. Предпочтительными пероральными стандартными лекарственными формами являются таблетки и капсулы, так как их легко вводить,таким образом, используются твердые фармацевтические носители. Необязательно, таблетки могут быть покрыты с помощью стандартных водных или неводных способов. Таблетка, содержащая композицию по данному изобретению, может быть получена путем прессования или формовкой, необязательно с одним или несколькими дополнительными ингредиентами или адъювантами. Прессованные таблетки могут быть получены прессованием, в соответствующей машине, активного вещества в сыпучей форме, такой как порошок или гранулы, необязательно смешанные с связующим агентом, смазывающим веществом,инертным разбавителем, поверхностно-активным или диспергирующим агентом. Формованные таблетки могут быть получены формовкой в соответствующей машине смеси порошка соединения, увлажненного инертным жидким разбавителем. Каждая таблетка предпочтительно содержит от около 0,1 мг до около 500 мг активного вещества, и каждые каше или капсула предпочтительно содержат от около 0,1 мг до около 500 мг активного вещества. Фармацевтические композиции по настоящему изобретению, подходящие для парентерального введения, могут быть получены в виде растворов или суспензий активных соединений в воде. Может быть включено подходя 004747 26 щее поверхностно-активное соединение, такое как, например, гидроксипропилцеллюлоза. Дисперсии могут быть также получены в глицерине,жидких полиэтилгликолях и их смеси в маслах. Кроме того, может быть включен консервант для предотвращения вредного роста микроорганизмов. Фармацевтические композиции по настоящему изобретению, подходящие для использования в качестве инъекции, включают стерильные водные растворы или дисперсии. Кроме того, композиции могут быть в виде стерильных порошков для приготовления перед непосредственным использованием таких стерильных растворов и дисперсий для инъекции. В любом случае, конечная форма для введения в виде инъекции должна быть стерильной и должна быть достаточно жидкой для легкого введения через шприц. Фармацевтические композиции должны быть стабильны в условиях производства и хранения; таким образом, предпочтительно, должны быть предохранены от вредного действия микроорганизмов, таких как бактерии и грибок. Носитель может быть растворителем или дисперсионной средой, содержащей, например, воду, этанол, полиол (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль), растительные масла и их соответствующие смеси. Фармацевтические композиции по настоящему изобретению могут быть в форме,подходящей для местного использования, такой как, например, аэрозоль, крем, мазь, лосьон,порошок в виде пудры или тому подобное. Кроме того, композиции могут быть получены в форме, подходящей для использования в устройствах для чрезкожного введения. Эти препараты могут быть изготовлены, используя соединение, представленное формулой I по данному изобретению, или его фармацевтически приемлемые соли, путем обычных технологических приемов. В качестве примера, крем или мазь получают путем смешивания гидрофильного вещества и воды вместе с от около 5 маc.% до около 10 маc.% соединения с получением крема или мази, имеющей желаемую консистенцию. Фармацевтические композиции по данному изобретению могут быть в форме, подходящей для ректального введения, где носитель представляет собой твердое вещество. Предпочтительно, чтобы из смеси изготовили суппозитории в виде единичной дозы. Соответствующие носители включают в себя масло какао и другие вещества, обычно используемые в данной области. Суппозитории можно удобно изготавливать сначала перемешиванием композиции со смягчителем или расплавленным носителем(ями), а затем охлаждением и приданием формы в пресс-формах. В дополнение к вышеуказанным ингредиентам носителей, фармацевтические соединения, описанные выше, могут включать, если 27 подходят, один или несколько дополнительных ингредиентов носителей, таких как растворители, буферы, вкусовые добавки, связывающие агенты, поверхностно-активные агенты, загустители, смазывающие вещества, консерванты(включая антиоксиданты) и тому подобное. Кроме того, могут быть включены другие адъюванты для придания композиции изотоничности по отношению к крови и предполагаемого реципиента. Композиции, содержащие соединение, описанное формулой I, или его фармацевтически приемлемые соли могут также быть получены в виде порошка или жидкого концентрата. Было обнаружено, что соединения и фармацевтические композиции по данному изобретению биологически активны в качестве ингибиторов ФДЭ 4. Соответственно, другим аспектом изобретения является лечение у млекопитающих, например, астмы, хронического бронхита, хронического обструктивного заболевания легких (ХОЗЛ), эозинофильной гранулемы, псориаза и других доброкачественных или злокачественных пролиферативных заболеваний кожи,эндотоксического шока (и связанных состояний,таких как ламинит и колики у лошадей), септического шока, язвенного колита, болезни Крона,повреждений миокарда и мозга, связанные с кровоснабжением, воспалительного артрита,остеопороза, хронического гломерулонефрита,атопического дерматита, крапивницы, респираторного дистресс синдрома у взрослых, респираторного дистресс синдрома у младенцев, хронического обструктивного заболевания у животных, несахарного диабета, аллергического ринита, аллергического конъюнктивита, весеннего конъюнктивита, артериального рестеноза,атеросклероза, нейрогенного воспаления, боли,кашля, ревматоидного артрита, анкилозирующего спондилита, отторжения трансплантата и реакции трансплантат против хозяина, гиперсекреции желудочного сока, сепсиса или септического шока, вызванного бактериальной, грибковой и вирусной инфекцией, воспаления и цитокин-связанной хронической дегенерации ткани, остеоартрита, рака, кахексии, мышечной слабости, депрессии, ухудшения памяти, монополярной депрессии, острых и хронических нейродегенеративных заболеваний с воспалительным компонентом, болезни Паркинсона,болезни Альцгеймера, травмы спинного мозга,ушиба головы, рассеянного склероза, роста опухоли и раковой инвазии нормальной ткани, заболеваний, которые могли бы облегчиться путем ингибирования изофермента ФДЭ 4 и в результате снижения уровней цАМФ при введении эффективных количеств соединений по данному изобретению. Термин млекопитающие включает в себя людей, а также животных,таких как, например, собаки, кошки, лошади,свиньи и крупный рогатый скот. Соответственно, понятно, что лечение млекопитающих, ис 004747 28 ключая людей, представляет собой лечение заболеваний, клинически коррелируемых с вышеперечисленными примерами человеческих заболеваний. Далее, как описано выше, соединение по данному изобретению может использоваться в сочетании с другими терапевтическими соединениями. В частности, комбинации соединения,ингибирующего ФДЭ 4 по данному изобретению, могут соответствующим образом быть использованы в сочетании с i) антагонистами лейкотриеновых рецепторов, ii) ингибиторами биосинтеза лейкотриенов, iii) селективными ингибиторами СОХ-2, iv) статинами, v) НПВС иvi) антагонистами М 2/М 3, vi) кортикостероидами, viii) антагонистами рецептора H1 (гистамин) и ix) агонистами бета 2 адренорецепторов. В другом аспекте было найдено, что соединение по данному изобретению может образовываться как метаболит в системе млекопитающего. Например, соединение по примеру 19,(5-(Е)-2-(3-6-[1-метил-1-(метилсульфонил) этил]-8-хинолинилфенил)-1-[4-(метилсульфонил)фенил]винил-1,2,4-оксадиазол-3-ил)метанол которое является ингибитором ФДЭ 4, образуется как метаболит in vivo, когда вводится соединение по примеру 14: Соответственно, настоящее изобретение включает пролекарства, которые in vivo образуют ингибиторы ФДЭ 4 как метаболит после введения таких пролекарств млекопитающему. Кроме того, данное изобретение включает способ лечения путем введения пролекарства с образованием in vivo эффективного количества ингибитора ФДЭ 4, описываемого формулой I. Аббревиатуры, используемые в данном описании, имеют следующие значения, представленные в таблице. Аббревиатуры, не представленные в таблице ниже, имеют обычно используемое значение, если специально не определено иного. Исследования, демонстрирующие биологическую активность Количественный анализ LPS и FMLP-индуцированного TNF-A и LTB4 в человеческой крови Цельная кровь снабжает белок и клеточнобогатую среду, подходящую для изучения биохимической эффективности противовоспалительных соединений, таких как РDЕ 4-селективных ингибиторов. Нормальная, нестимулированная человеческая кровь не содержит обнаруживаемые уровни TNF- и LTB4. При стиму 004747 30 ляции LPS экспрессируются активированные моноциты и секретируется TNF- вплоть до 8 ч,а плазменные уровни остаются стабильными в течение 24 ч. В опубликованных исследованиях показано, что ингибирование TNF- путем увеличения внутриклеточного цАМФ путем ингибирования ФДЭ 4 и/или усиления активности аденилциклазы происходит на уровне транскрипции. Синтез LTB4 также чувствителен к уровням внутриклеточного цАМФ и может быть полностью ингибированLTB4 незначительно стимулирует LPS в цельной крови, для синтеза LTB4 активированным нейтрофилами необходима дополнительная стимуляция LPS после стимуляции fMLP человеческой цельной крови. Таким образом, используя тот же самый образец крови, можно оценить воздействие соединения на активность двух замещающих маркерных генов ФДЭ 4 в цельной крови в соответствии со следующим способом. Свежую кровь собирали в гепаринсодержащие пробирки путем пункции вены здоровых добровольцев (мужчины и женщины). Эти объекты не имели никаких очевидных воспалительных состояний и не принимали никаких НСПВС (NSAIDS) в течение, по крайней мере, 4 дней до взятия крови. Аликвоты крови по 500 мкл предварительно инкубировали либо с 2 мкл носителя (ДМСО), либо с 2 мкл исследуемого соединения при различных концентрациях в течение 15 мин при 37 С. После этого добавляли либо 10 мкл носителя (PBS) в качестве контроля, либо 10 мкл LPS (конечная концентрация 1 мкг/мл; L-2630 Sigma ChemicalCo., St. Louis, МО) из Е. coli, серотип 0111:B4; разведение в 0,1% мас./об. BSA (в PBS. Через 24 ч инкубации при 37 в кровь добавляли еще 10 мкл PBS (контроль) или 10 мкл LPS (конечная концентрация 1 мкг/мл) и инкубировали в течение 30 мин при 37 С. Кровь затем стимулировали либо 10 мкл PBS (контроль), либо 10 мкл(Sigma); разведение в 1% мас. /об. BSA (в PBS в течение 15 мин при 37 С. Образцы крови центрифугировали при 1500 х g в течение 10 мин при 4 С с получением плазмы. Аликвоту плазмы 50 мкл смешивали с 200 мкл метанола для преципитации белка и центрифугировали, как описано выше. Супернатант анализировали наLTB4, используя набор ферментов иммуноанализа (520111 от Cayman Chemical Co., Ann Arbor, MI) в соответствии с технологическим способом. TNF- анализировали в разведенной плазме (в PBS), используя набор ELISA (Cistron Противоаллергическая активность in vivo Соединения по изобретению были исследованы на оказание эффекта на аллергическое воспаление легких, вызванное IgE, индуцированное при вдыхании антигена у сенсибилизированных морских свинок. Морские свинки первоначально сенсибилизировали к овальбумину при умеренной иммуносупресси, вызванной циклофосфамином, путем внутрибрюшинной инъекцией антигена в сочетании с оксидом алюминия и вакциной коклюша. Стимулирующие дозы антигена вводили спустя две и четыре недели. На шестой неделе, животных стимулировали аэрозольным овальбумином одновременно с внутрибрюшинным введением антигистаминного агента (мепирамин). Еще через 48 ч проводилил бронхиальный альвеолярный лаваж(BAL) и подсчитывали число эозинофилов и других лейкоцитов в жидкостях BAL. Легкие также удаляли для гистологического исследования на воспалительное повреждение. Введение соединений примеров (0,001-10 мг/кг i.p. или р.о.) до трех раз в течение 48 ч после антигенной стимуляции приводило к значительному снижению эозинофилов и накоплению других воспалительных лейкоцитов. Также у животных, которым вводили соединения примеров,воспалительное повреждение легких было меньше. Протокол исследования SPA основанной активности PDE Соединения, которые ингибируют гидролиз цАМФ до АМФ с помощью цАМФспецифической фосфодиэтилэстеразы типа IV,были исследованы на 96-луночной плашке следующим образом. На 96-лучночную плашку при 30 С наносили исследуемое соединение (растворенные в 2 мкл ДМСО), 188 мл субстратного буфера, содержащего [2,8-3 Н]аденозин 3',5'-циклический фосфат (цАМФ, от 100 нМ до 50 мкМ) , 10 мМ МдСl2, 1 мМ ЭДТА, 50 мМ Tris, рН 7,5. Реакцию инициировали добавлением 10 мл человеческого рекомбинанта PDE4 (количество контролировалось таким образом, чтобы в течение 10 мин образовывалось 10% продукта). Реакцию останавливал через 10 мин добавлением 1 мг стеклянных бус (AmershamPharmacia Biotech, Inc., Piscataway, NJ). Полученный продукт АМФ количественно определяли на Wallac Microbeta счетчике 96-луночной плашке (EGG Wallac 'Co., Gaithersburg, MD). Сигнал в присутствии фермента определяли как фоновый. 100% активность определяли как обнаруживаемый сигнал в присутствии фермента и ДМСО, вычитая фон. Процент ингибирования подсчитывали соответствующим образом. Значение IC50 приближали к нелинейной регрессии,используя уравнение стандартного 4-параметрового/мультиплетного связывающего сайта из десяти точек титрования. 32 Значение IC50 в примерах 1-42 определяли с 100 нМ цАМР, используя очищенный GSTсвязанный белок человеческой рекомбинантной фосфодиэстеразы IVa (met-248), полученной из экспресс системы бакуловирус/Sf-9. ЗначениеICso в примерах 1-42 обычно находятся в области от 0,14 нМ до 10,24 нМ, хотя в одном примере было значение IC50, равное 109 нМ. Приведенные ниже примеры даны для иллюстрации определенных предпочтительных воплощений изобретения и не предназначены для ограничения изобретения. Если специально не определено иного,экспериментальные способы проводили при следующих условиях. Все операции осуществляли при комнатной температуре или при температуре окружающей среды, а именно: при температуре, находящейся в области от 18-25 С. Упаривание растворителя проводили используя роторный испаритель при пониженном давлении (6004000 паскалей: 4,5-30 мм рт.ст.) при температуре бани до 60 С. После проведения реакции осуществляли тонкослойную хроматографию (ТСХ), и время реакции указано только для иллюстрации. Точки плавления даны в интервале и 'd' обозначает разложение. Приведенные точки плавления получены для веществ полученных таким образом, как описано. В некоторых препаратах полиморфизм может приводить к выделению веществ с различными точками плавления. Структуру и степень очистки всех конечных продуктов подтверждали, по крайней мере, одним из следующих способов: ТСХ, масс-спектроскопия, спектром ядерномагнитного резонанса (ЯМР) или микроаналитическими данными. Выход приведен только для иллюстрации. Если указаны, данные ЯМР представлены в виде значений дельтадля главных диагностических протонов, даны в миллионных долях (м.д.) относительно тетраметилсилана (TMS) как внутреннего стандарта,определены при 300 МГц, 400 МГц или 500 МГц, используя индикаторный растворитель. Для сигнальных пиков приведены обычные аббревиатуры: с. синглет; д. дуплет; т. триплет; м. мультиплет; ушир. уширенный; и тому подобное. Кроме того, Аr обозначает ароматический сигнал. Химические символы имеют свои обычные значения; также использовались следующие аббревиатуры: об. (объем), мас. (масса),т.кип. (точка кипения), т.пл. (точка плавления),л (литр(ы, мл (миллилитры), г (грамм(ы, мг(миллиграммы), моль (моли), моль (миллимоли), экв. (эквивалент(ы. Способы синтеза Соединения по настоящему изобретению могут быть получены в соответствии со следующими способами. Заместители являются такими же как в формуле I, если не определено иначе.Y = галоген, Н; А = 4-(метилтио)бензальдегид; Е = электрофил; Аr = арил или гетероарил. Согласно схеме 1 выше и таблицы по схеме 1 ниже, промежуточное спиртовое соединение II может быть получено взаимодействием металлопроизводного арила или гетероарила III,такого как галогенид магнийорганического соединения, с 4-(метилтио)бензальдегидом (А) в органическом растворителе, таком как ТГФ. Промежуточное спиртовое соединение II может также быть получено путем обработки арил или гетероарилгидрида или бромида IV с основанием или металлоорганическим соединением, таким как н-бутиллитий, в органическом растворителе, таком как ТГФ, а затем с 4(метилтио)бензальдегидом. Альтернативно,промежуточное спиртовое соединение II может также быть получено следующими химическими преобразованиями: 1) обработкой арил- или гетероарилдигидрида, галогенгидрида или дигалогенида соединения V с основанием или металлорганическим соединением, таким как н-бутиллитий, в органическом растворителе, таком как ТГФ, затем электрофилом, таким как ацетон или 4(метилтио)бензальдегид; 2) последовательной обработкой основанием или металлорганическим соединением,таким как н-бутиллитий, в органическом растворителе, таком как ТГФ, затем электрофилом,таким как ацетон или 4-(метилтио)бензальдегид,где в первом или втором преобразовании должен использоваться 4-(метилтио)бензальдегид в качестве электрофила. Сульфон-спирт VI может быть получен окислением сульфида-спирта II окислителем, таким как оксон в растворителе,таком как смесь ТГФ/МЕОН/Н 2 О. Кетоны VII иVIII могут быть получены окислением спиртов, 004747CH2Cl2. Сульфон-кетон VIII может также быть получен окислением сульфид-кетона VII окислителем, таким как оксон в растворителе, таком как смесь ТГФ/МЕОН/Н 2 О. Таблица. Схемы: кетоны-78 С по каплям добавляли бромид 4-фторфенилмагния (1,0 М в ТГФ, 19,7 мл, 19,7 ммоль). Полученный раствор перемешивали при -78 С в течение 3 ч и гасили насыщенным водным раствором NH4Cl. Затем смесь разбавляли EtOAc и 10%НСl, экстрагировали и промывали (NаНСО 3(насыщ.), насыщенным солевым раствором). Органическую фазу сушили над MgSO4 и концентрировали. Затем осадок обрабатывали МnОr (28,6 г, 330 ммоль) в CH2Cl2 (150 мл) и реакционную смесь перемешивали при комнатной температуре в течение ночи. Смесь фильтровали через слой из силикагеля (EtOAc) с получением 2,6 г (4-фторфенил)[4-(метилтио)фенил]кетонового соединения. Стадия 2. (4-Фторфенил)[4-(метилсульфонил)фенил]кетон. К раствору сульфида, конкретно (4-фторфенил)[4-(метилтио)фенил]кетона, со стадии 1(2,0 г, 8,1 ммоль) в ТГФ/МеОН/Н 2 О (80/40/40 мл) добавляли оксон (7,5 г, 12,2 ммоль). Смесь перемешивали при комнатной температуре в течение 4 ч, гасили NаНСО 3 (насыщ.) и разбавляли EtOAc. Органическую фазу промывалиNаНСО 3 (насыщ.), насыщенным солевым раствором, сушили над Na2SO4, фильровали и концентрировали. Кристаллизация (СН 2 С 12/гексан) давала (4-фторфенил)[4-(метилсульфонил)фе 35 нил]кетон, соединение кетона K1, в виде белого твердого вещества. Кетон K2. (1-Метил-1 Н-имидазол-2-ил)[4(метилтио)фенил]кетон. Кетон K2 получали следующим способом. Стадия 1. (1-Метил-1 Н-имидазол-2-ил)[4(метилтио)фенил]метанол. В раствор N-метилимидазола (10,0 г, 122 ммоль) в 500 мл ТГФ при -78 С по каплям добавляли н-бутиллитий (2,5 М в гексане, 48,7 мл,118 ммоль) и полученный раствор перемешивали при -78 С в течение 30 мин. Затем добавляли 4-(метилтио)бензальдегид (14,73 мл, 110 ммоль) при -78 С, и смесь перемешивали до завершения реакции по данным ТСХ и гасили NH4Cl(насыщ.). Затем смесь разбавляли EtOAc, экстрагировали и промывали (NаНСО 3 (насыщ.),насыщенным солевым раствором). Органическую фазу сушили над MgSO4, фильтровали и концентрировали. Кристаллизация (EtOAc/гексан) давала (1-метил-1 Н-имидазол-2-ил)[4-(метилтио)фенил]метанол. Стадия 2. (1-Метил-1 Н-имидазол-2-ил)[4(метилтио)фенил]кетон. В раствор спирта со стадии 1 (25,7 г, 111 ммоль) в EtOAc (250 мл) и СН 2 Сl2 (250 мл) добавляли МnО 2 (140 г, 1,66 моль) и реакционную смесь перемешивали при комнатной температуре в течение ночи. Смесь фильтровали через слой из силикигеля (EtOAc) с получением кетона K2. Кетон K3. (4-Метилсульфонил)(фенил) кетон. Кетон K3 получали следующим способом. Стадия 1. (4-Метилтио)(фенил)метанол. В раствор 4-(метилтио)бензальдегида (1,0 г, 6,5 ммоль) в ТГФ (20 мл) при 0 С добавляли фенилмагнийхлорид (2 М, ТГФ, 3,5 мл, 7,0 ммоль). После выдерживания смеси в течение 0,5 ч при комнатной температуре, ее нейтрализовали насыщенным раствором NH4Cl, разбавляли водой и экстрагировали Et2O. Органические экстракты промывали (Н 2 О) (насыщенным солевым раствором), сушили (MgSO4), фильтровали и концентрировали. Очистка с помощью энергичного перемешивания в гексане/Et2O и фильтрация давали (4-метилтио)(фенил)метанол в виде белого твердого продукта. Стадия 2. (4-Метилтио)(фенил)кетон.(4-Метилтио)(фенил)кетон получали обработкой (4-метилтио)(фенил)метанола со стадии 1 с помощью МnО 2, как описано для стадии 2 способа получения K4 ниже. Стадия 3. (4-Метилсульфонил)(фенил)кетон. В раствор (4-метилтио)(фенил)кетона со стадии 2 (0,98 г, 4,3 ммоль) в СНСl3 (10 мл) при 0 С добавляли мХПБК (м-хлорпербензойная кислота) (1,7 г, 10 ммоль). После выдерживания смеси в течение 0,5 ч при комнатной температуре в смесь добавляли Са(ОН)2 (1,7 г, 23 ммоль) и перемешивали в течение 1 ч. Фильтрация через 36 целит (Celite) и концентрирование давали кетон K3 в виде белого твердого продукта. Кетон K4. (1,3-Тиазол-2-ил)[4-(метилтио) фенил]кетон. Кетон K4 получали следующим способом. Стадия 1. (1,3-Тиазол-2-ил)[4-(метилтио) фенил]метанол. В раствор тиазола (5,0 г, 58,7 ммоль) в ТГФ (250 мл) при -78 С по каплям добавляли нбутиллитий (2,5 М в гексане, 23,5 мл, 58,7 ммоль), и полученный раствор перемешивали при -78 С в течение 10 мин. Затем добавляли 4(метилтио)бензальдегид (7,1 мл, 53,4 ммоль) при -78 С. Полученную смесь перемешивали до завершения реакции и гасили насыщенным водным раствором NH4Cl. Затем смесь разбавляли(NаНСО 3 (насыщ.), насыщенным солевым раствором). Органическую фазу сушили над MgSO4 и концентрировали. Затем осадок очищали с помощью флэш-хроматографии(80% СН 2 Сl2/20% EtOAc) с получением (1,3-тиазол-2 ил)[4-(метилтио)фенил]метанола. Стадия 2. (1,3-Тиазол-2-ил)[4-(метилтио) фенил]кетон. В раствор (1,3-тиазол-2-ил)[4-(метилтио) фенил]метанола со стадии 1 (10,0 г, 42,1 ммоль) в EtOAc (250 мл) добавляли МnОr (70 г, 843 ммоль), и реакционную смесь перемешивали при 25 С в течение ночи. Смесь фильтровали через слой из силикaгеля (EtOAc) с получение соединения кетона K4. Кетон K5. (1,3-Тиазол-2-ил)[4-(метилсульфонил)фенил]кетон. Кетон K5 получали следующим способом. К раствору K4 (1,3-тиазол-2-ил)[4-(метилтио) фенил]кетона (8,2 г, 34,7 ммоль) в ТГФ/МеОН/ Н 2 О (350/175/175 мл) добавляли оксон (42,6 г,69,4 ммоль). Реакционную смесь перемешивали при 25 С в течение 3 ч и гасили насыщенным водным раствором NаНСО 3. Полученную затем смесь разбавляли EtOAc, экстрагировали и промывали (NаНСО 3 (насыщ.), насыщенным солевым раствором). Органическую фазу сушили над MgSO4 и концентрировали. Затем осадок очищали путем кристаллизации (EtOAc/гексан) с получением (1,3-тиазол-2-ил)[4-(метилсульфонил)фенил]кетона. Кетон K6. [5-(1-Гидрокси-1-метилэтил)1,3-тиазол-2-ил][4-(метилсульфонил)фенил] кетон. Кетон K6 получали следующим способом. Стадия 1. [5-(1-Гидрокси-1-метилэтил)-1,3 тиазол-2-ил][4-(метилтио)фенил]кетон. В раствор тиазола (1,0 г, 12,0 ммоль) в ТГФ (100 мл) при -78 С по каплям добавляли нбутиллитий (2,3 М в гексане, 5,3 мл, 12,3 ммоль) и полученный раствор перемешивали при -78 С в течение 10 мин. Затем добавляли 4-(метилтио) бензальдегид (7,1 мл, 53,4 ммоль) при -78 С. Полученную смесь перемешивали при комнатной температуре 10 мин и охлаждали при -78 С. 37 Затем по каплям добавляли н-бутиллитий (2,3 М в гексане, 5,3 мл, 12,3 ммоль), и полученный раствор перемешивали при 25 С в течение 10 мин и гасили ацетоном (3,0 мл). Затем смесь разбавляли EtOAc и 10% НСl, экстрагировали и промывали (NаНСО 3 (насыщ.), насыщенным солевым раствором). Органическую фазу сушили над MgSO4 и концентрировали. Затем осадок обрабатывали МnО 2 (20,4 г, 235 ммоль) вCH2Cl2 (250 мл), и реакционную смесь перемешивали при комнатной температуре в течение ночи. Полученную затем смесь фильтровали через слой из силикигеля (EtOAc). Флэшхроматография (90% СН 2 Сl2/10% EtOAc) давала[5-(1-гидрокси-1-метилэтил)-1,3-тиазол-2-ил][4(метилтио)фенил]кетон. Стадия 2. [5-(1-Гидрокси-1-метилэтил)-1,3 тиазол-2-ил][4-(метилсульфонил)фенил]кетон. В раствор сульфида, то есть [5-(1 гидрокси-1-метилэтил)-1,3-тиазол-2-ил][4-(метилтио)фенил]кетона, со стадии 1 (1,7 г, 5,8 ммоль) в ТТФ/МеОН/Н 2 О (100/50/50 мл) добавляли оксон (7,1 г, 11,5 ммоль). Реакционную смесь перемешивали при 25 С в течение 3 ч и гасили насыщенным водным растворомNаНСО 3. Затем смесь разбавляли EtOAc, экстрагировали и промывали (NаНСО 3 (насыщ.),насыщенным солевым раствором). Органическую фазу сушили над MgSO4 и концентрировали. Затем осадок очищали кристаллизацией(EtOAc/гексан) с получением кетона K6. Кетон K7. (6-Метил-3-пиридинил)[4-(метилсульфонил)фенил]кетон. Кетон K7 получали следующим способом. Стадия 1. (6-Метил-3-пиридинил)[4-(метилтио)фенил]метанол. В раствор 3-бром-6-метилпиридина (760 мг, 1 экв.) в ТГФ (20 мл) при -78 С, медленно добавляли н-бутиллитий в гексане (1,1 экв.). Затем раствор перемешивали в течение 30 мин. После этого медленно добавляли 4-(тиометил) бензальдегид (738 мг, 1,1 экв.). Раствор нагревали до комнатной температуры, добавляли NH4Cl(6-Метил-3-пиридинил)[4-(метилтио)фенил]метанол получали осаждением эфиром/гексаном и использовали на следующей стадии без дополнительного очищения. Стадия 2. (6-Метил-3-пиридинил)[4-(метилсульфонил)фенил]метанол. Следуя описанному выше способу со стадии 2 получения кетона K1, но используя в качестве исходного продукта вместо (4-фторфенил)[4-(метилтио)фенил]кетона сульфид (6 метил-3-пиридинил)[4-(метилтио)фенил]метанола со стадии 1, получали (6-метил-3 пиридинил)[4-(метилсульфонил)фенил]метанол. Стадия 3. (6-Метил-3-пиридинил)[4-(метилсульфонил)фенил]кетон. Следуя описанному выше способу со стадии 2 получения кетона K2, но используя в ка 004747 38 честве исходного продукта вместо (1-метил-1 Нимидазол-2-ил)[4-(метилтио)фенил]метанола(6 метил-3-пиридинил)[4-(метилсульфонил)фенил] метанол со стадии 2, получали кетон K7. Кетон K8. (5-Метил-2-пиридинил)[4-(метилсульфонил)фенил]кетон. Кетон K8 получали,согласно способу, описанному для кетона К 7, но заменяя 3-бром-6-метилпиридин на 2-бром-5 метилпиридин. Кетон К 9. Бис-[(4-метилсульфонил)фенил]кетон. Кетон K9 получали, согласно способу,описанному для кетона K7, но заменяя 3-бром 6-метилпиридин на 4-бромтиоанизол и используя двойное количество оксона в стадии сульфидного окисления. Кетон(2-Пиридинил)[4-(метилсульфонил)фенил]кетон. Кетон К 10 получали,согласно способу, описанному для кетона К 7, но заменяя 3-бром-6-метилпиридин на 2 бромпиридин. Кетон K11. [5-(1-Гидрокси-1-метилэтил)-2 пиридинил][4-(метилсульфонил)фенил]кетон. Кетон K11 получали следующим способом. Стадия 1. [5-(1-Гидрокси-1-метилэтил)-2 пиридинил][4-(метилтио)фенил]метанол. К суспензии 2,5-дибромпиридина (5,12 г, 1 экв.) в эфире при -78 С, медленно добавляли нбутиллитий в гексане (1,05 экв.). Полученный желто-оранжевый осадок перемешивали в течение 30 мин. Затем добавляли ацетон (1,54 мл,1,05 экв.) Раствор выдерживали при -78 С еще 30 мин. В полученную оранжевую суспензию медленно вводили с помощью шприца нбутиллитий в гексане (1,1 экв.). Затем суспензию перемешивали в течение 1 ч при -78 С. После этого добавляли 4-(метилтио)бензальдегид(2,85 мл, 1,1 экв.). Полученную суспензию нагревали до -35 С и гасили раствором NН 4 Сl (насыщ.). Добавляли воду и EtOAc и органический слой сушили над MgSO4, упаривали и очищали флэш-хроматографией (EtOAc) с получением [5(1-гидрокси-1-метилэтил)-2-пиридинил][4(метилтио)фенил]метанола. Стадия 2. [5-(1-гидрокси-1-метилэтил)-2 пиридинил][4-(метилсульфонил)фенил]метанол.[4-(метилсульфонил)фенил]метанол получали,согласно способу, описанному выше для стадии 2 получения кетона K1, но используя в качестве исходного продукта вместо (4-фторфенил)[4(метилтио)фенил]-4-фторфенилкетона сульфид,то есть [5-(1-гидрокси-1-метилэтил)-2-пиридинил][4-(метилтио)фенил]метанол, со стадии 1. Стадия 3. [5-(1-Гидрокси-1-метилэтил)-2 пиридинил][4-(метилсульфонил)фенил]кетон. Кетон K11 получали, согласно способу,описанному выше для стадии 2 получения кетона K2, но используя в качестве исходного продукта вместо (1-метил-1 Н-имидазол-2-ил)[4(метилтио)фенил]метанола[5-(1-гидрокси-1 39 метилэтил)-2-пиридинил][4-(метилсульфонил) фенил]метанол со стадии 2. Боронатные соединения, которые используют для получения соединений по данному изобретению, могут быть получены в соответствии со схемой 2, приведенной ниже: Схема 2. Синтез боронатов. Арилбромиды IX и X могут быть получены обработкой бензилфосфонийбромида XI основанием, таким как трет-BuOK или LiHMDS в органическом растворителе, таком как ТГФ, с последующим добавлением в реакционную смесь кетона VII или VIII. Сульфид в IX может быть преобразован в сульфон X обработкой оксоном в растворителе, таком как смесь ТГФ/МеОН/Н 2 О. Боронатный эфир XII может быть получен при нагревании арилбромида X с пинаколдибораном в присуствии основания,такого как КОАс, и катализатора, такого как(200 мл) и CH3CN (50 мл) при 25 С по каплям добавляли трет-ВиОК (1,0 М в ТГФ, 19,9 мл,19,9 ммоль) и полученный красный раствор перемешивали при комнатной температуре в течение 20 мин. К полученному продукту затем добавляли при 25 С кетон K2 (4,4 г, 18,9 ммоль). Полученную смесь перемешивали при 60 С в 40 течение 2 дней и гасили NH4C1 (насыщ.). Затем смесь разбавляли EtOAc. Органическую фазу промывали NаНСО 3 (насыщ.), насыщенным солевым раствором, сушили над MgSO4, фильтровали и концентрировали, и использовали непосредственно на следующей стадии 2. Стадия 2. (Е)-2-(3-Бромфенил)-1-(1-метил 1 Н-имидазол-2-ил)-1-[4-(метилсульфонил)фенил]этен. К раствору сырого сульфида, то есть (E/Z)2-(3-бромфенил)-1-(1-метил-1 Н-имидазол-2-ил)1-[4-(метилтио)фенил]этена, со стадии 1 (18,9 ммоль) в ТТФ/МеОН/Н 2 О (200/100/100 мл) добавляли оксон (23,2 г, 37,8 ммоль). Смесь перемешивали при комнатной температуре в течение 4 ч, гасили NаНСО 3 (насыщ.) и разбавлялиEtOAc. Органическую фазу промывали NаНСО 3(0,2 г; 0,24 ммоль) в 50 мл ДМФ перемешивали при 90 С в течение 4 ч. Полученную смесь охлаждали до комнатной температуры, разбавляли(500 мл) и ДМФ (200 мл) при 0 С добавляли по каплям LiHMDS (1,0 М в ТГФ, 86,9 мл, 86,9 ммоль), и полученный красный раствор перемешивали при комнатной температуре в течение 20 мин. К полученному продукту затем добавляли при 0 С кетон K4 (18,6 г, 79,0 ммоль). Смесь перемешивали до завершения реакции по данным ТСХ и гасили NH4Cl (насыщ.). Затем смесь разбавляли EtOAc. Органическую фазу промывали NаНСО 3 (насыщ.), насыщенным солевым раствором, сушили над MgSO4, фильтровали и концентрировали. Флэш-хроматография (СН 2 Сl2) давала (E/Z)-2-(3-бромфе 41 нил)-1-(1,3-тиазол-2-ил)-1-[4-(метилтио)фенил] этен (смесь изомеров 1,5 к 1). Стадия 2. (E/Z)-2-(3-Бромфенил)-1-(1,3 тиазол-2-ил)-1-[4-(метилсульфонил)фенил]этен.R раствору сульфида, то есть (E/Z)-2-(3 бромфенил)-1-(1,3-тиазол-2-ил)-1-[4-(метилтио) фенил]этена, со стадии 1 (24,8 г, 63,9 ммоль) в ТТФ/МеОН/Н 2 О (600/300/300 мл) добавляли оксон (78,5 г, 128 ммоль). Полученную реакционную смесь перемешивали при комнатной температуре в течение ночи. Полученную смесь гасили NаНСО 3 (насыщ.) и разбавляли EtOAc. Органическую фазу промывали NаНСО 3 (насыщ.), насыщенным солевым раствором, сушили над Na2SO4, фильтровали и концентрировали с получением (E/Z)-2-(3-бромфенил)-1-(1,3 тиазол-2-ил)-1-[4-(метилсульфонил)фенил]этена(12,3 г, 125 ммоль) и PdCl2 (dppf) (1,46 г, 1,78 ммоль) в 350 мл ДМФ перемешивали при 90 С в течение 4 ч. Полученную смесь охлаждали до комнатной температуры, разбавляли EtOAc,промывали Н 2 О (3 х), насыщенным солевым раствором, сушили над Na2SO4, фильтровали и концентрировали. Флэш-хроматография(Tol/ацетон, 9/1) давала боронат В 2 (смесь изомеров 3 к 1) в виде пены. Боронат В 3. Пинакол 3-(Е)-2-(5-метил-2 пиридинил)-2-[4-(метилсульфонил)фенил]этенилфенилборонат. Боронат В 3 получали следующим способом. Стадия 1. (Е)-2-(3-Бромфенил)-1-(5-метил 2-пиридинил)-1-[4-(метилсульфонил)фенил] этилен. Согласно способу, описанному для стадии 1 получения бороната В 1, но используя в качестве исходного продукта вместо кетона K2 кетон K8, и после разделения изомеров с помощью флэш-хроматографии получали (Е)-2-(3 бромфенил)-1-(5-метил-2-пиридинил)-1-[4-(метилсульфонил)фенил]этилен. Стадия 2. Пинакол 3-(Е)-2-(5-метил-2 пиридинил)-2-[4-(метилсульфонил)фенил]этенилфенилборонат. Боронат В 3 получали, согласно способу,описанному для стадии 3 получения бороната В 1, но используя в качестве исходного продукта вместо (Е)-2-(3-бромфенил)-1-(1-метил-1 Н-имидазол-2-ил)-1-[4-(метилсульфонил)фенил]этена бромид (Е)-2-(3-бромфенил)-1-(5-метил-2-пиридинил)-1-[4-(метилсульфонил)фенил]этилен со стадии 1. Боронат В 4. Пинакол 3-(Е)-2-(5-(1 гидрокси-1-метилэтил)-2-пиридинил)-2-[4-(ме 004747 42 тилсульфонил)фенил]этенилфенилборонат. Боронат В 4 получали следующим способом. Стадия 1. (Е)-2-(3-Бромфенил)-1-[5-(1 гидрокси-1-метилэтил)-2-пиридинил]-1-[4-(метилсульфонил)фенил]этен. Согласно способу, описанному для стадии 1 получения бороната В 1, но заменяя в качестве исходного продукта кетон K2 на кетон K11, и после разделения изомеров с помощью флэшхроматографии, получали (Е)-2-(3-бромфенил)1-[5-(1-гидрокси-1-метилэтил)-2-пиридинил]-1[4-(метилсульфонил)фенил]этен. Стадия 2. Пинакол 3-(Е)-2-(5-(1-гидрокси-1-метилэтил)-2-пиридинил)-2-[4-(метилсульфонил)фенил]этенилфенилборонат. Боронат В 4 получали, согласно способу,описанному для стадии 3 получения бороната В 1, но заменяя в качестве исходного продукта(Е)-2-(3-бромфенил)-1-[5-(1-гидрокси-1 метилэтил)-2-пиридинил]-1-[4-(метилсульфонил)фенил]этена со стадии 1. Арилбромидные соединения, которые используются для получения соединений по данному изобретению, могут быть получены согласно схемам 3 и 4, приведенным ниже: Согласно схеме 3, представленной выше,может быть получено нитрильное промежуточное соединение ХIIIа путем алкилирования 4 метоксифенола хлорацетонитрилом в присутствии основания, такого как карбонат калия, в растворителе, таком как ацетон. Амид-оксим XIV может быть получен обработкой нитрила XIII гидроксилом амина в растворителе, таком как метанол, в присутствии основания, такого как ацетат натрия. Образование оксадизола XVI может быть достигнуто путем активации арилуксусной кислоты XV карбонилдиимидазолом в растворителе, таком как ДМФ, а затем добавлением амидоксима XIV и далее нагреванием реакционной смеси. Схема 4. Синтез арилбромидаXVII путем нагревания с арилуксусной кислотой XV в присутствии основания, такого как пиперидин, в растворителе, таком как толуол,давала ненасыщенную кислоту XVIIIа. После образования хлорангидрида кислоты XVIIIа insitu путем обработки тионилхлорида и основанием, таким как триэтиламин, в растворителе,таком как толуол, в реакционную смесь добавляли амин с получением амида XVIIIb. Оксадиазол-этен XVIIIc может быть получен путем нагревания OX1 с XVII в присутствии основания, такого как пипиридин, в растворителе, таком как толуол. Схема 4 (приложение). Синтез арилбромида Согласно схеме 4, представленной выше,обработка кислоты XVIIIa диазометаном в растворителе, таком как ТГФ, давала метиловый эфир XVIlId. Восстановление эфира XVIIId с помощью DIBAL-H в растворителе, таком как ТГФ, давало аллильный спирт XVIIIe. Преобразование спиртовой группы в XVIIIe в удаляемую группу, такую как мезилат, используя агенты, такие как метансульфонилхлорид и триэтиламин в растворителе, таком как ТГФ, а затем замещение нуклеофилом, таким как диметиламин, в растворителе, таком как ДМФ, давало соединение XVIIIf. Арилбромид АВ 1. (Е)-3-(3-Бромфенил)-2[4-(метилсульфонил)фенил]-2-пропеновая кислота. Арилбромид АВ 1 получали следующим способом. В раствор 3-бромбензальдегида (12,9 г, 70 ммоль) в толуоле (100 мл) добавляли 4(метилсульфонил)фенилуксусную кислоту (15 г,70 ммоль) и пиперидин (2 мл). После кипячения с обратным холодильников в течение ночи смесь охлаждали до комнатной температуры. В полученную таким образом взвесь добавляли толуол (10 мл). Фильтрация давала (Е)-3-(3 бромфенил)-2-[4-(метилсульфонил)фенил]-2 004747 44 пропеновую кислоту в виде белого твердого вещества. Арилбромид АВ 2. (Е)-N-Изопропил-3-(3 бромфенил)-2-[4-(метилсульфонил)фенил]-2 пропенамид. Арилбромид АВ 2 получали следующим способом. В раствор АВ 1 (24,9 г, 65 ммоль) в толуоле (250 мл) добавляли тионилхлорид (14,3 мл, 196 ммоль) и триэтиламин (34 мл, 245 ммоль). После перемешивания при комнатной температуре в течение 0,5 ч добавляли изопропиламин (28 мл, 327 ммоль). После дополнительных 2 ч при комнатной температуре смесь охлаждали до 0 С и нейтрализовали насыщенным раствором NH4Cl, затем экстрагировали(Hex:EtOAc, 1:1 - чистый EtOAc) давала (Е)-Nизопропил-3-(3-бромфенил)-2-[4-(метилсульфонил)фенил]-2-пропенамид. Арилбромид АВ 3. (Е)-3-(3-Бромфенил)-2[4-(метилсульфонил)фенил]-2-пропенамид. Арилбромид АВ 3 получали в соответствии со способом, описанным для арилбромида АВ 2,но используя в качестве исходного продукта вместо изопропиламина гидроксид аммония. Арилбромид АВ 4.(Е)-N-(трет-Бутил)-3-(3-бромфенил)-2-[4(метилсульфонил)фенил]-2-пропенамид. Арилбромид АВ 4 получали в соответствии со способом, описанным для арилбромида АВ 2,но используя в качестве исходного продукта вместо изопропиламина трет-бутиламин. Арилбромид АВ 5. (Е)-1-(3-Бромфенил)-2(3-метил-1,2,4-оксадиазол-5-ил)-2-[4-(метилсульфонил)фенил]этен. Арилбромид АВ 5 получали следующим способом. Стадия 1 (схема 3, оксадиазол OX1).(3-Метил-1,2,4-оксадиазол-5-ил)[4-(метилсульфонил)фенил]метан. К раствору 4-(метилсульфонил)фенилуксусной кислоты (15 г, 70 ммоль) в ДМФ (300 мл) при комнатной температуре добавляли карбонилдиимидазол (12,5 г, 77 ммоль). После 0,5 ч при комнатной температуре добавляли оксим ацетамида (5,7 г, 77 ммоль). После перемешивания полученной смеси в течение ночи при комнатной температуре смесь нагревали до 120 С в течение 6 ч. После охлаждения до комнатной температуры смесь гасили Н 2 О и экстрагировали EtOAc. Органические экстракты промывали 45 К раствору 3-бромбензальдегида (2,2 г,11,9 ммоль) в толуоле (30 мл) добавляли продукт стадии 1 (OX1) (3,0 г, 11,9 ммоль) и пиперидин (0,4 мл). После кипячения с обратным холодильником в течение ночи смесь охлаждали до комнатной температуры. К полученной взвеси добавляли МеОН (30 мл). После дополнительного кипячения с обратным холодильником и охлаждения до 0 С, фильтрация давала (Е)-1(3-бромфенил)-2-(3-метил-1,2,4-оксадиазол-5 ил)-2-[4-(метилсульфонил)фенил]этен в виде белого твердого вещества. Бромхинолины, которые используются для получения соединений по данному изобретению, могут быть получены в соответствии со схемой 5, представленной ниже. Схема 5. Получение бромхинолинов. Согласно схеме 5, представленной выше, и таблицы для схемы 5, представленной ниже,обработка бромметильного соединения XIX нуклеофилом, таким как метансульфинат натрия или цианид калия в растворителе, таком как ДМФ или смеси ДМФ и воды, может использоваться для получения соединений ХХа. Соединение ХХb может быть получено обработкой ХХа основанием, таким как трет-бутоксид калия(1,1 экв.) в растворителе, таком как ТГФ, с последующим добавлением полученной смеси в раствор метил йодида в растворителе, таком как ТГФ. Соединение ХХс может быть получено обработкой ХХb основанием, таким как третбутоксид калия (1,1 экв.) в растворителе, таком как ТГФ, с последующим добавлением полученной смеси в раствор метил йодида в растворителе, таком как ТГФ. Соединение ХХс (где R1= CN) может быть также получено обработкой ХХа основанием, таким как трет-бутоксид калия(2,2 экв.) и метил йодидом в растворителе, таком как ТГФ. Соединение ХХс (где R1 = SO2Me) может также быть получено обработкой ХХа основанием, таким как трет-бутоксид калия (1,3 экв.), и метил йодидом (1,6 экв.) в растворителе,таком как ТГФ, а затем дополнительным количеством метил йодида (1,6 экв.) и дополнительным количеством того же основания (1,0 экв.). Схема 5 (таблица). Бромхинолины Бромхинолин Ql. 6-(Метилсульфонил)метил-8-бромхинолин. Бромхинолин Q1 получали следующим способом. В 6-бромметил-8-бромхинолин (60 г,200 ммоль) (описан в международной патентной публикации WO 94/22852) и метансульфинат натрия (27,6 г, 270 ммоль) добавляли ДМФ (500 мл). После перемешивания в течение ночи при комнатной температуре, смесь гасили Н 2 О (2000 мл), перемешивали в течение одного часа, выделяли фильтрацией и промывали Et2O с получением 6-(метилсульфонил)метил-8 бромхинолина. Бромхинолин Q2. 6-[1-(Метилсульфонил) этил]-8-бромхинолин. Бромхинолин Q2 получали следующим способом. В раствор бромхинолина Q1 (16,1 г,54 ммоль) в ТГФ (500 мл) при -78 С, добавляли трет-бутоксид калия (59 мл, 1 н. в ТГФ). Через 0,5 ч при -78 С полученную смесь перемешивали при 0 С в течение 45 мин и затем переносили с помощью канюли по каплям в раствор MeI(16,7 мл, 268,3 ммоль) в ТГФ (160 мл). После перемешивания в течение ночи при комнатной температуре смесь нейтрализовали насыщенным раствором NH4Cl и экстрагировали EtOAc. Органические экстракты промывали (Н 2 О), (насыщенным солевым раствором), сушили(MgSO), фильтровали и концентрировали. Перемешивание в эфире с последующим выделением путем фильтрации давало 6-[1(метилсульфонил)этил]-8-бромхинолин. Бромхинолин Q3. 6-[1-Метил-1-(метилсульфонил)этил]-8-бромхинолин. Бромхинолин(55 мл, 1 н. в ТГФ). После перемешивания 0,5 ч при -78 С полученную смесь перемешивали при 0 С в течение 45 мин и затем переносили по каплям в раствор MeI (15,6 мл, 250 ммоль) в ТГФ (40 мл) при 0 С. После перемешивания в течение ночи при комнатной температуре смесь нейтрализовали насыщенным раствором NH4Cl и экстрагировали EtOAc. Органические экстракты промывали (Н 2 О, насыщенным солевым раствором), сушили (MgSO4) , фильтровали и концентрировали. Перемешивание в эфире с последующим выделением путем фильтрации давало 47 6-[1-метил-1-(метилсульфонил)этил]-8-бромхинолин. Бромхинолин Q4. 6-Цианометил-8-бромхинолин. Бромхинолин Q4 получали следующим способом. В 6-бромметил-8-бромхинолин (3 г,10 ммоль) (описан в международной патентной публикации WO 94/22852) и цианид калия (1,6 г, 25 ммоль) добавляли ДМФ (10 мл) и Н 2 О (5 мл). После нагревания при 100 С в течение 1 ч полученную смесь гасили Н 2 О (100 мл) и экстрагировали EtOAc. Органические экстракты промывали (Н 2 О, насыщенным солевым раствором), сушили (MgSO4), фильтровали и концентрировали. Очищение флэш-хроматографией(27 мл, 27 ммоль). Через 2 ч при -78 С смесь нагревали до 0 С и нейтрализовали насыщенным раствором NH4Cl, затем экстрагировали(Н 2 О, насыщенным солевым раствором), сушили (MgSO4), фильтровали и концентрировали. Очищение флэш-хроматографией (Hex:EtOAc,3:1) с получением 6-[1-метил-1-цианоэтил]-8 бромхинолина. Бензил фосфорные реагенты, которые использовали для получения соединения по данному изобретению, могут быть получены в соответствии со схемой 6, представленной ниже. Схема 6. Получение бензил фосфорных реагентов. Арилхинолины формулы XXII могут быть получены реакцией присоединения бромхинолина XX и бороновой кислоты XXI путем нагревания в присутствии катализатора, такого как Рd(РРh3)4 и основания, такого как карбонат натрия (водный) в растворителе, таком как ДМФ. Спирт XXII может быть преобразован в бромид XXIII обработкой НВr (вод.) в растворителе, таком как уксусная кислота. Спирт XXII может быть преобразован до метил сульфонат 004747 48 ного эфира XXIV с помощью хлорида метансульфонила в присутствии основания, такого как триэтиламин в растворителе, таком как дихлорметан. Бензил фосфорные реагенты XXV могут быть получены либо нагреванием XXIII в присутствии PPh3 в растворителе, таком как ацетонитрил, либо нагреванием XXIII или XXIV с диэтилфосфитом и основанием, таким как трет-бутоксид калия в растворителе, таком как ТГФ. Бромид бензилфосфония P1. Бромид [3-(6 изопропил-8-хинолинил)бензил](трифенил)фосфония. Бромид бензилфосфония Р 1 получали следующим способом. Стадия 1. 6-Изопропил 8-[3-(гидроксиметил)фенил]хинолин. Смесь 6 изопропил-8-бромхинолина (11,1 г, 44,4 ммоль)WO 94/22852), 3-(гидроксиметил)фенилбороновой кислоты (8,70 г, 57,2 ммоль), Na2CO3 (2M,71 мл, 142 ммоль) и Pd(PPh3)4 (2,51 мг, 2,17 ммоль) в 280 мл ДМЭ перемешивали при 80 С в течение 5 ч. Полученную смесь охлаждали до комнатной температуры, разбавляли EtOAc,промывали насыщенным солевым раствором,сушили над Na2SO4, фильтровали и концентрировали. Флэш-хроматография (Hex/EtOAc, 1/1) и перемешивание в СН 2 Сl/гексане (1/9) давали 6-изопропил-8-[3-(гидроксиметил)фенил]хинолин в виде белого твердого вещества. Стадия 2. 6-Изопропил-8-[3-(бромметил) фенил]хинолин. Суспензию гидроксиметильного продукта соединения данной стадии 1 (7,40 г,26,7 ммоль) в АсОН (50 мл) и НВr (50 мл, 48% вод.) перемешивали в течение 12 ч при 100 С. Смесь охлаждали до комнатной температуры,выливали в NaOH (2 н.) во льду, рН доводили до 8 и смесь разбавляли эфиром. Органическую фазу промывали насыщенным солевым раствором, сушили над MgSO4, фильтровали и концентрировали с выходом 6-изопропил-8-[3(бромметил)фенил]хинолина в виде желтого твердого продукта. Стадия 3. Бромид [3-(6-изопропил-8-хинолинил)бензил](трифенил)фосфония. В раствор бромметильного продукта соединения данной стадии 2 (3,807 г, 11,1 ммоль) в 40 мл СН 3 СN добавляли трифенилфосфин(3,22 г, 12,3 ммоль). Смесь перемешивали при 60 С в течение 12 ч, охлаждали до комнатной температуры, разбавляли эфиром, фильтровали и промывали эфиром с получением бромида [3(6-изопропил-8-хинолинил)бензил](трифенил) фосфония. Бензилфосфонат Р 2. Диэтил 3-(6-изопропил-8-хинолинил)бензилфосфонат. Бензилфосфонат Р 2 получали следующим способом. Бромметильное соединение стадии 2,представленной выше, синтеза Р 1 (11,34 г, 1 экв.) растворяли в ТГФ (170 мл). Добавляли диэтилфосфит (3,87 мл, 1,05 экв.) и раствор охлаждали до 0 С. После этого медленно добавляли трет-ВuОК (3,87 мл, 1 н. в ТГФ). РеакционнуюNH4Cl (насыщ.), воды и EtOAc. Органическую фазу отделяли и промывали насыщенным солевым раствором, сушили над MgSO4 и концентрировали. Очищение флэш-хроматографией на силикагеле (гексан : EtOAc, 1/9) давало диэтил 3-(6-изопропил-8-хинолинил)бензилфосфонат в виде прозрачного масла. Бензилфосфонат Р 3. Диэтил 3-[6-(1-циано 1-метилэтил)-8-хинолинил]бензилфосфонат. Бензилфосфонат Р 3 получали следующим способом. Стадия 1. 6-(1-Циано-1-метилэтил)-8-[3(гидроксиметил)фенил]хинолин. В соответствии со стадией 1 выше описанного способа для бромида бензилфосфония Р 1,но заменяя в качестве исходного продукта 6 изопропил-8-бромхинолин на бромхинолин Q5 получали 6-(1-циано-1-метилэтил)-8-[3-(гидроксиметил)фенил]хинолин. Стадия 2. Метансульфонат 3-[6-(1-циано 1-метилэтил)-8-хинолинил]бензила. В раствор спирта 6-(1-циано-1-метилэтил)8-[3-(гидроксиметил)фенил]хинолина данной стадии 1 (5,15 г, 17 ммоль) в СН 2 Сl2 (150 мл) при -78 С добавляли Et3N (3,6 мл, 26 ммоль) и хлорид метансульфонила (MsCl) (1,6 мл, 21 ммоль). Через 0,5 ч при -78 С смесь нейтрализовали насыщенным раствором NH4Cl, разбавляли водой и экстрагировали простым эфиром. Органические экстракты промывали (Н 2 О, насыщенным солевым раствором), сушили(MgSO4), фильтровали и концентрировали с получением метансульфоната 3-[6-(1-циано-1 метилэтил)-8-хинолинил]бензила в виде белой пены. Стадия 3. Диэтил 3-[6-(1-циано-1 метилэтил)-8-хинолинил]бензилфосфонат. В раствор диэтилфосфита (2,5 мл, 18 ммоль) в ТГФ (100 мл) при -78 С добавляли трет-бутоксид калия (1 М, ТГФ, 16 мл, 16 ммоль) и мезилатное соединение метансульфоната 3-[6(1-циано-1-метилэтил)-8-хинолинил] бензила со стадии 2 (5,1 г, 13,5 ммоль). Через 0,5 ч при 78 С и 12 ч при комнатной температуре полученную смесь нейтрализовали насыщенным раствором NH4Cl, разбавляли водой и экстрагировали простым эфиром. Органические экстракты промывали (Н 2 О, насыщенным солевым раствором), сушили (MgSO4), фильтровали и концентрировали. Очистка флэш-хроматографией(Hex:EtOAc, 1:4 до 1:10) давало диэтил 3-[6-(1 циано-1-метилэтил)-8-хинолинил]бензилфосфонат в виде масла. Схема 7. Реакция присоединения бензилфосфорного соединения - кетона. Соединения, соответствующие формуле I,могут быть получены, используя реакционные пути, указанные на схеме 7 выше. СоединениеXXVI может быть получено добавлением раствора кетона VII в растворителе, таком как ТГФ,в смесь бензилфосфорного реагента XXV и основания, такого как трет-бутоксид калия, в растворителе, таком как ТГФ. Соединения, соответствующие формуле I, могут затем быть получены обработкой XXVI оксоном в смеси растворителей, такой как ТГФ/МеОН/вода. Альтернативно, соединения формулы I могут быть получены взаимодействием кетона VIII с XXV в присутствии основания, такого как третбутоксида калия, в растворителе, таком как ТГФ. Согласно схеме 7, представленной выше, и табл.1, представленной ниже, реакция присоединения кетонов и бензилфосфорных реагентов давала соединения примеров, представленных в таблице. Схема 8. Реакция присоединения арилбромида - бромхинолина. Согласно схеме 8, соединения, соответствующие формуле I, могут быть получены преобразованием in situ арилбромида XVIII в соответствующий боронатный эфир при нагревании с диборонатным эфиром пинакола, катализатором, таким как [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий (II), и основанием, таким как ацетат калия, в растворителе, таком как ДМФ, с последующим добавлением бромхинолина XX, дополнительного количества катализатора, дополнительного количества основания,такого как карбонат натрия (водный) и с дополнительным временем нагревания. Согласно схеме 8, представленной выше,табл.2 и табл. 2 (приложение), представленной ниже, реакция присоединения арилбромида с бромхинолином давала соединения примеров,представленных в виде таблицы. Соединения по данному изобретению могут быть получены в соответствии со схемой 9,представленной ниже. Схема 9 На схеме 9 схематически представлено получение соединений формулы I, где альдегидXXVII может быть получен нагреванием бромхинолина XX, 3-формилбензолбороновой кислоты, катализатора, такого как Pd(PPh3)4 и основания, такого как карбонат натрия (водный) в растворителе, таком как ДМФ. Альдегид XXVII может быть преобразован в соединение примера 18 нагреванием с XVI в присутствии основания,такого как пиперидин, в растворителе, таком как толуол. Соединение примера 19 может быть получено обработкой соединения примера 18 нитратом церия-аммония (CAN) в смеси растворителей, таких как ацетонитрил/вода. Альтернативно, альдегид XXVII может быть преобразован в ненасыщенную кислоту XXVIII нагреванием с XV и основанием, таким как пиперидин, в растворителе, таком как толуол. Кислота XXVIII может быть затем преобразована в амид I (пример 27, 28 и 29) обработкой системой связывания, например, EDCI, HOBt и амин,в растворителе, таком как ДМФ. Соединения по данному изобретению могут быть получены присоединением бромхинолиновых соединий и боронатными соединениями в соответствии со схемой 10, представленной ниже. Схема 10. Реакция присоединения бромхинолина - бороната. 53 Схема 10 показывает каким образом соединения формулы I могут быть получены при реакции присоединения бромхинолина XX с боронатом сложного эфира XII в присутствии катализатора, такого как Pd(OAc)2, РРh3 и основания, такого как карбонат натрия (водный) в растворителе, таком как н-пропанол. Ссылаясь на табл. 3, реакция присоединения бромхинолина и бората давала продукты примеров, представленных в виде таблицы. Продукты примеров 1 и 2 получали в соответствии со следующим способом. К смеси бензилфосфоната Р 2 (330 мг, 0,83 ммоль) и кетонаK3 (200 мг, 0,77 ммоль) в ТГФ (6 мл) при комнатной температуре добавляли трет-бутоксид калия (1 М, ТГФ, 0,83 мл, 0,83 ммоль). Через 1 ч при комнатной температуре смесь разбавляли водой и экстрагировали Et2O, органические экстракты промывали (Н 2 О), (насыщенным солевым раствором), сушили (MgSO4), фильтровали и концентрировали. Очистка флэш-хроматографией (Hex: EtOAc, 7:3) давала продукты примеров 1 и 2 в виде белой пены, где один продукт был менее полярным, чем другой продукт. Продукт примера 1 представлял собой менее полярный Z-изомер, а продукт примера 2 представлял собой более полярный Е-изомер. Пример 1. ЯМР 1 Н (400 МГц, ацетон-d6)8,79 (кв., 1 Н), 8,28 (кв., 1 Н), 7,94 (д, 2 Н), 7,73 (д,1 Н), 7,6-7,1 (м, 14 Н), 3,14 (м, 1 Н), 2,97 (с, 3 Н),1,34 (д, 6 Н). Продукт примера 3 получали в соответствии со следующим способом. К суспензии бромида бензилфосфония Р 1 (320 мг, 0,531 ммоль) в 2,5 мл ТГФ при -78 С по каплям добавляли трет-ВuОК (1,0 М в ТГФ, 0,55 мл, 0,55 ммоль) и полученный раствор красного цвета перемешивали в течение 30 мин при 0 С. К этому полученному продукту при -78 С затем по каплям добавляли кетон K5 (122 мг, 0,455 ммоль) в 2 мл ТГФ. Смесь нагревали при комнатной температуре, затем перемешивали в течение 1 ч, гасилиNH4Cl (насыщенный) и разбавляли EtOAc. Органическую фазу промывали насыщенным солевым раствором, сушили Na2SO4, фильтровали и концентрировали. Флэш-хроматография (патронный силикагель, Hex/EtOAc от 10 до 100% в 20 мин) давала продукт примера 3 (смесь изомера 1,5 к 1). ЯМР 1 Н (500 МГц, ацетон-d6)8,79-8,78 Продукт примера 4 получали следующим способом. Стадия 1. 6-Изопропил-8-(3-(Е)-2-(1 метил-1 Н-имидазол-2-ил)-2-[4(метилтио)фенил] винилфенил)хинолин. 6-Изопропил-8-(3-(Е)-2-(1-метил-1 Нимидазол-2-ил)-2-[4-(метилтио)фенил]винил фенил)хинолин получали в соответствии со спо 55 собом получения примера 3, заменяя в качестве исходного продукта K5 на K2. Стадия 2. 6-Изопропил-8-(3-(Е)-2-(1 метил-1 Н-имидазол-2-ил)-2-[4-(метилсульфонил)фенил]винилфенил)хинолин. Продукт примера 4 получали в соответствии со способом получения бората В 1 (стадия 2 схемы 2), но заменяя в качестве исходного продукта Примеры 5 и 6 получали следующим способом. Продукты примеров 5 и 6 получали в соответствии со способом получения примера 1, но заменяя в качестве исходного продукта кетонK3 на K1, и с помощью очистки флэшхроматографией (50% EtOAc/50% гексан). ЯМР 1 Н (500 МГц, ацетон-d6) пример 5: основной (Z) изомер:8,78 (дд, 1 Н), 8,25 (дд,1 Н), 7,93 (д, 2 Н), 7,72 (д, 1 Н), 7,55-7,40 (м, 6 Н),7,35 (м, 2 Н), 7,25 (т, 1 Н), 7,23 (с, 1 Н), 7,11 (т,2 Н), 7,05 (д, 1 Н), 3,12 (м, 1 Н), 2,96 (с, 3 Н), 1,34 Продукт примера 7 получали в соответствии со способом примера 1, но заменяя в качестве исходного продукта кетон K3 на K6. Очистка флэш-хроматографией (100% EtOAc) давала продукт примера 7 в виде смеси изомеров. ЯМР 1 Н (400 МГц, ацетон-d6)8,80 (м,1 Н), 8,30 (м, 1 Н), 8,05 (д (основной), 1,44 Н),7,93 (д (второстепенный), 0,55 Н), 7,85 (с (основной), 0,72 Н), 7,77 (с (второстепенный), 0,28 Н),7,75-7,45 (м, 7 Н) 7,35 (т (второстепенный),0,28 Н), 7,28 (т (основной), 0,72 Н), 7,21 (д (второстепенный), 0,28 Н), 7,10 (д (основной),0,72 Н), 4,7 (м, 1 Н), 3,15 (м, 1 Н), 3,15 (с (второстепенный), 0,84), 2,99 (s (основной), 2,16 Н),1,60 (м, 6 Н), 1,35 (м, 6 Н). Продукт примера 8 получали в соответствии со способом получения примера 1, но заменяя в качестве исходного продукта кетон K3 наK6 и бензилфосфонат Р 2 на Р 3. Очистка флэшхроматографией (20% СН 2 Сl2/80% EtOAc) давала продукт примера 8 в виде смеси изомеров. ЯМР 1 Н (400 МГц, ацетон-d6)8,92 (м,1 Н), 8,45 (м, 1 Н), 8,10 (м, 1 Н), 8,05 (т, 1 Н), 7,93 Пример 9 получали следующим способом. Стадия 1. 2-Mетил-2-[8-(3-(Е)-2-(1-метил 1 Н-имидазол-2-ил)-2-[4-(метилтио)фенил]винилфенил)-6-хинолинил]пропаннитрил получали в соответствии со способом получения примера 1, но заменяя в качестве исходных продуктов кетон K3 на K2 и бензил фосфонат Р 2 на Р 3. Стадия 2. 2-Метил-2-[8-(3-(Е)-2-(1-метил 1 Н-имидазол-2-ил)-2-[4-(метилсульфонил)фенил]винилфенил)-6-хинолинил]пропаннитрил,продукт примера 9, получали в соответствии со способом, который использовался для получения бороната В 1 (стадия 2 схемы 2), но заменяя в качестве исходного продукта (E/Z)-2-(3 бромфенил)-1-(1-метил-1 Н-имидазол-2-ил)-1-[4(метилтио)фенил]этилен на сульфид, полученный в представленной стадии 1. Продукт примера 9 получали после очистки флэшхроматографией (97% EtOAc Et3N/3%). ЯМР 1 Н (400 МГц, ацетон-d6)8,92 (дд,1 Н), 8,45 (дд, 1 Н), 8,10 (д, 1 Н), 7,93 (д, 2 Н), 7,76 Продукт примера 10 получали в соответствии со следующим способом. Смесь бромхинолина Q2 (105 мг, 0,33 ммоль), бороната В 2 (236 мг, 0,51 ммоль), Nа 2 СО 3 (2 М, 0,65 мл, 1,3 ммоль), Pd(OAc)2 (6,3 мг, 0,028 ммоль) и РРh3(28 мг, 0,11 ммоль) в 4 мл н-пропанола перемешивали при 90 С в течение 2 ч. Смесь охлаждали при комнатной температуре, разбавлялиEtOAc, промывали насыщенным солевым раствором, сушили над Nа 2SO4, фильтровали и концентрировали. Флэш-хроматография (толуол/ацетон; 4/1) и перемешивание в гексане/EtOAc давали продукт примера 10 (единичный изомер) в виде белого твердого вещества. Пример 11 получали в соответствии со способом, описанным в примере 10, но заменяя бромхинолин Q2 на Q3 и используя боронат В 2. Флэш-хроматография (толуол/ацетон; 9/1) и перемешивание в EtOAc/Hex давала продукт примера 11 (единственный изомер) в виде белого твердого вещества. ЯМР 1 Н (400 МГц, ацетон-d6)8,90 (дд,1 Н), 8,41 (дд, 1 Н), 8,23 (с, 1 Н), 8,02-7,99 (д, 3 Н),7,95 (с, 1 Н), 7,86 (д, 1 Н), 7,70 (д, 2 Н), 7,60-7,54 Пример 12 получали в соответствии со способом, описанным в примере 10, используя бромхинолин Q2, но заменяя боронат В 2 н В 1. Флэш-хроматография (95% СН 2 Сl2/5% EtOH) давала соединение примера 12. ЯМР 1 Н (400 МГц, ацетон-d6)8,92 (дд,1 Н), 8,45 (дд, 1 Н) 8,10 (с, 1 Н), 7,93 (д, 2 Н), 7,767,65 (м, 4 Н), 7,59 (дд, 1 Н) 7,39 (т, 1 Н), 7,26 (с,1 Н), 7,18 (с, 1 Н), 7,05 (м, 2 Н), 4,7 (кв., 1 Н), 3,40 Пример 13 получали в соответствии со способом, описанным в примере 10, но заменяя бромхинолин Q2 на Q3 и заменяя боронат В 2 на В 1. Флэш-хроматография (95% EtOAc/5 %Et3N) давала продукт примера 13 (единичный изомер) в виде пены. ЯМР 1 Н (400 МГц, ацетон-d6)8,92 (дд,1 Н), 8,45 (дд, 1 Н), 8,37 (д, 1 Н), 8,05 (д, 1 Н), 7,93 Примеры 14 и 15 получали в соответствии со следующим способом. Раствор бромида арила АВ 5 (249 мг, 0,57 ммоль), диборонового сложного эфира пинакола (167 мг, 0,66 ммоль),[1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладия (II) (12 мг, 0,015 ммоль) и ацетата калия (17 6 мг, 1,8 ммоль) в ДМФ (N,Nдиметилформамид) (10 мл) дегазировали и размешивали при 80 С в течение 3 ч. К полученной таким образом смеси при 25 С затем добавляли бромхинолин Q3 (150 мг, 0,46 ммоль), [1,1'бис(дифенилфосфино)ферроцен]дихлорпалладий(II) (12 мг, 0,015 ммоль) и карбонат натрия(0,6 мл, 2 М). После дегазирования смесь нагревали при 80 С в течение ночи. Затем смесь ох 004747 60 лаждали до комнатной температуры, гасили Н 2 О и экстрагировали EtOAc. Органические экстракты промывали (Н 2 О, насыщенным солевым раствором), сушили (MgSO4), фильтровали и концентрировали. Очистка флэш-хроматографией (гексан : EtOAc : Et3N, 22 : 68 : 10, затем гексаном : Еt : ОАс, 3:1) давала оба изомераMS (M+1): 588,2. Альтернативно, продукт примера 14 может быть получен в соответствии со следующим способом. К метансульфоновой кислоте (8-10 экв.) при 20 С добавляли м-нитробезолсульфонат натрия (0,6-0,8 экв.), а затем гептагидрат сульфата железа (0,01-0,05 экв.). К полученной смеси добавляли 2-бром-4-метиланилин (1 экв.).
МПК / Метки
МПК: C07D 215/12, A61K 31/47
Метки: фосфодиэстеразы-4, ингибиторы, 8-арилхинолиновые, замещенные
Код ссылки
<a href="https://eas.patents.su/30-4747-zameshhennye-8-arilhinolinovye-ingibitory-fosfodiesterazy-4.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенные 8-арилхинолиновые ингибиторы фосфодиэстеразы-4</a>
Предыдущий патент: Производные бензимидазола и имидазопиридина в качестве ингибиторов репликации респираторно-синцитиального вируса
Следующий патент: Полиморфные формы 4-амино-6,7-диметокси-2-(5-метансульфонамидо-1,2,3,4-тетрагидроизохинолин-2-ил)-5-(2-пиридил) хиназолина и его мезилатной соли
Случайный патент: Способ контроля подлинности и перемещения алкогольной продукции (варианты) и система для осуществления способов


































