Производные фторпиридинона, полезные в качестве антибактериальных агентов
Номер патента: 24782
Опубликовано: 31.10.2016
Авторы: Рейлли Юса, Монтгомери Джастин Йэн, Браун Мэттью Фрэнк, Че Йе, Мелник Майкл Джозеф, Пламмер Марк Стефен, Прайс Лорен Майкл
Формула / Реферат
1. Соединение формулы
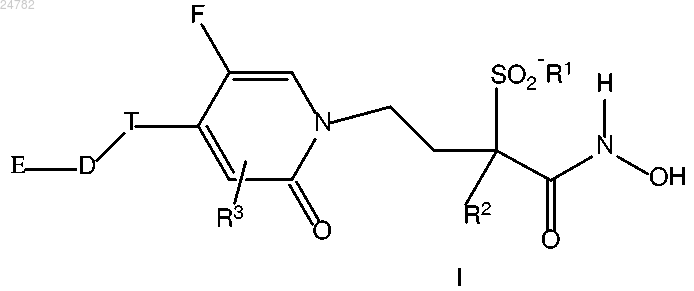
или его фармацевтически приемлемая соль, где
R1 представляет собой С1-С3алкил;
R2 представляет собой водород или С1-С3алкил;
R3 представляет собой водород, галоген, гидрокси, циано, С1-С3алкил, С1-С3алкокси, трифторметил или трифторметокси;
T представляет собой этинил, (C6-C10)арил, возможно замещенный заместителями в количестве вплоть до 4, причем каждый заместитель независимо выбран из галогена; циано; нитро; гидрокси; (C1-C6)алкила, возможно замещенного заместителями в количестве вплоть до 3, выбранными из галогена, циано, -OR4, -SR4 и -NR4R5; (C1-C6)алкокси, возможно замещенного галогенами в количестве вплоть до 3; фосфата; -SO2NR4R5; -(CH2)m-NR5-C(O)-R4; -(CH2)m-C(O)-N-R4R5; -C(O)-R4, -C(O)-O-R4; -SR4, -SO2R4 и -NR4R5; или гетероарил, представляющий собой 5- или 6-членное ароматическое кольцо, содержащее 1, 2, 3 или 4 атома азота, либо 1 атом кислорода, либо 1 атом серы, либо 1 атом азота и 1 атом серы, либо 1 атом азота и 1 атом кислорода, либо 2 атома азота и 1 атом кислорода, либо 2 атома азота и 1 атом серы, или бициклическую группу, в которой вышеуказанное гетероарильное кольцо конденсировано с бензольным кольцом или 5- или 6-членным ароматическим кольцом, содержащим 1 или 2 атома азота, либо 1 атом кислорода, либо 1 атом серы, в котором вплоть до 4 атомов углерода указанного гетероарила могут быть замещены заместителем, выбранным из галогена; циано; нитро; гидрокси; (C1-C6)алкила, возможно замещенного заместителями в количестве вплоть до 3, выбранными из галогена, -OR4 и -SR4; (C1-C6)алкокси; -SR4 и -NR4R5;
каждый m независимо означает целое число от 0 до 4;
D отсутствует или представляет собой -(CH2)r-, -(CH2)n-O-(CH2)p- или связь;
r означает целое число 1, 2 или 3;
каждый из n и p независимо означает целое число 0, 1 или 2;
E отсутствует или представляет собой заместитель, выбранный из:
1) (C3-C10)циклоалкила, возможно замещенного группой гидрокси;
2) (C6-C10)арила;
3) гетероарила, представляющего собой 5- или 6-членное ароматическое кольцо, содержащее 1, 2, 3 или 4 атома азота, либо 1 атом азота и 1 атом серы, либо 1 атом азота и 1 атом кислорода, либо 2 атома азота и 1 атом кислорода, либо 2 атома азота и 1 атом серы, возможно замещенного (C1-C4)алкилом, (C1-C4)алкокси, гидрокси или -SR4; и
4) гетероциклической группы, представляющей собой 3- или 4-членное кольцо, содержащее гетероатом, выбранный из кислорода, азота и серы, либо 5- или 6-членное кольцо, содержащее 1 или 2 атома азота, либо 1 атом кислорода, либо 1 атом серы;
при условии, что:
1) если E отсутствует, то D также отсутствует;
2) если E и D оба отсутствуют, R3 представляет собой водород, и каждый из R1 и R2 представляет собой метил, то T не является незамещенным фенилом;
каждый из R4 и R5 независимо представляет собой водород или С1-С3алкил.
2. Соединение по п.1 или его фармацевтически приемлемая соль, где каждый из R1 и R2 представляет собой метил.
3. Соединение по п.1 или 2 или его фармацевтически приемлемая соль, где R3 представляет собой водород.
4. Соединение по п.2 или 3 или его фармацевтически приемлемая соль, где указанное соединение является R-энантиомером.
5. Соединение по любому из пп.1, 2, 3 или 4 или его фармацевтически приемлемая соль, где T представляет собой фенил, который возможно может быть замещенным заместителями в количестве вплоть до 4, причем каждый заместитель независимо выбран из галогена; циано; нитро; гидрокси; (C1-C6)алкила, возможно замещенного заместителями в количестве вплоть до 3, выбранными из галогена, циано, -OR4, -SR4 и -NR4R5; (C1-C6)алкокси, возможно замещенного галогенами в количестве вплоть до 3; фосфата; -SO2NR4R5; -(CH2)m-NR5-C(O)-R4; -(CH2)m-C(O)-N-R4R5; -C(O)-R4, -C(O)-O-R4; -SR4, -SO2R4 и -NR4R5.
6. Соединение по любому из пп.1, 2, 3, 4 или 5 или его фармацевтически приемлемая соль, где D и E оба отсутствуют.
7. Соединение по любому из пп.1-5 или его фармацевтически приемлемая соль, где D представляет собой связь.
8. Соединение по п.7 или его фармацевтически приемлемая соль, где E представляет собой циклопропил или циклогексил, возможно замещенные группой гидрокси; пиримидинил, триазолил, пиридинил или изоксазолил, возможно замещенные (C1-C4)алкилом, (C1-C4)алкокси, гидрокси или SR4.
9. Соединение формулы
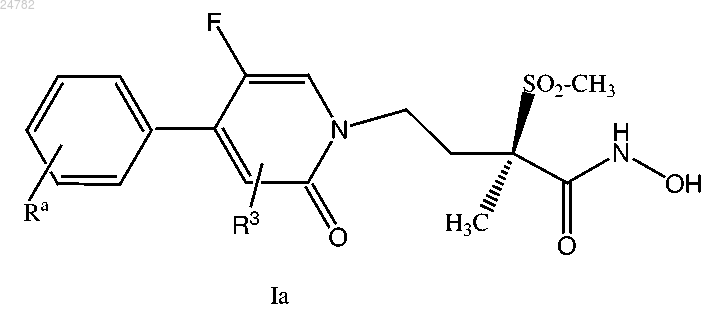
или его фармацевтически приемлемая соль, где
R3 представляет собой водород, галоген, гидрокси, циано, С1-С3алкил, С1-С3алкокси, трифторметил или трифторметокси;
Ra представляет собой один или более заместителей, выбранных из С1-С3алкила, С1-С3алкокси, фтора, хлора, гидрокси, трифторметила и трифторметокси.
10. (2R)-4-{5-Фтор-2-оксо-4-[4-(2H-1,2,3-триазол-2-ил)фенил]пиридин-1(2H)-ил}-N-гидрокси-2-метил-2-(метилсульфонил)бутанамид или его фармацевтически приемлемая соль.
11. (2R)-4-[5-Фтор-4-(2-фтор-4-метоксифенил)-2-оксопиридин-1(2H)-ил]-N-гидрокси-2-метил-2-(метилсульфонил)бутанамид или его фармацевтически приемлемая соль.
12. Фармацевтическая композиция, которая ингибирует LpxC [UDP-3-O-(R-3-гидроксимиристоил)-N-ацетилглюкозаминдеацетилаза], содержащая соединение по любому из пп.1-11 или его фармацевтически приемлемую соль в смеси по меньшей мере с одним фармацевтически приемлемым эксципиентом.
13. Способ лечения грамотрицательных бактериальных инфекций, включающий введение соединения по любому из пп.1-11 или его фармацевтически приемлемой соли пациенту, нуждающемуся в таком лечении.
14. Применение соединения по любому из пп.1-11 или его фармацевтически приемлемой соли в изготовлении лекарственного средства против грамотрицательных бактериальных инфекций.
Текст
Изобретение относится к новому классу производных гидроксамовой кислоты формулы I где радикалы R1, R2, R3, Т, D и E такие, как определено в описании изобретения. Также настоящее изобретение относится к применению вышеуказанных производных гидроксамовой кислоты формулы I в качестве ингибиторов LpxC и, более конкретно, к их применению для лечения бактериальных инфекций. Область изобретения Данное изобретение относится к новым производным гидроксамовой кислоты. Изобретение также относится к способам использования таких соединений в лечении бактериальных инфекций (в частности грамотрицательных инфекций) и к фармацевтическим композициям, содержащим такие соединения. Предшествующий уровень техники Инфицирование грамотрицательными бактериями, такими как Pseudomonas aeruginosa, энтеробактерии, продуцирующие Р-лактамазы широкого спектра (ESBL), и Acinetobacter baumannii, является большой проблемой здравоохранения, особенно в случае внутрибольничных инфекций. Кроме того, наблюдается увеличение уровня устойчивости к существующим в настоящее время антибиотическим терапевтическим средствам, что серьезно ограничивает возможности лечения. Например, в 2002 году 33% инфекций Pseudomonas aeruginosa в учреждениях интенсивной терапии были устойчивы к фторхинолонам, а устойчивость к имипенему составляла 22% (CID 42: 657-68, 2006). Помимо этого, инфекции, устойчивые ко многим лекарственным средствам (MDR), также увеличиваются. В случае Pseudomonasaeruginosa, количество MDR инфекций увеличилось с 4% в 1992 до 14% в 2002 (Biochem Pharm 71: 991,2006). Грамотрицательные бактерии уникальны в том, что их внешняя мембрана содержит липополисахарид (LPS), который имеет решающее значение для сохранения целостности мембраны и важен для жизнеспособности бактерий (обзор опубликован в Ann. Rev. Biochem 76: 295-329, 2007). Основным липидным компонентом LPS является липид А, и ингибирование биосинтеза липида А является летальным для бактерий. Липид А синтезируется на цитоплазматической поверхности бактериальной внутренней мембраны путем, в который вовлечены девять разных ферментов. Эти ферменты являются высококонсервативными в большинстве грамотрицательных бактерий. LpxC [UDP-3-O-(R-3-гидроксимиристоил)-Nацетилглюкозаминдеацетилаза] является ферментом, который катализирует первую коммитированную стадию в пути биосинтеза липида А, удаление N-ацетильной группы UDP-3-O-(R-3-гидроксимиристоил)N-ацетилглюкозамина. LpxC представляет собой Zn2+-зависимый фермент, который не имеет гомолога у млекопитающих, что делает его хорошей мишенью для разработки новых антибиотиков. Известно несколько ингибиторов LpxC с низкой нМ аффинностью (Biochemistry 45: 7940-48, 2006). Краткое изложение сущности изобретения Обнаружен новый класс ингибиторов LpxC. Эти соединения или их фармацевтически приемлемые соли могут иметь приведенную ниже формулу I:R2 представляет собой водород или С 1-С 3 алкил;T представляет собой этинил, (C6-C10)арил, возможно замещенный заместителями в количестве вплоть до 4, причем каждый заместитель независимо выбран из группы, состоящей из галогена; циано; нитро; гидрокси; (C1-C6)алкила, возможно замещенного заместителями в количестве вплоть до 3, выбранными из группы, состоящей из галогена, циано, -OR4, -SR4 и -NR4R5; (C1-C6)алкокси, возможно замещенного галогенами в количестве вплоть до 3; фосфата; -SO2NR4R5; -(CH2)m-NR5-C(O)-R4; -(CH2)mC(O)-N-R4R5; -C(O)-R4, -C(O)-O-R4; -SR4, -SO2R и -NR4R5; или гетероарил, представляющий собой 5- или 6-членное ароматическое кольцо, содержащее 1, 2, 3 или 4 атома азота, либо 1 атом кислорода, либо 1 атом серы, либо 1 атом азота и 1 атом серы, либо 1 атом азота и 1 атом кислорода, либо 2 атома азота и 1 атом кислорода, либо 2 атома азота и 1 атом серы, или бициклическую группу, в которой вышеуказанное гетероарильное кольцо конденсировано с бензольным кольцом или 5- или 6-членным ароматическим кольцом, содержащим 1 или 2 атома азота, либо 1 атом кислорода, либо 1 атом серы, в котором вплоть до 4 атомов углерода указанного гетероарила могут быть замещены заместителем, выбранным из группы, состоящей из галогена; циано; нитро; гидрокси; (C1-C6)алкила, возможно замещенного заместителями в количестве вплоть до 3, выбранными из группы, состоящей из галогена, -OR4 и -SR4; (C1C6)алкокси; -SR4 и -NR4R5; каждый m независимо означает целое число от 0 до 4;D отсутствует или представляет собой -(CH2)r-, -(CH2)n-O-(CH2)p- или связь;r означает целое число 1, 2 или 3; каждый из n и p независимо означает целое число 0, 1 или 2;E отсутствует или представляет собой заместитель, выбранный из группы, состоящей из: 1) (C3-C10)циклоалкила, возможно замещенного группой гидрокси; 2) (C6-C10)арила;-1 024782 3) гетероарила, представляющего собой 5- или 6-членное ароматическое кольцо, содержащее 1, 2, 3 или 4 атома азота, либо 1 атом азота и 1 атом серы, либо 1 атом азота и 1 атом кислорода, либо 2 атома азота и 1 атом кислорода, либо 2 атома азота и 1 атом серы, возможно замещенного (C1-C4)алкилом, (C1C4)алкокси, гидрокси или -SR4; и 4) гетероциклической группы, представляющей собой 3- или 4-членное кольцо, содержащее гетероатом выбранный из кислорода, азота и серы, либо 5- или 6-членное кольцо, содержащее 1 или 2 атома азота, либо 1 атом кислорода, либо 1 атом серы; при условии, что: 1) если E отсутствует, то D также отсутствует; 2) если E и D оба отсутствуют, R3 представляет собой водород, и каждый из R1 и R2 представляет собой метил, то T не является незамещенным фенилом; каждый из R4 и R5 независимо представляет собой водород или С 1-С 3 алкил. В предпочтительном воплощении у соединений по изобретению или их фармацевтически приемлемых солей каждый из R1 иR2 представляет собой метил. В еще одном предпочтительном воплощении у соединений по изобретению или их фармацевтически приемлемых солей R3 представляет собой водород. В более предпочтительном воплощении соединения по изобретению или их фармацевтически приемлемые соли являются R-энантиомерами. В еще одном предпочтительном воплощении у соединений по изобретению или их фармацевтически приемлемых солей T представляет собой фенил, который возможно может быть замещенным заместителями в количестве вплоть до 4, причем каждый заместитель независимо выбран из группы, состоящей из галогена; циано; нитро; гидрокси; (C1-C6)алкила, возможно замещенного заместителями в количестве вплоть до 3, выбранными из группы, состоящей из галогена, циано, -OR4, -SR4 и -NR4R5; (C1-C6) алкокси, возможно замещенного галогенами в количестве вплоть до 3; фосфата; -SO2NR4R5; -(CH2)mNR5-C(O)-R4; -(CH2)m-C(O)-N-R4R5; -C(O)-R4, -C(O)-O-R4; -SR4, -SO2R4 и -NR4R5. В еще одном предпочтительном воплощении у соединений по изобретению или их фармацевтически приемлемых солей D и E оба отсутствуют. В еще одном предпочтительном воплощении у соединений по изобретению или их фармацевтически приемлемых солей D представляет собой связь. В более предпочтительном воплощении у соединений по изобретению или их фармацевтически приемлемых солей E представляет собой циклогексил или циклопропил, возможно замещенные группой гидрокси; пиримидинил, триазолил, пиридинил или изоксазолил, возможно замещенные (C1-C4)алкилом,(C1-C4)алкокси, гидрокси или SR4. Также в настоящем изобретении предложены соединения формулы или их фармацевтически приемлемые соли,где R3 представляет собой водород, галоген, гидрокси, циано, С 1-С 3 алкил, С 1-С 3 алкокси, трифторметил или трифторметокси;Ra представляет собой один или более заместителей, выбранных из группы, состоящей из C1 С 3 алкила, С 1-С 3 алкокси, фтора, хлора, гидрокси, трифторметила и трифторметокси. Также в настоящем изобретении предложен (2R)-4-5-фтор-2-оксо-4-[4-(2H-1,2,3-триазол-2 ил)фенил]пиридин-1(2H)-ил-N-гидрокси-2-метил-2-(метилсульфонил)бутанамид или его фармацевтически приемлемая соль. Кроме того, в настоящем изобретении предложен (2R)-4-[5-фтор-4-(2-фтор-4-метоксифенил)-2 оксопиридин-1(2H)-ил]-N-гидрокси-2-метил-2-(метилсульфонил)бутанамид или его фармацевтически приемлемая соль. Также в настоящем изобретении предложена фармацевтическая композиция, которая ингибируетLpxC [UDP-3-O-(R-3-гидроксимиристоил)-N-ацетилглюкозаминдеацетилаза], содержащая соединение по изобретению или его фармацевтически приемлемую соль в смеси по меньшей мере с одним фармацевтически приемлемым эксципиентом. Также в настоящем изобретении предложен способ лечения грамотрицательных бактериальных инфекций, включающий введение соединения по изобретению или его фармацевтически приемлемой соли пациенту, нуждающемуся в таком лечении. Кроме того, в настоящем изобретении предложено применение соединения по изобретению или его фармацевтически приемлемой соли в изготовлении лекарственного средства против грамотрицательных бактериальных инфекций. Подробное описание изобретения Заголовки в этом документе используются только для облегчения его чтения. Их никоим образом не следует толковать как ограничивающие изобретение или притязания. Соединения формулы I проявляют антибактериальную активность, в частности против грамотрицательных микроорганизмов. Их можно применять для лечения бактериальных инфекций у млекопитающих, в частности у людей. Эти соединения можно также применять в ветеринарии, например для лечения инфекций у домашнего скота и животных-компаньонов. Соединения формулы I полезны для лечения различных инфекций, в частности грамотрицательных инфекций, включая внутрибольничную пневмонию, инфекции мочевых путей, системные инфекции(бактериемия и сепсис), кожные инфекции и инфекции мягких тканей, хирургические инфекции, внутрибрюшинные инфекции, легочные инфекции (включая инфекции у пациентов с муковисцидозом), Helicobacter pylori (и ослабление ассоциированных желудочных осложнений, таких как пептическая язва, желудочный канцерогенез и т.д.), эндокардит, диабетические инфекции стопы, остеомиелит и инфекции центральной нервной системы. Для упрощения введения соединения обычно смешивают по меньшей мере с одним эксципиентом и готовят в виде фармацевтической лекарственной формы. Примеры таких лекарственных форм включают таблетки, капсулы, растворы/суспензии для инъекций, аэрозоли для ингаляций, кремы/мази для местного, ушного или офтальмического применения и растворы/суспензии для перорального приема. Определения и иллюстративные примеры Используемые по всему тексту данной заявки, включая формулу изобретения, термины имеют значения, которые определены ниже, если конкретно не указано иное. Формы множественного числа и единственного числа, за исключением указанных чисел, следует считать взаимозаменяемыми. а) "С 1-С 3 алкил" относится к разветвленной или прямоцепочечной алкильной группе, содержащей от 1 до 3 атомов углерода, такой как метил, этил, н-пропил или изопропил и т.д. б) "С 1-С 3 алкокси" относится к алкоксигруппе с прямой или разветвленной цепью, содержащей от 1 до 3 атомов углерода, такой как метокси, этокси, н-пропокси, изопропокси и т.д. в) "галоген" относится к атому хлора, фтора, йода или брома. г) "С 1-С 6 алкил" относится к разветвленной или прямоцепочечной алкильной группе, содержащей от 1 до 6 атомов углерода, такой как метил, этил, н-пропил, изопропил, н-бутил, изобутил, пентил и т.д. д) "С 1-С 6 алкил, возможно замещенный" относится к разветвленной или прямоцепочечной алкильной группе, содержащей от 1 до 6 атомов углерода, такой как метил, этил, н-пропил, изопропил, н-бутил,изобутил, пентил и т.д. Такая алкильная группа возможно может быть замещенной, и в ней вплоть до 3 атомов водорода могут быть замещены заместителем, выбранным из группы, состоящей из галогена, циано, сульфонамида, имино, -OR4, -SR4 и -NR4R5, где каждый из R4 и R5 независимо представляет собой водород или С 1-С 3 алкил. е) "С 1-С 6 алкокси" относится к алкоксигруппе с прямой или разветвленной цепью, содержащей от 1 до 6 атомов углерода, такой как метокси, этокси, н-пропокси, изопропокси, н-бутокси, изобутокси, пентокси и т.д. ж) "С 1-С 6 алкокси, возможно замещенный" относится к алкоксигруппе с прямой или разветвленной цепью, содержащей от 1 до 6 атомов углерода, такой как метокси, этокси, н-пропокси, изопропокси, нбутокси, изобутокси, пентокси и т.д. Такая алкоксигруппа возможно может быть замещенной, и в ней вплоть до 3 атомов водорода могут быть замещены заместителем, выбранным из группы, состоящей из галогена, циано, сульфонамида, имино, -OR4, -SR4, и -NR4R5, где каждый из R4 и R5 независимо представляет собой водород или С 1-С 3 алкил. з) "(C6-C10)арил" означает циклический ароматический углеводород, содержащий от 6 до 10 атомов углерода. Примерами таких арильных групп являются фенил, нафтил и т.д. и) "(C6-C10)арил, возможно замещенный" означает циклический ароматический углеводород, как он определен выше. Такая арильная группировка возможно может быть замещенной заместителями, не являющимися водородом, в количестве вплоть до 4, причем каждый заместитель независимо выбран из группы, состоящей из галогена, циано, нитро, гидрокси, (C1-C6)алкила, возможно замещенного, (C1C6)алкокси, возможно замещенного, трифторметила, трифторметокси, фосфата, -SO2NR4R5, -(CH2)m-NR5C(O)-R4, -(CH2)m-C(O)-N-R4R5, -C(O)-R4, -C(O)-O-R4, -SR4, -SO2R4 и -NR4R5,где m, R4 и R5 такие, как определено выше, и каждый m независимо означает целое число от 0 до 4. Эти заместители могут одинаковыми или разными и могут быть находиться в любом положении кольца, которое является химически допустимым. "Фенил, возможно замещенный" относится к фенильному кольцу, замещенному как описано выше. к) "Гетероарил" относится к ароматическому кольцу, имеющему один или более гетероатомов, выбранных из кислорода, азота и серы. Более конкретно, он относится к 5- или 6-членному кольцу, содержащему 1, 2, 3 или 4 атома азота; 1 атом кислорода; 1 атом серы; 1 атом азота и 1 атом серы; 1 атом азота и 1 атом кислорода; 2 атома азота и 1 атом кислорода; или 2 атома азота и 1 атом серы. 5-Членное кольцо имеет 2 двойные связи, а 6- членное кольцо имеет 3 двойные связи (далее "5-6-членный гетероарил"). Термин "гетероарил" также охватывает бициклические группы, в которых гетероарильное кольцо кон-3 024782 денсировано с бензольным кольцом, гетероциклическим кольцом, циклоалкильным кольцом или еще одним гетероарильным кольцом. Примерами таких гетероарильных кольцевых систем являются, но ими не ограничены, пирролил, фуранил, тиенил, имидазолил, оксазолил, индолил, тиазолил, пиразолил, пиридинил, пиримидинил, пуринил, хинолинил, бензофуран, тетразол, изохинолинил, оксадиазолил, тиадиазолил, изотиазолил, изоксазолил, триазолил, бензо[b]тиенил, 2-, 4-, 5-, 6- или 7-бензоксазолил, 7 бензимидазолил или бензотиазолил. л) "Гетероарил, возможно замещенный" относится к гетероарильной группировке, как она определена непосредственно выше, в которой вплоть до 4 атомов углерода гетероарильной группировки могут быть замещены заместителем, причем каждый заместитель независимо выбран из группы, состоящей из галогена, циано, нитро, гидрокси, (C1-C6)алкила, возможно замещенного, (C1-C6)алкокси, возможно замещенного, трифторметила, трифторметокси, фосфата, -SO2NR4R5, -(CH2)m-N-C(O)-R4, -(CH2)m-C(O)-NR4R5, -C(O)-R4, -C(O)-O-R4, -SR4, -SO2R4 и -NR4R5, где m, R4 и R5 такие, как определено выше. Эти заместители могут одинаковыми или разными и могут быть находиться в любом положении кольца, которое является химически допустимым. Любое упоминание "возможно замещенного 5-6-членного гетероарила" относится к 5-6-членному гетероарильному кольцу, которое определено в пункте (к), имеющему характер замещения, описанный непосредственно выше. м) "(C3-C10)циклоалкил" относится к насыщенному или частично насыщенному моноциклическому,бициклическому, мостиковому бициклическому или трициклическому алкильному радикалу, где каждая циклическая группировка имеет от 3 до 10 атомов углерода. Примерами таких циклоалкильных радикалов являются циклопропил, циклобутил, циклопентил, циклогексил, циклооктил и т.п. н) "(C3-C10)циклоалкил, возможно замещенный" относится к (C3-C10)циклоалкильной группировке,как она описана выше. Такая циклоалкильная группа возможно может быть замещенной, и в ней вплоть до 4 атомов водорода могут быть замещены заместителем, выбранным из группы, состоящей из галогена,циано, нитро, гидрокси, (C1-C6)алкила, возможно замещенного, (C1-C6)алкокси, возможно замещенного,трифторметила, трифторметокси, фосфата, оксо, -SO2NR4R5, -(CH2)m-NR5-C(O)-R4, -(CH2)m-C(O)-N-R4R5,-C(O)-R4, -C(O)-O-R4, -SR4, -SO2R4 и -NR4R5, где m, R4 и R5 такие, как определено выше. Эти заместители могут одинаковыми или разными и могут быть находиться в любом положении кольца, которое является химически допустимым. о) "(C3-C6)циклоалкил" относится к циклопропильной, циклобутильной, циклопентильной или циклогексильной группировке, каждая из которых возможно может быть замещенной, как описано выше,если это химически допустимо. п) "гетероцикл" или "гетероциклическое кольцо" относится к любому 3- или 4-членному кольцу,содержащему гетероатом, выбранный из кислорода, азота и серы; или к 5-, 6-, 7-, 8-, 9- или 10-членному кольцу, содержащему 1, 2 или 3 атома азота; 1 атом кислорода; 1 атом серы; 1 атом азота и 1 атом серы; 1 атом азота и 1 атом кислорода; 2 атома кислорода в положениях, не являющихся соседними; 1 атом кислорода и 1 атом серы в положениях, не являющихся соседними; или 2 атома серы в положениях, не являющихся соседними. 5-Членное кольцо имеет от 0 до 1 двойной связи, 6- и 7-членные кольца имеют от 0 до 2 двойных связей, и 8-, 9- или 10-членные кольца могут иметь 0, 1, 2 или 3 двойные связи. Термин"гетероциклическая группа" также охватывает бициклические группы, в которых любое из вышеуказанных гетероциклических колец конденсировано с бензольным кольцом, циклогексановым или циклопентановым кольцом или еще одним гетероциклическим кольцом (например, индолил, хинолил, изохинолил, тетрагидрохинолил, бензофурил, дигидробензофурил или бензотиенил и т.п.). Гетероциклические группы включают: пирролидинил, тетрагидрофуранил, тетрагидротиофенил, пиперидинил, пиперазинил,азепан, азокан, морфолинил, изохромил, хинолинил, тетрагидротриазин, тетрагидропиразол, дигидрооксатиол-4-ил, дигидро-1H-изоиндол, тетрагидро-оксазолил, тетрагидро-оксазинил, тиоморфолинил,тетрагидропиримидинил, диоксолинил, октагидробензофуранил, октагидробензимидазолил и октагидробензотиазолил. р) "Гетероциклическая группа, возможно замещенная" относится к гетероциклической группировке, как она определена непосредственно выше, в которой вплоть до 4 атомов углерода гетероциклической группировки могут быть замещены заместителем, причем каждый заместитель независимо выбран из группы, состоящей из галогена, циано, нитро, гидрокси, (C1-C6)алкила, возможно замещенного, (C1C6)алкокси, возможно замещенного, трифторметила, трифторметокси, пентафторсульфонила, фосфата,оксо, SO2NR4R5, -(CH2)m-N-C(O)-R4, -(CH2)m-C(O)-N-R4R5, -C(O)-R4, -C(O)-O-R4, -SR4, -SO2R4 и -NR4R5,где m, R4 и R5 такие, как определено выше. Эти заместители могут быть одинаковыми или разными и могут быть находиться в любом положении кольца, которое является химически допустимым. Любой атом азота в таком гетероциклическом кольце возможно может быть замещен (C1-C6)алкилом или любым другим заместителем, указанным выше, если такое замещение является химически допустимым. Любой атом серы в кольце дополнительно может быть замещен 1 или 2 атомами кислорода (если такое замещение является химически допустимым). с) "Терапевтически эффективное количество" относится к количеству соединения формулы I, которое при введении пациенту обеспечивает достижение желаемого эффекта, т.е. уменьшения тяжести симптомов, связанных с бактериальной инфекцией, снижения количества бактерий в пораженной ткани-4 024782 и/или предотвращения увеличения количества бактерий в пораженной ткани (локализованного или системного). т) "Пациент" относится к теплокровным животным, таким как, например, домашний скот, морские свинки, мыши, крысы, песчанки, кошки, кролики, собаки, обезьяны, шимпанзе и люди. у) "Лечить" относится к способности соединений облегчать, ослаблять или замедлять прогрессирование бактериальной инфекции (или состояния) у пациента или любого повреждения ткани, связанного с заболеванием. ф) "Фармацевтически приемлемый" показывает, что вещество или композиция должно(а) быть совместимым(ой) химически и/или токсикологически с другими ингредиентами, входящими в состав композиции, и/или с млекопитающим, которого лечат им(ею). х) "Изомер" означает "стереоизомер" и "геометрический изомер", которые определены ниже. ц) "Стереоизомер" относится к соединениям, которые обладают одним или более хиральными центрами, и каждый центр может существовать в R или S конфигурации. Стереоизомеры включают все диастереомерные, энантиомерные и эпимерные формы, а также их рацематы и смеси. ч) "Геометрический изомер" относится к соединениям, которые могут существовать в цис, транс,анти, entgegen (E) и zusammen (Z) формах, а также в виде их смесей. ш) Соединения "Формулы I", "формулы I", "формулы (I)" и "соединения по изобретению" используются взаимозаменяемо по всему тексту заявки и должны считаться синонимами. щ) Термины "пиридон" и "пиридинон" используются в данной заявке взаимозаменяемо. Если не указано иное, то никакой разницы или различия не предполагается. Специалисту в данной области это будет понятно. Фраза "фармацевтически приемлемая(ые) соль(и)", использованная в данном документе, если не указано иное, охватывает соли, образованные кислотными или основными группами, которые могут присутствовать в соединениях по настоящему изобретению. Соединения по настоящему изобретению,которые являются по своей природе основными, способны образовывать многочисленные соли с различными неорганическими и органическими кислотами. Кислотами, которые могут быть использованы для получения фармацевтически приемлемых солей присоединения кислоты таких основных соединений,являются те кислоты, которые образуют нетоксичные соли присоединения кислоты, т.е. соли, содержащие фармакологически приемлемые анионы, например соли гидрохлорид, гидробромид, гидройодид,нитрат, сульфат, бисульфат, фосфат, кислый фосфат, изоникотинат, ацетат, лактат, салицилат, цитрат,кислый цитрат, тартрат, пантотенат, битартрат, аскорбат, сукцинат, малеат, гентизинат, фумарат, глюконат, глюкуронат, сахарат, формиат, бензоат, глутамат, метансульфонат, этансульфонат, бензолсульфонат,пара-толуолсульфонат и памоат [т.е., 1,1'-метилен-бис-(2-гидрокси-3-нафтоат)]. Помимо тех кислот, которые упомянуты выше, соединения по настоящему изобретению, содержащие основную группировку,такую как аминогруппа, могут образовывать фармацевтически приемлемые соли с различными аминокислотами. Изобретение также относится к солям присоединения основания соединений по изобретению. Химическими основаниями, которые могут быть использованы в качестве реагентов для получения этих фармацевтически приемлемых солей с основаниями, являются те основания, которые образуют нетоксичные соли оснований с такими соединениями. Такие нетоксичные соли оснований включают, но ими не ограничены, соли с такими фармакологически приемлемыми катионами, как катионы щелочных металлов (например калия и натрия) и катионы щелочно-земельных металлов (например кальция и магния),аммониевые или водорастворимые соли присоединения амина, такого как N-метилглюкамин-(меглумин),и низший алканоламмониевые соли и другие основные соли с фармацевтически приемлемыми органическими аминами. Подходящие основные соли образуются из оснований, которые образуют нетоксичные соли. Не ограничительными примерами подходящих основных солей являются алюминиевые соли, соли с аргинином, соли с бензатином, кальциевые соли, соли с холином, диэтиламином, диоламином, глицином, лизином, магниевые соли, соли с меглумином, соли с оламином, калиевые, натриевые соли, соли с трометамином и цинковые соли. Гемисоли с кислотами и основаниями также могут быть образованы, например гемисульфатные и гемикальциевые соли. Обзор по подходящим солям смотри в Handbook of Pharmaceutical Salts: Properties, Selection, and Use by Stahl and Wermuth (Wiley-VCH, 2002). Способы получения фармацевтически приемлемых солей соединений по изобретению известны специалисту в данной области. Некоторые соединения формулы (I) могут существовать в виде геометрических изомеров. Соединения формулы (I) могут иметь один или более асимметрических центров, существуя, таким образом, в виде двух или более стереоизомерных форм. Настоящее изобретение охватывает все индивидуальные стереоизомеры и геометрические изомеры соединений формулы (I) и их смеси. Индивидуальные энантиомеры могут быть получены в результате хирального разделения или синтеза с использованием релевантного энантиомера. Кроме того, соединения по настоящему изобретению могут существовать в как в несольватированных, так и в сольватированных формах с фармацевтически приемлемыми растворителями, такими как-5 024782 вода, этанол и т.п. В общем, для целей настоящего изобретения сольватированные формы считаются эквивалентными несольватированным формам. Соединения могут также существовать в одном или более кристаллических состояниях, т.е. в виде полиморфов, или они могут существовать в виде аморфных твердых веществ. Все такие формы охвачены формулой изобретения. Изобретение также относится к пролекарствам соединений по изобретению. Так, некоторые производные соединений по изобретению, которые сами могут обладать небольшой фармакологической активностью или могут не обладать фармакологической активностью, при введении в или на организм могут превращаться, например в результате гидролитического расщепления, в соединения по изобретению,обладающие желаемой активностью. Такие производные называются "пролекарствами". Дополнительную информацию по применению пролекарств можно найти в Pro-drugs as Novel Delivery Systems, Vol. 14, ACS Symposium Series (T. Higuchi и W. Stella) и в Bioreversible Carriers in Drug Design, PergamonPress, 1987 (Ed. E. B. Roche, American Pharmaceutical Association). Данное изобретение также охватывает соединения по изобретению, содержащие защитные группы. Для специалиста в данной области очевидно, что соединения по изобретению могут быть также получены с некоторыми защитными группами, которые полезны для очистки или хранения и могут быть удалены перед введением пациенту. Введение и удаление защитных групп функциональных групп описано вGroups in Organic Synthesis", 3rd edition, T.W. Greene and P.G.M. Wuts, Wiley-Interscience (1999). Настоящее изобретение также охватывает меченные изотопами соединения, которые идентичны соединениям формулы I, но за исключением того, что один или более атомов заменены атомом, имеющим атомную массу или массовое число, отличающиеся от атомной массы или массового числа, обычно встречающихся в природе. Примеры изотопов, которые могут быть введены в соединения по изобретению, включают изотопы водорода, углерода, азота, кислорода, фосфора, фтора и хлора, такие как, без ограничения, 2H, 3H, 13C, 14C, 15N, 17O, 18O, 31P, 32P, 35S, 18F и 36Cl соответственно. Соединения по настоящему изобретению, их пролекарства и фармацевтически приемлемые соли указанных соединений или указанных пролекарств, которые содержат вышеупомянутые изотопы и/или другие изотопы других атомов, входят в объем данного изобретения. Некоторые меченные изотопом соединения по настоящему изобретению, например те, в которые введены такие радиоактивные изотопы, как 3H и 14C, полезны в анализах распределения лекарственных средств и/или субстратов в тканях. Изотопы тритий, т.е. 3H, и углерод-14, т.е. 14C, являются особенно предпочтительными с точки зрения легкости их получения и обнаружения. Кроме того, замещение более тяжелыми изотопами, такими как дейтерий, т.е. 2H, может давать некоторые терапевтические преимущества благодаря их более высокой метаболической стабильности, например увеличение периода полувыведения in vivo или снижение требований к дозировке и, следовательно, может быть предпочтительным в некоторых обстоятельствах. Меченные изотопом соединения по данному изобретению и их пролекарства могут быть получены, как правило, по методикам, раскрытым на схемах и/или в примерах, приведенных ниже, при замене реагента, не меченного изотопом,доступным реагентом, меченным изотопом. Все соединения формулы I содержат сульфонильную группировку, которая изображена ниже: Эта сульфонильная группировка всегда будет замещена низшей алкильной группировкой. Обычно эта группировка будет представлять собой метил. Атом углерода, соседний с сульфонильной группой,возможно может быть замещен, как показано, заместителем R2. Обычно R1 и R2 оба будут представлять собой метил. Для специалиста в данной области очевидно, что углерод, соседний с сульфонильной группировкой, представляет собой хиральный центр. Следовательно, соединения могут существовать в виде рацемата, в виде S-энантиомера или в виде R-энантиомера. В дополнительном воплощении соединения можно получать и вводить в виде R-энантиомера, который изображен ниже: Для специалиста в данной области очевидно, что синтезированные соединения редко будут присутствовать исключительно в виде единственного энантиомера. Противоположный энантиомер (т.е. Sэнантиомер) может присутствовать лишь в незначительных количествах (т.е. энантиомер будет "по существу чистый"). Это незначительное количество может составлять вплоть до 10 мас.%, чаще не более чем 5 мас.%, в еще одном воплощении не более чем 1 мас.% или, более конкретно, не более чем 0,5 мас.%. Все соединения формулы I содержат пиридиноновую группировку, которая изображена ниже: Это пиридиноновое кольцо будет связано с остатком молекулы по положениям 1 и 4, как показано выше. Положение 3 всегда будет замещено группой фторо, как показано выше. Пиридиноновая группировка возможно может быть замещена, как показано, группировкой R3. R3 может представлять собой один заместитель, не являющийся водородом, как определено выше. Этот заместитель, не являющийся водородом, может быть расположен либо в положении 2, либо в положении 5 пиридинонового кольца. Обычно R3 будет представлять собой водород.T всегда будет присутствовать в молекуле. Эта группировка будет представлять собой этинил, арил или гетероарил (и каждая кольцевая система может быть замещенной, как определено выше). В типичных случаях T будет представлять собой фенил, который возможно может быть замещенным. Когда T представляет собой гетероарил, тогда он может быть связан с пиридиноном посредством углеродуглеродной связи (т.е. гетероатом(ы) не будет(ут) связан(ы) с пиридиноном). Если E присутствует, и D представляет собой связь, то она может представлять собой любую химически допустимую связь, т.е. углерод-углеродную, углерод-азотную и т.д. Присутствие D и E является возможным. Если они присутствуют, D обычно будет представлять собой связь, и E будет представлять собой 5-6-членный гетероарил или (C3-C6)циклоалкил, каждый из которых возможно может быть замещенным, как определено выше. Более конкретные воплощения изобретения включают соединения формулы I, где: а) R1 представляет собой метил; б) R2 представляет собой метил; в) R3 представляет собой водород; г) соединение присутствует в виде R-энантиомера (т.е. по существу чистого); д) T представляет собой фенил, который возможно может быть замещенным, и D и E оба отсутствуют; и е) T представляет собой фенил, D представляет собой связь, и E представляет собой либо C3 С 6 циклоалкил, либо 5-6-членный гетероарил, каждый из которых возможно может быть замещенным. В еще одном воплощении изобретение относится к соединениям формулы I, по существу чистым,где: а) каждый из R1 и R2 представляет собой метил, R3 представляет собой водород и T, D и E такие, как определено; б) каждый из R1 и R2 представляет собой метил, R3 представляет собой водород, T представляет собой возможно замещенный фенил и E и D оба отсутствуют; в) каждый из R1 и R2 представляет собой метил, R3 представляет собой водород, T представляет собой возможно замещенный фенил, D представляет собой связь и E представляет собой 5-6-членный гетероарил, который возможно может быть замещенным; и г) каждый из R1 и R2 представляет собой метил, R3 представляет собой водород, T представляет собой возможно замещенный фенил, D представляет собой связь и E представляет собой C3-C6 циклоалкил,который возможно может быть замещенным. В еще одном воплощении изобретение относится к подгруппе соединений формулы Ia, приведенной ниже, где молекула присутствует в виде R-энантиомера (т.е. S-энантиомер возможно может присутствовать в незначительных количествах). Как показано ниже, R1 и R2 представляют собой метил, R3 представляет собой водород, E и D оба отсутствуют, и T представляет собой замещенный фенил. Более конкретно, Ra представляет собой один или более заместителей, выбранных из группы, состоящей из C1 С 3 алкила, С 1-С 3 алкокси, фтора, хлора, гидрокси, трифторметила и трифторметокси. В еще одном воплощении изобретение относится к подгруппе соединений формулы Ib, приведенной ниже, где молекула присутствует в виде R-энантиомера (т.е. S-энантиомер возможно может присутствовать в виде незначительной примеси). Как показано ниже, R1 и R2 представляют собой метил, R3 представляет собой водород, T представляет собой фенил, D представляет собой связь и E представляет собой 5-6-членный гетероарил, который возможно может быть замещенным.-7 024782 В более конкретном воплощении изобретения ингибитор LpxC представляет собой следующее соединение или его фармацевтически приемлемую соль: В более конкретном воплощении изобретения ингибитор LpxC представляет собой следующее соединение или его фармацевтически приемлемую соль: Синтез Соединения формулы I могут быть получены различными способами, которые аналогичным способам, известным в данной области. Реакционные схемы, представленные ниже, иллюстрируют два альтернативных способа получения этих соединений. Другие способы, включая их модификации, будут очевидны специалисту в данной области. Синтез соединений формулы I представлен ниже на схеме A. На первой стадии проводят Nалкилирование, показанное на стадии A. Пиридинон, имеющий структуру 1, подвергают взаимодействию с сульфонильным производным, имеющим структуру 2, с образованием промежуточного соединения, имеющего структуру 3. Соединение, имеющее структуру 3, дополнительно может быть дериватизировано с образованием соединений формулы I. Показаны два альтернативных синтеза (вариант A или B),но ясно видно, что они являются вариантами одного и того же синтеза. Разница заключается только в порядке, в котором проводят стадии. Вначале в варианте A галогенид, изображенный символом X, в положении 4 пиридинона, имеющего структуру 3, замещают желаемой концевой группировкой E-D-T-M1, где M1 представляет собой металл-содержащий радикал, такой как производное бора, подходящий для проведения типичной реакции перекрестного сочетания, такой как реакция Сузуки-Мияура (Suzuki-Miyaura). Гидролиз или удаление этильной защитной группы (или других подходящих защитных групп) на стадии C дает соединение,имеющее структуру 5. Терминальную карбоновую кислоту, имеющую структуру 5, затем превращают в защищенное производное гидроксамовой кислоты, которое имеет структуру 8. Удаление защитной группы с защищенного производного гидроксамовой кислоты, имеющего структуру 8, как показано на стадииH, приводит к получению конечного продукта формулы I. Хотя эти реакции известны специалисту в данной области, они более подробно обсуждаются ниже. Вначале, в варианте B схемы A, этильную защитную группу (или другие обычные защитные группы) удаляют из пиридинона, имеющего структуру 3, с образованием соединения, имеющего структуру 6,как показано на стадии E. На стадии F терминальную карбоновую кислоту, имеющую структуру 6, превращают в защищенное производное гидроксамовой кислоты, имеющее структуру 7, посредством амидирования. На стадии G галогенидную функциональную группу в положении 4 пиридиноновой группировки затем напрямую замещают желаемой концевой группировкой, E-D-T-M1, путем проведения реакции сочетания с получением защищенного производного гидроксамовой кислоты, имеющего структуру 8. Как и до этого, удаление защитных групп из защищенных производных гидроксамовой кислоты, как показано на стадии H, приводит к получению соединений формулы I.N-алкилирование, показанное выше на стадии A, может быть осуществлено с использованием методов, известных специалисту в данной области. Одно из исходных веществ представляет собой производное 2-пиридинона, имеющее структуру 1. В этом пиридиноне X будет представлять собой галогенид,и R3 будет представлять собой такую группировку, которая нужна в конечном продукте. Многие из этих производных пиридинона известны в данной области, а остальные могут быть получены способами синтеза, аналогичными способам, известным в данной области. Описание таких способов дано в Tet. Lett.(2005) Vol 46, 7917. Получение 2 ниже также иллюстрирует их получение. Другим реагентом в N-алкилировании, показанном на стадии A, является защищенный алкилсульфонат, имеющий структуру 2, где R1 и R2 представляют собой одинаковую группировку, которая нужна в конечном продукте. Изображена этильная защитная группа, но может быть введена любая стандартная защитная группа. Эти алкилсульфонаты также известны в данной области. Описание их получения дано в Journal of Organic Chemistry, (1980) Vol 45, 8, 1486-1489. Получение 1 ниже также иллюстрирует их получение.N-алкилирование может быть осуществлено методами, известными в данной области. Обычно эквивалентные количества соединений, имеющих структуру 1 и 2, приводят в контакт в смеси апротонного и протонного растворителей, например в смеси тетрагидрофурана и трет-бутанола, в присутствии основания, такого как карбонат калия, карбонат цезия, карбонат натрия, гидрид натрия и т.д. Если желательно, то можно использовать агент переноса, такой как тетрабутиламмонийбромид. Реагенты обычно нагревают и проводят реакцию до конца. Целевой продукт, имеющий структуру 3, может быть выделен способами, известными в данной области. При желании, продукт, имеющий структуру 3, может быть очищен, или, альтернативно, неочищенный продукт может быть использован на следующей стадии реакции. Получение 2 ниже иллюстрирует такое N-алкилирование. Схема A иллюстрирует, как вводить группировку гидроксамовой кислоты в молекулы. Вначале с карбоновой кислоты удаляют защитную группу, в результате образуется промежуточное соединение,имеющее структуру 5 и 6, как показано на стадии C (вариант A) и стадия E (вариант B) соответственно. Методика, по которой это удаление осуществляют, будет варьировать в зависимости от реальной защитной группы, и это известно специалистам в данной области. Обсуждение потенциальных защитных групп и методов их удаления дано в публикациях McOmie или Greene, указанных выше. В получении 2-9 024782 ниже описано, как происходит удаление этильной группировки, показанное на схеме A. На стадиях F и D группировку гидроксамовой кислоты, как показано, вводят в молекулу. Можно использовать защищенный источник гидроксиламина с последующей реакцией удаления защитных групп (альтернативно, чтобы исключить стадии удаления защитных групп, можно прямо вводить гидроксиламин). В любом случае, гидроксамовую кислоту вводят в молекулу, используя стандартные реакции амидирования. Например, соединение, имеющее структуру 5 (вариант A) или 6 (вариант B), может быть приведено в контакт с избытком оксалилхлорида в апротонном растворителе, таком как дихлорметан, в течение периода времени, достаточного для обеспечения образования соответствующего хлорангидрида кислоты, с последующим добавлением избытка либо гидроксиламина, либо защищенного гидроксиламина. Реакцию затем проводят до конца, и защищенные промежуточные соединения, имеющие структуру 7 (вариант B) или 8 (вариант A), выделяют из реакционной среды и очищают известными в данной области методами. Как упомянуто выше, удаление любых защитных групп может быть осуществлено способами, известными в данной области (смотри Greene или McOmie выше). Альтернативно, амид может быть образован с использованием реагента амидного сочетания, 1,1'-карбонилдиимидазола (CDI), 2 хлор-4,6-диметокси-1,3,5-триазина (CDMT) или 1-этил-3-(3-диметиламинопропил)карбодиимида (EDCI),как известно в данной области. На схеме А также показано, как вводить в молекулу концевую группировку, E-D-T. Независимо от того, выбран ли вариант А или вариант В, реакцию сочетания в итоге проводят с целью присоединения концевой группировки, E-D-T, по положению 4 пиридинонового промежуточного соединения. На схеме А сореагент показан как E-D-T-M1, где E-D-T-M1 представляет собой такую же группировку, которая нужна в конечном продукте, за исключением того, что она будет замещена металлом (или металлоидом),таким как магний, медь, бороновый эфир/кислота и т.д., в нужной точке присоединения к пиридиноновому промежуточному соединению, имеющему структуру 3 или 7 (т.е. другому реагенту). Концевые группы, охваченные формулой I, т.е. E-D-T, либо известны в данной области, либо могут быть получены способами, аналогичными способам, известным в данной области. Реакцию сочетания можно проводить многими различными методами. Для образования углеродуглеродной связи может быть использована стратегия Сузуки-Мияура (Suzuki-Miyaura). В такой реакцииM1 будет представлять собой бороновую кислоту/эфир. Эквивалентные молярные количества реагентов приводят в контакт в растворителе, таком как тетрагидрофуран, 2-метилтетрагидрофуран, 1,4-диоксан,вода, толуол или их смесь, в присутствии катализатора на основе переходного металла, например свободного или связанного со смолой палладиевого или никелевого катализатора, вместе с основанием, таким как карбонат натрия, карбонат калия, фторид цезия, карбонат цезия и т.д. Реакционную смесь нагревают под воздействием микроволнового излучения или другими традиционными методами до достижения адекватного превращения. Сразу после окончания реакции целевой продукт может быть выделен и извлечен из реакционной смеси и затем очищен известными в данной области методами. Аналогично,можно использовать стратегию Кастро-Стивенса (Castro-Stevens) или Соногашира-Хагихара (Sonogashira-Hagihara); группировка T будет представлять собой подходящий концевой ацетиленовый радикал,подвергаемый реакции в присутствии соли меди, такой йодид меди. В такой реакции M1 может представлять собой образующийся in situ радикал. Эквивалентные молярные количества реагентов приводят в контакт в растворителе, таком как тетрагидрофуран, 2-метилтетрагидрофуран, диметилформамид или их смесь, в присутствии катализатора на основе переходного металла, такого как свободный или связанный со смолой палладиевые или никелевый катализатор, вместе с подходящим основанием, таким как подходящее органическое основание, например N,N-диизопропилэтиламин. Реакционную смесь нагревают под воздействием микроволнового излучения или другими традиционными методами до достижения адекватного превращения. Сразу после окончания реакции целевой продукт может быть выделен и извлечен из реакционной смеси и затем очищен известными в данной области методами. Реакционные схемы, приведенные выше для получения соединения формулы I, являются только иллюстративными. Как очевидно специалисту в данной области, они могут быть модифицированы в зависимости от конкретного соединения, доступности реагентов и т.д. Применение в медицине и ветеринарии Соединения можно применять для лечения или предупреждения инфекционных заболеваний, в частности инфекционных заболеваний, вызываемых восприимчивыми и устойчивыми ко многим лекарственным средствам (MDR) грамотрицательными бактериями. Примерами таких грамотрицательных бактерий являются Acinetobacter baumannii, Acinetobacter spp., Achromobacter spp., Aeromonas spp., Bacteroides fragilis, Bordetella spp., Borrelia spp., Brucella spp., Campylobacter spp., Citrobacter diversus (koseri),Citrobacter freundii, Enterobacter aerogenes, Enterobacter cloacae, Escherichia coli, Francisella tularensis, Fusobacterium spp., Haemophilus influenzae (-лактамаза-положительные и отрицательные), Helicobacter pylori, Klebsiella oxytoca, Klebsiella pneumoniae (включая те, которые кодируют -лактамазы широкого спектра (здесь далее "ESBLs"), Legionella pneumophila, Moraxella catarrhalis (-лактамаза-положительные и отрицательные), Morganella morganii, Neisseria gonorrhoeae, Neisseria meningitidis, Proteus vulgaris, Porphyromonas spp., Prevotella spp., Mannheimia haemolyticus, Pasteurella spp., Proteus mirabilis, Providenciaspp., Pseudomonas aeruginosa, Pseudomonas spp., Salmonella spp., Shigella spp., Serratia marcescens, Treponema spp., Burkholderia cepacia, Vibrio spp., Yersinia spp. и Stenotrophomonas mulophilia. Примерами других грамотрицательных микроорганизмов являются члены семейства Enterobacteriaceae, которые экспрессируют ESBLs; KPCs, CTX-M, металлолактамазы (такие как NDM-1, например) и бета-лактамазыAmpC-типа, которые придают устойчивость к доступным в настоящее время цефалоспоринам, цефамицинам, карбапенемам и комбинациям ингибиторов бета-лактамов/бета-лактамаз. В более конкретном воплощении грамотрицательные бактерии выбраны из группы, состоящей изmaltophilia, Pseudomonas aeruginosa и членов семейств Enterobacteriaceae и Pseudomonas, которые экспрессируют ESBLs, KPCs, CTX-M, металлолактамазы и бета-лактамазы AmpC-типа, которые придают устойчивость к доступным в настоящее время цефалоспоринам, цефамицинам, карбапенемам и комбинациям ингибиторов бета-лактамов/бета-лактамаз. Примеры инфекций, которые можно лечить соединениями формулы I, включают внутрибольничную пневмонию, инфекции мочевых путей, системные инфекции (бактериемию и сепсис), кожные инфекции и инфекции мягких тканей, хирургические инфекции, внутрибрюшинные инфекции, легочные инфекции у пациентов с муковисцидозом, пациентов, страдающих легочными инфекциями, эндокардит,диабетические инфекции стопы, остеомиелит и инфекции центральной нервной системы. Помимо этого, соединения можно применять для лечения инфекций Helicobacter pylori в желудочно-кишечном тракте людей (и других млекопитающих). С устранением этих бактерий связано улучшение состояния здоровья, включая уменьшение диспептических симптомов, снижение возможности рецидива пептической язвы и кровотечения, снижение риска развития рака желудка и т.д. Более подробное обсуждение уничтожения H. pylori и их пагубного воздействия при желудочно-кишечном заболевании можно найти на сайте www.informahealthcare.com, Expert Opin. Drug Saf. (2008) 7(3). Чтобы проявлять эту противоинфекционную активность, соединения необходимо вводить в терапевтически эффективном количестве. Под "терапевтически эффективным количеством" подразумевается количество соединения, достаточное для лечения инфекции, в разумном соотношении польза/риск, подходящим для любого такого терапевтического лечения. Следует иметь в виду, однако, что общую суточную дозировку соединения будет устанавливать, руководствуясь обоснованным медицинским суждением, лечащий врач. Конкретный уровень терапевтически эффективной дозы для каждого конкретного пациента будет зависеть от множества различных факторов, включая расстройство, которое нужно лечить,и тяжесть расстройства; активность конкретного используемого соединения; конкретную используемую композицию; возраст, масса тела, общее состояние здоровья, пол и диета пациента; время введения, путь введения и скорость экскреции конкретного используемого соединения; продолжительность лечения; лекарственные средства, используемые в комбинации или совместно с используемым конкретным соединением; и подобные факторы, известные в области медицины. Однако в качестве общей рекомендации, общая суточная доза обычно будет составлять от примерно 0,1 мг/кг/сутки до примерно 5000 мг/кг/сутки в однократной дозе или разделенных дозах. Типично, дозировки для людей будут находиться в диапазоне от примерно 10 мг до примерно 3000 мг в сутки, в однократной дозе или многократных дозах. Обычно любой путь для лечения инфекционных заболеваний, включая пероральный, парентеральный, местный, ректальный, трансмукозальный и интестинальный, можно использовать для введения соединений. Парентеральное введение включает инъекции для продуцирования системного эффекта или инъекции непосредственно в больной участок. Примерами парентеральных путей введения являются подкожные, внутривенные, внутримышечные, интрадермальные, интратекальные и внутриглазные, интраназальные, интраветрикулярные инъекции или инфузии. Местное введение включает лечение легкодоступных участков путем местного нанесения, такого как, например, нанесение в глаза, уши, в том числе при инфекциях наружного и среднего уха, вагинальное, на открытую рану, кожу, включая поверхностную кожу и субдермальные структуры, или нижний кишечный тракт. Трансмукозальное введение включает назальный аэрозоль или ингаляционные применения. Композиции Соединения по изобретению могут быть приготовлены для введения любым путем, применяемым в медицине или ветеринарии, по аналогии с другими биоактивными агентами, такими как антибиотики. Такие методы известны в данной области и резюмированы ниже. Композиция может быть приготовлена для введения любым путем, известным в данной области,таким как субдермальный, ингаляционный, пероральный, местный или парентеральный. Композиции могут быть приготовлены в любой форме, известной в данной области, включая, но не ограничивая ими,таблетки, капсулы, порошки, гранулы, пастилки, кремы или жидкие препараты, такие как пероральные или стерильные парентеральные растворы или суспензии. Местные композиции по настоящему изобретению могут быть представлены, например, в виде мазей, кремов или лосьонов, офтальмических мазей/капель и ушных капель, импрегнированных повязок и- 11024782 аэрозолей, и могут содержать подходящие традиционные добавки, такие как консерванты, растворители,способствующие прониканию лекарственного средства, и мягчительные средства и т.д. Такие местные композиции могут также содержать традиционные носители, такие как основы для кремов или мазей и этанол или олеиловый спирт для лосьонов. Такие носители могут присутствовать в композиции в количестве, например, от примерно 1% вплоть до 98%. Таблетки и капсулы для перорального введения могут быть в форме стандартной дозы и могут содержать традиционные эксципиенты, такие как связывающие агенты, например аравийскую камедь, желатин, сорбит, трагакант или поливинилпирролидон; наполнители, например лактозу, сахар, маисовый крахмал, фосфат кальция, сорбит или глицин; скользящие вещества для таблетирования, например стеарат магния, тальк, полиэтиленгликоль или диоксид кремния; разрыхлители, например картофельный крахмал; или приемлемые увлажняющие агенты, такие как лаурилсульфат натрия. Таблетки могут быть покрыты оболочкой способами, известными в обычной фармацевтической практике. Пероральные жидкие препараты могут быть в форме, например, водных или масляных суспензий,растворов, эмульсий, сиропов или эликсиров, или могут быть представлены в виде сухого продукта для разведения водой или другим подходящим разбавителем перед использованием. Такие жидкие препараты могут содержать традиционные добавки, такие как суспендирующие агенты, например сорбит, метилцеллюлозу, сироп глюкозы, желатин, гидроксиэтилцеллюлозу, карбоксиметилцеллюлозу, гель стеарата алюминия или гидрированные пищевые жиры, эмульгирующие агенты, например лецитин, моноолеат сорбитана или аравийскую камедь; неводные носители (которые могут включать пищевые масла),например миндальное масло, масляные эфиры, такие как глицерин, пропиленгликоль или этиловый спирт; консерванты, например метил- или пропил-пара-гидроксибензоат или сорбиновую кислоту и, при желании, традиционные корригенты или красители. Для парентерального введения жидкие стандартные лекарственные формы, приготовленные с использованием соединения и стерильного носителя, обычно воды. Соединение, в зависимости от используемого носителя и концентрации, может быть либо суспендировано, либо растворено в носителе или другом подходящем растворителе. При приготовлении растворов соединение может быть растворено в воде для инъекций и стерилизовано фильтрацией перед заполнением раствора в подходящий флакон или ампулу и герметизацией. Преимущественно, агенты, такие как местный анестетик, консервант и буферные агенты, могут быть растворены в носителе. Для повышения стабильности композиция может быть заморожена после заполнения во флакон, и вода может быть удалена в вакууме. Сухой лиофилизированный порошок затем герметично закрывают во флаконе, и в комплекте может поставляться флакон с водой для инъекций для разведения порошка с получением жидкости перед применением. Парентеральные суспензии получают по существу таким же способом, за исключением того, что соединение суспендируют в носителе, а не растворяют, и стерилизация невозможно осуществлять фильтрацией. Соединение может быть стерилизовано под воздействием этиленоксида, затем суспендировано в стерильном носителе. Преимущественно, в состав композиции включают поверхностно-активное вещество или увлажняющий агент, чтобы способствовать равномерному распределению соединения. Композиции могут содержать, например, от примерно 0,1 мас.% до примерно 100 мас.% активного вещества в зависимости от способа введения. Если композиции содержат дозировочные единицы, то каждая единица будет содержать, например, от примерно 0,5-1000 мг активного ингредиента. Дозировка для применения в лечении взрослого человека будет находиться в диапазоне, например, от примерно 10 до 3000 мг с сутки, в зависимости от пути и частоты введения. При желании, соединения по изобретению можно вводить в комбинации с одним или более дополнительными антибактериальными агентами ("дополнительный активный агент"). Такое использование соединений по изобретению в комбинации с дополнительным активным агентом может быть предназначено для одновременного, раздельного или последовательного применения. Примеры и получения, приведенные ниже, дополнительно иллюстрируют соединения по настоящему изобретению и способы получения таких соединений. Следует иметь в виду, что объем настоящего изобретения никоим образом не ограничен рамками приведенных ниже Примеров и получений. Если не указано иное, в приведенных ниже Примерах молекулы с единственным хиральным центром существуют в виде рацемической смеси. Если не указано иное, молекулы с двумя или более хиральными центрами существуют в виде рацемической смеси диастереомеров. Индивидуальные энантиомеры/диастереомеры могут быть получены способами, известными специалистам в данной области. Примеры Экспериментальные методики Эксперименты проводили, как правило, в инертной атмосфере (азот или аргон), особенно в случаях,когда использовали чувствительные к кислороду или влаге реагенты или промежуточные соединения. Коммерческие растворители и реагенты использовали, как правило, без дополнительной очистки, в том числе безводные растворители в тех случаях, когда это подходит (обычно продукты Sure-Seal от Aldrich Chemical Company, Milwaukee, Wisconsin). Масс-спектрометрические данные были получены либо методом жидкостная хроматография/масс-спектрометрия (ЖХМС), либо масс-спектрометрия с химической ионизацией при атмосферном давлении (ХИАД). Данные по химическим сдвигам для ядерного- 12024782 магнитного резонанса (ЯМР) выражены в частях на миллион (млн-1, ) в привязке к остаточным пикам от использованных дейтерированных растворителей. Точки плавления не корректировали. Масс-спектры низкого разрешения (МСЛР) регистрировали либо на Hewlett Packard 5989, используя химическую ионизацию (аммоний), либо на платформе Fisons (или Micro Mass) с химической ионизацией при атмосферном давлении (ХИАД), где в качестве ионизирующего агента используется смесь 50/50 ацетонитрил/вода с 0,1% муравьиной кислотой. Комнатной температурой или температурой окружающей среды является температура 20-25C. Что касается примеров синтеза, в которых упоминаются методики, описанные в других примерах,реакционные условия (длительность реакции и температура) могут варьировать. Как правило, протекание реакций отслеживали тонкослойной хроматографией или масс-спектрометрией, и в тех случаях, когда это целесообразно, реакционные смеси подвергали обработке. Процедуры очистки могут варьировать от эксперимента к эксперименту: как правило, растворители и соотношения растворителей для элюентов/градиентов выбирали таким образом, чтобы обеспечивались подходящие значения Rf или времени удерживания. В обсуждении, изложенном выше, и в примерах, приведенных ниже, сокращения имеют указанные ниже значения. Если сокращение не определено, то оно имеет его общепринятое значение.Ac2O = уксусный ангидрид; ХИАД = химическая ионизация при атмосферном давлении; водн. = водный; 9-BBN = 9-борабицикло[3.3.1]нонан;H2N-OTHP = O-тетрагидро-2H-пиран-2-ил-гидроксиламин; НОВТ = гидроксибензотриазол; ЖХВД = жидкостная хроматография высокого давления; Гц = герц; Получение исходных веществ Получение 1. Синтез Темплата 1 (Т 1). Этил-4-бром-2-метил-2-(метилсульфонил)бутаноат и индивидуальные энантиомеры (R) и (S). Стадия А) Этил-2-(метилсульфонил)пропаноат. Метансульфинат натрия (103 г, 937 ммоль) объединяли с этил-2-хлорпропионатом (109 г, 892 ммоль) в этаноле (350 мл) в одногорлой круглодонной колбе на 500 мл. Реакционную смесь нагревали до 77C в течение 20 ч и затем оставляли охлаждаться до комнатной температуры. Твердое вещество удаляли фильтрованием через целит, и фильтр промывали этанолом. Объединенные фильтраты концентрировали в вакууме. Неочищенный продукт суспендировали в диэтиловом эфире (250 мл), и твердое вещество удаляли фильтрованием. Фильтрат концентрировали в вакууме с получением указанного в заголовке соединения в виде бледно-желтого масла (51 г, 73%). 1H ЯМР (400 МГц, ХЛОРОФОРМ-d)млн-1 1.32 (t,J=7.05 Гц, 3H) 1.67 (d, J=7.47 Гц, 3H) 3.05 (s, 3H) 3.83-3.92 (m, 1 Н) 4.18-4.37 (m, 2H). Стадия В) Этил-4-бром-2-метил-2-(метилсульфонил)бутаноат. Гидрид натрия (60%-ная дисперсия в минеральном масле, 2,33 г, 58,3 ммоль) промывали гексанами(210 мл) в двугорлой круглодонной колбе на 100 мл в атмосфере азота, затем суспендировали в DMF(30 мл). Суспензию обрабатывали по каплям этил-2-(метилсульфонил)пропаноатом (10,0 г, 55,49 ммоль) в DMF (10 мл). Смесь перемешивали 30 мин при к.т., охлаждали до 0C и обрабатывали по каплям 1,2 дибромэтаном (5,17 мл, 58,8). Смесь оставляли нагреваться до комнатной температуры, одновременно перемешивая в течение ночи. Смесь гасили насыщенным водн. хлоридом аммония (100 мл) и экстрагировали диэтиловым эфиром (450 мл). Объединенные органические фазы промывали 50%-ным насыщенным хлоридом натрия (450 мл), сушили (MgSO4) и концентрировали в вакууме. Неочищенное вещество очищали хроматографией на диоксиде кремния (350 г, 230-400 меш), используя в качестве элюента EtOAc в гексанах (10-20%), с получением указанного в заголовке соединения в виде бледно-желтого масла (7,9 г, 50%). 1H ЯМР (400 МГц, ХЛОРОФОРМ-d)млн-1 1.33 (t, J=7.05 Гц, 3H) 1.64 (s, 3H) 2.492.59 (m, 1H) 2.78 (ddd, J=13.89, 10.16, 6.64 Гц, 1H) 3.05 (s, 3H) 3.33-3.41 (m, 1H) 3.46-3.54 (m, 1H) 4.224.37 (m, 2H). Стадия С) Хиральное разделение этил-4-бром-2-метил-2-(метилсульфонил)бутаноата. Неочищенный этил-4-бром-2-метил-2-(метилсульфонил)бутаноат (1,82 кг) очищали флэшхроматографией с использованием колонки LP-600 и толуола в качестве элюента с получением чистого этил-4-бром-2-метил-2-(метилсульфонил)бутаноата (1,63 кг). Очищенное вещество растворяли в этаноле(75 г/л) и разделяли хиральной колоночной хроматографией (условия указаны в табл. 1) на МСС-2 с получением энантиомера 1 (738,4 г, Rt (время удерживания) (= 4,719 мин, []55920 = +14,1) с 99% энантиомерной чистотой (ее) и энантиомера 2 (763,8 г, Rt = 4,040 мин) с 95% ее. Чистоту энантиомеров определяли хиральной ЖХВД, колонка 4,6250 мм Chiralpak AD, 10 мкм, длина волны 215 нм, подвижная фаза: этанол, изократическое элюирование при 1 мл/мин при температуре окружающей среды. Таблица 1 Стадия А) Соединение III. 5-Фтор-4-йодпиридин-2(1 Н)-он. Концентрированную HCl (50 мл) добавляли в смесь 2,5-дифтор-4-йодпиридина (2,0 г, 8,3 ммоль) в 1,4-диоксане (350 мл) и воде (100 мл). Смесь нагревали до температуры дефлегмации и перемешивали при этой температуре в течение ночи. Реакционную смесь концентрировали досуха, и остаток растирали в воде (20 мл). Твердое вещество собирали фильтрованием и промывали водой (230 мл) и гексанами(330 мл). Твердое вещество сушили в вакууме с получением указанного в заголовке соединения в виде желтого твердого вещества (1,0 г, 50%). МС (ЖХМС) m/z 240,0 (М+1). 1H ЯМР (400 МГц, DMSO-d6)млн-1 7.02 (d, J=5.07 Гц, 1H) 7.68 (d, J=2.34 Гц, 1H) 11.50 (br. s., 1H). Стадия В) Темплат 2 (Т 2). Этил-(2R)-4-(5-фтор-4-йод-2-оксопиридин-1(2H)-ил)-2-метил-2(метилсульфонил)бутаноат. Карбонат цезия (1,77 г, 5,44 ммоль) добавляли в суспензию 5-фтор-4-йодпиридин-2(1H)-она (1,00 г,4,2 ммоль) и этил-(2R)-4-бром-2-метил-2-(метилсульфонил)бутаноата (1,56 г, 5,44 ммоль) в безводномTHF (45 мл). Эту реакционную смесь нагревали до 70C и перемешивали при этой температуре в течение ночи. Реакционную смесь гасили водой (100 мл) и экстрагировали EtOAc (2100 мл). Объединенные органические фазы промывали рассолом (100 мл), сушили (MgSO4), фильтровали и концентрировали. Неочищенный продукт очищали флэш-хроматографией, используя колонку Varian SF15-24g и элюент(691 мг, 37%). МС (ЖХМС) m/z 446,0 (М+1). 1H ЯМР (400 МГц, ХЛОРОФОРМ-d)млн-1 1.36 (t, 3H) 1.75 (s, 3H) 2.37-2.57 (m, 2H) 3.10 (s, 3H) 3.83-4.02 (m, 1H) 4.16-4.37 (m, 3H) 7.15 (d, 1H) 7.20 (d, J=3.32 Гц,1H). Стадия С) Соединение IV. (2R)-4-(5-Фтор-4-йод-2-оксопиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутановая кислота. Гидроксид калия (669 мг, 7,7 ммоль) добавляли в раствор этил-(2R)-4-(5-фтор-4-йод-2 оксопиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутаноата (691 мг, 1,55 ммоль) в смеси 2-метилтетрагидрофуран:вода (2:1 22,5 мл), и раствор перемешивали при 70C в течение 2 ч. Реакционную смесь разбавляли 1 н. водн. NaOH (50 мл). Органические фазы разделяли, и водный слой промывали EtOAc(250 мл) и подкисляли до pH 3, используя 3 М водный раствор HCl. Водный слой экстрагировали EtOAcN-Метилморфолин (120 мкл, 1,1 ммоль) добавляли в раствор CDMT (178 мг, 1,01 ммоль) и (2R)-4(5-фтор-4-йод-2-оксопиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутановой кислоты (280 мг, 0,762 ммоль) в 2-метилтетрагидрофуране (7,60 мл), и эту реакционную смесь перемешивали при к.т. в течение 1 ч. В реакционную смесь добавляли ТНР-гидроксиламин (117 мг, 1,00 ммоль), и реакционную смесь перемешивали в течение ночи при к.т. Реакционную смесь гасили водой (50 мл), и водный слой экстрагировали EtOAc (350 мл). Объединенные органические фазы промывали рассолом (50 мл), сушили(MgSO4), фильтровали и концентрировали с получением указанного в заголовке соединения в виде не совсем белого твердого вещества (399,8 мг) МС (ЖХМС) 515,0 (М-1). Пример 1. (2R)-4-5-Фтор-2-оксо-4-[4-(2H-тетразол-2-ил)фенил]пиридин-1(2H)-ил]-2-метил-2-(метилсульфонил)-N-(тетрагидро-2H-пиран-2-илокси)бутанамид(191 мг, 1,91 ммоль) в 1,4-диоксане (4,78 мл). Полученную суспензию нагревали до 80C и перемешивали ее при этой температуре в течение ночи. Реакционной смеси давали возможность охладиться, фильтровали ее через целит и концентрировали в вакууме. Неочищенный продукт очищали флэшхроматографией, используя силикагелевую (40 г) колонку Redisep и элюент EtOAc в н-гептане (0-50%), с получением указанного в заголовке соединения в виде светло-желтого твердого вещества (258 мг, 99%). МС (ЖХМС) m/z 273,2 (М+1). 1H ЯМР (400 МГц, ХЛОРОФОРМ-d)млн-1 1.36 (s, 12H) 7.66-7.73 (m, 2H) 7.96-8.02 (m, 2H) 9.01 (s, 1H). Стадия В)Pd EnCat (317 мг, 0,10 ммоль) добавляли в смесь карбоната калия (393 мг, 2,84 ммоль), 2-[4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-2H-тетразола (258,4 мг, 0,95 ммоль) и (2R)-4-(5-фтор-4 йод-2-оксопиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)-N-(тетрагидро-2H-пиран-2-илокси)бутанамида (490 мг, 0,95 ммоль), Т 3, в смеси 1,4-диоксан:вода (4:1, 10 мл). Реакционную смесь нагревали до 80C и перемешивали при этой температуре в течение ночи. Реакционную смесь фильтровали через целит, и фильтр промывали метанолом (250 мл). Объединенные фильтраты концентрировали при пониженном давлении, и полученное неочищенное вещество очищали флэш-хроматографией, используя элюент EtOAc в н-гептане (20-100%) и метанол в EtOAc (0-10%), с получением указанного в заголовке соединения в виде светло-рыжевато-коричневого твердого вещества (500 мг, 98%). МС (ЖХМС) m/z 534,4(М-1). Стадия С) (2R)-4-5-Фтор-2-оксо-4-[4-(2H-тетразол-2-ил)фенил]пиридин-1(2H)-ил]-N-гидрокси-2 метил-2-(метилсульфонил)бутанамид. Соляную кислоту (4,0 М в 1,4-диоксане, 1,7 мл, 6,63 ммоль) добавляли в раствор (2R)-4-5-фтор-2 оксо-4-[4-(2H-тетразол-2-ил)фенил] пиридин-1(2H)-ил-2-метил-2-(метилсульфонил)-N-(тетрагидро-2Hпиран-2-илокси)бутанамида (500 мг, 0,94 ммоль) в смеси дихлорметан:метанол (5:1, 6 мл) при комнатной температуре. Эту реакционную смесь перемешивали в течение 1 ч, затем концентрировали при пониженном давлении с получением остатка, который растирали в смеси диэтиловый эфир:пентан (1:1) в течение ночи. Твердое вещество собирали фильтрованием и сушили при пониженном давлении с получением указанного в заголовке соединения в виде твердого вещества (340 мг, 76%). МС (ЖХМС) m/z 451,0 Стадия А) (2R)-4-[5-Фтор-4-(2-фтор-3-метилфенил)-2-оксопиридин-1(2H)-ил]-2-метил-2-(метилсульфонил)-N-(тетрагидро-2H-пиран-2-илокси)бутанамид. Указанное в заголовке соединение (470 мг, 48,7%) было получено в виде твердого вещества из (2 фтор-3-метилфенил)бороновой кислоты (388 мг, 2,52 ммоль) по методике, аналогичной методике, описанной для (2R)-4-5-фтор-2-оксо-4-[4-(2H-тетразол-2-ил)фенил]пиридин-1(2H)-ил-2-метил-2-(метилсульфонил)-N-(тетрагидро-2H-пиран-2-илокси)бутанамида, пример 1, стадия В. МС (ЖХМС) m/z 499(М+1). 1H ЯМР (400 МГц, МЕТАНОЛ-d4)млн-1 1.49-1.57 (m, 3H) 1.59 (d, J=3.71 Гц, 3H) 1.64-1.74 (m,3H) 2.16-2.26 (m, 1H) 2.27-2.31 (m, 3H) 3.10 (d, J=5.66 Гц, 3H) 3.31 (s, 1H) 3.47-3.55 (m, 1H) 3.72-3.88 (m,1H) 3.90 (s, 1H) 3.99-4.15 (m, 2H) 4.94-4.99 (m, 1H) 6.47 (d, J=7.22 Гц, 1H) 7.20-7.26 (m, 1H) 7.26-7.32 (m,1H) 7.40-7.47 (m, 1H) 8.01 (dd, J= 11.90, 5.85 Гц, 1H) 11.52 (d, J= 3.51 Гц, 1H). Стадия В) (2R)-4-[5-Фтор-4-(2-фтор-3-метилфенил)-2-оксопиридин-1(2H)-ил]-N-гидрокси-2-метил 2-(метилсульфонил)бутанамид. Указанное в заголовке соединение (185 мг, 46,6%) было получено в виде твердого вещества из (2R)4-[5-фтор-4-(2-фтор-3-метилфенил)-2-оксопиридин-1(2H)-ил]-2-метил-2-(метилсульфонил)-N-(тетрагидро-2H-пиран-2-илокси)бутанамида (477 мг, 0,957 ммоль) по методике, аналогичной методике, описанной для (2R)-4-5-фтор-2-оксо-4-[4-(2H-тетразол-2-ил)фенил]пиридин-1(2H)-ил-N-гидрокси-2-метил-2-(ме- 17024782 тилсульфонил)бутанамида, пример 1, стадия С. МС (ЖХМС) m/z 415 (М+1) 1H ЯМР (400 МГц, DMSOd6)млн-1 1.54 (s, 3H) 2.13 (ddd, J=13.03, 11.07, 4.78 Гц, 1H) 2.40-2.45 (m, 1H) 3.08 (s, 3H) 3.76 (td, J=11.81,5.07 Гц, 1H) 4.02 (td, J=11.85, 5.17 Гц, 1H) 6.53 (d, J = 7.61 Гц, 1H) 7.45-7.64 (m, 4H) 8.02 (d, J= 6.63 Гц,1H) 9.11-9.26 (m, 1H) 11.00-11.13 (m, 1H). Пример 3. (2R)-4-[4-(4-Хлорфенил)-5-фтор-2-оксопиридин-1(2H)-ил]-N-гидрокси-2-метил-2-(метилсульфонил)бутанамид Стадия А) (2R)-4-[4-(4-Хлорфенил)-5-фтор-2-оксопиридин-1(2H)-ил]-2-метил-2-(метилсульфонил)N-(тетрагидро-2H-пиран-2-илокси)бутанамид. Указанное в заголовке соединение (870 мг, 59,8%) было получено в виде твердого вещества из (4 хлорфенил)бороновой кислоты (610 мг, 4,36 ммоль) по методике, аналогичной методике, описанной для(400 МГц, DMSO-d6)млн-1 1.17-1.28 (m, 2H) 1.45-1.53 (m, 3H) 1.56 (d, J=3.71 Гц, 3H) 1.60-1.72 (m, 3H) 2.08-2.23 (m, 1H)3.07 (d, J=6.44 Гц, 3H) 3.48 (d, J= 11.12 Гц, 1H) 3.67-3.85 (m, 1H) 3.96-4.12 (m, 2H) 4.884.97 (m, 1H) 6.53 (d, J=7.61 Гц, 1H) 7.50-7.62 (m, 3H) 8.00 (dd, J=13.07, 6.63 Гц, 1H) 11.50 (s, 1H). Стадия В) (2R)-4-[4-(4-Хлорфенил)-5-фтор-2-оксопиридин-1(2H)-ил]-N-гидрокси-2-метил-2-(метилсульфонил)бутанамид. Указанное в заголовке соединение (340 мг, 47,0%) было получено в виде твердого вещества из (2R)4-[4-(4-хлорфенил)-5-фтор-2-оксопиридин-1(2H)-ил]-2-метил-2-(метилсульфонил)-N-(тетрагидро-2Hпиран-2-илокси)бутанамида (870 мг, 1,74 ммоль) по методике, аналогичной методике, описанной для Стадия A) (2R)-4-[5-Фтор-4-(2-фторфенил)-2-оксопиридин-1(2H)-ил]-2-метил-2-(метилсульфонил)N-(тетрагидро-2H-пиран-2-илокси)бутанамид. Указанное в заголовке соединение (230 мг, 81,7%) было получено в виде твердого вещества из (2 фторфенил)бороновой кислоты (122 мг, 0,871 ммоль) по методике, аналогичной методике, описанной для(2R)-4-5-фтор-2-оксо-4-[4-(2H-тетразол-2-ил)фенил]пиридин-1(2H)-ил-2-метил-2-(метилсульфонил)-N-(тетрагидро-2H-пиран-2-илокси)бутанамида, пример 1, стадия В. МС (ЖХМС) m/z 485 (М+1). 1H ЯМР (400 МГц, DMSO-d6)млн-1 1.21-1.28 (m, 2H) 1.48-1.56 (m, 3H) 1.58 (d, J=3.71 Гц, 3H) 1.63-1.74 (m,3H) 2.15-2.26 (m, 1H) 3.10 (d, J=5.66 Гц, 3H) 3.34 (br. s., 1H) 3.51 (d, J=10.73 Гц, 1H) 3.71-3.88 (m, 1H) 3.99-4.15 (m, 2H) 4.94-4.99 (m, 1H) 6.50 (d, J=7.02 Гц, 1H) 7.31-7.40 (m, 2H) 7.46-7.53 (m, 1H) 7.56 (m,J=7.76, 7.76, 5.56, 1.76 Гц, 1H) 8.01 (dd, J= 11.90, 5.85 Гц, 1H) 11.51 (d, J=3.32 Гц, 1H). Стадия В) (2R)-4-[5-Фтор-4-(2-фторфенил)-2-оксопиридин-1(2H)-ил]-N-гидрокси-2-метил-2-(метилсульфонил)бутанамид. Указанное в заголовке соединение (68 мг, 36,0%) было получено в виде твердого вещества из (2R)4-[5-фтор-4-(2-фторфенил)-2-оксопиридин-1(2H)-ил]-2-метил-2-(метилсульфонил)-N-(тетрагидро-2Hпиран-2-илокси)бутанамида (230 мг, 0,475 ммоль) по методике, аналогичной методике, описанной для- 18024782 Стадия А) (2R)-4-[4-(2,3-Дигидро-1-бензофуран-5-ил)-5-фтор-2-оксопиридин-1(2H)-ил]-2-метил-2(метилсульфонил)-N-(тетрагидро-2H-пиран-2-илокси)бутанамид. Указанное в заголовке соединение (198 мг, 61,0%) было получено в виде твердого вещества из 2,3 Дигидро-1-бензофуран-5-илбороновой кислоты (153 мг, 0,871 ммоль) по методике, аналогичной методике, описанной для (2R)-4-5-фтор-2-оксо-4-[4-(2H-тетразол-2-ил)фенил]пиридин-1(2H)-ил-2-метил-2(метилсульфонил)-N-(тетрагидро-2H-пиран-2-илокси)бутанамида, пример 1, стадия В. МС (ЖХМС) m/z 509 (М+1). 1H ЯМР (400 МГц, DMSO-d6)млн-1 1.46-1.56 (m, 2H) 1.58 (d, J=4.10 Гц, 3H) 1.63-1.76 (m,3H) 2.12-2.27 (m, 1H) 2.40-2.48 (m, 1H) 3.10 (d, J=6.05 Гц, 3H) 3.23 (t, J=8.78 Гц, 2H) 3.35 (br. s, 1H) 3.51(d, J=7.81 Гц, 1H) 6.81-6.92 (m, 1H) 7.28-7.39 (m, 1H) 7.47 (s, 1H) 7.96 (dd, J=12.78, 6.73 Гц, 1H) 11.55 (s,1H). Стадия В) (2R)-4-[4-(2,3-Дигидро-1-бензофуран-5-ил)-5-фтор-2-оксопиридин-1(2H)-ил]-N-гидрокси-2-метил-2-(метилсульфонил)бутанамид. Указанное в заголовке соединение (165 мг, 53,0%) было получено в виде твердого вещества из (2R)4-[4-(2,3-дигидро-1-бензофуран-5-ил)-5-фтор-2-оксопиридин-1(2H)-ил]-2-метил-2-(метилсульфонил)-N(тетрагидро-2H-пиран-2-илокси)бутанамида (198 мг, 0.389 ммоль) по методике, аналогичной методике,описанной для (2R)-4-5-фтор-2-оксо-4-[4-(2H-тетразол-2-ил)фенил]пиридин-1(2H)-ил-N-гидрокси-2 метил-2-(метилсульфонил)бутанамида, пример 1, стадия С. МС (ЖХМС) m/z 425 (М+1). 1H ЯМР (400 МГц, DMSO-d6)млн-1 1.57 (s, 3H) 2.16 (dd, J=5.56, 1.07 Гц, 1H) 2.36-2.49 (m, 1H) 3.11 (s, 3H) 3.23 (t, J= 8.59 Гц, 2H) 3.66-3.86 (m, 1H) 4.04 (dd, J= 6.15, 0.88 Гц, 1H) 4.59 (t, J= 8.78 Гц, 2H) 6.45 (d, J= 7.81 Гц, 1H) 6.87 (d, J=8.39 Гц, 1H) 7.34 (dd, J=8.20, 1.95 Гц, 1H) 7.46 (s, 1H) 7.98 (d, J=6.83 Гц, 1H) 9.15-9.31 (m, 1H) 11.01-11.19 (m, 1H). Пример 6. (2R)-4-[4-(3,4-Дифторфенил)-5-фтор-2-оксопиридин-1(2H)-ил]-N-гидрокси-2-метил-2(метилсульфонил)бутанамид Стадия A) (2R)-4-[4-(3,4-Дифторфенил)-5-фтор-2-оксопиридин-1(2H)-ил]-2-метил-2-(метилсульфонил)-N-(тетрагидро-2H-пиран-2-илокси)бутанамид. Указанное в заголовке соединение (760 мг, 52,1%) было получено в виде твердого вещества из (3,4 дифторфенил)бороновой кислоты (596 мг, 3,78 ммоль) по методике, аналогичной методике, описанной для(2R)-4-5-фтор-2-оксо-4-[4-(2H-тетразол-2-ил)фенил]пиридин-1(2H)-ил-2-метил-2-(метилсульфонил)-N-(тетрагидро-2H-пиран-2-илокси)бутанамида, пример 1, стадия В. МС (ЖХМС) m/z 503 (М+1). Стадия В) (2R)-4-[4-(3,4-Дифторфенил)-5-фтор-2-оксопиридин-1(2H)-ил]-N-гидрокси-2-метил-2(метилсульфонил)бутанамид. Указанное в заголовке соединение (350 мг, 55,0%) было получено в виде твердого вещества из (2R)4-[4-(3,4-дифторфенил)-5-фтор-2-оксопиридин-1(2H)-ил]-2-метил-2-(метилсульфонил)-N-(тетрагидро 2H-пиран-2-илокси)бутанамида (760 мг, 1,51 ммоль) по методике, аналогичной методике, описанной для Стадия A) (2R)-4-5-Фтор-2-оксо-4-[4-(2,2,2-трифторэтокси)фенил]пиридин-1(2H)-ил]-2-метил-2(метилсульфонил)-N-(тетрагидро-2H-пиран-2-илокси)бутанамид. Указанное в заголовке соединение (860 мг, 78,6%) было получено в виде твердого вещества из [4(2,2,2-трифторэтокси)фенил]бороновой кислоты (554 мг, 2,52 ммоль) по методике, аналогичной методике, описанной для (2R)-4-5-фтор-2-оксо-4-[4-(2H-тетразол-2-ил)фенил]пиридин-1(2H)-ил-2-метил-2(метилсульфонил)-N-(тетрагидро-2H-пиран-2-илокси)бутанамида, пример 1, стадия В. МС (ЖХМС) m/z 565 (М+1). Стадия В) (2R)-4-5-Фтор-2-оксо-4-[4-(2,2,2-трифторэтокси)фенил]пиридин-1(2H)-ил-N-гидрокси 2-метил-2-(метилсульфонил)бутанамид. Указанное в заголовке соединение (310 мг, 42,3%) было получено в виде твердого вещества из (2R)4-5-фтор-2-оксо-4-[4-(2,2,2-трифторэтокси)фенил]пиридин-1(2H)-ил-2-метил-2-(метилсульфонил)-N- 19024782 Стадия A) (2R)-4-[4-(3,4-Дигидро-2H-хромен-6-ил)-5-фтор-2-оксопиридин-1(2H)-ил]-2-метил-2(метилсульфонил)-N-(тетрагидро-2H-пиран-2-илокси)бутанамид. Указанное в заголовке соединение (500 мг, 82,3%) было получено в виде твердого вещества из 3,4 дигидро-2H-хромен-6-илбороновой кислоты (228 мг, 1,28 ммоль) по методике, аналогичной методике,описанной для(2R)-4-5-фтор-2-оксо-4-[4-(2H-тетразол-2-ил)фенил]пиридин-1(2H)-ил-2-метил-2(метилсульфонил)-N-(тетрагидро-2H-пиран-2-илокси)бутанамида, пример 1, стадия В. МС (ЖХМС) m/z 523 (М+1). Стадия В) (2R)-4-[4-(3,4-Дигидро-2H-хромен-6-ил)-5-фтор-2-оксопиридин-1(2H)-ил]-N-гидрокси-2 метил-2-(метилсульфонил)бутанамид. Указанное в заголовке соединение (240 мг, 57,1%) было получено в виде твердого вещества из (2R)4-[4-(3,4-дигидро-2H-хромен-6-ил)-5-фтор-2-оксопиридин-1(2H)-ил]-2-метил-2-(метилсульфонил)-N(тетрагидро-2H-пиран-2-илокси)бутанамида (500 мг, 0,957 ммоль) по методике, аналогичной методике,описанной для (2R)-4-5-фтор-2-оксо-4-[4-(2H-тетразол-2-ил)фенил]пиридин-1(2H)-ил-N-гидрокси-2 метил-2-(метилсульфонил)бутанамида, пример 1, стадия С. МС (ЖХМС) m/z 439 (М+1). 1H ЯМР (400 МГц, DMSO-d6)млн-1 1.52 (s, 3H) 1.83-1.97 (m, 2H) 2.12 (ddd, J=13.03, 11.27, 5.17 Гц, 1H) 2.34-2.44 (m,1H) 2.75 (t, J=6.34 Гц, 2H) 3.07 (s, 3H) 3.71 (td, J=11.76, 5.17 Гц, 1H) 3.92-4.07 (m, 1H) 4.08-4.20 (m, 2H) 6.42 (d, J=7.61 Гц, 1H) 6.79 (d, J=8.39 Гц, 1H) 7.20-7.32 (m, 2H) 7.94 (d, J = 6.83 Гц, 1H) 9.20 (br. s., 1H) 11.07 (s, 1H). Пример 9. (2R)-4-5-Фтор-4-[4-(метилтио)фенил]-2-оксопиридин-1(2H)-ил]-N-гидрокси-2-метил-2(метилсульфонил)бутанамид Стадия А) Этил-(2R)-4-5-фтор-4-[4-(метилтио)фенил]-2-оксопиридин-1(2H)-ил]-2-метил-2-(метилсульфонил)бутаноат. 1,4-Диоксан (10 мл) и 3 М водн. K3PO4 (1,12 мл, 3,3 ммоль) добавляли в колбу, содержащую [4(метилтио)фенил]бороновую кислоту (0,283 г, 1,68 ммоль), Pd(dppf)Cl2 (82 мг, 0,112 ммоль) и этил-(2R)4-(5-фтор-4-йод-2-оксопиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутаноат, Т 2, (500 мг, 1,12 ммоль), которую предварительно продували азотом. Смесь нагревали до 60C и перемешивали при этой температуре в течение 1 ч. Реакционную смесь разбавляли EtOAc и промывали водой. Органические фазы сушили (MgSO4), фильтровали и концентрировали. Неочищенный продукт очищали флэшхроматографией на колонке с 40 г диоксида кремния, используя в качестве элюента EtOAc в н-гептане(0-100%), с получением указанного в заголовке соединения в виде смолы (492 мг, 99%). МС (ЖХМС) m/z 442,1 (М+1). 1H ЯМР (400 МГц, ХЛОРОФОРМ-d)млн-1 1.17-1.27 (m, 3H) 1.74 (s, 3H) 2.38-2.61 (m, 5 Н) 3.09 (s, 3H) 3.88-4.02 (m, 1H) 4.17-4.32 (m, 3H) 6.57 (d, J=7.61 Гц, 1H) 7.21-7.34 (m, 3H) 7.37-7.48 (m, 2H). Стадия В) (2R)-4-5-Фтор-4-[4-(метилтио)фенил]-2-оксопиридин-1(2H)-ил]-2-метил-2-(метилсульфонил)бутановая кислота. Моногидрат гидроксида лития (165 мг, 6,68 ммоль) добавляли в раствор этил-(2R)-4-5-фтор-4-[4(метилтио)фенил]-2-оксопиридин-1(2H)-ил-2-метил-2-(метилсульфонил)бутаноата (0,492 г, 1,12 ммоль) в смеси THF:вода (1:1, 14 мл), и эту реакционную смесь перемешивали при к.т. в течение 18 ч. Реакционную смесь подкисляли 4 М водн. HCl с получением осадка. Твердое вещество собирали фильтрованием и сушили в вакууме с получением указанного в заголовке соединения в виде твердого вещества (339 мг, 73%). МС (ЖХМС) m/z 414,1 (М+1). 1H ЯМР (400 МГц, DMSO-d6)млн-1 1.54 (s, 3H) 2.17 (ddd,J=13.42, 10.00, 5.07 Гц, 1H) 2.41-2.45 (m, 1H) 2.49 (s, 3 H), 3.14 (s, 3 H) 3.78-4.15 (m, 2H) 6.46 (d, J=7.81 Гц,1H) 7.28-7.39 (m, 2H) 7.43-7.55 (m, 2H) 8.01 (d, J=6.83 Гц, 1H). Стадия С) (2R)-4-5-Фтор-4-[4-(метилтио)фенил]-2-оксопиридин-1(2H)-ил]-2-метил-2-(метилсульфонил)-N-(тетрагидро-2H-пиран-2-илокси)бутанамид.(192 мг, 1,64 ммоль) и HATU (447 мг, 1,23 ммоль) добавляли в раствор (2R)-4-5-фтор-4-[4(метилтио)фенил]-2-оксопиридин-1(2H)-ил-2-метил-2-(метилсульфонил)бутановой кислоты (339 мг,0,82 ммоль) в DMF (10 мл). Эту реакционную смесь перемешивали при к.т. в течение 18 ч. Реакционную смесь разбавляли EtOAc и промывали рассолом. Органические фазы сушили (MgSO4), фильтровали и концентрировали. Неочищенный остаток очищали флэш-хроматографией на колонке с 40 г диоксида кремния, используя в качестве элюента EtOAc в н-гептане (0-100%), с получением указанного в заголовке соединения (420 мг, 100%). МС (ЖХМС) m/z 511,4 (М-1). Стадия D) (2R)-4-5-Фтор-4-[4-(метилтио)фенил]-2-оксопиридин-1(2H)-ил]-N-гидрокси-2-метил-2(метилсульфонил)бутанамид. Водный раствор HCl (4 М, 3 мл) добавляли в раствор (2R)-4-5-фтор-4-[4-(метилтио)фенил]-2 оксопиридин-1(2H)-ил-2-метил-2-(метилсульфонил)-N-(тетрагидро-2H-пиран-2-илокси)бутанамида (437 мг, 0,852 ммоль) в THF (10 мл), и эту реакционную смесь перемешивали при к.т. в течение 3 ч. Реакционную смесь концентрировали и затем несколько раз подвергали азеотропной перегонке с EtOAc и нгептаном с получением указанного в заголовке соединения в виде не совсем белого твердого вещества Стадия А) Этил-(2R)-4-[4-(4-этоксифенил)-5-фтор-2-оксопиридин-1(2H)-ил]-2-метил-2-(метилсульфонил)бутаноат. Указанное в заголовке соединение (320 мг, 64%) было получено в виде смолы из (4 этоксифенил)бороновой кислоты (280 мг, 1,68 ммоль) по методике, аналогичной методике, описанной для этил-(2R)-4-5-фтор-4-[4-(метилтио)фенил]-2-оксопиридин-1(2H)-ил-2-метил-2-(метилсульфонил) бутаноата, пример 9, стадия А. МС (ЖХМС) m/z 440,3 (М+1). 1H ЯМР (400 МГц, ХЛОРОФОРМ-d)млн-1 1.22 (t, J=7.12 Гц, 3H) 1.40 (t, J=7.02 Гц, 3H) 1.73 (s, 3H) 2.36-2.61 (m, 2H) 3.09 (s, 3H) 3.85-3.98 (m,1H) 4.07 (dd, J=14.93, 7.12 Гц, 2H) 4.25 (m, 3H) 6.51-6.58 (m, 1H) 6.93 (d, J=8.98 Гц, 3H) 7.22-7.31 (m, 1H) 7.44 (d, J=7.02 Гц, 1H). Стадия В)(2R)-4-[4-(4-Этоксифенил)-5-фтор-2-оксопиридин-1(2H)-ил]-2-метил-2-(метилсульфонил)бутановая кислота. Гидроксид лития (108 мг, 4,37 ммоль) добавляли в раствор этил-(2R)-4-[4-(4-этоксифенил)-5-фтор 2-оксопиридин-1(2H)-ил]-2-метил-2-(метилсульфонил)бутаноата (320 мг, 0,728 ммоль) в смеси тетрагидрофуран:вода (1:1, 20 мл), и эту реакционную смесь перемешивали при к.т. до окончания реакции. Реакционную смесь подкисляли 4 М водн. HCl и экстрагировали EtOAc. Объединенные органические слои сушили (MgSO4), фильтровали и концентрировали с получением указанного в заголовке соединения в виде твердого вещества (220 мг, 73%). МС (ЖХМС) m/z 412,2 (М+1). 1H ЯМР (400 МГц, DMSO-d6)млн-1 1.26-1.40 (m, 3H) 1.54 (s, 3H) 2.07-2.26 (m, 1H) 2.43 (d, J=6.24 Гц, 1H) 3.14 (s, 3H) 3.83-4.15 (m, 4H) 6.42 (d, J=7.81 Гц, 1H) 6.93-7.07 (m, 2H) 7.50 (dd, J=8.68, 1.85 Гц, 2H) 7.97 (d, J=6.83 Гц, 1H). Стадия С) (2R)-4-[4-(4-Этоксифенил)-5-фтор-2-оксопиридин-1(2H)-ил]-2-метил-2-(метилсульфонил)-N-(тетрагидро-2H-пиран-2-илокси)бутанамид. Указанное в заголовке соединение (273 мг, 100%) было получено из (2R)-4-[4-(4-этоксифенил)-5 фтор-2-оксопиридин-1(2H)-ил]-2-метил-2-(метилсульфонил)бутановой кислоты (220 мг, 0,535 ммоль) по методике, аналогичной методике, описанной для (2R)-4-5-фтор-4-[4-(метилтио)фенил]-2-оксопиридин 1(2H)-ил-2-метил-2-(метилсульфонил)-N-(тетрагидро-2H-пиран-2-илокси)бутанамида, пример 9, стадия С. МС (ЖХМС) m/z 509,4 (М+1). Стадия D) (2R)-4-[4-(4-Этоксифенил)-5-фтор-2-оксопиридин-1(2H)-ил]-N-гидрокси-2-метил-2(метилсульфонил)бутанамид. Указанное в заголовке соединение (205 мг, 83%) было получено в виде твердого вещества из (2R)4-[4-(4-этоксифенил)-5-фтор-2-оксопиридин-1(2H)-ил]-2-метил-2-(метилсульфонил)-N-(тетрагидро-2Hпиран-2-илокси)бутанамида (297 мг, 0,582 ммоль) по методике, аналогичной методике, описанной для Стадия А) (2R)-4-[5-Фтор-2-оксо-4-(4-пропилфенил)пиридин-1(2H)-ил]-2-метил-2-(метилсульфонил)-N-(тетрагидро-2H-пиран-2-илокси)бутанамид. Указанное в заголовке соединение (75,5 мг, 21%) было получено в виде твердого вещества из (2R)4-(5-фтор-4-йод-2-оксопиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)-N-(тетрагидро-2H-пиран-2 илокси)бутанамида, Т 3, (360 мг, 0,697 ммоль) и (4-пропилфенил)бороновой кислоты (171 мг, 1,04 ммоль) по методике, аналогичной методике, описанной для этил (2R)-4-5-фтор-4-[4-(метилтио)фенил]-2 оксопиридин-1(2H)-ил-2-метил-2-(метилсульфонил)бутаноата, пример 9, стадия А. МС (ЖХМС) m/z 507,4 (М-1). Стадия В) (2R)-4-[5-Фтор-2-оксо-4-(4-пропилфенил)пиридин-1(2H)-ил]-N-гидрокси-2-метил-2(метилсульфонил)бутанамид. Указанное в заголовке соединение (58 мг, 94%) было получено в виде твердого вещества из (2R)-4[5-фтор-2-оксо-4-(4-пропилфенил)пиридин-1(2H)-ил]-2-метил-2-(метилсульфонил)-N-(тетрагидро-2Hпиран-2-илокси)бутанамида (75 мг, 0,15 ммоль) по методике, аналогичной методике, описанной для Стадия А) (2R)-4-5-Фтор-2-оксо-4-[4-(пентафтор-6-сульфанил)фенил]-пиридин-1(2H)-ил]-2 метил-2-(метилсульфонил)-N-(тетрагидро-2H-пиран-2-илокси)бутанамид. 1,4-Диоксан добавляли к 1-бром-4-(пентафтор-6-сульфанил)бензолу (500 мг, 1,77 ммоль),4,4,4',4',5,5,5',5'-октаметил-2,2'-би-1,3,2-диоксаборолану (628 мг, 2,47 ммоль), ацетату калия (347 мг, 3,53 ммоль) и Pd(dppf)Cl2 (130 мг, 0,177 ммоль). Эту смесь нагревали до 80C и перемешивали при этой температуре в течение 3 ч. Добавляли (2R)-4-(5-фтор-4-йод-2-оксопиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)-N-(тетрагидро-2H-пиран-2-илокси)бутанамид, Т 3, (456 мг, 0,883 ммоль) и водн. Na2CO3 (2,0 н., 1,77 мл, 3,53 ммоль), и реакционную смесь перемешивали при 80C в течение ночи. Смесь разбавлялиEtOAc и промывали рассолом. Органические фазы сушили (MgSO4), фильтровали и концентрировали. Неочищенный остаток очищали флэш-хроматографией на колонке с 40 г диоксида кремния, используя в качестве элюента EtOAc в н-гептане (0-100%), с получением указанного в заголовке соединения (205 мг,39,2%). МС (ЖХМС) m/z 591,4 (М-1). Стадия В) (2R)-4-5-Фтор-2-оксо-4-[4-(пентафтор-6-сульфанил)фенил]-пиридин-1(2H)-ил-Nгидрокси-2-метил-2-(метилсульфонил)бутанамид. Водный раствор HCl (1,0 М) добавляли в раствор (2R)-4-5-фтор-2-оксо-4-[4-(пентафтор-6 сульфанил)фенил]пиридин-1(2H)-ил-2-метил-2-(метилсульфонил)-N-(тетрагидро-2H-пиран-2-илокси) бутанамида (81 мг, 0,14 ммоль), и эту реакционную смесь перемешивали при к.т. в течение ночи. Реакционную смесь концентрировали в вакууме с получением указанного в заголовке соединения в виде твердого вещества (70 мг, 100%). МС (ЖХМС) m/z 509,1 (М+1). 1H ЯМР (400 МГц, DMSO-d6)млн-1 1.58 (s, 3H) 2.06-2.26 (m, 1H) 3.11 (s, 3H) 3.70-3.89 (m, 1H) 3.97-4.14 (m, 1H) 6.64 (d, J=7.41 Гц, 1H) 7.81 (d,2H) 8.04 (d, J=8.78 Гц, 2H) 8.11 (d, J=6.44 Гц, 1H). Пример 13. (2R)-4-[5-Фтор-4-(3-метилфенил)-2-оксопиридин-1(2H)-ил]-N-гидрокси-2-метил-2(метилсульфонил)бутанамид Стадия А) (2R)-4-[5-Фтор-4-(3-метилфенил)-2-оксопиридин-1(2H)-ил]-2-метил-2-(метилсульфонил)-N-(тетрагидро-2H-пиран-2-илокси)бутанамид. Указанное в заголовке соединение (510 мг, 55%) было получено в виде смолы из (3 метилфенил)бороновой кислоты (384 мг, 2,82 ммоль) по методике, аналогичной методике, описанной для(2R)-4-[5-Фтор-4-(3-метилфенил)-2-оксопиридин-1(2H)-ил]-N-гидрокси-2-метил-2(метилсульфонил)бутанамид. Указанное в заголовке соединение (255 мг, 61%) было получено в виде твердого вещества из (2R)4-[5-фтор-4-(3-метилфенил)-2-оксопиридин-1(2H)-ил]-2-метил-2-(метилсульфонил)-N-(тетрагидро-2Hпиран-2-илокси)бутанамида (510 мг, 1,06 ммоль) по методике, аналогичной методике, описанной для Стадия А) (2R)-4-[5-Фтор-4-(4-фтор-3-метилфенил)-2-оксопиридин-1(2H)-ил]-2-метил-2-(метилсульфонил)-N-(тетрагидро-2H-пиран-2-илокси)бутанамид. Указанное в заголовке соединение (360 мг, 38%) было получено в виде смолы из (4-фтор-3 метилфенил)бороновой кислоты (434 мг, 2,82 ммоль) по методике, аналогичной методике, описанной для(2R)-4-5-фтор-2-оксо-4-[4-(2H-тетразол-2-ил)фенил]пиридин-1(2H)-ил-2-метил-2-(метилсульфонил)-N(тетрагидро-2H-пиран-2-илокси)бутанамида, пример 1, стадия В. МС (ЖХМС) m/z 497,0 (М-1). Стадия В) (2R)-4-[5-Фтор-4-(4-фтор-3-метилфенил)-2-оксопиридин-1(2H)-ил]-N-гидрокси-2-метил 2-(метилсульфонил)бутанамид. Указанное в заголовке соединение (271 мг, 91%) было получено в виде белого твердого вещества из Стадия А) 3-(4-Бромфенокси)оксетан. 4-Бромфенол (2,5 г, 14,5 ммоль) и K3CO3 (5,45 г, 39,4 ммоль) добавляли в раствор оксетан-3-ил-4 метилбензолсульфоната (3,00 г, 13,1 ммоль) в DMF (10 мл) в герметично закрытой пробирке. Реакционную смесь нагревали до 100C и перемешивали при этой температуре в течение 24 ч. Реакционную смесь разбавляли EtOAc и промывали водой. Органический слой сушили (MgSO4), фильтровали и концентрировали с получением указанного в заголовке соединения. MS (ГХМС) m/z 228. Это вещество использовали на следующей стадии без дополнительной очистки. Стадия В) 4,4,5,5-Тетраметил-2-[4-(оксетан-3-илокси)фенил]-1,3,2-диоксаборолан. Указанное в заголовке соединение (3,11 г, 86%) было получено из 3-(4-бромфенокси)оксетана (3,00 г, 13,1 ммоль) по методике, аналогичной методике, описанной для 2-[4-(4,4,5,5-тетраметил-1,3,2 диоксаборолан-2-ил)фенил]-2H-тетразола, пример 1, стадия A. MS (ГХМС) m/z 276. 1H ЯМР (400 МГц,ХЛОРОФОРМ-d)млн-1 1.31 (s, 12H) 4.70-4.79 (m, 2H) 4.91-5.00 (m, 2H) 5.18-5.27 (m, 1H) 6.67 (d, J=8.78 Гц, 2H) 7.73 (d, J=8.78 Гц, 2H). Стадия С) 5-Фтор-1-(3R)-3-(метилсульфонил)-3-[(тетрагидро-2H-пиран-2-илокси)амино]бутил-4[4-(оксетан-3-илокси)фенил]пиридин-2(1H)-он. 1,4-Диоксан (20 мл) и воду (5 мл) добавляли в колбу, содержащую (2R)-4-(5-фтор-4-йод-2 оксопиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)-N-(тетрагидро-2H-пиран-2-илокси)бутанамид, Т 3(287 мг, 0,56 ммоль), 4,4,5,5-тетраметил-2-[4-(оксетан-3-илокси)фенил]-1,3,2-диоксаборолан (301 мг, 1,09 ммоль), Pd(PPh3)4 (65 мг, 0,06 ммоль), и карбонат калия (230 мг, 1,67 ммоль), которую предварительно продували N2. Эту смесь нагревали до 80C и перемешивали при этой температуре в течение ночи. Реакционную смесь концентрировали и очищали флэш-хроматографией на двух колонках с 12 г диоксида кремния. Первую колонку элюировали метанолом в дихлорметане (0-20%). Вторую колонку элюировалиEtOAc в н-гептане (0-100%), затем метанолом в дихлорметане (0-20%) с получением указанного в заго- 23024782 ловке соединения в виде твердого вещества (164 мг, 54%). МС (ЖХМС) m/z 537,4 (М-1). Стадия D) 5-Фтор-1-[(3R)-3-(гидроксиамино)-3-(метилсульфонил)бутил]-4-[4-(оксетан-3-илокси) фенил]пиридин-2(1H)-он. Трифторуксусную кислоту (1 мл) добавляли в раствор 5-фтор-1-(3R)-3-(метилсульфонил)-3[(тетрагидро-2H-пиран-2-илокси)амино]бутил-4-[4-(оксетан-3-илокси)фенил]пиридин-2(1H)-она(164 мг, 0,304 ммоль) в DCM (10 мл). Эту реакционную смесь перемешивали при к.т. в течение ночи и затем концентрировали в вакууме. Остаток растворяли в дихлорметане и н-гептане и снова концентрировали с получением указанного в заголовке соединения в виде твердого вещества. (113 мг, 82%). МС (ЖХМС) Стадия A) (2R)-4-[4-(4-Хлор-2-фторфенил)-5-фтор-2-оксопиридин-1(2H)-ил]-2-метил-2-(метилсульфонил)бутановая кислота. В 3-литровую колбу с механическим перемешиванием добавляли этил-(2R)-4-(5-фтор-4-йод-2 оксопиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутаноат, Т 2 (100 г, 225 ммоль), (4-хлор-2 фторфенил)бороновой кислоты (25,5 г, 146 ммоль) и Pd(dppf)2Cl2 (4,93 г, 6,74 ммоль). Колбу продувалиN2, затем добавляли дегазированный 2-метилтетрагидрофуран (1 л) и 3 М водн. K3PO4 (225 мл, 674 ммоль). Реакционную смесь нагревали до 75C и перемешивали при этой температуре в течение 30 мин. Добавляли дополнительное количество (4-хлор-2-фторфенил)бороновой кислоты (25,5 г, 146 ммоль), и реакционную смесь нагревали в течение 1,5 ч. Смеси давали возможность охладиться до к.т., и водный слой отделяли. Органические слой пропускали через слой целита и помещали назад в реакционный сосуд. Добавляли гидроксид лития (28 г, 667 ммоль) в воде (700 мл), и смесь нагревали до 50C и перемешивали при этой температуре в течение 1 ч. Смеси давали возможность охладиться, и водный слой отделяли. В водный слой добавляли целит, и смесь фильтровали через слой целита. Фильтрат помещали в колбу с верхнеприводной мешалкой и осторожно подкисляли 4 М водн. HCl и нагревали до 50C при перемешивании до образования осадка. Твердое вещество собирали фильтрованием и сушили в вакууме с получением указанного в заголовке соединения в виде рыжевато-коричневого твердого вещества (68,7 г, 74%). МС (ЖХМС) m/z 420,6 (М+1). 1H ЯМР (400 МГц, DMSO-d6)млн-1 1.54 (s, 3H) 2.18 (ddd,J=13.17, 10.24, 5.07 Гц, 1H) 2.41-2.45 (m, 1H) 3.10-3.19 (s, 3H) 3.87-4.08 (m, 2H) 6.47 (d, J=7.02 Гц, 1H) 7.42 (dd, J=8.39, 1.95 Гц, 1H) 7.48-7.56 (m, 1H) 7.60 (dd, J=9.95, 1.95 Гц, 1H) 8.06 (d, J=6.05 Гц, 1H). Стадия В) (2R)-4-[4-(4-Хлор-2-фторфенил)-5-фтор-2-оксопиридин-1(2H)-ил]-2-метил-2-(метилсульфонил)-N-(тетрагидро-2H-пиран-2-илокси)бутанамид.N-Метилморфолин (54 мл, 491 ммоль) и 2-хлор-4,6-диметокси-1,3,5-триазин (43,1 г, 245 ммоль) добавляли в раствор (2R)-4-[4-(4-хлор-2-фторфенил)-5-фтор-2-оксопиридин-1(2H)-ил]-2-метил-2-(метилсульфонил)бутановой кислоты (68,7 г, 164 ммоль) в 2-метилтетрагидрофуране (1 л), и эту реакционную смесь перемешивали при к.т. в течение 2 ч. Добавляли O-(тетрагидро-2H-пиран-2-ил)гидроксиламин(28,8 г, 245 ммоль), и реакционную смесь перемешивали при к.т. в течение 1 ч. Смесь фильтровали, и фильтрат концентрировали. Неочищенный остаток очищали колоночной хроматографией на силикагеле,элюируя 40% EtOAc в н-гептане (4 л) и EtOAc (6 л). Целевые фракции собирали и концентрировали с получением указанного в заголовке соединения в виде белого смолистого твердого вещества. (74,82 г,88%). МС (ЖХМС) m/z 517,9 (М-1). Стадия С) (2R)-4-[4-(4-Хлор-2-фторфенил)-5-фтор-2-оксопиридин-1(2H)-ил]-N-гидрокси-2-метил-2(метилсульфонил)бутанамид. Воду (312 мл) и 1 н. водн. HCl (23,9 мл, 23,9 ммоль) добавляли в раствор (2R)-4-[4-(4-хлор-2 фторфенил)-5-фтор-2-оксопиридин-1(2H)-ил]-2-метил-2-(метилсульфонил)-N-(тетрагидро-2H-пиран-2 илокси)бутанамида (74,7 г, 144,1 ммоль) в этаноле (126 мл). Эту реакционную смесь нагревали до 70C и перемешивали при этой температуре в течение ночи. Реакционной смеси давали возможность охладиться, и твердое вещество собирали фильтрованием и промывали водой до тех пор, пока фильтрат не стал иметь pH примерно 5. Твердое вещество сушили в вакууме с получением указанного в заголовке соединения в виде белого твердого вещества (46,48 г, 74%). МС (ЖХМС) m/z 435,6 (М+1). 1H ЯМР (400 МГц,DMSO-d6)млн-1 1.56 (s, 3H) 2.09-2.21 (m, 1H) 2.44 (d, J=5.27 Гц, 1H) 3.10 (s, 3H) 3.77 (td, J=11.90, 5.07 Гц, 1H) 4.04 (td, J=11.95, 4.98 Гц, 1H) 6.51 (d, J=7.02 Гц, 1H) 7.44 (dd, J=8.29, 2.05 Гц, 1H) 7.50-7.56 (m,1H) 7.62 (dd, J=9.95, 1.95 Гц, 1H) 8.04 (d, J=5.85 Гц, 1H) 9.22 (s, 1H) 11.05 (s, 1H). Пример 17. (2R)-4-[5-фтор-4-(2-фтор-3-метоксифенил)-2-оксопиридин-1(2H)-ил]-N-гидрокси-2 метил-2-(метилсульфонил)бутанамид Стадия А) (2R)-4-[5-Фтор-4-(2-фтор-3-метоксифенил)-2-оксопиридин-1(2H)-ил]-2-метил-2-(метилсульфонил)бутановая кислота. Комплекс дихлорида 1,1'-бис(дифенилфосфино)ферроцен-палладия(II) с дихлорметаном (5,90 г,7,22 ммоль) добавляли в смесь этил-(2R)-4-(5-фтор-4-йод-2-оксопиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутаноата, Т 2 (29,63 г, 66,55 ммоль), (2-фтор-3-метоксифенил)бороновой кислоты (18,50 г,108,9 ммоль) и трехосновного фосфата калия (54,5 г, 205 ммоль) в 2-метилтетрагидрофуране (450 мл) и деионизированной воде (225 мл). Эту смесь нагревали до 60C и перемешивали при этой температуре в течение ночи. Реакционной смеси давали возможность охладиться до к.т. Водный слой отделяли от органических фаз, и органические фазы промывали водой (200 мл) и рассолом (200 мл), сушили (MgSO4) и фильтровали. В фильтрат добавляли порошок Darco G-60 - 100 меш и перемешивали в течение 1 ч. Твердое вещество удаляли фильтрованием через целит, и фильтр промывали EtOAc (примерно 300 мл). Объединенные фильтраты концентрировали с получением красного масла (30,62 г). Это масло растворяли в 2-метилтетрагидрофуране (450 мл) и деионизированной воде (225 мл). В смесь добавляли гидроксид калия (26,1 г, 465 ммоль), и реакционную смесь нагревали до 50C и перемешивали при этой температуре в течение ночи. Реакционной смеси давали возможность охладиться до к.т. Водный слой отделяли и промывали диэтиловым эфиром (2200 мл). Водный слой медленно подкисляли при перемешивании концентрированной HCl до pH 1, и суспензию перемешивали в течение 1 ч. Суспензию фильтровали, и твердое вещество промывали водой (3100 мл) и гексанами (3300 мл). Твердое вещество сушили в вакууме с получением указанного в заголовке соединения в виде рыжевато-коричневого твердого веществаN-Метилморфолин (11 мл, 96,2 ммоль) добавляли в раствор CDMT (13,5 г, 116 ммоль) и (2R)-4-[5 фтор-4-(2-фтор-3-метоксифенил)-2-оксопиридин-1(2H)-ил]-2-метил-2-(метилсульфонил)бутановой кислоты (26,49 г, 63,77 ммоль) в 2-метилтетрагидрофуране (640 мл), и эту реакционную смесь перемешивали в течение 2 ч. В реакционную смесь добавляли ТНР-гидроксиламин (13,5 г, 116 ммоль), и реакционную смесь перемешивали в течение ночи при к.т. Реакционную смесь гасили насыщенным водным раствором бикарбоната натрия (500 мл). Органические слой отделяли и промывали водой (300 мл) и рассолом (300 мл), затем сушили (MgSO4) и фильтровали. Darco G-60, порошок 100 меш, добавляли в фильтрат, и суспензию перемешивали в течение 1 ч. Древесный уголь удаляли фильтрованием через целит, и фильтр промывали EtOAc (1 л). Фильтрат концентрировали с получением указанного в заголовке соединения в виде желтовато-белого твердого вещества (30,49, 92,93%). МС (ЖХМС) m/z 513,9 (М-1). Стадия С) (2R)-4-[5-Фтор-4-(2-фтор-3-метоксифенил)-2-оксопиридин-1(2H)-ил]-N-гидрокси-2 метил-2-(метилсульфонил)бутанамид. пара-Толуолсульфонат пиридиния (190 мг, 0,76 ммоль) добавляли в раствор (2R)-4-[5-фтор-4-(2 фтор-3-метоксифенил)-2-оксопиридин-1(2H)-ил]-2-метил-2-(метилсульфонил)-N-(тетрагидро-2H-пиран 2-илокси)бутанамида (777 мг, 1,51 ммоль) в этаноле (15 мл). Эту реакционную смесь нагревали до 50C и перемешивали при этой температуре в течение ночи. В раствор добавляли дополнительное количество пара-толуолсульфоната пиридиния (118 мг, 0,47 ммоль), и реакционную смесь нагревали при 60C в течение 3 ч. Реакционной смеси давали возможность охладиться до к.т., и осадок собирали фильтрованием. Твердое вещество промывали этанолом (15 мл) и гексанами (15 мл) и сушили в вакууме с получением указанного в заголовке соединения в виде белого твердого вещества (413 мг, 63,5%). МС (ЖХМС) m/z 431,0 (М+1). 1H ЯМР (400 МГц, DMSO-d6)млн-1 1.57 (s, 1H) 2.08-2.25 (m, 0 Н) 2.41-2.56 (m, 1H) 3.023.19 (m, 3H) 3.71-3.85 (m, 1H) 3.88 (s, 3H) 3.98-4.13 (m, 1H) 6.47 (d, J=7.02 Гц, 1H) 6.93-7.08 (m, 1H) 7.197.36 (m, 2H) 8.04 (d, J=5.66 Гц, 1H) 9.24 (d, J=1.56 Гц, 1H) 11.07 (d, J=1.56 Гц, 1H). Пример 18. (2R)-4-[5-Фтор-4-4-[(транс-4-гидроксициклогексил)метокси]фенил-2-оксопиридин 1(2H)-ил]-N-гидрокси-2-метил-2-(метилсульфонил)бутанамид Стадия А) Этил 4-(тетрагидро-2H-пиран-2-илокси)циклогексанкарбоксилат. Пиридиний-4-толуолсульфонат (2,57 г, 10,2 ммоль) добавляли в раствор этил-4-гидроксициклогексанкарбоксилата (8,8 г, 51,10 ммоль) и 3,4-дигидро-2H-пирана (8,60 г, 102 ммоль) в DCM (200 мл), и эту реакционную смесь перемешивали при к.т. в течение 16 ч. Реакционную смесь гасили насыщенным- 25024782 водн. NaHCO3. Слои разделяли, и органический слой промывали водой. Органический слой сушили(Na2SO4), фильтровали и концентрировали. После очистки флэш-хроматографией на колонке с 200 г диоксида кремния, используя в качестве элюента EtOAc в гексанах (5-10%), получили указанное в заголовке соединение в виде прозрачного масла (11,1 г, 85%). Стадия В)(+/-)-[транс-4(тетрагидро-2H-пиран-2-илокси)циклогексил]метанол. Боргидрид натрия (3,69 г, 97,5 ммоль) добавляли в раствор этил-4-(тетрагидро-2H-пиран-2 илокси)циклогексанкарбоксилата (2,50 г, 9,75 ммоль) в этаноле (100 мл) при 0C. Эту реакционную смесь оставляли нагреваться до к.т. в условиях, когда ледяная баня теряет силу. Через 2 суток реакционную смесь охлаждали до 0C и гасили добавлением 1 н. водн. HCl до прекращения шипения, pH 5-6. Реакционную смесь концентрировали, и полученный остаток распределяли между EtOAc и водой. Слои разделяли, и водный слой экстрагировали EtOAc. Органические слои объединяли, сушили (MgSO4),фильтровали и концентрировали. После очистки на силикагелевой (100 г) колонке с использованием в качестве элюента EtOAc в гексанах (10-40%) получили две смеси энантиомеров в виде прозрачных масел: (+/-)-[цис-4-(тетрагидро-2H-пиран-2-илокси)циклогексил]метанол (387 мг, 18%); 1H ЯМР (400 МГц,ХЛОРОФОРМ-d)млн-1 1.30-1.65 (m, 12H) 1.64-1.76 (m, 1H) 1.76-1.94 (m, 3H) 3.33-3.64 (m, 3H) 3.80-4.01(+/-)-[транс-4-(тетрагидро-2H-пиран-2-илокси)циклогексил]метанол (824, 39,4%); 1H ЯМР (400 МГц, ХЛОРОФОРМ-d)млн-1 0.86-1.11 (m, 2H) 1.16-1.31 (m, 1H) 1.31-1.64 (m, 7 Н) 1.64-1.77 (m, 1H) 1.78-1.93 (m, 3H) 1.99-2.14 (m, 2H) 3.35-3.67 (m, 4H) 3.80-4.04 (m, 1H) 4.63-4.79 (m, 1H). Стадия С) 2-[(транс-4-[4-(4,4,5,5-Тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]метил] циклогексил)окси]тетрагидро-2H-пиран Диизопропилазодикарбоксилат (2,1 мл, 10,5 ммоль) добавляли в раствор [транс-4-(тетрагидро-2Hпиран-2-илокси)циклогексил]метанола (2,05 г, 9,57 ммоль), 4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2 ил)фенола (2,3 г, 10,7 ммоль), трифенилфосфина (2,76 г, 10,5 ммоль) и триэтиламина (1,5 мл,10,5 ммоль) в THF (150 мл) при 0C. Реакционную смесь оставляли нагреваться до к.т. и перемешивали в течение ночи. Добавляли воду (200 мл), и реакционную смесь экстрагировали EtOAc (600 мл). Органические фазы промывали 1 М водн. NaOH (4100 мл), рассолом, затем сушили (Na2SO4), фильтровали и концентрировали при пониженном давлении. Неочищенный остаток очищали флэш-хроматографией, используя в качестве элюента 20% EtOAc в гексанах, с получением указанного в заголовке соединения в виде белого твердого вещества (1,9 г, 48%). МС (ХИАД) m/z 417,3 (М+1). Стадия D) Этил-(2R)-4-[5-фтор-2-оксо-4-(4-[транс-4-(тетрагидро-2H-пиран-2-илокси)циклогексил] метоксифенил)пиридин-1(2H)-ил]-2-метил-2-(метилсульфонил)бутаноат.Pd(dppf)Cl2 (350 мг, 0,431 ммоль) добавляли в раствор этил-(2R)-4-(5-фтор-4-йод-2-оксопиридин 1(2H)-ил)-2-метил-2-(метилсульфонил)бутаноата (1,6 г, 3,6 ммоль), 2-[(транс-4- [4-(4,4,5,5-тетраметил 1,3,2-диоксаборолан-2-ил)фенокси]метилциклогексил)оху]тетрагидро-2H-пирана (1,9 г, 4,49 ммоль) и трехосновного фосфата калия (2,9 г, 10,8 ммоль) в смеси 2-метилтетрагидрофуран/вода (5:1, 240 мл). Реакционную смесь нагревали до 80C и перемешивали при этой температуре в течение 16 ч. Реакционной смеси давали возможность охладиться до к.т. и добавляли воду (50 мл). Смесь экстрагировали EtOAc(3150 мл). Объединенные органические фазы сушили (Na2SO4), фильтровали и концентрировали при пониженном давлении с получением указанного в заголовке соединения в виде светло-рыжеватокоричневого твердого вещества (1,4 г, 64%). МС (ЖХМС) m/z 608,2 (М+1). Стадия Е) (2R)-4-[5-Фтор-2-оксо-4-(4-[транс-4-(тетрагидро-2H-пиран-2-илокси)циклогексил]метоксифенил)пиридин-1(2H)-ил]-2-метил-2-(метилсульфонил)бутановая кислота. Водный раствор гидроксида лития (2,0 М, 5,8 мл, 2,3 ммоль) добавляли в раствор этил-(2R)-4-[5 фтор-2-оксо-4-(4-[транс-4-(тетрагидро-2H-пиран-2-илокси)циклогексил]метоксифенил)пиридин-1(2H)ил]-2-метил-2-(метилсульфонил)бутаноата (1,4 г, 2,3 ммоль) в этаноле (40 мл). Реакционную смесь нагревали до 50C в течение 3 ч. Реакционной смеси давали возможность охладиться до температуры окружающей среды и затем подкисляли до pH примерно 3 добавлением 1,0 н. водн. HCl. Смесь экстрагировали EtOAc (3150 мл). Объединенные органические фазы сушили (Na2SO4), фильтровали и концентрировали при пониженном давлении с получением указанного в заголовке соединения в виде белого твердого вещества (1,28 г, 98%). МС (ЖХМС) m/z 580,3 (М+1). Стадия F) (2R)-4-[5-Фтор-2-оксо-4-(4-[транс-4-(тетрагидро-2H-пиран-2-илокси)циклогексил] метокси-фенил)пиридин-1(2H)-ил]-2-метил-2-(метилсульфонил)-N-(тетрагидро-2H-пиран-2-илокси)бутанамид.N-Метилморфолин (340 мкл, 3,09 ммоль) добавляли в суспензию (2R)-4-[5-фтор-2-оксо-4-(4[транс-4-(тетрагидро-2H-пиран-2-илокси)циклогексил]метокси-фенил)пиридин-1(2H)-ил]-2-метил-2(метилсульфонил)бутановой кислоты (1,28 г, 2,21 ммоль), 2-хлор-4,6-диметокси-1,3,5-триазина (510 мг,2,87 ммоль) в 2-метилтетрагидрофуране (30 мл), и эту реакционную смесь перемешивали в течение 1 ч при к.т. Добавляли O-(тетрагидро-2H-пиран-2-ил)гидроксиламин (61 мг, 0,52 ммоль), и реакционную смесь перемешивали в течение ночи при к.т. Добавляли воду (50 мл), и смесь экстрагировали EtOAc(3150 мл). Объединенные органические фазы сушили (Na2SO4), фильтровали и концентрировали при пониженном давлении. Неочищенное вещество очищали флэш-хроматографией, используя в качестве элюента EtOAc в н-гептане (75-100%), с получением указанного в заголовке соединения в виде светлокоричневого остатка (700 мг, 46%). МС (ЖХМС) m/z 677,4 (М+1). Стадия G) (2R)-4-[5-фтор-4-4-[(транс-4-гидроксициклогексил)метокси 1 фенил]-2-оксопиридин 1(2H)-ил]-N-гидрокси-2-метил-2-(метилсульфонил)бутанамид. Соляную кислоту (4,0 М в 1,4-диоксане, 1,7 мл, 6,63 ммоль) добавляли в раствор (2R)-4-[5-фтор-2 оксо-4-(4-[транс-4-(тетрагидро-2H-пиран-2-илокси)циклогексил]метоксифенил)пиридин-1(2H)-ил]-2 метил-2-(метилсульфонил)-N-(тетрагидро-2H-пиран-2-илокси)бутанамида (450 мг, 0,66 ммоль) в смеси 1,4-диоксан:DCM:вода (2:2:1, 5 мл) при комнатной температуре. Через 1 ч реакционную смесь концентрировали при пониженном давлении. Неочищенный остаток растирали в этаноле (10 мл) в течение ночи. Твердое вещество собирали фильтрованием, промывали этанолом (5 мл) и сушили при пониженном давлении с получением указанного в заголовке соединения в виде белого твердого вещества (110 мг,33%). МС (ЖХМС) m/z 511,1 (М+1). 1H ЯМР (400 МГц, DMSO-d6)млн-1 0.97-1.19 (m, 4H) 1.54 (s, 3H) 1.58-1.72 (m, 1H) 1.72-1.89 (m, 4H) 2.04-2.23 (m, 1H) 2.41 (m, 1H) 3.08 (s, 3H) 3.18-3.40 (m, 1H) 3.65-3.84Pd Encat (580 мг, 0,17 ммоль) добавляли в смесь карбоната калия (723 мг, 5,2 ммоль), (3-фтор-4 метоксифенил)бороновой кислоты (318 мг, 2,1 ммоль) и (2R)-4-(5-фтор-4-йод-2-оксопиридин-1(2H)-ил)2-метил-2-(метилсульфонил)-N-(тетрагидро-2H-пиран-2-илокси)бутанамида, Т 3, (900 мг, 1,7 ммоль) в смеси 1,4-диоксан:вода (5:1, 24 мл). Реакционную смесь нагревали до 80C и перемешивали при этой температуре в течение ночи. Реакционную смесь фильтровали через слой целита, который промывали метанолом (250 мл). Фильтрат концентрировали при пониженном давлении, и полученную неочищенное вещество очищали флэш-хроматографией, используя в качестве элюента EtOAc в гептанах (20-100%),затем 10% метанола в EtOAc, с получением указанного в заголовке соединения в виде светлорыжеватого остатка (800 мг, 99%). МС (ЖХМС) m/z 495,1 (М-1). Стадия В) (2R)-4-[5-Фтор-4-(3-фтор-4-метоксифенил)-2-оксопиридин-1(2H)-ил]-N-гидрокси-2-метил-2-(метилсульфонил)бутанамид. Указанное в заголовке соединение (400 мг, 58%) было получено в виде твердого вещества из (2R)4-[5-фтор-4-(3-фтор-4-метоксифенил)-2-оксопиридин-1(2H)-ил]-2-метил-2-(метилсульфонил)-N-(тетрагидро-2H-пиран-2-илокси)бутанамида (800 мг, 1,65 ммоль) по методике, аналогичной методике, описанной для получения (2R)-4-[5-фтор-4-4-[(транс-4-гидроксициклогексил)метокси]фенил-2-оксопиридин 1(2H)-ил]-N-гидрокси-2-метил-2-(метилсульфонил)бутанамида, пример 18, стадия G. МС (ЖХМС) m/z 413,1 (М+1). 1H ЯМР (400 МГц, DMSO-d6)млн-1 1.54 (s, 3H) 2.06-2.18 (m, 1H) 2.38-2.47 (m, 1H) 3.08 (s,3H) 3.74 (td, J=12.00, 4.88 Гц, 1H) 3.87 (s, 3H) 4.02 (td, J=11.85, 4.98 Гц, 1H) 6.52 (d, J=7.81 Гц, 1H) 7.217.31 (m, 1H) 7.34-7.51 (m, 2H) 7.99 (d, J=6.83 Гц, 1H) 9.20 (s, 1H) 11.06 (br. s, 1H). Пример 20. (2R)-4-[5-Фтор-2-оксо-4-(4-пиримидин-2-илфенил)пиридин-1(2H)-ил]-N-гидрокси-2 метил-2-(метилсульфонил)бутанамидK3PO4 (28,3 мл, 28,3 ммоль) и Pd(PPh3)4 (330 мг, 0,31 ммоль) в DMF (140 мл) нагревали до 80C и перемешивали при этой температуре в течение 16 ч. В реакционную смесь добавляли воду (100 мл), и смесь экстрагировали EtOAc (3200 мл). Объединенные органические фазы сушили (Na2SO4), фильтровали и концентрировали при пониженном давлении. Неочищенное вещество очищали флэшхроматографией, используя в качестве элюента 17% EtOAc в н-гептане, с получением указанного в заголовке соединения в виде белого твердого вещества (0,7 г, 28%). МС (ЖХМС) m/z 283,1 (М+1). 1H ЯМР(400 МГц, ХЛОРОФОРМ-d)млн-1 1.36 (s, 12H) 7.19 (t, J=4.68 Гц, 1H) 7.93 (d, J=8.00 Гц, 2H) 8.43 (d,J=7.81 Гц, 2H) 8.81 (d, J=4.68 Гц, 2H). Стадия В) Этил-(2R)-4-[5-Фтор-2-оксо-4-(4-пиримидин-2-илфенил)пиридин-1(2H)-ил]-2-метил-2(метилсульфонил)бутаноат. Указанное в заголовке соединение (278 мг, 87%) было получено в виде светло-рыжеватокоричневого твердого вещества из 2-[4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]пиримидина(270 мг, 0,94 ммоль) и этил-(2R)-4-(5-фтор-4-йод-2-оксопиридин-1(2H)-ил)-2-метил-2-(метилсульфонил) бутаноата, Т 2, (300 мг, 0,67 ммоль) по методике, аналогичной методике, описанной для получения этил(2R)-4-[5-фтор-2-оксо-4-(4-[транс-4-(тетрагидро-2H-пиран-2-илокси)циклогексил]метоксифенил)пиридин-1(2H)-ил]-2-метил-2-(метилсульфонил)бутаноата, пример 18, стадия D. МС (ЖХМС) m/z 474,2(М+1). Стадия С) (2R)-4-[5-Фтор-2-оксо-4-(4-пиримидин-2-илфенил)пиридин-1(2H)-ил]-2-метил-2-(метилсульфонил)бутановая кислота. Указанное в заголовке соединение (250 мг, 98%) было получено в виде светло-коричневой смолы из этил-(2R)-4-[5-фтор-2-оксо-4-(4-пиримидин-2-илфенил)пиридин-1(2H)-ил]-2-метил-2-(метилсульфонил) бутаноата (270 мг, 0,57 ммоль) по методике, аналогичной методике, описанной для получения (2R)-4-[5 фтор-2-оксо-4-(4-[транс-4-(тетрагидро-2H-пиран-2-илокси)циклогексил]метокси-фенил)пиридин 1(2H)-ил]-2-метил-2-(метилсульфонил)бутановой кислоты, пример 18, стадия Е. МС (ЖХМС) m/z 446,1(2R)-4-[5-фтор-2-оксо-4-(4-пиримидин-2-илфенил)пиридин-1(2H)-ил]-2-метил-2-(метилсульфонил)бутановой кислоты (250 мг, 0,56 ммоль) и О-(тетрагидро-2H-пиран-2-ил)гидроксиламина (87 мг, 0,74 ммоль) по методике, аналогичной методике, описанной для получения (2R)-4-[5-фтор-2-оксо-4-(4-[транс-4(тетрагидро-2H-пиран-2-илокси)циклогексил]метокси-фенил)пиридин-1(2H)-ил]-2-метил-2-(метилсульфонил)-N-(тетрагидро-2H-пиран-2-илокси)бутанамида, пример 18, стадия F. МС (ЖХМС) m/z 543,0(М+1). Стадия Е) (2R)-4-[5-Фтор-2-оксо-4-(4-пиримидин-2-илфенил)пиридин-1(2H)-ил]-N-гидрокси-2 метил-2-(метилсульфонил)бутанамид. Указанное в заголовке соединение (80 мг, 30%) было получено в виде рыжевато-коричневого твердого вещества из (2R)-4-[5-фтор-2-оксо-4-(4-пиримидин-2-илфенил)пиридин-1(2H)-ил]-2-метил-2(метилсульфонил)-N-(тетрагидро-2H-пиран-2-илокси)бутанамида (312 мг, 0,57 ммоль) по методике, аналогичной методике, описанной для получения (2R)-4-[5-фтор-4-4-[(транс-4-гидроксициклогексил)метокси]фенил-2-оксопиридин-1(2H)-ил]-N-гидрокси-2-метил-2-(метилсульфонил)бутанамида, пример 18,стадия G. МС (ЖХМС) m/z 461,1 (М+1). 1H ЯМР (400 МГц, МЕТАНОЛ-d4)млн-1 1.70 (s, 3H) 2.31-2.45 Стадия А) 5-Метокси-2-[4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]пиримидин. Указанное в заголовке соединение (700 мг, 17%) было получено в виде белого твердого вещества из 2-хлор-5-метоксипиримидина (1,85 г, 12,8 ммоль) и 2,2'-(1,4-фенилен)бис(4,4,5,5-тетраметил-1,3,2 диоксаборолана) (6,9 г, 21,0 ммоль) по методике, аналогичной методике, описанной для получения 2-[4(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]пиримидина, пример 20, стадия А. МС (ЖХМС) m/z 313,1 (М+1). 1H ЯМР (400 МГц, ХЛОРОФОРМ-d)млн-1 1.33 (s, 12H) 3.93 (s, 3H) 7.83-7.90 (m, 2H) 8.288.34 (m, 2H) 8.45 (s, 2H). Стадия В) (2R)-4-5-Фтор-4-[4-(5-метоксипиримидин-2-ил)фенил]-2-оксопиридин-1(2H)-ил]-2 метил-2-(метилсульфонил)-N-(тетрагидро-2H-пиран-2-илокси)бутанамид. Указанное в заголовке соединение (900 мг, 95%) было получено в виде рыжевато-коричневого твердого вещества из 5-метокси-2-[4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]пиримидина(719 мг, 2,3 ммоль) и (2R)-4-(5-фтор-4-йод-2-оксопиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)-N(тетрагидро-2H-пиран-2-илокси)бутанамида, Т 3, (850 мг, 1,65 ммоль) по методике, аналогичной методи- 28024782 ке, описанной для получения (2R)-4-[5-фтор-4-(3-фтор-4-метоксифенил)-2-оксопиридин-1(2H)-ил]-2 метил-2-(метилсульфонил)-N-(тетрагидро-2H-пиран-2-илокси)бутанамида, пример 19 Стадия А. МС(ЖХМС) m/z 573,2 (М+1). Стадия С) (2R)-4-5-Фтор-4-[4-(5-метоксипиримидин-2-ил)фенил]-2-оксопиридин-1(2H)-ил]-Nгидрокси-2-метил-2-(метилсульфонил)бутанамид. Указанное в заголовке соединение (50 мг, 6%) было получено в виде светло-коричневого твердого вещества из (2R)-4-5-фтор-4-[4-(5-метоксипиримидин-2-ил)фенил]-2-оксопиридин-1(2H)-ил-2-метил-2(метилсульфонил)-N-(тетрагидро-2H-пиран-2-илокси)бутанамида (900 мг, 1,57 ммоль) по методике, аналогичной методике, описанной для получения (2R)-4-[5-фтор-4-4-[(транс-4-гидроксициклогексил) метокси]фенил-2-оксопиридин-1(2H)-ил]-N-гидрокси-2-метил-2-(метилсульфонил)бутанамида, пример 18,стадия G. МС (ЖХМС) m/z 491,1 (М+1). 1H ЯМР (400 МГц, DMSO-d6)млн-1 1.53 (s, 3H) 2.08-2.19 (m,1H) 2.39-2.48 (m, 1H) 3.07 (s, 3H) 3.69-3.78 (m, 1H) 3.92 (s, 3H) 3.96-4.08 (m, 1H) 6.56 (d, J=7.71 Гц, 1H) 7.67 (m, J=8.70, 2.00 Гц, 2H) 8.01 (d, J=6.54 Гц, 1H) 8.34-8.38 (m, 2H) 8.64 (s, 2H) 9.19 (br. d, J=1.80 Гц, 1H) 11.04 (br. d, J=1.90 Гц, 1H). Пример 22. (2R)-4-5-Фтор-4-[4-(4-метокси-2H-1,2,3-триазол-2-ил)фенил]-2-оксопиридин-1(2H)ил-N-гидрокси-2-метил-2-(метилсульфонил)бутанамид Стадия А) 2-(4-Бромфенил)-4-метокси-2H-1,2,3-триазол. Карбонат цезия (4,5 г, 13,7 ммоль) добавляли в раствор 2-(4-бромфенил)-2H-1,2,3-триазол-4-ола (1,1 г, 4,6 ммоль) и метилйодида (0,36 мл, 5,7 ммоль) в THF (50 мл). Реакционную смесь нагревали до 60C и перемешивали ее при этой температуре в течение 16 ч. В реакционную смесь добавляли воду (20 мл), и полученную смесь экстрагировали EtOAc (2150 мл). Объединенные органические фазы сушили над карбонатом калия, фильтровали и концентрировали при пониженном давлении с получением указанного в заголовке соединения в виде рыжевато-коричневого твердого вещества (1,1 г, 95%). 1H ЯМР (400 МГц,МЕТАНОЛ-d4)млн-1 3.98 (s, 3H) 7.39 (s, 1H) 7.55-7.62 (m, 2H) 7.79-7.86 (m, 2H). Стадия В) 4-Метокси-2-[4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-2H-1,2,3-триазол.(1,1 г, 2,6 ммоль), 4,4,4',4',5,5,5',5'-октаметил-2,2'-би-1,3,2-диоксаборолана (1,3 г, 5,2 ммоль), ацетата калия (1,3 г, 13,0 ммоль) в смеси 2-метилтетрагидрофуран:вода (5:1, 60 мл). Эту реакционную смесь нагревали до 80C и перемешивали при этой температуре в течение 16 ч. Реакционной смеси давали возможность охладиться до к.т. и добавляли воду (50 мл). Реакционную смесь фильтровали через целит, который промывали EtOAc (150 мл). Фильтрат концентрировали при пониженном давлении, и полученную неочищенное вещество очищали флэш-хроматографией, используя в качестве элюента EtOAc в н-гептане(10-60%), с получением указанного в заголовке соединения в виде светло-рыжевато-коричневого твердого вещества (1,2 г, 92%). МС (ЖХМС) m/z 302,3 (М+1). 1H ЯМР (400 МГц, МЕТАНОЛ-d4)млн-1 1.33 (s,12H) 4.01 (s, 3H) 7.40 (s, 1H) 7.78-7.84 (m, 2H) 7.88-7.95 (m, 2H). Стадия С) (2R)-4-5-Фтор-4-[4-(4-метокси-2H-1,2,3-триазол-2-ил)фенил]-2-оксопиридин-1(2H)-ил]2-метил-2-(метилсульфонил)-N-(тетрагидро-2H-пиран-2-илокси)бутанамид. Указанное в заголовке соединение (1,15 мг, 88%) было получено в виде рыжевато-коричневого твердого вещества из 4-метокси-2-[4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-2H-1,2,3 триазолв (0,98 г, 1,4 ммоль) и (2R)-4-(5-фтор-4-йод-2-оксопиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)-N-(тетрагидро-2H-пиран-2-илокси)бутанамида, Т 3, (1,2 г, 2,3 ммоль) по методике, аналогичной методике, описанной для получения (2R)-4-[5-фтор-4-(3-фтор-4-метоксифенил)-2-оксопиридин-1(2H)ил]-2-метил-2-(метилсульфонил)-N-(тетрагидро-2H-пиран-2-илокси)бутанамида, пример 19 Стадия А. МС (ЖХМС) m/z 562,0 (М+1). Стадия D) (2R)-4-5-Фтор-4-[4-(4-метокси-2H-1,2,3-триазол-2-ил)фенил]-2-оксопиридин-1(2H)-ил]N-гидрокси-2-метил-2-(метилсульфонил)бутанамид. Указанное в заголовке соединение (700 мг, 70%) было получено в виде светло-рыжеватокоричневого твердого вещества из (2R)-4-5-фтор-4-[4-(4-метокси-2H-1,2,3-триазол-2-ил)фенил]-2-оксопиридин-1(2H)-ил-2-метил-2-(метилсульфонил)-N-(тетрагидро-2H-пиран-2-илокси)бутанамида (1,15 г,2,04 ммоль) по методике, аналогичной методике, описанной для получения (2R)-4-[5-фтор-4-4-[(транс-4-гидроксициклогексил)метокси]фенил-2-оксопиридин-1(2H)-ил]-N-гидрокси-2-метил-2-(метилсульфонил)бутанамида, пример 18, стадия G. МС (ЖХМС) m/z 480,2 (М+1). 1H ЯМР (400 МГц, DMSO-d6)млн-1 1.53 (s, 3H) 2.07-2.18 (m, 1H) 2.39-2.48 (m, 1H) 3.06 (s, 3H) 3.69-3.77 (m, 1H) 3.95 (s, 3H) 3.97-4.08
МПК / Метки
МПК: A61K 31/4412, C07D 213/69, A61K 31/4433, C07D 401/10, C07D 413/10, A61K 31/4439, A61K 31/4427, C07D 405/04, A61P 31/00, C07D 417/12, C07D 405/12, C07D 213/64, C07D 401/04
Метки: полезные, антибактериальных, агентов, производные, качестве, фторпиридинона
Код ссылки
<a href="https://eas.patents.su/30-24782-proizvodnye-ftorpiridinona-poleznye-v-kachestve-antibakterialnyh-agentov.html" rel="bookmark" title="База патентов Евразийского Союза">Производные фторпиридинона, полезные в качестве антибактериальных агентов</a>
Предыдущий патент: Реактор для проведения автотермической дегидрогенизации газовой фазы
Следующий патент: Способ формования анионно-модифицированной целлюлозы
Случайный патент: Способ получения вспененных пластмасс, в частности пенополимеров на основе пвх, и состав полимерной смеси для осуществления указанного способа












