N-(2-{2-диметиламиноэтил-метиламино}-4-метокси-5-{[4-(1-метилиндол-3-ил)пиримидин-2-ил]амино}фенил)проп-2-енамид и его фармацевтически приемлемые соли в качестве модуляторов egfr, полезных для лечения рака
Номер патента: 24421
Опубликовано: 30.09.2016
Авторы: Уорд Ричард Эндрью, Муруган Андиаппан, Редферн Хизер Мэри, Чинтакунтла Чандрасехара Редди, Кадамбар Васанта Кришна, Финлей Морис Реймонд Верскойл, Баттеруорт Сэм, Чуакуи Клаудио Эдмундо
Формула / Реферат
1. Соединение N-(2-{2-диметиламиноэтил-метиламино}-4-метокси-5-{[4-(1-метилиндол-3-ил)пиримидин-2-ил]амино}фенил)проп-2-енамид
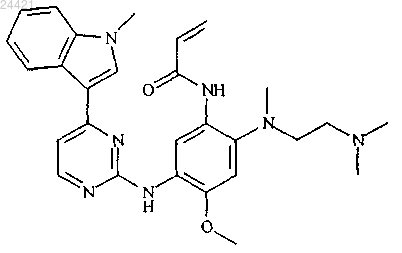
или его фармацевтически приемлемая соль.
2. Соединение N-(2-{2-диметиламиноэтил-метиламино}-4-метокси-5-{[4-(1-метилиндол-3-ил)пиримидин-2-ил]амино}фенил)проп-2-енамид по п.1.
3. Фармацевтически приемлемая соль по п.1, представляющая собой мезилатную соль N-(2-{2-диметиламиноэтил-метиламино}-4-метокси-5-{[4-(1-метилиндол-3-ил)пиримидин-2-ил]амино}фенил)проп-2-енамида.
4. Фармацевтическая композиция, обладающая активностью ингибитора L858R EGFR (рецептор эпидермального фактора роста) мутанта, и/или T790M EGFR мутанта, и/или EGFR мутанта с делецией в экзоне 19, содержащая соединение или его фармацевтически приемлемую соль по любому из пп.1-3 вместе с фармацевтически приемлемым разбавителем или носителем.
5. Применение соединения или его фармацевтически приемлемой соли по любому из пп.1-3 в качестве ингибитора L858R EGFR мутанта, и/или T790M EGFR мутанта, и/или EGFR мутанта с делецией в экзоне 19.
6. Применение соединения или его фармацевтически приемлемой соли по любому из пп.1-3 в лечении рака.
7. Применение по п.6, где рак представляет собой немелкоклеточный рак легких.
8. Применение соединения или его фармацевтически приемлемой соли по любому из пп.1-3 для изготовления лекарственного средства для лечения рака.
9. Применение по п.8, где рак представляет собой немелкоклеточный рак легких.
Текст
N-(2-2-ДИМЕТИЛАМИНОЭТИЛ-МЕТИЛАМИНО-4-МЕТОКСИ-5-[4-(1 МЕТИЛИНДОЛ-3-ИЛ)ПИРИМИДИН-2-ИЛ]АМИНОФЕНИЛ)ПРОП-2-ЕНАМИД И ЕГО ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ В КАЧЕСТВЕ МОДУЛЯТОРОВ EGFR,ПОЛЕЗНЫХ ДЛЯ ЛЕЧЕНИЯ РАКА Эндрью (GB), Кадамбар Васанта Кришна, Чинтакунтла Чандрасехара Редди, Муруган Андиаппан (IN),Редферн Хизер Мэри (GB), Чуакуи Клаудио Эдмундо (US) Настоящее изобретение относится к N-(2-2-диметиламиноэтил-метиламино-4-метокси-5-[4-(1 метилиндол-3-ил)пиримидин-2-ил]аминофенил)проп-2-енамиду Баттеруорт Сэм, Финлей Морис Реймонд Верскойл, Уорд Ричард и его фармацевтически приемлемым солям, которые могут быть полезны в лечении или предупреждении заболевания или медицинского состояния, опосредованного некоторыми мутированными формами рецептора эпидермального фактора роста (например, L858R активирующий мутант, активирующий мутант с делецией в экзоне 19 и T790M резистентный мутант). Такие соединения и их соли могут быть полезны в лечении или предупреждении ряда различных злокачественных новообразований. Изобретение также относится к фармацевтическим композициям, содержащим указанное соединение или его фармацевтически приемлемую соль,и к применению указанного соединения или его фармацевтически приемлемой соли в качестве ингибитора L858R EGFR мутанта, и/или T790M EGFR мутанта, и/или EGFR мутанта с делецией в экзоне 19 или для изготовления лекарственного средства для лечения рака. Настоящее изобретение относится к некоторым 2-(2,4,5-замещенным анилино)пиримидиновым соединениям и их фармацевтически приемлемым солям, которые могут быть полезны в лечении или предупреждении заболевания или медицинского состояния, опосредованного некоторыми мутированными формами рецептора эпидермального фактора роста (например, L858R активирующий мутант, активирующий мутант с делецией в экзоне 19 и T790M резистентный мутант). Такие соединения и их соли могут быть полезны в лечении или предупреждении ряда различных злокачественных новообразований. Изобретение также относится к фармацевтическим композициям, содержащим указанные соединения и их соли, особенно полезным полиморфным формам этих соединений и солей, промежуточным соединениям, полезным в получении указанных соединений, и к способам лечения заболеваний, опосредованных разнообразными различными формами EGFR, с использованием указанных соединений и их солей.EGFR представляет собой трансмембранный белок тирозинкиназу, являющуюся членом семействаerbB рецептора. При связывании лиганда фактора роста, такого как эпидермальный фактор роста (EGF),рецептор может гомодимеризоваться с другой молекулой EGFR или гетеродимеризоваться с другим членом семейства, таким как erbB2 (HER2), erbB3 (HER3) или erbB4 (HER4). Гомо- и/или гетеро-димеризация erbB рецепторов приводит в результате к фосфорилированию ключевых тирозиновых остатков во внутриклеточном домене и ведет к стимуляции огромного количества внутриклеточных путей передачи сигнала, вовлеченных в клеточную пролиферацию и выживание. Нарушение регуляции передачи сигнала erbB семейства запускает пролиферацию, инвазию, метастазы,ангиогенез и выживание опухолевой клетки и было описано для многих человеческих злокачественных новообразований, в том числе легкого, головы и шеи, а также груди. Таким образом, ErbB семейство представляет рациональную мишень для разработки противораковых лекарственных средств, и в настоящее время в клинической практике доступен ряд агентов, направленных на EGFR или erbB2, включая гефитиниб (IRESSA), эрлотиниб (TARCEVA) и лапатиниб(TYKERB, TYVERB). Подробное описание передачи сигнала erbB рецептора и его вовлеченности в онкогенез представлено в New England Journal of Medicine (2008). Vol. 358, 1160-74 и Biochemical andVol. 350, 2129-39), что активирующие мутации в EGFR коррелировали с ответом на терапию гефитинибом при немелкоклеточном раке легких (NSCLC). Наиболее распространенные EGFR активирующие мутации L858R и delE746A750 приводят в результате к увеличению аффинности в отношении низкомолекулярных ингибиторов тирозинкиназы, таких как гефитиниб и эрлотиниб, и снижению аффинности в отношении аденозинтрифосфата (ATP) по сравнению с EGFR дикого типа (WT). В итоге, возникает приобретенная резистентность к терапии гефитинибом или эрлотинибом, например, посредством мутации гена-привратника остатка T790M, которую, как сообщают, обнаруживают у 50% клинически резистентных пациентов. Полагают, что данная мутация не препятствует связыванию гефитиниба или эрлотиниба с EGFR стерически, а просто изменяет аффинность к ATP до уровней, сравнимых с WT EGFR. В свете важности этой мутации в резистентности к существующим терапиям, направленным наEGFR, авторы полагают, что агенты, которые могут ингибировать EGFR-несущую мутацию генапривратника, могут быть особенно полезны в лечении рака. Сохраняется необходимость в соединениях, которые могут проявлять благоприятные профили эффективности против WT EGFR в сравнении с активирующими мутантными формами EGFR (напримерL858R EGFR мутанта, или delE746A750 мутанта, или EGFR мутанта с делецией в экзоне 19), и/или резистентными мутантными формами EGFR (например, T790M EGFR мутанта), и/или избирательно в отношении других ферментных рецепторов, которые могут сделать соединения особенно перспективными для разработки в качестве терапевтических агентов. В данном отношении, остается необходимость в соединениях, которые показывают более высокую степень ингибирования некоторых активирующих или резистентных мутантных форм EGFR, в то же время показывая относительно низкое ингибирование WTEGFR. Такие соединения, как ожидают, могут быть более подходящими в качестве терапевтических агентов, особенно для лечения рака, в виду снижения токсикологических признаков, ассоциированных с ингибированием WT EGFR. Такие токсикологические признаки, как известно, проявляются как таковые у человека в виде кожных сыпей и/или диареи. Заявители неожиданно обнаружили, что одно или более 2-(2,4,5-замещенных анилино)пиримидиновых соединений имеют высокую эффективность против нескольких мутантных форм EGFR, в то же время проявляя относительно низкое ингибирование WTEGFR. Соединение(я) по изобретению могут также проявлять благоприятные физические свойства (например, высокую растворимость в воде, высокую проницаемость и/или низкое связывание с белками плазмы) и/или благоприятные профили токсичности (например, пониженную hERG блокирующую способность) и/или благоприятные метаболические профили по сравнению с другими известными ингибиторами EGFR/EGFR мутантов. Таким образом, такое(ие) соединение(я) может(гут) быть особенно полезно(ы) в лечении болезненных состояний, в которые вовлечены EGFR и/или активирующие мутации В первом аспекте изобретения предложено соединение формулы (I)R2 выбран из метокси и метила; иR3 выбран из (3R)-3-(диметиламино)пирролидин-1-ила, (3S)-3-(диметиламино)пирролидин-1-ила, 3(диметиламино)азетидин-1-ила, [2-(диметиламино)этил](метил)амино, [2-(метиламино)этил](метил)амино, 5-метил-2,5-диазаспиро[3.4]окт-2-ила, (3aR,6aR)-5-метилгексагидропирроло[3,4-b]пиррол-1(2H)-ила,1-метил-1,2,3,6-тетрагидропиридин-4-ила, 4-метилпиперизин-1-ила, 4-[2-(диметиламино)-2-оксоэтил]пиперазин-1-ила, метил[2-(4-метилпиперазин-1-ил)этил]амино, метил[2-(морфолин-4-ил)этил]амино, 1 амино-1,2,3,6-тетрагидропиридин-4-ила и 4-[(2S)-2-аминопропаноил]пиперазин-1-ила; или его фармацевтически приемлемая соль. В одном воплощении предложено соединение формулы (I), как показано выше, гдеR2 выбран из метокси и метила; иR3 выбран из (3R)-3-(диметиламино)пирролидин-1-ила, (3S)-3-(диметиламино)пирролидин-1-ила, 3(диметиламино)азетидин-1-ила, [2-(диметиламино)этил](метил)амино, 5-метил-2,5-диазаспиро[3.4]окт-2 ила, (3aR,6aR)-5-метилгексагидропирроло[3,4-b]пиррол-1(2H)-ила, 1-метил-1,2,3,6-тетрагидропиридин-4 ила, 4-метилпиперизин-1-ила, 4-[2-(диметиламино)-2-оксоэтил]пиперазин-1-ила, метил[2-(4-метилпиперазин-1-ил)этил]амино, метил[2-(морфолин-4-ил)этил]амино, 1-амино-1,2,3,6-тетрагидропиридин-4-ила и 4-[(2S)-2-аминопропаноил]пиперазин-1-ила; или его фармацевтически приемлемая соль. В одном воплощении предложено соединение формулы (I), как показано выше, гдеR2 выбран из метокси и метила; иR3 выбран из (3R)-3-(диметиламино)пирролидин-1-ила, (3S)-3-(диметиламино)пирролидин-1-ила, 3(диметиламино)азетидин-1-ила, [2-(диметиламино)этил](метил)амино, 5-метил-2,5-диазаспиро[3.4]окт-2 ила, (3aR,6aR)-5-метилгексагидропирроло[3,4-b]пиррол-1(2H)-ила, 1-метил-1,2,3,6-тетрагидропиридин-4 ила, 4-метилпиперизин-1-ила, 4-[2-(диметиламино)-2-оксоэтил]пиперазин-1-ила, метил[2-(4-метилпиперазин-1-ил)этил]амино, метил[2-(морфолин-4-ил)этил]амино, 1-амино-1,2,3,6-тетрагидропиридин-4-ила и 4-[(2S)-2-аминопропаноил]пиперазин-1-ила; или его фармацевтически приемлемая соль. Подходящая фармацевтически приемлемая соль соединения формулы (I) представляет собой, например, соль присоединения кислоты. Например, соль присоединения кислоты может быть образована с использованием неорганической или органической кислоты. Соль присоединения кислоты может быть образована с использованием неорганической кислоты, выбранной из соляной кислоты, бромистоводородной кислоты, серной кислоты и фосфорной кислоты. Соль присоединения кислоты может быть образована с использованием органической кислоты, выбранной из трифторуксусной кислоты, лимонной кислоты, малеиновой кислоты, щавелевой кислоты, уксусной кислоты, муравьиной кислоты, бензойной кислоты, фумаровой кислоты, янтарной кислоты, винной кислоты, молочной кислоты, пировиноградной кислоты, метансульфоновой кислоты, бензолсульфоновой кислоты и паратолуолсульфоновой кислоты. В одном воплощении предложена мезилатная соль N-(2-2-диметиламиноэтил-метиламино-4 метокси-5-[4-(1-метилиндол-3-ил)пиримидин-2-ил]аминофенил)проп-2-енамида. Следует понимать, что соединение формулы (I) и его фармацевтически приемлемые соли могут существовать в сольватированных формах и несольватированных формах. Например, сольватированная форма может представлять собой гидратированную форму. Следует понимать, что настоящее изобретение охватывает все такие сольватированные и несольватированные формы. Соединение формулы (I) может быть введено в форме пролекарства, которое распадается в организме человека или животного с получением соединения формулы (I). Примеры пролекарств включаютin vivo гидролизуемые сложные эфиры соединения формулы (I). In vivo гидролизуемые сложные эфиры могут быть образованы этерификацией гидроксильной группы в соединении формулы (I). Разные формы пролекарств известны в данной области техники. Например, такие пролекарственные производные можно найти в:Pharm Bull, 32, 692 (1984). В одном аспекте изобретения предложены соединения формулы (I), которые ингибируют одну или более активирующих или резистентных мутаций EGFR, например L858R активирующий мутант, активирующий мутант EGFR с делецией в экзоне 19 и T790M резистентный мутант. Премущественно такие соединения могут быть полезны для лечения рака у пациента, у которого развился или у которого может присутствовать риск развития уровня резистентности до уровня существующих терапий на основе EGFR ингибитора. В одном аспекте предложены соединения формулы (I), которые показывают более высокую степень ингибирования активирующих или резистентных мутантных форм EGFR по сравнению с WT EGFR. Такие соединения, как ожидают, могут быть более подходящими в качестве терапевтических агентов, особенно для лечения рака, в виду снижения токсикологических признаков, ассоциированных с ингибированием WT EGFR. Такие токсикологические признаки, как известно, проявляются как таковые у человека в виде кожных сыпей и/или диареи. В одном воплощении предложено соединение формулы (I), как показано выше, гдеR3 выбран из (3R)-3-(диметиламино)пирролидин-1-ила, (3S)-3-(диметиламино)пирролидин-1-ила, 3(диметиламино)азетидин-1-ила, [2-(диметиламино)этил](метил)амино, 5-метил-2,5-диазаспиро[3.4]окт-2 ила, (3aR,6aR)-5-метилгексагидропирроло[3,4-b]пиррол-1(2H)-ила, 1-метил-1,2,3,6-тетрагидропиридин-4 ила, 4-метилпиперизин-1-ила, 4-[2-(диметиламино)-2-оксоэтил]пиперазин-1-ила, метил[2-(4-метилпиперазин-1-ил)этил]амино, метил[2-(морфолин-4-ил)этил]амино, 1-амино-1,2,3,6-тетрагидропиридин-4 ила и 4-[(2S)-2-аминопропаноил]пиперазин-1-ила; или его фармацевтически приемлемая соль. В дополнительном воплощении предложено соединение формулы (I), как показано выше, гдеR3 выбран из (3R)-3-(диметиламино)пирролидин-1-ила, 3-(диметиламино)-азетидин-1-ила, [2-(диметиламино)этил](метил)амино, 1-метил-1,2,3,6-тетрагидропиридин-4-ила и 4-метилпиперизин-1-ила; или его фармацевтически приемлемая соль. В дополнительном воплощении предложено соединение формулы (I), как показано выше, гдеR3 выбран из (3R)-3-(диметиламино)пирролидин-1-ила, (3S)-3-(диметиламино)пирролидин-1-ила, 3(диметиламино)азетидин-1-ила, [2-(диметиламино)этил](метил)амино, 5-метил-2,5-диазаспиро[3.4]окт-2 ила, (3aR,6aR)-5-метил-гексагидропирроло[3,4-b]пиррол-1(2H)-ила, 1-метил-1,2,3,6-тетрагидропиридин 4-ила, 4-метилпиперизин-1-ила, 4-[2-(диметиламино)-2-оксоэтил]пиперазин-1-ила, метил[2-(4-метилпиперазин-1-ил)этил]амино, метил[2-(морфолин-4-ил)этил]амино, 1-амино-1,2,3,6-тетрагидропиридин-4 ила и 4-[(2S)-2-аминопропаноил]пиперазин-1-ила; или его фармацевтически приемлемая соль. В дополнительном воплощении предложено соединение формулы (I), как показано выше, гдеR3 выбран из (3R)-3-(диметиламино)пирролидин-1-ила, 3-(диметиламино)-азетидин-1-ила, [2-(диметиламино)этил](метил)амино и 4-метилпиперизин-1-ила; или его фармацевтически приемлемая соль. В дополнительном воплощении предложено соединение формулы (I), как показано выше, гдеR3 выбран из (3R)-3-(диметиламино)пирролидин-1-ила, (3S)-3-(диметиламино)пирролидин-1-ила, 3(диметиламино)азетидин-1-ила, [2-(диметиламино)этил]-(метил)амино, 5-метил-2,5-диазаспиро[3.4]окт 2-ила, (3aR,6aR)-5-метилгексагидропирроло[3,4-b]пиррол-1(2H)-ила, 1-метил-1,2,3,6-тетрагидропиридин 4-ила, 4-метилпиперизин-1-ила, 4-[2-(диметиламино)-2-оксоэтил]пиперазин-1-ила, метил[2-(4-метилпиперазин-1-ил)этил]амино, метил[2-(морфолин-4-ил)этил]амино, 1-амино-1,2,3,6-тетрагидропиридин-4 ила и 4-[(2S)-2-аминопропаноил]пиперазин-1-ила; или его фармацевтически приемлемая соль. В дополнительном воплощении предложено соединение формулы (I), как показано выше, гдеR3 выбран из (3R)-3-(диметиламино)пирролидин-1-ила, (3S)-3-(диметиламино)пирролидин-1-ила, 3(диметиламино)азетидин-1-ила, [2-(диметиламино)этил](метил)амино, 5-метил-2,5-диазаспиро[3.4]окт-2 ила, (3aR,6aR)-5-метилгексагидропирроло[3,4-b]пиррол-1(2H)-ила, 1-метил-1,2,3,6-тетрагидропиридин-4 ила, 4-метилпиперизин-1-ила, 4-[2-(диметиламино)-2-оксоэтил]пиперазин-1-ила, метил[2-(4-метилпиперазин-1-ил)этил]амино, метил[2-(морфолин-4-ил)этил]амино, 1-амино-1,2,3,6-тетрагидропиридин-4-ила и 4-[(2S)-2-аминопропаноил]пиперазин-1-ила; или его фармацевтически приемлемая соль. В дополнительном воплощении предложено соединение формулы (I), как показано выше, где:R3 выбран из [2-(диметиламино)этил](метил)амино, (3aR,6aR)-5-метилгексагидропирроло[3,4b]пиррол-1(2H)-ила, (3R)-3-(диметиламино)пирролидин-1-ила, 1-метил-1,2,3,6-тетрагидропиридин-4-ила,3-(диметиламино)азетидин-1-ила, 5-метил-2,5-диазаспиро[3.4]окт-2-ила; или его фармацевтически приемлемая соль. В дополнительном воплощении предложено соединение формулы (I), как показано выше, гдеR3 выбран из [2-(диметиламино)этил](метил)амино, (3aR,6aR)-5-метилгексагидропирроло[3,4-b]пиррол-1(2H)-ила, (3R)-3-(диметиламино)пирролидин-1-ила, 1-метил-1,2,3,6-тетрагидропиридин-4-ила, 3(диметиламино)азетидин-1-ила, 5-метил-2,5-диазаспиро[3.4]окт-2-ила; или его фармацевтически приемлемая соль. В одном воплощении предложено соединение формулы (I), как показано выше, гдеR3 представляет собой [2-(диметиламино)этил]-(метил)амино или [2-(метиламино)этил](метил)амино; или его фармацевтически приемлемая соль. Некоторые значения переменных групп являются такими, как указано ниже. Такие значения могут быть использованы в комбинации с любыми из определений, формул, аспектов или воплощений, определенных здесь, образуя дополнительные воплощения по изобретениюR3 представляет собой 4-[(2S)-2-аминопропаноил]пиперазин-1-ил. В дополнительном воплощении изобретения, касающегося любого пункта или воплощения соединения формулы (I), описанного здесь или выводимого отсюда, или его фармацевтически приемлемой соли, предложен такой пункт или воплощение, где одно из соединений примеров этой заявки не заявляется. Во избежание сомнений, соединения примеров представляют собой те, которые перечислены как пример 1, пример 2 и так далее, в описанном ниже экспериментальном разделе. Таким образом, например, в одном воплощении предложено соединение формулы (I), как показано выше, гдеR2 выбран из метокси и метила; иR3 выбран из (3R)-3-(диметиламино)пирролидин-1-ила, (3S)-3-(диметиламино)пирролидин-1-ила, 3(диметиламино)азетидин-1-ила, [2-(диметиламино)этил](метил)амино, [2-(метиламино)этил](метил)амино, 5-метил-2,5-диазаспиро[3.4]окт-2-ила, (3aR,6aR)-5-метилгексагидропирроло[3,4-b]пиррол-1(2H)-ила,1-метил-1,2,3,6-тетрагидропиридин-4-ила, 4-метилпиперизин-1-ила, 4-[2-(диметиламино)-2-оксоэтил]пиперазин-1-ила, метил[2-(4-метилпиперазин-1-ил)этил]амино, метил[2-(морфолин-4-ил)этил]амино, 1 амино-1,2,3,6-тетрагидропиридин-4-ила и 4-[(2S)-2-аминопропаноил]пиперазин-1-ила; или его фармацевтически приемлемая соль,где соединение формулы (I) не представляет собой N-(2-2-диметиламиноэтил-метиламино-4-метокси-5-[4-(1-метилиндол-3-ил)пиримидин-2-ил]аминофенил)проп-2-енамид. Таким образом, в одном воплощении предложено соединение формулы (I), как показано выше, гдеR2 выбран из метокси и метила; иR3 выбран из (3R)-3-(диметиламино)пирролидин-1-ила, (3S)-3-(диметиламино)пирролидин-1-ила, 3(диметиламино)азетидин-1-ила, [2-(диметиламино)этил](метил)амино, 5-метил-2,5-диазаспиро[3.4]окт-2 ила, (3aR,6aR)-5-метилгексагидропирроло[3,4-b]пиррол-1(2H)-ила, 1-метил-1,2,3,6-тетрагидропиридин-4 ила, 4-метилпиперизин-1-ила, 4-[2-(диметиламино)-2-оксоэтил]пиперазин-1-ила, метил[2-(4-метилпиперазин-1-ил)этил]амино, метил[2-(морфолин-4-ил)этил]амино, 1-амино-1,2,3,6-тетрагидропиридин-4-ила и 4-[(2S)-2-аминопропаноил]пиперазин-1-ила; или его фармацевтически приемлемая соль,где соединение формулы (I) не представляет собой N-(2-2-диметиламиноэтил-метиламино-4-метокси-5-[4-(1-метилиндол-3-ил)пиримидин-2-ил]аминофенил)проп-2-енамид. Таким образом, в дополнительном воплощении предложено соединение формулы (I), как показано выше, гдеR2 выбран из метокси и метила; иR3 выбран из (3R)-3-(диметиламино)пирролидин-1-ила, (3S)-3-(диметиламино)пирролидин-1-ила, 3(диметиламино)азетидин-1-ила, [2-(диметиламино)этил]-(метил)амино, 5-метил-2,5-диазаспиро[3.4]окт 2-ила, (3aR,6aR)-5-метилгексагидропирроло[3,4-b]пиррол-1(2H)-ила, 1-метил-1,2,3,6-тетрагидропиридин 4-ила, 4-метилпиперизин-1-ила, 4-[2-(диметиламино)-2-оксоэтил]пиперазин-1-ила, метил[2-(4-метилпиперазин-1-ил)этил]амино, метил[2-(морфолин-4-ил)этил]амино, 1-амино-1,2,3,6-тетрагидропиридин-4 ила и 4-[(2S)-2-аминопропаноил]пиперазин-1-ила; или его фармацевтически приемлемая соль,где соединение формулы (I) не представляет собой N-(2-2-диметиламиноэтил-метиламино-4 метокси-5-[4-(1-метилиндол-3-ил)пиримидин-2-ил]аминофенил)проп-2-енамид. В дополнительных воплощениях изобретения предложены любые из соединений примеров (как они названы здесь в экспериментальном разделе, в их форме свободного основания). В дополнительных воплощениях изобретения предложены любые из соединений примеров (как они названы здесь в экспериментальном разделе, в их форме свободного основания) или их фармацевтически приемлемые соли. Таким образом, примеры лишь некоторых из вышеупомянутых воплощений даны ниже. В одном воплощении предложен N-(5-[5-хлор-4-(1H-индол-3-ил)пиримидин-2-ил]амино-2-(3R)3-диметиламинопирролидин-1-ил-4-метоксифенил)проп-2-енамид. В одном воплощении предложен N-(5-[5-хлор-4-(1H-индол-3-ил)пиримидин-2-ил]амино-2-2-диметиламиноэтил-метиламино-4-метоксифенил)проп-2-енамид или его фармацевтически приемлемая соль. ил)пиримидин-2-ил]амино-2-2-диметиламиноэтил-метиламино-4-метоксифенил)проп-2-енамид или его фармацевтически приемлемая соль. В одном воплощении предложен N-(5-[5-хлор-4-(1-метилиндол-3-ил)пиримидин-2-ил]амино-22-диметиламиноэтил-метиламино-4-метоксифенил)проп-2-енамид. В одном воплощении предложен N-(5-[5-циано-4-(1H-индол-3-ил)пиримидин-2-ил]амино-4-метокси-2-4-метилпиперазин-1-илфенил)проп-2-енамид или его фармацевтически приемлемая соль. В одном воплощении предложен N-(5-[5-циано-4-(1H-индол-3-ил)пиримидин-2-ил]амино-4-метокси-2-4-метилпиперазин-1-илфенил)проп-2-енамид. В одном воплощении предложен N-(2-2-диметиламиноэтил-метиламино-4-метокси-5-[4-(1-метилиндол-3-ил)пиримидин-2-ил]аминофенил)проп-2-енамид или его фармацевтически приемлемая соль. В одном воплощении предложен N-(2-2-диметиламиноэтил-метиламино-4-метокси-5-[4-(1-метилиндол-3-ил)пиримидин-2-ил]аминофенил)проп-2-енамид. В одном воплощении предложен N-(5-[5-циано-4-(1-метилиндол-3-ил)пиримидин-2-ил]амино-22-диметиламиноэтил-метиламино-4-метоксифенил)проп-2-енамид или его фармацевтически приемлемая соль. В одном воплощении предложен N-(5-[5-циано-4-(1-метилиндол-3-ил)пир имидин-2-ил]амино-22-диметиламиноэтил-метиламино-4-метоксифенил)проп-2-енамид. В одном воплощении предложен N-5-[(5-циано-4-пиразоло[1,5-a]пиридин-3-илпиримидин-2 ил)амино]-2-[2-диметиламиноэтил-метиламино]-4-метоксифенилпроп-2-енамид или его фармацевтически приемлемая соль. В одном воплощении предложен N-5-[(5-циано-4-пиразоло[1,5-a]пиридин-3-илпиримидин-2 ил)амино]-2-[2-диметиламиноэтил-метиламино]-4-метоксифенилпроп-2-енамид. В одном воплощении предложен N-5-[(5-циано-4-пиразоло[1,5-a]пиридин-3-илпиримидин-2 ил)амино]-2-[3-диметиламиноазетидин-1-ил]-4-метоксифенилпроп-2-енамид или его фармацевтически приемлемая соль. В одном воплощении предложен N-5-[(5-циано-4-пиразоло[1,5-a]пиридин-3-илпиримидин-2 ил)амино]-2-[3-диметиламиноазетидин-1-ил]-4-метоксифенилпроп-2-енамид. В одном воплощении предложен N-(2-2-диметиламиноэтил-метиламино-4-метокси-5-[4-(4,5,6,7 тетрагидропиразоло[1,5-a]пиридин-3-ил)пиримидин-2-ил]аминофенил)проп-2-енамид. В одном воплощении предложен N-(2-2-диметиламиноэтил-метиламино-4-метокси-5-[4-(4,5,6,7 тетрагидропиразоло[1,5-a]пиридин-3-ил)пиримидин-2-ил]аминофенил)проп-2-енамид или его фармацевтически приемлемая соль. В одном воплощении предложен N-2-[2-диметиламиноэтил-метиламино]-4-метокси-5-[(4-пиразоло[1,5-a]пиридин-3-илпиримидин-2-ил)амино]фенилпроп-2-енамид. В одном воплощении предложен N-2-[2-диметиламиноэтил-метиламино]-4-метокси-5-[(4-пиразоло[1,5-a]пиридин-3-илпиримидин-2-ил)амино]фенилпроп-2-енамид или его фармацевтически приемлемая соль. В одном воплощении предложен N-(2-[2-диметиламиноэтил-метиламино]-5-[4-(1H-индол-3-ил)пиримидин-2-ил]амино-4-метоксифенил)проп-2-енамид. В одном воплощении предложен N-(2-[2-диметиламиноэтил-метиламино]-5-[4-(1H-индол-3-ил)пиримидин-2-ил]амино-4-метоксифенил)проп-2-енамид или его фармацевтически приемлемая соль. В одном воплощении предложен N-(4-метокси-5-[4-(1-метилиндол-3-ил)пиримидин-2-ил]амино 2-[метил-(2-метиламиноэтил)амино]фенил)проп-2-енамид или его фармацевтически приемлемая соль. В одном воплощении предложен N-(4-метокси-5-[4-(1-метилиндол-3-ил)пиримидин-2-ил]амино 2-[метил-(2-метиламиноэтил)амино]фенил)проп-2-енамид. Соединения формулы (I) могут быть получены путем взаимодействия соединения формулы (II) или его соли (где G, R1, R2 и R3 являются такими, как определено в данном описании), с активированным производным акриловой кислоты (например, акрилоилхлоридом или соответствующим активированным сложным эфиром), в растворителе, таком как CH2Cl2, тетрагидрофуран, N,N-диметилформа-6 024421 мид или N,N-диметилацетамид. Таким образом, промежуточные соединения формулы (II) образуют дополнительный аспект настоящего изобретения. Таким образом, в дополнительном аспекте изобретения предложено соединение формулы (II) (как показано выше), гдеR3 выбран из (3R)-3-(диметиламино)пирролидин-1-ила, (3S)-3-(диметиламино)пирролидин-1-ила, 3(диметиламино)азетидин-1-ила, [2-(диметиламино)этил](метил)амино, 5-метил-2,5-диазаспиро[3.4]окт-2 ила, (3aR,6aR)-5-метилгексагидропирроло[3,4-b]пиррол-1(2H)-ила, 1-метил-1,2,3,6-тетрагидропиридин-4 ила, 4-метилпиперизин-1-ила, 4-[2-(диметиламино)-2-оксоэтил]пиперазин-1-ила, метил[2-(4-метилпиперазин-1-ил)этил]амино, метил[2-(морфолин-4-ил)этил]амино, 1-амино-1,2,3,6-тетрагидропиридин-4-ила и 4-[(2S)-2-(трет-бутоксикарбонил)аминопропаноил]пиперазин-1-ила; или его соль. В одном воплощении предложено соединение формулы (II) (как показано выше), гдеR3 выбран из (3R)-3-(диметиламино)пирролидин-1-ила, (3S)-3-(диметиламино)пирролидин-1-ила, 3(диметиламино)азетидин-1-ила, [2-(диметиламино)этил](метил)амино, 5-метил-2,5-диазаспиро[3.4]окт-2 ила, (3aR,6aR)-5-метилгексагидропирроло[3,4-b]пиррол-1(2H)-ила, 1-метил-1,2,3,6-тетрагидропиридин-4 ила, 4-метилпиперизин-1-ила, 4-[2-(диметиламино)-2-оксоэтил]пиперазин-1-ила, метил[2-(4-метилпиперазин-1-ил)этил]амино, метил[2-(морфолин-4-ил)этил]амино, 1-амино-1,2,3,6-тетрагидропиридин-4-ила и 4-[(2S)-2-(трет-бутоксикарбонил)аминопропаноил]пиперазин-1-ила; или его соль. В дополнительном воплощении предложено соединение формулы (II) (как показано выше), где:R3 выбран из (3R)-3-(диметиламино)пирролидин-1-ила, (3S)-3-(диметиламино)пирролидин-1-ила, 3(диметиламино)азетидин-1-ила, [2-(диметиламино)этил](метил)амино, [2-(метиламино)этил](метил)амино, 5-метил-2,5-диазаспиро[3.4]окт-2-ила, (3aR,6aR)-5-метилгексагидропирроло[3,4-b]пиррол-1(2H)-ила,1-метил-1,2,3,6-тетрагидропиридин-4-ила, 4-метилпиперизин-1-ила, 4-[2-(диметиламино)-2-оксоэтил]пиперазин-1-ила, метил[2-(4-метилпиперазин-1-ил)этил]амино, метил[2-(морфолин-4-ил)этил]амино, 1 амино-1,2,3,6-тетрагидропиридин-4-ила и 4-[(2S)-2-аминопропаноил]пиперазин-1-ила; или его соль. В дополнительных воплощениях изобретения предложено любое из промежуточных соединений(как они названы здесь в экспериментальном разделе, в их форме свободного основания). В дополнительных воплощениях изобретения предложено любое из промежуточных соединений(как они названы здесь в экспериментальном разделе, в их форме свободного основания) или их фармацевтически приемлемых солей. Таким образом, примеры лишь некоторых из вышеупомянутых воплощений даны ниже. В одном воплощении предложено промежуточное соединение 100 или его соль. Таким образом, в данном случае предложен N1-(2-диметиламиноэтил)-5-метокси-N1-метил-N4-[4-(1 метилиндол-3-ил)пиримидин-2-ил]бензол-1,2,4-триамин или его соль. В одном воплощении предложен N1-(2-диметиламиноэтил)-5-метокси-N1-метил-N4-[4-(1-метилиндол-3-ил)пиримидин-2-ил]бензол-1,2,4-триамин. В одном воплощении предложено промежуточное соединение 168 или его соль. Таким образом, в данном случае предложен N1-(2-диметиламиноэтил)-N4-[4-(1H-индол-3-ил)пиримидин-2-ил]-5-метокси-N1-метилбензол-1,2,4-триамин или его соль. В одном воплощении предложен N1-(2-диметиламиноэтил)-N4-[4-(1H-индол-3-ил)пиримидин-2-ил]5-метокси-N1-метилбензол-1,2,4-триамин. Аминосоединения формулы (II) могут быть получены путем восстановления соответствующих нитросоединений. Когда G представляет собой индол-3-ил, тогда атом азота индольной группы может быть защищен подходящей защитной группой для азота, например фенилсульфонильной защитной группой. Примеры защитных групп, включая защитные группы, подходящие для защиты атомов азота (а также средства образования и возможного снятия защиты), см. в T.W. Greene and P.G.M. Wuts, "ProtectiveGroups in Organic Synthesis", Second Edition, John WileySons, New York, 1991. Эти дополнительные промежуточные соединения образуют еще один аспект изобретения. Таким образом, в дополнительном аспекте изобретения предложено соединение формулы (III)R3 выбран из (3R)-3-(диметиламино)пирролидин-1-ила, (3S)-3-(диметиламино)пирролидин-1-ила, 3(диметиламино)азетидин-1-ила, [2-(диметиламино)этил](метил)амино, 5-метил-2,5-диазаспиро[3.4]окт-2 ила, (3aR,6aR)-5-метилгексагидропирроло[3,4-b]пиррол-1(2H)-ила, 1-метил-1,2,3,6-тетрагидропиридин-4 ила, 4-метилпиперизин-1-ила, 4-[2-(диметиламино)-2-оксоэтил]пиперазин-1-ила, метил[2-(4-метилпиперазин-1-ил)этил]амино, метил[2-(морфолин-4-ил)этил]амино, 1-амино-1,2,3,6-тетрагидропиридин-4-ила и 4-[(2S)-2-(трет-бутоксикарбонил)аминопропаноил]пиперазин-1-ила; или его соль. В одном воплощении данного аспекта изобретения предложено соединение формулы (III), как показано выше, гдеR3 выбран из (3R)-3-(диметиламино)пирролидин-1-ила, (3S)-3-(диметиламино)пирролидин-1-ила; 3(диметиламино)азетидин-1-ила, [2-(диметиламино)этил](метил)амино, 5-метил-2,5-диазаспиро[3.4]окт-2 ила, (3aR,6aR)-5-метилгексагидропирроло[3,4-b]пиррол-1(2H)-ила, 1-метил-1,2,3,6-тетрагидропиридин-4 ила, 4-метилпиперизин-1-ила, 4-[2-(диметиламино)-2-оксоэтил]пиперазин-1-ила, метил[2-(4-метилпиперазин-1-ил)этил]амино, метил[2-(морфолин-4-ил)этил]амино, 1-амино-1,2,3,6-тетрагидропиридин-4-ила и 4-[(2S)-2-(трет-бутоксикарбонил)аминопропаноил]пиперазин-1-ила; или его соль. В дополнительном воплощении данного аспекта изобретения предложено соединение формулыR3 выбран из (3R)-3-(диметиламино)пирролидин-1-ила, (3S)-3-(диметиламино)пирролидин-1-ила, 3(диметиламино)азетидин-1-ила, [2-(диметиламино)этил](метил)амино, [2-(метиламино)этил](метил)амино, 5-метил-2,5-диазаспиро[3.4]окт-2-ила, (3aR,6aR)-5-метилгексагидропирроло[3,4-b]пиррол-1(2H)-ила,1-метил-1,2,3,6-тетрагидропиридин-4-ила, 4-метилпиперизин-1-ила, 4-[2-(диметиламино)-2-оксоэтил]пиперазин-1-ила, метил[2-(4-метилпиперазин-1-ил)этил]амино, метил[2-(морфолин-4-ил)этил]амино, 1 амино-1,2,3,6-тетрагидропиридин-4-ила и 4-[(2S)-2-аминопропаноил]пиперазин-1-ила; или его соль. Один из примеров "N-защитной группы" в радикале "1-(N-защитная группа)индол-3-ил" представляет собой фенилсульфонильную группу. В одном воплощении предложено промежуточное соединение 101 или его соль. Таким образом, в данном случае предложен N'-(2-диметиламиноэтил)-2-метокси-N'-метил-N-[4-(1 метилиндол-3-ил)пиримидин-2-ил]-5-нитробензол-1,4-диамин или его соль. В одном воплощении предложен N'-(2-диметиламиноэтил)-2-метокси-N'-метил-N-[4-(1-метилиндол-3-ил)пиримидин-2-ил]-5-нитробензол-1,4-диамин. В одном воплощении предложено промежуточное соединение 169 или его соль. Таким образом, в данном случае предложен N'-(2-диметиламиноэтил)-N-[4-(1H-индол-3-ил)пиримидин-2-ил]-2-метокси-N'-метил-5-нитробензол-1,4-диамин или его соль. В одном воплощении предложен N'-(2-диметиламиноэтил)-N-[4-(1H-индол-3-ил)пиримидин-2-ил]2-метокси-N'-метил-5-нитробензол-1,4-диамин. В одном воплощении предложено промежуточное соединение 175 или его соль. Таким образом, в данном случае предложен N4-(2-диметиламиноэтил)-2-метокси-N4-метил-N1-[4-(1 метилиндол-3-ил)пиримидин-2-ил]-5-нитробензол-1,4-диамин или его соль.-8 024421 В одном воплощении предложен N4-(2-диметиламиноэтил)-2-метокси-N4-метил-N1-[4-(1-метилиндол-3-ил)пиримидин-2-ил]-5-нитробензол-1,4-диамин. Некоторые соединения формулы (III) имеют группу R3, присоединенную к фенильному кольцу формулы (III) через атом азота группы R3. Эти соединения могут быть получены путем взаимодействия соответствующего амина с подходящим фторсоединением. Такие промежуточные соединения образуют еще один аспект изобретения. Таким образом, в дополнительном аспекте изобретения предложено соединение формулы (IV)R2 представляет собой метокси; или его соль. В одном воплощении данного аспекта изобретения предложено соединение формулы (IV), как показано выше, гдеR2 представляет собой метокси; или его соль. В одном воплощении предложено промежуточное соединение 68 или его соль. Таким образом, в данном случае предложен N-(4-фтор-2-метокси-3-нитрофенил)-4-(1H-индол-3 ил)пиримидин-2-амин или его соль. В одном воплощении предложен N-(4-фтор-2-метокси-5-нитрофенил)-4-(1H-индол-3-ил)пиримидин-2-амин. В одном воплощении предложено промежуточное соединение 129 или его соль. Таким образом, в данном случае предложен N-(4-фтор-2-метокси-5-нитрофенил)-4-(1-метилиндол 3-ил)пиримидин-2-амин или его соль. В одном воплощении предложен N-(4-фтор-2-метокси-5-нитрофенил)-4-(1-метилиндол-3-ил)пиримидин-2-амин. В одном воплощении предложено промежуточное соединение 176 или его соль. Таким образом, в данном случае предложен N-(4-фтор-2-метокси-5-нитрофенил)-4-(1-метилиндол 3-ил)пиримидин-2-амин или его соль. В одном воплощении предложен N-(4-фтор-2-метокси-5-нитрофенил)-4-(1-метилиндол-3-ил)пиримидин-2-амин. Некоторые соединения формулы (III) имеют группу R3, присоединенную к фенильному кольцу формулы (III) через атом азота группы R3. Эти соединения могут быть получены путем взаимодействия соответствующего борорганического соединения (например боратного сложноэфирного соединения) с подходящим арилбромидным или арилхлоридным соединением. Например, борорганическое соединение может представлять собой (4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-R3. Такие промежуточные соединения образуют еще один аспект изобретения. Таким образом, в дополнительном аспекте изобретения предложено соединение формулы (V)X представляет собой бром или хлор; собой метокси; или его соль. В одном воплощении соединения формулы (V) X представляет собой бром. В одном воплощении соединения формулы (V) X представляет собой хлор. В одном воплощении предложено промежуточное соединение 145. Таким образом, в данном случае предложен N-(4-бром-2-метокси-5-нитрофенил)-4-(1-метилиндол 3-ил)пиримидин-2-амин или его соль. В одном воплощении предложен N-(4-бром-2-метокси-5-нитрофенил)-4-(1-метилиндол-3-ил)пиримидин-2-амин. Предпочтительно соединения по настоящему изобретению могут быть получены путем взаимодействия соединения формулы (II) с 3-хлорпропаноилхлоридом в присутствии основания (например, карбоната щелочного металла, например, карбоната калия) в подходящем растворителе, например ацетоне. Таким образом получают промежуточное соединение формулы (VI), которое может быть выделено в виде твердого вещества (в форме его свободного основания или в виде соли), или оно может оставаться в растворе, и обрабатывают основанием (например, гидроксидом щелочного металла, например, NaOH) для превращения соединения формулы (VI) в соответствующее соединение формулы (I). Таким образом,соединения формулы (VI) и его соли являются полезными химическими промежуточными соединениями при образовании соединений формулы (I). Таким образом, в дополнительном аспекте изобретения предложено соединение формулы (VI) или его соль, где G, R1, R2 и R3 являются такими, как определено здесь. В одном воплощении предложено соединение формулы (VI), как показано выше, или его соль, гдеR2 выбран из метокси и метила; иR3 выбран из (3R)-3-(диметиламино)пирролидин-1-ила, (3S)-3-(диметиламино)пирролидин-1-ила, 3(диметиламино)азетидин-1-ила, [2-(диметиламино)этил](метил)амино, [2-(метиламино)этил](метил)амино, 5-метил-2,5-диазаспиро[3.4]окт-2-ила, (3aR,6aR)-5-метилгексагидропирроло[3,4-b]пиррол-1(2H)-ила,1-метил-1,2,3,6-тетрагидропиридин-4-ила, 4-метилпиперизин-1-ила, 4-[2-(диметиламино)-2-оксоэтил]пиперазин-1-ила, метил[2-(4-метилпиперазин-1-ил)этил]амино, метил[2-(морфолин-4-ил)этил]амино, 1 амино-1,2,3,6-тетрагидропиридин-4-ила и 4-[(2S)-2-аминопропаноил]пиперазин-1-ила. В дополнительном воплощении предложено соединение формулы (VI), как показано выше, или его соль, гдеR2 выбран из метокси и метила; иR3 выбран из (3R)-3-(диметиламино)пирролидин-1-ила, (3S)-3-(диметиламино)пирролидин-1-ила, 3(диметиламино)азетидин-1-ила, [2-(диметиламино)этил](метил)амино, 5-метил-2,5-диазаспиро[3.4]окт-2 ила, (3aR,6aR)-5-метилгексагидропирроло[3,4-b]пиррол-1(2H)-ила, 1-метил-1,2,3,6-тетрагидропиридин-4 ила, 4-метилпиперизин-1-ила, 4-[2-(диметиламино)-2-оксоэтил]пиперазин-1-ила, метил[2-(4-метилпиперазин-1-ил)этил]амино, метил[2-(морфолин-4-ил)этил]амино, 1-амино-1,2,3,6-тетрагидропиридин-4-ила и 4-[(2S)-2-аминопропаноил]пиперазин-1-ила. В дополнительном воплощении предложено промежуточное соединение 174 или его соль. Таким образом, в данном случае предложен 3-хлор-N-[2-[2-диметиламиноэтил-(метил)амино]-4 метокси-5-4-(1-метилиндол-3-ил)пиримидин-2-ил]амино]фенил]пропанамид или его соль. В одном воплощении предложен 3-хлор-N-[2-[2-диметиламиноэтил-(метил)амино]-4-метокси-5-4(1-метилиндол-3-ил)пиримидин-2-ил]амино]фенил]пропанамид. Другие промежуточные соединения полезны в получении некоторых соединений формулы (I). Таким образом, например, в одном воплощении предложено промежуточное соединение 170 или его соль. В дополнительном воплощении предложено промежуточное соединение 171 или его соль. В еще одном воплощении предложено промежуточное соединение 172 или его соль. В одном воплощении предложено промежуточное соединение 144 или его соль. Согласно дополнительному аспекту изобретения предложена фармацевтическая композиция, со- 10024421 держащая соединение формулы (I) или его фармацевтически приемлемую соль, как определено выше,вместе с фармацевтически приемлемым разбавителем или носителем. Композиции по изобретению могут быть представлены в форме, подходящей для перорального применения (например, в виде таблеток, лепешек, твердых или мягких капсул, водных или масляных суспензий, эмульсий, диспергируемых порошков или гранул, сиропов или эликсиров), для местного применения (например, в виде кремов, мазей, гелей или водных или масляных растворов или суспензий),для введения путем ингаляции (например, в виде тонкоизмельченного порошка или жидкого аэрозоля),для введения путем инсуффляции (например, в виде тонкоизмельченного порошка) или для парентерального введения (например, в виде стерильного водного или масляного раствора для внутривенного,подкожного, внутримышечного или внутримышечного дозирования или в виде суппозитория для ректального дозирования). Композиции по изобретению могут быть получены путем традиционных методик с использованием общепринятых фармацевтических эксципиентов, хорошо известных в данной области техники. Таким образом, композиции, предназначенные для перорального применения, могут содержать, например, один или более красителей, подсластителей, корригентов и/или консервантов. Соединение формулы (I) обычно вводят теплокровному животному в единичной дозе в диапазоне 5-5000 мг/м 2 площади тела животного, то есть приблизительно 0,1-100 мг/кг, и это обычно обеспечивает терапевтически эффективную дозу. Стандартная лекарственная форма, такая как таблетка или капсула,обычно содержит, например, 1-250 мг активного ингредиента. Суточная доза по необходимости варьирует в зависимости от организма, подлежащего лечению, конкретного пути введения и тяжести заболевания, которое лечат. Соответственно, врач, который занимается лечением конкретного пациента, может определить оптимальную дозировку. В контексте настоящего описания термин "терапия" также включает "профилактику", если нет конкретных указаний на противоположное. Термины "терапевтический" и "терапевтически" следует интерпретировать соответственно. Термин "лечение", как он использован здесь, имеет обычное повседневное значение при борьбе с заболеванием с целью полного или частичного облегчения от его некоторых или всех симптомов либо коррекции или компенсирования патологии, лежащей в его основе. Термин "профилактика", как он использован здесь, имеет обычное повседневное значение и включает первичную профилактику развития заболевания и вторичную профилактику, при которой, если заболевание уже развилось, пациент временно или постоянно защищен от обострения или ухудшения заболевания или развития новых симптомов, ассоциированных с этим заболеванием. Как результат его ингибирующей активности против L858R EGFR мутанта, T790M EGFR мутанта и активирующего мутанта с делецией в экзоне 19, соединение формулы (I) и его фармацевтически приемлемые соли, как ожидают, будут полезны в лечении заболеваний или медицинских состояний, опосредованных исключительно или отчасти EGFR мутантной активностью, например, рака. Виды рака, которые могут поддаваться лечению с использованием соединения формулы (I) или его фармацевтически приемлемых солей, включают рак яичника, рак шейки матки, колоректальный рак, рак груди, рак поджелудочной железы, глиому, глиобластому, меланому, рак предстательной железы, лейкоз, лимфому, неходжкинскую лимфому, рак желудка, рак легкого, гепатоцеллюлярный рак, рак желудка, стромальную опухоль желудочно-кишечного тракта (GIST), рак щитовидной железы, рак желчных протоков, рак эндометрия, рак почки, анапластическую крупноклеточную лимфому, острый миелоидный лейкоз (AML), множественную миелому, меланому и мезотелиому, но не ограничены ими. Предусмотрено, что в способах лечения рака, упомянутого здесь, соединение формулы (I) будут вводить млекопитающему, более конкретно, представляющему собой человека. Аналогично, в случае применения Соединения формулы (I) для лечения рака, упомянутого здесь, предусмотрено, что соединение формулы (I) будут вводить млекопитающему, более конкретно, представляющему собой человека. Согласно другому аспекту изобретения предложено соединение формулы (I), как оно определено здесь, или его фармацевтически приемлемая соль для применения в качестве лекарственного средства. Согласно дополнительному аспекту изобретения предложено соединение формулы (I), как оно определено здесь, или его фармацевтически приемлемая соль для применения в лечении заболевания, опосредованного через L858R EGFR мутант и/или T790M EGFR и/или активирующий мутант с делецией в экзоне 19. В одном воплощении изобретения указанное заболевание, опосредованное через L858R EGFR мутант и/или T790M EGFR и/или активирующий мутант с делецией в экзоне 19, представляет собой рак. Согласно дополнительному аспекту изобретения предложено применение соединения формулы (I),как оно определено здесь, или его фармацевтически приемлемой соли для изготовления лекарственного средства для лечения заболевания, опосредованного через L858R EGFR мутант и/или T790M EGFR и/или активирующий мутант с делецией в экзоне 19. В одном воплощении изобретения указанное заболевание,опосредованное через L858R EGFR мутант и/или T790M EGFR и/или активирующий мутант с делецией в экзоне 19, представляет собой рак. Согласно дополнительному аспекту изобретения предложено применение соединения формулы (I),как оно определено здесь, или его фармацевтически приемлемой соли для изготовления лекарственного средства для лечения рака. Согласно дополнительному аспекту изобретения предложен способ использования соединения формулы (I), как оно определено здесь, или его фармацевтически приемлемой соли для лечения рака. Согласно этому аспекту изобретения предложен способ продуцирования противоракового эффекта у теплокровного животного, такого как человек, нуждающегося в таком лечении, включающий введение указанному животному эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли, как определено здесь. Согласно дополнительному аспекту изобретения предложен способ лечения человека, страдающего заболеванием, при котором благоприятно ингибирование L858R EGFR мутанта и/или T790M EGFR мутанта и/или активирующего мутанта с делецией в экзоне 19, включающий стадии введения субъекту,нуждающемуся в этом, терапевтически эффективного количества соединения формулы (I), как оно определено выше, или его фармацевтически приемлемой соли. В одном воплощении изобретения заболевание, при котором благоприятно ингибирование L858R EGFR мутанта и/или T790M EGFR мутанта и/или активирующего мутанта с делецией в экзоне 19, представляет собой рак. В любом из аспектов или воплощений, упомянутых в данном описании, где рак упоминается в общем смысле, указанный рак может быть выбран из рака яичника, рака шейки матки, колоректального рака, рака груди, рака поджелудочной железы, глиомы, глиобластомы, меланомы, рака предстательной железы, лейкоза, лимфомы, неходжкинской лимфомы, рака желудка, рака легкого, гепатоцеллюлярного рака, рака желудка, стромальной опухоли желудочно-кишечного тракта (GIST), рака щитовидной железы, рака желчных протоков, рака эндометрия, рака почки, анапластической крупноклеточной лимфомы,острого миелоидного лейкоза (AML), множественной миеломы, меланомы и мезотелиомы. В любом из аспектов или воплощений изобретения, где рак упоминается в общем смысле, могут быть применимы следующие воплощения. В одном воплощении рак представляет собой рак яичника. В одном воплощении рак представляет собой рак шейки матки. В одном воплощении рак представляет собой колоректальный рак. В одном воплощении рак представляет собой рак груди. В одном воплощении рак представляет собой рак поджелудочной железы. В одном воплощении рак представляет собой глиому. В одном воплощении рак представляет собой глиобластому. В одном воплощении рак представляет собой меланому. В одном воплощении рак представляет собой рак предстательной железы. В одном воплощении рак представляет собой лейкоз. В одном воплощении рак представляет собой лимфому. В одном воплощении рак представляет собой неходжкинскую лимфому. В одном воплощении рак представляет собой рак желудка. В одном воплощении рак представляет собой рак легкого. В одном воплощении рак представляет собой немелкоклеточный рак легкого. В одном воплощении рак представляет собой гепатоцеллюлярный рак. В одном воплощении рак представляет собой желудочный рак. В одном воплощении рак представляет собой стромальную опухоль желудочно-кишечного тракта(GIST). В одном воплощении рак представляет собой рак щитовидной железы. В одном воплощении рак представляет собой рак желчных протоков. В одном воплощении рак представляет собой рак эндометрия. В одном воплощении рак представляет собой рак почки. В одном воплощении рак представляет собой анапластическую крупноклеточную лимфому. В одном воплощении рак представляет собой острый миелоидный лейкоз (AML). В одном воплощении рак представляет собой множественную миелому. В одном воплощении рак представляет собой меланому. В одном воплощении рак представляет собой мезотелиому. Противораковое лечение, описанное выше, можно применять в качестве единственной терапии, либо оно может включать, в дополнение к соединению по изобретению, традиционное хирургическое вмешательство, или радиотерапию, или химиотерапию, или иммунотерапию. Такая химиотерапия может быть введена параллельно, одновременно, последовательно или раздельно с лечением соединением по изобретению и может включать один или более агентов из следующих категорий противоопухолевых агентов:(1) антипролиферативные/противоопухолевые лекарственные средства и их комбинации, применяемые в медицинской онкологии, такие как алкилирующие агенты (например, цис-платина, оксалиплатин, карбоплатин, циклофосфамид, хлорметин, мелфалан, хлорамбуцил, бусульфан, темозоламид и нитрозомочевины); антиметаболиты (например, гемцитабин и антифолаты, такие как фторпиримидины типа 5-фторурацила и тегафура, ралтитрексед, метотрексат, цитозинарабинозид и гидроксимочевина); проти- 12024421 воопухолевые антибиотики (например, антрациклины типа адриамицина, блеомицина, доксорубицина,дауномицина, эпирубицина, идарубицина, митомицина-С, дактиномицина и митрамицина); антимитотические агенты (например, винкаалкалоиды типа винкристина, винбластина, виндезина и винорелбина и таксоиды типа таксола и таксотера и ингибиторы полокиназы); и ингибиторы топоизомеразы (например,эпиподофиллотоксины типа этопозида и тенипозида, амсакрина, топотекана и камптотецина);(2) цитостатические агенты, такие как антиэстрогены (например тамоксифен, фулвестрант, торемифен, ралоксифен, дролоксифен и йодоксифен), антиандрогены (например бикалутамид, флутамид, нилутамид и кипротерона ацетат), антагонисты рилизинг-фактора лютеинизирующего гормона (LHRH) или агонисты LHRH (например гозерелин, лейпрорелин и бусерелин), прогестогены (например мегестрола ацетат), ингибиторы ароматазы (например анастрозол, летрозол, воразол и эксеместан) и ингибиторы 5 редуктазы, такие как финастерид;[AZD0530 (саракатиниб); WO 01/94341], N-(2-хлор-6-метилфенил)-2-6-[4-(2-гидроксиэтил)пиперазин-1 ил]-2-метилпиримидин-4-иламинотиазол-5-карбоксамида (дасатиниб, BMS-354825; J. Med. Chem., 2004,47, 6658-6661) и босутиниб (SKI-606), и ингибиторы металлопротеиназы типа маримастата, ингибиторы функции урокиназных рецепторов активаторов плазминогена или антитела к гепараназе);(4) ингибиторы функции фактора роста: например, такие ингибиторы включают антитела к факторам роста и антитела к рецепторам фактора роста (например, анти-erbB2 антитело трастузумаб [Herceptin], анти-EGFR антитело панитумумаб, анти-erbB1 антитело цетуксимаб [Erbitux, C225] и любые антитела к факторам роста и рецепторам фактора роста, раскрытые Stern et al. Critical reviews in oncology/haematology, 2005, Vol. 54, p. 11-29); такие ингибиторы также включают ингибиторы тирозинкиназы,например ингибиторы семейства эпидермального фактора роста (например, ингибиторы тирозинкиназы семейства EGFR, такие как N-(3-хлор-4-фторфенил)-7-метокси-6-(3-морфолинопропокси)хиназолин-4 амин(гефитиниб, ZD1839), N-(3-этинилфенил)-6,7-бис-(2-метоксиэтокси)хиназолин-4-амин(эрлотиниб,OSI-774) и 6-акриламидо-N-(3-хлор-4-фторфенил)-7-(3-морфолинопропокси)хиназолин-4-амин (CI 1033),ингибиторы erbB2 тирозинкиназы, такие как лапатиниб); ингибиторы семейства факторов роста гепатоцитов; ингибиторы инсулинового семейства факторов роста; ингибиторы семейства тромбоцитарных факторов роста, такие как иматиниб и/или нилотиниб (AMN107); ингибиторы серин/треонинкиназ (например, ингибиторы передачи сигнала Ras/Raf, такие как ингибиторы фарнезилтрансферазы, например сорафениб (BAY 43-9006), типифарниб (R115777) и лонафарниб (SCH66336, ингибиторы передачи сигнала через MEK- и/или AKT-киназы, ингибиторы c-kit, ингибиторы abl-киназы, ингибиторы PI3 киназы, ингибиторы Plt3-киназы, ингибиторы CSF-1R-киназы, ингибиторы IGF рецепторной (инсулиноподобный фактор роста) киназы; ингибиторы aurora-киназы (например AZD1152, РН 739358, VX-680,MLN8054, R763, МР 235, МР 529, VX-528 и АХ 39459) и ингибиторы циклинзависимой киназы, такие как(5) антиангиогенные агенты, такие как агенты, которые ингибируют эффекты сосудистого эндотелиального фактора роста [например, антитело против сосудистого эндотелиального фактора роста бевацизумаб [Avastin] и, например, ингибитор тирозинкиназы VEGF-рецептора, такие как вандетаниб(AZD2171; пример 240 в заявке WO 00/47212), соединения, такие как соединения, раскрытые в публикациях международных заявок WO 97/22596, WO 97/30035, WO 97/32856 и WO 98/13354), и соединения с другими механизмами действия (например, линомид, ингибиторы функции avp3 интегрина и ангиостатин);(6) сосудоповреждающие агенты, такие как комбретастатин A4 и соединения, раскрытые в публикациях международных заявок WO 99/02166, WO 00/40529, WO 00/41669, WO 01/92224, WO 02/04434 и(8) антисмысловые терапии, например такие, которые направлены на мишени, перечисленные выше, такие как ISIS 2503, антисмысловая anti-ras;(9) подходы генной терапии, включая, например, подходы для замещения аберрантных генов, таких как аберрантный p53, или аберрантный BRCA1 или BRCA2, подходы GDEPT (ген-направленная фермент-пролекарственная терапия), такие как подходы, использующие цитозиндеаминазу, тимидинкиназу или бактериальный фермент нитроредуктазу, и подходы увеличения толерантности пациента к химиотерапии или радиотерапии, такие как генная терапия множественной лекарственной устойчивости; и(10) иммуннотерапевтические подходы, включая, например, ex-vivo и in-vivo подходы для увеличения иммуногенности опухолевых клеток пациента, такие как трансфекция цитокинами, такими как интерлейкин 2, интерлейкин 4 или гранулоцитарно-макрофагеальный колониестимулирующий фактор,подходы для уменьшения анергии Т-клеток, подходы, использующие трансфицированные иммунные клетки, такие как цитокин-трансфицированные дендритные клетки, подходы, использующие цитокинтрансфицированные опухолевые клеточные линии, подходы, использующие анти-идиотипические анти- 13024421 тела, подходы к снижению функции иммуносупрессивных клеток, таких как регуляторные Т-клетки, миелоидные супрессорные клетки или EDO (индоламин-2,3,-дезоксигеназа)-экспрессирующие дендритные клетки, и подходы, использующие вакцины против рака, состоящие из белков или пептидов, имеющих происхождение из опухолеассоциированных антигенов, таких как NY-ESO-1, MAGE-3, WT1 илиHer2/neu. Таким образом, в дополнительном аспекте изобретения предложен фармацевтический продукт, содержащий соединение формулы (I), как определено выше, и дополнительное противоопухолевое вещество, как определено выше, для совместного лечения рака. В таком аспекте изобретения предложен фармацевтический продукт, содержащий соединение формулы (I) или его фармацевтически приемлемую соль, как определено выше, и дополнительное противоопухолевое вещество, как определено выше, для совместного лечения рака. В данном описании, когда термин "совместное лечение" используют со ссылкой на комбинированное лечение, следует понимать, что это может относиться к одновременному, раздельному или последовательному введению. Ссылки на "совместное введение" следует интерпретировать аналогичным образом. В одном аспекте изобретения "совместное лечение" относится к одновременному введению. В другом аспекте изобретения "совместное лечение" относится к раздельному введению. В еще одном аспекте изобретения "совместное лечение" относится к последовательному введению. Когда введение является последовательным или раздельным, время выдержки перед введением второго компонента не должно быть таким, чтобы утрачивалось преимущество эффекта, возникающее в результате применения комбинации. Таким образом, в одном воплощении последовательное введение включает введение каждого компонента комбинации в течение периода 11 суток. В другом воплощении этот период составляет 10 суток. В еще одном воплощении этот период составляет 9 суток. В еще одном воплощении этот период составляет 8 суток. В еще одном воплощении этот период составляет 7 суток. В еще одном воплощении этот период составляет 6 суток. В еще одном воплощении этот период составляет 5 суток. В еще одном воплощении этот период составляет 4 суток. В еще одном воплощении этот период составляет 3 суток. В еще одном воплощении этот период составляет 2 суток. В еще одном воплощении этот период составляет 24 ч. В еще одном воплощении этот период составляет 12 ч. Таким образом, в одном воплощении изобретения предложено применение соединения формулы (I) или его фармацевтически приемлемой соли, как определено в данном описании, и дополнительного противоопухолевого вещества для совместного лечения рака. В одном воплощении изобретения предложено применение соединения формулы (I) или его фармацевтически приемлемой соли, как определено в данном описании, и дополнительного противоопухолевого вещества для одновременного, раздельного или последовательного лечения рака. В одном воплощении предложен способ продуцирования противоракового эффекта у теплокровного животного, такого как человек, который нуждается в таком лечении, включающий введение указанному животному соединения формулы (I) или его фармацевтически приемлемой соли и совместное введение дополнительного противоопухолевого вещества указанному животному, где количества соединения формулы (I) или его фармацевтически приемлемой соли и дополнительного противоопухолевого вещества являются в совокупности эффективными в продуцировании противоракового эффекта. В одном воплощении предложен способ продуцирования противоракового эффекта у теплокровного животного, такого как человек, который нуждается в таком лечении, включающий введение указанному животному соединения формулы (I) или его фармацевтически приемлемой соли и одновременное,раздельное или последовательное введение дополнительного противоопухолевого вещества указанному животному, где количества соединения формулы (I) или его фармацевтически приемлемой соли и дополнительного противоопухолевого вещества являются в совокупности эффективными в продуцировании противоракового эффекта. При изготовлении лекарственных композиций важной для лекарственного вещества является форма, в которой оно может быть удобным образом обработано и переработано. Это является важным не только с точки зрения проведения промышленно приемлемого способа производства, но и с точки зрения последующего производства фармацевтических препаратов (например пероральных лекарственных форм, таких как таблетки), содержащих активное соединение. Различные физические свойства кристаллических форм относительно друг друга и относительно некристаллического состояния могут оказывать значительное влияние на химическую и фармацевтическую обработку соединения, особенно когда соединение готовят или используют в промышленном масштабе. Кроме того, в изготовлении пероральных лекарственных композиций важно, чтобы достоверный и воспроизводимый профиль концентрации лекарства в плазме достигался после введения пациенту. Вариабельность профиля абсорбции лекарства у разных пациентов в желудке, кишечнике или кровотоке может влиять на безопасность и эффективность лекарства. Химическая стабильность, стабильность в твердом состоянии и "срок годности" активных ингредиентов также являются очень важными факторами. Лекарственное вещество и содержащие его композиции должны быть способны сохранять эффективность в течение приемлемых периодов времени без су- 14024421 щественного изменения физико-химических характеристик активного компонента (например, его химического состава, плотности, гигроскопичности и растворимости). Более того, важным является способность предложить лекарственное средство в форме, которая является как можно более химически чистой. Аморфные материалы могут представлять проблемы в этом отношении. Например, такие материалы, как правило, сложны в обработке и изготовлении, проявляют недостоверную растворимость и, как часто обнаруживают, являются нестабильными и химически загрязненными. Специалисту в данной области понятно, что если лекарственное средство может быть легко получено в стабильной кристаллической форме, вышеупомянутые проблемы могут быть решены. Таким образом, в изготовлении промышленно пригодных и фармацевтически приемлемых лекарственных композиций, важно предложить, там где это возможно, лекарственное средство в кристаллической и стабильной форме. Следует отметить, однако, что эта цель не всегда достижима. Действительно, обычно невозможно предсказать, исходя только лишь из молекулярной структуры, каким будет поведение соединения при кристаллизации, ни самого по себе, ни в форме соли. Это может быть определено только эмпирически. В дополнительном аспекте изобретения некоторые соединения и их соли могут быть получены в кристаллических формах. Эти кристаллические формы могут быть охарактеризованы как конкретные полиморфные формы. Когда говорят, что настоящее изобретение относится к кристаллической форме,степень кристалличности составляет предпочтительно более чем примерно 60%, более предпочтительно более чем примерно 80%, предпочтительно более чем примерно 90% и более предпочтительно более чем примерно 95%. Наиболее предпочтительно степень кристалличности составляет более чем примерно 98%. Конкретные твердые формы, описанные здесь, проявляют картины дифракции рентгеновских лучей на порошке по существу такие же, как картины дифракции рентгеновских лучей на порошке, показанные на фигурах, и имеют индивидуальные значения 2-тета, как показано в таблицах, включенных в данное описание. Следует понимать, что значения 2-тета картины дифракции рентгеновских лучей на порошке могут слегка варьировать в зависимости от оборудования или в зависимости от образца, и такие записанные значения не следует интерпретировать как абсолютные. Известно, что может быть получена картина дифракции рентгеновских лучей на порошке, имеющая одну или более ошибок измерения в зависимости от условий измерения (таких как используемое оборудование или аппаратура). Например, в целом известно, что интенсивности в картине дифракции рентгеновских лучей на порошке могут отклоняться в зависимости от условий измерения. Таким образом, следует понимать, что твердые формы по настоящему изобретению не ограничены кристаллами, которые дают картины дифракции рентгеновских лучей на порошке, идентичные картинам дифракции рентгеновских лучей на порошке, показанным на фигурах, и любые кристаллы, дающие картины дифракции рентгеновских лучей на порошке по существу такие же, как те, которые показаны на фигурах, входят в объем настоящего изобретения. Специалист в области рентгеновской порошковой дифракции способен оценить сходство по существу картин дифракции рентгеновских лучей на порошке. Специалисты в области рентгеновской порошковой дифракции понимают, что на относительную интенсивность пиков могут влиять, например, размер зерен выше 30 мкм, а также неунитарные соотношения, которые могут влиять на анализ образцов. Специалисты также понимают, что на позицию отражений может влиять точная высота, на которую образец устанавливают в дифрактометр, а также калибровка нуля дифрактометра. Плоскостность поверхности образца также может оказывать небольшое влияние. Поэтому представляемые данные картин дифракции не следует воспринимать как абсолютные значения (Jenkins, RSnyder, R.L. Introduction to X-Ray Powder Diffractometry John WileySons 1996;Bunn, C.W. (1948), Chemical Crystallography, Clarendon Press, London; Klug, H.P.Alexander, L.E. (1974),X-Ray Diffraction Procedures). В общем, ошибка измерений угла дифракции в рентгеновской порошковой дифрактограмме равна приблизительно плюс или минус 0,2 2-тета, и такую степень ошибки измерений следует принимать во внимание при рассмотрении картин дифракции рентгеновских лучей на порошке на фигурах, а также при прочтении данных, содержащихся в таблицах, включенных в данное описание. Более того, следует понимать, что интенсивности могут отклоняться в зависимости от экспериментальных условий и приготовления образца (предпочтительная ориентация). В данном описании N-(2-2-диметиламиноэтилметиламино-4-метокси-5-[4-(1-метилиндол-3 ил)пиримидин-2-ил]аминофенил)проп-2-енамид обозначен как "соединение X". Было обнаружено, что исходно образуемое соединение X является аморфным твердым веществом. Несколько полезных кристаллических полиморфных форм в результате были получены с использованием условий, описанных здесь в экспериментальном разделе. Во всех воплощениях, относящихся к твердым формам, описанным здесь, пики на картинах дифракции рентгеновских лучей на порошке измерены с использованием CuK излучения. Полиморфная форма A соединения X Таким образом, в дополнительном аспекте изобретения предложена полиморфная форма A соединения X. Эта полиморфная форма может быть охарактеризована тем, что дает по меньшей мере одно из следующих значений 29, измеренных с использованием CuK излучения: 7,8 и 21,8. Полиморфная форма А соединения X характеризуется картиной дифракции рентгеновских лучей на порошке, по существу, как показано на фиг. 1. Десять пиков дифракции рентгеновских лучей на порошке для этой полиморфной формы [угол 2 тета (2), интенсивность (%)] представляют собой 7,8 (100%), 21,8 (73,4%), 13,3 (59,4%), 6,6 (49,5%), 23,9(40,5%), 9,6 (38,1%), 14,5 (35,3%), 15,6 (33,2%), 22,7 (31,2%) и 19,1 (29,8%). Согласно настоящему изобретению предложена полиморфная форма A соединения X, которая имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с одним характеристическим пиком при значении 2-тета, примерно равном 7,8. Согласно настоящему изобретению предложена полиморфная форма A соединения X, которая имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с одним характеристическим пиком при значении 2-тета, примерно равном 21,8. Согласно настоящему изобретению предложена полиморфная форма A соединения X, которая имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с двумя характеристическими пиками при значениях 2-тета, примерно равных 7,8 и 21,8. Согласно настоящему изобретению предложена полиморфная форма A соединения X, которая имеет картину дифракции рентгеновских лучей на порошке с характеристическими пиками при значениях 2 тета, примерно равных 7,8, 21,8, 13,3, 6,6, 23,9, 9,6, 14,5, 15,6, 22,7 и 19,1. Согласно настоящему изобретению предложена полиморфная форма A соединения X, которая имеет картину дифракции рентгеновских лучей на порошке, по существу, такую же, как картина дифракции рентгеновских лучей на порошке, показанная на фиг. 1. Согласно настоящему изобретению предложена полиморфная форма A соединения X, которая имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с одним характеристическим пиком при значении 2-тета, равном 7,8 плюс или минус 0,2 2-тета. Согласно настоящему изобретению предложена полиморфная форма A соединения X, которая имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с одним характеристическим пиком при значении 2-тета, равном 21,8 плюс или минус 0,2 2-тета. Согласно настоящему изобретению предложена полиморфная форма A соединения X, которая имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с двумя характеристическими пиками при значениях 2-тета, равных 7,8 и 21,8, где указанные значения могут отличаться на плюс или минус 0,2 2-тета. Согласно настоящему изобретению предложена полиморфная форма A соединения X, которая имеет картину дифракции рентгеновских лучей на порошке с характеристическими пиками при значениях 2 тета, равных 7,8, 21,8, 13,3, 6,6, 23,9, 9,6, 14,5, 15,6, 22,7 и 19,1, где указанные значения могут отличаться на плюс или минус 0,2 2-тета. Полиморфная форма B соединения X В дополнительном аспекте изобретения предложена полиморфная форма B соединения X. Эта полиморфная форма может быть охарактеризована тем, что дает по меньшей мере одно из следующих значений 29, измеренных с использованием CuK излучения: 9,3 и 23,4. Полиморфная форма В соединения X характеризуется картиной дифракции рентгеновских лучей на порошке, по существу, как показано на фиг. 3. Десять пиков дифракции рентгеновских лучей на порошке для этой полиморфной формы [угол 2 тета (2), интенсивность (%)] представляют собой 9,3 (100%), 23,4 (75,0%), 10,5 (63,6%), 17,7 (54,3%),21,0 (48,1%), 16,1 (46,4%), 26,1 (44,2%), 18,6 (41,8%), 26,7 (32,2%) и 20,6 (30,9%). Согласно настоящему изобретению предложена полиморфная форма B соединения X, которая имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с одним характеристическим пиком при значении 2-тета, примерно равном 9,3. Согласно настоящему изобретению предложена полиморфная форма B соединения X, которая имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с одним характеристическим пиком при значении 2-тета, примерно равном 23,4. Согласно настоящему изобретению предложена полиморфная форма B соединения X, которая имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с двумя характеристическими пиками при значениях 2-тета, примерно равных 9,3 и 23,4. Согласно настоящему изобретению предложена полиморфная форма B соединения X, которая имеет картину дифракции рентгеновских лучей на порошке с характеристическими пиками при значениях 2 тета, примерно равных 9,3, 23,4, 10,5, 17,7, 21,0, 16,1, 26,1, 18,6, 26,7 и 20,6. Согласно настоящему изобретению предложена полиморфная форма B соединения X, которая имеет картину дифракции рентгеновских лучей на порошке, по существу, такую же, как картина дифракции рентгеновских лучей на порошке, показанная на фиг. 3. Согласно настоящему изобретению предложена полиморфная форма B соединения X, которая имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с одним характеристическим пиком при значении 2-тета, равном 9,3 плюс или минус 0,2 2-тета. Согласно настоящему изобретению предложена полиморфная форма B соединения X, которая имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с одним характеристическим пиком при значении 2-тета, равном 23,4 плюс или минус 0,2 2-тета. Согласно настоящему изобретению предложена полиморфная форма B соединения X, которая имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с двумя характеристическими пиками при значениях 2-тета, равных 9,3 и 23,4, где указанные значения могут отличаться на плюс или минус 0,2 2-тета. Согласно настоящему изобретению предложена полиморфная форма B соединения X, которая имеет картину дифракции рентгеновских лучей на порошке с характеристическими пиками при значениях 2 тета, равных 9,3, 23,4, 10,5, 17,7, 21,0, 16,1, 26,1, 18,6, 26,7 и 20,6, где указанные значения могут отличаться на плюс или минус 0,2 2-тета. Полиморфная форма C соединения X В дополнительном аспекте изобретения предложена полиморфная форма C соединения X. Эта полиморфная форма может быть охарактеризована тем, что дает по меньшей мере одно из следующих значений 2, измеренных с использованием CuK излучения: 6,0 и 11,3. Полиморфная форма C соединения X характеризуется картиной дифракции рентгеновских лучей на порошке, по существу, как показано на фиг. 5. Десять пиков дифракции рентгеновских лучей на порошке для этой полиморфной формы [угол 2 тета (2), интенсивность (%)] представляют собой 6,0 (100%), 11,3 (58,2%), 7,5 (40,5%), 10,3 (21,9%), 12,0(20,1%), 24,9 (19,4%), 13,0 (16,9%), 14,5 (13,5%), 16,5 (13,5%) и 18,3 (11,8%). Согласно настоящему изобретению предложена полиморфная форма C соединения X, которая имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с одним характеристическим пиком при значении 2-тета, примерно равном 6,0. Согласно настоящему изобретению предложена полиморфная форма C соединения X, которая имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с одним характеристическим пиком при значении 2-тета, примерно равном 11,3. Согласно настоящему изобретению предложена полиморфная форма C соединения X, которая имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с двумя характеристическими пиками при значениях 2-тета, примерно равных 6,0 и 11,3. Согласно настоящему изобретению предложена полиморфная форма C Соединения X, которая имеет картину дифракции рентгеновских лучей на порошке с характеристическими пиками при значениях 2 тета, примерно равных 6,0, 11,3, 7,5, 10,3, 12,0, 24,9, 13,0, 14,5, 16,5 и 18,3. Согласно настоящему изобретению предложена полиморфная форма C соединения X, которая имеет картину дифракции рентгеновских лучей на порошке, по существу, такую же, как картина дифракции рентгеновских лучей на порошке, показанная на фиг. 5. Согласно настоящему изобретению предложена полиморфная форма C Соединения X, которая имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с одним характеристическим пиком при значении 2-тета, равном 6,0 плюс или минус 0,2 2-тета. Согласно настоящему изобретению предложена полиморфная форма C Соединения X, которая имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с одним характеристическим пиком при значении 2-тета, равном 11,3 плюс или минус 0,2 2-тета. Согласно настоящему изобретению предложена полиморфная форма C Соединения X, которая имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с двумя характеристическими пиками при значениях 2-тета, равных 6,0 и 11,3, где указанные значения могут отличаться на плюс или минус 0,2 2-тета. Согласно настоящему изобретению предложена полиморфная форма C Соединения X, которая имеет картину дифракции рентгеновских лучей на порошке с характеристическими пиками при значениях 2 тета равных 6,0, 11,3, 7,5, 10,3, 12,0, 24,9, 13,0, 14,5, 16,5 и 18,3, где указанные значения могут отличаться на плюс или минус 0,2 2-тета. Полиморфная форма D соединения X В дополнительном аспекте изобретения предложена полиморфная форма D соединения X, которая,как полагают, является моногидратной кристаллической формой. Эта полиморфная форма может быть охарактеризована тем, что дает по меньшей мере одно из следующих значений 2, измеренных с использованием CuK излучения: 9,3 и 10,5. Полиморфная форма D соединения X характеризуется картиной дифракции рентгеновских лучей на порошке, по существу, как показано на фиг. 7. Десять пиков дифракции рентгеновских лучей на порошке для этой полиморфной формы [угол 2- 17024421 тета (2), интенсивность (%)] представляют собой 9,3 (100%), 10,5 (90,6%), 16,1 (75,8%), 26,1 (75,2%),21,0 (70,9%), 20,6 (56,9%), 16,8 (56,5%), 17,7 (53,3%), 14,7 (41,3%) и 9,7 (38,3%). Согласно настоящему изобретению предложена полиморфная форма D соединения X, которая имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с одним характеристическим пиком при значении 2-тета, примерно равном 9,3. Согласно настоящему изобретению предложена полиморфная форма D соединения X, которая имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с одним характеристическим пиком при значении 2-тета, примерно равном 10,5. Согласно настоящему изобретению предложена полиморфная форма D соединения X, которая имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с двумя характеристическими пиками при значениях 2-тета, примерно равных 9,3 и 10,5. Согласно настоящему изобретению предложена полиморфная форма D соединения X, которая имеет картину дифракции рентгеновских лучей на порошке с характеристическими пиками при значениях 2 тета, примерно равных 9,3, 10,5, 16,1, 26,1, 21,0, 20,6, 16,8, 17,7, 14,7 и 9,7. Согласно настоящему изобретению предложена полиморфная форма D соединения X, которая имеет картину дифракции рентгеновских лучей на порошке, по существу, такую же, как картина дифракции рентгеновских лучей на порошке, показанная на фиг. 7. Согласно настоящему изобретению предложена полиморфная форма D соединения X, которая имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с одним характеристическим пиком при значении 2-тета, равном 9,3 плюс или минус 0,2 2-тета. Согласно настоящему изобретению предложена полиморфная форма D соединения X, которая имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с одним характеристическим пиком при значении 2-тета, равном 10,5 плюс или минус 0,2 2-тета. Согласно настоящему изобретению предложена полиморфная форма D соединения X, которая имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с двумя характеристическими пиками при значениях 2-тета, равных 9,3 и 10,5, где указанные значения могут отличаться на плюс или минус 0,2 2-тета. Согласно настоящему изобретению предложена полиморфная форма D соединения X, которая имеет картину дифракции рентгеновских лучей на порошке с характеристическими пиками при значениях 2 тета, равных 9,3, 10,5, 16,1, 26,1, 21,0, 20,6, 16,8, 17,7, 14,7 и 9,7, где указанные значения могут отличаться на плюс или минус 0,2 2-тета. Полиморфная форма E соединения X В дополнительном аспекте изобретения предложена полиморфная форма E соединения X, которая,как полагают, является кристаллической 1,25-стехиометрически гидратной формой соединения X. Эта полиморфная форма может быть охарактеризована тем, что дает по меньшей мере одно из следующих значений 2, измеренных с использованием CuK излучения: 9,2 и 22,9. Полиморфная форма E соединения X характеризуется картиной дифракции рентгеновских лучей на порошке, по существу, как показано на фиг. 10. Десять пиков дифракции рентгеновских лучей на порошке для этой полиморфной формы [угол 2 тета (2), интенсивность (%)] представляют собой: 9,2 (100%), 22,9 (84,0%), 14,6 (80,3%), 12,7 (77,8%),16,5 (66,4%), 26,9 (60,3%), 9,7 (95,6%), 14,0 (52,3%), 10,4 (49,9%) и 19,5 (48,3%). Согласно настоящему изобретению предложена полиморфная форма E соединения X, которая имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с одним характеристическим пиком при значении 2-тета, примерно равном 9,2. Согласно настоящему изобретению предложена полиморфная форма E соединения X, которая имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с одним характеристическим пиком при значении 2-тета, примерно равном 22,9. Согласно настоящему изобретению предложена полиморфная форма E соединения X, которая имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с двумя характеристическими пиками при значениях 2-тета, примерно равных 9,2 и 22,9. Согласно настоящему изобретению предложена полиморфная форма E соединения X, которая имеет картину дифракции рентгеновских лучей на порошке с характеристическими пиками при значениях 2 тета, примерно равных 9,2, 22,9, 14,6, 12,7, 16,5, 26,9, 9,7, 14,0, 10,4 и 19,5. Согласно настоящему изобретению предложена полиморфная форма E соединения X, которая имеет картину дифракции рентгеновских лучей на порошке, по существу, такую же, как картина дифракции рентгеновских лучей на порошке, показанная на фиг. 10. Согласно настоящему изобретению предложена полиморфная форма E соединения X, которая имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с одним характеристическим пиком при значении 2-тета, равном 9,2 плюс или минус 0,2 2-тета. Согласно настоящему изобретению предложена полиморфная форма E соединения X, которая имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с одним характеристическим пиком при значении 2-тета, равном 22,9 плюс или минус 0,2 2-тета. Согласно настоящему изобретению предложена полиморфная форма E соединения X, которая имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с двумя характеристическими пиками при значениях 2-тета, равных 9,2 и 22,9, где указанные значения могут отличаться на плюс или минус 0,2 2-тета. Согласно настоящему изобретению предложена полиморфная форма E соединения X, которая имеет картину дифракции рентгеновских лучей на порошке с характеристическими пиками при значениях 2 тета, равных 9,2, 22,9, 14,6, 12,7, 16,5, 26,9, 9,7, 14,0, 10,4 и 19,5, где указанные значения могут отличаться на плюс или минус 0,2 2-тета. Полиморфная форма F соединения X В дополнительном аспекте изобретения предложена полиморфная форма F Соединения X, которая,как полагают, является 0,25-стехиометрически гидратной формой соединения X. Эта полиморфная форма может быть охарактеризована тем, что дает по меньшей мере одно из следующих значений 2, измеренных с использованием CuK излучения: 18,7 и 8,99. Полиморфная форма F соединения X характеризуется картиной дифракции рентгеновских лучей на порошке, по существу, как показано на фиг. 13. Десять пиков дифракции рентгеновских лучей на порошке для этой полиморфной формы [угол 2 тета (2), интенсивность (%)] представляют собой: 18,7 (100%), 8,9 (87,7%), 15,1 (80,3%), 25,4 (74,6%),14,5 (72,3%), 22,9 (69,6%), 9,9 (51,1%), 28,2 (42,0%), 8,2 (24,2%) и 11,9 (22,3%). Согласно настоящему изобретению предложена полиморфная форма F соединения X, которая имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с одним характеристическим пиком при значении 2-тета, примерно равном 18,7. Согласно настоящему изобретению предложена полиморфная форма F соединения X, которая имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с одним характеристическим пиком при значении 2-тета, примерно равном 8,9. Согласно настоящему изобретению предложена полиморфная форма F соединения X, которая имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с двумя характеристическими пиками при значениях 2-тета, примерно равных 18,7 и 8,9. Согласно настоящему изобретению предложена полиморфная форма F соединения X, которая имеет картину дифракции рентгеновских лучей на порошке с характеристическими пиками при значениях 2 тета, примерно равных 18,7, 8,9, 15,1, 25,4, 14,5, 22,9, 9,9, 28,2, 8,2 и 11,9. Согласно настоящему изобретению предложена полиморфная форма F соединения X, которая имеет картину дифракции рентгеновских лучей на порошке, по существу, такую же, как картина дифракции рентгеновских лучей на порошке, показанная на фиг. 13. Согласно настоящему изобретению предложена полиморфная форма F Соединения X, которая имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с одним характеристическим пиком при значении 2-тета, равном 18,7 плюс или минус 0,2 2-тета. Согласно настоящему изобретению предложена полиморфная форма F Соединения X, которая имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с одним характеристическим пиком при значении 2-тета, равном 8,9 плюс или минус 0,2 2-тета. Согласно настоящему изобретению предложена полиморфная форма F Соединения X, которая имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с двумя характеристическими пиками при значениях 2-тета, равных 18,7 и 8,9, где указанные значения могут отличаться на плюс или минус 0,2 2-тета. Согласно настоящему изобретению предложена полиморфная форма F соединения X, которая имеет картину дифракции рентгеновских лучей на порошке с характеристическими пиками при значениях 2 тета, равных 18,7, 8,9, 15,1, 25,4, 14,5, 22,9, 9,9, 28,2, 8,2 и 11,9, где указанные значения могут отличаться на плюс или минус 0,2 2-тета. Полиморфная форма K соединения X В дополнительном аспекте изобретения предложена полиморфная форма K соединения X. Эта полиморфная форма может быть охарактеризована тем, что дает по меньшей мере одно из следующих значений 2, измеренных с использованием CuK излучения: 8,4 и 9,7. Полиморфная форма K соединения X характеризуется картиной дифракции рентгеновских лучей на порошке, по существу, как показано на фиг. 16. Десять пиков дифракции рентгеновских лучей на порошке для этой полиморфной формы [угол 2 тета (2), интенсивность (%)] представляют собой: 8,4 (100%), 9,7 (37,7%), 12,2 (32,4%), 15,1 (25,2%),24,7 (20,7%), 9,0 (16,8%), 21,9 (13,9%), 19,5 (13,9%), 24,2 (13,8%) и 18,3 (11,8%). Согласно настоящему изобретению предложена полиморфная форма K соединения X, которая имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с одним характеристическим пиком при значении 2-тета, примерно равном 8,4. Согласно настоящему изобретению предложена полиморфная форма K соединения X, которая име- 19024421 ет картину дифракции рентгеновских лучей на порошке по меньшей мере с одним характеристическим пиком при значении 2-тета, примерно равном 9,7. Согласно настоящему изобретению предложена полиморфная форма K соединения X, которая имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с двумя характеристическими пиками при значениях 2-тета примерно равных 8,4 и 9,7. Согласно настоящему изобретению предложена полиморфная форма K соединения X, которая имеет картину дифракции рентгеновских лучей на порошке с характеристическими пиками при значениях 2 тета, примерно равных 8,4, 9,7, 12,2, 15,1, 24,7, 9,0, 21,9, 19,5, 24,2 и 18,3. Согласно настоящему изобретению предложена полиморфная форма K соединения X, которая имеет картину дифракции рентгеновских лучей на порошке, по существу, такую же, как картина дифракции рентгеновских лучей на порошке, показанная на фиг. 16. Согласно настоящему изобретению предложена полиморфная форма K соединения X, которая имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с одним характеристическим пиком при значении 2-тета, равном 8,4 плюс или минус 0,2 2-тета. Согласно настоящему изобретению предложена полиморфная форма K соединения X, которая имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с одним характеристическим пиком при значении 2-тета, равном 9,7 плюс или минус 0,2 2-тета. Согласно настоящему изобретению предложена полиморфная форма K соединения X, которая имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с двумя характеристическими пиками при значениях 2-тета, равных 8,4 и 9,7, где указанные значения могут отличаться на плюс или минус 0,2 2-тета. Согласно настоящему изобретению предложена полиморфная форма K соединения X, которая имеет картину дифракции рентгеновских лучей на порошке с характеристическими пиками при значениях 2 тета, равных 8,4, 9,7, 12,2, 15,1, 24,7, 9,0, 21,9, 19,5, 24,2 и 18,3, где указанные значения могут отличаться на плюс или минус 0,2 2-тета. В данном описании мезилатная соль N-(2-2-диметиламиноэтил-метиламино-4-метокси-5-[4-(1 метилиндол-3-ил)пиримидин-2-ил]аминофенил)проп-2-енамида обозначена как "мезилатная соль Y". Полиморфная форма A мезилатной соли Y В дополнительном аспекте изобретения предложена полиморфная форма A мезилатной соли Y. Эта полиморфная форма может быть охарактеризована тем, что дает по меньшей мере одно из следующих значений 2, измеренных с использованием CuK излучения: 5,6 и 6,5. Полиморфная форма A мезилатной соли Y характеризуется картиной дифракции рентгеновских лучей на порошке, по существу, как показано на фиг. 18. Десять пиков дифракции рентгеновских лучей на порошке для этой полиморфной формы [угол 2 тета (2), интенсивность (%)] представляют собой: 5,6 (100%), 6,5 (66,7%), 10,2 (97,2%), 21,0 (96,2%),13,5 (91,7%), 22,7 (89,6%), 19,3 (80,6%), 27,3 (75,7%), 15,7 (71,2%) и 19,9 (66,7%). Согласно настоящему изобретению предложена полиморфная форма A мезилатной соли Y, которая имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с одним характеристическим пиком при значении 2-тета, примерно равном 5,6. Согласно настоящему изобретению предложена полиморфная форма A мезилатной соли Y, которая имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с одним характеристическим пиком при значении 2-тета, примерно равном 6,5. Согласно настоящему изобретению предложена полиморфная форма A мезилатной соли Y, которая имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с двумя характеристическими пиками при значениях 2-тета, примерно равных 5,6 и 6,5. Согласно настоящему изобретению предложена полиморфная форма A мезилатной соли Y, которая имеет картину дифракции рентгеновских лучей на порошке с характеристическими пиками при значениях 2-тета, примерно равных 5,6, 6,5, 10,2, 21,0, 13,5, 22,7, 19,3, 27,3, 15,7 и 19,9. Согласно настоящему изобретению предложена полиморфная форма A мезилатной соли Y, которая имеет картину дифракции рентгеновских лучей на порошке, по существу, такую же, как картина дифракции рентгеновских лучей на порошке, показанная на фиг. 18. Согласно настоящему изобретению предложена полиморфная форма A мезилатной соли Y, которая имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с одним характеристическим пиком при значении 2-тета, равном 5,6 плюс или минус 0,2 2-тета. Согласно настоящему изобретению предложена полиморфная форма A мезилатной соли Y, которая имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с одним характеристическим пиком при значении 2-тета, равном 6,5 плюс или минус 0,2 2-тета. Согласно настоящему изобретению предложена полиморфная форма A мезилатной соли Y, которая имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с двумя характеристическими пиками при значениях 2-тета, равных 5,6 и 6,5, где указанные значения могут отличаться на плюс или минус 0,2 2-тета. Согласно настоящему изобретению предложена полиморфная форма A мезилатной соли Y, которая имеет картину дифракции рентгеновских лучей на порошке с характеристическими пиками при значениях 2-тета, равных 5,6, 6,5, 10,2, 21,0, 13,5, 22,7, 19,3, 27,3, 15,7 и 19,9, где указанные значения могут отличаться на плюс или минус 0,2 2-тета. Полиморфная форма B мезилатной соли Y В дополнительном аспекте изобретения предложена полиморфная форма B мезилатной соли Y. Эта полиморфная форма может быть охарактеризована тем, что дает по меньшей мере одно из следующих значений 2, измеренных с использованием CuK излучения: 7,2 и 8,6. Полиморфная форма B мезилатной соли Y характеризуется картиной дифракции рентгеновских лучей на порошке, по существу, как показано на фиг. 20. Десять пиков дифракции рентгеновских лучей на порошке для этой полиморфной формы [угол 2 тета (2), интенсивность (%)] представляют собой: 7,2 (50,2%), 8,6 (55,2%), 15,3 (100%), 10,4 (92,6%),25,7 (74,0%), 26,1 (63,9%), 16,4 (55,2%), 9,5 (47,5%), 22,1 (46,9%) и 18,8 (47,7%). Согласно настоящему изобретению предложена полиморфная форма B мезилатной соли Y, которая имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с одним характеристическим пиком при значении 2-тета, примерно равном 7,2. Согласно настоящему изобретению предложена полиморфная форма B мезилатной соли Y, которая имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с одним характеристическим пиком при значении 2-тета, примерно равном 8,6. Согласно настоящему изобретению предложена полиморфная форма B мезилатной соли Y, которая имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с двумя характеристическими пиками при значениях 2-тета, примерно равных 7,2 и 8,6. Согласно настоящему изобретению предложена полиморфная форма B мезилатной соли Y, которая имеет картину дифракции рентгеновских лучей на порошке с характеристическими пиками при значениях 2-тета, примерно равных 7,2, 8,6, 15,3, 10,4, 25,7, 26,1, 16,4, 9,5, 22,1 и 18,8. Согласно настоящему изобретению предложена полиморфная форма B мезилатной соли Y, которая имеет картину дифракции рентгеновских лучей на порошке, по существу, такую же, как картина дифракции рентгеновских лучей на порошке, показанная на фиг. 20. Согласно настоящему изобретению предложена полиморфная форма B мезилатной соли Y, которая имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с одним характеристическим пиком при значении 2-тета, равном 7,2 плюс или минус 0,2 2-тета. Согласно настоящему изобретению предложена полиморфная форма B мезилатной соли Y, которая имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с одним характеристическим пиком при значении 2-тета, равном 8,6 плюс или минус 0,2 2-тета. Согласно настоящему изобретению предложена полиморфная форма B мезилатной соли Y, которая имеет картину дифракции рентгеновских лучей на порошке по меньшей мере с двумя характеристическими пиками при значениях 2-тета, равных 7,2 и 8,6, где указанные значения могут отличаться на плюс или минус 0,2 2-тета. Согласно настоящему изобретению предложена полиморфная форма B мезилатной соли Y, которая имеет картину дифракции рентгеновских лучей на порошке с характеристическими пиками при значениях 2-тета, равных 7,2, 8,6, 15,3, 10,4, 25,7, 26,1, 16,4, 9,5, 22,1 и 18,8, где указанные значения могут отличаться на плюс или минус 0,2 2-тета. Перечень фигур Все фигуры относятся к твердым формам соединения N-(2-2-диметиламиноэтил-метиламино-4 метокси-5-[4-(1-метилиндол-3-ил)пиримидин-2-ил]аминофенил)проп-2-енамида ("соединение X") или его мезилатной соли, когда указано ("мезилатная соль Y"). Фиг. 1. Картина дифракции рентгеновских лучей на порошке формы А. Фиг. 2. Термограмма ДСК формы А. Фиг. 3. Картина дифракции рентгеновских лучей на порошке формы B. Фиг. 4. Термограмма ДСК формы B. Фиг. 5. Картина дифракции рентгеновских лучей на порошке формы C. Фиг. 6. Термограмма ДСК формы C. Фиг. 7. Картина дифракции рентгеновских лучей на порошке формы D (моногидрат). Фиг. 8. Термограмма ДСК формы D моногидрата. Фиг. 9. Термограмма ТГА формы D моногидрата. Фиг. 10. Картина дифракции рентгеновских лучей на порошке формы Е (гидратированная форма). Фиг. 11. Термограмма ДСК формы Е (гидратированная форма). Фиг. 12. Термограмма ТГА формы Е (гидратированная форма). Фиг. 13. Картина дифракции рентгеновских лучей на порошке формы F (гидратированная форма). Фиг. 14. Термограмма ДСК формы F (гидратированная форма). Фиг. 15. Термограмма ТГА формы F (гидратированная форма). Фиг. 16. Картина дифракции рентгеновских лучей на порошке формы K. Фиг. 17. Термограмма ДСК формы K. Фиг. 18. Картина дифракции рентгеновских лучей на порошке формы А мезилатной соли. Фиг. 19. Термограмма ДСК формы А мезилатной соли. Фиг. 20. Картина дифракции рентгеновских лучей на порошке формы B мезилатной соли. Фиг. 21. Термограмма ДСК формы B мезилатной соли. Методики химического синтеза и биологического анализа Следующие сокращения могут быть использованы: THF означает тетрагидрофуран; DIPEA означает диизопропилэтиламин; насыщ. означает насыщенный водный раствор; FCC означает флэшколоночную хроматографию с использованием диоксида кремния; TFA означает трифторуксусную кислоту; к.т. означает комнатную температуру; DMF означает N,N-диметилформамид; DMSO означает диметилсульфоксид; DMA означает N,N-диметилацетамид; EtOAc означает этилацетат; ч. означает час(ы); протонный ЯМР: (1H ЯМР) определяли с использованием дейтерированного диметилсульфоксида при 400 или 500 МГц при примерно 20-30C, если не указано иное. Использованы стандартные сокращения для ЯМР (s означает синглет; d означает дублет; dd означает дублет дублетов; t означает триплет; q означает квартет; p означает пентет; m означает мультиплет; br означает широкий и так далее). Когда железо упоминается в качестве реагента, оно представляет собой порошок железа, 325 меш и восстановленный водород. Приведенные значения анализа (мкМ) для данного примера представляют собой значения концентрации, при которой наблюдается 50%-ное ингибирование (IC50). Дифракцию рентгеновских лучей на порошке (XRPD) осуществляли с использованием оборудования Bruker D4. Рентгеновскую порошковую дифрактограмму определяли путем закрепления образца кристаллического материала на монокристаллической кремниевой пластинке (SSC) Bruker и разравнивания образца в тонкий слой с помощью предметного стекла. Образец вращали со скоростью 30 оборотов в минуту (для улучшения статистических подсчетов) и облучали рентгеновскими лучами, генерируемыми медной длинно-тонкофокусной трубкой,работающей при 40 кВ и 40 мА, с длиной волны 1,5418 Ангстрем (CuK излучение). Коллимированный пучок рентгеновских лучей от источника пропускали через установку с автоматически регулируемой расходимостью щелей при V20 (длина пути 20 мм), и отраженное излучение направляли через антирассеивающую щель 5,89 мм и детекторную щель 9,55 мм. Образец подвергали воздействию в течение 0,03 с с шагом 2-тета 0,00570 (непрерывный режим сканирования) в интервале углов 2-тета от 2 до 40 градусов в режиме тета-тета. Время прогона составляло 3 мин 36 с. Этот прибор был оснащен детектором,определяющим изменение положения (Lynxeye). Контроль и сбор данных осуществляли с помощью DellOptiplex 686 NT 4.0 Workstation, работающего с программным продуктом Diffrac+. Дифференциальную сканирующую калориметрию (ДСК) осуществляли с использованием дифференциального сканирующего калориметра "ТА Instruments Q1000. Как правило, менее чем 5 мг материала, помещенного в стандартный алюминиевый тигель с крышкой, нагревали в диапазоне температур от 25 до 300 С с постоянной скоростью нагревания 10 С в мин. Использовали продувку газообразным азотом со скоростью потока 50 мл в минуту. Любую кристаллическую форму, которая дает дифрактограммы XRPD или термограммы ДСК по существу идентичные тем, которые здесь описаны, входят в объем настоящих изобретений. Специалист в данной области техники способен определить сходство, по существу, дифрактограмм и термограмм. Анализ 1. Анализ клеточного фосфорилирования EGFR с делецией в экзоне 19 (активирующий одиночный мутант) Линию клеток легких человека PC9 (EGFR с делецией в экзоне 19) получали из Американской коллекции типовых культур. PC9 сохраняли в среде RPMI 1640, содержащей 10%-ную эмбриональную телячью сыворотку и 2 мМ глутамин. Клетки выращивали в увлажняемом инкубаторе при 37 С с 5% CO2. Анализы для измерения клеточного фосфорилирования эндогенного p-EGFR в клеточных лизатах осуществляли согласно протоколу, описанному в RD Systems Duo Set IC Human Phospho-EGF R ELISA(RD Systems, номер по каталогу DYC1095). 40 мкл клеток высевали (10000 клеток/лунка) в ростовую среду в черных 384-луночных планшетахCorning с прозрачным дном и инкубировали при 37C с 5% CO2 в течение ночи. Клетки акустически дозировали с использованием Echo 555, при этом соединения серийно разбавляли в 100%-ном DMSO. Планшеты инкубировали в течение дополнительных 2 часов, затем среду отсасывали и в каждую лунку добавляли 40 мкл 1 буфера для лизиса. Черные 384-луночные планшеты Greiner с высоким связыванием покрывали иммобилизованным антителом и затем блокировали 3%-ным BSA. После удаления блока 15 мкл лизата переносили в черные 384-луночные планшеты Greiner с высоким связыванием и инкубировали в течение 2 ч. После аспирации и промывки планшетов PBS добавляли 20 мкл детектируемого антитела и инкубировали в течение 2 ч. После аспирации и промывки планшетов PBS добавляли 20 мкл флуорогенного пероксидазного субстрата QuantaBlu (Thermo Fisher Scientific, номер по каталогу 15169) и инкубировали в течение 1 ч. В планшеты добавляли 20 мкл раствора, блокирующего QuantaBlu, и флуоресценцию считывали на планшет-ридере Envision с использованием длины волны возбуждения 352 нм и длины волны излучения 460 нм. Данные, полученные с каждым соединением, вводили в программный пакет (такой как Origin) для аналитической аппроксимации кривых. Исходя из этих данных получали значения IC50, определенные путем расчета концентрации соединения, которое требуется для получения 50% эффекта. Анализ 2. Анализ клеточного фосфорилирования L858R/T790M EGFR (двойной мутант) Линии клеток легких человека NCI-H1975 получали из Американской коллекции типовых культур.NCI-H1975 сохраняли в среде RPMI 1640, содержащей 10%-ную эмбриональную телячью сыворотку и 2 мМ глутамин. Клетки выращивали в увлажняемом инкубаторе при 37 С с 5% CO2. Анализы для измерения клеточного фосфорилирования эндогенного p-EGFR в клеточных лизатах осуществляли согласно протоколу, описанному в RD Systems DuoSet IC Human Phospho-EGF R ELISA (RD Systems, номер по каталогу DYC1095). 40 мкл клеток высевали (10000 клеток/лунка) в ростовую среду в черных 384 луночных планшетах Corning с прозрачным дном и инкубировали при 37C с 5% CO2 в течение ночи. Клетки акустически дозировали с использованием Echo 555, при этом соединения серийно разбавляли в 100%-ном DMSO. Планшеты инкубировали в течение дополнительных 2 ч, затем среду отсасывали и в каждую лунку добавляли 40 мкл 1 буфера для лизиса. Черные 384-луночные планшеты Greiner с высоким связыванием покрывали иммобилизованным антителом и затем блокировали 3%-ным BSA. После удаления блока, 15 мкл лизата переносили в черные 384-луночные планшеты Greiner с высоким связыванием и инкубировали в течение 2 ч. После аспирации и промывки планшетов PBS добавляли 20 мкл детектируемого антитела и инкубировали в течение 2 ч. После аспирации и промывки планшетов PBS добавляли 20 мкл детектируемого антитела и инкубировали в течение 2 ч. После аспирации и промывки планшетов PBS добавляли 20 мкл флуорогенного пероксидазного субстрата QuantaBlu (Thermo FisherScientific, номер по каталогу 15169) и инкубировали в течение 1 ч. В планшеты добавляли 20 мкл раствора, блокирующего QuantaBlu, и флуоресценцию считывали на планшет-ридере Envision с использованием длины волны возбуждения 352 нм и длины волны излучения 460 нм. Данные, полученные с каждым соединением, вводили в программный пакет (такой как Origin) для аналитической аппроксимации кривых. Исходя из этих данных получали значения IC50, определенные путем расчета концентрации соединения, которое требуется для получения 50% эффекта. Анализ 3. Анализ клеточного фосфорилирования EGFR дикого типа Линию клеток толстой кишки человека LoVo получали из Американской коллекции типовых культур. LoVo сохраняли в среде RPMI 1640, содержащей 3%-ную обедненную эмбриональную телячью сыворотку и 2 мМ глутамин. Клетки выращивали в увлажняемом инкубаторе при 37C с 5% CO2. Анализы для измерения клеточного фосфорилирования эндогенного p-EGFR в клеточных лизатах осуществляли согласно протоколу, описанному в RD Systems DuoSet IC Human Phospho-EGF R ELISA (RD Systems,номер по каталогу DYC1095). 40 мкл клеток высевали (15000 клеток/лунка) в ростовую среду в черных 384-луночных планшетах Corning с прозрачным дном и инкубировали при 37C с 5% CO2 в течение ночи. Клетки акустически дозировали с использованием Echo 555, при этом соединения серийно разбавляли в 100%-ном DMSO. Планшеты инкубировали в течение дополнительных 2 ч, затем стимулировали 100 нг/мл в течение 10 мин и среду отсасывали и в каждую лунку добавляли 40 мкл 1 буфера для лизиса. Черные 384-луночные планшеты Greiner с высоким связыванием покрывали иммобилизованным антителом и затем блокировали 3%-ным BSA. После удаления блока 15 мкл лизата переносили в черные 384-луночные планшеты Greiner с высоким связыванием и инкубировали в течение 2 ч. После аспирации и промывки планшетов PBS добавляли 20 мкл детектируемого антитела и инкубировали в течение 2 часов. После аспирации и промывки планшетов PBS добавляли 20 мкл флуорогенного пероксидазного субстрата QuantaBlu (Thermo Fisher Scientific, номер по каталогу 15169) и инкубировали в течение 1 ч. В планшеты добавляли 20 мкл раствора, блокирующего QuantaBlu, и флуоресценцию считывали на планшет-ридере Envision с использованием длины волны возбуждения 352 нм и длины волны излучения 460 нм. Данные, полученные с каждым соединением, вводили в программный пакет (такой как Origin) для аналитической аппроксимации кривых. Исходя из этих данных получали значения IC50, определенные путем расчета концентрации соединения, которое требуется для получения 50% эффекта. Данные анализа (мкМ) для соединений примеров этой заявки показаны в таблице ниже. Хотя данные анализа изложены с определенным количеством значащих цифр, это не следует воспринимать как представление того, что данные определяют с точностью именно до этого количества значащих цифр. Пример 1. N-4-Метокси-2-[1-метил-3,6-дигидро-2H-пиридин-4-ил]-5-[(5-метил-4-пиразоло[1,5a]пиридин-3-илпиримидин-2-ил)амино]фенил)проп-2-енамид Акрилоилхлорид (0,331 мл, 1 М в THF, 0,33 ммоль) добавляли по каплям к раствору 6-метокси-4-(1 метил-1,2,3,6-тетрагидропиридин-4-ил)-N1-[5-метил-4-(пиразоло[1,5-a]пиридин-3-ил)пиримидин-2- 24024421 ил]бензол-1,3-диамина (промежуточное соединение 1, 146 мг, 0,33 ммоль) и DIPEA (0,086 мл, 0,50 ммоль) в THF (4 мл) при -10C в течение 1-минутного периода в атмосфере N2. Полученную смесь перемешивали при 0C в течение 15 мин и затем концентрировали в вакууме. Остаток растворяли в CH2Cl2 (5 мл) с небольшим количеством CH3OH. Этот раствор затем промывали насыщ. NaHCO3 (2 мл), сушили(MgSO4) и затем концентрировали в вакууме. В результате очистки посредством FCC, элюирования 525% CH3OH в CH2Cl2 и концентрирования соответствующих фракций в вакууме получили материал, который растворяли в смеси CH2Cl2:7 н. метанольный аммиак 100:8 (1 мл) и фильтровали через набивку 1 г диоксида кремния. В результате концентрирования полученного раствора получили указанное в заголовке соединение (70 мг, 38%) в виде бледно-оранжевой пены; 1H ЯМР: 2.27 (3H, s), 2.37 (2H, m), 2.42 (3H,s), 2.53-2.57 (2H, m), 2.97 (2H, m), 3.87 (3H, d), 5.66 (2H, d), 6.14 (1H, d), 6.39 (1H, d), 6.86 (1H, s), 7.07 (1H,t), 7.42 (1H, m), 7.98 (1H, s), 8.17 (1H, s), 8.32 (1H, s), 8.48 (1H, d), 8.58 (1H, s), 8.81 (1H, d), 9.29 (1H, s);m/z: ES+ MH+ 496. Пример 2. N-(5-[5-Хлор-4-(1H-индол-3-ил)пиримидин-2-ил]амино-4-метокси-2-[1-метил-3,6-дигидро-2H-пиридин-4-ил]фенил)проп-2-енамид Акрилоилхлорид (0,217 мл, 1M в THF, 0,22 ммоль) добавляли по каплям к суспензии N'-[5-хлор-4(1H-индол-3-ил)пиримидин-2-ил]-4-метокси-6-(1-метил-3,6-дигидро-2H-пиридин-4-ил)бензол-1,3-диамина (промежуточное соединение 7, 100 мг, 0,22 ммоль) и DIPEA (0,057 мл, 0,33 ммоль) в THF (3 мл) при -5C в течение 1-минутного периода в атмосфере N2. Полученную смесь перемешивали при 0C в течение 15 минут и затем концентрировали в вакууме. Остаток растворяли в CH2Cl2 (5 мл) с несколькими каплями CH3OH и промывали насыщ. NaHCO3 (2 мл). Органический раствор затем сушили (MgSO4) и загружали на диоксид кремния в вакууме. В результате очистки посредством FCC, элюирования 5-25%CH3OH в CH2Cl2 и концентрирования соответствующих фракций в вакууме получили остаток, который промывали CH3OH (0,3 мл) и сушили на воздухе с получением указанного в заголовке соединения (37 мг, 31%) в виде бежевого кристаллического твердого вещества. 1H ЯМР: 2.28 (3H, s), 2.38 (2H, m), 2.55(1H, t), 7.47 (1H, d), 7.98 (1H, s), 8.33 (1H, s), 8.36 (1H, d), 8.42 (1H, s), 8.49 (1H, s), 9.29 (1H, s), 11.86 (1H,s); m/z: ES+ MH+ 515. Пример 3. N-(5-[4-(1H-Индол-3-ил)-5-метилпиримидин-2-ил]амино-4-метокси-2-[4-метилпиперазин-1-ил]фенил)проп-2-енамид Акрилоилхлорид (0,025 мл, 0,30 ммоль) добавляли по каплям к N'-[4-(1H-индол-3-ил)-5-метилпиримидин-2-ил]-4-метокси-6-(4-метилпиперазин-1-ил)бензол-1,3-диамину (промежуточное соединение 12,135 мг, 0,30 ммоль) и DIPEA (0,090 мл, 0,33 ммоль) в CH2Cl2 (10 мл) и DMF (2 мл) при 0C в атмосфереN2. Полученную суспензию перемешивали при 0C в течение 2 часов, затем оставляли нагреваться до к.т. Смесь затем разбавляли водой (15 мл) и экстрагировали CH2Cl2 (40 мл). Полученный органический раствор промывали насыщенным Na2CO3 (20 мл) и затем насыщенным рассолом (20 мл). Раствор затем сушили (MgSO4) и концентрировали в вакууме. В результате очистки посредством FCC, элюируя 1-5% 7M метанольным аммиаком в CH2Cl2, получили неочищенный продукт. Дополнительная очистка препаративной HPLC (колонка Waters SunFire, диоксид кремния 5 мкм, диаметр 19 мм, длина 100 мм) с элюированием смесями понижающейся полярности воды (содержащей 0,1%-ную муравьиную кислоту) иCH3CN с последующей HPLC (колонка Waters XBridge Prep C18 OBD, диоксид кремния 5 мкм, диаметр 19 мм, длина 100 мм) с элюированием смесями понижающейся полярности воды (содержащей 1% NH3) иCH3CN дала указанное в заголовке соединение (23 мг, 15%) в виде белого твердого вещества; 1H ЯМР: 2.26 (3H, s), 2.37 (3H, s), 2.48-2.57 (4 Н, m), 2.87 (4 Н, t), 3.84 (3H, s), 5.70 (1 Н, d), 6.18 (1 Н, dd), 6.59 (1H,dd), 6.87 (1H, s), 7.05 (1H, dd), 7.15 (1H, t), 7.44 (1H, d), 7.83 (1H, s), 7.98 (1 Н, d), 8.22 (1 Н, s), 8.34 (1H, d),8.49 (1 Н, s), 8.97 (1H, s), 11.68 (1H, s); m/z: ES+ MH+ 498,60. Пример 4. N-5-[(5-Хлор-4-пиразоло[1,5-a]пиридин-3-илпиримидин-2-ил)амино]-2-[(3R)-3-диметиламинопирролидин-1-ил]-4-метоксифенилпроп-2-енамид Раствор акрилоилхлорида (0,042 мл, 0,51 ммоль) в CH2Cl2 (1 мл) добавляли по каплям к смеси N-(5 хлор-4-пиразоло[1,5-a]пиридин-3-илпиримидин-2-ил)-4-[(3R)-3-диметиламино-пирролидин-1-ил]-6 метоксибензол-1,3-диамина (промежуточное соединение 18, 245 мг, 0,51 ммоль) и DIPEA (0,097 мл, 0,56 ммоль) в CH2Cl2 (10 мл), которую охлаждали на бане лед/вода. Смесь перемешивали в течение 2 ч и затем промывали рассолом, сушили (Na2SO4) и концентрировали в вакууме. В результате очистки посредством FCC, элюируя 2% 7 н. метанольного аммиака в CH2Cl2, получили пену после концентрирования в вакууме. Эту пену растирали с использованием CH2Cl2 и диэтилового эфира и полученное твердое вещество собирали фильтрованием и сушили с получением указанного в заголовке соединения (157 мг, 58%) в виде желтого твердого вещества; 1H ЯМР: 1.68-1.83 (1H, m), 2.05-2.16 (1H, m), 2.18 (6H, s), 2.64-2.76(1H, s); m/z: ES+ MH+ 533,5. Пример 5. N-5-[(5-Хлор-4-пиразоло[1,5-a]пиридин-3-илпиримидин-2-ил)амино]-2-[3-диметиламиноазегидин-1-ил]-4-метоксифенилпроп-2-енамид Раствор акрилоилхлорида (0,038 мл, 0,47 ммоль) в CH2Cl2 (1 мл) добавляли по каплям к перемеши- 25024421(0,090 мл, 0,52 ммоль) в CH2Cl2 (5 мл), который охлаждали на бане лед/вода. Смесь перемешивали в течение 3 ч и затем промывали рассолом, сушили (Na2SO4) и концентрировали в вакууме. В результате очистки посредством FCC, элюируя 0-5% 7 н. метанольного аммиака в CH2Cl2, получили указанное в заголовке соединение (221 мг, 90%) в виде желтого твердого вещества; 1H ЯМР: 2.09 (6H, s), 3.08 (1H, p),3.55-3.62 (2H, m), 3.76 (3H, s), 3.97 (2H, t), 5.66 (1H, dd), 6.16 (1H, dd), 6.25 (1H, s), 6.45 (1H, dd), 7.10 (1 Н,dd), 7.35 (1H, s), 7.39 (1H, dd), 8.25-8.40 (1H, m), 8.35 (1H, s), 8.45 (1 Н, s), 8.81 (1 Н, d), 8.92 (1 Н, s), 9.24(1H, s); m/z: ES+ MH+ 519,56. Пример 6. N-5-[(5-Хлор-4-пиразоло[1,5-a]пиридин-3-илпиримидин-2-ил)амино]-2-[2-диметиламиноэтил-метиламино]-4-метоксифенилпроп-2-енамид Акрилоилхлорид (1,248 мл, 1 М в THF, 1,25 ммоль) добавляли по каплям к N4-[5-хлор-4-(пиразоло[1,5-a]пиридин-3-ил)пиримидин-2-ил]-N1-[2-(диметиламино)этил]-5-метокси-N1-метилбензол-1,2,4 триамину (промежуточное соединение 33, 530 мг, 1,13 ммоль) и DIPEA (0,244 мл, 1,36 ммоль) в THF (20 мл), который охлаждали до 0C. Эту смесь перемешивали при 0C в течение 2 ч. Смесь затем концентрировали в вакууме. Полученный остаток растворяли в CH2Cl2 (100 мл), затем промывали последовательно насыщенным NaHCO3 (25 мл), водой (25 мл) и насыщенным рассолом (25 мл). Органический раствор концентрировали в вакууме. В результате очистки посредством FCC, элюируя 0-20% 2 М метанольного аммиака в CH2Cl2, и дополнительной очистки посредством FCC, элюируя 0-20% CH3OH в CH2Cl2, получили коричневую смолу. ЖХ-МС анализ показал, что все еще присутствуют примеси. Предприняли дополнительную очистку посредством FCC, элюируя 0-20% CH3OH в CH2Cl2. Соответствующие фракции концентрировали с получением коричневой смолы, содержащей указанное в заголовке соединение. Попытки превратить эту смолу в твердое вещество путем растирания не удались. Лиофилизация из смесиCH3CN/вода также не удалась, но лиофилизация из смеси CH3OH/вода дала коричневое полутвердое вещество. В результате растирания полутвердого вещества с диэтиловым эфиром с последующим выпариванием эфира получили указанное в заголовке соединение (191 мг, 32%) в виде бледно-желтого порошкообразного твердого вещества; 1H ЯМР: (CDCl3) 2.28 (6H, s), 2.32 (2H, t), 2.71 (3H, s), 2.84-2.92 (2H, m),3.87 (3H, s), 5.67 (1H, dd), 6.29 (1 Н, dd), 6.37 (1H, dd), 6.80 (1H, s), 6.89 (1H, td), 7.23-7.33 (1H, m), 7.46(1H, s), 8.45 (1H, s), 8.52 (1H, d), 8.56 (1H, d), 8.94 (1H, s), 9.39 (1H, s), 10.09 (1H, s); m/z: ES+ MH+ 521,29. Пример 7. N-2-[(3aR,6aR)-5-Метил-2,3,3a,4,6,6a-гексагидропирроло[3,2-c]пиррол-1-ил]-5-[(5-хлор 4-пиразоло[1,5-a]пиридин-3-илпиримидин-2-ил)амино]-4-метоксифенилпроп-2-енамид Акрилоилхлорид (1 М в THF, 0,225 мл, 0,22 ммоль) в CH2Cl2 (1 мл) добавляли по каплям к смеси 4[(3aR,6aR)-5-метил-2,3,3a,4,6,6a-гексагидропирроло[3,2-c]пиррол-1-ил]-N-(5-хлор-4-пиразоло[1,5-a]пиридин-3-илпиримидин-2-ил)-6-метоксибензол-1,3-диамина (промежуточное соединение 35, 105 мг, 0,21 ммоль) и DIPEA (0,041 мл, 0,24 ммоль) в CH2Cl2 (3 мл), которую охлаждали на бане лед/вода. Смесь перемешивали в течение 0,5 ч, промывали рассолом и затем концентрировали в вакууме. В результате очистки посредством FCC, элюируя 0-2,5% 7 н. метанольного аммиака в CH2Cl2, получили указанное в заголовке соединение (60 мг, 52%) в виде бледно-желтого твердого вещества; 1H ЯМР: 1.77-1.81 (1H, m),1.95-2.16 (5H, m), 2.24-2.35 (1H, m), 2.38-2.48 (1H, m), 2.86-2.90 (1H, m), 3.18-3.22 (1H, m), 3.37-3.45 (1H,m), 3.76 (3H, s), 4.33-4.37 (1H, m), 5.68 (1H, dd), 6.18 (1H, dd), 6.51 (1H, dd), 6.66 (1H, s), 7.10 (1H, dt), 7.337.41 (1H, m), 7.65 (1H, s), 8.3-8.4 (2H, m), 8.56 (1H, s), 8.81 (1H, d), 8.94 (1H, s), 9.38 (1H, s); m/z: ES+, MH+ 545,57. Пример 8. N-5-[(5-Хлор-4-пиразоло[1,5-a]пиридин-3-илпиримидин-2-ил)амино]-4-метокси-2-[5-метил-2,5-диазаспиро[3.4]октан-2-ил]фенилпроп-2-енамид Раствор акрилоилхлорида (5,71 мг, 0,06 ммоль) в CH2Cl2 (1 мл) добавляли по каплям к смеси N'-(5 хлор-4-пиразоло[1,5-a]пиридин-3-илпиримидин-2-ил)-4-метокси-6-(5-метил-2,5-диазаспиро[3.4]октан-2 ил)бензол-1,3-диамина (промежуточное соединение 45, 31 мг, 0,06 ммоль) в CH2Cl2 (5 мл), которую охлаждали на бане лед/вода. Смесь перемешивали в течение 3 ч и затем промывали рассолом, сушили(Na2SO4) и концентрировали в вакууме. В результате очистки посредством FCC, элюируя 0-2% 7 н. метанольного аммиака в CH2Cl2, получили указанное в заголовке соединение (21 мг, 61%) в виде желтой пены; 1H ЯМР: 1.70 (2H, dd), 1.98-2.11 (2H, m), 2.37 (3H, s), 2.62 (2H, t), 3.65 (2H, d), 3.76 (3H, s), 3.95 (2H,d), 5.67 (1H, d), 6.09-6.27 (2H, m), 6.43 (1H, dd), 7.10 (1H, t), 7.30 (1H, s), 7.34-7.45 (1H, m), 8.35 (2H, s),8.44 (1H, s), 8.81 (1H, d), 8.92 (1H, s), 9.20 (1H, s); m/z: ES+ MH+ 545,5. Пример 9. N-(5-[(5-Хлор-4-пиразоло[1,5-a]пиридин-3-илпиримидин-2-ил)амино]-4-метокси-2-[1-метил-3,6-дигидро-2H-пиридин-4-ил]фенилпроп-2-енамид Раствор акрилоилхлорида (0,026 мл, 0,32 ммоль) в CH2Cl2 (1 мл) добавляли по каплям к смеси N'-(5 хлор-4-пиразоло[1,5-a]пиридин-3-илпиримидин-2-ил)-4-метокси-6-(1-метил-3,6-дигидро-2H-пиридин-4 ил)бензол-1,3-диамина (промежуточное соединение 55, 150 мг, 0,32 ммоль) и DIPEA (0,062 мл, 0,36 ммоль) в СН 2 С 12 (5 мл), которую охлаждали на бане лед/вода. Смесь перемешивали в течение 3 ч и затем промывали рассолом, сушили (Na2SO4) и концентрировали в вакууме. В результате очистки посредством 5.62-5.73 (2H, m), 6.14 (1H, dd), 6.43 (1H, dd), 6.88 (1H, s), 7.12 (1H, dt), 7.39-7.47 (1H, m), 7.83 (1H, s),8.41-8.50 (2H, m), 8.63 (1H, s), 8.85 (1H, d), 8.95 (1H, s), 9.36 (1H, s); m/z: ES+ MH+ 516,25. Пример 10. N-5-[(5-Хлор-4-пиразоло[1,5-a]пиридин-3-илпиримидин-2-ил)амино]-2-[4-(2-диметиламино-2-оксоэтил)пиперазин-1-ил]-4-метоксифенилпроп-2-енамид Раствор акрилоилхлорида (0,030 мл, 0,37 ммоль) в CH2Cl2 (1 мл) добавляли по каплям к перемешиваемому раствору 2-(4-2-амино-4-[(5-хлор-4-пиразоло[1,5-aпиридин-3-илпиримидин-2-ил)амино]-5 метоксифенилпиперазин-1-ил)-N,N-диметилацетамида (промежуточное соединение 57, 0,19 г, 0,35 ммоль) и DIPEA (0,067 мл, 0,39 ммоль) в CH2Cl2 (5 мл). Смесь перемешивали в течение 0,5 ч, затем разбавляли CH2Cl2 (20 мл) и промывали насыщенным рассолом (225 мл). Органический раствор сушили(MgSO4) и концентрировали в вакууме. В результате очистки посредством FCC, элюируя 5%-нымCH3OH в CH2Cl2, получили указанное в заголовке соединение (0,157 г, 75%) в виде желтого твердого вещества; 1H ЯМР: (CDC13) 2.76 (4H, s), 2.90-2.96 (4H, m), 2.98 (3H, s), 3.12 (3H, s), 3.30 (2H, s), 3.87 (3H,s), 5.65-5.77 (1H, m), 6.18-6.37 (2H, m), 6.80 (1H, s), 6.90 (1H, t), 7.28 (1H, d), 7.42 (1H, s), 8.44 (1H, s), 8.468.59 (3H, m), 8.93 (1H, s), 9.33 (1H, s); m/z: ES+ MH+ 590,52. Пример 11. (S)-N-2-[4-(2-Аминопропаноил)пиперазин-1-ил]-5-[(5-хлор-4-пиразоло[1,5-a]пиридин 3-илпиримидин-2-ил)амино]-4-метоксифенилпроп-2-енамид Раствор акрилоилхлорида (10,2 мкл, 0,13 ммоль) в CH2Cl2 (3 мл) добавляли по каплям к перемешиваемому раствору (S)-трет-бутил-N-[1-(4-2-амино-4-[(5-хлор-4-пиразоло[1,5-a]пиридин-3-илпиримидин 2-ил)амино]-5-метоксифенилпиперазин-1-ил)-1-оксопропан-2-ил]карбамата (промежуточное соединение 59, 65 мг) и DIPEA (0,75 мл) в CH2Cl2 (10 мл), который охлаждали на бане лед/вода. Смесь перемешивали в течение 0,75 ч, затем гасили водой (10 мл) и 2 М Na2SO3 (5 мл). Фазы отделяли и органический раствор сушили (MgSO4) и концентрировали в вакууме. Полученный остаток растворяли в CH2Cl2 (3 мл) и затем обрабатывали TFA (0,1 мл). После стояния в течение 0,25 ч добавляли вторую порцию TFA (0,2 мл). После еще одного 0,25-часового периода этот раствор концентрировали в вакууме и очищали препаративной HPLC (колонка Waters SunFire, диоксид кремния 5 мкм, диаметр 19 мм, длина 100 мм), элюируя смесями понижающейся полярности воды (содержащей 0,1%-ную муравьиную кислоту) и CH3CN. Фракции, содержащие целевое соединение, концентрировали в вакууме с получением указанного в заголовке соединения (17 мг, 6% от 5-хлор-N-(4-фтор-2-метокси-5-нитрофенил)-4-пиразоло[1,5-a]пиридин-3 ил-пиримидин-2-амина) в виде белого твердого вещества; 1H ЯМР: 1.25 (3H, s), 2.83-2.96 (4H, m), 3.653.82 (7H, m), 4.14-4.23 (1H, m), 5.73 (1H, d), 61.9 (1H, d), 6.64-6.70 (1H, m), 6.69 (1H, s), 7.08-7.12 (1H, m) 7.30-7.37 (1H, m), 8.20-8.28 (2H, m), 8.35-8.41 (2H, m), 8.68 (1H, s), 8.80-8.84 (1H, m), 8.95 (1H, s), 9.119.15 (1H, m); m/z: ES+ MH+ 576,60. Пример 12. N-5-[(5-Хлор-4-пиразоло[1,5-a]пиридин-3-илпиримидин-2-ил)амино]-2-[(3S)-3-диметиламинопирролидин-1-ил]-4-метоксифенилпроп-2-енамид Раствор акрилоилхлорида (0,042 мл, 0,52 ммоль) в CH2Cl2 (1 мл) добавляли по каплям к смеси (S)N1-[5-хлор-4-(пиразоло[1,5-a]пиридин-3-ил)пиримидин-2-ил]-4-[3-(диметиламино)пирролидин-1-ил]-6 метоксибензол-1,3-диамина (промежуточное соединение 61, 250 мг, 0,52 ммоль) и DIPEA (0,099 мл, 0,57 ммоль) в CH2Cl2 (5 мл), которую охлаждали на бане лед/вода. Смесь перемешивали в течение 3 ч и затем промывали рассолом, сушили (Na2SO4) и концентрировали в вакууме. В результате очистки посредствомFCC, элюируя 2% 7 н. метанольного аммиака в CH2Cl2, получили указанное в заголовке соединение (194 мг, 70%) в виде желтого твердого вещества; 1H ЯМР: 1.69-1.83 (1H, m), 2.05-2.16 (1H, m), 2.19 (6H, s),2.65-2.78 (1H, m), 3.18-3.29 (3H, m), 3.35-3.46 (1H, m), 3.77 (3H, s), 5.67 (1H, dd), 6.16 (1H, dd), 6.48 (1H,dd), 6.54 (1H, s), 7.12 (1H, t), 7.37 (1H, t), 7.43 (1H, s), 8.3-8.46 (2H, m), 8.55 (1H, s), 8.83 (1H, d), 8.94 (1H,s), 9.37 (1H, s); m/z: ES+ MH+ 533,5. Пример 13. N-(5-[(5-Хлор-4-пиразоло[1,5-a]пиридин-3-илпиримидин-2-ил)амино]-4-метокси-2-[4 метилпиперазин-1-ил]фенилпроп-2-енамид Раствор акрилоилхлорида (0,092 мл, 1,14 ммоль) в CH2Cl2 (1 мл) добавляли по каплям к смеси N'-(5 хлор-4-пиразоло[1,5-a]пиридин-3-илпиримидин-2-ил)-4-метокси-6-(4-метилпиперазин-1-ил)бензол-1,3 диамина (промежуточное соединение 63, 480 мг, 1,03 ммоль) и DIPEA (0,214 мл, 1,24 ммоль) в CH2Cl2(18 мл) при к.т. Через 0,25 ч добавляли дополнительное количество акрилоилхлорида (15 мг в 0,15 млCH2Cl2 ). Смесь перемешивали в течение 0,5 ч и затем промывали рассолом, сушили (Na2SO4) и концентрировали в вакууме. В результате очистки посредством FCC, элюируя 2,5% 7 н. метанольного аммиака в CH2Cl2 , получили указанное в заголовке соединение (390 мг, 73%) в виде желтого твердого вещества после растирания с CH3OH; 1H ЯМР: 2.27 (3H, s), 2.53-2.61 (4H, m), 2.84-2.97 (4H, m), 3.77 (3H, s), 5.70(1H, d), 6.17 (1H, d), 6.61 (1H, dd), 6.89 (1H, s), 7.11 (1H, t), 7.3-7.42 (1H, m), 8.10 (1H, s), 8.26-8.47 (2H, m),8.70 (1H, s), 8.83 (1H, d), 8.96 (1H, s), 9.02 (1H, s); m/z: ES+ MH+ 519. Пример 14. N-5-[(5-Циано-4-пиразоло[1,5-a]пиридин-3-илпиримидин-2-ил)амино]-4-метокси-2-[4 метилпиперазин-1-ил]фенилпроп-2-енамид Раствор акрилоилхлорида (0,017 мл, 0,21 ммоль) в CH2Cl2 (0,6 мл) добавляли к смеси 2-[5-амино-2 метокси-4-(4-метилпиперазин-1-ил)фенил]амино-4-пиразоло[1,5-a]пиридин-3-илпиримидин-5-карбонитрила (промежуточное соединение 65, 87 мг, 0,19 ммоль) и DIPEA (0,063 мл, 0,38 ммоль) в CH2Cl2 (1,5 мл) при 0C. Смесь затем перемешивали при 0C в течение 4 ч (за это время добавляли дополнительные 0,5 экв. акрилоилхлорида). Смесь затем разбавляли CH2Cl2, дважды промывали насыщенным NaHCO3,затем водой и затем сушили (MgSO4). В результате очистки посредством FCC, элюируя 0-6% метанольным аммиаком в CH2Cl2, получили указанное в заголовке соединение (67 мг, 69%) в виде желтого твердого вещества; 1H ЯМР: (102C) 2.30 (3H, s), 2.56-2.59 (4H, m), 2.93-2.96 (4H, m), 3.78 (3H, s), 5.67-5.7(1H, s), 8.72 (1H, br s), 8.76 (1H, d), 8.91 (1H, s), 8.96 (1H, br s); m/z: ES+ MH+ 510,5. Пример 15. N-(5-[4-(1H-Индол-3-ил)пиримидин-2-ил]амино-4-метокси-2-4-метилпиперазин-1 илфенил)проп-2-енамид К перемешиваемому раствору N'-[4-(1H-индол-3-ил)пиримидин-2-ил]-4-метокси-6-(4-метилпиперазин-1-ил)бензол-1,3-диамина (промежуточное соединение 66, 96 мг, 0,22 ммоль) в CH2Cl2 (15 мл) при 2C добавляли DIPEA (0,039 мл, 0,22 ммоль) и акрилоилхлорид (0,018 мл, 0,22 ммоль). Полученный раствор перемешивали при 2C в течение 0,25 ч, затем оставляли нагреваться до к.т. и перемешивали в течение еще 3,5 часов. Смесь затем разбавляли CH3OH (10 мл), загружали непосредственно на диоксид кремния. В результате очистки посредством FCC, элюируя 0-10% CH3OH в CH2Cl2 (содержащим 1% концентрированный аммиак (водн. получили не совсем белое твердое вещество, которое, по-видимому,содержало DIPEA.HCl согласно ЯМР-анализу. Это твердое вещество затем растворяли в смеси 1:1CH2Cl2/2-метилтетрагидрофуран (30 мл) и полученный раствор промывали раствором NaOH (2M, 230 мл), водой (230 мл) и затем насыщенным рассолом (30 мл). Органический раствор сушили (MgSO4) и концентрировали в вакууме с получением указанного в заголовке соединения (2 мг, 2%) в виде белого твердого вещества после растирания с диэтиловым эфиром. Маточные жидкости от растирания концентрировали в вакууме с получением второго образца указанного в заголовке соединения (10 мг, 9%) в виде белого твердого вещества; 1H ЯМР: 2.27 (3H, s), 2.55 (4H, s), 2.82-2.95 (4H, m), 3.84 (3H, d), 5.73 (1H,d), 6.24 (1H, dd), 6.62 (1H, dd), 6.89 (1H, s), 7.07-7.21 (2H, m), 7.25 (1H, d), 7.46 (1H, d), 7.89 (1H, s), 8.29(2,3,4,5,6-Пентафторфенил)проп-2-еноат (0,030 мл, 0,19 ммоль) добавляли по каплям к раствору 4 метокси-6-(4-метилпиперазин-1-ил)-N'-(4-пиразоло[1,5-a]пиридин-3-илпиримидин-2-ил)бензол-1,3 диамина (промежуточное соединение 69, 67 мг, 0,16 ммоль) в DMF (0,6 мл) при к.т. в атмосфере N2. Полученный раствор перемешивали при к.т. в течение 1,5 ч и затем разбавляли CH2Cl2 (9 мл). Этот раствор добавляли к диоксиду кремния l,5g для флэш-хроматографии, который увлажняли CH2Cl2 в загруженном сухим способом картридже, и неочищенный продукт элюировали с диоксида кремния с использованиемCH2Cl2. В результате дополнительной очистки посредством FCC, элюируя 2-7% 2 н. метанольного аммиака в CH2Cl2 получили материал, который дополнительно очищали посредством FCC, элюируя 5-20%CH3OH в CH2Cl2. Соответствующие фракции концентрировали в вакууме, и в результате растирания получили кристаллическое твердое вещество, которое промывали THF (0,1 мл) с получением указанного в заголовке соединения (23 мг, 28%) в виде бежевого кристаллического твердого вещества; 1H ЯМР: 2.332.43 (3H, m), 2.62-2.81 (4H, m), 2.94 (4H, s), 3.85 (3H, s), 5.72 (1H, d), 6.18 (1H, m), 6.55-6.69 (1H, m), 6.89(1H, d), 8.80 (1H, s), 9.03 (1H, s); m/z: ES+ MH+ 485. Пример 17. N-(5-[5-Хлор-4-(1H-индол-3-ил)пиримидин-2-ил]амино-4-метокси-2-4-метилпиперазин-1-илфенил)проп-2-енамид Акрилоилхлорид (0,621 мл, 1 М в THF, 0,62 ммоль) добавляли по каплям к N'-[5-хлор-4-(1H-индол 3-ил)пиримидин-2-ил]-4-метокси-6-(4-метилпиперазин-1-ил)бензол-1,3-диамину (промежуточное соединение 74, 288 мг, 0,62 ммоль) и DIPEA (0,119 мл, 0,68 ммоль) в THF (15 мл) при 0C в атмосфере N2. Полученную суспензию перемешивали при 0C в течение 1 ч и затем оставляли нагреваться до к.т. Смесь затем разбавляли водой (15 мл) и концентрировали в вакууме. Полученный остаток растворяли в смесиCH2Cl2 (20 мл) и CH3OH (5 мл) и полученный раствор промывали водой и насыщенным рассолом. Органический раствор сушили (MgSO4) и концентрировали в вакууме. В результате очистки посредствомFCC, элюируя 1 -8% 7M метанольного аммиака в CH2Cl2, получили неочищенный продукт в виде бледно-коричневой сухой пленки. Этот материал растворяли в CH2Cl2, и бежевое твердое вещество осаждалось из раствора. Этот раствор разбавляли диэтиловым эфиром и затем смесь фильтровали. Собранное твердое вещество промывали дополнительным количеством диэтилового эфира и сушили с получением указанного в заголовке соединения (134 мг, 42%) в виде бежевого твердого вещества; 1H ЯМР: 2.27 (3H,s), 2.53-2.59 (4H, m), 2.87-2.94 (4H, m), 3.79 (3H, s), 5.70 (1H, d), 6.17 (1H, dd), 6.60 (1H, dd), 6.89 (1H, s),7.01 (1H, t), 7.16 (1H, t), 7.45 (1H, d), 8.20 (1H, s), 8.27 (1H, d), 8.35 (1H, s), 8.43 (1H, s), 8.49 (1H, d), 8.96(1H, s), 11.81 (1H, s); m/z: ES+ MH+ 518,51. Пример 18. N-(4-Метокси-5-[5-метил-4-(1-метилиндол-3-ил)пиримидин-2-ил]амино-2-4-метилпиперазин-1-илфенил)проп-2-енамид Акрилоилхлорид (0,358 мл, 1M в THF, 0,36 ммоль) добавляли по каплям к смеси 4-метокси-N'-[5 метил-4-(1-метилиндол-3-ил)пиримидин-2-ил]-6-(4-метилпиперазин-1-ил)бензол-1,3-диамина (промежу- 28024421 точное соединение 77, 164 мг, 0,36 ммоль) и DIPEA (0,069 мл, 0,39 ммоль) в THF (15 мл) при 0C в атмосфере N2. Полученную суспензию перемешивали при 0C в течение 1 часа, затем оставляли нагреваться до к.т. Смесь затем разбавляли водой (15 мл) и концентрировали в вакууме. Полученный материал растворяли в смеси CH2Cl2 (20 мл) и CH3OH (5 мл). Полученный раствор промывали водой и насыщенным рассолом. Органический раствор затем сушили (MgSO4) и концентрировали в вакууме. В результате очистки посредством FCC, элюируя 1-8% 7 М метанольного аммиака в CH2Cl2, после концентрирования соответствующих фракций в вакууме получили желтую сухую пленку. Этот материал растворяли в CH2Cl2 и полученный раствор разбавляли диэтиловым эфиром, что привело к бежевому твердому веществу, выпадающему в осадок из раствора. Это твердое вещество собирали фильтрованием, промывали диэтиловым эфиром и затем сушили с 5 получением указанного в заголовке соединения (96 мг, 52%); 1H ЯМР: 2.26 (3H, s), 2.37 (3H, s), 2.51 (4H, s), 2.87 (4H, s), 3.83 (3H, s), 3.89 (3H, s), 5.70 (1H, d), 6.17 (1H, d), 6.60(1H, dd), 6.86 (1H, s), 7.09 (1H, t), 7.22 (1H, t), 7.48 (1H, d), 7.87 (1H, s), 8.05 (1H, s), 8.21 (1H, s), 8.37 (1H,d), 8.46 (1H, s), 9.00 (1H, s); m/z: ES+ MH+ 512,46. Пример 19. N-(2-2-диметиламиноэтил-метиламино-4-метокси-5-[5-метил-4-(1-метилиндол-3 ил)пиримидин-2-ил]аминофенил)проп-2-енамид Акрилоилхлорид (0,026 мл, 1M в THF, 0,32 ммоль) добавляли по каплям к смеси N1-(2-диметиламиноэтил)-5-метокси-N1-метил-N4-[5-метил-4-(1-метилиндол-3-ил)пиримидин-2-ил]бензол-1,2,4 триамина (промежуточное соединение 81, 147 мг, 0,32 ммоль) и DIPEA (0,061 мл, 0,35 ммоль) в THF (15 мл) при 0C в атмосфере N2. Полученную суспензию перемешивали при 0C в течение 1 ч, затем оставляли нагреваться до к.т. Смесь затем разбавляли водой (15 мл) и концентрировали в вакууме. Полученный материал растворяли в смеси CH2Cl2 (20 мл) и CH3OH (5 мл). Полученный раствор промывали водой и насыщенным рассолом и затем сушили (MgSO4) и концентрировали в вакууме. В результате очистки посредством FCC, элюируя 1-8% 7M метанольного аммиака в CH2Cl2, после концентрирования соответствующих фракций в вакууме получили желтую сухую пленку. Этот материал растворяли в CH2Cl2 и полученный раствор разбавляли диэтиловым эфиром. Этот раствор концентрировали в вакууме и сушили с получением указанного в заголовке соединения (93 мг, 57%) в виде бежевого твердого вещества; 1H ЯМР: 2.21 (6H, s), 2.28-2.34 (2H, m), 2.37 (3H, s), 2.73 (3H, s), 2.89 (2H, t), 3.81 (3H, s), 3.89 (3H, s), 5.72(1H, dd), 6.19 (1H, dd), 6.38 (1H, dd), 7.02 (1H, d), 7.06 (1H, d), 7.18-7.23 (1H, m), 7.48 (1H, d), 7.91 (1H, s),8.06 (1H, s), 8.22 (1H, s), 8.36 (1H, d), 8.75 (1H, s), 10.11 (1H, s); m/z: ES+ MH+ 514,36. Пример 20. N-(2-(3R)-3-диметиламинопирролидин-1-ил-4-метокси-5-[5-метил-4-(1-метилиндол 3-ил)пиримидин-2-ил]аминофенил)проп-2-енамид Акрилоилхлорид (0,043 мл, 1M в THF, 0,53 ммоль) добавляли по каплям к смеси 4-[(3R)-3-диметиламинопирролидин-1-ил]-6-мегокси-N-[5-метил-4-(1-метилиндол-3-ил)пиримидин-2-ил]бензол-1,3-диамина (промежуточное соединение 83, 252 мг, 0,53 ммоль) и DIPEA (0,103 мл, 0,59 ммоль) в THF (15 мл) при 0C в атмосфере N2. Полученную суспензию перемешивали при 0C в течение 1 часа и затем оставляли нагреваться до к.т. Смесь затем разбавляли водой (15 мл) и концентрировали в вакууме. Полученный материал растворяли в смеси CH2Cl2 (20 мл) и CH3OH (5 мл). Полученный раствор промывали водой и насыщенным рассолом. Водные промывки снова экстрагировали три раза с использованием CH2Cl2. Объединенные органические растворы сушили (MgSO4) и концентрировали в вакууме. В результате очистки посредством FCC, элюируя 1-8% CH3OH в CH2Cl2, после концентрирования соответствующих фракций в вакууме получили желтую сухую пленку. Этот материал растворяли в CH2Cl2 и полученный раствор разбавляли диэтиловым эфиром. Полученную смесь перемешивали в течение 30 мин и затем концентрировали в вакууме с получением указанного в заголовке соединения (133 мг, 47%) в виде желтого твердого вещества; 1H ЯМР: 1.67-1.81 (1H, m), 2.09 (1H, s), 2.19 (6H, s), 2.35 (3H, s), 2.72 (1H, s), 3.20m/z: ES+ MH+ 526,66. Пример 21. N-(5-[5-Хлор-4-(1-метилиндол-3-ил)пиримидин-2-ил]амино-2-(3R)-3-диметиламинопирролидин-1-ил-4-метоксифенил)проп-2-енамид Акрилоилхлорид (0,459 мл, 1M в THF, 0,46 ммоль) при 0C под N2 добавляли по каплям к смеси N[5-хлор-4-(1-метилиндол-3-ил)пиримидин-2-ил]-4-[(3R)-3-диметиламинопирролидин-1-ил]-6-метоксибензол-1,3-диамина (промежуточное соединение 85, 226 мг, 0,46 ммоль) и DIPEA (0,088 мл, 0,51 ммоль) в THF (15 мл). Полученную суспензию перемешивали при 0C в течение 1 ч, затем оставляли нагреваться до к.т. Смесь затем разбавляли водой (15 мл) и концентрировали в вакууме. Полученный материал растворяли в смеси CH2Cl2 (20 мл) и CH3OH (5 мл). Полученный раствор промывали водой и насыщ. рассолом. Органический раствор сушили (MgSO4) и концентрировали в вакууме. В результате очистки посредством FCC с элюированием 1-8% 7M метанольного аммиака в CH2Cl2 и после концентрирования соответствующих фракций в вакууме получали желтую сухую пленку. Этот материал растворяли вCH2Cl2 и полученный раствор разбавляли диэтиловым эфиром. В результате получали желтое студенистое твердое вещество, выпадавшее в осадок из раствора. Смесь концентрировали в вакууме и сушили с получением указанного в заголовке соединения (142 мг, 57%) в виде желтого твердого вещества; 1H ЯМР: 1.68-1.81 (1H, m), 2.04-2.14 (1H, m), 2.18 (6H, s), 2.64-2.75 (1H, m), 3.22 (3H, dd), 3.32-3.44 (1H, m),- 29
МПК / Метки
МПК: C07D 471/04, A61K 31/506, A61K 31/437, C07D 401/02, A61P 35/00
Метки: модуляторов, рака, фармацевтически, n-(2-{2-диметиламиноэтил-метиламино}-4-метокси-5-{[4-(1-метилиндол-3-ил)пиримидин-2-ил]амино}фенил)проп-2-енамид, полезных, egfr, качестве, лечения, приемлемые, соли
Код ссылки
<a href="https://eas.patents.su/30-24421-n-2-2-dimetilaminoetil-metilamino-4-metoksi-5-4-1-metilindol-3-ilpirimidin-2-ilaminofenilprop-2-enamid-i-ego-farmacevticheski-priemlemye-soli-v-kachestve-modulyatorov-egfr-poleznyh.html" rel="bookmark" title="База патентов Евразийского Союза">N-(2-{2-диметиламиноэтил-метиламино}-4-метокси-5-{[4-(1-метилиндол-3-ил)пиримидин-2-ил]амино}фенил)проп-2-енамид и его фармацевтически приемлемые соли в качестве модуляторов egfr, полезных для лечения рака</a>
Предыдущий патент: Сигарета, снабженная воспламенительным устройством
Следующий патент: Фармацевтически приемлемые сокристаллы n-[2-(7-метокси-1-нафтил)этил]ацетамида и способы их получения
Случайный патент: Соединения на основе пиридина и пиримидина в качестве ингибиторов сигнального пути wnт для лечения рака


































