Производные пиридазино [4,5-b] хинолин-5-оксида или их фармацевтически приемлемые соли, их применение в качестве антагонистов глицина, фармацевтическая композиция, способ получения производных пиридазино [ 4,5-b] хинолин-5-оксида или их соли холина
Номер патента: 1711
Опубликовано: 25.06.2001
Авторы: Рожков Евгений, Даниш Войцех, Гольд Маркус, Пискунова Ирина, Калвиньш Иварс, Парсонс Кристофер Грэхам Рафаэль
Формула / Реферат
1. Производные пиридазино[4,5-b]хинолин-5-оксида общей формулы
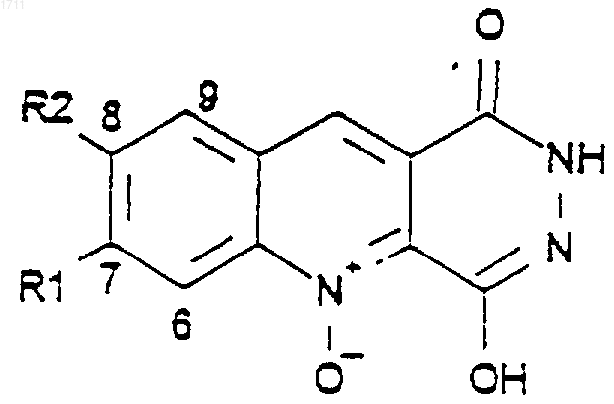
где R1 и R2 выбирают из группы, включающей водород, галоген и метокси, или где R1 и R2 вместе образуют метилендиокси, или их фармацевтически приемлемые соли.
2. Соединение по п.1, где соль выбирают из соли холина и соли 4-тетраметиламмония.
3. Соединение по п.1, которое выбирают из группы, включающей
4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]хинолин-5-оксид,
8-хлор-4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]хинолин-5-оксид,
8-бром-4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]хинолин-5-оксид,
8-фтор-4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]хинолин-5-оксид,
7,8-дихлор-4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]хинолин-5-оксид,
7-бром-8-хлор-4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]хинолин-5-оксид и
7-хлор-8-бром-4-гидрокси-1-оксо-1,2-дигидропиридазино-[4,5-b]хинолин-5-оксид и
фармацевтически приемлемую соль любого из вышеперечисленных соединений.
4. Соединение по п.2, которое выбирают из группы, включающей
соль 4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]хинолин-5-оксид-холина,
соль 8-хлор-4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]хинолин-5-оксид-холина,
соль 8-бром-4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]хинолин-5-оксид-холина,
соль 8-фтор-4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]хинолин-5-оксид-холина,
соль 7,8-дихлор-4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]хинолин-5-оксид-холина,
соль 7-бром-8-хлор-4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]хинолин-5-оксид-холина и
соль 7-хлор-8-бром-4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]хинолин-5-оксид-холина.
5. Фармацевтическая композиция, содержащая в качестве активного ингредиента эффективное по отношению к глицинB антагонистическое количество соединения по п.1 вместе с фармацевтически приемлемым носителем или разбавителем.
6. Фармацевтическая композиция по п.5, содержащая в качестве активного ингредиента соединение по п.1 в форме соли холина.
7. Фармацевтическая композиция по п. 5, содержащая соединение, выбранное из группы, включающей
4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]-хинолин-5-оксид,
8-хлор-4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]хинолин-5-оксид,
8-бром-4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]хинолин-5-оксид,
8-фтор-4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]хинолин-5-оксид,
7,8-дихлор-4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]хинолин-5-оксид,
7-бром-8-хлор-4-гидрокси-1-оксо-1,2-дигидропиридазино-[4,5-b]хинолин-5-оксид и
7-хлор-8-бром-4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]-хинолин-5-оксид
или фармацевтически приемлемую соль любого из вышеперечисленных соединений.
8. Фармацевтическая композиция по п.6, содержащая в качестве соли холина эффективное количество соединения, выбранного из группы, включающей
соль 4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]хинолин-5-оксид-холина,
соль 8-хлор-4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]хинолин-5-оксид-холина,
соль 8-бром-4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]хинолин-5-оксид-холина,
соль 8-фтор-4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]хинолин-5-оксид-холина,
соль 7,8-дихлор-4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]хинолин-5-оксид-холина,
соль 7-бром-8-хлор-4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]хинолин-5-оксид-холина и
соль 7-хлор-8-бром-4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]хинолин-5-оксид-холина.
9. Применение соединения по п.1 для производства лекарственного препарата для борьбы с неврологическими нарушениями, связанными с эксцитотоксичностью и дисфункцией глутаматергической нейротрансмиссии в живом животном, при содержании в указанном препарате соединения по п.1 в эффективном по отношению к глицинB антагонистическом количестве.
10. Применение по п.9, при котором используется соединение по п.1 в форме соли холина.
11. Применение по п.9, при котором используется соединение, выбранное из группы, включающей
4-гидрокси-1-оксо-1,2-дигидропиридазино [4,5-b] хинолин-5-оксид,
8-хлор-4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]хинолин-5-оксид,
8-бром-4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]хинолин-5-оксид,
8-фтор-4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]хинолин-5-оксид,
7,8-дихлор-4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]хинолин-5-оксид,
7-бром-8-хлор-4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]хинолин-5-оксид и
7-хлор-8-бром-4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]хинолин-5-оксид
или фармацевтически приемлемая соль любого из вышеперечисленных соединений.
12. Применение по п.10, при котором используется соединение, выбранное из группы, включающей
соль 4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]хинолин-5-оксид-холина,
соль 8-хлор-4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]хинолин-5-оксид-холина,
соль 8-бром-4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]хинолин-5-оксид-холина,
соль 8-фтор-4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]хинолин-5-оксид-холина,
соль 7,8-дихлор-4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]хинолин-5-оксид-холина,
соль 7-бром-8-хлор-4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]хинолин-5-оксид-холина и
соль 7-хлор-8-бром-4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]хинолин-5-оксид-холина.
13. Способ получения производных пиридазино[4,5-b]хинолин-5-оксида и их фармацевтически приемлемых солей по п.1, включающий стадию превращения диметил хинолин-2,3-дикарбоксилат-1-оксида в соль гидразина реакцией с гидразин-гидратом и гидролиз образующейся соли гидразина с последующим получением в случае необходимости соответствующей фармацевтически приемлемой соли.
14. Способ по п.13, где полученный 4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b] хинолин-5-оксид превращают в его соль холина реакцией с гидроокисью холина.
Текст
1 Область изобретения Новые химические соединения, которые являются пиридо-фталазин-дионами, содержащие их фармацевтические композиции и их применение при неврологических нарушениях,связанных с эксцитотоксичностью и дисфункцией глутаматергической нейротрансмиссии. Обоснование изобретения и предшествующий уровень техники Глутамат является, вероятно, основным стимулирующим медиатором в центральной нервной системе, но, кроме того, возможно, вовлекается во многие патологические и эксцитотоксичные процессы. И, как таковой, представляет большой интерес при получении антагонистов глутамата для терапевтического применения (см., Danysz W, et.al., 1995, Drug NewsPerspectives, 8, pp.261 -277, для обзора). Глутамат активирует три основных типа ионотропного (ионотропического) рецептора, а именно, амино-3-гидрокси-5-метил-4-изоксазолпропионовую кислоту (АМРА), каинат и N-метил-Dаспартат (NMDA) и некоторые типы метаботропических рецепторов. Антагонизм NMDA рецепторов потенциально имеет широкую область терапевтического применения. Функциональное ингибирование NMDA рецепторов может быть достигнуто через воздействие на различные участки распознавания, такие как участок первичного медиатора, нечувствительный к стрихнину участок глицина (глицинВ), участок полиамина и участок фенциклидина, локализованный внутри катионного канала. Десенсибилизация рецептора может представлять физиологический процесс, который служит механизмом эндогенного регулирования для предотвращения долговременной нейротоксичной активации глутамат-рецепторов, но допускает их временную физиологическую активацию. В случае NMDA рецептора совместным агонистом глицина является эндогенный лиганд,ингибирующий такую десенсибилизацию путем активации участка глицинаB. Интересно, что ишемия повышает не только концентрацию внеклеточного глутамата, но также концентрацию глицина и, хотя этот последний эффект является менее явным, он в действительности сохраняется много дольше. Следовательно, некоторые полные глицинB-антагонисты могут восстанавливать нормальную синаптическую передачу в таких условиях путем повышенияNMDA рецепторной десенсибилизации до ее физиологического уровня. В действительности,на основании общего введения лабораторным животным, было выдвинуто предположение, что глицинВ-антагонисты могут давать большее терапевтическое окно, чем агенты, действующие на другие участки распознавания NMDA рецепторного комплекса. К сожалению, плохие фармако-кинетические свойства большинства глицинB-антагонистов, до самого последнего времени, исключали четкую проверку этого пред 001711 2 положения после общего введения. Однако сообщается, что некоторые глицинВ-антагонисты имеют очень хорошие терапевтические индексы после общего введения в моделях гипералгезии и в качестве транквилизаторов (анксиолитиков). Настоящее изобретение Заявителями получен ряд трициклическихN-оксид-производные этих соединений, и они не описаны и не выдвинуты в качестве возможных соединений в патенте Zeneca. Соединения класса II также являются сильными антагонистами глицинаB in vitro (в лабораторном сосуде) и проявляют значительно большую in vivo (в живом организме) общую усвояемость и/или проникновение через гематоэнцефалический барьер, чем соединения класса I. Кроме того,солевые производные этих соединений получают, к примеру, добавлением холина и 4 тетраметиламмония (4-NН 3), дополнительно улучшая биоприменимость. Новые соединения по данному изобретению имеют прогнозируемое применение в лечении следующих болезней. 1. Острая эксцитотоксичность, такая как ишемия во время внезапного приступа, травма,гипоксия, гипогликемия и печеночная энцефалопатия (гепатаргия). 2. Хронические нейродегенеративные заболевания, такие как болезнь Альцгеймера, васкулярное слабоумие, болезнь Паркинсона, болезнь Huntington', рассеянный склероз, боковой амиотрофический склероз, СПИД-нейродегенерация, оливопонтоцеребеллярная дистрофия,синдром Tourette', мотонейронная болезнь, митохондриальная дисфункция, синдром Корсакова и болезнь Крейтцфельда-Якоба. 3. Другие болезни, связанные с длительными восстановительными изменениями в центральной нервной системе, такие как хроническая боль, толерантность к лекарственному средству, лекарственная зависимость и привыкание к чрезмерному употреблению лекарственных средств (например, к опиатам, кокаину,бензодиазепинам и алкоголю) и поздняя дискинезия. 4. Эпилепсия (распространенный и парциальный комплексный эпилептические припадки), шизофрения, боязнь, депрессия, острая боль, мышечная спастичность и шум в ушах. Цели изобретения Цель изобретения состоит в получении новых и более эффективных соединений пиридофталазин-диона, их фармацевтических композиций и разработке способа лечения ими неврологических нарушений, связанных с эксцитотоксичностью и дисфункцией глутаматергической нейротрансмиссии. Дальнейшая цель изо 3 бретения состоит в получении таких новых соединений, композиций и способа, которые соответствуют вышеуказанным теоретическим требованиям. Дополнительные цели будут выявлены ниже, а еще другие цели изобретения очевидны для любого специалиста в соответствующей области. Краткое описание изобретения Итак, изобретение включает следующие аспекты, среди прочего, отдельно или в комбинации. Соединение, которое выбирают из тех пиридил-фталазин-дионов, что имеют следующую формулу: где R1 и R2 выбирают из группы, включающей водород, галоген и метокси, или где R1 и R2 вместе образуют метилендиокси, и его фармацевтически приемлемые соли; такое соединение, соль которого выбирают из его соли с холином или 4-тетраметиламмонием; такое соединение, которое выбирают из группы, включающей 4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]хинолин-5-оксид,8-хлор-4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b] хинолин-5-оксид,8-бром-4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b] хинолин-5-оксид,8-фтор-4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]хинолин-5-оксид,7,8-дихлор-4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b] хинолин-5-оксид,7-бром-8-хлор-4-гидрокси-1-оксо-1,2 дигидропиридазино[4,5-b]хинолин-5-оксид и 7-хлор-8-бром-4-гидрокси-1-оксо-1,2 дигидропиридазино[4,5-b]хинолин-5-оксид и фармацевтически приемлемую соль любого из вышеперечисленных соединений; и такое соединение, которое выбирают из группы,включающей соль 4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b] хинолин-5-оксид-холина,соль 8-хлор-4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]хинолин-5-оксид-холина,соль 8-бром-4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]хинолин-5-оксид-холина,соль 8-фтор-4-гидрокси-1-оксо-1,2-дигидропиридазино [4,5-b]хинолин-5-оксид-холина,соль 7,8-дихлор-4-гидрокси-1-оксо-1,2 дигидропиридазино[4,5-b]хинолин-5-оксидхолина,соль 7-бром-8-хлор-4-гидрокси-1-оксо-1,2 дигидропиридазино[4,5-b]хинолин-5-оксидхолина и 4 соль 7-хлор-8-бром-4-гидрокси-1-оксо-1,2 дигидропиридазино[4,5-b]хинолин-5-оксидхолина. Кроме того, фармацевтическая композиция, содержащая в качестве активного ингредиента такое соединение в эффективном глицинBантагонистическом количестве; такая фармацевтическая композиция, содержащая в качестве активного ингредиента такое соединение, в эффективном глицинB-антагонистическом количестве, в форме соли холина; такая фармацевтическая композиция, содержащая в качестве активного ингредиента соединение, в эффективном глицинB-антагонистическом количестве, которое выбирают из группы, включающей 4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b] хинолин-5-оксид,8-хлор-4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]хинолин-5-оксид,8-бром-4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]хинолин-5-оксид,8-фтор-4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]хинолин-5-оксид,7,8-дихлор-4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]хинолин-5-оксид,7-бром-8-хлор-4-гидрокси-1-оксо-1,2 дигидропиридазино[4,5-b]хинолин-5-оксид и 7-хлор-8-бром-4-гидрокси-1-оксо-1,2 дигидропиридазино[4,5-b]хинолин-5-оксид или фармацевтически приемлемую соль любого из вышеперечисленных соединений; и такая фармацевтическая композиция, содержащая в качестве активного ингредиента соединение, в эффективном глицинB-антагонистическом количестве, которое выбирают из группы,включающей соль 4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]хинолин-5-оксид-холина,соль 8-хлор-4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]хинолин-5-оксид-холина,соль 8-бром-4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]хинолин-5-оксид-холина,соль 8-фтор-4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]хинолин-5-оксид-холина,соль 7,8-дихлор-4-гидрокси-1-оксо-1,2 дигидропиридазино[4,5-b]хинолин-5-оксидхолина,соль 7-бром-8-хлор-4-гидрокси-1-оксо-1,2 дигидропиридазино[4,5-b]-хинолин-5-оксидхолина и соль 7-хлор-8-бром-4-гидрокси-1-оксо-1,2 дигидропиридазино[4,5-b]хинолин-5-оксидхолина. Далее, способ борьбы с неврологическими нарушениями, связанными с эксцитотоксичностью и дисфункцией глутаматергической нейротрансмиссии в живом животном, включающий стадию введения требующему лечения живому животному такого соединения или фармацевтической композиции, в эффективном глицинB-антагонистическом количестве, такой спо 5 соб, где соединение существует в форме соли холина; такой способ, где соединение выбирают из группы, включающей 4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]-хинолин-5-оксид,8-хлор-4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]хинолин-5-оксид,8-бром-4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]хинолин-5-оксид,8-фтор-4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]хинолин-5-оксид,7,8-дихлор-4-гидрокси-1-оксо-1,2 дигидропиридазино[4,5-b]хинолин-5-оксид,7-бром-8-хлор-4-гидрокси-1-оксо-1,2 дигидропиридазино[4,5-b]хинолин-5-оксид и 7-хлор-8-бром-4-гидрокси-1-оксо-1,2 дигидропиридазино[4,5-b]хинолин-5-оксид или фармацевтически приемлемую соль любого из вышеперечисленных соединений; и такой способ борьбы с неврологическими нарушениями, связанными с эксцитотоксичностью и дисфункцией глутаматергической нейротрансмиссии в живом животном, включающий стадию введения требующему лечения живому животному соединения, в эффективном глицинВ-антагонистическом количестве, которое выбирают из группы, включающей соль 4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]хинолин-5-оксид-холина,соль 8-хлор-4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]хинолин-5-оксид-холина,соль 8-бром-4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]хинолин-5-оксид-холина,соль 8-фтор-4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]хинолин-5-оксид-холина,соль 7,8-дихлор-4-гидрокси-1-оксо-1,2 дигидропиридазино[4,5-b]хинолин-5-оксидхолина,соль 7-бром-8-хлор-4-гидрокси-1-оксо-1,2 дигидропиридазино[4,5-b]хинолин-5-оксидхолина и соль 7-хлор-8-бром-4-гидрокси-1-оксо-1,2 дигидропиридазино[4,5-b]хинолин-5-оксидхолина. Подробное описание изобретения Подразумевается, что последующее обсуждение, примеры и фармакология приведены с целью иллюстрации данного изобретения, а не в порядке ограничения. Способы и результаты Основная структура трициклических "пиридо-фталазин-дионов" класса I и класса II: 6 Химия Основной способ получения диметил-хинолин 2,3-дикарбоксилат-1-оксидов (3) Охлажденный раствор (ледяная баня) 2 нитробензальдегида 1 (25 мМ) и натрия (27 мМ) в безводном метаноле (40 мл) обрабатывают в течение 30 мин раствором диметил (диэтоксифосфинил) сукцината 2 (30 мМ, получен как описано Linke et al., Lieb. Ann. Chem., 1980(4),542) в безводном метаноле (10 мл). Полученный темный раствор перемешивают при 0-5 С в течение 1,5 ч, растворитель упаривают при пониженном давлении и остаток распределяется между этилацетатом и водой. Этилацетат сушат над сульфатом натрия и затем упаривают при пониженном давлении. Остаток перекристаллизовывают из изопропанола, получая указанный в заглавии диметил хинолин-2,3-дикарбоксилат 1-оксид 3 в виде не совсем белого (или светложелтого) порошка. 1 Физические свойства и Н-ЯМРспектральные данные для соединений 3 приведены в таблицах 1 и 2. а. 5-Бром-4-хлор-2-нитробензальдегид (1f). К смеси серной кислоты (40 мл) и нитрата натрия (2,66 г, 31,3 мМ) при 0-5 С добавляют 3 бром-4-хлорбензальдегид (6,25 г, 28,5 мМ). Полученную смесь перемешивают при комнатной температуре в течение 7 часов и разбавляют ледяной водой (300 мл). Осажденные твердые продукты отфильтровывают, промывают водой и сушат, получая порошок. Перекристаллизация этого соединения из смеси изопропанола и водыH-ЯМР (СDСl3), : 8,02 (с, 1 Н), 8,43 (с,1 Н), 10,39 (с,1 Н). Основной способ получения диметил хинолин 2,3-дикарбоксилатов (7) Раствор N-оксида 3 (10 мМ) и трихлорида фосфора (30 мМ) в безводном хлороформе (100 мл) нагревают до температуры кипения с обратным холодильником в течение 7 ч. Растворитель удаляют при пониженном давлении и остаток распределяется между этилацетатом и водой. 7 Органический слой сушат над сульфатом натрия и затем упаривают при пониженном давлении. Остаток перекристаллизовывают из изопропанола, получая указанный в заглавии диметил хинолин-2,3-дикарбоксилат 7 в виде не совсем белого (или светло-желтого) порошка. 1 Физические свойства иH-ЯМРспектральные данные для соединений 7 приведены в таблицах 3 и 4. Основной способ получения 4-гидрокси-1-оксо 1,2-дигидропиридазино[4,5-b]хинолин-5 оксидов (5) К перемешиваемому раствору (или суспензии) диметил хинолин-2,3-дикарбоксилат-1 оксид 3 (5 мМ) в кипящем этаноле (25 мл) в атмосфере аргона добавляют гидразин-гидрат (15 мМ) и смесь нагревают до температуры кипения с обратным холодильником в течение 3 ч, за это время образуется темный осадок. После охлаждения до комнатной температуры реакционную смесь отфильтровывают, и собранные твердые продукты промывают этанолом и диэтиловым эфиром и сушат, получая соль гидразина 4. Это вещество перемешивают при 70-110 С 3 ч в уксусной кислоте (15 мл) и, после охлаждения до комнатной температуры, смесь разбавляют водой (45 мл) и затем фильтруют, чтобы собрать твердые продукты. Собранные твердые продукты промывают этанолом и сушат, получая темно-желтое твердое вещество. Несколько перекристаллизаций этого продукта из диметилформамида дают указанный в заглавии пиридазино[4,5-b]хинолин-5-оксид 5 в виде оранжевого порошка. 1 Физические свойства иH-ЯМРспектральные данные для соединений 5 приведены в таблицах 5 и 6. Основной способ получения 1,4-диоксо-1,2,3,4 тетрагидропиридазино[4,5-b] хинолинов (9) К перемешиваемому раствору (или суспензии) диметил хинолин-2,3-дикарбоксилата 7 (5 мМ) в кипящем этаноле (25 мл) добавляют гидразин-гидрат (30 мМ) и смесь нагревают до температуры кипения с обратным холодильником в течение 8 ч, за это время образуется осадок. После охлаждения до комнатной температуры реакционную смесь отфильтровывают, и собранные твердые продукты промывают этанолом и диэтиловым эфиром и сушат, получая соль гидразина 8. Это вещество перемешивают при 70-100 С 3 ч в уксусной кислоте (15 мл) и,после охлаждения до комнатной температуры,смесь разбавляют водой (45 мл) и затем фильтруют, чтобы собрать твердые продукты. Собранные твердые продукты промывают этанолом и диэтиловым эфиром и сушат, получая указанный в заглавии пиридазино[4,5-b] хинолин 9 в виде желтого порошка. 1 Физические свойства иH-ЯМРспектральные данные для соединений 9 приведены в таблицах 7 и 8. 8 Основной способ получения солей 4-гидрокси-1 оксо-1,2-дигидропиридазино[4,5-b]хинолин-5 оксид-холина (6) и солей 1,4-диоксо-1,2,3,4 тетрагидропиридазино[4,5-b]хинолин-холина (10) К перемешиваемой суспензии пиридазино[4,5-b] хинолина 9 или N-оксида 5 (10 мМ) в метаноле (50 мл) добавляют гидроокись холина(10,5 мМ, 45 вес.% раствор в метаноле). Полученный раствор концентрируют, используя роторный испаритель, и твердый остаток перекристаллизовывают из этанола, получая указанную в заглавии соль холина 10 или 6 в виде гигроскопичного оранжевого (или красного) порошка. Физические свойства и 1H-ЯМР-спектральные данные для соединений 6 и 10 приведены в таблицах 9, 10 и 11, 12, соответственно. Таблица 2. 1H-ЯМР (СDСl3)-спектральные данные для соединений 3 9 Таблица 4. 1H-ЯМР (CDCl3)-спектральные данные для соединений 7 10 Таблица 10. 1H-ЯМР (CD3OD)-спектральные данные для солей холина 6 Таблица 6. 1H-ЯМР (ДМСО-d6) -спектральные данные для соединений 5 Таблица 12. 1H-ЯМР(CD3 ОD)-спектральные данные для солей холина 10 Таблица 8. 1H-ЯМР (ДМСО-d6) - спектральные данные для соединений 9In vitro Изучение рецепторного связывания Получение мембран и определение белка Препарирование ткани осуществляют согласно Foster A.C.Wong EHF, 1987, Brit.J.Pharmacol. 91, pp. 403-409. Самцов SpragueDawley крыс (200-250 г) обезглавливают и быстро удаляют головной мозг. Кору головного мозга расслаивают и гомогенизируют в 20 объемах охлажденной льдом 0,32 М сахарозы, используя стекло-тефлоновый гомогенизатор. Гомогенат центрифугируют при 1000 об/мин в течение 10 мин. Осадок в пробирке после центрифугирования отбрасывают и супернатант центрифугируют при 20 000 об/мин в течение 20 мин. Образовавшийся осадок в пробирке после центрифугирования повторно суспендируют в 20 объемах дистиллированной воды и центрифугируют в течение 20 мин при 8000 об/мин. Затем супернатант и светлый слой кровяного сгустка трижды центрифугируют (48 000 об/мин в течение 20 мин) в присутствии 5 мМ Трис-НСl рН 7,4. Все стадии центрифугирования выполняют при 4 С. После повторного суспендирования в 5 объемах 5 мМ Трис-НСl, рН 7,4 суспензию мембран быстро замораживают при -80 С до дня испытаний. В день испытаний мембраны размораживают и промывают четыре раза путем 11 суспендирования в 5 мМ Трис-НСl, рН 7,4 и центрифугируют при 48.000 об/мин в течение 20 мин. Конечный осадок в пробирке после центрифугирования суспендируют в буфере для испытания. Количество белка в конечном препарате определяют по способу Lowry O.H. et.al., 1951,J. Biol. Med., 90, p.210 с некоторыми модификациями Hartfree E.F., 1972, Analyt.Biochem. 48,рр.422-427. 50 мкл образцов белка (в трех экземплярах) разбавляют до 1 мл дистиллированной водой и обрабатывают 0,9 мл раствора, содержащего 2 г калий-натриевого тартрата и 100 гNа 2 СО 3 в 500 мл 1 н. NaOH и 500 мл воды. Холостой опыт и стандарт (с альбумином бычьей сыворотки) подготавливают таким же образом. Пробирки помещают в водяную баню при 50 С на 10 мин и охлаждают до комнатной температуры. Добавляют 100 мкл раствора, содержащего 2 г калий-натриевого тартрата и 1 г CuSO4 x 5H2O в 90 мл воды и 10 мл 1 н NaOH. Образцы оставляют при комнатной температуре, по меньшей мере, на 10 мин, затем быстро добавляют при перемешивании 3 мл реагента FolinCiocalteu (1 мл реагента разбавляют 15 мл воды). Пробирки вновь нагревают при 50 С в течение 10 мин и охлаждают до комнатной температуры. Затем определяют абсорбцию в 1 см кюветах при 650 нм. Конечная концентрация белка, используемая для изучении, находится в пределах 100-250 мкг/мл. Инкубирование в обоих испытаниях на связывание заканчивают, используя фильтрующую систему Millipore. Образцы, все в тройном экземпляре, промывают трижды при постоянном вакууме 2,5 мл охлажденного льдом буфера для испытаний на фильтрах из стекловолокна,поставляемых SchleicherSchuell . После разделения и промывки фильтры помещают в сцинтиллирующую жидкость (5 мл; UltimaGold) и удерживаемую на фильтрах радиоактивность определяют, используя обычный жидкий сцинтилляционный считчик (Hewlett Packard, Liquid scintillation Analyser). "Общее связывание" представляет абсолютное количество радиолиганда, связанного в отсутствии какихлибо добавок, тогда как "неспецифическое связывание" определяют в присутствии высокой концентрации конкурента. Испытание на [3 Н] 5,7-DCKA-связывание Эксперименты проводят способами, представляющими модификацию предшествующих[3H]5,7-DCKA определяют, добавляя немеченый глицин при 0,1 мМ. Стоп-раствор содержит 10 мМ Трис-НСl и 10 мМ сульфата магния, рН 7,4. 12 Фильтрование выполняют по возможности быстро. Эксперименты по замещению выполняют с фиксированной концентрацией [3 Н]5,7-DCKA,равной 10 нМ. Испытуемые соединения разбавляют водой или ДМСО и добавляют, по меньшей мере, в 5 различных концентрациях. Испытание на связывание [3 Н]глицина Испытание, на связывание [3 Н]глицина выполняют по способу, описанному Kessler M.,et. al., 1989, JJ. Neurochem. 52, pp. 1319-1328. Кортикальные мембраны крыс получают как описано выше и конечные осадки в пробирке после центрифугирования суспендируют в 50 мМ Трис-ацетат, рН 7,4. По меньшей мере, 5 различных концентраций испытуемых соединений инкубируют с 20 нм [3H]глицина в течение 30 мин при 4 С в присутствии 100 мкМ стрихнина. Все соединения растворяют в воде или ДМСО, соответственно. Неспецифическое связывание определяют путем введения 100 мкМ глицина в инкубируемую смесь. Инкубирование обрывают, разбавляя образцы 2 мл стопраствора (50 мМ Трис-HCl, включая 10 мМ сульфата магния, рН 7,4, охлажденный до 2 С) с последующим дополнительным промыванием 2,5 мл буфера. Фильтрование выполняют по возможности быстро. Результаты Восемь из числа исследуемых соединений имеют значения IC50 в [3H] -DCKA-испытании 1 мкМ (см. таблицу 13). Активность шести отобранных соединений в[3H]-глицинсвязывании, на первый взгляд, выше, но это не отражается в больших различиях величин Kd(не приведено). Из пар соединений, представляющих особый интерес, соединения класса II обладают большим сродством в [3 Н]-DCKAиспытании, чем соединения класса I. Это различие не так очевидно в [3 Н] -глицин-испытании.Superior colliculi получают из эмбрионов крыс (Е 20-Е 21) и затем переносят в буферный раствор солей Hank (Gibco), не содержащий 13 кальция и магния. Клетки подвергают механической диссоциации в 0,05% DNAase/0,3% ovomucoid (овомукоид) (Sigma). С последующей 15-минутной преинкубацией с 0,66% трипсин/ 0,1% DNAase (Sigma). Затем диссоциированные клетки центрифугируют при 18G в течение 10 мин, ресуспендируют в минимальном количестве основной среды (Gibco) и высевают при плотности 200000 клеток см-2 на предварительно покрытые поли-L-лизином (Sigma) пластиковые чашки петри (Falcon). Клетки выращивают на основной среде с минимальным количествомNаНСО 3/НЕРЕS-буфера, дополненной 5% сывороткой плода коровы и 5% лошадиной сыворотки (Gibco) и инкубируют при 37 С с 5% СО 2 при влажности 95%. Среду полностью заменяют с последующим ингибированием дополнительного глиального митоза цитозинD-арабинофуранозидом (20 мкМ Sigma) после приблизительно 7 дней in vitro. После чего среду частично меняют дважды в неделю. Культура superiorcolliculus была выбрана для этих экспериментов,поскольку она обеспечивает очень стабильные условия регистрации, которые являются абсолютной предпосылкой для экспериментов по зависимости от напряжения и кинетических экспериментов. Кроме того, относительно небольшие нейроны (нервные клетки) (сома 15-20 мкм ) идеально подходят для минимизации проблем диффузии в буфере для экспериментов кламп-концентрации. Пэтч-кламп регистраторы были изготовлены из этих нейронов с полированными стеклянными электродами (4-6 МОм) по методу целой клетки при комнатной температуре (20-22 С) с добавлением ЕРС-7-усилителя (List). Испытуемые соединения наносят с помощью коммутационных каналов сделанной на заказ системы для быстрого переливания с общим истечением(периоды обмена 10-20 миллисекунд). Состав внутриклеточного раствора следующий (мМ):(0,25); рН доводят до 7,3 с помощью СsОН или НСl. Внутриклеточные растворы имеют следующий основной состав (мМ): NaCl (140), КСl(3), СаСl2 (0,2), глюкоза (10), HEPES (10), сахароза (4,5), тетродотоксин (ТТХ 310-4). В большинстве экспериментов глицин (1 мкМ) присутствует во всех растворах. Эксперименты по испытанию глицин-зависимости трициклических"пиридо-фталазин-дионов" осуществляют при постоянном присутствии возрастающих концентраций глицина (1-10 мкМ). Результаты Пять пар трициклических "пиридофталазин-дионов" имеют значения IC50, по сравнению с внутренними токами для NMDA(200 мкМ), в области низких мкМ и соединения класса II обычно в 2-3 раза более активны, чем соединения класса I (таблица 14 а). Наибольшую активность из них имеют Mrz 2/502 и Mrz 2/514. 14 Этот эффект опосредован на участок глицинаB,как очевидный, путем параллельного сдвига кривых концентрация - ответная реакция в присутствии возрастающих концентраций глицина. Таким образом, величины Kb для Mrz 2/502, как определено по соотношению Cheng-Prusoff, являются одними и теми же в глицине 1, 3 и 10 мкМ (80, 124 и 118 нМ, соответственно). Кроме того, действия Mrz 2/501 и Mrz 2/502 не зависят от напряжения. Все испытанные соединения приблизительно в 3-10 раз более активны по отношению к токам установившегося режима,чем к максимальным токам. Производные холина обладают аналогичными эффективностями относительно свободных кислот in vitro (таблица 14b). В противоположность, из этих сильных антагонистов глицинаB только три являются очень слабыми антагонистами токов, направленных внутрь к АМРА (100 мкМ). Mrz 2/502,Mrz 2/514 и Mrz 2/516 имеют значения IC50 относительно максимальных АМРА-индуцированных токов 25, 73 и 18 мкМ, соответственно,но в значительной степени не активны в отношении платовых токов, все значения IC50100 мкМ (таблица 14 а). Этот профиль активности,хотя очень слабый, является характерным для конкурентных АМРА-рецепторных антагонистов, которые предпочтительно блокируют максимально не десенсибилизированное состояние,состояние низкого сродства рецептора (см. Parson C.G. et.al., 1994, Neuropharmacology 33, pp. 589-604). Таблица 14 а Макси- Плато- Макси- ПлатоMrz вый мальный вый мальный Соединение 2/ АМРА 15 Эксцитотоксичность in vitro Способы Выделение кортикальных нейронов осуществляют аналогично способу, описанному для регистраторов в виде скобки из наклеенного пластыря, за тем исключением, что используют зародыши крыс на 17-19 дни развития плода. Нейроны высевают на пластину с 24 ячейками(Greiner), при плотности 300 000 клеток/ячейка,покрытая поли-D-лизином 0,025 мг/мл. Клетки выращивают в Dulbecco's модифицированной основной среде (DMEM, GIBCO), дополненной 10% термически инактивированной околоплодной серозной жидкости теленка (Gibco). Культуры выдерживают при 37 С и 5% СO2. Среду обновляют первый раз через одну неделю и затем каждые 3 дня, заменяя половину среды,свежей средой. Для экспериментов используют культуры, выдержанные 17 дней. Взаимодействие с ЕАА осуществляют в не содержащей сыворотку МЕМ-N2-среде (Bottenstein J.E. et.al.,1979, Proc. Natl. Acad.Sci. USA 76, pp. 514-517),содержащей 0,5 мМ NMDA, 1 мкМ глицина и испытуемое лекарственное средство. Перед добавлением NMDA, клетки предварительно инкубируют с лекарственными средствами и 1 мкМ глицина в течение 15 мин. Через 24 ч цитотоксический эффект оценивают морфологически под фазово-контрастным микроскопом и оценивают количественно биохимически, измеряя истечение LDH. Активность LDH определяют в супернатанте спустя 24 ч по способу Wroblewski F.LaDue J.S., 1955,Soc. Exp. Biol. Med. 90, p.210). Вкратце, 0,1 мл супернатанта добавляют к 0,9 мл натрий-фосфатного буфера (рН 7,5), содержащего пируват натрия (22,7 мМ) и NADH (0,8 мг/10 мл) при комнатной температуре. Превращение пирувата в лактат регистрируют при 340 нм в течение 10 мин на спектрофотометре Контрона. Результаты Полные кривые концентрация - ответная реакция все же не доступны. Однако, Mrz 2/501 и Mrz 2/502 при низких концентрациях являются эффективными нейрозащитными средствамиin vitro, очевидно, что Mrz 2/502 является более активным в этом отношении (см. таблицу 15).In vivo Противоконвульсивная активность Цель Изучение NMDA-рецепторных антагонистических свойств испытуемых агентов путем оценки противоконвульсивных действий. Дополнительно изучают роль органических кислотных транспортных средств в удалении из 16 головного мозга испытуемых агентов, путем применения ингибитора, пробеницида (Probenicid), продолжительности противоконвульсивного действия. Способы Для NMDA-испытания на летальность (Leander et.al., 1988, Brain Res. 448, p.115) используют самцов мышей альбиносов Swiss (19-21 г),содержащихся по 10-15 на клетку. Для пентилентетразол (PTZ)-индуцируемых конвульсий используют самцов мышей альбиносов Swiss(58 х 38 х 20 см), тогда как в испытаниях на максимальный электрошок (MES) и испытаниях на двигательную недостаточность используютNMR самок мышей (18-28 г), содержащихся по 5 на клетку. Всех животных обеспечивают водой и пищей ад либитум (на усмотрение исполнителя) при 12-часовом цикле день-ночь (день с 6 часов утра) и при контролируемой температуре (200,5C). Все эксперименты выполняют между 10 часами утра и 5 часами дня. Испытуемые соединения впрыскивают внутрибрюшинно(i.p) за 15 мин до стимулирования конвульсий,если не оговорено особо (см. ниже). Mrz 2/502 растворяют в растворе соли, дополненномNaOH. Большинство других агентов растворяют в следующем растворе: 0,606 г Трис; 5,0 г глюкозы; 0,5 г Твин 80 и 95 мл воды. Соли холина и тетраметиламмония растворяют в дистиллированной воде. В испытании на NMDA-индуцируемые конвульсии, на мышах, сначала получают соотношение доза - ответная реакция, чтобы определить дозу ED97, которую затем используют для испытания антагонистических свойств. После впрыскивания ЕD97-дозы NMDA, животных помещают в маленькую клетку (20 х 28 х 14 см) и наблюдают в течение 20 мин. Фармакологической конечной точкой является гибель, которой предшествуют клонические конвульсии и тонические припадки. Пентилентетразол впрыскивают при дозе 90 мг/кг (i.p). Затем подсчитывают наличие общих тонических конвульсий в течение 30 мин,поскольку этот параметр более чувствителен к антагонистам NMDA-рецепторов, чем клонические конвульсии. За фармакологическую конечную точку берут наличие тонуса в задних конечностях при вытягивании.MES (100 Гц, 0,5 с длительность шока, 50 мА шоковая интенсивность, 0,9 мс длительность импульса, Uqo Basile) прикладывают посредством корнеальных электродов. Подсчитывают наличие тонических конвульсий (тоническое вытягивание задних лап с минимальным углом к телу 90). В дополнительном эксперименте мышам впрыскивают пробеницид (200 мг/кг) за 30 мин до введения испытуемых агентов, чтобы определить роль органического кислотного транспортного средства в очищении (длительность действия). Цель состоит в получении зна 17 чений ED50 для всех параметров, оцениваемых использованием теста Litchfield J.T., WilcoxonF., 1949, J. Pharmacol. Exp. Ther. 96, p. 99 для количественной характеристики реакции на дозу. Результаты Из испытанных соединений, только четыре соединения, все класса II, эффективны при i.p. введении в М.Е.S.-испытании (Mrz 2/499, Mrz 2/502, Mrz 2/516 и Mrz 2/514, см. таблицу 16 а). Действующие совместно соединения класса I не активны. Очевидно, все четыре соединения имеют очень короткий полупериод жизни invivo. По-видимому, PTZ-испытание является более чувствительной моделью действия глицинB-антагонистов, вводимых i.p, и, в действительности, те же самые соединения класса II активны при 2-4-кратном снижении доз, тогда как соединения класса I остаются неактивными(таблица 16 а). Соли холина именно этих производных Nоксида (структуры II) имеют ярко выраженную противоконвульсивную активность во всех трех моделях, тогда как их нe-N-оксидные производные либо не активны, либо мало активны (таблица 16b). Кроме того, кажется, что соли холина обладают большей продолжительностью действия. Впрыскивание пробенецида значительно продляет продолжительность противоконвульсивного воздействия всех испытуемых агентов. К примеру, полупериоды жизни соединений 2/514 и 2/570 составляют около 40 и 80 минут,соответственно, в отсутствии пробеницида. В присутствии пробеницида полупериоды жизни продляются до порядка 180 и 210 мин, соответственно. Итак, очевидно, что органические кислотные транспортные средства в хороидальных нервных сплетениях вне головного мозга играют важную роль в кратковременности действия испытуемых соединений. Пробенецид при используемой дозе (200 мг/кг) сам по себе не обладает независимым действием на MESиндуцируемые конвульсии. Микроэлектрофоретическое применение ЕАА агонистов на спинномозговые нейроны invivo. Исследуют способность этих глицинBантагонистов действовать как(внутривенное) введение, по сравнению с ответными реакциями отдельных нейронов в спинном мозге крыс на микроэлектрофоретическое нанесение АМРА и NMDA. Соединения классаNMDA-рецепторными антагонистами in vivo при значениях ID50 1,2 и 1,8 мг/кг i.v, соответственно, тогда как исходные соединения класса I полностью не активны даже при увеличении этих значений до 16 мг/кг i.v. Трех-четырехкратное превышение доз также дает антагонистические ответные реакции на АМРА, хотя это свидетельствует об отсутствии селективности по сравнению с испытаниями in vitro (таблица 17 а). В этой модели соли холина обладают приблизительно равной активностью со свободными кислотами после i.v введения, но слегка более селективны в отношении NMDA по сравнению с АМРА (таблица 17b). Снова, не-Nоксидные производные (соединения класса I) не активны. Обсуждение Четыре соединения класса II, Mrz 2/499,Mrz 2/501, Mrz 2/514 и Mrz 2/516 являются глицинВ-антагонистами in vitro и обладают значительно большей in vivo системной и/или CNS 19 применимостью, чем связанные исходные соединения класса I (Mrz 2/585, Mrz 2/501, Mrz 2/503 и Mrz 2/519). Доступ к CNS является главной проблемой почти для всех глицинBантагонистов, полученных к настоящему времени, но этот новый класс соединений преодолевает это основное препятствие и, следовательно,они являются терапевтически актуальными глицинB-антагонистами. Аддитивные соли Используя вышеизложенные способы, получают аддитивные соли соединений 5, 6, 7, 8, 9 и 10 с четвертичными аминами (к примеру, 4 тетраметиламмонием,4-тетраэтиламмонием),четвертичными аминоспиртами (к примеру, холином) или четвертичными аминокислотами (к примеру, N,N,N-триметилсерином). Соли холина и 4-тетраметиламмония (4-NН 3) существенно улучшают биоприменимость и являются предпочтительными. Фармацевтические композиции Соединения по данному изобретению могут быть переработаны в фармацевтические композиции, включающие фармацевтически приемлемый носитель или разбавитель вдобавок к активному соединению по данному изобретению. Такие композиции могут быть введены живому животному, особенно живому человеку,путем перорального или парентерального способа введения. К примеру, твердые препараты или фармацевтические композиции для перорального введения могут быть взяты в форме капсул, таблеток, пилюль, порошков или гранул. В таких твердых фармацевтических составах активное соединение или его пролекарство смешивают, по меньшей мере, с одним фармацевтически приемлемым разбавителем или носителем, таким как тростниковый сахар, лактоза, крахмал, тальк или синтетические или натуральные смолы, связующим веществом, таким как желатин, смазывающим веществом, таким как стеарат натрия и/или разъединяющим веществом, таким как бикарбонат натрия. Для обеспечения эффекта замедленного высвобождения в фармацевтическую композицию может быть включено такое соединение, как гидроколлоид или другой полимер. Дополнительные вещества,такие как смазывающие вещества или буферы,могут также быть добавлены общепринятым способом. При желании, таблетки, пилюли или гранулы могут быть покрыты энтеросолюбильной оболочкой. Жидкости для перорального применения могут быть в форме липосом,эмульсий, растворов или суспензий, содержащих обычно используемые инертные разбавители, такие как вода. Вдобавок, такие жидкие фармацевтические композиции могут также содержать смачивающие, эмульгирующие, диспергирующие или, вообще, поверхностноактивные агенты, равно как подсластители, отдушки или придающие аромат вещества. 20 Подходящими препаратами для парентерального применения могут быть, среди прочего, стерильные водные и неводные растворы,суспензии, липосомы или эмульсии. В качестве фармацевтически приемлемого разбавителя или носителя могут быть использованы дополнительные вещества, среди которых многие уже известны для этой формы введения фармацевтической композиции. Зависящая от предполагаемого способа введения и продолжительности лечения точная доза активных соединений в препаратах по данному изобретению может быть изменена, главным образом, по усмотрению лечащего врача или ветеринара. Активные агенты данного изобретения, безусловно, могут быть объединены для введения с другими фармакологически активными агентами. В композициях по данному изобретению соотношения активного агента или агентов в композиции могут широко варьироваться, необходимым является только, чтобы активный ингредиент по данному изобретению или его пролекарство составляли или обеспечивали эффективное количество, т.е. такое количество, при котором в выбранной лекарственной форме будет присутствовать подходящая эффективная доза. Очевидно, что несколько лекарственных форм, равно как несколько индивидуальных активных соединений можно вводить одновременно или приблизительно в одно и то же время, или даже в той же самой фармацевтической композиции или в том же фармацевтическом составе. Способ лечения Как указано ранее, соединения по данному изобретению пригодны, особенно, в форме фармацевтических композиций, для перорального или парентерального введения, точные индивидуальные дозы, равно как суточные дозы, в каждом конкретном случае определяются,конечно, в соответствии с хорошо установленными медицинскими и/или ветеринарными принципами и согласно предписаниям лечащего врача или ветеринара. В дополнение к пероральному или парентеральному введению, можно использовать ректальное (прямо кишечное) и/или внутривенное введение, когда используют парентеральное введение, то дозы обычно значительно снижаются, хотя пероральное введение является предпочтительным. Пригодным является количество приблизительно от одного до трех грамм на день в форме повторной или разделенной дозы. Более широкий интервал, порядка 0,5 - 10 г на день, также может быть применен в зависимости от состояния конкретного больного. Хотя найдено, что 500 мг активной основы особенно пригодно для применения в таблетках, индивидуальные дозировки могут варьироваться приблизительно от 200 до 1000 мг, а 500 мг, рекомендуемые для применения в таблетках, можно, 21 конечно, вводить перорально, к примеру, от одного до трех раз в день. Само собой разумеется, что в разовой дозе можно вводить больше,чем одну таблетку, если требуется достичь вышеуказанных рекомендуемых суточных количеств для перорального введения от одного до трех грамм в день. Как уже сказано, соединение по изобретению или его пролекарственная форма могут быть введены живому животному, включая живого человека, любым из многочисленных путей, к примеру, перорально в виде капсул или таблеток, парентерально в форме стерильных растворов или суспензий, или подкожной или внутримышечной имплантацией кусочка ткани,а в некоторых случаях внутривенно в форме стерильных растворов. Другими очевидными способами введения являются кожный, подкожный, транс-буккальный, внутримышечный и внутрибрюшинный, и конкретный способ введения, как обычно, выбирает лечащий врач или ветеринар. Таким образом, установлено, что данное изобретение предлагает новые соединения пиридо-фталазин-диона и содержащие их фармацевтические композиции, а также способ борьбы с неврологическими нарушениями, связанными с эксцитотоксичностью и вследствие этого с дисфункцией глутаматергической нейротрансмиссии, все вместе это дает долгожданное решение ранее существовавшей проблемы,неадекватно решаемой на предшествующем уровне техники. Следует понимать, что данное изобретение не ограничивается соединениями, композициями, способами или методиками, строго соответствующими указанным, поскольку многочисленные модификации и изменения их сразу же становятся очевидными для специалиста в той области техники, к которой это изобретение принадлежит, поэтому данное изобретение следует рассматривать ограниченным только общими рамками объема, которые могут быть установлены на основании приложенных пунктов. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Производные пиридазино[4,5-b]хинолин-5-оксида общей формулы где R1 и R2 выбирают из группы, включающей водород, галоген и метокси, или где R1 и R2 вместе образуют метилендиокси, или их фармацевтически приемлемые соли. 2. Соединение по п.1, где соль выбирают из соли холина и соли 4-тетраметиламмония. 3. Соединение по п.1, которое выбирают из группы, включающей[4,5-b]хинолин-5-оксид,8-хлор-4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]хинолин-5-оксид,8-бром-4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]хинолин-5-оксид,8-фтор-4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]хинолин-5-оксид,7,8-дихлор-4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]хинолин-5-оксид,7-бром-8-хлор-4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]хинолин-5-оксид и 7-хлор-8-бром-4-гидрокси-1-оксо-1,2-дигидропиридазино-[4,5-b]хинолин-5-оксид и фармацевтически приемлемую соль любого из вышеперечисленных соединений. 4. Соединение по п.2, которое выбирают из группы, включающей соль 4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]хинолин-5-оксид-холина,соль 8-хлор-4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]хинолин-5-оксид-холина,соль 8-бром-4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]хинолин-5-оксид-холина,соль 8-фтор-4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]хинолин-5-оксид-холина,соль 7,8-дихлор-4-гидрокси-1-оксо-1,2 дигидропиридазино[4,5-b]хинолин-5-оксидхолина,соль 7-бром-8-хлор-4-гидрокси-1-оксо-1,2 дигидропиридазино[4,5-b]хинолин-5-оксидхолина и соль 7-хлор-8-бром-4-гидрокси-1-оксо-1,2 дигидропиридазино[4,5-b]хинолин-5-оксидхолина. 5. Фармацевтическая композиция, содержащая в качестве активного ингредиента эффективное по отношению к глицинB антагонистическое количество соединения по п.1 вместе с фармацевтически приемлемым носителем или разбавителем. 6. Фармацевтическая композиция по п.5,содержащая в качестве активного ингредиента соединение по п.1 в форме соли холина. 7. Фармацевтическая композиция по п. 5,содержащая соединение, выбранное из группы,включающей 4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]-хинолин-5-оксид,8-хлор-4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]хинолин-5-оксид,8-бром-4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]хинолин-5-оксид,8-фтор-4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]хинолин-5-оксид,7,8-дихлор-4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]хинолин-5-оксид,7-бром-8-хлор-4-гидрокси-1-оксо-1,2-дигидропиридазино-[4,5-b]хинолин-5-оксид и 7-хлор-8-бром-4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]-хинолин-5-оксид или фармацевтически приемлемую соль любого из вышеперечисленных соединений. 8. Фармацевтическая композиция по п.6,содержащая в качестве соли холина эффективное количество соединения, выбранного из группы, включающей соль 4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]хинолин-5-оксид-холина,соль 8-хлор-4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]хинолин-5-оксид-холина,соль 8-бром-4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]хинолин-5-оксид-холина,соль 8-фтор-4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]хинолин-5-оксид-холина,соль 7,8-дихлор-4-гидрокси-1-оксо-1,2 дигидропиридазино[4,5-b]хинолин-5-оксидхолина,соль 7-бром-8-хлор-4-гидрокси-1-оксо-1,2 дигидропиридазино[4,5-b]хинолин-5-оксидхолина и соль 7-хлор-8-бром-4-гидрокси-1-оксо-1,2 дигидропиридазино[4,5-b]хинолин-5-оксидхолина. 9. Применение соединения по п.1 для производства лекарственного препарата для борьбы с неврологическими нарушениями, связанными с эксцитотоксичностью и дисфункцией глутаматергической нейротрансмиссии в живом животном, при содержании в указанном препарате соединения по п.1 в эффективном по отношению к глицинB антагонистическом количестве. 10. Применение по п.9, при котором используется соединение по п.1 в форме соли холина. 11. Применение по п.9, при котором используется соединение, выбранное из группы,включающей 4-гидрокси-1-оксо-1,2-дигидропиридазино 8-фтор-4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]хинолин-5-оксид,7,8-дихлор-4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]хинолин-5-оксид,7-бром-8-хлор-4-гидрокси-1-оксо-1,2 дигидропиридазино[4,5-b]хинолин-5-оксид и 7-хлор-8-бром-4-гидрокси-1-оксо-1,2 дигидропиридазино[4,5-b]хинолин-5-оксид или фармацевтически приемлемая соль любого из вышеперечисленных соединений. 12. Применение по п.10, при котором используется соединение, выбранное из группы,включающей соль 4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]хинолин-5-оксид-холина,соль 8-хлор-4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]хинолин-5-оксид-холина,соль 8-бром-4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]хинолин-5-оксид-холина,соль 8-фтор-4-гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b]хинолин-5-оксид-холина,соль 7,8-дихлор-4-гидрокси-1-оксо-1,2 дигидропиридазино[4,5-b]хинолин-5-оксидхолина,соль 7-бром-8-хлор-4-гидрокси-1-оксо-1,2 дигидропиридазино[4,5-b]хинолин-5-оксидхолина и соль 7-хлор-8-бром-4-гидрокси-1-оксо-1,2 дигидропиридазино[4,5-b]хинолин-5-оксидхолина. 13. Способ получения производных пиридазино[4,5-b]хинолин-5-оксида и их фармацевтически приемлемых солей по п.1, включающий стадию превращения диметил хинолин-2,3 дикарбоксилат-1-оксида в соль гидразина реакцией с гидразин-гидратом и гидролиз образующейся соли гидразина с последующим получением в случае необходимости соответствующей фармацевтически приемлемой соли. 14. Способ по п.13, где полученный 4 гидрокси-1-оксо-1,2-дигидропиридазино[4,5-b] хинолин-5-оксид превращают в его соль холина реакцией с гидроокисью холина.
МПК / Метки
МПК: A61K 31/5025, C07D 471/04, A61P 25/26
Метки: глицина, пиридазино, производных, антагонистов, 4,5-b, холина, качестве, фармацевтическая, способ, получения, применение, соли, хинолин-5-оксида, композиция, фармацевтически, производные, приемлемые
Код ссылки
<a href="https://eas.patents.su/13-1711-proizvodnye-piridazino-45-b-hinolin-5-oksida-ili-ih-farmacevticheski-priemlemye-soli-ih-primenenie-v-kachestve-antagonistov-glicina-farmacevticheskaya-kompoziciya-sposob-polucheniy.html" rel="bookmark" title="База патентов Евразийского Союза">Производные пиридазино [4,5-b] хинолин-5-оксида или их фармацевтически приемлемые соли, их применение в качестве антагонистов глицина, фармацевтическая композиция, способ получения производных пиридазино [ 4,5-b] хинолин-5-оксида или их соли холина</a>
Предыдущий патент: Радиатор с высоким сопротивлением к внутреннему давлению, в частности, для систем отопления
Следующий патент: Способ загрузки или дозагрузки величины денежной суммы на карту-носитель информации
Случайный патент: Трициклические соединения, способ их получения и фармацевтические композиции, которые их содержат












