Производные пиридо[2,3-d]пиримидина и их фармацевтически приемлемые соли, фармацевтическая композиция, обладающая ингибирующей протеин-тирозин-киназу активностью, способ лечения заболеваний, опосредованных клеточной пролиферацией, и способ лечения рака, атеросклероза, псориаза или рестеноза
Номер патента: 897
Опубликовано: 26.06.2000
Авторы: Блэнкли Клифтон Джон, Хэмби Джэймс Марино, Доэрти Эннет Мэриэн, Клачко Сильвестер, Босчелли Дайянэ Хэррис, Пэнек Роберт
Формула / Реферат
1. Производные пиридо[2,3-d]пиримидина общей формулы (I)
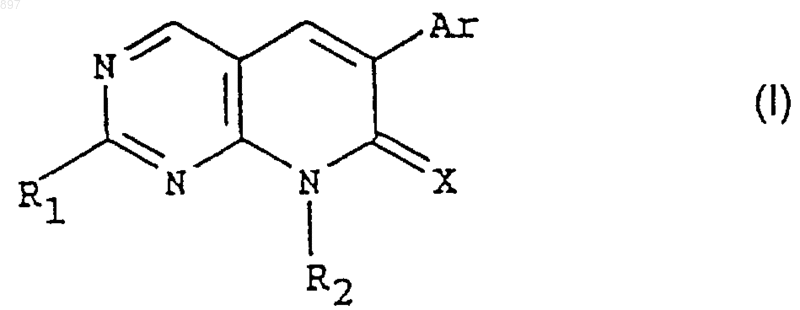
где X означает иминогруппу, N-ацил, кислород или серу;
R1 означает группы NR3R4S(O)mR3, где m является 0,1 или 2, или ОR3;
R2, R3 и R4 независимо означают водород, группу (СН2)nPh, где Ph является фенилом, не замещенным или замещенным 1-3 остатками из группы, включающей галоген, гидроксил, карбоксил, алкил с 1-6 атомами углерода, не замещенный или замещенный гидроксилом, карбоксилом, алкоксикарбонилом с 1-6 атомами углерода в алкоксильной части, аминогруппой, алкиламиногруппой или диалкиламиногруппой с 1-6 атомами углерода в каждой алкильной части и n является 0, 1, 2 или 3, гетероароматический остаток с 4-9 кольцевыми атомами, из которых 1-4 атома выбраны из группы, включающей кислород, азот и серу, циклоалкил с 3-6 атомами углерода, алканоил с 1-6 атомами углерода, алкил с 1-6 атомами углерода, алкенил с 2-6 атомами углерода и алкинил с 2-6 атомами углерода, при этом алкил, алкенил и алкинил могут быть замещены группой NR5R6, где R5 и R6 независимо означают водород, алкил с 1-6 атомами углерода, алкенил с 2-6 атомами углерода, алкинил с 2-6 атомами углерода, группу (СН2)nРh, где Рh и n имеют вышеуказанные значения, циклоалкил с 3-6 атомами углерода, гетероароматический остаток с 4-9 кольцевыми атомами, из которых 1-4 атома выбраны из группы, включающей кислород, азот и серу, или R5 и R6 вместе с атомом азота, с которым они связаны, могут образовать цикл, содержащий 3-7 атомов углерода, в который могут также входить 1, 2 или 3 гетероатома, выбранные из группы, включающей азот, кислород и серу; фенилом, не замещенным или замещенным 1-3 остатками из вышеуказанной группы, тиоалкилом с 1-6 атомами углерода, алкилоксигруппой с 1-6 атомами углерода, гидроксилом, карбоксилом, галогеном или циклоалкилом с 3-6 атомами углерода,
R4 может дополнительно означать группу -С(=O)R3, -С(=O)ОR3, -SO2R3, -SO2NR5R6, -C(=O)NR5R6, -C(=S)NR5R6, -С(=NН)R3, -C(=NH)NR5R6, где R3, R5 и R6 имеют вышеуказанные значения, или
R3 и R4 вместе с атомом азота, с которым они связаны, могут образовывать цикл, содержащий от 3 до 7 атомов углерода, в который могут также входить 1, 2 или 3 гетероатома, выбранные из группы, включающей азот, кислород, и серу,
Аr означает фенил, не замещенный или замещенный 1-3 остатками из группы, включающей галоген, гидроксил, алкил с 1-6 атомами углерода, тиоалкил с 1-6 атомами углерода, алкоксил с 1-6 атомами углерода, трифторметил, тиогруппу, цианогруппу, нитрогруппу, алканоил с 1-6 атомами углерода, алканоилоксигруппу с 1-6 атомами углерода, группу -COOR7, где R7 означает алкил с 1-6 атомами углерода или галоген, и группу -NR5R6, где R5 и R6 имеют вышеуказанное значение, или гетероароматический остаток с 4-9 кольцевыми атомами, из которых 1-4 атома выбраны из группы, включающей кислород, азот и серу,
при условии, что если R2 означает водород, то Х не означает иминогруппу, или их фармацевтически приемлемые соли.
2. Производные пиридо[2,3-d]пиримидина общей формулы (I) по п.1, где Аr означает фенил, двукратно замещенный независимыми остатками из числа галогена и алкила с 1-6 атомами углерода.
3. Производные пиридо[2,3-d]пиримидина по п.2, у которых R2 означает алкил с 1-6 атомами углерода, не замещенный или замещенный остатками, указанными в п. 1.
4. Производные пиридо[2,3-d]пиримидина по п.3, у которых R1 означает группу NR3R4.
5. Производные пиридо[2,3-d]пиримидина по п.4, у которых R3 означает водород.
6. Производные пиридо[2,3-d]пиримидина по п.5, у которых R4 означает водород.
7. Производные пиридо[2,3-d]пиримидина по п.6, у которых Х означает иминогруппу.
8. Производные пиридо[2,3-d]пиримидина общей формулы (I) по п.1, где Х означает кислород, R1 означает NR3R4, где R3 является водородом или алкилом с 1-6 атомами углерода и R4 является алкилом с 1-6 атомами углерода или замещенным алкилом с 1-6 атомами углерода, R2 означает алкил с 1-6 атомами углерода и Аr означает фенил, двукратно замещенный независимыми остатками из числа алкила с 1-6 атомами углерода и галогена.
9. Производные пиридо[2,3-d]пиримидина по п.6, где Х означает кислород.
10. Производные пиридо[2,3-d]пиримидина по п.5, где R4 означает алкил с 1-6 атомами углерода, замещенный группой NR5R6.
11. Производные пиридо[2,3-d]пиримидина по п.10, где R5 и R6 оба являются алкилами с 1-6 атомами углерода.
12. Производные пиридо[2,3-d]пиримидина по п.10, где Х означает иминогруппу.
13. Производные пиридо[2,3-d]пиримидина по п.11, где Х означает кислород.
14. Производные пиридо[2,3-d]пиримидина по п.6, где Х означает серу.
15. Производные пиридо[2,3-d]пиримидина по п.4, где Х означает кислород.
16. Производные пиридо[2,3-d]пиримидина по п.3, где R1 означает ОR3.
17. Производные пиридо[2,3-d]пиримидина по п.16, где Х означает иминогруппу.
18. Производные пиридо[2,3-d]пиримидина по п.16, где Х означает кислород.
19. Производные пиридо[2,3-d]пиримидина по п.3, где R1 является S(O)mR3.
20. Производные пиридо[2,3-d]пиримидина по п.19, где Х означает иминогруппу или кислород.
21. Производные пиридо[2,3-d]пиримидина по п.19, где Х означает N-ацил.
22. Производные пиридо[2,3-d]пиримидина общей формулы (I) по п.1, в котором R1 означает NHPh', где Рh' имеет указанное для Ph значение или означает пиридил, не замещенный или замещенный указанными для фенила остатками, R2 является алкилом с 1-6 атомами углерода, не замещенным или замещенным указанными остатками, Х означает кислород или иминогруппу и Аr означает фенил, двукратно замещенный независимыми остатками из числа алкила с 1-6 атомами углерода и галогена.
23. Производные пиридо[2,3-d]пиримидина общей формулы (I) по п.1, где R1 означает группу NHR4, где R4 является фенилом, не замещенным или замещенным указанными остатками, R2 означает алкил с 1-6 атомами углерода, не замещенный или замещенный указанными остатками, и Х означает иминогруппу или кислород.
24. Производные пиридо[2,3-d]пиримидина общей формулы (I) по п.1, где R3 означает водород и R4 означает циклоалкил.
25. Производные пиридо[2,3-d]пиримидина по п.1, представляющие
6-(2,6-дихлорфенил)-8-метил-2-[3-(4-метилпиперазин-1-ил)пропиламино]-8Н-пиридо[2,3-d]пиримидин-7-он;
6-(2,6-дихлорфенил)-8-метил-2-метиламино-8Н-пиридо[2,3-d]пиримидин-7-он;
6-(2,6-дихлорфенил)-2-диметиламино-8-метил-8Н-пиридо[2,3-d]пиримидин-7-он;
6-(2,6-дихлорфенил)-2-этиламино-8-метил-8Н-пиридо[2,3-d]пиримидин-7-он;
6-(2,6-дихлорфенил)-2-этиламино-8-метил-8Н-пиридо[2,3-d]пиримидин-7-он;
6-(2,6-дихлорфенил)-2-(2-гидроксиэтиламино)-8-метил-8Н-пиридо-[2,3-d]пиpимидин-7-oн;
6-(2,6-дихлорфенил)-2-изопропиламино-8-метил-8Н-пиридо[2,3-d]пиримидин-7-он;
2-бутиламино-6-(2,6-дихлорфенил)-8-метил-8Н-пиридо[2,3-d]пиримидин-7-он;
2-бензиламино-6-(2,6-дихлорфенил)-8-метил-8Н-пиридо[2,3-d]пиримидин-7-он;
6-(2,6-дихлорфенил)-8-метил-2-(3-морфолин-4-илпропиламино)-8Н-пиpидo[2,3-d]пиpимидин-7-oн;
6-(2,6-дихлорфенил)-2-[2-(3,4-диметоксифенил)этиламино]-8-метил-8H-пиpидo[2,3-d]пиpимидин-7-oн;
6-(2,6-дихлорфенил)-8-метил-2-[(пиридин-2-илметил)амино]-8Н-пиридо[2,3-d]пиримидин-7-он;
6-(2,6-дихлорфенил)-8-метил-2-[(пиридин-3-илметил)амино]-8Н-пиpидo[2,3-d]пиpимидин-7-oн;
6-(2,6-дихлорфенил)-8-метил-2-(2-пиридин-2-илэтиламино)-8Н-пиридо[2,3-d]пиримидин-7-он;
6-(2,6-дихлорфенил)-2-{3-[4-(2-метоксифенил)пиперазин-1-ил]пропиламино}-8-метил-8Н-пиридо[2,3-d]пиримидин-7-он;
6-(2,6-дихлорфенил)-8-метил-2-[4-(4-метилпиперазин-1-ил)бутиламинo]-8H-пиpидo[2,3-d]пиpимидин-7-oн;
сложный трет-бутиловый эфир 6-[6-(2,6-дихлорфенил)-8-метил-7-окco-7,8-дигидpoпиpидo[2,3-d]пиpимидин-2-илaминo]кaпpoнoвoй кислоты;
6-[6-(2,6-дихлорфенил)-8-метил-7-оксо-7,8-дигидропиридо[2,3-d]пиримидин-2-иламино]капроновую кислоту;
6-(2,6-дихлорфенил)-8-этил-2-[3-(4-метилпиперазин-1-ил)пропиламино]-8Н-пиридо[2,3-d]пиримидин-7-он;
6-(2,6-дихлорфенил)-8-метил-2-[5-(4-метилпиперазин-1-ил)пентиламино]-8Н-пиридо[2,3-d]пиримидин-7-он;
сложный этиловый эфир 4-{4-[6-(2,6-дихлорфенил)-8-метил-7-оксо-7,8-дигидропиридо[2,3-d]пиримидин-2-иламино]фенил} масляной кислоты;
4-{4-[6-(2,6-дихлорфенил)-8-метил-7-оксо-7,8-дигидропиридо[2,3-d]-пиримидин-2-иламино]фенил} масляную кислоту;
2-амино-6-(2,6-дихлорфенил)-8-метилпиридо[2,3-d]пиримидин-7(8Н)-он;
2-амино-6-фенил-8-метилпиридо[2,3-d]пиримидин-7(8Н)-он;
2-амино-6-(2,6-дихлорфенил)-8-этилпиридо[2,3-d]пиримидин-7(8Н)-он;
2-амино-6-(2,6-дихлорфенил)-8-пропил-8Н-пиридо[2,3-d]пиримидин-7-он;
2-амино-8-бутил-6-(2,6-дихлорфенил)-8Н-пиридо[2,3-d]пиримидин-7-он;
2-амино-6-(2,6-дихлорфенил)-8-изобутил-8Н-пиридо[2,3-d]пиримидин-7-он;
2-амино-6-(2,6-дихлорфенил)-8-(3-диметиламинопропил)-8Н-пиридo[2,3-d]пиpимидин-7-oн;
сложный метиловый эфир [2-амино-6-(2,6-дихлорфенил)-7-оксо-7Н-пиpидo[2,3-d]пиpимидин-8-ил]yкcycнoй кислоты;
сложный трет-бутиловыйй эфир[2-амино-6-(2,6-дихлорфенил)-7-оксо-7H-пиpидo[2,3-d]пиpимидин-8-ил]yкcycнoй кислоты;
[2-амино-6-(2,6-дихлорфенил)-7-оксо-7Н-пиридо[2,3-d]пиримидин-8-ил]уксусную кислоту;
2-aминo-8-бeнзил-6-(2,6-диxлopфeнил)-8H-пиpидo[2,3-d]пиpимидин-7-он;
2-амино-8-(3-бромбензил)-6-(2,6-дихлорфенил)-8Н-пиридо[2,3-d]-пиримидин-7-он;
сложный метиловый эфир 4-[2-амино-6-(2,6-дихлорфенил)-7-оксо-7H-пиpидo[2,3-d]пиpимидин-8-илмeтил]бeнзoйнoй кислоты;
2-амино-8-(2,6-дихлорбензил)-6-(2,6-дихлорфенил)-8Н-пиридо-[2,3-d]-nиpимидин-7-oн;
2-амино-6-(2,6-дихлорфенил)-8-(4-метоксибензил)-8Н-пиридо-[2,3-d]пиpимидин-7-oн;
2-амино-6-(2,6-дихлорфенил)-8-пиридин-4-илметил-8Н-пиридо-[2,3-d]-пиpимидин-7-oн;
2-aминo-6-(2,6-диxлopфeнил)-8-(3-фeнилnpoпил)-8H-пиpидo[2,3-d]-пиримидин-7-он;
[6-(2,6-дихлорфенил)-7-имино-8-метил-7,8-дигидропиридо[2,3-d]-пиримидин-2-ил]-(3-диэтиламинопропил)амин;
[6-(2,6-дихлорфенил)-8-метил-7-оксо-7,8-дигидропиридо[2,3-d]пиримидин-2-ил]-(3-диэтиламинопропил)амин;
N-[6-(2,6-дихлорфенил)-8-метил-7-оксо-7,8-дигидропиридо[2,3-d]пиримидин-2-ил]ацетамид;
2-амино-6-(2,6-дихлорфенил)-8-метилпиридо[2,3-d]пиримидин-7(8Н)-тион;
N-[[6-(2,6-дихлорфенил)-7-оксо-8-метил-7,8-дигидропиридо[2,3-d]пиримидин-2-ил]полуамид янтарной кислоты;
1-[6-(2,6-дихлорфенил)-7-оксо-8-метил-7,8-дигидропиридо[2,3-d]пиримидин-2-ил]пирролидин-2,5-дион;
6-(2,6-дихлорфенил)-2-гидрокси-8-метил-8Н-пиридо[2,3-d]пиримидин-7-илиденамин;
6-(2,6-диxлopфeнил)-2-(2-этoкcиэтoкcи)-8-мeтил-8H-пиpидo[2,3-d]пиримидин-7-илиденамин;
6-(2,6-диxлopфeнил)-2-гидpoкcи-8-мeтил-8H-пиpидo[2,3-d]пиpимидин-7-он;
6-(2,6-дихлорфенил)-2-[2-(диэтиламино)этокси]-8-метил-8Н-пиридо-[2,3-d]пиpимидин-7-oн;
6-(2,6-диxлopфeнил)-8-мeтил-2-мeтилcyльфaнил-8H-пиpидo[2,3-d]-пиримидин-7-илиденамин;
6-(2,6-дихлорфенил)-8-этил-2-метилсульфанил-8Н-пиридо[2,3-d]-пиримидин-7-илиденамин;
6-(2,6-дихлорфенил)-2-метансульфинил-8-метил-8Н-пиридо[2,3-d]-пиримидин-7-он;
6-(2,6-дихлорфенил)-8-метил-2-метилсульфанил-8Н-пиридо[2,3-d]-пиримидин-7-он;
6-(2,6-дихлорфенил)-2-метансульфонил-8-метил-8Н-пиридо[2,3-d]-пиримидин-7-он;
6-(2,6-дихлорфенил)-8-метил-2-метилсульфанил-8Н-пиридо[2,3-d]-пиримидин-7-он;
6-(2,6-дихлорфенил)-8-этил-2-метансульфонил-8Н-пиридо[2,3-d]-пиримидин-7-он;
N-[6-(2,6-дихлорфенил)-8-метил-2-метилсульфанил-8Н-пиридо-[2,3-d]пиpимидин-7-илидeн]aцeтaмид;
N-[6-(2,6-диxлopфeнил)-8-этил-2-мeтилcyльфaнил-8H-пиpидo[2,3-d]-пиримидин-7-илиден]ацетамид;
N-[6-(2,6-дихлорфенил)-2-(4-диэтиламинобутиламино)-8-метил-8Н-пиридо[2,3-d]пиpимидин-7-илидeн]aцeтaмид;
6-(2,6-диxлopфeнил)-8-мeтил-2-фeнилaминo-8H-пиpидo[2,3-d]пиримидин-7-он;
2-(3-бромфениламино)-6-(2,6-дихлорфенил)-8-метил-8Н-пиридо[2,3-d]пиримидин-7-он;
2-(4-хлорфениламино)-6-(2,6-дихлорфенил)-8-метил-8Н-пиридо[2,3-d]пиpимидин-7-oн;
2-(бензо[1,3]диоксол-5-иламино)-6-(2,6-дихлорфенил)-8-метил-8Н-пиридо[2,3-d]пиримидин-7-он;
6-(2,6-дихлорфенил)-8-метил-2-(пиридин-4-иламино)-8Н-пиридо [2,3-d]пиримидин-7-он;
6-(2,6-дихлорфенил)-8-метил-2-п-толиламино-8Н-пиридо[2,3-d]-пиримидин-7-он;
6-(2,6-дихлорфенил)-2-(4-метоксифениламино)-8-метил-8Н-пиридо[2,3-d]пиримидин-7-он;
6-(2,6-дихлорфенил)-8-этил-2-фениламино-8Н-пиридо[2,3-d]пиримидин-7-он;
6-(2,6-дихлорфенил)-2-(2-метоксифениламино)-8-метил-8Н-пиридо[2,3-d]пиримидин-7-он;
6-(2,6-дихлорфенил)-2-(3-метоксифениламино)-8-метил-8Н-пиридo[2,3-d]пиpимидин-7-oн;
6-(2,6-дихлорфенил)-2-(4-метокси-3-метилфениламино)-8-метил-8Н-пиридо[2,3-d]пиримидин-7-он;
6-(2,6-дихлорфенил)-8-этил-2-(4-метоксифениламино)-8Н-пиридо[2,3-d]пиримидин-7-он;
6-(2,6-дихлорфенил)-8-этил-2-(4-гидроксифениламино)-8Н-пиридo[2,3-d]пиpимидин-7-oн;
6-(2,6-дихлорфенил)-2-(4-этоксифениламино)-8-этил-8Н-пиридо[2,3-d]пиримидин-7-он;
6-(2,6-дихлорфенил)-2-(3,4-диметоксифениламино)-8-этил-8Н-пиридo[2,3-d]пиpимидин-7-oн;
6-(2,6-дихлорфенил)-8-этил-2-(3,4,5-триметоксифениламино)-8Н-пиpидo[2,3-d]пиpимидин-7-oн;
6-(2,6-дихлорфенил)-8-метил-2-(пиридин-3-иламино)-8Н-пиридо[2,3-d]пиримидин-7-он;
6-(2,6-дихлорфенил)-2-[4-(2-диэтиламиноэтокси)фениламино]-8-метил-8Н-пиридо[2,3-d]пиримидин-7-он;
6-(2,6-дихлорфенил)-2-(3-гидроксиметилфениламино)-8-метил-8Н-пиридо[2,3-d]пиримидин-7-он;
6-(2,6-дихлорфенил)-2-(3,5-диметоксифениламино)-8-метил-8Н-пиpидo[2,3-d]пиpимидин-7-oн;
сложный метиловый эфир {4-[6-(2,6-дихлорфенил)-8-метил-7-оксо-7,8-дигидpoпиpидo[2,3-d]пиpимидин-2-илaминo]фeнил}yкcycнoй кислоты;
6-(2,6-дихлорфенил)-2-(6-метоксипиридин-3-иламино)-8-метил-8Н-пиридо[2,3-d]пиримидин-7-он;
{4-[6-(2,6-дихлорфенил)-8-метил-7-оксо-7,8-дигидропиридо[2,3-d]пиpимидин-2-илaминo]фeнил}yкcycнyю кислоту;
6-(2,6-дихлорфенил)-2-(3-гидроксифениламино)-8-метил-8Н-пиридо[2,3-d]пиримидин-7-он;
сложный этиловый эфир 4-[6-(2,6-дихлорфенил)-8-метил-7-оксо-7,8-дигидропиридо[2,3-d]пиримидин-2-иламино]бензойной кислоты;
сложный этиловый эфир 3-[6-(2,6-дихлорфенил)-8-метил-7-оксо-7,8-диrидpoпиpидo[2,3-d]пиpимидин-2-илaминo]бeнзoйнoй кислоты;
3-[6-(2,6-дихлорфенил)-8-метил-7-оксо-7,8-дигидропиридо[2,3-d]пиpимидин-2-илaминo]бeнзoйнyю кислоту;
6-(2,6-дихлорфенил)-8-этил-2-(пиридин-4-иламино)-8Н-пиридо[2,3-d]пиримидин-7-он;
[6-(2-бром-6-хлорфенил)-8-этил-7-имино-7,8-дигидропиридо[2,3-d]-пиримидин-8-ил]фениламин;
6-(2-бром-6-хлорфенил)-8-этил-2-фениламино-8Н-пиридо[2,3-d]-пиримидин-7-он;
(8-этил-7-имино-6-фенил-7,8-дигидропиридо[2,3-d]пиримидин-2-ил)-2-фениламин;
8-этил-6-фeнил-2-фeнилaминo-8H-пиpидo[2,3-d]пиpимидин-7-oн;
(6-(3,5-диметилфенил)-8-этил-7-имино-7,8-дигидропиридо[2,3-d]-пиримидин-2-ил)-2-фениламин;
6-(3,5-димeтилфeнил)-8-этил-2-фeнилaминo-8H-пиpидo[2,3-d]пиримидин-7-он;
8-этил-2-фeнилaминo-6-тиoфeн-3-ил-8H-пиpидo[2,3-d]пиpимидин-7-он;
(8-этил-7-имино-6-тиофен-2-ил-7,8-дигидропиридо[2,3-d]пиримидин-2-ил)фениламин;
8-этил-2-фeнилaминo-6-тиoфeн-2-ил-8H-пиpидo[2,3-d]пиpимидин-7-он;
(8-этил-7-иминo-6-пиpидин-4-ил-7,8-дигидpoпиpидo[2,3-d]пиpимидин-2-ил)-2-фениламин;
8-этил-2-фeнилaминo-6-пиpидин-4-ил-8H-пиpидo[2,3-d]пиpимидин-7-он;
(8-этил-7-имино-6-нафталин-2-ил-7,8-дигидропиридо[2,3-d]пиримидин-2-ил)фениламин;
8-этил-6-нафталин-2-ил-2-фениламино-8Н-пиридо[2,3-d]пиримидин-7-он;
(6-бифенил-4-ил-8-этил-7-имино-7,8-дигидропиридо[2,3-d]пиримидин-2-ил)фениламин;
6-бифенил-4-ил-8-этил-2-фениламино-8Н-пиридо[2,3-d]пиримидин-7-он и
2-циклогексиламино-6-(2,6-дихлорфенил)-8-метил-8Н-пиридо[2,3-d]-пиримидин-7-он.
26. Фармацевтическая композиция, обладающая ингибирующей протеин-тирозин-киназу активностью, содержащая активное вещество и, как минимум, один фармацевтически приемлемый носитель, отличающаяся тем, что в качестве активного вещества она содержит соединение по п.1 или его фармацевтически приемлемую соль в эффективном количестве.
27. Способ лечения заболеваний, опосредованных клеточной пролиферацией, заключающийся во введении активного вещества млекопитающему, отличающийся тем, что в качестве активного вещества вводят соединение по п.1 или его фармацевтически приемлемую соль в терапевтически эффективном количестве.
28. Способ лечения рака, атеросклероза, псориаза или рестеноза, заключающийся во введении активного вещества млекопитающему, отличающийся тем, что в качестве активного вещества вводят соединение по п.1 или его фармацевтически приемлемую соль в эффективном количестве.
Текст
1 Изобретение относится к новым гетероциклическим соединениям, обладающим биологической активностью, более конкретно к новым производным пиридо[2,3-d]пиримидина и их фармацевтически приемлемым солям, фармацевтической композиции, обладающей ингибирующей протеин-тирозин-киназу активностью, способу лечения заболеваний, опосредованных клеточной пролиферацией и способу лечения рака, атеросклероза, псориаза или рестеноза. Известны производные пиридо[2,3d]пиримидина, обладающие биологической активностью, в частности диуретической активностью (см. патент US3 534 039, С 07 d 51/46,1970 г.). Задачей изобретения является разработка новых производных пиридо[2,3-d]пиримидина,обладающих биологической активностью, в частности ингибирующей протеин-тирозин-киназу активностью. Данная задача решается предлагаемыми производными пиридо[2,3-d]-пиримидина общей формулы (I)R2, R3 и R4 независимо означают водород,группу (CH2)nPh, где Ph является фенилом, не замещенным или замещенным 1-3 остатками из группы, включающей галоген, гидроксил, карбоксил, алкил с 1-6 атомами углерода, не замещенный или замещенный гидроксилом, карбоксилом, алкоксикарбонилом с 1-6 атомами углерода в алкоксильной части, аминогруппой, алкиламиногруппой или диалкиламиногруппой с 1-6 атомами углерода в каждой алкиьной части и n является 0, 1, 2 или 3, гетероароматический остаток с 4-9 кольцевыми атомами, из которых 1-4 атома выбраны из группы, включающей кислород, азот и серу, циклоалкил с 3-6 атомами углерода, алканоил с 1-6 атомами углерода, алкил с 1-6 атомами углерода, алкенил с 2-6 атомами углерода и алкинил с 2-6 атомами углерода, при этом алкил, алкенил и алкинил могут быть замещены группой NR5R6, где R5 и R6 независимо означают водород, алкил с 1-6 атомами углерода, алкенил с 2-6 атомами углерода,алкинил с 2-6 атомами углерода, группу(СН 2)nРh, где Рh и n имеют вышеуказанные значения, циклоалкил с 3-6 атомами углерода, гетероароматический остаток с 4-9 кольцевыми атомами, из которых 1-4 атома выбраны из группы, включающей кислород, азот и серу, или 2 связаны, могут образовать цикл, содержащий 37 атомов углерода, в который могут также входить 1, 2 или 3 гетероатома, выбранные из группы, включающей азот, кислород и серу, фенилом, не замещенным или замещенным 1-3 остатками из вышеуказанной группы, тиоалкилом с 1-6 атомами углерода, алкилоксигруппой с 1-6 атомами углерода, гидроксилом, карбоксилом,галогеном или циклоалкилом с 3-6 атомами углерода;R4 может дополнительно означать группуR3 и R4 вместе с атомом азота, с которым они связаны, могут образовывать цикл, содержащий от 3 до 7 атомов углерода, в который могут также входить 1, 2 или 3 гетероатома,выбранные из группы, включающей азот, кислород, и серу,Аr означает фенил, не замещенный или замещенный 1-3 остатками из группы, включающей галоген, гидроксил, алкил с 1-6 атомами углерода, тиоалкил с 1-6 атомами углерода, алкоксил с 1-6 атомами углерода, трифторметил,тиогруппу, цианогруппу, нитрогруппу, алканоил с 1-6 атомами углерода, алканоилоксигруппу с 1-6 атомами углерода, группу -COOR7, где R7 означает алкил с 1-6 атомами углерода или галоген, и группу -NR5R6, где R5 и R6 имеют вышеуказанные значения, или гетероароматический остаток с 4-9 кольцевыми атомами, из которых 1-4 атома выбраны из группы, включающей кислород, азот и серу,при условии, что если R2 означает водород,то Х не означает иминогруппу,или их фармацевтически приемлемыми солями. В первую группу предпочтительных производных пиридо[2,3-d]пиримидина общей формулы (I) входят соединения, у которых Ar означает фенил, двукратно замещенный независимыми остатками из числа галогена и алкила с 1-6 атомами углерода, a R1, R2 и Х имеют вышеуказанные значения. Во вторую группу предпочтительных производных пиридо[2,3-d]пиримидина общей формулы (I) входят соединения, у которых R2 означает алкил с 1-6 атомами углерода, не замещенный или замещенный вышеуказанными остатками, а Аr означает фенил, двукратно замещенный независимыми остатками из числа галогена и алкила с 1-6 атомами углерода. В третью группу предпочтительных производных пиридо[2,3-d]пиримидина общей формулы (I) входят соединения, у которых R1 означает группу NR3R4, R2 означает алкил с 1-6 атомами углерода, не замещенный или замещенный вышеуказанными остатками, а Ar означает фенил, двукратно замещенный независимыми остатками из числа галогена и алкила с 16 атомами углерода. 3 В четвертую группу предпочтительных производных пиридо[2,3-d]пиримидина общей формулы (I) входят соединения, у которыхNR3R4, где R3 означает водород, R2 означает алкил с 1-6 атомами углерода, не замещенный или замещенный вышеуказанными остатками, а Аr означает фенил, двукратно замещенный независимыми остатками из числа галогена и алкила с 1-6 атомами углерода. В пятую группу предпочтительных производных пиридо[2,3-d]пиримидина общей формулы (I) входят соединения, у которых R1 означает группу NR3R4, где R4 и R5 означают водород, R2 означает алкил с 1-6 атомами углерода,не замещенный или замещенный вышеуказанными остатками, а Ar означает фенил, двукратно замещенный независимыми остатками из числа галогена и алкила с 1-6 атомами углерода. В шестую группу предпочтительных производных пиридо[2,3-d]пиримидина общей формулы (I) входят соединения, у которых Х означает иминогруппу, R1 означает группуNR3R4, где R3 и/или R4 означают водород, R2 означает алкил с 1-6 атомами углерода, не замещенный или замещенный вышеуказанными остатками, а Ar означает фенил, двукратно замещенный независимыми остатками из числа галогена и алкила с 1-6 атомами углерода. В седьмую группу предпочтительных производных пиридо[2,3-d]пиримидина общей формулы (I) входят соединения, у которых Х означает кислород, R1 означает NR3R4, где R3 является водородом или алкилом с 1-6 атомами углерода и R4 является алкилом с 1-6 атомами углерода или замещенным алкилом с 1-6 атомами углерода, R2 означает алкил с 1-6 атомами углерода и Ar означает фенил, двукратно замещенный независимыми остатками из числа алкила с 1-6 атомами углерода и галогена. В восьмую группу предпочтительных производных пиридо[2,3-d]пиримидина общей формулы (I) входят соединения, у которых Х означает водород, R1 означает группу NR3R4,где R3 и/или R4 означают водород, R2 означает алкил с 1-6 атомами углерода, не замещенный или замещенный вышеуказанными остатками, аAr означает фенил, двукратно замещенный независимыми остатками из числа галогена и алкила с 1-6 атомами углерода. В девятую группу предпочтительных производных пиридо[2,3-d]пиримидина общей формулы (I) входят соединения, у которых R1 означает группу NR3R4, где R3 означают водород, a R4 означает алкил с 1-6 атомами углерода,замещенный группой NR5R6, где R5 и R6 оба предпочтительно означают алкил с 1-6 атомами углерода, R2 означает алкил с 1-6 атомами углерода, не замещенный или замещенный вышеуказанными остатками, а Аr означает фенил,двукратно замещенный независимыми остатками из числа галогена и алкила с 1-6 атомами углерода. 4 В десятую группу предпочтительных производных пиридо[2,3-d]пиримидина общей формулы (I) входят соединения, у которых R1 означает группу NR3R4, где R3 означают водород, a R4 означает алкил с 1-6 атомами углерода,замещенный группой NR5R6, Х - иминогруппу, а Аr означает фенил, двукратно замещенный независимыми остатками из числа галогена и алкила с 1-6 атомами углерода. В одиннадцатую группу предпочтительных производных пиридо[2,3-d]пиримидина общей формулы (I) входят соединения, у которых R1 означает группу NR3R4, где R3 означают водород, а R4 означает алкил с 1-6 атомами углерода, замещенный группой NR5R6, где R5 и R6 оба означают алкил с 1-6 атомами углерода, Х кислород, R2 означает алкил с 1-6 атомами углерода, не замещенный или замещенный вышеуказанными остатками, а Аr означает фенил,двукратно замещенный независимыми остатками из числа галогена и алкила с 1-6 атомами углерода. В двенадцатую группу предпочтительных производных пиридо[2,3-d]пиримидина общей формулы (I) входят соединения, у которых R1 означает группу NR3R4, где R3 и R4 означают водород, R2 означает алкил с 1-6 атомами углерода, не замещенный или замещенный вышеуказанными остатками, Х - серу, а Аr означает фенил, двукратно замещенный независимыми остатками из числа галогена и алкила с 1-6 атомами углерода. В тринадцатую группу предпочтительных производных пиридо[2,3-d]пиримидина общей формулы (I) входят соединения, у которых R1 означает группу NR3R4, R2 означает алкил с 1-6 атомами углерода, не замещенный или замещенный вышеуказанными остатками, Х - кислород, Аг означает фенил, двукратно замещенный независимыми остатками из числа галогена и алкила с 1-6 атомами углерода. В четырнадцатую группу предпочтительных производных пиридо[2,3-d]пиримидина общей формулы (I) входят соединения, у которых R1 означает группу ОR3 или S(O)mR3, R2 означает алкил с 1-6 атомами углерода, не замещенный или замещенный вышеуказанными остатками, а Ar означает фенил, двукратно замещенный независимыми остатками из числа галогена и алкила с 1-6 атомами углерода. В пятнадцатую группу предпочтительных производных пиридо[2,3-d]пиримидина общей формулы (I) входят соединения, у которых R1 означает группу ОR3, R2 означает алкил с 1-6 атомами углерода, не замещенный или замещенный вышеуказанными остатками, Х - кислород или иминогруппу, Ar означает фенил,двукратно замещенный независимыми остатками из числа галогена и алкила с 1-6 атомами углерода. В шестнадцатую группу предпочтительных производных пиридо[2,3-d]пиримидина 5 общей формулы (I) входят соединения, у которых R1 означает группу S(O)mR3, R2 означает алкил с 1-6 атомами углерода, не замещенный или замещенный вышеуказанными остатками, Х- кислород или N-ацил, а Ar означает фенил,двукратно замещенный независимыми остатками из числа галогена и алкила с 1-6 атомами углерода. В семнадцатую группу предпочтительных производных пиридо[2,3-d]пиримидина общей формулы (I) входят соединения, у которых R1 означает NHPh', где Рh' имеет указанное для Ph значение или означает пиридил, не замещенный или замещенный указанными для фенила остатками, R2 является алкилом с 1-6 атомами углерода, незамещенным или замещенным указанными остатками, Х означает кислород или иминогруппу и Аr означает фенил, двукратно замещенный независимыми остатками из числа алкила с 1-6 атомами углерода и галогена. В восемнадцатую группу предпочтительных производных пиридо[2,3-d]пиримидина общей формулы (I) входят соединения, у которых R4 является фенилом, не замещенным или замещенным указанными остатками, R2 означает алкил с 1-6 атомами углерода, не замещенный или замещенный указанными остатками, и Х означает иминогруппу или кислород. В девятнадцатую группу предпочтительных производных пиридо[2,3-d]пиримидина общей формулы (I) входят соединения, у которых R3 означает водород и R4 означает циклоалкил. В частности, предпочитаются производные пиридо[2,3-d]пиримидина вышеприведенной общей формулы (I), представляющие следующие соединения: 6-(2,6-дихлорфенил)-8-метил-2-[3-(4 метилпиперазин-1-ил)пропиламино]-8 Нпиридо[2,3-d]пиримидин-7-он; 6-(2,6-дихлорфенил)-8-метил-2-метиламино-8 Н-пиридо[2,3-d]пиримидин-7-он; 6-(2,6-дихлорфенил)-2-диметиламино-8 метил-8 Н-пиридо[2,3-d]пиримидин-7-он; 6-(2,6-дихлорфенил)-2-этиламино-8-метил 8 Н-пиридо[2,3-d]пиримидин-7-он; 6-(2,6-дихлорфенил)-2-(2-гидроксиэтиламино)-8-метил-8 Н-пиридо-[2,3-d]пиримидин-7 он; 6-(2,6-дихлорфенил)-2-изопропиламино-8 метил-8 Н-пиридо[2,3-d]пиримидин-7-он; 2-бутиламино-6-(2,6-дихлорфенил)-8 метил-8 Н-пиридо[2,3-d]пиримидин-7-он; 2-бензиламино-6-(2,6-дихлорфенил)-8 метил-8 Н-пиридо[2,3-d]пиримидин-7-он; 6-(2,6-дихлорфенил)-8-метил-2-(3-морфолин-4-илпропиламино)-8 Н-пиpидo[2,3-d] пиpимидин-7-oн; 6-(2,6-дихлорфенил)-2-[2-(3,4-диметоксифенил)этиламино]-8-метил-8 Н-пиpидo[2,3-d] пиpимидин-7-oн;[2,3-d]пиpимидин-7-oн; сложный этиловый эфир 4-4-[6-(2,6 дихлорфенил)-8-метил-7-оксо-7,8-дигидpoпиpидo[2,3-d]пиpимидин-2-илaминo]фeнилмасляной кислоты; 4-4-[6-(2,6-диxлopфeнил)-8-мeтил-7-oкco7,8-дигидpoпиpидo[2,3-d]пиримидин-2-иламино]фенилмасляную кислоту; 2-амино-6-(2,6-дихлорфенил)-8-метилпиридо[2,3-d]пиримидин-7(8 Н)-он; 2-aминo-6-фeнил-8-мeтилпиpидo[2,3d]пиpимидин-7(8H)-oн; 2-амино-6-(2,6-дихлорфенил)-8-этилпиридо[2,3-d]пиримидин-7(8 Н)-он; 2-амино-6-(2,6-дихлорфенил)-8-пропил 8 Н-пиридо[2,3-d]пиримидин-7-он; 2-aминo-8-бyтил-6-(2,6-диxлopфeнил)-8Hпиpидo[2,3-d]пиpимидин-7-oн; 2-aминo-6-(2,6-диxлopфeнил)-8-изoбyтил 8H-пиpидo[2,3-d]пиpимидин-7-он; 2-амино-6-(2,6-дихлорфенил)-8-(3-диметиламинопропил)-8 Н-пиридо-[2,3-d]пиримидин 7-он; сложный метиловый эфир[2-амино-6-(2,6 дихлорфенил)-7-оксо-7 Н-пиридo[2,3-d]пиpимидин-8-ил]yкcycнoй кислоты; сложный трет-бутиловыйй эфир[2-амино 6-(2,6-дихлорфенил)-7-оксо-7 Н-пиpидo[2,3d]пиpимидин-8-ил]yкcycнoй кислоты; 7 2-амино-8-(3-бромбензил)-6-(2,6-дихлорфенил)-8 Н-пиридо[2,3-d]-пиримидин-7-он; сложный метиловый эфир 4-[2-амино-6(2,6-дихлорфенил)-7-оксо-7 Н-пиридо[2,3-d] пиримидин-8-илметил]бензойной кислоты; 2-aминo-8-(2,6-диxлopбeнзил)-6-(2,6-диxлopфeнил)-8H-пиpидo[2,3-d]-пиримидин-7-он; 2-амино-6-(2,6-дихлорфенил)-8-(4-метоксибензил)-8 Н-пиридо[2,3-d]пиримидин-7-он; 2-aминo-6-(2,6-диxлopфeнил)-8-пиpидин-4 илмeтил-8H-пиpидo[2,3-d]-пиримидин-7-он; 2-амино-6-(2,6-дихлорфенил)-8-(3-фенилпропил)-8 Н-пиридо[2,3-d]-пиримидин-7-он;N-[6-(2,6-дихлорфенил)-2-(4-диэтиламинобутиламино)-8-метил-8 Н-пиридо[2,3-d]пиpимидин-7-илидeн]aцeтaмид; 6-(2,6-диxлopфeнил)-8-мeтил-2-фeнилaминo-8H-пиpидo[2,3-d]пиpимидин-7-он; 2-(3-бpoмфeнилaминo)-6-(2,6-диxлopфeнил)-8-мeтил-8H-пиpидo[2,3-d]-пиримидин-7 он; 2-(4-xлopфeнилaминo)-6-(2,6-диxлopфeнил)-8-мeтил-8H-пиpидo[2,3-d]-пиримидин-7 он; 2-(бензо[1,3]диоксол-5-иламино)-6-(2,6 дихлорфенил)-8-метил-8 Н-пиридo[2,3-d]пиpимидин-7-oн; 6-(2,6-диxлopфeнил)-8-мeтил-2-(пиpидин 4-илaминo)-8H-пиpидo[2,3-d]-пиримидин-7-он; 6-(2,6-диxлopфeнил)-8-мeтил-2-п-тoлилaминo-8H-пиpидo[2,3-d]пиpимидин-7-он; 6-(2,6-дихлорфенил)-2-(4-метоксифениламино)-8-метил-8 Н-пиридо-[2,3-d]пиримидин-7 он; 6-(2,6-диxлopфeнил)-8-этил-2-фeнилaминo-8H-пиpидo[2,3-d]пиpимидин-7-он; 6-(2,6-дихлорфенил)-2-(2-метоксифениламино)-8-метил-8 Н-пиридо-[2,3-d]пиримидин-7 он; 6-(2,6-дихлорфенил)-2-(3-метоксифениламино)-8-метил-8 Н-пиридо-[2,3-d]пиримидин-7 он; 6-(2,6-дихлорфенил)-2-(4-метокси-3 метилфениламино)-8-метил-8 Н-пиридо[2,3d]пиримидин-7-он; 6-(2,6-дихлорфенил)-8-этил-2-(4-метоксифениламино)-8 Н-пиридо-[2,3-d]пиримидин-7oн; 6-(2,6-дихлорфенил)-8-этил-2-(4-гидроксифениламино)-8 Н-пиридо-[2,3-d]пиpимидин-7oн; 6-(2,6-дихлорфенил)-2-(4-этоксифениламино)-8-этил-8 Н-пиридо-[2,3-d]пиримидин-7 он; 6-(2,6-дихлорфенил)-2-(3,4-диметоксифениламино)-8-этил-8 Н-пиридo[2,3-d]пиpимидин 7-oн; 6-(2,6-дихлорфенил)-8-этил-2-(3,4,5 триметоксифениламино)-8 Н-пиридо[2,3-d] пиримидин-7-он; 6-(2,6-дихлорфенил)-8-метил-2-(пиридин 3-иламино)-8 Н-пиридо-[2,3-d]пиримидин-7-он; 6-(2,6-дихлорфенил)-2-[4-(2-диэтиламиноэтокси)фениламино]-8-метил-8H-пиpидo[2,3-d] пиpимидин-7-oн; 6-(2,6-дихлорфенил)-2-(3-гидроксиметилфениламино)-8-метил-8 Н-пиридо[2,3-d]пиримидин-7-он; 6-(2,6-дихлорфенил)-2-(3,5-диметоксифениламино)-8-метил-8 Н-пиридo[2,3-d]пиpимидин-7-oн; сложный метиловый эфир 4-[6-(2,6 дихлорфенил)-8-метил-7-оксо-7,8-дигидpoпиpидo[2,3-d]пиpимидин-2-илaминo]фeнил 9 6-(2,6-дихлорфенил)-2-(6-метоксипиридин 3-иламино)-8-метил-8 Н-пиридо[2,3-d]пиримидин-7-он; 4-[6-(2,6-дихлорфенил)-8-метил-7-оксо 7,8-дигидропиридо[2,3-d]пиримидин-2 иламино]фенилуксусную кислоту; 6-(2,6-дихлорфенил)-2-(3-гидроксифениламино)-8-метил-8 Н-пиридо-[2,3-d]пиpимидин-7-oн; сложный этиловый эфир 4-[6-(2,6 дихлорфенил)-8-метил-7-оксо-7,8-дигидpoпиpидo[2,3-d]пиpимидин-2-илaминo]бeнзoйнoй кислоты; сложный этиловый эфир 3-[6-(2,6 дихлорфенил)-8-метил-7-оксо-7,8-дигидpoпиpидo[2,3-d]пиpимидин-2-илaминo]бeнзoйнoй кислоты; 3-[6-(2,6-диxлopфeнил)-8-мeтил-7-oкco7,8-дигидpoпиpидo[2,3-d]пиpимидин-2 иламино]бензойную кислоту; 6-(2,6-диxлopфeнил)-8-этил-2-(пиpидин-4 илaминo)-8H-пиpидo[2,3-d]пиримидин-7-он; 10 Фармацевтически приемлемые соли соединений формулы (I) получают в результате присоединения кислоты и/или основания. Фармацевтически приемлемые соли, получающиеся при присоединении кислот к соединениям формулы (I), включают соли, полученные с применением неорганических кислот, как,например, соляная кислота, азотная кислота,фосфорная кислота, серная кислота, бромистоводородная кислота, иодистоводородная кислота, фосфористая кислота и им подобные, а также соли, полученные с применением органических кислот, как, например, алифатические моно- и дикарбоновые кислоты, фенилзамещенные предельные одноосновные кислоты жирного ряда,предельные одноосновные гидроксикислоты жирного ряда, двухосновные предельные кислоты жирного ряда, ароматические кислоты, алифатические и ароматические сульфокислоты и так далее. Эти соли включают, таким образом,сульфат, пиросульфат, бисульфат, сульфит, бисульфит, нитрат, фосфат, кислый фосфат, первичный кислый фосфат, метафосфат, пирофосфат, хлорид, бромид, иодид, ацетат, пропионат,каприлат, изобутират, оксалат, малонат, сукцинат, суберат, себацат, фумарат, малеат, манделат, бензоат, хлорбензоат, метилбензоат, динитробензоат, фталат, бензолсульфонат, толуолсульфонат, фенилацетат, цитрат, лактат, малеат,тартрат, метансульфонат и им подобные. Также возможны и соли аминокислот, как, например,аргинат и им подобные, и глюконат, галактуронат. Соли, образующиеся при присоединении кислот к основным соединениям, получают общепринятым способом при взаимодействии вещества в виде свободного основания с достаточным количеством желаемой кислоты. Вещество в виде свободного основания может быть регенерировано при взаимодействии соли с основанием и выделении свободного основания обычным способом. Соединения в виде свободных оснований несколько отличаются от соответствующих солей определенными физическими свойствами, как, например, растворимость в полярных растворителях, но, с другой стороны,соли эквивалентны соответствующим свободным основаниям для целей настоящего изобретения. Фармацевтически приемлемые соли, образующиеся при присоединении оснований, получают с использованием металлов или аминов,как, например, щелочные или щелочноземельные металлы или органические амины. Примерами металлов, используемых в качестве катионов, являются натрий, калий, магний,кальций и им подобные. Примеры подходящих аминов включают N,N'-дибензилэтилендиамин,хлорпрокаин, холин, диэтаноламин, этилендиамин, N-метилглюкамин и прокаин. Соли, образующиеся при присоединении оснований к кислотным соединениям (напри 11 мер, когда R3 означает карбоксиалкильную группу, такую, как карбоксиметил или 3 карбоксибутил,), получают при взаимодействии свободной кислотной формы с достаточным количеством желаемого основания для получения соли обычным способом. Соединение в форме свободной кислоты может быть регенерировано при взаимодействии соли с кислотой и выделении свободной кислоты общепринятым способом. Соединения в форме свободной кислоты несколько отличаются от соответствующих форм в виде солей по некоторым физическим свойствам, таким, как растворимость в полярных растворителях, но с другой стороны соли эквивалентны соответствующей им свободной кислоте с точки зрения целей настоящего изобретения. Производные пиридо[2,3-d]пиримидина вышеприведенной общей формулы (I) или их фармацевтически приемлемые соли могут представлять собой активное вещество фармацевтической композиции с ингибирующей протеинтирозин-киназу активностью, которая помимо не менее одного фармацевтически приемлемого носителя содержит указанные соединения в эффективном количестве. Такая фармацевтическая композиция является вторым объектом изобретения. Благодаря указанной биологической активности соединения формулы (I) и их фармацевтически приемлемые соли могут применяться для лечения заболеваний, опосредованных клеточной пролиферацией, в частности, рака,атеросклероза, псориаза, рестеноза. Данный способ является третьим объектом изобретения. Соединения формулы (I) могут быть получены при синтезах, представленных на схемах IVII. Хотя на этих схемах часто указаны точные структуры, такие способы применимы к аналогичным соединениям формулы (I), предоставляя подходящие соображения для защиты или снятия защиты с реакционноспособных функциональных групп способами, стандартными в органической химии. Например, для предотвращения нежелательных побочных реакций гидроксильные группы обычно нуждаются в превращении в простые или сложные эфиры при химических реакциях по другим участкам молекулы. Защищающая гидроксил группа легко удаляется, давая при этом свободную гидроксигруппу. Аминогруппы и карбоксильные группы также превращают в соответствующие производные для их защиты от нежелательных побочных реакций. Типичные защитные группировки и способы их присоединения и отщепления подробно описаны Greene и Wuts в кн. Защитные группы в органическом синтезе, изд.John Wiley and Sons, Нью-Йорк, (2-е издание; 1991), и McOmie, Защитные группы в органической химии, изд. Plenum Press, Нью-Йорк, 1973. На схеме I представлен типичный способ получения пиридо[2,3-d]пиримидин-7(8 Н)-онов 12 и 7(8 Н)-имидов по изобретению, т.е. соединений формулы I, в которых Х означает кислород или иминогруппу. Синтез начинают, подвергая реакции цианацетат, например этиловый эфир этоксиметиленциануксусной кислоты, с тиоизомочевиной, например сульфатом 2-метил-2 тиоизомочевины, с целью получения 5-циан-4 гидрокси-2-(метилсульфанил)пиримидина. Более подробно эта реакция описана в Helv. Chim.(1959). Затем 4 гидроксипиримидин подвергают реакции с галогенирующим агентом, как, например, хлорокись фосфора или тионилхлорид, для получения 4-галогенпиримидина, например, 5-циан-4-хлор 2-(метилсульфанил)пиримидина. Затем галогенпиримидин подвергают реакции с аминомR2NH2 и получают 5-циан-4-R2-амино-2(метилсульфанил)пиримидин. Используемый амин может иметь в качестве R2 группу, которую желательно иметь в конечном продукте формулы I, например, алкил, такой, как метил,или R2 может быть группой, которая может быть затем удалена, например, бензильной или ей подобной, чтобы получить соединения формулы I, в которых R2 является водородом. Соединения, где R2 означает водород, могут быть проалкилированы или проацетилированы стандартными способами. Реакцию между галогенпиримидином и амином R2NH2 обычно проводят путем смешивания эквимолярных количеств галогенпиримидина и амина в инертном органическом растворителе, как, например, толуол, ксилол, хлористый метилен или им подобные, при температуре от около 50 до около 150 С. Избыток амина может быть утилизирован при необходимости. Полученный таким образом 4-аминопиримидин затем подвергают реакции с гидразином или замещенным гидразином, чтобы заместить 2 метилсульфанильную группу и получить 2 гидразин-4-R2-амино-5-цианпиримидин. Гидразинопиримидин подвергают реакции с нитритом натрия в разбавленной водой минеральной кислоте для диазотирования гидразинового остатка и получают 2-азидо-4-R2-амино-5 цианпиримидин. Реакция этого соединения с восстановителем в присутствии, например, никеля Ренея приводит к гидрированию как циангруппы, так и азидогруппы с образованием 2 амино-4-R2-амино-5-пиримидинкарбоксальдегида. Альтернативно 4-R2-амино-5-пиримидинкарбоксальдегиды могут быть получены, исходя из коммерчески доступного сложного эфира 4 галоген-5-пиримидинкарбоновой кислоты. Например, этиловый эфир 2-метилсульфанил-4 хлор-5-пиримидинкарбоновой кислоты (приобретенный в Альдрич Ко.) может быть подвергнут реакции с амином R2NH2, например, метиламином, бензиламином и им подобным, для замещения хлора в положении 4 и получения соответствующего этилового эфира 2 13 метилсульфанил-4-R2-амино-5-пиримидинкарбоновой кислоты. Сложноэфирную группу восстанавливают в спирт, например, при реакции с алюмогидридом лития в тетрагидрофуране, и спиртовую группу затем окисляют в альдегидную при реакции с окислителем, например дихроматом натрия, закисью марганца и им подобным, для получения соответствующего 2 метилсульфанил-4-R2-амино-5-пиримидинкарбоксальдегида. Метилсульфанильную группу в положении 2 замещают гидразином, гидразиновую группу диазотируют и затем восстанавливают, как описано выше, для получения желаемого 2-амино-4-R2-амино-5-пиримидинкарбоксальдегида. Пиримидинкарбоксальдегид затем подвергают реакции с арилацетонитрилом в присутствии основания в растворителе, как, например,ксилол, 2-этоксиэтанол, диоксан или им подобные, как показано на схеме I. Типичными основаниями, которые могут быть использованы,являются гидрид натрия, метилат натрия, металлический натрий, карбонат калия и им подобные. Пиримидинкарбоксальдегид и арилацетонитрил обычно используются примерно в эквимолярных количествах. Типичные арилацетонитрилы, которые могут быть использованы,включают фенилацетонитрил, 2,6-дихлорфенилацетонитрил, 2,6-диметилфенилацетонитрил, отолилацетонитрил, пиридилацетонитрил, фуранилацетонитрил, нафтилацетонитрил и им подобные. Реакцию обычно проводят в инертном растворителе, как, например, метилцеллозольв или этилцеллозольв, диглим, диметилформамид или им подобные, и при повышенной температуре от примерно 50 С до примерно 200 С, и обычно реакция в основном заканчивается в течение примерно от 2 до 24 ч. Продукт реакции, 6-арил-7-имино-8-замещенный-7,8-дигидропиридо[2,3-d]пиримидин-2-иламин формулыNR3R4, легко выделяют при прибавлении воды к реакционной смеси, что обычно вызывает осаждение продукта. Полученный имин может быть далее при необходимости очищен при перекристаллизации из растворителей, таких, как этилацетат, ацетон, изопропиловый спирт и им подобные, или при хроматографии на твердых носителях, например силикагеле. Полученный таким образом 6-арил-7 имино-8-замещенный-7,8-дигидропиридо[2,3d]пиримидин-2-иламин имеет формулу 6-Арил-7-имино-8-замещенные-7,8-дигидропиридо[2,3-d]пиримидин-2-ил-амины являются полезными терапевтическими средствами, а также промежуточными соединениями, поскольку они легко превращаются в соответствующее 7-кето-производное при простом нагревании в минеральной кислоте, как, например,соляная кислота, серная кислота, фосфорная кислота или им подобные. Гидролиз обычно в основном завершается примерно через 5-24 ч,когда его проводят при температуре примерно от 60 до 200 С. Продукт 2-амино-6-арил-8 замещенный-пиридо[2,3-d]пиримидин-7(8 Н)-он легко выделяют при удалении растворителя реакции, например, при упаривании в вакууме, и кристаллизации из обычных растворителей, таких, как этилацетат, ацетон, тетрагидрофуран и им подобные. 7-Оксопиридо[2,3-d]пиримидины данного изобретения могут быть альтернативно получены при простом гидролизе 7-аминопиридопиримидина в минеральной кислоте, как проиллюстрировано на схемеII. 7 Аминопиридопиримидины легко получают способами, описанными в патенте США 3,534,039. 7-Аминопиридопиримидин легко растворяется в минеральной кислоте, например, в концентрированной соляной кислоте, в серной кислоте, в фосфорной кислоте или им подобных. Реакция гидролиза обычно завершается через примерно 12-24 ч, когда ее проводят при температуре примерно от 80 С до примерно 200 С. Продукт легко выделяют при удалении растворителя реакции и кристаллизации из растворителя, такого, как диметилсульфоксид, диметилформамид,диоксан или им подобные. 7-Оксопиридо[2,3-d]пиримидины альтернативно могут быть получены при реакции 2,4 диамино-5-пиримидинкарбоксальдегида со сложным эфиром арилуксусной кислоты, как показано ниже где R2, R3, R4 и Аr являются такими, как указано выше, и алкил является низшим алкилом, как,например, метил, этил, изобутил и им подобные. Реагенты обычно смешивают в инертном растворителе, как, например, диметилформамид,тетрагидрофуран или этилцеллозольв, и сложный эфир арилуксусной кислоты используют обычно в избытке, например, в 0,5-1,0 молярном избытке по отношению к пиримидину. Реакцию проводят в присутствии основания, например метилата натрия или гидрида натрия, и обычно она завершается в течение примерно 2 -24 ч,когда е проводят при повышенной температуре примерно от 50 до 120 С. Полученные 7 оксопиридо[2,3-d]пиримидины выделяют при удалении растворителей, используемых в реакции, и кристаллизации продукта из органического растворителя, как, например, метиловый спирт, этилацетат или им подобные. Процесс можно проводить с 2-окси- /R1= -ОR3/ и 2-тио/R1=-SR3/-производными 4-амино-5-пиримидинкарбоксальдегида с целью получения соответствующих 7-оксо-2-окси- и 2-тиопиридо[2,3d]пиримидинов согласно изобретению. Соединения по изобретению, в которых R2 в формуле I означает другие заместители, а не водород, легко могут быть получены при использовании замещенного амина R2NH2 в описанной выше реакции или альтернативно при алкилировании пиридопиримидина, в которомR2 является водородом, как, например, проиллюстрировано на схеме II. Реакцию обычно проводят при смешивании пиридопиримидина с эквимолярным количеством или избытком алкилирующего агента, например алкилгалогенида, как, например, йодистый метил, бромистый бензил, 3-гексен-1-илиодид или им подобные, в общем растворителе, как, например, толуол,ксилол, диметилформамид или им подобные. Для катализирования реакции и для действия в качестве акцептора кислоты может быть добавлено основание, например, гидроокись натрия. Полученный продукт, замещенный по положению 8 пиридопиримидин, легко выделяют при удалении используемых в реакции растворителей и затем очищают, если необходимо, при хроматографии или кристаллизации из толуола,ацетона или им подобных растворителей. Схема III иллюстрирует реакцию 2 аминопиридопиримидинов с ацилирующими и диацилирующими агентами для образования амидов или циклических аминосистем. Например, 2-аминопиридопиримидин формулы где R2 означает другой заместитель, а не водород, Х означает кислород или серу и Аr является таким, как указано выше, может быть подвергнут реакции с эквимолярным количеством или небольшим избытком галоидангидрида кислоты или ангидрида кислоты, чтобы провести ацилирование 2-аминогруппы. Типичные галоидангидриды кислот включают хлористый ацетил,бензоилбромид, пропионилиодид и им подобные. Обычно используемые ангидриды включают уксусный ангидрид, ангидрид пропионовой кислоты и смешанные ангидриды, как, например, ангидрид уксусной и масляной кислоты. Ацилирующие агенты, как, например, янтарный ангидрид и ему подобные, могут быть использованы для образования циклических имидов, как показано на схеме III. Соединения по изобретению, в которых Х означает серу, имеют формулу где R1, R2 и Аr являются такими, как указано выше. Эти пиридопиримидинтионы получают при реакции соответствующих 7-оксосоединений (т.е. где Х означает кислород) с эквивалентным количеством реагента Lawesson'а или пятисернистого фосфора в растворителе,предпочтительно в пиридине или толуоле, при повышенной температуре от около 90 до 125 С в течение примерно от 1 до 24 ч. Продукт легко выделяют, просто удаляя используемые для проведения реакции растворители, и дальнейшая очистка может быть осуществлена при желании обычными способами, как, например,кристаллизация, хроматография и им подобные. 2-Окси-, 2-тио- и 2-аминопиридопиримидины по изобретению, соединения формулы могут альтернативно быть получены, как показано на схемах IV и V. Схема IV иллюстрирует способ синтеза соединений с основной боковой цепочкой в положении 2-пиридо[2,3-d]пиримидиновой циклической системы, например, где R1 означает NR3R4 и R3 означает водород или алкил с 1-6 атомами углерода, замещенный NR5R6, и R4 означает водород. На первой стадии альдегид, например 4-метиламино-2-метилсульфанилпиримидин-5 17 карбальдегид, подвергают конденсации с производным арилацетонитрила, например с 2,6 дихлорфенилацетонитрилом, в общем растворителе, например, N,N-диметилформамиде, и в присутствии избытка (от 1 до 5 молей) основания, предпочтительно измельченного в порошок карбоната калия или карбоната цезия, при температуре предпочтительно в интервале 110153 С в течение от 0,5 до 25 ч. Получающиеся 7-имино-2-метилсульфанилпроизводные годятся для получения разнообразных 2 аминопроизводных. Например, обработка 100500%-ным молярным избытком первичного амина, такого, как N,N-диэтиламинопропиламин, при температуре в интервале 100-150 С в течение примерно от 1 до 24 ч приводит к соответствующим 2-замещенным аминопроизводным. В случае аминов, которые кипят при температуре, меньшей, чем около 100 С, например,метиламин, этиламин, пропиламин и им подобные, для достижения желаемой температуры реакции может быть использован подходящий сосуд высокого давления. Получающиеся 2 амино-7-иминопроизводные легко подвергаются гидролизу, если желательно, в 2-амино-7 оксопроизводные при реакции с сильной минеральной кислотой, как, например, концентрированная соляная кислота или серная кислота, при температуре кипения в течение продолжительного периода времени, в интервале от 6 ч до 7 дней. Альтернативно, 7-имино-2-метилсульфанилпроизводные могут быть проацетилированы при реакции с хлорангидридами и ангидридами карбоновых кислот, например, хлористым ацетилом или ангидридом пропионовой кислоты,для получения соответствующих 7-ацилимино 2-метилсульфанилпиридопиримидинов. Эти соединения могут быть подвергнуты реакции с амином, как описано выше, чтобы осуществить замещение 2-метилсульфанильной группы и получить2-аминопиридопиримидин, имеющий ацилиминогруппу в положении 7 (т.е. Х = Nацил). 7-Ацилимидопроизводные могут быть подвергнуты реакции с сильной кислотой, как описано выше,для гидролиза 7 ацилиминогруппы в 7-оксогруппу. Сульфанильные соединения формулы I,т.е. где R1 означает SR3, легко окисляются в соответствующие сульфоксиды и сульфоны при реакции с такими средствами, как мхлорпербензойная кислота, перекись водорода,перборат натрия, кислый персульфат калия и им подобные. Как указывалось выше, сульфанильные,сульфинильные и сульфонильные производные формулы I особенно пригодны для получения соответствующих аминопроизводных, так как они легко реагируют с аминами (НNR3R4), подвергаясь нуклеофильному замещению. Это особенно предпочтительный способ получения 2 ариламино- и 2-гетероариламиносоединений по 18 изобретению (например, где R3 означает фенил или пиридил). Вышеописанные реакции окисления и нуклеофильного замещения проиллюстрированы на схеме VI. Окисление сульфанильного соединения формулы I осуществляют при реакции последнего с эквимолярным количеством окислителя,предпочтительно м-хлорпербензойной кислоты,для получения соответствующего сульфоксида или с двумя молярными эквивалентами для получения соответствующего сульфона. Окисление обычно проводят в органическом растворителе, как, например, хлороформ или дихлорметан, и, как правило, оно завершается в пределах от 1 до 24 ч, когда его проводят при температуре от 25 до 45 С. Большие количества окислителя и более продолжительное время реакции обеспечивают полное образование сульфона. Соответствующий сульфоксид или сульфон легко выделяют при фильтрации или при удалении используемого в реакции растворителя путем упаривания под вакуумом. Амины легко замещают сульфанильные,сульфинильные и сульфонильные группы, что приводит к соединениям формулы I, где R1 является NR3R4. Это особенно предпочтительный способ получения ариламиносоединений, т.е. фениламиносоединений, замещенных фениламиносоединений, гетероариламиносоединений(например, пиридиламиносоединений, тиениламиносоединений) и замещенных гетероариламиносоединений (например, этилпиридиламиносоединений). Замещение осуществляют при смешивании сульфанильного, сульфинильного или сульфонильного соединения с амином,предпочтительно первичным или вторичным амином. Амин обычно используют в избытке,например, от примерно 20 до 500-молярного избытка по отношению к сульфанильному,сульфинильному или сульфонильному соединению. Реагенты обычно смешивают чистыми или в общем органическом растворителе, например,диметилформамиде, простом этоксиэтиловом эфире, ледяной уксусной кислоте, диметилсульфоксиде и им подобных. Реакция обычно завершается через период примерно от 5 мин до примерно 6 ч, когда она проводится при повышенной температуре от примерно 100 до примерно 250 С. Продукт реакции, соединение формулы I, где R1 означает NR3R4, легко выделяют при фильтрации или при удалении используемого в реакции растворителя путем упаривания. Продукт может быть очищен далее, если желательно, путем кристаллизации, хроматографии или им подобных способов. 2-Аминопиридопиримидины по изобретению (формула I, где R1 означает NR3R4) могут альтернативно быть получены при реакции 2,4 диамино-5-пиримидинкарбоксальдегида с арилацетонитрилом (ArCH2CN). 2,4-Диамино-5 пиримидинкарбоксальдегиды могут быть получены из легко доступных 2-сульфанил- или 19 сульфинилпиримидинов при нуклеофильном замещении амином, как описано выше. Например, 2-сульфанил-4-(замещ.)амино-5-алкоксикарбонилпиримидин может быть подвергнут реакции с окислителем, как, например, оксазиридин, чтобы получить соответствующий сульфоксид или сульфон. Сульфоксидный или сульфоновый заместитель легко замещается при реакции с амином (HNR3R4), в результате чего образуется соответствующий 2,4-диамино-5 алкоксикарбонилпиримидин. Алкоксикарбонильный участок может быть превращен в альдегидный стандартными способами (т.е. восстановлением в спирт и окислением спирта в альдегид). 2,4-Диамино-5-пиримидинкарбоксальдегид легко реагирует с арилацетонитрилом с образованием 2-амино-6-арилпиридопиримидина по изобретению. Вышеупомянутые реакции представлены на схеме VII. Как указано выше, некоторые соединения по изобретению являются основными по характеру из-за замещающей группы, которая является основной, такой, как, например, аминогруппы. Соединения формулы I, в которых R1 означает NR3R4, являются обычно основными. Такие основные соединения легко образуют фармацевтически приемлемые соли с любым числом неорганических и органических кислот. Соли обычно являются кристаллическими и водорастворимыми и таким образом хорошо подходят для орального введения и ему подобного. Схема V иллюстрирует синтез 2 оксопиридопиримидинов. Промежуточные соединения с 2-метилсульфанильными заместителями, такими, как описано выше, могут быть подвергнуты реакции с алкоголятом, как, например, этоксиэтилат натрия, который обычно получают из эквивалентных количеств гидрида натрия и спирта. Обычно этоксиэтанол используется в качестве растворителя для реакции. Реакцию лучше проводить при повышенной температуре примерно от 100 до примерно 150 С, и обычно реакция заканчивается через промежуток времени примерно от 15 мин до примерно 6 ч. Получающийся простой 2-(2 этокси)этоксиэфир легко превращают в 2 гидроксисоединение при реакции с сильной минеральной кислотой, предпочтительно с 6 н. соляной кислотой, в течение примерно от 5 мин до 1 ч. 2-Гидрокси-7-иминопроизводное может быть гидролизовано в 7-оксосоединение при продолжительной реакции с сильной минеральной кислотой, предпочтительно с концентрированной соляной кислотой, при температуре кипения в течение периода времени примерно от 6 ч до 7 дней. Алкилирование и аралкилирование 2-гидроксипроизводных (предпочтительно, когда R2 означает другой заместитель, а не водород) могут быть проведены при желании при реакции с алкилирующим агентом, как, например, иодистый метил, бензилбромид, диэтиламиноэтилхлорид и им подобные, в общем рас 000897 20 творителе, предпочтительно диметилформамиде, обычно в присутствии основания, например порошкообразного карбоната калия. Такие реакции обычно заканчиваются в течение 2 ч, когда проводятся при температурах примерно от 25 до 100 С. Продукт легко выделяют при удалении используемых в реакции растворителей,дальнейшая очистка может быть осуществлена путем кристаллизации, хроматографии или подобными им способами. Схема I 23 Следующие подробные примеры далее иллюстрируют синтез соединений данного изобретения. Примеры являются только иллюстративными, их нельзя рассматривать как лимитирующие изобретение в каком-нибудь отношении. Пример 1. 5-Циан-4-гидрокси-2-метилсульфанилпиримидин. К раствору свежеперегнанного этилового эфира этоксиметиленциануксусной кислоты(118,99 г) в метаноле (800 мл) при 5 С прибавляли 2-метил-2-тиоизомочевину (107,69 г). К этой смеси прибавляли раствор метилата натрия в метаноле, приготовленный при растворении металлического натрия (35,59 г) в метаноле (800 мл). Реакционной смеси давали нагреться до комнатной температуры и перемешивали в течение 6 ч. После выдерживания в течении ночи растворитель удаляли в вакууме, остаток растворяли в 1500 мл воды при 50 С при перемешивании и раствор фильтровали горячим. Фильтрат подкисляли до рН 2 концентрированной соляной кислотой и оставляли на ночь при комнатной температуре. Продукт отфильтровывали и сушили, получали 48,33 г 5-циан-4 гидрокси-2-метилсульфанилпиримидина. Этот продукт использовали непосредственно на следующей стадии без дальнейшей очистки. Пример 2. 4-Хлор-5-циан-2-метилсульфанилпиримидин. Смесь 5-циан-4-гидрокси-2-метилсульфанилпиримидина (48,33 г) из примера 1 и хлорокиси фосфора (150 мл) нагревали при кипении в течение 3 ч. Реакционную смесь оставляли для охлаждения до комнатной температуры, фильтровали и фильтрат упаривали досуха в вакууме. Остаток распределяли между хлористым метиленом и водой, охлажденной до 0 С. Органический слой отделяли, промывали водой, сушили над сульфатом магния, фильтровали и упаривали в вакууме. Остаток нагревали до кипения в гексане (750 мл) при перемешивании. Горячий гексановый раствор декантировали от нерастворимого остатка и оставляли охлаждаться до комнатной температуры, получали 32 г 4-хлор 5-циан-2-метилсульфанилпиримидина. Пример 3. 5-Циан-4-метиламино-2-метилсульфанилпиримидин. Через холодный (5 С) раствор 4-хлор-5 циан-2-метилсульфанилпиримидина из примера 2 в диэтиловом эфире (700 мл) барботировали газообразный метиламин в течение 20 мин. Реакционную смесь перемешивали в течение 30 мин при 5 С, затем давали нагреться до комнатной температуры и перемешивали в течение ночи. Тонкослойная хроматография на пластинках с силикагелем указывала на незавершенность реакции. Реакционную смесь заново охлаждали до 5 С и барботировали газообразный метиламин через суспензию при перемешивании еще 20 мин. Реакционную смесь перемешивали при 25 С в течение 6 ч, затем оставляли на 24 ночь. Нерастворимый продукт собирали и суспендировали в воде при перемешивании. Суспензию фильтровали и продукт сушили в вакууме, получали 25,87 г указанного в заглавии 5-циан-4-метиламино-2-метилсульфанилпиримидина; т.пл. 185-187 С. Анализ, вычисленный для C7H8N4S: С, 46,65; Н, 4,47; N, 31,09; Найдено: С, 46,62; Н, 4,61; N, 31,43. Пример 4. 5-Циан-2-гидразино-4-метиламинопиримидин. Смесь 5-циан-4-метиламино-2-метилсульфанилпиримидина (25,86 г) из примера 3 и гидразингидрата (52 мл) в этаноле (250 мл) нагревали при кипении с перемешиванием в течение 3 ч. Реакционную смесь охлаждали до комнатной температуры и нерастворимый продукт собирали при фильтрации, промывали холодным водным этиловым спиртом (1:1) и получали 23 г указанного в заглавии соединения. При кристаллизации из этилового спирта получали аналитически чистый образец 5-циан-2-гидразино 4-метиламинопиримидина; т.пл. 247-249 С. Анализ, вычисленный для С 6 Н 8N6: С, 43,90; Н, 4,91; N, 51,21; Найдено: С, 44,05; Н, 4,92; N, 51,39. Пример 5. 2-Азидо-5-циан-4-метиламинопиримидин. К холодному (5 С) раствору 5-циан-2 гидразино-4-метиламинопиримидина (21,7 г) из примера 4 в смеси воды (260 мл) и концентрированной соляной кислоты (26,5 мл) прибавляли по каплям раствор азотистокислого натрия(10,03 г) в воде (25 мл) при механическом перемешивании сверху. Образовывался белый осадок, после того, как прибавление было закончено, перемешивали реакционную смесь еще дополнительно 20 мин при 5 С. Нерастворимый продукт отфильтровывали и промывали холодной водой, получали 22,4 г указанного в заглавии соединения после сушки при 23 С в высоком вакууме в течение ночи. При кристаллизации из этилового спирта получали аналитически чистый образец 2-азидо-5-циан-4-метиламинопиримидина; т.пл. 225-230 С. Анализ, вычисленный для С 6H5N7: С, 41,14; Н, 2,88; N, 55,99; Найдено: С, 40,88; Н, 2,81; N, 55,82. Пример 6. 2-Амино-4-метиламино-5 пиримидинкарбоксальдегид. К суспензии 2-азидо-5-циан-4-метиламинопиримидина (22,24 г) из примера 5 в 400 мл 50%-ной водной муравьиной кислоты прибавляли никелевый катализатор Ренея (5 г). Реакционную смесь встряхивали в атмосфере водорода (2,82 кг/см 2) в аппарате Парра для гидрирования. Наблюдалось бурное выделение газа, когда смесь встряхивали при комнатной температуре. Через 30 мин аппарат вентилировали,прибавляли дополнительное количество никеля Ренея (5 г), в аппарат заново подавали водород и смесь встряхивали в течение ночи. Катализатор 25 удаляли при фильтрации и фильтрат упаривали в высоком вукууме. Остаток суспендировали в воде и фильтровали. Нерастворимый остаток собирали и растворяли в 450 мл кипящей воды. Водный раствор фильтровали и рН фильтрата доводили до 7 с помощью 1 н. едкого натра. Осажденный продукт отфильтровывали и перекристаллизовывали из этилового спирта, получали 5,0 г 2-амино-4-метиламино-5-пиримидинкарбоксальдегида. Пример 7. 6-(2,6-Диметилфенил)-7-имино 8-метил-7,8-дигидропиридо[2,3-d]пиримидин-2 иламин. К 2-этоксиэтанолу (7 мл) при -10 С осторожно прибавляли при перемешивании гидрид натрия (60%-ная суспензия в минеральном масле, 83 мг, 2,08 ммоля). Смеси давали нагреться до комнатной температуры и прибавляли 2,6 диметилфенилацетонитрил (1,5 г, 10,33 ммоля),а затем 2-амино-4-метиламино-5-пиримидинкарбоксальдегид (1,5 г, 9,86 ммоля) из примера 6. Полученную в результате реакционную смесь нагревали при кипении в течение 2 ч, давали ей охладиться до комнатной температуры и выливали в воду. Нерастворимый технический продукт отфильтровывали и сушили на фильтре. Продукт очищали при растворении в кипящем этилацетате и прибавлении горячего гексана до момента непосредственно перед осаждением. Горячий раствор отфильтровывали, при охлаждении осаждался продукт, получали 1,22 г 6(2,6-диметилфенил)-7-имино-8-метил-7,8 дигидропиридо[2,3-d)пиримидин-2-иламина; т.пл. 197-198 С. Анализ, вычисленный для C16H17N5. 0,15 H2O: С, 68,14; Н, 6,18; N, 24,83; Найдено: С, 68,19; Н, 6,14; N, 24,60. Пример 8. 6-(2-Метилфенил)-7-имино-8 метил-7,8-дигидропиридо[2,3-d]пиримидин-2 иламин. Указанное в заглавии соединение получали аналогичным описанному в примере 7 способом, исходя из 2-метилфенилацетонитрила (0,72 г, 5,45 ммоля) и 2-амино-4-метиламино-5 пиримидинкарбоксальдегида (0,79 г, 5,19 ммоля). Как описывали выше, гидрид натрия (60%ная суспензия в минеральном масле, 0,083 г,2,08 ммоля) и 2-этоксиэтанол были использованы в качестве соответствующего основания и растворителя. Продукт очищали при кристаллизации из этилацетата - гексана и получали 0,68 г 6-(2-метилфенил)-7-имино-8-метил-7,8 дигидропиридо[2,3-d]пиримидин-2-иламина; т. пл. 189-190 С. Анализ, вычисленный для C15H15N5: С, 67,91; Н, 5,70; N, 26,40; Найдено: С, 67,52; Н, 5,71; N, 26,33. Пример 9. 6-Фенил-7-имино-8-метил-7,8 дигидропиридо[2,3-d]пиримидин-2-иламин. Указанное в заглавии соединение получали аналогичным описанному в примере 7 способом, исходя из фенилацетонитрила (6,5 мл) и 2 000897 26 амино-4-метиламино-5-пиримидинкарбоксальдегида (8,10 г). Однако вместо гидрида натрия в этой реакции использовали метилат натрия (0,5 г). Продукт очищали перекристаллизацией из изопропилового спирта и получали 9,2 г 6 фенил-7-имино-8-метил-7,8-дигидропиридо[2,3d]пиримидин-2-иламина; т. пл. 201-203 С. Анализ, вычисленный для C14H13N5: С, 66,91; Н, 5,21; N, 27,87; Найдено; С, 66,74; Н, 5,22; N, 27,90. Пример 10. 2,7-Диамино-6-(2,6-дихлорфенил)пиридо[2,3-d]пиримидин.(Получен по способу из патента США 3,534,039). К раствору 2-этоксиэтилата натрия, полученному из 0,14 г натрия и 60 мл 2 этоксиэтилового спирта, прибавляли 2,07 г 2,4 диамино-5-пиримидинкарбоксальдегида и 2,79 г 2,6-дихлорфенилацетонитрила. Смесь нагревали при кипении в течение 4 ч, давали ей охладиться до комнатной температуры и выпавший в осадок продукт фильтровали и промывали диэтиловым эфиром, получали 2,7-диамино-6-(2,6 дихлорфенил)пиридо[2,3-d]пиримидин; т. пл. 325-332 С. Пример 11. 2-Амино-6-(2,6-дихлорфенил) пиридо[2,3-d]пиримидин-7(8 Н)-он. Раствор 2,7-диамино-6-(2,6-дихлорфенил) пиридо[2,3-d]пиримидина (30,6 г) из примера 10 в концентрированной соляной кислоте (200 мл) нагревали при кипении в течение 24 ч. Реакционной смеси давали охладиться до комнатной температуры, затем фильтровали, промывали водой и сушили в вакууме, получали 16,5 г неочищенного продукта. Фильтрат кипятили еще 24 ч и после охлаждения получали дополнительно 8,8 г продукта. Оба продукта объединяли и перекристаллизовывали из диметилформамида, дважды промывали диэтиловым эфиром и сушили в вакууме, получали 5,9 г 2-амино-6(2,6-дихлорфенил)пиридо[2,3-d]пиримидин 7(8 Н)-она; т.пл. (разл.) 410 С. Анализ, вычисленный для C13H8Cl2N4O: С, 50,84; Н, 2,62; N, 18,24; Найдено: С, 50,45; Н, 2,87; N, 18,09. Пример 12. 2-Амино-6-(2,6-дихлорфенил)8-метилпиридо[2,3-d]пиримидин-7(8 Н)-он. К смеси 2-амино-6-(2,6-дихлорфенил) пиридо[2,3-d]пиримидин-7(8 Н)-она (3,7 г) из примера 11 в диметилформамиде прибавляли гидрид натрия (50%-ная суспензия в минеральном масле, 0,64 г). Получающуюся суспензию нагревали при 65 С в течение 0,5 ч до растворения. Затем охлаждали до 50 С и прибавляли в реакционную смесь по каплям раствор метилиодида (2,0 г) в диметилформамиде (10 мл). Реакционную смесь нагревали и выдерживали при 60-80 С в течение 3 ч. После охлаждения до комнатной температуры реакционную смесь выливали в воду со льдом. Нерастворимый белый продукт отфильтровывали, промывали водой и перекристаллизовывали из этилового 27 спирта с использованием активированного угля,получали 1,9 г 2-амино-6-(2,6-дихлорфенил)-8 метилпиридо[2,3-d]пиримидин-7(8 Н)-она; т. пл. 235-237 С. Анализ, вычисленный для С 14 Н 10 Сl2N4 О: С, 52,36; Н, 3,14; N, 17,44; Найдено; С, 52,03; Н, 3,24; N, 17,46. Пример 13. 2-Амино-6-(2,6-диметилфенил)-8-метилпиридо[2,3-d]пиримидин-7(8 Н)он. Смесь 6-(2,6-диметилфенил)-7-имино-8 метил-7,8-дигидропиридо[2,3-d]пиримидин-2 иламина (0,96 г) из примера 7 и водной 6 н. соляной кислоты (25 мл) нагревали при кипении в течение 2 дней. Смеси давали охладиться до комнатной температуры и выдерживали в течение ночи при температуре окружающей среды. Нерастворимый белый твердый остаток отфильтровывали, промывали водой и сушили на воздухе. Неочищенный продукт растворяли в горячем этиловом спирте, прибавляли горячий этилацетат до момента непосредственно перед началом выпадения осадка и фильтровали горячий раствор. После охлаждения чистый продукт подвергали кристаллизации и получали 25 мг 2 амино-6-(2,6-диметилфенил)-8-метилпиридо[2,3-d]пиримидин-7(8 Н)-она; плавится с постепенным разложением выше 235 С. Анализ,вычисленный дляC16H16N4O 1 НСl0,15 Н 2O: С, 59,38; Н, 5,53; N, 17,31; Найдено: С, 59,42; Н, 5,37; N, 17,53. Пример 14. 2-Амино-6-(2-метилфенил)-8 метилпиридо[2,3-d]пиримидин-7(8 Н)-он. К смеси 6-(2-метилфенил)-7-имино-8 метил-7,8-дигидропиридо[2,3-d]пиримидин-2 иламина (0,30 г) из примера 8 и концентрированной соляной кислоты (0,6 мл) прибавляли воду (11 мл). Реакционную смесь кипятили 20 ч,затем оставляли охлаждаться до комнатной температуры. Белый осадок из реакционной смеси отфильтровывали и промывали водой. Продукт сушили в вакууме, получали 0,21 г 2 амино-6-(2-метилфенил)-8-метилпиридо[2,3-d] пиримидин-7(8 Н)-она; т. пл. 239-241 С. Анализ, вычисленный для C15H14N4O1,46 НСl: С, 56,45; Н, 4,88; N, 17.55; Найдено: С, 56,47; Н, 4,68; N, 17,59. Пример 15. N-[6-(2,6-Дихлорфенил)-8 метил-7-оксо-7,8-дигидропиридо[2,3-d]пиримидин-2-ил]ацетамид. Смесь 64,2 мг (0,20 ммоля) 2-амино-6-(2,6 дихлорфенил)-8-метилпиридо[2,3-d]пиримидин 7(8 Н)-она (из примера 12) и 1 мл уксусного ангидрида нагревали до кипения. Полученный раствор выдерживали при кипении в течение 20 мин и упаривали при атмосферном давлении до объема около 0,25 мл. Раствор охлаждали до 25 С и разбавляли диэтиловым эфиром (1 мл). Отделившиеся кристаллы фильтровали и промывали диэтиловым эфиром, получали N-[6 000897(44,0 мг); т. пл. 258-260 С. Масс-спектр (химическая ионизация /х.и./) 363 (М 1). Анализ, вычисленный для C16H12Cl2N4O2: С, 52,91; Н, 3,33; N, 15,43; Найдено: С, 52,73; Н, 3,47; N, 15,09. Пример 16. N-[6-(2,6-Дихлорфенил)-7 оксо-8-метил-7,8-дигидропиридо[2,3-d]пиримидин-2-ил]полуамид янтарной кислоты. Смесь 0,40 г (1,25 ммоля) 2-амино-6-(2,6 дихлорфенил)-8-метилпиридо[2,3-d]пиримидин 7(8 Н)-она (из примера 12) и 2,00 г (10,0 ммоля) янтарного ангидрида подвергали реакции при 145 С. Через 10 мин гомогенный расплав охлаждали и растирали с 25 мл воды. Смесь нагревали при температуре кипения в течение 5 мин для гидролиза избытка ангидрида. Смесь фильтровали горячей и осадок на фильтре промывали 10 мл кипящей воды. Высушенный осадок (0,50 г) растирали с 8 мл метилового спирта: хлороформа (1:20). Нерастворимый твердый остаток отфильтровывали и промывали 1 мл такого же растворителя, получали 0,037 г указанного в заглавии соединения; т. пл. 214-218 С. Анализ, вычисленный для C18H14Cl2N4O40,8H2O: С, 49,62; Н, 3,61; N, 12,86; Найдено: С, 49,26; Н, 3,16; N, 12,83. Пример 17. 1-[6-(2,6-Дихлорфенил)-7 оксо-8-метил-7,8-дигидропиридо[2,3-d]пиримидин-2-ил]пирролидин-2,5-дион. Метанольно-хлороформный фильтрат из примера 16 хроматографировали на силикагеле,вымывая метанолом:хлороформом(1:20,об./об.), получали 0,161 г чистого кристаллического 1-[6-(2,6-дихлорфенил)-7-оксо-8-метил 7,8-дигидропиридо[2,3-d]пиримидин-2-ил]пирролидин-2,5-диона; т. пл. 303-305 С. Анализ, вычисленный для C18H12Cl2N4O3: С, 53,62; Н, 3,00; N, 13,89; Найдено: С, 53,75; Н, 2,90; N, 13,79. Пример 18. 4-Метиламино-2-метилсульфанилпиримидин-5-карбоксальдегид. Раствор 4,00 г (0,022 моля) 5-циан-4 метиламино-2-метилсульфанилпиримидина ( из примера 3) в 150 мл 50%-ной водной муравьиной кислоты подвергали реакции с 6,0 г никеля Ренея в воде. Смесь перемешивали при 25 С в течение 12 ч. Твердые продукты отфильтровывали и промывали 40 мл 50%-ной водной муравьиной кислоты. При охлаждении в бане со льдом медленно прибавляли холодный насыщенный раствор карбоната калия к зеленому фильтрату до полного осаждения твердого осадка (рН ещ кислотный; рН около 5). Твердое вещество экстрагировали 200 мл этилацетата и раствор сушили (карбонатом калия), фильтровали и упаривали; получали 2,30 г (57%); т. пл. 98-100 С; при тонкослойной хроматографии(М+1). Анализ, вычисленный для C7H9N3OS: С, 45,89; Н, 4,95; N, 22,93. Найдено: С, 46,24; Н, 4,88; N, 23,11. Пример 18 А. Альтернативный синтез 4 метиламино-2-метилсульфанилпиримидин-5 карбоксальдегида. К раствору этилового эфира 4-хлор-2 метилсульфанил-5-пиримидинкарбоновой кислоты (18,66 г, 80,4 ммоля) в 260 мл тетрагидрофурана прибавляли триэтиламин (34 мл, 244 ммоля), а затем 30 мл 40%-ного водного раствора метиламина. Раствор перемешивали 30 мин при 25 С, затем концентрировали в вакууме и распределяли между хлороформом и насыщенным водным раствором бикарбоната натрия. Органический слой промывали соляным раствором, сушили над сульфатом магния, фильтровали и упаривали, получали белый твердый остаток. Твердый остаток суспендировали в гексане и фильтровали, получали 14,7 г (81%) этилового эфира 4-метиламино-2-метилсульфанил-5 пиримидинкарбоновой кислоты, т. пл. 91-93 С. Анализ, вычисленный для C9H13N3O2S: С, 47,56; Н, 5,76; N, 18,49. Найдено: С, 47,93; Н, 5,67; N, 18,58. Раствор этилового эфира 4-метиламино-2 метилсульфанил-5-пиримидинкарбоновой кислоты (4,36 г, 19,3 ммоля) в 60 мл тетрагидрофурана прибавляли по каплям к имеющей комнатную температуру суспензии алюмогидрида лития (1,10 г, 29,0 ммоля) в 40 мл тетрагидрофурана. Через 10 мин реакцию осторожно останавливали прибавлением 2 мл воды, 2 мл 15%ного едкого натра и ещ 7 мл воды. Смесь перемешивали в течение 1 ч и образовавшийся белый осадок отфильтровывали и промывали этилацетатом. Фильтрат концентрировали в вакууме и прибавляли гексан:этилацетат 3:1. Твердый продукт собирали и получали 2,99 г(84%) 4-метиламино-2-метилсульфанил-5 пиримидинметанола; т. пл. 155-157 С. Анализ, вычисленный для С 7 Н 11N3 ОS: С, 45,39; Н, 5,99; N, 22,68. Найдено: С, 45,42; Н, 5,93, N, 22,42. 4-Метиламино-2-метилсульфанил-5-пиримидинметанол (2,40 г, 13,0 ммоля) в 7 мл уксусной кислоты прибавляли к раствору дигидрата двухромовокислого натрия (1,30 г, 4,4 ммоля) в 6 мл уксусной кислоты. После выдержки в течение 2 ч при комнатной температуре прибавляли ещ дигидрат двухромовокислого натрия (0,3 г,1,0 ммоль) в 1 мл уксусной кислоты. После общего времени реакции в 3,5 ч ярко-желтый твердый продукт отфильтровывали. К фильтрату прибавляли воду (30 мл), затем водную гидроокись аммония до щелочной реакции (рН 9,0). Смесь охлаждали в холодильнике в течение 30 мин. Осадок собирали и растворяли в этилацетате, раствор сушили над сульфатом магния. После фильтрации и концентрирования в ва 000897 30 кууме получали 0,72 г (30%) 4-метиламино-2 метилсульфанил-5-пиримидинкарбоксальдегида; т. пл. 99-101 С. Анализ, вычисленный для C7H9N3OS: С, 45,89; Н, 4,95; N, 22,93. Найдено: С, 45,80; Н, 4,96; N, 22,86. Пример 19. 6-(2,6-Дихлорфенил)-8-метил 2-метилсульфанил-8 Н-пиридо[2,3-d]пиримидин 7-илиденамин. Порошкообразный карбонат калия (0,8 г; 5,8 ммоля) прибавляли к раствору 0,220 г (1,2 ммоля) альдегида из примера 18 и 0,235 г (1,26 ммоля) (примерно 5%-ный избыток) 2,6 дихлорфенилацетонитрила в 2,0 мл диметилформамида. Смесь нагревали при перемешивании при 125 С в течение 6 ч. К охлажденной смеси прибавляли этилацетат (5 мл) и твердый продукт отфильтровывали и промывали этилацетатом. Фильтрат концентрировали в вакууме. Смолообразный остаток растирали с 10 мл воды и образовавшийся твердый продукт отфильтровывали, хорошо промывали водой и сушили. Этот неочищенный продукт хроматографировали, нанося хлороформный раствор на колонку с силикагелем, промытую хлороформом. Вещество с колонки вымывали гексаном:этилацетатом 1:1 (об./об.), собирая фракции, в которых обнаруживали пятно с Rf 0,25 при ТСХ (в гексане: этилацетате 1:1). При упаривании растворителей получали твердый продукт. Твердый продукт растворяли примерно в 0,5 мл хлористого метилена. Образовывались кристаллы. Прибавляли петролейный эфир (около 2 мл) и кристаллы отфильтровывали, получали 0,168 г (40%) 6(2,6-дихлорфенил)-8-метил-2-метилсульфанил 8 Н-пиридо[2,3-d]пиримидин-7-илиденамина, т. пл. 198-200 С. Масс-спектр (х.и.) 351 (М+1). Анализ, вычисленный для C15H12Cl2N4S: С, 51,29; Н, 3,44; N, 15,95. Найдено: С. 51,31; Н, 3,41; N, 15,73. Пример 20. [6-(2,6-Дихлорфенил)-7-имино 8-метил-7,8-дигидропиридо[2,3-d]пиримидин-2 ил]-(3-диэтиламинопропил)амин. Раствор 0,275 г (0,78 ммоля) метилсульфанильного производного из примера 19 в 3 млN,N-диэтиламинопропиламина нагревали при перемешивании в течение 16 ч на масляной бане с температурой 135 С (температура в реакционном сосуде примерно 125 С). Избыток амина удаляли в вакууме, а оставшееся масло растворяли в 10 мл диэтилового эфира. Мутный раствор осветляли целитом, фильтровали и концентрировали. Остаток растирали с петролейным эфиром и фильтровали, получали 0,288 г (выход 85%). Перекристаллизация из этилацетата - петролейного эфира приводила к чистому продукту,идентифицированному как 31 С, 57,60; Н, 6,10; N, 19,19. Найдено: С, 57,46; Н, 5,85; N, 19,16. Пример 21. [6-(2,6-Дихлорфенил)-8-метил 7-оксо-7,8-дигидропиридо[2,3-d]пиримидин-2 ил]-(3-диэтиламинопропил)амин. Раствор 0,111 г (0,25 ммоля) иминопроизводного из примера 20 в 5 мл концентрированной соляной кислоты нагревали при кипении в течение 6 дней. Разбавленную кислоту упаривали в вакууме, а остаток растворяли в 1,0 мл воды. Прибавляли водный 10%-ный раствор карбоната калия для полного осаждения смолистого вещества. Растворитель декантировали, а смолистое вещество растворяли в 15 мл хлористого метилена. Раствор сушили над безводным карбонатом калия, фильтровали и фильтрат упаривали. Оставшееся смолистое вещество растворяли в 0,5 мл диэтилового эфира. Образовавшийся кристаллический продукт отфильтровывали и высушивали, получали [6-(2,6 дихлорфенил)-8-метил-7-оксо-7,8-дигидропиридо[2,3-d]пиримидин-2-ил]-(3-диэтиламинопропил)амин. Масс-спектр (х.и.) 434 (М+). Пример 22. 6-(2,6-Дихлорфенил)-2-(2 этоксиэтокси)-8-метил-8 Н-пиридо[2,3-d]пиримидин-7-илиденамин. Количество в 40,0 мг (1,0 ммоль) 60%-ной суспензии гидрида натрия в минеральном масле прибавляли при перемешивании к 5,0 мл этоксиэтанола. После прекращения выделения водорода прибавляли 0,351 г (1,0 ммоль) метилсульфанильного производного из примера 19. Раствор нагревали при 135 С в течение 15 мин. Реакционную смесь охлаждали. Прибавляли воду со льдом (50 мл) для осаждения твердого смолистого вещества. Это вещество экстрагировали диэтиловым эфиром, раствор сушили (карбонатом калия) и концентрировали до объема в 15 мл. Выпавшие кристаллы отфильтровывали и промывали диэтиловым эфиром, получали продукт,идентифицированный как 6-(2,6 дихлорфенил)-2-(2-этоксиэтокси)-8-метил-8 Нпиридо[2,3-d]пиримидин-7-илиденамин; т.пл. 133-135 С. Масс-спектр (х.и.) 393 (М+1). Анализ, вычисленный для C18H18Cl2N4O2: С, 54,97; Н, 4,61; N, 14,25. Найдено: С, 55,05; Н, 4,65; N, 14,15. Пример 23. 6-(2,6-Дихлорфенил)-2 гидрокси-8-метил-8 Н-пиридо[2,3-d]пиримидин 7-илиденамин. Раствор 78,0 мг (0,20 ммоля) простого этоксиэтилового эфира из примера 22 в 1,0 мл 6 н. соляной кислоты нагревали при кипении в течение 5 мин. Растворитель удаляли при упаривании в вакууме. Оставшуюся твердую солянокислую соль перекристаллизовывали из этилового спирта - этилацетата и получали кристаллический гидрохлорид 6-(2,6-дихлорфенил)-2-гидрокси-8-метил-8 Н-пиридо[2,3-d] пиримидин-7-илиденамина; т. пл. 255-260 С. Масс-спектр (х.и.) 321 (М+1).C2H5OH: С, 47,21; Н, 3,48; N, 15,08. Найдено: С, 47,21; Н, 3,40; N, 14,73. Пример 24. 6-(2,6-Дихлорфенил)-2 гидрокси-8-метил-8 Н-пиридо[2,3-d]пиримидин 7-он. Раствор 76,0 мг (0,19 ммоля) иминопроизводного из примера 23 в 5,0 мл концентрированной соляной кислоты нагревали при кипении в течение 3 дней и растворитель затем удаляли при упаривании. Остаток растирали с водой,фильтровали и сушили, получали 6-(2,6-дихлорфенил)-2-гидрокси-8-метил-8 Н-пиридо[2,3d]пиримидин-7-он в виде гидрата. Масс-спектр(х.и.) 322 (М+). Анализ, вычисленный для C14H9Cl2N3O21,25 Н 2O: С, 48,78; Н, 3,37; N, 12,19. Найдено: С, 48,68; Н, 3,25; N, 11,96. Пример 25. 6-(2,6-Дихлорфенил)-2-[2(диэтиламино)этокси]-8-метил-8 Н-пиридо[2,3d]пиримидин-7-он. Смесь 0,173 г (0,5 ммоля) 2-гидроксипроизводного из примера 24 0,086 г (0,5 ммоля) хлоргидрата 2-диэтиламиноэтилхлорида, 3 мл диметилформамида и 1,0 г порошкообразного безводного карбоната калия перемешивали при комнатной температуре в течение 24 ч. Для осаждения неочищенного продукта прибавляли воду (25 мл). Очистку осуществляли при хроматографии на силикагеле и получали желаемое соединение, идентифицированное как 6-(2,6 дихлорфенил)-2-[2-(диэтиламино)этокси]-8 метил-8 Н-пиридо[2,3-d]пиримидин-7-он. Пример 26. 2-Амино-6-фенил-8-метилпиридо[2,3-d]пиримидин-7(8 Н)-он. Это соединение получали из 6-фенил-7 имино-8-метил-7,8-дигидропиридо[2,3-d]пиримидин-2-иламина из примера 9 при кислотном гидролизе, аналогичном описанному в примере 14; т. пл. 250-255 С. Пример 27. 2-Амино-6-(2,6-дихлорфенил)8-метилпиридо[2,3-d]пиримидин-7(8 Н)-тион. Смесь 0,321 г (1,0 ммоль) 2-амино-6-(2,6 дихлорфенил)-8-метилпиридо[2,3-d]пиримидин 7(8 Н)-она из примера 12 и 0,404 г (1,0 ммоль) реагента Lawesson'а в 10 мл пиридина нагревали при кипении и перемешивании в течение 24 ч. Растворитель упаривали в вакууме, а остаток растирали с 20 мл воды, фильтровали и осадок на фильтре промывали водой. После очистки хроматографией на силикагеле получали желаемое соединение, идентифицированное как 2 амино-6-(2,6-дихлорфенил)-8-метилпиридо[2,3d]пиримидин-7(8 Н)-тион. Пример 28. N-[6-(2,6-Дихлорфенил)-8-метил-2-метилсульфанил-8 Н-пиридо[2,3-d]пиримидин-7-илиден]ацетамид. Смесь 0,161 г (0,46 ммоля) 6-(2,6 дихлорфенил)-8-метил-2-метилсульфанил-8 Нпиридо[2,3-d]пиримидин-7-илиденамина из примера 19 и 1,0 мл уксусного ангидрида нагревали до растворения при температуре кипения. Через 2 мин кипения раствор концентрировали до половины объема, после чего образовывались кристаллы. Смесь охлаждали, прибавляли 2 мл диэтилового эфира и продукт отфильтровывали и промывали диэтиловым эфиром; т. пл. 229-231 С. Масс-спектр (х.и.) 393 (М+). Анализ, вычисленный для C17H14Cl2N4OS: С, 51,92; Н, 3,59; N, 14,25. Найдено: С, 52,12; Н, 3,62; N, 14,20. Пример 29. N-[6-(2,6-Дихлорфенил)-2-(4 диэтиламинобутиламино)-8-метил-8 Н-пиридо Смесь 0,112 г (0,29 ммоля) N-[6-(2,6 дихлорфенил)-8-метил-2-метилсульфанил-8 Нпиридо[2,3-d]пиримидин-7-илиден]ацетамида из примера 28 и 1,0 мл (большой избыток) 4(диэтиламино)бутиламина нагревали при перемешивании на нагретой до 135 С масляной бане. Через 1 ч раствор концентрировали при пониженном давлении и остаток растирали с 1 мл этилацетата. Прибавляли петролейный эфир (1 мл) и продукт фильтровали. Масс-спектр (х.и.) 489 (М+). Пример 30. 2-Амино-6-(2,6-дихлорфенил)8-этилпиридо[2,3-d]пиримидин-7(8 Н)-он. К суспензии гидрида натрия (60%-ная в минеральном масле, 27 мг) в 5 мл диметилформамида прибавляли 2-амино-6-(2,6-дихлорфенил)-пиридо[2,3-d]пиримидин-7(8 Н)-он (172 мг, 0,56 ммоля) из примера 11. Смесь нагревали при 50 С в течение 1 ч и получали прозрачный раствор. Прибавляли йодистый этил (60 мкл,0,75 ммоля) и раствор перемешивали при 50 С в течение 3,5 ч, охлаждали до комнатной температуры и выливали в 30 мл воды со льдом. Выпавший осадок отфильтровывали и распределяли между этилацетатом и водой. Органический слой отделяли и сушили над сульфатом магния,фильтровали и концентрировали в вакууме. После флеш-хроматографии и вымывания этилацетатом получали 104 мг (55%) 2-амино-6-(2,6 дихлорфенил)-8-этилпиридо[2,3-d]пиримидин 7(8 Н)-она; т. пл. 207-209 С. 34 Анализ, вычисленный для C15H12Cl2N4O: С, 53,75; Н, 3,61; N, 16,71. Найдено: С, 53,84; Н, 3,67; N, 16,57. Пример 31. 2-Амино-6-(2,6-дихлорфенил)8-пропил-8 Н-пиридо[2,3-d]пиримидин-7-он. К суспензии гидрида натрия (60%-ная в минеральном масле, 31 мг) в 6 мл диметилформамида прибавляли 2-амино-6-(2,6 дихлорфенил)-пиридо[2,3-d]пиримидин-7(8 Н)он из примера 11 (205 мг, 0,67 ммоля). Смесь нагревали при 50 С в течение 1 ч, получался прозрачный раствор. Прибавляли 1-иодпропан(100 мкл, 1,03 ммоля) и раствор перемешивали при 50 С в течение 10 мин, затем охлаждали до комнатной температуры и выливали в 40 мл воды со льдом. Образовавшийся осадок отфильтровывали и промывали водой. Остаток сушили и очищали с помощью флешхроматографии, вымывали гексаном - этилацетатом 1:1, получали 159 мг (68%) 2-амино-6(2,6-дихлорфенил)-8-пропил-8 Н-пиридо[2,3-d] пиримидин-7-она; т. пл. 196-197 С. Анализ, вычисленный для C16H14Cl2N4O: С, 55,03; Н, 4,04; N, 16,04. Найдено: С, 55,28; Н, 4,22; N, 15,81. Пример 32. 2-Амино-8-бутил-6-(2,6 дихлорфенил)-8 Н-пиридо[2,3-d]пиримидин-7 он. К суспензии гидрида натрия (60%-ная в минеральном масле, 34 мг) в 6 мл диметилформамида прибавляли 2-амино-6-(2,6-дихлорфенил)-пиридо[2,3-d]пиримидин-7(8 Н)-он (202 мг, 0,66 ммоля). Смесь нагревали до 50 С, что приводило к прозрачному раствору. Прибавляли 1-иодбутан (105 мкл, 0,92 ммоля) и раствор перемешивали при 50 С в течение 30 мин, затем охлаждали до комнатной температуры и выливали в 40 мл воды со льдом. Образовавшийся осадок отфильтровывали и промывали водой. Остаток сушили и очищали с помощью флешхроматографии, вымывая с градиентом гексаном - этилацетатом 1:1 до одного этилацетата,получали 152 мг (64%) 2-амино-8-бутил-6-(2,6 дихлорфенил)-8 Н-пиридо[2,3-d]пиримидин-7 она; т. пл. 202-205 С. Анализ, вычисленный для C17H16Cl2N4O0,08EtOAc: С, 56,18; Н, 4,52; N, 15,13. Найдено: С, 56,39; Н, 4,64; N, 14,99. Пример 33. 2-Амино-6-(2,6-дихлорфенил)8-изобутил-8 Н-пиридо[2,3-d]пиримидин-7-он. К суспензии гидрида натрия (60%-ная в минеральном масле, 36 мг) в 8 мл диметилформамида прибавляли 2-амино-6-(2,6-дихлорфенил)пиридо[2,3-d]пиримидин-7(8 Н)-он (205 мг, 0,67 ммоля). Смесь нагревали при 60 С в течение 20 мин и получали в результате прозрачный раствор. Прибавляли 1-иод-2 метилпропан (110 мкл, 0,94 ммоля) и раствор перемешивали при 50 С в течение 30 мин. Прибавляли дополнительное количество 1-иод-2 метилпропана (40 мкл, 0,34 ммоля) и раствор 35 перемешивали при 50 С в течение 40 мин, затем охлаждали до комнатной температуры и выливали в 40 мл воды со льдом. Образовавшийся осадок отфильтровывали и промывали водой. Смолистый остаток растворяли в этилацетате и промывали водой. Органический слой сушили над сульфатом магния, фильтровали и концентрировали в вакууме. Полученное в результате твердое вещество очищали с помощью флешхроматографии, вымывая гексаном - этилацетатом 1:1, получали 123 мг (51%) 2-амино-6-(2,6 дихлорфенил)-8-изобутил-8 Н-пиридо[2,3-d] пиримидин-7-она; т. пл. 193-195 С. Анализ, вычисленный для C17H16Cl2N4O: С, 56,21; Н, 4,44; N, 15,42. Найдено: С, 56,60; Н, 4,59; N, 15,11. Пример 34. 2-Амино-6-(2,6-дихлорфенил)8-(3-диметиламинопропил)-8 Н-пиридо[2,3-d] пиримидин-7-он. К суспензии гидрида натрия (60%-ная в минеральном масле, 50 мг) в 8 мл диметилформамида прибавляли 2-амино-6-(2,6 дихлорфенил)пиридо[2,3-d]пиримидин-7(8 Н)-он(319 мг, 1,04 ммоля). Смесь нагревали при 70 С в течение 1,5 ч и получали в результате прозрачный раствор. Во вторую колбу, содержащую гидрид натрия (60%-ная суспензия в минеральном масле, 68 мг) в 6 мл диметилформамида, прибавляли хлоргидрат 3-диметиламинопропилхлорида (248 г, 1,56 ммоля). Эту суспензию перемешивали при комнатной температуре в течение 30 мин, затем нагревали при 70 С в течение 10 мин и прибавляли к вышеупомянутому раствору натриевой соли 2-амино-6-(2,6 дихлорфенил)-пиридо[2,3-d]пиримидин-7(8 Н)она. Полученную в результате суспензию нагревали при 70 С в течение 3 ч, затем охлаждали до комнатной температуры и фильтровали, промывая этилацетатом. Фильтрат концентрировали в вакууме и прибавляли этилацетат и гексан. Полученный в результате твердый продукт отфильтровывали и сушили в вакууме, получали 216 мг (53%) 2-амино-6-(2,6-дихлорфенил)-8-(3 диметиламинопропил)-8 Н-пиридо[2,3d]пиримидин-7-она; т. пл. 136-141 С. Анализ, вычисленный для C18H19Cl2N5O: С, 55,11; Н, 4,88; N, 17,85. Найдено: С, 55,07; Н, 5,00; N, 17,53. Пример 35. Метиловый эфир [2-амино-6(2,6-дихлорфенил)-7-оксо-7 Н-пиридо[2,3-d] пиримидин-8-ил]уксусной кислоты. К суспензии гидрида натрия (60%-ная в минеральном масле, 38 мг) в 6 мл диметилформамида прибавляли 2-амино-6-(2,6-дихлорфенил)пиридо[2,3-d]пиримидин-7(8 Н)-он (203 мг, 0,66 ммоля). Смесь нагревали при 50 С в течение 40 мин и в результате получали прозрачный раствор. Прибавляли метиловый эфир хлоруксусной кислоты (90 мкл, 1,03 ммоля) и раствор нагревали при 50 С в течение 20 мин,затем охлаждали до комнатной температуры и выливали в 30 мл воды со льдом. Полученный в 36 результате осадок отфильтровывали и промывали водой. Водный фильтрат экстрагировали этилацетатом и органический слой сушили над сульфатом магния, фильтровали и упаривали. Твердые продукты объединяли и очищали с помощью флеш-хроматографии, элюируя с градиентом гексаном - этилацетатом 1:1 до одного этилацетата, получали 152 мг (61%) метилового эфира [2-амино-6-(2,6-дихлорфенил)-7-оксо-7 Нпиридо[2,3-d]пиримидин-8-ил]уксусной кислоты; т. пл. 188-190 С. Анализ, вычисленный для С 16 Н 12 Сl2N4O3: С, 50,68; Н, 3,19; N, 14,77. Найдено: С, 50,74; Н, 3,31; N, 14,39. Пример 36. трет-Бутиловый эфир [2 амино-6-(2,6-дихлорфенил)-7-оксо-7 Н-пиридо[2,3-d]пиримидин-8-ил]уксусной кислоты. К суспензии гидрида натрия (60%-ная в минеральном масле, 67 мг) в 10 мл диметилформамида прибавляли 2-амино-6-(2,6 дихлорфенил)-пиридо[2,3-d]пиримидин-7(8 Н)он (398 мг, 1,30 ммоля). Смесь нагревали при 45-55 С в течение 40 мин, получая в результате прозрачный раствор. Прибавляли третбутиловый эфир бромуксусной кислоты (250 мкл, 1,69 ммоля) и раствор перемешивали при 50 С в течение нескольких минут, затем охлаждали до комнатной температуры и выливали в 60 мл воды со льдом. Образующийся в результате осадок отфильтровывали и промывали водой. Твердое вещество очищали с помощью флеш-хроматографии, элюируя с градиентом гексаном-этилацетатом 1:2 до одного этилацетата, получали 165 мг (30%) трет-бутилового эфира[2-амино-6-(2,6-дихлорфенил)-7-оксо-7 Нпиридо[2,3-d]пиримидин-8-ил]уксусной кислоты; т. пл. 171-173 С. Анализ, вычисленный для C19H18Cl2N4O3: С, 54,17; Н, 4,31; N, 13,30. Найдено: С, 54,17; Н, 4,34; N, 13,08. Пример 37. 6-(2,6-Дихлорфенил)-8-метил 2-метилсульфанил-8 Н-пиридо[2,3-d]пиримидин 7-он. Раствор 0,20 г (0,51 ммоля) N-[6-(2,6 дихлорфенил)-8-метил-2-метилсульфанил-8 Нпиридо[2,3-d]пиримидин-7-илиден]ацетамида из примера 28 в 2,0 мл 6 н. соляной кислоты нагревали при перемешивании до температуры кипения. Немедленно отделялись кристаллы. Густую смесь нагревали еще 2 мин при температуре кипения, охлаждали и фильтровали. Осадок на фильтре хорошо промывали водой и сушили,получали 0,175 г (92%); т. пл. 249-251 С. Массспектр (х.и.) 352 (М+). Анализ, вычисленный для C15H11Cl2N3OS1,4 Н 2 О: С, 47,58; Н, 3,57; N, 11,16. Найдено; С, 47,60; Н, 3,12; N, 11,14. Пример 38. 6-(2,6-Дихлорфенил)-8-метил 2-[3-(4-метилпиперазин-1-ил)пропиламино]-8 Нпиридо[2,3-d]пиримидин-7-он. 37 Смесь 0,152 г (0,43 ммоля) 6-(2,6 дихлорфенил)-8-метил-2-метилсульфанил-8 Нпиридо[2,3-d]пиримидин-7-она из примера 37 и 1,0 г (6,40 ммоля) 1-(3-аминопропил)-4 метилпиперазина нагревали при перемешивании в течение 3 ч на масляной бане с температурой 170 С (температура в реакционном сосуде примерно 160 С). Избыток амина удаляли в вакууме. Прибавляли воду (5 мл) и отделившееся смолистое вещество экстрагировали 50 мл 10% хлористого метилена в диэтиловом эфире. Органическую фазу трижды промывали 10 мл воды, сушили (карбонат калия), обрабатывали активированным углем, фильтровали и концентрировали. Оставшийся смолистый продукт растворяли в 3 мл диэтилового эфира. Кристаллы, которые отделялись при добавлении затравки, отфильтровывали и промывали диэтиловым эфиром; получали 0,033 г; т.пл. 170-172 С. Масс-спектр (х.и.) 461 (М+). Анализ, вычисленный для С 22 Н 26 Сl2N6 О: С, 57,27; Н, 5,68; N, 18,21. Найден: С, 57,39; Н, 5,70; N, 18,10. Пример 39. 6-(2,6-Дихлорфенил)-2-метансульфонил-8-метил-8 Н-пиридо[2,3-d]пиримидин-7-он. Количество 50-60%-ной м-хлорнадбензойной кислоты, составляющее 0,346 г (1,00 ммоль) (допуская, что была 50%-ная надкислота), прибавляли при 25 С к перемешиваемому раствору 0,165 г (0,47 ммоля) 6-(2,6 дихлорфенил)-8-метил-2-метилсульфанил-8 Нпиридо[2,3-d]пиримидин-7-она из примера 37 в 15 мл хлороформа, раствор перемешивали в течение ночи. Прибавляли 0,25 г (3,2 ммоля) диметилсульфоксида для уменьшения избытка надкислоты. Через 15 мин хлороформный раствор промывали 30 мл насыщенного раствора бикарбоната натрия и затем водой. Отделившийся органический слой сушили над сернокислым натрием, фильтровали и концентрировали до объема примерно в 5 мл. Выпадали кристаллы. Прибавляли около 5 мл петролейного эфира и фильтровали; получали 0,165 г (92%); т. пл. 290 С. Масс-спектр (х.и.) 384 (М+). Анализ, вычисленный для C15H11Cl2N3O3S: С, 46,89; Н, 2,89; N, 10,94. Найдено: С, 47,14; Н, 2,96; N, 10,87. Пример 40. 6-(2,6-Дихлорфенил)-8-метил 2-метиламино-8 Н-пиридо[2,3-d]пиримидин-7 он. 6-(2,6-Дихлорфенил)-8-метил-2-метилсульфанил-8 Н-пиридо[2,3-d]пиримидин-7-он из примера 37 в количестве 0,165 г (0,47 ммоля) помещали в трубку для работы под давлением,снабженную магнитной мешалкой. Трубку охлаждали в бане с сухим льдом в ацетоне, примерно 3 мл газа монометиламина конденсировались в трубке. Прибавляли диметилформамид(1,0 мл), трубку плотно закрывали и оставляли е для нагревания до комнатной температуры. При перемешивании реакционную смесь нагре 000897 38 вали на масляной бане с температурой 110 С,используя при этом защитный экран. Через 10 мин все твердое вещество растворилось. Раствор нагревали на масляной бане в течение 20 ч. Трубку охлаждали в бане с сухим льдом в ацетоне, открывали и нагревали до комнатной температуры для удаления избытка амина. Большую часть диметилформамида упаривали в вакууме и получали кристаллы. Твердое вещество растирали с 5 мл воды, фильтровали, промывали водой и сушили; получали 0,128 г. Очистку осуществляли при перекристаллизации из этилацетата - петролейного эфира и получали 0,081 г чистого продукта; т. пл. 243-244 С. Масс-спектр(х.и.) 335 (М+). Анализ, вычисленный для C15H12Cl2N4O: С, 53,75; Н, 3,61; N, 16,71. Найдено: С, 53,91; Н, 3,64; N, 16,80. Пример 41. 6-(2,6-Дихлорфенил)-2 диметиламино-8-метил-8 Н-пиридо[2,3-d]пиримидин-7-он. Это соединение получали по методике, подобной описанной в примере 40, исходя из 6(2,6-дихлорфенил)-8-метил-2-метилсульфанил 8 Н-пиридо[2,3-d]пиримидин-7-она из примера 37 и газообразного диметиламина; т. пл. 256258 С. Масс-спектр (х.и.) 349 (М+). Анализ, вычисленный для C16H14Cl2N4O: С, 55,03; Н, 4,04; N, 16,04. Найдено: С, 55,13; Н, 4,06; N, 16,03. Пример 42. 6-(2,6-Дихлорфенил)-2 этиламино-8-метил-8 Н-пиридо[2,3-d]пиримидин-7-он. Это соединение получали по методике, подобной описанной выше в примере 40, исходя из 6-(2,6-дихлорфенил)-8-метил-2-метилсульфанил-8 Н-пиридо[2,3-d]пиримидин-7-она из примера 37 и газообразного этиламина; т.пл. 180- 182 С. Масс-спектр (х.и.) 349 (М+). Анализ, вычисленный для C16H14Cl2N4O: С, 55,03; Н, 4,04; N, 16,04. Найдено: С, 55,17; Н, 4,08; N, 16,07. Пример 43. 6-(2,6-Дихлорфенил)-2-(2 гидроксиэтиламино)-8-метил-8 Н-пиридо[2,3d]пиримидин-7-он. Смесь 0,165 г (0,47 ммоля) 6-(2,6 дихлорфенил)-8-метил-2-метилсульфанил-8 Нпиридо[2,3-d]пиримидин-7-она из примера 37,1,0 г (16,4 ммоля) этаноламина и 0,5 мл диметилформамида нагревали при перемешивании в течение 1,5 ч на масляной бане с температурой 125 С. Полученный раствор концентрировали в вакууме и оставшийся смолистый остаток растирали с 5 мл воды. Липкий твердый остаток отфильтровывали, хорошо промывали водой и перекристаллизовывали из ацетона/петролейного эфира, получали 0,071 г чистого продукта; т.пл. 128-131 С. Масс-спектр (х.и.) 365 (М+). Анализ, вычисленный для C16H14Cl2N4O20,7 С 3 Н 6 О: С, 53,56; Н, 4,52; N, 13,81. 39 Найдено: С, 53,88; Н, 4,46; N, 14,17. Пример 44. 6-(2,6-Дихлорфенил)-2 изопропиламино-8-метил-8 Н-пиридо[2,3-d] пиримидин-7-он. Это соединение получали по методике, подобной описанной в примере 40, исходя из 6(2,6-дихлорфенил)-8-метил-2-метилсульфанил 8 Н-пиридо[2,3-d]пиримидин-7-она из примера 37 и изопропиламина; т.пл. 194-196 С. Массспектр (х.и.) 363 (М+). Анализ, вычисленный для C17H16Cl2N4O: С, 56,21; Н, 4,44; N, 15,42. Найдено: С, 56,17; Н, 4,48; N, 15,43. Пример 45. 2-Бутиламино-6-(2,6-дихлорфенил)-8-метил-8 Н-пиридо[2,3-d]пиримидин-7 он. Смесь 0,177 г (0,50 ммоля) 6-(2,6 дихлорфенил)-8-метил-2-метилсульфанил-8 Нпиридо[2,3-d]пиримидин-7-она из примера 37,10 мл н-бутиламина и 1,0 мл диметилформамида нагревали при перемешивании до кипения(масляная баня с температурой 110 С). Через 1 ч растворение заканчивалось. После 20 ч кипячения избыток амина и диметилформамид выпаривали и остаток растирали с водой, фильтровали, промывали водой и сушили; получили 0,180 г. Перекристаллизация из этилацетата/петролейного эфира приводила к очищенному продукту; получали 0,116 г; т. пл. 184-186 С. Масс-спектр (х.и.) 377 (М+). Анализ, вычисленный для C18H18Cl2N4O: С, 57,31; Н, 4,81; N, 14,85. Найдено: С, 57,41; Н, 4,81; N, 14,83. Пример 46. 2-Бензиламино-6-(2,6 дихлорфенил)-8-метил-8 Н-пиридо[2,3-d] пиримидин-7-он. Смесь 0,165 г (0,47 ммоля) 6-(2,6 дихлорфенил)-8-метил-2-метилсульфанил-8 Нпиридо[2,3-d]пиримидин-7-она из примера 37,0,50 г (4,70 ммоля) бензиламина и 0,5 мл диметилформамида нагревали при перемешивании на масляной бане с температурой 120 С. Через 5 мин растворение закончилось. Через 5 ч избыток амина и диметилформамид выпаривали в вакууме и остаток растирали с раствором 1 мл ацетона и 2 мл петролейного эфира. Твердый липкий осадок отфильтровывали и перекристаллизовывали из этилацетата/петролейного эфира, получали 0,092 г чистого продукта; т. пл. 217-219 С. Масс-спектр (х. и.) 411 (М+). Анализ, вычисленный для C17H14Cl2N4O5: С, 61,33; Н, 3,92; N, 13,62. Найдено; С, 61,30; Н, 4,02; N, 13,59. Пример 47. 6-(2,6-Дихлорфенил)-8-метил 2-(3-морфолин-4-илпропиламино)-8 Н-пиридо[2,3-d]пиримидин-7-он. Смесь 0,165 г (0,47 ммоля) 6-(2,6 дихлорфенил)-8-метил-2-метилсульфанил-8 Нпиридо[2,3-d]пиримидин-7-она из примера 37,1,00 г (6,90 ммоля) N-(3-аминопропил) морфолина и 0,5 мл диметилформамида нагревали при перемешивании на масляной бане с 40 температурой 125 С. Через 2 мин все растворялось. Через 1,5 ч избыток амина и диметилформамид выпаривали в вакууме и остаток растирали с 5 мл воды. Смолистое вещество растворяли в 25 мл этилацетата, раствор промывали водой(25 мл), сушили (карбонатом калия) и концентрировали. После растворения в 5 мл диэтилового эфира отделялись кристаллы чистого продукта; получено 0,101 г; т. пл. 140-142 С. Масс-спектр (х.и.) 448 (M1). Анализ, вычисленный для C21H23Cl2N4O2: С, 56,26; Н, 5,17; N, 15,62. Найдено: С, 56,48; Н, 5,24; N, 15,53. Пример 48. 6-(2,6-Дихлорфенил)-2-[2-(3,4 диметоксифенил)этиламино]-8-метил-8 Нпиридо[2,3-d]пиримидин-7-он. Смесь 0,165 г (0,47 ммоля) 6-(2,6 дихлорфенил)-8-метил-2-метилсульфанил-8 Нпиридо[2,3-d]пиримидин-7-она из примера 37,0,8 г (4,40 ммоля) 2-(3,4-диметоксифенил) этиламина и 0,5 мл диметилформамида нагревали при перемешивании на масляной бане с температурой 125 С. Через 2 мин все растворялось. Через 5 ч избыток амина и диметилформамид выпаривали в вакууме, а остаток растирали с 10 мл воды. Смолистый продукт растворяли в 75 мл диэтилового эфира и раствор промывали водой (210 мл) и сушили (карбонатом калия). Солянокислую соль получали, пропуская хлористый водород (газ) в этот эфирный раствор для осаждения смолистого продукта. Диэтиловый эфир декантировали, а смолистый остаток растворяли в 2,0 мл 2-пропанола. Кристаллы выпадали при добавлении затравки. Прибавляли диэтиловый эфир (10 мл) и кристаллы очищенного вещества отфильтровывали и промывали диэтиловым эфиром; выход составил 0,034 г; т. пл. 152-155 С. Масс-спектр (х.и.) 485 (M1). Анализ, вычисленный для С 24 Н 22 Сl2N4O3HCl 0,75 С 3 Н 8O: С, 55,61; Н, 5,16; N, 9,88. Найдено: С, 55,32; Н, 5,28; N, 9,50. Пример 49. 6-(2,6-Дихлорфенил)-8-метил 2-[(пиридин-2-илметил)амино]-8 Н-пиридо[2,3d]пиримидин-7-он. Смесь 0,165 г (0,47 ммоля) 6-(2,6 дихлорфенил)-8-метил-2-метилсульфанил-8 Нпиридо[2,3-d]пиримидин-7-она из примера 37,1,08 г (10,0 ммоля) 2-(аминометил)пиридина и 0,5 мл диметилформамида нагревали при перемешивании на масляной бане с температурой 130 С. Через 2 мин все растворялось. Через 2 ч избыток амина и диметилформамид выпаривали в вакууме. К остатку прибавляли диэтиловый эфир (5 мл). Немедленно образовывались кристаллы. Прибавляли воду (5 мл) и всю смесь фильтровали. Осадок на фильтре промывали 5 мл диэтилового эфира, 5 мл воды и затем сушили; получали 0,164 г. Перекристаллизация из этилацетата приводила к 0,075 г чистого про 41 дукта; т.пл. 198-201 С. Масс-спектр (х.и.) 412(M+). Анализ, вычисленный для C20H15Cl2N5O: С, 58,27; Н, 3,67; N, 16,99. Найден: С, 58,36; Н, 3,82; N, 16,82. Пример 50. 6-(2,6-Дихлорфенил)-8-метил 2-[(пиридин-3-илметил)амино]-8 Н-пиридо[2,3d]пиримидин-7-он. Это соединение было получено по методике, подобной описанной в примере 49, исходя из 0,165 г (0,47 ммоля) 6-(2,6-дихлорфенил)-8 метил-2-метилсульфанил-8 Н-пиридо[2,3-d] пиримидин-7-она из примера 37 и 1,08 г (10,0 ммоля) 3-(аминометил)пиридина, выход чистого продукта составлял 0,053 г; т. пл. 224-226 С. Масс-спектр (х.и.) 412 (M+). Анализ, вычисленный для C20H15Cl2N5O: С, 58,27; Н, 3,67; N, 16,99. Найдено: С, 58,36; Н, 3,78; N, 16,79. Пример 51. 6-(2,6-Дихлорфенил)-8-метил 2-(2-пиридин-2-илэтиламино)-8 Н-пиридо[2,3d]пиримидин-7-он. Это соединение получали по методике,описанной в примере 49, исходя из 0,165 г (0,47 ммоля) 6-(2,6-дихлорфенил)-8-метил-2-метилсульфанил-8 Н-пиридо[2,3-d]пиримидин-7-она из примера 37 и 1,00 г (8,20 ммоля) 2-(2 аминоэтил)пиридина, выход чистого продукта составил 0, 082 г; т.пл. 173-174 С. Масс-спектр(х.и.) 426 (M+). Анализ, вычисленный для C21H17Cl2N5O: С, 59,17; Н, 4,02; N, 16,43. Найдено: С, 59,28; Н, 4,11; N, 16,29. Пример 52. 6-(2,6-Дихлорфенил)-2-3-[4(2-метоксифенил)пиперазин-1-ил]пропиламино-8-метил-8 Н-пиридо[2,3-d]пиримидин-7 он. Это соединение было получено по методике, подобной описанной в примере 49, исходя из 0,165 г (0,47 ммоля) 6-(2,6-дихлорфенил)-8 метил-2-метилсульфанил-8 Н-пиридо[2,3-d] пиримидин-7-она из примера 37 и 1,00 г (4,00 ммоля) 1-(3-аминопропил)-4-(2-метоксифенил) пиперазина, выход чистого продукта составил 0,103 г; т.пл. 187-188 С. Масс-спектр (х.и.) 553(M+). Анализ, вычисленный для C28H30Cl2N6O2: С, 60,76; Н, 5,46; N, 15,18. Найдено: С, 61,04; Н, 5,41; N, 15,20. Пример 53. 6-(2,6-Дихлорфенил)-2 метансульфинил-8-метил-8 Н-пиридо[2,3-d] пиримидин-7-он. Это соединение выделяли как побочный продукт при окислении м-хлорпербензойной кислотой 6-(2,6-дихлорфенил)-8-метил-2 метилсульфанил-8 Н-пиридо[2,3-d]пиримидин-7 она из примера 37 в одном опыте, аналогичном примеру 39, но при более коротком времени реакции; т. пл. 244 - 247 С. Масс-спектр (х.и.) 368 (М+). Анализ, вычисленный для C15H11Cl2N3O2S: С, 48,93; Н, 3,01; N, 11,41. 42 Найдено: С, 48,42; Н, 3,20; N, 11,05. Пример 54. 6-(2,6-Дихлорфенил)-8-метил 2-фениламино-8 Н-пиридо[2,3-d]пиримидин-7 он. Раствор 0,113 г (0,29 ммоля) 6-(2,6 дихлорфенил)-2-метансульфонил-8-метил-8 Нпиридо[2,3-d]пиримидин-7-она из примера 39 в 1,00 г (10, 70 ммоля) анилина кипятили (184 С) в течение 3 мин. Большую часть избытка анилина упаривали в вакууме. Оставшийся смолистый остаток растворяли в 1,0 мл этилацетата. При добавлении затравки выпадали кристаллы; получали 0,088 г. Дальнейшую очистку с целью удаления темных окрашенных примесей осуществляли путем хроматографии на силикагеле,вымывая хлороформом, а затем этилацетатом гексаном 1:1, получали чистый кристаллический продукт, выход 0,046 г; т. пл. 247-249 С. Массспектр (х.и.) 397 (M+). Анализ, вычисленный для C20H14Cl2N4O: С, 60,47; Н, 3,55; N, 14,10. Найдено: С, 60,25; Н, 3,64; N, 14,00. Пример 55. 2-(3-Бромфениламино)-6-(2,6 дихлорфенил)-8-метил-8 Н-пиридо[2,3-d]пиримидин-7-он. Раствор 0,155 г (0,40 ммоля) 6-(2,6 дихлорфенил)-2-метансульфонил-8-метил-8 Нпиридо[2,3-d]пиримидин-7-она из примера 39 в 0,50 г (2,90 ммоля) 3-броманилина выдерживали при кипении (251 С) в течение 5 мин. Большую часть избытка 3-броманилина выпаривали в вакууме. Оставшийся охлажденный смолистый осадок растирали с 1,0 мл диэтилового эфира. Образовавшиеся фиолетовые кристаллы отфильтровывали и промывали 2 мл диэтилового эфира, получали 0,186 г. Дальнейшую очистку для удаления темных окрашенных примесей осуществляли с помощью хроматографии на силикагеле, вымывая хлороформом, а затем этилацетатом-гексаном 1:1 для получения чистого кристаллического продукта; т. пл. 246248 С. Масс-спектр (х.и.) 447 (M+). Анализ, вычисленный для C20H13BrCl2N4O: С, 50,45; Н, 2,75; N, 11,77. Найдено: С, 50,53; Н, 2,76; N, 11,52. Пример 56. 2-(4-Хлорфениламино)-6-(2,6 дихлорфенил)-8-метил-8 Н-пиридо[2,3-d]пиримидин-7-он. Смесь 0,113 г (0,29 ммоля) 6-(2,6 дихлорфенил)-2-метансульфонил-8-метил-8 Нпиридо[2,3-d]пиримидин-7-она из примера 39 в 0,50 г (3,90 ммолей) 4-хлоранилина нагревали при перемешивании при температуре кипения(238 С) в течение 5 мин. К охлажденному темносинему реакционному раствору прибавляли 3 мл этилацетата. Прибавляли 3 мл петролейного эфира для полного осаждения темного твердого продукта. Твердый продукт отфильтровывали и промывали этилацетатом-гексаном 1:1; получали 0,078 г. Неочищенный твердый продукт для удаления темных окрашенных примесей очищали с помощью хроматографии на силикагеле, 43 вымывая хлороформом, а затем этилацетатомгексаном 1:1 для получения чистого кристаллического продукта; получали 0,056 г; т. пл. 255256 С. Масс-спектр (х.и.) 431 (М+). Анализ, вычисленный для С 20 Н 13 Сl3N4O: С, 55,64; Н, 3,04; N, 12,98. Найдено: С, 55,75; Н, 3,04; N, 12.97. Пример 57. 2-(Бензо[1,3]диоксол-5 иламино)-6-(2,6-дихлорфенил)-8-метил-8 Нпиридо[2,3-d]пиримидин-7-он. Смесь 0,113 г (0,29 ммоля) 6-(2,6 дихлорфенил)-2-метансульфонил-8-метил-8 Нпиридо[2,3-d]пиримидин-7-она из примера 39 и 0,50 г (3,70 ммоля) 3,4-метилендиоксианилина нагревали при перемешивании на масляной бане с температурой 200 С. Полученный раствор нагревали в течение 5 мин и охлаждали до комнатной температуры. Прибавляли 2 мл этилацетата и отфильтровывали незначительное количество твердого вещества. Кристаллы, медленно выпадавшие в фильтрате, отфильтровывали и промывали 2 мл этилацетата; получали 0,080 г. Твердый продукт для удаления темных окрашенных примесей очищали с помощью хроматографии на силикагеле, вымывая хлороформом, а затем этилацетатом - гексаном 1:1 для получения чистого кристаллического продукта; получали 0,054 г; т. пл. 240-241 С. Масс-спектр(х.и.) 441 (M+). Анализ, вычисленный для C21H14Cl2N4O3: С, 57,16; Н, 3,20; N, 12,70. Найдено: С, 56,95; Н, 3,11; N, 12,47. Пример 58. 6-(2,6-Дихлорфенил)-8-метил 2-(пиридин-4-иламино)-8 Н-пиридо[2,3-d]пиримидин-7-он. Смесь 0,550 г (1,25 ммоля) 6-(2,6 дихлорфенил)-2-метансульфонил-8-метил-8 Нпиридо[2,3-d]пиримидин-7-она из примера 39 и 1,50 г (16,0 ммолей) 4-аминопиридина нагревали при перемешивании на масляной бане с температурой 150 С. Полученный раствор нагревали в течение 10 мин и охлаждали до комнатной температуры. Затвердевший расплав растирали с 3 мл метилового спирта. После 24 ч выдержки образовавшийся зернистый твердый продукт фильтровали и промывали 2 мл метанола и 2 мл диэтилового эфира; получали 0,471 г. Гидрохлорид получали следующим образом: полученное выше неочищенное основание суспендировали в 5 мл метилового спирта. При перемешивании прибавляли 1 мл 2 н. соляной кислоты до полного растворения. Дополнительно прибавляли соляную кислоту до легкого помутнения раствора. Кристаллы, выделившиеся при введении затравки, отфильтровывали и промывали 10 мл диэтилового эфира с 10% метилового спирта, а затем диэтиловым эфиром; получали 0,485 г. Перекристаллизация из метилового спирта/диэтилового эфира приводила к 0,405 г очищенного кристаллического продукта; т. пл. 338-340 С. Масс-спектр (х.и.) 398 (М+). Анализ, вычисленный для C19H13Cl2N5OHCl Н 2O: С, 50,40; Н, 3,56; N, 15,47. Найдено: С, 50,78; Н, 3,18; N, 15,50. Пример 59. 6-(2,6-Дихлорфенил)-8-метил 2-[4-(4-метилпиперазин-1-ил)бутиламино]-8 Нпиридо[2,3-d]пиримидин-7-он. Смесь 0,152 г (0,43 ммоля) 6-(2,6 дихлорфенил)-8-метил-2-метилсульфанил-8 Нпиридо[2,3-d]пиримидин-7-она из примера 37 и 0,50 г (2,90 ммоля) 1-(4-аминобутил)-4 метилпиперазина нагревали при перемешивании на масляной бане с температурой 170 С. Через 2 мин растворение было завершено. Через 2 ч раствор охлаждали до комнатной температуры и темный смолистый продукт растворяли в 25 мл диэтилового эфира. Раствор промывали водой (45 мл). Большая часть окрашивающих веществ уходила в промывную воду. Эфирный раствор сушили над карбонатом калия, фильтровали и концентрировали до объема около 2 мл. Кристаллы, отделившиеся при внесении затравки,отфильтровывали и промывали диэтиловым эфиром, получали 0,063 г; т. пл. 130-132 С. Масс-спектр (х.и.) 475 (M+). Анализ, вычисленный для С 23 Н 28 Сl2N6O: С, 58,11; Н, 5,94; N, 17,68. Найдено: С, 58,39; Н, 5,99; N, 17,53. Пример 60. 2-Циклогексиламино-6-(2,6 дихлорфенил)-8-метил-8 Н-пиридо[2,3-d]пиримидин-7-он. Смесь 0,100 г (0,26 ммоля) 6-(2,6 дихлорфенил)-2-метансульфонил-8-метил-8 Нпиридо[2,3-d]пиримидин-7-она из примера 39 и 0,300 г (3,00 ммоля) циклогексиламина нагревали до температуры кипения (134 С). Полученный раствор нагревали при кипении в течение 2 мин. Большую часть избытка амина выпаривали в вакууме. Оставшийся смолистый продукт горячим растворяли в 2 мл этилацетата. Прибавляли петролейный эфир (2 мл) и кристаллы, выпавшие из охлажденного раствора, отфильтровывали и промывали водой; получали 0,090 г. Перекристаллизация из этилацетата приводила к кристаллическому продукту в количестве 0,048 г; т. пл. 242-244 С. Масс-спектр (х.и.) 403 (М+). Анализ, вычисленный для C20H20Cl2N4O: С, 59,56; Н, 5,00; N, 13,89. Найдено: С, 59,92; Н, 5,03; N, 13,86. Пример 61. трет-Бутиловый эфир 6-[6-(2,6 дихлорфенил)-8-метил-7-оксо-7,8-дигидропиридо[2,3-d]пиримидин-2-иламино]капроновой кислоты. Смесь 0,152 г (0,40 ммоля) 6-(2,6 дихлорфенил)-2-метансульфонил-8-метил-8 Нпиридо[2,3-d]пиримидин-7-она из примера 39 и 0,750 г (4, 00 ммоля) трет-бутилового эфира 5 аминокапроновой кислоты нагревали при перемешивании на масляной бане с температурой 120 С до полного растворения. Через 10 мин раствор охлаждали до комнатной температуры и 45 прибавляли 20 мл 10%-ного раствора бисульфата калия с кусочками льда. Отделившийся смолистый остаток экстрагировали 30 мл диэтилового эфира. Органическую фазу промывали водой (35 мл), сушили над сульфатом магния,фильтровали и концентрировали до объема в 2 мл. Кристаллы, отделившиеся при внесении затравки, отфильтровывали и промывали 1 мл диэтилового эфира, получали 0,150 г; т.пл.7075 С. Масс-спектр (х.и.) 491 (M+). Анализ, вычисленный для С 24 Н 28 Сl2N4O30,2H2O: С, 58,22; Н, 5,78; N, 11,32. Найдено: С, 57,84; Н, 5,71; N, 11,04. Пример 62. 6-[6-(2,6-Дихлорфенил)-8 метил-7-оксо-7,8-дигидропиридо[2,3-d]пиримидин-2-иламино]капроновая кислота. Раствор 0,095 г (0,19 ммоля) третбутилового эфира 6-[6-(2,6-дихлорфенил)-8 метил-7-оксо-7,8-дигидропиридо[2,3-d]пиримидин-2-иламино]капроновой кислоты из примера 61 в 0,75 мл трифторуксусной кислоты при 25 С выдерживали в течение 1 ч. Большую часть трифторуксусной кислоты выпаривали. Оставшийся смолистый продукт растирали с 2 мл воды и декантировали. Прибавляли 1 мл метилового спирта для растворения большей части смолистого вещества, когда появлялись хорошо оформленные кристаллы. Прибавляли воду (1 мл) и твердый продукт отфильтровывали и сушили, получали 0,100 г; т. пл. 240-242 С. Массспектр (х.и.) 435 (М+). Анализ, вычисленный для С 20 Н 20 Сl2N4O3 СF3 СООН 0,75 СН 3 ОН: С, 47,65; Н, 4,22; N, 9,77. Найдено: С, 47,38; Н, 4,28; N, 9,72. Пример 63. 6-(2,6-Дихлорфенил)-8-метил 2-п-толиламино-8 Н-пиридо[2,3-d]пиримидин-7 он. Смесь 0,113 г (0,29 ммоля) 6-(2,6 дихлорфенил)-2-метансульфонил-8-метил-8 Нпиридо[2,3-d]пиримидин-7-она из примера 39 и 0, 50 г (4,70 ммоля) 4-метиланилина нагревали при перемешивании на масляной бане с температурой 180 С. Полученный раствор нагревали в течение 10 мин. Большую часть избытка 4 метиланилина выпаривали в вакууме. Остаток растворяли в 1 мл этилацетата. Кристаллы, выпавшие из темного раствора, отфильтровывали и промывали 2 мл этилацетата, а затем диэтиловым эфиром; получали 0,111 г. Перекристаллизация из этилацетата приводила к чистому продукту, получали 0, 050 г; т.пл. 243-245 С. Массспектр (х.и.) 411 (М+). Анализ, вычисленный для C21H16Cl2N4O: С, 61,33; Н, 3,92; N, 13,62. Найдено: С, 61,11; Н, 4,00; N, 13,41. Пример 64. 6-(2,6-Дихлорфенил)-2-(4 метоксифениламино)-8-метил-8 Н-пиридо[2,3d]пиримидин-7-он. 46 Смесь 0,113 г (0,29 ммоля) 6-(2,6 дихлорфенил)-2-метансульфонил-8-метил-8 Нпиридо[2,3-d]пиримидин-7-она из примера 39 и 0,50 г (4,10 ммоля) 4-метоксианилина нагревали при перемешивании на масляной бане с температурой 180 С. Полученный раствор нагревали в течение 10 мин. Большую часть избытка анилина выпаривали в вакууме. Остаток растворяли в 2 мл этилацетата. Кристаллы, выпавшие из темного раствора, отфильтровывали и промывали 2 мл этилацетата, получали 0,102 г. Перекристаллизация из этилацетата приводила к 0,047 г чистого продукта; т. пл. 221-223 С. Масс-спектр(х.и.) 427 (М+). Анализ, вычисленный для C21H16Cl2N4O2: С, 59,03; Н, 3,77; N, 13,11. Найдено: С, 59,19; Н, 3,84; N, 13,07. Пример 65. 6-(2,6-Дихлорфенил)-8-этил-2 метилсульфанил-8 Н-пиридо[2,3-d]пиримидин-7 илиденамин. Порошкообразный безводный карбонат калия в количестве 20 г прибавляли к раствору 4,95 г(0,025 моля) 4-этиламино-2 метилсульфанилпиримидин-5-карбальдегида и 5,25 г (0,028 моля) 2,6-дихлорфенилацетонитрила в 50 мл диметилформамида. Смесь нагревали при перемешивании на масляной бане с температурой 130 С (температура в реакционном сосуде около 120 С) в течение 16 ч. Смесь охлаждали и фильтровали. Осадок на фильтре промывали 30 мл диметилформамида. К фильтрату прибавляли воду до легкого помутнения. Кристаллы, выпавшие при внесении затравки,отфильтровывали, промывали 20 мл воды - диметилформамида 1:1, а затем 20 мл воды и сушили; получали 4,30 г; т. пл. 217-219 С. Массспектр (х.и.) 365 (M+). Пример 66. N-[6-(2,6-Дихлорфенил)-8 этил-2-метилсульфанил-8 Н-пиридо[2,3-d]пиримидин-7-илиден]ацетамид. Смесь 2,70 г (7,40 ммоля) 6-(2,6 дихлорфенил)-8-этил-2-метилсульфанил-8 Нпиридо[2,3-d]пиримидин-7-илиденамина из примера 65 и 15 мл уксусного ангидрида нагревали при перемешивании до температуры кипения. Полученный раствор нагревали при кипении в течение 5 мин и концентрировали в вакууме до объема около 8 мл. Раствор охлаждали и прибавляли эфир (8 мл). Выпавшие хорошо оформленные кристаллы отфильтровывали и промывали 5 мл диэтилового эфира и 10 мл петролейного эфира; получали 2,68 г; т. пл. 175177 С. Масс-спектр (х.и.) 407 (M+). Пример 67. 6-(2,6-Дихлорфенил)-8-этил-2 метилсульфанил-8 Н-пиридо[2,3-d]пиримидин-7 он.N-[6-(2,6-Дихлорфенил)-8-этил-2-метилсульфанил-8 Н-пиридо[2,3-d]пиримидин-7 илиден]ацетамид из примера 66 в количестве 2,40 г (5,90 ммоля) растворяли в 35 мл 6 н. соляной кислоты при 25 С. Раствор нагревали при перемешивании до температуры кипения. Через 47 1 мин отделялись кристаллы продукта. Еще через 5 мин нагревания при температуре кипения смесь охлаждали, фильтровали и осадок на фильтре промывали последовательно 5 мл 6 н. соляной кислоты, 15 мл воды, 5 мл 2-пропанола и 5 мл диэтилового эфира; получали 2,11 г(98%). Очищенный продукт выделяли при использовании хроматографии на силикагеле, вымывали этилацетатом - хлороформом 1:1; т. пл. 233-236 С. Масс-спектр (х.и.) 366 (M+). Анализ, вычисленный для C16 Н 13 Сl2N3OS0,1C4H8O20,25 Н 2 О: С, 51,89; Н, 3,80; N, 11,07. Найдено: С, 51,89; Н, 3,58; N, 10,99. Пример 68. 6-(2,6-Дихлорфенил)-8-этил-2 метансульфонил-8 Н-пиридо[2,3-d]пиримидин-7 он. Раствор 0,66 г (1,80 ммоля) 6-(2,6 дихлорфенил)-8-этил-2-метилсульфанил-8 Нпиридо[2,3-d]пиримидин-7-она из примера 67 в 50 мл хлороформа обрабатывали при перемешивании 1,50 г (4,32 ммоля) 50-60%-ной мхлорнадбензойной кислотой (допуская, что была 50%-ная надкислота). Раствор выдерживали при комнатной температуре в течение 16 ч. Прибавляли диметилсульфоксид в количестве 0,50 г (6,80 ммоля) для уменьшения избытка надкислоты. Через 15 мин раствор промывали (230 мл) насыщенным раствором бикарбоната натрия, а затем 30 мл воды. Хлороформный раствор сушили над безводным сульфатом натрия,фильтровали и концентрировали до объема 10 мл. Прибавляли петролейный эфир до легкого помутнения. Отделившиеся кристаллы отфильтровывали и промывали диэтиловым эфиром; получали 0,401 г; т. пл.214-216 С. Массспектр (х.и.) 398 (M+). Анализ, вычисленный для C16 Н 13 Сl2N3 О 3S0,25 Н 2 О: С, 47,70; Н, 3,38; N, 10,43. Найдено: С, 47,41; Н, 3,17; N, 10,23. Пример 69. 6-(2,6-Дихлорфенил)-8-этил-2 фениламино-8 Н-пиридо[2,3-d]пиримидин-7-он. Смесь 0,134 г (0,33 ммоля) 6-(2,6 дихлорфенил)-8-этил-2-метансульфонил-8 Нпиридо[2,3-d]пиримидин-7-она из примера 68 и 0,500 г (5,40 ммоля) анилина нагревали при перемешивании до кипения на масляной бане с температурой 195 С. Полученный раствор кипятили в течение 5 мин. Большую часть избытка анилина выпаривали в вакууме. Оставшееся смолистое вещество растворяли в 15 мл этилацетата. После фильтрации относительно малого количества нерастворенного вещества раствор фильтровали через слой силикагеля для удаления фиолетовой окраски. Фильтрат концентрировали до объема в 2 мл. Прибавляли петролейный эфир до легкого помутнения. Выделившиеся при внесении затравки кристаллы отфильтровывали и промывали петролейнымC4H8O2: С, 60,98; Н, 4,19; N, 12,93. Найдено: С, 61,19; Н, 4,29; N, 12,57. Пример 70. 6-(2,6-Дихлорфенил)-8-этил-2[3-(4-метилпиперазин-1-ил)пропиламино]-8 Нпиридо[2,3-d]пиримидин-7-он. Смесь 0,150 г (0,41 ммоля) 6-(2,6 дихлорфенил)-8-этил-2-метилсульфанил-8 Нпиридо[2,3-d]пиримидин-7-она из примера 67 и 0,500 г (3,20 ммоля) 1-(3-аминопропил)-4 метилпиперазина нагревали на масляной бане с температурой 180 С. Полученный раствор нагревали в течение 0,5 ч. Большую часть избытка амина выпаривали в вакууме. Оставшееся смолистое вещество растирали с 2 мл воды и декантировали. Смолистое вещество растворяли в 15 мл диэтилового эфира. Раствор промывали водой (35 мл), сушили (сульфатом натрия),фильтровали и концентрировали до объема в 2 мл. Прибавляли петролейный эфир до легкого помутнения. Отделившиеся при внесении затравки кристаллы отфильтровывали и промывали 2 мл смеси (3:1) диэтилового эфира и петролейного эфира; получали 0,90 г; т. пл. 126128 С. Масс-спектр (х.и.) 475 (М+). Анализ, вычисленный для С 23 Н 28 Сl2N6 О 0,4H2O: С, 57,24; Н, 6,01; N, 17,42. Найдено: С, 57,33; Н, 6,04; N, 17,07. Пример 71. 6-(2,6-Дихлорфенил)-2-(2 метоксифениламино)-8-метил-8 Н-пиридо[2,3-d] пиримидин-7-он. Смесь 0,113 г (0,29 ммоля) 6-(2,6 дихлорфенил)-2-метансульфонил-8-метил-8 Нпиридо[2,3-d]пиримидин-7-она из примера 39 и 0,50 г (4,10 ммоля) 2-метоксианилина нагревали при перемешивании на масляной бане с температурой 175 С. Полученный раствор нагревали 5 мин и охлаждали до комнатной температуры. Прибавляли 2 мл диэтилового эфира. Выпавшие кристаллы отфильтровывали и промывали 1 мл диэтилового эфира; получали 0,070 г. Для удаления окрашенных примесей твердое вещество хроматографировали на силикагеле, вымывая хлороформом. Перекристаллизация из диэтилового эфира приводила к 0,029 г чистого вещества; т. пл. 200-201 С. Масс-спектр (х.и.) 427 (M+). Анализ, вычисленный для C21H16Cl2N4O2: С, 59,03; Н, 3,77; N, 13,11. Найдено: С, 59,09; Н, 3,87; N, 13,02. Пример 72. 6-(2,6-Дихлорфенил)-2-(3 метоксифениламино)-8-метил-8 Н-пиридо[2,3d]пиримидин-7-он. Смесь 0,113 г (0,29 ммоля) 6-(2,6 дихлорфенил)-2-метансульфонил-8-метил-8 Нпиридо[2,3-d]пиримидин-7-она из примера 39 и 0,50 г (4,10 ммоля) 3-метоксианилина нагревали при перемешивании на масляной бане с темпе 49 ратурой 175 С. Полученный раствор нагревали в течение 5 мин и охлаждали до комнатной температуры. Прибавляли диэтиловый эфир (2 мл). Выпавшие кристаллы отфильтровывали и промывали 2 мл диэтилового эфира; получали 0,083 г. Твердое вещество для удаления темных окрашенных примесей очищали с помощью хроматографии на силикагеле, вымывая хлороформом. Перекристаллизация из диэтилового эфира приводила к 0,037 г чистого вещества; т. пл. 203-204 С. Масс-спектр (х.и.) 427 (М+). Анализ, вычисленный для C21H16Cl2N4O20,5H2O: С, 57,81; Н, 3,93; N, 12,84. Найдено: С, 57,98; Н, 3,82; N, 12,71. Пример 73. 6-(2,6-Дихлорфенил)-2-(4 метокси-3-метилфениламино)-8-метил-8 Нпиридо[2,3-d]пиримидин-7-он. Смесь 0,113 г (0,29 ммоля) 6-(2,6 дихлорфенил)-2-метансульфонил-8-метил-8 Нпиридо[2,3-d]пиримидин-7-она из примера 39 и 0,40 г (2,9 ммоля) 3-метил-4-метоксианилина нагревали при перемешивании на масляной бане с температурой 165 С. Полученный раствор нагревали в течение 5 мин и охлаждали до комнатной температуры. Прибавляли диэтиловый эфир (1 мл). Выпавшие кристаллы отфильтровывали и промывали 2 мл диэтилового эфира; получали 0,109 г. Твердое вещество очищали от темных окрашенных примесей путем хроматографии на силикагеле при вымывании хлороформом и затем этилацетатом. Этилацетатный элюат концентрировали до объема в 3 мл. При охлаждении выпадали кристаллы чистого продукта, получали 0,060 г; т.пл. 218-220 С. Массспектр (х.и.) 441 (М+). Анализ, вычисленный для C22H18Cl2N4O2: С, 59,88; Н, 4,11; N, 12,70. Найдено: С, 59,88; Н, 4,14; N, 12,57. Пример 74. 6-(2,6-Дихлорфенил)-8-этил-2(4-метоксифениламино)-8 Н-пиридо[2,3-d]пиримидин-7-он. Раствор 0,100 г (0,25 ммоля) 6-(2,6 дихлорфенил)-8-этил-2-метансульфонил-8 Нпиридо[2,3-d]пиримидин-7-она из примера 68 и 0,061 г (0,50 ммоля) 4-метоксианилина в 0,5 мл диметилформамида нагревали при кипении в течение 10 мин. Прибавляли три капли воды. При внесении затравки выпадали кристаллы. Дополнительно добавляли еще три капли воды для осаждения дополнительного количества липкого твердого вещества. После декантации твердый остаток растирали с 0,5 мл этилацетата и 0,5 мл петролейного эфира. Твердое вещество отфильтровывали и промывали петролейным эфиром - этилацетатом 1:1, сушили; получали 0,080 г. Очистку осуществляли путем фильтрации раствора в этилацетате через слой силикагеля. Концентрирование фильтрата до объема в 1 мл приводило к чистому кристаллическому продукту; получали 0,033 г; т. пл. 213-215 С. Масс-спектр (х.и.) 441 (M+). 50 Анализ, вычисленный для C22H18Cl2N4O2: С, 59,88; Н, 4,11; N, 12,70. Найдено: С, 59,52; Н, 4,17; N, 12,56. Пример 75. 6-(2,6-Дихлорфенил)-8-этил-2(4-гидроксифениламино)-8 Н-пиридо[2,3-d] пиримидин-7-он. Смесь 0,048 г (0,11 ммоля) 6-(2,6 дихлорфенил)-8-этил-2-(4-метоксифениламино)8 Н-пиридо[2,3-d]пиримидин-7-она из примера 74 и 15 мл концентрированной (48%) бромистоводородной кислоты нагревали при перемешивании при кипении в течение 3 ч. Из полученного раствора при охлаждении выпадали кристаллы; получали 0,033 г; т.пл. 255-258 С. Массспектр (х.и.) 427 (М+). Анализ, вычисленный для C21H16Cl2N4O2 НВгH2O: С, 47,93; Н, 3,64; N, 10,65. Найдено: С, 47,78; Н, 3,29; N, 10,46. Пример 76. 6-(2,6-Дихлорфенил)-2-(4 этоксифениламино)-8-этил-8 Н-пиридо[2,3-d] пиримидин-7-он. Смесь 0,150 г (0,38 ммоля) 6-(2,6 дихлорфенил)-8-этил-2-метансульфонил-8 Нпиридо[2,3-d]пиримидин-7-она из примера 68 и 0,500 г (3,60 ммоля) 4-этоксианилина сплавляли при нагревании на масляной бане с температурой 160 С в течение 10 мин. Темно-фиолетовый расплав охлаждали и растворяли в 1 мл теплой ледяной уксусной кислоты. Этот раствор разбавляли водой до 10 мл для осаждения твердого вещества. Твердое вещество отфильтровывали,хорошо промывали водой и сушили; получали 0,140 г. Очистку осуществляли при фильтрации раствора в этилацетате через слой силикагеля и промывании силикагеля этилацетатом. Фильтрат концентрировали до объема в 2 мл и прибавляли 2 мл петролейного эфира. Кристаллы,выпавшие при внесении затравки, отфильтровывали и промывали диэтиловым эфиром; получали 0,094 г; т. пл. 192-194 С. Масс-спектр(х.и.) 455 (М+). Анализ, вычисленный для С 23 Н 20 Сl2N4O2: С, 60,67; Н, 4,43; N, 12,30. Найдено: С, 60,62; Н, 4,53; N, 12,11. Пример 77. 6-(2,6-Дихлорфенил)-2-(3,4 диметоксифениламино)-8-этил-8 Н-пиридо[2,3d]пиримидин-7-он. Смесь 0,150 г (0,38 ммоля) 6-(2,6 дихлорфенил)-8-этил-2-метансульфонил-8 Нпиридо[2,3-d]пиримидин-7-она из примера 68 и 0,500 г (3,30 ммоля) 3,4-диметоксианилина нагревали на масляной бане с температурой 160 С в течение 5 мин. Темносиний раствор охлаждали и растворяли в 2 мл теплой ледяной уксусной кислоты. Этот раствор разбавляли до объема в 10 мл водой для осаждения твердого вещества. Твердое вещество отфильтровывали, хорошо промывали водой и сушили; получали 0,200 г. Очистку осуществляли при фильтрации раствора в этилацетате (25 мл) через слой силикагеля и промывании силикагеля этилацетатом. Фильт 51 рат концентрировали до объема в 3 мл. Кристаллы, выпавшие при внесении затравки, отфильтровывали и промывали 1 мл этилацетата,затем 1 мл диэтилового эфира; получали 0,116 г; т. пл. 221-223 С. Масс-спектр (х.и.) 471 (M+). Анализ, вычисленный для С 23 Н 20 Сl2N4O3: С, 58,61; Н, 4,28; N, 11,89. Найдено: С, 58,31; Н, 4,31; N, 11,71. Пример 78. 6-(2,6-Дихлорфенил)-8-этил-2(3,4,5-триметоксифениламино)-8 Н-пиридо[2,3d]пиримидин-7-он. Смесь 0,150 г (0,38 ммоля) 6-(2,6 дихлорфенил)-8-этил-2-метансульфонил-8 Нпиридо[2,3-d]пиримидин-7-она из примера 68 и 0,500 г (2,70 ммоля) 3,4,5-триметоксианилина нагревали на масляной бане с температурой 160 С в течение 5 мин. Темный раствор охлаждали и растворяли в 2 мл теплой ледяной уксусной кислоты. Этот раствор разбавляли до объема 15 мл водой для осаждения фиолетового твердого вещества. Твердое вещество отфильтровывали, хорошо промывали водой и сушили,получали 0,140 г. Очистку осуществляли при фильтрации раствора в этилацетате (30 мл) через слой силикагеля и промывании силикагеля этилацетатом. Фильтрат концентрировали до объема 3 мл. Кристаллы, выпавшие при внесении затравки, отфильтровывали и промывали 1 мл этилацетата и 1 мл диэтилового эфира; получали 0,054 г; т. пл. 275-278 С. Масс-спектр (х.и.) 501 (M+). Анализ, вычисленный для C24H22Cl2N4O4: С, 57,50; Н, 4,42; N, 11,17. Найдено: С, 57,41; Н, 4,51; N, 10,98. Пример 79. 6-(2,6-Дихлорфенил)-8-метил 2-(пиридин-3-иламино)-8 Н-пиридо[2,3d]пиримидин-7-он. Смесь 0,165 г (0,47 ммоля) 6-(2,6 дихлорфенил)-8-метил-2-метилсульфанил-8 Нпиридо[2,3-d]пиримидин-7-она из примера 37,0,500 г (5,30 ммоля) 3-аминопиридина в виде основания и 0,066 г (0,50 ммоля) хлоргидрата 3 аминопиридина нагревали при перемешивании на масляной бане с температурой 210 С в течение 1 ч. Прибавляли воду (5 мл) к охлажденной реакционной смеси для осаждения твердого вещества. Твердое вещество отфильтровывали,хорошо промывали водой и сушили; получали 0,147 г. Очистку осуществляли путем хроматографии на силикагеле при вымывании хлороформом, а затем этилацетатом. Этилацетатный элюат, содержащий очищенный продукт, концентрировали до объема 2 мл. Кристаллы, выпавшие при внесении затравки, отфильтровывали и промывали 0,5 мл этилацетата и 1 мл диэтилового эфира; получали 0,810 г; т. пл. 247248 С. Масс-спектр (х.и.) 398 (М+). Анализ, вычисленный для С 19 Н 13 Сl2N5 О: С, 57,30; Н, 3,29; N, 17,59. Найдено: С, 57,33; Н, 3,38; N, 17,43. 52 Пример 80. 6-(2,6-Дихлорфенил)-2-[4-(2 диэтиламиноэтокси)фениламино]-8-метил-8 Нпиридо[2,3-d]пиримидин-7-он. Смесь 0,155 г (0,40 ммоля) 6-(2,6 дихлорфенил)-8-метил-2-метилсульфанил-8 Нпиридо[2,3-d]пиримидин-7-она из примера 37,0,167 г (0,80 ммоля) 4-(2-диэтиламиноэтокси) анилина и 1 мл простого 2-метоксиэтилового эфира (т.кип. 162 С) нагревали при перемешивании на масляной бане с температурой 150 С. Все твердое вещество постепенно растворилось за 10 мин. Раствор нагревали еще 10 мин и охлаждали до 100 С. Добавляли по каплям воду до легкого помутнения. Кристаллы, выпавшие при внесении затравки, отфильтровывали, промывали 0,5 мл диэтилового эфира и 2 мл воды, сушили; получали 0,105 г. Очистку проводили хроматографически, вымывая хлороформом, затем этилацетатом и наконец хлороформом с 10% метилового спирта для получения фракции, содержащей чистый продукт. Элюат упаривали досуха. Оставшееся аморфное твердое вещество растворяли в 1 мл теплого этилацетата. Кристаллы, выпавшие при внесении затравки, отфильтровывали и осторожно промывали этилацетатом и диэтиловым эфиром; получали 0,042 г; т.пл. 141-143 С. Масс-спектр (х.и.) 512 (M+). Анализ, вычисленный для C26H27Cl2N5O2: С, 60,94; Н, 5,31; N, 13,67. Найдено: С, 60,96; Н, 5,36; N, 13,52. Пример 81. 6-(2,6-Дихлорфенил)-8-метил 2-[5-(4-метилпиперазин-1-ил)пентиламино]-8 Нпиридо[2,3-d]пиримидин-7-он. Смесь 0,165 г (0,47 ммоля) 6-(2,6 дихлорфенил)-8-метил-2-метилсульфанил-8 Нпиридо[2,3-d]пиримидин-7-она из примера 37 и 0,50 г (2,70 ммоля) 1-(5-аминопентил)-4 метилпиперазина нагревали при перемешивании на масляной бане с температурой 180-185 С. Через 2 мин все растворилось. Через 0,5 ч раствор охлаждали до комнатной температуры и прибавляли 5 мл воды для осаждения смолистого напоминающего тянучку осадка. Декантировали и смолистое вещество растирали опять с 5 мл воды. Декантировали и смолистый остаток обрабатывали 35 мл диэтилового эфира. Эфирный раствор промывали водой (250 мл), сушили (карбонатом калия) и концентрировали до объема 5 мл. Прибавляли петролейный эфир до легкого помутнения. Кристаллы, выпавшие при внесении затравки, отфильтровывали и промывали смесью 80% диэтилового эфира и 20% петролейного эфира; получали 0,060 г; т. пл. 110112 С. Масс-спектр (х.и.) 489 (М+). Анализ, вычисленный для С 24 Н 30Cl2N6 О: С, 58,90; Н, 6,18; N, 17,17. Найдено: С, 58,75; Н, 6,14; N, 16,96. Пример 82. 6-(2,66-Дихлорфенил)-2-(3 гидроксиметилфениламино)-8-метил-8 Нпиридо[2,3-d]пиримидин-7-он. Смесь 0,155 г (0,40 ммоля) 6-(2,6 дихлорфенил)-2-метансульфонил-8-метил-8 Н 53 пиридо[2,3-d]пиримидин-7-она из примера 39 и 0,500 г (4,10 ммоля) 3-(гидроксиметил)анилина нагревали на масляной бане с температурой 180 С в течение 10 мин. При примерно 120 С прибавляли 2 мл ледяной уксусной кислоты для растворения смолистого остатка. Прибавляли воду (20 мл) для осаждения твердого вещества. Смесь фильтровали. Осадок на фильтре хорошо промывали водой и сушили; получали 0,130 г. Очистку осуществляли путем хроматографии на силикагеле, элюируя хлороформом, а затем этилацетатом для получения фракции, содержащей чистый продукт. Этилацетатный элюат концентрировали до объема в 1 мл. Кристаллы,выпавшие при внесении затравки, отфильтровывали и промывали 0,5 мл этилацетата, а затем 1 мл диэтилового эфира; получали 0,059 г; т. пл. 215-217 С. Масс-спектр (х.и.) 427 (M+). Анализ, вычисленный для C21H16Cl2N4O2: С, 59,03; Н, 3,77; N, 13,11. Найдено: С, 59,14; Н, 3,91; N, 12,78. Пример 83. 6-(2,6-Дихлорфенил)-2-(3,5 диметоксифениламино)-8-метил-8 Н-пиридо[2,3d]пиримидин-7-он. Смесь 0,155 г (0,40 ммоля) 6-(2,6 дихлорфенил)-2-метансульфонил-8-метил-8 Нпиридо[2,3-d]пиримидин-7-она из примера 39 и 0,400 г (2,60 ммоля) 3,5-диметоксианилина нагревали на масляной бане с температурой 160 С в течение 5 мин. При температуре около 100 С прибавляли 1 мл ледяной уксусной кислоты для растворения расплава. Прибавляли воду (10 мл) для осаждения смолистого осадка. Декантировали и растворяли смолистый осадок в 35 мл хлористого метилена. Раствор промывали водой(2 х 20 мл), сушили над сульфатом магния, обрабатывали активированным углем, фильтровали и концентрировали. Оставшийся смолистый остаток очищали при хроматографии на силикагеле, элюируя хлороформом, а затем гексаном этилацетатом 2:1 для получения фракции, содержащей чистый продукт. Элюат упаривали почти досуха, при этом выпадали кристаллы. Кристаллы отфильтровывали и промывали 0,5 мл диэтилового эфира; получали 0,059 г; т. пл. 228-230 С. Масс-спектр (х.и.) 457 (M+). Анализ, вычисленный для C22H18Cl2N4O3: С, 57,78; Н, 3,97; N, 12,25. Найдено: С, 57,93; Н, 4,07; N, 12,16. Пример 84. Метиловый эфир 4-[6-(2,6 дихлорфенил)-8-метил-7-оксо-7,8-дигидропиридо[2,3-d]пиримидин-2-иламино]фенил уксусной кислоты. Смесь 0,226 г (0,58 ммоля) 6-(2,6 дихлорфенил)-2-метансульфонил-8-метил-8 Нпиридо[2,3-d]пиримидин-7-она из примера 39 и 0,40 г (2,80 ммоля) метилового эфира 4 аминофенилуксусной кислоты основания нагревали на масляной бане с температурой 160165 С. Полученный раствор нагревали в течение 10 мин и охлаждали до комнатной температуры. Раствор обрабатывали 1 мл ледяной ук 000897 54 сусной кислотой для растворения. Прибавляли воду (10 мл) для осаждения смолистого осадка. Смесь подвергали декантации, а оставшийся смолистый остаток растворяли в 20 мл хлороформа. Хлороформный раствор промывали 25 мл воды, сушили (сульфатом магния), фильтровали и концентрировали. Очистку осуществляли при хроматографии на силикагеле, вымывая хлороформом, а затем этилацетатом - гексаном 1:1 для получения фракции, содержащей чистый продукт. Элюат упаривали досуха для получения твердого вещества; получали 0,141 г. После перекристаллизации из этилацетата получали кристаллы, выход 0,054 г; т. пл. 224-226 С. Масс-спектр (х.и.) 469 (M+). Анализ, вычисленный для С 23 Н 18 Сl2N4O3: С, 58,86; Н, 3,87; N, 11,94. Найдено: С, 59,10; Н, 3,94; N, 11,85. Пример 85. 6-(2,6-Дихлорфенил)-2-(6 метоксипиридин-3-иламино)-8-метил-8Hпиридо[2,3-d]пиримидин-7-он. Смесь 0,155 г (0,40 ммоля) 6-(2,6 дихлорфенил)-2-метансульфонил-8-метил-8 Нпиридо[2,3-d]пиримидин-7-она из примера 39 и 0,50 г (4,00 ммоля) 5-амино-2-метоксипиридина нагревали при перемешивании на масляной бане с температурой 160 С. Полученный раствор нагревали в течение 10 мин и охлаждали до комнатной температуры. Прибавляли воду (10 мл) для осаждения смолистого осадка. Смесь подвергали декантации, а оставшийся смолистый осадок растирали с 5 мл воды. Отфильтровывали образовавшееся твердое коричневое вещество, хорошо промывали водой и сушили; получали 0,135 г. Очистку проводили путем хроматографии на силикагеле, вымывая хлороформом, а затем этилацетатом для получения фракции, содержащей чистый продукт. Элюат концентрировали до объема 2 мл. Выпавшие при внесении затравки кристаллы отфильтровывали и промывали 0,2 мл этилацетата, а затем 0,5 мл диэтилового эфира; получали 0,045 г; т. пл. 233-235 С. Масс-спектр (х.и.) 428 (M+). Анализ, вычисленный для C20H15Cl2N5O2: С, 56,09; Н, 3,53; N, 16,35. Найдено: С, 56,07; Н, 3,53; N, 16,06. Пример 86. 4-[6-(2,6-Дихлорфенил)-8 метил-7-оксо-7,8-дигидропиридо[2,3-d]пиримидин-2-иламино]фенилуксусная кислота. Метиловый эфир 4-[6-(2,6-дихлорфенил)8-метил-7-оксо-7,8-дигидропиридо[2,3-d]пиримидин-2-иламино]фенилуксусной кислоты из примера 84 в количестве 0,065 г (0,14 ммоля) растворяли в 25 мл горячего метилового спирта при перемешивании. При температуре кипения прибавляли 1 мл 2 н. едкого натра. После кипячения в течение 1 ч раствор концентрировали до объема в 5 мл (из раствора выпадало твердое вещество). Прибавляли воду (10 мл) до полного растворения. Прибавляли ледяную уксусную кислоту (0,25 мл) для осаждения твердого продукта в виде свободной кислоты. Твердое веще 55 ство отфильтровывали, хорошо промывали водой и сушили; получали 0,060 г. Очистку проводили при растворении в 60 мл хлористого метилена - метилового спирта 1:1. Отфильтровывали следы твердого вещества и фильтрат концентрировали при перемешивании до объема в 2 мл. Отделившееся твердое вещество отфильтровывали и промывали 0,5 мл метилового спирта и диэтиловым эфиром; получали 0,050 г; т.пл. 286-290 С. Масс-спектр (х.и.) 455 (М+). Анализ, вычисленный для С 22 Н 16 Сl2N4O3: С, 58,04; Н, 3,54; N, 12,31. Найдено: С, 58,28; Н, 3,59; N, 12,19. Пример 87. 6-(2,6-Дихлорфенил)-2-(3 гидроксифениламино)-8-метил-8 Н-пиридо[2,3d]пиримидин-7-он. Смесь 0,155 г (0,40 ммоля) 6-(2,6 дихлорфенил)-2-метансульфонил-8-метил-8 Нпиридо[2,3-d]пиримидин-7-она из примера 39 и 0,50 г (4,60 ммоля) 3-аминофенола плавили на масляной бане с температурой 160 С в течение 10 мин. Расплав охлаждали до примерно 100 С и прибавляли для растворения 5 мл ледяной уксусной кислоты. Прибавляли воду до возникновения легкого помутнения. Выпавшие при внесении затравки кристаллы отфильтровывали,хорошо промывали водой и сушили; получали 0,104 г. После перекристаллизации из этилацетата/петролейного эфира получали 0,035 г кристаллического продукта; т. пл. 290-292 С. Массспектр (х.и.) 413 (M+). Анализ, вычисленный для C20H14Cl2N4O20,25H2O: С, 57,50; Н, 3,50; N, 13,41. Найдено: С, 57,68; Н, 3,50; N, 13,36. Пример 88. Этиловый эфир 4-[6-(2,6 дихлорфенил)-8-метил-7-оксо-7,8-дигидропиридо[2,3-d]пиримидин-2-иламино]бензойной кислоты. Смесь 0,226 г (0,58 ммоля) 6-(2,6 дихлорфенил)-2-метансульфонил-8-метил-8 Нпиридо[2,3-d]пиримидин-7-она из примера 39 и 0,40 г (2,42 ммоля) этилового эфира 4 аминобензойной кислоты плавили на масляной бане с температурой 170 С для получения прозрачного расплава. Через 15 мин в горячем расплаве начинали отделяться кристаллы. Реакционную смесь охлаждали и растирали с 2 мл этилацетата. Прибавляли петролейный эфир (1 мл). Смесь фильтровали и осадок на фильтре промывали 2 мл диэтилового эфира; получали 0,200 г. Перекристаллизация из этилацетата приводила к 0,078 г чистого продукта; т. пл. 278-280 С. Масс-спектр (х.и.) 469 (M+). Анализ, вычисленный для C23H18Cl2N4O3 0,1 H2O: С, 58,63; Н, 3,89; N, 11,89. Найдено: С, 58,43; Н, 4,01; N, 11,61. Пример 89. Этиловый эфир 3-[6-(2,6 дихлорфенил)-8-метил-7-оксо-7,8-дигидро 000897 56 пиридо[2,3-d]пиримидин-2-иламино]бензойной кислоты. Смесь 0,226 г (0,58 ммоля) 6-(2,6 дихлорфенил)-2-метансульфонил-8-метил-8 Нпиридо[2,3-d]пиримидин-7-она из примера 39 и 0,40 г (2,42 ммоля) этилового эфира 3 аминобензойной кислоты плавили на масляной бане с температурой 170 С для получения прозрачного расплава. Через 6 мин расплав охлаждали примерно до 100 С. Прибавляли ледяную уксусную кислоту (1 мл) для растворения расплава. Для осаждения твердого вещества прибавляли воду (5 мл). Твердое вещество отфильтровывали, хорошо промывали водой и растирали с 2 мл метилового спирта. Смесь фильтровали, осадок на фильтре промывали 1 мл метилового спирта и затем диэтиловым эфиром; получали 0,194 г. После перекристаллизации из этилацетата получали чистый продукт; выход 0,075 г; т. пл. 238-240 С. Масс-спектр(х.и.) 469 (М+). Анализ, вычисленный для С 23 Н 18 Сl2N4O3: С, 58,86; Н, 3,87; N, 11,94. Найдено: С, 58,91; Н, 3,96; N, 11,87. Пример 90. 3-[6-(2,6-Дихлорфенил)-8 метил-7-оксо-7,8-дигидропиридо[2,3-d]пиримидин-2-иламино]бензойная кислота. Этиловый эфир 3-[6-(2,6-дихлорфенил)-8 метил-7-оксо-7,8-дигидропиридо[2,3-d]пиримидин-2-иламино]бензойной кислоты из примера 89 в количестве 0,065 г (0,139 ммоля) растворяли в 75 мл кипящего метилового спирта. Прибавляли 2 н. едкий натр (2 мл) и прозрачный раствор выдерживали при кипении в течение 2 ч. Раствор концентрировали при перемешивании до объема примерно в 15 мл. Мутный раствор фильтровали горячим для удаления следов твердого вещества. Фильтрат концентрировали до объема около 4 мл. Прибавляли воду (5 мл) до помутнения смеси. Прибавляли ледяную уксусную кислоту (1 мл) для осаждения хлопьевидного твердого вещества. Твердое вещество отфильтровывали, хорошо промывали водой и сушили; получали 0,048 г. Очистку проводили при растворении в 4 мл теплого диметилформамида и прибавлении 20 мл диэтилового эфира. Кристаллы, медленно выпадавшие из прозрачного раствора, отфильтровывали и промывали диэтиловым эфиром и затем водой (для удаления следов ацетата натрия); получали 0,025 г; т.пл. 300 С. Масс-спектр (х.и.) 441 (M+). Анализ, вычисленный для С 21 Н 14 Сl2N4O3: С, 57,16; Н, 3,20; N, 12,70. Найдено: С, 56,88; Н, 3,42; N, 12,52. Пример 91. Этиловый эфир 4-4-[6-(2,6 Дихлорфенил)-8-метил-7-оксо-7,8-дигидропиридо[2,3-d]пиримидин-2-иламино]фенил масляной кислоты. Смесь 0,452 г (1,16 ммоля) 6-(2,6 дихлорфенил)-2-метансульфонил-8-метил-8 Нпиридо[2,3-d]пиримидин-7-она из примера 39 и 1,00 г (4,83 ммоля) этилового эфира 4 57 аминофенилмасляной кислоты основания нагревали на масляной бане с температурой 160165 С. Через 1 мин все растворялось. Через 10 мин реакционную смесь охлаждали до примерно 100 С и прибавляли 2 мл ледяной уксусной кислоты для растворения вязкого вещества. Прибавляли воду (20 мл) для осаждения смолистого осадка. Смесь подвергали декантации, а оставшийся смолистый осадок растирали с водой (310 мл). Смолистый осадок растворяли в 25 мл хлористого метилена и раствор промывали 25 мл воды, сушили (сульфатом магния),фильтровали и упаривали. Оставшееся вещество растворяли в 2 мл горячего этилацетата. Выпавшие при внесении затравки кристаллы отфильтровывали и промывали 2 мл диэтилового эфира; получали 0,358 г. Дальнейшая очистка путем хроматографии на силикагеле была необходима для удаления следов примесей. Раствор вещества в хлороформе наносили на колонку и вещество вымывали этилацетатом - гексаном 1:1. Элюат концентрировали и смолистый остаток растворяли в 5 мл теплого диэтилового эфира. Кристаллы чистого вещества выпадали при внесении затравки; получали 0,256 г; т.пл. 169170 С. Масс-спектр (х.и.) 511 (M+). Анализ, вычисленный для С 26 Н 24 Сl2N4O3: С, 61,06; Н, 4,73; N, 10,96. Найдено: С, 61,19; Н, 4,76; N, 10,86. Пример 92. 4-4-[6-(2,6-Дихлорфенил)-8 метил-7-оксо-7,8-дигидропиридо[2,3-d]пиримидин-2-иламино]фенилмасляная кислота. Прибавляли 5 мл 2 н. едкого натра к горячему перемешиваемому раствору 0,170 г (0,33 ммоля) этилового эфира 4-4-[6-(2,6 дихлорфенил)-8-метил-7-оксо-7,8-дигидропиридо[2,3-d]пиримидин-2-иламино]фенилмасляной кислоты из примера 91. Раствор выдерживали при кипении в течение 1 ч. Прибавляли 1 мл ледяной уксусной кислоты и реакционный раствор упаривали до объема около 25 мл. Прибавляли воду (50 мл) для осаждения твердого вещества. Смесь фильтровали и осадок на фильтре тщательно промывали водой и сушили; получали 0,130 г. В таких условиях гидролиз не проходил до конца. Продукт очищали для удаления исходного сложного эфира с помощью хроматографии на силикагеле, элюировали метиловым спиртом - хлороформом 1:20, получали 55 мг чистой кислоты; т. пл. 169-171 С. Массспектр (х.и.) 483 (М+). Анализ, вычисленный для С 24 Н 20 Сl2N4O3: С, 59,64; Н, 4,17; N, 11,59. Найдено: С, 59,77; Н, 4,24; N, 11,44. Пример 93. (2,6-Дихлорфенил)-8-этил-2(пиридин-4-иламино)-8 Н-пиридо[2,3-d]пиримидин-7-он. Смесь 0,126 г (0,31 ммоля) 6-(2,6 дихлорфенил)-2-метансульфонил-8-этил-8 Нпиридо[2,3-d]пиримидин-7-она в виде гидрата с 0,25 моля воды из примера 68 и 0,300 г (3,20 ммоля) 4-аминопиридина нагревали при пере 000897 58 мешивании на масляной бане с температурой 150 С в течение 10 мин. Через три минуты выпадали кристаллы. Смесь охлаждали и прибавляли 1 мл метилового спирта. Твердое вещество отфильтровывали, промывали 1 мл метилового спирта, а затем диэтиловым эфиром; получали 0,100 г. Солянокислую соль получали следующим образом. Описанное выше неочищенное основание суспендировали в 2 мл метилового спирта. Прибавляли 1 мл 2 н. соляной кислоты и смесь нагревали до полного растворения. Прибавляли еще 2 мл 2 н. соляной кислоты. Выпавшие при внесении затравки кристаллы отфильтровывали и последовательно промывали 1 мл 2 н. соляной кислоты, 2 мл этилацетата, а затем диэтиловым эфиром; получали 0,110 г. Перекристаллизация из метилового спирта/диэтилового эфира приводила к 0,063 г кристаллического продукта; т. пл. 325-330 С. Массспектр (х.и.) 412 (M+). Анализ, вычисленный для C20H15Cl2N5OHCl: С, 53,53; Н, 3,59; N, 15,61. Найдено: С, 53,48; Н, 3,74; N, 15,38. Пример 94. Этиловый эфир 4-этиламино-2 метилтио-5-пиримидинкарбоновой кислоты. К раствору этилового эфира 4-хлор-2 метилтио-5-пиримидинкарбоновой кислоты(10,0 г, 43,10 ммоля) в 150 мл тетрагидрофурана при комнатной температуре прибавляли триэтиламин (18,5 мл, 133 ммоля), а затем 9 мл 70%ного водного раствора этиламина. Раствор перемешивали 30 мин, затем концентрировали в вакууме и распределяли между хлороформом и насыщенным водным раствором бикарбоната натрия. Органический слой сушили над сульфатом магния, фильтровали и концентрировали,получали 9,32 г (90%) этилового эфира 4 этиламино-2-метилтио-5-пиримидинкарбоновой кислоты в виде масла. Анализ, вычисленный для С 10 Н 15N3O2S: С, 49,77; Н, 6,27; N, 17,41. Найдено: С, 49,77; Н, 6,24; N, 17,30. Пример 95. 4-Этиламино-2-метилтио-5 пиримидинметанол. Раствор этилового эфира 4-этиламино-2 метилтио-5-пиримидинкарбоновой кислоты (8,93 г, 37,1 ммоля) в 100 мл тетрагидрофурана прибавляли по каплям к находящейся при комнатной температуре суспензии алюмогидрида лития (2,30 г, 60,5 ммоля) в 100 мл тетрагидрофурана. Через 10 мин реакцию осторожно обрывали с помощью 4,5 мл воды, 4,5 мл 15%ного едкого натра и 16 мл воды, смесь перемешивали в течение 1,5 ч. Белый осадок отделяли при фильтрации и промывали этилацетатом. Фильтрат концентрировали в вакууме и прибавляли гексан : этилацетат 1:1. Твердое вещество отделяли и получали 6,77 г (92%) 4-этиламино 2-метилтио-5-пиримидинметанола; т. пл. 152156 С. Анализ, вычисленный для C8H13N3OS: С, 48,22; Н, 6,58; N, 21,09. 59 Найдено: С, 48,14; Н, 6,61; N, 20,85. Пример 96. 4-Этиламино-2-метилтио-5 формилпиримидин. К 4-этиламино-2-метилтио-5-пиримидинметанолу (6,44 г, 32,4 ммоля) в 600 мл хлороформа прибавляли двуокись марганца (21,0 г,241 ммоль) в течение трех минут. Суспензию перемешивали при комнатной температуре в течение 2 ч и прибавляли дополнительно 5,5 г двуокиси марганца. Перемешивание продолжали в течение 4,5 ч. Смесь затем фильтровали через целит, промывая хлороформом. Фильтрат упаривали в вакууме и получали 6,25 г (97%) 4 этиламино-2-метилтио-5-формилпиримидина; т. пл. 58-61 С. Анализ, вычисленный для C8H11N3OS: С, 48,71; Н, 5,62; N, 21,30. Найдено: С, 48,62; Н, 5,60; N, 21,28. Пример 97. Этиловый эфир 4-этиламино-2 метансульфинилпиримидин-5-карбоновой кислоты. К раствору этилового эфира 4-этиламино 2-метилтио-5-пиримидинкарбоновой кислоты(2,011 г, 8,34 ммоля) в 70 мл хлороформа при комнатной температуре прибавляли -транс-2(фенилсульфонил)-3-фенилоксазиридин (2,70 г,10,34 ммоля). Раствор перемешивали при комнатной температуре в течение 7 ч, затем концентрировали в вакууме. Остаток очищали с помощью флеш-хроматографии, вымывая с градиентом этилацетатом до этилацетата с 3% метанола, получали 2,07 г (97%) этилового эфира 4-этиламино-2-метансульфинилпиримидин-5 карбоновой кислоты; т. пл. 54-56 С. Анализ, вычисленный для С 10 Н 15N3 О 3S: С, 46,68; Н, 5,88; N, 16,33. Найдено: С, 46,56; Н, 5,68; N, 16,23. Пример 98. Этиловый эфир 4-этиламино-2 фениламинопиримидин-5-карбоновой кислоты. Раствор этилового эфира 4-этиламино-2 метансульфинилпиримидин-5-карбоновой кислоты (166 мг, 0,65 ммоля) в 4 мл анилина нагревали до 110 С в течение 30 мин. Раствор охлаждали до комнатной температуры и концентрировали в вакууме. При флеш-хроматографии с вымыванием гексаном : этилацетатом 2:1 получали 158 мг (87%) белого твердого вещества,которое по данным ЯМР-спектра являлось в основном желаемым продуктом. Пример 99. (4-Этиламино-2-фениламинопиримидин-5-ил)метанол. Раствор этилового эфира 4-этиламино-2 фениламинопиримидин-5-карбоновой кислоты(109 мг, 0,38 ммоля) в 6 мл тетрагидрофурана прибавляли по каплям к находящейся при комнатной температуре суспензии алюмогидрида лития (35 мг, 0,92 ммоля) в 5 мл тетрагидрофурана. Через 25 мин прибавляли еще 30 мг алюмогидрида лития и продолжали перемешивание в течение 30 мин. Реакцию осторожно обрывали с помощью 120 мкл воды, 200 мкл 15%-ного едкого натра и 300 мкл воды. После перемеши 000897 60 вания в течение 1 ч белый осадок удаляли при фильтрации, промывая этилацетатом. Фильтрат концентрировали в вакууме и неочищенное вещество очищали при флеш-хроматографии,элюируя этилацетатом, получали 36 мг (39%)(4-этиламино-2-фениламинопиримидин-5 ил)метанола; т. пл. 174-176 С. Анализ, вычисленный для C13H16N4O: С, 63,92; Н, 6,60; N, 22,93. Найдено: С, 63,97; Н, 6,58; N, 22,79. Пример 100. 4-Этиламино-2-фениламинопиримидин-5-карбальдегид. К раствору (4-этиламино-2-фениламинопиримидин-5-ил)метанола (173 г, 0,71 ммоля) в 15 мл хлороформа прибавляли двуокись марганца (600 мг, 6,89 ммоля). После перемешивания при комнатной температуре в течение ночи смесь фильтровали через прокладку из целита,промывали хлороформом. Фильтрат концентрировали в вакууме и получали 170 мг (99%) 4 этиламино-2-фениламинопиримидин-5-карбальдегида; т. пл. 155-157 С. Анализ, вычисленный для C13H14N4O: С, 64,45; Н, 5,82; N, 23,12. Найдено: С, 64,31; Н, 6,01; N, 22,98. Пример 101. (8-Этил-7-имино-6-тиофен-3 ил-7,8-дигидропиридо[2,3-d]пиримидин-2-ил)фениламин. К суспензии гидрида натрия (60%-ная в минеральном масле, 27 мг) в 5 мл 2 этоксиэтанола прибавляли 3-тиофенацетонитрил (168 мг, 1,36 ммоля). После перемешивания в течение 5 мин при комнатной температуре прибавляли 4-этиламино-2-фениламинопиримидин-5-карбальдегид (300 мг, 1,24 ммоля) и реакционную смесь нагревали при 120 С в течение 2 ч, получая в результате темнокоричневый раствор. После охлаждения раствор выливали в воду, что вызывало выпадение осадка. Полученный осадок отфильтровывали и промывали водой. Неочищенный продукт очищали при флеш-хроматографии, элюируя хлористым метиленом с 5% метилового спирта, а затем хлористым метиленом с 10% метилового спирта. При концентрировании фракций, содержащих продукт, получали 340 мг (78%) (8 этил-7-имино-6-тиофен-3-ил-7,8-дигидропиридо[2,3-d]пиримидин-2-ил)фениламина; т. пл. 220222 С. Масс-спектр (х.и.) 348 (M+). Анализ, вычисленный для C19H17N5S: С, 65,68; Н, 4,93; N, 20,16. Найдено: С, 64,42; Н, 4,86; N, 19,78. Пример 102. 8-Этил-2-фениламино-6 тиофен-3-ил-8 Н-пиридо[2,3-d]пиримидин-7-он. Соединение получали из (8-этил-7-имино 6-тиофен-3-ил-7,8-дигидропиридо[2,3-d]пиримидин-2-ил)фениламина, следуя методике из примера 116. Продукт очищали при флешхроматографии, элюируя хлористым метиленом с 5% метилового спирта, а затем хлористым метиленом с 10% метилового спирта; т. пл. 223225 С. Масс-спектр (х.и.) 349 (M+).
МПК / Метки
МПК: A61K 31/519, C07D 471/04, A61P 35/00
Метки: атеросклероза, способ, композиция, активностью, рестеноза, соли, псориаза, фармацевтически, лечения, фармацевтическая, пролиферацией, ингибирующей, производные, рака, опосредованных, клеточной, протеин-тирозин-киназу, приемлемые, обладающая, пиридо[2,3-d]пиримидина, заболеваний
Код ссылки
<a href="https://eas.patents.su/30-897-proizvodnye-pirido23-dpirimidina-i-ih-farmacevticheski-priemlemye-soli-farmacevticheskaya-kompoziciya-obladayushhaya-ingibiruyushhejj-protein-tirozin-kinazu-aktivnostyu-sposob-lech.html" rel="bookmark" title="База патентов Евразийского Союза">Производные пиридо[2,3-d]пиримидина и их фармацевтически приемлемые соли, фармацевтическая композиция, обладающая ингибирующей протеин-тирозин-киназу активностью, способ лечения заболеваний, опосредованных клеточной пролиферацией, и способ лечения рака, атеросклероза, псориаза или рестеноза</a>
Предыдущий патент: Способ окисления полисахарида
Случайный патент: Фармацевтическая композиция, содержащая фенофибрат, и способ ее получения












