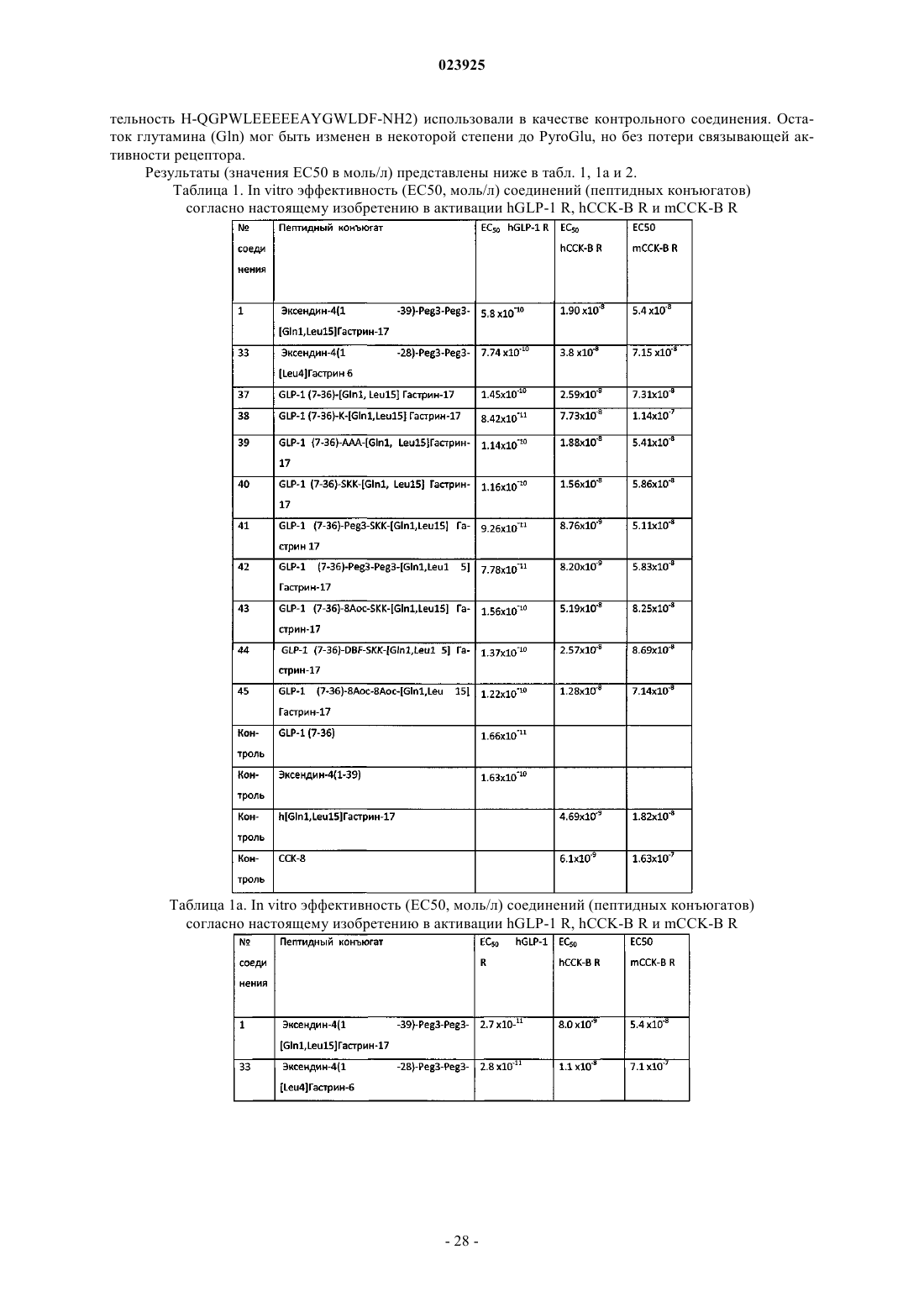
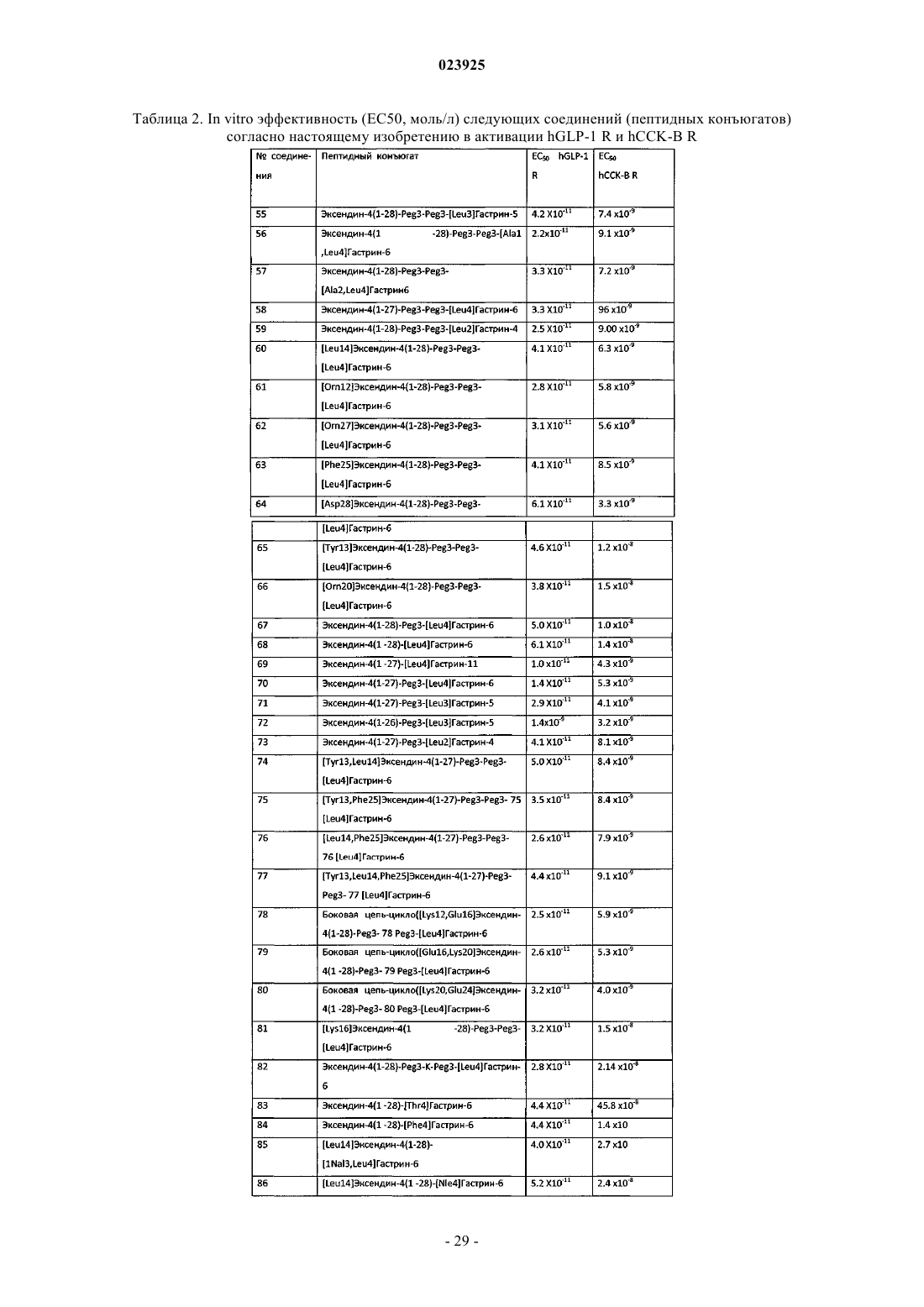
Пептидные конъюгаты агонистов рецептора glp-1 и их применение
Номер патента: 23925
Опубликовано: 29.07.2016
Авторы: Толборг Якоб Линд, Неэруп Трине Сковлунд Рюге, Ролстед Камилла, Эстерлунд Торбен, Мартенссон Ульрика, Брорсон Марианна, Фосгерау Кельд
Формула / Реферат
1. Пептидный конъюгат, имеющий формулу I
R1-Z-L-Y-R2 (I),
в которой
R1 представляет собой Н, С1-4 алкил, ацетил, формил, бензоил или трифторацетил;
R2 представляет собой ОН или NH2;
Z содержит последовательность Эксендина-4(1-39), имеющую последовательность
His-Gly-Glu-Gly-Thr-Phe-Thr-Ser-Asp-Leu-Ser-Lys-Gln-Met-Glu-Glu-Glu-Ala-Val-Arg-Leu-Phe-Ile-Glu-Trp-Leu-Lys-Asn-Gly-Gly-Pro-Ser-Ser-Gly-Ala-Pro-Pro-Pro-Ser,
или его аналога Za;
L представляет собой необязательную линкерную группу; и
Y содержит последовательность Гастрина-17, имеющую последовательность
Gln-Gly-Pro-Trp-Leu-Glu-Glu-Glu-Glu-Glu-Ala-Tyr-Gly-Trp-Y15-Asp-Phe,
в которой Y15 выбран из Leu, Nle, Phe и Thr
или его аналога Ya.
2. Пептидный конъюгат по п.1, отличающийся тем, что:
(i) Za имеет до 10 замен в положениях и/или содержит укорочение на С-конце на 1-12 аминокислот по сравнению с последовательностью Эксендина-4; и/или
(ii) Ya имеет до 5 замен в положениях по сравнению с последовательностью Гастрина-17 и/или содержит укорочение на N-конце на 1-13 аминокислот по сравнению с последовательностью Гастрина-17.
3. Пептидный конъюгат по п.1 или 2, отличающийся тем, что
Za представляет собой пептидную последовательность, имеющую формулу IIa
His-Z2-Z3-Gly-Thr-Phe-Thr-Ser-Z9-Z10-Z11-Z12-Z13-Z14-Glu-Z16-Z17-Z18-Z19-Z20-Z21-Z22-Z23-Z24-Z25-Z26-Z27-Z28-Z29-Z30-Z31-Z32-Z33-Z34-Z35-Z36-Z37-Z38-Z39 (IIa),
в которой
Z2 выбран из Gly, Ala, Ser, Aib, Thr, Leu и Ile;
Z3 выбран из Glu и Asp;
Z9 выбран из Asp и Glu;
Z10 выбран из Leu, Val, Ile и Ala;
Z11 выбран из Ser и Aib;
Z12 выбран из Ser, Gln, Arg, Cys, Lys, Glu и Orn;
Z13 выбран из Arg, Ser, Gin, Tyr и Glu;
Z14 выбран из Gly, Cys, Phe, Tyr, Trp, Lys, Met, Leu, Nle и Ile;
Z16 выбран из Asp, Gly, Aib, Glu, Lys и Cys;
Z17 выбран из Glu, Cys, Lys, Ser и Gln;
Z18 выбран из Ala и Aib;
Z19 выбран из Val, Leu, Ile и Ala;
Z20 выбран из Arg, Lys, Cys, Orn и Glu;
Z21 выбран из Leu и Glu;
Z22 выбран из Phe и Ala;
Z23 выбран из Ile и Leu;
Z24 выбран из Glu, Cys, Lys, Ala и Arg;
Z25 выбран из Trp, Cys, Lys и Phe;
Z26 выбран из Leu и Ile;
Z27 выбран из Ile, Val, Gln, Lys, Cys, Arg и Orn;
Z28 выбран из Asn, Ser, Asp, Aib, Gln, Lys, Cys, Arg, Tyr, bAla, Glu, Orn и Leu или он отсутствует;
Z29 выбран из Gly, Aib и bAla или он отсутствует;
Z30 выбран из Gly, Cys, Lys и Arg или он отсутствует;
Z31 выбран из Pro, Ser и Asp или он отсутствует;
Z32 выбран из Ser и Lys или он отсутствует;
Z33 представляет собой Ser или он отсутствует;
Z34 выбран из Gly и Lys или он отсутствует;
Z35 представляет собой Ala или он отсутствует;
Z36 представляет собой Pro или он отсутствует;
Z37 представляет собой Pro или он отсутствует;
Z38 представляет собой Pro или он отсутствует;
Z39 представляет собой Ser или он отсутствует;
L представляет собой пептидную последовательность, имеющую формулу IIb
L1-L2-L3-L4 (IIb),
в которой
L1 выбран из Ser, Ala, Lys, Orn, bAla, 8Aoc, DBF, Peg3, Cys и Gln или он отсутствует;
L2 выбран из Ser, Ala, Lys, Orn, bAla, 8Aoc, DBF, Peg3, Cys и Gln или он отсутствует;
L3 выбран из Ser, Ala, Lys, Orn, bAla, 8Aoc, DBF, Peg3, Cys и Gln или он отсутствует;
L4 выбран из Ser, Ala, Lys, Orn, bAla, 8Aoc, DBF, Peg3, Cys и Gln или он отсутствует;
Ya представляет собой пептидную последовательность, имеющую формулу IIc
Y1-Y2-Y3-Y4-Y5-Y6-Y7-Y8-Y9-Y10-Y11-Y12-Y13-Y14-Y15-Asp-Y17 (IIc),
в которой
Y1 представляет собой Gln или он отсутствует;
Y2 представляет собой Gly или он отсутствует;
Y3 представляет собой Pro или он отсутствует;
Y4 представляет собой Trp или он отсутствует;
Y5 представляет собой Leu или он отсутствует;
Y6 представляет собой Glu или он отсутствует;
Y7 представляет собой Glu или он отсутствует;
Y8 представляет собой Glu или он отсутствует;
Y9 представляет собой Glu или он отсутствует;
Y10 представляет собой Glu или он отсутствует;
Y11 представляет собой Ala или он отсутствует;
Y12 выбран из Ala и Tyr или он отсутствует;
Y13 выбран из Gly и Ala, или он отсутствует;
Y14 выбран из Trp, Phe, 1Nal и Met;
Y15 выбран из Leu, Nle, Phe и Thr и
Y17 выбран из Phe и 3-(3-пиридил)аланина.
4. Пептидный конъюгат по любому из пп.1-3, отличающийся тем, что
Za представляет собой пептидную последовательность, имеющую формулу IIIa
His-Gly-Glu-Gly-Thr-Phe-Thr-Ser-Z9-Leu-Ser-Z12-Z13-Z14-Glu-Z16-Glu-Ala-Val-Z20-Leu-Phe-Ile-Z24-Z25-Leu-Z27-Z28 (IIIa),
в которой
Z9 выбран из Asp и Glu;
Z12 выбран из Lys, Arg и Orn;
Z13 выбран из Gln и Tyr;
Z14 выбран из Met и Leu;
Z16 выбран из Glu, Cys и Lys;
Z20 выбран из Arg, Lys и Orn;
Z24 выбран из Lys и Glu;
Z25 выбран из Trp, Lys, Cys и Phe;
Z27 выбран из Lys, Arg и Orn;
Z28 выбран из Asn и Asp или он отсутствует;
L представляет собой пептидную последовательность, имеющую формулу IIIb
L1-L2-L3-L4 (IIIb),
в которой
L1 выбран из Peg3, Gln, Cys, Lys и Orn или он отсутствует;
L2 выбран из Peg3, Gln, Cys, Lys и Orn или он отсутствует;
L3 выбран из Peg3, Gln, Cys, Lys и Orn или он отсутствует;
L4 выбран из Peg3, Gln, Cys, Lys и Orn или он отсутствует;
Ya представляет собой пептидную последовательность, имеющую формулу IIIc
Y12-Y13-Y14-Y15-Asp-Y17 (IIIc),
в которой
Y12 выбран из Tyr и Ala или он отсутствует;
Y13 выбран из Gly и Ala или он отсутствует;
Y14 выбран из Trp, 1Nal и Phe;
Y15 выбран из Leu, Nle, Thr и Phe и
Y17 выбран из Phe и 3-(3-пиридил)аланина.
5. Пептидный конъюгат по любому из пп.1-4, отличающийся тем, что
Za представляет собой пептидную последовательность, имеющую формулу IVa
His-Gly-Glu-Gly-Thr-Phe-Thr-Ser-Z9-Leu-Ser-Z12-Gln-Met-Glu-Z16-Glu-Ala-Val-Arg-Leu-Phe-Ile-Glu-Trp-Leu-Z27-Z28 (IVa),
в которой
Z9 выбран из Glu и Asp;
Z12 выбран из Lys и Orn;
Z16 выбран из Glu и Lys;
Z27 выбран из Lys и Orn;
Z28 выбран из Asn и Asp или он отсутствует;
L представляет собой пептидную последовательность, имеющую формулу IVb
L1-L2-L3-L4 (IVb),
в которой
L1 выбран из Peg3, Gln, Cys, Lys и Orn или он отсутствует;
L2 выбран из Peg3, Gln, Cys, Lys и Orn или он отсутствует;
L3 выбран из Peg3, Gln, Cys, Lys и Orn или он отсутствует;
L4 выбран из Peg3, Gln, Cys, Lys и Orn или он отсутствует;
Ya представляет собой пептидную последовательность, имеющую формулу IVc
Y12-Y13-Trp-Leu-Asp-Phe (IVc),
в которой
Y12 представляет собой Tyr или он отсутствует и
Y13 представляет собой Gly или он отсутствует.
6. Пептидный конъюгат по любому из пп.1-5, отличающийся тем, что
Za представляет собой пептидную последовательность, имеющую формулу Va
His-Gly-Glu-Gly-Thr-Phe-Thr-Ser-Z9-Leu-Ser-Z12-Tyr-Leu-Glu-Z16-Glu-Ala-Val-Arg-Leu-Phe-Ile-Glu-Phe-Leu-Z27-Z28 (Va),
в которой
Z9 выбран из Glu и Asp;
Z12 выбран из Lys и Orn;
Z16 выбран из Glu и Lys;
Z27 выбран из Lys и Orn;
Z28 выбран из Asn и Asp, или он отсутствует;
L представляет собой пептидную последовательность, имеющую формулу Vb
L1-L2-L3-L4 (Vb),
в которой
L1 выбран из Peg3, Gln, Cys, Lys и Orn или он отсутствует;
L2 выбран из Peg3, Gln, Cys, Lys и Orn или он отсутствует;
L3 выбран из Peg3, Gln, Cys, Lys и Orn или он отсутствует;
L4 выбран из Peg3, Gln, Cys, Lys и Orn или он отсутствует;
Ya представляет собой пептидную последовательность, имеющую формулу Vc
Y12-Y13-Trp-Leu-Asp-Phe (Vc),
в которой
Y12 представляет собой Tyr или он отсутствует и
Y13 представляет собой Gly или он отсутствует.
7. Пептидный конъюгат по любому из предыдущих пунктов, отличающийся тем, что пептидная последовательность формулы I содержит один или несколько внутримолекулярных мостиков.
8. Пептидный конъюгат по п.7, отличающийся тем, что указанный внутримолекулярный мостик образуется между боковыми цепями двух аминокислотных остатков, которые разделены тремя аминокислотами в линейной последовательности согласно формуле I.
9. Пептидный конъюгат по п.8, отличающийся тем, что указанный внутримолекулярный мостик образуется между боковыми цепями пар остатков х и х+3, х+4 или х+5.
10. Пептидный конъюгат по любому из пп.7-9, отличающийся тем, что указанный внутримолекулярный мостик представляет собой лактамное кольцо.
11. Пептидный конъюгат по любому из пп.7-10, отличающийся тем, что указанный внутримолекулярный мостик включает пару остатков, в которых:
Z12 представляет собой Lys и Z16 представляет собой Glu; Z12 представляет собой Glu и Z16 представляет собой Lys;
Z16 представляет собой Glu и Z20 представляет собой Lys; Z16 представляет собой Lys и Z20 представляет собой Glu;
Z20 представляет собой Glu и Z24 представляет собой Lys; Z20 представляет собой Lys и Z24 представляет собой Glu.
12. Пептидный конъюгат по любому из пп.1-11, отличающийся тем, что Za имеет по меньшей мере 75% идентичности с природным эксендином-4, например по меньшей мере 80, 85, 90 или 95%.
13. Пептидный конъюгат по любому из пп.1-11, отличающийся тем, что Ya имеет по меньшей мере 70% идентичности с природным гастрином, например по меньшей мере 75, 80, 85, 90 или 95%.
14. Пептидный конъюгат по любому из предыдущих пунктов, отличающийся тем, что пептид формулы I имеет последовательность:
Эксендин-4(1-39)-Peg3-Peg3-[Gln1,Leu15]Гастрин-17,
Эксендин-4(l-39)-[Gln1,Leu15]Гастрин-17,
Эксендин-4(1-39)-K-[Gln1,Leu15]Гастрин-17,
Эксендин-4(1-39)-ААА-[Gln1,Leu15]Гастрин-17,
Эксендин-4(1-39)-SKK-[Gln1,Leu15]Гастрин-17,
Эксендин-4(1-39)-Peg3-SKK-[Gln1,Leu15]Гастрин-17,
Эксендин-4(1-39)-8Aoc-SKK-[Gln1,Leu15]Гастрин-17,
Эксендин-4(l-39)-DBF-SKK-[Gln1,Leu15]Гастрин-17,
Эксендин-4(1-39)-8Аос-8Aoc-[Gln1,Leu15]Гастрин-17,
Эксендин-4(1-39)-[Leu4]Гастрин-6,
Эксендин-4(1-39)-K-[Leu4]Гастрин-6,
Эксендин-4(1-39)-ААА-[Leu4]Гастрин-6,
Эксендин-4(1-39)-SKK-[Leu4]Гастрин-6,
Эксендин-4(1-39)-Peg3-SKK-[Leu4]Гастрин-6,
Эксендин-4(1-39)-Peg3-Peg3-[Leu4]Гастрин-6,
Эксендин-4(1-39)-8Аос-SKK-[Leu4]Гастрин-6,
Эксендин-4(1-39)-DBF-SKK-[Leu4]Гастрин-6,
Эксендин-4(1-39)-8Аос-8Аос-[Leu4]Гастрин- 6,
Эксендин-4(1-28)-[Gln1,Leu15]Гастрин-17,
Эксендин-4(1-28)-K-[Gln1,Leu15]Гастрин-17,
Эксендин-4(1-28)-AAA-[Gln1,Leu15]Гастрин-17,
Эксендин-4(1-28)-SKK-[Gln1,Leu15]Гастрин-17,
Эксендин-4(1-28)-Peg3-SKK-[Gln1,Leu15]Гастрин-17,
Эксендин-4(1-28)-Peg3-Peg3-[Gln1,Leu15]Гастрин-17,
Эксендин-4(1-28)-8Aoc-SKK-[Gln1,Leu15]Гастрин-17,
Эксендин-4(l-28)-DBF-SKK-[Gln1,Leu15]Гастрин-17,
Эксендин-4(1-28)-8Aoc-8Aoc-[Gln1,Leu15]Гастрин-17,
Эксендин-4(1-28)-[Leu4]Гастрин-6,
Эксендин-4(1-28)-K-[Leu4]Гастрин-6,
Эксендин-4(1-28)-ААА-[Leu4]Гастрин-6,
Эксендин-4(1-28)-SKK-[Leu4]Гастрин-6,
Эксендин-4(1-28)-Peg3-SKK-[Leu4]Гастрин-6,
Эксендин-4(1-28)-Peg3-Peg3-[Leu4]Гастрин-6,
Эксендин-4(1-28)-8Аос-SKK-[Leu4]Гастрин-6,
Эксендин-4(1-28)-DBF-SKK-[Leu4]Гастрин-6,
Эксендин-4(1-28)-8Аос-8Аос-[Leu4]Гастрин-6,
или его фармацевтически приемлемая соль или сольват.
15. Пептидный конъюгат по пп.1-11, отличающийся тем, что пептид формулы I имеет
последовательность:
Эксендин-4(1-28)-Peg3-Peg3-[Leu3]Гастрин-5,
Эксендин-4(1-28)-Peg3-Peg3-[Ala1,Leu4]Гастрин-6,
Эксендин-4(1-28)-Peg3-Peg3-[Ala2,Leu4]Гастрин-6,
Эксендин-4(1-27)-Peg3-Peg3-[Leu4]Гастрин-6,
Эксендин-4(1-28)-Peg3-Peg3-[Leu2]Гастрин-4,
[Leu14]Эксендин-4(l-28)-Peg3-Peg3-[Leu4]Гастрин-6,
[Orn12]Эксендин-4(l-28)-Peg3-Peg3-[Leu4]Гастрин-6,
[Orn27]Эксендин-4(l-28)-Peg3-Peg3-[Leu4]Гастрин-6,
[Phe25]Эксендин-4(1-28)-Peg3-Peg3-[Leu4]Гастрин-6,
[Asp28]Эксендин-4(l-28)-Peg3-Peg3-[Leu4]Гастрин-6,
[Tyr13]Эксендин-4(1-28)-Peg3-Peg3-[Leu4]Гастрин-6,
[Orn20]Эксендин-4(l-28)-Peg3-Peg3-[Leu4]Гастрин-6,
Эксендин-4(1-28)-Peg3-[Leu4]Гастрин-6,
Эксендин-4(1-28)-[Leu4]Гастрин-6,
Эксендин-4(1-27)-[Leu4]Гастрин-11,
Эксендин-4(1-27)-Peg3-[Leu4]Гастрин-6,
Эксендин-4(1-27)-Peg3-[Leu3]Гастрин-5,
Эксендин-4(1-26)-Peg3-[Leu3]Гастрин-5,
Эксендин-4(1-27)-Peg3-[Leu2]Гастрин-4,
[Tyr13,Leu14]Эксендин-4(1-27)-Peg3-Peg3-[Leu4]Гастрин-6,
[Tyr13,Phe25]Эксендин-4(1-27)-Peg3-Peg3-[Leu4]Гастрин-6,
[Leu14,Phe25]Эксендин-4(1-27)-Peg3-Peg3-[Leu4]Гастрин-6,
[Tyr13,Leu14,Phe25]Эксендин-4(1-27)-Peg3-Peg3-[Leu4]Гастрин-6,
Боковая цепь-цикло([Lys12,Glu16]Эксендин-4(1-28)-Peg3-Peg3-[Leu4]Гастрин-6,
Боковая цепь-цикло([Glu16,Lys20]Эксендин-4(1-28)-Peg3-Peg3-[Leu4]Гастрин-6,
Боковая цепь-цикло([Lys20,Glu24]Эксендин-4(1-28)-Peg3-Peg3-[Leu4]Гастрин-6,
[Lys16]Эксендин-4(1-28)-Peg3-Peg3-[Leu4]Гастрин-6,
Эксендин-4(1-28)-Peg3-K-Peg3-[Leu4]Гастрин-6,
Эксендин-4(1-28)-[Thr4]Гастрин-6,
Эксендин-4(1-28)-[Phe4]Гастрин-6,
[Leu14]Эксендин-4(1-28)-[1Nal3,Leu4]Гастрин-6,
[Leu14]Эксендин-4(1-28)-[Nle4]Гастрин-6,
[Leu14]Эксендин-4(1-28)-[Leu4,[3-(3-пиридил)-Ala]6]Гастрин-6,
[Glu9,Leu14,Phe25,Tyr13]Эксендин-4(1-27)-Peg3-Peg3-[Leu4]Гастрин-6,
[Leu14,Phe25,Tyr13]Эксендин-4(1-27)-Peg3-Peg3-[Leu4,Phe3]Гастрин-6,
[Glu9,Leu14,Phe25,Tyr13]Эксендин-4(1-27)-Peg3-Peg3-[Leu4,Phe3]Гастрин-6,
[Arg27,Leu14,Phe25,Tyr13]Эксендин-4(1-27)-Peg3-[Leu4]Гастрин-6,
[Arg12,27,Leu14,Lys16,Phe25,Tyr13]Эксендин-4(1-27)-Peg3-[Leu4]Гастрин-6,
[Arg12,27,Leu14,Lys20,Phe25,Tyr13]Эксендин-4(1-27)-Peg3-[Leu4]Гастрин-6,
[Arg12,27,Leu14,Lys24,Phe25,Tyr13]Эксендин-4(1-27)-Peg3-[Leu4]Гастрин-6,
[Arg12,Leu14,Phe25,Tyr13]Эксендин-4(1-27)-Peg3-[Leu4]Гастрин-6,
[Glu9,Leu14,Phe25,Tyr13]Эксендин-4(1-27)-[Leu2]Гастрин-4,
[Glu9,Leu14,Phe25,Tyr13]Эксендин-4(1-27)-Peg3-[Leu2]Гастрин-4,
[Glu9,Leu14,Phe25,Tyr13]Эксендин-4(l-27)-Orn-Peg3-[Leu2]Гастрин-4,
[Glu9,Leu14,Phe25,Tyr13]Эксендин-4(l-27)-Peg3-Orn-[Leu2]Гастрин-4,
[Glu9,Leu14,Phe25,Tyr13]Эксендин-4(1-27)-Orn-Orn-[Leu2]Гастрин-4,
[Glu9,Leu14,Phe25,Tyr13]Эксендин-4(1-27)-[Leu4]Гастрин-6,
[Glu9,Leu14,Phe25,Tyr13]Эксендин-4(1-27)-Peg3-[Leu4]Гастрин-6,
[Glu9,Leu14,Phe25,Tyr13]Эксендин-4(l-27)-Orn-Peg3-[Leu4]Гастрин-6,
[Glu9,Leu14,Phe25,Tyr13]Эксендин-4(l-27)-Peg3-Orn-[Leu4]Гастрин-6,
[Glu9,Leu14,Phe25,Tyr13]Эксендин-4(1-27)-Orn-Orn-[Leu4]Гастрин-6,
или его фармацевтически приемлемая соль или сольват.
16. Пептидный конъюгат, имеющий формулу VI
R1-X-L-Y-R2 (VI),
в которой
R1 представляет собой Н, С1-С4 алкил, ацетил, формил, бензоил или трифторацетил;
R2 представляет собой ОН или NH2;
X содержит последовательность GLP-1 (7-36), имеющую последовательность
His-Ala-Glu-Gly-Thr-Phe-Thr-Ser-Asp-Val-Ser-Ser-Tyr-Leu-Glu-Gly-Gln-Ala-Ala-Lys-Glu-Phe-Ile-Ala-Trp-Leu-Val-Lys-Gly-Arg,
или ее аналога Ха,
L представляет собой линкер, содержащий до 4 природных или неприродных аминокислот или их комбинацию, или он отсутствует;
Y содержит последовательность Гастрина-17, имеющую последовательность
Gln-Gly-Pro-Trp-Leu-Glu-Glu-Glu-Glu-Glu-Ala-Tyr-Gly-Trp-Y15-Asp-Phe,
при этом Y15 выбран из Leu, Nle, Phe и Thr
или его аналога Ya.
17. Пептидный конъюгат по п.16, отличающийся тем, что:
(i) Xa имеет до 5 замен в положениях и/или у него отсутствуют 1-2 аминокислоты на С-конце по сравнению с последовательностью GLP-1; и/или
(ii) Ya имеет до 5 замен в положениях по сравнению с последовательностью Гастрина-17 и/или у него отсутствуют 1-13 аминокислот на N-конце по сравнению с последовательностью Гастрина-17.
18. Пептидный конъюгат по любому из пп.16-17, отличающийся тем, что:
Xa представляет собой пептидную последовательность, имеющую формулу VIIa
His-Х8-Glu-Gly-Thr-Phe-Thr-Ser-Asp-Val-Ser-Ser-Tyr-Leu-Glu-Gly-Gln-Ala-Ala-X26-Glu-Phe-Ile-Ala-Trp-Leu-Val-X34-Gly-X36 (VIIa),
в которой
X8 выбран из Ala, Aib и Gly;
X26 выбран из Arg и Lys;
X34 выбран из Arg и Lys;
Х36 выбран из Arg и Lys;
L представляет собой пептидную последовательность, имеющую формулу VIIb
L1-L2-L3-L4 (VIIb),
в которой
L1 выбран из Ser, Ala, Lys, Orn, bAla, 8Aoc, DBF, Peg3, Cys, Gln или он отсутствует;
L2 выбран из Ser, Ala, Lys, Orn, bAla, 8Aoc, DBF, Peg3, Cys, Gln или он отсутствует;
L3 выбран из Ser, Ala, Lys, Orn, bAla, 8Aoc, DBF, Peg3, Cys, Gln или он отсутствует;
L4 выбран из Ser, Ala, Lys, Orn, bAla, 8Aoc, DBF, Peg3, Cys, Gln или он отсутствует;
Ya представляет собой пептидную последовательность, имеющую формулу VIIc
Y1-Y2-Y3-Y4-Y5-Y6-Y7-Y8-Y9-Y10-Y11-Y12-Y13-Y14-Y15-Asp-Y17 (VIIc),
в которой
Y1 представляет собой Gln или он отсутствует;
Y2 представляет собой Gly или он отсутствует;
Y3 представляет собой Pro или он отсутствует;
Y4 представляет собой Trp или он отсутствует;
Y5 представляет собой Leu или он отсутствует;
Y6 представляет собой Glu или он отсутствует;
Y7 представляет собой Glu или он отсутствует;
Y8 представляет собой Glu или он отсутствует;
Y9 представляет собой Glu или он отсутствует;
Y10 представляет собой Glu или он отсутствует;
Y11 представляет собой Ala или он отсутствует;
Y12 выбран из Ala, Tyr или он отсутствует;
Y13 выбран из Gly, Ala или он отсутствует;
Y14 выбран из Trp, Phe, 1Nal и Met;
Y15 выбран из Leu, Nle, Phe и Thr и
Y17 выбран из Phe и 3-(3-пиридил)аланина.
19. Пептидный конъюгат по любому из пп.16-18, отличающийся тем, что
Xa представляет собой пептидную последовательность, имеющую формулу VIIIa
His-Х8-Glu-Gly-Thr-Phe-Thr-Ser-Asp-Val-Ser-Ser-Tyr-Leu-Glu-Gly-Gln-Ala-Ala-X26-Glu-Phe-Ile-Ala-Trp-Leu-Val-X34-Gly-X36 (VIIIa),
в которой
X8 выбран из Ala, Aib и Gly;
X26 выбран из Arg и Lys;
X34 выбран из Arg и Lys;
Х36 выбран из Arg и Lys;
L представляет собой пептидную последовательность, имеющую формулу VIIIb
L1-L2-L3-L4 (VIIIb),
в которой
L1 выбран из Peg3, Orn, Cys, Lys и Gln или он отсутствует;
L2 выбран из Ser, Ala, Orn, Cys, Lys и Gln или он отсутствует;
L3 выбран из Lys, Ala, Cys, Orn и Gln или он отсутствует;
L4 выбран из Lys, Orn, Ala, Peg3, Cys и Gln или он отсутствует;
Ya представляет собой пептидную последовательность, имеющую формулу VIIIc
Y12-Y13-Y14-Y15-Asp-Phe (VIIIc),
в которой
Y12 выбран из Tyr, Ala или он отсутствует и
Y13 выбран из Gly, Ala или он отсутствует;
Y14 выбран из Trp и Phe;
Y15 выбран из Leu, Trp и Phe.
20. Пептидный конъюгат по любому из пп.16-19, отличающийся тем, что:
Xa представляет собой пептидную последовательность, имеющую формулу IXa
His-Х8-Glu-Gly-Thr-Phe-Thr-Ser-Asp-Val-Ser-Ser-Tyr-Leu-Glu-Gly-Gln-Ala-Ala-X26-Glu-Phe-Ile-Ala-Trp-Leu-Val-X34-Gly-X36 (IXa),
в которой
X8 выбран из Ala, Aib и Gly;
Х26 выбран из Arg и Lys;
Х34 выбран из Arg и Lys;
Х36 выбран из Arg и Lys;
L представляет собой пептидную последовательность, имеющую формулу IXb
L1-L2-L3-L4 (IXb),
в которой
L1 выбран из Orn, Peg3, Cys, Lys и Gln или он отсутствует;
L2 выбран из Orn, Peg3, Cys, Lys и Gln или он отсутствует;
L3 выбран из Orn, Peg3, Cys, Lys и Gln или он отсутствует;
L4 выбран из Orn, Peg3, Cys, Lys и Gln или он отсутствует;
Ya представляет собой пептидную последовательность, имеющую формулу IXc
Y12-Y13-Trp-Leu-Asp-Phe (IXc),
в которой
Y12 представляет собой Tyr или он отсутствует и
Y13 представляет собой Gly или он отсутствует.
21. Пептидный конъюгат по любому из пп.16-20, отличающийся тем, что Ха имеет по меньшей мере 85% идентичности с природным эксендином-4, например по меньшей мере 90, 95, 97, 98, 99 или 99,5%.
22. Пептидный конъюгат по любому из пп.16-21, отличающийся тем, что по меньшей мере один из Lys или Cys дополнительно конъюгирован с липофильным заместителем.
23. Пептидный конъюгат по любому из пп.16-21, отличающийся тем, что пептид формулы VI имеет последовательность:
GLP-1 (7-36)-[Gln1,Leu15]Гастрин-17,
GLP-1 (7-36)-K-[Gln1,Leu15]Гастрин-17,
GLP-1 (7-36)-AAA-[Gln1,Leu15]Гастрин-17,
GLP-1 (7-36)-SKK-[Gln1,Leu15]Гастрин-17,
GLP-1 (7-36)-Peg3-SKK-[Gln1,Leu15]Гастрин-17,
GLP-1 (7-36)-Peg3-Peg3-[Gln1,Leu15]Гастрин-17,
GLP-1 (7-36)-8Aoc-SKK-[Gln1,Leu15]Гастрин-17,
GLP-1 (7-36)-DBF-SKK-[Gln1,Leu15]Гастрин-17,
GLP-1 (7-36)-8Aoc-8Aoc-[Gln1,Leu 15]Гастрин-17,
GLP-1 (7-36)-[Leu4]Гастрин-6,
GLP-1 (7-36)-K-[Leu4]Гастрин-6,
GLP-1 (7-36)-ААА-[Leu4]Гастрин-6,
GLP-1 (7-36)-SKK-[Leu4]Гастрин-6,
GLP-1 (7-36)-Peg3-SKK-[Leu4]Гастрин-6,
GLP-1 (7-36)-Peg3-Peg3-[Leu4]Гастрин-6,
GLP-1 (7-36)-8Aoc-SKK-[Leu4]Гастрин-6,
GLP-1 (7-36)-DBF-SKK-[Leu4]Гастрин-6
GLP-1 (7-36)-8Аос-8Аос-[Leu4]Гастрин-6,
[Aib8,Arg34]GLP-1 (7-37)-Peg3-Peg3-[Leu4]Гастрин-6,
[Arg34]GLP-1 (7-37)-Peg3-Peg3-[Leu4]Гастрин-6,
или его фармацевтически приемлемая соль или сольват.
24. Пептидный конъюгат по любому из пп.16-22, отличающийся тем, что пептид формулы VI имеет последовательность:
[Lys(Гексадеканоил-изоGlu)34]GLP-1(7-37)-Peg3-Peg3-[Leu4]Гастрин-6,
[Arg34,Lys(Гексадеканоил-изоGlu)26]GLP-1(7-37)-Peg3-Peg3-[Leu4]Гастрин-6,
[Arg26,34,Lys(Гексадеканоил-изоGlu)36]GLP-1(7-37)-Peg3-Peg3-[Leu4]Гастрин-6,
[Lys(Гексадеканоил-изоGlu)26]GLP-1(7-37)-Peg3-Peg3-[Leu4]Гастрин-6,
[Arg26,34,Gly8,Lys(Гексадеканоил-изоGlu)36]GLP-1(7-37)-Peg3-Peg3-[Leu4]Гастрин-6,
[Aib8,Arg34,Lys(Гексадеканоил-изоGlu)26]GLP-1(7-37)-Peg3-Peg3-[Leu4]Гастрин-6,
или его фармацевтически приемлемая соль или сольват.
25. Применение пептидного конъюгата или его фармацевтически приемлемой соли или сольвата по любому из пп.1-24 в качестве лекарственного средства для индукции у нуждающегося в этом субъекта неогенеза панкреатических островков.
26. Применение пептидного конъюгата или его фармацевтически приемлемой соли или сольвата по любому из пп.1-24 в качестве лекарственного средства для предотвращения у нуждающегося в этом субъекта апоптоза β-клеток в панкреатических островках.
27. Применение пептидного конъюгата или его фармацевтически приемлемой соли или сольвата по любому из пп.25-26, отличающееся тем, что указанный субъект представляет собой человека.
28. Способ лечения нуждающегося в этом субъекта от заболевания или расстройства, выбранного из группы, состоящей из:
сахарного диабета 1 типа, сахарного диабета 2 типа, предиабета, синдрома инсулинорезистентности, нарушения толерантности к глюкозе (IGT), болезненных состояний, связанных с повышенным уровнем глюкозы в крови, гипергликемии, гипертензии, атерогенной дислипидемии, артериосклероза (например, атеросклероз), ишемической болезни сердца, заболевания периферических артерий, инсульта, микроангиопатии, желудочного заболевания, метаболического синдрома, рака (например, рака толстой кишки), воспалительной болезни кишечника (ВБК) и синдрома раздраженного кишечника (СРК),
указанный способ включает введение указанному субъекту терапевтически эффективного количества пептидного конъюгата или его фармацевтически приемлемой соли или сольвата по пп.1-24.
29. Способ по п.28, отличающийся тем, что указанный субъект представляет собой человека.
30. Фармацевтическая композиция, содержащая пептидный конъюгат или его фармацевтически приемлемую соль или сольват по пп.1-24 совместно с фармацевтически приемлемым носителем, наполнителем или основой.
31. Способ лечения состояния, вызванного или характеризующегося избыточной массой тела, например, для лечения и/или предотвращения ожирения, патологического ожирения, воспаления, вызванного ожирением, заболевания желчного пузыря, вызванного ожирением, апноэ сна, вызванного ожирением, метаболического синдрома, предиабета, указанный способ включает введение нуждающемуся в этом субъекту терапевтически эффективного количества пептидного конъюгата или его фармацевтически приемлемой соли или сольвата по любому из пп.1-24.
32. Применение соединения по любому из пп.1-24 для предотвращения набора веса или обеспечения потери веса у субъекта, который в этом нуждается.
33. Применение соединения по любому из пп.1-24 в способе улучшения уровней глюкозы в периферической крови, переносимости глюкозы и/или уровня холестерина в периферической крови, снижения уровней ЛПНП в периферической крови и/или повышения соотношения ЛПВП/ЛПНП у нуждающегося в этом субъекта.
34. Применение по любому из пп.25-27, 32, 33, отличающееся тем, что соединение вводят как часть комбинированной терапии совместно с агентом для лечения диабета, ожирения, дислипидемии или гипетензии.
35. Применение по п.34, отличающееся тем, что агент для лечения диабета представляет собой метформин, сульфонилмочевину, глинид, ингибитор DPP-IV, глитазон, инсулин или аналог инсулина.
36. Применение по п.34, отличающееся тем, что агент для лечения ожирения представляет собой агонист рецептора глюкагонподобного пептида 1, пептид YY или его аналог, антагонист рецептора каннабиноидов 1, ингибитор липазы, агонист рецептора меланокортина 4 или антагонист рецептора меланинконцентрирующего гормона 1.
37. Применение по п.34, отличающееся тем, что агент для лечения гипертензии представляет собой ингибитор ангиотензинпревращающего фермента, блокатор рецептора ангиотензина II, диуретик, бета-блокатор или блокатор кальциевых каналов.
38. Применение по п.34, отличающееся тем, что агент для лечения дислипидемии представляет собой статин, фибрат, ниацин и/или ингибитор всасывания холестерина.
39. Способ по любому из пп.28, 29, 31, отличающийся тем, что соединение вводят как часть комбинированной терапии совместно с агентом для лечения диабета, ожирения, дислипидемии или гипертензии.
40. Способ по п.39, отличающийся тем, что агент для лечения диабета представляет собой метформин, сульфонилмочевину, глинид, ингибитор DPP-IV, глитазон, инсулин или аналог инсулина.
41. Способ по п.39, отличающийся тем, что агент для лечения ожирения представляет собой агонист рецептора глюкагонподобного пептида 1, пептид YY или его аналог, антагонист рецептора каннабиноидов 1, ингибитор липазы, агонист рецептора меланокортина 4 или антагонист рецептора меланинконцентрирующего гормона 1.
42. Способ по п.39, отличающийся тем, что агент для лечения гипертензии представляет собой ингибитор ангиотензинпревращающего фермента, блокатор рецептора ангиотензина II, диуретик, бета-блокатор или блокатор ионов кальция.
43. Способ по п.39, отличающийся тем, что агент для лечения дислипидемии представляет собой статин, фибрат, ниацин и/или ингибитор всасывания холестерина.
44. Способ получения соединения по любому из пп.1-24, отличающийся тем, что указанный способ включает:
синтез указанного соединения методикой твердофазного или жидкофазного пептидного синтеза и
выделение конечного продукта пептидного конъюгата с получением соединения по любому из пп.1-24.
45. Применение соединения по любому из пп.1-24 в способе улучшения уровней глюкозы в периферической крови, переносимости глюкозы и/или уровня холестерина в периферической крови, снижения уровней ЛПНП в периферической крови и/или повышения соотношения ЛПВП/ЛПНП у нуждающегося в этом субъекта, при этом используется режим дозирования "лекарственные каникулы".
46. Устройство, содержащее по меньшей мере один пептидный конъюгат или его фармацевтически приемлемую соль или сольват по пп.1-24, для введения пептидного конъюгата субъекту.
47. Набор, содержащий по меньшей мере один пептидный конъюгат или его фармацевтически приемлемую соль или сольват по пп.1-24 и также содержащий упаковку и инструкцию по применению.
Текст
ПЕПТИДНЫЕ КОНЪЮГАТЫ АГОНИСТОВ РЕЦЕПТОРА GLP-1 И ИХ ПРИМЕНЕНИЕ Настоящее изобретение относится, в частности, к определенным пептидным конъюгатам и применению указанных конъюгатов при лечении разнообразных заболеваний или нарушений,включая диабет (1 и/или 2 типа) и заболевания или расстройства, вызванные диабетом. Неэруп Трине Сковлунд Рюге (DK),Эстерлунд Торбен (SE), Толборг Якоб Линд, Фосгерау Кельд (DK),Мартенссон Ульрика (SE), Брорсон Марианна, Ролстед Камилла (DK) Нилова М.И. (RU) Область техники Настоящее изобретение относится, в частности, к некоторым пептидным конъюгатам и применению указанных конъюгатов при лечении разнообразных заболеваний или нарушений, включая диабет (1 и/или 2 типа) и заболевания или расстройства, вызванные диабетом. Настоящая заявка испрашивает приоритет согласно заявкам на патент США 61/395119 и 61/470170, которые включены в настоящее описание в полном объеме посредством ссылки. Уровень развития техники Диабет, в частности диабет 1 и 2 типа, вместе с ожирением, которое считается основным фактором,обуславливающим развитие, в частности, диабета 2 типа, представляет собой растущую и одну из самых серьезных в мире проблему здравоохранения. Заболевания или расстройства, которые могут возникнуть вследствие не вылеченного диабета, включают сердечно-сосудистые заболевания и заболевания периферических артерий, болезни микро- и макрососудов, инсульт и, возможно, некоторые формы рака. Для диабета характерна нарушенная физиологическая регуляция уровня глюкозы в крови, а среди основных условий, которые могут привести к диабету, считаются снижение или потеря массы и функции -клеток поджелудочной железы с сопутствующим сокращением или потерей выработки эндогенного инсулина и/или резистентностью к инсулину (сниженной чувствительностью к инсулину), т.е. снижение или потеря способности эндогенного инсулина осуществлять адекватную регуляцию уровня глюкозы в крови. В ответ на присутствие и всасывание питательных веществ в кишечнике слизистой оболочкой ЖКТ вырабатываются некоторые гормоны, которые снижают уровень глюкозы в крови. К ним относятся глюкагонподобный пептид-1 (GLP-1), глюкозозависимый инсулинотропный пептид (GIP) и секретин.(1998)]. Полная последовательность проглюкагона содержит 29 аминокислотную последовательность глюкагона, 36 или 37 аминокислотную последовательность GLP-1, а также 34 аминокислотную последовательность глюкагонподобного пептида-2 (GLP-2; кишечнотропный пептид). GLP-1 человека (7-37) имеет аминокислотную последовательность HAEGTFTSDVSSYLEGQA-AKEFIAWLVKGRG (SEQ IDNO: 114). Отмечено, что GLP-1 выполняет ряд функций. Это гормон, который усиливает глюкозостимулированную секрецию инсулина у здоровых людей (и, следовательно, принадлежит к группе гормонов, известных как инкретиновые гормоны). Кроме того, GLP-1 снижает концентрацию глюкагона, задерживает опорожнение желудка, стимулирует биосинтез (про)инсулина и повышает чувствительность к инсулину[см., например, Nauck, Horm. Metab. Res. 47: 1253-1258 (1997)]. Также GLP-1 усиливает способность клеток поджелудочной железы воспринимать и реагировать (посредством секреции инсулина) на глюкозу у пациентов с нарушенной переносимостью глюкозы [см., например, Byrne, Eur. J. Clin. Invest. 28: 7278 (1998)]. Инсулинотропный эффект GLP-1 у человека увеличивает скорость исчезновения глюкозы и уменьшает эндогенную продукцию глюкозы, отчасти из-за повышения уровня инсулина, а отчасти из-за повышения чувствительности к инсулину [см., например, D'Alessio, Eur. J. Clin. Invest. 28: 72-78 (1994)]. Тем не менее, короткий период полувыведения нативного GLP-1 in vivo составлял основную фармакологическую проблему при попытках использовать гормон в качестве лекарственного средства. У человека и крысы GLP-1 быстро разлагается дипептидилпептидазой-IV (DPP-IV) до GLP-1 (9-36) амида, который выступает эндогенным антагонистом рецептора GLP-1. Были предложены несколько стратегий для преодоления этой проблемы, в одних из которых используются ингибиторы DPP-FV, в то время как в других используются DPP-IV-устойчивые аналоги GLP-1 (7-36) амида. Так называемые эксендины, которые составляют другую группу пептидов, которые снижают уровень глюкозы в крови, обладают некоторым сходством последовательностей (53%) с GLP-1 (7-36) [см.,например, Гок и соавт., J. Biol. Chem. 268: 19650-1 9655 (1993)]. Эксендины были найдены в слюне видовHelodermatidae (ядозубы). Экзендин-3 присутствует в слюне Heloderma horridum (мексиканский ядозуб),в то время как эксендин-4 присутствует в слюне Heloderma suspectum (Gita Monster).Аминокислотная последовательность экзендина-4, которая отличается от экзендина-3 в положениях два и три, представляет собой HGEGTFTSDLSKQMEEEAVRLFEWLKNGGPSSGAPPPS-NH2 (SEQ ID NO: 115). Сообщали, что эксендин-4 является мощным агонистом рецептора GLP-1 на модели выделенных клеток инсулиномы крысы [Goke et al., loc. cit.]. В публикации WO 99/07404 описано, что при системном введении эксендина-4 уровень глюкозы в крови снижается на 40% у мышей db/db с диабетом, также сообщали о продолжительном глюкозопонижающем действии при однократной ежедневной инъекции эксендина-4 у мышей с диабетом ob/ob [Grieg et al., Diabetologia 42: 45-50 (1999)]. В публикациях US 5424286 и WO 98/05351 описано, что агонисты эксендина-3, эксендина-4 и эксендина можно использовать при лечении диабета для снижения двигательной активности желудка и отсрочки опустошения желудка и профилактики гипергликемии, и в публикации WO 98/30231 также описано, что их можно применять для снижения потребления пищи. Пептидный гормон гастрин секретируется клетками слизистой желудка и G-клетками двенадцатиперстной кишки, и среди главных физиологических функций данного гормона у человека является сти-1 023925 муляция секреции желудочного сока (т.е. HCl) и способствование перистальтики желудка. Другие обнаруженные действия гастрина включают стимуляцию роста клеток, и также есть показания, что гастрин может играть роль при неогенезе островков, т.е. стимуляции роста инсулинсекретирующих -клеток островков поджелудочной железы [см., например, Korc, M., J. Clin. Invest., 92: 1113-1114 (1993); Rooman etal. Diabetes 51: 686-690 (2002)], и благодаря этому способствовать регуляции уровня глюкозы в крови. Гастрин имеет один рецептор с другим пептидным желудочно-кишечным гормоном, холецистокинином (CCK). Рецепторы CCK-А R и CCK-В R имеют разные аффинности к вариантам гастрина иCCK. CCK-А R (или CCK R1) выступает преимущественно рецептором для сульфатированного CCK,тогда как CCK-В R (или CCK R2) связывает в одинаковой степени хорошо CCK и гастрин. Считается,что CCK-В R представляет собой "рецептор гастрина" из-за более высокого уровня гастрина по сравнению с CCK в плазме [Foucaud et al. Reg. Peptides 145: 17-23 (2008)].CCK-B R может запускать несколько внутриклеточных путей после связывания лиганда, что считается причиной различных физиологических функций CCK. Ключевыми путем, регулируемым CCK-В R,является путь MAPK (митогенактивированные протеинкиназы) или ERK (внеклеточные регулируемые киназы), который также активируется несколькими гормонами роста. Это является ключевой особенностью функции пролиферации клеток гастрина. Поскольку CCK-В R экспрессируется в поджелудочной железе, гастрин может участвовать в пролиферации клеток и регенерации островков в данной ткани. У людей гастрин встречается в основном в трех формах, а именно Гастрин -34, Гастрин-17 и Гастрин-14 (в зависимости от общего количества аминокислот в рассматриваемой последовательности). Также обнаружили Гастрин-6. Более короткие формы получаются при расщеплении С-концевого амидированного Гастрина-34, таким образом, Гастрин-17 состоит из С-концевых последних 17 остатков Гастрина-34 (соответствующих остаткам прогастрина (55-71), Гастрин-14 из С-концевых последних 14 остатков (соответствующих остаткам прогастрина (58-71) и Гастрин-6 состоит только из С-концевых последних 6 остатков (соответствующих остаткам прогастрина (66-71). Они представляют собой амидированные формы гастрина, которые связываются с высоким сродством с CCK-В R и выполняют функцию пролиферации клеток. В Гастрине-17 человека N-концевой аминокислотный остаток представляет собой остаток пироглутаминовой кислоты (PyroGlu). Амидированные С-концевые 6 аминокислот являются ключевыми рецепторсвязывающими остатками гастрина. В публикации WO 2005/072045 описаны, в частности, комбинации "агонистов GLP-1" и "соединений гастрина", предположительно оказывающие благоприятное действие на профилактику и/или лечение состояний и/или заболеваний, при которых было показано терапевтическое действие "агониста GLP-1" или "соединения гастрина". В публикации WO 2007/095737 описаны, между прочим, аналогичные комбинации "агонистов эксендина" и "соединений гастрина", которые также предположительно оказывают благоприятное действие на профилактику и/или лечение состояний и/или заболеваний, при которых было показано терапевтическое действие "агонистов эксендина" или "соединения гастрина". Данные [получаемые из исследований с применением мышей с диабетом без ожирения (NOD), широко используемых в качестве животной модели диабета человека 1 типа], представленные в публикацииWO 2005/072045, по-видимому, указывают на то, что некоторые комбинации "агониста GLP-1" и "соединения гастрина" согласно описанию могут оказывать благоприятное действие по нормализации уровней глюкозы в крови на модели мышей с острым диабетом NOD по сравнению с действием, наблюдаемым при применении рассматриваемого "агониста GLP-1" (или "соединения гастрина") по отдельности. Данные [также полученные в результате исследований с применением диабетических мышей без ожирения(NOD)], представленные в публикации WO 2007/095737, по-видимому, указывают на то, что некоторые комбинации "агонист эксендина"/"соединение гастрина" согласно описанию оказывают благоприятное действие по нормализации уровней глюкозы и инсулина в крови на модели мышей с острым диабетомNOD по сравнению с действием, наблюдаемым при применении рассматриваемого "агониста эксендина"(или "соединения гастрина") по отдельности, и что некоторые комбинации "агонист рецептора GLP1"/"гастрина" согласно описанию могут оказывать благоприятное действие в отношении индукции регенерации клеток островков по сравнению с действием, наблюдаемым при использовании "агониста рецептора GLP-1" по отдельности. В публикациях WO 2005/072045 и WO 2007/095737 также описана возможность образования конъюгатов, содержащих "агонист GLP-1" или "агонист эксендина", соответственно, и "соединение гастрина", ковалентно спаренные или связанные (т.е. конъюгированных) друг с другом, возможно с помощью промежуточного линкера или спейсера. Подходящим спейсером является моно- или дисахарид, аминокислота, сульфат, сукцинат, ацетат или олигомерный полимерный спейсер или линкер, содержащий одну или несколько таких групп. Также описаны предполагаемые способы, с помощью которых можно получить рассматриваемые типы конъюгатов. Тем не менее, ни в одном из последних рассматриваемых документов не приведены препаративные или другие данные для обоснования того, что любой рассматриваемый тип конъюгата был на самом деле приготовлен и охарактеризован или были проверены его биологические/физиологические свойства или активность - во время подачи соответствующей международной заявки. Также можно отметить, что ни в публикации WO 2005/072045, ни в публикации WO 2007/095737 не приведены данные in vivo, in vitro или другие данные, подтверждающие, что комбинации"агонист GLP-1"/"соединение гастрина" или "агонист эксендина"/"соединение гастрина", соответственно,согласно описанию и использованные в данном описании, могут быть полезны при лечении, например,диабета 2 типа. Краткое описание изобретения Согласно настоящему изобретению было обнаружено, что некоторые конъюгаты, содержащие две ковалентно спаренные или связанные пептидных группы, могут проявлять неожиданно высокую терапевтическую активность при лечении, например, диабета (диабета 1 и/или 2 типа) или различных заболеваний или состояний, вызываемых диабетом, по сравнению с терапевтической активностью комбинации двух отдельных рассматриваемых пептидов. В более широком аспекте настоящее изобретение обеспечивает пептидный конъюгат агониста рецептора GLP-1 и гастрина, в частности гастрина с заменой в положении 15, выбранной из Leu, Me, Phe иThr. Более конкретно, настоящее изобретение обеспечивает пептидные конъюгаты Эксендина-4 и гастрина, а также пептидные конъюгаты GLP-1 и гастрина. Согласно первому аспекту настоящее изобретение, таким образом, обеспечивает пептидный конъюгат, имеющий формулу IR2 представляет собой ОН или NH2;Z содержит последовательность эксендина-4 (1-39), имеющую последовательность His-Gly-Glu-GlyThr-Phe-Thr-Ser-Asp-Leu-Ser-Lys-Gln-Met-Glu-Glu-Glu-Ala-Val-Arg-Leu-Phe-He-Glu-Trp-Leu-Lys-AsnGly-Gly-Pro-Ser-Ser-Gly-Ala-Pro-Pro-Pro-Ser (SEQ ID NO: 115) или его аналог Za;L представляет собой необязательную линкерную группу; иY содержит последовательность Гастрина-17, имеющую последовательность Gln-Gly-Pro-Trp-LeuGlu-Glu-Glu-Glu-Glu-Ala-Tyr-Gly-Trp-Y15-Asp-Phe (SEQ ID NO: 116), в которой Y15 выбран из Leu, Nle,Phe и Thr или его аналог Ya. Также настоящее изобретение обеспечивает пептидный конъюгат, в котором:(i) Za имеет до 10 замен в положениях и/или содержит укорочение на С-конце на 1-12 аминокислот по сравнению с последовательностью эксендина; и/или(ii) Ya имеет до 5 замен по сравнению с последовательностью Гастрина-17 и/или содержит укорочение на N-конце на 1-13 аминокислот по сравнению с последовательностью Гастрина-17. Согласно одному варианту реализации настоящее изобретение обеспечивает пептидный конъюгат,в которомZa представляет собой пептидную последовательность, имеющую формулу IIaZ23 выбран из Не и Leu;L представляет собой пептидную последовательность, имеющую формулу IIbYa представляет собой пептидную последовательность, имеющую формулу IIcY17 выбран из Phe и 3-(3-пиридил)аланина. Согласно другому варианту реализации настоящее изобретение обеспечивает пептидный конъюгат,в которомZa представляет собой пептидную последовательность, имеющую формулу IIIaL представляет собой пептидную последовательность, имеющую формулу IIIbYa представляет собой пептидную последовательность, имеющую формулу IIIcY17 выбран из Phe и 3-(3-пиридил)аланина. Согласно другому варианту реализации настоящее изобретение обеспечивает пептидный конъюгат,в которомZa представляет собой пептидную последовательность, имеющую формулу IVaL представляет собой пептидную последовательность, имеющую формулу IVbYa представляет собой пептидную последовательность, имеющую формулу IVcY13 представляет собой Gly или он отсутствует. Согласно еще одному варианту реализации настоящее изобретение обеспечивает пептидный конъюгат, в которомZa представляет собой пептидную последовательность, имеющую формулу VaL представляет собой пептидную последовательность, имеющую формулу VbYa представляет собой пептидную последовательность, имеющую формулу VcY13 представляет собой Gly или он отсутствует. Более того, настоящее изобретение обеспечивает пептидный конъюгат, в котором пептидная последовательность формулы I содержит один или более внутримолекулярных мостиков. Также настоящее изобретение обеспечивает пептидный конъюгат, согласно которому указанный внутримолекулярный мостик образуется между боковыми цепями двух аминокислотных остатков, которые разделены тремя аминокислотами, в линейной аминокислотной последовательности согласно формуле I. Согласно определенному варианту реализации настоящее изобретение обеспечивает пептидный конъюгат, в котором внутримолекулярный мостик образуется между боковыми цепями пар остатков х и х+3, х+4, х+5 и т.д. Согласно другому определенному варианту реализации настоящее изобретение обеспечивает пептидный конъюгат, в котором указанный внутримолекулярный мостик представляет собой лактамное кольцо. Согласно другому определенному варианту реализации настоящее изобретение обеспечивает пеп-5 023925 тидный конъюгат, в котором указанный внутримолекулярный мостик включает пару остатков, при этомZ20 представляет собой Lys и Z24 представляет собой Glu. Согласно другому аспекту настоящего изобретения обеспечивается пептидный конъюгат, имеющий формулу VIR2 представляет собой ОН или NH2;(SEQ ID NO: 114) или его аналог Ха;L представляет собой линкер, содержащий до 4 природных или не природных аминокислот или их комбинацию, или он отсутствует;Y содержит последовательность Гастрина-17, имеющую последовательность Gln-Gly-Pro-Trp-LeuGlu-Glu-Glu-Glu-Glu-Ala-Tyr-Gly-Trp-Y15-Asp-Phe. При этом Y15 выбран из Leu, Nle, Phe и Thr или его аналог Ya. Согласно одному варианту реализации настоящее изобретение обеспечивает пептидный конъюгат,в котором(i) Xa имеет до 5 замен в положениях и/или имеет укорочение на С-конце на 1-2 аминокислоты по сравнению с последовательностью GLP-1; и/или(ii) Ya имеет до 5 замен в положениях по сравнению с последовательностью Гастрина-17, и/или содержит укорочение на N-конце на 1-13 аминокислот по сравнению с последовательностью Гастрина-17. Согласно другому варианту реализации настоящее изобретение обеспечивает пептидный конъюгат,в котором Xa представляет собой пептидную последовательность, имеющую формулу VIIaL представляет собой пептидную последовательность, имеющую формулу VIIbYa представляет собой пептидную последовательность, имеющую формулу VIIcY17 выбран из Phe и 3-(3-пиридил)аланина. Согласно еще одному варианту реализации настоящее изобретение обеспечивает пептидный конъюгат, в которомXa представляет собой пептидную последовательность, имеющую формулу VIIIaL представляет собой пептидную последовательность, имеющую формулу VIIIbYa представляет собой пептидную последовательность, имеющую формулу VIIIcY15 выбран из Leu, Thr и Phe. Согласно определенному варианту реализации настоящее изобретение обеспечивает пептидный конъюгат, в которомXa представляет собой пептидную последовательность, имеющую формулу IXaL представляет собой пептидную последовательность, имеющую формулу IXbYa представляет собой пептидную последовательность, имеющую формулу IXcY13 представляет собой Gly или он отсутствует. Согласно другому определенному варианту реализации настоящее изобретение обеспечивает пептидный конъюгат, в котором по меньшей мере один из Lys или Cys также конъюгирован с липофильным заместителем. Согласно другому аспекту настоящее изобретение относится к пептидному конъюгату, имеющему формулу Эксендин-4(1-39)-Peg3-Peg3-[Gln1,Leu15]Гастрин-17, (1) Эксендин-4(1-39)-[Gln1,Leu15]Гастрин-17, (2) Эксендин-4(1-39)-K-[Gln1,Leu15]Гастрин-17, (3) Эксендин-4(1-39)-AAA-[Gln1,Leu15]Гастрин-17, (4) Эксендин-4(1-39)-SKK-[Gln1,Leu15]Гастрин-17, (5) Эксендин-4(1-39)-Peg3-SKK-[Gln1,Leu15]Гастрин-17, (6) Эксендин-4(1-39)-8Aoc-SKK-[Gln1,Leu15]Гастрин-17, (7) Эксендин-4(1-39)-DBF-SKK-[Gln1,Leu15]Гастрин-17, (8) Эксендин-4(1-39)-8Aoc-8Aoc-[Gln1,Leu15]Гастрин-17, (9) Эксендин-4(1-39)-[Leu4]Гастрин-6, (10) Эксендин-4(1-39)-K-[Leu4]Гастрин-6, (11)GLP-1 (7-36)-8Aoc-8Aoc-[Leu4]Гастрин-6, (54). При этом каждая пептидная группа из Эксендин-4(1-39), Эксендин-4(1-28) и GLP-1 (7-36) ковалентно присоединена (т.е. связана или спарена) к оставшейся части соответствующей молекуле конъюгата через ее С-терминальную часть, и каждая пептидная группа из [Gln1,Leu15]Гастрин-17 и[Leu4]Гастрин-6 ковалентно присоединена (т.е. связана или спарена) к оставшейся части соответствующей молекуле конъюгата через ее N-терминальную часть; или его фармацевтически приемлемая соль или сольват. Согласно определенному аспекту пептидные конъюгаты согласно настоящему изобретению можно получить с помощью стандартных синтетических методов с применением рекомбинантных систем экспрессии или любого другого подходящего метода. Таким образом, конъюгаты можно синтезировать различными путями, включая, например, методы, которые включают:(а) синтез пептидного конъюгата с помощью стандартной твердофазной или жидкофазной методологии, поэтапно или с помощью сборки фрагментов, и выделение и очистку конечного продукта пептидного конъюгата;(б) экспрессию конструкции нуклеиновой кислоты, которая кодирует пептидный конъюгат, в хозяйской клетке и выделение продукта экспрессии или культуры хозяйских клеток; или(в) осуществление экспрессии in vitro в бесклеточной системе конструкции нуклеиновой кислоты,которая кодирует пептидный конъюгат, и выделение продукта экспрессии; Или посредством любой комбинации указанных методов (а), (б) или (в) для получения фрагментов пептидного конъюгата, последующего легирования фрагментов для получения пептидного конъюгата и выделения пептидного конъюгата. Среди других аспектов настоящего изобретения находятся способы лечения различных состояний,заболеваний или нарушений (включая диабет (тип 1 и 2) и различных со стояний, заболеваний и расстройств, связанных с диабетом), включающие введение пептидного конъюгата согласно настоящему изобретению (в свободной форме или в виде его фармацевтически приемлемой соли или сольвата), а также фармацевтических композиций, содержащих пептидный конъюгат или его фармацевтически приемлемую соль или сольват согласно настоящему изобретению. Согласно конкретному аспекту пептидные конъюгаты согласно настоящему изобретению также можно использовать в качестве фармацевтических агентов для лечения резистентности к инсулину, непереносимости глюкозы, предиабетов, повышенных уровней глюкозы натощак, диабетов 1 и 2 типов,гипертензии и/или дислипидемии (или комбинации указанных метаболических факторов риска), атеросклероза, артериосклероза, болезни коронарных артерий сердца, болезни периферических артерий и инсульта. Их также можно применять для профилактики увеличения веса, способствования потери веса,снижения избыточной массы тела и/или лечения ожирения (например, благодаря контролю аппетита,питания, потребления пищи, потребления калорий и/или расхода энергии), включая патологическое ожирение, а также связанные с этим заболевания, расстройства и состояния здоровья, включая, но не ограничиваясь ими, воспаление, связанное с ожирением, связанная с ожирением болезнь желчного пузыря и вызванное ожирением апноэ сна. Действие пептидных конъюгатов согласно настоящему изобретению на указанные состояния может быть опосредовано в целом или частично влиянием на массу тела или может не за висеть от этого. Краткое описание фигур Фиг. 1. Средняя концентрация в плазме в зависимости от времени (прямо пропорциональная) после внутривенного и подкожного введения мышам 100 нмоль/кг. А: Соединения 33, В: Соединения 1. Данные представлены в виде среднееSD, n=3/точка измерения. Фиг. 2. Средняя концентрация в плазме в зависимости от времени (прямо пропорциональная) после подкожного введения мышам 100 нмоль/кг соединения 33, 74, 76, 77, 78 и 80. n= 2/точка измерения. На фиг. 3 представлены данные общего содержания панкреатического инсулина (в мкг) у мышейdb/db с диабетом после введения (i) трех концентраций (1, 10 и 50 нмоль/кг) Соединения 1 согласно настоящему изобретению [Эксендин-4(1-39)-Peg3-Peg3-[Gln1,Leu15]Гастрин-17; см. ниже], (ii) трех соответствующих концентраций 1:1 аддитивной комбинации пептидов Эксендин-4(1-39) и h[Leu15]Гастрин 17 (1, 10 и 50 нмоль/кг каждого пептида) и (iii) носителя. Фиг. 4. -глюкозы в крови у мышей. Данные обрабатывали с применением критерия КрускалаУоллиса с последующим множественным сравнением с применением критерия Данна, р 0.001. Сравнение Соединения 33, Эксендин-4, комбинации Эксендин-4(1-39) и h[Leu15]Гастрин-17 и носителя соответственно; n = 16-19 в группе. Фиг. 5. -инсулина в плазме у мышей. Данные обрабатывали с применением критерия КрускалаУоллиса с последующим множественным сравнением с применением критерия Данна, р 0.001. Сравнение Соединения 33, Эксендин-4, комбинации Эксендин-4(1-39) и h[Leu15]Гастрин-17 и носителя соответственно; n = 16-19 в группе. Фиг. 6. Содержание панкреатического инсулина у мышей. Данные обрабатывали с применением критерия Крускала-Уоллиса с последующим множественным сравнением с применением критерия Данна, р 0.01. Сравнение Соединения 33, Эксендин-4, комбинации Эксендин-4(1-39) и h[Leu15]Гастрин 17 и носителя соответственно; n = 16-19 в группе. Фиг. 7. -HbA1c у мышей. Данные обрабатывали с применением критерия Крускала-Уоллиса с последующим множественным сравнением с применением критерия Данна, р 0.01, р 0.001. Сравнение Соединения 33, Эксендина-4, комбинации Эксендин-4(1-39) и h[Leu15]Гастрин-17 и носителя соответственно; n = 16-19 в группе. Фиг. 8. -С-пептида в плазме у мышей. Данные обрабатывали с применением критерия КрускалаУоллиса с последующим множественным сравнением с применением критерия Данна, р 0.05. Сравнение Соединения 33, Эксендин-4, комбинации Эксендин-4(1-39) и h[Leu15]Гастрин-17 и носителя соответственно; n = 16-19 в группе. Фиг. 9. Влияние подкожного введения Эксендин-4, Лираглутида или Соединения 33 на переносимость глюкозы по результатам измерения площади под кривой (AUC) после на грузки глюкозой мышейdb/db. Применяли три режима введения (А) Профилактика, (Б) Лечение или (С) Каникулы. Данные представлены в виде среднего и SEM (n= 8-13/группа). Статистика: Данные сравнивали с применением двухфакторного анализа АНОВА с после дующей поправкой Бонферрони: р 0.05; р 0.01; р 0.001 против носителя. Фиг. 10. Влияние подкожного введения Эксендин-4, Лираглутида или Соединения 33 на уровень глюкозы в крови натощак через 8 ч после последнего приема пищи у мышей db/db. Применяли три режима введения (А) Профилактика, (Б) Лечение или (С) Каникулы. Данные представлены в виде среднего и SEM (n=8-13/группа). Статистика: данные сравнивали с применением двухфакторного анализа АНОВА с последующей поправ кой Бонферрони: р 0.05; "р 0.01; р 0.001 против носителя. Фиг. 11. Влияние подкожного введения Эксендин-4, Лираглутида или Соединения 33 на конечные значения (93 день) уровня (А) С-пептида в плазме, (Б) инсулина в плазме или (С) HbA1 с (%).Данные представлены в виде среднего и SEM (n=8-13/группа). Статистика: Данные сравнивали с использованием однофакторного анализа АНОВА, теста Крускала-Уоллиса с последующим анализом Данна: р 0.001,р 0.01, р 0.05 простив носителя. Подробное описание изобретения Как уже показано выше, один аспект настоящего изобретения относится к пептидному конъюгату,имеющему формулу Эксендин-4(1-39)-Peg3-Peg3-[Gln1,Leu15]Гастрин-17, (1) Эксендин-4(1-39)-[Gln1,Leu15]Гастрин-17, (2) Эксендин-4(1-39)-K-[Gln1,Leu15]Гастрин-17, (3) Эксендин-4(1-39)-ААА-[Gln1,Leu15]Гастрин-17, (4) Эксендин-4(1-39)-SKK-[Gln1,Leu15]Гастрин-17, (5) Эксендин-4(1-39)-Peg3-SKK-[Gln1,Leu15]Гастрин-17, (6) Эксендин-4(1-39)-8Aoc-SKK-[Gln1,Leu15]Гастрин-17, (7) Эксендин-4(1-39)-DBF-SKK-[Gln1,Leu15]Гастрин-17, (8) Эксендин-4(1-39)-8 Аос-8 Аос-[Gln1,Leu15]Гастрин-17, (9) Эксендин-4(1-39)-[Leu4]Гастрин-6, (10) Эксендин-4(1-39)-К-[Leu4]Гастрин-6, (11) Эксендин-4(1-39)-ААА-[Leu4]Гастрин-6, (12) Эксендин-4(1-39)-8KK-[Leu4]Гастрин-6, (13) Эксендин-4(1-39)-Peg3-SKK-[Leu4]Гастрин-6, (14) Эксендин-4(1-39)-Peg3-Peg3-[Leu4]Гастрин-6, (15) Эксендин-4(1-39)-8 Аос-8KK-[Leu4]Гастрин-6, (16) Эксендин-4(1-39)-DBF-SKK-[Leu4]Гастрин-6, (17) Эксендин-4(1-39)-8 Аос-8 Аос-[Leu4]Гастрин-6, (18) Эксендин-4(1-28)-[Gln1,Leu15]Гастрин-17, (19) Эксендин-4(1-28)-К-[Gln1,Leu15]Гастрин-17, (20) Эксендин-4(1-28)-ААА-[Gln1,Leu15]Гастрин-17, (21) Эксендин-4(1-28)-SKK-[Gln1,Leu15]Гастрин-17, (22) Эксендин-4(1-28)-Peg3-SKK-[Gln1,Leu15]Гастрин-17, (23) Эксендин-4(1-28)-Peg3-Peg3-[Gln1,Leu15]Гастрин-17, (24) Эксендин-4(1-28)-8Aoc-SKK-[Gln1,Leu15]Гастрин-17, (25) Эксендин-4(1-28)-DBF-SKK-[Gln1,Leu15]Гастрин-17, (26) Эксендин-4(1-28)-8 Аос-8 Аос-[Gln1,Leu15]Гастрин-17, (27) Эксендин-4(1-28)-[Leu4]Гастрин-6, (28) Эксендин-4(1-28)-К-[Leu4]Гастрин-6, (29) Эксендин-4(1-28)-ААА-[Leu4]Гастрин-6, (30) Эксендин-4(1-28)-8KK-[Leu4]Гастрин-6, (31) Эксендин-4(1-28)-Peg3-SKK-[Leu4]Гастрин-6, (32) Эксендин-4(1-28)-Peg3-Peg3-[Leu4]Гастрин-6, (33) Эксендин-4(1-28)-8 Аос-8 КК-[Leu4]Гастрин-6, (34) Эксендин-4(1-28)-DBF-SKK-[Leu4]Гастрин-6, (35) Эксендин-4(1-28)-8 Аос-8 Аос-[Leu4]Гастрин-6, (36)GLP-1 (7-36)-8Aoc-8Aoc-[Leu4]Гастрин-6, (54). При этом каждая из пептидных групп Эксендин-4(1-39), Эксендин-4(1-28) и GLP-1 (7-36) ковалентно соединена с оставшейся частью соответствующей молекулой конъюгата через ее С-конец, и каждая из пептидных групп [Gln1,Leu15]Гастрин-17 и [Leu4]Гастрин-6 ковалентно соединена с оставшейся частью соответствующей молекулы конъюгата через ее N-конец; или его фармацевтически приемлемая соль или сольват. Согласно другому аспекту настоящее изобретение относится к пептидному конъюгату, имеющему формулу Эксендин-4(1-28)-Peg3-Peg3-[Leu3]Гастрин-5 (55) Эксендин-4(1-28)-Peg3-Peg3-[Ala1,Leu4]Гастрин-6 (56) Эксендин-4(1-28)-Peg3-Peg3-[Ala2,Leu4]Гастрин-6 (57) Эксендин-4(1-27)-Peg3-Peg3-[Leu4]Гастрин-6 (58) Эксендин-4(1-28)-Peg3-Peg3-[Leu2]Гастрин-4 (59)[Arg34]GLP-1(7-37)-Peg3-Peg3-[Leu4]Гастрин-6 (113) или его фармацевтически приемлемая соль или сольват. Приведенные выше формулы для пептидных конъюгатов согласно настоящему изобретению, которые записаны с использованием традиционных и широко используемых сокращений/обозначений для различных рассматриваемых пептидных групп [т.е. Эксендин-4(1-39), Эксендин-4(1-28) и GLP-1(7-36)] могут быть записаны в виде традиционной полной аминокислотной последовательности, как представлено ниже (линкерные группы выделены жирным шрифтом)(SEQ ID NO: 113) H-HAEGTFTSDVSSYLEGQAAKEFIAWLVRGRG-Peg3-Peg3-YGWLDF-NH2,при этом сокращения Peg3, 8Aoc, DBF, 1 Nal, bAla, Orn, DPR, Dbu, Gaba и Aib обозначают следующие не встречающиеся в природе аминокислотные группы:Orn: орнитин Таким образом, принимая во внимание расположение линкерной группы в пептидном конъюгате согласно настоящему изобретению, линкерная группа -Peg3-Peg3-, например, обозначает следующую химическую группу:-NH-CH2-CH2-0-CH2-CH2-0-CH2-C(0)-NH-CH2-CH2-0-CH2-CH2-0-CH2-C(0)-,при этом группа -NH- слева от рассматриваемой линкерной группы, ковалентно присоединенная-С(О)- справа от рассматриваемой линкерной группы, присоединенная к группе, полученной от гастрина,рассматриваемого пептидного конъюгата. В оставшихся обозначенных линкерных группах -K- обозначает остаток аминокислоты лизина, -ААА- обозначает трипептидный остаток -Ala-Ala-Ala-, и -SKK- обозначает трипептидный остаток -Ser-Lys-Lys-. Следует понимать, что в некоторых пептидных конъюгатах согласно настоящему изобретению, перечисленных выше, группа пептидной последовательности GLP-1 (7-36) получается от последовательности GLP-1 человека (hGLP-1) или его аналога. Следует понимать, что в некоторых пептидных конъюгатах согласно настоящему изобретению, перечисленных выше, группа пептидной последовательности Эксендин-4(1-39) получена от последовательности Эксендин-4 Heloderma suspectum или представляет собой ее аналог. Аналогично группы [Gln1,Leu15]Гастрин-17 и [Leu4]Гастрин-6 в указанных конъюгатах получены от гастрина человека. Следует понимать, что SEQ ID NO: 1 равнозначна Соединению 1, SEQ ID NO: 2 равнозначна Соединению 2 и т.д. Следует понимать, что каждый из указанных выше пептидных конъюгатов 1-54 по от дельности,т.е. соединение 1, или соединение 2, или соединение 3 (и т.д. до соединения 54) и, кроме того, каждый из пептидных конъюгатов 55-113, перечисленных ниже (см. табл. 2 и 3 в примере 2), по отдельности, т.е. соединение 55 или соединение 56(и т.д. до соединения 113) или его фармацевтически приемлемая соль или сольват, составляют также отдельный аспект настоящего изобретения. В контексте настоящего изобретения, если аминокислоты не обозначены с помощью их полного наименования (например, аланин, аргинин и т.д.), они обозначены с помощью своих традиционных трехбуквенных и/или однобуквенных сокращений (например, Ala или А для аланина, Arg или R для аргинина и т.д.). Термин "пептидный конъюгат" в контексте настоящего изобретения обозначает молекулу, в которой первая пептидная группа присоединена (т.е. связана или соединена) непосредственно или с помощью линкерной химической группы (т.е. мостика или спейсера) посредством ковалентной химической связи со второй пептидной группой. Соединения согласно настоящему изобретению могут нести один или несколько внутримолекулярных лактамных колец в пептидной последовательности. Каждый такой мостик в соединениях, перечисленных в табл. 2 (обозначенный с помощью приставки "боковая цепь-цикло"),образуется между боковой цепью, содержащей карбоновую кислоту, и другой боковой цепью, содержащей амин. Два аминокислотных остатка обычно разделены тремя аминокислотами в линейной последовательности. В пептидных конъюгатах согласно настоящему изобретению эксендин-4 или Za может совпадать по меньшей мере на 75% с природным эксендин-4, например, по меньшей мере на 80, 85, 90 или 95%. В пептидных конъюгатах согласно настоящему изобретению гастрин или Ya может совпадать по меньшей мере на 70% с природным гастрином, например, по меньшей мере на 75, 80, 85, 90 или 95%. В пептидных конъюгатах согласно настоящему изобретению GLP-1 или Xa может совпадать по меньшей мере на 85% с природным GLP-1, например, по меньшей степени на 90 или 95%. Согласно одному варианту реализации полипептид согласно настоящему изобретению может содержать аминокислотную последовательность, представленную на одной из SEQ ID NO: 1, 2, 3, 4, 5, 6, 7,8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38,39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68,69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98,99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112 и 113 или ее функциональный фрагмент/вариант, который по меньшей мере приблизительно на 80, 85, 90, 95, 97, 98, 99, 99,5% совпадает с одной или несколькими указанными последовательностями или их функциональными фрагментами/вариантами, которая имеет не более чем 20, 15, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 замену аминокислот по сравнению с одной или несколькими указанными последовательностями, без сигнальной последовательности или с ней, без замены одного или нескольких остатков цистеина на другой остаток, такой как серин, или с ней, и их непрерывными сегментам, имеющими по меньшей мере 2 аминокислотных остатка в длину. Согласно одному варианту реализации полипептид согласно настоящему изобретению (i) совпадает по аминокислотной последовательности по меньшей мере на 99% с одной из SEQ ID NO: 1, 2, 3, 4, 5, 6, 7,8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38,39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68,69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98,99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112 и 113, или ее частью; или (ii) содержит по меньшей мере 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56,57, 58, 59 или 60 непрерывных аминокислот любой из SEQ ID NO: 1, 2, 3, 4, 5, 6, 7, 8, 9, 1 0, 11, 12, 13, 14,15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44,45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74,- 15023925 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103,104, 105, 106, 107, 108, 109, 110, 111, 112 и 113; или (iii) и то, и другое. Термин "фармацевтически приемлемая соль" в контексте настоящего изобретения (фармацевтически приемлемая соль пептидного конъюгата согласно настоящему изобретению) обозначает соль, которая является безопасной для пациента или человека, которому вводят указанную соль. Она может представлять собой соль, выбранную из кислотно-аддитивных солей и основных солей. Примеры кислотноаддитивных солей включают хлориды, цитраты и ацетаты. Примеры основных солей включают соли, в которых катион выбирают среди щелочных металлов, таких как ионы натрия или калия, катионов щелочно-земельных металлов, таких как кальций или магний, а также ионы аммония, такие как ионы типаN(R1)(R2)(R3)(R4)+, где R1, R2, R3 и R4 независимо обычно обозначают водород, возможно замещенный С 1-6 алкил или возможно замещенный С 2-6 алкенил. Примеры C1-6 алкильных групп включают метил,этил, 1-пропил и 2-пропил. Примеры важных С 2-6 алкенильных групп включают винил, 1-пропенил и 2 пропенил. Другие примеры фармацевтически приемлемых солей описываются в публикации 17 издания"Remington's Pharmaceutical Sciences", Alfonso R. Gennaro (Ed.), Mark Publishing Company, Easton, PA,USA, 1985 (и ее более ранних изданиях), в третьем издании "Encyclopaedia of Pharmaceutical Technology",James Swarbrick (Ed.), Informa Healthcare USA (Inc.), NY, USA, 2007, и J. Pharm. Sci. 66: 2 (1977). Термин "сольват" в контексте настоящего изобретения обозначает комплекс с определен ной стехиометрией, образованный между растворенным веществом (в данном случае, пептидным конъюгатом или фармацевтически приемлемой солью согласно настоящему изобретению) и растворителем. Растворитель в данной связи может представлять собой, например, воду, этанол или другие фармацевтически приемлемые, обычно с малым молекулярным весом органические вещества, такие как, но не ограничиваясь ими, уксусная кислота или молочная кислота. Если рассматриваемый растворитель представляет собой воду, то сольват обычно обозначают термином гидрат. Другой аспект настоящего изобретения относится к пептидному конъюгату или его фармацевтически приемлемой соли согласно настоящему изобретению, для применения в качестве лекарственного средства. Согласно другому аспекту рассматриваемое лекарственное средство представляет собой лекарственное средство для применения при излечении пациента, нуждающегося в этом, от одного из следующих заболеваний или нарушений или связанных состояний: сахарный диабет 1 типа, сахарный диабет 2 типа, предиабет, синдром инсулинорезистентности, нарушение толерантности к глюкозе (IGT), болезненные состояния, связанные с повышенным уровнем глюкозы в крови, гипергликемия, гипертензия,атерогенная дислипидемия, артериосклероз (например, атеросклероз), ишемическая болезнь сердца, заболевание периферических артерий, инсульт, микроангиопатия, желудочное заболевание, метаболический синдром, рак (например, рак толстой кишки), воспалительная болезнь кишечника (ВБК) и синдром раздраженного кишечника (СРК). Другие заболевания или нарушения, имеющие возможную актуальность в этой связи, включают ожирение, патологическое ожирение, воспаление, вызванное ожирением, вы званные ожирением заболевания желчного пузыря и апноэ сна, вызванное ожирением. Согласно еще одному аспекту указанное лекарственное средство представляет собой лекарственное средство для применения для индуцирования у пациента, нуждающегося в этом, неогенеза островков поджелудочной железы (например, для содействия формированию новых -клеток в островках поджелудочной железы). Согласно еще одному аспекту указанное лекарственное средство представляет собой лекарственное средство для применения для индуцирования у пациента, нуждающегося в этом, выживания -клеток в островках поджелудочной железы (например, для предотвращения потери -клеток в островках поджелудочной железы). Согласно еще одному аспекту указанное лекарственное средство представляет собой лекарственное средство для применения для предотвращения у пациента, нуждающегося в этом, апоптоза -клеток в островках поджелудочной железы (например, для предотвращения потери -клеток в островках поджелудочной железы). Согласно еще одному аспекту настоящего изобретения указанное лекарственное средство представляет собой лекарственное средство для применения для понижения у пациента, нуждающегося в этом, уровней гемоглобина b1 Ас (гликозилированного гемоглобина; HbA1 с) в крови. Согласно еще одному своему аспекту настоящее изобретения относится к пептидному конъюгату согласно настоящему изобретению для изготовления лекарственного средства для лечения пациента,нуждающегося в этом, от одного или нескольких следующих состояний, заболеваний или нарушений: сахарный диабет 1 типа, сахарный диабет 2 типа, предиабет, синдром инсулинорезистентности, нарушение толерантности к глюкозе (IGT), болезненные состояния, связанные с повышенным уровнем глюкозы в крови, гипергликемия, гипертензия, атерогенная дислипидемия, артериосклероз (например, атеросклероз), ишемическая болезнь сердца, заболевание периферических артерий, инсульт, микроангиопатия,желудочное заболевание, метаболический синдром, рак (например, рак толстой кишки), воспалительная болезнь кишечника (ВБК) и синдром раздраженного кишечника (СРК). Пептидный конъюгат согласно настоящему изобретению можно применять для изготовления лекарственного средства для индуцирования неогенеза островков поджелудочной железы у пациента, нуждающегося в этом; изготовления лекарственного средства для предотвращения апоптоза -клеток в островках поджелудочной железы у пациента, нуждающегося в этом; или изготовления лекарственного средства для снижения уровней гемоглобина HbAc (гликозилированного гемоглобина; HbA1c) в крови пациента, нуждающегося в этом. Среди других родственных аспектов дополнительные аспекты настоящего изобретения представляют собой соответствующие способы лечения состояний, заболеваний или нарушений, кроме указанных выше. Таким образом, один такой дополнительный аспект настоящего изобретения относится к способу лечения пациента, нуждающегося в этом, от одного или нескольких следующих заболеваний или нарушений: сахарный диабет 1 типа, сахарный диабет 2 типа, предиабет, синдром инсулинорезистентности, нарушение толерантности к глюкозе (IGT), болезненные состояния, связанные с повышенным уровнем глюкозы в крови, гипергликемия, гипертензия, атерогенная дислипидемия, артериосклероз (например,атеросклероз), ишемическая болезнь сердца, заболевание периферических артерий, инсульт, микроангиопатия, желудочное заболевание, метаболический синдром, рак (например, рак толстой кишки), воспалительная болезнь кишечника (ВБК) и синдром раздраженного кишечника (СРК),указанный способ включает введение пациенту терапевтически эффективного количества пептидного конъюгата или его фармацевтически приемлемой соли или сольвата согласно настоящему изобретению. Кроме того, другие возможные актуальные состояния, заболевания или нарушения в контексте способов лечения согласно настоящему изобретению включают ожирение, патологическое ожирение, воспаление, вызванное ожирением, болезнь желчного пузыря, вызванную ожирением, и вызванное ожирением апноэ сна. Другой аспект настоящего изобретения относится к способу индуцирования неогенеза островков поджелудочной железы у пациента, нуждающегося в этом, указанный способ включает введение пациенту терапевтически эффективного количества пептидного конъюгата или его фармацевтически приемлемой соли или сольвата согласно настоящему изобретению. Дополнительный аспект настоящего изобретения относится к способу обеспечения выживания клеток в островках поджелудочной железы у пациента, нуждающегося в этом, указанный способ включает введение пациенту терапевтически эффективного количества пептидного конъюгата или его фармацевтически приемлемой соли или сольвата согласно настоящему изобретению. Дополнительный аспект настоящего изобретения относится к способу снижения или предотвращения апоптоза -клеток в островках поджелудочной железы у пациента, нуждающегося в этом, указанный способ включает введение пациенту терапевтически эффективного количества пептидного конъюгата или фармацевтически приемлемой соли или ее сольвата согласно настоящему изобретению. Другой аспект настоящего изобретения относится к способу снижения уровней гемоглобина b1 Ас(гликозилированный гемоглобин; HbA1c) в крови пациента, нуждающегося в этом, указанный способ включает введение пациенту терапевтически эффективного количества пептидного конъюгата или его фармацевтически приемлемой соли или сольвата согласно настоящему изобретению. Другие аспекты настоящего изобретения относятся к следующему: способ лечения пациента, нуждающегося в этом, от болезненного состояния, вызванного повышенными уровнями глюкозы; способ снижения уровней глюкозы у пациента, нуждающегося в этом; способ стимуляции высвобождения инсулина у пациента, нуждающегося в этом; способ регуляции опорожнения желудка у пациента, нуждающегося в этом; и способ снижения уровней липидов в плазме у пациента, нуждающегося в этом. В каждом из последних способов согласно настоящему изобретению указанный способ включает введение пациенту терапевтически эффективного количества пептидного конъюгата или его фармацевтически приемлемой соли или сольвата согласно настоящему изобретению. Термин "терапевтически эффективное количество" при использовании в контексте описанных выше способов лечения или других терапевтических вмешательств в соответствии с изобретением относится к количеству, достаточному для того, чтобы вылечить, улучшить, облегчить или частично остановить клинические проявления определенного заболевания, расстройства или состояния, которое является объектом лечения или другого рассматриваемого терапевтического вмешательства. Количество, достаточное для достижения этой цели, определяется как терапевтически эффективное количество. Вводимое количество и способ введения можно адаптировать для достижения оптимальной эффективности. Эффективное для данной цели количество будет зависеть, в частности, от тяжести заболевания, расстройства или состояния, которое является объектом определенного лечения или другого терапевтического вмешательства, веса тела и общего состояния рассматриваемого пациента, питания, возможного сопутствующего лечения и от других факторов, хорошо известных специалистам в данной области медицины. Определить подходящий размер дозы и режим дозирования, наиболее подходящие для введения пептидного конъюгата или его фармацевтически приемлемой соли или сольвата в соответствии с изобретением человеку,можно, руководствуясь результатами, полученными с помощью настоящего изобретения, и их можно подтвердить в ходе правильно разработанных клинических испытаний. Эффективную дозу и протокол лечения можно определить с помощью традиционных способов, начиная с низкой дозы на лабораторных животных, а затем увеличивая дозу, контролируя при этом эффекты, а также систематически изменяя режим дозирования. Многочисленные факторы могут быть приняты во внимание врачом при определении оптимальной дозировки для данного объекта. Такие соображения хорошо известны специалисту в данной области. Термины "лечение" и его грамматические варианты (например, "излечиваемый", "лечение", "лечить") при употреблении в данном контексте относятся к подходу для получения полезных или желаемых клинических результатов. Для целей настоящего изобретения, полезные или желаемые клинические результаты включают, но не ограничиваются ими, облегчение симптомов, снижение степени заболевания, стабилизацию (т.е. не ухудшение) состояния заболевания, задержку или замедление прогрессирования заболевания, улучшение или временное улучшение болезненного состояния и ремиссию (частичную или полную), как заметную, так и незаметную. "Лечение" может также обозначать продление выживаемости по сравнению с ожидаемой продолжительностью жизни в отсутствие лечения. "Лечение" в некоторых вариантах реализации изобретения может представлять собой вмешательство, которое осуществляется с целью предупреждения развития или изменения патологии состояния, заболевания или расстройства. Соответственно, термин "лечение" может относиться как к терапевтическому вмешательству,так и к профилактическим или превентивным мерам. Субъект (например, человек), нуждающийся в лечении, таким образом, может представлять собой субъекта, который уже страдает от болезни или расстройства, о котором идет речь, или субъекта, у которого следует предотвратить расстройство. Термин"лечение", таким образом, включает подавление или снижение усиления тяжести патологического состояния или симптомов (например, увеличения веса или гипергликемии) по сравнению с отсутствием лечения и не обязательно должно означать полное прекращение соответствующего заболевания, расстройства или состояния. Термин "агонист" в контексте настоящего изобретения обозначает вещество (лиганд), которое активирует тип рецептора, о котором идет речь. Термин "агонист рецептора GLP-1" в контексте настоящего изобретения обозначает вещество (лиганд) (иногда обозначаемый как "агонист GLP-1"), которое активирует рецептор GLP-1, такой как рецептор GLP-1 человека. Вещества, которые активируют рецептор GLP-1 человека, включают природные пептидные гормоны GLP-1 GLP-1 (7-37), GLP-1 (7-36)амид, оксинтомодулин, эксендин-3, эксендин-4,глюкагон, желудочный ингибиторный полипептид (GIP) и их функциональные аналоги и производные. Термин "антагонист" при употреблении в контексте настоящего изобретения относится к веществу(лиганду), которое блокирует, нейтрализует или противодействует влиянию другого вещества (лиганда),которое функционирует как агонист по отношению к рассматриваемому типу рецептора. В контексте настоящего изобретения пациент, который нуждается в определенном лечении или другом терапевтическом вмешательстве, упомянутый в связи с различными аспектами настоящего изобретения, описанными выше, предпочтительно представляет собой млекопитающее и, более точно, человека. Дополнительный аспект настоящего изобретения относится к фармацевтической композиции, содержащей пептидный конъюгат или его фармацевтически приемлемую соль или сольват согласно настоящему изобретению вместе с фармацевтически приемлемым носителем, наполнителем или основой. Синтез пептидных конъюгатов Пептидные конъюгаты согласно настоящему изобретению могут быть изготовлены с помощью стандартных методов синтеза, посредством применения систем рекомбинантной экспрессии или с помощью любого другого подходящего метода. Таким образом, конъюгаты можно синтезировать различными способами, включая, например, способ, который включает:(а) синтез пептидного конъюгата посредством стандартной твердофазной или жидкостно-фазной методики, как поэтапно, так и с помощью сборки фрагментов и выделения и очистки конечного продукта пептидного конъюгата;(б) экспрессию конструкции нуклеиновой кислоты, которая кодирует пептидный конъюгат, в клетке-хозяине и выделение продукта экспрессии из культуры клеток-хозяина; или(в) осуществления экспрессии конструкции нуклеиновой кислоты, которая кодирует пептидный конъюгат, in vitro в бесклеточной системе и очистку продукта экспрессии; или любую комбинацию способов (а), (б) или (в) для получения фрагментов пептидного конъюгата,последующего лигирования фрагментов для получения пептидного конъюгата и выделения пептидного конъюгата. Часто может быть предпочтительно синтезировать конъюгаты согласно настоящему изобретению с помощью твердофазного или жидкофазного пептидного синтеза. В связи с этим можно привести в качестве ссылки публикацию WO 98/11125 или, в том числе, Fields G.B. et al. "Principles and Practice of Solid- 18023925Phase Peptide Synthesis"; в Synthetic Peptides, Gregory A. Grant (ed.), Oxford University Press (2 издание,2002) и примеры синтеза в них. Одна или несколько боковых аминокислотных цепей в соединении согласно настоящему изобретению могут быть также конъюгированы с липофильным заместителем. Указанный липофильный заместитель может быть ковалентно связан с атомом в боковой цепи аминокислоты или в другом случае может быть конъюгирован с боковой цепью аминокислоты с помощью спейсера. Аминокислота может представлять собой часть пептида Z или часть пептида Y. Не желая быть связанным теорией, считается, что липофильный заместитель связывает альбумин в кровотоке, защищая, таким образом, соединения согласно настоящему изобретению от ферментативного разрушения, что повышает период полураспада соединений. Спейсер при наличии используется для обеспечения интервала между соединением и липофильным заместителем. Указанный липофильный заместитель может быть присоединен к боковой аминокислот ной цепи или спейсеру в виде сложного эфира, сульфонового эфира, тиоэфира, амида или сульфонамида. Соответственно, будет ясно, что предпочтительно липофильный заместитель включает ацильную группу, сульфонильную группу, атом N, атом О или атом S, который образует часть сложного эфира, тиоэфира, амида или сульфонамида. Предпочтительно ацильная группа в липофильных заместителях образует часть амида или сложного эфира с боковой цепью аминокислоты или спейсером. Липофильный заместитель может включать углеводородную цепь, включающую 4-30 атомов. Предпочтительно она имеет по меньшей мере 8 или 12 атомов С, и предпочтительно она имеет 24 атомов С или меньше или 20 атомов С или меньше. Углеводородная цепь может быть линейной или разветвленной или может быть насыщенной или ненасыщенной. Будет ясно, что предпочтительно углеводородная цепь замещена на группу, которая образует часть присоединения к боковой цепи аминокислоты или спейсера, например, ацильную группу, сульфонильную группу, атом N, атом О или атом S. Наиболее предпочтительно углеводородная цепь замещена на ацил и соответственно углеводородная цепь может представлять собой часть алкильной группы, например, пальмитил, капроил, лауроил, миристоил или стеароил. Соответственно, указанный липофильный заместитель может иметь формулу, показанную ниже Липофильный заместитель может представлять собой, например, ацильную группу, сульфонильную группу, NH, N-алкил, атом О или атом S, предпочтительно ацил. n представляет собой целое число от 3 до 29, предпочтительно по меньшей мере 7 или по меньшей мере 11 и предпочтительно 23 или меньше или более предпочтительно 19 или меньше. Углеводородная цепь может быть дополнительно замещена. Например, она может дополнительно иметь до трех заместителей, выбранных из NH2, ОН и СООН. Если углеводородная цепь является дополнительно замещенной, предпочтительно она дополнительно замещена только одним заместителем. В другом случае углеводородная цепь может включать циклоалкан или гетероциклоалкан, например, показанный ниже Предпочтительно циклоалкан или гетероциклоалкан представляет собой шестичленное кольцо. Более предпочтительно он представляет собой пиперидин. В другом случае липофильный заместитель может иметь в основе остов циклопентанофенантрена,который может быть частично или полностью ненасыщенным или насыщенным. Каждый атом углерода в остове может быть замещен Me или ОН. Например, липофильный заместитель может представлять собой холил, дезоксихолил или литохолил. Как упомянуто выше, липофильный заместитель может быть конъюгирован с боковой цепью аминокислоты с помощью спейсера. При наличии, спейсер присоединен к липофильному заместителю и к боковой цепи аминокислоты. Спейсер может быть присоединен к липофильному заместителю и боковой цепи аминокислоты независимо в виде сложного эфира, сульфонилового эфира, тиоэфира, амида или сульфонамида. Соответственно, он может включать две группы, независимо выбранные из ацила, сульфонила, атома N, атома О или атома S. Спейсер может иметь следующую формулу: При этом каждый из В и D независимо выбирают из ацила, сульфонила, NH, N-алкила, атома О или атома S, предпочтительно из ацила и NH. Предпочтительно n представляет собой целое число от 1 до 10,предпочтительно от 1 до 5. Спейсер может быть возможно замещен одним или несколькими заместителями, выбранными из С 0-6 алкила, С 0-6 алкиламина, С 0-6 гидроксиалкила и С 0-6 карбоксиалкила. В другом случае спейсер может иметь две или несколько повторяющихся единиц согласно формуле выше. Каждый из В, D и п выбирают независимо для каждой повторяющейся единицы. Смежные повторяющиеся единицы могут быть ковалентно соединены друг с другом через их соответствующие В и D группы. Например, группы В и D смежных повторяющихся единиц вместе могут образовывать сложный эфир, сульфониловый эфир, тиоэфир, амид или сульфонамид. Свободные единицы В и D на каждом конце спейсера присоединены к боковой цепи аминокислоты и липофильному заместителю согласно описанию выше. Предпочтительно спейсер имеет пять или меньше, четыре или меньше или три или меньше повторяющихся единиц. Более предпочтительно спейсер имеет две повторяющиеся единицы или представляет собой отдельную единицу. Спейсер (или одна или несколько повторяющихся единиц спейсера, если он имеет повторяющиеся единицы) может представлять собой, например, природную или неприродную аминокислоту. Следует понимать, что в случае аминокислот, имеющих функциональные боковые цепи, В и/или D могут представлять собой группу в боковой цепи аминокислоты. Спейсер может представлять собой природную или неприродную аминокислоту. Например, спейсер (или одна или несколько повторяющихся единиц спейсера, если он имеет повторяющиеся единицы) может представлять собой Gly, Pro, Ala, Val, Leu, Ile,Met, Cys, Phe, Tyr, Trp, His, Lys, Arg, Gln, Asn, oc-Glu, -Glu, Asp, Ser Thr, Gaba, Aib, bAla, 5-аминопентаноил, 6-аминогексаноил, 7-аминогептаноил, 8-аминооктаноил, 9-аминонаноил или 10-аминолдеканоил. Например, спейсер может представлять собой одну аминокислоту, выбранную среди -Glu, Gaba, bAla и oc-Gly. Липофильный заместитель может быть конъюгирован с боковой цепью аминокислоты в соединениях согласно настоящему изобретению. Предпочтительно боковая цепь аминокислоты включает карбокси-, гидрокси-, тиол-, амидную или аминогруппу для образования сложного эфира, сульфонового эфира,тиоэфира, амида или сульфонамида со спейсером или липофильным заместителем. Например, липофильный заместитель может быть конъюгирован с, Asp, Glu, Gln, His, Lys, Arg, Ser, Thr, Tyr, Trp, Cys илиDbu, Dpr или Orn. Предпочтительно липофильный заместитель конъюгирован с Lys или Cys. Тем не менее, любая аминокислота, обозначенная как Lys в формулах, приведенных в настоящем описании, может быть замещена на Dbu, Dpr или Orn, если добавлен липофильный заместитель. Пример липофильного заместителя и спейсера показан на формуле ниже На ней Lys из соединения согласно настоящему изобретению (например, от X) ковалентно присоединен к -Glu (спейсеру) через амидную группу. Пальмитил ковалентно присоединен к спейсеру -Glu через амидную группу. Альтернативно или дополнительно одна или несколько боковых цепей аминокислот в соединении согласно настоящему изобретению могут быть конъюгированы с полимерной группой, например, с целью увеличения растворимости и/или периода полураспада in vivo (например, в плазме) и/или биодоступности. Такие модификации, также известно, снижают клиренс (например, почечный клиренс) терапевтических белков и пептидов. Полимерная группа предпочтительно растворима в воде (амфифильная или гидрофильная), нетоксична и фармацевтически инертна. Подходящие полимерные группы включают полиэтиленгликоль (PEG), гомо- или сополимеры PEG, монометилзамещенный полимер PEG (mPEG) или полиоксиэтиленглицерин (POG) (см., например, публикации в Int. J. Hematology 68: 1 (1998); Bioconjugate Chem. 6: 150 (1995); и Crit. Rev. Therap. Drug Carrier Sys. 9: 249 (1992. Другие подходящие полимерные группы включают полиаминокислоты, такие как полилизин, полиаспарагиновая кислота и полиглутаминовая кислота (см., например, публикации Gombotz, et al. (1995),Bioconjugate Chem., vol. 6: 332-351; Hudecz et al. (1992), Bioconjugate Chem., vol. 3, 49-57; Tsukada et al.(1984), J. Natl. Cancer Inst, vol. 73, 721-729; и Pratesi et al. (1985), Br. J. Cancer, vol. 52: 841-848). Полимерная группа может быть линейной или разветвленной. Она может иметь молекулярную массу 500-40,000 Да, например, 500-10,000, 1000-5000, 10,000-20,000 или 20,000-40,000 Да. Соединение может содержать две или более таких групп, в этом случае общая молекулярная масса всех таких групп обычно будет находиться в пределах, указанных выше. Полимерная группа может быть связана (посредством ковалентной связи) с амино, карбокси- или тиолгруппами боковой цепи аминокислоты. Предпочтительными примерами являются тиоловые группы остатков Cys и эпсилон-аминогруппы остатка Lys, и также могут быть использованы карбоксильные группы остатков Asp и Glu. Специалист будет хорошо осведомлен о подходящих методах, которые могут быть использованы для выполнения реакции конденсации. Например, группа PEG, имеющая метоксигруппу, может быть связана с тиоловой группой Cys посредством малеимидной связи с применением реагентов, коммерчески доступных у Nektar Therapeutics AL (см. также WO 2008/101017 и ссылки, приведенные выше, для более подробного описания подходящей химии). Терапевтические способы применения В дальнейшем следует понимать, что ссылки на использование пептидных конъюгатов согласно настоящему изобретению также включают использование их фармацевтически приемлемой соли или сольвата. Пептидные конъюгаты согласно настоящему изобретению могут обеспечить привлекательный вариант лечения метаболических заболеваний или нарушений, в том числе сахарного диабета, в частности 1-го типа и/или сахарного диабета 2 типа и, возможно, ожирения. Сахарный диабет представляет собой группу метаболических заболеваний, характеризующихся гипергликемией, возникающей в результате нарушений в секреции инсулина и/или действия инсулина. Острые симптомы диабета включают чрезмерную выработку мочи, возникающую компенсационную жажду и увеличение потребления жидкости, нарушение зрения, необъяснимую потерю веса, вялость, а также изменения в энергетическом обмене. Хроническая гипергликемия диабета связана с нарушениями макро- и микрососудов, которые могут привести к долгосрочному повреждению, дисфункции и в не которых случаях - в итоге к отказу различных органов, в частности глаз (особенно в виде диабетической ретинопатии), почек (в виде диабетической нефропатии), нервов (в виде диабетической нейропатии),сердца и кровеносных сосудов. Диабет можно разделить на три класса, а именно сахарный диабет 1 типа,сахарный диабет 2 типа и гестационный диабет, на основе их патогенетических особенностей. Диабет 1 типа составляет 5-10% от всех случаев диабета и вызывается аутоиммунным разрушением инсулинсекретирующих панкреатических -клеток. Диабет 2 типа составляет 90-95% случаев диабета и является результатом сложного комплекса метаболических расстройств. Сахарный диабет 2 типа является следствием того, что продукция собственного инсулина и/или чувствительность к инсулину всего организма становится недостаточной для поддержания уровня глюкозы в плазме крови ниже диагностического порога. Гестационный диабет обозначает любую степень толерантности к глюкозе, выявленную во время беременности. Также признается существование состояния, известного как предиабет. Оно включает в себя, например, нарушенный уровень глюкозы натощак и нарушенную толерантность к глюкозе и, в целом, относится к тем состояниям, которые возникают, когда уровень глюкозы в крови повышен, но находится ниже уровней, установленных для клинического диагноза сахарного диабета. Большая доля пациентов с сахарным диабетом 2 типа и предиабетом имеет повышенный риск заболеваемости и смертности в связи с высокой распространенностью дополнительных метаболических факторов риска, включая абдоминальное ожирение (избыточная жировая ткань вокруг внутренних органов брюшной полости), атерогенную дислипидемию (нарушение уровня жиров в крови, включая высокие уровни триглицеридов, низкий уровень холестерина ЛПВП и/или высокие уровни холестерина ЛПНП,что способствует образованию бляшек в стенках артерий), повышенное кровяное давление (гипертония),протромботические состояния (например, высокие уровни фибриногена или ингибитора активатора плазминогена-1 в крови) и провоспалительные состояния (например, повышенный уровень Среактивного белка в крови). В свою очередь, ожирение приводит к повышенному риску развития, например, предиабета, диабета 2 типа, некоторых видов рака, обструктивного апноэ сна и заболеваний желчного пузыря. Дислипидемия связана с повышенным риском сердечно-сосудистых заболеваний. Липопротеины высокой плотности (ЛПВП) имеют клиническое значение, так как существует обратная корреляция между концентрациями ЛПВП в плазме и риском атеросклероза. Большая часть холестерина, отложенного в атеросклеротических бляшках, происходит от липопротеинов низкой плотности (ЛПНП), и, следовательно, повышенные концентрации ЛПНП тесно связаны с атеросклерозом. Соотношение ЛПВП/ЛПНП параметров используется для оценки клинического риска развития атеросклероза и коронарного атеросклероза, в частности. Без связи с какой-либо конкретной теорией, представляется, что пептидные конъюгаты согласно настоящему изобретению могут неожиданно сочетать физиологическое действие агонистов рецептораGLP-1 с действием пептидов гастрина, см. выше, таким образом, что наблюдаемая активность может быть значительно больше, чем при использовании соответствующей аддитивной комбинации (неконъюгированных) отдельных пептидных компонентов. Следовательно, считается, что пептидные конъюгаты согласно настоящему изобретению могут быть особенно полезными при лечении предиабета, диабета(особенно сахарного диабета 1 и/или 2 типа) и вызванных диабетом состояний, болезней или расстройств, таких как те, которые рассмотрены выше, включая лечение для обеспечения образования клеток панкреатических островков (регенерации островков), и благодаря этому, производство инсулина,что будет полезно в отношении регуляции концентрации глюкозы в крови. Поэтому пептидные конъюгаты согласно настоящему изобретению могут иметь значение, в частности, для ограничения или торможения прогрессирования заболевания сахарного диабета 1 и/или 2 типа. Пептиды согласно настоящему изобретению могут дополнительно быть полезны для содействия выживанию и подавлению апоптоза -клеток в панкреатических островках. Действие GLP-1 и гастрина включает не только воздействие на пролиферацию и созревание -клеток, но и предотвращение апоптоза-клеток и повышение неогенеза, таким образом, действие пептидов согласно настоящему изобретению может включать такое действие эффекты и их влияние на улучшенную регуляцию инсулина и глюкозы. Пептидные конъюгаты согласно настоящему изобретению, таким образом, могут быть полезны в качестве лекарственных средств для лечения резистентности к инсулину, нарушения толерантности к глюкозе,предиабета, повышенного уровня глюкозы натощак, диабета 1 и/или 2 типа, гипертонии и/или дислипидемии (или комбинации этих метаболических факторов риска), атеросклероза, артериосклероза, ишемической болезни сердца, заболевания периферических артерий и инсульта. Они также могут быть полезны для предотвращения набора веса, обеспечения снижения веса, снижения избыточной массы тела и/или лечения ожирения (например, контроля аппетита, питание, приема пищи, потребления калорий и/или расхода энергии), включая патологическое ожирение, а также сопутствующих заболеваний, расстройств и состояний здоровья, включая, но не ограничиваясь ими, воспаление, вызванное ожирением, заболевания желчного пузыря, вызванные ожирением, и апноэ сна, вызванное ожирением. Влияние пептидных конъюгатов согласно настоящему изобретению на эти условия может быть опосредовано в целом или частично влиянием на массу тела или может не зависеть от них. Фармацевтически композиции В описании ниже следует понимать, что включение одного или нескольких пептидных конъюгатов согласно настоящему изобретению в фармацевтическую композицию включает также фармацевтически приемлемую соли или сольват пептидного конъюгата согласно настоящему изобретению. Пептидные конъюгаты согласно настоящему изобретению могут быть приготовлены в виде фармацевтических композиций, которые подходят для применения с или без хранения и которые обычно содержат терапевтически эффективное количество по меньшей мере одного пептидного конъюгата согласно настоящему изобретению, вместе с фармацевтически приемлемым носителем, наполнителем или основой. Термин "фармацевтически приемлемый носитель" включает любые стандартные фармацевтические носители. Фармацевтически приемлемые носители для терапевтического применения хорошо известны в области фармацевтики и описаны, например, в "Remington's Pharmaceutical Sciences", 17-е издание, Alfonso R. Gennaro (Ed.), Mark Publishing Company, Easton, PA, USA, 1985. Например, можно применять стерильный физиологический раствор и фосфатно-солевой буфер при слегка кислых или физиологических значениях рН. Приемлемые рН-буферные агенты могут представлять собой, например, фосфат,цитрат, ацетат, трис-(гидроксиметил)аминометан (TRIS), N-трис-(гидроксиметил)метил-3-аминопропансульфоновая кислоту (TAPS), бикарбонат аммония, диэтаноламин, гистидин, аргинин, лизин или уксусную кислоту (например, в виде ацетата натрия) или их смеси. Термин также включает любые носители,перечисленные в Фармакопеи США для использования для животных, включая человека. Фармацевтическая композиция согласно изобретению может находиться в единичной лекарственной форме. В такой форме композиция разделена на единичные дозы, содержащие соответствующие количества активного компонента или компонентов. Единичная лекарственная форма может быть представлена в виде упакованного препарата, при этом упаковка содержит дискретные количества препарата,например, упакованные таблетки, капсулы или порошки во флаконах или ампулах. Единичная лекарственная форма может представлять собой, например, капсулы, облатки или таблетки сами по себе, или она может представлять собой соответствующее количество любой из этих упакованных форм. Единичная лекарственная форма также может быть предоставлена в виде формы для инъекции одной дозы, например в форме ручки, содержащей жидкофазную композицию (обычно водную). Композиции могут быть сформулированы для любого подходящего пути и средства введения. Фармацевтически приемлемые носители или разбавители включают те, которые используются в композициях, подходящих для,например, перорального, интравитреального, ректального, вагинального, назального, местного, энтерального или парентерального (включая подкожное, внутримышечное, внутривенное, внутрикожное и трансдермальное) введения или введения путем ингаляции. Композиции могут быть представлены в виде единичной лекарственной формы и могут быть получены любым способом из хорошо известных способов в области фармацевтического препарата. Подкожный или трансдермальный способы введения могут быть особенно подходящими для пептидных конъюгатов согласно настоящему изобретению. Еще один аспект настоящего изобретения относится к устройствам, лекарственным форм и упаковке, используемым для доставки фармацевтических препаратов данного изобретения. Таким образом, по крайней мере один указанный пептидный конъюгат, или его часть, или вариант в стабильных или консервированных составах или растворах согласно настоящему описанию может быть введен пациенту в соответствии с настоящим изобретением с помощью различных методов, включая подкожные или внутримышечные инъекции; трансдермальный, легочный, трансмукозальный пути введения, имплантацию,осмотический насос, картридж, микронасос или другие средства, известные специалисту в данной области, а также известные в данной области. Еще один аспект изобретения относится к композициям для орального введения. Препараты для перорального введения могут включать совместное введение вспомогательных веществ (например, резорцинов и неионных поверхностно-активных веществ, такие как полиоксиэтиленолеиловый эфир и нгексадецилполиэтиленовый эфир), чтобы искусственно повысить проницаемость стенки кишечника, а также одновременное введение ферментативных ингибиторов (например, ингибиторов трипсина поджелудочной железы, диизопропилфторфосфата (DFF) и тразилола) для подавления деградации ферментами. Активное соединение лекарственной формы твердого типа для перорального введения может быть смешано по меньшей мере с одной добавкой, включая лактозу, целлюлозу, маннит, трегалозу, раффинозу,мальтит, декстран, крахмал, агар, аргинаты, хитины, хитозаны, пектины, трагакант, гуммиарабик, желатин, коллаген, казеин, альбумин, синтетический или полусинтетический полимер и глицерид. Эти лекарственные формы могут также содержать другой тип (типы) добавок, например неактивный разбавитель,смазки, такие как стеарат магния, парабены, консерванты, такие как сорбиновая кислота, аскорбиновая кислота, альфа-токоферол, антиоксидант, такие как цистеин, дезинтегратор, связующее вещество, загуститель, буферный агент, подсластитель, ароматизатор, ароматизации агент и т.д. Дозы Обычная доза пептидного конъюгата согласно настоящему изобретению, использованная в контексте настоящего изобретения, может находиться в диапазоне от 0,001 до 100 мг/кг массы тела в день, например, от примерно 0,01 до примерно 50 мг/кг массы тела в день, например, от около 0,05 до около 10 мг/кг массы тела в сутки, которое вводят в виде од ной или нескольких доз, например, от одной до трех доз. Как уже указывалось в некоторой степени выше, точная используемая доза будет зависеть, в частности, от характера и тяжести заболевания или расстройства, пола, возраста, массы тела и общего состояния субъекта, подлежащего лечению; возможных других сопутствующих заболеваний или расстройств,которые подвергаются лечению или должны подвергнуться лечению, а также других факторов, которые будут известны к врачу специалисту в данной области. Сочетанная терапия Как отмечалось выше, следует понимать, что ссылка на следующие пептидные конъюгаты изобретения распространяется также на его фармацевтически приемлемую соль или сольват, а также композицию, содержащую более одного из различных пептидных конъюгатов согласно настоящему изобретению. Пептидный конъюгат согласно настоящему изобретению можно вводить как часть комбинированной терапии вместе с другим активным агентом для лечения рассматриваемого заболевания или расстройства, например, сахарного диабета, ожирения, метаболического синдрома, дислипидемии или гипертонии, и в таких случаях два активные агента можно вводить вместе или по отдельности, например, в качестве составляющих в той же фармацевтической композиции или лекарственной форме, или в виде отдельных лекарственных форм. Таким образом, пептидный конъюгат можно использовать в сочетании с анти диабетическим агентом известного типа, включая, но не ограничиваясь ими, метформин, сульфонилмочевину, глинит, ингибиторы DPP-IV, глитазон или инсулин или аналог инсулина. В предпочтительном варианте реализации изобретения пептидный конъюгат согласно настоящему изобретению вводят в комбинации с инсулином или его аналогом, ингибитором DPP-IV, сульфонилмочевиной или метформином, в частности сульфонилмочевиной или метформином для достижения адекватного контроля гликемии. В более предпочтительном варианте реализации пептидный конъюгат вводят в комбинации с инсулином или аналогом инсулина для достижения адекватного контроля гликемии. Примеры приемлемых аналогов инсулина включают, но не ограничиваются ими, Лантус, Новорапид, Хумалог, НовоМикс, Актрафан НМ,Левемир, Деглюдек и Апидра. Другие значимые в данном случае антидиабетические препараты включают агонисты рецептора GLP-1, такие как экзенатид (Буетта; Эксендин-4) и лираглутид (Виктоза). Пептидный конъюгат согласно настоящему изобретению также можно применять в сочетании со средством против ожирения известного типа, включая, но не ограничиваясь ими, пептид YY или его аналог, нейропептид Y (NPY) или его аналог, антагонист каннабиноидных рецепторов 1, ингибитор липазы,преостровковый пептид человека (HIP), агонист рецептора меланокортина 4 или антагонист рецептора меланинконцентрирующего гормона 1. Пептидный конъюгат согласно настоящему изобретению также можно использовать в сочетании со средством против гипертензии известного типа, включая, но не ограничиваясь ими, ингибитор ангиотензинпревращающего фермента, блокатор рецептора ангиотензина II, диуретик, бета-блокатор или блокатор кальциевых каналов. Пептидный конъюгат согласно настоящему изобретению также можно использовать в сочетании со средством против дислипидемии известного типа, включая, но не ограничиваясь ими, статин, фибрат,ниацин и/или ингибитор всасывания холестерина. Пептидный конъюгат согласно настоящему изобретению также можно использовать в сочетании с ингибитором протонного насоса (т.е. фармацевтическим агентом, имеющим фармакологическую активность в качестве ингибитора H7K+-ATPase) известного типа, включая, но не ограничиваясь ими, агент типа производного бензимидазола или имидазопиридина,например Омепразол, Ланзопразол, Декслансопразол, Эзомепразол, Пантопразол, Рабепразол,Золпидем, Алпидем, Сарипидем или Некопидем. Пептидный конъюгат согласно настоящему изобретению, более того, можно использовать в сочетании с противовоспалительным агентом известного типа, включая, но не ограничиваясь ими: стероиды и кортикостероиды, такие как беклометазон, метилпреднизолон, бетаметазон, преднизолон, дексаметазон и гидрокортизон; нестероидные противовоспалительные средства (NSAID), такие как производные пропионовой кислоты (например, альминопрофен, беноксапрофен, буклоксовая кислота, карпрофен, фенбуфен, фенопрофен, флупрофен, флурбипрофен, ибупрофен, индопрофен, кетопрофен, миропрофен, напроксен,оксапрозин, пирпрофен, пранопрофен, супрофен, тиапрофеновая кислота и тиоксапрофен); производные уксусной кислоты (например, индометацин, ацеметацин, алклофенак, клиданак, диклофенак, фенклофенак, фенклокислота, фентиазак, фурофенак, ибуфенак, изоксепак, оксипинак, сулиндак, тиопинак, толметин и зидометацин зомепирак); фенамовой кислоты (например, флуфенамовая кислоты, меелофенамовая кислота, мефенамовая кислота, нифлумовая кислота и толфенамовая кислота); бифенилкарбоновой кислоты (например, дифлунизал и флуфенизал); оксикамы (например, изоксикам, пироксикам,судоксикам и теноксикам); салицилаты (например, ацетилсалициловая кислота и сульфасалазин) и пиразолоны (например, апазон, безпиперилон, фепразон, мофебутазон, оксифенбутазон и фенилбутазон); ингибиторы ЦОГ II, такие как рофекоксиб и целекоксиб; препараты интерферона бета (например, интерферон бета-1 или интерферона бета-1 б); и некоторые другие соединения, такие как 5-аминосалициловая кислота и пролекарства и их фармацевтически приемлемые соли. Было показано, что метформин обладает противовоспалительными свойствами [см. Haffner et al.,Diabetes 54: 1566-1572 (2005)] и поэтому также может быть полезен в на стоящем контексте. Каждая из приведенных публикаций и патентных заявок включена в настоящее описание посредством ссылки в полном объеме Следующие примеры демонстрируют некоторые конкретные варианты осуществления настоящего изобретения. Следующие примеры проводились с использованием стандартных методик, которые хорошо известны специалистам в данной области, за исключением случаев, описанных подробно. Следует понимать, что эти примеры даны только для иллюстрации и ограничивают условия или масштаб изобретения. Поэтому их не следует истолковать как ограничивающие объем настоящего изобретения. Примеры Сокращения, используемые в настоящих примерах, включаютMeCN: ацетонитрил ВЭЖХ: высокоэффективная жидкостная хроматография МС: масс-спектрометрияBSA: бычий сывороточный альбумин сАМР: циклический аденозинмонофосфатp-ERK: фосфорилированная внеклеточная регулируемая киназаNEP: N-метилпирролидон Лираглутид: [Arg34,Lys(Гексадеканоил-изоGlu)26]GLP-1 (7-37) Пример 1. Синтез соединения и свойства пептидов Материалы и методы Если не указано иначе, реагенты и растворители, использованные ниже, были коммерчески доступны в виде класса стандартных лабораторных реагентов или аналитического класса и использовали без дополнительной очистки. Общая методика синтеза пептидных конъюгатов согласно настоящему изобретению Твердофазный синтез пептидов осуществляли на СЕМ Liberty Peptide Synthesizer с использованием стандартной химии Fmoc. Смолу TentaGel S Ram (1 г; 0.25 ммоль/г) вымачивали в NMP (10 мл) перед применением и переносили из пробирки в реакционный сосуд с использованием DCM и NMP. Псевдо- 24023925 пролины, которые представляют собой дипептиды, используемые для минимизации агрегации во время синтеза пептидов, такие как Fmoc-Phe-Thr(-Me,Me-Pro)-OH и Fmoc-Asp-Ser(-Me,Me-Pro)-OH, использовали при необходимости, и искусственные аминокислоты, образующие линкерные группы Peg3, 8 Аос и DBF (см. выше), использовали в качестве Fmoc-защищенных аминокислот (т.е. Fmoc-Peg3-OH, Fmoc8Aoc-OH и Fmoc-DBF-OH соответственно) без изменения общей методики. Конденсация Аминокислоту-Fmoc в NMP/DMF/DCM (1:1:1; 0.2 М; 5 мл) добавляли к смоле в микроволновой печи СЕМ Discover вместе с HATU/NMP (0.5 М; 2 мл) и DIPEA/NMP (2.0 М; 1 мл). Смесь нагревали до 75 С в течение 5 мин при пропускании пузырьков азота через смесь. Затем смесь промывали NMP (410 мл). Снятие защиты Пиперидин/NMP (20%; 10 мл) добавляли в смолу для начального снятия защиты и нагревали смесь в микроволновой печи (40 С; 30 с). Осушали реакционный сосуд и добавляли вторую порцию пиперидина/NMP (20%; 10 мл) и нагревали еще раз (75 С; 3 мин). Смолу затем промывали NMP (610 мл). Расщепление Смолу промывали EtOH (310 мл) и Et20 (310 мл) и высушивали до постоянного веса при комнатной температуре (r.t.). Сырой пептид отщепляли от смолы с помощью обработки TFA/этандитиолом(95/5, 40 мл, 2 ч; r.t.). Большую часть TFA удаляли при пониженном давлении и сырой пептид осаждали,трижды промывали Et20 и высушивали до постоянного веса при комнатной температуре. Очистка и характеристика Сырой пептид очищали до степени чистоты более 90% с помощью препаративной обратно-фазовой ВЭЖХ, с использованием рабочей станции PerSeptive BiosysteMC VISION, снабженной соответствующей колонкой и коллектором фракций, и пропускали через нее градиент буфера А (0.1% TFA, водный) и буфера В (0.1% TFA, 90% MeCN, водный). Фракции анализировали методами аналитической ВЭЖХ и МС и соответствующие фракции накапливали и лиофилизировали. Конечный продукт характеризовали методом ВЭЖХ и МС. Пример синтеза Эксендин-4(1-39)-Peg3-Peg3-[Gln1,Leu15]Гастрин-17 (Соединение 1) синтезировали на синтезаторе пептидов СЕМ Liberty Peptide Synthesizer с использованием смолы TentaGel S Ram (0,67 г; 0.23 ммоль/г) и химии Fmoc согласно описанию выше. Использовали Fmoc-8-амино-3,6-диоксаоктановую кислоту и псевдопролины Fmoc-Phe-Thr(-Me,Me-Pro)-OH и Fmoc-Ser(tBu)-Ser(-Me,Me-Pro)-OH. Пептид отщепляли от смолы согласно описанию выше и проводили очистку на колонке Gemini-NX(0.1% TFA; 90% MeCN; водный). Продукт элюировали по линейному градиенту буфера В от 20 до 50% в течение 47 мин и собирали фракции (9 мл) с помощью коллектора фракций. Соответствующие фракции анализировали методами аналитической ВЭЖХ и МС, накапливали и лиофилизировали с получением белого порошка (122 мг), который по результатам аналитической ВЭЖХ характеризовали как на 58% чистый. Продукт очищали повторно на колонке Luna (125 см; 5 мкм; С 8) при пропускании 4 мл/мин смеси буфера А (0.1% TFA; водный) и буфера В (0.1% TFA; 90% MeCN; водный). Продукт элюировали по линейному градиенту буфера В от 20 до 50% в течение 47 мин и собирали фракции (2 мл) с помощью коллектора фракций. Соответствующие фракции анализировали методами аналитической ВЭЖХ и МС, накапливали и лиофилизировали с получением белого порошка (63 мг), который по результатам аналитической ВЭЖХ характеризовали как на 82% чистый. Другую часть Соединения 1 синтезировали с применением смолы TentaGel S Ram (0,70 г; 0.23 ммоль/г) и использовали те же условия для синтеза и отщепления, как описано выше. Очистку проводили на колонке Gemini-NX (525 см; 10 мкм; С 18) при пропускании 35 мл/мин смеси буфера А (0.1% TFA; водный) и буфера В (0.1% TFA; 90% MeCN; водный). Продукт элюировали по линейному градиенту буфера В от 20 до 50% в течение 47 мин и собирали фракции (9 мл) с помощью коллектора фракций. Соответствующие фракции анализировали методами аналитической ВЭЖХ и МС, накапливали и лиофилизировали с получением белого порошка (113 мг), который по результатам аналитической ВЭЖХ характеризовали как на 57% чистый. Продукт очищали повторно на колонке Luna (125 см; 5 мкм; С 8) при пропускании 4 мл/мин смеси буфера А (0.1% TFA; водный) и буфера В (0.1% TFA; 90% MeCN; водный). Продукт элюировали по линейному градиенту буфера В от 20 до 55% в течение 47 мин и собирали фракции (2 мл) с помощью коллектора фракций. Соответствующие фракции анализировали методами аналитической ВЭЖХ и МС, накапливали и лиофилизировали с получением белого порошка (29 мг), который по результатам аналитической ВЭЖХ характеризовали как на 77% чистый. Продукты первого синтеза (63 мг; 82%) и второго синтеза (29 мг; 77%) объединяли и еще раз очищали на колонке Kromasil (125 см; 10 мкм; С 8) при пропускании 4 мл/мин смеси буфера А (0.1% TFA; водный) и буфера В (0.1% TFA; 90% MeCN; водный). Продукт элюировали по линейному градиенту бу- 25023925 фера В от 25 до 65% в течение 47 мин и собирали фракции (2 мл) с помощью коллектора фракций. Соответствующие фракции анализировали методами аналитической ВЭЖХ и МС, накапливали и лиофилизировали с получением белого порошка (33 мг), который по результатам аналитической ВЭЖХ характеризовали как на 94% чистый. Масса составила 6553.39 Да по результатам МС (рассчитана 6553.06 Да). Эксендин-4(1-28)-Peg3-Peg3-[Leu4]Гастрин-6 (Соединение 33) синтезировали на синтезаторе пептидов СЕМ Liberty Peptide Synthesizer с использованием смолы TentaGel S Ram (0,55 г; 0.23 ммоль/г) и химии Fmoc согласно описанию выше. Использовали Fmoc-8-амино-3,6-диоксаоктановую кислоту и псевдопролин Fmoc-Phe-Thr(-Me,Me-Pro)-OH. Пептид отщепляли от смолы согласно описанию выше и проводили очистку на колонке Gemini-NX (525 см; 10 мкм; С 18) при пропускании 35 мл/мин смеси буфера А (0.1% TFA; водный) и буфера В (0.1% TFA; 90% MeCN; водный). Продукт элюировали по линейному градиенту буфера В от 25 до 55% в течение 47 мин и собирали фракции (9 мл) с помощью коллектора фракций. Соответствующие фракции анализировали методами аналитической ВЭЖХ и МС, накапливали и лиофилизировали с получением белого порошка (70 мг), который по результатам аналитической ВЭЖХ характеризовали как на 90% чистый. Масса составила 4364.08 Да по результатам МС (рассчитана 4364.11 Да).[Glu9,Leu14,Phe25,Tyr13]Эксендин-4(1-27)-[Leu4]Гастрин-6 (Соединение 101) синтезировали на синтезаторе пептидов СЕМ Liberty Peptide Synthesizer с использованием смолы TentaGel S Ram (1,15 г; 0.25 ммоль/г) и химии Fmoc согласно описанию выше. Использовали Fmoc-Phe-Thr(-Me,Me-Pro)-OH. Использовали NEP вместо NMP во время сопряжения и снятия защиты. Пептид отщепляли от смолы согласно описанию выше и проводили очистку на колонке Gemini-NX(0.1% TFA; 90% MeCN; водный). Продукт элюировали по линейному градиенту буфера В от 20 до 50% в течение 47 мин и собирали фракции (9 мл) с помощью коллектора фракций. Соответствующие фракции анализировали методами аналитической ВЭЖХ и МС, накапливали и лиофилизировали с получением белого порошка (50 мг), который по результатам аналитической ВЭЖХ характеризовали как на 85% чистый. Масса составила 3952.00.08 Да по результатам МС (рассчитана 3951.97 Да).GLP-1 (7-36)-Peg3-Peg3-[Gln1,Leu15]Гастрин-17 (Соединение 42) синтезировали на синтезаторе пептидов СЕМ Liberty Peptide Synthesizer с использованием смолы TentaGel S Ram (1,16 г; 0.23 ммоль/г) и химии Fmoc согласно описанию выше. Использовали Fmoc-8-амино-3,6-диоксаоктановую кислоту и псевдопролин Fmoc-Ser(tBu)-Ser(Psi Me, Me-Pro)-ОН. Пептид отщепляли от смолы согласно описанию выше и проводили очистку на колонке Gemini-NX(0.1% TFA; 90% MeCN; водный). Продукт элюировали по линейному градиенту буфера В от 25 до 45% в течение 47 мин и собирали фракции (9 мл) с помощью коллектора фракций. Соответствующие фракции анализировали методами аналитической ВЭЖХ и МС, накапливали и лиофилизировали с получением белого порошка (172 мг), который по результатам аналитической ВЭЖХ характеризовали как на 86% чистый. Масса составила 5664.72 Да по результатам МС (рассчитана 5664.70 Да). [Arg34,Lys(Гексадеканоил-изоGlu)26]GLP-1 (7-37)-Peg3-Peg3-[Leu4]Гастрин-6 (Соединение 107) синтезировали на синтезаторе пептидов СЕМ Liberty Peptide Synthesizer с использованием смолы TentaGel S Ram (1,30 г; 0.25 ммоль/г) и Fmoc-химии согласно описанию выше. NEP использовали вместо NMP во время конденсации и снятия защиты. Использовали Fmoc-8-амино-3,6-диоксаоктановую кислоту и псевдопролин Fmoc-PheThr(-Ме,Ме-Pro)-ОН, а также Fmoc-Lys(Dde)-OH на стадии прикрепления для ацилирования. N-конец пептида, прикрепленного к твердой фазе, защищали Boc с использованием Вос 20 (330 мг) и DIPEA (54 мкл) в DCM. Затем защитную группу Dde отщепляли с использованием гидразингидрата/NEP (4%; 215 мин), и смолу промывали NEP (82 мин), DIEA/NEP (10%; 55 мин) и NEP (82 мин). Синтез осуществляли на СЕМ Liberty Peptide Synthesizer согласно описанию выше с использованием Fmoc-Glu-OtBu и гексадеканоевой кислоты. NEP использовали вместо NMP во время конденсации и снятия защиты. Пептид отщепляли от смолы согласно описанию выше и проводили очистку на колонке Gemini-NX (525 см; 10 мкм; С 18) при пропускании 35 мл/мин смеси буфера А (0.1% TFA; водный) и буфера В (0.1% TFA; 90% MeCN; водный). Продукт элюировали по линейному градиенту буфера В от 30 до 70% в течение 47 мин и собирали фракции (9 мл) с помощью коллектора фракций. Соответствующие фракции анализировали методами аналитической ВЭЖХ и МС, накапливали и лиофилизировали с получением белого порошка (60 мг), который по результатам аналитической ВЭЖХ характеризовали как на 88% чистый. Масса составила 4819.95 Да по результатам МС (рассчитана 4819.45 Да). Пример 2. Активация (ЕС 50) рецептора GLP-1 и рецептора Гастрина CCK-В in vitro пептидными конъюгатами согласно настоящему изобретению Материалы и методы Анализ эффективности рецептора GLP-1 (GLP-1 R) человека:In vitro действие пептидных конъюгатов согласно настоящему изобретению оценивали с помощью измерения индукции сАМР после стимуляции рецептора GLP-1 (7-36), эксендин-4(1-39) или исследуемыми конъюгатами согласно настоящему изобретению с использованием набора FlashPlate сАМР про- 26023925 изводства Perkin-Elmer. Вкратце, клетки HEK293, экспрессирующие GLP-1 R человека (стабильная клеточная линия, полученная посредством трансфекции кДНК GLP-1 R и отбора стабильных клонов), сеяли в концентрации 40,000 клеток/лунка в 96-луночные микротитровальные планшеты, покрытые 0.01% поли-L-лизином, и культивировали в течение одного дня в 100 мкл питательной среды [DMEM, 10% FCS,пенициллин (100 МЕ/мл), стрептомицин (100 мкг/мл)]. В день проведения анализа удаляли питательную среду и клетки однократно промывали 200 мкл буфера Тирод [соль Тирод (9.6 г/л), 10 мМ HEPES, рН 7.4]. Клетки инкубировали в 100 мкл буфера Тирод, содержащего повышающиеся концентрации исследуемых соединений, 100 мкМ IB MX и 0.1% BSA в течение 15 мин при 37 С. Реакцию останавливали добавлением 25 мкл 0.5 М HCl и инкубировали на льду в течение 60 мин. Для получения деталей методологии смотрите публикацию WO 2008/152403. Анализ эффективности CCK-В рецептор (CCK-В R) Для исследования связывания и активации ССК-В R получили стабильные линии клеток, экспрессирующие один из рецепторов CCK человека или мыши тем же образом, каким были получены клеточные линии hGLP-1 R (см. выше). Вкратце, авторы использовали клетки HEK293 для трансфекции кДНК(NM009827) и mCCK-B R (NM007627)] человека или мыши, все клонированные в плазмиду трансфекции pIRES-neo2dNGFR. Клетки культивировали по стандартному протоколу в питательной среде и трансфицировали плазмидой с использованием Lipofectamin (Invitrogen). Клетки, стабильно экспрессирующие рецепторы CCK, отбирали с добавлением G418 в питательную среду (только клетки, поглотившие и встроившие плазмиду с экспрессией кДНК, выживали) и культивировали их. Стоковые суспензии клеток замораживали для последующего использования.In vitro действия пептидных конъюгатов согласно настоящему изобретению оценивали с помощью измерения p-ERK (с использованием анализа AlphaScreen SureFire p-ERK) в клетках HEK293, стабильно экспрессировавших CCK-В R (рецептор гастрина с высоким сродством) человека и мыши соответственно. Анализы эффективности рецепторов гастрина (анализы AlphaScreen SureFire p-ERK) проводили согласно следующему описанию. День 1. Посев клеток Описываемые клетки, экспрессировавшие CCK-В R, высеивали в концентрации 20,000 клеток/лунка в 100 мкл питательной среды [DMEM, 10% FCS, пенициллин (100 МЕ/мл), стрептомицин (100 мкг/мл)] в 96-луночные планшеты, покрытые поли-D-лизином. Клетки инкубировали в инкубаторе(37 С, 5% CO2) в течение двух дней. День 3. Смена среды на бессывороточную Питательную среду меняли на 80 мкл бессывороточной среды [DMEM, пенициллин (100 МЕ/мл),стрептомицин (100 мкг/мл)] на лунку и продолжали инкубировать клетки в течение 19 ч в инкубаторе(37 С, 5% CO2). День 4. Стимуляция пептидным конъюгатом и анализ AlphaScreen SureFire p-ERK 1. Через 19 ч добавляли 20 мкл бессывороточной среды, содержавшей одну из 5 раз личных концентраций пептидного конъюгата (в трех повторениях для каждой концентрации), и клетки инкубировали в течение 5 мин при комнатной температуре. 2. Среду для стимуляции удаляли, быстро переворачивая планшет вверх тормашками, и в каждую лунку добавляли 60 мкллизирующего буфера (из набора для анализа SureFire). 3. Планшет перемешивали на шейкере для планшетов в течение 5 мин и помещали на лед. 4. Анализ SureFire P-ERK: 4 мкл каждого супернатанта переносили в 384-луночный проксипланшет (Perkin Elmer). 5. 4 мкл каждого из двух лизатов контролей (нестимулированный и стимулированный) добавляли в проксипланшет в двух повторениях. 6. Смешивали 60 частей реакционного буфера, 10 частей буфера для активации, 1 часть акцепторных бусин и 1 часть донорских бусин (реакционный буфер + буфер для активации + бусины). 7 мкл полученного реакционного буфера + активационного буфера + бусин добавляли в лунки проксипланшета,перед добавлением в лунки смесь тщательно ресуспендировали. 7. Планшет инкубировали в течение 2 ч в темном боксе при 22 С в инкубаторе. 8. Планшет анализировали на свето-эмиссионном ридере планшетов Envision (Perkin-Elmer) с использованием соответствующей программы считывания (Perkin-Elmer). Пептидные конъюгаты согласно настоящему изобретению исследовали в описанных выше анализах (т.е. эффективность активации GLP-1GLP-1 (7-36) человека и эксендин-4(1-39) использовали в качестве положительного контроля в анализе эффективности активации рецептора GLP-1 человека (hGLP-1 R), и h[Gln1,Leu15]Гастрин 17 иCCK-8 (состоящий из С-терминальных 8 активных аминокислотных остатков CCK) использовали в качестве положительных контролей при анализе эффективности рецептора CCK-В человека (hCCK-B R) и анализе рецептора CCK-В мыши (mCCK-B R). В данном исследовании активации рецептора CCK h[Gln1,Leu15]Гастрин 17 (имеющий последова- 27023925 тельность H-QGPWLEEEEEAYGWLDF-NH2) использовали в качестве контрольного соединения. Остаток глутамина (Gln) мог быть изменен в некоторой степени до PyroGlu, но без потери связывающей активности рецептора. Результаты (значения ЕС 50 в моль/л) представлены ниже в табл. 1, 1 а и 2. Таблица 1. In vitro эффективность (ЕС 50, моль/л) соединений (пептидных конъюгатов) согласно настоящему изобретению в активации hGLP-1 R, hCCK-B R и mCCK-B R Таблица 1a. In vitro эффективность (ЕС 50, моль/л) соединений (пептидных конъюгатов) согласно настоящему изобретению в активации hGLP-1 R, hCCK-B R и mCCK-B R Таблица 2. In vitro эффективность (ЕС 50, моль/л) следующих соединений (пептидных конъюгатов) согласно настоящему изобретению в активации hGLP-1 R и hCCK-B R
МПК / Метки
МПК: A61K 38/22, C07K 19/00, C07K 14/595, C07K 14/575
Метки: агонистов, рецептора, конъюгаты, glp-1, применение, пептидные
Код ссылки
<a href="https://eas.patents.su/30-23925-peptidnye-konyugaty-agonistov-receptora-glp-1-i-ih-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Пептидные конъюгаты агонистов рецептора glp-1 и их применение</a>
Предыдущий патент: Столб для ограждения
Следующий патент: Замороженное кондитерское изделие
Случайный патент: Применение адгезионной композиции, содержащей арилдинитрилоксид, заплата для ремонта шин, содержащая такую адгезионную композицию, и шина