Хинолиноновые соединения в качестве агонистов рецептора 5-ht4
Номер патента: 13567
Опубликовано: 30.06.2010
Авторы: Голдблум Адам, Лонг Дэниэл Д., Гендрон Роланд, Дзян Лань, Маркесс Дэниэл, Фазери Пол Р., Тернер Дерек С., Чои Сеок-Ки
Формула / Реферат
1. Хинолинкарбоксамидное соединение формулы (I)
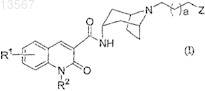
где R1представляет собой водород;
R2 представляет собой С3-4алкил;
а имеет значение 0 или 1;
Z представляет собой группу формулы (а)
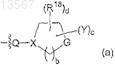
где b имеет значение 1, 2 или 3;
d имеет значение 0 или 1;
X представляет собой углерод и Q выбран из -A-, -A(CH2)2N(R4)- и -S(O)2(CH2)2N(R4)- или
X представляет собой азот и Q выбран из -S(O)2CH2C(O)-, -SCH2C(O)-, -OC(O)-, -S(O)2-, -S(O)2(CH2)2-,
-A(CH2)2-, ![]()
G представляет собой W и с имеет значение 0, где W выбран из -N{C(O)R9}-, -N{S(O)2R10}-, -N{C(O)OR12}-, -N{C(O)NR13R14}-, -N{S(O)2NR13R14}-, -N{R16}-, -S(O)2-, -O- и -S-;
при условии, что когда G представляет собой W, с имеет значение 0 и b имеет значение 1, тогда
X представляет собой углерод или
G представляет собой углерод, с имеет значение 1 и
Y представляет собой группу формулы (b)
![]()
где е имеет значение 0 или 1;
W' выбран из -N(R8)C(O)R9, -N(R8)S(O)2R10, -N(R8)С(O)OR12, -N(R8)C(O)NR13R14, -N(R8)S(O)2NR13R14,
-С(O)NR13R14, -ОС(O)NR13R14, -OR15 и -N(R8)R16;
при условии, что когда X представляет собой азот, е имеет значение 0 и W' присоединен к атому углерода, связанному с X, тогда
W' представляет собой -С(O)NR13R14 или -С(O)OR12;
А выбран из -S(O)2CH2C(O)N(R3)-, -N{C(O)R5}-, -N{C(O)NR6aR6b}-, -N{S(O)2C1-3алкил}-, -N{S(O)2NR6aR6b}-, -S(O)2N(R7a)- и -OC(O)N(R7b)-;
R3 и R4независимо представляют собой С1-4алкил;
R5 представляет собой водород, C1-3алкил, C1-3алкокси, С4-6циклоалкил или пиримидин-4-ил;
R6a и R6b независимо представляют собой водород, C5-6циклоалкил или С1-4алкил, где С1-4алкил необязательно замещен гидрокси, C1-3алкокси или циано;
R7a и R7b независимо представляют собой водород или C1-4алкил;
R8 представляет собой водород или С1-4алкил;
R9 представляет собой водород, фуранил, тетрагидрофуранил, пиридинил или С1-4алкил;
R10 представляет собой С1-4алкил, необязательно замещенный S(O)2С1-3алкилом или 1-3 атомами галогена;
R11 представляет собой -NR13R14 или С1-4алкил;
R12 представляет собой С1-4алкил;
R13, R14 и R15 независимо представляют собой водород или C1-4алкил;
R16 представляет собой -(CH2)r-R17, где r имеет значение 0, 1, 2 или 3;
R17 представляет собой водород, гидрокси, циано, C1-3алкил, C1-3алкокси, -С(O)NR13R14, -CF3, пиролил, пиролидинил, пиридинил, тетрагидрофуранил, -N(R8)С(O)OR12, -ОС(O)NR13R14, -N(R8)S(O)2CH3,
-S(O)2NR13R14 или 2-оксоимидазолидин-1-ил, где C1-3алкокси необязательно замещен гидрокси; при условии, что, когда r имеет значение 0, R17 выбран из водорода, C1-3алкила и пиридинила и когда r имеет значение 1, R17 представляет собой водород или R17:образует углерод-углеродную связь с атомом углерода в -(CH2)r-;
R18 представляет собой C1-3алкил, необязательно замещенный гидрокси;
или его фармацевтически приемлемая соль или стереоизомер.
2. Хинолинкарбоксамидное соединение по п.1, где
R1 представляет собой водород;
R2 представляет собой С3-4алкил и
d имеет значение 0.
3. Соединение по п.1 или 2, где
X представляет собой углерод и Q представляет собой -А- или
X представляет собой азот и Q выбран из -ОС(O)-, -S(O)2-, -S(O)2(CH2)2- и -А(CH2)2-.
4. Соединение по любому из пп.1-3, где
X представляет собой углерод и Q выбран из -N{C(O)R5}-, -N{C(O)NR6aR6b}-, -N{S(O)2С1-3алкил}- и
-S(O)2N(R7a)- или
X представляет собой азот и Q выбран из -ОС(O)-, -S(O)2-, -S(O)2(CH2)2-, -S(O)2N(R7a)(CH2)2-,
-N{C(O)R5}(CH2)2- и -N{S(O)2С1-3алкил}(CH2)2-.
5. Соединение по любому из пп.1-4, где
G представляет собой W и с имеет значение 0, где W выбран из -N{C(O)R9}-, -N{S(O)2R10}-,
-N{C(O)NR13R14}-, -N{R16}- и -S(O)2-; или
G представляет собой углерод, с имеет значение 1 и Y представляет собой группу формулы (b), где W' выбран из -N(R8)C(O)R9, -N(R8)S(O)2R10, -S(R11)(O)2, -N(R8)С(O)NR13R14, -OR15 и -N(R8)R16.
6. Соединение по любому из пп.1-5, где G представляет собой W и с имеет значение 0.
7. Соединение формулы (I)
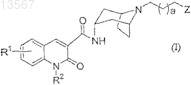
где R1представляет собой водород;
R2 представляет собой С3-4алкил;
а имеет значение 0 или 1;
Z представляет собой группу формулы (с)
![]()
где X представляет собой углерод и Q представляет собой -А- или
X представляет собой азот и Q выбран из -ОС(O)-, -S(O)2-, -S(O)2(CH2)2- и -А(CH2)2-;
b имеет значение 1, X представляет собой углерод и W представляет собой -S(O)2- или
b имеет значение 2, X представляет собой углерод или азот и W выбран из -S(O)2-, -N{C(O)R9}-,
-N{S(O)2R10}-, -N{C(O)NR13R14}- и -N{R16}-; или
Z представляет собой группу формулы (d)
![]()
где Q выбран из -ОС(O)-, -S(O)2-, -S(O)2(CH2)2- и -A(CH2)2-;
W' выбран из -N(R8)C(O)R9, -N(R8)S(O)2R10, -N(R8)С(O)NR13R14, -OR15 и -N(R8)R16;
при условии, что когда W' присоединен к атому углерода, связанному с атомом азота кольца, тогда
W' представляет собой -С(O)NR13R14; и
b имеет значение 1 или 2 и
А выбран из -S(O)2CH2C(O)N(R3)-, -N{C(O)R5}-, -N{C(O)NR6aR6b}-, -N{S(O)2С1-3алкил}-, -N{S(O)2NR6aR6b}-, -S(O)2N(R7a)- и -OC(O)N(R7b)-;
R3 представляет собой С1-4алкил;
R5 представляет собой водород, C1-3алкил или С1-3алкокси;
R6a и R6b независимо представляют собой водород или C1-4алкил;
R7a и R7b независимо представляют собой водород или C1-4алкил;
R8 представляет собой водород, метил или этил;
R9 представляет собой тетрагидрофуранил, метил или этил;
R10 представляет собой метил или этил;
R11 представляет собой метил или этил;
R13 и R14 независимо представляют собой водород, метил или этил;
R15 представляет собой водород или метил;
R16 представляет собой -(CH2)r-R17, где r имеет значение 0, 1 или 2 и R17 выбран из гидрокси, циано, C1-3 алкила и C1-3алкокси; при условии, что, когда r имеет значение 0, R17 выбран из C1-3алкила, и когда r имеет значение 1, R17 представляет собой циано или C1-3алкил;
или его фармацевтически приемлемая соль или стереоизомер.
8. Соединение по п.7, где Z представляет собой группу формулы (с), где X представляет собой азот и Q выбран из -OC(O)-, -S(O)2-, -S(O)2(CH2)2-, -S(O)2N(R7a)(CH2)2-, -N{C(O)C1-3алкокси}(CH2)2- и -N{S(O)2С1-3 алкил}(CH2)2-.
9. Соединение по п.7, где Z представляет собой группу формулы (с), где X представляет собой углерод и Q выбран из -N{С(O)С1-3алкокси}-, -N{C(O)NR6aR6b}-, -N{S(O)2С1-3алкил}- и -S(O)2N(R7a)-.
10. Соединение по п.7, где Z представляет собой группу формулы (d), где Q выбран из -ОС(O)- и -S(O)2-.
11. Соединение по п.7, где соединение выбрано из
{(1S,3R,5R)-8-[3-(4-метансульфонилпиперазин-1-сульфонил)пропил]-8-азабицикло[3,2,1]окт-3-ил}амида 1-изопропил-2-оксо-1,2-дигидрохинолин-3-карбоновой кислоты;
{(1S,3R,5R)-8-[3-(3-диметиламинопиролидин-1-сульфонил)пропил]-8-азабицикло[3,2,1]окт-3-ил}амида 1-изопропил-2-оксо-1,2-дигидрохинолин-3-карбоновой кислоты;
((1S,3R,5R)-8-{3-[4-(2-гидроксиэтил)пиперазин-1-сульфонил]пропил}-8-азабицикло[3,2,1]окт-3-ил)амида 1-изопропил-2-оксо-1,2-дигидрохинолин-3-карбоновой кислоты;
{(1S,3R,5R)-8-[3-(4-метилпиперазин-1-сульфонил)пропил]-8-азабицикло[3,2,1]окт-3-ил}амида 1-изопропил-2-оксо-1,2-дигидрохинолин-3-карбоновой кислоты;
((1S,3R,5R)-8-{2-[метансульфонил(1-пропилпиперидин-4-ил)амино]этил}-8-азабицикло[3,2,1]окт-3-ил)амида 1-изопропил-2-оксо-1,2-дигидрохинолин-3-карбоновой кислоты;
[(1S,3R,5R)-8-(3-{[1-(2-метоксиэтил)пиперидин-4-ил]метилсульфамоил}пропил)-8-азабицикло[3,2,1]окт-3-ил]амида 1-изопропил-2-оксо-1,2-дигидрохинолин-3-карбоновой кислоты;
((1S,3R,5R)-8-{3-[(1-метансульфонилпиперидин-4-ил)метилсульфамоил]пропил}-8-азабицикло[3,2,1]окт-3-ил)амида 1-изопропил-2-оксо-1,2-дигидрохинолин-3-карбоновой кислоты;
[(1S,3R,5R)-8-(3-{[1-(2-цианоэтил)пиперидин-4-ил]метилсульфамоил}пропил)-8-азабицикло[3,2,1]окт-3-ил]амида 1-изопропил-2-оксо-1,2-дигидрохинолин-3-карбоновой кислоты;
((1S,3R,5R)-8-{2-[(1,1-диоксотетрагидро-1l6-тиофен-3-ил)метансульфониламино]этил}-8-азабицикло[3,2,1]окт-3-ил)амида 1-изопропил-2-оксо-1,2-дигидрохинолин-3-карбоновой кислоты;
((1S,3R,5R)-8-{2-[1-(1,1-диоксотетрагидро-1l6-тиофен-3-ил)-3,3-диметилуреидо]этил}-8-азабицикло[3,2,1]-окт-3-ил)амида 1-изопропил-2-оксо-1,2-дигидрохинолин-3-карбоновой кислоты;
метилового эфира (1,1-диоксотетрагидро-1l6-тиофен-3-ил)-(2-{(1S,3R,5R)-3-[(1-изопропил-2-оксо-1,2-дигидрохинолин-3-карбонил)амино]-8-азабицикло[3,2,1]окт-8-ил}этил)карбаминовой кислоты;
[(1S,3R,5R)-8-(2-{[2-(4-диметилкарбамоилпиперазин-1-ил)этил]метансульфониламино}этил)-8-азабицикло-[3,2,1]окт-3-ил]амида 1-изопропил-2-оксо-1,2-дигидрохинолин-3-карбоновой кислоты;
((1S,3R,5R)-8-{2-[2-(4-метансульфонилпиперазин-1-ил)этансульфонил]этил}-8-азабицикло[3,2,1]окт-3-ил)амида 1-изопропил-2-оксо-1,2-дигидрохинолин-3-карбоновой кислоты;
[(1S,3R,5R)-8-(2-{2-[4-(тетрагидрофуран-2-карбонил)пиперазин-1-ил]этансульфонил}этил)-8-азабицикло[3,2,1]окт-3-ил]амида 1-изопропил-2-оксо-1,2-дигидрохинолин-3-карбоновой кислоты;
((1S,3R,5R)-8-{2-[2-(4-этансульфонилпиперазин-1-ил)этансульфонил]этил}-8-азабицикло[3,2,1]окт-3-ил)амида 1-изопропил-2-оксо-1,2-дигидрохинолин-3-карбоновой кислоты;
метилового эфира (1,1-диоксогексагидро-1l6-тиопиран-4-ил)-(2-{(1S,3R,5R)-3-[(1-изопропил-2-оксо-1,2-дигидрохинолин-3-карбонил)амино]-8-азабицикло[3,2,1]окт-8-ил}этил)карбаминовой кислоты;
((1S,3R,5R)-8-{2-[1-(1,1-диоксотетрагидро-1l6-тиофен-3-ил)-3-метилуреидо]этил}-8-азабицикло[3,2,1]окт-3-ил)амида 1-изопропил-2-оксо-1,2-дигидрохинолин-3-карбоновой кислоты;
метилового эфира (2-{(1S,3R,5R)-3-[(1-изопропил-2-оксо-1,2-дигидрохинолин-3-карбонил)амино]-8-азабицикло[3,2,1]окт-8-ил}этил)-[2-(4-метансульфонилпиперазин-1-илэтил]карбаминовой кислоты;
метилового эфира [2-(4-диметилкарбамоилпиперазин-1-ил)этил]-(2-{(1S,3R,5R)-3-[(1-изопропил-2-оксо-1,2-дигидрохинолин-3-карбонил)амино]-8-азабицикло[3,2,1]окт-8-ил}этил)карбаминовой кислоты;
метилового эфира [2-(4-ацетилпиперазин-1-ил)этил]-(2-{(1S,3R,5R)-3-[(1-изопропил-2-оксо-1,2-дигидрохинолин-3-карбонил)амино]-8-азабицикло[3,2,1]окт-8-ил}этил)карбаминовой кислоты;
метилового эфира [2-(1,1-диоксо-1l6-тиоморфолин-4-ил)этил]-(2-{(1S,3R,5R)-3-[(1-изопропил-2-оксо-1,2-дигидрохинолин-3-карбонил)амино]-8-азабицикло[3,2,1]окт-8-ил}этил)карбаминовой кислоты;
метилового эфира (1,1-диоксотетрагидро-1l6-тиофен-3-ил)-(3-{(1S,3R,5R)-3-[(1-изопропил-2-оксо-1,2-дигидрохинолин-3-карбонил)амино]-8-азабицикло[3,2,1]окт-8-ил}пропил)карбаминовой кислоты;
метилового эфира ((S)-1,1-диоксотетрагидро-1l6-тиофен-3-ил)-(2-{(1S,3R,5R)-3-[(1-изопропил-2-оксо-1,2-дигидрохинолин-3-карбонил)амино]-8-азабицикло[3,2,1]окт-8-ил}этил)карбаминовой кислоты;
{(1S,3R,5R)-8-[3-(метил-{2-[4-(тетрагидрофуран-2-карбонил)пиперазин-1-ил]этил}сульфамоил)пропил]-8-азабицикло[3,2,1]окт-3-ил}амида 1-изопропил-2-оксо-1,2-дигидрохинолин-3-карбоновой кислоты;
((1S,3R,5R)-8-{3-[4-(тетрагидрофуран-2-карбонил)пиперазин-1-сульфонил]пропил}-8-азабицикло-[3,2,1]окт-3-ил)амида 1-изопропил-2-оксо-1,2-дигидрохинолин-3-карбоновой кислоты;
{(1S,3R,5R)-8-[3-(4-ацетилпиперазин-1-сульфонил)пропил]-8-азабицикло[3,2,1]окт-3-ил}амида 1-изопропил-2-оксо-1,2-дигидрохинолин-3-карбоновой кислоты;
3-{(1S,3R,5R)-3-[(1-изопропил-2-оксо-1,2-дигидрохинолин-3-карбонил)амино]-8-азабицикло[3,2,1]окт-8-ил}пропилового эфира 4-метансульфонилпиперазин-1-карбоновой кислоты;
3-{(1S,3R,5R)-3-[(1-изопропил-2-оксо-1,2-дигидрохинолин-3-карбонил)амино]-8-азабицикло[3,2,1]окт-8-ил}пропилового эфира 4-(тетрагидрофуран-2-карбонил)пиперазин-1-карбоновой кислоты;
3-{(1S,3R,5R)-3-[(1-изопропил-2-оксо-1,2-дигидрохинолин-3-карбонил)амино]-8-азабицикло[3,2,1]окт-8-ил}пропиловый эфир 4-ацетилпиперазин-1-карбоновой кислоты и
3-{(1S,3R,5R)-3-[(1-изопропил-2-оксо-1,2-дигидрохинолин-3-карбонил)амино]-8-азабицикло[3,2,1]окт-8-ил}пропилового эфира 4-гидроксипиперидин-1-карбоновой кислоты.
и их фармацевтически приемлемых солей и стереоизомеров.
12. Фармацевтическая композиция, пригодная в качестве агониста рецептора 5-HT4, включающая терапевтически эффективное количество соединения по любому из пп.1-11 и фармацевтически приемлемый носитель.
13. Применение соединения по любому из пп.1-11 для лечения медицинских состояний у млекопитающих, связанных с активностью рецептора 5-HT4.
14. Применение соединения по любому из пп.1-11 для получения лекарственного средства для лечения медицинского состояния у млекопитающего, связанного с активностью рецептора 5-HT4.
15. Применение по п.14, где заболевание или состояние представляют собой расстройства, обусловленные пониженной перистальтикой желудочно-кишечного тракта.
16. Применение по п.15, где расстройство, обусловленное пониженной перистальтикой желудочно-кишечного тракта, представляет собой синдром раздраженной толстой кишки с преобладающими запорами.
17. Способ лечения млекопитающего, у которого наблюдается медицинское состояние, связанное с активностью рецептора 5-HT4, при этом способ включает введение млекопитающему терапевтически эффективного количества фармацевтической композиции, содержащей фармацевтически приемлемый носитель и соединение по любому из пп.1-11.
18. Способ по п.17, где медицинское состояние выбрано из группы, включающей синдром раздраженной толстой кишки (IBS), хронические запоры, функциональную диспепсию, замедленное опорожнение желудка, гастроэзофагеальный рефлюкс (GERD), гастропарез, диабетическую и идиопатическую гастропатию, постоперационную непроходимость кишечника, псевдообструкцию кишечника и индуцированное лекарственными средствами замедленное прохождение содержимого по пищеварительному тракту.
19. Способ лечения расстройств, обусловленных пониженной перистальтикой желудочно-кишечного тракта у млекопитающего, при этом способ включает введение млекопитающему терапевтически эффективного количества фармацевтической композиции, содержащей фармацевтически приемлемый носитель и соединение по любому из пп.1-11.
20. Способ по п.19, где расстройство, обусловленное пониженной перистальтикой желудочно-кишечного тракта, выбрано из группы, включающей хронические запоры, синдром раздраженной толстой кишки с преобладающими запорами, диабетический и идиопатический гастропарез и функциональную диспепсию.
21. Способ получения соединения формулы (I)

где R1, R2, а и Z определены в п.1;
или его фармацевтически приемлемой соли, или стереоизомера, при этом способ включает взаимодействие соединения формулы (III)

или его соли или стереоизомера с соединением формулы (IV)
![]()
где L1представляет собой галоген или сложный сульфоновый эфир в качестве удаляемой группы,
с получением соединения формулы (I), или его фармацевтически приемлемой, соли или стереоизомера.
22. Способ получения соединения формулы (I-а)
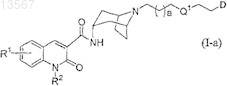
где Q1выбран из -S(O)2- и -А- и
D выбран из группы формулы (D1)
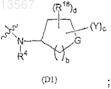
и группы формулы (D2)
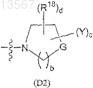
где R1, R2, R4, R18, A, Y, G, а, b, с и d определены в п.1;
или его фармацевтически приемлемой соли или стереоизомера, при этом способ включает взаимодействие соединения формулы (V)
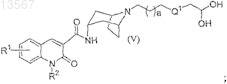
с соединением формулы (VI)
![]()
с получением соединения формулы (I-а) или его фармацевтически приемлемой соли, или сольвата, или стереоизомера.
23. Способ получения соединения формулы (I-b)
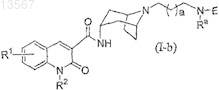
где Ra представляет собой -C(O)R5, -С(O)NR6aR6b, -S(O)2С1-3алкил или -S(O)2NR6aR6bи
Е выбран из группы формулы (Е1)
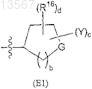
и группы формулы -CH2CH2-D,
где D выбран из группы формулы (D1)

и группы формулы (D2)
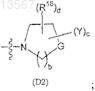
где R1, R2, R4, R5, R6a, R6b, R18, Y, G, a, b, с и d определены в п.1;
или его фармацевтически приемлемой соли или стереоизомера, при этом способ включает взаимодействие соединения формулы (VII)
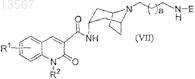
с соединением формулы (VIII)
![]()
где L3-Ra представляет собой С1-4алкилизоцианат или L3представляет собой галоген, п-нитрофенол или сложный сульфоновый эфир в качестве удаляемой группы и Ra представляет собой -C(O)R5, -C(O)NR6aR6b,
-S(O)2С1-3алкил или -S(O)2NR6aR6b;
с получением соединения формулы (I-b) или его соли, сольвата или стереоизомера.
24. Способ изучения биологической системы или образца, содержащих рецептор 5-HT4, при этом способ включает:
(a) контактирование биологической системы или образца с соединением по любому из пп.1-11 и
(b) определение эффекта, оказываемого соединением на биологическую систему или образец.
Текст
013567 Предпосылки изобретения Область изобретения Настоящее изобретение направлено на хинолинонкарбоксамидные соединения, которые являются полезными в качестве агонистов рецептора 5-HT4. Настоящее изобретение также направлено на фармацевтические композиции, включающие такие соединения, на способы с использованием таких соединений для лечения медицинских состояний, опосредованных активностью рецептора 5-HT4, а также на способы и промежуточные соединения, полезные для получения таких соединений. Область техники Серотонин (5-гидрокситриптамин, 5-HT) представляет собой нейротрансмиттер, который является широко распространенным по всему организму как в центральной нервной системе, так и в периферических системах. Идентифицированы по меньшей мере семь подтипов серотониновых рецепторов, и взаимодействие серотонина с этими разными рецепторами связано с различными физиологическими функциями. Поэтому существует большая заинтересованность в разработке терапевтических средств, которые нацелены на конкретные подтипы рецептора 5-HT. В частности, в последнее время в центре внимания была идентификация рецепторов 5-HT4 и фармацевтических средств, которые взаимодействуют с ними (см., например, обзор Langlois andFischmeister, J. Med. Chem. 2003, 46, 319-344.) Например, агонисты рецептора 5-HT4 являются полезными для лечения расстройств пониженной перистальтики желудочно-кишечного тракта. Такие расстройства включают синдром раздраженной толстой кишки (IBS), хронические запоры, функциональную диспепсию, замедленное опорожнение желудка, гастроэзофагеальный рефлюкс (GERD), гастропарез, постоперационную непроходимость кишечника, псевдообструкцию кишечника и индуцированное лекарственными средствами замедленное прохождение содержимого по пищеварительному тракту. Кроме того,было сделано предположение, что некоторые соединения-агонисты рецептора 5-HT4 можно использовать для лечения расстройств центральной нервной системы, включая когнитивные расстройства, поведенческие расстройства, расстройства настроения и нарушения контроля автономной функции. Несмотря на потенциальную широкую применимость фармацевтических средств, модулирующих активность рецептора 5-HT4, в настоящее время клиническое применение нашли лишь несколько соединений-агонистов рецептора 5-HT4. Одно средство, цисаприд, которое широко использовали для лечения нарушений перистальтики желудочно-кишечного тракта, было снято с рынка, как сообщалось, по причине сердечных побочных эффектов. Последняя стадия клинических испытаний другого средства, прукалоприда, была приостановлена. Следовательно, существует необходимость в новых агонистах рецептора 5-HT4, которые достигают желаемых эффектов с минимальными побочными эффектами. Предпочтительные средства могут обладать, среди прочего, улучшенной селективностью, активностью, фармакокинетическими свойствами и/или продолжительностью действия. Краткое описание изобретения Настоящее изобретение обеспечивает новые соединения, которые обладают активностью агонистов рецептора 5-HT4. Среди прочих свойств, соединения по настоящему изобретению, как было обнаружено,являются сильными и селективными агонистами рецептора 5-HT4. Соответственно настоящее изобретение обеспечивает соединение формулы (I)Z представляет собой группу формулы (а)X представляет собой углерод и Q выбран из -А-, A(CH2)2N(R4)- и -S(O)2(CH2)2N(R4)- илиX представляет собой азот и Q выбран из -S(O)2CH2C(O)-, -SCH2C(O)-, -OC(O)-, -S(O)2-,-S(O)2(CH2)2-, -A(CH2)2-,G представляет собой W и с имеет значение 0, где W выбран из -NC(O)R9-, -NS(O)2R10-,-NС(O)OR12-, -NC(O)NR13R14-, -NS(O)2NR13R14-, -NR16-, -S(O)2-, -O-, и -S-;X представляет собой углерод илиY представляет собой группу формулы (b)R3 и R4 независимо представляют собой С 1-4 алкил;R6a и R6b независимо представляют собой водород, C5-6 циклоалкил или С 1-4 алкил, где С 1-4 алкил необязательно замещен гидрокси, C1-3 алкокси или циано;R7a и R7b независимо представляют собой водород или C1-4 алкил;R8 представляет собой водород или С 1-4 алкил;R13, R14 и R15 независимо представляют собой водород или C1-4 алкил;R17 представляет собой водород, гидрокси, циано, C1-3 алкил, C1-3 алкокси, -С(O)NR13R14, -CF3, пиролил, пиролидинил, пиридинил, тетрагидрофуранил, -N(R8)С(O)OR12, -ОС(O)NR13R14, -N(R8)S(O)2CH3,-S(O)2NR13R14 или 2-оксоимидазолидин-1-ил, где C1-3 алкокси необязательно замещен гидрокси; при условии, что, когда r имеет значение 0, R17 выбран из водорода, C1-3 алкила и пиридинила и когда r имеет значение 1,R17 представляет собой водород илиR18 представляет собой C1-3 алкил, необязательно замещенный гидрокси; или его фармацевтически приемлемую соль или стереоизомер. Настоящее изобретение также обеспечивает фармацевтическую композицию, включающую соединение по настоящему изобретению и фармацевтически приемлемый носитель. Настоящее изобретение также обеспечивает способ лечения заболевания или состояния, связанного с активностью рецептора 5-HT4, например расстройство пониженной перистальтики желудочнокишечного тракта, при этом способ включает введение млекопитающему терапевтически эффективного количества соединения по настоящему изобретению. Кроме того, настоящее изобретение обеспечивает способ лечения заболевания или состояния, связанного с активностью рецептора 5-HT4 у млекопитающего, при этом способ обеспечивает введение млекопитающему терапевтически эффективного количества фармацевтической композиции, включающей фармацевтически приемлемый носитель и соединение по настоящему изобретению. Соединения по настоящему изобретению также можно использовать в качестве исследовательских инструментов, т.е. для исследования биологических систем или образцов, или для исследования активности других химических соединений. Следовательно, в других аспектах заявленного способа настоящее изобретение обеспечивает способ с использованием соединения формулы (I) или его фармацевтически приемлемой соли, или сольвата, или стереоизомера в качестве исследовательского инструмента для исследования биологической системы или образца или для выявления новых агонистов рецептора 5-HT4,при этом способ включает в себя контактирование биологической системы или образца с соединением по настоящему изобретению и определение эффектов, оказываемых соединением на биологическую систему или образец. В отдельных и особых аспектах настоящее изобретение также обеспечивает способы синтеза и промежуточные соединения, описанные в заявке на изобретение, которые являются полезными для получения соединений по настоящему изобретению. Настоящее изобретение также обеспечивает соединения по настоящему изобретению, описанные в заявке на изобретение, для использования в терапевтическом лечении, а также использование соединения по настоящему изобретению для получения композиции или лекарственного средства для лечения заболевания или состояния, связанного с активностью рецептора 5-HT4, например расстройств понижен-2 013567 ной перистальтики желудочно-кишечного тракта у млекопитающего. Подробное описание изобретения Настоящее изобретение обеспечивает новые хинолинонкарбоксамидные агонисты рецептора 5-HT4 формулы (I) или их фармацевтически приемлемые соли или стереоизомеры. Эти соединения могут содержать один или несколько хиральных центров, и, когда такой хиральный центр или центры присутствуют, настоящее изобретение направлено на рацемические смеси, чистые стереоизомеры и стереоизомерно обогащенные смеси таких изомеров, если не указано иное. Когда указан конкретный стереоизомер, специалисту в данной области должно быть понятно, что могут присутствовать минорные количества других стереоизомеров в композициях по настоящему изобретению, если не указано иное, при условии, что любое использование композиции в целом не ограничивается присутствием таких других изомеров. Соединения по настоящему изобретению также содержат некоторые основные группы (например,аминогруппы), поэтому соединения формулы (I) и их промежуточные соединения могут существовать в различных солевых формах. Все такие солевые формы включены в объем настоящего изобретения. Также в объем настоящего изобретения включены фармацевтически приемлемые соли соединений формулы (I). Примеры вариантов воплощения изобретения Указанные ниже заместители и значения предназначены в качестве репрезентативных примеров и вариантов воплощения различных аспектов настоящего изобретения. Эти репрезентативные значения,кроме того, предназначены для определения таких аспектов и вариантов воплощения изобретения, но они не предназначены для исключения других вариантов воплощения изобретения или ограничения объема настоящего изобретения. В этой связи указание в настоящем описании, что конкретное значение или заместитель являются предпочтительными, ни в коей мере не означает исключение других значений или заместителей из настоящего изобретения, если конкретно не указано иное. В конкретном аспекте R1 представляет собой водород, R2:представляет собой С 3-4 алкил и d имеет значение 0. В конкретном аспекте X представляет собой углерод и Q представляет собой -А- или X представляет собой азот и Q выбран из -ОС(O)-, S(O)2-, -S(O)2(CH2)2- и -А(CH2)2-. В конкретном аспекте X представляет собой углерод и Q выбран из -NC(O)R5-, -NC(O)NR6aR6b-,-NS(O)2 С 1-3 алкил- и -S(O)2N(R7a)- или X представляет собой азот и Q выбран из -ОС(O)-, S(O)2-,-S(O)2(CH2)2-, -S(O)2N(R7a)(CH2)2-, -NC(O)R5(CH2)2- и -NS(O)2 С 1-3 алкил(CH2)2-. В конкретном аспекте G представляет собой W и с имеет значение 0, где W выбран из -NC(O)R9-,-NS(O)2R10-, -NC(O)NR13R14-, -NR16- и -S(O)2- или G представляет собой углерод, с имеет значение 1 и Y представляет собой группу формулы (b), где W' выбран из N(R8)C(O)R9, -N(R8)S(O)2R10, -S(R11)(O)2,-N(R8)С(O)NR13R14, -OR15 и -N(R8)R16. В конкретном аспекте G представляет собой W и с имеет значение 0. В объем настоящего изобретения входят соединения, представленные в табл. 1-5. Химическое название символов, которые использованы, проиллюстрированы для соединения примера 28 которое имеет название [(1R,3R,5S)-8-(2-[2-(4-диметилкарбамоилпиперазин-1-ил)этил]метансульфониламиноэтил)-8-азабицикло[3,2,1]окт-3-ил]амид 1-изопропил-2-оксо-1,2-дигидрохинолин-3 карбоновой кислоты, в соответствии с программой AutoNom software, поставляемой фирмой MDL Information Systems, GmbH (Frankfurt, Germany). Обозначение (1S,3R,5R) указывает относительную ориентацию связей, связывающихся с бициклической кольцевой системой, которые обозначены сплошными или штрихованными клиньями. Соединение имеет альтернативное названиеN-[(3-эндо)-8-(2-[2-(4-диметилкарбамоилпиперазин-1 ил)этил]метансульфониламиноэтил)-8-азабицикло-[3,2,1]окт-3-ил]-1-(1-метилэтил)-2-оксо-1,2-дигидро 3-хинолинкарбоксамид. Во всех соединениях по настоящему изобретению, название которых представлено ниже, хинолинонкарбоксамид присутствует эндо относительно азабициклооктильной группы. В частности, можно указать следующие конкретные соединения:-4 013567 Определения При описании соединений, композиций и способов по настоящему изобретению указанные ниже термины имеют следующие значения, если не указано иное. Термин "алкил" означает одновалентную насыщенную углеводородную группу, которая может быть линейной или разветвленной или представляет собой их сочетание. Примеры конкретных значений для С 1-4 алкильных групп включают в качестве примера метил, этил, н-пропил (n-Pr), изопропил (i-Pr),н-бутил (n-Bu), втор-бутил, изобутил и трет-бутил. Термин "алкилен" означает двухвалентную насыщенную углеводородную группу, которая может быть линейной или разветвленной или представляет собой их сочетание. Примеры конкретных значений для С 2-5 алкилена включают этилен, пропилен изопропилен, бутилен и пентилен и т.п. Термин "алкокси" означает одновалентную группу -О-алкил, где алкил определен выше. Репрезентативные алкоксигруппы включают в качестве примера метокси, этокси, пропокси, бутокси и т.п. Термин "циклоалкил" означает одновалентную насыщенную карбоциклическую группу, которая может быть моноциклической или полициклической. Если не указано иное, такие циклоалкильные группы обычно содержат от 3 до 10 атомов углерода. Репрезентативные С 3-6 циклоалкильные группы включают в качестве пример, циклопропил, циклобутил, циклопентил, циклогексил и т.п. Термин "галоген" означает фтор, хлор, бром или йод. Термин "соединение" означает соединение, которое было получено синтетическим путем или любым другим путем, например в результате метаболизма. Термин "терапевтически эффективное количество" означает количество, достаточное для осуществления лечения при введении пациенту, нуждающемуся в лечении. Термин "лечение", как он используется в настоящем описании, означает лечение заболевания, расстройства или медицинского состояния пациента, такого как млекопитающее (в частности, человек), которое включает:(a) профилактику заболевания, расстройства или медицинского состояния, предотвращая его возникновение, т.е. профилактическое лечение пациента;(b) улучшение состояния заболевания, расстройства или медицинского состояния, т.е. устранение заболевания, расстройства или медицинского состояния пациента или его регрессию;(c) подавление заболевания, расстройства или медицинского состояния, т.е. замедление или приостановление развития заболевания, расстройства или медицинского состояния пациента; или(d) облегчение симптомов заболевания, расстройства или медицинского состояния пациента. Термин "фармацевтически приемлемая соль" означает соль, полученную из кислоты или основания,которая является приемлемой для введения пациенту, такому как млекопитающее. Такие соли можно получить из фармацевтически приемлемых неорганических или органических кислот и из фармацевтически приемлемых оснований. Обычно фармацевтически приемлемые соли соединений по настоящему изобретению получают из кислот. Соли, полученные из фармацевтически приемлемых кислот, включают, но не ограничиваются этим,соли уксусной, бензолсульфоновой, бензойной, камфорсульфоновой, лимонной, этансульфоновой, фумаровой, глюконовой, глутаминовой, бромисто-водородной, соляной, молочной, малеиновой, яблочной,миндальной, метансульфоновой, слизевой, азотной, пантотеновой, фосфорной, янтарной, серной, винной, п-толуолсульфоновой, ксинафойной (1-гидрокси-2-нафтойной кислоты), нафталин-1,5 дисульфоновой кислоты и т.п. Термин "сольват" означает комплекс или агрегат, образованный одной или несколькими молекулами растворяемого вещества, т.е. соединения по настоящему изобретению или его фармацевтически приемлемой соли, и одной или несколькими молекулами растворителя. Такие сольваты обычно представляют собой кристаллические твердые вещества, имеющие, по существу, стабильное молярное отношение растворяемого вещества и растворителя. Репрезентативные растворители включают в качестве примера воду, метанол, этанол, изопропанол, уксусную кислоту и т.п. Когда растворитель представляет собой воду, образуемый сольват представляет собой гидрат. Должно быть понятно, что термин "или его фармацевтически приемлемая соль, или сольват его стереоизомера" включает все варианты сочетаний терминов "соли, сольваты и стереоизомеры", такие как сольват фармацевтически приемлемой соли стереоизомера соединения формулы (I). Термин "удаляемая группа" означает функциональную группу или атом, которые могут быть замещены другой функциональной группой или атомом в реакции замещения, такой как реакция нуклеофильного замещения. В качестве примера репрезентативные удаляемые группы включают галоген, например группы хлора, брома и йода; группы эфиров сульфоновой кислоты, такие как мезилат, тозилат,брозилат, нозилат и т.п.; и ацилоксигруппы, такие как ацетокси, трифторацетокси и т.п. Термин "аминозащитная группа" означает защитную группу, подходящую для предотвращения нежелательных реакций по азоту амино. Репрезентативные аминозащитные группы включают, но не ограничиваются этим, формил; ацильные группы, например алканоильные группы, такие как ацетил; алкоксикарбонильные группы, такие как трет-бутоксикарбонил (Boc); арилметоксикарбонилльные группы,такие как бензилоксикарбонил (Cbz) и 9-флуоренилметоксикарбонил (Fmoc); арилметильные группы,-5 013567 такие как бензил (Bn), тритил (Tr) и 1,1-ди-(4'-метоксифенил)метил; силильные группы, такие как триметилсилил (TMS) и трет-бутилдиметилсилил (TBDMS); и т.п. Термин "гидроксизащитная группа" означает защитную группу, подходящую для предотвращения нежелательных реакций гидроксильной группы. Термин "гидроксилзащитная группа" означает защитную группу, подходящую для предотвращения нежелательных реакций по гидроксильной группе. Репрезентативные гидроксилзащитные группы включают, но не ограничиваются этим, силильные группы, включая три(1-6C)алкилсилильные группы, такие как триметилсилил (TMS), триэтилсилил (TES), трет-бутилдиметилсилил (TBS) и т.п.; сложные эфиры(ацильные группы), включая (1-6 С)алканоильные группы, такие как формил, ацетил и т.п.; арилметильные группы, такие как бензил (Bn), п-метоксибензил (РМВ), 9-флуоренилметил (Fm), дифенилметил(бензгидрил, DPM) и т.п. Кроме того, две гидроксильные группы также могут быть защищены, как алкилиденовая группа, такая как проп-2-илидин, образованная, например, в результате реакции с кетоном,таким как ацетон. Общие методики синтеза. Соединения по настоящему изобретению можно получить из легко доступных исходных веществ с использованием следующих общих способов и методик. Несмотря на то что конкретный аспект настоящего изобретения проиллюстрирован на схемах ниже, специалисту в данной области должно быть понятно, что все аспекты настоящего изобретения можно получить с использованием способов, рассмотренных в настоящем описании или с использованием других способов, реагентов и исходных веществ,известных специалистам в данной области. Также должно быть понятно, что, когда указаны типичные или предпочтительные условия процессов (т.е. температуры реакции, время, мольные отношения реагентов, растворители, давление и т.д.), другие условия процессов также можно использовать, если не указано иное. Оптимальные условия реакций могут варьировать в зависимости от конкретных используемых реагентов или растворителей, но такие условия может определить специалист в данной области методом оптимизации с использованием рутинных методик. Кроме того, как должно быть понятно специалисту в данной области, могут быть необходимы традиционные защитные группы для защиты некоторых функциональных групп от нежелательных реакций,которые имеют место. Выбор подходящей защитной группы для конкретной функциональной группы, а также подходящие условия для введения и удаления защитной группы хорошо известны из области техники. Например, различные защитные группы и их введение и удаление описаны в Т.W. Greene andG.M. Wuts, Protective Groups in Organic Synthesis, Third Edition, Wiley, New York, 1999 и ссылках, указанных в этом документе. Заместители и переменные, показанные на представленных ниже схемах, имеют определение, раскрытое в настоящем изобретении, если не указано иное. В одном способе синтеза соединения формулы (I) получают, как показано на схеме А. Схема А Как показано на схеме А, соединение формулы (III) подвергают взаимодействию с соединением формулы (IV), где L1:представляет собой удаляемую группу, такую как галоген, например хлор, или группу эфира сульфоновой кислоты, такую как мезилат, тозилат, брозилат, нозилат и т.п., с получением соединения формулы (I) или его соли, или сольвата, или стереоизомера. Когда L1 представляет собой удаляемую группу галогена, такого как хлор, реакцию обычно осуществляют контактированием соединения формулы (III) примерно с 1-4 экв. соединения формулы (IV) в инертном разбавителе, таком как N,N-диметилформамид (ДМФА), в присутствии избыточного количества основания, например примерно от 3 до примерно 6 экв. основания, такого как N,Nдиизопропилэтиламин или 1,8-диазабицикло-[5,4,0]ундец-7-ен (DBU), в присутствии катализатора, такого как йодид натрия. Подходящие инертные разбавители также включают ДМФА, дихлорметан, трихлорметан,1,1,2,2-тетрахлорэтан, тетрагидрофуран, метанол, этанол и т.п. Подходящие катализаторы включают,например, йодид натрия, йодид калия и йодид тетрабутиламмония. Реакцию обычно осуществляют при температуре примерно от 15 до примерно 90 С в течение примерно от 4 до примерно 48 ч или до тех пор,пока реакция, по существу, не завершится.-6 013567 Продукт формулы (I) выделяют и очищают, используя традиционные методики. Например, продукт можно концентрировать досуха при пониженном давлении, поглощать в водный, слегка подкисленный раствор и очищать методом ВЭЖХ хроматографии. Альтернативно, соединения формулы (I), где X представляет собой углерод и Q выбран из-А(CH2)2N(R4)- и -S(O)2(CH2)2N(R4)- или X представляет собой азот и Q выбран из -S(O)2(CH2)2- и-А(CH2)2-; можно получить, как показано на схеме В, представленной ниже, с получением соединения формулы (I-а). Схема В Как показано на схеме В, соединение формулы (V), где Q1:выбран из -S(O)2- и -А-, подвергают взаимодействию с H-D, амином соединения формулы (VI), где D выбран из группы формулы (D1) с получением соединения формулы (I-а) или его соли, или сольвата, или стереоизомера. Должно быть понятно, что хотя промежуточное соединение (V) представлено в форме альдегидгидрата, промежуточное соединение (V) может быть равным образом представлено в форме альдегида. На схеме В промежуточное соединение (V) подвергают восстановительному сочетанию с амином формулы (VI) с получением соединения формулы (I-а). Обычно получают раствор примерно от 1 до примерно 3 экв. амина формулы (VI) и восстановителя в инертном разбавителе в присутствии основания, такого как, например, N,N-диизопропилэтиламин или 1,8-диазабицикло-[5,4,0]ундец-7-ен (DBU). Подходящие восстановители, например, включают водород в присутствии катализатора на основе металла ГруппыVIII, такого как палладий на угле или борогидрид, такой как триацетоксиборогидрид натрия, цианоборогидрид натрия, цианоборогидрид лития и т.п. Подходящие инертные разбавители включают ацетонитрил, галогенированные углеводороды, такие как дихлорметан (DCM) и дихлорэтан, спирты, такие как метанол, этанол и изопропиловый спирт, или смеси таких разбавителей. Промежуточное соединение (V) медленно добавляют к смеси амина. Как правило, эту реакцию осуществляют при температуре примерно от 0 до примерно 50 С в течение времени примерно от 10 мин до примерно 12 ч или до тех пор, пока реакция, по существу, не завершится. Продукт реакции затем выделяют, используя традиционные методики, такие как экстракция, перекристаллизация, хроматография и т.п. Альтернативно, соединение формулы (I-а), где Q1 представляет собой -S(O)2-, можно получить взаимодействием промежуточного соединения (V-a) с соединением формулы (VI), с получением соединения формулы (I-а), где Q1 представляет собой-S(O)2-, или его соли или сольвата или стереоизомера.-7 013567 Эту реакцию обычно осуществляют либо в присутствии основания, такого какN,N'-диизопропилэтиламин или неорганические основания, такие как гидроксид натрия и гидроксид калия, когда участвующие в реакции амины предоставляются в форме соли, или в отсутствии основания,когда участвующие в реакции амины предоставляются в нейтральной форме. Как правило, эту реакцию осуществляют в инертном разбавителе, таком как дихлорметан, метанол, этанол, ДМФА или вода, при температуре примерно от 0 до примерно 100 С до тех пор, пока реакция, по существу, не завершится. Продукт реакции затем выделяют с использованием традиционных методик, таких как экстракция, перекристаллизация, хроматография и т.п. Соединение формулы (I-а) также может быть получено взаимодействием промежуточного соединения (V-b) где L2 представляет собой удаляемую группу,с соединением формулы (VI) с получением соединения формулы (I-а). Типичные условия для этой реакции сочетания описаны на схеме А. Альтернативно, соединения формулы (I), где X представляет собой углерод и Q выбран из -А 1- и 1-А (CH2)2N(R4)- или X представляет собой азот и Q выбран из -A1(CH2)2-, где А 1 выбран из -NC(O)R5-,-NC(O)NR6aR6b-, -NS(O)2 С 1-3 алкил- и NS(O)2NR6aR6b-; можно получить, как показано на схеме С,представленной ниже. Схема С Как показано на схеме С, соединение формулы (VII), где Е выбран из группы формулы (Е 1) и группы формулы -CH2CH2-D, где D выбран из группы формулы (D1) и группы формулы (D2); подвергают взаимодействию с соединением формулы (VIII), где L3-Ra представляет собойC1-4 алкилизоцианат или L3 представляет собой удаляемую группу, такую как галоген, п-нитрофенол, или группу эфира сульфоновой кислоты и Ra представляет собой -C(O)R5, -С(O)NR6aR6b, -S(O)2C1-3 алкил или-S(O)2NR6aR6b; с получением соединения формулы (I-b) или его соли, или сольвата, или стереоизомера. Обычно соединение (VII) подвергают контактированию примерно с 1-6 экв. соединения (VIII) в инертном разбавителе, таком как дихлорметан, хлороформ, N-метилпиролидинон, ДМФА или т.п., в присутствии от 2 до 3 экв. основания, такого как N,N-диизопропилэтиламин, триэтиламин, карбонат калия, гидроксид натрия и т.п. Реакцию обычно осуществляют при температуре примерно от 0 до примерно 120 С в течение времени примерно от 10 мин до примерно 24 ч или до тех пор, пока реакция, по существу, не завершится, с получением соединения формулы (I-b).-8 013567 Соединение формулы (III) можно получить, как показано на схеме D. Схема D На схеме D замещенную хинолинонкарбоновую кислоту (1) подвергают взаимодействию с защищенным аминотропаном (2), где Р 1 представляет собой аминозащитную группу, с получением защищенного промежуточного соединения (III-р), у которого затем удаляют защиту с получением соединения формулы (III). Замещенную хинолинонкарбоновую кислоту (1) можно легко получить при помощи методик, аналогичных тем, которые описаны в литературе Suzuki et al., Heterocycles, 2000, 53, 2471-2485 и в примерах ниже. Защищенный аминотропан (2) или аминоазабициклооктан можно получить из легко доступных исходных веществ. Например, когда защитная группа Р 1 представляет собой Boc, защищенный тропан можно получить контактированием 2,5-диметокситетрагидрофурана примерно с 1-2 экв., предпочтительно около 1,5 экв. бензиламина и небольшого избыточного количества, например около 1,1 экв.,1,3-ацетондикарбоновой кислоты в подкисленном водном растворе в присутствии буферного агента, такого как кислый фосфорно-кислый натрий. Реакционную смесь нагревают до температуры примерно от 50 до примерно 100 С для обеспечения декарбоксилирования любых карбоксилированных промежуточных соединений в продукте, 8-бензил-8-азабицикло[3,2,1]октан-3-оне, обычно N-бензилтропанон. Полученный N-бензилтропанон обычно подвергают взаимодействию с небольшим избыточным количеством ди-трет-бутилдикарбоната (обычно указываемого как (Boc)2 О), например около 1,1 экв., в атмосфере водорода в присутствии катализатора на основе переходного металла с получениемBoc-защищенного промежуточного соединения, трет-бутилового эфира 3-оксо-8-азабицикло[3,2,1]октан 8-карбоновой кислоты. Реакцию обычно осуществляют при температуре окружающей среды в течение примерно от 12 до примерно 72 ч. В конце трет-бутиловый эфир 3-оксо-8-азабицикло[3,2,1]октан-8 карбоновой кислоты подвергают контактированию с большим избытком, например по меньшей мере около 25 экв. формиата аммония в инертном разбавителе, таком как метанол, в присутствии катализатора на основе переходного металла с получением промежуточного соединения (2), где Р 1 представляет собойBoc, в эндоконфигурации с высокой стереоспецифичностью, например отношение эндо к экзо 99:1. Реакцию обычно осуществляют при температуре окружающей среды в течение примерно от 12 до примерно 72 ч или до тех пор, пока реакция, по существу, не завершится. Предпочтительно, когда реагентформиат аммония добавляют по порциям. Например, трет-бутиловый эфир 3-оксо-8 азабицикло[3,2,1]октан-8-карбоновой кислоты подвергают контактированию начальной порцией формиата аммония примерно от 15 до примерно 25 экв., с интервалом времени примерно от 12 до примерно 36 ч добавляют еще одну порцию формиат аммония примерно от 5 до примерно 10 экв. Следующее добавление можно повторить с таким же интервалом. Продукт может быть очищен с использованием традиционных методик, таких как щелочная экстракция. Промежуточное соединение (III) можно получить путем сочетания замещенной хинолинонкарбоновой кислоты (1) с защищенным аминотропаном (2) в условиях, аналогичных тем, которые описаны на схеме А для образования амидной связи. Защитную группу Р 1 можно удалить при помощи стандартных методик с получением промежуточного соединения (III). Например, когда защитная группа представляет собой Boc, типичный способ удаления - это обработка кислотой, такой как трифторуксусная кислота, с получением кислотной соли промежуточного соединения. Защитную группу Cbz в качестве еще одного примера удобным образом удаляют гидролизом над подходящим металлическим катализатором, таком как палладий на угле.-9 013567 Промежуточное соединение формулы (IV) можно получить, как показано на схеме Е. Схема Е Как показано на схеме Е, соединение формулы (IV) можно получить взаимодействием амина, промежуточного соединения (4), (6) или (8), с промежуточным соединением (3), (5) или (7) соответственно,содержащим удаляемую группу L4, с получением соединения формулы (IV). Q3 и Q4 определены ниже. Например, соединение формулы (IV), где X представляет собой углерод и Q выбран из-S(O)2CH2C(O)N(R3)-, -S(O)2(CH2)2N(R4)-, -S(O)2N(R7a)-, -OC(O)N(R7b)- и -А(CH2)2N(R4)-, можно получить по схеме E-(i) взаимодействием промежуточного соединения (3), где L1 и L4 представляют собой удаляемые группы и Q3 выбран из -S(O)2CH2C(O)-, -S(O)2(CH2)2-, -S(O)2-, -ОС(O)- и -А(CH2)2-, с промежуточным соединением (4), где Rb выбран из R3, R4, R7a и R7b, которые определены выше; с получением соединения формулы (IV). Аналогично, соединение формулы (IV), где X представляет собой азот и Q выбран из-S(O)2CH2C(O)-, -SCH2C(O)-, -S(O)2-, -S(O)2(CH2)2-, -ОС(O)-, -A(CH2)2-,можно получить по схеме E-(ii) взаимодействием промежуточного соединения (5), где L1 и L4 представляют собой удаляемые группы и Q4 выбран из -S(O)2CH2C(O)-, -SCH2C(O)-, -S(O)2-, -S(O)2(CH2)2-, -ОС(O)-,с промежуточным соединением (6), с получением соединения-А(CH2)2-,формулы (IV). Аналогично, соединение формулы (IV), где X представляет собой углерод и Q представляет собой-А 1-, где А 1 выбран из -NC(O)R5-, -NC(O)NR6aR6b-, -NS(O)2 С 1-3 алкил- и NS(O)2NR6aR6b-; можно получить по схеме E-(iii) взаимодействием промежуточного соединения (7), где L1 и L4 представляют собой удаляемые группы, с промежуточным соединением (8), где Ra представляет собой -C(O)R5,-С(O)NR6aR6b, -S(O)2 С 1-3 алкил или -S(O)2NR6aR6b; с получением соединения формулы (IV). Реакции схемы Е обычно осуществляют в условиях, описанных выше для схемы А, а также проиллюстрированных в примерах, представленных в настоящей описании. Соединение формулы (V) можно получить, как показано на схеме F. Схема F где диметоксиацетальное промежуточное соединение (9) (где Q1 выбран из -S(O)2- и -А-) гидролизуют в водном растворе сильной кислоты, например 3 н. или 6 н. HCl, с получением соединения формулы(V). Хотя промежуточное соединение (V) представлено в форме альдегидгидрата, оно равным образом может быть представлено в форме альдегида. Промежуточное соединение (9-а), представитель промежуточного соединения (9), где а имеет значение 0 и Q1 выбран из -NC(O)R5-, -NC(O)NR6aR6b-, -NS(O)2 С 1-3 алкил- и -NS(O)2NR6aR6b-, можно- 10013567 получить, как показано на схеме G. Схема G Как показано на схеме G, промежуточное соединение (III) подвергают восстановительномуN-алкилированию взаимодействием с диметоксиацетальдегидом с получением промежуточного соединения формулы (10). Эту реакцию обычно осуществляют контактированием промежуточного соединения(III) примерно с 1-4 экв. диметоксиацетальдегида в инертном разбавителе в присутствии основания, такого как N,N'-диизопропилэтиламин, и примерно 1-2 экв. восстановителя. Реакцию обычно осуществляют при температуре окружающей среды в течение примерно от 1 до примерно 2 ч или до тех пор, пока реакция, по существу, не завершится. Подходящие инертные разбавители включают дихлорметан, трихлорметан, 1,1,2,2-тетрахлорэтан и т.п. Типичные восстановители включают триацетоксиборогидрид натрия, борогидрид натрия и цианоборогидрид натрия. Продукт (10) выделяют при помощи стантартных методик. Затем промежуточное диметоксисоединение (10) гидролизуют в водном растворе сильной кислоты,например 3 н. или 6 н. HCl, с получением промежуточного соединения дигидроксиэтила (11). Реакцию обычно осуществляют при температуре примерно от 25 до примерно 100 С в течение времени примерно от 15 мин до примерно 2 ч или до тех пор, пока реакция, по существу, не завершится. Затем промежуточное соединение (11) подвергают восстановительному сочетанию с аминоацетальдегиддиметилацеталем с получением промежуточного соединения (12). Обычно получают раствор примерно от 1 до примерно 2 экв. аминоацетальдегиддиметилацеталя и восстановителя в инертном разбавителе. Промежуточное соединение (11) медленно добавляют к смеси амина. Реакцию обычно осуществляют при температуре окружающей среды в течение около 15 мин до примерно 2 ч или до тех пор, пока реакция, по существу, не завершится. В завершение промежуточное соединение (12) подвергают взаимодействию с соединением формулы (VIII) с получением промежуточного соединения (9-а). Типичные условия для этой реакции описаны на схеме С выше. Соединение формулы (VII) можно получить, как показано на схеме Н. Схема Н путем восстановительного сочетания промежуточного соединения дигидроксиацеталя (11) с промежу- 11013567 точным соединением (13) или (14) с получением соединения формулы (VII). Например, соединение формулы (VII), где Е представляет собой группу формулы (Е 1), можно получить путем восстановительного сочетания промежуточного соединения (11) с промежуточным соединением (14). Тогда как соединение формулы (VII), где Е представляет собой группу формулы -CH2CH2-D, можно получить путем восстановительного сочетания промежуточного соединения (11) с промежуточным соединением (13). Типичные условия для этих реакций описаны выше на схеме В. Соединения формул (VI) и (VIII) и промежуточные соединения (3)-(8), (13) и (14), используемые в реакциях, описанных в изобретении, являются коммерчески доступными или их можно легко получить при помощи стандартных методик из обычных исходных веществ. Дополнительные детали, касающиеся специфических условий реакций, и другие методики для получения репрезентативных соединений по настоящему изобретению или их промежуточных соединений описаны в примерах ниже. Следовательно, настоящее изобретение обеспечивает способ получения соединения формулы (I) где R1, R2, а и Z определены выше для соединения формулы (I),или его фармацевтически приемлемой соли, или сольвата, или стереоизомера, при этом способ включает взаимодействие соединения формулы (III) или его соли или стереоизомера с соединением формулы (IV) где L1 представляет собой удаляемую группу,с получением соединения формулы (I) или его фармацевтически приемлемой соли, или сольвата, или стереоизомера. Настоящее изобретение, кроме того, обеспечивает способ получения соединения формулы (I-а) где Q1 выбран из -S(O)2- и -А- и D выбран из группы формулы (D1) где R1, R2, R4, R18, A, Y, G, a, b, c и d определены выше для соединения формулы (I); или его фармацевтически приемлемой соли, или сольвата, или стереоизомера, при этом способ включает взаимодействие соединения формулы (V) с соединением формулы (VI) с получением соединения формулы (I-а) или его фармацевтически приемлемой соли или сольвата или стереоизомера. Следовательно, настоящее изобретение, кроме того, обеспечивает соединение формулы (I-а). Настоящее изобретение также обеспечивает способ получения соединения формулы (I-b) где Ra представляет собой -C(O)R5, -С(O)NR6aR6b, -S(O)2C1-3 алкил или -S(O)2NR6aR6b и Е выбран из группы формулы (Е 1) и группы формулы -CH2CH2-D, где D выбран из группы формулы (D1) где R1, R2, R4, R5, R6a, R6b, R18, У, G, a, b, с и d определены выше для соединения формулы (I); или его фармацевтически приемлемой соли, или сольвата, или стереоизомера, при этом способ включает взаимодействие соединения формулы (VII) с соединением формулы (VIII) где L3-Ra представляет собой С 1-4 алкилизоцианат или L3 представляет собой удаляемую группу и Ra представляет собой -C(O)R5, -C(O)NR6aR6b, -S(O)2 С 1-3 алкил или -S(O)2NR6aR6b; с получением соединения формулы (I-b) или его фармацевтически приемлемой соли, сольвата или стереоизомера. Кроме того, настоящее изобретение обеспечивает соединение формулы (I-b). Настоящее изобретение также обеспечивает продукты способов, описанных в настоящем изобретении. Фармацевтические композиции. Хинолинонкарбоксамидные соединения по настоящему изобретению обычно вводят пациенту в форме фармацевтической композиции. Такие фармацевтические композиции можно вводить пациенту- 13013567 любым приемлемым путем введения, включая, но не ограничиваясь этим, пероральный, ректальный, вагинальный, назальный при помощи ингаляции, местный (включая чрескожный) и парентеральный пути введения. Следовательно, в одном из аспектов, относящихся к композициям, настоящее изобретение направлено на фармацевтическую композицию, включающую фармацевтически приемлемый носитель или эксципиент и терапевтически эффективное количество соединения формулы (I) или его фармацевтически приемлемой соли. Необязательно, такие фармацевтические композиции могут содержать другие терапевтические средства и/или средства для формулирования композиций, если это желательно. Фармацевтические композиции по настоящему изобретению обычно содержат терапевтически эффективное количество соединения по настоящему изобретению или его фармацевтически приемлемой соли. Обычно такие фармацевтические композиции содержат примерно от 0,1 до примерно 95 мас.%,активного вещества; предпочтительно примерно от 5 до примерно 70 мас.% и более предпочтительно примерно от 10 до примерно 60 мас.% активного вещества. Любой традиционный носитель или эксципиент можно использовать в фармацевтических композициях по настоящему изобретению. Выбор конкретного носителя или эксципиента или сочетаний носителей или эксципиентов зависит от способа введения, используемого для лечения конкретного пациента или типа медицинского состояния или состояния заболевания. Принимая это во внимание, получение подходящей фармацевтической композиции для конкретного способа введения находится в пределах компетенции специалистов в области фармацевтики. Кроме того, ингредиенты для таких композиций являются коммерчески доступными, например от Sigma, P.O. Box 14508, St. Louis, MO 63178. В качестве дополнительной иллюстрации традиционные методы формулирования композиций описаны вRemington: The Science and Practice of Pharmacy, 20th Edition, Lippincott WilliamsWhite, Baltimore,Maryland (2000) and H.C. Ansel et al., Pharmaceutical Dosage forms and Drug Delivery Systems, 7th Edition,Lippincott WilliamsWhite, Baltimore, Maryland (1999). Репрезентативные примеры веществ, которые могут служить в качестве фармацевтически приемлемых носителей, включают, но не ограничиваются этим, следующие: (1) сахара, такие как лактоза, глюкоза и сахароза; (2) крахмалы, такие как кукурузный крахмал и картофельный крахмал; (3) целлюлозу,такую как микрокристаллическая целлюлоза и ее производные, такие как натриевая соль карбоксиметилцеллюлозы, этилцеллюлоза и ацетат целлюлозы; (4) порошкообразный трагакант; (5) солод; (6) желатин;(7) тальк; (8) эксципиенты, такие как масло какао и воски для суппозиториев; (9) масла, такие как арахисовое масло, масло семян хлопчатника, саффлоровое масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло; (10) гликоли, такие как пропиленгликоль; (11) многоатомные спирты, такие как глицерин, сорбит, маннит и полиэтиленгликоль; (12) сложные эфиры, такие как этилолеат и этиллаурат; (13) агар; (14) буферные вещества, такие как гидроксид магния и гидроксид алюминия; (15) альгиновую кислоту; (16) апирогенную воду; (17) изотонический солевой раствор; (18) раствор Рингера; (19) этиловый спирт; (20) фосфатные буферные растворы; и (21) другие нетоксичные, совместимые вещества,используемые в фармацевтических композициях. Фармацевтические композиции по настоящему изобретению обычно получают путем тщательного и тесного смешивания или компаундирования соединения по настоящему изобретению с фармацевтически приемлемым носителем и одним или несколькими необязательными ингредиентами. Если это необходимо или желательно, полученную однородно смешанную смесь можно затем подвергать формованию или загружать в таблетки, капсулы, пилюли и т.п., используя традиционные методики и оборудование. Фармацевтические композиции по настоящему изобретению предпочтительно формируют в стандартную лекарственную форму. Термин "стандартная лекарственная форма" означает физически дискретную единицу, подходящую для дозирования пациенту, т.е. каждая единица содержит определенное количество активного вещества, рассчитанное для получения желаемого терапевтического эффекта, либо отдельно, либо в сочетании с одной или несколькими дополнительными единицами. Например, такие стандартные лекарственные формы могут представлять собой капсулы, таблетки, пилюли и т.п. В предпочтительном варианте воплощения изобретения фармацевтические композиции по настоящему изобретению являются подходящими для перорального введения. Подходящие фармацевтические композиции для перорального введения могут быть в форме капсул, таблеток, пилюль, лепешек, саше,драже, порошков, гранул; или в форме раствора или суспензии в водной или неводной жидкости; или в форме жидкой эмульсии масло-в-воде или вода-в-масле; или в форме эликсира или сиропа; и т.п.; при этом каждая содержит предварительно определенное количество соединения по настоящему изобретению в качестве активного ингредиента. Когда они предназначены для перорального введения в твердой лекарственной форме (т.е. в форме капсул, таблеток, пилюль и т.п.), фармацевтические композиции по настоящему изобретению обычно включают соединение по настоящему изобретению в качестве активного ингредиента и один или несколько фармацевтически приемлемых носителей, таких как цитрат натрия или вторичный кислый фосфат кальция. Необязательно или альтернативно, такие твердые лекарственные формы могут также включать: (1) наполнители или вещества, придающие объем, такие как крахмалы, микрокристаллическая целлюлоза, лактоза, сахароза, глюкоза, маннит и/или кремниевая кислота; (2) связующие, такие как карбок- 14013567 симетилцеллюлоза, альгинаты, желатин, поливинилпиролидон, сахароза и/или аравийская камедь; (3) увлажняющие вещества, такие как глицерин; (4) разрыхлители, такие как агар-агар, карбонат кальция,картофельный или тапиоковый крахмал, альгиновая кислота, некоторые силикаты и/или карбонат натрия; (5) вещества, замедляющие растворение, такие как парафин; (6) ускорители абсорбции, такие как соединения четвертичного аммония; (7) смачивающие вещества, такие как цетиловый спирт и/или глицеринмоностеарат; (8) абсорбенты, такие как каолиновая и/или бентонитовая глина; (9) смазывающие вещества, такие как тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия и/или их смеси; (10) красители; и (11) буферные вещества. Агенты высвобождения, смачивающие вещества, агенты покрытия, подсластители, отдушки и ароматизаторы, консерванты и антиоксиданты также могут присутствовать в фармацевтических композициях по настоящему изобретению. Примеры фармацевтически приемлемых антиоксидантов включают:(1) водорастворимые антиоксиданты, такие как аскорбиновая кислота, цистеингидрохлорид, бисульфат натрия, метабисульфат натрия, сульфит натрия и т.п.;(3) вещества, образующие хелатные комплексы с металлами, такие как лимонная кислота, этилендиаминтетрауксусная кислота (EDTA), сорбит, винная кислота, фосфорная кислота и т.п. Агенты покрытия для таблеток, капсул, пилюль и т.п. включают вещества, используемые для энтеросолюбильных покрытий, такие как ацетатфталатцеллюлоза (САР), поливинилацетат фталат (PVAP),фталат гидроксипропилметилцеллюлозы, сополимеры метакриловой кислоты-эфира метакриловой кислоты, ацетаттримеллитатцеллюлоза (CAT), карбоксиметилэтилцеллюлоза (СМЕС), гидроксипропилметилцеллюлозаацетатсукцинат (HPMCAS) и т.п. Если это желательно, фармацевтические композиции по настоящему изобретению также могут быть сформулированы для получения замедленного или контролируемого высвобождения активного ингредиента с использованием в качестве примера гидроксипропилметилцеллюлозы в различных пропорциях или других полимерных матриц, липосом и/или микросфер. Кроме того, фармацевтические композиции по настоящему изобретению, необязательно, могут содержать вещества, делающие композицию непрозрачной, и могут быть сформулированы таким образом,чтобы активный ингредиент высвобождался только или предпочтительно в определенной области желудочно-кишечного тракта, необязательно, замедленным способом. Примеры используемых веществ, в которые заливают композиции, включают полимерные вещества и воски. Активный ингредиент также может быть в микроинкапсулированной форме, если это является подходящим, с одним или несколькими из описанных выше эксципиентов. Подходящие жидкие лекарственные формы для перорального введения включают в качестве иллюстрации фармацевтически приемлемые эмульсии, микроэмульсии, растворы, суспензии, сиропы и эликсиры. Такие жидкие лекарственные формы обычно включают активный ингредиент и инертный разбавитель, такой как, например, вода или другие растворители, солюбилизирующие вещества и эмульгаторы,такие как этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, масла (такие как, например, масло семян хлопчатника,арахисовое, кукурузное, масло из проростков семян, оливковое, касторовое и кунжутное масла), глицерин, тетрагидрофуриловый спирт, полиэтиленгликоли и эфиры жирных кислот сорбитана, и смеси этих веществ. Суспензии, помимо активного ингредиента, могут содержать суспендирующие вещества, такие как, например, этоксилированные изостеариловые спирты, сложные эфиры полиоксиэтиленсорбита и сорбитана, микрокристаллическая целлюлоза, метагидроксид алюминия, бентонит, агар-агар и трагакант,и смеси этих веществ. Альтернативно, фармацевтические композиции по настоящему изобретению формулируют для введения ингаляцией. Подходящие фармацевтические композиции для введения ингаляцией обычно предоставляются в форме аэрозоля или порошка. Такие композиции, как правило, вводят с использованием хорошо известных устройств для доставки, таких как мерный ингалятор, ингалятор сухого порошка,аэрозольный ингалятор или аналогичное устройство для доставки. При введении ингаляцией с использованием находящегося под давлением контейнера фармацевтические композиции по настоящему изобретению обычно включают активный ингредиент и подходящий пропеллент, такой как дихлордифторметан, трихлорфторметан, дихлортетрафторэтан, диоксид углерода или другой подходящий газ. Кроме того, фармацевтические композиции могут быть в форме капсулы или картриджа (например,выполненных из желатина), которые включают в себя соединение по настоящему изобретению и порошок, подходящий для использования в ингаляторе порошка. Подходящие порошковые основы включают в качестве примера лактозу или крахмал. Соединения по настоящему изобретению также можно вводить чрескожно с использованием известных чрескожных систем доставки и эксципиентов. Например, соединение по настоящему изобретению может быть смешано с веществами, усиливающими его проникновение, такими как пропиленгликоль, полиэтиленгликоль монолаурат, азациклоалкан-2-оны и т.п., и включено в пластырь или аналогич- 15013567 ную систему доставки. В таких чрескожных композициях, если это желательно, можно использовать дополнительные эксципиенты, включая желирующие вещества, эмульгаторы и буферы. Представленные ниже композиции иллюстрируют репрезентативные фармацевтические композиции по настоящему изобретению. Пример композиции А. Твердые желатиновые капсулы для перорального введения получают следующим образом. Репрезентативная методика: ингредиенты тщательно смешивают и затем загружают в твердую желатиновую капсулу (260 мг композиции на капсулу). Пример композиции В. Твердые желатиновые капсулы для перорального введения получают следующим образом. Репрезентативная методика: ингредиенты тщательно смешивают и затем пропускают через сито 45 меш США и загружают в твердую желатиновую капсулу (200 мг композиции на капсулу). Пример композиции С. Капсулы для перорального введения получают следующим образом. Репрезентативная методика: ингредиенты тщательно смешивают и затем загружают в желатиновую капсулу (310 мг композиции на капсулу). Пример композиции D. Таблетки для перорального введения получают следующим образом. Репрезентативная методика: активный ингредиет, крахмал и целлюлозу пропускают через сито 45 меш США и тщательно смешивают. Раствор поливинилпиролидона смешивают с полученными порошками и эту смесь затем пропускают через сито 14 меш США. Полученные гранулы сушат при 50-60 С и пропускают через сито 18 меш США. Затем к гранулам добавляют натрий карбоксиметилкрахмал, стеарат магния и тальк (предварительно пропущенные через сито 60 меш США). После смешивания смесь прессуют на машине для таблетирования с получением таблетки массой 100 мг. Пример композиции Е. Таблетки для перорального введения получают следующим образом.- 16013567 Репрезентативная методика: ингредиенты тщательно смешивают и затем прессуют и формируют в таблетки (440 мг композиции на таблетку). Пример композиции F. Таблетки с насечкой для перорального введения получают следующим образом. Репрезентативная методика: ингредиенты тщательно смешивают и прессуют и формируют в таблетки с насечкой (215 мг композиции на таблетку). Пример композиции G. Суспензию для перорального введения получают следующим образом. Репрезентативная методика: ингредиенты смешивают с образованием суспензии, содержащей 10 мг активного ингредиента на 10 мл суспензии. Пример композиции Н. Сухой порошок для введения ингаляцией получают следующим образом. Репрезентативная методика: активный ингредиент измельчают и затем смешивают с лактозой. Полученную смесь затем загружают в желатиновый картридж для ингаляции. Содержимое картриджа вводят при помощи ингалятора порошка. Пример композиции I. Сухой порошок для введения ингаляцией в мерном ингаляторе получают следующим образом. Репрезентативная методика: суспензию, содержащую 5 мас.% соединения по настоящему изобретению и 0,1 мас.%, лецитина, получают путем диспергирования 10 г активного соединения в виде тонкоизмельченных частиц средним размером менее 10 мкм в растворе, образованном из 0,2 г лецитина, растворенного в 200 мл деминерализованной воды. Суспензию сушат распылением и полученное вещество измельчают до получения частиц, имеющих средний диаметр менее 1,5 мкм. Частицы загружают в картриджи с находящимся под давлением 1,1,1,2-тетрафторэтаном.- 17013567 Пример композиции J. Композицию для инъекций получают следующим образом. Репрезентативная методика: указанные выше ингредиенты смешивают и рН доводят до 4,00,5 при помощи 0,5 н. HCl или 0,5 н. NaOH. Пример композиции K. Капсулы для перорального введения получают следующим образом. Репрезентативная методика: ингредиенты тщательно смешивают и затем загружают в желатиновую капсулу (размер 1, белая, непрозрачная) (264 мг композиции на капсулу). Пример композиции L. Капсулы для перорального введения получают следующим образом. Репрезентативная методика: ингредиенты тщательно смешивают и затем загружают в желатиновую капсулу (размер 1, белая, непрозрачная) (148 мг композиции на капсулу). Должно быть понятно, что любую форму соединений по настоящему изобретению (т.е. свободное основание, фармацевтическую соль или сольват), которая является подходящей для конкретного способа введения, можно использовать в фармацевтических композициях, обсуждаемых выше. Применение. Хинолинонкарбоксамидные соединения по настоящему изобретению являются агонистами рецептора 5-HT4 и поэтому, как ожидается, будут полезными для лечения медицинских состояний, опосредованных рецептором 5-HT4 или связанных с активностью рецептора 5-HT4, т.е. медицинских состояний,которые можно облегчить с использованием агонистов рецептора 5-HT4. Такие медицинские состояния включают, но не ограничиваются этим, синдром раздраженной толстой кишки (IBS), хронические запоры, функциональную диспепсию, замедленное опорожнение желудка, гастроэзофагеальный рефлюкс(GERD), гастропарез, постоперационную непроходимость кишечника, псевдообструкцию кишечника и индуцированное лекарственными средствами замедленное прохождение содержимого по пищеварительному тракту. Кроме того, было сделано предположение, что некоторые соединения-агонисты рецептора 5-HT4 можно использовать для лечения расстройств центральной нервной системы, включая когнитивные расстройства, поведенческие расстройства, расстройства настроения и нарушения контроля автономной функции. В частности, соединения по настоящему изобретению повышают перистальтику желудочнокишечного (GI) тракта и, таким образом, ожидается, что они будут полезными для лечения расстройствGI тракта, вызванных пониженной перистальтикой у млекопитающих, включая человека. Такие нарушения перистальтики GI включают в качестве иллюстрации хронические запоры, синдром раздраженной толстой кишки с преобладающими запорами (C-IBS), диабетический и идиопатический гастропарез и функциональную диспепсию. Поэтому в одном аспекте настоящее изобретение обеспечивает способ повышения перистальтики желудочно-кишечного тракта у млекопитающего, при этом способ включает введение млекопитающему терапевтически эффективного количества фармацевтической композиции, включающей фармацевтически приемлемый носитель и соединение по настоящему изобретению. В другом аспекте настоящее изобретение обеспечивает способ лечения расстройств пониженной перистальтики желудочно-кишечного тракта у млекопитающего, при этом способ включает введение млекопитающему терапевтически эффективного количества фармацевтической композиции, включаю- 18013567 щей фармацевтически приемлемый носитель и соединение по настоящему изобретению. При использовании для лечения расстройств пониженной перистальтики GI тракта или других состояний, опосредованных рецепторами 5-HT4, соединения по настоящему изобретению обычно вводят перорально в разовой суточной дозе или в нескольких дозах в сутки, хотя можно использовать и другие формы введения. Количество активного вещества, вводимого в расчете на дозу, или общее количество,вводимое в сутки, обычно определяет лечащий врач с учетом соответствующих обстоятельств, включая состояние, которое лечат, выбранный путь введения, конкретное вводимое соединение и его соответствующую активность, возраст, вес и ответную реакцию конкретного пациента, тяжесть симптомов у пациента и т.п. Подходящие дозы для лечения расстройств пониженной перистальтики GI тракта или других расстройств, опосредованных рецепторами 5-HT4, находятся в пределах примерно от 0,0007 до примерно 20 мг/кг/день активного вещества, включая примерно от 0,0007 до примерно 1 мг/кг/день. Для человека со средним весом 70 кг это количество составит примерно от 0,05 до примерно 70 мг/день активного вещества. В одном аспекте настоящего изобретения соединения по настоящему изобретению применяют для лечения хронических запоров. При использовании для лечения хронических запоров соединения по настоящему изобретению обычно вводят перорально в разовой суточной дозе или в нескольких дозах в сутки. Предпочтительно доза для лечения хронических запоров, как ожидают, должна находиться в пределах примерно от 0,05 до примерно 70 мг/день. В другом аспекте настоящего изобретения соединения по настоящему изобретению применяют для лечения синдрома раздраженной толстой кишки. При использовании для лечения синдрома раздраженной толстой кишки с преобладающими запорами соединения по настоящему изобретению обычно вводят перорально в разовой суточной дозе или в нескольких дозах в сутки. Предпочтительно доза для лечения синдрома раздраженной толстой кишки с преобладающими запорами должна, как ожидают, находиться в пределах 0,05 до примерно 70 мг/день. В другом аспекте настоящего изобретения соединения по настоящему изобретению применяют для лечения диабетического гастропареза. При использовании для лечения диабетического гастропареза соединения по настоящему изобретению обычно вводят перорально в разовой суточной дозе или в нескольких дозах в сутки. Предпочтительно доза для лечения диабетического гастропареза должна, как ожидают, находиться в пределах примерно от 0,05 до примерно 70 мг/день. Еще в одном аспекте настоящего изобретения соединения по настоящему изобретению применяют для лечения функциональной диспепсии. При использовании для лечения функциональной диспепсии соединения по настоящему изобретению обычно вводят перорально в разовой суточной дозе или в нескольких дозах в сутки. Предпочтительно доза для лечения функциональной диспепсии должна, как ожидают, находится в пределах примерно от 0,05 до примерно 70 мг/день. Настоящее изобретение также обеспечивает способ лечения млекопитающего, страдающего от заболевания или состояния, связанного с активностью рецептора 5-HT4, при этом способ включает введение млекопитающему терапевтически эффективного количества соединения по настоящему изобретению или фармацевтической композиции, включающей соединение по настоящему изобретению. Поскольку соединения по настоящему изобретению являются агонистами рецептора 5-HT4, такие соединения также являются полезными в качестве исследовательских инструментов для исследования или изучения биологических систем или образцов, содержащих рецепторы 5-HT4, или для обнаружения новых агонистов рецептора 5-HT4. Более того, поскольку соединения по настоящему изобретению демонстрируют селективность связывания в отношении рецепторов 5-HT4 по сравнению со связыванием с рецепторами других подтипов 5-HT, конкретно 5-HT3 рецепторами, такие соединения являются, в частности, полезными для исследования эффектов селективного агонизма рецепторов 5-HT4 в биологической системе или образце. В таких исследованиях, которые можно осуществлять либо in vitro или in vivo,можно использовать любую подходящую биологическую систему или образец, содержащие рецепторы 5-HT4. Репрезентативные биологические системы или образцы, подходящие для таких исследований,включают, но не ограничиваются этим, клетки, клеточные экстракты, плазменные мембраны, образцы тканей, млекопитающих (таких как мыши, крысы, морские свинки, кролики, собаки, свиньи и т.д.) и т.п. В этом аспекте настоящего изобретения биологическую систему или образец, включающие рецепторы 5-HT4, подвергают контактированию с агонизирующим 5-HT4 рецептор количеством соединения по настоящему изобретению. Эффекты агонизирующего действия в отношении рецепторов 5-HT4 затем определяют с использованием традиционных методик и оборудования, таких как анализы связывания радиолиганда и функциональные анализы. Такие функциональные анализы включают опосредованные лигандом изменения внутриклеточного циклического аденозинмонофосфата (сАМР), опосредованные лигандом изменения активности фермента аденилилциклазы (которая синтезирует сАМР), опосредованные лигандом изменения включения аналогов гуанозинтрифосфата (GTP), таких как [35S]GTPS (гуанозин 5'О-(-тио)трифосфат) или GTP-Eu, в выделенные мембраны через катализируемый рецептором обменGTP аналогов на GDP аналоги, опосредованные лигандом изменения ионов свободного внутриклеточно- 19013567 го кальция (измеренное, например, с использованием планшет-ридера флуоресцентного изображения,или FLIPR от Molecular Devices, Inc.) и измерения активации митогенактивированной протеинкиназы(MAPK). Соединение по настоящему изобретению может проявлять агонистическое действие или повышать активацию рецепторов 5-HT4 в любом функциональном анализе из перечисленных выше или в аналогичных анализах. Обеспечивающее агонистическое действие в отношении 5-HT4 рецептора количество соединения по настоящему изобретению обычно составляет примерно от 1 до примерно 1000 нмоль. Кроме того, соединения по настоящему изобретению можно использовать в качестве исследовательских инструментов для выявления новых агонистов рецептора 5-HT4. В этом варианте воплощения изобретения данные о связывании с рецепторами 5-HT4 или функциональные данные для испытываемого соединения или группы испытываемых соединений сравнивают с данным связывания с рецепторами 5-HT4 или функциональными данными для соединений по настоящему изобретению для определения тех испытываемых соединений, которые обладают лучшим связыванием или функциональной активностью,если такие имеются. Этот аспект настоящего изобретения включает в качестве отдельных вариантов воплощения изобретения как получение сравнительных данных (с использованием соответствующих анализов), так и анализ данных, полученных в результате испытаний, для выявления представляющих интерес испытываемых соединений. Помимо других свойства, было обнаружено, что соединения по настоящему изобретению являются сильными агонистами рецептора 5-HT4 и обнаруживают существенную селективность в отношении рецепторов 5-HT4 подтипа по сравнению с подтипом 5-HT3 рецепторов в анализе связывания радиолиганда. Кроме того, соединения по настоящему изобретению, которые были испытаны на модели крысы,обычно демонстрировали превосходные фармакокинетические свойства в модели крысы. Таким образом,ожидается, что соединения по настоящему изобретению должны быть биодоступны при пероральном введении. Кроме того, эти соединения обычно, как было показано, демонстрируют приемлемый уровень ингибирования тока ионов калия в in virto модели фиксации потенциала с использованием выделенных цельных клеток, экспрессирующих hERG кардиального калиевого канала. Анализ фиксации потенциала представляет собой одобренный предклинический метод оценки потенциальной возможности фармацевтических средств изменять картину кардиальной реполяризации, конкретно, вызывать так называемуюQT пролонгацию, которую связывают с сердечной аритмией (Cavero et al., Opinion on Pharmacotherapy,2000, 1, 947-73, Fermini et al., Nature Reviews Drug Discovery, 2003, 2, 439-447) Следовательно, фармацевтические композиции, включающие соединения по настоящему изобретению, как ожидают, будут иметь приемлемый кардиальный профиль. Эти свойства, а также применимость соединений по настоящему изобретению можно продемонстрировать с использованием различных in virto и in vivo анализов, хорошо известных специалистам в данной области. Репрезентативные анализы описаны более подробно в представленных ниже примерах. Примеры Представленные ниже примеры синтеза и биологические примеры предназначены для иллюстрации настоящего изобретения и ни в коем случае не должны рассматриваться как ограничивающие объем настоящего изобретения. В представленных ниже примерах следующие аббревиатуры имеют следующие значения, если не указано иное. Аббревиатуры, которые не определены ниже, имеют их обычное принятое значение. Реагенты и растворители закупали у коммерческих поставщиков (Aldrich, Fluka, Sigma и т.д.) и использовали без дополнительной очистки. Реакции осуществляли в атмосфере азота, если не указано иное.- 20013567 За ходом реакции следили при помощи тонкослойной хроматографии (ТСХ), аналитической высокоэффективной жидкостной хроматографии (анал. ВЭЖХ) и масс-спектрометрии, эти методы подробно описываются ниже и отдельно в конкретных примерах реакций. Реакционные смеси обрабатывали, как конкретно описано для каждой реакции; обычно их очищали при помощи экстракции и других методов очистки, таких как зависимые от температуры и растворителя кристаллизация и осаждение. Кроме того, реакционные смеси очищали рутинным способом при помощи препаративной ВЭЖХ: общий протокол описан ниже. Идентификацию продуктов реакции осуществляли рутинным способом при помощи масси 1 Н-ЯМР-спектрометрии. Для измерений методом ЯМР образец растворяли в дейтерированном растворителе (CD3OD, CDCl3 или DMSO-d6) и 1 Н-ЯМР спектры получали при помощи устройства VarianGemini 2000 (300 МГц) в стандартных условиях наблюдения. Масс-спектрометрическую идентификацию соединений осуществляли методом ионизации электроспреем (ESMS) при помощи устройства PerkinElmer (РЕ SCIEX API 150 EX). Общий протокол для аналитической ВЭЖХ Неочищенные соединения растворяли в 50% MeCN/H2O (с 0,1% ТФУ) при концентрации 0,5-1,0 мг/мл и анализировали с использованием следующих условий. Колонка:Zorbax Bonus-RP (размер частиц 3,5 мкм, 2,150 мм) Скорость потока: 0,5 мл/мин Подвижные фазы: 5% MeCN/H2O с 0,1% ТФУ (изократный; 0-0,5 мин); 5% MeCN/H2O с 0,1% ТФУ 75% MeCN/H2O с 0,1% ТФУ (линейный градиент 0,5-4 мин) Длина волны детекции: 214, 254 и 280 нм Другие условия, если их используют, подробно описаны ниже. Общий протокол для препаративной ВЭЖХ очистки Неочищенные соединения растворяли в 50% уксусной кислоте в воде при концентрации 50-100 мг/мл, фильтровали и фракционировали с использованием следующей методики. Колонка:YMC Pack-Pro C18 (50 а 20 мм; в.д.=5 мкм) Скорость потока: 40 мл/мин Подвижные фазы: А=90% MeCN/10% H2O/0,l% ТФУ; В=98% Н 2 О/2% MeCN/0,1% ТФУ Градиент: 10% А/90% В 50% А/50% В в течение 30 мин (линейный) Длина волны детекции: 214 нм Получение вторичных аминов Получение различных вторичных аминов, используемых в качестве промежуточных соединений в синтезе соединений формулы (I), описано ниже. Тиоморфолин-1,1-диоксид получали из тиоморфолина при помощи защиты вторичного амина с получением N-Boc тиоморфолина Boc)2O, МеОН), окисления до сульфона (mCPBA, CH2Cl2, 0 С) и удаления защитной N-Boc группы с получением свободного амина (CF3CO2H, CH2Cl2).N-Сульфонильные производные пиперазина получали из N-Boc пиперазина взаимодействием с соответствующим сульфонилхлоридом (iPr2NEt, CH2Cl2, 0 С) и удалением защитной группы N-Boc(CF3CO2H, CH2Cl2). 1-Метансульфонилпиперазин: 1 Н-ЯМР (CDCl3; нейтральный):(м.д.) 3,1 (т, 4 Н), 2,9 (т, 4 Н), 2,7 (с, 3 Н). 1-(Метилсульфонил)метансульфонилпиперазин: 1 Н-ЯМР (CD3OD):(м.д.) 2,90 (с, 3 Н), 3,02 (м, 4 Н), 3,38 (м, 4 Н), 4,61 (с, 2 Н). Метансульфонилпиперазин также получали взаимодействием метансульфонилхлорида с избыточным количеством пиперазина (2 экв.) в воде. Рацемическую форму или форму отдельного хирального изомера 3-ацетиламинопиролидина получали путем обработки N1-Boc-3-аминопиролидина (рацемат, 3R или 3S) ацетилхлоридом (iPr2NEt,CH2Cl2, 0 С) и удаления защитной группы N-Boc (CF3CO2H, CH2Cl2). 3-(Ацетамидо)пиролидин: 1 Н-ЯМР (DMSO-d6; ТФУ соль):(м.д.) 4,2 (квинт., 1 Н), 3,3-3,1 (м, 3 Н), 2,9 (м, 1 Н), 2,0 (м, 1 Н), 1,8(ушир.с, 4 Н). 3-R)-2-Гидроксипропионамидо)пиролидин получали после амидирования N'-Boc-3-аминопиролидина (L-молочная кислота, РуВОР, ДМФА, КТ) и удаления защитной N-Boc группы (CF3CO2H,CH2Cl2).(3R)-аминопиролидина получали путем обработки 1N -Boc-(3R)-аминопиролидина пропионилсульфонилхлоридом или циклогексилметилсульфонилхлори- 21013567 дом (i-Pr2NEt, CH2Cl2, 0 С) и удаления защитной группы N-Boc (CF3CO2H, CH2Cl2). 3-(N-Ацетил-N-метиламидо)пиперидин получали из N3-Cbz-защищенного трет-бутилового эфира 3-аминопиперидин-1-карбоновой кислоты (De Costa, В., et al. J. Med. Chem. 1992, 35, 4334-43) после четырех стадий синтеза: i) MeI, n-BuLi, ТГФ, -78 С до КТ; ii) H2 (1 атм), 10% Pd/C, EtOH; iii) AcCl,i-Pr2NEt, CH2Cl2; iv) CF3CO2H, CH2Cl2.N3-Алкансульфонильные производные 3-аминопиперидина синтезировали взаимодействием хиральной или рацемической формы трет-бутилового эфира 3-аминопиперидин-1-карбоновой кислоты с соответствующим алкансульфонилхлоридом (i-Pr2NEt, CH2Cl2) и удалением защитной группы N-BocChem. 1961, 26, 4394-9, взаимодействием 3-сульфолена с необходимым первичным амином в метаноле(S)-1,1-Диоксотетрагидро-16-тиофен-3-иламин получали следующим образом: 1) N-Boc-защита (S)-3-тетрагидротиофенамина (Dehmlow, E.V.; Westerheide, R. Synthesis 1992, 10,947-9) обработкой (Boc)2O в метаноле при комнатной температуре в течение около 12 ч; 2) окисление путем обработки при помощи mCPBA в дихлорметане до N-Boc-защищенного (S)-1,1-диоксотетрагидро-16-тиофен-3-иламина при 0 С в течение около 5 ч и 3) удаление защитной группы N-Boc из сульфонового производного при помощи ТФУ в дихлорметане при комнатной температуре в течение 1 ч с получением свободного амина, который выделяли в виде ТФУ соли. (R)-1,1-диоксотетрагидро-16-тиофен-3-иламин получали с использованием такого же способа, но заменяя (S)-3-тетрагидротиофенамин (R)-3-тетрагидротиофенамином.N-производные пиперазина, такие как 1-(метоксикарбонил)пиперазин, 1-(диметиламинокарбонил)пиперазин и 1-(диметиламиносульфонил)пиперазин получали взаимодействием пиперазина с метилхлорформиатом, диметиламинохлорформиатом или диметиламиносульфамоилхлоридом соответственно. 1-Метиламино-2-метилсульфонилэтан получали взаимодействием метиламина с метилвинилсульфоном в метаноле.N-Boc-защищенного этандиамина, после четырех стадий реакций в следующей последовательности:i) метилсульфонилхлорид, триэтиламин; ii) Mel, CS2CO3; iii) NaH, 1-бром-2-метоксиэтан; iv) CF3CO2H. Изонипекотамид (пиперидин-4-карбоксамид) и пролинамид закупали у Aldrich. 2-Гидроксиметилморфолин получали от Tyger Scientific Product. Метил 4-пиперидинилкарбамат получали взаимодействием Ni-Boc-защищенного 4-аминопиперидина с метилхлорформиатом с последующим удалением защитной N-Boc-группы. 4-Пиперидинолдиметилкарбамат и N-диметил-N'-(3-пиперидинил)мочевину получали взаимодействием диметилкарбамоилхлорида с N-Boc-защищенным 4-пиперидинолом или Ni-Boc-3-аминопиперидином соответственно. 3-(Метиламино)-1-(диметиламиносульфонил)пиролидин получали взаимодействием 3-(N-метил-NBoc-аминопиролидина с диметилсульфамоилхлоридом. 2-(3-Пиролидинил)изотиазолидин-1,1-диоксид синтезировали путем обработкиNi-Boc-защищенного 3-аминопиролидина 3-хлорпропилсульфонилхлоридом в присутствии триэтиламина и с последующей обработкой ТФУ для удаления защитной Boc-группы. Пример 1. Синтез метилового эфира (1,1-диоксотетрагидро-16-тиофен-3-ил)-(2-(1S,3R,5R)-3-[(1 изопропил-2-оксо-1,2-дигидрохинолин-3-карбонил)амино]-8-азабицикло[3,2,1]окт-8-илэтил)карбаминовой кислотыa) Получение 8-бензил-8-азабицикло[3,2,1]октан-3-она. Концентрированную соляную кислоту (30 мл) добавляли к гетерогенному раствору 2,5-диметокситетрагидрофурана (82,2 г, 0,622 моль) в воде (170 мл) при перемешивании. В отдельной колбе, охлажденной до 0 С (ледяная баня), к раствору бензиламина (100 г, 0,933 моль) в воде (350 мл) медленно добавляли концентрированную соляную кислоту (92 мл). Раствор 2,5-диметокситетрагидрофурана перемешивали в течение примерно 20 мин, разбавляли водой (250 мл) и затем добавляли раствор бензиламина с последующим добавлением раствора 1,3-ацетондикарбоновой кислоты(100 г, 0,684 моль) в воде (400 мл), а затем добавляли раствор кислого фосфорнокислого натрия (44 г,0,31 моль) в воде (200 мл). рН доводили до 1-4,5 с использованием 40% NaOH. Полученный мутный и бледно-желтый раствор перемешивали в течение ночи. Раствор затем подкисляли до рН 3, исходя из рН 7,5 с использованием 50% раствора соляной кислоты, нагревали до 85 С и перемешивали в течение 2 ч. Раствор охлаждали до комнатной температуры, подщелачивали до рН 12 при помощи 40% раствораNaOH и экстрагировали дихлорметаном (3500 мл). Объединенные органические слои промывали насыщенным солевым раствором, сушили (MgSO4), фильтровали и концентрировали при пониженном давлении с получением неочищенного указанного в заголовке промежуточного соединения в виде вязкого коричневого масла (52 г). К раствору неочищенного промежуточного соединения в метаноле (1000 мл) добавляли ди-третбутилдикарбонат (74,6 г, 0,342 моль) при 0 С. Раствору давали нагреться до комнатной температуры и перемешивали в течение ночи. Метанол удаляли при пониженном давлении и полученное масло растворяли в дихлорметане (1000 мл). Промежуточное соединение экстрагировали в 1 М Н 3 РО 4 (1000 мл) и- 23013567 промывали дихлорметаном (3250 мл). Водный слой подщелачивали до рН 12 при помощи водного раствора NaOH и экстрагировали дихлорметаном (3500 мл). Объединенные органические слои сушили(MgSO4), фильтровали и концентрировали при пониженном давлении с получением указанного в заголовке промежуточного соединения в виде вязкого светло-коричневого масла. 1b) Получение трет-бутилового эфира 3-оксо-8-азабицикло[3,2,1]октан-8-карбоновой кислоты. К раствору 8-бензил-8-азабицикло[3, 2,1]октан-3-она (75 г, 0,348 моль) в EtOAc (300 мл) добавляли раствор ди-трет-бутилдикарбоната (83,6 г, 0,383 моль, 1,1 экв.) в EtOAc (300 мл). Полученный раствор и промывку (100 мл EtOAc) добавляли в 1-литровый аппарат Парра для гидрирования, содержащий 23 г гидроксида палладия (20 мас.%. Pd, в расчете на сухое вещество, на углероде, 50% смоченный водой; например, катализатор Pearlman) в потоке азота. Реакционный сосуд дегазировали (чередуя вакуум и N2 5 раз) и создавали повышенное давление газообразного Н 2 до 60 фунт/кв.дюйм. Реакционный раствор перемешивали в течение 2 дней и снова загружали Н 2 по мере необходимости для поддержания давления Н 2 на уровне 60 фунт/кв.дюйм до тех пор, пока реакция не завершалась, согласно данным тонкослойной хроматографии на силикагеле. Раствор затем фильтровали через слой Целита и концентрировали при пониженном давлении с получением указанного в заголовке промежуточного соединения с количественным выходом в виде вязкого масла цвета от желтого до оранжевого (51 г). Это масло использовали на следующей стадии без дальнейшей обработки. 1 Н-ЯМР (CDCl3):(м.д.) 4,5 (уширенный, 2 Н, CH-NBoc), 2,7 (уширенный, 2 Н, CH2CO), 2,4-2,3 (дд,2 Н, CH2CH2), 2,1 (уширенный м, 2H, CH2CO), 1,7-1,6 (дд, 2 Н, CH2CH2), 1,5 (с, 9 Н, (CH3)3COCON. с) Получение трет-бутилового эфира (1S,3R,5R)-3-амино-8-азабицикло[3,2,1]октан-8-карбоновой кислоты. К раствору продукта предыдущей стадии (75,4 г, 0,335 моль) в метаноле (1 л) добавляли формиат аммония (422,5 г, 6,7 моль), воду (115 мл) и 65 г палладия на активированном угле (10% в расчете на сухое вещество, 50% смоченный водой; Degussa type E101NE/W) в потоке N2 при перемешивании при помощи механической мешалки. Через 24 и 48 ч каждый раз добавляли дополнительные порции формиата аммония (132 г, 2,1 моль). После того как реакция прекращалась, по данным аналитической ВЭЖХ,добавляли Celite (500 г) и полученную густую суспензию фильтровали и затем собранное твердое вещество промывали метанолом (500 мл). Фильтраты объединяли и концентрировали при пониженном давлении до полного удаления метанола. Полученный мутный двухфазный раствор затем разбавляли 1 М фосфорной кислоты до конечного объема от 1,5 до 2,0 л при рН 2 и промывали дихлорметаном (3700 мл). Водный слой подщелачивали до рН 12 с использованием 40% водного раствора NaOH и экстрагировали дихлорметаном (3700 мл). Объединенные органические слои сушили над MgSO4, фильтровали и концентрировали с использованием роторного испарителя, а затем высокого вакуума с получением 52 г(70%) указанного в заголовке промежуточного соединения, обычно N-Boc-эндо-3-аминотропана, в виде твердого вещества цвета от белого до бледно-желтого. Отношение изомеров амина эндо к экзо в продукте составило 99:1 по данным 1 Н-ЯМР анализа (чистота 96% по данным аналитической ВЭЖХ). 1 Н-ЯМР (CDCl3):(м.д.) 4,2-4,0 (ушир. д, 2 Н, CHNBoc), 3,25 (т, 1 Н, CHNH2), 2,1-2,05 (м, 4 Н), 1,9(3,56 мл, 62 ммоль) в воде (2 л) при комнатной температуре добавляли ацетон (228,2 мл, 3,11 моль). Через 4 ч суспензию охлаждали до 0 С и перемешивали еще в течение 2,5 ч, затем фильтровали. Твердое вещество собирали и промывали водой и мокрое твердое вещество охлаждали и сушили при помощи лиофилизации с получением 2,2,-диметил-1,4-дигидро-2 Н-бензо[1,3]оксазина (332,2 г, 98%) в виде не совсем белого твердого вещества. 1 Н-ЯМР (CDCl3; 300 МГц): 1,48 (с, 6 Н, С(CH3)2), 4,00 (ушир.с, 1 Н, NH), 4,86 (с, 2 Н, CH2), 6,66 (д,1 Н, ArH), 6,81 (т, 1H, ArH), 6,96 (д, 1H, ArH), 7,10 (т, 1H, ArH). Раствор 2,2,-диметил-1,4-дигидро-2 Н-бензо[1,3]оксазина (125 г, 0,77 моль) в ТГФ (1 л) фильтровали через сцинтилляционную воронку и затем добавляли по каплям через капельную воронку в течение 2,5 ч к перемешиваемому раствору 1,0 М LiAlH4 в ТГФ (800 мл) при 0 С. Реакцию гасили медленным добавлением по порциям Na2SO410H2O (110 г) в течение 1,5 ч при 0 С. Реакционную смесь перемешивали в течение ночи, фильтровали и твердые соли тщательно промывали при помощи ТГФ. Фильтрат концентрировали при пониженном давлении с получением 2-изопропиламинофенилметанола (120 г, 95%) в ви- 24013567 де желтого масла. 1 Н-ЯМР (CDCl3; 300 МГц): 1,24 (д, 6 Н, CH(CH3)2), 3,15 (ушир.с, 1 Н, ОН), 3,61 (септ., 1 Н, CH(CH3)2),4,57 (с, 2 Н, CH2), 6,59 (т, 1H, ArH), 6,65 (д, 1H, ArH), 6,99 (д, 1H, ArH), 7,15 (т, 1H, ArH). Диоксид марганца (85%, 182,6 г, 1,79 моль) добавляли к перемешиваемому раствору 2-изопропиламинофенилметанола (118 г, 0,71 моль) в толуоле (800 мл) и реакционную смесь нагревали до 117 С в течение 4 ч. Реакционной смеси давали охладиться до комнатной температуры в течение ночи и затем фильтровали через слой целлита и элюировали толуолом. Фильтрат концентрировали при пониженном давлении с получением 2-изопропиламинобензальдегида (105 г, 90%) в виде оранжевого масла. 1 Н-ЯМР (CDCl3; 300 МГц): 1,28 (д, 6 Н, CH(CH3)2), 3,76 (септ., 1 Н, CH(CH3)2), 6,65 (т, 1 Н, ArH), 6,69(д, 1H, ArH), 7,37 (д, 1H, ArH), 7,44 (т, 1H, ArH), 9,79 (с, 1H, CHO). 2,2-Диметил[1,3]диоксан-4,6-дион, обычно называемый кислотой Meldrum (166,9 г, 1,16 моль), добавляли к перемешиваемому раствору 2-изопропиламинобензальдегида (105 г, 0,64 моль), уксусной кислоты (73,6 мл, 1,29 моль) и этилендиамина (43,0 мл, 0,64 моль) в метаноле (1 л) при 0 С. Реакционную смесь перемешивали в течение 1 ч при 0 С, а затем при комнатной температуре в течение ночи. Полученную суспензию фильтровали и твердое вещество промывали метанолом и собирали с получением указанного в заголовке промежуточного соединения, 1-изопропил-2-оксо-1,2-дигидрохинолин-3 карбоновой кислоты (146 г, 98%), в виде твердого вещества не совсем белого цвета. 1 Н-ЯМР (CDCl3; 300 МГц): 1,72 (д, 6 Н, CH(CH3)2), 5,50 (ушир.с, 1 Н, CH(CH3)2), 7,44 (т, 1 Н, ArH),7,75-7,77 (м, 2H, ArH), 7,82 (д, 1H, ArH), 8,89 (с, 1 Н, CH).e) Получение трет-бутилового эфира (1S,3R,5R)-3-[1-изопропил-2-оксо-1,2-дигидрохинолин-3 карбонил)амино]-8-азабицикло[3,2,1]октан-8-карбоновой кислоты. Тионилхлорид (36,6 мл, 0,52 моль) добавляли к перемешиваемой суспензии 1-изопропил-2-оксо 1,2-дигидрохинолин-3-карбоновой кислоты (80 г, 0,35 моль) в толуоле (600 мл) при 85 С и реакционную смесь затем нагревали до 95 С в течение 2 ч. Реакционную смесь охлаждали до комнатной температуры и затем добавляли в течение 25 мин к интенсивно перемешиваемому двухфазному раствору третбутилового эфира (1S,3R,5R)-3-амино-8-азабицикло[3,2,1]октан-8-карбоновой кислоты (78,2 г, 0,35 моль) и гидроксида натрия (69,2 г, 1,73 моль) в толуоле/воде (1:1) (1 л). Через 1 ч слоям давали разделиться и органическую фазу концентрировали при пониженном давлении. Водную фазу промывали EtOAc (1 л),затем (500 мл) и объединенные органические экстракты использовали для растворения концентрированного органического остатка. Этот раствор промывали 1 М H3PO4 (500 мл), насыщенным водным раствором NaHCO3 (500 мл) и насыщенным солевым раствором (500 мл), сушили над MgSO4, фильтровали и концентрировали при пониженном давлении с получением указанного в заголовке промежуточного соединения (127,9 г, примерно 84%) в виде твердого вещества желтого цвета. 1 Н-ЯМР (CDCl3): 1,47 (с, 9 Н), 1,67 (д, 6 Н), 1,78-1,84 (м, 2 Н), 2,04-2,18 (м, 6 Н), 4,20-4,39 (м, 3 Н), 5,65f) Получение (1S,3R,5R)-8-азабицикло[3,2,1]окт-3-иламида 1-изопропил-2-оксо-1,2-дигидрохинолин-3-карбоновой кислоты. К перемешиваемому раствору продукта предыдущей стадии (127,9 г) в CH2Cl2 (600 мл) при 0 С добавляли ТФУ (300 мл). Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 1 ч и затем концентрировали при пониженном давлении. Маслянистый коричневый остаток затем выливали в интенсивно перемешиваемый раствор простого эфира (3 л), и сразу же происходило образование твердого осадка. Суспензию перемешивали в течение ночи и затем твердое вещество собирали фильтрованием и промывали простым эфиром с получением указанного в заголовке промежуточного соединения в форме соли трифторуксусной кислоты (131,7 г, 86% от двух стадий) в виде твердого вещества светло-желтого цвета. 1 Н-ЯМР (CDCl3): 1,68 (д, 6 Н), 2,10 (д, 2 Н), 2,33-2,39 (м, 4 Н), 2,44-2,61 (м, 2 Н), 4,08 (ушир.с, 2 Н),4,41 (м, 1 Н), 5,57 (ушир.с, 1 Н), 7,31 (м, 1 Н), 7,66 (м, 2 Н), 7,77 (д, 1 Н), 8,83 (с, 1 Н), 9,38 (ушир.д, 2 Н),10,78 (д, 1 Н).(5,44 г; 12 ммоль), растворенного в 50 мл дихлорметана. После перемешивания в течение 35 мин при температуре окружающей среды к реакционной смеси добавляли триацетоксиборогидрид натрия (3,7 г; 17,3 ммоль). Через 90 мин к реакционной смеси медленно добавляли воду (50 мл) и насыщенный растворNaHCO3 (100 мл) на ледяной бане для гашения реакции. Смесь разбавляли 500 мл дихлорметана и переносили в делительную воронку. Органический слой собирали и промывали насыщенным растворомNaHCO3 (250 мл) и насыщенным солевым раствором (350 мл). Смесь сушили над MgSO4 и упаривали в вакууме с получением указанного в заголовке промежуточного соединения.(1S,3R,5R)-8-[(2,2-Диметокси)этил]-8-азабицикло[3,2,1]окт-3-иламид 1-изопропил-2-оксо-1,2 дигидрохинолин-3-карбоновой кислоты (5,5 г) суспендировали в 50 мл 6 М соляной кислоты, затем нагревали при 70 С в течение 1 ч. Реакционную смесь охлаждали до 0 С и разбавляли дихлорметаном(100 мл), а затем водный слой подщелачивали путем медленного добавления 6 М NaOH (80 мл). Смесь затем смешивали с 80 мл дихлорметана и переносили в делительную воронку. Органический слой собирали, промывали насыщенным солевым раствором, сушили над MgSO4 и упаривали досуха с получением указанного в заголовке промежуточного соединения в форме альдегидгидрата.(1S,3R,5R)-8-[2-(1,1-диоксотетрагидро-16-тиофен-3-иламино)этил]-8-азабицикло[3,2,1]окт-3-иламида 1-изопропил-2-оксо-1,2-дигидрохинолин-3-карбоновой кислоты. 1,1-Диоксотетрагидро-16-тиофен-3-иламин в форме соли трифторуксусной кислоты (500 мг; 2 ммоль), N,N'-диизопропилэтиламин (0,35 мл) и триацетоксиборогидрид натрия (422 мг; 2 ммоль) добавляли во флакон, содержащий 10 мл дихлорметана. Смесь перемешивали в течение 5 мин, а затем добавляли (1S,3R,5R)-8-[(2,2-дигидрокси)этил]-8-азабицикло[3,2,1]окт-3-иламид 1-изопропил-2-оксо-1,2 дигидрохинолин-3-карбоновой кислоты (0,427 г). Полученную в результате смесь перемешивали в течение 1 ч, после чего реакцию считали завершенной на основании данных ВЭЖХ и массспектрометрического анализа. Медленно добавляли воду (20 мл) для гашения оставшегося в смеси восстановителя. Смесь разбавляли 100 мл дихлорметана и встряхивали в воронке, после чего органический слой собирали. Органический слой промывали 1 М NaOH (40 мл) и насыщенным солевым раствором(50 мл), сушили над MgSO4 и упаривали с получением указанного в заголовке промежуточного соединения в виде бесцветного твердого вещества. Этот неочищенный продукт использовали на следующей стадии без дальнейшей обработки.j) Синтез метилового эфира (1,1-диоксотетрагидро-16-тиофен-3-ил)-(2-(1S,3R,5R)-3-[(1 изопропил-2-оксо-1,2-дигидрохинолин-3-карбонил)амино]-8-азабицикло[3,2,1]окт-8-илэтил)карбаминовой кислоты.N,N'-Диизопропилэтиламин (0,07 мл, 0,4 ммоль) и метилхлорформиат (0,02 мл, 0,26 ммоль) добавляли к раствору ДМФА (1 мл), содержащему продукт предыдущей стадии (1S,3R,5R)-8-[2-(1,1 диоксотетрагидро-16-тиофен-3-иламино)этил]-8-азабицикло[3,2,1]окт-3-иламид 1-изопропил-2-оксо 1,2-дигидрохинолин-3-карбоновой кислоты (65 мг, 0,13 ммоль). Реакционную смесь встряхивали при комнатной температуре в течение 30 мин и концентрировали в вакууме с получением маслянистого остатка. Остаток растворяли в 50% водном растворе уксусной кислоты (1 мл) и очищали препаративной ВЭЖХ с получением указанного в заголовке соединения. Следуя методике, описанной в примере 1, стадия (j), указанное в заголовке соединение получали замещением метилхлорформиата, N,N'-диизопропилэтиламина и ДМФА метилсульфонилхлоридом, DBU и дихлорметаном соответственно. Следуя методике, описанной в примере 1, стадия (j), указанное в заголовке соединение получали замещением метилхлорформиата N,N'-диметилкарбамоилхлоридом. Следуя методике, описанной в примере 1, стадия (j), указанное в заголовке соединени получали замещением метилхлорформиата метилизоцианатом.(m/z): [M+H]+; рассчитано для C28H39N5O5S: 558,27; найдено: 558,2. Время удерживания (анал. ВЭЖХ: 10-40% MeCN/H2O в течение 6 мин) = 2,69 мин. Пример 5. Синтез метилового эфира (1,1-диоксогексагидро-16-тиопиран-4-ил)-(2-(1S,3R,5R)-3[(1-изопропил-2-оксо-1,2-дигидрохинолин-3-карбонил)амино]-8-азабицикло[3,2,1]окт-8-илэтил)карбаминовой кислоты Следуя методике, описанной в примере 1, указанное в заголовке соединение получали замещением 1,1-диоксотетрагидро-16-тиофен-3-иламина, соли трифторуксусной кислоты, в примере 1, стадия (i),1,1-диоксогексагидро-16-тиопиран-4-иламином.(m/z): [M+H]+; рассчитано для C29H40N4O6S: 573,27; найдено: 573,2. Время удерживания (анал. ВЭЖХ: 10-40% MeCN/H2O в течение 6 мин) = 2,70 мин. Пример 6. Синтез метилового эфира R)-1,1-диоксотеатрагидро-16-тиофен-3-ил)-(2-(1S,3R,5R)-3[(1-изопропил-2-оксо-1,2-дигидрохинолин-3-карбонил)амино]-8-азабицикло[3,2,1]окт-8-илэтил)карбаминовой кислоты(R)-1,1-Диоксотетрагидро-16-тиофен-3-иламин в форме соли трифторуксусной кислоты (278 мг; 1,1 ммоль) и триацетоксиборогидрид натрия (254 мг; 1,2 ммоль) добавляли во флакон, содержащий 4 мл дихлорметана. Смесь перемешивали в течение 5 мин перед добавлением (1S,3R,5R)-8-[(2,2 дигидрокси)этил]-8-азабицикло[3,2,1]окт-3-иламида 1-изопропил-2-оксо-1,2-дигидрохинолин-3-карбоновой кислоты (0,420 г; 1,1 ммоль), продукта примера 1 стадии (h). Смесь перемешивали в течение 1 ч,- 27013567 после чего реакцию считали завершенной на основании данных ВЭЖХ и масс-спектрометрического анализа. Медленно добавляли воду (10 мл) для гашения оставшегося восстановителя. Смесь разбавляли 50 мл дихлорметана и встряхивали в воронке, после чего органический слой собирали. Смесь промывали 1 М NaOH (20 мл) и насыщенным солевым раствором (20 мл), сушили над MgSO4 и упаривали с получением указанного в заголовке промежуточного соединения в виде бесцветного твердого вещества. Этот неочищенный продукт использовали на следующей стадии без дополнительной очистки.b) Синтез метилового эфира R)-1,1-диоксотетрагидро-16-тиофен-3-ил)-(2-(1S,3R,5R)-3-[(1 изопропил-2-оксо-1,2-дигидрохинолин-3-карбонил)амино]-8-азабицикло[3,2,1]окт-8-илэтил)карбаминовой кислоты.N,N'-Диизопропилэтиламин (0,38 мл, 2,2 ммоль) и метилхлорформиат (0,11 мл, 1,4 ммоль) добавляли к раствору в ДМФА (1 мл), содержащему 8-(1S,3R,5R)-[2-R)-1,1-диоксотетрагидро-16-тиофен-3 иламино)этил]-8-азабицикло[3,2,1]окт-3-иламид 1-изопропил-2-оксо-1,2-дигидрохинолин-3-карбоновой кислоты (365 мг, 0,73 ммоль), полученный на стадии (а) выше. Реакционную смесь встряхивали при комнатной температуре в течение около 30 мин, затем концентрировали в вакууме с получением маслянистого остатка. Остаток растворяли в 50% водном растворе уксусной кислоты (1 мл) и очищали препаративной ВЭЖХ с получением указанного в заголовке соединения.(m/z): [M+H]+; рассчитано для C28H38N4O6S: 559,27; найдено: 559,4. Время удерживания (анал. ВЭЖХ: 10-40% MeCN/Н 2 О в течение 6 мин) = 2,56 мин. Пример 7. Синтез метилового эфира S)-1,1-диоксотетрагидро-16-тиофен-3-ил)-(2-(1S,3R,5R)-3[(1-изопропил-2-оксо-1,2-дигидрохинолин-3-карбонил)амино]-8-азабицикло[3,2,1]окт-8-илэтил)карбаминовой кислоты(m/z): [M+H]+; рассчитано для C28H38N4O6S: 559,27; найдено: 559,4. Время удерживания (анал. ВЭЖХ: 10-40% MeCN/H2O в течение 6 мин) = 2,56 мин. Пример 8. Синтез метилового эфира (1,1-диоксотетрагидро-16-тиофен-3-ил)-(3-(1S,3R,5R)-3-[(1 изопропил-2-оксо-1,2-дигидрохинолин-3-карбонил)амино]-8-азабицикло[3,2,1]окт-8-илпропил)карбаминовой кислотыN,N'-Диизопропилэтиламин (15,7 мл, 90 ммоль) и N-Boc-3-бромпропанамин (14,2 г, 60 ммоль) добавляли к раствору (1S,3R,5R)-8-азабицикло[3,2,1]окт-3-иламида 1-изопропил-2-оксо-1,2-дигидрохинолин-3-карбоновой кислоты, в форме моно-соли трифторуксусной кислоты (13,6 г; 30 ммоль) (продукт примера 1 стадии (f, растворенного в 120 мл метанола. Смесь нагревали при температуре кипения с обратным холодильником в течение 16 ч с последующим добавлением второй порции N-Boc-3 бромпропанамина (7 г, 30 ммоль). Смесь нагревали при температуре кипения с обратным холодильником еще в течение 16 ч, концентрировали в вакууме и очищали колоночной флэш-хроматографией (элюент 10% MeOH/CH2Cl2). Продукт растворяли в дихлорметане (50 мл), затем добавляли трифторуксусную кислоту (50 мл). После перемешивания при комнатной температуре в течение 30 мин раствор концентрировали в вакууме и полученный остаток суспендировали в простом эфире (200 мл). Отвержденный остаток собирали фильтрованием с получением указанного в заголовке промежуточного соединения в виде ТФУ-соли, которую преобразовывали в нейтральную форму путем растворения соли в дихлорметане с последующей промывкой водным раствором NaOH.b) Получение 8-(1S,3R,5R)-[3-(l,1-диоксотетрагидро-16-тиофен-3-иламино)пропил]-8-азабицикло[3,2,1]окт-3-иламида 1-изопропил-2-оксо-1,2-дигидрохинолин-3-карбоновой кислоты. Гидроксид калия (3 мг), растворенный в воде (0,1 мл) и 2,5-дигидротиофен-1,1-диоксиде (0,236 г,2 ммоль), добавляли к раствору [8-(1S,3R,5R)-(3-аминопропил)-8-азабицикло-[3,2,1]окт-3-ил] амида 1-изопропил-2-оксо-1,2-дигидрохинолин-3-карбоновой кислоты (свободное основание; 0,16 г, 0,4 ммоль) в ДМФА (1 мл). Смесь перемешивали при 75 С в течение 16 ч в атмосфере азота. Упаривание в вакууме давало указанное в заголовке промежуточное соединение, которое использовали на следующей стадии без дополнительной очистки.c) Синтез метилового эфира (1,1-диоксотетрагидро-16-тиофен-3-ил)-(3-(1S,3R,5R)-3-[(1 изопропил-2-оксо-1,2-дигидрохинолин-3-карбонил)амино]-8-азабицикло[3,2,1]окт-8-илпропил)карбаминовой кислоты.N,N'-диизопропилэтиламин (0,28 мл, 1,6 ммоль) и метилхлорформиат (75 мг, 0,8 ммоль) добавляли к раствору 8-(1S,3R,5R)-[3-(1,1-диоксотетрагидро-16-тиофен-3-иламино)пропил]-8-азабицикло[3,2,1]окт 3-иламида 1-изопропил-2-оксо-1,2-дигидрохинолин-3-карбоновой кислоты (0,206 г, 0,4 ммоль), растворенного в ДМФА (2 мл). Реакционную смесь перемешивали при комнатной температуре в течение около 30 мин, затем концентрировали в вакууме. Остаток растворяли в 50% водном растворе уксусной кислоты(1 мл) и очищали препаративной ВЭЖХ с получением указанного в заголовке соединения.a) Получение [(1S,3R,5R)-8-(2-этансульфонилэтил)-8-азабицикло[3,2,1]окт-3-ил]амида 1-изопропил 2-оксо-1,2-дигидрохинолин-3-карбоновой кислоты. Винилсульфон (1,1 г, 9,32 ммоль) добавляли по каплям к перемешиваемому раствору дихлорметана(1S,3R,5R)-8-азабицикло[3,2,1]окт-3-иламид 1-изопропил-2-оксо-1,2 дигидрохинолин-3-карбоновой кислоты (1,58 г, 4,64 ммоль), продукт примера 1 стадии (f). Реакционную смесь перемешивали при комнатной температуре в течение ночи, затем концентрировали в вакууме с получением указанного в заголовке промежуточного соединения в виде маслянистого остатка, который использовали на следующей стадии без дополнительной очистки.b) Синтез 1S,3R,5R)-8-2-[2-(4-метансульфонилпиперазин-1-ил)этансульфонил]этил-8-азабицикло[3,2,1]окт-3-ил)амида 1-изопропил-2-оксо-1,2-дигидрохинолин-3-карбоновой кислоты. 1-Метилсульфонилпиперазин (656 мг, 0,4 ммоль) добавляли к раствору [(1S,3R,5R)-8-(2 этансульфонилэтил)-8-азабицикло [3,2,1]окт-3-ил]амида 1-изопропил-2-оксо-1,2-дигидрохинолин-3 карбоновой кислоты (45 мг, 0,1 ммоль) в 1 мл дихлорметана. Реакционную смесь встряхивали при комнатной температуре в течение ночи и концентрировали в вакууме с получением маслянистого остатка. Остаток растворяли в 50% водном растворе уксусной кислоты (1 мл), затем очищали препаративной ВЭЖХ с получением указанного в заголовке соединения. Указанное в заголовке соединение получали с использованием способа, описанного в примере 9,замещением в примере 9, стадия (b), 1-метилсульфонилпиперазина пиперазин-1-ил-(тетрагидрофуран-2 ил)метаноном. Указанное в заголовке соединение получали с использованием способа, описанного в примере 9,замещением в примере 9, стадия (b), 1-метилсульфонилпиперазина 1-этилсульфонилпиперазином.N,N'-Диизопропилэтиламин (0,10 мл, 6 ммоль), а затем 3-хлорпропил-1-сульфонилхлорид (53,1 мг,0,3 ммоль) добавляли в 5-мл стеклянный флакон, содержащий N-ацетилпиперазин (38 мг, 0,3 ммоль),растворенный в дихлорметане (1 мл). Реакционную смесь встряхивали при комнатной температуре в течение около 0,5 ч, затем упаривали в вакууме с получением указанного в заголовке промежуточного соединения в виде маслянистого остатка, который использовали без дальнейшей обработки.(45,3 мг, 0,1 ммоль) добавляли к продукту предыдущей стадии, растворенному в ДМФА (1 мл). Смесь встряхивали при 85 С в течение 24 ч, затем концентрировали в вакууме. Концентрированный остаток растворяли в 50% водном растворе уксусной кислоты (1 мл), затем очищали препаративной ВЭЖХ с получением указанного в заголовке соединения. Указанное в заголовке соединение получали с использованием способа, описанного в примере 12,замещением в примере 12, стадия (а), N-ацетилпиперазина пиперазин-1-ил-(тетрагидрофуран-2 ил)метаноном.
МПК / Метки
МПК: A61K 31/496, A61K 31/541, A61P 1/00, A61K 31/5355, C07D 451/04, A61K 31/4709
Метки: соединения, хинолиноновые, рецептора, качестве, агонистов, 5-ht4
Код ссылки
<a href="https://eas.patents.su/30-13567-hinolinonovye-soedineniya-v-kachestve-agonistov-receptora-5-ht4.html" rel="bookmark" title="База патентов Евразийского Союза">Хинолиноновые соединения в качестве агонистов рецептора 5-ht4</a>












