Пиримидиноновые соединения для применения в лечении заболеваний или состояний, опосредованных lp-pla2
Формула / Реферат
1. Соединение формулы (I) или его фармацевтически приемлемая соль
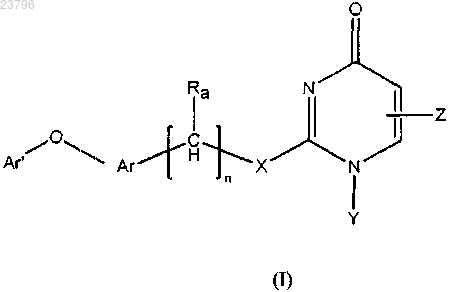
где n равно 1, 2 или 3;
X представляет собой CH2, О, S, NH или N-(C1-C6-алкил);
Y представляет собой Н, C1-C6-алкил или C3-C6-циклоалкил;
Z представляет собой Н, C1-C6-алкил, C1-C6-галогеналкил, -CH2-фенил, -CH2-гетероарил, -(CH2)2C(=O)-OCH3, -CH2-гетероциклоалкил, -CH2COOH или -CH2C(=O)-гетероциклоалкил, где фенил, гетероарил или гетероциклоалкил могут быть необязательно замещены одним или более заместителями, независимо выбранными из группы, состоящей из C1-C6-алкила, C1-C6-алкоксила, C1-C3-галогеналкила, CN, галогена и -OH;
Ra представляет собой водород или C1-C3-алкил;
Ar представляет собой фенил или гетероарил, который представляет собой 6-членную моноциклическую кольцевую систему, каждый из которых необязательно замещен одним или более заместителями, независимо выбранными из группы, состоящей из CN, галогена, C1-C6-алкила, C1-C6-алкокси и C1-C6-галогеналкила; и
Ar' представляет собой фенил или гетероарил, любой из которых необязательно замещен одним или более заместителями, независимо выбранными из группы, состоящей из CN, галогена, C1-C6-алкила, C1-C6-алкокси, C1-C6-галогеналкила, -O-C1-С6-галогеналкила;
гетероциклоалкил представляет собой насыщенную или ненасыщенную 4-8-членную моноциклическую кольцевую систему или 7-11-членную бициклическую кольцевую систему, содержащие 1-4 гетероатома в кольце;
гетероарил представляет собой моноциклическое или бициклическое ароматическое кольцо, содержащее 1-4 различных гетероатома в кольце,
при условии, что, когда X представляет собой S и Z представляет собой C1-C6-алкил, Ar' не является незамещенным фенилом,
и исключения соединения
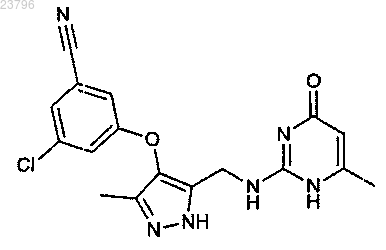
2. Соединение по п.1, где
n равно 1 или 2;
X представляет собой CH2, О, S, NH или NCH3;
Y представляет собой Н или C1-C3-алкил;
Z представляет собой Н, C1-C3-алкил, C1-C3-галогеналкил, -CH2-фенил, -CH2-гетероарил, (CH2)2С(=O)-OCH3, -CH2-гетероциклоалкил, -CH2COOH, -CH2C(=O)-гетероциклоалкил, где фенил, гетероарил или гетероциклоалкил необязательно замещены одним или более заместителями, независимо выбранными из группы, состоящей из C1-C6-алкила, C1-C6-алкоксила, C1-C3-галогеналкила, CN, галогена и -OH;
Ra представляет собой водород или CH3;
Ar представляет собой фенил, необязательно замещенный одним или более заместителями, независимо выбранными из группы, состоящей из CN, галогена, C1-C6-алкила, C1-C6-алкокси и CF3; и
Ar' представляет собой фенил или гетероарил, любой из которых необязательно замещен одним или более заместителями, независимо выбранными из группы, состоящей из CN, галогена, C1-C6-алкила, C1-C6-алкокси, C1-C6-галогеналкила и -O-C1-С6-галогеналкила.
3. Соединение по п.1 или 2, где n равно 2.
4. Соединение по любому из пп.1-3, где X представляет собой O.
5. Соединение по любому из пп.1-4, где Y представляет собой Н или CH3.
6. Соединение по любому из пп.1-5, где Z представляет собой -CH2-пиримидинил, замещенный одним заместителем, выбранным из CH3 или OCH3.
7. Соединение по любому из пп.1-6, где Ra представляет собой водород.
8. Соединение по любому из пп.1-7, где Ar представляет собой незамещенный фенил.
9. Соединение по любому из пп.1-8, где Ar' представляет собой фенил, замещенный Cl и CF3.
10. Соединение по п.1, где соединение имеет структуру формулы (IA), или его фармацевтически приемлемые соли:
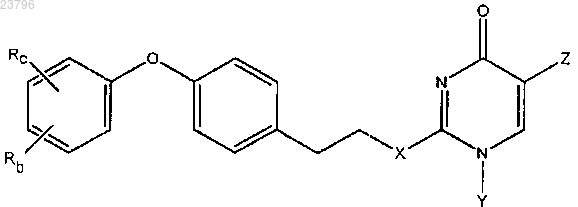
где Z представляет собой -CH2-пиримидинил, где пиримидинил необязательно замещен одним OCH3;
X представляет собой О;
Y представляет собой Н;
Rc и Rb независимо представляют собой галоген или CF3.
11. Соединение по п.1, где соединение имеет структуру
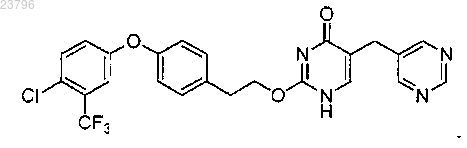
или его фармацевтически приемлемая соль.
12. Соединение по п.1, где соединение имеет структуру
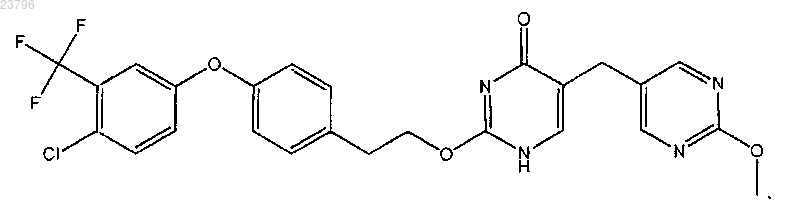
или его фармацевтически приемлемая соль.
13. Фармацевтическая композиция для лечения заболевания, связанного с активностью Lp-PLA2, содержащая соединение формулы (I) по любому из пп.1-12 и фармацевтически приемлемый носитель.
14. Способ лечения болезни Альцгеймера у субъекта, включающий введение нуждающемуся в лечении субъекту безопасного и эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли по любому из пп.1-12.
15. Способ лечения атеросклероза у субъекта, включающий введение нуждающемуся в лечении субъекту безопасного и эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли по любому из пп.1-12.
Текст
ПИРИМИДИНОНОВЫЕ СОЕДИНЕНИЯ ДЛЯ ПРИМЕНЕНИЯ В ЛЕЧЕНИИ ЗАБОЛЕВАНИЙ ИЛИ СОСТОЯНИЙ, ОПОСРЕДОВАННЫХ Lp-PLA2 Изобретение относится к новым соединениям, которые ингибируют Lp-PLA2 активность, способам их получения, содержащим их композициям и их применению для лечения заболеваний, связанных с активностью Lp-PLA2, например атеросклероза, болезни Альцгеймера и/или диабетического отека желтого пятна.(71)(73) Заявитель и патентовладелец: ГЛЭКСО ГРУП ЛИМИТЕД (GB) Родственные заявки По заявке на данное изобретение испрашивается приоритет РСТ международной заявкиPCT/CN2010/079465, поданной 6 декабря 2010 г. в Государственное Ведомство по интеллектуальной собственности Народной Республики Китай, полное содержание которой включено в настоящее изобретение с помощью ссылки. Область техники, к которой относится настоящее изобретение Настоящее изобретение относится к новым пиримидиноновым соединениям, способам их получения, промежуточным соединениям, пригодным для их получения, содержащим их фармацевтическим композициям и их применению в терапии для лечения заболеваний или состояний, опосредованныхLp-PLA2. Уровень техники настоящего изобретения Липопротеин-ассоциированная фосфолипаза A (Lp-PLA2), ранее известная как ацетилгидролаза фактора активации тромбоцитов (PAF-AH), представляет собой фермент, фосфолипазу А 2, участвующий в гидролизе липидов липопротеинов или фосфолипидов. Lp-PLA2 перемещается с липопротеином низкой плотности (LDL) и быстро расщепляет окисленные фосфатидилхолиновые молекулы, полученные в результате окисления LDL (см., например, Zalewski A., et al., Arterioscler. Thromb. Vase. Biol., 25, 5, 92331(2005. Lp-PLA2 гидролизует sn-2 эфир окисленных фосфатидилхолинов, давая липидные медиаторы,лизофосфатидилхолин (LysoPC) и окисленные неэтерифицированные жирные кислоты (NEFA). Наблюдали, что LysoPC и NEFA вызывают воспалительный ответ (см., например, Zalewski A., et al. (2005. Ряд Lp-PLA2 ингибиторов и/или их применение описывали ранее (см., например, опубликованные патентные заявкиWO 96/13484, WO 96/19451, WO 97/02242, WO 97/12963, WO 97/21675,WO 97/21676, WO 97/41098, WO 97/41099, WO 99/24420, WO 00/10980, WO 00/66566, WO 00/66567,WO 00/68208, WO 01/60805, WO 02/30904, WO 02/30911, WO 03/015786, WO 03/016287, WO 03/041712,WO 03/042179, WO 03/042206, WO 03/042218, WO 03/086400, WO 03/87088, WO 08/048867,US 2008/0103156, US 2008/0090851, US 2008/0090852 и WO 08/048866). Описанные применения включают лечение заболевания, которое включает или связано с эндотелиальной дисфункцией, заболевания,которое включает окисление липидов в связи с Lp-PLA2 активностью (например, связанного с образованием лизофосфатидилхолина и окисленных свободных жирных кислот), и заболевания, которое включает активированные моноциты, макрофаги или лимфоциты или которое связано с повышенной вовлеченностью моноцитов, макрофагов или лимфоцитов. Примеры конкретных заболеваний или состояний включают атеросклероз (например, периферический васкулярный атеросклероз и цереброваскулярный атеросклероз), диабет, гипертензию, стенокардию после ишемии и реперфузии, ревматоидный артрит,инсульт, воспалительные заболевания мозга, такие как болезнь Альцгеймера, различные нейропсихиатрические расстройства, такие как шизофрения, инфаркт миокарда, ишемия, реперфузионное повреждение, сепсис, острое и хроническое воспаление и псориаз. Lp-PLA2 ингибиторы и/или их применение также описывают, например, в РСТ публикацияхWO 05/003118 (и его канадский член семейства СА 2530816 А 1); WO 06/063811; WO 06/063813 и WO 2008/141176; JP 200188847 и опубликованных патентных заявкахUS 2008/0279846 A1, US 2010/0239565 А 1 и US 2008/0280829 A1. Другие исследователи исследовали эффекты, связанные с Lp-PLA2 и его ингибиторами. Например,данные исследования также показали, что LysoPC способствует развитию атеросклеротических бляшек,которые могут, в конце концов, приводить к образованию некротического ядра (см., например, Wilenskyet al., Current Opinion in Lipidology, 20, 415-420 (2009. Кроме того, влияние Lp-PLA2 ингибиторов на состав склеротических бляшек продемонстрировано в диабетической и гиперхолестеринемической модели на свиньях ускоренного коронарного атеросклероза (см., например, Wilensky et al., Nature Medicine,10, 1015-1016 (2008. Данные результаты исследований дают дополнительные доказательства того, чтоLp-PLA2 ингибиторы можно применять для лечения атеросклероза. Дополнительные исследования обнаружили, что высокая Lp-PLA2 активность связана с высоким риском деменции, включая болезнь Альцгеймера (AD) (см., например, Van Oijen, et al. Annals ofNeurology, 59, 139 (2006. Высокие концентрации окисленного LDL также наблюдались у AD пациентовAssoc Disord, 24, April-June (2010); Sinem, et al. Current Alzheimer Research, 7, 463-469 (2010. Кроме того, данные исследований показали, что нейровоспаление присутствует у AD пациентов, и многочисленные цитотоксические воспалительные цитокины активируются у AD пациентов (см., например,Colangelo, et al., Journal of Neuroscience Research, 70, 462-473 (2002); Wyss-Coray, Nature Medicine, 12,Sept. (2006. Исследование показало, что LysoPC функционирует как провоспалительный фактор, высвобождающий многочисленные цитотоксические воспалительные цитокины (см. Shi, et al. Atherosclerosis, 191, 54-62 (2007. Следовательно, данные недавние исследования дают дополнительные доказательства того, что ингибиторы Lp-PLA2 можно применять для лечения AD ингибированием активностиLp-PLA2 и снижением LysoPC продуцирования. Кроме того, обработка Lp-PLA2 ингибитором в диабетической и гиперхолестеринемической модели на свиньях показала, что утечка через гематоэнцефалический барьер и белковые бета-амилоидные (А) бляшки в мозге, патологические признаки болезни Альцгеймера, ослабляются (см. опубликованную па-1 023796 тентную заявку 2008/0279846). Данная публикация описывает несколько применений Lp-PLA2 ингибиторов для лечения заболеваний, связанных с утечкой через гематоэнцефалический барьер, включая,например, болезнь Альцгеймера и васкулярную деменцию. Кроме того, нейровоспаление, включая высвобождение многочисленных цитотоксических воспалительных цитокинов, является общей особенностью всех нейродегенеративных заболеваний, включая множественный склероз, амиотрофический латеральный склероз, болезнь Паркинсона, болезнь Альцгеймера и т.д. (см., например, Perry, Acta Neuropathol, 120, 277-286 (2010. Как обсуждалось выше,Lp-PLA2 ингибиторы могут ослаблять воспаление, например ослабляя высвобождение многочисленных цитокинов подавлением LysoPC продуцирования (см., например, Shi, et al. Atherosclerosis 191, 54-62(2007. Таким образом, ингибирование Lp-PLA2 является потенциальным терапевтическим лечением нейродегенеративных заболеваний, включая множественный склероз, амиотрофический латеральный склероз, болезнь Паркинсона и т.д. В добавление к воспалительному эффекту, LysoPC вовлечен в активацию лейкоцитов, индукцию апоптоза и регулирование эндотелиальной дисфункции (см., например, Wilensky et al., Current Opinion inLipidology, 20, 415-420 (2009. Следовательно, считают, что Lp-PLA2 ингибиторы можно применять для лечения повреждения ткани, связанной с диабетом, снижением продуцирования LysoPC, которое может вызывать непрерывный цикл васкулярного воспаления и усиливать продуцирование активных форм кислорода (ROS). В свете воспалительной роли Lp-PLA2 и связи между локализованными процессами воспаления и диабетической ретинопатией, постулируют, что Lp-PLA2 можно применять для лечения диабетического заболевания глаз. Глаукома и возрастная макулярная дегенерация (AMD) представляют собой нейродегенеративные заболевания сетчатки. Исследования указывают на то, что воспаление, включая TNF-альфа индукцию,может играть важную роль в патогенезе глаукомы и AMD (см., например, Buschini et al., Progress inNeurobiology, 95, 14-25 (2011); Tezel, Progress in Brain Research, vol. 173, ISSN0079-6123, Chapter 28). Таким образом, рассматривая функцию Lp-PLA2 ингибиторов, блокирующую высвобождение воспалительных цитокинов (см., например, Shi, et al. Atherosclerosis, 191, 54-62 (2007, считают, что Lp-PLA2 ингибиторы могут обеспечивать потенциальное терапевтическое применение и для глаукомы, и для AMD. Принимая во внимание ряд патологических ответов, которые опосредованы Lp-PLA2, попытались получить соединения, которые ингибируют его активность. Хотя ряд данных соединений описан на предшествующем уровне техники, остается постоянная необходимость в ингибиторах Lp-PLA2, которые можно применять в лечении ряда заболеваний. Сущность настоящего изобретения В первом аспекте настоящее изобретение относится к соединению формулы (I)Z представляет собой Н, C1-C6-алкил, C1-C6-галогеналкил, -CH2-фенил, -CH2-гетероарил,-(CH2)2C(=O)-OCH3, -CH2-гетероциклоалкил, -CH2COOH, -CH2C(=O)-гетероциклоалкил, где фенил, гетероарил или гетероциклоалкил необязательно замещены одним или более заместителями, независимо выбранными из группы, состоящей из C1-C6-алкила, C1-C6-алкоксила, C1-C3-галогеналкила, CN, галогена иRa представляет собой водород или C1-C3-алкил;Ar представляет собой фенил или гетероарил, любой из которых необязательно замещен одним или более заместителями, независимо выбранными из группы, состоящей из CN, галогена, C1-C6-алкила,C1-C6-алкокси и C1-C6-галогеналкила; иAr' представляет собой фенил или гетероарил, любой из которых необязательно замещен одним или более заместителями, независимо выбранными из группы, состоящей из CN, галогена, C1-C6-алкила,C1-C6-алкоки, C1-C6-галогеналкила и -O-C1-С 6-галогеналкила; и при условии, что, когда X представляет собой S, и Z представляет собой C1-C6-алкил, Ar' представляет собой незамещенный фенил. Настоящее изобретение также относится к фармацевтическим композициям, содержащим соединение настоящего изобретения и фармацевтически приемлемые носители. Настоящее изобретение также относится к способам лечения заболевания, связанного с активностью Lp-PLA2, которые включают лечение нуждающегося в лечении субъекта терапевтически эффективным количеством ингибитора Lp-PLA2. Заболевание может быть связано с повышенной вовлеченностью-2 023796 моноцитов, макрофагов или лимфоцитов; с образованием лизофосфатидилхолина и окисленных свободных жирных кислот; с окислением липидов в сочетании с Lp-PLA2 активностью или с эндотелиальной дисфункцией. Настоящее изобретение также относится к способам лечения заболевания ингибированием Lp-PLA2 активности. Примеры заболеваний включают, но не ограничиваются, нейродегенеративное заболевание(например, болезнь Альцгеймера, васкулярную деменцию), атеросклероз, инсульт, нарушение метаболизма костной ткани (например, нарушения костного мозга), дислипидемию, болезнь Паджета, диабет II типа, метаболический синдром, резистентность к инсулину и гиперпаратиреоз, диабетическое глазное заболевание (например, отек желтого пятна, диабетическую ретинопатию и задний увеит), отек желтого пятна, заживление ран, ревматоидный артрит, хроническое обструктивное заболевание легких (COPD) и множественный склероз. Данные способы включают введение безопасного и эффективного количества соединения настоящего изобретения нуждающемуся в лечении субъекту. Предполагается, что настоящее изобретение не ограничивается любой конкретной стадией заболевания (например, ранней или прогрессирующей). Настоящее изобретение также относится к способам лечения болезни Альцгеймера. Способы включают введение нуждающемуся в лечении субъекту безопасного и эффективного количества соединения настоящего изобретения. Настоящее изобретение также относится к способам снижения накопления бета-амилоида (также называемого "А") в мозге субъекта. Способы включают введение нуждающемуся в лечении субъекту безопасного и эффективного количества соединения настоящего изобретения. В определенном варианте осуществления бета-амилоид представляет собой Abeta-42. Настоящее изобретение также относится к способам лечения заболеваний и расстройств глаз введением соединения настоящего изобретения. В определенном варианте осуществления настоящее изобретение относится к способам лечения отека желтого пятна, которые включают введение субъекту безопасного и эффективного количества соединения настоящего изобретения. В определенном варианте осуществления отек желтого пятна связан с диабетическим заболеванием глаз, например диабетической ретинопатией. В одном варианте осуществления отек желтого пятна связан с задним увеитом. Настоящее изобретение также относится к применению соединения настоящего изобретения для получения медикамента для лечения заболеваний, описанных в настоящем изобретении. Настоящее изобретение также относится к соединению, описанному в настоящем изобретении, для применения в осуществлении способов лечения, описанных в настоящем изобретении. Подробное описание настоящего изобретения Вышеприведенные и другие аспекты настоящего изобретения будут далее описаны более подробно,принимая во внимание определения и способы, относящиеся к настоящему изобретению. Должно быть ясно, что настоящее изобретение может быть воплощено различными способами и не следует делать выводы, что оно ограничено вариантами осуществления, изложенными в настоящем изобретении. Скорее,данные варианты осуществления приведены так, чтобы данное описание было всесторонним и полным и более полно передавало объем настоящего изобретения специалисту в данной области техники. Терминология, применяемая в описании настоящего изобретения, приведена с целью только описания конкретных вариантов осуществления и не предполагается, что она ограничивает настоящее изобретение. Как применяют в описании вариантов осуществления настоящего изобретения и прилагаемой формулы изобретения, предполагается, что формы единственного числа включают также формы множественного числа, если контекст явно не указывает иначе. Кроме того, как применяют в настоящем изобретении, "и/или" относится к и включает любую и все возможные комбинации одного или более из соответствующих перечисленных пунктов. Кроме того, ясно, что термины "включает" и/или "включая",при применении в настоящем описании, определяют наличие указанных признаков, целых, стадий, операций, элементов и/или компонентов, но не препятствуют присутствию или добавлению одного или более других признаков, целых, стадий, операций, элементов, компонентов и/или их групп. В общем, номенклатура, применяемая в настоящем изобретении, и лабораторные методики органической химии, медицинской химии, биологии и вирусологии, описанные в настоящем изобретении, являются хорошо известными и обычно применяемыми в данной области техники. Если не указано иначе,все технические и научные термины, применяемые в настоящем изобретении, обычно имеют значения,общеизвестные специалистам в данной области техники, и к которой настоящее изобретение принадлежит. В случае, когда имеется множество определений для термина, определяемого в настоящем изобретении, определения в данном параграфе имеют приоритет, если не указано иначе. Все патенты, патентные заявки и публикации, на которые ссылаются в настоящем изобретении,включены с помощью ссылки во всей своей полноте. В случае конфликта в терминологии, настоящее описание является определяющим.-3 023796 А. Определения. Как применяют в настоящем изобретении, термин "заболевание" относится к любому изменению состояния тела или некоторых из органов, прерывающему или нарушающему выполнение функций и/или вызывающему симптомы, такие как дискомфорт, дисфункция, дистресс или даже смерть у пораженного субъекта или у тех, кто находится в контакте с данным субъектом. Заболевание может включать раздражение, хилость, недомогание, недуг, расстройство, недомогание, заболевание, жалобы, предрасположенность и/или аффектацию. Термин "нейродегенеративное заболевание", как применяют в настоящем изобретении, относится к широкому разнообразию заболеваний центральной нервной системы, характеризуемому постепенной и прогрессирующей потерей нервной ткани и/или функции нервной ткани. Нейродегенеративное заболевание представляет собой класс неврологических расстройств или заболеваний, где неврологическое заболевание характеризуется постепенной и прогрессирующей потерей нервной ткани и/или измененной неврологической функцией, обычно пониженной неврологической функцией как результат постепенной и прогрессирующей потери нервной ткани. В одном варианте осуществления неврологические заболевания, описанные в настоящем изобретении, представляют собой неврологические заболевания или расстройства, где имеется нарушение гематоэнцефалитического барьера, например проницаемый гематоэнцефалитический барьер. Примеры нейродегенеративных заболеваний, когда присутствует нарушение гематоэнцефалитического барьера, включают, но не ограничиваются, болезнь Альцгеймера, болезнь Хантингтона, болезнь Паркинсона, васкулярную деменцию и подобные. Термин "васкулярная деменция" также называют "мультиинфарктная деменция", которая относится к группе синдромов, вызванных различными механизмами, все из которых приводят в результате к повреждениям мозга. Основными подтипами васкулярной деменции являются, например, васкулярные умеренные когнитивные нарушения, мультиинфарктная деменция, васкулярная деменция в результате ключевого единичного инфаркта (воздействующего на таламус, переднюю артерию большого мозга, теменную долю головного мозга или поясную извилину), васкулярная деменция в результате геморрагических повреждений, болезнь малых сосудов (включая, например, васкулярную деменцию в результате лакунарных повреждений и болезни Бинсвангера), и смешанная болезнь Альцгеймера с васкулярной деменцией. Фразы "гематоэнцефалитический барьер" или "ВВВ" применяют взаимозаменяемо в настоящем изобретении и применяют для ссылки на барьер проницаемости, который присутствует в кровяных сосудах по мере их перемещения через ткани мозга, который строго ограничивает и тщательно регулирует то,что обменивается между кровью и тканями мозга. Компоненты гематоэнцефалитического барьера включают эндотелиальные клетки, которые образуют наиболее глубокую выстилку всех кровяных сосудов,непроницаемые перегородки между соседними эндотелиальными клетками, которые являются структурным аналогом ВВВ, базальную мембрану эндотелиальных клеток и процесс роста соседних астроцитов,которые покрывают практически всю открытую наружную поверхность кровеносного сосуда. Фраза "нарушение метаболизма костной ткани", как применяют в настоящем изобретении, относится к широкому набору заболеваний и расстройств костей, характеризующихся постепенной и прогрессирующей потерей костной ткани. Нарушения метаболизма костной ткани, описанные в настоящем изобретении, представляют собой нарушения метаболизма костной ткани, в результате которых имеется состояние диффузно уменьшенной плотности костей и/или пониженной прочности костей. Данные заболевания характеризуются гистологическим признаком. Примеры нарушений метаболизма костной ткани включают, но не ограничиваются, остеопороз, который характеризуется пониженным минеральным и костным матриксом, и размягчение костей, которое характеризуется пониженным минеральным, но незатронутым костным матриксом. Термины "остеопеническое заболевание" или "остеопения" применяют в настоящем изобретении взаимозаменяемо, и они относятся к заболеваниям с пониженными кальцификацией и/или плотностью костей и представляют собой описательные термины, применяемые для ссылки на все системы скелета, в которых наблюдаются пониженные кальцификация и/или плотность костей. Остеопения также относится к пониженной костной массе в результате нарушенного остеоидного синтеза. Термин "остеопороз" относится к заболеваниям, когда минеральный и/или костный матрикс ослабляется и/или снижается костная масса."Алкил" относится к моновалентной насыщенной углеводородной цепи, содержащей указанное количество атомов углерода. Например, C1-C6-алкил относится к алкильной группе, содержащей от 1 до 6 атомов углерода. В еще других вариантах осуществления алкильные группы содержат 1-2, 3, 4 или 5 атомов углерода. Алкильные группы могут быть необязательно замещены одним или более заместителями, как определено в настоящем изобретении. Алкильная группа может быть нормальной или разветвленной. В одном варианте осуществления разветвленные алкильные группы могут содержать одно, два или три разветвления. Примеры алкила включают, но не ограничиваются, метил, метилэтил, этил, пропил (н-пропил и изопропил), метилпропил, бутил (н-бутил, изобутил и трет-бутил), пентил (н-пентил,изопентил и неопентил) и гексил."Алкокси" относится к группе -О-алкил. В одном варианте осуществления алкоксильные группы содержат 1-2, 3, 4, 5 или 6 атомов углерода. Примеры алкоксигрупп включают, но не ограничиваются,метокси, этокси и пропокси."Циклоалкил" относится к насыщенному моноциклическому углеводородному кольцу, содержащему 3-10 атомов углерода. В некоторых вариантах осуществления циклоалкил содержит 3-6 атомов углерода. Примеры циклоалкила включают циклопропил, циклобутил, циклопентил и циклогексил."Галогеналкил" относится к алкильной группе, как определено выше, содержащей один или более атомов галогена, выбранных из F, Cl, Br или I, которая является замещенной по любому или всем из атомов углерода алкильной группы замещением атомов водорода, соединенных с атомами углерода. Примеры галогеналкильных групп включают, но не ограничиваются, хлорметил, бромэтил, трифторметил,дихлорметил, -CH2CF3."Гетероциклоалкил" относится к насыщенному или ненасыщенному кольцу, содержащему 1-4 гетероатома в качестве членов кольца. Однако гетероциклоалкильные кольца не являются ароматическими. Гетероциклоалкильные кольца, содержащие более одного гетероатома, могут содержать различные гетероатомы. Гетероциклоалкильные группы можно необязательно замещать одним или более заместителями, как определено в настоящем изобретении. Гетероциклоалкильные группы представляют собой моноциклические кольцевые системы или конденсированные, спиро- или мостиковые бициклические кольцевые системы. Моноциклические гетероциклоалкильные кольца содержат от 4 до 8 членов. Бициклические гетероциклоалкильные кольца содержат от 7 до 11 членов. В некоторых вариантах осуществления гетероциклоалкил является моноциклическим. В одном варианте осуществления гетероциклоалкил содержит один или два атома азота в качестве членов. В определенных вариантах осуществления гетероциклоалкил является насыщенным. В других вариантах осуществления гетероциклоалкил является ненасыщенным, но не ароматическим. Примеры гетероциклоалкила включают пиперидинил, пиперазинил,пирролидинил, азетидинил, тетрагидрофуранил, дигидрофуранил, пиранил, тетрагидропиранил, дигидропиранил, тетрагидротиенил, пиразолидинил, оксазолидинил и тиазолидинил."Гетероарил" относится к моноциклическому или бициклическому ароматическому кольцу, содержащему 1-4 гетероатома в кольце. Гетероарильные группы, содержащие более одного гетероатома, могут содержать различные гетероатомы. Гетероарильные группы могут необязательно быть замещены одним или более заместителями, как определено в настоящем изобретении. Гетероарильные группы представляют собой моноциклические кольцевые системы, содержащие 5, 6 или 7 членов, или бициклические кольцевые системы, содержащие 7, 8, 9, 10 или 11 членов. В одном варианте осуществления гетероарильные группы представляют собой моноциклическую кольцевую систему, содержащую 6 членов. В других вариантах осуществления гетероарильная группа содержит один или два атома азота в качестве членов. Примеры гетероарила включают, но не ограничиваются, пирролил, пиразолил, пиридинил, пиримидинил, индолил, пиримидинонил, оксадиазолил, тиазолил, пиримидин-2(1 Н)-онил, пиридазинил, 2-пиридонил."Необязательно замещенный" показывает, что группа, такая как алкил, алкенил, акинил, арил (например, фенил), циклоалкил, циклоалкенил, гетероциклоалкил или гетероарил, может быть незамещенной или группа может быть замещена одним или более заместителями, как определено. Как применяют в настоящем изобретении, "замещенный" в отношении группы показывает, что один или более атомов водорода, соединенных с атомами (например, атомом углерода) в группе, замещен заместителями, выбранными из группы определенных заместителей. Должно быть ясно, что термин"замещенный" включает подразумеваемое условие, что замещение соответствует допустимой валентности замещаемого атома и заместителей и что замещение приводит в результате к стабильному соединению (т.е. соединению, которое не подвергается спонтанному превращению, такому как перегруппировка,циклизация или элиминирование, и которое является достаточно устойчивым для того, чтобы выдержать выделение из реакционной смеси). Когда сообщают, что группа может содержать один или более заместителей, один или более (в зависимости от ситуации) членов в группе могут быть замещены. Кроме того,один член в группе может быть замещен более чем одним заместителем при условии, что данное замещение соответствует допустимой валентности атома. Примеры заместителей включают, но не ограничиваются, галоген, гидроксил, амино, замещенный амин, амид, -SH, циано, нитро, тиоалкил, карбоксил,-NH-C(=NH)-NH2, алкил, алкенил, алкинил, алкоксил, арил, гетероарил, циклоалкил, гетероциклоалкил, в которых алкил, алкенил, алкинил, алкоксил, арил, гетероарил, циклоалкил, тиоалкил и гетероциклоалкил можно дополнительно замещать. Подходящие заместители определяют в настоящем изобретении для каждой замещенной или необязательно замещенной группы. Как применяют в настоящем изобретении, "лечение" в отношении заболевания обозначает:(1) улучшение или предотвращение заболевания или одного или более биологических проявлений заболевания;(2) воздействие на (а) один или более процессов в биологическом каскаде, который приводит к или является ответственным за заболевание или (b) одно или более из биологических проявлений заболева-5 023796 ния;(3) снятие одного или более симптомов или эффектов, связанных с заболеванием; и/или(4) замедление развития заболевания или одного или более из биологических проявлений заболевания. Как применяют в настоящем изобретении, "сольват" относится к комплексу различной стехиометрии, образованному растворяемым веществом и растворителем. Данные растворители для цели настоящего изобретения могут препятствовать биологической активности растворенного вещества. Примеры подходящих растворителей включают, но не ограничиваются, воду, метанол, этанол и уксусную кислоту. В одном варианте осуществления применяемый растворитель представляет собой фармацевтически приемлемый растворитель. Примеры подходящих фармацевтически приемлемых растворителей включают,без ограничения, воду, этанол и уксусную кислоту. В определенном варианте осуществления применяемым растворителем является вода. Как применяют в настоящем изобретении, "субъект" обозначает млекопитающее (например, собаку, кошку, лошадь, корову, овцу, козу, обезьяну и т.д.) и человека, включая и мужские и женские особи, и включая новорожденных, младенцев, подростков, юношей, взрослых и пожилых субъектов, и дополнительно включая любые расы и этносы, включая, но не ограничиваясь, белых, черных, азиатов, американских индейцев и испаноязычных. Как применяют в настоящем изобретении, "фармацевтически приемлемые соли" относится к солям,которые сохраняют требуемую биологическую активность исходного соединения и проявляют минимальные нежелательные токсикологические эффекты. Данные фармацевтически приемлемые соли можно получить in situ в процессе конечных выделения и очистки соединения или отдельно реакцией очищенного соединения в его форме свободной кислоты или свободного основания с подходящим основанием или кислотой соответственно. Как применяют в настоящем изобретении, "безопасное и эффективное количество" в отношении соединения настоящего изобретения или другого фармацевтически активного агента обозначает количество соединения, достаточное для лечения заболевания у субъекта, но достаточно небольшое для того,чтобы избежать серьезных побочных эффектов (при приемлемом соотношении риск/польза) по результатам тщательной медицинской оценки. Безопасное и эффективное количество соединения будет изменяться в зависимости от конкретно выбранного соединения (например, учитывая активность, эффективность и время полуразложения соединения); выбранного пути введения; заболевания, которое подвергают лечению; тяжести заболевания, которое подвергают лечению; возраста, размера, веса и физического состояния пациента, которого подвергают лечению; медицинской истории пациента, подвергаемого лечению; продолжительности лечения; природы параллельной терапии; требуемого терапевтического эффекта; и подобных факторов, но, тем не менее, может быть легко определено специалистом в данной области техники. В. Соединения. Настоящее изобретение относится, в первом аспекте к соединениям формулы (I) и их фармацевтически приемлемым солям:Z представляет собой Н, C1-C6-алкил, C1-C6-галогеналкил, -CH2-фенил, -CH2-гетероарил,-(CH2)2C(=O)-OCH3, -CH2-гетероциклоалкил, -CH2COOH, -CH2C(=O)-гетероциклоалкил, где фенил, гетероарил или гетероциклоалкил необязательно замещены одним или более заместителями, независимо выбранными из группы, состоящей из C1-C6-алкила, C1-C6-алкоксила, C1-C3-галогеналкила, CN, галогена иRa представляет собой водород или C1-C3-алкил;Ar представляет собой фенил или гетероарил, любой из которых необязательно замещен одним или более заместителями, независимо выбранными из группы, состоящей из CN, галогена, C1-C6-алкила,C1-C6-алкокси и C1-C6-галогеналкила; иAr' представляет собой фенил или гетероарил, любой из которых необязательно замещен одним или более заместителями, независимо выбранными из группы, состоящей из CN, галогена, C1-C6-алкила,C1-C6-алкокси C1-C6-галогеналкила и -O-C1-С 6 галогеналкила; и при условии, что, когда X представляет собой S и Z представляет собой C1-C6-алкил, Ar' представляет собой незамещенный фенил.-6 023796 В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I), гдеZ представляет собой Н, C1-C3-алкил, C1-C3-галогеналкил, -CH2-фенил, -CH2-гетероарил,(CH2)2C(=O)-OCH3, -CH2-гетероциклоалкил, -CH2COOH, -CH2C(=O)-гетероциклоалкил, где фенил, гетероарил или гетероциклоалкил необязательно замещены одним или более заместителями, независимо выбранными из группы, состоящей из C1-C6-алкила, C1-C6-алкоксила, C1-C3-галогеналкила, CN, галогена иRa представляет собой водород или CH3;Ar представляет собой фенил, необязательно замещенный одним или более заместителями, независимо выбранными из группы, состоящей из CN, галогена, C1-C6-алкила, C1-C6-алкокси и CF3; иAr' представляет собой фенил или гетероарил, любой из которых необязательно замещен одним или более заместителями, независимо выбранными из группы, состоящей из CN, галогена, C1-C6-алкила,C1-C6-алкокси, C1-C6-галогеналкила и -O-C1-С 6-галогеналкила. В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I), гдеZ представляет собой Н, C1-C6-алкил, -CH2-гетероарил, (CH2)2C(=O)-OCH3, -CH2COOH, где гетероарил можно необязательно заместить одним или более заместителями, независимо выбранными из группы, состоящей из C1-C6-алкила, C1-C6-алкоксила, C1-C6-галогеналкила, CN, галогена и -OH;Ra представляет собой водород или C1-C3-алкил;Ar представляет собой фенил, который необязательно замещен одним или более заместителями,выбранными из группы, состоящей из CN, галогена, C1-C6-алкила, C1-C6-алкокси и C1-C6-галогеналкила;Ar' представляет собой фенил или гетероарил, любой из которых необязательно замещен одним или более заместителями, выбранными из группы, состоящей из CN, галогена, C1-C6-алкила, C1-C6-алкокси иC1-C6-галогеналкила. В одном варианте осуществления настоящее изобретение также относится к соединениям любого из приведенных выше вариантов осуществления, где n равно 1. В одном варианте осуществления настоящее изобретение также относится к соединениям любого из приведенных выше вариантов осуществления, где n равно 2. В одном варианте осуществления настоящее изобретение также относится к соединениям любого из приведенных выше вариантов осуществления, где X представляет собой O. В одном варианте осуществления настоящее изобретение также относится к соединениям любого из приведенных выше вариантов осуществления, где X представляет собой CH2. В одном варианте осуществления настоящее изобретение также относится к соединениям любого из приведенных выше вариантов осуществления, где X представляет собой NH или NCH3. В одном варианте осуществления настоящее изобретение также относится к соединениям любого из приведенных выше вариантов осуществления, где X представляет собой S. В одном варианте осуществления настоящее изобретение также относится к соединениям любого из приведенных выше вариантов осуществления, где Y представляет собой Н или CH3. В одном варианте осуществления настоящее изобретение также относится к соединениям любого из приведенных выше вариантов осуществления, где Y представляет собой Н. В одном варианте осуществления настоящее изобретение также относится к соединениям любого из приведенных выше вариантов осуществления, где Y представляет собой CH3. В одном варианте осуществления настоящее изобретение также относится к соединениям любого из приведенных выше вариантов осуществления, где Y представляет собойC3-C6-циклоалкил. В одном варианте осуществления настоящее изобретение также относится к соединениям любого из приведенных выше вариантов осуществления, где Z представляет собой -CH2-гетероарил,-CH2-гетероциклоалкил или -CH2C(=O)-гетероциклоалкил, где гетероарил выбран из группы, состоящей из пиримидинила, пиразолила, индолила, пиримидинонила, оксадиазолила, тиазолила, пиридинила, пиридазинила, пирролидинила и 2-пиридонила, и гетероциклоалкил выбран из группы, состоящей из пиперидинила, пиперазинила и пирролидинила. В одном варианте осуществления настоящее изобретение также относится к соединениям любого из приведенных выше вариантов осуществления, где Z представляет собой -CH2-фенил, где фенил необязательно замещен одним или более заместителями, независимо выбранными из группы, состоящей изCN, галогена и -OH. В одном варианте осуществления настоящее изобретение также относится к соединениям любого из приведенных выше вариантов осуществления, где Z представляет собой-CH2-пиримидинил, где пиримидинил необязательно замещен одним или более заместителями, независимо выбранными из группы, состоящей из CH3, CF3 и OCH3. В одном варианте осуществления настоящее изобретение также относится к соединениям любого из приведенных выше вариантов осуществле-7 023796 ния, где Z представляет собой -CH2-пиримидинил, где пиримидинил является незамещенным. В одном варианте осуществления настоящее изобретение также относится к соединениям любого из приведенных выше вариантов осуществления, где Z представляет собой -CH2-пиримидинил, замещенный одним заместителем, выбранным из CH3 или OCH3. В одном варианте осуществления настоящее изобретение также относится к соединениям любого из приведенных выше вариантов осуществления, где Z представляет собой -CH2-фенил, где фенил является незамещенным. В одном варианте осуществления настоящее изобретение также относится к соединениям любого из приведенных выше вариантов осуществления,где Z представляет собой -CH2-фенил, необязательно замещенный одним или более заместителями, независимо выбранными из группы, состоящей из CN, галогена и -OH. В одном варианте осуществления настоящее изобретение также относится к соединениям любого из приведенных выше вариантов осуществления, где Z представляет собой -CH2-пиразолил, необязательно замещенный CH3. В одном варианте осуществления настоящее изобретение также относится к соединениям любого из приведенных выше вариантов осуществления, где Z представляет собой -CH2-гетероциклоалкил,-CH2C(=O)-гетероциклоалкил, где гетероциклоалкил выбран из группы, состоящей из пиперидинила,пиперазинила и пирролидинила, и гетероциклоалкил необязательно замещен одним или более заместителями, независимо выбранными из группы, состоящей из галогена и CH3. В одном варианте осуществления настоящее изобретение также относится к соединениям любого из приведенных выше вариантов осуществления, где Z представляет собой C1-C3-алкил. В одном варианте осуществления настоящее изобретение также относится к соединениям любого из приведенных выше вариантов осуществления, где Z представляет собой этил. В одном варианте осуществления настоящее изобретение также относится к соединениям любого из приведенных выше вариантов осуществления,где Z представляет собой -CH2-тиазолил. В одном варианте осуществления настоящее изобретение также относится к соединениям любого из приведенных выше вариантов осуществления, где Z представляет собой -CH2-пиримидин-2(1 Н)-онил. В одном варианте осуществления настоящее изобретение также относится к соединениям любого из приведенных выше вариантов осуществления, где Z представляет собой -CH2-2-пиридонил. В одном варианте осуществления настоящее изобретение также относится к соединениям любого из приведенных выше вариантов осуществления, где Z представляет собой-CH2-индолил, необязательно замещенный CH3. В одном варианте осуществления настоящее изобретение также относится к соединениям любого из приведенных выше вариантов осуществления, где Z представляет собой -(CH2)2C(=O)-OCH3. В одном варианте осуществления настоящее изобретение также относится к соединениям любого из приведенных выше вариантов осуществления, где Z представляет собой -CH2COOH. В одном варианте осуществления настоящее изобретение также относится к соединениям любого из приведенных выше вариантов осуществления, где Z представляет собой -CH2CF3. В одном варианте осуществления настоящее изобретение также относится к соединениям любого из приведенных выше вариантов осуществления, где Ra представляет собой водород. В одном варианте осуществления настоящее изобретение также относится к соединениям любого из приведенных выше вариантов осуществления, где Ra представляет собой CH3. В одном варианте осуществления настоящее изобретение также относится к соединениям любого из приведенных выше вариантов осуществления, где Ar представляет собой фенил, необязательно замещенный одним или более заместителями, независимо выбранными из группы, состоящей из CN, галогена, C1-C6-алкила, C1-C6-алкокси и CF3. В одном варианте осуществления настоящее изобретение также относится к соединениям любого из приведенных выше вариантов осуществления, где Ar представляет собой незамещенный фенил. В одном варианте осуществления настоящее изобретение также относится к соединениям любого из приведенных выше вариантов осуществления, где Ar представляет собой фенил,замещенный одним или более заместителями, независимо выбранными из группы, состоящей из CN, F,CF3 и OCH3. В одном варианте осуществления настоящее изобретение также относится к соединениям любого из приведенных выше вариантов осуществления, где Ar представляет собой фенил, замещенный одним CN. В одном варианте осуществления настоящее изобретение также относится к соединениям любого из приведенных выше вариантов осуществления, где Ar представляет собой фенил, замещенный одним или более F. В одном варианте осуществления настоящее изобретение также относится к соединениям любого из приведенных выше вариантов осуществления, где Ar представляет собой фенил, замещенный одним OCH3. В одном варианте осуществления настоящее изобретение также относится к соединениям любого из приведенных выше вариантов осуществления, где Ar представляет собой фенил,замещенный одним CF3. В одном варианте осуществления настоящее изобретение также относится к соединениям любого из приведенных выше вариантов осуществления, где Ar представляет собой фенил,замещенный одним галогеном и одним CH3. В одном варианте осуществления настоящее изобретение также относится к соединениям любого из приведенных выше вариантов осуществления, где Ar представляет собой фенил, замещенный одним -OCF3 и одним Cl. В одном варианте осуществления настоящее изобретение также относится к соединениям любого из приведенных выше вариантов осуществления, где Ar представляет собой фенил, замещенный одним или более галогенами, и каждый заместитель может быть одинаковым или различным.-8 023796 В одном варианте осуществления настоящее изобретение также относится к соединениям любого из приведенных выше вариантов осуществления, где Ar' представляет собой фенил, замещенный Cl иCF3. В одном варианте осуществления настоящее изобретение также относится к соединениям любого из приведенных выше вариантов осуществления, где Ar' представляет собой фенил, замещенный однимCF3. В одном варианте осуществления настоящее изобретение также относится к соединениям любого из приведенных выше вариантов осуществления, где Ar' представляет собой фенил, замещенный одним или более F. В одном варианте осуществления настоящее изобретение также относится к соединениям любого из приведенных выше вариантов осуществления, где Ar' представляет собой фенил, замещенный одним F и одним CF3. В одном варианте осуществления настоящее изобретение также относится к соединениям любого из приведенных выше вариантов осуществления, где Ar' представляет собой фенил, замещенный одним галогеном и одним CH3. В одном варианте осуществления настоящее изобретение также относится к соединениям любого из приведенных выше вариантов осуществления, где Ar' представляет собой фенил, замещенный одним Cl и одним -OCF3. В одном варианте осуществления настоящее изобретение также относится к соединениям любого из приведенных выше вариантов осуществления,где Ar' представляет собой фенил, замещенный одним или более галогеном, и каждый заместитель может быть одинаковым или различным. В одном варианте осуществления настоящее изобретение также относится к соединениям любого из приведенных выше вариантов осуществления, где Ar' представляет собой гетероарил, необязательно замещенный одним или более заместителями, независимо выбранными из группы, состоящей из CN, галогена, C1-C6-алкила, C1-C6-алкокси и C1-C6-галогеналкила, и где гетероарил выбран из группы, состоящей из пиридинила, пиридазинила или пиримидинила. В одном варианте осуществления настоящее изобретение также относится к соединениям любого из приведенных выше вариантов осуществления, где Ar' представляет собой пиридинил, замещенный CF3. В одном варианте осуществления настоящее изобретение также относится к соединениям любого из приведенных выше вариантов осуществления, где Ar' представляет собой пиридинил, замещенный Cl. В одном варианте осуществления настоящее изобретение также относится к соединениям любого из приведенных выше вариантов осуществления, где Ar' представляет собой пиридинил, замещенный одним Cl и одним CF3. В одном варианте осуществления настоящее изобретение также относится к соединениям любого из приведенных выше вариантов осуществления, где Ar' представляет собой пиридинил, замещенный одним CH3. В одном варианте осуществления настоящее изобретение также относится к соединениям любого из приведенных выше вариантов осуществления, где Ar' представляет собой пиридазинил, замещенный однимCF3. В одном варианте осуществления настоящее изобретение также относится к соединениям любого из приведенных выше вариантов осуществления, где Ar' представляет собой пиридазинил, замещенный одним Cl. В одном варианте осуществления настоящее изобретение также относится к соединениям любого из приведенных выше вариантов осуществления, где Ar' представляет собой пиримидинил, замещенный одним CF3 и одним Cl. В одном варианте осуществления настоящее изобретение также относится к соединениям любого из приведенных выше вариантов осуществления, где Ar' представляет собой пиримидинил, замещенный одним Cl. В одном варианте осуществления настоящее изобретение также относится к соединениям любого из приведенных выше вариантов осуществления, где Ar' представляет замещенный пиримидинил. В одном варианте осуществления соединения формулы (I) имеют структуру формулы (IA) или их фармацевтически приемлемая соль,где Z, X и Y определяют, как в формуле (I),Rc и Rb независимо выбраны из группы, состоящей из Н, галогена и CF3. В одном варианте осуществления соединение формулы (IA), гдеZ представляет собой -CH2-фенил или -CH2-гетероарил, где фенил или гетероарил может быть необязательно замещен одним или более заместителями, выбранными из группы, состоящей из Н,C1-C6-алкила, C1-C6-алкоксила, C1-C6-галогеналкила, CN, галогена и -OH;Rc и Rb независимо выбраны из группы, состоящей из Н, галогена и CF3. В одном варианте осуществления соединение формулы (IA), где Z представляет собой -CH2-фенил,где фенил необязательно замещен одним или более заместителями, независимо выбранными из группы,состоящей из CN, галогена и -OH. В одном варианте осуществления соединение формулы (IA), где Z представляет собой -CH2-пиримидинил, где пиримидинил необязательно замещен одним заместителем,-9 023796 выбранным из CH3 или OCH3. В одном варианте осуществления соединение формулы (IA), где Z представляет собой -CH2-незамещенный пиримидинил. В одном варианте осуществления соединение формулы (IA), где Z представляет собой -CH2-пиримидинил, замещенный одним заместителем, выбранным изCH3 или OCH3. В одном варианте осуществления соединение формулы (IA), где Z представляет собой-CH2-пиримидинил, необязательно замещенный одним OCH3. В одном варианте осуществления соединение формулы (IA), где Z представляет собой -CH2-незамещенный фенил. В одном варианте осуществления соединение формулы (IA), где Z представляет собой -CH2-фенил, необязательно замещенный одним или более заместителями, независимо выбранными из группы, состоящей из CN, галогена и -OH. В одном варианте осуществления настоящее изобретение также относится к соединениям любого из приведенных выше вариантов осуществления, относящимся к формуле (IA), где X представляет собой О. В одном варианте осуществления настоящее изобретение также относится к соединениям любого из приведенных выше вариантов осуществления, относящимся к формуле (IA), где X отсутствует. В одном варианте осуществления настоящее изобретение также относится к соединениям любого из приведенных выше вариантов осуществления, относящимся к формуле (IA), где X представляет собой NH или NCH3. В одном варианте осуществления настоящее изобретение также относится к соединениям любого из приведенных выше вариантов осуществления, относящимся к формуле (IA), где Y представляет собой Н. В одном варианте осуществления настоящее изобретение также относится к соединениям любого из приведенных выше вариантов осуществления, относящимся к формуле (IA), где Y представляет собойCH3. В одном варианте осуществления настоящее изобретение также относится к соединениям любого из приведенных выше вариантов осуществления, относящимся к формуле (IA), Rc и Rb независимо представляют собой галоген или CF3. В одном варианте осуществления настоящее изобретение также относится к соединениям любого из приведенных выше вариантов осуществления, относящимся к формуле(IA), Rc и Rb независимо представляют собой Cl или CF3. В одном варианте осуществления соединение формулы (I) или его фармацевтически приемлемая соль имеет структуру формулы (IA), где Z представляет собой -CH2-пиримидинил, где пиримидинил необязательно замещен одним OCH3; X представляет собой О; Y представляет собой Н; Rc и Rb независимо представляют собой галоген или CF3. В одном варианте осуществления соединение согласно формуле (I) или формуле (IA) имеет структуру или его фармацевтически приемлемая соль. В одном варианте осуществления соединение согласно формуле (I) или формуле (IA) имеет структуру или его фармацевтически приемлемая соль. Соединения формулы (I), формулы (IA) или их фармацевтически приемлемые соли или их фармацевтически приемлемые сольваты могут существовать в стереизомерных формах (например, оно содержит один или более асимметрических атомов углерода). Отдельные стереоизомеры (энантиомеры и диастереомеры) и их смеси включены в объем настоящего изобретения. Настоящее изобретение также включает отдельные изомеры соединений формулы (I) или формулы (IA) или фармацевтически приемлемых солей, или фармацевтически приемлемых сольватов в виде смеси их изомеров, в которых обращен один или более хиральных центров. Аналогично, ясно, что соединения формулы (I) или формулы (IA) или их фармацевтически приемлемые соли, или их фармацевтически приемлемые сольваты могут существовать в таутомерных формах, отличных от формул, показанных в формуле, и они также включены в объем настоящего изобретения. Ясно, что настоящее изобретение включает все комбинации и поднаборы конкретных групп, определенных в настоящем изобретении выше. Объем настоящего изобретения включает смеси стереоизомеров, а также очищенные энантиомеры или энантиомерно/диастереомерно обогащенные смеси. Также включенными в объем настоящего изобретения являются отдельные изомеры соединений формулы (I) или формулы (IA) или их фармацевтически приемлемых солей или фармацевтически приемлемых сольватов, а также любые их полностью или частично уравновешенные смеси. Настоящее изобретение также включает отдельные изомеры соединений формулы (I) или формулы (IA) или их фармацевтически приемлемых солей или фармацевтически приемлемых сольватов, а также смеси их- 10023796 изомеров, в которых обращен один или более хиральных центров. Ясно, что настоящее изобретение включает все комбинации и поднаборы конкретных групп, определенных в настоящем изобретении выше. Определенные соединения, описанные в настоящем изобретении, могут содержать один или более хиральных атомов или могут иначе быть способными существовать в виде энантиомеров. Соединения настоящего изобретения включают смеси энантимеров, а также очищенные энантимеры или энантиомерно обогащенные смеси. Также включенными в объем настоящего изобретения являются отдельные изомеры соединений настоящего изобретения, а также любые их полностью или частично уравновешенные смеси. Настоящее изобретение также включает отдельные изомеры заявленных соединений в виде смеси их изомеров, в которых обращен один или более хиральных центров. Кроме того, ясно, что любые таутомеры и смеси таутомеров соединений, описанных в настоящем изобретении, включены в объем соединений настоящего изобретения. Различные изомерные формы можно отделить или разделить друг от друга общепринятыми способами или любой указанный изомер можно получить общепринятыми способами получения или стереоспецифическими или асимметрическими способами получения. Настоящее изобретение также включает различные дейтерированные формы соединений формулы(I) или формулы (IA) или их фармацевтически приемлемых солей или фармацевтически приемлемых сольватов. Каждый имеющийся в наличии атом водорода, соединенный с атомом углерода, можно независимо заместить атомом дейтерия. Специалист в данной области техники знает, как получить дейтерированные формы соединений формулы (I) или формулы (IA) или их фармацевтически приемлемых солей или фармацевтически приемлемых сольватов. Имеющиеся в продаже дейтерированные исходные соединения можно применять в получении дейтерированных форм соединений формулы (I) или формулы (IA) или их фармацевтически приемлемых солей или фармацевтически приемлемых сольватов или их можно получить, применяя общепринятые способы, применяя дейтерированные реагенты (например, литийалюмодейтерид). В добавление к форме свободного основания соединений, описанных в настоящем изобретении, солевая форма соединений также включена в объем настоящего изобретения. Фармацевтически приемлемые соли можно получить in situ в процессе конечного выделения или очистки соединения, или отдельно реакцией очищенного соединения в его форме свободной кислоты или свободного основания с подходящим основанием или кислотой соответственно. В одном варианте осуществления соединения настоящего изобретения могут содержать кислотную функциональную группу, которая является достаточно кислой для того, чтобы образовывать соли. Типичные соли включают фармацевтически приемлемые соли металлов, такие как натриевые, калиевые,литиевые, кальциевые, магниевые, алюминиевые и цинковые соли; карбонаты и бикарбонаты фармацевтически приемлемого катиона металла, такого как натрий, калий, литий, кальций, магний, алюминий и цинк; фармацевтически приемлемые первичные, вторичные и третичные амины, включая алифатические амины, ароматические амины, алифатические диамины и гидроксиалкиламины, такие как метиламин,этиламин, диэтиламин, триэтиламин, этилендиамин, этаноламин, диэтаноламин и циклогексиламин. В определенных вариантах осуществления соединения настоящего изобретения могут содержать основную группу и, следовательно, быть способны образовывать фармацевтически приемлемые соли присоединения кислоты обработкой подходящей кислотой. Подходящие кислоты включают фармацевтически приемлемые неорганические кислоты и фармацевтически приемлемые органические кислоты. Данные соли могут быть кристаллическими или аморфными. Примеры фармацевтически приемлемых солей присоединения кислоты включают гидрохлорид, гидробромид, нитрат, метилнитрат, сульфат, бисульфат, сульфамат, фосфат, ацетат, гидроксиацетат, фенилацетат, пропионат, бутират, изобутират, валерат, малеат, гидроксималеат, акрилат, фумарат, малат, тартрат, цитрат, салицилат, п-аминосалицилат,гликолят, лактат, гептаноат, фталат, оксалат, сукцинат, бензоат, о-ацетоксибензоат, хлорбензоат, метилбензоат, динитробензоат, гидроксибензоат, метоксибензоат, манделат, таннат, формиат, стеарат, аскорбат, пальмитат, олеат, пируват, памоат, малонат, лаурат, глутарат, глутамат, эстолат, метансульфонат(безилат),п-аминобензолсульфонат, п-толуолсульфонат (тозилат) и нафталин-2-сульфонат. В некоторых вариантах осуществления фармацевтически приемлемые соли включают L-тартрат, этандисульфонат (эдизилат),сульфат, фосфат, п-толуолсульфонат (тозилат), гидрохлоридную соль, метансульфонат, цитрат, фумарат,бензолсульфонат, малеат, гидробромат, L-лактат, малонат и S-камфор-10-сульфонат. Некоторые из данных солей образуют сольваты, некоторые являются кристаллическими. Как применяют в настоящем изобретении, термин "соединения настоящего изобретения" обозначает и соединения согласно формуле (I), формуле (IA), их фармацевтически приемлемые соли, и их фармацевтически приемлемые сольваты. Термин "соединение настоящего изобретения" также появляется в настоящем изобретении и относится к соединению согласно формуле (I), формуле (IA), его фармацевтически приемлемым солям, и к их фармацевтически приемлемым сольватам. Соединения настоящего изобретения могут существовать в твердой или жидкой форме. В твердом состоянии соединения настоящего изобретения могут существовать в кристаллической или некристаллической форме или в виде их смеси. Что касается соединений настоящего изобретения, которые находятся- 11023796 в кристаллической форме, специалисту в данной области техники ясно, что фармацевтически приемлемые сольваты могут образовываться, когда молекулы растворителя включены в кристаллическую решетку при кристаллизации. Сольваты могут содержать неводные растворители, такие как этанол, изопропанол, ДМСО, уксусная кислота, этаноламин и этилацетат, или они могут содержать воду в качестве растворителя, которые включены в кристаллическую решетку. Сольваты, в которых вода является растворителем, которая включена в кристаллическую решетку, обычно называют "гидратами". Гидраты включают стехиометрические гидраты, а также составы, содержащие различные количества воды. Настоящее изобретение включает все данные сольваты. Кроме того, специалисту в данной области техники ясно, что определенные соединения настоящего изобретения, которые существуют в кристаллической форме, включая их различные сольваты, могут проявлять полиморфизм (т.е. способность находиться в отличных кристаллических структурах). Данные отличные кристаллические формы обычно известны как "полиморфы". Полиморфы имеют одинаковый химический состав, но отличаются упаковкой, геометрическим расположением и другими описательными свойствами кристаллического твердого состояния. Полиморфы, следовательно, могут иметь различные физические свойства, такие как форма, плотность, жесткость, деформируемость, стабильность и свойства растворимости. Полиморфы обычно обладают отличными температурами плавления,УФ-спектрами и порошковыми рентгеновскими дифрактограммами, которые можно применять для идентификации. Специалисту в данной области техники ясно, что отличные полиморфы можно получить, например, изменением или регулированием условий и реагентов реакций, применяемых в получении соединения. Например, изменение температуры, давления или растворителя может приводить в результате к полиморфам. Кроме того, один полиморф может самопроизвольно превращаться в другой полиморф в определенных условиях. Настоящее изобретение включает все данные полиморфы. С. Получение соединений. Способ, который будут применять для получения соединений, описанных в настоящем изобретении, зависит от требуемых соединений. Такие факторы как выбор конкретных заместителей и различных возможных положений конкретных заместителей играют роль в подборе пути, которому будут следовать при получении конкретных соединений настоящего изобретения. Данные факторы являются известными специалисту в данной области техники. В общем, соединения настоящего изобретения можно получить стандартными способами, известными в данной области техники и известными аналогичными им способами. Общие способы для получения соединений настоящего изобретения изложены ниже. Специалисту в данной области техники ясно, что если заместители, описанные в настоящем изобретении, являются несовместимыми со способами получения, описанными в настоящем изобретении,заместитель можно защищать подходящей защитной группой, которая стабильна в условиях реакции. Защитную группу можно удалить в подходящем месте в последовательности реакций, получая требуемое промежуточное соединение или целевое соединение. Подходящие защитные группы и способы защиты и деблокирования различных заместителей, применяя данные подходящие защитные группы, являются известными специалисту в данной области техники; их примеры можно найти в Т. Greene и Р. Wuts, Protecting Groups in Chemical Synthesis (3rd ed.), John WileySons, NY (1999). В некоторых случаях заместитель можно специально выбирать так, чтобы он был реакционноспособным в применяемых условиях реакции. В данных обстоятельствах данные условия реакции превращают выбранный заместитель в другой заместитель, который или является пригодным в качестве промежуточного соединения,или является требуемым заместителем в целевом соединении. Схемы А-С дают примерный способ получения соединений настоящего изобретения. Схема А Общая экспериментальная схема А дает примерный способ получения промежуточного соединения 3 и 4. Когда Z содержит ароматическое кольцо, стадия (i) представляет собой реакцию Хека реакцией 1 с метилакрилатом, применяя подходящую палладиевую каталитическую систему, такую как Pd(OAc)/трио-толилфосфин, Pd(dppf)Cl2 в подходящем растворителе, таком как диметилформамид (DMF) при подходящей температуре, такой как приблизительно 130 С, давая промежуточное соединение, которое затем восстанавливают Н 2 (стадия (ii, применяя катализатор, такой как палладий/уголь, никель Ренея в спиртовом растворителе, получая 2. Когда Z представляет собой Н, алкильную цепь, -(CH2)2C(=O)-OCH3, -CH2COOH, 2 обычно является имеющимся в продаже.- 12023796 Стадию (iii) осуществляют реакцией 2 с метилформиатом, применяя подходящее основание, такое как гидрид натрия, трет-бутоксид калия в подходящем растворителе, таком как тетрагидрофуран (THF),получая 3. Дополнительная реакция 3 с тиомочевиной, применяя подходящее основание, такое как третбутоксид калия, гидроксид натрия, в подходящем спиртовом растворителе, таком как изопропанол, этанол, дает 4. Схема В Схема В дает пример способа получения соединения 8, 10, 12, 14 и 16, где X определяют в формуле(I). Стадию (v) осуществляют реакцией Ar'OH и 5 с подходящим неорганическим основанием, таким как карбонат калия, в полярном растворителе, таком как DMF, при подходящей температуре, такой как температура в диапазоне 80-140 С, получая промежуточное соединение 6. Промежуточное соединение 6 восстанавливают на стадии (х) подходящим восстанавливающим реагентом, таким как NaBH4, в подходящем спиртовом растворителе, таком как этанол, получая промежуточный спирт, который затем хлорируют на стадии (xi) подходящим хлорирующим агентом, таким как сульфонилдихлорид, в подходящем растворителе, таком как дихлорметан, получая 9. Стадию (xii) проводят реакцией 9 с 4 в присутствии подходящего основания, такого как диизопропилэтиламин (DIPEA),триэтиламин (TEA), K2CO3 в подходящем растворителе, таком как хлороформ, дихлорметан, при подходящей температуре, такой как температура в диапазоне от комнатной температуры до 60 С, получая 10,где Ar', Ar, Z определяют в формуле (I). Стадия(xv) представляет собой реакцию Виттига реакцией 2-(трифенилфосфанилиден)ацетонитрила с 6, применяя подходящее основание, такое как NaOH, третбутоксид калия, н-BuLi, в подходящем растворителе, таком как дихлорметан, THF, при подходящей температуре, такой как температура в диапазоне от 0 С до комнатной температуры, получая алкен, который можно восстанавливать Н 2 как на стадии (ii), описанной выше, получая 13. Стадию (xvii) можно проводить реакцией 13 с метанолом в кислых условиях, таких как ацетилхлорид/метанол, затем с последующей реакцией с аммиаком в метаноле, получая имидамидное промежуточное соединение, которое можно циклизовать с 3 на стадии (xviii) в присутствии подходящего основания, такого как ацетат калия, в подходящем растворителе, таком как толуол, при кипячении с обратным холодильником в течение ночи,получая 14, где Ar', Ar, Z определяют в формуле (I). Стадия (vi) представляет собой реакцию Виттига реакцией 6 с бромидом метилтрифенилфосфония,получая алкен, который может реагировать с подходящим основанием, таким как 9-борабицикло[3,3,1]нонан (9-BBN), затем H2O2, в подходящем растворителе, таком как THF, получая спирт 7. Стадию (viii) осуществляют реакцией 7 с цианамидом в присутствии подходящего сильного кислого реагента, такого как трифторметансульфокислота, HCl в подходящем растворителе, таком какTHF, 1,4-диоксан, при подходящей температуре, такой как 0 С, получая карбамимидатное промежуточное соединение. Стадию (ix) осуществляют реакцией карбамимидатного промежуточного соединения с 3 в присутствии подходящего основания, такого как K2CO3, в подходящем растворителе, таком какN-метил-2-пирролидон (NMP), 1,4-диоксан, в подходящем диапазоне температур, таком как 120-160 С,получая 8, в котором Ar', Ar, Z определяют в формуле (I). Стадию (xiii) осуществляют реакцией 7 с подходящим реагентом, таким как Ph3P/йод в подходящем растворителе, таком как дифторметан, получая 11. Стадию (xiv) осуществляли реакцией 11 с 4 в присутствии подходящего основного реагента, такого как K2CO3, в подходящем полярном растворителе, таком как DMF, получая 12, в котором Ar', Ar, Z определяют в формуле (I). Стадию (xix) осуществляют реакцией 6 с нитрометаном в присутствии ацетата аммония в подходящем растворителе, таком как уксусная кислота, получая нитровинильное промежуточное соединение,которое восстанавливают Н 2 на стадии (хх), как на стадии (ii). Затем полученный в результате нитроэтил реагирует с подходящим восстанавливающим реагентом, таким как NaBH4 на стадии (xxi) в подходящем растворителе, таком как метанол, в присутствии подходящего реагента, такого как гексагидрат хлорида никеля(II), получая амин 15. Стадию (xxii) осуществляют реакцией 15 с 1 Н-пиразол-1-карбоксимидамидом в присутствии подходящего основания, такого как диизопропилэтиламин (DIPEA), в подходящем растворителе, таком какDMF, получая гуанидиновое промежуточное соединение, которое затем циклизуют на стадии (xxiii) реакцией с 3 в подходящем растворителе, таком как этанол при подходящей температуре, такой как 100 С,получая 16, в котором Ar', Ar, Z определяют в формуле (I). Схема С Схема С дает примерный вариант получения соединения 18. Стадию (xxiv) осуществляют реакцией исходного соединения 8, 10, 12, 14 или 16 с 17 в присутствии подходящего основания, такого как DIPEA, K2CO3, в подходящем растворителе, таком как дихлорметан, получая 18, в котором Ar', Ar, X, Y, Z определяют в формуле (I). Схема D Альтернативно, соединения формулы (I) можно получить, применяя способы, описанные на схеме D. 3 можно получить, как описано на схеме А. Стадию (xxv) можно осуществлять реакцией 19 с 3 и подходящим основанием, таким как K2CO3,DIPEA, KOAc, трет-BuOK, EtONa, при подходящей температуре, такой как 80-160 С, в подходящем растворителе, таком как DMF, этанол, толуол, NMP, получая 20. Стадию (xxvi) можно осуществлять аналогично стадии (xxiv), как описано на схеме С, получая 21, в котором Ar', Ar, X, Y, Ra и Z определяют в формуле (I). Схема Е Альтернативно, соединения формулы (I) можно также получить, применяя способ, описанный на схеме Е. Стадию (xxvii) можно осуществлять реакцией 3 с 22 и подходящим основанием, таким как K2CO3,DIPEA, KOAc, трет-BuOK, EtONa, при подходящей температуре в диапазоне температур, таком как 80- 14023796 160 С, в подходящем растворителе, таком как DMF, этанол, толуол, NMP, получая 23. Стадия (xxviii) представляет собой реакцию алкилирования 23 с 24 в присутствии подходящего основания, такого как K2CO3, в подходящем растворителе, таком как DMF, NMP, при подходящей температуре, такой как 25-80 С, получая 25. Стадию (xxix) можно осуществлять как стадию (xxiv), получая 26, в котором Ar', Ar, X, Y, Ra и Z определяют в формуле (I). Общие экспериментальные способы Нагревание реакционной смеси микроволновым облучением осуществляли на Smith Creator (купленном у Personal Chemistry, Forboro/MA, в настоящее время находящемся в собственности Biotage), Emrys Optimizer (купленном у Personal Chemistry) или Explorer (предоставленном СЕМ Discover,Matthews/NC) СВЧ. Общепринятые способы можно применять в настоящем изобретении для обработки реакций и очистки продуктов примеров. Ссылки в примерах ниже, относящиеся к сушке органических слоев или фаз, могут относиться к сушке раствора над сульфатом магния или сульфатом натрия и фильтрованию осушающего агента согласно общепринятым способам. Продукты можно обычно получить удалением растворителя упариванием при пониженном давлении. Очистку соединений в примерах можно осуществлять общепринятыми способами, такими как хроматография и/или перекристаллизация, применяя подходящие растворители. Хроматографические способы являются известными специалисту в данной области техники и включают, например, колоночную хроматографию, флэш-хроматографию, ВЭЖХ (высокоэффективную жидкостную хроматографию) иAnaltech Silica Gel GF и Е. Merck Silica Gel 60 F-254 тонкослойные пластинки применяли для тонкослойной хроматографии. Флэш- и гравитационную хроматографию осуществляли на Е. Merck Kieselgel 60 (230-400 мэш) силикагеле. Препаративную ВЭЖХ проводили, применяя Gilson препаративную систему, применяя Luna 5u C18(2) 100A обращенно-фазовую колонку, элюируя 10-80 градиентом (0,1%TFA в ацетонитриле/0,1% водная TFA) или 10-80 градиентом (ацетонитрил/вода). CombiFlash систему,применяемую для очистки в настоящем изобретении, покупали у Isco, Inc. CombiFlash очистку осуществляли, применяя предварительно заполненную SiO2 колонку, детектор с УФ длиной волны 254 нм и смешанный растворитель. Термины "CombiFlash", "Biotage", "Biotage 75" и "Biotage SP4" при применении в настоящем изобретении относятся к имеющимся в продаже автоматическим системам очистки, применяя предварительно заполненные силикагелем картриджи. Конечные соединения охарактеризовывали LCMS (условия, приведенные ниже) или ЯМР. 1 Н-ЯМР спектры регистрировали, применяя Bruker Avance 400 МГц спектрометр. CDCl3 представляет собой дейтерохлороформ, ДМСО-d6 представляет собой гексадейтеродиметилсульфоксид, и CD3OD (или MeOD) представляет собой тетрадейтерометанол. Химические сдвиги приводили в частях на миллионотносительно тетраметилсилана (TMS) или ЯМР растворителя, являющегося внутренним стандартом. Сокращения для ЯМР данных являются следующими: с = синглет, д = дуплет, т = триплет, кв. = квадруплет, м = мультиплет, дд = дуплет дуплетов, дт = дуплет триплетов, арр = явный, ушир. = уширенный. J показывает ЯМР константу связывания, измеренную в герцах. Масс-спектры получали на приборах,применяя способ электроспрей ионизации (ES). Все температуры приведены в градусах Цельсия. Все другие сокращения представляют собой, как описано в ACS Style Guide (American Chemical Society,Washington, DC, 1986).LCMS условия. 1) Кислые условия: Подвижная фаза: вода, содержащая 0,05% TFA/0,05% ацетонитрил. Колонка: Agilent SB-C18 4,630 мм-1,8 мкм. Детектирование: MS и матричный фотодиодный детектор (PDA). 2) Основные условия: Подвижная фаза: вода, содержащая 10 ммоль NH4HCO3/ацетонитрил. Колонка: XBridgeTM C18 4,650 мм-3,5 мкм. Обнаружение: MS и матричный фотодиодный детектор (PDA).- 15023796 Колонка: Xbridge Prep C18 колонка (5 мкм, 1950 мм). Подвижная фаза: вода, содержащая 0,04% аммиак/ацетонитрил. Сокращения и источники Следующие сокращения и источники применяют в настоящем изобретении ниже:ChemBioDraw Ultra или MDL ISIS/Draw 2.5 SP1. Примеры Следующие способы получения и примеры даны для более конкретной иллюстрации настоящего изобретения. Предполагается, что данные примеры не ограничивают объем настоящего изобретения, но,скорее, обеспечивают специалиста в данной области техники руководством для получения и применения соединений, композиций и способов настоящего изобретения. Когда описывают конкретные варианты осуществления настоящего изобретения, специалисту в данной области техники ясно, что различные изменения и модификации можно осуществлять, не выходя за пределы объема и сущности настоящего изобретения. Промежуточные соединения Раствор 5-бромпиримидина (22,82 г, 144 ммоль), метил 2-пропеноата (14,83 г, 172 ммоль), ацетата палладия(II) (0,322 г, 1,435 ммоль), три-о-толилфосфина (0,874 г, 2,87 ммоль) и TEA (32,0 г, 3,16 ммоль) в DMF (100 мл) грели при 130 С в атмосфере N2 в течение 7 ч. После охлаждения реакционную смесь распределяли между водой (200 мл) и DCM (200 мл). Органическую фазу собирали, промывали водой(4 200 мл), соляным раствором, сушили над сульфатом натрия и концентрировали в вакууме, получая неочищенное заявленное в заголовке соединение в виде бледно-желтого твердого вещества (18,4 г,95 ммоль, 66,4%). ЖХМС: rt=1,01 мин, [М+Н+] = 165. Раствор метил (2 Е)-3-(5-пиримидинил)-2-пропеноата (19,2 г, 117 ммоль) и Pd/C (2 г, 1,879 ммоль) в метаноле (100 мл) перемешивали в атмосфере Н 2 при 50 С в течение ночи. Смесь фильтровали через слой целита и концентрировали, получая неочищенное заявленное в заголовке соединение в виде желтого масла (18 г, 56% выход). ЖХМС: rt=1,11 мин, [М+Н+] = 167. К охлажденному на льду раствору трет-BuOK (43,0 г, 384 ммоль) в безводном THF (300 мл), перемешиваемому в атмосфере азота, добавляли по каплям метилформиат (18,43 г, 307 ммоль) и метил 3-(пиримидин-5-ил)пропаноат (25,5 г, 153 ммоль) в безводном THF (10 мл) в течение 1 ч. Смесь перемешивали в течение 3 ч. Растворитель удаляли и остаток растворяли в воде (150 мл). Водную фазу промывали эфиром (3200 мл) и затем к водному раствору добавляли AcOH, доводя pH до 5. Твердое вещество собирали и сушили, получая целевое соединение. Фильтрат экстрагировали DCM (2200 мл) и объединенную органическую фазу сушили над сульфатом натрия, фильтровали и концентрировали. Две порции объединяли, получая заявленное в заголовке соединение в виде желтого твердого вещества (18 г, 57,4% выход). ЖХМС: rt=0,96 мин, [М+Н+] = 195. Смесь 5-бром-2-(метилокси)пиримидина (25,0 г, 132 ммоль), метил 2-пропеноата (13,7 г,159 ммоль), ацетата палладия(II) (0,297 г, 1,32 ммоль), три-о-толилфосфина (0,805 г, 2,65 ммоль) и триэтиламина (29,4 г, 291 ммоль) в DMF (75 мл) грели при 130 С в атмосфере N2 в течение 3 ч, затем разбавляли водой (200 мл) и DCM (200 мл). Органический слой собирали, промывали водой (4200 мл) и соляным раствором, сушили над сульфатом натрия и концентрировали, получая заявленное в заголовке соединение в виде бледно-желтого твердого вещества (24 г, 81%), который применяли без дополнительной очистки.(300 мг) в метаноле (250 мл) перемешивали при 50 С в атмосфере Н 2 в течение двух дней, фильтровали через слой целита и концентрировали, получая заявленное в заголовке соединение в виде желтого масла(20 г, 68%), который применяли без дополнительной очистки. ЖХМС: rt=1,17 мин, [М+Н+] = 196. К суспензии NaH (14,7 г, 367 ммоль) в DME (216 мл) добавляли по каплям смесь метил 3-[2-(метилокси)-5-пиримидинил]пропаноата (18 г, 92 ммоль) и метилформиата (33,1 г, 550 ммоль) вDME (216 мл) в атмосфере N2 при 0 С. Реакционную смесь перемешивали при 25 С в течение ночи, затем фильтровали через слой целита. Фильтрат разбавляли эфиром (500 мл), выдерживали в течение приблизительно 2 ч и повторно фильтровали. Остаток на фильтре промывали диэтиловым эфиром и сушили,получая заявленное в заголовке соединение (14 г, 51,7%), который применяли в следующей стадии без дополнительной очистки. Раствор 1-метил-1 Н-пиразола (20 г, 244 ммоль) в сухом DMF (50 мл) нагревали до 90 С, затем добавляли POCl3 (23,84 мл, 256 ммоль) по каплям в течение 1 ч, в то время как внутреннюю температуру- 17023796 поддерживали между 95-100 С. После нагревания в течение дополнительных 2 ч смесь охлаждали и выливали на лед (500 г). Ее экстрагировали DCM (2300 мл), объединенные органические фазы промывали соляным раствором (50 мл), сушили над MgSO4 и концентрировали, получая заявленное в заголовке соединение в виде коричневого масла (18 г). ЖХМС: rt=0,90 мин, [М+Н+] = 111. Смесь 1-метил-1 Н-пиразол-4-карбальдегида (13 г, 118 ммоль), малоновой кислоты (12,29 г,118 ммоль), пиридина (65 мл) и пиперидина (0,234 мл, 2,361 ммоль) грели при 110 С в атмосфере аргона в течение 4 ч. После охлаждения добавляли воду (100 мл) с последующим добавлением водного аммиака(12 мл), получая прозрачный раствор, который подкисляли до pH 1 хлористо-водородной кислотой. Осадок собирали фильтрацией, промывали водой и сушили, получая заявленное в заголовке соединениеH2SO4 (1,760 мл, 33,0 ммоль) в метаноле (40 мл) и полученную в результате смесь кипятили с обратным холодильником в течение 4 ч. Ее охлаждали до комнатной температуры, затем выливали на лед. Кислоту нейтрализовали водным гидроксидом натрия и экстрагировали DCM (280 мл). Органические фазы собирали и объединяли, сушили над MgSO4 и концентрировали. Остаток промывали петролейным эфиром и концентрировали, получая заявленное в заголовке соединение (7 г, 71,8% выход). ЖХМС: rt=1,13 мин, [М+Н+] = 167.(300 мл) добавляли Pd/C (4 г, 37,6 ммоль) при комнатной температуре. Реакционную смесь перемешивали при 40 С в течение 12 ч в атмосфере водорода. Реакционную смесь охлаждали до комнатной температуры, затем твердое вещество удаляли фильтрацией. Фильтрат концентрировали в вакууме, получая заявленное в заголовке соединение в виде бесцветного масла (17,8 г, 80% выход). ЖХМС: rt=1,27 мин, [М+Н+] = 169.(14,02 г, 233 ммоль) в сухом THF (20 мл) добавляли по каплям в течение 2 ч к перемешиваемой, охлажденной на льду суспензии трет-BuOK (31,2 г, 278 ммоль) в сухом THF (160 мл) в атмосфере аргона. Затем смесь нагревали до комнатной температуры и перемешивали в течение 16 ч. Растворители удаляли в вакууме и остаток растворяли в воде (50 мл). Раствор экстрагировали этилацетатом (230 мл) и водную фазу нейтрализовали 1 М HCl до рН 5. Твердое вещество собирали. Фильтрат экстрагировали этилацетатом (240 мл), сушили над Na2SO4, фильтровали и концентрировали в вакууме. Твердые остатки объединяли, получая заявленное в заголовке соединение в виде белого твердого вещества (9,1 г, 39,8% выход). ЖХМС: rt=1,05 мин, [М+Н+] = 197. Раствор бромацетонитрила (26,2 г, 218 ммоль) и трифенилфосфина (52,0 г, 198 ммоль) в этилацетате (240 мл) перемешивали при 85 С в течение ночи, фильтровали и промывали петролейным эфиром. Остаток на фильтре сушили на воздухе, получая заявленное в заголовке соединение в виде белого твердого вещества (75 г), которое применяли без дополнительной очистки. К смеси бромида (цианометил)трифенилфосфония (70,6 г, 185 ммоль) и гидроксида натрия (7,39 г,185 ммоль) в DCM (100 мл) и воде (300,00 мл) при 0 С добавляли 3-бром-4-фторбензальдегид (25,0 г,123 ммоль). Ее оставляли нагреваться до комнатной температуры и перемешивали в течение 2 ч. Органический слой отделяли и водный слой экстрагировали DCM дважды. Объединенные органические фазы сушили над Na2SO4 и концентрировали, получая неочищенный продукт, который промывали диэтиловым эфиром. Остаток очищали, получая заявленное в заголовке соединение в виде белого твердого вещества (35 г, 88% выход). ЖХМС: rt=1,50 мин, [М+Н+] = 226. К раствору (Е)-3-(3-бром-4-фторфенил)акрилонитрила (35,0 г, 108 ммоль) в этаноле (20 мл) при 0 С добавляли тетрагидроборат натрия (16,40 г, 434 ммоль). Реакционную смесь нагревали до 70 С и перемешивали в течение 4 ч. Добавляли воду для прекращения реакции и органический слой отделяли. Водный слой экстрагировали DCM дважды и объединенную органическую фазу сушили и концентрировали. Остаток очищали хроматографией, получая заявленное в заголовке соединение в виде масла (20 г, 64,7% выход). ЖХМС: rt=1,45 мин, [М+Н+] = 228.(6,32 мл, 156 ммоль) при 0 С добавляли ацетилхлорид (7,51 мл, 105 ммоль) по каплям в течение 5 мин. Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 2 ч. Смесь охлаждали до 0 С на ледяной бане, к которой добавляли по каплям аммиак (30,1 мл, 210 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Смесь фильтровали и фильтрат концентрировали, получая неочищенный продукт. Затем перекристаллизация из толуол/метанол (1:1) давала заявленное в заголовке соединение в виде белого твердого вещества (5,2 г, 93% выход). ЖХМС: rt=1,18 мин, [М+Н+] = 245.(100 мл) перемешивали при 115 С в течение 2,5 ч. После охлаждения смесь разбавляли водой, затем экстрагировали DCM (250 мл). Объединенную органическую фазу концентрировали, получая неочищенное заявленное в заголовке соединение в виде светло-желтого твердого вещества (6,0 г, 77% выход). Неочищенный продукт применяли без дополнительной очистки. ЖХМС: rt=1,20 мин, [М+Н+] = 389. Смесь 2-(3-бром-4-фторфенэтил)-5-(пиримидин-5-илметил)пиримидин-4(1 Н)-она (1,5 г, 3,7 ммоль),цианида меди(I) (399 мг, 4,4 ммоль) в NMP (5 мл) грели в микроволновом реакторе при 200 С в течение 1,5 ч. После охлаждения до комнатной температуры смесь фильтровали. Фильтрат распределяли между этилацетатом (20 мл) и водой (30 мл). Органическую фазу собирали, промывали водой (230 мл), соля- 19023796 ным раствором (20 мл), сушили над Na2SO4, фильтровали и концентрировали, получая заявленное в заголовке соединение в виде серого твердого вещества (1,0 г, 55% выход), которое применяли без дополнительной очистки. ЖХМС: rt=1,31 мин, [М+Н+] = 336.NMP (20 мл) грели в микроволновом реакторе при 130 С в течение 2 ч. Смесь очищали обращеннофазовой Biotage, получая заявленное в заголовке соединение (1,2 г, 40,6% выход). ЖХМС: время выдерживания = 2,52 мин, [М+Н+] = 419. Смесь 2-[2-(3-бром-4-фторфенил)этил]-5-[2-(метилокси)-5-пиримидинил]метил-4(1 Н)пиримидинона (300 мг, 0,716 ммоль) и цианида меди(I) (77 мг, 0,859 ммоль) в NMP (2 мл) грели в микроволновом реакторе при 200 С в течение 2 ч. Затем очистка Biotage давала заявленное в заголовке соединение (80 мг, 30,6% выход). ЖХМС: время выдерживания = 2,21 мин, [М+Н+] = 366. Смесь 4-хлор-3-(трифторметил)фенола (3,2 г, 16,28 ммоль), 4-фторбензальдегида (2,425 г,19,54 ммоль) и K2CO3 (3,38 г, 24,42 ммоль) в DMF (25 мл) грели в микроволновом реакторе при 120 С в течение 20 мин. Затем очистка ISCO системой давала заявленное в заголовке соединение в виде желтого твердого вещества (4,9 г, 100% выход). ЖХМС: время выдерживания = 3,78 мин, [М+Н+] = 300,9.(16,76 г,419 ммоль) добавляли к раствору 4-[4-хлор-3 трифторметил)фенил]оксибензальдегида (20 г, 66,5 ммоль) и йодида этилтрифенилфосфония (25,7 г,71,9 ммоль) в THF (140 мл) при 0 С. Полученную в результате смесь перемешивали при комнатной температуре в течение ночи. Добавляли медленно соляной раствор (80 мл), прекращая реакцию. Органическую фазу собирали и промывали соляным раствором (280 мл), сушили над безводным сульфатом натрия и концентрировали. Затем очистка колоночной хроматографией давала заявленное в заголовке соединение в виде бесцветного масла (15,75 г, 78% выход).(b) Обеспечивают альтернативным вариантом, получая соединение D21. К суспензии бромида метилтрифенилфосфония (64,7 г, 181 ммоль) в безводном тетрагидрофуране (THF) (20 мл) добавляли по каплям н-бутиллитий (113 мл, 181 ммоль) при -78 С в течение 30 мин. Реакционную смесь перемешивали в течение 1 ч и затем добавляли раствор 4-[4-хлор-3-(трифторметил)фенил]оксибензальдегида(36,3 г, 121 ммоль) в безводном тетрагидрофуране (15 мл). Реакционную смесь нагревали медленно до комнатной температуры и перемешивали в течение ночи при комнатной температуре. Смесь гасили водой и экстрагировали этилацетатом. Органическую фазу сушили безводным Na2SO4 и концентрировали при пониженном давлении. Неочищенный образец очищали колонкой с силикагелем (220 г), применяя гексан/этилацетат (20:1) в качестве элюента, получая заявленное в заголовке соединение (28 г, 94 ммоль,78% выход). ЖХМС: время выдерживания = 4,29 мин. 9-BBN (158 мл, 79 ммоль) добавляли к раствору 1-хлор-2-(трифторметил)-4-(4 винилфенокси)бензола (15,75 г, 52,7 ммоль) в THF (160 мл) при 0 С. Полученную в результате реакционную смесь перемешивали при комнатной температуре в течение ночи. К смеси добавляли воду (16 мл),3 М NaOH раствор (80 мл) и 30% пероксид водорода (80 мл). Ее перемешивали при 50 С в течение 2 ч,концентрировали в вакууме и разбавляли этилацетатом (200 мл). Органическую фазу собирали, промывали водой (2100 мл) и соляным раствором (100 мл), сушили над сульфатом натрия и концентрировали. Затем очистка колоночной хроматографией давала заявленное в заголовке соединение в виде бесцветного масла (12,13 г, 71,7% выход). ЖХМС: время выдерживания = 2,08 мин, [М+Н+] = 299.DCM (30 мл) и воде (60 мл) добавляли 4-[4-хлор-3-(трифторметил)фенил]оксибензальдегид (13,0 г,43,2 ммоль) при 0 С. Ее перемешивали при комнатной температуре в течение 4 ч. Очистка флэшхроматографией давала заявленное в заголовке соединение в виде белого твердого вещества (12 г).(18,0 г,55,6 ммоль) и Pd/C (2,00 г, 1,88 ммоль) в THF (150 мл) перемешивали при 25 С в атмосфере Н 2 в течение ночи, фильтровали через слой целита и концентрировали. Очистка колоночной хроматографией давала заявленное в заголовке соединение в виде белого твердого вещества (15 г). К раствору 3-(4-[4-хлор-3-(трифторметил)фенил]оксифенил)пропаннитрила (20,0 г, 61,4 ммоль) в толуоле (30 мл) и метаноле (30 мл) добавляли по каплям ацетилхлорид (18,8 г, 239 ммоль) в течение 5 мин при 0 С в атмосфере N2. Реакционную смесь перемешивали при 25 С в течение 8 ч, затем концентрировали. Ее растворяли в толуоле (5 мл), охлаждали до 0 С в бане со льдом, медленно смешивали с аммиаком (30,0 мл, 210 ммоль), перемешивали при 25 С в течение ночи, фильтровали, промывали смесью толуол/метанол (1/1) и концентрировали. Затем очистка перекристаллизацией из диэтилового эфира(50 мл) давала заявленное в заголовке соединение в виде белого твердого вещества (5,4 г, 25,7%). 4-[4-Хлор-3-(трифторметил)фенил]оксибензальдегид (3 г, 9,98 ммоль) смешивали со спиртовым раствором метиламина (1,549 г, 49,9 ммоль). Реакционную смесь перемешивали при 23 С в течение ночи. Добавляли NaBH4 (1,132 г, 29,9 ммоль) и перемешивали в течение дополнительных 2 ч. Затем очистка ISCO системой давала заявленное в заголовке соединение в виде желтого твердого вещества. ЖХМС: время выдерживания = 2,53 мин, [М+Н+] = 316,1.(77 мг, 0,998 ммоль) в AcOH (5 мл) добавляли нитрометан (0,323 мл, 5,99 ммоль). Ее грели при 120 С в течение 3 ч, затем концентрировали в вакууме. Остаток растворяли в DCM (30 мл), промывали насыщенным NaHCO3 водным раствором (220 мл) и соляным раствором. Органическую фазу собирали, сушили над Na2SO4, фильтровали, концентрировали, получая заявленное в заголовке соединение в виде коричневого твердого вещества (680 мг, 66,4% выход), которое применяли без дополнительной очистки. ЖХМС: время выдерживания = 4,17 мин, [М+Н+] = 344,1. К раствору (Е)-1-хлор-4-(4-(2-нитровинил)фенокси)-2-(трифторметил)бензола (640 мг, 1,862 ммоль) в 2-пентаноле (5 мл) и хлороформе (15,00 мл) добавляли силикагель (2 г) и затем NaBH4 (282 мг,7,45 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 3 ч. Смесь очищали флэш колонкой, получая заявленное в заголовке соединение (330 мг, 49,2% выход). ЖХМС: время выдерживания = 4,62 мин, [M+H+] = NA. К смеси 1-хлор-4-(4-(2-нитроэтил)фенокси)-2-(трифторметил)бензола (17 г, 49,2 ммоль) и гексагидрата хлорида никеля (II) (46,6 г, 197 ммоль) в метаноле (300 мл) при 0 С добавляли порциями NaBH4(3,72 г, 98 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Очистка колоночной хроматографией давала заявленное в заголовке соединение в виде желтого масла (8,86 г, 51,4% выход). ЖХМС: время выдерживания = 2,51 мин, [М+Н+] = 316,1.(20 г, 164 ммоль). Внутреннюю температуру повышали выше 20 С в процессе добавления. После завершения добавления, мутную смесь оставляли при комнатной температуре с периодическим перемешиванием до того, как она станет гомогенной и не будет содержать кристаллов (в течение ночи). Затем ее выливали при перемешивании в 500 мл дробленого льда и воду. Выпавший нитрогуанидин фильтровали. Затем перекристаллизация из 400 мл кипящей воды давала заявленное в заголовке соединение в виде игольчатых кристаллов (17 г, 100% выход). К раствору N-нитрогуанидина (912 мг, 8,76 ммоль) в этаноле (50,0 мл) добавляли метил 2-формил 3-(1-метил-1 Н-пиразол-4-ил)пропаноат (858 мг, 4,38 ммоль). Его перемешивали при 70 С в течение ночи. После удаления растворителя добавляли 10 мл воды. Затем добавляли HCl (конц.), доводя до рН 3, и раствор перемешивали при 0 С в течение 1 ч. Твердое вещество собирали фильтрацией. Его сушили в течение ночи при 50 С, получая заявленное в заголовке соединение в виде грязно-белого твердого вещества (674 мг, 61,5% выход). ЖХМС: время выдерживания = 1,17 мин, [М+Н+] = 251,1. К раствору метил 2-формил-3-[2-(метилокси)-5-пиримидинил]пропаноата (2 г, 8,92 ммоль) и третбутоксида калия (3,00 г, 26,8 ммоль) в этаноле (15 мл) добавляли чистый N-нитрогуанидин (1,857 г,17,84 ммоль). Реакционную смесь перемешивали при 120 С в течение 1 ч. После удаления растворителя добавляли 5 мл воды, растворяя твердое вещество, и HCl (конц.) применяли для доведения до рН 3. Осадок собирали, получая заявленное в заголовке соединение (1,8 г, 72,5% выход). ЖХМС: время выдерживания = 0,96 мин, [М+Н+] = 279,1. Раствор 5-[2-(метилокси)-5-пиримидинил]метил-2-(нитроамино)-4(1 Н)-пиримидинона (200 мг,0,719 ммоль) в хлороформе (5 мл) смешивали с метилйодидом (0,054 мл, 0,863 ммоль). Реакционную смесь перемешивали при 23 С в течение ночи. Затем очистка обращенно-фазовой Biotage давала заявленное в заголовке соединение (35 мг, 16,66% выход). ЖХМС: время выдерживания = 1,62 мин, [М+Н+] = 293,1.(500 мг,1,998 ммоль) и DIPEA (1,745 мл, 9,99 ммоль) в хлороформе (5 мл) смешивали с метилйодидом (0,150 мл,2,398 ммоль). Реакционную смесь перемешивали при 23 С в течение ночи. Затем очистка ВЭЖХ давала заявленное в заголовке соединение (103 мг, 19,51% выход). ЖХМС: время выдерживания = 1,46 мин, [М+Н+] = 265,1.(150 мг, 1,365 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Затем очистка обращенно-фазовой Biotage давала заявленное в заголовке соединение (315 мг, 93% выход) в виде белого порошка. ЖХМС: время выдерживания = 2,88 мин, [М+Н+] = 371,9. К смеси 4-бромбензонитрила (2,6 г, 14,28 ммоль), Pd(OAc)2 (0,064 г, 0,286 ммоль) и три-о-толилфосфина (0,261 г, 0,857 ммоль) в сухом DMF (20 мл) добавляли этил 2-пропеноат (2,282 мл,21,43 ммоль) и TEA (3,98 мл, 28,6 ммоль). Ее грели при 110 С в течение 1 ч. Затем очистка колоночной флэш-хроматографией давала заявленное в заголовке соединение в виде белого твердого вещества (2,7 г,92% выход). ЖХМС: время выдерживания = 3,03 мин, [М+Н+] = 202,0.(2,7 г, 13,42 ммоль) в этилацетате (40 мл) в атмосфере аргона. Его смешивали с TEA (3,74 мл,26,8 ммоль) и муравьиной кислотой (2,57 мл, 67,1 ммоль). Реакционную смесь кипятили с обратным холодильником при 90 С в атмосфере аргона в течение 1 ч. Затем ее фильтровали через слой целита. Затем фильтрат промывали водой, 5% NaHCO3 раствором и соляным раствором, сушили над Na2SO4 и концентрировали, получая заявленное в заголовке соединение в виде бледно-желтого масла (2,65 г, 97% выход). ЖХМС: время выдерживания =2,94 мин, [М+Н+] = 204,0. К раствору этил[бис-(метилокси)фосфорилил]ацетата (1,980 мл, 11,99 ммоль) в THF-DMF (60 мл,v/v=5:1) при 0 С добавляли порциями трет-BuOK (1,458 г, 12,99 ммоль). Полученную в результате смесь перемешивали при комнатной температуре в течение 30 мин, затем смешивали с раствором 2,4,6-трифторбензальдегида (1,6 г, 9,99 ммоль) в THF (10 мл) при 0 С. Ее нагревали до комнатной температуры и смесь перемешивали в течение 45 мин. Ее смешивали с водным хлоридом аммония и затем экстрагировали этилацетатом. Органический слой промывали соляным раствором, сушили над Na2SO4,фильтровали и концентрировали. Остаток очищали колоночной флэш-хроматографией, получая заявленное в заголовке соединение в виде бледно-желтого масла (2,0 г, 87% выход). ЖХМС: время выдерживания = 3,52 мин, [М+Н+] = 231,1.TEA (2,409 мл, 17,38 ммоль) и муравьиной кислоты (1,666 мл, 43,4 ммоль). Реакционную смесь кипятили с обратным холодильником при 90 С в атмосфере аргона в течение 1 ч. Реакционную смесь фильтровали через слой целита и затем фильтрат промывали водой, 5% NaHCO3 раствором и соляным раствором перед сушкой над Na2SO4. Удаление растворителя при пониженном давлении давало заявленное в заголовке соединение в виде бледно-желтого масла (1,8 г, 89% выход). К суспензии NaH (1,102 г, 27,6 ммоль) в DME (15 мл) добавляли по каплям раствор этил 3-(4-цианофенил)пропаноата (1,4 г, 6,89 ммоль) и этилформиата (2,77 мл, 34,4 ммоль) в DME (15 мл). Затем реакционную смесь перемешивали при комнатной температуре в течение ночи. Ее нейтрализовали уксусной кислотой (1,7 мл), затем экстрагировали EtOAc. Органические фазы собирали, промывали соляным раствором, сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали колоночной флэш-хроматографией, элюируя РЕ:ЕА=2:1, получая заявленное в заголовке соединение в виде бледножелтого масла (1,3 г, 82% выход). ЖХМС: время выдерживания = 2,47 и 3,13 мин (смесь кетонового и енольного изомеров), [М+Н+] = 232, 2. К суспензии NaH (2,338 г, 58,5 ммоль) в DME (20 мл) добавляли по каплям раствор этил 3-фенилпропаноата (3,2 г, 19,49 ммоль) и этилформиата (6,28 мл, 78 ммоль) в DME (20 мл) при комнатной температуре. Затем реакционную смесь перемешивали в течение ночи. Ее нейтрализовали уксусной кислотой (4 мл), затем экстрагировали EtOAc. Органическую фазу собирали, промывали соляным раствором, сушили над Na2SO4, фильтровали и концентрировали, получая неочищенное заявленное в заголовке соединение (4,02 г, 100% выход). ЖХМС: время выдерживания = 2,82 и 3,51 мин (смесь кетонового и енольного изомеров), [М+Н+] = 207,1. К суспензии NaH (1,240 г, 31,0 ммоль) в DME (15 мл) добавляли по каплям раствор этил 3-(2,4,6-трифторфенил)пропаноата (1,8 г, 7,75 ммоль) и этилформиата (3,12 мл, 38,8 ммоль) в DME(15 мл) при комнатной температуре. Затем реакционную смесь перемешивали в течение ночи. Ее нейтрализовали уксусной кислотой (1,8 мл), затем экстрагировали ЕА. Органический слой собирали, промывали соляным раствором, сушили над Na2SO4, фильтровали и концентрировали, получая заявленное в заголовке соединение (2,017 г, 100% выход). ЖХМС: время выдерживания = 2,98 и 3,67 мин, [М+Н+] = 261,0, в виде смеси кетонового К раствору 2-(4-[4-хлор-3-(трифторметил)фенил]оксифенил)этанола (2,63 г, 8,30 ммоль) и цианамида (0,419 г, 9,97 ммоль) в сухом THF (25 мл) в атмосфере аргона добавляли трифторметансульфокислоту (0,885 мл, 9,97 ммоль).Смесь грели при 55 С в течение 3 ч. Затем очистка обращенно-фазовойK2CO3 (23,45 г, 170 ммоль) добавляли к раствору 3-(трифторметил)фенола (25 г, 154 ммоль) и 4-фторбензальдегида (19,14 г, 154 ммоль) в DMF (300 мл) и реакционную смесь перемешивали при 140 С в течение 4 ч. После охлаждения до комнатной температуры реакционную смесь выливали в ледя- 24023796 ную воду (2500 мл), экстрагировали этилацетатом (2500 мл) и промывали соляным раствором(2200 мл). Органическую фазу сушили сульфатом натрия, фильтровали и концентрировали, получая заявленное в заголовке соединение в виде коричневого твердого вещества (35 г, 66,9% выход). ЖХМС: время выдерживания = 1,62 мин, [М+Н+] = 267.NaH (23,66 г, 592 ммоль) добавляли к раствору 4-(3-(трифторметил)фенокси)бензальдегида (25 г,94 ммоль) и йодида метилтрифенилфосфония (36,2 г, 101 ммоль) в THF (180 мл) при 0 С. Реакционную смесь перемешивали при комнатной температуре в течение ночи. Затем очистка колоночной флэшхроматографией давала заявленное в заголовке соединение в виде бесцветного масла (24,4 г, 98% выход).(24,4 г, 92 ммоль) в THF (200 мл) при 0 С и полученную в результате реакционную смесь перемешивали при комнатной температуре в течение ночи. К смеси медленно добавляли 3 М NaOH раствор (140 мл) и 30% пероксид водорода (123 мл) при 0 С и реакционную смесь перемешивали при 50 С в течение 2 ч. Затем очистка колоночной хроматографией давала заявленное в заголовке соединение в виде бесцветного масла (17 г, 63,8% выход). ЖХМС: время выдерживания = 1,79 мин, [М-OH]+ = 265. К раствору 2-(4-(3-(трифторметил)фенокси)фенил)этанола (1,395 г, 4,94 ммоль) и цианамида (0,249 г, 5,93 ммоль) в THF (15 мл) добавляли трифлатную кислоту (0,527 мл, 5,93 ммоль) в атмосфере аргона. Смесь грели при 55 С в течение 3 ч. Смесь очищали обращенно-фазовой Biotage с TFA, получая заявленное в заголовке соединение (1,4 г, 59,8% выход). ЖХМС: время выдерживания = 1,23 мин, [М+Н+] = 325. К суспензии трет-бутоксида калия (3,86 г, 34,4 ммоль) в THF (20 мл) в атмосфере азота при комнатной температуре добавляли раствор этилбутаноата (2,275 мл, 17,22 ммоль) в диэтиловом эфире (20,0 мл). Реакционную смесь перемешивали при комнатной температуре в течение 3 ч. Смесь гасили и концентрировали, получая заявленное в заголовке соединение. ЖХМС: время выдерживания =2,34 мин, [М+Н+] = 143. Смесь 4-хлор-3-(трифторметил)фенола (3,4 г, 17,30 ммоль), 3,4,5-трифторбензальдегида (2,7 г,16,87 ммоль) и K2CO3 (2,80 г, 20,24 ммоль) в DMF грели в микроволновом реакторе при 60 С в течение 1 ч. Затем очистка колоночной флэш-хроматографией давала заявленное в заголовке соединение (4,5 г,79% выход). ЖХМС: время выдерживания = 3,88 мин, [М+Н+] = 337. К суспензии бромида метилтрифенилфосфония (5,73 г, 16,04 ммоль) в безводном THF (20 мл) добавляли по каплям н-бутиллитий (10,03 мл, 16,04 ммоль) при -78 С в течение 30 мин. Ее перемешивали в течение 1 ч, затем добавляли 4-[4-хлор-3-(трифторметил)фенил]окси-3,5-дифторбензальдегид (4,5 г,13,37 ммоль). Ее нагревали медленно до комнатной температуры и перемешивали в течение ночи при комнатной температуре. Затем очистка колоночной флэш-хроматографией давала заявленное в заголовке соединение (3,2 г, 71,5% выход). К раствору 4-хлор-3-(трифторметил)фенил 4-этенил-2,6-дифторфенилового эфира (3,2 г,9,56 ммоль) в THF (10 мл) добавляли по каплям 9-BBN (38,2 мл, 19,12 ммоль) при 0 С. Реакционную смесь перемешивали при комнатной температуре в течение ночи. Ее смешивали с NaOH (19,12 мл,57,4 ммоль) и H2O2 (5,86 мл, 57,4 ммоль), смесь перемешивали при 55 С в течение 4 ч. Ее гасили Na2SO3 и экстрагировали ЕА (3100 мл). Органические фазы собирали, объединяли, сушили безводным Na2SO4 и концентрировали, получая заявленное в заголовке соединение (3,10 г, 92% выход). ЖХМС: время выдерживания = 4,72 мин, [М+Н+] = 352.(3,1 г,8,79 ммоль) и цианамида (0,443 г, 10,55 ммоль) в безводном THF (20 мл) добавляли трифторметансульфокислоту (1,873 мл, 21,10 ммоль) при 0 С. Реакционную смесь перемешивали при 60 С в течение 4 ч. Затем очистка обращенно-фазовой Biotage давала заявленное в заголовке соединение в виде белого твердого вещества (1,5 г, 31,3% выход). ЖХМС: время выдерживания = 3,64 мин, [М+Н+] = 395. Смесь 4-хлор-3-(трифторметил)фенола (7,61 г, 38,7 ммоль), 3, 4-дифторбензальдегида (5,0 г,35,2 ммоль) и Cs2CO3 (11,46 г, 35,2 ммоль) грели в микроволновом реакторе при 80 С в течение 1 ч. Затем очистка колоночной флэш-хроматографией давала заявленное в заголовке соединение (9,0 г, 80% выход). ЖХМС: время выдерживания = 3,80 мин, [М+Н+] = 319. К суспензии бромида метилтрифенилфосфония (6,73 г, 18,83 ммоль) в безводном THF (20 мл) добавляли по каплям н-бутиллитий (11,77 мл, 18,83 ммоль) при -78 С в течение 30 мин. Ее перемешивали в течение 1 ч, затем добавляли 4-[4-хлор-3-(трифторметил)фенил]окси-3-фторбензальдегид (5,0 г,15,69 ммоль). Ее нагревали медленно до комнатной температуры и перемешивали в течение ночи при комнатной температуре. Затем очистка колоночной флэш-хроматграфией давала заявленное в заголовке соединение (4,0 г, 80% выход). ЖХМС: время выдерживания =5,7 мин, [М+Н+] = 316.THF (13 мл) добавляли по каплям 9-BBN (50,5 мл, 25,3 ммоль) при 0 С. Реакционную смесь перемешивали при комнатной температуре в течение ночи, затем смешивали с NaOH (25,3 мл, 76 ммоль) и Н 2 О 2(7,74 мл, 76 ммоль). Смесь перемешивали при 55 С в течение 4 ч, гасили Na2SO3 и экстрагировали ЕА(2,55 мл, 28,7 ммоль) при 0 С. Реакционную смесь перемешивали при 60 С в течение 4 ч. Затем очистка обращенно-фазовой Biotage давала заявленное в заголовке соединение в виде белого твердого вещества Смесь 4-хлор-3-(трифторметил)фенола (2 г, 10,18 ммоль), K2CO3 (2,109 г, 15,26 ммоль) и 4-фторбензонитрила (1,232 г, 10,18 ммоль) в DMF (20 мл) грели при 120 С в течение ночи. Ее разбавляли водой и экстрагировали EtOAc. Органические фазы собирали, промывали водой и соляным раствором,сушили над Na2SO4 и концентрировали, получая заявленное в заголовке соединение в виде коричневого масла. ЖХМС: время выдерживания = 3,81 мин, [М+Н+] = 298. К суспензии LiAlH4 (280 мг, 7,38 ммоль) в сухом THF (15 мл) при 0 С в атмосфере N2 добавляли 4-[4-хлор-3-(трифторметил)фенил]оксибензонитрил (1,5 г, 5,04 ммоль) в THF (10 мл) по каплям. Раствор перемешивали при комнатной температуре в течение 2,5 ч. Затем очистка обращенно-фазовойDIPEA (0,337 мл, 1,929 ммоль) в сухом DMF (8 мл) добавляли 1 Н-пиразол-1-карбоксимидамид (285 мг,1,929 ммоль). Реакционную смесь герметично закрывали и перемешивали при комнатной температуре в течение ночи. Затем очистка обращенно-фазовой Biotage давала заявленное в заголовке соединение в виде желтого твердого вещества. ЖХМС: время выдерживания = 2,78 мин, [М+Н+] = 344.(175 мг, 1,185 ммоль). Реакционную колбу герметично закрывали и перемешивали при комнатной температуре в течение ночи. Затем очистка обращенно-фазовой Biotage давала заявленное в заголовке соединение в виде белого твердого вещества. ЖХМС: время выдерживания = 2,88 мин, [М+Н+] = 358.(200 мл) добавляли K2CO3 (13,33 г, 96 ммоль). Смесь грели при 140 С в течение 4 ч. После охлаждения до комнатной температуры смесь выливали в ледяную воду (300 мл) и выдерживали в течение ночи. Твердое вещество собирали фильтрацией, промывали водой, перерастворяли в ЕА (200 мл) и промывали соляным раствором (100 мл). Органическую фазу сушили сульфатом натрия, фильтровали и концентрировали, получая заявленное в заголовке соединение (17 г, 7 5 ммоль, 84% выход) в виде желтого твердого вещества. ЖХМС: время выдерживания = 1,52 мин, [М+Н+] = 217. К раствору бромида (цианометил)трифенилфосфония (10,61 г, 27,8 ммоль) и NaOH (1,387 г,- 27023796 34,7 ммоль) в воде (30 мл) и DCM (15 мл) добавляли 4-(4-фторфенокси)бензальдегид (5 г, 23,13 ммоль) при 0 С. Смесь перемешивали при комнатной температуре в течение 4 ч. Добавляли к смеси DCM(50 мл) и воду (50 мл), органическую фазу промывали водой (50 мл), соляным раствором (50 мл), сушили над безводным сульфатом натрия и концентрировали. Очистка флэш-хроматографией давала заявленное в заголовке соединение (5,1 г, 21,09 ммоль, 91% выход) в виде белого твердого вещества. ЖХМС: время выдерживания = 1,60 мин, [М+Н+] = 240. К раствору 3-(4-(4-фторфенокси)фенил)акрилонитрила (5 г, 20,90 ммоль) в этаноле (80 мл) добавляли NaBH4 (5,44 г, 144 ммоль). Смесь грели при 70 С в течение ночи. После охлаждения до комнатной температуры реакционную смесь гасили водой (50 мл) и этанол удаляли при пониженном давлении. Остаток распределяли между ЕА (100 мл) и водой (50 мл). Органическую фазу промывали насыщеннымNaHCO3 раствором (80 мл), соляным раствором (50 мл), сушили над сульфатом натрия, концентрировали и очищали флэш-хроматографией, получая заявленное в заголовке соединение (4,7 г, 16,48 ммоль, 79% выход) в виде белого твердого вещества. ЖХМС: время выдерживания = 1,55 мин, [М+Н+] = 242. К раствору 3-(4-(4-фторфенокси)фенил)пропаннитрила (4,4 г, 18,24 ммоль) в толуоле (25 мл) и метаноле (5,94 мл) добавляли по каплям AcCl (6,48 мл, 91 ммоль) при 0 С в течение 5 мин. Смесь перемешивали при комнатной температуре в течение 2 ч. Смесь охлаждали до 0 С в ледяной бане и добавляли по каплям аммиак (26,1 мл, 182 ммоль) в метаноле в течение 5 мин. Смесь перемешивали при комнатной температуре в течение ночи. Смесь фильтровали для удаления твердых веществ и твердые вещества промывали толуолом (40 мл) и метанолом (40 мл). Объединенный фильтрат концентрировали в вакууме,остаток растирали с диэтиловом эфиром, полученное в результате белое твердое вещество собирали фильтрацией, промывали диэтиловым эфиром и сушили в вакууме, получая заявленное в заголовке соединение (5,4 г, 16,12 ммоль, 88% выход) в виде белого твердого вещества. ЖХМС: время выдерживания = 1,03 мин, [М+Н+] = 259. К раствору 3-(4-(4-хлор-3-(трифторметил)фенокси)фенил)пропаннитрила (1 г, 3,07 ммоль) в толуоле (4 мл) и метаноле (1 мл) добавляли по каплям AcCl (1,091 мл, 15,35 ммоль) при 0 С в течение 5 мин. Смесь перемешивали при комнатной температуре в течение 2 ч. Смесь охлаждали до 0 С в ледяной бане и добавляли по каплям аммиак (4,39 мл, 30,7 ммоль) в метаноле в течение 5 мин. Смесь перемешивали при комнатной температуре в течение ночи. Смесь фильтровали для удаления твердых веществ и твердое вещество промывали толуолом (20 мл) и метанолом (20 мл). Объединенный фильтрат концентрировали в вакууме, остаток растирали с диэтиловым эфиром, полученное в результате белое твердое вещество собирали фильтрацией, промывали диэтиловым эфиром и сушили в вакууме, получая заявленное в заголовке соединение (0,85 г, 2,242 ммоль, 73% выход) в виде белого твердого вещества. ЖХМС: время выдерживания = 1,17 мин, [М+Н+] = 343. К раствору бромида (цианометил)трифенилфосфония (8,61 г, 22,54 ммоль) и NaOH (1,127 г,28,2 ммоль) в воде (24 мл) и DCM (12 мл) добавляли 4-(3-(трифторметил)фенокси)бензальдегид (5 г,18,78 ммоль) при 0 С. Смесь перемешивали при комнатной температуре в течение 4 ч. Добавляли к смеси DCM (50 мл) и воду (50 мл), органическую фазу промывали водой (50 мл), соляным раствором(50 мл), сушили над безводным сульфатом натрия и концентрировали. Очистка флэш-хроматографией давала заявленное в заголовке соединение (5,07 г, 17,26 ммоль, 92% выход) в виде бледно-желтого масла(медленно затвердевало, образуя белое твердое вещество). ЖХМС: время выдерживания = 1,67 мин, [М+Н+] = 290.(80 мл) добавляли NaBH4 (4,5 г, 119 ммоль). Реакционную смесь перемешивали при 70 С в течение ночи. После охлаждения до комнатной температуры реакционную смесь гасили водой (50 мл) и этанол удаляли при пониженном давлении. Остаток распределяли между ЕА (100 мл) и водой (50 мл). Органическую фазу промывали насыщенным NaHCO3 раствором (80 мл), соляным раствором (50 мл), сушили над сульфатом натрия, концентрировали и очищали флэш-хроматографией, получая заявленное в заголовке соединение (4,3 г, 13,89 ммоль, 80% выход) в виде бесцветного масла. ЖХМС: время выдерживания = 1,64 мин, без MS сигнала.(18 мл) и метаноле (4,47 мл) добавляли по каплям AcCl (4,88 мл, 68,7 ммоль) при 0 С в течение 5 мин. Смесь перемешивали при комнатной температуре в течение 2 ч. Смесь охлаждали до 0 С в ледяной бане и добавляли по каплям аммиак (19,62 мл, 137 ммоль) в метаноле в течение 5 мин. Смесь перемешивали при комнатной температуре в течение ночи. Смесь фильтровали для удаления твердых веществ и твердое вещество промывали толуолом (40 мл) и метанолом (40 мл). Фильтрат концентрировали в вакууме. Остаток растирали с диэтиловым эфиром, получая только следы белого твердого вещества (0,3 г). Фильтрат концентрировали в вакууме, получая заявленное в заголовке соединение (3,13 г,8,03 ммоль, 58,5% выход) в виде бледно-желтого твердого вещества. ЖХМС: время выдерживания = 1,07 мин, [М+Н+] = 309. К раствору 4-(4-фторфенокси)бензальдегида (10 г, 46,3 ммоль) в метаноле (50 мл) добавляли порциями NaBH4 (1,750 г, 46,3 ммоль), после добавления смесь перемешивали при комнатной температуре в течение ночи. После удаления растворителя остаток разбавляли DCM (50 мл), суспензию фильтровали через слой целита, фильтрат концентрировали, получая заявленное в заголовке соединение (7 г,30,5 ммоль, 65,9% выход) в виде серого твердого вещества. ЖХМС: время выдерживания = 1,49 мин, [М+Н+] = 219. К раствору (4-(4-фторфенокси)фенил)метанола (7 г, 32,1 ммоль) и пиридина (5,19 мл, 64,2 ммоль) в дифторметане (DCM) (100 мл) добавляли дихлорид серы (7,63 г, 64,2 ммоль) по каплям при 0 С. После добавления смесь перемешивали при комнатной температуре в течение ночи. Смесь промывали насыщенным NaHCO3 раствором (240 мл) и соляным раствором (40 мл), органическую фазу сушили надNa2SO4, фильтровали и концентрировали, получая неочищенный продукт, который очищали колоночной хроматографией (силикагель, элюирование РЕ:EtOAc=6:1), получая чистый 1-(хлорметил)-4-(4 фторфенокси)бензол (2,2 г, 8,83 ммоль, 27,5% выход) в виде светло-желтого масла. ЖХМС: время выдерживания = 1, 56 мин, [М+Н+] = 237.(200 мл) добавляли медленно порциями NaBH4 (2,64 г, 69,8 ммоль). Смесь перемешивали при комнатной температуре в течение ночи. После удаления растворителя остаток разбавляли DCM. Полученную в результате суспензию фильтровали, фильтрат концентрировали в вакууме, получая заявленное в заголовке соединение (17,6 г, 55,2 ммоль, 79% выход) в виде желтого твердого вещества. ЖХМС: время выдерживания = 1,71 мин, [М+Н+] = 303, 305.
МПК / Метки
МПК: C07D 401/12, C07D 403/12, C07D 239/47, C07D 239/36, C07D 413/06, C07D 417/06, C07D 403/06, C07D 239/56, C07D 401/14, C07D 403/14, C07D 239/52, C07D 401/06
Метки: пиримидиноновые, соединения, состояний, лечении, заболеваний, применения, опосредованных, lp-pla2
Код ссылки
<a href="https://eas.patents.su/30-23796-pirimidinonovye-soedineniya-dlya-primeneniya-v-lechenii-zabolevanijj-ili-sostoyanijj-oposredovannyh-lp-pla2.html" rel="bookmark" title="База патентов Евразийского Союза">Пиримидиноновые соединения для применения в лечении заболеваний или состояний, опосредованных lp-pla2</a>
Предыдущий патент: Назальное распылительное устройство
Следующий патент: Композиции, состоящие из гербицида и защитного вещества
Случайный патент: Способ лечения злокачественной опухоли с использованием анти-erbb3 антитела


































