Соединения и композиции в качестве ингибиторов протеинкиназы
Номер патента: 18282
Опубликовано: 28.06.2013
Авторы: Марсилдже Томас Х., Нгуйен Трук Нгок, Хуан Чэнь, Мишелли Пьерр-Ив, Чэнь Бэй, Пэй Вэй, Гэ Йонсюй, Ву Баогэнь, Ли Юньчэн, Гао Чжаобо, Цзян Тао, Чжу Сюфэн
Формула / Реферат
1. Соединение формулы (1)
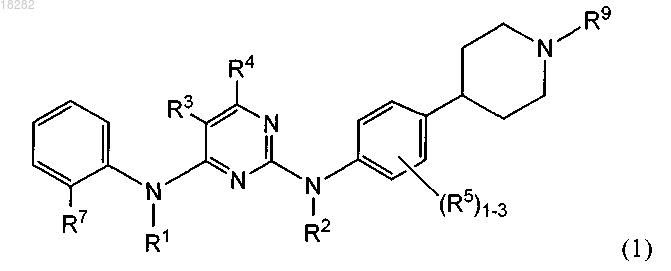
или его физиологически приемлемая соль,
где R1 и R2 представляют собой H;
R3 представляет собой галоген;
R4 представляет собой H;
альтернативно, R3 и R4 вместе с атомами углерода, к которым они присоединены, могут образовывать 5-6-членное кольцо, содержащее 1-3 гетероатома азота и необязательно замещенное 1-2 группами R10, где R10 представляет собой галоген, C1-6алкил, фенил или NR2;
R5 представляет собой C1-6алкил или C1-6алкоксигруппу;
R7 представляет собой S(O)0-2R19 или S(O)2NRR20, где R19 и R20 независимо представляют собой C1-6алкил или галогензамещенный C1-6алкил или R20 представляет собой H;
R9 представляет собой -L-CR(OR17)-CtF(2t+1), где t имеет значение 1-3; -L-S(O)2R18, -L-S(O)2NRR17,
-L-S(O)2NR(CR2)pNR(R17), -L-S(O)2NR(CR2)pOR17 или радикал, выбранный из формул (а), (b), (с) или (d):
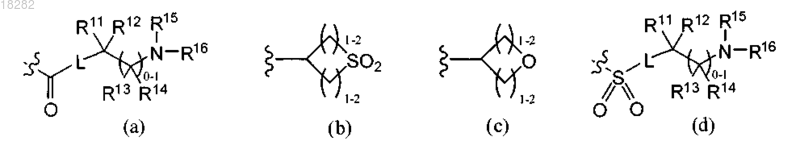
где R11, R12, R13, R14, R15 и R16 независимо выбраны из Н или C1-6алкила или
R11 и R12, R12 и R15, R15 и R16, R13 и R14 или R13 и R15 вместе с атомами углерода и/или азота, к которым они присоединены, могут образовывать 3-7-членное насыщенное, ненасыщенное или частично ненасыщенное кольцо, необязательно содержащее 1-2 гетероатома, выбранных из N и О;
L представляет собой (CR2)1-4 или связь;
каждый R и R17 независимо представляют собой H или C1-6алкил;
R18 представляет собой C1-6алкил;
p имеет значение 2-4.
2. Соединение по п.1, где указанное соединение имеет формулу (3)

где R3 представляет собой галоген;
альтернативно, R3 и R4 вместе с атомами углерода, к которым они присоединены, могут образовывать 5-6-членное кольцо, содержащее 1-3 гетероатома азота и необязательно замещенное 1-2 группами R10;
R5a и R5b независимо представляют собой C1-6алкил или C1-6алкоксигруппу;
R7 представляет собой S(O)0-2R19;
R1, R2, R4, R9, R10 и R19 являются такими, как определено в п.1.
3. Соединение по п.2, где R5a представляет собой метоксигруппу или изопропоксигруппу и R5b представляет собой метил.
4. Соединение по п.1, где указанное соединение имеет формулу (3A), (3B), (3C) или (3D):
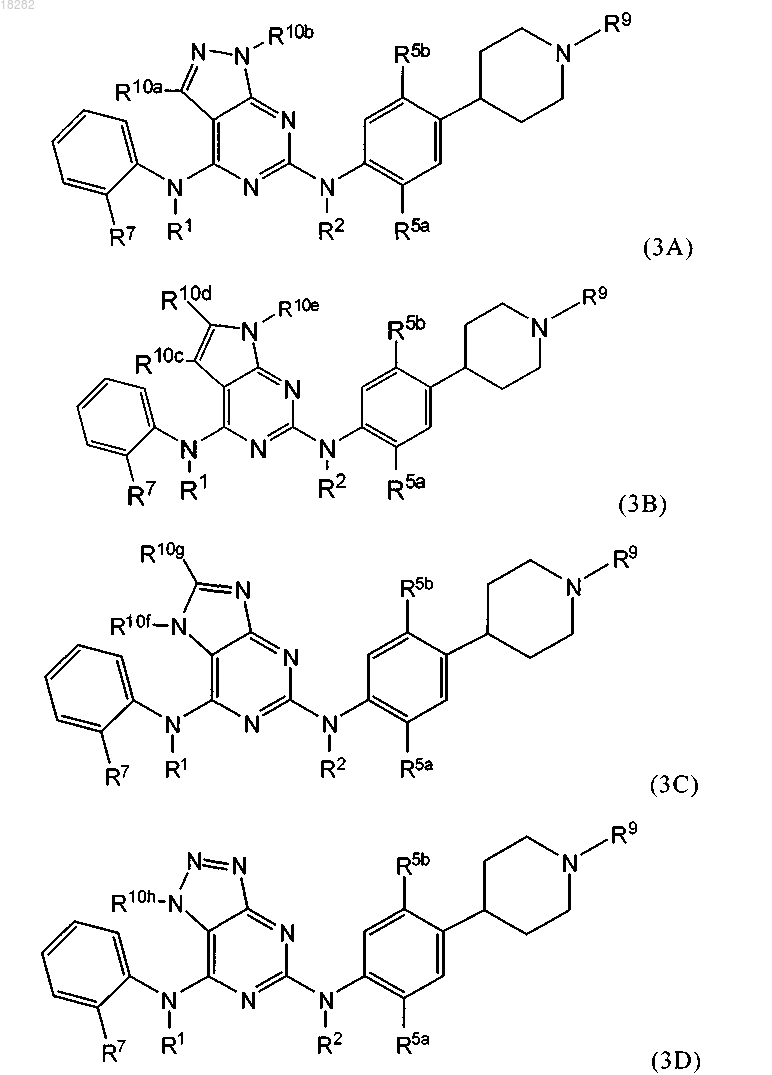
где R5a представляет собой метоксигруппу или изопропоксигруппу;
R5b представляет собой метил;
R10b, R10e, R10f и R10h независимо представляют собой H или C1-6алкил;
R10a, R10c, R10d и R10g независимо представляют собой Н, галоген, C1-6алкил, NR2 или фенил;
R1, R2, R7, R9 и R являются такими, как определено в п.1.
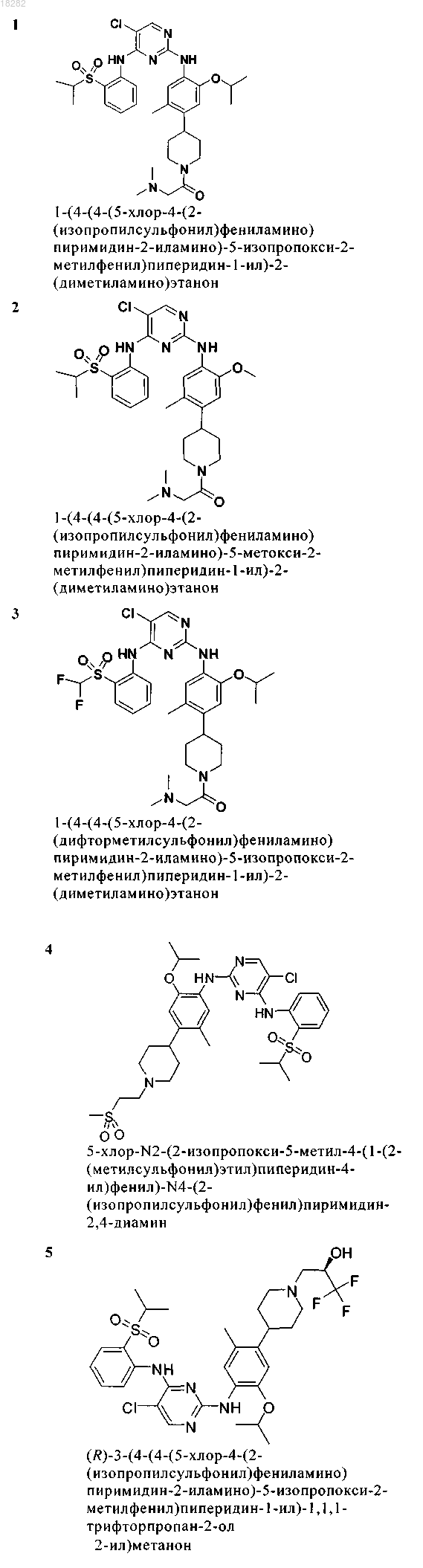
5. Соединение по п.1, где указанное соединение выбрано из группы, состоящей из следующих соединений:
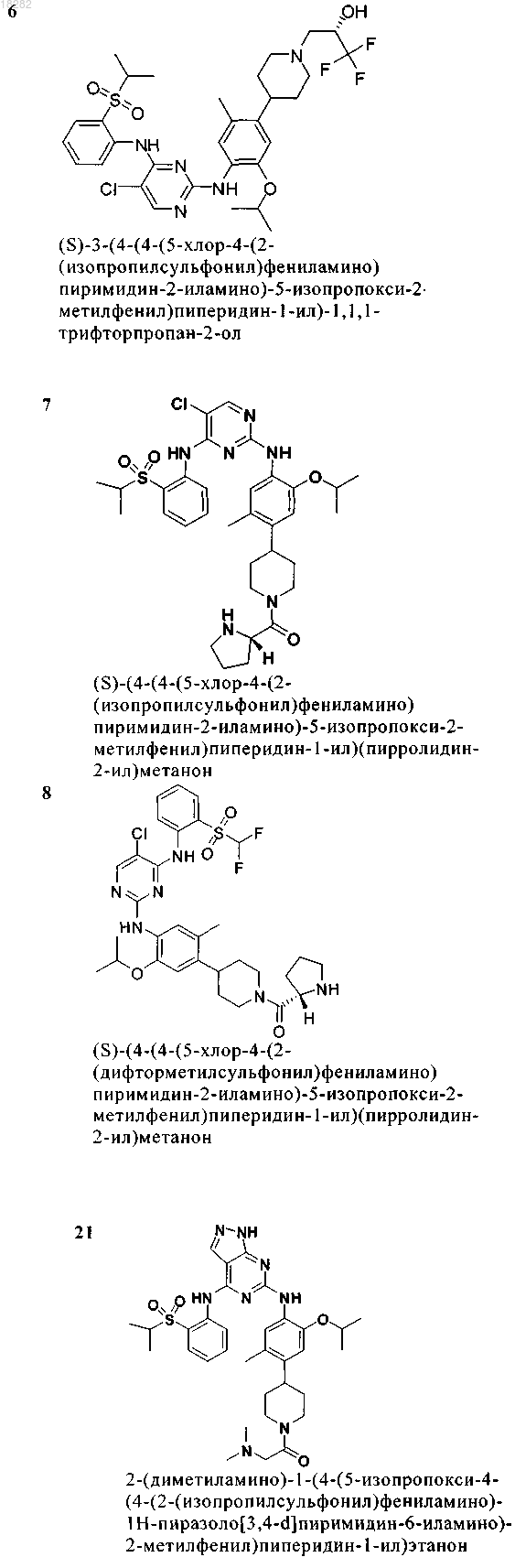
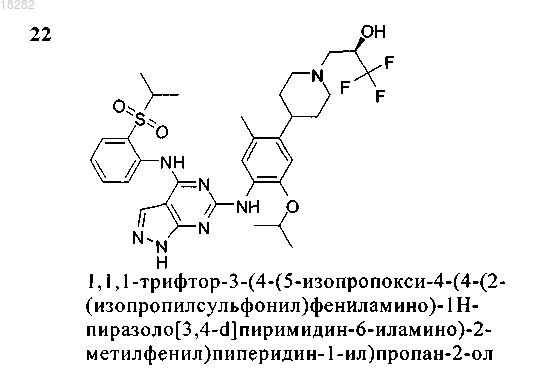
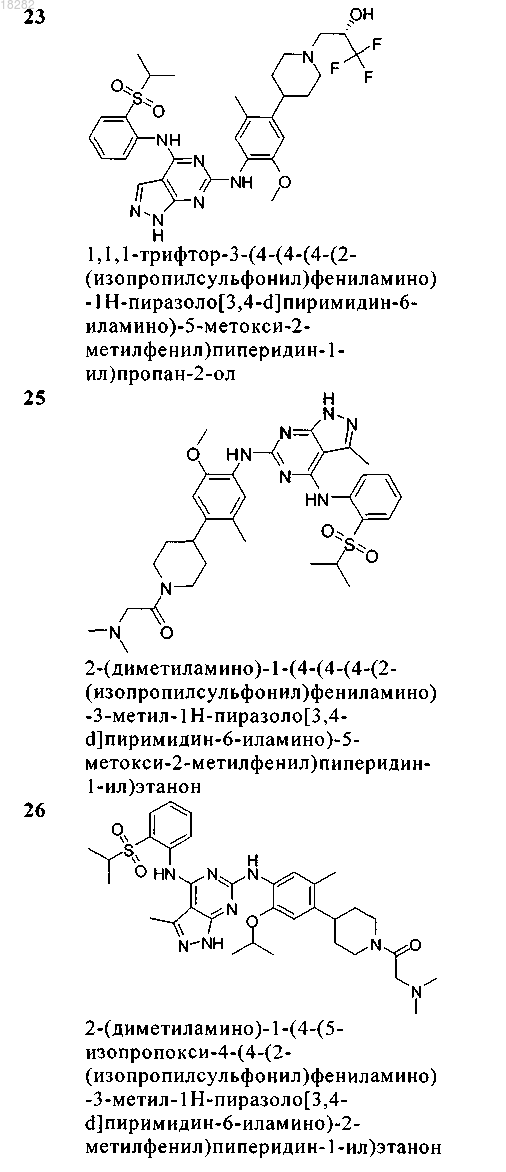
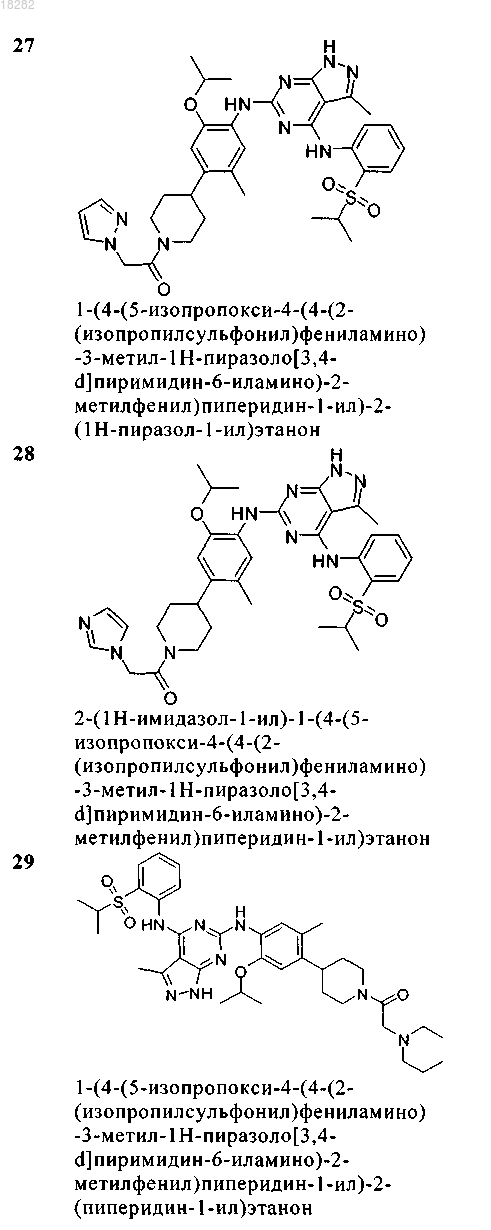
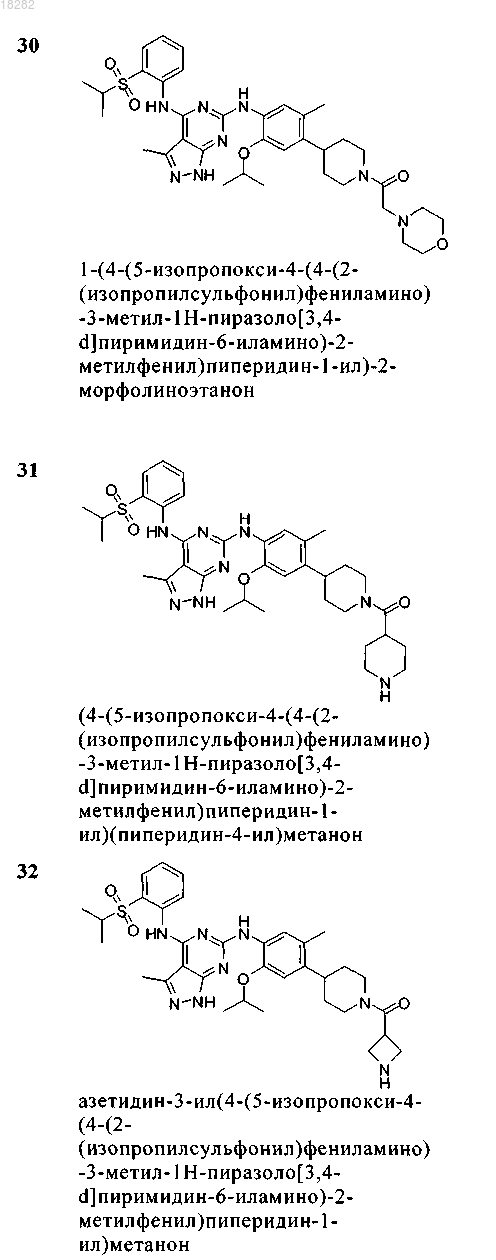
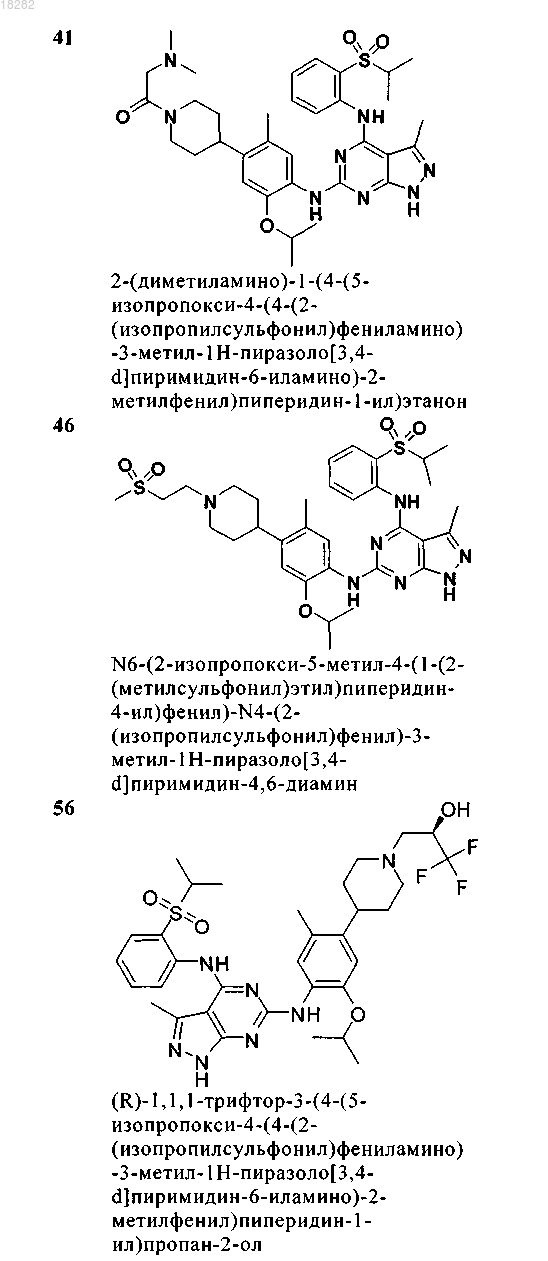
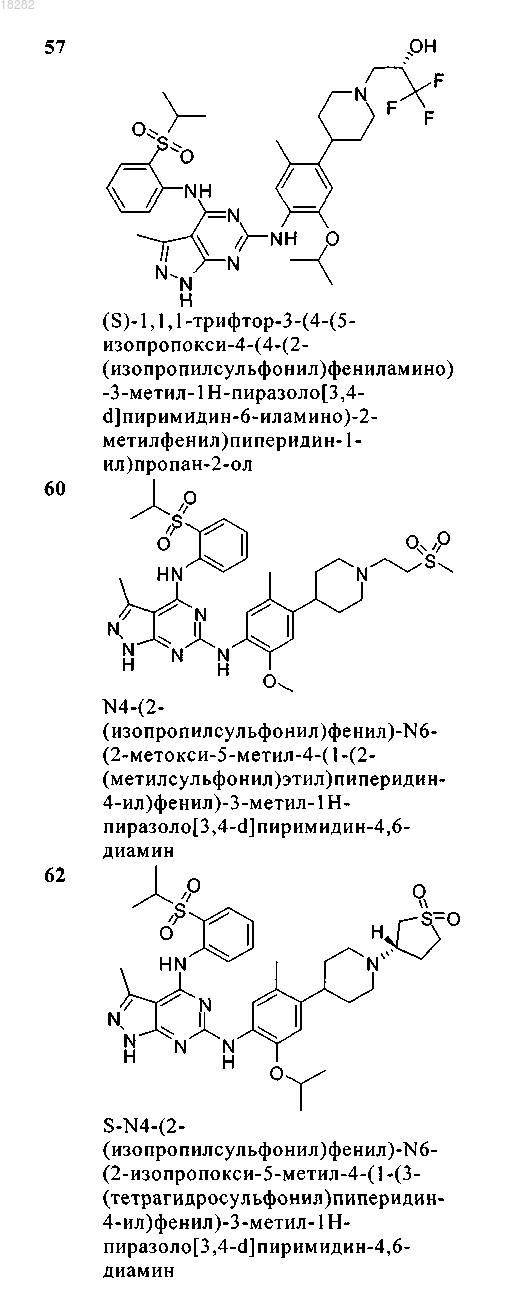
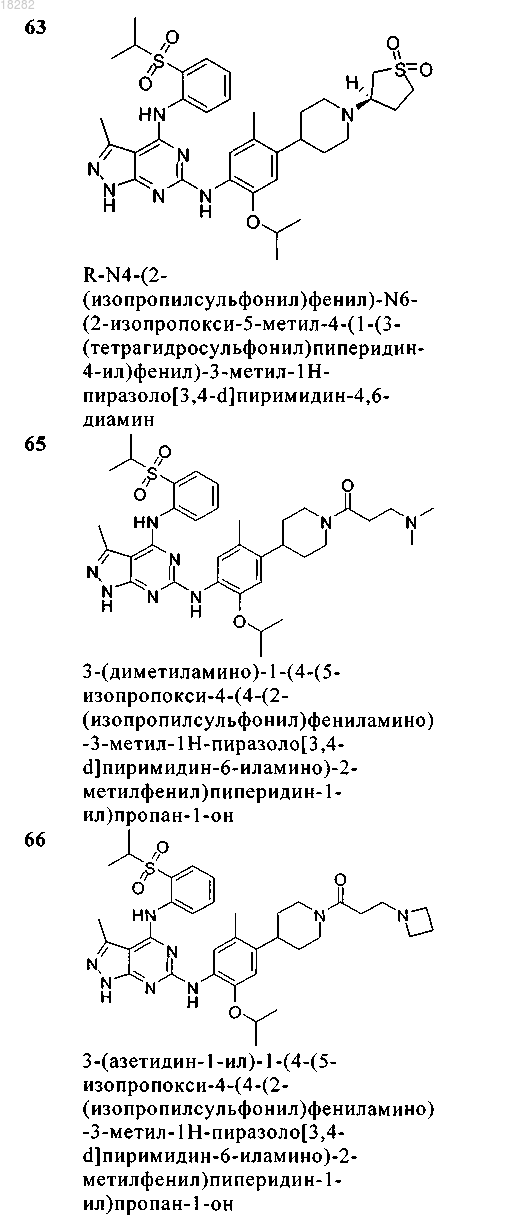
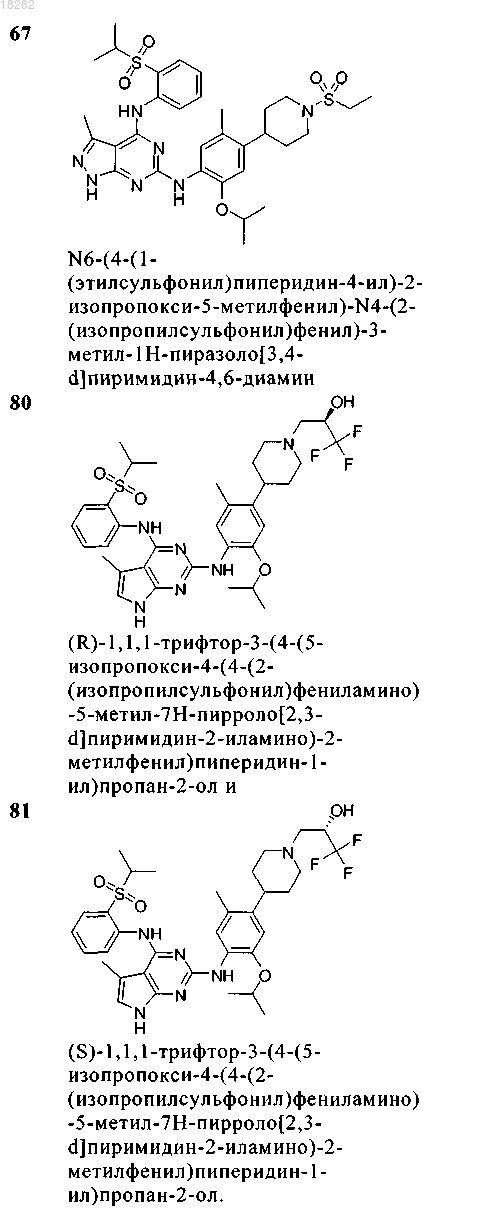
6. Соединение формулы (4)
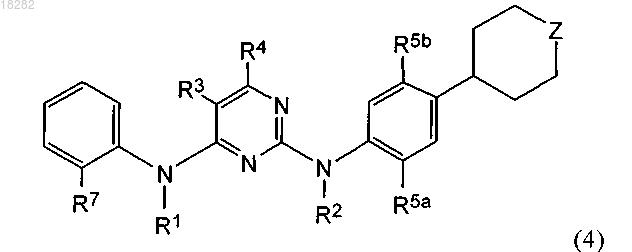
или его физиологически приемлемая соль,
где Z представляет собой NR9a или О;
R1 и R2 представляют собой H;
R3 и R4 вместе с атомами углерода, к которым они присоединены, образуют кольцо, выбранное из группы:
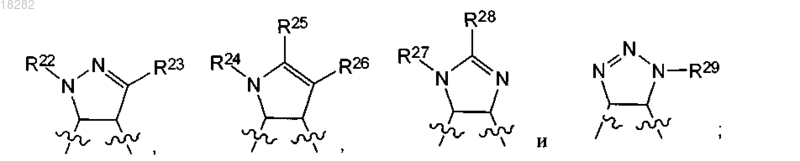
R5a и R5b независимо представляют собой C1-6алкил или C1-6алкоксигруппу;
R7 представляет собой S(O)0-2R19 или S(O)2NRR20, где R19 и R20 независимо представляют собой C1-6алкил или галогензамещенный C1-6алкил или R20 представляет собой H;
каждый R9a независимо представляет собой Н, C1-6алкил, -(CR2)p-OR17, -L-C(O)-R17, -C(O)O-R17 или -L-C(O)-NRR17, где R и R17 вместе с атомом N в NRR17 могут образовывать 5-6-членное кольцо, необязательно содержащее О или S;
L представляет собой (CR2)1-4 или связь;
R17 представляет собой водород, бензил, C1-6алкил, необязательно замещенный галогеном, или C3-7циклоалкил, необязательно замещенный C1-6алкилом или галогеном;
R22, R24, R27 и R29 независимо представляют собой H или C1-6алкил;
R23, R25, R26 и R28 независимо представляют собой Н, C1-6алкил, NR2 или галоген;
каждый R представляет собой Н или C1-6алкил;
при условии, что R22 и R23, оба, не представляют собой Н; R24, R25 и R26, все, не представляют собой Н и R27 и R28, оба, не представляют собой Н.
7. Соединение по п.6, где указанное соединение имеет формулу (4) и выбрано из группы, состоящей из следующих соединений:

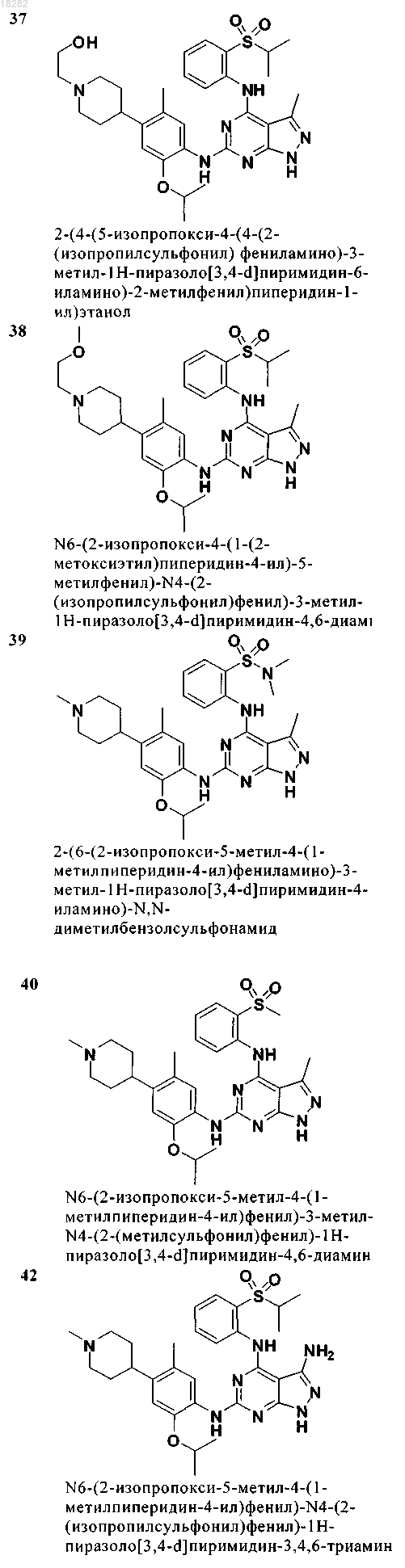
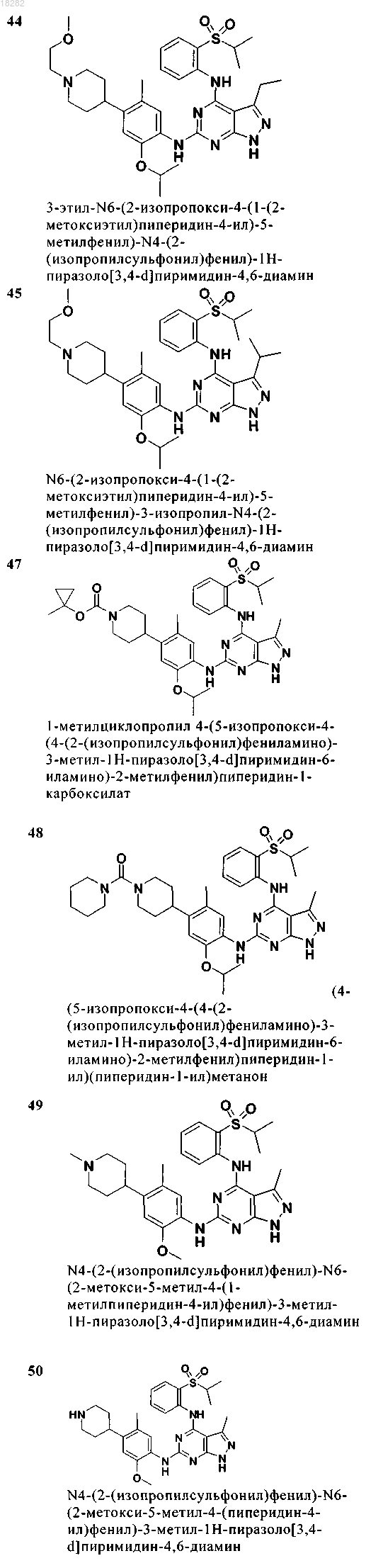
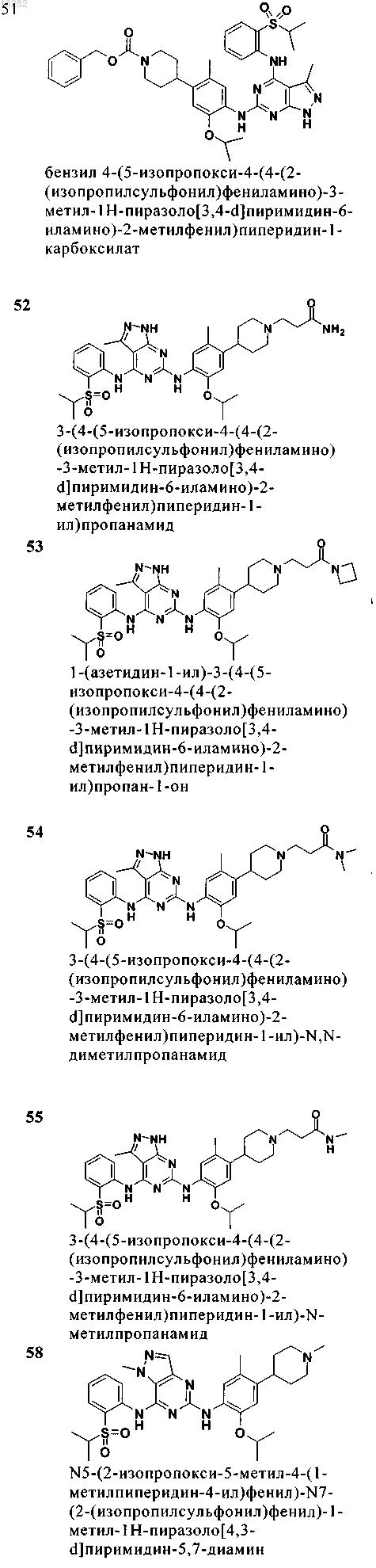
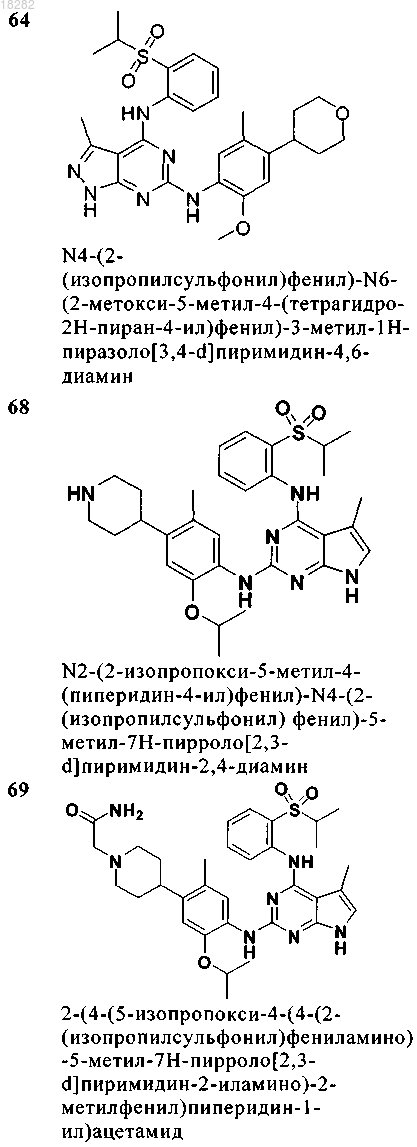

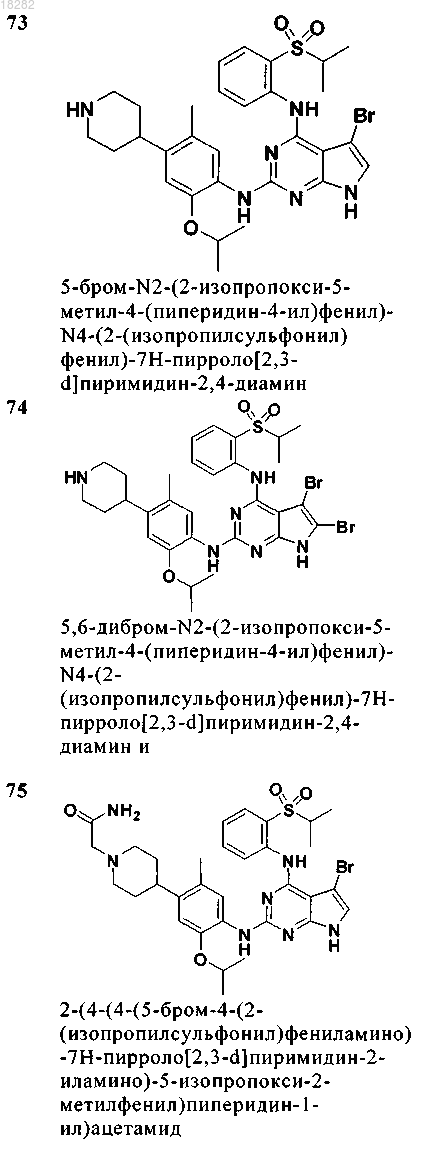

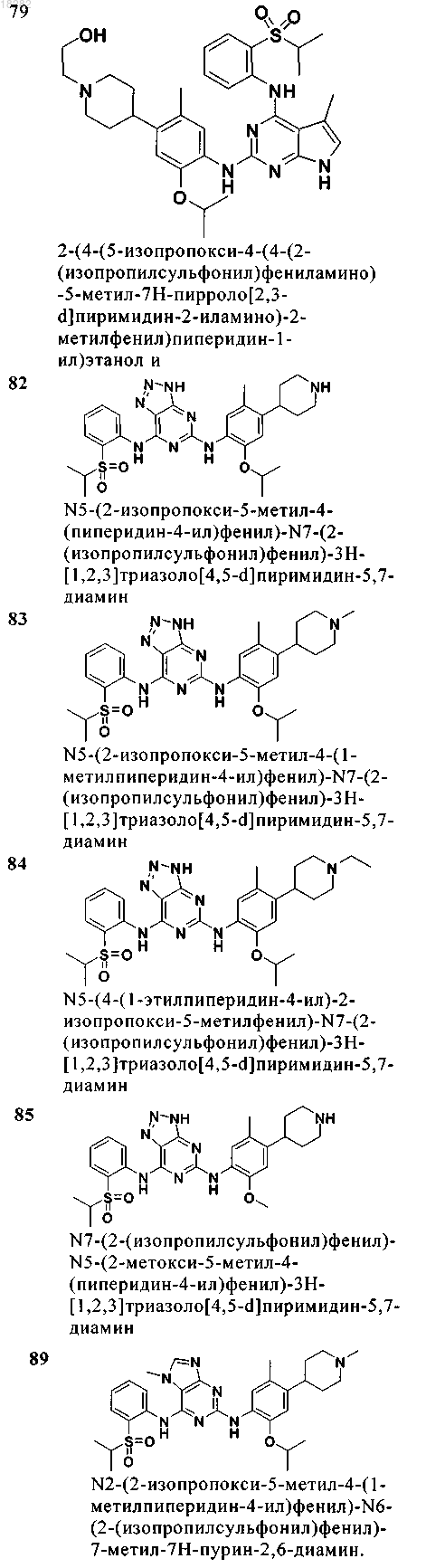
8. Соединение формулы (5)
или его физиологически приемлемая соль,
где R1 и R2 представляют собой Н;
R5a и R5b независимо представляют собой C1-6алкил или C1-6алкоксигруппу;
R7 представляет собой S(O)0-2R19 или S(O)2NRR20, где R19 и R20 независимо представляют собой C1-6алкил или галогензамещенный C1-6алкил или R20 представляет собой Н;
каждый R9a независимо представляет собой Н, C1-6алкил, -(CR2)p-OR17, -L-C(O)-R17, -C(O)O-R17 или -L-C(O)-NRR17, где R и R17 вместе с атомом N в NRR17 могут образовывать 5-6-членное кольцо, необязательно содержащее О или S;
L представляет собой (CR2)1-4 или связь;
R17 представляет собой водород, бензил, C1-6алкил, необязательно замещенный галогеном, или C3-7циклоалкил, необязательно замещенный C1-6алкилом или галогеном;
R21 представляет собой Н или C1-6алкил.
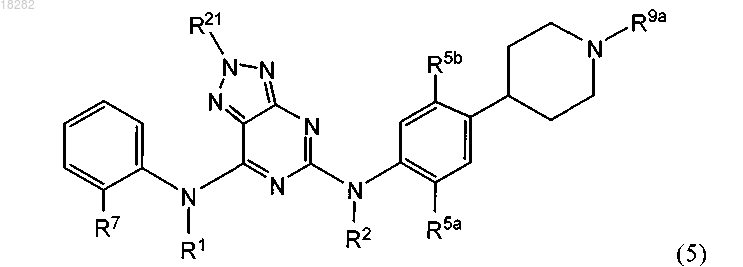
9. Соединение по п.8, где указанное соединение имеет формулу (5) и выбрано из группы, состоящей из следующих соединений:
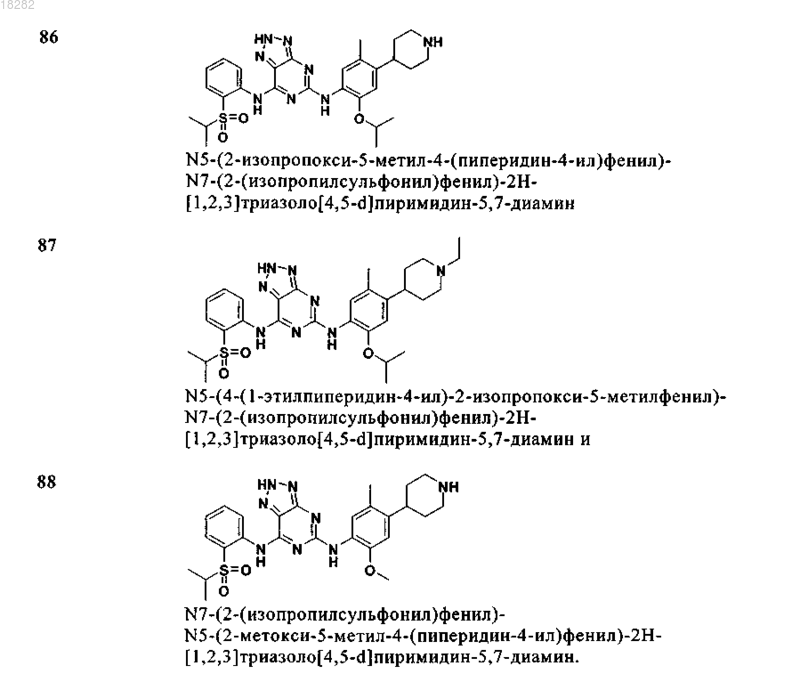
10. Соединение по п.8, где указанное соединение имеет формулу (5) и R9a представляет собой H или C1-6алкил.
11. Фармацевтическая композиция, обладающая ингибирующим действием в отношении анапластической лимфомной киназы, включающая терапевтически эффективное количество соединения по любому из пп.1-10 и физиологически приемлемый носитель.
12. Применение соединения по любому из пп.1-10 для изготовления лекарственного средства для лечения состояния, опосредованного анапластической лимфомной киназой, где указанное состояние представляет собой аутоиммунное заболевание, заболевание, связанное с трансплантацией, инфекционное заболевание или клеточное пролиферативное нарушение.
13. Применение соединения по любому из пп.1-10 для изготовления лекарственного средства для лечения клеточного пролиферативного нарушения, где указанное клеточное пролиферативное нарушение представляет собой множественную миелому, нейробластому, лимфому, лейкемию, меланому, саркому, остеосаркому, синовиальную саркому, саркому Эвинга, гепатому, желудочно-кишечную опухоль стромы или солидную опухоль груди, почек, простаты, прямой кишки, яичников, поджелудочной железы, легких, матки, дыхательного тракта, головного мозга, желудочно-кишечного тракта, мочевыводящих путей, глаз, печени, кожи, головы и шеи, щитовидной железы или паращитовидной железы.
14. Способ получения соединения формулы (6) или его фармацевтически приемлемой соли
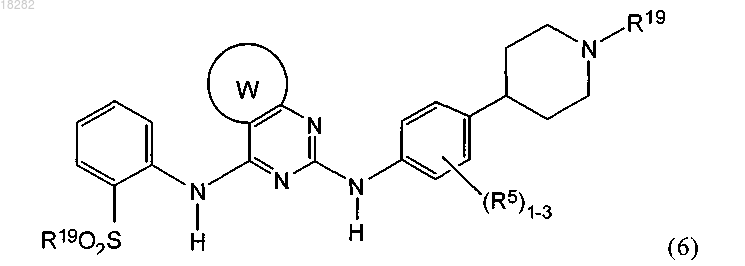
где W представляет собой 5-6-членное кольцо, содержащее 1-3 атома азота;
R5 представляет собой C1-6алкил или C1-6алкоксигруппу;
R19 представляет собой C1-6алкил;
включающий:
а) взаимодействие реагента формулы (6а) с реагентом формулы (6b) или его фармацевтически приемлемой солью:
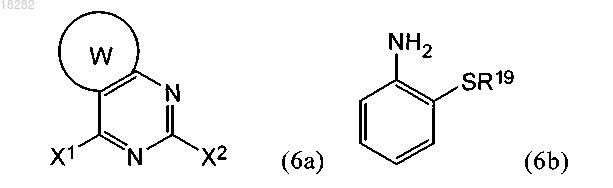
в условиях, подходящих для получения промежуточного соединения формулы (6с)
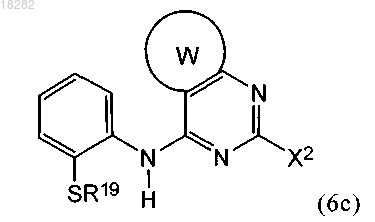
б) взаимодействие указанного промежуточного соединения формулы (6с) с окисляющим агентом с получением промежуточного соединения формулы (6d)
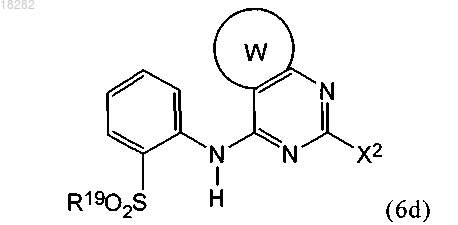
где X1 и X2 представляют собой уходящую группу;
в) взаимодействие указанного промежуточного соединения формулы (6d) с реагентом формулы (6e) или его фармацевтически приемлемой солью
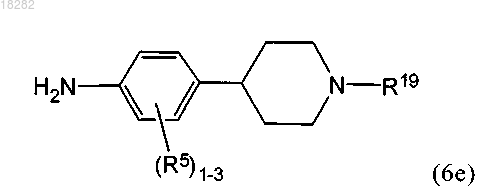
в условиях, подходящих для получения соединения формулы (6) или его фармацевтически приемлемой соли.
15. Способ по п.14, где указанное соединение формулы (6) имеет формулы (6f), (6g), (6h) или (6i):
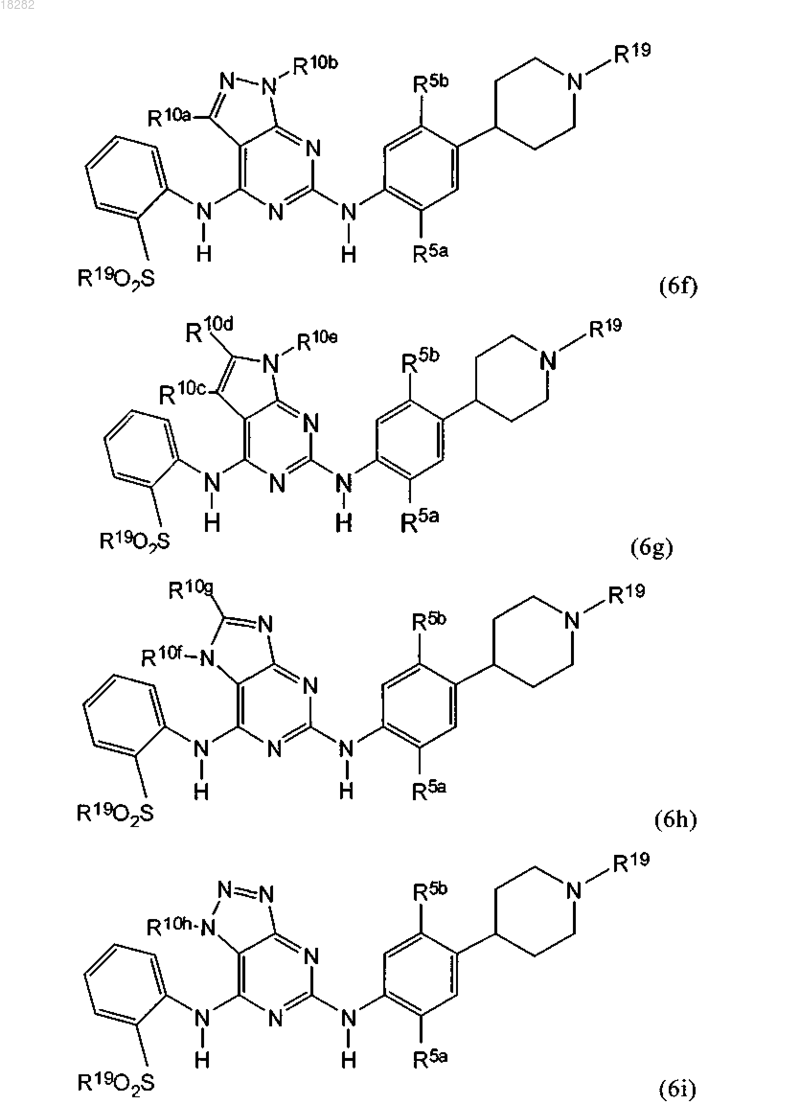
где R5a представляет собой метоксигруппу или изопропоксигруппу;
R5b представляет собой метил;
R10a, R10b, R10c, R10d, R10e, R10f, R10g и R10h независимо представляют собой Н, галоген, C1-6алкил, NH2 или фенил;
каждый R19 является таким, как определено в п.14.
16. Способ по п.14, где указанный реагент формулы (6e) синтезируют:
i) взаимодействием реагента формулы (7) с алкилирующим агентом с получением промежуточного соединения формулы (8)
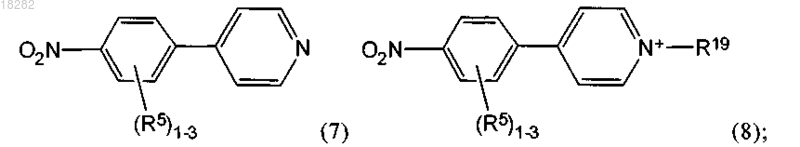
ii) восстановлением указанного промежуточного соединения формулы (8) с получением реагента формулы (6e),
где R5 и R19 являются такими, как определено в п.14.
17. Способ по п.16, где указанный алкилирующий агент представляет собой метил п-толуолсульфонат.
18. Способ по п.16, где указанное промежуточное соединение формулы (8) восстанавливают гидрированием.
Текст
Изобретение относится к новым производным пиримидина формулы (1) и их фармацевтическим композициям, а также к способам применения таких соединений. Например, производные пиримидина по изобретению могут использоваться для лечения,облегчения или профилактики состояния, которое связано с ингибированием активности анапластической лимфомной киназы (ALK), онкогена c-ros (ROS), инсулиноподобного фактора роста (IGF-1R) и/или инсулинового рецептора (InsR) или их комбинации. Ссылки на заявки-аналоги Заявка на данное изобретение имеет приоритет согласно заявке на патент US 61/043111, поданной 07.04.2008, и заявке на патент US 61/116023, поданной 19.11.2008, каждая из которых включена в описание полностью в качестве ссылки. Область техники, к которой относится изобретение Настоящее изобретение относится к ингибиторам протеинкиназы, более конкретно - к новым производным пиримидина и их фармацевтическим композициям, и к их применению в качестве фармацевтических средств. Уровень техники Рак представляет собой заболевание, вызванное нарушенным ростом ткани. Некоторые виды рака обладают потенциалом вторгаться в локальные ткани, а также метастазировать в различные органы. Это заболевание может развиваться в большом ряду различных органов, тканей и клеточных типов. Следовательно, термин "рак" относится к набору тысяч других заболеваний. Анапластическая лимфомная киназа (ALK), член суперсемейства инсулинового рецептора рецепторных тирозинкиназ, участвует в онкогенезе в гематопоэтических и негематопоэтических опухолях. Нарушенная экспрессия полноцепочечных белков рецептора ALK участвует в нейробластомах и глиобластомах, и слитые белки ALK встречаются при лимфоме анапластичных больших клеток. Исследование слитых белков ALK также повышает возможность новых терапевтических способов лечения пациентов сALK-положительными злокачественными образованиями (статья Pulford et al., Cell. Mol. Life Sci., 2004,61, p. 2939-2953). Передача сигнала инсулиноподобного фактора роста (IGF-1) в большой степени встречается при раке, с рецептором IGF-1 (IGF-1R) в качестве преобладающего фактора. IGR-1R является важным для трансформации опухоли и выживания злокачественных клеток, но только частично участвует в нормальном клеточном росте. Связывание IGF-1R, как предполагается, является обещающим подходом для терапии рака (статья Larsson et al., Br. J. Cancer, 2005, 92, p. 2097-2101).ROS1, гомолог онкогена вируса саркомы 1 V-ros Avian UR2 (также известный как ROS), высоко экспрессируется в различных опухолевых клеточных линиях. ROS1 представляет собой тирозинкиназу орфанового рецептора, чей киназный домен главным образом связан с ALK. ROS1 высоко экспрессируется в различных опухолевых клеточных линиях. Слитые белки ROS1, полученные в результате генетических отклонений, обнаружены при раке легких и в некоторых клеточных линиях глиобластомы (статьиRikova K. et al., Cell, 2007, 131, p. 1190; Sharma S. et al., Oncogene Res., 1989, 5, p. 91). Нарушенная экспрессия ROS1 описана при глиоме (статья Watkins D. et al., Cancer Genet Cytogenet., 1994, 72, p. 130). Ингибиторы киназы ROS1 способны блокировать рост опухолей, управляемый слиянием ROS1 или нарушением экспрессии или активации. Несмотря на развитие уровня техники, остается потребность в противораковых терапиях и противораковых соединениях. Описание изобретения Настоящее изобретение относится к новым производным пиримидина и их фармацевтическим композициям, а также к их применению в качестве фармацевтических средств. В одном варианте осуществления настоящее изобретение относится к соединению формулы (1) или его физиологически приемлемой соли,где R1 и R2 представляют собой H;C1-6 алкил или галогензамещенный C1-6 алкил или R20 представляет собой H;R9 представляет собой -L-CR(OR17)-CtF(2t+1), где t имеет значение 1-3; -L-S(O)2R18, -L-S(O)2NRR17,-L-S(O)2NR(CR2)pNR(R17), -L-S(O)2NR(CR2)pOR17 или радикал, выбранный из формул (a)-(c) или (d) где R11, R12, R13, R14, R15 и R16 независимо выбраны из H или C1-6 алкила или R11 и R12, R12 и R15, R15 иR , R13 и R14 или R13 и R15 вместе с атомами углерода и/или азота, к которым они присоединены, могут образовывать 3-7-членное насыщенное, ненасыщенное или частично ненасыщенное кольцо, необязательно содержащее 1-2 гетероатома, выбранных из N и O;L представляет собой (CR2)1-4 или связь; каждый R и R17 независимо представляют собой H или C1-6 алкил;p имеет значение 2-4. В одном варианте осуществления настоящее изобретение относится к соединению формулы (3) 16R5a и R5b независимо представляют собой C1-6 алкил или C1-6 алкоксигруппу;R1, R2, R4, R9, R10 и R19 являются такими, как определено в формуле (1). В конкретных вариантах осуществления описанной выше формулы (3)R5a представляет собой метоксигруппу или изопропоксигруппу;R5b представляет собой метил. В других конкретных вариантах осуществления изобретение относится к соединению формул (3A),(3B), (3C) или (3D): где R5a представляет собой метоксигруппу или изопропоксигруппу;R10b, R10e, R10f и R10h независимо представляют собой H или C1-6 алкил;R10a, R10c, R10d и R10g независимо представляют собой Н, галоген, C1-6 алкил, NR2 или фенил; В другом варианте осуществления изобретение относится к соединению формулы (4) или его физиологически приемлемой соли,где Z представляет собой NR9a или O;R5a и R5b независимо представляют собой C1-6 алкил или C1-6 алкоксигруппу;C1-6 алкил или галогензамещенный C1-6 алкил или R20 представляет собой H; каждый R9a независимо представляет собой H, C1-6 алкил, -(CR2)p-OR17, -L-C(O)-R17, -C(O)O-R17 илиR22, R24, R27 и R29 независимо представляют собой H или C1-6 алкил;R23, R25, R26 и R28 независимо представляют собой H, C1-6 алкил, NR2 или галоген; каждый R представляет собой H или C1-6 алкил; при условии, что R22 и R23, оба, не представляют собой H; R24, R25 и R26, все, не представляют собой 27H; R и R28, оба, не представляют собой H. В другом варианте осуществления изобретение относится к соединению формулы (5) или его физиологически приемлемой соли,где R1 и R2 представляют собой H;R5a и R5b независимо представляют собой C1-6 алкил или C1-6 алкоксигруппу;C1-6 алкил или галогензамещенный C1-6 алкил или R20 представляет собой H; каждый R9a независимо представляет собой Н, C1-6 алкил, -(CR2)P-OR17, -L-C(O)-R17, -C(O)O-R17 илиR21 представляет собой H или C1-6 алкил. В некоторых примерах изобретение относится к соединению формулы (5), где R9a представляет собой H или C1-6 алкил. В другом варианте осуществления изобретение относится к способу получения соединения формулы (6) или его фармацевтически приемлемой соли:R19 представляет собой C1-6 алкил; включающему: а) взаимодействие реагента формулы (6 а) с реагентом формулы (6b) или его фармацевтически приемлемой солью: в условиях, подходящих для получения промежуточного соединения формулы (6 с) б) взаимодействие указанного промежуточного соединения формулы (6 с) с окисляющим агентом с получением промежуточного соединения формулы (6d) где X1 и X2 представляют собой уходящую группу; в) взаимодействие указанного промежуточного соединения формулы (6d) с реагентом формулы (6e) или его фармацевтически приемлемой солью: в условиях, подходящих для получения соединения формулы (6) или его фармацевтически приемлемой соли. В одном варианте осуществления изобретение относится к способу получения соединения формул где R5a представляет собой метоксигруппу или изопропоксигруппу;R10a, R10b, R10c, R10d, R10e, R10f, R10g и R10h независимо представляют собой H, галоген, C1-6 алкил, NH2 или фенил; каждый R19 является таким, как определено в формуле (6) выше. В способах по изобретению указанный реагент формулы (6e) синтезируют:i) взаимодействием реагента формулы (7) с алкилирующим агентом с получением промежуточного соединения формулы (8):ii) восстановлением указанного промежуточного соединения формулы (8) с получением реагента формулы (6e),где R5 и R19 являются такими, как определено выше в формуле (6). В некоторых примерах алкилирующий агент представляет собой метил п-толуолсульфонат. В других примерах промежуточное соединение формулы (8) восстанавливают гидрированием. В другом варианте осуществления настоящее изобретение относится к фармацевтическим композициям, содержащим соединение формул (1), (3), (3A)-(3D), (4) или (5) и физиологически приемлемый носитель. Изобретение также относится к применению соединения формул (1), (3), (3A)-(3D), (4) или (5) для изготовления лекарственного средства для лечения состояния, опосредованного анапластической лимфомной киназой. В конкретных вариантах осуществления указанное состояние представляет собой аутоиммунное заболевание, заболевание трансплантации, инфекционное заболевание или клеточное пролиферативное нарушение. Кроме того, изобретение относится к применению соединения формул (1), (3), (3A)-(3D), (4) или (5) для изготовления лекарственного средства для лечения клеточного пролиферативного нарушения. В конкретных примерах соединения по изобретению могут использоваться для лечения клеточного пролиферативного нарушения, включая, но не ограничиваясь ими, множественную миелому, нейробластому,лимфому, лейкемию, меланому, саркому, остеосаркому, синовиальную саркому, саркому Эвинга, гепатому, желудочно-кишечную опухоль стромы или солидную опухоль груди, почек, простаты, прямой кишки, щитовидной железы, яичников, поджелудочной железы, легких, матки, дыхательного тракта, головного мозга, желудочно-кишечного тракта, мочевыводящих путей, глаз, печени, кожи, головы и шеи,щитовидной железы или паращитовидной железы. Определения."Алкил" обозначает группу и как структурный элемент других групп, например галогензамещенного алкила и алкоксигруппы, может быть линейным или разветвленным. Необязательно замещенный алкил, алкенил или алкинил, как здесь используется, может быть необязательно галогенированным (например, CF3) или может иметь один или несколько атомов углерода, которые замещены или заменены на гетероатом, такой как NR, O или S (например, -OCH2CH2O-, алкилтиолы, тиоалкоксигруппа, алкиламины и т.д.)."Арил" обозначает моноциклическое или конденсированное бициклическое ароматическое кольцо,содержащее атомы углерода. "Арилен" обозначает двухвалентный радикал, полученный из арильной группы. Например, арильной группой может быть фенил, инденил, инданил, нафтил или 1,2,3,4 тетрагидронафталенил, который может быть необязательно замещен в орто-, мета- или пара-положении."Гетероарил", как здесь используется, обозначает арил, как описано выше, в котором один или несколько членов кольца являются гетероатомами. Примеры гетероарилов включают, но не ограничиваются ими, пиридил, пиразинил, индолил, индазолил, хиноксалинил, хинолинил, бензофуранил, бензопиранил, бензотиопиранил, бензо[1,3]диоксол, имидазолил, бензоимидазолил, пиримидинил, фуранил, оксазолил, изоксазолил, триазолил, бензотриазолил, тетразолил, пиразолил, тиенил, пирролил, изохинолинил,пуринил, тиазолил, тетразинил, бензотиазолил, оксадиазолил, бензоксадиазолил и т.д."Карбоциклическое кольцо", как здесь используется, обозначает насыщенное или частично ненасыщенное, моноциклическое, конденсированное бициклическое или мостиковое полициклическое кольцо, содержащее атомы углерода, которое необязательно может быть замещено, например, =O. Примеры карбоциклических колец включают, но не ограничиваются ими, циклопропил, циклобутил, циклопентил,циклогексил, циклопропилен, циклогексанон и т.д."Гетероциклическое кольцо", как здесь используется, является таким, как определено выше для карбоциклического кольца, где один или несколько атомов углерода в кольце являются гетероатомами. Например, гетероциклическое кольцо может содержать N, О, S, -N=, -S-, -S(O), -S(O)2- или -NR-, где R может представлять собой водород, C1-4 алкил или защитную группу. Примеры гетероциклических колец включают, но не ограничиваются ими, морфолино, пирролидинил, пирролидинил-2-он, пиперазинил,пиперидинил, пиперидинилон, 1,4-диокса-8-азаспиро[4.5]дец-8-ил, 1,2,3,4-тетрагидрохинолинил и т.д. Гетероциклические кольца, как здесь используется, могут включать бициклические амины и бицикличе-5 018282 ские диамины. Как здесь используется, атом H в любых группах заместителя (например, CH2) включает все подходящие изотопные варианты, например H, 2H и 3 Н. Как здесь используется, уходящая группа представляет собой атом (или группу атомов), который перемешается в виде стабильных типов, забирая с собой связывающие электроны. Обычно уходящая группа представляет собой анион (например, Cl-) или нейтральную молекулу (например, H2O). Подходящие уходящие группы включают, но не ограничиваются ими, галоген, алкоксигруппу, алкилтиогруппу, арилоксигруппу, тозильную группу и арилтиогруппу. Специалисту в данной области техники известны другие уходящие группы, подходящие для применения в настоящем изобретении. Как здесь используется, окисляющий агент представляет собой соединение, которое переносит атомы кислорода. Обычные окисляющие агенты включают, но не ограничиваются ими, перхлораты, хлорат,хлорит, гипохлорит, йод и другие галогены, пероксиды, сульфоксиды, персерную кислоту, соединения шестивалентного хрома, такие как хромовая и дихромовая кислоты и триоксид хрома, хлорхромат пиридиния (РСС) и хроматные/дихроматные соединения, пербораты и т.д. Специалисту в данной области техники известны другие окисляющие агенты, подходящие для применения в настоящем изобретении. Как здесь используется, алкилирующий агент представляет собой соединение, которое переносит алкильную группу, и включает нуклеофильные алкилирующие агенты, электрофильные алкилирующие агенты, радикалалкилирующие агенты или карбиналкилирующие агенты. Как здесь используется, гидрирование обозначает химическую реакцию, которая приводит к добавлению водорода. Гидрирование обычно проводят для восстановления или насыщения ненасыщенного органического соединения. Реакцию обычно проводят в присутствии катализатора, такого как металлы платиновой группы; некаталитическое гидрирование протекает при высоких температурах. Если не указано иное, когда заместитель обозначен как "необязательно замещенный", это обозначает, что заместитель представляет собой группу, которая может быть замещена одной или несколькими группами, отдельно и независимо выбранными, например, из необязательно галогенированного алкила,алкенила, алкинила, алкоксигруппы, алкиламина, алкилтиогруппы, алкинила, амида, аминогруппы,включая моно- и дизамещенные аминогруппы, арила, арилоксигруппы, арилтиогруппы, карбонила, карбоцикла, цианогруппы, циклоалкила, галогена, гетероалкила, гетероалкенила, гетероалкинила,гетероарила,гетероциклила,гидроксигруппы,изоцианатогруппы,изотиоцианатогруппы,меркаптогруппы, нитрогруппы, О-карбамила, N-карбамила, О-тиокарбамила, N-тиокарбамила,С-амидогруппы, N-амидогруппы, S-сульфонамидогруппы, N-сульфонамидогруппы, С-карбоксигруппы,О-карбоксигруппы, пергалогеналкила, перфторалкила, силила, сульфонила, тиокарбонила, тиоцианатогруппы, тригалогенметансульфонила и из защищенных соединений. Термины "совместное введение", или "объединенное введение", или им подобные, как здесь используется, означают введение выбранных терапевтических агентов отдельному пациенту и включают режимы лечения, в которых агенты необязательно вводят одним и тем же способом введения или в одно и то же время. Термин "фармацевтическая комбинация", как здесь используется, означает продукт, который получают смешением или объединением более одного активного ингредиента, и включает фиксированные и нефиксированные комбинации активных ингредиентов. Термин "фиксированная комбинация" обозначает, что активные ингредиенты, например соединение формулы (1) и совместно вводимый агент, оба, вводятся пациенту одновременно в форме одного целого или одной дозировки. Термин "нефиксированная комбинация" означает, что активные ингредиенты, например соединение формулы (1) и совместно вводимый агент, оба, вводятся пациенту раздельными частями совместно, одновременно или последовательно в неограниченном периоде времени, где такое введение обеспечивает терапевтически эффективные уровни двух соединений в организме пациента. Последнее также включает коктейльную терапию, например введение трех или более активных ингредиентов. Термин "терапевтически эффективное количество" означает количество конкретного соединения,которое вызывает биологический или медицинский отклик в клетке, ткани, органе, системе, животном или человеке, которое определяется исследователем, ветеринаром, врачом или другим доктором. Термин "введение" или "вводимый" субъекту соединения обозначает прием соединения формулы по изобретению и его пролекарства субъекту, нуждающемуся в таком лечении."Химиотерапевтический агент" представляет собой химическое соединение, полезное для лечения рака. Примеры химиотерапевтических агентов включают алкилирующие агенты, такие как тиотепа и(включая синтетический аналог топотекана (HYCAMTIN), СРТ-11 (иринотекан, CAMPTOSAR), аце-6 018282 тилкамптотецин, скополектин и 9-аминокамптотецин); бриостатин; каллистатин; CC-1065 (включая его синтетические аналоги адозелезина, карзелезина и бизелезина); подофиллотоксин; подофиллиновую кислоту; тенипозид; криптофицины (в частности, криптофицин 1 и криптофицин 8); доластатин; дуокармицин (включая синтетические аналоги, KW-2189 и СВ 1-ТМ 1); элеутеробин; панкратистатин; саркодиктиин; спонгистатин; горчичный азот, такой как хлорамбуцил, хлорнафазин, холофосфамид, эстрамустин,ифосфамид, мехлоретамин, гидрохлорид оксида мехлоретамина, мельфалан, новембицин, фенестерин,преднимустин, трофосфамид, горчичный урацил; нитрозомочевины, такие как кармустин, хлорозотоцин,фотемустин, ломустин, нимустин и ранимнустин; антибиотики, такие как ендииновые антибиотики (например, калихеамицин, особенно калихеамицин гамма II и калихеамицин омега II (см., например, статьюAgnew, Chem Intl. Ed. Engl., 1994, 33, p. 183-186); динемицин, включая динемицин А; эсперамицин; а также хромофор неокарциностацина и связанные хромопротеиновые хромофоры ендииновых антибиотиков), аклациномизины, актиномицин, аутрамицин, азасерин, блеомицины, кактиномицин, карабицин,каминомицин, карзинофилин, хромомицин, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксоL-норлейцин, ADRIAMYCIN доксорубицин (включая морфолинодоксорубицин, цианоморфолинодоксорубицин, 2-пирролинодоксорубицин и дезоксидоксорубицин), эпирубицин, эзорубицин, идарубицин,марцелломицин, митомицины, такие как митомицин С, митофенольная кислота, ногаламицин, оливомицины, пепломицин, потфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатин, зорубицин; антиметаболиты, такие как метотрексат и 5-фторурацил (5-FU); аналоги фолиевой кислоты, такие как деноптерин, метотрексат, птероптерин, триметрексат; аналоги пурина, такие как флударабин, 6-меркаптопурин, тиамиприн, тиогуанин; аналоги пиримидина, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидезоксиуредин, доксифлуредин, эноцитабин, флоксуридин; андрогены, такие как калустерон, пропионат дромостанолона,эпитиостанол, мепитиостан, тестолактон; антиадреналиновые средства, такие как аминоглутетимид, митотан, трилостан; корректор фолиевой кислоты, такой как фролиновая кислота; ацеглатон; альдофосфамидгликозид; аминолевулиновая кислота; енилурацил; амсакрин; бестрабуцил; бисантрен; эдатраксат; дефофамин; демеколцин; диазиквуон; эльфомитин; ацетат эллиптиния; эпотилон; этоглуцид; нитрат галлия; гидроксимочевину; лентинан; лонидайнин; майтансиноиды, такие как майтансин и ансамитоцины; митогуазон; митоксантрон; мопиданмол; нитраерин; пентостатин; фенамет; пирарубицин; лозоксантрон; 2-этилгидразид; прокарбазин; PSK полисахаридный комплекс (JHS Natural Products, Eugene, Oreg.); разоксан; ризоксин; сизофуран; спирогерманий; тенуазоновую кислоту; триазиквуон; 2,2',2"-трихлортриэтиламин; трихотецены (особенно T-2 токсин, верракурин А, роридин А и ангуидин); уретан; виндезин (ELDISINE, FILDESIN); дакарбазин; манномустин; митобронетол; митолактол; пипоброман; гацитозин; арабинозид ("Ara-С"); тиотепа; таксоиды, например TAXOL паклитаксель(Bristol-Myers Squibb Oncology, Princeton, N.J.), ABRAXANE без кремофора, альбуминовый состав наночастиц паклитакселя (American Pharmaceutical Partners, Schaumberg, Ill.) и TAXOTERE доксетаксель (Rhone-Poulenc Rorer, Antony, Франция); хлоранбуцил; гемцитабин (GEMZAR); 6-тиогуанин; меркаптопурин; метотрексат; аналоги платина, такие как цисплатин и карбоплатин; винбластин(VELBAN); платину; этопозид (VP-16); ифосфамид; митоксантрон; винкристин (ONCOVIN); оксалиплатин; лейкововин; винорельбин (NAVELBINE); новантрон; эдатрексат; дауномицин; аминоптерин; ибандронат; ингибитор топоизомеразы RFS 2000; дифторметилорнитин (DMFO); ретиноиды, такие как ретиновая кислота; капецитабин (XELODA); фармацевтически приемлемые соли, кислоты или производные любого из вышеперечисленных; а также комбинации двух или более из вышеперечисленных,такие как CHOP, сокращение для комбинированной терапии циклофосфамида, доксорубицина, винкристина и преднизолона, и FOLFOX, сокращение для лечения оксалиплатином (ELOXATIN) вместе с 5-FU и лейковорином. Кроме того, "химиотерапевтический агент" может включать противогормональные агенты, которые действуют для регулирования, снижения, блокирования или ингибирования действий гормонов, которые могут стимулировать рост рака, и часто в форме системного или общего лечения. Они могут быть самими гормонами. Примеры включают антиэстрогены и селективные модуляторы эстрогенового рецептора(SERM), включая, например, тамоксифен (включая NOLVADEX тамоксифен), EVISTA ралоксифен,дролоксифен, 4-гидрокситамоксифен, триоксифен, кеоксифен, LY117018, онапристон и FARESTON торемифен; антипрогестероны; регуляторы эстрогенового рецептора (ERD); агенты, которые служат для подавления или отключения яичников, например агонисты леутинизированный гормонвысвобождающего гормона (LHRH), такие как LUPRON и ELIGARD ацетат леупролида, ацетат госерелина, ацетат бусерелина и триптерилин; другие антиандрогены, такие как флутамид, нилутамид и бикалутамид; и ингибиторы ароматазы, которые ингибируют фермент ароматазу, который регулирует выработку эстрогена в надпочечниках, такие как, например, 4(5)-имидазолы, аминоглутетимид, MEGASE ацетат мегестрола, AROMASIN эксеместан, форместанин, фадрозол, RIVISOR ворозол, FEMARA летрозол и ARIMIDEX анастрозол. Кроме того, такое определение химиотерапевтических агентов включает бисфосфонаты, такие как клодронат (например, BONEFOS или OSTAC), DIDROCAL(1,3-диоксоланнуклеозидный аналог цитозина); антисмословые олигонуклеотиды, особенно те, которые ингибируют экспрессию генов в сигнальных путях, участвующих в нарушенной клеточной пролиферации, такие как, например, PKC-альфа, Raf, H-Ras и рецептор эпидермального фактора роста (EGF-R); вакцины, такие как THERATOPE вакцина и вакцины генной терапии, например ALLOVECTIN вакцина, LEUVECTIN вакцина и VAXID вакцина; LURTOTECAN ингибитор топоизомеразы 1;ErbB-2 и EGFR, также известный как GW572016) и фармацевтически приемлемые соли, кислоты или производные любого из вышеперечисленных. Способы осуществления изобретения Настоящее изобретение относится к новым производным пиримидина и их фармацевтическим композициям, а также к способам применения таких соединений. В одном варианте осуществления изобретение относится к соединению формулы (1) или его физиологически приемлемой соли,где R1 и R2 представляют собой H;C1-6 алкил или галогензамещенный C1-6 алкил или R20 представляет собой H;-L-S(O)2R18, -L-S(O)2NRR17, -L-S(O)2NR(CR2)pNR(R17), -L-S(O)2NR(CR2)pOR17 или радикал, выбранный из формул (а), (b), (с) или (d) где R11, R12, R13, R14, R15 и R16 независимо выбраны из Н или C1-6 алкила илиR11 и R12, R12 и R15, R15 и R16, R13 и R14 или R13 и R15 вместе с атомами углерода и/или азота, к которым они присоединены, могут образовывать 3-7-членное насыщенное, ненасыщенное или частично ненасыщенное кольцо, необязательно содержащее 1-2 гетероатома, выбранных из N и О;L представляет собой (CR2)1-4 или связь; каждый R и R17 независимо представляют собой H или C1-6 алкил;R18 представляет собой C1-6 алкил; р имеет значение 2-4. В одном варианте осуществления изобретение относится к соединению формулы (3)R5a и R5b независимо представляют собой C1-6 алкил или C1-6 алкоксигруппу;-8 018282 В конкретных вариантах осуществления описанной выше формулы (3) R5a представляет собой метоксигруппу или изопропоксигруппу и R5b представляет собой метил. В других конкретных вариантах осуществления изобретение относится к соединению формул (3A),(3B), (3C) или (3D) где R5a представляет собой метоксигруппу или изопропоксигруппу;R10b, R10e, R10f и R10h независимо представляют собой H или C1-6 алкил;R10a, R10c, R10d и R10g независимо представляют собой Н, галоген, C1-6 алкил, NR2 или фенил;R1, R2, R7, R9 и R являются такими, как определено для формулы (1). В другом варианте осуществления изобретение относится к соединению формулы (4) или его физиологически приемлемой соли,где Z представляет собой NR9a или О;R5a и R5b независимо представляют собой C1-6 алкил или C1-6 алкоксигруппу;C1-6 алкил или галогензамещенный C1-6 алкил или R20 представляет собой H; каждый R9a независимо представляет собой Н, C1-6 алкил, -(CR2)p-OR17,-L-C(O)-R17, -C(O)O-R17 или -L-C(O)-NRR17, где R и R17 вместе с атомом N в NRR17 могут образовывать 5-6-членное кольцо, необязательно содержащее О или S;R22, R24, R27 и R29 независимо представляют собой H или C1-6 алкил;R23, R25, R26 и R28 независимо представляют собой Н, C1-6 алкил, NR2 или галоген; каждый R представляет собой H или C1-6 алкил; при условии, что R22 и R23, оба, не представляют собой H; R24, R25 и R26, все, не представляют собойH и R27 и R28, оба, не представляют собой H. В другом варианте осуществления изобретение относится к соединению формулы (5) или его физиологически приемлемой соли,где R1 и R2 представляют собой H;R5a и R5b независимо представляют собой C1-6 алкил или C1-6 алкоксигруппу;C1-6 алкил или галогензамещенный C1-6 алкил или R20 представляет собой H; каждый R9a независимо представляет собой Н, C1-6 алкил, -(CR2)p-OR17, -L-C(O)-R17, -C(O)O-R17 илиR21 представляет собой H или C1-6 алкил. В другом варианте осуществления изобретение относится к способу получения соединения формулы (6) или его фармацевтически приемлемой солиR19 представляет собой C1-6 алкил; включающему: а) взаимодействие реагента формулы (6 а) с реагентом формулы (6b) или его фармацевтически приемлемой солью в условиях, подходящих для получения промежуточного соединения формулы (6 с) б) взаимодействие указанного промежуточного соединения формулы (6 с) с окисляющим агентом с получением промежуточного соединения формулы (6d) где X1 и X2 представляют собой уходящую группу; в) взаимодействие указанного промежуточного соединения формулы (6d) с реагентом формулы (6e) или его фармацевтически приемлемой солью в условиях, подходящих для получения соединения формулы (6) или его фармацевтически приемлемой соли. В одном варианте осуществления изобретение относится к способу получения соединения формул где R5a представляет собой метоксигруппу или изопропоксигруппу;R10a, R10b, R10c, R10d, R10e, R10f, R10g и R10h независимо представляют собой Н, галоген, C1-6 алкил, NH2 или фенил; каждый R19 является таким, как определено в формуле (6). В каждой из описанных выше формул любые асимметричные атомы углерода могут присутствовать в (R)-, (S)- или (R,S)-конфигурации. Соединения, таким образом, могут присутствовать в виде смесей изомеров или в виде чистых изомеров, например в виде чистых энантиомеров или диастереомеров. Настоящее изобретение также включает возможные таутомеры соединений по изобретению. Любые приведенные здесь формулы также представляют собой немеченые формы, а также изотопно меченые формы соединений. Изотопно меченые соединения имеют структуры, представленные приведенными формулами, за исключением того, что один или несколько атомов заменены атомом, имеющим выбранную атомную массу или массовый номер. Примеры изотопов, которые могут быть включены в соединения по изобретению, включают изотопы водорода, углерода, азота, кислорода, фосфора, фтора и хлора, такие как 2H, 3H, 11 С, 13 С, 14 С, 15N, 18F 31P, 32P, 35S, 36Cl, 125I соответственно. Настоящее изобретение включает различные изотопно меченые соединения, как здесь определено,например соединения, в которых присутствуют радиоактивные изотопы, такие как 3 Н, 13 С и 14 С. Такие изотопно меченые соединения полезны для метаболических исследований (например, с 14 С), исследований кинетики реакции (например, с 2 Н или 3 Н), методик определения или визуализации, таких как позитронная эмиссионная томография (PET) или однофотонная эмиссионная компьютерная томография(SPECT), включая анализы тканевого распределения лекарственного препарата или субстрата, или для радиоактивного лечения пациентов. В других примерах 18F или меченое соединение может использоваться для исследований PET или SPECT. Изотопные варианты соединений, возможно, имеют измененную метаболическую жизнеспособность соединения и/или придают небольшие изменения физических свойств, таких как гигроскопичность и им подобные. Изотопные варианты также имеют потенциал по- 11018282 вышения эффективности и безопасности, повышения биодоступности и времени полувыведения, изменения связывания с белками, изменения биораспределения, повышения доли активных метаболитов и/или снижения образования реакционных или токсичных метаболитов. Изотопно меченые соединения настоящего изобретения и их пролекарства обычно могут быть получены осуществлением методик, описанных на приведенных далее схемах или в примерах и получениях путем замены легкодоступным изотопно меченым реагентом неизотопно меченого реагента. Для каждой из описанных выше формул каждая необязательно замещенная группа может быть замещена C1-6 алкилом, C2-6 алкенилом или C3-6 алкинилом, каждый из которых может быть необязательно галогенирован или необязательно содержать атом углерода, который может быть заменен или замещенN, S, О или их комбинациями (например, гидроксил C1-8 алкил, C1-8 алкоксил C1-8 алкил); галогеном, аминогруппой, амидиногруппой, C1-6 алкоксигруппой; гидроксилом, метилендиоксигруппой, карбоксигруппой; C1-8 алкилкарбонилом; C1-8 алкоксикарбонилом, карбамоилом, C1-8 алкилкарбамоилом, сульфамоилом,цианогруппой, оксогруппой, нитрогруппой или необязательно замещенным карбоциклическим кольцом,гетероциклическим кольцом, арилом или гетероарилом, как описано выше. Фармакология и полезность. Соединения по изобретению и их фармацевтически приемлемые соли обладают ценными фармакологическими свойствами при тестировании in vitro в бесклеточных анализах с киназой и в клеточных анализах и, следовательно, полезны в качестве фармацевтических средств. В одном варианте осуществления соединения (1), (3), (3A)-(3D), (4) или (5) могут ингибировать активность тирозинкиназы анапластической лимфомной киназы (ALK) и слитого белка NPM-ALK. Этот белок тирозинкиназы является результатом слияния генов нуклеофозмина (NPM) и ALK, делая активность белка тирозинкиназы ALK лиганднезависимым. NPM-ALK играет ключевую роль в передаче сигнала ряда гематопоэтических и других клеток человека, что приводит к гематологическим и неоплатическим заболеваниям, например к анапластической лимфоме больших клеток (ALCL) и неходжкинской лимфоме (NHL), конкретно - к ALK+NHL или Alkomas, в воспалительных миофибробластомных опухолях (IMT) и нейробластомах (статья Duyster et al., 2001, Oncogene 20, p. 5623-5637). В дополнение кNPM-ALK, другие слияния генов идентифицированы при гематологических и неопластических заболеваниях человека, например TPM3-ALK (слияние немышечного тропомиозина с ALK). Ингибирование активности тирозинкиназы ALK может быть показано, используя известные методы, например, используя рекомбинантный киназный домен ALK в аналогии с киназным анализом VEGFR, описанным в статье J. Wood et al., Cancer Res., 2000, 60, p. 2178-2189. Обычно ферментативные анализы in vitro с помощью белка тирозинкиназы GST-ALK осуществляли в 96-луночных планшетах в виде анализа со связыванием на фильтре в 20 мМ Tris HCl, pH - 7,5, 3 мМ MgCl2, 10 мМ MnCl2, 1 мМ DTT,0,1 Ci/анализ (=30 мкл) [-33 Р]-АТФ, 2 мкМ АТФ, 3 мкг/мл поли (Glu, Tur 4:1) Poly-EY (Sigma P-0275),1% ДМСО, 25 нг фермента ALK. Анализы инкубировали в течение 10 мин при комнатной температуре. Реакции останавливали добавлением 50 мкл 125 мМ EDTA и реакционную смесь переносили в планшетуMAIP Multiscreen (Millipore, Bedford, MA, США), заранее смоченную метанолом и повторно смоченную через 5 мин H2O. После промывания (0,5% H3PO4) планшеты определяли количественно в жидкостном сцинтилляционном счетчике. Значения IC50 рассчитывали линейным регрессионным анализом процентного ингибирования. Соединения (1), (3), (3A)-(3D), (4) или (5) могут потенциально ингибировать рост NPM-ALK человека, сверхэкспрессирующий клетки BaF3 мыши (DSMZ Deutsche Sammiung von Mikroorganismen undZelikulturen GmbH, Германия). Экспрессия NPM-ALK может осуществляться трансфекцией клеточной линии BaF3 с помощью вектора экспрессии pClneo (Promega Corp., Madison WI, США), кодирующегоNPM-ALK, и последующей селекции G418 резистентных клеток. Нетрансфицированные BaF3 клетки зависят от IL-3 в отношении клеточной выживаемости. Наоборот, NPM-ALK, экспрессирующие клеткиBaF3 (называемые далее BaF3-NPM-ALK) могут пролиферировать в отсутствие IL-3 из-за того, что они получают пролиферативный сигнал через киназу NPM-ALK. Предполагаемые ингибиторы киназыNPM-ALK, следовательно, устраняют сигнал роста и могут приводить к антипролиферативной активности. Антипролиферативная активность предполагаемых ингибиторов киназы NPM-ALK, однако, может подавляться добавлением IL-3, который обеспечивает сигналы роста через механизм, независимый отNPM-ALK. Аналогичная клеточная система, использующая киназу FLT3, также была описана (см. статью Е. Weisberg et al., Cancer Cell; 2002, 1, p. 433-443). Ингибирующая активность соединений по изобретению может определяться следующим образом. Обычно клетки BaF3-NPM-ALK (15,000/микротитровальная планшета) переносили в 96-луночные микротитровальные планшеты. Тестируемые соединения, растворенные в диметилсульфоксиде (ДМСО),добавляли в ряду концентраций (серии разбавлений) таким образом, чтобы конечная концентрация ДМСО не превышала 1% (об.). После добавления планшеты инкубировали в течение двух суток, в это время контрольные культуры без тестируемого соединения способны подвергаться двум циклам клеточного деления. Рост клеток BaF3-NPM-ALK измеряли с помощью окрашивания YOPRO [статья Т. Idziorek et al., J. Immunol. Methods; 1995, 185, p. 249-258]: 25 мкл буфера для лизиса, содержащего 20 мМ цитрата натрия, pH 4,0, 26,8 мМ хлорида натрия, 0,4% NP40, 20 мМ EDTA и 20 мМ добавляли в каждую лунку. Лизис клеток завершался через 60 мин при комнатной температуре и общее количествоBiosystems) со следующими установками: возбуждение (нм) 485/20 и поглощение (нм) 530/25. Значения IC50 могут быть определены компьютерной системой с использованием формулыIC50 = [(ABStest - ABSstart)/(ABScontrol - ABSstart)]100,где ABS - поглощение. Значение IC50 в этих экспериментах показывает ту концентрацию тестируемого соединения, которая приводит к количеству клеток, которое на 50% меньше количества, которое получают с помощью контроля без ингибитора. Соединения по изобретению в свободной форме или в форме фармацевтически приемлемой соли могут иметь ценные фармакологические свойства, например, как показано в тестах invitro, описанных в данном изобретении. Обычно соединения по изобретению имеют значения IC50 от 1 нМ до 10 мкМ. В некоторых примерах соединения по изобретению имеют значения IC50 от 1 нМ до 5 мкМ или более предпочтительно от 1 нМ до 1 мкМ. В других примерах соединения по изобретению имеют значения IC50 менее 1 нМ или более 10 мкМ. Соединения по изобретению могут проявлять процентное ингибирование более 50% или в других вариантах осуществления могут проявлять процентное ингибирование более 70% в отношении ALK при 10 мкМ. Антипролиферативное действие соединений по изобретению также может определяться на клеточной линии лимфомы KARPAS-299 человека (DSMZ Deutsche Sammiung von Mikroorganismen undZelikulturen GmbH, Braunschweig, Германия, описанной в статье WG Dirks et al., Int. J. Cancer, 2002, 100,p. 49-56), используя ту же методику, описанную выше для клеточной линии BaF3-NPM-ALK. В некоторых вариантах осуществления соединения по изобретению могут проявлять ингибирующую активность со значениями IC50 в диапазоне от около 0,01 до 1 мкМ. Действие соединений по изобретению на автофосфорилирование ALK может определяться на клеточной линии лимфомы KARPAS-299 человека с помощью иммуноблота, как описано в статье W.G. Dirks et al., Int. J. Cancer, 2002, 100, p. 49-56. В другом варианте осуществления соединения по изобретению могут ингибировать фокальную адгезионную киназу (FAK) и могут быть полезны в качестве фармацевтических средств для лечения состояния, вызванного нарушением сигнальных каскадов, связанных с FAK, такого как для лечения конкретных опухолей. Ингибирование эндогенной передачи сигналов FAK приводит к снижению моторики и в некоторых случаях вызывает гибель клеток. С другой стороны, усиление передачи сигналов FAK экзогенной экспрессией повышает клеточную моторику. Кроме того, FAK сверхэкспрессируется при инвазивном и метастатическом раке эпителия, мезенхимы, щитовидной железы и простаты. Следовательно,ингибитор FAK, вероятно, является лекарственным препаратом для противоопухолевого роста и метастаз. Соединения по изобретению, следовательно, могут быть полезны для профилактики и/или лечения позвоночных, более конкретно млекопитающих, страдающих неопластическим заболеванием, в частности опухоль груди, рак кишечника (толстой кишки и прямой кишки), рак желудка и рак яичников и простаты, немелкоклеточный рак легких, мелкоклеточный рак легких, рак печени, меланома, рак мочевого пузыря и рак головы и шеи. Соотношение между ингибированием FAK и иммунной системой описано, например, в статьеG.A. van Seventer et al., Eur. J. Immunol., 2001, 31, p. 1417-1427. Следовательно, соединения по изобретению, например, полезны для профилактики и/или лечения позвоночных, более конкретно млекопитающих, страдающих нарушениями иммунной системы, заболеваниями или нарушениями, опосредованными Т-лимфоцитами, В-лимфоцитами, тучными клетками и/или эозинофилами, например острое или хроническое отторжение органа или ткани алло- или ксенографта, атеросклероз, окклюзия сосуда вследствие повреждения сосуда, такого как ангиопластика, рестеноз, гипертензия, сердечная недостаточность,хроническое обструктивное заболевание легких, болезнь ЦНС, такая как болезнь Альцгеймера или амиотрофический латеральный склероз; рак; инфекционное заболевание, такое как СПИД; септический шок или зрелый респираторный дистресс-синдром, травма при ишемии/реперфузии, например инфаркт миокарды, инсульт, кишечная ишемия, почечная недостаточность или геморрагический шок или травматический шок. В другом варианте осуществления соединения по изобретению могут ингибировать белок, связанный с зета-цепью 70 (ZAP-70). Взаимодействие протеинтирозинкиназы ZAP-70 с агентами по изобретению может быть показано, например, их способностью предотвращать фосфорилирование LAT-11 (линкер для активации Т-клеток) протеинтирозинкиназой ZAP-70 человека в водном растворе. Следовательно, соединения по изобретению могут использоваться для профилактики или лечения нарушений или заболеваний, в которых играет роль ингибирование ZAP-70. Соединения по изобретению также могут ингибировать рецептор инсулиноподобного фактора роста 1 (IGF-1R) и могут использоваться для лечения опосредованных IGF-1R заболеваний. Примеры опосредованных IGF-1R заболеваний включают, но не ограничиваются ими, пролиферативные заболевания,такие как опухоли, например опухоли груди, почек, простаты, прямой и ободочной кишки, щитовидной железы, яичников, поджелудочной железы, нейронов, легких, матки и желудочно-кишечного тракта, а также остеосаркомы и меланомы. Эффективность соединений по изобретению в качестве ингибиторов активности тирозинкиназы IGF-1R может быть показана с помощью клеточного захвата ELISA. В этом анализе определяли активность соединений по изобретению в отношении (IGF-1)-индуцированного автофосфорилирования IGF-1R. Соединения по изобретению также могут быть полезны для лечения и/или профилактики острых или хронических воспалительных заболеваний или нарушений или аутоиммунных заболеваний, таких как ревматоидный артрит, остеоартрит, системная красная волчанка, тироидит Хашимото, рассеянный склероз, астенический бульбарный паралич, диабет (I и II типа) и связанные с ними нарушения, респираторные заболевания, такие как астма или воспалительное повреждение печени, воспалительное гломерулярное повреждение, кожные проявления иммунных нарушений или заболеваний, воспалительные и гиперпролиферативные кожные заболевания (такие как псориаз, атопический дерматит, аллергический контактный дерматит, раздражающий контактный дерматит и другие экзематозные дерматиты, себорейный дерматит), воспалительные глазные заболевания, например, синдром Сьергена, кератоконъюнктивит или увеит, болезнь раздраженного кишечника, болезнь Крона или язвенный колит. В соответствии с изложенным настоящее изобретение включает:(1) соединение по изобретению для применения в качестве фармацевтического средства;(2) соединение по изобретению для применения в качестве ингибитора ALK, например для применения в любом из описанных выше конкретных показаний;(3) фармацевтическую композицию, например, для применения в любом из описанных выше конкретных показаний, содержащую соединение по изобретению в качестве активного ингредиента вместе с одним или несколькими фармацевтически приемлемыми разбавителями или носителями;(4) применение соединения по изобретению для изготовления лекарственного средства для лечения или профилактики заболевания или состояния, при котором играет роль или участвует активация ALK;(5) применение соединения по изобретению для изготовления лекарственного средства для лечения или профилактики заболевания, которое чувствительно к ингибированию анапластической лимфомной киназы;(6) применение в соответствии с пунктом (5), где излечиваемое заболевание выбрано из анапластической крупноклеточной лимфомы, неходжкинской лимфомы, воспалительных миофибробластомных опухолей, нейробласты и неопластических заболеваний;(7) применение в соответствии с пунктами (5) или (6), где соединение или его фармацевтически приемлемая соль описаны в одном из примеров. Введение и фармацевтические композиции. Обычно соединения по изобретению вводят в терапевтически эффективных количествах любыми обычными и приемлемыми способами, известными из уровня техники, отдельно или в комбинации с одним или несколькими терапевтическими агентами. Терапевтически эффективное количество может широко варьироваться в зависимости от степени тяжести заболевания, возраста и относительного здоровья субъекта, активности используемого соединения и других факторов, известных специалисту в данной области техники. Например, для лечения неопластических заболеваний и нарушений иммунной системы необходимая дозировка будет также зависеть от способа введения, в частности, излечиваемого состояния и нужного эффекта. Обычно удовлетворительные результаты получают при систематических суточных дозировках от около 0,01 до около 100 мг/кг веса тела или особенно от около 0,03 до 2,5 мг/кг веса тела. Показанная суточная дозировка для большего млекопитающего, например человека, может находиться в диапазоне от около 0,5 до около 2000 мг или более конкретно от около 0,5 до около 100 мг, которая обычно вводится, например, раздельными дозами вплоть до четырех раз в день или в замедленной форме. Подходящие единичные дозированные формы для перорального введения включают от около 1 до 50 мг активного ингредиента. Соединения по изобретению могут вводиться в виде фармацевтических композиций любым обычным способом; энтерально, перорально, например в форме таблеток или капсул, или парентерально, например в форме инъекционных растворов или суспензий, или местно, например в форме лосьонов, гелей,мазей или кремов либо в назальной или суппозитарной форме. Фармацевтические композиции, включающие соединение настоящего изобретения в свободной форме или в форме фармацевтически приемлемой соли вместе по крайней мере с одним фармацевтически приемлемым носителем или разбавителем, могут быть изготовлены обычным способом методами смешения, гранулирования, покрытия, растворения или лиофилизации. Например, фармацевтические композиции, содержащие соединение по изобретению вместе по крайней мере с одним фармацевтически приемлемым носителем или разбавителем, могут быть получены обычным способом смешением с фармацевтически приемлемым носителем или разбавителем. Единичные дозированные формы для перорального введения содержат, например, от около 0,1 до около 500 мг активного вещества. В одном варианте осуществления фармацевтические композиции представляют собой растворы активного ингредиента, включая суспензии или дисперсии, такие как изотонические водные растворы. В случае лиофилизованных композиций, содержащих активный ингредиент отдельно или вместе с носите- 14018282 лем, таким как маннит, дисперсии или суспензии могут быть получены перед применением. Фармацевтические композиции могут быть стерилизованы и/или содержать адъюванты, такие как консерванты,стабилизаторы, увлажняющие или эмульгирующие агенты, промоторы раствора, соли для регулирования осмотического давления и/или буферы. Подходящие консерванты включают, но не ограничиваются ими,антиоксиданты, такие как аскорбиновая кислота, или микробиотические средства, такие как сорбиновая или бензойная кислота. Растворы или суспензии также могут включать агенты для повышения вязкости,включая, но не ограничиваясь ими, натрийкарбоксиметилцеллюлозу, карбоксиметилцеллюлозу, декстран, поливинилпирролидон, желатины или солюбилизаторы, например Tween 80 (моноолеат полиоксиэтилен(20)сорбита). Суспензии в масле могут включать в качестве масляного компонента растительные, синтетические или полусинтетические масла, обычные для инъекционных целей. Примеры включают жидкие эфиры сложных кислот, которые содержат в качестве кислотного компонента длинные жирные кислоты, содержащие от 8 до 22 атомов углерода или в некоторых вариантах осуществления от 12 до 22 атомов углерода. Подходящие жидкие эфиры жирных кислот включают, но не ограничиваются ими, лауриновую кислоту, тридециловую кислоту, миристиновую кислоту, пентадециловую кислоту, пальмитиновую кислоту, маргариновую кислоту, стеариновую кислоту, арахидиновую кислоту, бехеновую кислоту или соответствующие ненасыщенные кислоты, например олеиновую кислоту, элаидиновую кислоту, эруциновую кислоту, брассидиновую кислоту и линолевую кислоту, и, при необходимости, могут содержать антиоксиданты, например витамин Е, 3-каротен или 3,5-ди-трет-бутилгидрокситолуол. Спиртовой компонент этих эфиров жирных кислот может содержать шесть атомов углерода и может быть моновалентным или поливалентным, например моно-, ди- или тривалентным спиртом. Подходящие спиртовые компоненты включают, но не ограничиваются ими, метанол, этанол, пропанол, бутанол или пентанол или их изомеры; гликоль и глицерин. Другие подходящие эфиры жирных кислот включают, но не ограничиваются ими, этилолеат, изопропилмиристат, изопропилпальмитат, LABRAFIL М 2375, (полиоксиэтиленглицерин), LABRAFIL М 1944 CS (ненасыщенные полигликозилированные глицериды, полученные введением спиртовых групп в масло абрикосовых косточек и содержащие глицериды и полиэтиленгликолевый эфир),LABRASOL (насыщенные полигликозилированные глицериды, полученные введением спиртовых групп ТСМ и содержащие глицериды и полиэтиленгликолевый эфир; все от GaKefosse, Франция) и/илиMIGLYOL 812 (триглицерид насыщенных жирных кислот с длиной цепи C8-C12 от Hls AG, Германия) и растительные масла, такие как хлопковое, миндальное, оливковое, касторовое, кунжутное, соевое или арахисовое масло. Фармацевтические композиции для перорального введения могут быть получены, например, объединением активного ингредиента с одним или несколькими твердыми носителями и, при необходимости,гранулированием полученной смеси, и обработкой смеси или гранул дополнительными эксципиентами с получением таблеток или ядер таблеток. Подходящие носители включают, но не ограничиваются ими, наполнители, такие как сахара, например лактоза, сахароза, маннит или сорбит, составы целлюлозы и/или фосфаты кальция, например трикальцийфосфат или гидрофосфат кальция, а также связующие, такие как крахмалы, например кукурузный, пшеничный, рисовый или картофельный крахмал, метилцеллюлоза, гидроксипропилметилцеллюлоза, натрийкарбоксиметилцеллюлоза и/или поливинилпирролидон, и/или, при необходимости, разрыхлители, такие как описанные выше крахмалы, карбоксиметилкрахмал, поперечно сшитый поливинилпирролидон, альгиновая кислота или ее соль, такая как альгинат натрия. Дополнительные эксципиенты включают поточные кондиционеры и лубриканты, например салициловую кислоту, тальк, стеариновую кислоту или ее соли, такие как стеарат магния или кальция, и/или полиэтилегликоль или ее производные. Ядра таблеток могут быть покрыты подходящими, необязательно энтеральными покрытиями с помощью, например, концентрированных растворов сахаров, которые могут включать гуммиарабик, тальк,поливинилпирролидон, полиэтиленгликоль и/или диоксид титана, или растворов покрытий в подходящих органических растворителях или смесях растворителей, или для получения энтеральных покрытий растворов подходящих составов целлюлозы, таких как фталат ацетилцеллюлозы или фталат гидроксипропилметилцеллюлозы. Красители или пигменты могут добавляться к таблеткам или покрытиям таблеток, например, в целях идентификации или для указания различных доз активного ингредиента. Фармацевтические композиции для перорального введения также могут включать твердые капсулы,включающие желатиновые или мягкие капсулы, содержащие желатин и пластификатор, такой как глицерин или сорбит. Твердые капсулы могут содержать активный ингредиент в форме гранул, например в смеси с наполнителями, такими как кукурузный крахмал, связующими и/или глидантами, такими как тальк или стеарат магния, и необязательно стабилизаторами. В мягких капсулах активный ингредиент может быть растворен или суспендирован в подходящих жидких эксципиентах, таких как жирные масла,парафиновое масло или жидкие полиэтиленгликоли или эфиры жирных кислот этилен- или пропиленгликоля, к которым также могут добавляться стабилизаторы и детергенты, например полиок- 15018282 сиэтиленсорбит жирные кислоты. Фармацевтические композиции, подходящие для ректального введения, например, представляют собой суппозитории, включающие комбинацию активного ингредиента и основу для суппозиториев. Подходящими основами для суппозиториев являются, например, природные или синтетические триглицериды, парафиновые углеводороды, полиэтиленгликоли или высшие алканолы. Фармацевтические композиции, подходящие для парентерального введения, могут содержать водные растворы активного ингредиента в растворимой в воде форме, например растворимой в воде соли,или в форме водных инъекционных суспензий, которые содержат вещества для повышения вязкости,например натрийкарбоксиметилцеллюлозу, сорбит и/или декстран, и, при необходимости, стабилизаторы. Активный ингредиент, необязательно вместе с эксципиентами, также может находиться в форме лиофилизата и может быть получен в растворе перед парентеральным введением добавлением подходящих растворителей. Растворы, такие как используются, например, для парентерального введения, также могут использоваться для инфузионных растворов. Изготовление инъекционных препаратов обычно осуществляют в стерильных условиях, которым является наполнение, например, в ампулы или сосуды и закрывание сосуда. Соединения по изобретению могут вводиться в виде отдельного активного ингредиента или вместе с другими лекарственными препаратами, полезными в отношении неопластических заболеваний или полезных при иммуномодулирующих режимах лечения. Например, соединения по изобретению могут использоваться в соответствии с изобретением в комбинации с фармацевтическими композициями, эффективными при различных заболеваниях, как описано выше, например с циклофосфамидом,5-фторурацилом, флударабином, гемцитабином, цисплатином, карбоплатином, винкристином, винбластином, этопозидом, иринотеканом, паклитакселем, доцетакселем, ритуксаном, доксорубицином, гефитинибом или иматинибом или также с циклоспоринами, рапамицинами, аскомицинами или их иммунодепрессантными аналогами, напримерциклоспорином А, циклоспорином G, FK-506, сиролимусом или эверолимусом, кортикостероидами, например, преднизоном, циклофосфамидом, азатиопреном,метотрексатом, солями золота, сульфазалазином, антималярийными средствами, брехинаром, лефлуномидом, мизорибином, микофенольной кислотой, микофенолятом, мофетилом, 15-дезоксиспергуалином,иммунодепрессорными моноклональными антителами, например моноклональным антителом к лейкоцитным рецепторам, например МНС, CD2, CD3, CD4, CD7, CD25, CD28, I CD40, CD45, CD58, CD80,CD86, CD152, CD137, CD154, ICOS, LFA-1, VLA-4 или их лиганды, или другими иммуномодулирующими соединениями, например CTLA41g. Настоящее изобретение также относится к фармацевтическим комбинациям, например набору,включающему а) первый агент, который представляет собой соединение по изобретению, как здесь описано, в свободной форме или в форме фармацевтически приемлемой соли и б) по крайней мере один совместный агент. Набор может включать инструкции по их применению. Способы получения соединений по изобретению. Общие методики получения соединений по изобретению описаны далее в примерах. В описанных реакциях реакционоспособные функциональные группы, например гидроксигруппа, аминогруппа, иминогруппа, тиогруппа или карбоксигруппа, где она необходима в конечном продукте, может быть защищена для устранения ее нежелательного участия в реакциях. Обычные защитные группы могут использоваться в соответствии со стандартной практикой (см., например, книгу T.W. Greene и P.G.M. Wuts,"Protective Groups in Organic Chemistry", John Wiley and Sons, 1991). В некоторых примерах соединения формулы (1) могут быть получены в соответствии с методикой синтеза, приведенной на схеме 1. Соединения формулы (6) также могут быть получены в соответствии с методиками синтеза, описанными на схеме 2. Схема 2 Соединения по изобретению, включая их соли, также получают в форме гидратов или их кристаллы могут включать, например, растворитель, использующийся при кристаллизации (представлены как сольваты). Соли обычно могут превращаться в соединения в свободной форме, например, обработкой подходящими основными агентами, например карбонатами щелочных металлов, гидрокарбонатами щелочных металлов или гидроксидами щелочных металлов, такими как карбонат калия или гидроксид натрия. Соединение по изобретению в форме основной аддитивной соли может быть превращено в соответствующую свободную кислоту обработкой подходящей кислотой (например, хлористо-водородной кислотой и т.д.). Ввиду тесной связи новых соединений в свободной форме и соединений в форме их солей, включая соли, которые могут использоваться в качестве промежуточных соединений, например для очистки или идентификации новых соединений, любая ссылка на свободные соединения должна пониматься как относящаяся также к соответствующим солям, если это возможно. Соли соединений по изобретению с солеобразующей группой могут быть получены известным способом. Кислотные аддитивные соли соединений (1), (2), (2 А), (3A)-(3D), (4) или (5), следовательно, могут быть получены обработкой кислотой или подходящим анионообменным реагентом. Фармацевтически приемлемые соли соединений по изобретению могут быть получены, например, в виде кислотных аддитивных солей, с органическими или неорганическими кислотами, из соединений (1), (2), (2 А), (3A)-(3D),(4) или (5) с основным атомом азота. Подходящие неорганические кислоты включают, но не ограничиваются ими, галогенсодержащие кислоты, такие как хлористо-водородная кислота, серная кислота или фосфорная кислота. Подходящие органические кислоты включают, но не ограничиваются ими, карбоновые, фосфорные, сульфоновые или сульфаминовые кислоты, такие как уксусная, пропионовая, октановая, декановая, додекановая, гликолевая, молочная, фумаровая, янтарная, адипиновая, пимелиновая, субериновая, азелаиновая, яблочная к,винная, лимонная кислоты, аминокислоты, такие как глутаминовая кислота или аспарагиновая кислота,малеиновая кислота, гидроксималеиновая кислота, метилмалеиновая кислота, циклогексанкарбоновая кислота, адамантанкарбоновая кислота, бензойная кислота, салициловая кислота, 4-аминосалициловая кислота, фталевая кислота, фенилуксусная кислота, миндальная кислота, коричная кислота, метан- или этансульфоновая кислота, 2-гидроксиэтанесульфоновая кислота, этан-1,2-дисульфоновая кислота, бензолсульфоновая кислота, 2-нафталенсульфоновая кислота, 1,5-нафталендисульфоновая кислота,2-, 3- или 4-метилбензолсульфоновая кислота, метилсерная кислота, этилсерная кислота, додецилсерная кислота, N-циклогексилсульфаминовая кислота, N-метил-, N-этил- или N-пропилсульфаминовая кислота или другие органические протонные кислоты, такие как аскорбиновая кислота. Для выделения или очистки также возможно использование фармацевтически неприемлемых солей, например пикратов или перхлоратов. Для терапевтического применения используются только фармацевтически приемлемые соли или свободные соединения (при необходимости в форме фармацевтических препаратов). Соединения по изобретению в неокисленной форме могут быть получены из N-оксидов соединений по изобретению обработкой восстанавливающим агентом (например, серой, диоксидом серы, трифенилфосфином, боргидридом лития, боргидридом натрия, трихлоридом фосфора, трибромидом или им подобными) в подходящем инертном органическом растворителе (например, ацетонитриле, этаноле, водном диоксане или им подобных) при температуре от 0 до 80 С. Пролекарственные производные соединений по изобретению могут быть получены способами, известными специалисту в данной области техники (например, более подробно см. книгу Saulnier et al.,1994, Bioorganic and Medicinal Chemistry Letters, vol. 4, p. 1985). Например, подходящие пролекарства могут быть получены реакцией нефункционализированного соединения по изобретению с подходящим карбамилирующим агентом (например, 1,1-ацилоксиалкилкарбанохлоридат, паранитрофенилкарбонат или им подобные). Защищенные производные соединений по изобретению могут быть получены методами, известными специалисту в данной области техники. Подробное описание методик, подходящих для создания защитных групп, и их удаление могут быть обнаружены в книге Т.W. Greene, "Protecting Groups in OrganicChemistry", 3-e изд., John Wiley and Sons, Inc., 1999. Соединения по изобретению могут быть получены в виде их отдельных стереоизомеров реакцией рацемической смеси соединения с оптически активным расщепляющим агентом с получением пары диастереоизомерных соединений, разделяя диастереомеры и восстанавливая оптически чистые энантиомеры. Расщепление энантиомеров может осуществляться с помощью ковалентных диастереомерных производных соединений по изобретению или с помощью диссоциируемых комплексов (например, кристаллические диастереомерные соли). Диастереомеры имеют различные физические свойства (например, температуры плавления, температуры кипения, растворимости, реакционоспособность и т.д.) и могут быть легко разделены на основании этих различий. Диастереомеры могут быть разделены фракционной кристаллизацией, хроматографией или методиками разделения/расщепления, основанными на различиях в растворимости. Оптически чистый энантиомер затем выделяют, наряду с расщепляющим агентом, любыми практическими методами, которые не приводят к рацемизации. Более подробное описание методик, подходящих для выделения стереоизомеров соединений из их рацемической смеси, может быть обнаружено в книге Jean Jacques, Andre Collet, Samuel H. Wilen, "Enantiomers, Racemates and Resolutions",John Wiley and Sons, Inc., 1981. Итак, соединения по изобретению могут быть получены способом, описанным в примерах:(а) необязательно превращением соединения по изобретению в фармацевтически приемлемую соль;(б) необязательно превращением формы соли соединения по изобретению в несолевую форму;(в) необязательно превращением неокисленной формы соединения по изобретению в фармацевтически приемлемый N-оксид;(г) необязательно превращением N-оксидной формы соединения по изобретению в его неокисленную форму;(д) необязательно выделением индивидуального изомера соединения по изобретению из смеси изомеров;(е) необязательно превращением нефункционализированного соединения по изобретению в фармацевтически приемлемое пролекарственное производное;(ж) необязательно превращением пролекарственного производного соединения по изобретению в его нефункционализированную форму. Несмотря на то что получение исходных материалов конкретно не описано, соединения являются известными или могут быть получены аналогично способам, известным из предшествующего уровня техники, или как описано далее в примерах. Специалисту в данной области техники ясно, что описанные выше превращения только иллюстрируют способы получения соединений настоящего изобретения и что другие хорошо известные способы аналогично могут использоваться. Настоящее изобретение далее представлено, но не ограничено, следующими примерами, которые иллюстрируют получение соединений по изобретению. Получение промежуточных соединений. Промежуточное соединение 1. 2,4,6-Трихлорпиримидин-5-карбальдегид Барбитуровую кислоту (5,0 г, 39,1 ммоль) добавляли к перемешиваемому раствору POCl3 (23,5 мл,252 ммоль) и ДМФА (3 мл, 38,8 ммоль) при комнатной температуре в атмосфере азота. Смесь кипятили с обратным холодильником в течение 15 ч, затем оставляли охлаждаться до комнатной температуры. Избыток POCl3 удаляли в вакууме и полученный вязкий материал осторожно выливали в раскрошенный лед (150 г). Бледно-коричневый осадок отфильтровывали и сушили в вакууме с получением 2,4,6 трихлорпиримидин-5-карбальдегида. Промежуточное соединение 2. 2,4-Дихлор-6-(2-(изопропилсульфонилфениламино)пиримидин-5-карбальдегид К перемешиваемому раствору 2,4,6-трихлорпиримидин-5-карбальдегида (5,0 г, 23,8 ммоль) в ДХМ (50 мл) добавляли 2-(изопропилсульфонил)анилин (9,5 г, 47,6 ммоль) при 0C в атмосфере азота. Реакционную смесь постепенно нагревали до комнатной температуры и перемешивали в течение ночи. Твердое вещество отфильтровывали и фильтрат концентрировали в вакууме и очищали хроматографией на силикагеле (ДХМ/EtOAC/гексан: 15/15/70) с получением 2,4-дихлор-6-(2(изопропилсульфонил)фениламино)пиримидин-5-карбальдегида.(797 мг, 2,14 ммоль) в ТГФ (10 мл) добавляли метилмагнийбромид (3,0 М в диэтиловом эфире, 6,4 мл,19,3 ммоль) при -78C в атмосфере азота. Реакционную смесь постепенно нагревали до комнатной температуры и перемешивали в течение ночи. Реакционную смесь выливали в 20 мл насыщенного водного раствора NH4Cl при 0C и разделяли между EtOAc (230 мл) и насыщенным раствором хлорида натрия(210 мл). Собранные органические экстракты сушили Na2SO4, концентрировали в вакууме и очищали хроматографией на силикагеле (EtOAc/гексан: 30/70) с получением 1-(2,4-дихлор-6-(2(изопропилсульфонил)фениламино)пиримидин-5-ил)этанола. К раствору 1-(2,4-дихлор-6-(2-(изопропилсульфонил)фениламино)пиримидин-5-ил)этанола (580 мг,1,49 ммоль) в ДХМ (30 мл) добавляли PDC (561 мг, 1,49 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь отфильтровывали через слой силикагеля и слой промывали 1 л ДХМ. Фильтрат концентрировали в вакууме с получением 1-(2,4-дихлор-6-(2(изопропилсульфонил)фениламино)пиримидин-5-ил)этанона в виде бледно-желтого твердого вещества. К раствору 1-(2,4-дихлор-6-(2-(изопропилсульфонил)фениламино)пиримидин-5-ил)этанона (113 мг,0,29 ммоль) в EtOH (2 мл) добавляли трет-бутил-4-(4-амино-5-изопропокси-2-метилфенил)пиперидин-1 карбоксилат (203 мг, 0,58 ммоль) и реакционную смесь нагревали при 130C в течение 30 мин. Реакционную смесь концентрировали в вакууме, затем очищали хроматографией на силикагеле (EtOAC/гексан: 3/7) с получением трет-бутил 4-(4-(5-ацетил-4-хлор-6-(2-(изопропилсульфонил)фениламино)пиримидин 2-иламино)-5-изопропокси-2-метилфенил)пиперидин-1-карбоксилата.(15 мл) и пропускали N2 в течение 5 мин. Добавляли трис-(дибензилиденацетон)дипалладий(0) (100 мг,0,109 ммоль, 0,1 экв.), 2-дициклогексилфосфин-2',6'-диметоксибифенил (112 мг, 0,272 ммоль, 0,25 экв.),1-хлор-5-изопропокси-2-метил-4-нитробензол (250 мг, 1,09 ммоль, 1,0 экв.) и K3PO4 (462 мг, 2,18 ммоль,2,0 экв.) в атмосфере N2. Реакционный сосуд закрывали и нагревали при микроволновом облучении при 150C в течение 20 мин. После охлаждения до комнатной температуры реакционную смесь разбавляли этилацетатом и промывали 1 н. водным раствором NaOH (дважды). Органический слой затем сушилиNa2SO4 и отфильтровывали. После концентрирования сырой продукт очищали хроматографией на силикагеле (градиент от гексана до 30% этилацетата в гексане) с получением 4-(5-изопропокси-2-метил-4 нитрофенил)пиридина в качестве коричневого твердого вещества. 4-(5-Изопропокси-2-метил-4-нитрофенил)пиридин с предшествующей стадии (438 мг, 1,61 ммоль) растворяли в уксусной кислоте (30 мл) при обработке ТФУК (0,24 мл, 3,22 ммоль) и PtO2 (176 мг,40 вес.%). Реакционную смесь интенсивно перемешивали при 1 атм H2 в течение 36 ч. Реакционную смесь отфильтровывали и фильтрат концентрировали в вакууме. Полученный остаток разбавляли этилацетатом и промывали 1 н. водным NaOH (дважды). Органический слой затем сушили Na2SO4 и отфильтровывали. После концентрирования сырой продукт (391 мг) растворяли в безводном CH2Cl2 (30 мл). Добавляли ТЭА (0,44 мл, 3,15, 2 экв.), затем Boc2O (344 мг, 1,57 моль, 1 экв.). Реакционную смесь перемешивали при комнатной температуре в течение 30 мин. Реакционную смесь концентрировали в вакууме. Полученный остаток очищали хроматографией на силикагеле (градиент от гексана до 30% этилацетата в гексане) с получением трет-бутилового эфира 4-(4-амино-5-изопропокси-2-метилфенил)пиперидин-1 карбоновой кислоты в виде клейкой пены.ESMS m/z 293,1 (M-tBu+H)+. Стадии 4 и 5. трет-Бутиловый эфир 4-(4-амино-5-изопропокси-2-метилфенил)пиперидин-1 карбоновой кислоты (170 мг, 0,488 ммоль) с предыдущей стадии, (2,5-дихлорпиримидин-4-ил)-[2(пропан-2-сульфонил)фенил]амин (169 мг, 0,488 ммоль, 1 экв.), ксантфос (28 мг, 0,049 ммоль, 0,1 экв.),ацетат палладия (5,5 мг, 0,024 ммоль, 0,05 экв.) и Cs2CO3 (477 мг, 1,46 ммоль, 3 экв.) растворяли в безводном ТГФ (6 мл). N2 пропускали через реакционную смесь в течение 5 мин и реакционный сосуд закрывали и нагревали при микроволновом излучении при 150C в течение 20 мин. Реакционную смесь отфильтровывали и фильтрат концентрировали в вакууме. После концентрирования сырой продукт очищали хроматографией на силикагеле (градиент от гексана до 30% этилацетата в гексане) с получением трет-бутилового эфира 4-(4-5-хлор-4-[2-(пропан-2-сульфонил)фениламино]пиримидин-2-иламино-5 изопропокси-2-метилфенил)пиперидин-1-карбоновой кислоты в виде желтой пленки.ESMS m/z 658,3 (M+H+). Этот продукт (105 мг, 0,160 ммоль) растворяли в CH2Cl2 (3 мл) и обрабатывали ТФУК (3 мл). Через 45 мин реакционную смесь концентрировали в вакууме. Добавляли 1 н. HCl в Et2O (25 мл), вызывая осаждение продукта в виде соли с HCl. Растворитель удаляли декантированием. Полученный 5-хлор-N2(2-изопропокси-5-метил-4-пиперидин-4-илфенил)-N2-[2-(пропан-2-сульфонил)фенил]пиримидин-2,4 диамин сушили в высоком вакууме, получая беловатый порошок. 1 К раствору 2,4,5-трихлорпиримидина (1 ммоль) и 2-(дифторметилсульфонил)анилина (1 ммоль) в 10 мл ДМФА добавляли гидрид натрия (2 ммоль) при 0C. Затем реакционную смесь нагревали до комнатной температуры и перемешивали при 50C в течение 1 ч. После обработки и ускоренной хроматографии (CH2Cl2/MeOH 9:1) получали продукт. К суспензии 2,5-дихлор-N-(2-(дифторметилсульфонил)фенил)пиримидин-4-амина (0,5 ммоль) в 1 мл изопропанола добавляли 2-изопропокси-5-метил-4-(пиперидин-4-ил)анилин (0,5 ммоль) и 4-метилбензолсульфоновую кислоту (0,5 ммоль). Суспензию перемешивали при 150C в течение 3 ч. После обработки и преп-ВЭЖХ получали продукт. Смесь 2-хлор-4-фтор-5-нитробензойной кислоты (5,0 г, 22,8 ммоль) и карбоната цезия (29,7 г,91,1 ммоль) в 2-пропаноле (100 мл) нагревали при 50C в течение ночи. Растворитель удаляли в вакууме и добавляли 100 мл воды. Концентрированную водную HCl добавляли по каплям к этому раствору при 0C до значения pH 2. Полученный осадок продукта выделяли фильтрацией, промывали водой и сушили в вакууме с получением 2-хлор-4-изопропокси-5-нитробензойной кислоты. трет-Бутиловый эфир 4-(2-хлор-4-изопропокси-5-нитробензоиламино)пиперидин-1-карбоновой кислоты К раствору 2-хлор-4-изопропокси-5-нитробензойной кислоты (10 г, 38,5 ммоль) в ДХМ (200 мл) и ДМФА (1 мл) медленно пипеткой добавляли тионилхлорид (9,17 г, 77 ммоль). Смесь перемешивали в течение 3 ч и концентрировали досуха. Полученное белое твердое вещество, 2-хлор-4-изопропокси-5 нитробензоилхлорид, сушили в вакууме. К смеси трет-бутилового эфира 4-аминопиперидин-1 карбоновой кислоты (1,44 г, 7,2 ммоль) и триэтиламина (3 мл, 21,6 ммоль) в ДХМ (100 мл) медленно пипеткой добавляли 2-хлор-4-изопропокси-5-нитробензоилхлорид (2 г, 7,2 ммоль), растворенный в ДХМ(10 мл). Смесь перемешивали при комнатной температуре в течение 3 ч и концентрировали. Полученное твердое вещество растворяли в этилацетате и промывали водой и насыщенным раствором хлорида натрия соответственно. После упаривания растворителя указанное в заголовке соединение получали в виде светло-желтого твердого вещества и непосредственно использовали на следующей стадии без дополнительной очистки. трет-Бутиловый эфир 4-(4-изопропокси-5-нитро-2-винилбензоиламино)пиперидин-1-карбоновой кислоты К смеси трет-бутилового эфира 4-(2-хлор-4-изопропокси-5-нитробензоиламино)пиперидин-1 карбоновой кислоты (7,2 ммоль), полученной на предыдущей стадии, добавляли дибутиловый эфир винилборной кислоты (1,72 г, 9,4 ммоль) и карбонат натрия (5,34 г, 50,4 ммоль) в смеси ТГФ/H2O(100/25 мл) и дихлор-бис-(трифенилфосфин)палладий(II) (442 мг, 5% ммоль). Смесь насыщали N2 в течение 3 мин и нагревали при 90C в атмосфере N2 в течение ночи в круглодонной колбе, оснащенной конденсатором. Смесь охлаждали до комнатной температуры и выливали в насыщенный водный раствор хлорида аммония. Смесь экстрагировали этилацетатом (3100 мл). Органические экстракты объединяли,промывали насыщенным раствором хлорида натрия и концентрировали. Сырой продукт очищали колоночной хроматографией на силикагеле (40% этилацетата в гексане) с получением трет-бутилового эфира 4-(4-изопропокси-5-нитро-2-винилбензоиламино)пиперидин-1-карбоновой кислоты в виде белого твердого вещества. 4-(5-изопропокси-6-нитро-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-1 трет-Бутиловый эфир 4-(4-изопропокси-5-нитро-2-винилбензоиламино)пиперидин-1-карбоновой кислоты, полученный на предыдущей стадии (1,9 г, 4,38 ммоль), растворяли в ДХМ (100 мл) и охлаждали до -78C. O3 (газ) пропускали через раствор до смены окраски раствора с голубой на серую. Раствор затем насыщали N2 (газ) до исчезновения голубой окраски. Раствор нагревали до комнатной температуры и обрабатывали смолой трифенилфосфина (5 г), предварительно замоченной в ДХМ (100 мл). Через 30 мин смесь отфильтровывали, фильтрат концентрировали и полученный остаток растворяли в смеси ДХМ/ТФУК (100 мл/25 мл). К этой смеси добавляли триэтилсилан (4,6 мл, 17,5 ммоль). Полученную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали и повторно растворяли в ДХМ и раствор ДХМ промывали 1 н. водным HCl (320 мл). Объединенные водные слои обрабатывали концентрированным водным раствором NaOH до значения pH 12. Водный слой экстрагировали этилацетатом (330 мл). Объединенные органические слои промывали насыщенным раствором хлорида натрия и сушили сульфатом натрия. Светло-желтое твердое вещество получали после упаривания органического растворителя. Твердое вещество растворяли в смеси метанола и триэтиламина (100 мл, 9:1 об.) К этой смеси добавляли ди-трет-бутилдикарбонат (680 мг, 3,1 ммоль). После перемешивания при 50C в течение 30 мин смесь концентрировали и очищали ускоренной колоночной хроматографией на силикагеле (элюент: 4050% этилацетата в гексане) с получением трет-бутилового эфира 4-(5-изопропокси-6-нитро-1-оксо-1,3 дигидроизоиндол-2-ил)пиперидин-1-карбоновой кислоты в виде белого твердого вещества. 1(10% на угле, 100 мг). Смесь гидрировали при 1 атм в водороде. Через 4 ч смесь отфильтровывали и концентрировали. Полученный анилин в виде желтого твердого вещества использовали на следующей стадии без дополнительной очистки. К смеси сырого продукта (2 ммоль) с предыдущей стадии добавляли(1,3 г, 4 ммоль) и ксантфос (115 мг, 0,2 ммоль) в ТГФ (20 мл), ацетат палладия (22 мг, 5% ммоль) в колбе для микроволнового излучения. Смесь насыщали N2 в течение 3 мин. Закрытую колбу нагревали при 150C в течение 20 мин при микроволновом излучении. Смесь охлаждали, отфильтровывали и концентрировали. Остаток очищали ускоренной колоночной хроматографией на силикагеле (элюент: 65% этилацетата в гексане) с получением желтого твердого вещества. Твердое вещество обрабатывали смесью ДХМ/ТФУК (1/1, 10 мл) в течение 1 ч, затем концентрировали в вакууме. Конечная очистка препаративной RP LC-MS приводила к получению 6-5-хлор-4-[2-(пропан-2-сульфонил)фениламино]пиримидин-2 иламино-5-изопропокси-2-пиперидин-4-ил-2,3-дигидроизоиндол-1-она в виде белого твердого вещества. 1 6-(5-Хлор-4-(2-(изопропилсульфонил)фениламино)пиримидин-2-иламино)-2-(1-(2(диметиламино)ацетил)пиперидин-4-ил)-5-изопропоксиизоиндолин-1-он. К раствору 6-(5-хлор-4-(2-(изопропилсульфонил)фениламино)пиримидин-2-иламино)-5 изопропокси-2-(пиперидин-4-ил)изоиндолин-1-она (20 мг, 0,03 ммоль) в ДМФА (1,0 мл) добавляли гидрохлорид 2-(диметиламин)ацетилхлорида (0,17 ммоль, 26 мг) и триэтиламин (0,18 ммоль, 18 мг). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч и твердый побочный продукт удаляли фильтрацией. Оставшийся фильтрат очищали препаративной RP-ВЭЖХ с получением 6-(5-хлор-4(2-(изопропилсульфонил)фениламино)пиримидин-2-иламино)-2-(1-(2-(диметиламино)ацетил)пиперидин 4-ил)-5-изопропоксиизоиндолин-1-она. Пример 5. К раствору 6-(5-хлор-4-(2-(изопропилсульфонил)фениламино)пиримидин-2-иламино)-5 изопропокси-2-(пиперидин-4-ил)изоиндолин-1-она (52 мг, 0,09 ммоль) в ДМФА (1,0 мл) добавляли последовательно (S)-1-(трет-бутоксикарбонил)пирролидин-2-карбоновую кислоту (19 мг, 0,09 ммоль),HATU (50 мг, 0,130 ммоль) и DIEA (0,174 ммоль, 30 мкл). Реакционную смесь перемешивали в течение 1 ч, затем разделяли между EtOAc и водой. Органические экстракты сушили (Na2SO4) и концентрировали в вакууме. Сырой продукт перемешивали в растворе ДХМ (1 мл) и ТФУК (1 мл) в течение 1 ч, затем концентрировали в вакууме. К раствору полученного сырого продукта в 1 мл MeOH и 1 мл ТГФ добавляли 3 капли AcOH, формальдегид (37 вес.% раствора в воде, 0,09 ммоль, 7 мг). После перемешивания в течение 1 ч добавляли цианоборгидрид натрия (0,18 ммоль, 11 мг) и реакционную смесь перемешивали в течение 30 мин. Реакционную смесь отфильтровывали и полученный фильтрат очищали препаративной(39 мг, 0,104 ммоль) и DIEA (0,138 ммоль, 24 мкл). Реакционную смесь перемешивали в течение 1 ч, затем разделяли между EtOAc и водой. Органические экстракты сушили (Na2SO4) и концентрировали в вакууме. Сырой продукт перемешивали в растворе ДХМ (1 мл) и ТФУК (1 мл) при комнатной температуре в течение 1 ч. Полученный раствор концентрировали и затем очищали препаративной RP-ВЭЖХ с получением 2-(1-(азетидин-3-карбонил)пиперидин-4-ил)-6-(5-хлор-4-(2-(изопропилсульфонил)фениламино)пиримидин-2-иламино)-5-изопропоксиизоиндолин-1-она. Пример 7. 2-(Диметиламино)-1-(4-(5-изопропокси-4-(4-(2-(изопропилсульфонил)фениламино)-1Hпиразоло[3,4-d]пиримидин-6-иламино)-2-метилфенил)пиперидин-1-ил)этанон (21)(10 г) в воде (300 мл). Раствор охлаждали до 5C и встряхивали с метилйодидом (12 г). Через 15-20 мин в раствор добавляли уголь, отфильтровывали и подкисляли уксусной кислотой с получением сырого продукта. Перекристаллизация из кислоты приводила к получению целевого продукта. К 40 мл оксихлорида фосфора и диметиланилина (3 мл) добавляли 2,2 г сырого 4-гидроксиметилмеркаптопиразоло[3,4-d]пиримидина. Раствор кипятили с обратным холодильником в течение 30-60 мин до растворения твердого вещества. Избыток фосфора удаляли при пониженном давлении. Сиропообразный остаток выливали при интенсивном перемешивании в смесь ледяной воды. Через 9 мин водный раствор экстрагировали диэтиловым эфиром. Эфирный раствор промывали холодной водой и сушили безводным сульфатом натрия. Реакционную смесь отфильтровывали и эфир удаляли под давлением с получением продукта. 211,0 (M+1)+. Раствор 4-хлор-6-метилмеркаптопиразоло[3,4-d]пиримидина (10 ммоль) и 2-(N,N-диметилсульфонил)анилина (10 ммоль) в 100 мл изопропанола перемешивали при кипении с обратным холодильником в течение 1 ч. После охлаждения до комнатной температуры к реакционной смеси добавляли триэтиламин (12 ммоль), затем раствор нагревали при кипении с обратным холодильником в течение 0,5 ч. После обработки и ускоренной хроматографии (гексан/EtOAc 4:1) получали продукт. 364,08 (M+1)+.(1 ммоль) в 10 мл 1,2-дихлорэтана добавляли МСРВА (3 ммоль) при 0C. После нагревания реакционной смеси до комнатной температуры и перемешивания в течение 1 ч продукт получали ускоренной хроматографией (CH2Cl2/MeOH 9:1).N-(2-(изопропилсульфонил)фенил)-6-(метилсульфонил)-1H-пиразоло[3,4d]пиримидин-4-амина (0,5 ммоль) в 1 мл изопропанола добавляли 2-изопропокси-5-метил-4-(пиперидин 4-ил)анилин (0,5 ммоль) и 4-метилбензолсульфоновую кислоту (0,5 ммоль). Суспензию перемешивали при 150C в течение 3 ч. После препаративной ВЭЖХ получали конечный продукт. 1 Н ЯМР (CDCl3, 400 МГц):8,74-8,77 (d, 1H), 8,24 (s, 1H), 7,92-7,96 (m, 2H), 7,65-7,70 (m, 1H), 7,277,33 (m, 1H), 6,85 (s, 1H), 4,60-4,67 (m, 1H), 3,71-3,74 (m, 2H), 3,25-3,32 (m, 1H), 2,78-2,97 (m, 6H), 2,282,33 (m, 5H), 1,95-1,98 (m, 2H), 1,39-1,41 (d, 6H), 1,33-1,35 (d, 6H);N6-(2-Изопропокси-5-метил-4-(пиперидин-4-ил)фенил)-N4-(2-(изопропилсульфонил)фенил)-1Hпиразоло[3,4-d]пиримидин-4,6-диамин (56 мг) растворяли в 3 мл дихлорметана. Раствор охлаждали до 5C и к раствору добавляли гидрохлорид 2-(диметиламино)ацетилхлорида (24 мг), затем триэтиламин(15 мг). Раствор перемешивали при комнатной температуре в течение около 30 мин. После препаративной LC-MS получали конечный продукт.MS (ES+): 649,32 (M+1)+. Повторением методик, описанных выше в примерах (промежуточные соединения и конечные соединения), используя подходящие исходные материалы, получали следующие соединения формулы I,представленные в табл. 1. Таблица 1
МПК / Метки
МПК: A61P 35/00, C07D 403/14, A61P 31/00, A61P 37/00, C07D 487/04, A61K 31/506, C07D 239/48, A61K 31/505, C07D 403/12, A61K 31/519
Метки: соединения, композиции, ингибиторов, протеинкиназы, качестве
Код ссылки
<a href="https://eas.patents.su/30-18282-soedineniya-i-kompozicii-v-kachestve-ingibitorov-proteinkinazy.html" rel="bookmark" title="База патентов Евразийского Союза">Соединения и композиции в качестве ингибиторов протеинкиназы</a>
Предыдущий патент: Гербицидный состав
Следующий патент: Сельскохозяйственное применение дигидроцитрата серебра
Случайный патент: Выкатной элемент с механизмом раздельного перемещения в шкафу комплектного распределительного устройства












